БИОХИМИЯ, 2023, том 88, вып. 10, с. 1985 - 2001
УДК 612.015.1;577.151;543.94
ЦИТОХРОМЫ Р450: ОСОБЕННОСТИ МЕХАНИЗМОВ
КАТАЛИЗА И ЭЛЕКТРОКАТАЛИЗА ДЛЯ СОЗДАНИЯ
БИОСЕНСОРОВ И БИОРЕАКТОРОВ
Обзор
© 2023 П.И. Королева1, Т.В. Булко1, Л.Е. Агафонова1, В.В. Шумянцева1,2*
1 Научно-исследовательский институт биомедицинской химии имени В.Н. Ореховича,
119121 Москва, Россия; электронная почта: viktoria.shumyantseva@ibmc.msk.ru
2 Российский национальный исследовательский медицинский университет имени Н.И. Пирогова,
117997 Москва, Россия
Поступила в редакцию 22.06.2023
После доработки 23.08.2023
Принята к публикации 25.08.2023
Цитохромы P450 - уникальное семейство ферментов, обнаруженное во всех царствах живых су-
ществ (у животных, бактерий, растений, грибов, архей). Основной функциональной ролью цито-
хромов P450 является биотрансформация экзогенных и эндогенных соединений. Данный обзор
посвящен проблеме повышения эффективности электрокатализа цитохромами P450, которые
обладают уникальными возможностями как для создания биосенсоров, так и для биотехнологи-
ческого применения. В работе рассмотрены основные способы создания реконструированных
и электрохимических каталитических систем на основе цитохромов P450, а также современные
тенденции и подходы к практическому применению цитохромов P450.
КЛЮЧЕВЫЕ СЛОВА: цитохром P450, каталитический механизм, биоэлектрохимия, электрокатализ.
DOI: 10.31857/S0320972523100172, EDN: OVNWSI
ВВЕДЕНИЕ.
роидов, таких как тестостерон, прогестерон,
РОЛЬ ЦИТОХРОМОВ Р450
андростендион, кортизол и желчные кислоты,
В БИОТРАНСФОРМАЦИИ ЭКЗОГЕННЫХ
подвергая их реакции гидроксилирования.
И ЭНДОГЕННЫХ СОЕДИНЕНИЙ
Цитохромы P450 11A1, 17A1, 19A1, 21A2 участ-
вуют в биосинтезе стероидных гормонов (прег-
Цитохромы P450 являются гемопротеина-
ненолон, прогестерон, андростендион, эстрон,
ми, относящимися к цитохромам типа b. Они
тестостерон, эстрадиол, кортизол и альдосте-
представлены в бактериях, грибах, растени-
рон) и холестерина [1, 2]. Кроме того, цитохро-
ях, дрожжах, беспозвоночных и позвоночных
мы P450 участвуют в метаболизме витамина D3,
животных. У млекопитающих цитохромы P450
арахидоновой кислоты, жирных кислот [3, 4].
обнаруживаются в различных органах. Их наи-
Крайне важным свойством цитохромов P450
большая концентрация наблюдается в тканях
является обезвреживание токсинов, попадаю-
печени, эпителии кишечника, мозга, легких,
щих в организм, а также биотрансформация
и почек. У человека выявлено 57 генов различ-
лекарственных средств. Наиболее экспресси-
ных цитохромов P450. Они подразделяются
руемые в организме человека цитохромы P450
на 18 семейств и 43 подсемейства. Цитохромы
3A4, 2C9, 2E1, 1A2 участвуют в 90% реакций
Р450 метаболизируют большое разнообразие
I фазы метаболических превращений всех при-
как эндогенных, так и экзогенных субстратов.
меняемых лекарств [2, 5].
Цитохромы P450 1A1, 2B6, 2C9, 3A4 играют
Цитохромы P450 катализируют стерео-
важную роль в катаболизме эндогенных сте- и региоспецифичные реакции в отношении
Принятые сокращения: АФК - активные формы кислорода; ДДАБ - дидодецилдиметиламмоний бромид;
CPR - NADPH-зависимая цитохром Р450 редуктаза.
* Адресат для корреспонденции.
1985
18
1986
КОРОЛЕВА и др.
→
Схема 1. Обобщенный механизм реакции, катализируемой цитохромом P450
насыщенных и ненасыщенных углеводоро-
различные подходы, способствующие повыше-
дов, ароматических соединений и стероидов.
нию эффективности цитохром Р450-фермен-
Под действием цитохромов P450 возможны
тативных систем, и, в перспективе, созданию
следующие реакции: окисление спиртов, N-,
биореакторов.
O-, S-деалкилирование, расщепление насы-
щенной углерод-углеродной (С-С) и угле-
род-водородной (C-H) связи с участием мо-
МЕХАНИЗМ ФУНКЦИОНИРОВАНИЯ
лекулярного кислорода при атмосферном дав-
ЦИТОХРОМ P450-СИСТЕМ
лении, приводящее к образованию более по-
лярного, по сравнению с субстратом, продукта
Особенностью каталитического меха-
реакции, способствуя тем самым II фазе ме-
низма цитохромов Р450 является бисубстрат-
таболизма с участием N-ацетилтрансферазы,
ная схема - с использованием двух субстра-
глутатион-S-трансферазы, глюкуронозилтранс-
тов, молекулярного кислорода и органической
феразы, эпоксидгидролазы и метилтрансфера-
молекулы, при этом один из атомов кислорода
зы [6]. Это приводит к большому разнообра-
присоединяется к молекуле субстрата, а другой
зию метаболических путей биотрансформации
протонируется с образованием воды (схема 1).
экзогенных и эндогенных соединений
[7].
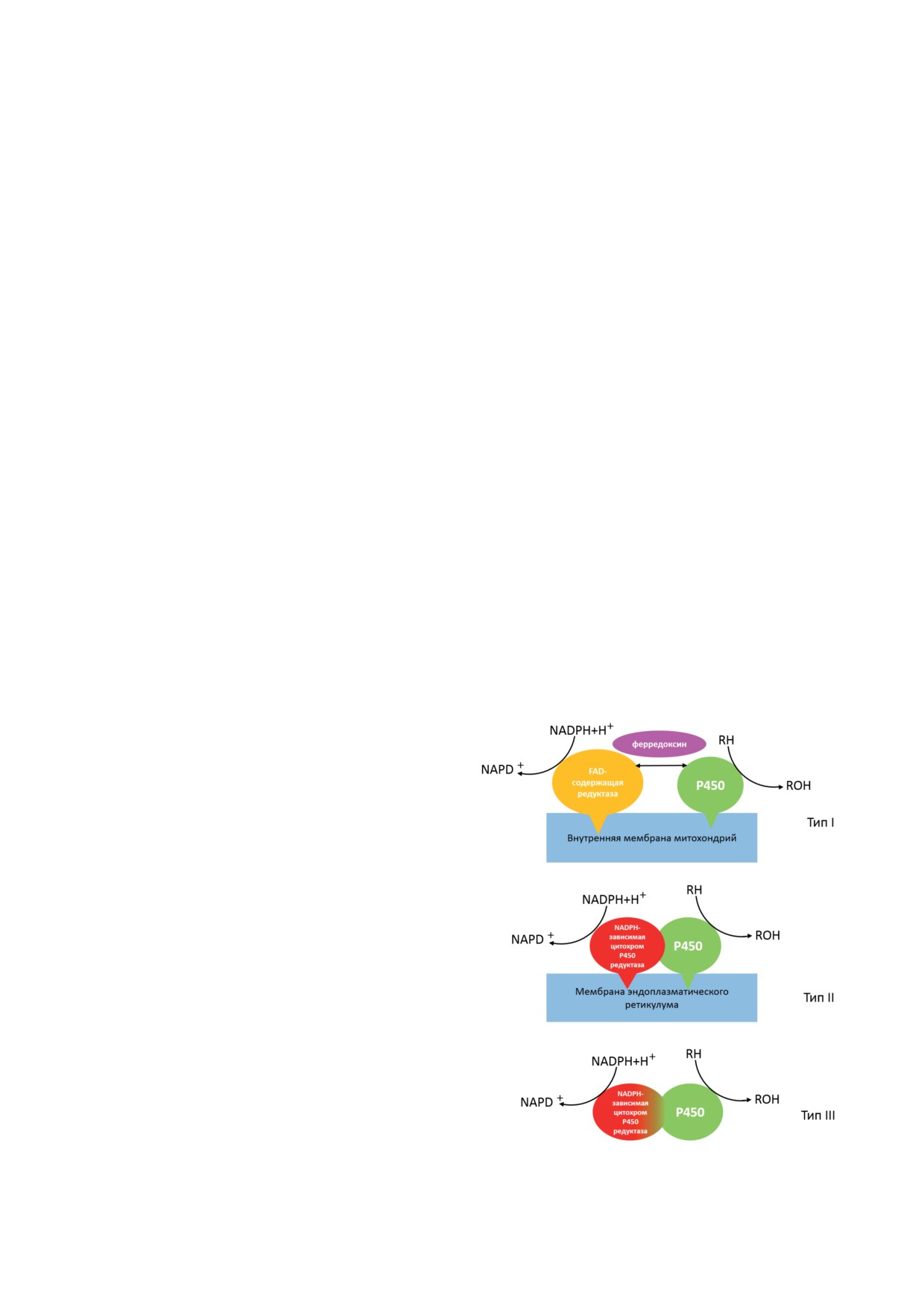
Для цитохромов P450 существуют различ-
Окисление лекарственного препарата, осу-
ные варианты электрон-транспортной цепи
ществляемое при участии изоферментов цито-
[12-14], характерные для различных организ-
хрома Р450, может приводить к снижению,
мов или различной клеточной локализации.
инактивации или изменению его фармако-
Для цитохромов P450 выделяют 10 классов
логических свойств или, наоборот, повышать
электрон-транспортных систем. В более об-
его фармакологическую активность. Напри-
щем виде их можно классифицировать на три
мер, изоформы CYP2D6 и CYP3A4 участвуют в
типа: митохондриальные, микросомальные и
метаболизме противоопухолевого препарата -
самодостаточные (рис. 1) [12-15].
тамоксифена, и образовании эндоксифена, об-
ладающего большей, по сравнению с тамокси-
феном, противоопухолевой активностью.
Благодаря разнообразию не только среди
цитохромов P450, но и многообразию субстра-
тов, метаболизируемых данными фермента-
ми, а также типов катализируемых реакций,
исследование каталитических свойств цито-
хромов P450 важно для решения медицинских
и фармакологических задач. В связи с этим
разработка систем для моделирования цито-
хром Р450-зависимых путей биотрансформа-
ции и специфических химических реакций
является актуальной задачей современной био-
технологии, биохимии, биоэлектрохимии, пер-
сонализированной медицины и энзимологии.
В последние годы был опубликован ряд
обзоров, посвященных созданию биосенсо-
ров на основе ферментов, в том числе цито-
хромов P450 и других гемопротеинов, участ-
вующих в метаболизме ксенобиотиков [8-11].
Основная цель данных обзоров - показать
разнообразие электрохимических биосенсоров
и их комбинации с другими методами, такими
как масс-спектрометрия, газовая и жидкостная
хроматография, для исследования метаболитов
Рис.
1. Структурная организация цитохром Р450-си-
реакций. Цель данного обзора - рассмотреть
стем [12-15]
БИОХИМИЯ том 88 вып. 10 2023
ЦИТОХРОМЫ Р450 КАК БИОСЕНСОРЫ И БИОРЕАКТОРЫ
1987
NADH/NADPH → редуктаза (FAD → FMN) → Цитохром P450
Схема 2. Электронный транспорт в микросомальных системах
К первому типу относятся как некоторые
Электронный транспорт в микросомаль-
бактериальные изоформы цитохрома P450,
ных системах происходит в соответствии со
так и локализованные в митохондриях эука-
схемой 2, где FAD - флавинадениндинуклео-
риот. Электрон-транспортная цепь таких ци-
тид и FMN - флавинмононуклеотид, вхо-
тохромов Р450 состоит из трех отдельных бел-
дящие в состав флавопротеина CPR [12].
ков: FAD-содержащей редуктазы, переносящей
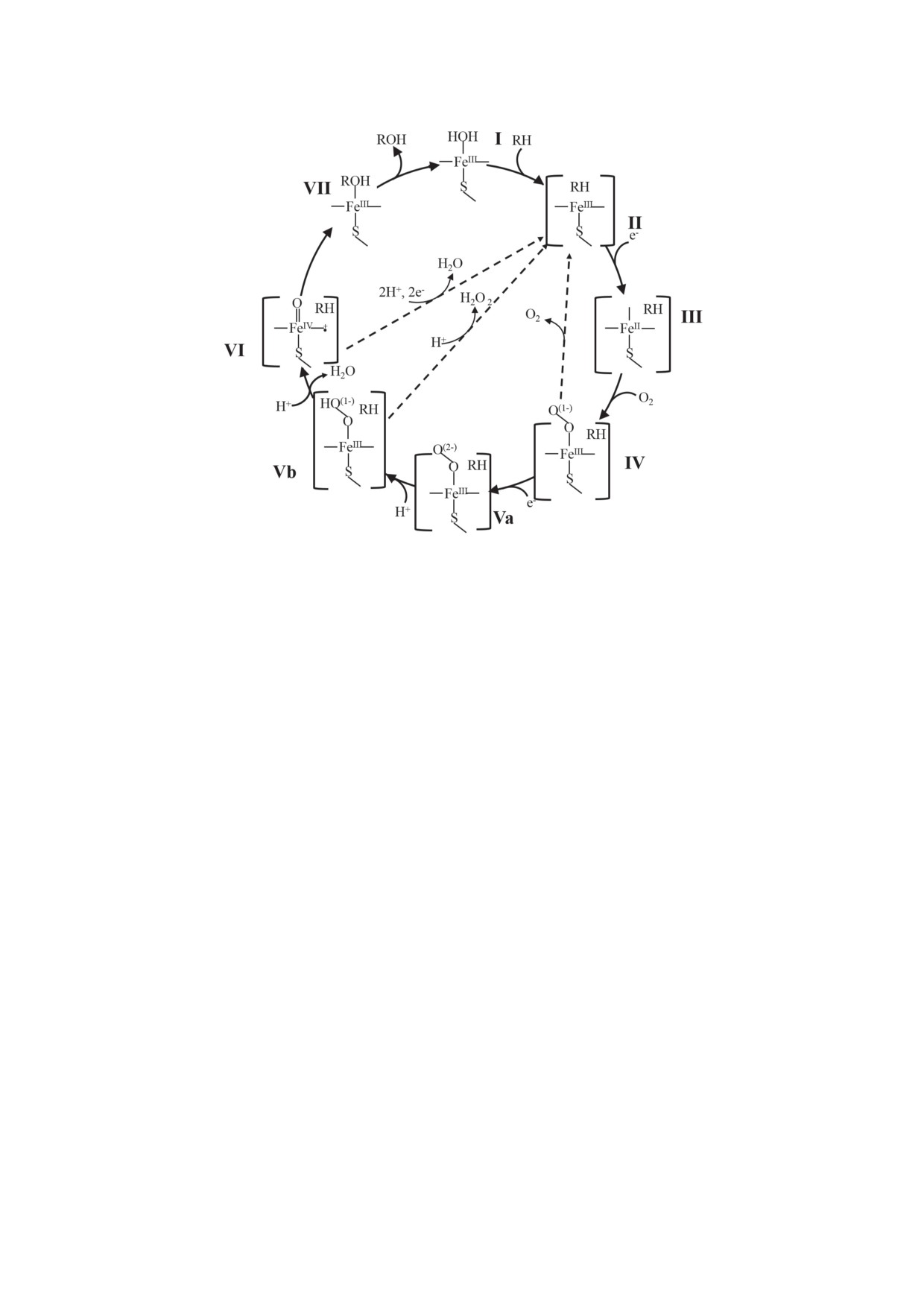
На рис. 2 представлен каталитический
восстановительные эквиваленты на ферредок-
цикл цитохрома P450 [2, 13, 19]. Впервые по-
син, который передает восстановительные эк-
следовательное двухэлектронное восстановле-
виваленты непосредственно на цитохром P450.
ние цитохрома P450 и существование несколь-
В бактериальных системах все перечисленные
ких интермедиатов было открыто для бактери-
белки растворимы, а в эукариотических клет-
ального цитохрома Р450 101 (CYP101) [20-22]
ках только ферредоксин является растворимым
и микросомальных систем [23] в конце 60-х-
и локализован в матриксе митохондрий, а ре-
начале 70-х гг. Связывание субстрата с фер-
дуктаза и цитохром Р450 закреплены на внут-
ментом в низко-спиновом FeIII-состоянии (I)
ренней мембране митохондрий. Примером
приводит к образованию фермент-субстрат-
цитохрома P450 млекопитающих митохондри-
ного комплекса и изменению низко-спино-
ального типа может служить семейство CYP11,
вого состояния (нередко частично, и иногда с
локализованное в надпочечниках и отвечаю-
вытеснением координированной воды из ак-
щее за биосинтез стероидных гормонов [16].
тивного центра фермента) в высоко-спиновый
Примером бактериальных цитохромов P450
субстрат-связывающий комплекс (II). Высо-
является фермент P450cam, относящийся к се-
ко-спиновый ион FeIII имеет более положи-
мейству CYP101 из Pseudomonas putida, отвеча-
тельный потенциал восстановления и, таким
ющих за биотрансформацию D-камфоры [17].
образом, ион железа гема активного центра
Второй тип электрон-транспортной цепи
цитохрома P450 принимает электрон и пере-
характерен для большинства изоформ цито-
ходит в FeII-состояние (III): FeIII + 1 e- → FeII.
хрома P450 эукариот, обладающих наиболь-
Среди различных изоферментов цитохро-
шим разнообразием каталитических реакций.
ма P450 возможны вариации в каталитиче-
Микросомальная система состоит из двух бел-
ском цикле и сдвиг спина не всегда осущест-
ков, интегрально закрепленных на поверхно-
вляется [24].
сти эндоплазматического ретикулума: NADPH-
Связывание кислорода приводит к обра-
зависимой цитохром Р450-редуктазы (CPR)
зованию окси-P450 (IV), который является
и цитохрома Р450. Цитохром b5 участвует в
последним относительно устойчивым интер-
независимом от CPR переносе электронов от
медиатом в этом цикле. Далее следует восста-
NADH-зависимой цитохром b5-редуктазы, а
новление комплекса окси-P450, последова-
также в аллостерической регуляции цитохро-
тельное образование интермедиата пероксо-
ма P450 [15].
FeIII (Va), его протонирование в интермедиат
Некоторые бактериальные цитохромы P450
гидропероксо-FeIII (Vb), второе протонирова-
принадлежат к самодостаточным ферментам.
ние дистального атома кислорода с частичным
В таких системах белок редокс-партнер нахо-
гетеролизом связи O-O и образованием вы-
дится на одной полипептидной цепи с цито-
соковалентной феррильной формы FeIV (VI)
хромом P450. Для таких белков существуют
и воды; оксигенация субстрата с формиро-
различные комбинации доменов, участвую-
ванием комплекса (VII) протекает при высо-
щих в электрон-транспортной цепи цитохро-
кой скорости, без накопления промежуточных
мов P450. Наиболее изученным из флавогемо-
интермедиатов, что затрудняет кинетические
протеинов является CYP102A1 (P450 BM3) из
исследования данного каскада реакций.
Bacillus megaterium, используемый в качестве
В дополнение к нескольким отдельным
модели эукариотических цитохромов P450
промежуточным состояниям, каждое из кото-
благодаря идентичной электрон-транспорт-
рых имеет свои собственные уникальные свой-
ной цепи, состоящей из редуктазы и цито-
ства, каталитический цикл цитохрома P450
хрома P450. В молекуле CYP102A1 гемовый
содержит по меньшей мере 3 разветвляющиеся
домен цитохрома P450 связан через N-конец
точки, где возможны дополнительные реак-
с CPR [18] (рис. 1).
ции [25].
БИОХИМИЯ том 88 вып. 10 2023
18*
1988
КОРОЛЕВА и др.
Рис. 2. Каталитический цикл цитохрома P450. Первым этапом каталитического цикла цитохрома P450 являет-
ся образование фермент-субстратного комплекса, и все последующие превращения происходят в этом комплек-
се [2, 13, 19, 23, 24]
К основным побочным путям протекания
мых химических реакций и метаболической
реакции относятся [19]:
активностью по отношению к лекарственным
• автоокислениие фермента окси-FeII (IV)
препаратам разработка биосенсоров и био-
с образованием супероксидного аниона и
реакторов на основе цитохромов Р450 пред-
возвращения фермента к его основному
ставляет важную и перспективную задачу для
состоянию (II);
фармакологии и для персонализированной
• пероксидное направление, когда коорди-
медицины (поиск новых субстратов и инги-
нированный пероксид или гидропероксид-
биторов этого класса гемопротеинов в режиме
ный анион (Va и Vb) отщепляются от иона
биосенсорного анализа), для биотехнологии в
железа, образуя пероксид водорода, таким
режиме биореакторов (получение прекурсоров,
образом, завершая непродуктивное (с точ-
сложных по строению и синтезу химических
ки зрения превращения субстрата) двух-
соединений), для медицины (анализ межлекар-
электронное восстановление кислорода;
ственных взаимодействий) (рис. 3) [27-31].
• оксидазное расщепление, где интермеди-
ат оксо-FeIV (VI) окисляется до воды вме-
сто оксигенации субстрата, что приводит
ПЕРСПЕКТИВЫ
к четырехэлектронному восстановлению
ЦИТОХРОМ Р450-БИОРЕАКТОРОВ
молекулы кислорода с последующим обра-
зованием двух молекул воды.
Цитохромы P450 являются наиболее уни-
Неполная сопряженность каталитического
версальными природными катализаторами
цикла, т.е. нарушение стехиометрии реакции,
благодаря следующим характеристикам:
является одним из затруднений, возникающим
• цитохромы P450 - функционально раз-
при катализе цитохромами P450. В результате
нообразные ферменты;
перечисленных выше реакций накапливаются
• цитохромы P450 катализируют регио- и
активные формы кислорода (АФК), которые
стереоспецифичное окисление неактивиро-
могут повреждать активный центр, что при-
ванных углеводородов, которое трудно про-
водит к самоинактивации фермента, а также
вести с помощью химического синтеза;
участвовать в реакциях неспецифического
• цитохромы P450 - уникальные хемо- и
окисления субстрата [26].
энантиоселективные ферменты, которые мо-
В связи с широкой субстратной специфич-
гут быть вовлечены в производство высоко-
ностью, большим разнообразием катализируе- ценных продуктов.
БИОХИМИЯ том 88 вып. 10 2023
ЦИТОХРОМЫ Р450 КАК БИОСЕНСОРЫ И БИОРЕАКТОРЫ
1989
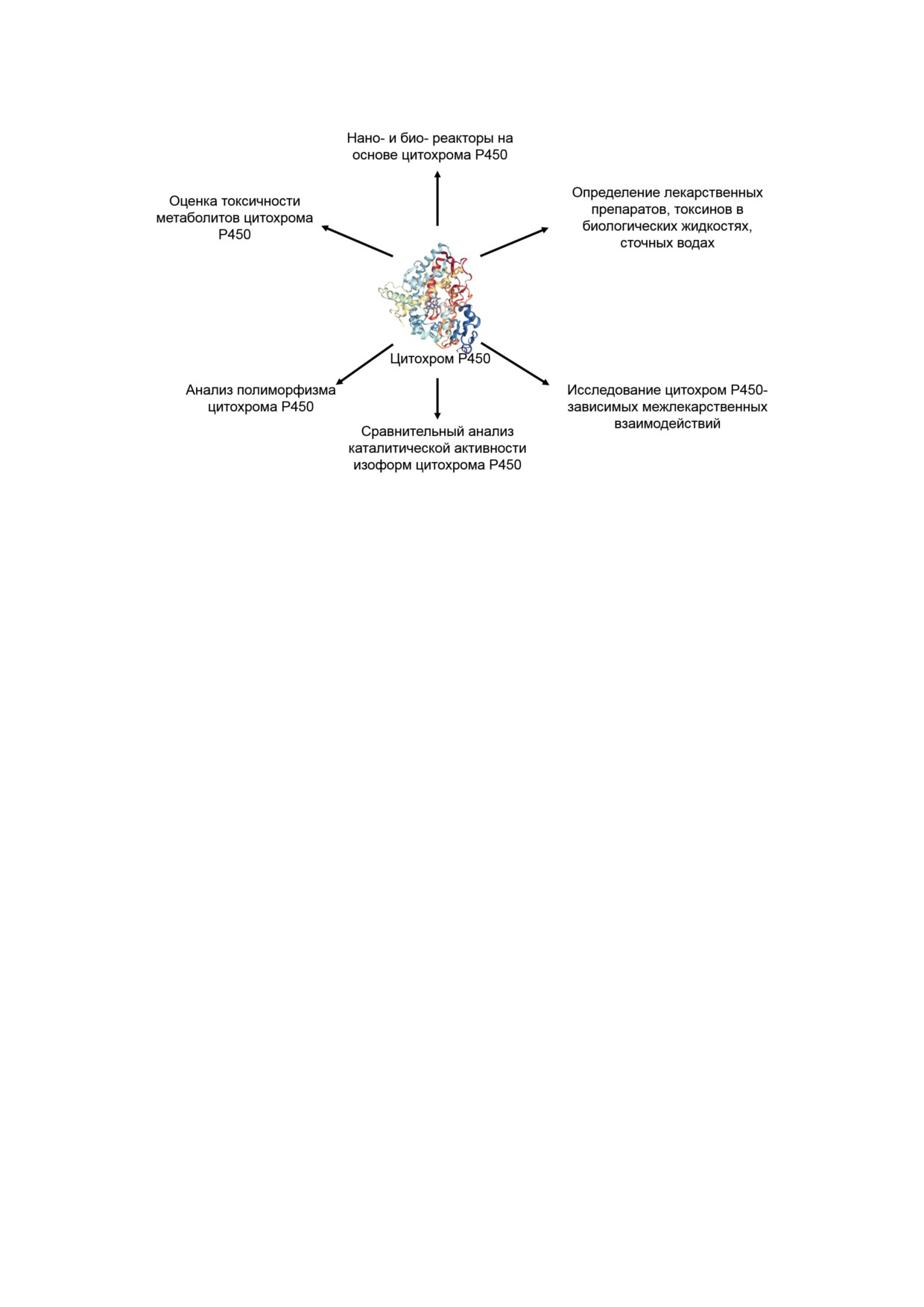
Рис. 3. Потенциальное применение цитохром Р450-систем
Особенностью цитохромов Р450 является
сосудистых заболеваний. Они действуют в
широкая субстратная специфичность. Кроме
качестве ингибиторов
3β-гидрокси-3-метил-
того, субстраты одного изофермента могут су-
глутарил-КоА (HMG-CoA) редуктазы, кото-
щественно отличаться между собой по струк-
рая является ферментом, контролирующим
туре и подвергаться ферментативному превра-
скорость биосинтеза холестерина. Праваста-
щению по различным механизмам. С другой
тин синтезируется из соединения компактина
стороны, одно и то же химическое соединение
через стереоселективное гидроксилирование.
может по-разному метаболизироваться разны-
Гидроксилирование в положении C-6 осущест-
ми изоформами цитохромов Р450. Эти причи-
вляется с использованием бактериальных фер-
ны делают цитохромы Р450 крайне перспектив-
ментов CYP105A3 (P450sca2) из Streptomyces
ными в качестве биореакторов.
carbophilus в процессе, разработанном компа-
Многие биологически активные соедине-
нией «Daiichi-Sankyo». Такие биореакторы раз-
ния растительного происхождения, проявляю-
работаны с использованием дополнительных
щие разнообразные терапевтические эффек-
NADPH-зависимых белков редокс-партнеров.
ты, могут быть получены биотехнологически
Концентрация NADPH поддерживается по-
с помощью цитохромов P450, найденных в ра-
стоянной при помощи ферментативной реге-
стениях [32]. Например, дитерпеноидный так-
нерирующей системы [27, 35-37].
сол (паклитаксел), один из компонентов коры
тихоокеанского тиса (Taxus brevifolia), эффек-
тивного антимитотического вещества, приме-
СЛОЖНОСТИ В СОЗДАНИИ
няемого как противораковое лекарство, может
ЦИТОХРОМ Р450-БИОРЕАКТОРОВ
быть получен с помощью биосинтеза, одной из
И ПУТИ ИХ ПРЕОДОЛЕНИЯ НА ОСНОВЕ
стадий которого является цитохром P450-за-
БИОХИМИЧЕСКИХ ПОДХОДОВ
висимое гидроксилирование в положении C-5
с последующей перегруппировкой [33]. Полу-
Потенциал применения цитохромов P450
чение аутокаидов, физиологически важных
в биотехнологии крайне широк, однако имеет
энантиоселективных производных арахидоно-
ряд ограничений, сдерживающих развитие это-
вой и линоленовой кислот, реализовано с по-
го направления [27, 29, 38-40]. Основным за-
мощью бактериального цитохрома P450 BM3
труднением в использовании цитохромов P450
и его мутантной формы F87V [34].
в качестве биореакторов является сложность и
Одним из примеров применения цитохро-
многостадийность каталитического цикла, тре-
мов Р450 на промышленном уровне является
бующая для функционирования фермента до-
синтез правастатина, который входит в состав
полнительных белков, выполняющих функцию
статинов, разработанных для снижения уров-
редокс-партнеров, а также кофактор NADPH
ня холестерина и уменьшения риска сердечно-
как источник электронов.
БИОХИМИЯ том 88 вып. 10 2023
1990
КОРОЛЕВА и др.
Ниже перечислены сложности, возникаю-
инактивации гемопротеинов и низкой опера-
щие при работе с цитохром Р450-системами.
ционной стабильности системы [28, 44-46].
По сравнению с другими классами ферментов
Неполная сопряженность каталитическо-
цитохромы P450 демонстрируют достаточно
го цикла цитохромов P450, представленная на
низкую скорость превращения субстрата. Это
рис. 2, может приводить к образованию АФК.
можно объяснить сложностью каталитическо-
Накопление АФК может приводить к окис-
го цикла цитохромов P450 и большим количе-
лительному стрессу и ряду заболеваний, а
ством энергии, затрачиваемым на диссоциа-
также повреждению и самоинактивации ци-
цию фермент-субстратного комплекса
[38].
тохрома P450 [46, 47]. Бактериальные цито-
Для каталитической реакции необходимы
хромы Р450 более стабильны по сравнению с
электроны, получаемые от NADH или NADPH.
ферментами из других источников [25, 48, 49].
Кроме источника электронов, для цитохро-
Для бактериальных цитохромов P450, ката-
мов P450 необходима эффективная электрон-
лизирующих реакции гидроксилирования, в
транспортная цепь, состоящая из белков ре-
качестве косубстрата может выступать перок-
докс-партнеров. Скорость реакции в этом
сид водорода. При таком механизме реакции
случае может лимитироваться скоростью пе-
с помощью «пероксидазного шунта» проис-
редачи электронов от белка к белку, а также
ходит превращение соединения II (см. рис. 2)
эффективностью белок-белкового взаимодей-
в соединение VI с превращением пероксида
ствия. Исключение составляют самодостаточ-
водорода в воду. Кроме того, для протекания
ные флавогемопротеины, в которых на одной
реакции по данному механизму могут исполь-
полипептидной цепи содержатся гемовый и
зоваться другие пероксиды, например пероксид
редуктазный домены. Примером является
кумола или трет-бутилгидропероксид [25, 48].
цитохром Р450 102А1 (BM3), выделенный из
В такой системе не требуются дорогостоящие
B. megaterium [41, 42].
кофакторы (NADH или NADPH) в качестве
Разработаны методы экспрессии слитных
доноров электронов. Данный подход уже был
конструкций, содержащих гемовый и редуктаз-
реализован в ряде работ. Например, в ра-
ный домены [43]. В процессе каталитического
боте Chen et al. [49] использовали цитохром
цикла цитохрома P450 может возникать разоб-
P450BSβ для реакций гидроксилирования жир-
щение между окислением NADH или NADPH
ных кислот в β-положении. Продукты такого
и образованием продукта, что приводит к
метаболического превращения представляют
накоплению АФК, которые могут приводить
большой интерес вследствие их биологической
к деградации как гемовой части, так и апо-
активности. Перспективным путем для полу-
протеина.
чения биотоплива является реакция декарбок-
При использовании цельноклеточных си-
силирования жирных кислот с образованием
стем, решающих проблему необходимости
алкенов с двойной связью в положении С-1.
добавления и регенерации кофактора, суще-
Это превращение катализируется ферментом
ствуют проблемы низкого потребления суб-
OleT, представителем семейства CYP152 [50].
страта и сниженного вывода продукта во вне-
Для моделирования цитохром Р450-зави-
клеточное пространство. Также существует
симых реакций были разработаны методы
проблема токсичности субстрата или продукта
реконструкции каталитической активности
для клетки.
этого класса гемопротеинов. Реконструиро-
Для преодоления сложностей каталитиче-
ванные системы содержат соответствующую
ского цикла цитохром Р450-зависимых реак-
изоформу цитохрома Р450, CPR, цитохром b5,
ций разработаны различные подходы. При-
фосфолипиды в соотношении, оптимальном
менение альтернативных доноров электронов
для моделирования и создания мембранного
на основе физико-химических методов может
окружения, а также NADPH в качестве источ-
быть использовано для прямого восстановле-
ника электронов [51-53]. Разработаны под-
ния фермент-субстратного комплекса без не-
ходы для повышения каталитической актив-
обходимости в CPR, цитохроме b5 и NADPH.
ности ферментов в реконструированных си-
Один из таких подходов использует протекание
стемах. В работе Shangguan et al. [53] была
реакции по пути «пероксидазного шунта» (пути
создана биферментная система, состоящая
VI → II и Vb → II; рис. 2, пунктирные линии) с
из цитохрома P450 1A1 и глюкозо-6-фосфат-
использованием пероксида водорода и орга-
дегидрогеназы, ковалентно иммобилизован-
нических пероксидов (например, гидропер-
ных на наночастицах золота, выращенных
оксида кумола). Однако пероксид-зависимые
на внутренних стенках мембраны из пори-
реакции, несмотря на высокие каталитические
стого оксида алюминия. Проведение каска-
константы, приводят в быстрой необратимой
да реакций в мембране из пористого оксида
БИОХИМИЯ том 88 вып. 10 2023
ЦИТОХРОМЫ Р450 КАК БИОСЕНСОРЫ И БИОРЕАКТОРЫ
1991
алюминия позволило увеличить скорость и
выход продуктов в обеих реакциях. Каталити-
ческая константа скорости CYP1A1-зависи-
мой реакции увеличивалась в 11 раз по сравне-
нию с ферментативной реакцией, проводимой
в растворе [53].
Для создания биореакторов на основе изо-
форм цитохрома P450 использовали магнит-
ные бусины, на которых были ковалентно
иммобилизованы фракции микросом пече-
ни крысы и человека, содержащие цитохро-
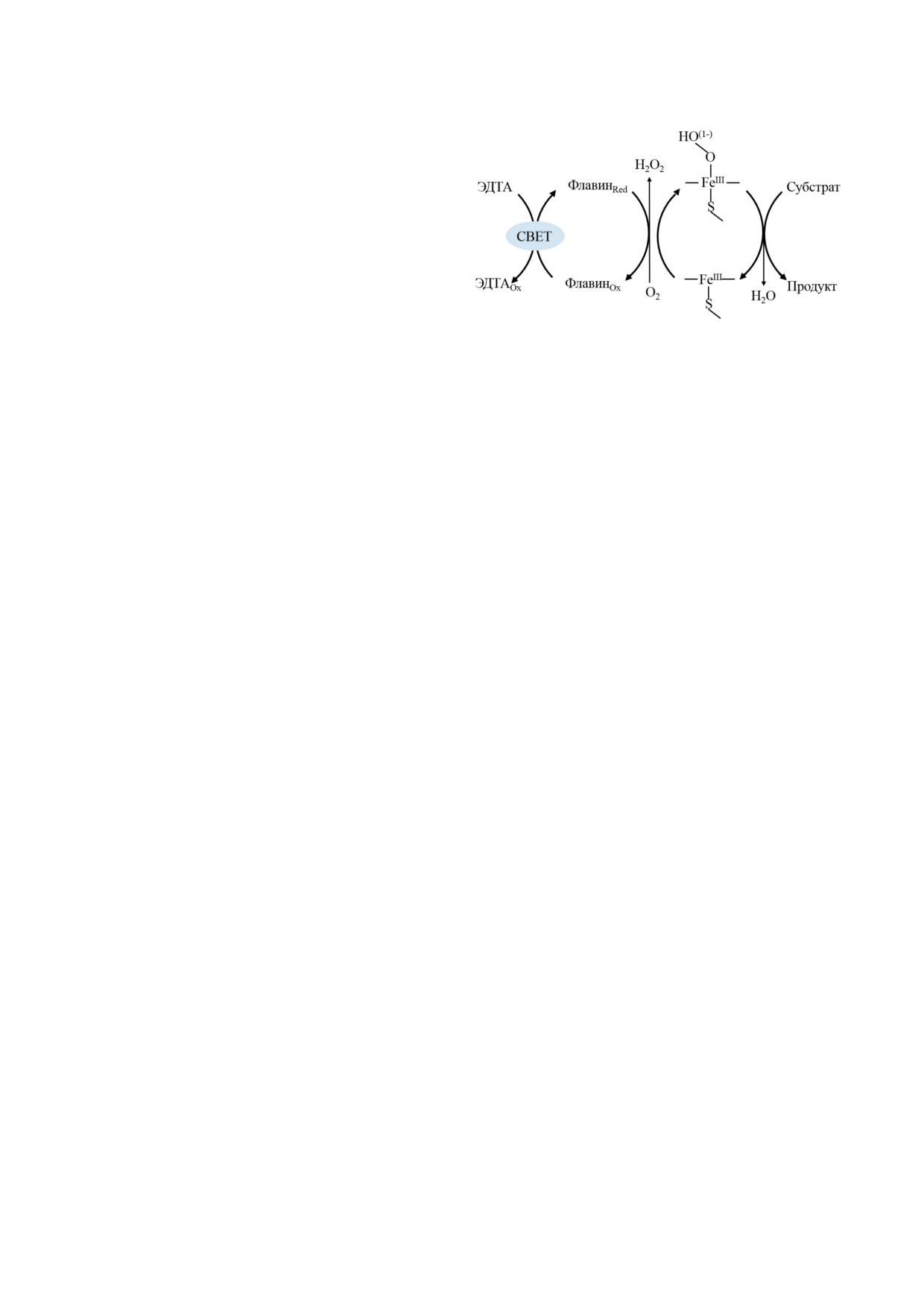
Рис. 4. Схема каталитического превращения субстрата
мы P450 3A4, 2С9 и 2D6. Авторы также ис-
цитохромом P450 под действием света на фотосенсиби-
пользовали реконструированную систему, где
лизирующие вещества
глюкозо-6-фосфатдегидрогеназа, регенерирую-
щая NADPH, также была иммобилизована на
магнитных бусинах. Помимо каталитической
света в видимом диапазоне может исполь-
эффективности данной системы, авторы отме-
зоваться как альтернативный путь создания
тили ее стабильность, использовав ее в трех
биореакторов [58]. В таких системах у рибо-
циклах [54]. Использование микросом печени
флавина, FAD или FMN под действием света
крысы и человека имеет этические проблемы,
и в присутствии ЭДТА (рис. 4), как донора
а также проблемы с воспроизводимостью ка-
электронов, происходит восстановление изо-
талитических параметров. Поэтому такой под-
аллоксазинового цикла либо с последующим
ход не может рассматриваться как эффектив-
переносом электронов на активный центр
ный и надежный метод создания биосенсоров
цитохрома P450, либо с образованием пер-
и биореакторов.
оксида водорода и катализом по механизму
Для функционализации полициклических
пероксидазного шунта
[45]. Использование
ароматических углеводородов (ПАУ) и их N-
данного подхода было изучено на реакциях
и O-содержащих производных использовали
гидроксилирования 4-нитрофенола и лаури-
цитохром P450 3A4 как фермент с широкой
новой кислоты под действием бактериального
субстратной специфичностью [55, 56]. В ка-
цитохрома P450 102A1 [59]. В качестве фото-
честве биокатализаторов был использован
сенсибилизирующего вещества в ряде систем
штамм дрожжей Komagataella phaffii, экспрес-
с бактериальными и человеческими цитохро-
сирующих цитохром P450 3A4. Целью работы,
мами P450 был использован эозин Y [60].
по мнению авторов, было получение в препа-
Электрохимические подходы. Электрохи-
ративных количествах функционализирован-
мические системы являются эффективными
ных ПАУ, что было реализовано на производ-
альтернативными донорами электронов, в ко-
ных флуорена, флуореноле и флуореноне [57].
торых именно электрод играет роль источ-
Авторам удалось масштабировать реакцию до
ника электронов. Используя количественные
объема 6 литров и получить выход 47,6% - для
закономерности электроанализа, обладающие
флуоренола и 9,7% - для флуоренона.
многопараметричностью, можно рассчитать ки-
нетические, каталитические и термодинами-
ческие параметры функционирования фер-
ФИЗИКО-ХИМИЧЕСКИЕ МЕТОДЫ
ментов [61]. Такой подход для количественно-
ДЛЯ СОЗДАНИЯ БИОРЕАКТОРОВ
го и сравнительного анализа каталитической
активности цитохромов P450 используется
Использование в качестве биореакторов
для поиска новых субстратов, ингибиторов,
реконструированных систем не является опти-
активаторов, эффекторов цитохромов Р450,
мальным по причине необходимости исполь-
а также для исследования межлекарствен-
зования белков редокс-партнеров. Поэтому
ных взаимодействий (рис. 5) [28, 36, 62, 63].
применение физико-химических методов с
Для эффективной иммобилизации цитохро-
альтернативными источниками электронов
мов P450 на поверхности электродов раз-
крайне актуально. Среди таких подходов для
работаны различные подходы, использую-
создания биореакторов можно выделить фото-
щие наноматериалы для модификации рабо-
восстановление и электровосстановление.
чей поверхности электрода, а также модифи-
Фотовосстановление. Применение фото-
каторы электродной поверхности, обеспечи-
сенсибилизирующих веществ для восстанов-
вающие сохранение нативной конформации
ления железа гема цитохрома P450 с помощью
и каталитических свойств фермента [61-63].
БИОХИМИЯ том 88 вып. 10 2023
1992
КОРОЛЕВА и др.
Рис. 5. Возможности применения электрохимических систем на основе цитохрома P450
Благодаря высокой эффективности цито-
фикатора, образование фермент-субстратного
хром Р450-электрохимических систем, с точки
комплекса может потребовать большее время
зрения аналитических характеристик, их при-
за счет диффузии субстрата к активному цен-
менение реализовано в режиме биосенсоров
тру фермента. Нами был предложен подход,
для поиска новых лекарственных препаратов
при котором предварительная инкубация ци-
в качестве субстратов или ингибиторов, для
тохрома Р450 3А4 (CYP3A4), нековалентно им-
анализа токсичных соединений в различных
мобилизованного на электроде за счет вклю-
средах (сточные воды, биологические жидко-
чения в матрицу ДДАБ с субстратом (антибио-
сти) [64-66].
тиком группы макролидов, эритромицином)
до стадии получения электронов, положи-
тельно влияла на выход продукта в электро-
ПУТИ ПОВЫШЕНИЯ КАТАЛИТИЧЕСКОЙ
каталитической реакции
[71]. Выход мета-
АКТИВНОСТИ ЦИТОХРОМОВ Р450
болита (формальдегида) возрос в 1,46 раза, а
В ЭЛЕКТРОХИМИЧЕСКИХ СИСТЕМАХ
максимальная скорость реакции увеличилась
с 9,21 × 10-11 M/мин до 1,40 × 10-10 M/мин.
Образование продуктивного фермент-суб-
Флавиновые нуклеотиды в качестве участ-
стратного комплекса. Электрохимические про-
ников цепи переноса электронов на электро-
цессы цитохром Р450-зависимых реакций ха-
де. Флавиновые нуклеотиды являются ко-
рактеризуются режимом тонкой пленки белка
факторами редуктаз - белков редокс-парт-
(сорбционный режим) на поверхности элек-
неров цитохрома P450, и, соответственно,
трода. Эти процессы не являются диффузи-
посредниками в передаче электронов между
онно-контролируемыми, что проявляется в
восстановительным эквивалентом NADPH и
линейной зависимости максимальной ампли-
цитохромом P450, согласно схеме 2 [72]. Для
туды анодного и катодного тока от скорости
моделирования классической электрон-транс-
сканирования, как было показано ранее [1,
портной схемы на электроде были исполь-
61, 67]. Количественные закономерности элек-
зованы различные подходы, основанные на
трохимических методов позволяют оценить
образовании комплексов или на включении
количество электроактивного фермента на
флавиновых кофакторов или флавин-содержа-
электроде для адекватного расчета кинетиче-
щих доменов в структуру цитохрома Р450. Ме-
ских параметров электроферментативной ре-
тодами генной инженерии к полипептидной
акции [61, 62, 67].
последовательности цитохрома P450 2C9 была
Особенностью каталитического цикла
присоединена последовательность флаводок-
цитохромов Р450 является многостадийность
сина (FLD) Desulfovibrio vulgaris, выбранная за
процесса. Первая стадия в катализе этого клас-
высокую схожесть с последовательностью до-
са гемопротеинов - образование комплекса
мена CPR, связывающей FMN. Авторы отме-
ферри-формы FeIII с субстратом (FeIII-RH).
чают, что использование модифицированно-
Далее, происходит перенос первого электрона
го белка CYP2C9-FLD, иммобилизованного
с образованием комплекса восстановленной
на стеклоуглеродном электроде, модифициро-
ферро-формы FeII с субстратом, а затем и с
ванном ДДАБ, способствует более эффектив-
кислородом в качестве второго субстрата [8,
ному переносу электронов, а каталитическая
19, 68-70] (рис. 2). Для фермента, иммобили-
активность в отношении субстрата S-варфа-
зованного (ковалентно или нековалентно) на
рина возрастает в 4 раза по сравнению с цито-
электроде или включенного в матрицу моди-
хромом Р450 2С9 (CYP2C9) [73].
БИОХИМИЯ том 88 вып. 10 2023
ЦИТОХРОМЫ Р450 КАК БИОСЕНСОРЫ И БИОРЕАКТОРЫ
1993
Рибофлавин, как медиатор электронного
электрода нанопористыми покрытиями на ос-
транспорта, был использован ранее при иссле-
нове таких материалов, как мезопористый ок-
довании полусинтетических флавогемопро-
сид кремния, оксид алюминия, оксид титана,
теинов на основе цитохрома Р450 2В4 [58] и на
мезопористый графен, индий, допированный
основе бактериальных цитохромов CYP106A2,
оксидом олова (ITO) [53, 76-79]. Применение
CYP107DY1, CYP107DY1, HmtS, HmtT,
нанопористых материалов для электрохими-
HmtN [74]. В качестве донора электронов был
ческого изучения ферментативных реакций
использован электрод
[58] и NADPH
[74].
обеспечивает переход электродной поверх-
Была исследована электрохимическая система,
ности от 2D- к 3D-режиму, способствует более
в которой нековалентный комплекс цитохро-
упорядоченному расположению белка на элек-
ма P450 3A4 с рибофлавином, FMN или FAD
троде, что выражается в увеличении эффек-
был иммобилизован на электроде [71]. Фла-
тивности электрокаталитических реакций [64,
виновые нуклеотиды, как низкомолекуляр-
77, 80]. В качестве нанопористых материалов
ные модели редуктазы, являются медиато-
могут использоваться материалы, обладающие
рами электронного транспорта, способствуя
следующими свойствами: химическая инерт-
эффективному восстановлению иона железа
ность, биосовместимость, электрохимическая
гема. При использовании флавиновых нуклео-
нейтральность при сохранении электронтранс-
тидов в качестве низкомолекулярных моделей
портных и проводящих свойств электрода.
редуктазы удалось достичь улучшения элек-
Проведение ферментативных реакций в «зам-
трохимических характеристик системы, таких
кнутых» пространствах (нанопорах, нанокана-
как электроактивная концентрация фермента,
лах, мицеллах, обращенных мицеллах) позволя-
а также рост такого параметра, как каталити-
ет смоделировать микроокружение ферментов
ческий ток в присутствии субстрата, который
и их молекулярную скученность («краудинг»)
является одной из важнейших характери-
в биологических системах, где ферменты нахо-
стик эффективности электрокатализа. Кроме
дятся в высоких концентрациях в ограничен-
того, удалось увеличить эффективность цито-
ных объемах [81].
хром Р450
3А4-зависимого электрокатализа
Для реализации данного подхода Mie
реакции N-деметилирования эритромицина
et al. [76] использовали золотой дисковый элек-
в 1,3, 1,7 и 2,1 раза в системе с рибофлавином,
трод, который подвергали процедуре аноди-
FAD и FMN соответственно. Также была рас-
рования. В результате этой процедуры по-
считана такая каталитическая характери-
верхность электрода становилась развитой
стика системы, как максимальная скорость
и приобретала углубления размером
20 нм.
реакции для системы без флавинов, равная
Авторами была показана эффективная иммо-
9,21 × 10-11 М/мин, 1,24 × 10-10 М/мин - в слу-
билизация цитохрома P450 3A4 на поверх-
чае рибофлавина, 1,57 × 10-10 М/мин и 1,87 ×
ности полученного электрода, модифициро-
× 10-10 М/мин - для FAD и FMN соответствен-
ванного нафталинтиолом. Для бактериального
но [71]. Такое увеличение максимальной ско-
цитохрома P450 BM3 была разработана элек-
рости реакции можно считать существенным,
трохимическая система на основе стеклоугле-
что позволяет рассматривать метод с исполь-
родного электрода, где для иммобилизации
зованием нековалентных комплексов цито-
фермента использованы наночастицы крем-
хрома P450 с флавинами как весьма эффек-
ния с разветвленными порами, модифици-
тивный.
рованные OH- или NH2-группами. При этом
Модификация поверхности электродов трех-
для закрепления наночастиц с иммобилизо-
мерными структурами для перехода от 2D- к
ванным цитохромом P450 BM3 использовали
3D-режиму. Электроды, применяемые в био-
хитозан. Такая система демонстрировала улуч-
электрохимии, как правило, представляют
шение электрохимических параметров, таких
собой плоские структуры. Для эффективного
как гетерогенная константа скорости переноса
электронного транспорта к активному цен-
электронов, каталитический ток, количество
тру фермента требуется иммобилизация бел-
электроактивного фермента, по сравнению с
ка на рабочей поверхности электрода. При
системой, в которой цитохром P450 BM3 был
этом существует проблема взаимодействия
иммобилизован непосредственно на поверх-
белка с «твердыми» 2D-поверхностями [75],
ности электрода [76]. Кроме того, наблюда-
что может приводит к изменению третичной
лись различия в свойствах систем, модифи-
и четвертичной структуры белка, влияющих
цированных наночастицами кремния с раз-
на каталитическую активность. Для преодо-
ветвленными порами, содержащими гидрок-
ления плоскостной структуры электродов был
сильные или аминогруппы. При модификации
предложен подход модификации поверхности
NH2-группами, заряженными положительно
БИОХИМИЯ том 88 вып. 10 2023
1994
КОРОЛЕВА и др.
Рис. 6. Схема иммобилизации цитохрома P450 3A4 по стратегии перехода от 2D-поверхности к 3D
в условиях проведения эксперимента, молеку-
оценки эффективности каталитического ци-
лы фермента ориентировались отрицательно
тохром Р450 3А4-зависимого процесса была
заряженным доменом редуктазы к поверхно-
рассчитана максимальная скорость реакции.
сти кремниевой наночастицы. Такой эффект
Для цитохрома P450 3A4, иммобилизованно-
вносил дополнительное упорядочивание и
го на электроде без нанопористого материа-
приводил к увеличению сродства к субстрату
ла, скорость реакции составила (4,3 ± 0,4) ×
тестостерону по сравнению с наночастицами
× 10-11 М/мин; для пор с диаметром 100 нм -
с OH-группами [76, 77].
(1,01 ± 0,04) × 10-10 М/мин; а для пор с диаме-
Для исследования кинетических пара-
тром 200 нм - (5,7 ± 0,3) × 10-11 М/мин.
метров цитохрома P450 3A4 была разработана
Совмещение двух подходов
- создание
система нанореактора на основе сложного
мембраноподобного покрытия и иммобили-
композита из сфер оксида кремния, нанопо-
зация цитохрома P450 3А4 в замкнутом про-
ристых графеновых пен и полидофамина [78].
странстве, моделирующим краудинг-эффект, -
Авторы показали, что кинетические пара-
было реализовано нами в работе Koroleva
метры реакций метаболизма стероидных гор-
et al. [83]. Для этого был использован липидо-
монов цитохромом P450 3A4 зависят от раз-
подобный модификатор электрода ДДАБ и
меров образованных пор наноструктур. При
мембранный белок стрептолизин O (рис. 6).
меньшем размере пор наблюдались наиболее
При послойном нанесении на электрод ДДАБ,
благоприятные параметры реакции. Для пор
а затем стрептолизина O в мембранной пленке,
размером 65, 120 и 260 нм были получены сле-
образованной ДДАБ, наблюдалось появление
дующие значения кажущейся константы Ми-
полостей, визуализируемых на изображениях,
хаэлиса (KMapp) для реакции гидроксилирова-
полученных с помощью атомно-силовой мик-
ния тестостерона: 110 ± 18 мкM, 276 ± 28 мкM
роскопии (АСМ). Данный подход позволил
и 333 ± 25 мкM соответственно в сравнении
зарегистрировать увеличение каталитическо-
с композитом без пор (430 ± 30 мкM). Изме-
го тока цитохрома P450 3А4 в присутствии
нение данного параметра свидетельствует об
субстрата эритромицина в 2 раза (с 0,6 мкА
увеличении сродства фермента к субстрату и
до 1,2 мкА) и повысить эффективность элек-
повышении эффективности каталитического
трокатализа реакции N-деметилирования эри-
процесса почти в 4 раза для наименьшего диа-
тромицина в 2,97 раза.
метра пор (65 нм).
Иммобилизация микросом. Микросомы -
Нами была разработана система, в которой
это морфологически замкнутые везикулы, со-
в качестве нанопористого материала использо-
держащие компоненты цитохром Р450-моно-
вались пластины из анодного оксида алюми-
оксигеназной системы, которые образуются
ния для модификации поверхности электро-
из эндоплазматического ретикулума при го-
да (рис. 4). Такой подход позволил значительно
могенизации ткани [84]. Микросомы печени
увеличить выход продукта реакции N-деметили-
используются как удобный источник фермен-
рования эритромицина цитохромом P450 3A4.
тов цитохрома P450 для анализа токсичности
При использовании пор размером 100 нм выход
in vitro и разработки новых лекарственных
продукта увеличивался в 2,32 раза, а при раз-
препаратов. Микросомы печени
- лабора-
мере пор 200 нм - в 1,32 раза. Такое различие
торно приготовленные субклеточные фракции
может быть обусловлено более упорядочен-
мембраны печени, содержащие метаболизи-
ной ориентацией молекулы фермента в порах
рующие лекарства, цитохромы P450 и их ре-
меньшего размера [82]. Для сравнительной
докс-партнеры (CPR и цитохром b5). Основным
БИОХИМИЯ том 88 вып. 10 2023
ЦИТОХРОМЫ Р450 КАК БИОСЕНСОРЫ И БИОРЕАКТОРЫ
1995
преимуществом использования микросом яв-
сить чувствительность сенсора к лекарствен-
ляется сохранение стабильности структуры
ным препаратам по сравнению с сенсорами,
фермента и каталитической активности за
где не были использованы магнитные нано-
счет микроокружения, которое не изменяется
частицы.
после выделения микросомальной фракции.
Описаны методы иммобилизации мик-
Кроме того, белки редокс-партнеры также
росом непосредственно на электроде без ис-
способствуют ускорению переноса электро-
пользования модификаторов или медиаторов
нов от электрода к активному центу цито-
электронного транспорта. В таких системах
хрома P450.
роль модификатора, защищающего фермент
Микросомы клеток насекомых, содержа-
от денатурации на поверхности электрода, вы-
щие цитохромы P450 1A2 и 3A4, экспресси-
полняют фосфолипиды оболочки микросом.
рованные при помощи бакуловируса, были
Впервые такой подход был реализован в рабо-
иммобилизованы на электроде из пиролити-
те Walgama et al. [90], где авторы использовали
ческого графита, модифицированного само-
электроды, изготовленные из различных мате-
организующимися слоями полиэтиленими-
риалов: пиролитического графита, стеклоугле-
на [85, 86]. Nerimetla и Krishnan [87] исполь-
рода или графита высокой степени очистки,
зовали микросомы печени крысы, содержа-
при этом обладающих различной неоднород-
щие цитохромы P450 3A, 2C, 2E1, 1A и 4A.
ностью поверхности. Авторы установили, что
Послойную иммобилизацию методом капель-
различная неоднородность поверхности элек-
ного нанесения проводили на электроде из
тродов влияет на электрохимические парамет-
пиролитического графита, модифицирован-
ры, при этом гетерогенная константа скоро-
ного поли (диаллилдиметиламмоний хлори-
сти переноса электронов выше для электродов
дом). Микросомы клеток насекомых, содер-
из более однородных (гладких) материалов,
жащие цитохромы P450, экспрессированные
таких как стеклоуглеродный электрод. Однако
при помощи бакуловируса (бактосомы, баку-
количество электроактивного белка, по рас-
лосомы), используются для иммобилизации
четам авторов, было больше для электродов
на электродах, модифицированных различ-
с неоднородной поверхностью, что можно
ными методами, направленными на увеличе-
объяснить более развитой поверхностью для
ние эффективности электрокаталитических
включения белка. В работе Walker et al. [91]
свойств [85-90]. Среди публикаций, посвя-
исследовали влияние неоднородности поверх-
щенных созданию биосенсоров на основе мик-
ности электрода на электрохимические харак-
росом, можно выделить основные тенденции:
теристики микросом с использованием диско-
создание биосенсоров для анализа лекарствен-
вого электрода. Целью работы было создание
ных веществ и разработка биореакторов для
биосенсора с прямой иммобилизацией мик-
получения функционально значимых мета-
росом на поверхности электрода без дополни-
болитов.
тельных медиаторов электронного транспорта.
Углеродные наноматериалы также нашли
Дисковые электроды из высокочистого гра-
свое применение в создании биосенсоров на
фита легко возобновляемы путем полировки.
основе микросом благодаря более развитой
Авторы выяснили, что оптимальным для им-
площади поверхности, что способствует улуч-
мобилизации микросом является поверхность
шению электрохимических характеристик си-
электрода с неоднородностью ~8 мкм; более
стемы [86]. Нанокомпозитные материалы на
гладкая поверхность хоть и способствует уве-
основе благородных металлов и углеродных
личению скоростей переноса электронов, од-
наноматериалов также применялись для им-
нако снижает ток в присутствии кислорода,
мобилизации микросом [85].
негативно сказываясь на эффективности ме-
В работе Nerimetla et al. [89] был предло-
таболизма субстрата.
жен метод иммобилизации, основанный на
С развитием методических подходов мо-
электростатическом взаимодействии. Микро-
лекулярной биологии стала доступна коэкс-
сомы, заряженные отрицательно благодаря
прессия в культурах клеток, инфицированных
фосфолипидам, смешивали с магнитными
рекомбинантными бакуловирусами, или в
наночастицами, модифицированными амино-
бактериальных клетках одновременно цито-
группами, которые затем адсорбировались
хрома P450, редуктазы и цитохрома b5. По-
на электродах из пиролитического графита.
лучаемые данным методом биологические
Такой подход позволяет увеличить количе-
материалы коммерчески доступны и реализу-
ство микросом на электроде за счет увели-
ются под названиями бактосомы (BactosomesTM,
чения площади поверхности, доступной для
компания «Cypex»), суперсомы (SupersomesTM,
иммобилизации, и, таким образом, повы-
разработанные компанией
«Gen Test») или
БИОХИМИЯ том 88 вып. 10 2023
1996
КОРОЛЕВА и др.
бакулосомы (BaculosomesTM, компания «Thermo-
ограниченный объем за счет использования
Fisher») [92, 93]. Применение бактосом для со-
трехмерных конструкций на основе нанопо-
здания биокатализаторов было продемонстри-
ристых материалов. При этом могут использо-
ровано в работе Nerimetla et al. [94]. В качестве
ваться различные материалы и их сочетания,
рабочего электрода авторы использовали по-
например, мезопористые материалы или по-
крытые золотом кристаллы кварца, модифи-
ристые мембраны. Электрохимические методы
цированные самоорганизующимися слоями
анализа функциональной активности фермен-
цистеамина, с адсорбированными пленками
тов получили широкое развитие вследствие
бактосом. В исследовании использовались
информативности методов и их многопара-
бактосомы, содержащие следующие комбина-
метричности. Кроме того, важный аспект -
ции белков: CYP2C9, CPR, CYP2C9 + CPR,
технологическая разработанность приборной
CYP3A4 + CPR. В качестве субстрата был вы-
базы и наличие программного обеспечения.
бран диклофенак, подвергающийся гидрокси-
Это позволяет стандартизовать исследования
лированию под действием CYP2C9 и CYP3A4.
и проводить сравнительный анализ ансамбля
Авторы оценили эффективность электроката-
различных биологических объектов. В связи
лиза различных систем и продемонстрировали
с этим электроанализ ферментов может быть
значимость CPR в бактосомальных пленках
одним из важнейших направлений в создании
для эффективности катализа, а также благо-
биосенсоров и биореакторов на основе цито-
творное влияние каталазы на скорость реак-
хромов Р450.
ции.
Вклад авторов. Шумянцева В.В. - концеп-
ция и руководство работой; Королева П.И. -
ЗАКЛЮЧЕНИЕ
написание текста статьи; Булко Т.В., Агафо-
нова Л.Е. - редактирование текста статьи.
В данном обзоре описаны подходы к
Финансирование. Исследование выполнено
повышению эффективности катализа цито-
при поддержке Российского научного фонда
хрома P450, представленные в современных
(грант
работах. Проведен анализ преимуществ в ис-
23-25-00064/).
пользовании цитохромов P450 при создании
Конфликт интересов. Авторы заявляют об
биореакторов, а также основные сложности и
отсутствии конфликта интересов.
затруднения на пути к их реализации. В каче-
Соблюдение этических норм. Настоящая
стве основной тенденции как для реконструи-
статья не содержит описания каких-либо ис-
рованных систем, так и для электрохимиче-
следований с участием людей или животных
ских является встраивание цитохрома P450 в
в качестве объектов.
СПИСОК ЛИТЕРАТУРЫ
1. Shumyantseva, V. V., Bulko, T. V., and Archakov,
epoxide intermediates, J. Biol. Chem., 257, 3771-3781,
A. I. (2005) Electrochemical reduction of cytochrome
doi: 10.1016/S0021-9258(18)34848-8.
P450 as an approach to the construction of biosensors
5. Zanger, U. M., and Schwab, M. (2013) Cytochrome
and bioreactors, J. Inorg. Biochem., 99, 1051-1063,
P450 enzymes in drug metabolism: regulation of
doi: 10.1016/j.jinorgbio.2005.01.014.
gene expression, enzyme activities, and impact of
2. Guengerich, F. P. (2015) Human cytochrome P450
genetic variation, Pharmacol. Ther., 138, 103-141,
enzymes, in Cytochrome P450: Structure, Mechanism,
doi: 10.1016/j.pharmthera.2012.12.007.
and Biochemistry (de Montellano, O. P. R., eds)
6. Crettol, S., Petrovic, N., and Murray, M. (2010) Phar-
Springer, N. Y., pp. 523-785, doi: 10.1007/978-3-
macogenetics of phase I and phase II drug metabo-
319-12108-6.
lism, Curr. Pharm. Des., 16, 204-219, doi: 10.2174/
3. Zhang, Y.-Y., and Yang, L.
(2009) Interactions
138161210790112674.
between human cytochrome P450 enzymes and ste-
7. Sono, M., Roach, M. P., Coulter, E. D., and Dawson,
roids: physiological and pharmacological implica-
J. H.
(1996) Heme-containing oxygenases, Chem.
tions, Expert Opin. Drug Metab. Toxicol., 5, 621-629,
Rev., 96, 2841-2887, doi: 10.1021/cr9500500.
doi: 10.1517/1742525090296764.
8. Zuccarello, L., Barbosa, C., Todorovic, S., and
4. Oliw, E. H., Guengerich, F. P., and Oates, J. A.
Selivera, C. M.
(2021) Electrocatalysis by heme
(1982) Oxygenation of arachidonic acid by hepatic
enzymes-applications in biosensing, Catalysts,
11,
monooxygenases. Isolation and metabolism of four
218, doi: 10.3390/catal11020218.
БИОХИМИЯ том 88 вып. 10 2023
ЦИТОХРОМЫ Р450 КАК БИОСЕНСОРЫ И БИОРЕАКТОРЫ
1997
9.
Bandookwala, M., Nemani, K. S., Chatterjee, B.,
20.
Katagiri, M., Ganguli, B. N., and Gunsalus, I. C.
and Sengupta, P.
(2020) Reactive metabolites:
(1968) A soluble cytochrome P-450 functional in
generation and estimation with electrochemistry
methylene hydroxylation, J. Biol. Chem., 243, 3543-
based analytical strategy as an emerging Screening
3546, doi: 10.1016/S0021-9258(18)93343-0.
tool, Curr. Anal. Chem., 16, 811-825, doi: 10.2174/
21.
Hedegaard, J., and Gunsalus, I. C. (1965) Mixed func-
1573411016666200131154202.
tion oxidation: IV. Aninduced methylene hydroxylase
10.
Portychova, L., and Schug, K. A. (2017) Instrumen-
in camphor oxidation, J. Biol. Chem., 240, 4038-4043,
tation and applications of electrochemistry coupled to
doi: 10.1016/S0021-9258(18)97147-4.
mass spectrometry for studying xenobiotic metabolism:
22.
Conrad, H. E., Lieb, K., and Gunsalus, I. C. (1965)
a review, Anal. Chim. Acta, 993, 1-21, doi: 10.1016/
Mixed function oxidation: III. An electron transport
j.aca.2017.08.050.
complex in camphor ketolactonization, J. Biol. Chem.,
11.
Grint, I., Crea, F., and Vasiliadou, R.
(2022)
240, 4029-4037, doi: 10.1016/S0021-9258(18)97146-2.
The combination of electrochemistry and micro-
23.
Estabrook, R. W., Hildebrandt, A., Baron, J.,
fluidic technology in drug metabolism studies,
Netter, K. J., and Leibman, K. (1971) A new spectral
ChemistryOpen,
11, e202200100, doi:
10.1002/
species associated with cytochrome P-450 in liver
open.202200100.
microsomes, Biochem. Biophys. Res. Commun., 3, 260-
12.
Waskell, L., and Kim, J.-J. P.
(2015) Electron
261, doi: 10.1016/0006-291X(71)90372-X.
transfer partners of cytochrome P450, in Cyto-
24.
Guengerich, F. P., and Johnson, W. W. (1997) Kinetics
chrome P450: Structure, Mechanism, and Biochem-
of ferric cytochrome P450 reduction by NADPH-cyto-
istry (de Montellano, O. P. R., eds) Springer, N. Y.,
chrome P450 reductase: rapid reduction in the absence
pp. 33-68, doi: 10.1007/978-3-319-12108-6.
of substrate and variations among cytochrome P450
13.
Im, S.-C., and Waskell, L. (2011) The interaction
systems, Biochemistry, 36, 14741-14750, doi: 10.1021/
of microsomal cytochrome P450
2B4 with its
bi9719399.
redox partners, cytochrome P450 reductase and
25.
Bernhardt, R. (1996) Cytochrome P450: structure,
cytochrome b5, Arch. Biochem. Biophys., 507, 144-153,
function and generation of reactive oxygen species,
doi: 10.1016/j.abb.2010.10.023.
Rev. Physiol. Biochem. Pharmacol.,
127,
137-221,
14.
Zhang, H., Im, S.-C., and Waskell, L. (2007) Cy-
doi: 10.1007/BFb0048267.
tochrome b5 increases the rate of product formation
26.
Hrycay, E. G., and Bandiera, S. M. (2012) The mono-
by cytochrome P450 2B4 and competes with cyto-
oxygenase, peroxidase, and peroxygenase properties
chrome P450 reductase for a binding site on cyto-
of cytochrome P450, Arch. Biochem. Biophys., 522,
chrome P450 2B4*, J. Biol. Chem., 282, 29766-29776,
71-89, doi: 10.1016/j.abb.2012.01.003.
doi: 10.1074/jbc.M703845200.
27.
Bernhardt, R., and Urlacher, V. B. (2014) Cytochromes
15.
Hannemann, F., Bichet, A., Ewen, K. M., and
P450 as promising catalysts for biotechnological
Bernhardt, R. (2007) Cytochrome P450 systems -
application: chances and limitations, Appl. Micro-
biological variations of electron transport chains,
biol. Biotechnol., 98, 6185-6203, doi: 10.1007/s00253-
Biochim. Biophys. Acta, 1770, 330-344, doi: 10.1016/
014-5767-7.
j.bbagen.2006.07.017.
28.
Kumar, S.
(2010) Engineering cytochrome P450
16.
Lambeth, J. D. (1990) in Molecular Mechanisms
biocatalysts for biotechnology, medicine and biore-
of Adrenal Steroidogenesis and Aspects of Regulation
mediation, Expert Opin. Drug Metab. Toxicol., 6,
and Application (Ruckpaul, K., and Rein, H., eds)
115-131, doi: 10.1517/17425250903431040.
De Gruyter, Berlin, Boston, pp.
58-100, doi:
29.
Venkatakrishnan, K., von Moltke, L. L., and
10.1515/9783112563281-003.
Greenblatt, D. J. (2001) Human drug metabolism
17.
Atkins, W. M., and Sligar, S. G. (1988) The roles
and the cytochromes P450: application and relevance
of active site hydrogen bonding in cytochrome
of in vitro models, J. Clin. Pharmacol., 41, 1149-1179,
P-450cam as revealed by site-directed mutagene-
doi: 10.1177/00912700122012724.
sis, J. Biol. Chem., 263, 18842-18849, doi: 10.1016/
30.
Baj-Rossi, C., De Micheli, G., and Carrara, S.
S0021-9258(18)37359-9.
(2011) P450-based nano-bio-sensors for personal-
18.
Narhi, L. O., and Fulco, A. J. (1986) Charac-
ized medicine, in Biosensors Emerging Materials and
terization of a catalytically self-sufficient 119,000-
Applications (Serra, P. A., ed) InTech, London, doi:
dalton cytochrome P-450 monooxygenase induced
10.5772/16328.
by barbiturates in Bacillus megaterium, J. Biol.
31.
Joseph, S., Rusling, J. F., Lvov, Y. M., Friedberg, T.,
Chem.,
261,
7160-7169, doi:
10.1016/S0021-9258
and Fuhr, U. (2003) An amperometric biosensor
(17)38369-2.
with human CYP3A4 as a novel drug screening tool,
19.
Denisov, I. G., Makris, T. M., Sligar, S. G., and
Biochem. Pharmacol., 65, 1817-1826, doi: 10.1016/
Schlichting, I. (2005) Structure and chemistry of
S0006-2952(03)00186-2.
cytochrome P450, Chem. Rev.,
105,
2253-2278,
32.
Morant, M., Bak, S., Møller, B. L., and Werck-
doi: 10.1021/cr0307143.
Reichhart, D. (2003) Plant cytochromes P450: tools
БИОХИМИЯ том 88 вып. 10 2023
1998
КОРОЛЕВА и др.
for pharmacology, plant protection and phytoreme-
45.
Strohmaier, S. J., De Voss, J. J., Jurva, U., Andersson, S.,
diation, Curr. Opin. Biotechnol., 14, 151-162, doi:
and Gillam, E. M. J. (2020) Oxygen surrogate systems
10.1016/s0958-1669(03)00024-7.
for supporting human drug-metabolizing cytochrome
33.
Jennewein, S., and Croteau, R.
(2001) Taxol:
P450 enzymes, Drug Metab. Dispos., 48, 432-437,
biosynthesis, molecular genetics, and biotechnological
doi: 10.1124/dmd.120.090555.
applications, Appl. Microbiol. Biotechnol., 57, 13-19,
46.
Albertolle, M. E., and Guengerich, F. P.
(2018)
doi: 10.1007/s002530100757.
The relationships between cytochromes P450
34.
Falck, J. R., Reddy, Y. K., Haines, D. C., Reddy,
and H2O2: Production, reaction, and inhibition,
K. M., Krishna, U. M., Graham, S., Murry, B., and
J. Inorg. Biochem.,
186,
228-234, doi:
10.1016/
Peterson, J. A.
(2001) Practical, enantiospecific
j.jinorgbio.2018.05.014.
syntheses of 14,15-EET and leukotoxin B (vernolic
47.
Veith, A., and Moorthy, B. (2018) Role of cytochrome
acid), Tetrahedron Lett., 42, 4131-4133, doi: 10.1016/
P450s in the generation and metabolism of reactive
S0040-4039(01)00694-3.
oxygen species, Curr. Opin. Toxicol.,
7,
44-51,
35.
Krishnan, S.
(2020) Bioelectrodes for evaluating
doi: 10.1016/j.cotox.2017.10.003.
molecular therapeutic and toxicity properties,
48.
Girhard, M., Kunigk, E., Tihovsky, S., Shumyantseva,
Curr. Opin. Electrochem., 19, 20-26, doi: 10.1016/
V. V., and Urlacher, V. B. (2013) Light-driven bio-
j.coelec.2019.09.004.
catalysis with cytochrome P450 peroxygenases, Bio-
36.
Sakaki T. (2012) Practical application of cytochrome
technol. Appl. Biochem., 60, 111-118, doi: 10.1002/
P450, Biol. Pharm. Bull., 35, 844-849, doi: 10.1248/
bab.1063.
bpb.35.844.
49.
Chen, H., Huang, M., Yan, W., Bai, W.-J., and
37.
Di Nardo, G., and Gilardi, G. (2020) Natural com-
Wang, X. (2021) Enzymatic regio- and enantiose-
pounds as pharmaceuticals: the key role of cyto-
lective C-H oxyfunctionalization of fatty acids,
chromes P450 reactivity, Trends Biochem. Sci., 45,
ACS Catal., 11, 10625-10630, doi: 10.1021/acscatal.
511-525, doi: 10.1016/j.tibs.2020.03.004.
1c03292.
38.
Girhard, M., Bakkes, P. J., Mahmoud, O., and
50.
Wise, C. E., Hsieh, C. H., Poplin, N. L., and Makris,
Urlacher, V. B. (2015) P450 Biotechnology, in Cyto-
T. M. (2018) Dioxygen activation by the biofuel-
chrome P450: Structure, Mechanism, and Biochem-
generating cytochrome P450 OleT, ACS Catal.,
istry (de Montellano, O. P. R., eds) Springer, N. Y.,
8, 9342-9352, doi: 10.1021/acscatal.8b02631.
pp. 451-520, doi: 10.1007/978-3-319-12108-_8.
51.
Yamazaki, H., Nakano, M., Imai, Y., Ueng, Y.-F.,
39.
Urlacher, V. B., and Girhard, M. (2012) Cytochrome
Guengerich, F. P., and Shimada, T. (1996) Roles of
P450 monooxygenases: an update on perspectives for
cytochrome b5 in the oxidation of testosterone and
synthetic application, Trends Biotechnol., 30, 26-36,
nifedipine by recombinant cytochrome P450 3A4 and
doi: 10.1016/j.tibtech.2011.06.012.
by human liver microsomes, Arch. Biochem. Biophys.,
40.
Bernhardt, R.
(2006) Cytochromes P450 as ver-
325, 174-182, doi: 10.1006/abbi.1996.0022.
satile biocatalysts, J. Biotechnol.,
124,
128-145,
52.
Backes, W. L., and Kelley, R. W. (2003) Organization of
doi: 10.1016/j.jbiotec.2006.01.026.
multiple cytochrome P450s with NADPH-cytochrome
41.
Yun, C.-H., Kim, K.-H., Kim, D.-H., Jung, H.-C.,
P450 reductase in membranes, Pharmacol. Ther., 98,
and Pan, J.-G. (2007) The bacterial P450 BM3: a
221-233, doi: 10.1016/s0163-7258(03)00031-7.
prototype for a biocatalyst with human P450 activ-
53.
Shangguan, L., Wei, Y., Liu, X., Yu, J., and Liu, S.
ities, Trends Biotechnol., 25, 289-298, doi: 10.1016/
(2017) Confining a bi-enzyme inside the nanochan-
j.tibtech.2007.05.003.
nels of a porous aluminum oxide membrane for accel-
42.
Correddu, D., Di Nardo, G., and Gilardi, G. (2021)
erating the enzymatic reactions, Chem. Commun., 53,
Self-sufficient class VII cytochromes P450: from full-
2673-2676, doi: 10.1039/C7CC00300E.
length structure to synthetic biology applications,
54.
Furlani, I. L., Oliveira, R. V., and Cass, Q. B. (2023)
Trends Biotechnol.,
39,
1184-1207, doi:
10.1016/
Immobilization of cytochrome P450 enzymes onto
j.tibtech.2021.01.011.
magnetic beads: an approach to drug metabolism and
43.
Gilardi, G., Meharenna, Y. T., Tsotsou, G. E.,
biocatalysis, Talanta Open, 7, 100181, doi: 10.1016/
Sadeghi, S. J., Fairhead, M., and Giannini, S. (2002)
j.talo.2023.100181.
Molecular Lego: design of molecular assemblies
55.
Brian, W. R., Sari, M. A., Iwasaki, M., Shimada, T.,
of P450 enzymes for nanobiotechnology, Biosens.
Kaminsky, L. S., and Guengerich, F. P. (1990) Cata-
Bioelectron., 17, 133-145, doi: 10.1016/s0956-5663
lytic activities of human liver cytochrome P-450 IIIA4
(01)00286-x.
expressed in Saccharomyces cerevisiae, Biochemistry,
44.
Cirino, P., and Arnold, F. (2002) Regioselectivity and
29, 11280-11292, doi: 10.1021/bi00503a018.
activity of cytochrome P450 BM-3 and mutant f87A
56.
Rendic, S. (2002) Summary of information on hu-
in reactions driven by hydrogen peroxide, Adv. Synth.
man CYP enzymes: human P450 metabolism
Catal., 344, 932-937, doi: 10.1002/1615-4169(200210)
data, Drug Metab. Rev., 34, 83-448, doi: 10.1081/
344:9<932::AID-ADSC932>3.0.CO;2-M.
dmr-120001392.
БИОХИМИЯ том 88 вып. 10 2023
ЦИТОХРОМЫ Р450 КАК БИОСЕНСОРЫ И БИОРЕАКТОРЫ
1999
57.
Srdič, M., Fessner, N. D., Yildiz, D., Glieder, A.,
68.
Lamb, D. C., Waterman, M. R., Kelly, S. L., and
Spiertz, M., and Schwaneberg, U. (2022) Preparative
Guengerich, F. P. (2007) Cytochromes P450 and
production of functionalized (N- and O-Heterocyclic)
drug discovery, Curr. Opin. Biotechnol., 18, 504-512,
polycyclic aromatic hydrocarbons by human
doi: 10.1016/j.copbio.2007.09.010.
cytochrome P450 3A4 in a bioreactor, Biomolecules,
69.
Guengerich, F. P.
(2021) Drug metabolism: cy-
12, 153, doi: 10.3390/biom12020153.
tochrome P450, in Reference Module in Biomedi-
58.
Shumyantseva, V. V., Bulko, T. V., Schmid, R. D.,
cal Sciences, Elsevier, Netherlands, doi:
10.1016/
and Archakov, A. I. (2002) Photochemical prop-
B978-0-12-820472-6.99996-1.
erties of a riboflavins/cytochrome P450 2B4 com-
70.
Bavishi, K., Laursen, T., Martinez, K. L., Møller,
plex, Biosens. Bioelectron, 17, 233-238, doi: 10.1016/
B. L., and Della Pia, E. A. (2016) Application of
S0956-5663(01)00181-6.
nanodisc technology for direct electrochemical
59.
Le, T.-K., Park, J. H., Choi, D. S., Lee, G.-Y., Choi,
investigation of plant cytochrome P450s and their
W. S., Jeong, K. J., Park, C. B., and Yun, C.-H. (2019)
NADPH P450 oxidoreductase. Sci. Rep., 6, 29459,
Solar-driven biocatalytic C-hydroxylation through
doi: 10.1038/srep29459.
direct transfer of photo induced electrons, Green
71.
Shumyantseva, V. V., Koroleva, P. I., Bulko, T. V.,
Chem., 21, 515-525, doi: 10.1039/c8gc02398k.
Shkel, T. V., Gilep, A. A., and Veselovsky, A. V.
60.
Park, J. H., Lee, S. H., Cha, Choi, G. S., D. S.,
(2023) Approaches for increasing the electrocatal-
Nam, D. H., Lee, J. H., Lee, J.-K., Yun, C.-H.
itic efficiency of cytochrome P450 3A4, Bioelectro-
Jeong, K. J., and Park, C. B. (2015) Cofactor-free
chemistry, 149, 108277, doi: 10.1016/j.bioelechem.
light-driven whole-cell cytochrome P450 cataly-
2022.108277.
sis, Angew. Chem., 127, 983-987, doi: 10.1002/anie.
72.
Miller, W. L.
(2005) Minireview: regulation of
201410059.
steroidogenesis by electron transfer, Endocrinology,
61.
Shumyantseva, V. V., Kuzikov, A. V., Masamrekh,
146, 2544-2550, doi: 10.1210/en.2005-0096.
R. A., Bulko, T. V., and Archakov, A. I. (2018) From
73.
Di Nardo, G., and Gilardi, G. (2021) Engineered
electrochemistry to enzyme kinetics of cytochrome
human CYP2C9 and its main polymorphic vari-
P450, Biosens. Bioelectron., 15, 192-204 doi: 10.1016/
ants for bioelectrochemical measurements of cat-
j.bios.2018.08.040.
alytic response, Bioelectrochemistry,
138,
107729,
62.
Schneider, E., and Clark, D. S. (2013) Cytochrome
doi: 10.1016/j.bioelechem.2020.107729.
P450 (CYP) enzymes and the development of
74.
Zhang, C., Lu, M., Lin, L., Huang, Z., Zhang, R.,
CYP biosensors, Biosens. Bioelectron.,
39,
1-13,
Wu, X., and Chen, Y. (2020) Riboflavin is directly
doi: 10.1016/j.bios.2012.05.043.
involved in N-dealkylation catalyzed by bacterial cy-
63.
Ducharme, J., and Auclair, K. (2018) Use of bio-
tochrome P450 monooxygenases, ChemBioChem, 21,
conjugation with cytochrome P450 enzymes, Bio-
2297-2305, doi: 10.1002/cbic.202000071.
chim. Biophys. Acta Proteins Proteomics, 1866, 32-51,
75.
Gray, J. J. (2004) The interaction of proteins with
doi: 10.1016/j.bbapap.2017.06.007.
solid surfaces, Curr. Opin. Struct. Biol., 14, 110-115,
64.
Valikhani, D., Bolivar, J. M., and Pelletier, J. N.
doi: 10.1016/j.sbi.2003.12.001.
(2021) An overview of cytochrome P450 immobiliza-
76.
Mie, Y., Ikegami, M., and Komatsu. Y.
(2016)
tion strategies for drug metabolism studies, biosens-
Nanoporous structure of gold electrode fabricated by
ing, and biocatalytic applications: challenges and op-
anodization and its efficacy for direct electrochemistry
portunities, ACS Catal., 11, 9418-9434, doi: 10.1021/
of human cytochrome P450, Chem. Lett., 45, 640-642,
acscatal.1c02017.
doi: 10.1246/cl.160164.
65.
Bistolas, N., Wollenberger, U., Jung, C., and Scheller,
77.
Dai, Q., Yang, L., Wang, Y., Cao, X., Yao, C., and Xu,
F. W. (2005) Cytochrome P450 biosensors - a review,
X. (2020) Surface charge-controlled electron transfer
Biosens. Bioelectron., 20, 2408-2423, doi: 10.1016/
and catalytic behavior of immobilized cytochrome
j.bios.2004.11.023.
P450 BM3 inside dendritic mesoporous silica
66.
Asturias-Arribas, L., Alonso-Lomillo, M. A., Domín-
nanoparticles, Anal. Bioanal. Chem., 412, 4703-4712,
guez-Renedo, O., and Arcos-Martínez, M. J. (2013)
doi: 10.1007/s00216-020-02727-0.
Electrochemical determination of cocaine using
78.
Xu, X., Zheng, Q., Bai, G., Dai, Q., Cao, X., Yao,
screen-printed cytochrome P450 2B4 based biosen-
Y., Liu, S., and Yao, C.
(2018) Polydopamine
sors, Talanta, 105, 131-134, doi: 10.1016/j.talanta.
functionalized nanoporous graphene foam as
2012.11.078.
nanoreactor for efficient electrode-driven metabolism
67.
Rusling, F., Wang, B., and Yun, S. (2008) Elec-
of steroid hormones, Biosens. Bioelectron., 119, 182-
trochemistry of redox enzymes, in Bioelectro-
190, doi: 10.1016/j.bios.2018.08.009.
chemistry: Fundametals, Experimental Techniques
79.
Lu, J., Li, H., Cui, D., Zhang, Y., and Liu, S.
and Applications (Bartlett, P. N., ed) John Wiley
(2014) Enhanced enzymatic reactivity for elec-
& Sons Ltd., New Jersey, pp. 39-85, doi: 10.1002/
trochemically driven drug metabolism by confin-
9780470753842.ch2.
ing cytochrome P450 enzyme in TiO2 nanotube
БИОХИМИЯ том 88 вып. 10 2023
2000
КОРОЛЕВА и др.
arrays, Anal. Chem., 86, 8003-8009, doi: 10.1021/
nanostructures for stereoselective green drug metab-
ac502234x.
olite synthesis, Chem. Commun., 51, 11681-11684,
80.
Shumyantseva, V. V., Kuzikov, A. V., Masamrekh,
doi: 10.1039/c5cc03364k.
R. A., Filippova, T. A., Koroleva, P. I., Agafonova,
88.
Xu, X., Bai, G., Song, L., Zheng, Q., Yao, Y., Liu, S.,
L. E., Bulko, T. V., and Archakov, A. I. (2022) En-
and Yao, C. (2017) Fast steroid hormone metabolism
zymology on an electrode and in a nanopore: anal-
assays with electrochemical liver microsomal
ysis algorithms, enzyme kinetics, and perspectives,
bioreactor based on polydopamine encapsulated gold-
BioNanoScience, 12, 1341-1355, doi: 10.1007/s12668-
graphene nanocomposite, Electrochim. Acta,
258,
022-01037-2.
1365-1374, doi: 10.1016/j.electacta.2017.11.195.
81.
Küchler, A., Yoshimoto, M., Luginbühl, S., Mavel-
89.
Nerimetla, R., Premaratne, G., Liu, H., and Krish-
li F., and Walde, P. (2016) Enzymatic reactions in
nan, S. (2018) Improved electrocatalytic metabolite
confined environments, Nat. Nanotech., 11, 409-420,
production and drug biosensing by human liver mic-
doi: 10.1038/nnano.2016.54.
rosomes immobilized on amine-functionalized mag-
82.
Шумянцева В. В., Королева П. И., Гилеп А. А., На-
netic nanoparticles, Electrochim. Acta, 280, 101-107,
польский К. С., Иванов Ю. Д., Канашенко С. Л.,
doi: 10.1016/j.electacta.2018.05.085.
Арчаков А. И. (2022) Повышение эффективности
90.
Walgama, C., Nerimetla, R., Materer, N. F.,
электрокатализа цитохрома Р450 3А4 с помощью
Schildkraut, D., Elman, J. F., and Krishnan. S.
модификации электрода пространственно-упоря-
(2015) A simple construction of electrochemical liver
доченными наноструктурами на основе анодного
microsomal bioreactor for rapid drug metabolism
оксида алюминия для исследования метаболиче-
and inhibition, Assays Anal. Chem., 87, 4712-4718,
ских превращений лекарственных препаратов,
doi: 10.1021/ac5044362.
Докл. Росс. Акад. Наук Науки о Жизни, 506, 62-67,
91.
Walker, A., Walgama, C., Nerimetla, R., Alavi,
doi: 10.31857/S26867389220502986.
S. H., Echeverria, E., Harimkar, S. P., McIlroy,
83.
Koroleva, P. I., Gilep, A. A., Kraevskiy, S. V., Tsybruk,
D. N., and Krishnan, S. (2020) Roughened graph-
T. V., and Shumyantseva, V. V. (2023) Improving the
ite biointerfaced with P450 liver microsomes: Sur-
efficiency of electrocatalysis of cytochrome P450
face and electrochemical characterizations, Col-
3A4 by modifying the electrode with membrane
loids Surf. B, 189, 110790, doi: 10.1016/j.colsurfb.
protein streptolysin o for studying the metabolic
2020.110790.
transformations of drugs, Biosensors,
13,
457,
92.
Kahma, H., Filppula, A. M., Launiainen, T.,
doi: 10.3390/bios13040457.
Viinamäki, J., Neuvonen, M., Evangelista, E. A.,
84.
Арчаков А. И. (1975) Микросомальное окисление,
Totah, R. A., and Backman, J. T. (2019) Disparities
Наука, Москва, 327 с.
in CYP2C8 inactivation between enzyme sources,
85.
Sultana, N., Schenkman, J. B., and Rusling. J. F.
Drug Metab. Dispos.,
47,
436-443, doi:
10.1124/
(2005) Protein film electrochemistry of microsomes
dmd.118.085498.
genetically enriched in human cytochrome P450
93.
Kumar, V., Rock, D. A., Warren, C. J., Tracy, T. S.,
monooxygenases, J. Am. Chem. Soc., 127, 13460-
and Wahlstrom, J. L. (2006) Enzyme source effects on
13461, doi: 10.1021/ja0538334.
CYP2C9 kinetics and inhibition, Drug Metab. Dispos.,
86.
Krishnan, S., and Rusling, J. F. (2007) Thin film
34, 1903-1908, doi: 10.1124/dmd.106.010249.
voltammetry of metabolic enzymes in rat liver
94.
Nerimetla, R., Walgama, C., Singh, V., Hartson,
microsomes, Electrochem. Commun., 9, 2359-2363,
S. D., and Krishnan, S. (2017) Mechanistic insights on
doi: 10.1016/j.elecom.2007.07.002.
the voltage-driven biocatalysis of a cytochrome P450
87.
Nerimetla, R., and Krishnan, S. (2015) Electroca-
bactosomal film on a self-assembled monolayer, ACS
talysis by subcellular liver fractions bound to carbon
Catal., 7, 3446-3453, doi: 10.1021/acscatal.6b03588.
CATALYTIC AND ELECTROCATALYTIC MECHANISMS
OF CYTOCHROMES P450 IN THE DEVELOPMENT
OF BIOSENSORS AND BIOREACTORS
Review
P. I. Koroleva1, T. V. Bulko1, L. E. Agafonova1, and V. V. Shumyantseva1,2*
1 Institute of Biomedical Chemistry (IBMC),
119121 Moscow, Russia; e-mail: viktoria.shumyantseva@ibmc.msk.ru
2 The Russian National Research Medical University named after N. I. Pirogov, 117997 Moscow, Russia
БИОХИМИЯ том 88 вып. 10 2023
ЦИТОХРОМЫ Р450 КАК БИОСЕНСОРЫ И БИОРЕАКТОРЫ
2001
Cytochromes P450 are unique family of isozymes, discovered in all kingdoms of living species (in animals,
bacteria, plants, fungi, archaea). The main functional role of the cytochromes P450 is biotransformation
of exogenous and endogenous compounds. This review is highlighted problem of enchasing effectivity of
electrocatalysis of cytochromes P450, enzymes that have unique capabilities both for biosensors’ design
and for biotechnological application. In this review paper, we summarize main methods and modern trends
based on biochemical mechanism of cytochromes P450 for development of reconstructing and electro-
chemical catalytic systems for practical application of these enzymes.
Keywords: cytochrome P450, mechanism of catalysis, bioelectrochemistry, electrocatalysis
19
БИОХИМИЯ том 88 вып. 10 2023