БИОХИМИЯ, 2023, том 88, вып. 11, с. 2109 - 2126
УДК 577.2
РЕТРОТРАНСПОЗОНЫ И ТЕЛОМЕРЫ
Обзор
© 2023 А.И. Калмыкова*, О.А. Соколова
Институт биологии развития им. Н.К. Кольцова РАН,
119334 Москва, Россия; электронная почта: allakalm@idbras.ru
Поступила в редакцию 19.06.2023
После доработки 24.07.2023
Принята к публикации 12.08.2023
Мобильные элементы (МЭ) составляют десятки процентов генома эукариот, являясь основным
источником нестабильности генома. Системы клеточной защиты подавляют экспансию МЭ на
всех стадиях их жизненного цикла. Белки подсемейств Piwi и Piwi-взаимодействующие короткие
РНК (piРНК) являются ключевыми элементами защитной системы, которая контролирует актив-
ность МЭ в гонадах многоклеточных животных, предотвращая наследуемые транспозиции и де-
фекты развития. В данном обзоре мы обсуждаем разнообразие регуляторных механизмов, с помо-
щью которых короткие РНК подавляют активность МЭ. Тем не менее активные МЭ присутствуют
в геномах, что свидетельствует об ограниченных возможностях этих механизмов защиты. Появля-
ется всё больше данных, которые свидетельствуют о том, что повышенная активность МЭ совпада-
ет в развитии с удлинением теломер и эпигенетическим перепрограммированием генома у разных
видов. У плодовой мухи Drosophila теломеры состоят из ретротранспозонов, а защитный механизм
с участием piРНК также необходим для поддержания теломер и контроля их длины. Следова-
тельно, работа защитных механизмов в данном случае должна быть тонко сбалансирована, чтобы
не только подавлять активность МЭ, но и поддерживать оптимальную длину и стабильность те-
ломер. Структурно-функциональная связь гомеостаза теломер с ретротранспозоном LINE1 у че-
ловека указывает на тесную взаимосвязь эгоистичных МЭ с жизненно важными функциями
генома. Такая связь, по-видимому, является наследием ретротранспозонного происхождения тело-
мер и позволяет сохранять активные МЭ в геноме. Своеобразной платой за такую «услугу» явля-
ется поддержание теломер и выполнение других жизненно важных функций, приобретённых МЭ
в процессе их одомашнивания в геноме.
КЛЮЧЕВЫЕ СЛОВА: ретротранспозоны, теломеры, теломераза, полиплоидия, Piwi, piРНК, зародышевая
линия, хроматин, LINE1, Drosophila.
DOI: 10.31857/S0320972523110076, EDN: MLIDFQ
ВВЕДЕНИЕ
ты и участвуя в ключевых механизмах раз-
вития и иммунного ответа [1-4]. МЭ вносят
К настоящему моменту накоплен доста-
вклад в формирование таких важных струк-
точный массив данных, который указывает на
тур хромосом, как центромеры и локус генов
то, что регуляция активности мобильных эле-
рибосомной РНК [5-8]. В данном обзоре мы
ментов (МЭ) и важные клеточные процессы
рассмотрим один из ярких примеров вклада
тесно связаны, и именно эта связь обеспечи-
ретротранспозонов в эволюцию генома, свя-
вает выживание в геноме МЭ, несмотря на
занных с происхождением и поддержанием
мощные системы подавления их активности.
теломер.
Каков механизм этого глобального геномного
Теломеры - концевые участки линейных
компромисса? МЭ служат богатым источни-
хромосом
- находятся в центре внимания
ком эволюционных преобразований в геноме,
множества исследователей уже больше 50 лет,
предоставляя энхансеры, промоторы, экзоны,
с 1971 г., когда было опубликовано блестящее
сайты сплайсинга, архитектурные элемен- предсказание Алексея Матвеевича Оловникова
Принятые сокращения: МЭ - мобильные элементы; piРНК - Piwi-interacting RNA, Piwi-взаимодействующие
короткие РНК; siРНК - Small interfering RNA, малые интерферирующие РНК.
* Адресат для корреспонденции.
2109
2110
КАЛМЫКОВА, СОКОЛОВА
об «Ахиллесовой пяте двойной спирали» -
мерами в геноме, которая, как показывают не-
о недорепликации концов хромосом [9, 10].
давние исследования, присутствует не только у
Им же было предположено существование
дрозофилы, но и у млекопитающих.
специализированной ДНК-полимеразы, ко-
торая обеспечивает удлинение теломерной
ДНК. Такой фермент, названный теломера-
ПОЧЕМУ ТЕЛОМЕРАЗА УТРАЧЕНА
зой, был обнаружен гораздо позже и оказал-
У МНОГИХ ВИДОВ НАСЕКОМЫХ
ся обратной транскриптазой, находящейся в
И ДРОЗОФИЛЫ?
комплексе с РНК-матрицей [11]. Предполага-
ется, что концы первичных линейных хромо-
Известно много видов растений и живот-
сом могли защищаться и поддерживаться за
ных, у которых в процессе эволюции теломе-
счёт присоединений ретроэлементов, а тело-
раза была утрачена, а для удлинения теломер
меразный рибонуклеопротеиновый комплекс
используются другие механизмы. У двукрылых
можно рассматривать как возникший в про-
ген теломеразы был потерян около 270 млн
цессе эволюции специализированный ретро-
лет назад [20]. Однако, несмотря на отсутствие
элемент, присоединяющийся на концы хромо-
теломеразы, представители отряда Diptera яв-
сом [12]. Действительно, филогенетический
ляются одними из наиболее многочисленных
анализ обратной транскриптазы выявил, что
и процветающих видов животных. Ген, коди-
теломераза и ретротранспозоны произошли
рующий теломеразу, не был найден в гено-
от общего предкового ретроэлемента [13-15].
мах видов Drosophila, а удлинение их теломер
Хотя у большинства организмов теломеры под-
происходит за счёт транспозиций мобильных
держиваются теломеразой, это не единствен-
элементов. Наиболее изученными являются
ный способ удлинения теломер. Среди совре-
теломерные ретроэлементы Drosophila melano-
менных видов животных есть такие, теломеры
gaster. Они представлены тремя семействами
которых поддерживаются за счёт присоеди-
ретротранспозонов типа LINE (Long Inter-
нений ретротранспозонов - это многие ви-
spersed Nuclear Elements) - HeT-A, TART и
ды насекомых, и в особенности семейство
TAHRE [21, 22]. В то же время у бабочки Bombyx
Drosophilidae. Считается, что у Drosophila тело-
mori (тутового шелкопряда) присутствует низ-
мераза была утеряна, а в поддержании теломер
коактивная теломераза, а теломерная ниша
участвуют специализированные теломерные
активно заполняется специализированными
ретротранспозоны. У шелкопряда смешанный
теломерными ретротранспозонами SART и
тип теломер, в поддержании которых участвует
TRAS [23]. С чем связана такая обратная эволю-
низкоактивная теломераза и специализиро-
ция и отказ от теломеразы, остаётся загадкой.
ванные теломерные ретроэлементы. У многих
Алексей Матвеевич Оловников особенно
видов животных, использующих теломеразу,
живо интересовался исключениями из правил,
включая человека, ретроэлементы также при-
ища объяснение тому или иному загадочному
соединяются к теломере в определённых усло-
явлению природы. В данной главе хотелось бы
виях [16, 17], используя двунитевой обрыв на
привести его оригинальные рассуждения по
конце хромосомы как удобную мишень для
поводу утраты теломеразы у дрозофилы, кото-
ретротранспозиций. В то же время у комаров
рые он высказывал в личной переписке: «Из-
не обнаружено ни теломеразы, ни теломерных
вестно, что хромосомы личиночных слюнных
ретроэлементов, а удлинение теломер, по-ви-
желез D. melanogaster подвергаются многим ра-
димому, происходит за счёт рекомбинации ко-
ундам эндорепликации. Вдобавок имеет место
ротких повторов сателлитной природы, обна-
соматический синапсис гомологичных хромо-
руженных в теломерах [18, 19].
сом. Однако строго точная боковая конъюга-
Теломеры, поддерживающиеся за счёт мо-
ция сестринских хроматид, плотно соединён-
бильных элементов, хоть и отличаются от те-
ных между собой по длине, с неизбежностью
ломер, которые поддерживаются с помощью
должна создавать в теломерной зоне чисто
теломеразы, тем не менее напоминают нам о
механическое препятствие для формирования
ретротранспозонном прошлом теломер. Ис-
теломеразной теломеры. Такая теломера дол-
следование регуляции теломер дрозофилы,
жна иметь теломерную петлю - трёхмерную
состоящих из ретротранспозонов, выявляет
структуру. Сотни конъюгированных хрома-
удивительное сходство, если не идентичность,
тидных концов, плотно объединённых в еди-
механизмов поддержания теломер и контроля
ном политенном пучке хроматид, создавали
активности МЭ. Это сходство приводит нас к
бы непреодолимые стерические препятствия
выводу о существовании тесной функциональ-
друг для друга при формировании своего 3D
ной связи между ретротранспозонами и тело-
теломерного комплекса. Поэтому дрозофилы,
БИОХИМИЯ том 88 вып. 11 2023
РЕТРОТРАНСПОЗОНЫ И ТЕЛОМЕРЫ
2111
применив политенизацию, были вынуждены
природе. Изучение теломер дрозофилы дало
отказаться от услуг теломеразы. В отличие от
нам возможность посмотреть с новой точки
указанной ситуации, процесс формирования
зрения на защитные механизмы регуляции МЭ
G-квадруплекса, защищающего конец ретро-
и их участие в функционировании теломер.
транспозона на конце каждой хроматиды, не
Наиболее ярким примером является участие
требует формирования теломерной петли и
механизма РНК-интерференции и коротких
благодаря этому легко совместим с боковой
РНК типа piРНК (Piwi-interacting RNA, Piwi-
конъюгацией хроматид. Можно предположить,
взаимодействующие короткие РНК) в контро-
что именно политенизация могла послужить
ле длины теломер дрозофилы в зародышевой
ключевой причиной выбора у дрозофилы аль-
линии.
тернативного способа защиты своих теломер.
Сама же политенизация хромосом в клетках
слюнных желез у личинок дрозофил, как из-
ПУТЬ С УЧАСТИЕМ piРНК:
вестно, необходима, в частности, для продук-
ИСТОЧНИКИ И МИШЕНИ piРНК
ции большого количества клейкого вещества
перед окукливанием. Плотная укладка хрома-
МЭ обнаружены во всех исследованных
тид, по-видимому, не используется теми орга-
организмах и представлены несколькими клас-
низмами, которые нуждаются в повышении
сами и многочисленными семействами [28].
копийности генов, но обладают при этом тело-
МЭ занимают почти половину генома челове-
меразными теломерами. Например, у инфузо-
ка и 20% генома D. melanogaster [29] и являются
рий, имеющих полиплоидный макронуклеус
основным источником мутаций, в том числе
и теломеразу, хромосомы фрагментированы.
тех, которые вызывают рак и нарушения раз-
Допустима также следующая альтернатива: если
вития [30, 31]. Существует множество различ-
теломеры, в отличие от остальной части поли-
ных стратегий для ограничения активности
тенизированных хроматид, не конъюгированы
МЭ в соматических клетках и предотвращения
(значит, свободны от упомянутого стериче-
наследуемых транспозиций в клетках заро-
ского препятствия), то это расширяет возмож-
дышевой линии. Особое внимание уделяется
ности применения теломеразного способа за-
регуляции транскрипции МЭ для подавления
щиты теломер. Поэтому могут существовать
первичной стадии их размножения. Тран-
виды, у которых на той или иной стадии раз-
скрипционный сайленсинг достигается двумя
вития используются политенные хромосомы и
основными механизмами, ведущими к фор-
теломераза-подобные белки, но концы хромо-
мированию неактивной структуры хроматина.
сом не спарены. Такие неспаренные концы
Первый и наиболее консервативный механизм
хромосом наблюдались, например, в специа-
компактизации хроматина связан с модифи-
лизированных политенных клетках и на кон-
кациями гистонов, особенно метилированием
цах мейотических пахитенных хромосом у
лизина 9 гистона 3 (H3K9me), с последующим
бобового растения Vigna unguiculata, исполь-
связыванием и распространением гетерохро-
зующего теломеразу [24, 25]. Тенденция к рас-
матинового белка 1 (HP1) [32]. Вторым мощ-
слаиванию концов хромосом на олиготеновые
ным механизмом репрессии транскрипции яв-
пучки наблюдается в политенных хромосомах
ляется метилирование ДНК, осуществляемое
некоторых других видов [26]» (из письма от
цитозин-5′-метилтрансферазами [33]. Как мо-
А.М. Оловникова А.И. Калмыковой, сентябрь
дификации гистонов, так и метилирование
2017 г.).
ДНК нацелены в геноме в значительной степе-
Действительно, недавно появилось сооб-
ни на МЭ, вызывая репрессию их транскрип-
щение, что теломерные ретротранспозоны не
ции. Главный вопрос заключается в том, как
только у представителей рода Drosophila, но и
рекрутировать эти универсальные механизмы
у других видов имеют тенденцию к формиро-
именно к МЭ? В соматических клетках позво-
ванию G-квадруплексов - вторичных струк-
ночных важную роль в метилировании ДНК
тур, образуемых последовательностями ДНК,
и гистонов на последовательностях эндоген-
обогащёнными гуаниновыми остатками [27].
ных ретровирусов играют белки семейства
Такие структуры могут защищать концы ли-
KRAB-ZFP (KRAB-containing zinc finger pro-
нейных хромосом при отсутствии теломерной
teins) [34, 35].
петли, характерной для теломер, поддерживае-
Наиболее консервативной, практически
мых с помощью теломеразы. Существование
универсальной для множества видов растений
альтернативных способов поддержания тело-
и животных системой распознавания «свой-
мер даёт уникальную возможность исследовать
чужой» является РНК-интерференция. Пути с
возникновение функциональных аналогий в
участием белков семейства Argonaute и связан-
БИОХИМИЯ том 88 вып. 11 2023
2112
КАЛМЫКОВА, СОКОЛОВА
ных с ними коротких РНК считают иммуни-
происхождения, называемых piРНК-предше-
тетом на уровне нуклеиновых кислот, т.к. эти
ственниками (pre-piРНК) [39, 40]. Наши зна-
механизмы способны сиквенс-специфически
ния по этому вопросу в основном были полу-
распознать и элиминировать чужеродные ну-
чены на модели оогенеза дрозофилы и приве-
клеиновые кислоты, принадлежащие вирусам,
ли к представлению о том, что piРНК-предше-
МЭ, трансгенам. Защита соматических клеток
ственники и их мишени кодируются разными
от вирусов осуществляется с помощью РНК-
геномными локусами (рис. 1, а). Нужно сразу
интерференции, белков Argonaute и малых
отметить, что этот механизм не является уни-
интерферирующих РНК (small interfering RNA,
версальным. Это представление возникло на
siРНК) длиной в 21 нуклеотид. В гонадах жи-
основе секвенирования библиотек коротких
вотных действует особая система защиты от
РНК, которые выявили скопления уникально
МЭ и вирусов, которая обеспечивается бел-
картирующихся piРНК в прицентромерном ге-
ками подсемейства Piwi семейства Argonaute и
терохроматине. Такие районы, являющиеся ис-
ассоциированными с ними короткими РНК -
точником piРНК, были названы piРНК-клас-
piРНК - длиной 24-30 нуклеотидов [36, 37].
терами [39]. Эти протяжённые области гено-
Важная особенность этой системы состоит в
ма размером до 200 т.п.н. (тысяч пар нуклео-
том, что комплекс Piwi-piРНК способен си-
тидов), обогащённые разрушенными копия-
квенс-специфично индуцировать модифика-
ми МЭ, кодируют необычные длинные тран-
ции хроматина МЭ, т.е. вызывать транскрип-
скрипты, из которых образуются зрелые piРНК,
ционный сайленсинг. Ядерные белки Piwi в
узнающие эухроматиновые активные копии МЭ.
комплексе с piРНК индуцируют формирова-
Это удивительный пример функционального
ние неактивного хроматина, используя ком-
применения участков генома, рассматривае-
плементарность piРНК и новообразованной
мых ранее как «мусорная» ДНК. У дрозофи-
мРНК МЭ. Это многостадийный процесс, тре-
лы описаны два типа piРНК-кластеров, одно-
бующий взаимодействия нескольких линкер-
цепочечные и двухцепочечные, которые тран-
ных и вспомогательных белков, их посттранс-
скрибируются в одном или двух направлениях,
ляционных модификаций, приводящих к кон-
соответственно, но все они продуцируют анти-
формационным изменениям, затем к сборке
смысловые piРНК-предшественники. Как они
и стабилизации белкового комплекса хрома-
таковыми получаются, легче понять для одно-
тина, управляемого Piwi-piРНК, и, наконец,
цепочечных piРНК-кластеров, в которых все
на последнем этапе - к рекрутированию уни-
разрушенные копии МЭ находятся в инвер-
версальных факторов гетерохроматина к МЭ
тированном положении по отношению к на-
[36, 38]. Такая тонкая регуляция требуется для
правлению транскрипции pre-piРНК. Самый
того, чтобы выключить именно МЭ и пред-
известный одноцепочечный piРНК-кластер -
отвратить ошибочную репрессию клеточных
это геномный локус flamenco D. melanogaster,
генов.
работающий в фолликулярных клетках яич-
Механизм сайленсинга, опосредованный
ника. Он содержит множество разрушенных
piРНК, представляет собой многоступенча-
копий МЭ на геномной минус-цепи по отно-
тый процесс. Основными стадиями этого про-
шению к направлению транскрипции. Таким
цесса являются образование длинных одно-
образом, зрелые piРНК, образованные из
цепочечных РНК-предшественников в ядре,
длинных транскриптов локуса flamenco, ком-
их процессинг в зрелые piРНК в цитоплазме и
плементарны мРНК МЭ и запускают их сай-
piРНК-опосредованный сайленсинг, который
ленсинг [39, 41]. Такие локусы генерируют
может происходить как в ядре (транскрипци-
piРНК против эндогенных ретровирусов, от-
онный сайленсинг), так и в цитоплазме (пост-
носящихся к семейству Gypsy. Такой сценарий
транскрипционный сайленсинг).
образования piРНК-кластеров повторяется в
Для выполнения своих функций зрелые
эволюции. Однонитевые piРНК-кластеры, схо-
piРНК должны комплементарно взаимодей-
жие с локусом flamenco, обнаружены у различ-
ствовать с кодирующими транскриптами МЭ,
ных видов рода Drosophila и комаров [42-44].
т.е. они должны быть антисмысловыми по от-
Более того, у мышей было обнаружено два
ношению к мРНК МЭ. Действительно, значи-
одноцепочечных piРНК-кластера, похожих на
тельная доля piРНК в гонадах комплементарна
локус flamenco, которые продуцируют корот-
МЭ, т.е. образуется не из мРНК МЭ. Причина
кие piРНК против эндогенных ретровирусов
и источник образования таких РНК в геноме
во время сперматогенеза [45].
неочевидны и обеспечиваются особыми меха-
Второй тип перицентромерных piРНК-
низмами. Считается, что piРНК образуются из
кластеров - это двухцепочечные кластеры,
длинных одноцепочечных РНК эндогенного
которые обеспечивают основную защиту про-
БИОХИМИЯ том 88 вып. 11 2023
РЕТРОТРАНСПОЗОНЫ И ТЕЛОМЕРЫ
2113
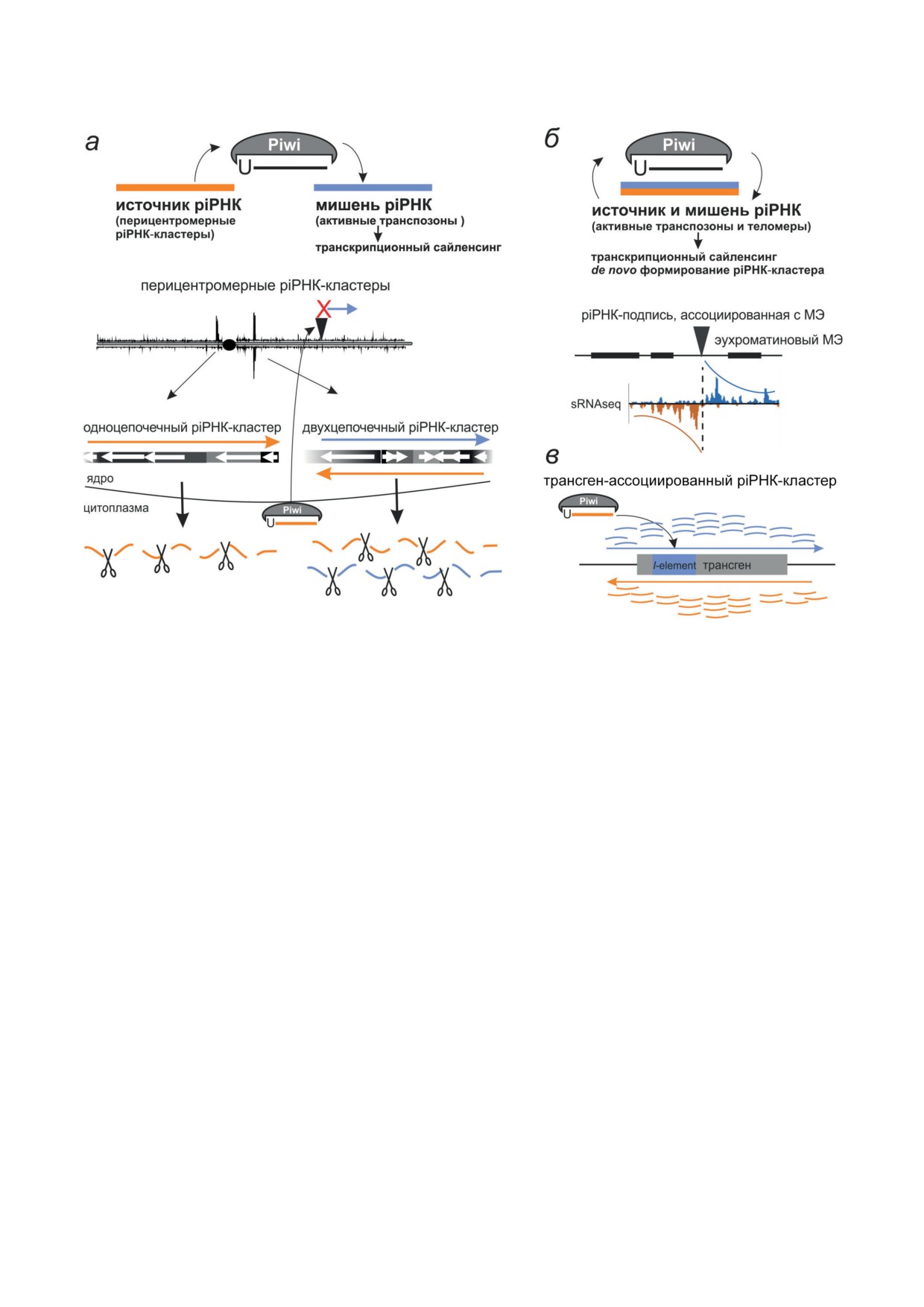
Рис. 1. В каких участках генома образуются предшественники piРНК? а - Гетерохроматические перицентромер-
ные кластеры piРНК являются источниками piРНК, которые нацелены на активные МЭ. Схематично показано
картирование коротких РНК на хромосому. Показан принцип работы двух типов piРНК-кластеров - одно- и двух-
цепочечных. Образующийся комплекс Piwi-piРНК распознаёт и сайленсирует активные копии МЭ (чёрный тре-
угольник). б - Активные копии МЭ формируют piРНК-кластеры. Схематически показана piРНК-«подпись» для
кластеров piРНК, ассоциированных с МЭ. sRNAseq - сиквенсы коротких РНК. в - Трансгенная модель демон-
стрирует, как активные МЭ в эухроматине становятся кластерами piРНК. Piwi в комплексе с эндогенной piРНК
к I-element распознаёт РНК в комплементарном трансгенном локусе, затем образуются транскрипты с обеих геном-
ных цепей, а из них - короткие РНК
тив МЭ в клетках зародышевой линии дрозо-
смысловых и антисмысловых транскриптов
филы. Эти локусы содержат сильно разрушен-
МЭ образуются piРНК обеих ориентаций.
ные копии МЭ, расположенные в случайных
Этот механизм, названный «пинг-понг», обна-
ориентациях. Двухцепочечные piРНК-класте-
ружен в гонадах всех изученных видов живот-
ры транскрибируются в двух направлениях,
ных и приводит не только к разрезанию мРНК
что приводит к образованию длинных неко-
МЭ (посттранскрипционному сайленсингу),
дирующих предшественников piРНК из обеих
но и продукции новых piРНК. Механизмы
геномных цепей [46]. Эти транскрипты экс-
образования и амплификации piРНК, а также
портируются в цитоплазму, где процессируют-
факторы их процессинга подробно описаны в
ся с образованием зрелых piРНК. Процессинг
недавних всеобъемлющих обзорах [36, 37, 47].
piРНК является наиболее консервативным
Считается, что двухцепочечные piРНК-
этапом piРНК-пути у разных видов. Внешняя
кластеры - хранилища информации в геноме
митохондриальная мембрана и околоядерный
о ранее происходивших инвазиях МЭ и свое-
компартмент служат платформой для процес-
образные ловушки для МЭ, т.к. их попада-
синга piРНК, который происходит в результа-
ние туда приведёт к образованию piРНК и
те действия цитоплазматических белков под-
подавлению активности родственных копий в
семейства Piwi, заряженных piРНК, и специа-
геноме [48]. Однако двухцепочечные piРНК-
лизированных рибонуклеаз. Мишенями раз-
кластеры оказались видоспецифичными для
резания являются как транскрипты МЭ, так
Drosophila и некоторых видов членистоногих,
и piРНК-предшественники из кластеров, а в
т.к. они не были обнаружены у подавляющего
результате последовательного расщепления
числа изученных видов животных, включая
6
БИОХИМИЯ том 88 вып. 11 2023
2114
КАЛМЫКОВА, СОКОЛОВА
млекопитающих. Остаётся открытым вопрос:
ном механизме супрессии транспозиций
существует ли консервативный механизм обра-
LINE1 [50, 51]. В случае узнавания комплексом
зования piРНК-предшественников, антисмыс-
Piwi-piРНК комплементарных транскриптов,
ловых по отношению к МЭ. Например, у мле-
по-видимому, индуцируется необычный тип
копитающих, несмотря на наличие огромного
конвергентной транскрипции геномных локу-
количества разрушенных копий МЭ в геноме,
сов, содержащих активные копии МЭ. Этот
смысловые и антисмысловые piРНК образу-
процесс зависит от геномного контекста
ются из индивидуальных копий эволюционно
встройки; встречная транскрипция в локусе
молодых активных ретротранспозонов [45].
инсерции МЭ способствует формированию
Действительно, piРНK-путь, нацеленный
piРНК-кластера [52]. Транскрипты, образую-
на подавление распространения МЭ в геноме,
щиеся с обеих геномных цепей, затем процес-
должен быть в первую очередь направлен на
сируются с образованием зрелых pi/siРНК.
активные копии МЭ. Более детальный анализ
Такой сценарий имеет очевидное биологиче-
библиотек коротких РНК из яичников дрозо-
ское значение, заключающееся в амплифика-
филы выявил, что не только гетерохромати-
ции защитных piРНК, которые направлены
новые piРНК-кластеры, но и полноразмерные
против наиболее агрессивных транскрипци-
эухроматиновые копии МЭ генерируют ко-
онно активных копий МЭ. Исследование
роткие РНК - как piРНК, так и siРНК. Это
трансгенов, содержащих фрагмент ДНК, на
говорит о том, что в местах недавних вставок
который нацелены эндогенные piРНК, позво-
МЭ происходит формирование новых локаль-
лило значительно продвинуться в понимании
ных двухцепочечных piРНК-кластеров
[49],
механизма формирования piРНК-кластеров
что напоминает сценарий образования piРНК
de novo [53-55]. Было показано, что трансген-
из активных копий LINE1 у человека [45].
ные конструкции на основе МЭ - I-element -
Отличительной особенностью таких МЭ-ас-
могут становиться новыми piРНК-кластерами.
социированных piРНК-кластеров является
Формирование таких piРНК-кластеров de novo
piРНК-«подпись» - асимметричный профиль
сопровождается возникновением низкого уров-
распределения коротких РНК до и после встрой-
ня транскрипции с минус-цепи и образова-
ки МЭ, возникающий в результате сквозной
нием смысловых и антисмысловых pi- и siРНК
транскрипции предшественников piРНК в
как из всего трансгена, так и из прилегающих
прилежащие к МЭ участки генома (рис. 1, б).
геномных последовательностей на расстоянии
Такая «подпись» очень характерна и может
от 1 до 10 т.п.н. от трансгена [56, 57] (рис. 1, в).
быть использована для предсказания неанно-
Сценарий, при котором активный МЭ
тированных встроек МЭ в геноме. Более того,
является источником piРНК, должен давать
распространение продукции коротких РНК за
селективные преимущества и быть эволюци-
пределы МЭ может затрагивать соседние гены,
онно выгодным. Вопрос о том, почему в ходе
подавляя их экспрессию [49]. Таким образом,
эволюции у Drosophila и других членистоногих
активные МЭ служат не только мишенями
сохранились протяжённые гетерохроматино-
piРНК-системы, вызывающей компактизацию
вые piРНК-кластеры, обслуживаемые особым
хроматина, но и источником коротких РНК,
транскрипционным аппаратом, остаётся от-
т.к. могут обеспечить продукцию siРНК и
крытым. Недавно появились данные о том,
piРНК de novo. Теломерные ретротранспозоны
что удаление наиболее протяжённых перицен-
дрозофилы, расположенные в виде тандемных
тромерных piРНК-кластеров у D. melanogaster
повторов в теломере, являются также источ-
не приводит к дерепрессии МЭ [58]. Это ука-
ником и мишенью piРНК, что обеспечивает
зывает на то, что гетерохроматиновые piРНК-
регуляцию экспрессии теломерных ретротранс-
кластеры не играют решающей роли в сайлен-
позонов по типу обратной связи, что будет об-
синге МЭ в стабильной лабораторной линии.
суждаться более подробно в следующей главе.
С большой вероятностью эту функцию успеш-
Механизм, который лежит в основе фор-
но выполняют МЭ-ассоциированные piРНК-
мирования новых piРНК-кластеров, ассоци-
кластеры, которые формируются с помощью
ированных с МЭ, и в особенности механизм
piРНК, унаследованных от матери через цито-
генерации двунаправленной транскрипции, до
плазму ооцита [59].
конца неясен. Антисмысловые промоторы из-
По-видимому, ответ нужно искать в осо-
вестны лишь для единичных представителей
бенностях среды обитания разных видов. При-
МЭ и являются, скорее, исключением. Напри-
родные популяции членистоногих подверга-
мер, антисмысловой промотор ретротранспо-
ются горизонтальному переносу МЭ, включая
зона человека LINE1 и образуемые с него
реинвазию родственных МЭ, ранее утрачен-
транскрипты участвуют в siРНК-опосредован-
ных в геноме [60, 61]. Память о прежних инва-
БИОХИМИЯ том 88 вып. 11 2023
РЕТРОТРАНСПОЗОНЫ И ТЕЛОМЕРЫ
2115
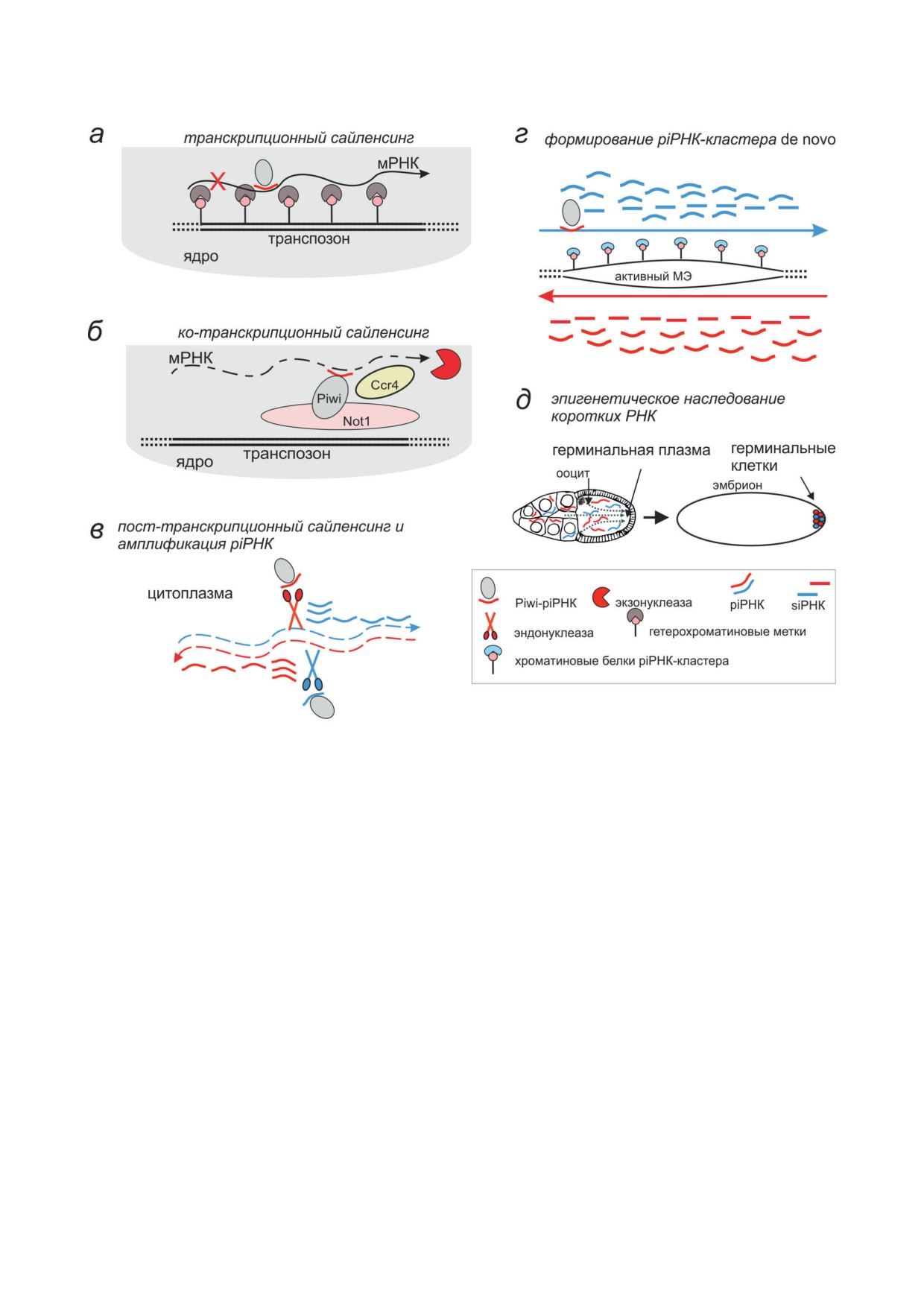
Рис. 2. Система с участием piРНК представляет собой многоуровневый механизм. У Drosophila piРНК могут инду-
цировать следующие процессы: (а) транскрипционную репрессию и компактизацию хроматина, (б) ко-транскрип-
ционную деградацию новообразованной РНК в ядре с участием деаденилазного ядерного комплекса Ccr4-Not,
(в) посттранскрипционную деградацию РНК, сопровождающуюся амплификацией piРНК, в цитоплазме, (г) про-
дукцию piРНК de novo на активных МЭ за счёт активации антисмысловой транскрипции, (д) передачу материнских
piРНК в комплексе с белками подсемейства Piwi потомству через герминальную плазму ооцита
зиях МЭ, хранящаяся в виде их фрагментов в
нилазной активностью [64]. Он привлекается
составе piРНК-кластеров, может спасти по-
ко-транскрипционно к транскриптам мобиль-
пуляцию при повторном заражении родствен-
ных элементов за счёт взаимодействия с ядер-
ными МЭ за счёт наличия комплементарных
ным комплексом Piwi-piРНК. Скорее всего,
piРНК и активации piРНК-опосредованного
за счёт деаденилазной активности комплекса
сайленсинга [39, 52, 57, 59, 62].
Ccr4-Not происходит удаление поли(А)-хво-
Идея о том, что активные копии МЭ слу-
ста на 3′-конце мРНК МЭ. Такие транскрип-
жат первичными мишенями piРНК-пути,
ты могут распознаваться ядерной системой
подтверждается недавно открытым механиз-
контроля качества РНК как аберрантные и
мом ко-транскрипционной деградации тран-
подвергаться экзонуклеазному расщеплению.
скриптов МЭ [63]. Несмотря на формирова-
Примечательно, что мишенями ядерного ком-
ние гетерохроматина в локусах, содержащих
плекса Ccr4-Not в основном являются актив-
активные копии МЭ, они тем не менее спо-
ные полноразмерные копии МЭ и теломерные
собны транскрибироваться в клетках зароды-
ретротранспозоны [63].
шевой линии. Избыток транскриптов МЭ в
Подводя итоги этого краткого обзора си-
ядрах клеток зародышевой линии дрозофилы
стемы контроля МЭ с помощью piРНК, можно
удаляется за счёт активности ядерного ком-
сказать, что piРНК могут индуцировать не-
плекса Ccr4-Not, который обладает деаде-
сколько важных процессов, которые направ-
БИОХИМИЯ том 88 вып. 11 2023
6*
2116
КАЛМЫКОВА, СОКОЛОВА
лены на подавление активности МЭ (рис. 2).
мер, при мутации генов, участвующих в этом
piРНК индуцируют транскрипционный сай-
пути, приводит к накоплению транскриптов
ленсинг в ядре, приводящий к сборке гетеро-
теломерных МЭ, которые, в свою очередь, яв-
хроматина в локусах МЭ [65-67]. Эта система
ляются интермедиатами удлинения теломер.
также работает на ко-транскрипционном уров-
Теломеры дрозофилы образованы специали-
не, вызывая деградацию транскриптов МЭ в
зированными МЭ, которые не встречаются в
сайтах транскрипции с помощью ядерных ну-
других геномных локусах. Тандемные клас-
клеаз [63]. piРНК-система осуществляет пост-
теры теломерных ретроэлементов являются
транскрипционное расщепление транскриптов
как источником piРНК, так и их мишенью,
МЭ в цитоплазме, что сопровождается ампли-
что представляет собой уникальный пример
фикацией piРНК и их последующим наследо-
саморегулируемого piРНК-кластера. Теломер-
ванием через цитоплазму ооцита [39, 59, 68-71].
ные ретротранспозоны дрозофилы обладают
Важно, что piРНК могут инициировать обра-
двунаправленными промоторами, что обеспе-
зование de novo piРНК-кластеров на полнораз-
чивает при расположении теломерных копий
мерных эухроматиновых встройках МЭ, сти-
«голова-к-хвосту» образование как смысло-
мулируя антисмысловую транскрипцию МЭ
вых, так и антисмысловых транскриптов, из
и всплеск продукции piРНК против наиболее
которых затем процессируют теломерные
активных МЭ [49]. Более того, быстрая эволю-
piРНК [76-79]. Drosophila не является един-
ция белков, участвующих в piРНК-пути, обес-
ственным примером такой регуляции - белки
печивает высокую адаптивность этой систе-
Piwi также участвуют в регуляции транспози-
мы к новым мишеням [72-74]. Несмотря на
ций теломерных ретротранспозонов SART и
огромный потенциал piРНК и других систем
TRAS у тутового шелкопряда Bombyx mori [80].
защиты от МЭ, паразитические МЭ успешно
Типичным свойством теломер является
обходят их, продолжая размножаться, вызывая
их гетерохроматиновое состояние. В клетках
вредные мутации, заболевания и нарушения
зародышевой линии дрозофилы гетерохрома-
развития.
тиновые факторы привлекаются к теломер-
Таким образом, создаётся парадоксальная
ным ретротранспозонам с участием piРНК-
ситуация, при которой для подавления актив-
системы [81]. При нарушении работы piРНК-
ности МЭ требуется его активность, за счёт
системы на теломерных повторах происходит
которой работает piРНК-система. По всей ви-
снижение количества основного белка гете-
димости, далекая от 100% эффективность этой
рохроматина HP1 и гистоновой модификации
и других систем защиты позволяет МЭ раз-
H3K9me3. С таким глобальным изменением
множаться в допустимых пределах, поставляя
структуры теломерного хроматина связано сме-
материал для эволюции генома и позитивного
щение теломерных кластеров хромосом от пе-
отбора, а также позволяя работать некоторым
риферии ядра, наблюдаемое в герминальных
жизненно важным системам, например, тело-
клетках яичников у piРНК мутантов дрозо-
мерам. Подробнее на этом явлении остано-
филы [81]. Транскрипция наиболее представ-
вимся ниже.
ленного теломерного повтора дрозофилы -
ретротранспозона НеТ-А - также регулиру-
ется в ядре на ко-транскрипционном уровне
РОЛЬ КОРОТКИХ piРНК
с помощью привлечения деаденилазного ком-
В РЕГУЛЯЦИИ ТЕЛОМЕР Drosophila
плекса Ccr4-Not [63]. С помощью методов кон-
фокальной микроскопии обнаружено форми-
Нарушение piРНК-системы у дрозофилы
рование околотеломерных телец, содержащих
приводит не только к активации МЭ, но и к
белковый комплекс Ccr4-Not, белок Piwi и
чрезмерному удлинению теломер за счёт уве-
факторы ядерного экспорта РНК [63]. Инте-
личения частоты присоединения ретротранс-
ресна параллель с биогенезом теломеразной
позонов к теломерам [75]. Это происходит по-
РНК человека, в котором также принимают
тому, что в клетках зародышевой линии исто-
участие неканонические деаденилазы Ccr4 и
щается пул коротких piРНК, специфичных
Caf1, сконцентрированные в ядерных тельцах
к теломерным ретротранспозонам. Действи-
Кахаля [82]. Таким образом, piРНК-система и
тельно, система piРНК не делает различий меж-
деаденилаза Ccr4-Not участвуют как в подав-
ду теломерными и паразитическими ретро-
лении активности паразитических МЭ, так и в
транспозонами и процессирует транскрипты
регуляции функций теломер дрозофилы.
теломерных ретротранспозонов с образова-
piРНК-система является негативным регу-
нием piРНК в клетках зародышевой линии.
лятором длины теломер у дрозофилы, т.е. чем
Уменьшение количества таких piРНК, напри-
активнее она работает, тем реже происходят
БИОХИМИЯ том 88 вып. 11 2023
РЕТРОТРАНСПОЗОНЫ И ТЕЛОМЕРЫ
2117
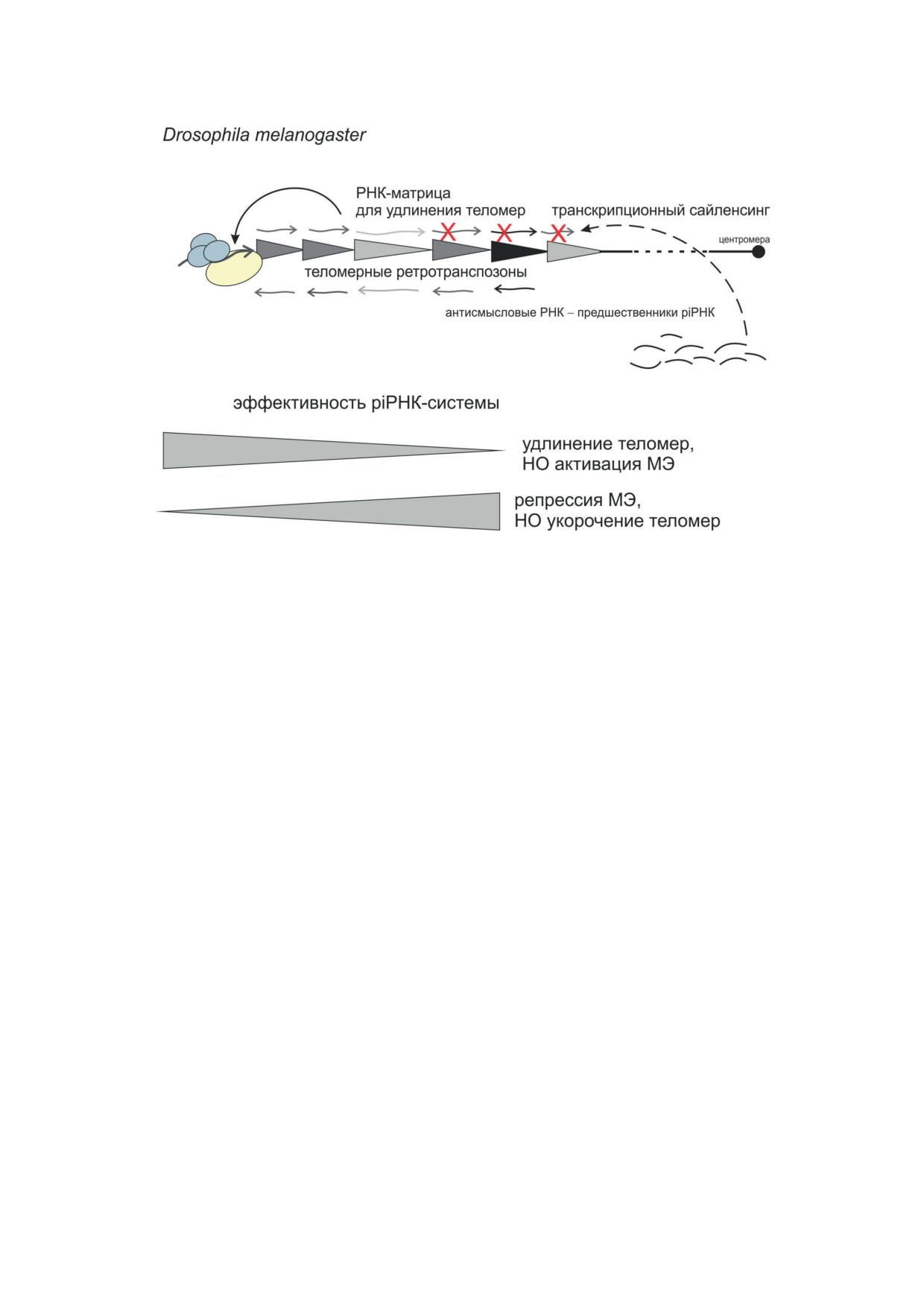
Рис. 3. Механизмы, регулирующие поддержание теломер и контроль МЭ, тесно связаны. Система piРНК контроли-
рует как активность паразитических МЭ, так и частоту присоединения теломерных ретротранспозонов на концы
хромосом в зародышевой линии дрозофилы
удлинения теломер. Сложная система обратной
вать критическое укорочение теломер. На ос-
связи регулирует уровень теломерных тран-
нове этих данных, пока ещё фрагментарных,
скриптов, теломерных piРНК, состояние тело-
хочется предположить, что защитная piРНК-
мерного хроматина, чтобы обеспечить необ-
система не может бесконечно повышать свою
ходимую для нормального развития частоту
эффективность и успешно удалять из генома
присоединений теломерных ретроэлементов к
МЭ, а, скорее, должна быть хорошо сбаланси-
концам хромосом. Эту сложную систему кон-
рована, чтобы защитить геном от неконтроли-
троля длины теломер ещё больше усложняет
руемого размножения МЭ и обеспечить над-
то, что механизм с участием piРНК должен
лежащее поддержание длины теломер (рис. 3).
успешно подавлять активность МЭ. Действи-
тельно, нарушение piРНК-системы приводит
не только к повышенной частоте теломерных
КОГДА И ПОЧЕМУ
присоединений, но и к активации МЭ и сте-
ПРОИСХОДИТ АКТИВАЦИЯ
рильности [75]. Противоположную ситуацию,
МОБИЛЬНЫХ ЭЛЕМЕНТОВ В РАЗВИТИИ?
т.е. активацию piРНК-системы и чрезмерное
укорочение теломер, удалось наблюдать на
Для понимания механизмов регуляции МЭ
одной из природных линий дрозофилы. Дело
стоит посмотреть, на каких этапах жизненного
в том, что из-за высокой вариабельности бел-
цикла происходит их активация в ходе нор-
ков, участвующих в piРНК-пути, среди при-
мального развития (рис. 4, а, б, в). Кратковре-
родных популяций дрозофил наблюдается раз-
менная активация МЭ наблюдается на ранних
личная эффективность процессинга piРНК,
стадиях гаметогенеза у различных видов [84].
что определяет разную степень защиты генома
У Drosophila существует короткий интервал на
от инвазии новых МЭ [83]. У мух, обладающих
ранних стадиях оогенеза, когда снижается уро-
наиболее эффективным процессингом piРНК,
вень ядерного белка Piwi и происходит актива-
отсутствовали полноразмерные копии основ-
ция транскрипции МЭ [85]. Транскрипты МЭ,
ного структурного элемента теломер - ретро-
образующиеся на этой стадии, процессируют-
транспозона HeT-A. Такая линия обладала
ся в цитоплазме с образованием коротких
сниженной фертильностью и жизнеспособнос-
piРНК с помощью других белков подсемейства
тью. Вполне вероятно, что высокоэффектив-
Piwi. Когда экспрессия Piwi выходит вновь
ная работа piРНК-системы, приводящая к
на высокий уровень, piРНК МЭ обеспечи-
мощной репрессии МЭ, также должна вызы-
вают подавление их собственной транскрипции
БИОХИМИЯ том 88 вып. 11 2023
2118
КАЛМЫКОВА, СОКОЛОВА
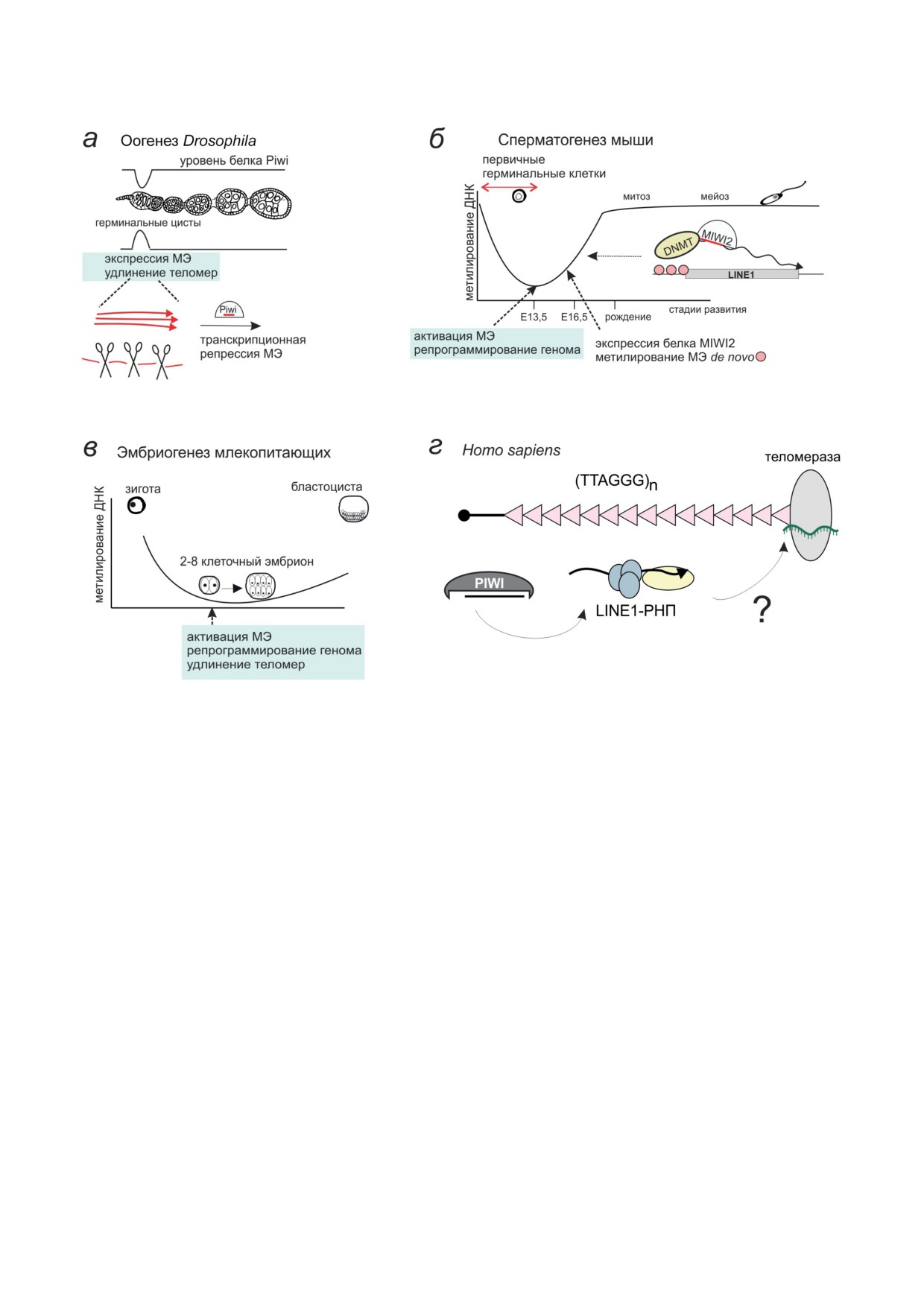
Рис. 4. Стадии развития, на которых происходит активация МЭ. а - В оогенезе дрозофилы активация МЭ и тело-
мерных ретротранспозонов происходит в герминальных цистах, когда снижается уровень белка Piwi. На этой стадии
образуются piРНК, которые запускают транскрипционный сайленсинг на последующих стадиях оогенеза. Предпо-
лагается, что на этой же стадии происходит удлинение теломер за счёт ретротранспозиций теломерных ретроэле-
ментов. б - Глобальное деметилирование ДНК в первичных зародышевых клетках во время сперматогенеза у мышей
сопровождается активацией МЭ. Затем устанавливается piРНК-опосредованное de novo ДНК-метилирование эволю-
ционно молодых активных копий LINE1. в - Мобилизация МЭ и удлинение теломер наблюдаются также во время
первых зиготических делений в эмбриогенезе млекопитающих. г - Репрессия LINE1 с помощью piРНК может опо-
средованно влиять на его теломерные функции в герминальных клетках млекопитающих (гипотеза)
на более поздних стадиях оогенеза [86]. На ран-
таза предоставляется другими теломерными
них стадиях оогенеза, где отсутствует белок
ретроэлементами - TART и/или TAHRE. Дей-
Piwi, также наблюдали активацию транскрип-
ствительно, ревертаза TART была обнаруже-
ции теломерных ретроэлементов HeT-A и TART,
на также в составе HeT-A-сфер в нейроблас-
которая приводила к образованию интерме-
тах [91]. Такие РНП, вероятно, и осуществляют
диатов удлинения теломер [66, 87, 88]. Такими
ретротранспозиции теломерных элементов на
интермедиатами у D. melanogaster являются сфе-
концы хромосом, удлиняя теломеры дрозо-
рические рибонуклеопротеиновые (РНП) ча-
филы. В норме транскрипция теломерных ре-
стицы, состоящие из белка Gag, кодируемо-
тротранспозонов HeT-A и TART наблюдается в
го ретротранспозоном HeT-A, заполненные
герминальных цистах яичника, а при наруше-
РНК HeT-A и способные направленно локали-
нии системы piРНК появляются сферические
зоваться на теломере [89, 90]. Впервые такие
частицы, состоящие из РНК и белка Gag, коди-
HeT-A-сферы были обнаружены в активно
руемых HeT-A [87]. По-видимому, удлинение
пролиферирующих клетках мозга у личинок,
теломер происходит на тех же стадиях, на кото-
а их появление на теломерах совпадало с ре-
рых активируются МЭ. Наиболее вероятно, что
пликацией теломер [89]. Основной структур-
это связано с ослаблением piРНК-защиты и на-
ный компонент теломер дрозофилы, НеТ-А, яв-
коплением транскриптов теломерных элемен-
ляется неавтономным, а обратная транскрип-
тов, а также с глобальной декомпактизацией
БИОХИМИЯ том 88 вып. 11 2023
РЕТРОТРАНСПОЗОНЫ И ТЕЛОМЕРЫ
2119
гетерохроматина и большей доступностью
русов [109-112]. Интересно, что ингибирова-
концов хромосом в дробящихся клетках-пред-
ние LINE1 приводит к нарушению экспрессии
шественниках гамет. Действительно, нару-
факторов плюрипотентности, в том числе
шения таких факторов гетерохроматина, как
Zscan4, и блокирует удлинение теломер в эм-
HP1, деметилазы гистонов Lsd1 и её кофакто-
бриональных стволовых клетках [113]. В свою
ра Ova, метилтрансфераз dSetdB1 и Suvar3-9,
очередь, РНК LINE1 играет роль репрессора
приводят как к активации МЭ, так и накоп-
транскрипции гена Dux, что необходимо для
лению транскриптов теломерных повторов
выхода клеток из состояния 2С и продолжения
[92-98], а у мутантов по гену Su(var)2-5, ко-
развития [114]. Также обнаружено, что промо-
дирующему HP1, и к удлинению теломер [98].
торы генов ранней дифференцировки содержат
Похожий сценарий можно наблюдать у других
регуляторные участки эндогенных ретровиру-
животных. У млекопитающих активация экс-
сов и регулируются кодируемыми ими белка-
прессии эволюционно молодых подсемейств
ми [115]. Таким образом, активация МЭ про-
ретроэлемента LINE1 происходит в приморди-
исходит во время коротких периодов развития,
альных клетках мужской зародышевой линии
связанных с перепрограммированием генома и
в период пренатального развития и совпадает
удлинением теломер у млекопитающих. Более
с глобальным деметилированием геномной
того, эти процессы взаимосвязаны тонкой ре-
ДНК [99]. У мышей на более поздних стадиях
гуляторной сетью, правильный баланс которой
сперматогенеза появление белка подсемейства
необходим для нормального развития.
Piwi, MILI2, запускает продукцию piРНК, ре-
В процессе естественного старения, как и
крутирование ДНК-метилазы и установление
при синдромах преждевременного старения,
piРНК-опосредованного de novo метилирова-
наблюдаются сходные для МЭ и теломерных
ния ДНК на последовательностях LINE1 [100].
повторов декомпактизация хроматина и актива-
В развитии млекопитающих происходит
ция экспрессии, приводящие к повреждениям
две волны деметилирования и реметилирова-
ДНК и клеточной гибели [116, 117], что ещё раз
ния ДНК - в первичных герминальных клет-
подчёркивает общность эпигенетической регу-
ках и на ранней стадии эмбриогенеза [101].
ляции теломер и МЭ на разных этапах развития.
Считается, что глобальное деметилирование
генома в первичных зародышевых клетках го-
над во время пренатального развития млеко-
УЧАСТИЕ LINE1 В ПОДДЕРЖАНИИ
питающих необходимо для перепрограмми-
ТЕЛОМЕР МЛЕКОПИТАЮЩИХ
рования эпигенома и установления паттерна
метилирования ДНК de novo, в том числе на
Сходство механизмов контроля МЭ и ре-
последовательностях активных ретротранспо-
гуляции теломер кажется очевидным для дро-
зонов [102, 103]. Деметилирование ДНК также
зофилы, где теломеры поддерживаются за счёт
необходимо для удлинения теломер на ранней
присоединений ретротранспозонов к концам
эмбриональной стадии, что сопровождается
хромосом. У большинства организмов тело-
повышенным уровнем транскрипции многих
меры поддерживаются за счёт активности те-
ретротранспозонов на этой стадии разви-
ломеразы - узкоспециализированной обрат-
тия [104-106]. Важную роль в поддержании
ной транскриптазы, компоненты которой ко-
деметилированного состояния ДНК и дере-
дируются обычными генами. Накапливается
прессии гетерохроматина в культивируемых
всё больше данных, которые говорят об уча-
эмбриональных стволовых клетках, индуци-
стии ретротранспозонов в функционировании
рованных плюрипотентных стволовых клет-
теломер у млекопитающих. При дисфункции
ках и 2-клеточных эмбрионах играет тран-
компонентов защитного теломерного комплек-
скрипционный фактор Zscan4 (Zinc finger and
са - шелтерина - ретротранспозон LINE1 спо-
SCAN domain containing 4) [107]. Zscan4 акти-
собен присоединяться с помощью обратной
вирует экспрессию генов, участвующих в го-
транскрипции к теломере в клетках человека
мологичной рекомбинации, что стимулирует
и становиться структурной частью теломерной
рекомбинационный механизм удлинения те-
ДНК [17]. Кроме того, LINE1 также способен
ломер в эмбриональных стволовых клетках,
играть роль в функционировании теломер.
2-клеточных эмбрионах и опухолевых клетках
В раковых клетках человека на фоне нокдауна
типа ALT (alternative lengthening of telomeres),
LINE1 наблюдалось снижение экспрессии бел-
использующих рекомбинацию для удлинения
ков шелтерина, падение активности теломера-
теломер [105, 106, 108]. В преимплатационных
зы и укорочение теломер [118]. Как уже упо-
эмбрионах наблюдается также активация ре-
миналось, ингибирование активности LINE1
тротранспозона LINE1 и эндогенных ретрови-
у 2-клеточных эмбрионов мышей блокирует
БИОХИМИЯ том 88 вып. 11 2023
2120
КАЛМЫКОВА, СОКОЛОВА
удлинение теломер и перепрограммирование
Усовершенствование быстро адаптируемой
генома [113]. Более того, РНП-частицы, со-
piРНК-системы, вероятно, ограничено её уча-
стоящие из РНК и белков, кодируемых LINE1,
стием в ключевых регуляторных функциях,
были обнаружены непосредственно на кон-
что создаёт конфликт между МЭ и геномом.
цах теломер в раковых клетках человека и
Можно предположить, что механизмы, приво-
в
2-клеточных эмбрионах мыши. Наконец,
дящие к уменьшению числа копий эгоистич-
LINE1-РНП были выявлены в комплексе
ных МЭ, отрицательно влияют на критические
с РНК, содержащей теломерные повторы
клеточные функции, выполняемые одомаш-
(TERRA) [113, 119]. Похоже, что LINE1 явля-
ненными МЭ, и именно эта связь обеспечи-
ется активным участником биогенеза теломер,
вает выживание эгоистичных МЭ в геноме.
хотя остаются открытыми вопросы о том, как
Каков механизм этого геномного компромис-
LINE1 туда попадает и какие компоненты те-
са? Мы думаем, что часть ответа можно найти
ломер он распознаёт. Учитывая существенную
в ретротранспозонном происхождении тело-
роль LINE1 в функционировании теломер,
мер и теломеразы. Активация МЭ в развитии
можно предположить наличие опосредованной
совпадает с перепрограммированием генома,
связи между piРНК-системой, регулирующей
стиранием эпигенетических меток и удлине-
экспрессию LINE1 в герминальных клетках,
нием теломер. У Drosophila двойственная роль
и теломерами у видов, использующих теломе-
piРНК-системы в поддержании целостности
разу (рис. 4, г).
теломер и репрессии МЭ обусловлена приро-
Изложенные данные обнаруживают удиви-
дой теломер, которые образованы ретротранс-
тельное сходство во временных интервалах и в
позонами. Однако теломеразу также можно
механизмах, регулирующих поддержание тело-
рассматривать как специализированный рет-
мер и контроль МЭ в геноме у млекопитающих.
роэлемент, который унаследовал функцио-
Изучение такой связи открывает новые пер-
нальную связь с ретротранспозонами, населя-
спективы в возможностях регуляции теломер
ющими геном. Таким образом, мы приходим к
в развитии, старении и в опухолевых клетках.
выводу, что защитные механизмы могут лишь
частично подавить активность эгоистичных
МЭ, будучи сбалансированы для выполнения
ЗАКЛЮЧЕНИЕ
жизненно важных функций, например, свя-
занных с поддержанием теломер. Однако нет
Отношения между геномом хозяина и МЭ
худа без добра - растущий объём данных ука-
часто определяют как геномный конфликт, и
зывает на огромный вклад одомашненных МЭ
механизмы, лежащие в основе этого конфлик-
в разнообразие регуляторных механизмов, ко-
та, сложны и противоречивы [120]. В те годы,
торые в конечном итоге приносят эволюцион-
когда ещё не были известны молекулярные ме-
ные преимущества геному хозяина.
ханизмы контроля МЭ, анализ популяционной
динамики МЭ выявил, что существует баланс
Вклад авторов. А.И. Калмыкова - концеп-
между скоростью размножения МЭ и механиз-
ция и написание текста статьи; О.А. Соколова -
мами, которые ограничивают этот процесс,
написание и редактирование текста статьи.
что приводит к поддержанию стабильного чис-
Финансирование. Работа выполнена при
ла копий МЭ в геноме [121]. По-видимому,
финансовой поддержке Российского научного
чрезмерное подавление активности МЭ не
фонда (грант № 23-24-00025, рук. О.А. Соко-
даёт селективного преимущества хозяину, что
лова).
подтверждено современными методами ана-
Конфликт интересов. Авторы заявляют об
лиза геномных данных природных популяций
отсутствии конфликта интересов.
дрозофилы. Так, например, количество piРНК
Соблюдение этических норм. Настоящая
не коррелирует с транспозиционной актив-
статья не содержит описания выполненных ав-
ностью МЭ, т.е. piРНК-система неоптималь-
торами исследований с участием людей или ис-
но адаптирована к защите генома от МЭ [122].
пользованием животных в качестве объектов.
СПИСОК ЛИТЕРАТУРЫ
1. Fueyo, R., Judd, J., Feschotte, C., and Wysocka, J.
2. Modzelewski, A. J., Gan Chong, J., Wang, T., and
(2022) Roles of transposable elements in the regulation
He, L. (2022) Mammalian genome innovation through
of mammalian transcription, Nat. Rev. Mol. Cell Biol.,
transposon domestication, Nat. Cell Biol., 24, 1332-
23, 481-497, doi: 10.1038/s41580-022-00457-y.
1340, doi: 10.1038/s41556-022-00970-4.
БИОХИМИЯ том 88 вып. 11 2023
РЕТРОТРАНСПОЗОНЫ И ТЕЛОМЕРЫ
2121
3.
Almojil, D., Bourgeois, Y., Falis, M., Hariyani, I.,
16.
Kordyukova, M., Olovnikov, I., and Kalmykova, A.
Wilcox, J., and Boissinot, S. (2021) The structural,
(2018) Transposon control mechanisms in telomere
functional and evolutionary impact of transposable
biology, Curr. Opin. Genet. Dev., 49, 56-62, doi:
elements in eukaryotes, Genes (Basel), 12, 918, doi:
10.1016/j.gde.2018.03.002.
10.3390/genes12060918.
17.
Morrish, T. A., Garcia-Perez, J. L., Stamato, T. D.,
4.
Nishihara, H. (2020) Transposable elements as genetic
Taccioli, G. E., Sekiguchi, J., and Moran, J. V.
accelerators of evolution: contribution to genome size,
(2007) Endonuclease-independent LINE-1 retro-
gene regulatory network rewiring and morphological
transposition at mammalian telomeres, Nature, 446,
innovation, Genes Genet. Syst., 94, 269-281, doi:
208-212, doi: 10.1038/nature05560.
10.1266/ggs.19-00029.
18.
Roth, C. W., Kobeski, F., Walter, M. F., and Biess-
5.
Hartley, G., and O’Neill, R. J. (2019) Centromere
mann, H. (1997) Chromosome end elongation by
repeats: hidden gems of the genome, Genes (Basel),
recombination in the mosquito Anopheles gambiae,
10, 223, doi: 10.3390/genes10030223.
Mol. Cell. Biol., 17, 5176-5183, doi: 10.1128/MCB.
6.
Chang, C. H., Chavan, A., Palladino, J., Wei, X.,
17.9.5176.
Martins, N. M. C., Santinello, B., Chen, C. C.,
19.
Compton, A., Liang, J., Chen, C., Lukyanchikova, V.,
Erceg, J., Beliveau, B. J., Wu, C. T., Larracuente,
Qi, Y., Potters, M., Settlage, R., Miller, D.,
A. M., and Mellone, B. G. (2019) Islands of retro-
Deschamps, S., Mao, C., Llaca, V., Sharakhov, I. V.,
elements are major components of Drosophila cen-
and Tu, Z. (2020) The beginning of the end: a chro-
tromeres, PLoS Biol., 17, e3000241, doi: 10.1371/
mosomal assembly of the new world malaria mos-
journal.pbio.3000241.
quito ends with a novel telomere, G3 (Bethesda), 10,
7.
Chueh, A. C., Northrop, E. L., Brettingham-Moore,
3811-3819, doi: 10.1534/g3.120.401654.
K. H., Choo, K. H., and Wong, L. H. (2009) LINE
20.
Mason, J. M., Randall, T. A., and Capkova
retrotransposon RNA is an essential structural and
Frydrychova, R. (2016) Telomerase lost? Chromosoma,
functional epigenetic component of a core neo-
125, 65-73, doi: 10.1007/s00412-015-0528-7.
centromeric chromatin, PLoS Genet., 5, e1000354,
21.
Pardue, M. L., and DeBaryshe, P. G.
(2008)
doi: 10.1371/journal.pgen.1000354.
Drosophila telomeres: a variation on the telomerase
8.
Nelson, J. O., Slicko, A., and Yamashita, Y. M.
theme, Fly, 2, 101-110, doi: 10.4161/fly.6393.
(2023) The retrotransposon R2 maintains Drosophila
22.
Casacuberta, E. (2017) Drosophila: retrotransposons
ribosomal DNA repeats, Proc. Natl. Acad. Sci. USA,
making up telomeres, Viruses, 9, 192, doi: 10.3390/
120, e2221613120, doi: 10.1073/pnas.2221613120.
v9070192.
9.
Olovnikov, A. M. (1971) Principle of marginotomy in
23.
Fujiwara, H., Osanai, M., Matsumoto, T., and Kojima,
template synthesis of polynucleotides [in Russian],
K. K. (2005) Telomere-specific non-LTR retrotrans-
Dokl. Akad. Nauk SSSR, 201, 1496-1499.
posons and telomere maintenance in the silkworm,
10.
Olovnikov, A. M. (1973) A theory of marginotomy.
Bombyx mori, Chromosome Res., 13, 455-467, doi:
The incomplete copying of template margin in
10.1007/s10577-005-0990-9.
enzymic synthesis of polynucleotides and biological
24.
Guerra, M., Kenton, A., and Bennett, M. D. (1996)
significance of the phenomenon, J. Theor. Biol.,
rDNA sites in mitotic and polytene chromosomes of
41, 181-190, doi: 10.1016/0022-5193(73)90198-7.
Vigna unguiculata (L.) Walp. and Phaseolus coccineus
11.
Blackburn, E. H. (1992) Telomerases, Annu. Rev.
L. revealed by in situ hybridization, Ann. Botany,
Biochem.,
61,
113-129, doi:
10.1146/annurev.bi.61.
78, 157-161, doi: 10.1006/anbo.1996.0108.
070192.000553.
25.
Iwata-Otsubo, A., Lin, J. Y., Gill, N., and Jackson,
12.
Garavis, M., Gonzalez, C., and Villasante, A. (2013)
S. A. (2016) Highly distinct chromosomal structures in
On the origin of the eukaryotic chromosome: the role
cowpea (Vigna unguiculata), as revealed by molecular
of noncanonical DNA structures in telomere evolu-
cytogenetic analysis, Chromosome Res., 24, 197-216,
tion, Genome Biol. Evol., 5, 1142-1150, doi: 10.1093/
doi: 10.1007/s10577-015-9515-3.
gbe/evt079.
26.
Zhimulev, I. F. (1996) Morphology and structure
13.
Gladyshev, E. A., and Arkhipova, I. R. (2007) Telo-
of polytene chromosomes, Adv. Genet., 34, 1-497,
mere-associated endonuclease-deficient Penelope-like
doi: 10.1016/s0065-2660(08)60533-7.
retroelements in diverse eukaryotes, Proc. Natl.
27.
Jedlicka, P., Tokan, V., Kejnovska, I., Hobza, R.,
Acad. Sci. USA, 104, 9352-9357, doi: 10.1073/pnas.
and Kejnovsky, E. (2023) Telomeric retrotransposons
0702741104.
show propensity to form G-quadruplexes in various
14.
Nakamura, T. M., and Cech, T. R. (1998) Reversing
eukaryotic species, Mob. DNA, 14, 3, doi: 10.1186/
time: origin of telomerase, Cell, 92, 587-590, doi:
s13100-023-00291-9.
10.1016/s0092-8674(00)81123-x.
28.
Wells, J. N., and Feschotte, C. (2020) A field guide
15.
Eickbush, T. H. (1997) Telomerase and retrotrans-
to eukaryotic transposable elements, Annu. Rev.
posons: which came first? Science, 277, 911-912,
Genet.,
54,
539-561, doi:
10.1146/annurev-genet-
doi: 10.1126/science.277.5328.911.
040620-022145.
БИОХИМИЯ том 88 вып. 11 2023
2122
КАЛМЫКОВА, СОКОЛОВА
29.
Merel, V., Boulesteix, M., Fablet, M., and Vieira, C.
RNA silencing of the gypsy endogenous retrovirus by
(2020) Transposable elements in Drosophila, Mob.
the Drosophila melanogaster flamenco gene, Genetics,
DNA, 11, 23, doi: 10.1186/s13100-020-00213-z.
166, 1313-1321, doi: 10.1534/genetics.166.3.1313.
30.
Anwar, S. L., Wulaningsih, W., and Lehmann, U.
42.
Aguiar, E., de Almeida, J. P. P., Queiroz, L. R.,
(2017) Transposable elements in human cancer: causes
Oliveira, L. S., Olmo, R. P., de Faria, I., Imler, J. L.,
and consequences of deregulation, Int. J. Mol. Sci., 18,
Gruber, A., Matthews, B. J., and Marques, J. T.
974, doi: 10.3390/ijms18050974.
(2020) A single unidirectional piRNA cluster similar
31.
Huang, C. R., Burns, K. H., and Boeke, J. D. (2012)
to the flamenco locus is the major source of EVE-
Active transposition in genomes, Annu. Rev. Genet., 46,
derived transcription and small RNAs in Aedes
651-675, doi: 10.1146/annurev-genet-110711-155616.
aegypti mosquitoes, RNA, 26, 581-594, doi: 10.1261/
32.
Lomberk, G., Wallrath, L., and Urrutia, R. (2006)
rna.073965.119.
The heterochromatin protein 1 family, Genome Biol.,
43.
Rozhkov, N. V., Zelentsova, E. S., Shostak, N. G.,
7, 228, doi: 10.1186/gb-2006-7-7-228.
and Evgen’ev, M. B. (2011) Expression of Drosophila
33.
Lyko, F. (2018) The DNA methyltransferase family:
virilis retroelements and role of small RNAs in their
a versatile toolkit for epigenetic regulation, Nat. Rev.
intrastrain transposition, PLoS One,
6, e21883,
Genet., 19, 81-92, doi: 10.1038/nrg.2017.80.
doi: 10.1371/journal.pone.0021883.
34.
Ecco, G., Cassano, M., Kauzlaric, A., Duc, J.,
44.
Van Lopik, J., Alizada, A., Trapotsi, M. A., Hannon,
Coluccio, A., Offner, S., Imbeault, M., Rowe, H. M.,
G. J., Bornelöv, S., and Czech Nicholson, B. (2023)
Turelli, P., and Trono, D. (2016) Transposable ele-
Unistrand piRNA clusters are an evolutionarily con-
ments and their KRAB-ZFP controllers regulate gene
served mechanism to suppress endogenous retrovi-
expression in adult tissues, Dev. Cell, 36, 611-623,
ruses across the Drosophila genus, Nat Commun., 14,
doi: 10.1016/j.devcel.2016.02.024.
7337, doi: 10.1038/s41467-023-42787-1.
35.
Yang, P., Wang, Y., and Macfarlan, T. S.
(2017)
45.
Aravin, A. A., Sachidanandam, R., Bourc’his, D.,
The role of KRAB-ZFPs in transposable element
Schaefer, C., Pezic, D., Toth, K. F., Bestor, T., and
repression and mammalian evolution, Trends Genet.,
Hannon, G. J. (2008) A piRNA pathway primed
33, 871-881, doi: 10.1016/j.tig.2017.08.006.
by individual transposons is linked to de novo DNA
36.
Czech, B., Munafo, M., Ciabrelli, F., Eastwood, E. L.,
methylation in mice, Mol. Cell, 31, 785-799, doi:
Fabry, M. H., Kneuss, E., and Hannon, G. J. (2018)
10.1016/j.molcel.2008.09.003.
piRNA-guided genome defense: from biogenesis to
46.
Andersen, P. R., Tirian, L., Vunjak, M., and
silencing, Annu. Rev. Genet., 52, 131-157, doi: 10.1146/
Brennecke, J. (2017) A heterochromatin-dependent
annurev-genet-120417-031441.
transcription machinery drives piRNA expression,
37.
Ozata, D. M., Gainetdinov, I., Zoch, A., O’Carroll, D.,
Nature, 549, 54-59, doi: 10.1038/nature23482.
and Zamore, P. D. (2019) PIWI-interacting RNAs:
47.
Sato, K., and Siomi, M. C. (2020) The piRNA
small RNAs with big functions, Nat. Rev. Genet.,
pathway in Drosophila ovarian germ and somatic cells,
20, 89-108, doi: 10.1038/s41576-018-0073-3.
Proc. Jpn. Acad. Ser. B Phys. Biol. Sci., 96, 32-42,
38.
Andreev, V. I., Yu, C., Wang, J., Schnabl, J., Tirian, L.,
doi: 10.2183/pjab.96.003.
Gehre, M., Handler, D., Duchek, P., Novatchkova, M.,
48.
Khurana, J. S., Wang, J., Xu, J., Koppetsch, B. S.,
Baumgartner, L., Meixner, K., Sienski, G., Patel, D. J.,
Thomson, T. C., Nowosielska, A., Li, C., Zamore,
and Brennecke, J. (2022) Panoramix SUMOylation
P. D., Weng, Z., and Theurkauf, W. E.
(2011)
on chromatin connects the piRNA pathway to the
Adaptation to P element transposon invasion in
cellular heterochromatin machinery, Nat. Struct. Mol.
Drosophila melanogaster, Cell,
147,
1551-1563,
Biol., 29, 130-142, doi: 10.1038/s41594-022-00721-x.
doi: 10.1016/j.cell.2011.11.042.
39.
Brennecke, J., Aravin, A. A., Stark, A., Dus, M.,
49.
Shpiz, S., Ryazansky, S., Olovnikov, I., Abramov, Y.,
Kellis, M., Sachidanandam, R., and Hannon, G. J.
and Kalmykova, A. (2014) Euchromatic transposon
(2007) Discrete small RNA-generating loci as master
insertions trigger production of novel Pi- and
regulators of transposon activity in Drosophila, Cell,
endo-siRNAs at the target sites in the Drosophila
128, 1089-1103, doi: 10.1016/j.cell.2007.01.043.
germline, PLoS Genet., 10, e1004138, doi: 10.1371/
40.
Aravin, A., Gaidatzis, D., Pfeffer, S., Lagos-
journal.pgen.1004138.
Quintana, M., Landgraf, P., Iovino, N., Morris, P.,
50.
Speek, M.
(2001) Antisense promoter of human
Brownstein, M. J., Kuramochi-Miyagawa, S.,
L1 retrotransposon drives transcription of adjacent
Nakano, T., Chien, M., Russo, J. J., Ju, J.,
cellular genes, Mol. Cell. Biol.,
21,
1973-1985,
Sheridan, R., Sander, C., Zavolan, M., and Tuschl, T.
doi: 10.1128/MCB.21.6.1973-1985.2001.
(2006) A novel class of small RNAs bind to MILI
51.
Yang, N., and Kazazian, H. H., Jr.
(2006) L1
protein in mouse testes, Nature, 442, 203-207, doi:
retrotransposition is suppressed by endogenously
10.1038/nature04916.
encoded small interfering RNAs in human cultured
41.
Sarot, E., Payen-Groschene, G., Bucheton, A., and
cells, Nat. Struct. Mol. Biol., 13, 763-771, doi: 10.1038/
Pelisson, A. (2004) Evidence for a piwi-dependent
nsmb1141.
БИОХИМИЯ том 88 вып. 11 2023
РЕТРОТРАНСПОЗОНЫ И ТЕЛОМЕРЫ
2123
52.
Komarov, P. A., Sokolova, O., Akulenko, N., Brasset, E.,
63.
Kordyukova, M., Sokolova, O., Morgunova, V.,
Jensen, S., and Kalmykova, A. (2020) Epigenetic
Ryazansky, S., Akulenko, N., Glukhov, S., and
requirements for triggering heterochromatinization
Kalmykova, A. (2020) Nuclear Ccr4-Not mediates the
and Piwi-interacting RNA production from transgenes
degradation of telomeric and transposon transcripts at
in the Drosophila germline, Cells, 9, 922, doi: 10.3390/
chromatin in the Drosophila germline, Nucleic Acids
cells9040922.
Res., 48, 141-156, doi: 10.1093/nar/gkz1072.
53.
De Vanssay, A., Bouge, A. L., Boivin, A., Hermant, C.,
64.
Collart, M. A., and Panasenko, O. O. (2012) The
Teysset, L., Delmarre, V., Antoniewski, C., and
Ccr4-Not complex, Gene, 492, 42-53, doi: 10.1016/
Ronsseray, S.
(2012) Paramutation in Drosophila
j.gene.2011.09.033.
linked to emergence of a piRNA-producing locus,
65.
Rozhkov, N. V., Hammell, M., and Hannon, G. J.
Nature, 490, 112-115, doi: 10.1038/nature11416.
(2013) Multiple roles for Piwi in silencing Drosophila
54.
Josse, T., Teysset, L., Todeschini, A. L., Sidor, C. M.,
transposons, Genes Dev., 27, 400-412, doi: 10.1101/
Anxolabehere, D., and Ronsseray, S. (2007) Telomeric
gad.209767.112.
trans-silencing: an epigenetic repression combining
66.
Shpiz, S., Olovnikov, I., Sergeeva, A., Lavrov, S.,
RNA silencing and heterochromatin formation,
Abramov, Y., Savitsky, M., and Kalmykova, A. (2011)
PLoS Genet.,
3,
1633-1643, doi:
10.1371/journal.
Mechanism of the piRNA-mediated silencing of
pgen.0030158.
Drosophila telomeric retrotransposons, Nucleic Acids
55.
Muerdter, F., Olovnikov, I., Molaro, A., Rozhkov,
Res., 39, 8703-8711, doi: 10.1093/nar/gkr552.
N. V., Czech, B., Gordon, A., Hannon, G. J., and
67.
Sienski, G., Donertas, D., and Brennecke, J. (2012)
Aravin, A. A. (2012) Production of artificial piRNAs
Transcriptional silencing of transposons by piwi and
in flies and mice, RNA, 18, 42-52, doi: 10.1261/
maelstrom and its impact on chromatin state and
rna.029769.111.
gene expression, Cell, 151, 964-980, doi: 10.1016/
56.
Akulenko, N., Ryazansky, S., Morgunova, V.,
j.cell.2012.10.040.
Komarov, P. A., Olovnikov, I., Vaury, C., Jensen, S.,
68.
Akkouche, A., Mugat, B., Barckmann, B., Varela-
and Kalmykova, A. (2018) Transcriptional and chro-
Chavez, C., Li, B., Raffel, R., Pelisson, A., and
matin changes accompanying de novo formation
Chambeyron, S. (2017) Piwi is required during Dro-
of transgenic piRNA clusters, RNA, 24, 574-584,
sophila embryogenesis to license dual-strand piRNA
doi: 10.1261/rna.062851.117.
clusters for transposon repression in adult ovaries, Mol.
57.
Olovnikov, I., Ryazansky, S., Shpiz, S., Lavrov, S.,
Cell, 66, 411-419, doi: 10.1016/j.molcel.2017.03.017.
Abramov, Y., Vaury, C., Jensen, S., and Kalmykova, A.
69.
Gunawardane, L. S., Saito, K., Nishida, K. M.,
(2013) De novo piRNA cluster formation in the
Miyoshi, K., Kawamura, Y., Nagami, T., Siomi, H.,
Drosophila germ line triggered by transgenes containing
and Siomi, M. C. (2007) A slicer-mediated mechanism
a transcribed transposon fragment, Nucleic Acids Res.,
for repeat-associated siRNA 5’ end formation in
41, 5757-5768, doi: 10.1093/nar/gkt310.
Drosophila, Science, 315, 1587-1590, doi: 10.1126/
58.
Gebert, D., Neubert, L. K., Lloyd, C., Gui, J.,
science.1140494.
Lehmann, R., and Teixeira, F. K. (2021) Large
70.
Han, B. W., Wang, W., Li, C., Weng, Z., and Zamore,
Drosophila germline piRNA clusters are evolutionarily
P. D. (2015) Noncoding RNA. piRNA-guided trans-
labile and dispensable for transposon regulation,
poson cleavage initiates Zucchini-dependent, phased
Mol. Cell,
81,
3965-3978, doi:
10.1016/j.molcel.
piRNA production, Science,
348,
817-821, doi:
2021.07.011.
10.1126/science.aaa1264.
59.
Brennecke, J., Malone, C. D., Aravin, A. A.,
71.
Mohn, F., Handler, D., and Brennecke, J. (2015) Non-
Sachidanandam, R., Stark, A., and Hannon, G. J.
coding RNA. piRNA-guided slicing specifies transcripts
(2008) An epigenetic role for maternally inherited
for Zucchini-dependent, phased piRNA biogenesis,
piRNAs in transposon silencing, Science, 322, 1387-
Science, 348, 812-817, doi: 10.1126/science.aaa1039.
1392, doi: 10.1126/science.1165171.
72.
Lewis, S. H., Salmela, H., and Obbard, D. J. (2016)
60.
Blumenstiel, J. P. (2019) Birth, school, work, death,
Duplication and diversification of dipteran argo-
and resurrection: the life stages and dynamics of
naute genes, and the evolutionary divergence of
transposable element proliferation, Genes (Basel),
Piwi and aubergine, Genome Biol. Evol., 8, 507-518,
10, 336, doi: 10.3390/genes10050336.
doi: 10.1093/gbe/evw018.
61.
Wallau, G. L., Vieira, C., and Loreto, E. L. S. (2018)
73.
Parhad, S. S., Tu, S., Weng, Z., and Theurkauf,
Genetic exchange in eukaryotes through horizontal
W. E. (2017) Adaptive evolution leads to cross-species
transfer: connected by the mobilome, Mob. DNA, 9, 6,
incompatibility in the piRNA transposon silencing
doi: 10.1186/s13100-018-0112-9.
machinery, Dev. Cell, 43, 60-70 e65, doi: 10.1016/
62.
Jensen, S., Gassama, M. P., and Heidmann, T. (1999)
j.devcel.2017.08.012.
Taming of transposable elements by homology-
74.
Vermaak, D., Henikoff, S., and Malik, H. S. (2005)
dependent gene silencing, Nat. Genet., 21, 209-212,
Positive selection drives the evolution of rhino,
doi: 10.1038/5997.
a member of the heterochromatin protein 1 family
БИОХИМИЯ том 88 вып. 11 2023
2124
КАЛМЫКОВА, СОКОЛОВА
in Drosophila, PLoS Genet., 1, 96-108, doi: 10.1371/
85.
Dufourt, J., Dennis, C., Boivin, A., Gueguen, N.,
journal.pgen.0010009.
Theron, E., Goriaux, C., Pouchin, P., Ronsseray, S.,
75.
Savitsky, M., Kwon, D., Georgiev, P., Kalmykova, A.,
Brasset, E., and Vaury, C. (2014) Spatio-temporal re-
and Gvozdev, V. (2006) Telomere elongation is under
quirements for transposable element piRNA-mediated
the control of the RNAi-based mechanism in the
silencing during Drosophila oogenesis, Nucleic Acids
Drosophila germline, Genes Dev., 20, 345-354, doi:
Res., 42, 2512-2524, doi: 10.1093/nar/gkt1184.
10.1101/gad.370206.
86.
Theron, E., Maupetit-Mehouas, S., Pouchin, P.,
76.
Danilevskaya, O. N., Traverse, K. L., Hogan, N. C.,
Baudet, L., Brasset, E., and Vaury, C. (2018) The
DeBaryshe, P. G., and Pardue, M. L. (1999) The two
interplay between the Argonaute proteins Piwi and Aub
Drosophila telomeric transposable elements have very
within Drosophila germarium is critical for oogenesis,
different patterns of transcription, Mol. Cell. Biol.,
piRNA biogenesis and TE silencing, Nucleic acids
19, 873-881, doi: 10.1128/MCB.19.1.873.
Res., 46, 10052-10065, doi: 10.1093/nar/gky695.
77.
Maxwell, P. H., Belote, J. M., and Levis, R. W.
87.
Kordyukova, M., Morgunova, V., Olovnikov, I.,
(2006) Identification of multiple transcription ini-
Komarov, P. A., Mironova, A., Olenkina, O. M., and
tiation, polyadenylation, and splice sites in the Dro-
Kalmykova, A. (2018) Subcellular localization and
sophila melanogaster TART family of telomeric ret-
Egl-mediated transport of telomeric retrotransposon
rotransposons, Nucleic Acids Res., 34, 5498-5507,
HeT-A ribonucleoprotein particles in the Drosophila
doi: 10.1093/nar/gkl709.
germline and early embryogenesis, PLoS One, 13,
78.
Radion, E., Ryazansky, S., Akulenko, N., Rozovsky, Y.,
e0201787, doi: 10.1371/journal.pone.0201787.
Kwon, D., Morgunova, V., Olovnikov, I., and Kal-
88.
Sokolova, O., Morgunova, V., Sizova, T. V., Komarov,
mykova, A. (2017) Telomeric retrotransposon HeT-A
P. A., Olenkina, O. M., Babaev, D. S., Mikhaleva,
contains a bidirectional promoter that initiates
E. A., Kwon, D. A., Erokhin, M., and Kalmykova, A.
divergent transcription of piRNA precursors in
(2023) The insulator BEAF32 controls the spatial-tem-
Drosophila germline, J. Mol. Biol., 429, 3280-3289,
poral expression profile of the telomeric retrotrans-
doi: 10.1016/j.jmb.2016.12.002.
poson TART in the Drosophila germline, Development,
79.
Shpiz, S., Kwon, D., Rozovsky, Y., and Kalmykova, A.
150, dev201678, doi: 10.1242/dev.201678.
(2009) rasiRNA pathway controls antisense expression
89.
Zhang, L., Beaucher, M., Cheng, Y., and Rong, Y. S.
of Drosophila telomeric retrotransposons in the
(2014) Coordination of transposon expression with
nucleus, Nucleic Acids Res., 37, 268-278, doi: 10.1093/
DNA replication in the targeting of telomeric retro-
nar/gkn960.
transposons in Drosophila, EMBO J., 33, 1148-1158,
80.
Tatsuke, T., Sakashita, K., Masaki, Y., Lee, J. M.,
doi: 10.1002/embj.201386940.
Kawaguchi, Y., and Kusakabe, T. (2010) The telo-
90.
Rashkova, S., Karam, S. E., Kellum, R., and Pardue,
mere-specific non-LTR retrotransposons SART1 and
M. L. (2002) Gag proteins of the two Drosophila
TRAS1 are suppressed by Piwi subfamily proteins in
telomeric retrotransposons are targeted to chromo-
the silkworm, Bombyx mori, Cell. Mol. Biol. Lett., 15,
some ends, J. Cell Biol., 159, 397-402, doi: 10.1083/
118-133, doi: 10.2478/s11658-009-0038-9.
jcb.200205039.
81.
Radion, E., Morgunova, V., Ryazansky, S.,
91.
Lopez-Panades, E., Gavis, E. R., and Casacuberta, E.
Akulenko, N., Lavrov, S., Abramov, Y., Komarov,
(2015) Specific localization of the Drosophila telomere
P. A., Glukhov, S. I., Olovnikov, I., and Kalmykova, A.
transposon proteins and RNAs, give insight in their
(2018) Key role of piRNAs in telomeric chromatin
behavior, control and telomere biology in this organ-
maintenance and telomere nuclear positioning in
ism, PLoS One, 10, e0128573, doi: 10.1371/journal.
Drosophila germline, Epigenetics Chromatin, 11, 40,
pone.0128573.
doi: 10.1186/s13072-018-0210-4.
92.
Lepesant, J. M. J., Iampietro, C., Galeota, E.,
82.
Wagner, E., Clement, S. L., and Lykke-Andersen, J.
Auge, B., Aguirrenbengoa, M., Merce, C.,
(2007) An unconventional human Ccr4-Caf1 dead-
Chaubet, C., Rocher V., Haenlin, M., Waltzer, L.,
enylase complex in nuclear Cajal bodies, Mol. Cell.
Pelizzola, M., and Di Stefano, L. (2020) A dual role
Biol., 27, 1686-1695, doi: 10.1128/MCB.01483-06.
of dLsd1 in oogenesis: regulating developmental genes
83.
Ryazansky, S., Radion, E., Mironova, A., Akulenko, N.,
and repressing transposons, Nucleic Acids Res., 48,
Abramov, Y., Morgunova, V., Kordyukova, M. Y.,
1206-1224, doi: 10.1093/nar/gkz1142.
Olovnikov, I., and Kalmykova, A. (2017) Natural
93.
Yang, F., Quan, Z., Huang, H., He, M., Liu, X.,
variation of piRNA expression affects immunity to
Cai, T., and Xi, R. (2019) Ovaries absent links dLsd1
transposable elements, PLoS Genet., 13, e1006731,
to HP1a for local H3K4 demethylation required for
doi: 10.1371/journal.pgen.1006731.
heterochromatic gene silencing, Elife,
8, e40806,
84.
Maupetit-Mehouas, S., and Vaury, C. (2020) Trans-
doi: 10.7554/eLife.40806.
poson reactivation in the germline may be useful for
94.
Sienski, G., Batki, J., Senti, K. A., Donertas, D.,
both transposons and their host genomes, Cells, 9,
Tirian, L., Meixner, K., and Brennecke, J. (2015)
1172, doi: 10.3390/cells9051172.
Silencio/CG9754 connects the Piwi-piRNA complex
БИОХИМИЯ том 88 вып. 11 2023
РЕТРОТРАНСПОЗОНЫ И ТЕЛОМЕРЫ
2125
to the cellular heterochromatin machinery, Genes
105. Dan, J., Rousseau, P., Hardikar, S., Veland, N.,
Dev., 29, 2258-2271, doi: 10.1101/gad.271908.115.
Wong, J., Autexier, C., and Chen, T. (2017) Zscan4 in-
95. Penke, T. J., McKay, D. J., Strahl, B. D., Matera,
hibits maintenance DNA methylation to facilitate telo-
A. G., and Duronio, R. J. (2016) Direct interroga-
mere elongation in mouse embryonic stem cells, Cell
tion of the role of H3K9 in metazoan heterochroma-
Rep., 20, 1936-1949, doi: 10.1016/j.celrep.2017.07.070.
tin function, Genes Dev., 30, 1866-1880, doi: 10.1101/
106. Zalzman, M., Falco, G., Sharova, L. V., Nishiyama, A.,
gad.286278.116.
Thomas, M., Lee, S. L., Stagg, C. A., Hoang, H. G.,
96. Teo, R. Y. W., Anand, A., Sridhar, V., Okamura, K.,
Yang, H. T., Indig, F. E., Wersto, R. P., and Ko, M. S.
and Kai, T.
(2018) Heterochromatin protein
1a
(2010) Zscan4 regulates telomere elongation and
functions for piRNA biogenesis predominantly from
genomic stability in ES cells, Nature, 464, 858-863,
pericentric and telomeric regions in Drosophila, Nat.
doi: 10.1038/nature08882.
Commun., 9, 1735, doi: 10.1038/s41467-018-03908-3.
107. Thool, M., Sundaravadivelu, P. K., Sudhagar, S., and
97. Wang, S. H., and Elgin, S. C. (2011) Drosophila
Thummer, R. P. (2022) A comprehensive review on
Piwi functions downstream of piRNA production
the role of ZSCAN4 in embryonic development, stem
mediating a chromatin-based transposon silencing
cells, and cancer, Stem Cell Rev. Rep., 18, 2740-2756,
mechanism in female germ line, Proc. Natl. Acad.
doi: 10.1007/s12015-022-10412-1.
Sci. USA,
108,
21164-21169, doi:
10.1073/pnas.
108. Dan, J., Zhou, Z., Wang, F., Wang, H., Guo, R.,
1107892109.
Keefe, D. L., and Liu, L. (2022) Zscan4 contributes
98. Savitsky, M., Kravchuk, O., Melnikova, L., and
to telomere maintenance in telomerase-deficient late
Georgiev, P. (2002) Heterochromatin protein 1 is in-
generation mouse ESCs and human ALT cancer cells,
volved in control of telomere elongation in Drosophi-
Cells, 11, 456, doi: 10.3390/cells11030456.
la melanogaster, Mol. Cell. Biol., 22, 3204-3218, doi:
109. Peaston, A. E., Evsikov, A. V., Graber, J. H., de Vries,
10.1128/MCB.22.9.3204-3218.2002.
W. N., Holbrook, A. E., Solter, D., and Knowles, B. B.
99. Molaro, A., Falciatori, I., Hodges, E., Aravin, A. A.,
(2004) Retrotransposons regulate host genes in mouse
Marran, K., Rafii, S., McCombie, W. R., Smith, A. D.,
oocytes and preimplantation embryos, Dev Cell., 7,
and Hannon, G. J. (2014) Two waves of de novo meth-
597-606, doi: 10.1016/j.devcel.2004.09.004.
ylation during mouse germ cell development, Genes
110. Kigami, D., Minami, N., Takayama, H., and Imai, H.
Dev., 28, 1544-1549, doi: 10.1101/gad.244350.114.
(2003) MuERV-L is one of the earliest transcribed
100. Zoch, A., Auchynnikava, T., Berrens, R. V.,
genes in mouse one-cell embryos, Biol. Reprod., 68,
Kabayama, Y., Schopp, T., Heep, M., Vasiliauskaite, L.,
651-654, doi: 10.1095/biolreprod.102.007906.
Perez-Rico, Y. A., Cook, A. G., Shkumatava, A.,
111. Fadloun, A., Le Gras, S., Jost, B., Ziegler-Birling, C.,
Rappsilber, J., Allshire, R. C., and O’Carroll, D.
Takahashi, H., Gorab, E., Carninci, P., and Torres-
(2020) SPOCD1 is an essential executor of piRNA-
Padilla, M. E. (2013) Chromatin signatures and ret-
directed de novo DNA methylation, Nature, 584,
rotransposon profiling in mouse embryos reveal reg-
635-639, doi: 10.1038/s41586-020-2557-5.
ulation of LINE-1 by RNA, Nat. Struct. Mol. Biol.,
101. Zeng, Y., and Chen, T. (2019) DNA methylation
20, 332-338, doi: 10.1038/nsmb.2495.
reprogramming during mammalian development,
112. Eckersley-Maslin, M. A., Svensson, V., Krueger, C.,
Genes (Basel), 10, 257, doi: 10.3390/genes10040257.
Stubbs, T. M., Giehr, P., Krueger, F., Miragaia, R. J.,
102. Shirane, K., Kurimoto, K., Yabuta, Y., Yamaji, M.,
Kyriakopoulos, C., Berrens, R. V., Milagre, I.,
Satoh, J., Ito, S., Watanabe, A., Hayashi, K.,
Walter, J., Teichmann, S. A., and Reik, W. (2016)
Saitou, M., and Sasaki, H. (2016) Global landscape
MERVL/Zscan4 network activation results in transient
and regulatory principles of DNA methylation repro-
genome-wide DNA demethylation of mESCs, Cell
gramming for germ cell specification by mouse plurip-
Rep., 17, 179-192, doi: 10.1016/j.celrep.2016.08.087.
otent stem cells, Dev. Cell, 39, 87-103, doi: 10.1016/
113. Wang, F., Chamani, I. J., Luo, D., Chan, K., Navarro,
j.devcel.2016.08.008.
P. A., and Keefe, D. L. (2021) Inhibition of LINE-1
103. Kohlrausch, F. B., Berteli, T. S., Wang, F., Navarro,
retrotransposition represses telomere reprogramming
P. A., and Keefe, D. L. (2022) Control of LINE-1
during mouse 2-cell embryo development, J. Assist
expression maintains genome integrity in germline and
Reprod. Genet., 38, 3145-3153, doi: 10.1007/s10815-
early embryo development, Reprod. Sci., 29, 328-340,
021-02331-w.
doi: 10.1007/s43032-021-00461-1.
114. Percharde, M., Lin, C. J., Yin, Y., Guan, J., Peixoto,
104. Akiyama, T., Xin, L., Oda, M., Sharov, A. A.,
G. A., Bulut-Karslioglu, A., Biechele, S., Huang, B.,
Amano, M., Piao, Y., Cadet, J. S., Dudekula, D. B.,
Shen, X., and Ramalho-Santos, M. (2018) A LINE1-
Qian, Y., Wang, W., Ko, S. B., and Ko, M. S. (2015)
nucleolin partnership regulates early development
Transient bursts of Zscan4 expression are accompanied
and ESC identity, Cell, 174, 391-405, doi: 10.1016/
by the rapid derepression of heterochromatin in mouse
j.cell.2018.05.043.
embryonic stem cells, DNA Res., 22, 307-318, doi:
115. Macfarlan, T. S., Gifford, W. D., Driscoll, S.,
10.1093/dnares/dsv013.
Lettieri, K., Rowe, H. M., Bonanomi, D., Firth, A.,
БИОХИМИЯ том 88 вып. 11 2023
2126
КАЛМЫКОВА, СОКОЛОВА
Singer, O., Trono, D., and Pfaff, S. L.
(2012)
119. Aschacher, T., Wolf, B., Aschacher, O., Enzmann, F.,
Embryonic stem cell potency fluctuates with
Laszlo, V., Messner, B., Turkcan, A., Weis, S., Spiegl-
endogenous retrovirus activity, Nature, 487, 57-63,
Kreinecker, S., Holzmann, K., Laufer, G., Ehrlich, M.,
doi: 10.1038/nature11244.
and Bergmann, M. (2020) Long interspersed element-1
116. Ghosh, S., and Zhou, Z. (2014) Genetics of aging,
ribonucleoprotein particles protect telomeric ends in
progeria and lamin disorders, Curr. Opin. Genet. Dev.,
alternative lengthening of telomeres dependent cells,
26, 41-46, doi: 10.1016/j.gde.2014.05.003.
Neoplasia, 22, 61-75, doi: 10.1016/j.neo.2019.11.002.
117. Gorbunova, V., Seluanov, A., Mita, P., McKerrow, W.,
120. Cosby, R. L., Chang, N. C., and Feschotte, C. (2019)
Fenyo, D., Boeke, J. D., Linker, S. B., Gage, F. H.,
Host-transposon interactions: conflict, cooperation,
Kreiling, J. A., Petrashen, A. P., Woodham, T. A.,
and cooption, Genes Dev., 33, 1098-1116, doi: 10.1101/
Taylor, J. R., Helfand, S. L., and Sedivy, J. M. (2021)
gad.327312.119.
The role of retrotransposable elements in ageing and
121. Charlesworth, B., and Langley, C. H. (1989) The pop-
age-associated diseases, Nature,
596,
43-53, doi:
ulation genetics of Drosophila transposable elements,
10.1038/s41586-021-03542-y.
Annu. Rev. Genet., 23, 251-287, doi: 10.1146/annurev.
118. Aschacher, T., Wolf, B., Enzmann, F., Kienzl, P.,
ge.23.120189.001343.
Messner, B., Sampl, S., Svoboda, M., Mechtcheria-
122. Kelleher, E. S., and Barbash, D. A. (2013) Analysis of
kova, D., Holzmann, K., and Bergmann, M. (2016)
piRNA-mediated silencing of active TEs in Drosophila
LINE-1 induces hTERT and ensures telomere
melanogaster suggests limits on the evolution of host
maintenance in tumour cell lines, Oncogene, 35, 94-
genome defense, Mol. Biol. Evol., 30, 1816-1829, doi:
104, doi: 10.1038/onc.2015.65.
10.1093/molbev/mst081.
RETROTRANSPOSONS AND TELOMERES
Review
A. I. Kalmykova* and O. A. Sokolova
Koltzov Institute of Developmental Biology, Russian Academy of Sciences,
119334 Moscow, Russia; e-mail: allakalm@idbras.ru
Transposable elements (TEs) comprise a significant part of eukaryotic genomes being a major source of
genome instability and mutagenesis. Cellular defense systems suppress the TE expansion at all stages of
their life cycle. Piwi proteins and Piwi-interacting RNAs (piRNAs) are key elements of the anti-transposon
defense system, which control TE activity in metazoan gonads preventing inheritable transpositions and de-
velopmental defects. In this review, we discuss various regulatory mechanisms by which small RNAs combat
TE activity. However, active transposons persist, suggesting these powerful anti-transposon defense mecha-
nisms have a limited capacity. A growing body of evidence suggests that increased TE activity coincides with
genome reprogramming and telomere lengthening in different species. In the Drosophila fruit fly, whose
telomeres consist only of retrotransposons, a piRNA-mediated mechanism is required for telomere main-
tenance and their length control. Therefore, the efficacy of protective mechanisms must be finely balanced
in order not only to suppress the activity of transposons, but also to maintain the proper length and stability
of telomeres. Structural and functional relationship between the telomere homeostasis and LINE1 retro-
transposon in human cells indicates a close link between selfish TEs and the vital structure of the genome,
telomeres. This relationship, which permits the retention of active TEs in the genome, is reportedly a legacy
of the retrotransposon origin of telomeres. The maintenance of telomeres and the execution of other crucial
roles that TEs acquired during the process of their domestication in the genome serve as a type of payment
for such a “service.”
Keywords: retrotransposons, telomeres, telomerase, polyploidy, Piwi, piRNA, germline, chromatin, LINE1,
Drosophila
БИОХИМИЯ том 88 вып. 11 2023