БИОХИМИЯ, 2023, том 88, вып. 11, с. 2127 - 2137
УДК 577.2
МОБИЛЬНЫЕ И НЕМОБИЛЬНЫЕ:
МНОГООБРАЗИЕ ОБРАТНЫХ ТРАНСКРИПТАЗ
И ИХ РЕКРУТИРОВАНИЕ ГЕНОМОМ ХОЗЯИНА
Обзор
© 2023 И.Р. Архипова*, И.А. Юшенова
Josephine Bay Paul Center for Comparative Molecular Biology and Evolution, Marine Biological Laboratory,
Woods Hole, MA 02543 USA; e-mail: iarkhipova@mbl.edu, iyushenova@mbl.edu
Поступила в редакцию 13.09.2023
После доработки 18.09.2023
Принята к публикации 20.09.2023
Обратные транскриптазы (reverse transcriptase, RT), или РНК-зависимые ДНК-полимеразы -
это необычные ферменты, которые впервые дали возможность пересмотреть общепринятое
представление об однонаправленном потоке генетической информации в клетке от ДНК к РНК
и белку. RT были впервые обнаружены в ретровирусах позвоночных, а впоследствии - повтор-
но обнаружены у большинства эукариот, бактерий и архей (что, по сути, охватывает все надцар-
ства живых организмов). В ретровирусах RT обеспечивают возможность копировать РНК-геном
в ДНК для последующего включения в геном хозяина, что важно для репликации и выживания.
В клеточных организмах большинство последовательностей RT происходит от ретротранспо-
зонов - типа самореплицирующихся генетических элементов, которые полагаются на обратную
транскрипцию для копирования и вставки своих последовательностей в новые места генома.
Однако некоторые ретроэлементы могут быть «одомашнены» и в конечном итоге стать цен-
ным дополнением к общему репертуару клеточных ферментов. Они могут быть полезными и при
этом либо вспомогательными - например, как элементы, генерирующие разнообразие (diversity-
generating elements) - либо даже незаменимыми, как теломеразные RT. В настоящее время обна-
руживают всё большее количество «одомашненных» генетических элементов, несущих гены RT.
Можно утверждать, что «одомашненные» RT и обратная транскрипция в целом более широко
распространены в клеточных организмах, чем считалось ранее, и что многие важные клеточные
функции, такие как поддержание стабильности концов хромосом, могли возникнуть из изначально
«эгоистичного» процесса преобразования РНК в ДНК.
КЛЮЧЕВЫЕ СЛОВА: обратная транскрипция, РНК-зависимая ДНК-полимераза, теломеразная обратная
транскриптаза.
DOI: 10.31857/S0320972523110088, EDN: MLIDVY
ВВЕДЕНИЕ
таких дальновидных работ заслуженное место
занимает теоретическое предсказание Алексея
На заре молекулярной биологии, когда
Оловникова о недорепликации концов ДНК в
ещё мало что было известно о молекулярной
линейных хромосомах и существовании спе-
природе биологических явлений, авторы мно-
циализированного фермента, способного ре-
гочисленных теоретических работ пытались
шить эту проблему [1, 2]. Хотя одновременно
предвидеть будущие открытия и обоснованно
открытие проблемы репликации концов ДНК
предсказать молекулярные механизмы, объяс-
было также сделано в статье Джеймса Уотсо-
няющие фундаментальные генетические прин-
на [3], внимание в ней было уделено в основ-
ципы. Примечательно, что лишь относительно
ном фаговой ДНК, не указывалось на необ-
малая часть таких работ выдержала испыта-
ходимость специализированной полимеразы,
ние временем и экспериментальную проверку,
а вместо этого акцент был смещён на нуклеа-
последовавшую в предстоящие годы. Среди зы, процессирующие концы ДНК.
Принятые сокращения: RT - reverse transcriptase, обратная транскриптаза.
* Адресат для корреспонденции.
2127
2128
АРХИПОВА, ЮШЕНОВА
За открытие теломеразы - специализиро-
Процесс синтеза ДНК с использованием
ванной полимеразы, которая может добавлять
РНК в качестве матрицы в целом обозначается
простые повторяющиеся последовательности
термином «обратная транскрипция», а соот-
к концам линейных хромосом, чтобы компен-
ветствующий фермент, способный осущест-
сировать потерю концевой ДНК после каждо-
влять эту реакцию, носит название «обратная
го цикла репликации - была присуждена Но-
транскриптаза» (reverse transcriptase, RT), так-
белевская премия, но путь к нему был долгим
же известная как «ревертаза» в русскоязыч-
и непростым. В первоначальном сообщении
ной литературе. Его экспериментальному от-
Грейдер и Блэкберн найденный в Tetrahymena
крытию Теминым и Балтимором более 50 лет
фермент обозначался как концевая трансфе-
назад [6, 7] (которое также было отмечено
раза [4], поскольку его обнаруженная актив-
Нобелевской премией) аналогичным обра-
ность заключалась в добавлении тандемных
зом предшествовала концепция синтеза ДНК
повторов к теломерным праймерам без оче-
на матрице вирусной ДНК Говарда Темина,
видной матрицы. Однако впоследствии соот-
известная как «гипотеза провируса» [8]. Мало
ветствующая матричная РНК была выявлена
кто догадывался, что, помимо открытия об-
как неотъемлемый компонент рибонуклео-
ратного потока генетической информации от
протеинового холофермента, что послужило
вирусной РНК к ДНК, этой гипотезой также
экспериментальным доказательством РНК-за-
были созданы предпосылки для открытия са-
висимого синтеза ДНК [5], хотя по-прежнему
мореплицирующихся подвижных генетиче-
считалось, что классифицировать теломераз-
ских элементов и для последующего осозна-
ный фермент как настоящую обратную тран-
ния того, что некоторые дополнительные или
скриптазу преждевременно.
даже незаменимые функции клетки-хозяина
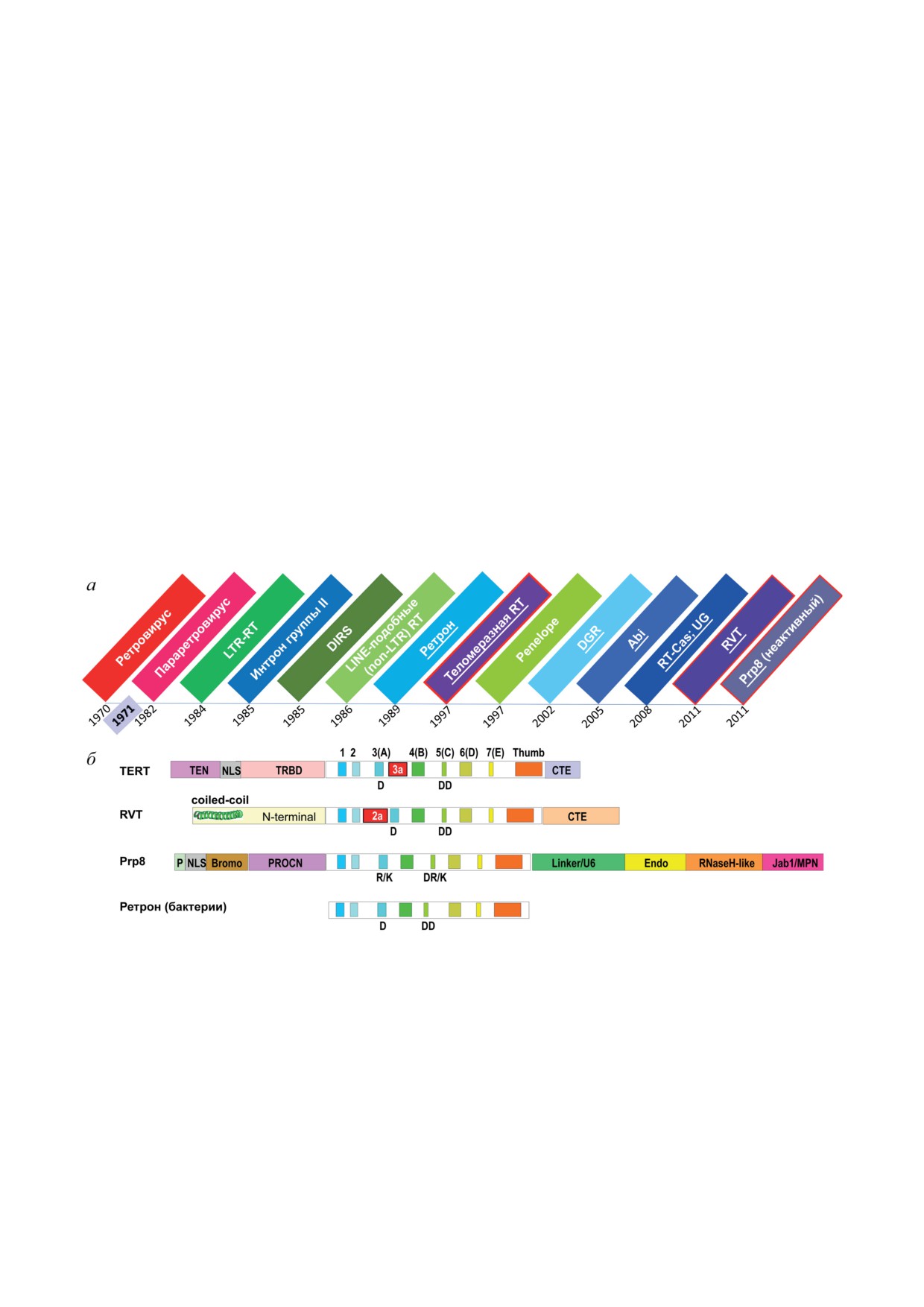
Рис. 1. Основные типы обратных транскриптаз (RT) из трёх надцарств живых организмов. а - Хронология открытия
RT. Основные типы RT, описанные в тексте, показаны следующими цветами: вирусные RT - оттенки красного; RT
эукариотических мобильных элементов - оттенки зелёного; прокариотические RT - оттенки синего; «одомашнен-
ные» эукариотические RT - оттенки фиолетового. «Одомашненные» RT подчёркнуты. Годы соответствуют первым
сообщениям о выявлении гомологии с каталитическим ядром RT. В 1971 г. впервые была обозначена проблема не-
полной репликации концов хромосом [1]. б - Примеры структурной организации «одомашненных» эукариотических
RT. Бактериальные ретроны включены для сравнения. Расположенное в центре каталитическое ядро RT представлено
семью консервативными мотивами, разделёнными спейсерами переменной длины с характерными длинными петля-
ми 2a и 3a (также называемая IFD), которые отмечены красным. Указаны аминокислотные остатки каталитической
триады D..DD и их некаталитические замены. Дополнительные домены по обе стороны от ядра RT и «большого паль-
ца»: TEN - незаменимый N-концевой домен теломеразы (telomerase essential N-terminal domain); TRBD - теломераз-
ный РНК-связывающий домен (telomerase RNA binding domain); CTE - C-концевое удлинение (C-terminal extension);
P - полипролиновый участок (polyproline stretch); NLS - сигнал ядерной локализации (nuclear localization signal);
Bromo - бромодомен; PROCN - центральный домен PRO8 (PRO8 central domain); Endo - эндонуклеазоподобный
домен (endonuclease-like); Jab1/MPN - предполагаемый деубиквитиназоподобный домен. Масштаб приблизительный.
Доменная структура представлена по различным литературным источникам [55, 57, 59].
БИОХИМИЯ том 88 вып. 11 2023
МНОГООБРАЗИЕ ОБРАТНЫХ ТРАНСКРИПТАЗ
2129
могут взять на себя потомки таких мобильных
тивно транскрибируемыми мультикопийными
элементов. Примечательно, что RT были обна-
генами, такими как повторяющиеся единицы
ружены примерно в то же время, когда была
рибосомальной ДНК или кластеры генов ги-
впервые выявлена проблема неполной репли-
стонов [13, 14]. Общее структурное сходство
кации концов хромосом (рис. 1).
LTR-ретротранспозонов и ретровирусов сразу
же стало очевидным при их клонировании из
дрозофилы и дрожжей [15]. Однако оконча-
РАЗВИТИЕ ПОДХОДОВ
тельное доказательство их близкого родства
К ВЫЯВЛЕНИЮ РЕТРОЭЛЕМЕНТОВ
с ретровирусами было получено в результате
анализа их полных нуклеотидных последова-
С момента открытия RT в ретровирусах
тельностей, выявившего их способность коди-
представление об их разнообразии необычай-
ровать фермент RT [16, 17]. Более того, харак-
но расширилось: от представления о них как
терные участки гомологии с консервативными
о чисто вирусных компонентах до открытия
мотивами RT вскоре были идентифицированы
их удивительно разнообразных структурных и
не только в ретровирусоподобных мобильных
функциональных ролей у эукариотических и
элементах, но также и в мобильных интронах
прокариотических хозяев (рис. 1, а). Ранние
митохондрий грибов II группы и других типах
достижения в области вирусологии привели к
мультикопийных эукариотических транспозо-
дальнейшему открытию обратной транскрип-
нов, таких как DIRS и LINE-подобные ретро-
ции в репликативных циклах гепаднавиру-
транспозоны [18-21]. В конце первых двух
сов и каулимовирусов (совместно названных
десятилетий изучения RT появились первые
параретровирусами [9]) - этому способство-
сообщения об их существовании у бактерий в
вала доступность методов выделения вирусов
форме ретронов, мультикопийных внехромо-
и биохимического анализа RT. Вскоре после
сомных химерных молекул ДНК-РНК, свя-
этого перспективы новых открытий смести-
занных через точку ветвления 2′-5′ [22, 23].
лись к обнаружению гомологии последова-
На следующем этапе в истории открытий
тельностей. Этот процесс ускорило появление
новых RT исследователи по-прежнему опи-
технологий секвенирования и знаковое откры-
рались на обнаружение гомологии последо-
тие общих мотивов аминокислотных последо-
вательностей, но преимущественно обнару-
вательностей в каталитическом ядре ДНК-по-
живались RT, присутствующие в меньшем ко-
лимераз вирусов, осуществляющих обратную
личестве копий, и большинство из них не
транскрипцию [10]. Вскоре после этого не-
относилось к мобильным элементам, а пред-
отъемлемой частью идентификации новых
ставляло собой однокопийные гены клетки-
RT стал поиск остатков аспартата, образую-
хозяина (рис. 1, а, подчёркнуто). Фактически
щих каталитическую триаду D..DD в актив-
известный на данный момент спектр эукарио-
ном центре RT. На представленной временной
тических ретротранспозонов не расширялся с
шкале изучения RT (рис. 1, а) основополагаю-
момента открытия Penelope-подобных ретро-
щим работам, в которых были впервые выяв-
элементов (Penelope-like elements, PLE) [24].
лены характерные остатки RT, был присвоен
Первый и наиболее известный случай «одо-
приоритет по сравнению с теми, в которых
машнивания» RT у эукариот был выявлен после
сообщалось о первоначальном биохимическом
доказательства того, что подлинную RT пред-
обнаружении РНК-зависимой полимеризации
ставляет собой теломераза. Проведение связи
ДНК. Это связано с тем, что полноценное экс-
между активностью RT и соответствующим фер-
периментальное подтверждение активности RT
ментом потребовало много сил и времени,
непременно должно включать в себя сайт-
в течение которого происходили и ошибоч-
направленный мутагенез остатков активного
ные определения [25]. Окончательного успеха
центра, присутствующих в двух из семи кон-
в определении каталитической субъединицы
сервативных мотивов, формирующих катали-
теломеразы как RT удалось достичь благодаря
тическое ядро RT (рис. 1, б).
выявлению консервативных мотивов в домене
Первая половина временной шкалы, до
«пальцев» и «ладони» RT, что подтвердила по-
1990-х гг., представлена в основном открытия-
теря активности ферментом при направленном
ми RT в различных типах вирусов и мобиль-
мутагенезе трёх инвариантных каталитических
ных генетических элементах. Действительно,
остатков аспартата [26]. Таким образом, было
мультикопийные мобильные элементы были
обнаружено, что однокопийный ген RT, при-
одними из первых компонентов эукариоти-
сутствующий почти у всех видов эукариот,
ческих геномов, клонированных на молеку-
отвечает за важную функцию клетки-хозяина
лярном уровне [11, 12], наряду с другими ак-
по удлинению концов линейных хромосом
7
БИОХИМИЯ том 88 вып. 11 2023
2130
АРХИПОВА, ЮШЕНОВА
для противодействия потере концевой ДНК
рые встречаются вместе с RT, а также состав
из-за недорепликации, или маргинотомии, как
соседних генов внутри мобилизуемой единицы
этот процесс был исходно назван Оловнико-
(рис. 2). Интересно, что ретровирусы, обнару-
вым [27]. В настоящее время новые типы RT
жение которых открыло эру изучения RT, ока-
выявляются в основном с помощью компью-
зались поразительно похожими на LTR-ретро-
терного поиска с использованием обширных
транспозоны, открытые более десяти лет позже,
геномных и метагеномных данных. В следую-
по составу генов, организации и циклу репли-
щих разделах мы кратко охарактеризуем RT,
кации, что указывает на общее эволюционное
принадлежащие к мобильным генетическим
происхождение [16, 17, 28]. RT гепаднавирусов
элементам, и сравним их с «одомашненными»
можно в целом отнести к основанию вирус-
и, соответственно, немобильными элементами.
ной/LTR-ветви эукариотических RT, в пред-
ставителях которой содержится C-концевой
домен РНКазы H для обеспечения реплика-
ЭУКАРИОТИЧЕСКИЕ
ции в цитоплазме, что позволяет не нуждаться
МОБИЛЬНЫЕ ЭЛЕМЕНТЫ:
в ядерных РНКазах H хозяина для разруше-
РЕТРОВИРУСЫ, ПАРАРЕТРОВИРУСЫ,
ния РНК в ДНК-РНК-гибриде (рис. 2). Ещё
РЕТРОТРАНСПОЗОНЫ
более необычными являются каулимовиру-
сы, RT которых сходна с таковой у Metaviri-
Чтобы понять и сравнить свойства вирус-
dae (также известных как Ty3/mdg4(gypsy)-
ных и мобильных RT, необходимо рассмотреть
подобные LTR-ретротранспозоны), так что
архитектуру консервативных доменов, кото-
их происхождение, скорее всего, гибридное -
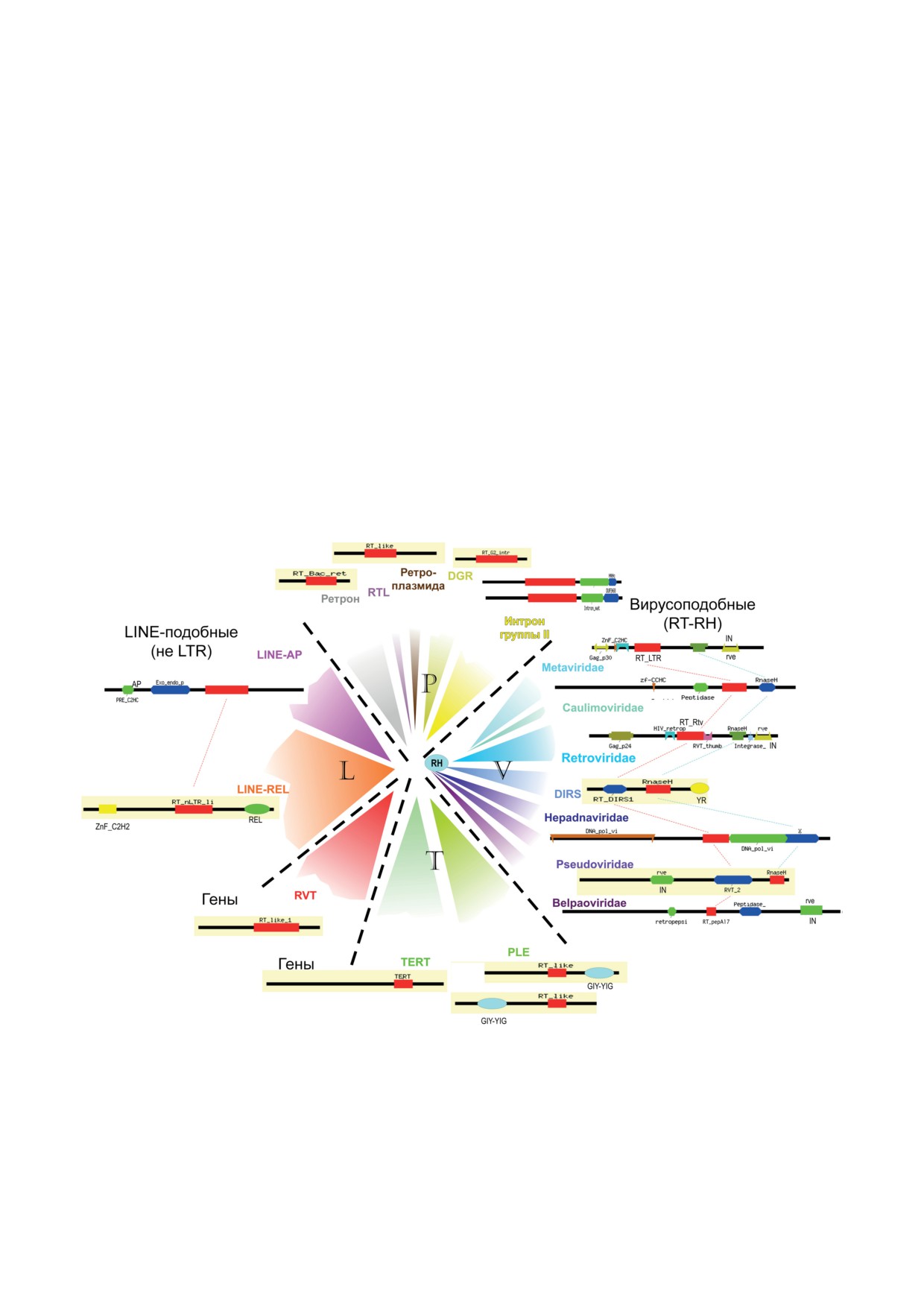
Рис. 2. Доменная архитектура основных типов RT, описанных в тексте. Для каждого типа представлена типичная
архитектура, выявленная с помощью CDART (Conserved Domain Architecture Retrieval Tool) в NCBI [63]. Обозначение
домена соответствует базе данных консервативных доменов NCBI (CDD) [64]. Цвета определяются CDART динами-
чески, а не фиксированы для каждого домена; для облегчения отслеживания гомологии домены RT и РНКазы H (RH)
соединены пунктирной линией. Расположенные по кругу элементы соответствуют приведённым в центре филогене-
тическим группам, взятым из работы Gladyshev et al. [55]. Буквы P, V, T и L соответствуют прокариотическим, вирусо-
подобным, теломеразоподобным и LINE-подобным ретроэлементам; гены rvt образуют отдельную группу, пока не
имеющую обозначения. Мобильные элементы содержат шесть различных типов ассоциированных нуклеаз/фосфо-
трансфераз, упомянутых в тексте: IN, AP, REL, YR, GIY-YIG, HNH. Вирусоподобные элементы названы согласно
классификации ICTV [29]. «Одомашненные» эукариотические RT (TERT, RVT) обозначены как «Гены»
БИОХИМИЯ том 88 вып. 11 2023
МНОГООБРАЗИЕ ОБРАТНЫХ ТРАНСКРИПТАЗ
2131
в результате захвата RT ДНК-вирусом [29].
модельной системой для изучения нестан-
Ty1/copia-подобные LTR-ретротранспозоны
дартных способов праймирования обратными
(Pseudoviridae) соответствуют общей струк-
транскриптазами (белковое праймирование,
туре LTR, но имеют другой порядок доменов.
в процессе которого RT использует в качестве
Все ретровирусоподобные элементы, входя-
праймера гидроксильную группу остатка тиро-
щие в таксономический порядок Ortervirales
зина или серина, или инициация de novo, при
(Retroviridae, Metaviridae, Pseudoviridae и Bel-
которой вообще не используется праймер). Их
paoviridae) [29], мобилизуются с помощью ин-
распространение всё же весьма ограничено,
тегразы (integrase, IN), которая отвечает за
поскольку они присутствуют лишь в несколь-
встраивание копии кДНК в новые участки
ких десятках видов грибов среди сотен сек-
хромосом. Отдельная группа элементов под
венированных грибных геномов. Ожидается,
названием DIRS мобилизуется с помощью ти-
что, будучи внехромосомными образования-
розинрекомбиназы (YR) вместо IN.
ми, они не подвергаются интеграции, но фор-
Ретротранспозоны подкласса LINE (также
мально составляют часть мобилома благодаря
известные как non-LTR) мобилизуются без об-
способности реплицироваться автономно.
разования цитоплазматической промежуточ-
ной кДНК: их RT использует механизм обрат-
ной транскрипции, праймируемой в сайте
НЕМОБИЛЬНЫЕ РЕТРОЭЛЕМЕНТЫ
интеграции (target-primed reverse transcription,
В БАКТЕРИЯХ И АРХЕЯХ:
TPRT) для синтеза кДНК непосредственно
РЕТРОНЫ, DGR, Abi/UG,
на сайте интеграции в хромосому, который
Cas-АССОЦИИРОВАННЫЕ,
разрезается одним из двух различных типов
G2I-ПОДОБНЫЕ
ассоциированных эндонуклеаз (EN) - AP-по-
добной или REL-подобной. Наконец, RT
Ретроны представляют собой своеобраз-
Penelope-подобных элементов (PLE) используют
ные
«одомашненные» бактериальные элемен-
для мобилизации ещё один тип EN (GIY-YIG),
ты, состоящие из ковалентно связанной РНК
в результате чего количество типов эндонукле-
и мультикопийной одноцепочечной ДНК
аз, связанных с ретротранспозонами эукариот,
(оцДНК) в одной разветвлённой молекуле,
достигает пяти. Более подробное свежее опи-
соединённой
2′-5′-фосфодиэфирными свя-
сание механизмов ретромобильности можно
зями [22, 23]. Каждый отдельный участок ре-
найти в обзоре Paul et al. [30].
трона кодирует последовательность белка RT,
некодирующую РНК, которая подвергается
обратной транскрипции с помощью RT с об-
ПРОКАРИОТИЧЕСКИЕ
разованием химерных одноцепочечных моле-
МОБИЛЬНЫЕ ЭЛЕМЕНТЫ:
кул ДНК/РНК, а также эффекторный ген,
ИНТРОНЫ ГРУППЫ II,
необходимый для антифаговой активности.
РЕТРОПЛАЗМИДЫ
Несмотря на то, что ретроны были первыми
прокариотическими немобильными ретро-
Интроны группы II (G2I) представляют со-
элементами, открытыми более 30 лет назад,
бой самосплайсинговые ретроэлементы, об-
их клеточная функция была выяснена только в
наруженные у бактерий, некоторых архей и
2020 г. [33-35]. Ретроны обеспечивают защиту
органелл эукариот [31]. Они были впервые
хозяина от широкого спектра фагов посред-
найдены в митохондриях грибов и, как было
ством абортивной инфекции и последующей
показано, обладают такой же структурной ор-
гибели клеток. Они широко распространены у
ганизацией у бактерий и архей и часто рассмат-
бактерий, являясь одним из основных компо-
риваются в качестве эволюционных предше-
нентов бактериальной иммунной системы. Од-
ственников эукариотических сплайсосомных
нако точные механизмы, посредством которых
интронов. Их ретромобильность обеспечи-
они дают бактериям устойчивость к фагам за
вается совместным действием каталитически
счёт обратной транскрипции, до сих пор неиз-
активной РНК, выполняющей функцию рибо-
вестны. Появление RT в трёхчастных модулях
зима в реакциях самосплайсинга и обратного
вместе с матрицей РНК и множеством предпо-
сплайсинга, а также кодируемой интроном RT,
лагаемых эффекторных генов предполагает их
которая синтезирует кДНК-копию интронной
прямое взаимодействие в индукции антифаго-
РНК в сайте-мишени с использованием меха-
вого ответа [36]. Действительно, такое взаимо-
низма TPRT.
действие наблюдалось в комплексе RT, род-
Ретроплазмиды были обнаружены в мито-
ственной ей оцДНК и связанной эффекторной
хондриях грибов [32] и долгое время служили
нуклеозиддезоксирибозилтрансферазы [37].
БИОХИМИЯ том 88 вып. 11 2023
7*
2132
АРХИПОВА, ЮШЕНОВА
Ретроэлементы, генерирующие разнообра-
заменён α-спиральным доменом, состоящим
зие (diversity-generating retroelements, DGR),
из повторов HEAT [45, 46]. Для значительной
представляют собой немобильные RT, кото-
части так называемых неизвестных групп RT
рые модифицируют соседние с ними после-
(unknown groups, UG) [47], некоторые из кото-
довательности ДНК у бактерий, архей и ви-
рых были независимо названы DRT (защитные
русов [38, 39]. Несмотря на то что DGR не
RT) [33], в более ранних исследованиях указы-
являются жизненно необходимыми ретро-
валось, что их невозможно отнести к конкрет-
элементами, они тем не менее полезны для
ному типу RT, но позже было обнаружено, что
своих хозяев. В наиболее детально описанной
они родственны RT Abi и играют роль в анти-
модельной системе DGR создают разнообра-
фаговой защите, находясь в так называемых
зие в С-концевой вариабельной области гена-
защитных островках, которые содержат мно-
мишени (mtd), кодирующего белок бактерио-
жество других генов, обеспечивающих защиту
фага BPP-1 Bordetella pertussis. Возникающая
от вторжения чужеродной ДНК [33, 45].
в результате этого гипервариабельность белка
RT-Cas: домены RT были обнаружены ря-
хвоста фага - области, которая контактирует
дом с CRISPR-ассоциированными генами или
с бактериальной клеткой во время инфек-
даже слиты с белками Cas [48-50]. Потенци-
ции - позволяет фагу инфицировать бактери-
ально эти RT могут обеспечивать бактериаль-
альные клетки с изменёнными рецепторами на
ный иммунитет, выполняя синтез кДНК на
поверхности. Используя подверженную ошиб-
РНК из бактериофагов, и действительно, было
кам обратную транскрипцию, DGR помогают
показано, что они опосредуют наследуемое
увеличить разнообразие продуктов генов, осо-
приобретение коротких последовательностей
бенно тех, которые участвуют в связывании
(спейсеров) из чужеродных РНК-элемен-
лигандов и прикреплении к клетке-хозяину.
тов [51]. Слияние с белками Cas не является
До сих пор остаётся загадкой то, как достига-
необходимым, хотя и способствует более эф-
ется адениновая специфичность целенаправ-
фективной кооперации взаимодействующих
ленного гипермутагенеза. Более того, провер-
доменов [52]. Эти RT не являются монофиле-
ка соседних генов в модулях DGR позволяет
тическими, поскольку включены в системы
предположить, что гипервариабельность мо-
CRISPR-Cas из нескольких бактериальных ли-
жет не ограничиваться переключением тро-
ний RT [50].
пизма и поверхностным дисплеем [40, 41].
Интроноподобные RT группы II
- гете-
Системы абортивной инфекции (abortive
рогенная группа немобильных RT, после-
infection systems, Abi), представленные AbiA,
довательности которых имеют сходство с
AbiK и Abi-P2, представляют собой бактери-
таковыми G2I, но лишены рибозимного ком-
альные ретроэлементы, служащие для защиты
понента - были впервые описаны в работе
определённых бактерий от фаговых инфек-
Simon et al. [48]. Недавно было обнаружено,
ций. Эти гены обнаружены только в геномах
что RT G2L из Pseudomonas aeruginosa (RT
некоторых бацилл (в основном у Lactococcus
G2L4) участвует в транслезионном синтезе
lactis), где в основном кодируются плазмидами
ДНК и репарации двухцепочечных разрывов
(AbiA и AbiK), а также в P2-подобных профа-
посредством микрогомологичного соединения
гах в Escherichia coli (Abi-P2). Хотя подробный
концов (microhomology-mediated end-joining,
механизм их действия до сих пор неизвестен,
MMEJ) [53]. Интересно, что замена YADD на
ясно, что белки Abi необходимы для блоки-
YIDD в активном центре RT G2L4 ответствен-
рования репликации фагов с последующей
на за сдвиг в сторону выполнения MMEJ вме-
запрограммированной гибелью клеток или
сто удлинения праймера, что характерно для
удалением фага [42, 43]. Интересно, что белок
каноничных RT G2I с YADD в каталитическом
AbiK, как было показано, осуществляет нема-
центре. Тем не менее каноничная RT G2I так-
тричную полимеризацию ДНК in vitro и кова-
же была способна выполнять репарацию ДНК.
лентно присоединяется к ДНК, что указывает
на белковое праймирование [44]. Таким обра-
зом, Abi представляют собой ещё один (поми-
НЕМОБИЛЬНЫЕ
мо ретронов) тип активных RT, который даёт
ЭУКАРИОТИЧЕСКИЕ RT
преимущество субпопуляции бактерий при
И ИХ ПРОИЗВОДНЫЕ:
атаке фагами. Следует отметить, что RT AbiP2
ТЕЛОМЕРАЗА, RVT, Prp8
и AbiK отличаются исключительной возмож-
ностью образовывать компактные тримеры
Теломеразная обратная транскриптаза
или гексамеры в растворе, а также отсутстви-
(TERT, telomerase reverse transcriptase), опи-
ем RT-домена «большого пальца», который
санная выше, несомненно, является наиболее
БИОХИМИЯ том 88 вып. 11 2023
МНОГООБРАЗИЕ ОБРАТНЫХ ТРАНСКРИПТАЗ
2133
известной RT с ключевой клеточной функ-
который заключает в себе центральную часть
цией. За счёт своей главной функции поддер-
крупного мультидоменного белка, связываю-
жания длины линейных хромосом она играет
щую U5-мяРНК (рис. 1, б). Отсутствие катали-
хорошо описанную роль в старении, развитии
тических остатков и очень высокая консерва-
рака и других заболеваний человека (аплас-
тивность последовательностей, обусловленная
тическая анемия, синдром кошачьего крика,
эволюционными ограничениями, налагаемы-
врождённый дискератоз и т.д.). Разрабатыва-
ми функцией сплайсосомы, препятствуют од-
ются многочисленные методы фармацевтиче-
нозначному филогенетическому размещению
ского воздействия на активную теломеразу и
этого RT-производного домена, но его проис-
связанную с ней матрицу РНК TERT в кон-
хождение, несомненно, восходит к последнему
тексте противораковой терапии и лечения воз-
общему предку всех эукариот.
растных заболеваний (недавний обзор приве-
дён в работе Fragkiadaki et al. [54]).
Гены, родственные обратной транскриптазе
ЗАКЛЮЧЕНИЕ
(reverse transcriptase-related genes, rvt), пред-
ставляют собой последний обнаруженный тип
Из приведённых выше описаний RT легко
«одомашненных» эукариотических RT, широ-
заключить, что те из них, которые принадле-
ко распространённый у грибов и иногда встре-
жат к типам, открытым в более ранние годы,
чающийся у отдельных растений, простейших
как правило, обнаруживались у многочис-
и беспозвоночных [55]. Поразительно, что эти
ленных организмов с большим количеством
гены присутствуют как у прокариот, так и у
копий RT. Вначале это были вирусы, а затем
эукариот, в отличие от всех других типов RT.
клеточные многокопийные мобильные гене-
Примечательно, что RVT изо всех типов бак-
тические элементы: у эукариот - LTR, DIRS и
терий образуют монофилетическую группу,
LINE-подобные ретротранспозоны, у прока-
что позволяет предположить, что они не были
риот - мобильные интроны группы II и ретро-
переданы горизонтально от эукариот, как из-
плазмиды, а также ретроны, продуцирующие
начально предполагалось, но, возможно, при-
многочисленные разветвлённые молекулы
сутствовали в бактериях до эукариогенеза [56].
ДНК-РНК в бактериальных клетках. Ретро-
Гены rvt кодируют активные RT-подобные бел-
мобильность обычно обеспечивается опре-
ки, которые у грибов могут полимеризовать
делённым типом эндонуклеазы, связанной
как dNTP, так и NTP. Белки RVT также спо-
с каждым мобильным элементом и дающей
собны к белковому праймированию. Хотя
возможность осуществлять внутрихромосом-
биологическая функция генов rvt ещё не пол-
ную вставку копии кДНК. На начальных эта-
ностью изучена, они явно сохраняются в ре-
пах многие эукариотические мобильные эле-
зультате естественного отбора, что указывает
менты были выявлены по своей способности
на их важность для клеток-хозяев. Эти гены
вызывать инсерционные мутации с видимыми
сильно активируются при аминокислотном го-
фенотипами в штаммах, где происходит транс-
лодании и применении некоторых антибиоти-
позиция мультикопийных элементов
[60].
ков у грибов, что позволяет предположить их
Сейчас очевидно, что RT могут выполнять
участие в ответе на такие агенты [55].
широкий спектр функций, помимо роли в рас-
Фактор процессинга пре-мРНК 8 (pre-
пространении
«эгоистичных» генетических
mRNA-processing factor 8, Prp8) представляет
элементов. Мы утверждаем, что многообразие
собой необычное «одомашненное» производ-
«одомашненных» RT было сильно занижено,
ное RT, которое потеряло два из трёх ката-
а их роль существенно недооценена, и суще-
литических остатков аспартата, в результате
ствует множество возможностей рекрутирова-
чего утратило способность полимеризовать
ния RT клетками-хозяевами, несмотря на то,
нуклеотиды [57]. Тем не менее Prp8 является
что в целом они не являются незаменимыми и
важной частью эукариотической сплайсосо-
распределены неравномерно. Неудивительно,
мы, регулирующей её сборку и конформацию
что иногда от первоначальной идентификации
во время сплайсинга пре-мРНК [58]. Было
того или иного элемента до правильного опре-
высказано предположение, что RT-фрагмент
деления его функции в клетке-хозяине может
Prp8 происходит от мобильных интронов
пройти много времени, вплоть до десятилетий,
группы II [59]. Это даёт нам ещё один пример
если он даёт хозяину селективное преимуще-
того, как в ходе эволюции «эгоистичные» рет-
ство лишь в определённых условиях. Теломе-
ротранспозоны могут давать начало важным
разная RT, кодируемая геном с одной копией,
компонентам эукариотических клеток, в дан-
представляет собой существенное исключение,
ном случае в качестве структурного элемента,
поскольку она практически повсеместно при-
БИОХИМИЯ том 88 вып. 11 2023
2134
АРХИПОВА, ЮШЕНОВА
сутствует в эукариотах, и открытие того факта,
reverse transcription, TPRT) с 3′-концов экспо-
что она кодирует специализированную RT, т.е.
нированных коротких G-богатых тандемных
фермент, который ранее считался характерным
повторов на концах линейных хромосом [62].
лишь для вирусов и мобильных элементов,
Трудно не удивляться тому, что специализиро-
произвело настоящую революцию в данной
ванный фермент, для которого Оловниковым
области исследований [26]. Тем не менее даже
была предсказана способность решать пробле-
критически важная функция поддержания ста-
му утраты концевой ДНК и сохранять целост-
бильности теломер может поддерживаться за
ность хромосом, происходит от мобильных
счёт независимых запасных путей [61].
элементов, изначально предназначенных для
Стоит подчеркнуть, что «приручение» RT
нарушения стабильности хромосом.
у эукариот неразрывно связано с появлением
дополнительных функциональных доменов,
Вклад авторов. И.Р. Архипова, И.А. Юше-
которые предотвращают произвольный синтез
нова - концепция, написание и редактирова-
ею кДНК с использованием случайных ком-
ние текста статьи; рисунки были адаптированы
бинаций праймер/матрица. В целом, не ожи-
И.А. из своей презентации на конференции
дается, что синтез копий кДНК на случайных
2022 г. «Пятьдесят лет обратной транскрипта-
матрицах РНК клетки-хозяина принесёт ей
зы» (Cold Spring Harbor, “Fifty Years of Reverse
пользу, и этот процесс следует предотвращать.
Transcriptase”).
Самый простой способ это сделать - устра-
Благодарности. Работа посвящена памяти
нить каталитическую активность путём заме-
Алексея Оловникова и заменяет собой запла-
ны остатков активного центра, как в случае
нированную ранее личную беседу, которая
Prp8. Другой вариант - изменить конфигура-
должна была произойти в Москве, но так
цию активного центра за счёт вставки допол-
и не состоялась.
нительных структурных петель, как в генах rvt.
Финансирование. Лабораторные исследо-
Наконец, TERT достигли строгой субстратной
вания поддержаны грантами Национально-
специфичности благодаря высокой степени
го института здравоохранения США (И.А.,
специализации в отношении несвязанной
R01GM111917) и Национального научного
высокоструктурированной РНК (называемой
фонда США (И.А. и И.Ю. - MCB-2139001,
TER или TR), которая содержит короткий
MCB-2326038).
обратный комплемент теломерной повторяю-
Конфликт интересов. Авторы заявляют об
щейся единицы, служащей матрицей, и спе-
отсутствии конфликта интересов.
цифически взаимодействует с доменом TRBD,
Соблюдение этических норм. Данная статья
выполняя высокопроцессивный синтез ДНК
не содержит описаний каких-либо исследо-
по механизму обратной транскрипции, прай-
ваний с участием людей или использованием
мируемой в сайте интеграции (target-primed
животных, выполненных авторами.
СПИСОК ЛИТЕРАТУРЫ
1. Olovnikov, A. M. (1971) Principle of marginotomy in
required for telomere repeat synthesis, Nature, 337,
template synthesis of polynucleotides [in Russian],
331-337, doi: 10.1038/337331a0.
Dokl. Akad. Nauk SSSR, 201, 1496-1499.
6. Temin, H. M., and Mizutani, S. (1970) RNA-depen-
2. Olovnikov, A. M. (1973) A theory of marginotomy.
dent DNA polymerase in virions of Rous sarcoma
The incomplete copying of template margin in
virus, Nature, 226, 1211-1213, doi: 10.1038/2261211a0.
enzymic synthesis of polynucleotides and biological
7. Baltimore, D. (1970) RNA-dependent DNA poly-
significance of the phenomenon, J. Theor. Biol.,
merase in virions of RNA tumour viruses, Nature, 226,
41, 181-190, doi: 10.1016/0022-5193(73)90198-7.
1209-1211, doi: 10.1038/2261209a0.
3. Watson, J. D. (1972) Origin of concatemeric T7
8. Temin, H. M. (1964) Nature of the provirus of Rous
DNA, Nat. New Biol., 239, 197-201, doi: 10.1038/
sarcoma, Nat. Cancer Inst. Monogr., 17, 557-570.
newbio239197a0.
9. Temin, H. M. (1985) Reverse transcription in the
4. Greider, C. W., and Blackburn, E. H. (1985) Identi-
eukaryotic genome: retroviruses, pararetrovirus-
fication of a specific telomere terminal transferase
es, retrotransposons, and retrotranscripts, Mol.
activity in Tetrahymena extracts, Cell, 43, 405-413,
Biol. Evol., 2, 455-468, doi: 10.1093/oxfordjournals.
doi: 10.1016/0092-8674(85)90170-9.
molbev.a040365.
5. Greider, C. W., and Blackburn, E. H. (1989) A telo-
10. Toh, H., Hayashida, H., and Miyata, T. (1983) Se-
meric sequence in the RNA of Tetrahymena telomerase
quence homology between retroviral reverse tran-
БИОХИМИЯ том 88 вып. 11 2023
МНОГООБРАЗИЕ ОБРАТНЫХ ТРАНСКРИПТАЗ
2135
scriptase and putative polymerases of hepatitis B virus
22.
Lampson, B. C., Sun, J., Hsu, M. Y., Vallejo-
and cauliflower mosaic virus, Nature, 305, 827-829,
Ramirez, J., Inouye, S., and Inouye, M. (1989) Re-
doi: 10.1038/305827a0.
verse transcriptase in a clinical strain of Escherichia
11.
Georgiev, G. P., Ilyin, Y. V., Ryskov, A. P., Tchurikov,
coli: production of branched RNA-linked msDNA,
N. A., Yenikolopov, G. N., Gvozdev, V. A., and
Science, 243, 1033-1038, doi: 10.1126/science.2466332.
Ananiev, E. V. (1977) Isolation of eukaryotic DNA
23.
Lim, D., and Maas, W. K. (1989) Reverse transcrip-
fragments containing structural genes and the adjacent
tase-dependent synthesis of a covalently linked,
sequences, Science,
195,
394-397, doi:
10.1126/
branched DNA-RNA compound in E. coli B, Cell,
science.401545.
56, 891-904, doi: 10.1016/0092-8674(89)90693-4.
12.
Finnegan, D. J., Rubin, G. M., Young, M. W.,
24.
Evgen’ev, M. B., Zelentsova, H., Shostak, N.,
and Hogness, D. S. (1978) Repeated gene families
Kozitsina, M., Barskyi, V., Lankenau, D. H., and
in Drosophila melanogaster, Cold Spring Harb.
Corces, V. G. (1997) Penelope, a new family of
Symp. Quant. Biol., 42, 1053-1063, doi: 10.1101/
transposable elements and its possible role in hybrid
sqb.1978.042.01.106.
dysgenesis in Drosophila virilis, Proc. Natl. Acad. Sci.
13.
Glover, D. M., White, R. L., Finnegan, D. J., and
USA, 94, 196-201, doi: 10.1073/pnas.94.1.196.
Hogness, D. S. (1975) Characterization of six cloned
25.
Lundblad, V., and Blackburn, E. H. (1990) RNA-
DNAs from Drosophila melanogaster, including one
dependent polymerase motifs in ESTl: Tentative
that contains the genes for rRNA, Cell, 5, 149-157,
identification of a protein component of an essential
doi: 10.1016/0092-8674(75)90023-9.
yeast telomerase, Cell, 60, 529-530, doi: 10.1016/
14.
Schaffner, W., Gross, K., Telford, J., and Birnstiel, M.
0092-8674(90)90653-v.
(1976) Molecular analysis of the histone gene cluster
26.
Lingner, J., Hughes, T. R., Shevchenko, A.,
of Psammechinus miliaris: II. The arrangement of
Mann, M., Lundblad, V., and Cech, T. R. (1997)
the five histone-coding and spacer sequences, Cell, 8,
Reverse transcriptase motifs in the catalytic subunit
471-478, doi: 10.1016/0092-8674(76)90214-2.
of telomerase, Science, 276, 561-567, doi: 10.1126/
15.
Georgiev, G. P. (1984) Mobile genetic elements in
science.276.5312.561.
animal cells and their biological significance, Eur. J.
27.
Olovnikov, A. M.
(1996) Telomeres, telomerase,
Biochem.,
145,
203-220, doi:
10.1111/j.1432-1033.
and aging: origin of the theory, Exp. Gerontol., 31,
1984.tb08541.x.
443-448, doi: 10.1016/0531-5565(96)00005-8.
16.
Saigo, K., Kugimiya, W., Matsuo, Y., Inouye, S.,
28.
Arkhipova, I. R., Mazo, A. M., Cherkasova, V. A.,
Yoshioka, K., and Yuki, S. (1984) Identification
Gorelova, T. V., Schuppe, N. G., and Ilyin, Y. V.
of the coding sequence for a reverse transcriptase-
(1986) The steps of reverse transcription of Drosophila
like enzyme in a transposable genetic element in
mobile genetic elements and U3-R-U5 structure
Drosophila melanogaster, Nature, 312, 659-661, doi:
of their LTRs, Cell,
44,
555-563, doi:
10.1016/
10.1038/312659a0.
0092-8674(86)90265-5.
17.
Emori, Y., Shiba, T., Kanaya, S., Inouye, S., Yuki, S.,
29.
Krupovic, M., Blomberg, J., Coffin, J. M.,
and Saigo, K. (1985) The nucleotide sequences of
Dasgupta, I., Fan, H., Geering, A. D., Gifford, R.,
copia and copia-related RNA in Drosophila virus-like
Harrach, B., Hull, R., Johnson, W., Kreuze, J. F.,
particles, Nature, 315, 773-776, doi: 10.1038/315773a0.
Lindemann, D., Llorens, C., Lockhart, B., Mayer, J.,
18.
Michel, F., and Lang, B. F. (1985) Mitochondrial
Muller, E., Olszewski, N., Pappu, H. R., Pooggin, M.,
class II introns encode proteins related to the reverse
Richert-Poggeler, K. R., et al. (2018) Ortervirales:
transcriptases of retroviruses, Nature, 316, 641-643,
A new viral order unifying five families of reverse-
doi: 10.1038/316641a0.
transcribing viruses, J. Virol., 92, e00515-18, doi:
19.
Cappello, J., Handelsman, K., and Lodish, H. F.
10.1128/jvi.00515-18.
(1985) Sequence of Dictyostelium DIRS-1: an appar-
30.
Paul, B. G., Yushenova, I. A., and Arkhipova,
ent retrotransposon with inverted terminal repeats and
I. R. (2022) The Diversity of Reverse Transcriptases
an internal circle junction sequence, Cell, 43, 105-115,
in Retrotransposons and Human Disease (Gabriel,
doi: 10.1016/0092-8674(85)90016-9.
A., ed.) World Scientific, Singapore, pp.
1-28,
20.
Hattori, M., Kuhara, S., Takenaka, O., and Sakaki, Y.
doi: 10.1142/9789811249228_0001.
(1986) L1 family of repetitive DNA sequences in
31.
Lambowitz, A. M., and Belfort, M. (2015) Mo-
primates may be derived from a sequence encoding
bile bacterial group II introns at the crux of eukary-
a reverse transcriptase-related protein, Nature, 321,
otic evolution, Microbiol. Spectr., 3, doi: 10.1128/
625-628, doi: 10.1038/321625a0.
microbiolspec.MDNA3-0050-2014.
21.
Fawcett, D. H., Lister, C. K., Kellett, E., and
32.
Arkhipova, I. R., and Yushenova, I. A. (2019) Giant
Finnegan, D. J. (1986) Transposable elements con-
transposons in eukaryotes: Is bigger better? Genome
trolling I-R hybrid dysgenesis in D. melanogaster are
Biol. Evol., 11, 906-918, doi: 10.1093/gbe/evz041.
similar to mammalian LINEs, Cell, 47, 1007-1015,
33.
Gao, L., Altae-Tran, H., Böhning, F., Makarova,
doi: 10.1016/0092-8674(86)90815-9.
K. S., Segel, M., Schmid-Burgk, J. L., Koob, J.,
БИОХИМИЯ том 88 вып. 11 2023
2136
АРХИПОВА, ЮШЕНОВА
Wolf, Y. I., Koonin, E. V., and Zhang, F.
(2020)
of the lactococcal abortive phage infection protein
Diverse enzymatic activities mediate antiviral
AbiK, J. Bacteriol., 187, 3721-3730, doi: 10.1128/
immunity in prokaryotes, Science, 369, 1077-1084,
jb.187.11.3721-3730.2005.
doi: 10.1126/science.aba0372.
43.
Lopatina, A., Tal, N., and Sorek, R. (2020) Abortive
34.
Millman, A., Bernheim, A., Stokar-Avihail, A.,
infection: bacterial suicide as an antiviral immune
Fedorenko, T., Voichek, M., Leavitt, A., Oppen-
strategy, Annu. Rev. Virol., 7, 371-384, doi: 10.1146/
heimer-Shaanan, Y., and Sorek, R. (2020) Bacterial
annurev-virology-011620-040628.
retrons function in anti-phage defense, Cell, 183,
44.
Wang, C., Villion, M., Semper, C., Coros, C.,
1551-1561, doi: 10.1016/j.cell.2020.09.065.
Moineau, S., and Zimmerly, S. (2011) A reverse
35.
Bobonis, J., Mitosch, K., Mateus, A., Karcher, N.,
transcriptase-related protein mediates phage resistance
Kritikos, G., Selkrig, J., Zietek, M., Monzon, V.,
and polymerizes untemplated DNA in vitro, Nucleic
Pfalz, B., Garcia-Santamarina, S., Galardini, M.,
Acids Res., 39, 7620-7629, doi: 10.1093/nar/gkr397.
Sueki, A., Kobayashi, C., Stein, F., Bateman, A.,
45.
Mestre, M. R., Gao, L. A., Shah, S. A., López-
Zeller, G., Savitski, M. M., Elfenbein, J. R., Andrews-
Beltrán, A., González-Delgado, A., Martínez-
Polymenis, H. L., and Typas, A. (2022) Bacterial
Abarca, F., Iranzo, J., Redrejo-Rodríguez, M.,
retrons encode phage-defending tripartite toxin-
Zhang, F., and Toro, N. (2022) UG/Abi: a highly
antitoxin systems, Nature, 609, 144-150, doi: 10.1038/
diverse family of prokaryotic reverse transcriptases
s41586-022-05091-4.
associated with defense functions, Nucleic Acids Res.,
36.
Mestre, M. R., González-Delgado, A., Gutiérrez-
50, 6084-6101, doi: 10.1093/nar/gkac467.
Rus, L. I., Martínez-Abarca, F., and Toro, N. (2020)
46.
Figiel, M., Gapińska, M., Czarnocki-Cieciura, M.,
Systematic prediction of genes functionally associated
Zajko, W., Sroka, M., Skowronek, K., and
with bacterial retrons and classification of the encoded
Nowotny, M. (2022) Mechanism of protein-primed
tripartite systems, Nucleic Acids Res., 48, 12632-12647,
template-independent DNA synthesis by Abi
doi: 10.1093/nar/gkaa1149.
polymerases, Nucleic Acids Res., 50, 10026-10040,
37.
Wang, Y., Guan, Z., Wang, C., Nie, Y., Chen, Y.,
doi: 10.1093/nar/gkac772.
Qian, Z., Cui, Y., Xu, H., Wang, Q., Zhao, F.,
47.
Zimmerly, S., and Wu, L. (2015) An unexplored
Zhang, D., Tao, P., Sun, M., Yin, P., Jin, S., Wu, S.,
diversity of reverse transcriptases in bacteria,
and Zou, T. (2022) Cryo-EM structures of Escherichia
Microbiol. Spectrum,
3, MDNA3-0058-2014, doi:
coli Ec86 retron complexes reveal architecture and
10.1128/microbiolspec.MDNA3-0058-2014.
defence mechanism, Nat. Microbiol., 7, 1480-1489,
48.
Simon, D. M., and Zimmerly, S. (2008) A diversity
doi: 10.1038/s41564-022-01197-7.
of uncharacterized reverse transcriptases in bacteria,
38.
Guo, H., Arambula, D., Ghosh, P., and Mill-
Nucleic Acids Res.,
36,
7219-7229, doi:
10.1093/
er, J. F. (2014) Diversity-generating retroelements
nar/gkn867.
in phage and bacterial genomes, Microbiol. Spectr.,
49.
Kojima, K. K., and Kanehisa, M. (2008) Systematic
2, MDNA3-0029-2014, doi: 10.1128/microbiolspec.
survey for novel types of prokaryotic retroelements
MDNA3-0029-2014.
based on gene neighborhood and protein architecture,
39.
Paul, B. G., Burstein, D., Castelle, C. J., Handa, S.,
Mol. Biol. Evol., 25, 1395-1404, doi: 10.1093/molbev/
Arambula, D., Czornyj, E., Thomas, B. C., Ghosh, P.,
msn081.
Miller, J. F., Banfield, J. F., and Valentine, D. L.
50.
Toro, N., Martinez-Abarca, F., Mestre, M. R.,
(2017) Retroelement-guided protein diversification
and Gonzalez-Delgado, A. (2019) Multiple origins
abounds in vast lineages of Bacteria and Archaea, Nat.
of reverse transcriptases linked to CRISPR-Cas
Microbiol., 2, 17045, doi: 10.1038/nmicrobiol.2017.45.
systems, RNA Biol., 16, 1486-1493, doi: 10.1080/
40.
Roux, S., Paul, B. G., Bagby, S. C., Nayfach, S.,
15476286.2019.1639310.
Allen, M. A., Attwood, G., Cavicchioli, R.,
51.
Silas, S., Mohr, G., Sidote, D. J., Markham, L. M.,
Chistoserdova, L., Gruninger, R. J., Hallam, S. J.,
Sanchez-Amat, A., Bhaya, D., Lambowitz, A. M., and
Hernandez, M. E., Hess, M., Liu, W. T., McAllister,
Fire, A. Z. (2016) Direct CRISPR spacer acquisition
T. A., O’Malley, M. A., Peng, X., Rich, V. I., Saleska,
from RNA by a natural reverse transcriptase-Cas1
S. R., and Eloe-Fadrosh, E. A. (2021) Ecology and
fusion protein, Science, 351, aad4234, doi: 10.1126/
molecular targets of hypermutation in the global
science.aad4234.
microbiome, Nat. Commun., 12, 3076, doi: 10.1038/
52.
Mohr, G., Silas, S., Stamos, J. L., Makarova,
s41467-021-23402-7.
K. S., Markham, L. M., Yao, J., Lucas-Elio, P.,
41.
Paul, B. G., and Eren, A. M. (2022) Eco-evolution-
Sanchez-Amat, A., Fire, A. Z., Koonin, E. V., and
ary significance of domesticated retroelements in mi-
Lambowitz, A. M. (2018) A reverse transcriptase-
crobial genomes, Mobile DNA, 13, 6, doi: 10.1186/
Cas1 fusion protein contains a Cas6 domain required
s13100-022-00262-6.
for both CRISPR RNA biogenesis and RNA spacer
42.
Fortier, L. C., Bouchard, J. D., and Moineau, S.
acquisition, Mol. Cell, 72, 700-714, doi: 10.1016/
(2005) Expression and site-directed mutagenesis
j.molcel.2018.09.013.
БИОХИМИЯ том 88 вып. 11 2023
МНОГООБРАЗИЕ ОБРАТНЫХ ТРАНСКРИПТАЗ
2137
53. Park, S. K., Mohr, G., Yao, J., Russell, R., and Lam-
59. Galej, W. P., Oubridge, C., Newman, A. J., and
bowitz, A. M. (2022) Group II intron-like reverse tran-
Nagai, K. (2013) Crystal structure of Prp8 reveals active
scriptases function in double-strand break repair, Cell,
site cavity of the spliceosome, Nature, 493, 638-643,
185, 3671-3688.e3623, doi: 10.1016/j.cell.2022.08.014.
doi: 10.1038/nature11843.
54. Fragkiadaki, P., Renieri, E., Kalliantasi, K., Kouvidi, E.,
60. Lambert, M. E., McDonald, J. F., and Weinstein, I. B.
Apalaki, E., Vakonaki, E., Mamoulakis, C.,
(1988) Eukaryotic Transposable Elements as Mutagenic
Spandidos, D. A., and Tsatsakis, A. (2022) Τelomer-
Agents, Cold Spring Harbor Laboratory Press,
ase inhibitors and activators in aging and cancer: A sys-
Cold Spring Harbor, NY.
tematic review, Mol. Med. Rep., 25, 158, doi: 10.3892/
61. Arkhipova, I. R. (2012) Telomerase, retrotransposons,
mmr.2022.12674.
and evolution, in Telomerases: Chemistry, Biology, and
55. Gladyshev, E. A., and Arkhipova, I. R. (2011) A wide-
Clinical Applications (Lue, N. F., and Autexier, C.,
spread class of reverse transcriptase-related cellular
eds.) John Wiley & Sons, Inc., Hoboken, NJ,
genes, Proc. Natl. Acad. Sci. USA, 108, 20311-20316,
pp. 265-299, doi: 10.1002/9781118268667.ch11.
doi: 10.1073/pnas.1100266108.
62. Lue, N. F., and Autexier, C. (2006) The structure
56. Yushenova, I. A., and Arkhipova, I. R. (2018) Bio-
and function of telomerase reverse transcriptase,
chemical properties of bacterial reverse transcrip-
Annu. Rev. Biochem.,
75,
493-517, doi:
10.1146/
tase-related (rvt) gene products: multimerization, pro-
annurev.biochem.75.103004.142412.
tein priming, and nucleotide preference, Curr. Genet.,
63. Geer, L. Y., Domrachev, M., Lipman, D. J., and
64, 1287-1301, doi: 10.1007/s00294-018-0844-6.
Bryant, S. H. (2002) CDART: protein homology by
57. Dlakic, M., and Mushegian, A. (2011) Prp8, the pivotal
domain architecture, Genome Res., 12, 1619-1623,
protein of the spliceosomal catalytic center, evolved
doi: 10.1101/gr.278202.
from a retroelement-encoded reverse transcriptase,
64. Marchler-Bauer, A., Derbyshire, M. K., Gonzales,
RNA, 17, 799-808, doi: 10.1261/rna.2396011.
N. R., Lu, S., Chitsaz, F., and Geer, L. Y. (2015)
58. Grainger, R. J., and Beggs, J. D. (2005) Prp8 protein:
CDD: NCBI’s conserved domain database,
at the heart of the spliceosome, RNA, 11, 533-557, doi:
Nucleic Acids Res., 43, D222-D226, doi: 10.1093/
10.1261/rna.2220705.
nar/gku1221.
TO BE MOBILE OR NOT:
THE VARIETY OF REVERSE TRANSCRIPTASES
AND THEIR RECRUITMENT BY HOST GENOMES
Review
I. R. Arkhipova* and I. A. Yushenova
Josephine Bay Paul Center for Comparative Molecular Biology and Evolution, Marine Biological Laboratory,
Woods Hole, MA 02543 USA; e-mail: iarkhipova@mbl.edu, iyushenova@mbl.edu
Reverse transcriptases (RT), or RNA-dependent DNA polymerases, are unorthodox enzymes that origi-
nally added a new angle to the conventional view of the unidirectional flow of genetic information in the
cell from DNA to RNA to protein. First discovered in vertebrate retroviruses, RTs were since re-discovered
in most eukaryotes, bacteria, and archaea, spanning essentially all domains of life. For retroviruses, RTs
provide the ability to copy the RNA genome into DNA for subsequent incorporation into the host genome,
which is essential for their replication and survival. In cellular organisms, most RT sequences originate from
retrotransposons, the type of self-replicating genetic elements that rely on reverse transcription to copy and
paste their sequences into new genomic locations. Some retroelements, however, can undergo domestica-
tion, eventually becoming a valuable addition to the overall repertoire of cellular enzymes. They can be
beneficial yet accessory, like the diversity-generating elements, or even essential, like the telomerase reverse
transcriptases. Nowadays, ever-increasing numbers of domesticated RT-carrying genetic elements are being
discovered. It may be argued that domesticated RTs and reverse transcription in general is more widespread
in cellular organisms than previously thought, and that many important cellular functions, such as chromo-
some end maintenance, may evolve from an originally selfish process of converting RNA into DNA.
Keywords: reverse transcription, RNA-dependent DNA polymerase, telomerase reverse transcriptase
БИОХИМИЯ том 88 вып. 11 2023