БИОХИМИЯ, 2023, том 88, вып. 11, с. 2314 - 2325
УДК 616.1;612.015.11
РАЗЛИЧИЯ В СТРУКТУРНЫХ ИЗМЕНЕНИЯХ
И ПАТОФИЗИОЛОГИЧЕСКИХ ЭФФЕКТАХ ЛИПОПРОТЕИДОВ
НИЗКОЙ ПЛОТНОСТИ ПРИ НАКОПЛЕНИИ В НИХ
АЦИЛГИДРОПЕРОКСИ-ПРОИЗВОДНЫХ В НАРУЖНОМ
ФОСФОЛИПИДНОМ МОНОСЛОЕ ИЛИ ПРИ ХИМИЧЕСКОЙ
МОДИФИКАЦИИ АПОПРОТЕИНА В-100
ПРИРОДНЫМ ДИКАРБОНИЛОМ
© 2023 В.З. Ланкин*, А.К. Тихазе, Г.Г. Коновалова
ФГБУ «Национальный медицинский исследовательский центр кардиологии
имени академика Е.И. Чазова» Минздрава России,
121552 Москва, Россия; электронная почта: lankin0309@mail.ru
Поступила в редакцию 04.08.2023
После доработки 20.09.2023
Принята к публикации 20.09.2023
Наночастицы липид-транспортирующей системы организма - липопротеиды низкой плотности
(ЛНП) плазмы крови легко подвергаются свободнорадикальному окислению с образованием их
основных модифицированных форм - собственно окисленные ЛНП (содержащие гидроперокси-
ацилы в фосфолипидах наружного слоя частиц) и дикарбонил-модифицированные ЛНП (апо-
протеин В-100 которых подвергся химической модификации по реакции Майара). На основании
исследования кинетики свободнорадикального окисления ЛНП установлено, что существующее
в литературе обозначение «окисленные липопротеиды» некорректно, поскольку не раскрыва-
ет природы окислительной модификации ЛНП. Показано, что «атерогенными» ЛНП (частицы
которых активно захватываются культивируемыми макрофагами) являются не истинно окис-
ленные ЛНП (в которых липогидроперокси-производные фосфолипидов были образованы при
ферментативном окислении С-15 липоксигеназой ретикулоцитов кролика), а дикарбонил-моди-
фицированные ЛНП. Обсуждается важная роль дикарбонил-модифицированных ЛНП в молеку-
лярных механизмах атерогенеза и дисфункции эндотелия.
КЛЮЧЕВЫЕ СЛОВА: окисленные липопротеиды низкой плотности (ЛНП), дикарбонил-модифициро-
ванные ЛНП, свободнорадикальное окисление, «атерогенные» ЛНП, окислительный стресс, карбониль-
ный стресс.
DOI: 10.31857/S0320972523110209, EDN: MNINOG
ВВЕДЕНИЕ
только для уточнения терминологии, но глав-
ным образом для установления связи между
В литературе достаточно давно активно
строением «окисленных липопротеидов» и их
обсуждается важная роль окисленных липопро-
ролью в молекулярных механизмах атерогенеза
теидов в атерогенезе [1-9] и в диабетогенезе [7, 8].
и дисфункции эндотелия. Следует отметить,
Тем не менее для выяснения роли окислен-
что термин «окисленные липопротеиды», пре-
ных липопротеидов в важнейших патофизио-
жде всего, применим к липопротеидам низ-
логических процессах, таких как атеросклероз
кой плотности (ЛНП) [1-4, 8]. Наночастицы
и сахарный диабет, следует определить, что
ЛНП осуществляют транспорт липидов, син-
собой представляют так называемые «окис-
тезируемых в печени, в периферические ткани.
ленные липопротеиды». Это необходимо не Нами установлено, что частицы именно ЛНП
Принятые сокращения: апоВ-100 - апопротеин В-100; ЛНП - липопротеиды низкой плотности; МДА - мало-
новый диальдегид; ПНЖК - полиненасыщенные жирные кислоты; LOX-1 - лектин-подобный рецептор-1 для окис-
ленных ЛНП; С-15 LOX - C-15 липоксигеназа ретикулоцитов кролика; LOOH - липогидропероксиды; TBARS -
продукты, реагирующие с 2-тиобарбитуровой кислотой.
* Адресат для корреспонденции.
2314
ЧТО ТАКОЕ «ОКИСЛЕННЫЕ» ЛИПОПРОТЕИДЫ?
2315
наиболее подвержены свободнорадикальной
му увеличению ее микровязкости вследствие
липопероксидации [10]. Первоначальным суб-
удаления из гидрофобного окружения поляр-
стратом окисления служат β-ацилы фосфо-
ных LOOH-содержащих β-ацилов, которые об-
липидов наружного слоя частиц ЛНП [11],
разуются при окислении ПНЖК (рис. 1) [14].
которые обычно представлены полиненасы-
Увеличение микровязкости при этом объясни-
щенными жирными кислотами (ПНЖК). Бо-
мо увеличением содержания в фосфолипидах
лее глубокое окисление, затрагивающее нена-
ригидных насыщенных и мононенасыщенных
сыщенные липиды гидрофобного ядра ЛНП
ацилов (рис. 1). Следует отметить, что при
(триглицериды и эфиры холестерина), разви-
NADPH-инициируемом окислении микросом
вается позднее [12]. «Окисленным» ЛНП при-
печени крысы нами было обнаружено разно-
писывается важная роль в первичном повреж-
направленное изменение активности ряда
дении сосудов, поскольку, как полагают, эти
мембраносвязанных ферментов [6-8], что, не-
частицы усиленно захватываются клетками
сомненно, является отражением изменения
стенки сосудов (макрофагами, плейоморфны-
конформации мембранных белков в процессе
ми гладкомышечными клетками и т.д.), кото-
свободнорадикального окисления. Аналогич-
рые превращаются в обогащенные липидами
ный процесс в наружном фосфолипидном
«пенистые клетки» [1-8, 9]. Скопления «пе-
слое частиц ЛНП может приводить к физиче-
нистых клеток» образуют липидные кластеры
ской модификации единственного белка этих
(липидные пятна или зоны липоидоза), кото-
частиц - апопротеина В-100 (апоВ-100), ко-
рые рассматриваются как первичные пред-
торый встроен в фосфолипидный монослой.
атеросклеротические повреждения стенки со-
Очевидно, что изменение конформации апоВ-
судов [6-9]. Исходя из теории жидкофазного
100 может влиять на его рецепторные свойства
окисления углеводородов [13], можно выделить
при взаимодействии со scavenger-рецептором
две основные стадии свободнорадикального
клеток стенки сосудов и, таким образом, опре-
окисления ЛНП, связанные с образованием
делять роль LOOH-содержащих ЛНП в атеро-
первичных и вторичных продуктов окисле-
генезе.
ния. Введение полярных гидроперокси-групп
Свободнорадикальное окисление ЛНП -
(-ООН) в ПНЖК-ацилы фосфолипидов на-
многостадийный процесс, при котором на-
ружного слоя частиц ЛНП (образование пер-
копление первичных продуктов окисления
вичных продуктов окисления - липогидро-
(рис. 2, реакция 1)
- LOOH - неизбежно
пероксидов, LOOH) должно сопровождаться
сопровождается образованием низкомолеку-
увеличением гидрофильности β-ацилов, вслед-
лярных водорастворимых вторичных продук-
ствие чего они могут «выдвигаться» в водную
тов окисления липидов альдегидной природы
фазу (рис. 1).
(рис. 2, реакция 2), таких как 4-гидроксиноне-
Это подтверждают наши эксперименты
наль и малоновый диальдегид (МДА) [6-8].
по окислению фосфолипидных липосом при
Известно, что МДА и другие дикарбони-
катализе С-15 животной липоксигеназой [14].
лы могут модифицировать белки по реакции
Увеличение содержания ацилгидроперокси-
Майара (Maillard reaction) вследствие взаимо-
производных в фосфолипидной мембране, как
действия альдегидной группы дикарбонилов с
и следовало ожидать, приводит к значительно-
концевыми аминогруппами белков (рис. 2, ре-
акция 3), что приводит к образованию ад-
дуктов с белками (поперечных сшивок типа
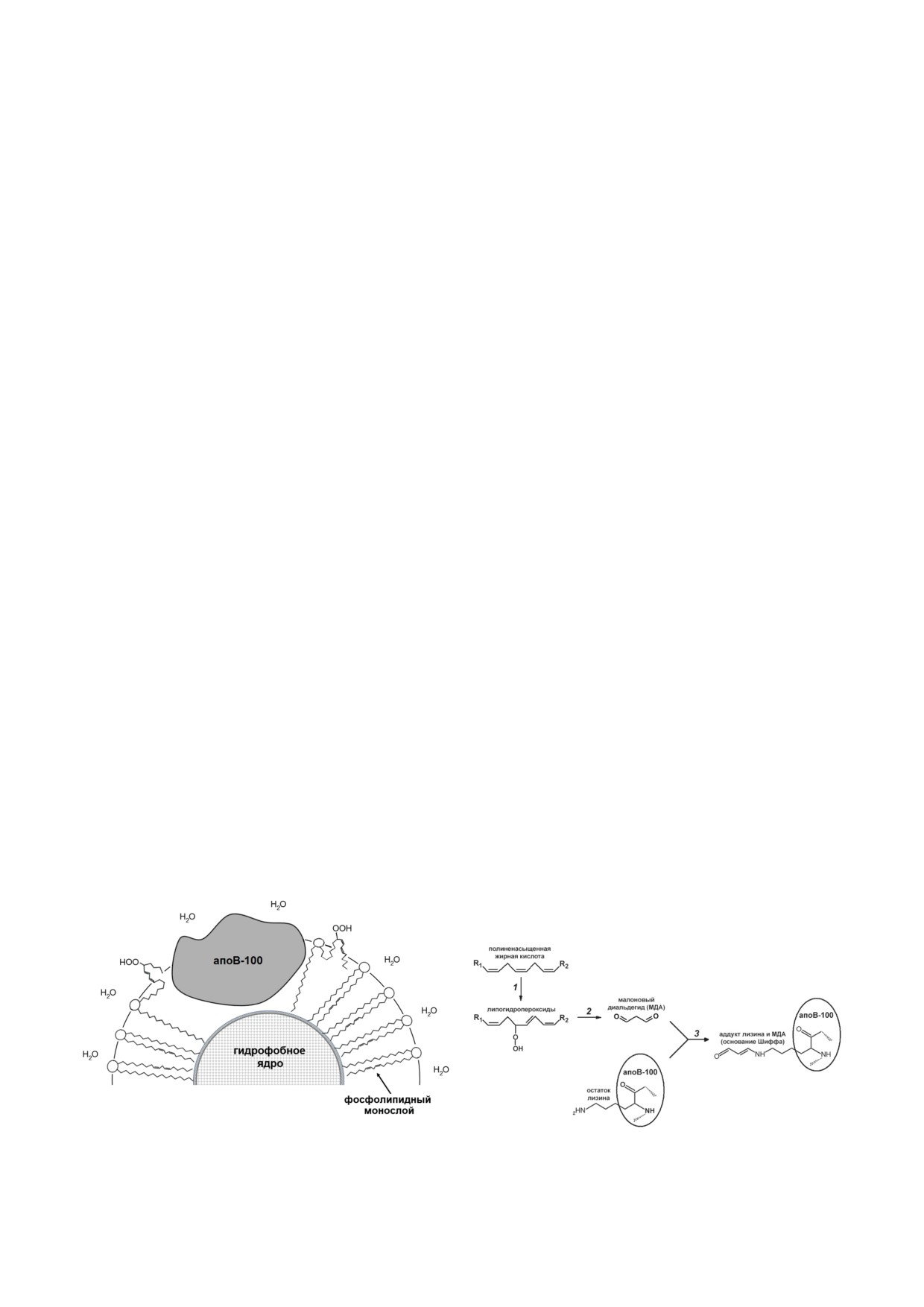
Рис. 1. Схема, иллюстрирующая возможность физиче-
ского изменения конформации апопротеина В-100 при
Рис. 2. Схема, иллюстрирующая образование первичных
образовании гидроперокси-производных ПНЖК-ацилов
и вторичных продуктов свободнорадикальной липопер-
в фосфолипидном монослое частиц ЛНП
оксидации ацилов ПНЖК в частицах ЛНП
БИОХИМИЯ том 88 вып. 11 2023
2316
ЛАНКИН и др.
шиффовых оснований)
[9, 15]. Представля-
ливания (NH4)2SO4 (55%), как описано ра-
ется вероятным, что именно такая химическая
нее [17], а затем последовательно очищена
модификация апоВ-100 изменяет рецепторные
до получения гомогенного белка (по данным
свойства частиц ЛНП, делая их более атеро-
SDS-электрофореза) с помощью ионообмен-
генными.
ной хроматографии на DEAE-Sephadex A50
Таким образом, основной целью настоя-
в линейном градиенте NaCl и препаратив-
щей работы было исследование патофизио-
ного изоэлектрического фокусирования [17].
логических особенностей действия окисленных
Препарат С-15 LOX из ретикулоцитов кролика
частиц ЛНП (содержащих первичные продук-
был очищен до гомогенного состояния в Ин-
ты окисления - гидроперокси-производные
ституте биохимии Университета им. А. Гум-
ПНЖК-ацилов фосфолипидного монослоя)
больдта (Берлин, Германия). Порции ЛНП
и МДА-модифицированных ЛНП (частиц ЛНП,
(0,5 мг белка/мл) окисляли при катализе
химически модифицированных вторичным
С-15 LOX при
37 °C в среде, содержащей
продуктом липопероксидации МДА). Учиты-
154 мМ NaCl и 20 мМ Tris-HCl (pH 7,4). По-
вая предполагаемую роль окислительно моди-
скольку С-15 LOX подвергается самоинактива-
фицированных ЛНП в атерогенезе, в работе
ции продуктом реакции (LOOH) [17], фер-
представлены сравнительные данные экспе-
мент добавляли трижды, контролируя окисле-
риментального исследования «атерогенности»
ние ЛНП по накоплению конъюгированных
(по захвату частиц ЛНП культивируемыми
диенов (LOOH) при 233 нм на спектрофото-
макрофагами) ферментативно окисленых и
метре UV-2600 Shimadzu («Shimadzu», Япония).
МДА-модифицированных ЛНП.
Для расчета концентрации LOOH исполь-
зовали коэффициент молярной экстинкции
25 000 М-1·см-1.
МАТЕРИАЛЫ И МЕТОДЫ
МДА-модифицированные ЛНП были по-
лучены путем обработки свежевыделенных
Изолирование ЛНП при помощи препара-
ЛНП приготовленным ex tempore МДА, кото-
тивного ультрацентрифугирования. ЛНП выде-
рый был получен из 1,1,3,3-тетраэтоксипро-
ляли из плазмы трех здоровых доноров, ко-
пана путем кислотного гидролиза [18]. Для
торую приобретали в ФГБУ «НМИЦ сердеч-
этого ЛНП (100 мкг апоВ-100) инкубировали
но-сосудистой хирургии им. А.Н. Бакулева».
с 1 мкмоль МДА в темноте при 37 °C (pH 6,5)
Кровь была взята натощак в присутствии
в течение 3 ч [18, 19]. Избыток МДА удаляли
1 мг/мл ЭДТА в качестве антикоагулянта и
диализом против 2000 объемов PBS (pH 7,4)
антиоксиданта. ЛНП выделяли при помощи
в течение 18 ч при 4 °C.
дифференциального ультрацентрифугирования
Исследование специфичности тест-набора
в градиенте плотности NaBr [16] с использова-
«Oxidized LDL ELISA». В нашем исследова-
нием ротора Ti50 на препаративной ультрацен-
нии мы использовали тест-набор «Oxidized
трифуге Optima XPN-80 («Beckman Coulter»,
LDL ELISA» фирмы «Mercodia», который ра-
США). Солевую суспензию ЛНП концентри-
нее успешно использовали в клинических ис-
ровали при помощи Sephadex G-100 Superfine
следованиях [20]. Тест-набор «Mercodia», как
(«GE Healthcare», США) и диализовали против
известно, содержит моноклональные анти-
2000 объемов 10 мМ K,Na-фосфатного буфера
тела mAb-4E6 к МДА-модифицированным
(pH 7,4) в течение 18 ч при 4 °C. Концентра-
ЛНП [20]. Образцы ЛНП, полученные от здо-
цию белка в препаратах ЛНП определяли по
ровых добровольцев, подвергали химической
методу Лоури, содержание апоВ-100 определя-
модификации различными дикарбонилами -
ли на химическом анализаторе Architect C8000
МДА (полученным, как описано выше), а так-
(«Abbot», США) при использовании реагентов
же глиоксалем и метилглиоксалем [21] (все ре-
той же фирмы.
агенты фирмы «Sigma-Aldrich», США), после
Выделение и очистка С-15 липоксигеназы
чего проводили количественное определение
ретикулоцитов кролика, ферментативное окис-
модифицированных ЛНП в диапазоне кон-
ление ЛНП и получение МДА-модифициро-
центраций 0-80 нг апоВ-100 в соответствии
ванных ЛНП. Экспериментальная анемия кро-
с инструкцией «Mercodia». Измерение погло-
ликов с последующим ретикулоцитозом была
щения проводили при 450 нм и температуре
вызвана ежедневным (в течение 4 дней) под-
25 °C с помощью планшетного спектрофото-
кожным введением гемолитика фенилгидрази-
метра BioTek EL808
(«BioTek Instruments»,
на (6,25 мг/кг). С-15 липоксигеназа (С-15 LOX)
США). Содержание модифицированных ЛНП
была выделена из лизата обогащенной рети-
в образцах рассчитывали по калибратору и
кулоцитами клеточной массы путем выса-
выражали в единицах на литр. Эффективность
БИОХИМИЯ том 88 вып. 11 2023
ЧТО ТАКОЕ «ОКИСЛЕННЫЕ» ЛИПОПРОТЕИДЫ?
2317
модификации аминокислотных остатков бел-
ление свежих порций фермента обеспечива-
ков (включая апоВ-100) дикарбонилами при
ло эффективное окисление ЛНП, поскольку
использованном нами методе проведения ре-
С-15 LOX подвергается инактивации накапли-
акции Майара, по литературным данным, со-
вающимися в ходе ферментативной реакции
ставляет не менее 80-90% [18, 22].
LOOH [17]. Накопление LOOH оценивали по
Исследование свободнорадикального Cu2+-
увеличению концентрации диеновых конъю-
инициированного окисления ЛНП и кинетики
гатов при 233 нм (ΔD233) [10] на спектрофото-
накопления первичных и вторичных продуктов.
метре UV-2600 Shimadzu.
После диализа пробы ЛНП разбавляли
Макрофаги были получены из крови здо-
до 50 мкг белка/мл раствором, содержащим
ровых людей в стерильных условиях. Моно-
154 мМ NaCl в 50 мМ K,Na-фосфатном буфе-
цитарно-лимфоцитарную фракцию выделяли
ре (рН 7,4), и окисление частиц инициирова-
в градиенте 9% фиколла/50% хипака, разве-
ли при 37 °C введением в среду инкубации
денных в сотношении
1 : 2,4
(«GE Health-
30 мкМ CuSO4, после чего через фиксирован-
care») [26]. Клетки подсчитывали в гемацито-
ные интервалы времени измеряли накопление
метре («Weber Scientific», США) и помещали
LOOH при 233 нм (ΔD233) на спектрофотомет-
в пластиковые стерильные планшеты для тка-
ре UV-2600 Shimadzu [10, 23, 24]. Одновремен-
невых культур («Nuclon», Дания) из расчета
но в параллельных пробах определяли содер-
5 × 105 клеток на лунку, после чего культиви-
жание TBARS (thiobarbituric acid reactive sub-
ровали в среде 199, содержащей 10% эмбрио-
stances) в нашей модификации, уровень кото-
нальной телячьей сыворотки («Flow», Вели-
рых при окислении ЛНП in vitro отражает пре-
кобритания), 2 мМ L-глутамина, 100 ед./мл
имущественно концентрацию МДА [25]. ЛНП
пенициллина,
100 ед./мл стрептомицина и
в образцах (1 мл) денатурировали добавлени-
2,5 мкг/мл фунгизона (все реактивы - «GIBCO»,
ем равного объема 10%-ной трихлоруксусной
США), в CO2-инкубаторе INNOVA
(«New
кислоты, и через 15 мин осадок седиментиро-
Brunswick Scientific», США) в атмосфере
вали при 2000 g в течение 30 мин в центрифуге
95% воздуха и 5% CO2 при 37 °C в течение
Sigma 3-16RL (Япония). К 1 объему суперна-
14 дней со сменой инкубационной среды каж-
танта в стеклянных контейнерах добавляли
дые 48 ч. После этого культуральную среду
2 объема 0,5%-ного водного раствора 2-тио-
заменяли на свежую среду 199, содержащую
барбитуровой кислоты («Sigma-Aldrich»), со-
10% липопротеин-дефицитной сыворотки кро-
держащей
0,5% бутилированного гидрокси-
ви человека (получали методом ультра-
толуола
(2,6-дитретбутил-4-метилфенол)BHT
центрифугирования при d > 1,215 г/мл [27]),
(«Sigma-Aldrich») в качестве антиоксиданта
2 мМ L-глутамина, 100 ед./мл пенициллина,
для предотвращения дальнейших окислитель-
100 ед./мл стрептомицина и 2,5 мкг/мл фун-
ных процессов. Контейнеры герметизировали
гизона, а затем добавляли исследуемые ЛНП.
завинчивающимися пластиковыми крышками
Через 7 ч инкубации в CO2-инкубаторе при
и нагревали в кипящей водяной бане в тече-
37 °C удаляли среду, содержащую ЛНП, и ли-
ние 20 мин. После охлаждения до комнатной
пиды из макрофагов трижды экстрагировали
температуры измеряли поглощение окрашен-
смесью гексан-изопропанол (3/2, v/v) [28]. Экс-
ного триметинового комплекса при
532 нм
тракт выпаривали под вакуумом и измеря-
против образцов, содержащих неокисленные
ли концентрацию общего холестерина с по-
ЛНП (ΔD532). Исследование кинетики медь-
мощью тест-набора фирмы
«Boehringer-
зависимого свободнорадикального окисления
Mannheim GmbH» (Германия) на химическом
липопротеидов по образованию LOOH и
анализаторе Multiscan MCC («Labsystems Oy»,
TBARS in vitro проводили, используя частицы,
Финляндия) при 492 нм.
изолированные из плазмы крови трех доноров
Статистический анализ результатов иссле-
(липопротеиды, выделенные из плазмы крови
дования. Статистический анализ результатов
каждого донора, использовали в независимых
исследования проводили с помощью пакетов
экспериментах).
программного обеспечения STATISTICA
10
Исследование «атерогенности» окисленных
(«Statsoft», США), MedCalc version
12.7.0.0
и МДА-модифицированных ЛНП по тесту по-
(«MedCalc Software», Бельгия) и Microsoft
глощения их культивируемыми макрофагами.
Excel 2010, версия 14.0.7263.5000, представляя
ЛНП окисляли ферментативно при 37 °C пу-
данные как среднее ± ошибка среднего. По-
тем трехкратного добавления по 1 ед./мл гомо-
скольку анализ данных показал, что распре-
генного препарата C-15 LOX в среду, содер-
деление признаков во всех случаях отличается
жащую 0,5 мг/мл белка ЛНП, 154 мМ NaCl
от нормального, для статистического анализа
и 20 мМ Tris-HCl (pH 7,4). Трехкратное добав-
применяли непараметрические методы ста-
БИОХИМИЯ том 88 вып. 11 2023
2318
ЛАНКИН и др.
тистики. Анализ различий количественных
модифицированным ЛНП [20]. Реакция, вы-
показателей при межгрупповых сравнениях
являемая с нативными ЛНП, несомненно,
выполняли с помощью непараметрическо-
отражает присутствие в исследуемых препара-
го критерия Манна-Уитни (Mann-Whitney
тах ЛНП некоторого количества образованных
U-test). Различия считали статистически зна-
in vivo МДА-модифицированных ЛНП. Тот
чимыми при р < 0,05.
факт, что глиоксаль-модифицированные ЛНП
и метилглиоксаль-модифицированные ЛНП
дают такую же реакцию, как и нативные ЛНП,
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
свидетельствует о том, что модификации
ЛНП, вызываемые этими дикарбонилами, не
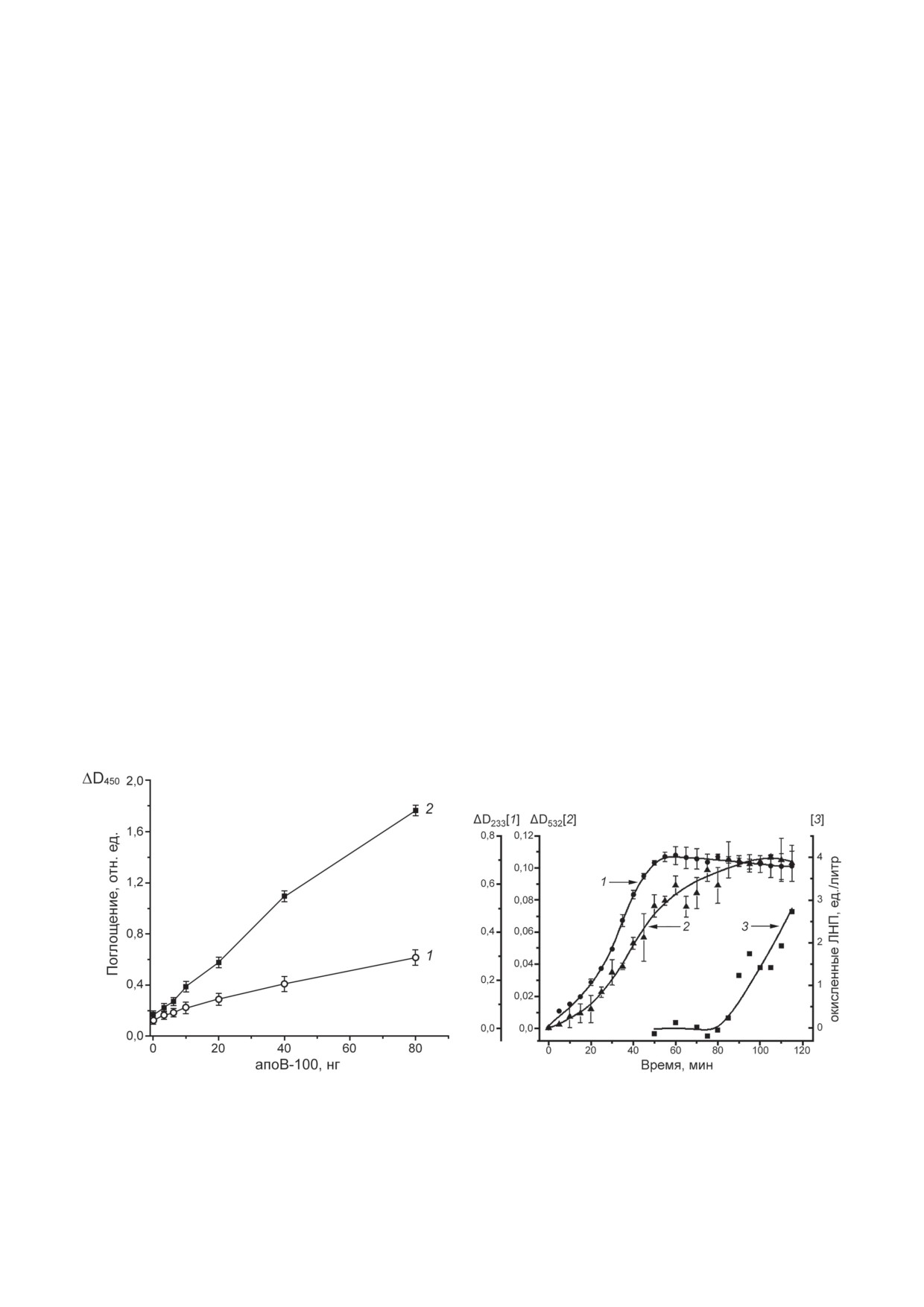
На рис. 3 представлены результаты иссле-
влияют на определение МДА-модифициро-
дования специфичности тест-набора
«Oxi-
ванных ЛНП тест-набором фирмы «Mercodia».
dized LDL ELISA» при определении различных
Следовательно, дикарбонил-модифицирован-
дикарбонил-модифицированных ЛНП.
ные ЛНП, отличные от МДА-модифицирован-
Поскольку было установлено, что данные
ных ЛНП, не являются антигенами для моно-
определения нативных (неокисленных) ЛНП,
клональных антител mAb-4E6. Таким образом,
глиоксаль-модифицированных ЛНП и ме-
тест-набор «Oxidized LDL ELISA» («Mercodia»)
тилглиоксаль-модифицированных ЛНП при
может быть использован для определения
всех исследованных концентрациях апоВ-100
МДА-модифицированных ЛНП in vitro и
достоверно не отличаются, полученные ре-
in vivo, поскольку модификации ЛНП други-
зультаты были использованы для построения
ми дикарбонилами не мешают определению
суммарной кривой (рис. 3, кривая 1). Данные
МДА-модифицированных ЛНП. Исходя из
определения МДА-модифицированных ЛНП
этого, мы неоднократно использовали тест-
представлены на рис. 3, кривая 2. При концен-
наборы фирмы «Mercodia» в наших клиниче-
трации 80 нг/мл апоВ-100 уровень выявлен-
ских исследованиях для определения уровня
ных МДА-модифицированных ЛНП состав-
МДА-модифицированных ЛНП в крови паци-
лял 74,2%, а суммарный уровень нативных и
ентов [29, 30].
других дикарбонил-модифицированных ЛНП
Полученные данные позволили использо-
составлял 25,8% (рис. 3, кривые 1 и 2). Таким
вать тест-набор фирмы «Mercodia» для опреде-
образом, при помощи тест-набора фирмы
ления содержания МДА-модифицированных
«Mercodia» определяются преимущественно
ЛНП в модельных экспериментах по Cu2+-
МДА-модифицированные ЛНП, что не уди-
инициируемому свободнорадикальному окис-
вительно, поскольку этот тест-набор содержит
лению ЛНП. Результаты этих экспериментов
моноклональные антитела mAb-4E6 к МДА-
представлены на рис. 4.
В соответствии со схемой свободно-
радикального окисления ЛНП (рис. 2) после
Рис. 3. Специфичность определения различных дикар-
Рис. 4. Кинетика накопления первичных продуктов
бонил-модифицированных ЛНП с использованием тест-
Cu2+-инициированного свободнорадикального окис-
набора «Oxidized LDL ELISA»: кривая 1 - суммарные
ления ЛНП - липогидропероксидов, ΔD233 (кривая 1);
данные определения неокисленных (нативных) ЛНП,
вторичных продуктов окисления - МДА, ΔD532 (кри-
глиоксаль-модифицированных ЛНП и метилглиоксаль-
вая 2) и определенных с помощью тест-набора фирмы
модифицированных ЛНП; кривая 2 - данные определе-
«Mercodia», в соответствии с нашими данными (см. в тек-
ния МДА-модифицированных ЛНП
сте статьи), МДА-модифицированных ЛНП (кривая 3)
БИОХИМИЯ том 88 вып. 11 2023
ЧТО ТАКОЕ «ОКИСЛЕННЫЕ» ЛИПОПРОТЕИДЫ?
2319
инициации окисления ионами Cu2+ начинают
окисления ЛНП, катализируемого С-15 LOX.
накапливаться первичные продукты (рис. 2,
Эта липоксигеназа животных (в отличие от
реакция 1) - LOOH-содержащие ЛНП (рис. 4,
растительной С-15 липоксигеназы соевых
кривая 1), а затем, с некоторым опозданием
бобов) способна окислять не только свобод-
(период индукции), - вторичные продукты
ные ПНЖК, но и полиеновые ацилы фосфо-
(рис. 2, реакция 2), определяемые по реак-
липидов биомембран и наружного фосфоли-
ции с 2-тиобарбитуровой кислотой (TBARS),
пидного слоя частиц ЛНП [35]. В проведенных
которые в модельной системе, в отличие от
нами экспериментах использовали три вида
условий in vivo, представлены практически
ЛНП - нативные (неокисленные), LOOH-со-
исключительно МДА (рис. 4, кривая 2) [25].
держащие ЛНП (ферментативно окисленные
Для образования МДА-модифицированных
при катализе С-15 LOX) и МДА-модифициро-
ЛНП (рис. 2, реакция 3) в условиях экспери-
ванные ЛНП. Следует отметить, что нативные
мента требуется более значительное время, что
ЛНП содержали следовое количество LOOH
отражает кривая 3 на рис. 4. Таким образом,
(не более 0,2 нмоль на мг белка ЛНП), тогда
при Cu2+-инициированном свободнорадикаль-
как уровень LOOH в ферментативно окис-
ном окислении ЛНП уже через 1 ч инкубации
ленных ЛНП возрос почти до 48 нмоль на мг
в системе должны присутствовать как LOOH-
белка ЛНП. При этом уровень LOOH в МДА-
содержащие ЛНП (истинно окисленные ЛНП),
модифицированных ЛНП практически не от-
так и МДА-модифицированные ЛНП в не-
личался от такового в неокисленных ЛНП. Все
предсказуемой пропорции (вследствие раз-
полученные модификации ЛНП инкубирова-
личий в липидном составе ЛНП и варьиро-
ли с культивируемыми макрофагами человека
вания условий окисления). Рис. 4 наглядно
в течение 7 ч, после чего определяли захват
демонстрирует различия в кинетике образо-
частиц ЛНП клетками по накоплению холе-
вания окисленных (LOOH-ЛНП) и МДА-мо-
стерина. Результаты исследования представ-
дифицированных ЛНП, причем эти данные
лены на рис. 5.
показывают, что определение
«окисленные
Как видно из представленных данных,
ЛНП» неприменимо к частицам ЛНП, под-
эффективность захвата макрофагами фермен-
вергнутых многочасовому окислению в мо-
тативно окисленных ЛНП (рис. 5, столбик 2)
дельной системе. Очевидно, что в этих усло-
практически не отличалась от захвата ма-
виях можно получить не так называемые
крофагами неокисленных (нативных) ЛНП
«окисленные ЛНП», а смесь истинно окислен-
(рис. 5, столбик 1). В то же время эффектив-
ных (LOOH-содержащих) ЛНП и МДА-моди-
ность захвата макрофагами МДА-модифици-
фицированных ЛНП (рис. 4). Тем не менее в
рованных ЛНП (рис. 5, столбик 3) возрастала
подавляющем большинстве различных экспе-
более чем в 4 раза по сравнению с нативными
риментов используют именно такие «окислен-
ные ЛНП», полученные при Cu2+-иницииро-
ванном свободнорадикальном окислении или
спонтанном окислении частиц ЛНП в течение
3-24 ч [8, 9, 31-34], что не позволяет коррект-
но интерпретировать получаемые результаты.
В связи с этим нам представлялось крайне
важным установить различия в патофизиоло-
гическом действии LOOH-содержащих ЛНП
и МДА-модифицированных ЛНП.
Очевидно, что все способы инициации
свободнорадикального окисления ЛНП (с ис-
пользованием металлов переменной валент-
ности, ферментных генераторов супероксид-
ного радикала, пероксида водорода и орга-
нических гидропероксидов, азоинициаторов
и т.д. [8]) приводят к одновременному обра-
зованию не только LOOH-содержащих ЛНП,
но и МДА-модифицированных ЛНП (рис. 4).
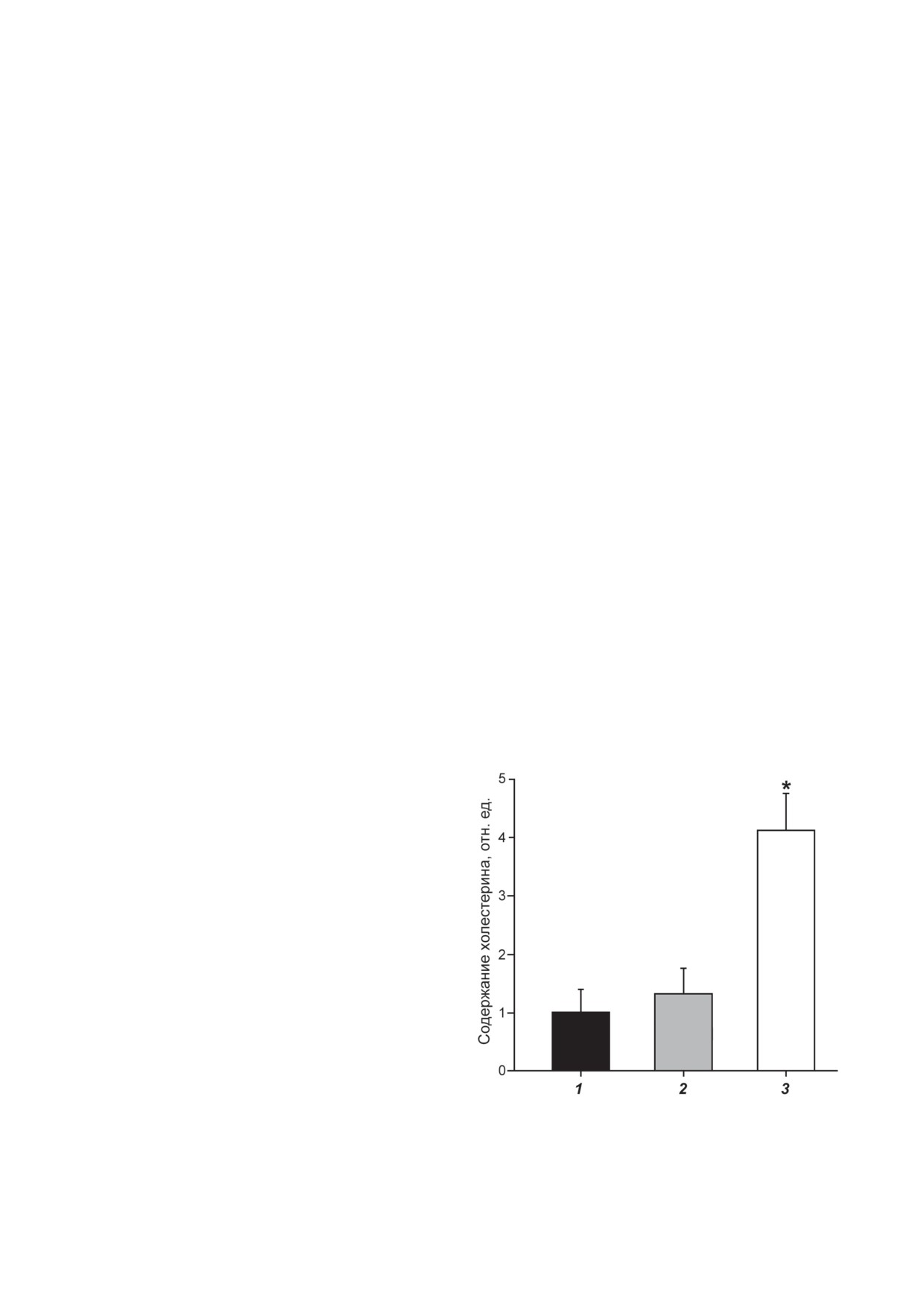
Рис. 5. Захват модифицированных частиц ЛНП культи-
Мы использовали единственно возможный
вируемыми макрофагами: 1 - нативные (неокисленные)
способ накопления исключительно LOOH в
ЛНП; 2 - LOOH-содержащие ЛНП (окисленные живот-
ЛНП (без примеси МДА-модифицирован-
ной С-15 липоксигеназой); 3 - МДА-модифицирован-
ных ЛНП) при помощи ферментативного
ные ЛНП (* р < 0,05)
БИОХИМИЯ том 88 вып. 11 2023
2320
ЛАНКИН и др.
белков в кровяном русле, включая апопротеин
В-100 частиц ЛНП и молекулы антиоксидант-
ных ферментов, таких как супероксиддисму-
таза (СОД), глутатионпероксидаза и др. [7, 38,
39]. Вследствие этого природные дикарбони-
лы являются мощными ингибиторами актив-
ности антиоксидантных ферментов, включая
СОД, глутатионпероксидазу и пероксиредок-
сины [39-41]. В связи с этим неудивительно,
что у больных атеросклерозом и сахарным диа-
бетом отмечается значительное снижение ак-
тивности антиоксидантных ферментов в клет-
ках крови [6-8,40]. Очевидно, что подавление
активности антиоксидантных ферментов при
накоплении дикарбонилов способствует уси-
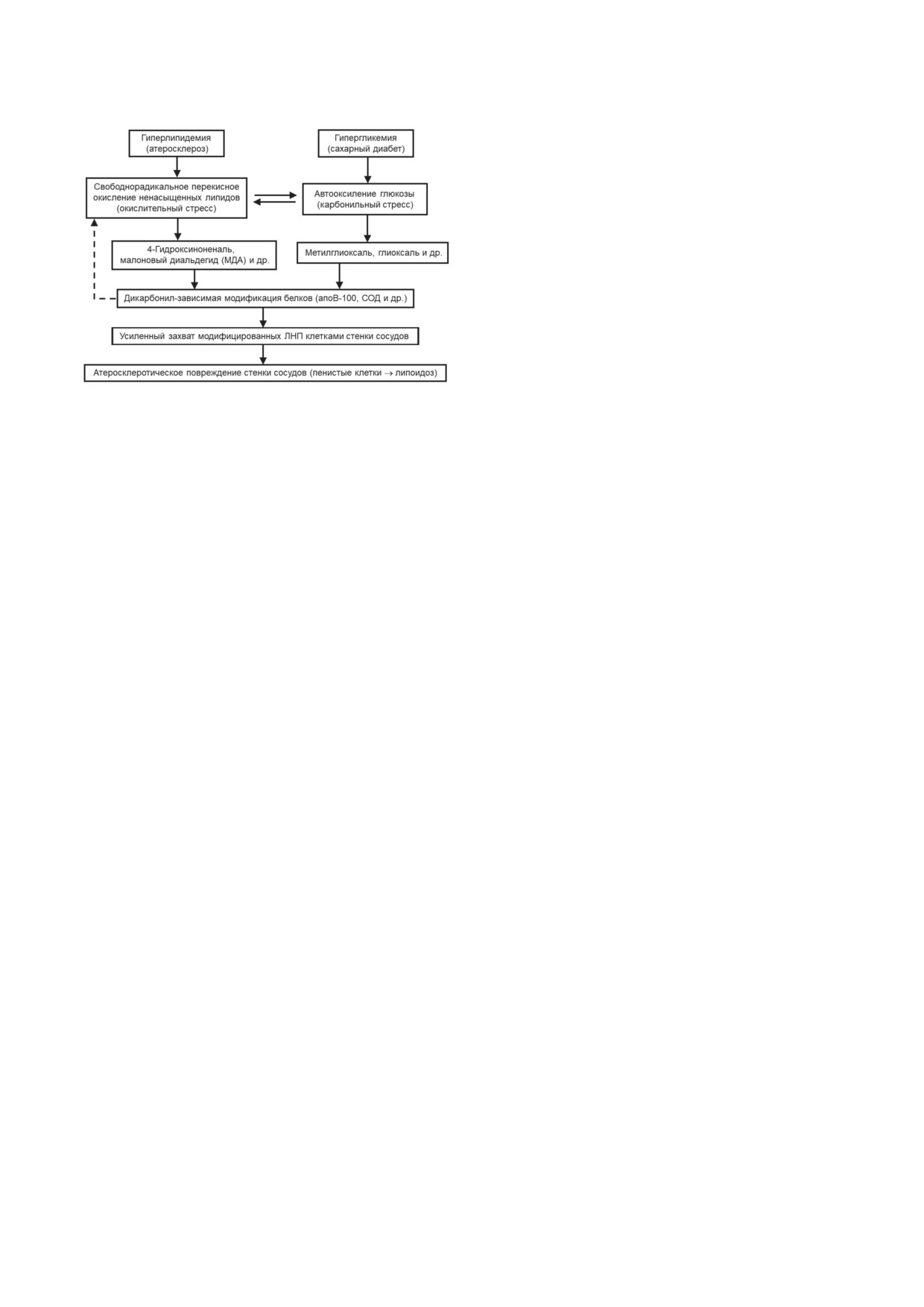
Рис. 6. Схема, иллюстрирующая роль дикарбонил-моди-
фицированных ЛНП в молекулярных механизмах пов-
лению окислительного стресса (рис. 6, пунк-
реждения стенки сосудов при атеросклерозе и сахарном
тирная линия). Окислительная модификация
диабете (пояснения в тексте)
ЛНП индуцирует образование обогащенных
липидами «пенистых клеток» [42], что способ-
ЛНП (рис. 5, столбик 1). Таким образом, по-
ствует возникновению липидных кластеров
лученные результаты свидетельствуют о том,
(зон липоидозов) в стенке сосудов, которые
что макрофаги преимущественно захватыва-
считаются первичными предатеросклеротиче-
ют не окисленные (LOOH-содержащие ЛНП),
скими поражениями [1-3, 6-8] (рис. 6). По-
а МДА-модифицированные ЛНП (рис. 5).
казательно, что электронегативная фракция
Можно полагать, что модификация ЛНП и
ЛНП, содержание LOOH в которой, как пра-
другими природными дикарбонилами также
вило, не увеличено (sic!), также является эф-
будет способствовать захвату ЛНП макрофага-
фективным индуктором образования «пени-
ми. Так, глиоксаль-модифицированные ЛНП
стых клеток» [43, 44]. Создается впечатление,
весьма эффективно захватываются культиви-
что электронегативная фракция ЛНП мо-
руемыми макрофагами [36, 37]. Исследование
жет быть идентична дикарбонил-модифициро-
захвата ЛНП культивируемыми макрофага-
ванным ЛНП (рис. 5, столбик 3). Как бы то
ми позволяет выявить «атерогенные» фрак-
ни было, частицы ЛНП, образованные in vivo
ции ЛНП, поскольку имитирует в модельных
и не содержащие значительных количеств
условиях процесс образования обогащенных
LOOH [43, 44] (не являющиеся истинно окис-
липидами «пенистых клеток» на ранних стади-
ленными, исходя из предлагаемой нами тер-
ях атерогенеза (формирование липоидозных
минологии), проявляют «атерогенность», сопо-
повреждений стенки сосудов) [6-8].
ставимую с МДА-модифицированными ЛНП
Исходя из того, что и дикарбонилы, накап-
(сравни рис. 5 и данные работ Yu et al. [43] и
ливающиеся при окислительном стрессе (та-
Estruch et al. [44]). К вышесказанному важно
кие как МДА), и структурные аналоги МДА,
добавить, что признанием ведущей роли ди-
образующиеся при карбонильном стрессе (та-
карбонил-модифицированных ЛНП в атеро-
кие как глиоксаль и метилглиоксаль), вызы-
генезе [6-8] можно логично объяснить су-
вают атерогенную модификацию ЛНП, нами
ществующую тесную связь атеросклероза с
были сформулированы представления о еди-
сахарным диабетом. Действительно, такие ши-
ном молекулярном механизме повреждения
роко известные факты, как увеличение рис-
стенки сосудов при атеросклерозе и сахарном
ка возникновения атеросклероза и быстрое
диабете [7, 8, 24]. Основные положения этой
прогрессирование атеросклероза при нали-
гипотезы представлены на рис. 6.
чии диабета, легко объяснимы существо-
Приведенная схема (рис. 6) показывает,
ванием единого молекулярного механизма
что образование как вторичных альдегидных
повреждения стенки сосудов дикарбонил-
продуктов липопероксидации при окисли-
модифицированными ЛНП, накапливающи-
тельном стрессе в процессе атерогенеза, так и
мися при окислительном или карбонильном
генерирование низкомолекулярных дикарбо-
стрессе (см. выше).
нилов при ферментативном окислении трио-
Лектин-подобный рецептор-1 для окис-
зофосфатов и автоокислении глюкозы при
ленных ЛНП (LOX-1) способствует развитию
карбонильном стрессе в конечном итоге при-
эндотелиальной дисфункции, вызывая про-
водит к химической модификации различных
атерогенную сигнализацию и формирование
БИОХИМИЯ том 88 вып. 11 2023
ЧТО ТАКОЕ «ОКИСЛЕННЫЕ» ЛИПОПРОТЕИДЫ?
2321
атероматозных бляшек путем поглощения эн-
указывать, с какими именно - LOOH-содер-
дотелием окисленных и электронегативных
жащими ЛНП, МДА-модифицированными
ЛНП [45-48]. Это приводит к инициации,
ЛНП или их смесью неустановленного соста-
прогрессированию и дестабилизации атеро-
ва - проводили данное исследование. Без со-
склеротических бляшек, что в конечном итоге
общения этих сведений интерпретация резуль-
провоцирует развитие инфаркта миокарда и
татов представляется затруднительной; более
некоторых форм инсульта [45-48]. Scavenger-
того, как следует из приведенных в нашей
рецептор LOX-1 является одним из наиболее
работе данных о мощных эффектах дикарбо-
важных рецепторов для окисленных ЛНП,
нил-модифицированных ЛНП, большая часть
активация которого вызывает увеличение
результатов, полученных с применением так
активности NADPH-оксидазы и генериро-
называемых «окисленных ЛНП», может быть
вания активных форм кислорода (АФК), что
объяснена присутствием в используемых пре-
активирует сигнальные пути, приводящие к
паратах ЛНП частиц с карбонильной модифи-
экспрессии провоспалительных цитокинов и
кацией.
прогрессированию атеросклероза [49]. Ранее
было показано, что «окисленные» ЛНП вызы-
вают интенсивное генерирование супероксид-
ЗАКЛЮЧЕНИЕ
ного анион-радикала в культуре эндотелиоци-
тов [31], что, несомненно, вызвано после-
Липопротеиды низкой плотности плазмы
довательной индукцией LOX-1 и NADPH-
крови представляют собой надмолекулярные
оксидазы. Согласно полученным нами пред-
липид-белковые комплексы (наночастицы) ли-
варительным данным, не
«окисленные», а
пид-транспортирующей системы организма.
дикарбонил-модифицированные ЛНП вызы-
Они легко подвергаются свободнорадикаль-
вают экспрессию LOX-1 и NADPH-оксидазы
ному окислению с образованием модифициро-
в культивируемых эндотелиоцитах пупочной
ванных форм, из которых важнейшими явля-
вены человека [50], причем МДА-модифици-
ются: истинно окисленные ЛНП (содержащие
рованные ЛНП обладают намного большим
гидроперокси-ацилы в фосфолипидах наруж-
эффектом, чем глиоксаль- и метилглиоксаль-
ного слоя частиц) и дикарбонил-модифициро-
модифицированные ЛНП [50]. Таким образом,
ванные ЛНП (апопротеин В-100 которых под-
нами получено еще одно убедительное дока-
вергся химической модификации по реакции
зательство того, что биологические эффекты
Майара). Изучение кинетики Cu2+-иницииро-
при свободнорадикальном окислении ЛНП
ванного свободнорадикального окисления ЛНП
вызваны не накоплением LOOH, а образова-
свидетельствует о том, что существующее в ли-
нием дикарбонил-модифицированных ЛНП.
тературе обозначение «окисленные ЛНП» не-
Следует отметить, что предлагаемый нами
корректно, поскольку не раскрывает природы
подход позволяет установить отличия в дей-
окислительной модификации ЛНП. Показано,
ствии отдельных дикарбонилов [21, 37], что
что «атерогенными» ЛНП (частицы которых
представляется немаловажным для выяснения
активно захватываются макрофагами) явля-
молекулярных механизмов атерогенеза и дис-
ются не собственно окисленные ЛНП (содер-
функции эндотелия. Кроме того, полученные
жащие LOOH-производные фосфолипидов),
нами данные ориентируют исследователей на
а ЛНП с химически модифицированным
разработку принципиально новых медикамен-
апоВ-100, образующиеся при взаимодействии
тозных средств для фармакотерапии атеро-
концевых NH2-групп белка с альдегидными
склеротических повреждений стенки сосудов,
группами (реакция Майара) природных ди-
направленных на детоксикацию и утилизацию
карбонилов (МДА-модифицированные ЛНП
накапливающихся при окислительном и кар-
и др.). Высказана гипотеза о важной роли ди-
бонильном стрессе природных дикарбонилов.
карбонил-модифицированных ЛНП в молеку-
В частности, перспективным представляется
лярных механизмах атерогенеза и дисфункции
синтез и проверка фармакологической актив-
эндотелия, на основании которой предлагают-
ности соединений, способных быть эффек-
ся новые подходы к разработке фармакотера-
тивными scavenger’ами дикарбонилов, таких
пии атеросклероза и сахарного диабета.
как соединения из класса производных гид-
розина [51, 52]. Следовательно, употребление
Вклад авторов. Ланкин В.З. - руководство
термина «окисленные ЛНП» является некор-
работой, написание статьи, обсуждение резуль-
ректным, причем при использовании в экс-
татов; Тихазе А.К. - написание и редактирова-
периментах частиц ЛНП, подвергнутых сво-
ние статьи; Коновалова Г.Г. - проведение экс-
боднорадикальному окислению, необходимо
периментов, техническая подготовка статьи.
19
БИОХИМИЯ том 88 вып. 11 2023
2322
ЛАНКИН и др.
Финансирование. Работа выполнена при
Конфликт интересов. Авторы заявляют об
финансовой поддержке Российского научного
отсутствии конфликта интересов.
фонда (грант № 22-15-00013).
Соблюдение этических норм. Настоящая
Благодарности. Авторы признательны
статья не содержит результатов выполненных
К.Б. Шумаеву за помощь в изготовлении ри-
авторами исследований с участием людей или
сунков.
использованием животных в качестве объектов.
СПИСОК ЛИТЕРАТУРЫ
1.
Steinbrecher, U. P., Parthasarathy, S., Leake, D. S.,
11.
Milne, G. L., Seal, J. R., Havrilla, C. M.,
Witztum, J. L., and Steinberg, D. (1984) Modification
Wijtmans, M., and Porter, N. A. (2005) Identification
of low density lipoprotein by cells involves lipid
and analysis of products formed from phospholipids
peroxidation and degradation low density lipoprotein
in the free radical oxidation of human low density
phospholipids, Proc. Natl. Acad. Sci. USA, 81, 3883-
lipoproteins, J. Lipid Res., 46, 307-319, doi: 10.1194/
3887, doi: 10.1073/pnas.81.12.3883.
jlr.M400311-JLR200.
2.
Steinberg, D., Parthasarathy, S., Carew, T. E., Khoo,
12.
Noguchi, N., Numano, R., Kaneda, H., and
J. C., and Witztum, J. L. (1989) Beyond cholesterol.
Niki, E. (1998) Oxidation of lipids in low density
Modification of low density lipoprotein that increase
lipoprotein particles, Free Radic. Res., 29, 43-52,
its atherogenicity, New Engl. J. Med., 320, 915-924,
doi: 10.1080/10715769800300061.
doi: 10.1056/NEJM198904063201407.
13.
Эмануэль Н. М., Денисов Е. Т., Майзус З. К. (1965)
3.
Kita, T., Ishii, K., Yokode, M., Kume, N., Nagano, Y.,
Цепные реакции окисления углеводородов в жидкой
Arai, H., and Kawai, C. (1990) The role of oxidized
фазе, Наука, Москва, с. 375.
low density lipoprotein in the pathogenesis of ath-
14.
Lankin, V. Z., Tikhaze, A. K., and Osis, Yu. G.
erosclerosis, Eur. Heart J., 11, 122-127, doi: 10.1093/
(2002) Modeling the cascade of enzymatic reactions
eurheartj/11.suppl_e.122.
in liposomes including successive free radical perox-
4.
Witztum, J. L., and Steinberg, D. (1991) Role of oxi-
idation, reduction, and hydrolysis of phospholipid
dized low-density lipoprotein in atherogenesis, J. Clin.
polyenoic acyls for studying the effect of these pro-
Invest., 88, 1785-1792, doi: 10.1172/JCI115499.
cesses on the structuraldynamic parameters of the
5.
Yla-Herttuala, S. (1994) Role of lipid and lipoprotein
membranes, Biochemistry (Moscow),
67,
566-574,
oxidation in the pathogenesis of atherosclerosis, Drugs
doi: 10.1023/a:1015502429453.
Today, 30, 507-514.
15.
Estévez, M., Padilla, P., Carvalho, L., Martín, L.,
6.
Lankin, V. Z., and Tikhaze, A. K. (2003) Atheroscle-
Carrapiso, A., and Delgado, J. (2019) Malondialde-
rosis as a free radical pathology and antioxidative ther-
hyde interferes with the formation and detection of pri-
apy of this disease, in: Free radicals, NO and Inflam-
mary carbonyls in oxidized proteins, Redox Biol., 26,
mation, IOS Press, Amsterdam, 344, pp. 218-231.
101277, doi: 10.1016/j.redox.2019.101277.
7.
Lankin, V. Z., and Tikhaze, A. K. (2017) Role of ox-
16.
Tertov, V. V., Kaplun, V. V., Dvoryantsev, S. N., and
idative stress in the genesis of atherosclerosis and di-
Orekhov, A. N. (1995) Apolipoprotein B-bound lipids
abetes mellitus: a personal look back on 50 years of
as a marker for evaluation of low density lipoprotein
research, Curr. Aging Sci., 10, 18-25, doi: 10.2174/
oxidation in vivo, Biochem. Biophys. Res. Commun.,
1874609809666160926142640.
214, 608-613, doi: 10.1006/bbrc.1995.2329.
8.
Lankin, V. Z., Tikhaze, A. K., and Melkumyants,
17.
Schewe, T., Wiesncr, R., and Rapoport, S. M. (1981)
A. M. (2022) Dicarbonyl-dependent modification of
Lipoxygenase from rabbit reticulocytes, Methods Enzy-
LDL as a key factor of endothelial dysfunction and
mol., 71, 430-441, doi: 10.1016/0076-6879(81)71054-1.
atherosclerotic vascular wall damage, Antioxidants,
18.
Requena, J. R., Fu, M. X., Ahmed, M. U., Jenkins,
11, 1565, doi: 10.3390/antiox11081565.
A. J., Lyons, T. J., Baynes, J. W., and Thorpe, S. R.
9.
Lankin, V. Z., Tikhaze, A. K., and Melkumyants,
(1997) Quantification of malondialdehyde and 4-hy-
A. M. (2023) Malondialdehyde as an important key
droxynonenal adducts to lysine residues in native and
factor of molecular mechanisms of vascular wall
oxidized human low-density lipoprotein, Biochem. J.,
damage under heart diseases development, Int. J. Mol.
322, 317-325, doi: 10.1042/bj3220317.
Sci., 24, 128, doi: 10.3390/ijms24010128.
19.
Fogelman, A. M., Shechter, I., Seager, J., Hokom, M.,
10.
Lankin, V. Z., Tikhaze, A. K., and Kosach, V. Ya.
Child, J. S., and Edwards, P. A. (1980) Malondialde-
(2022) Comparative susceptibility to oxidation of
hyde alteration of low density lipoproteins leads to cho-
different classes of blood plasma lipoproteins, Bio-
lesteryl ester accumulation in human monocyte-mac-
chemistry (Moscow),
87,
1335-1341, doi:
10.1134/
rophages, Proc. Natl. Acad. Sci. USA, 77, 2214-2218,
S0006297922110128.
doi: 10.1073/pnas.77.4.2214.
БИОХИМИЯ том 88 вып. 11 2023
ЧТО ТАКОЕ «ОКИСЛЕННЫЕ» ЛИПОПРОТЕИДЫ?
2323
20.
Sigurdardottir, V., Fagerberg, B., and Hulthe, J.
Malondialdehyde - modified low-density lipoproteins
(2002) Circulating oxidized low-density lipoprotein
as biomarker for atherosclerosis, Blood Press, 19,
(LDL) is associated with risk factors of the metabolic
164-168, doi: 10.3109/08037051.2010.484158.
syndrome and LDL size in clinically healthy 58 year
31.
Galle, J., Schneider, R., Heinloth, A., Wanner, C.,
old men (AIR Study), J. Int. Med., 252, 440-447,
Galle, P. R., Conzelmann, E., Dimmeler, S., and
doi: 10.1046/j.1365-2796.2002.01054.x.
Heermeier, K. (1999) Lp(a) and LDL induce apoptosis
21.
Lankin, V. Z., Konovalova, G. G., Domogatsky, S. P.,
in human endothelial cells and in rabbit aorta:
Tikhaze, A. K., Klots, I. N., and Ezhov, M. V. (2023)
role of oxidative stress, Kidney Int., 55, 1450-1461,
Clearance and utilization of dicarbonyl-modified LDL
doi: 10.1046/j.1523-1755.1999.00351.x.
in monkeys and humans, Int. J. Mol. Sci., 24, 10471,
32.
Zhao, R., Ma, X., Xie, X., and Shen, G. X. (2009)
doi: 10.3390/ijms241310471.
Involvement of NADPH oxidase in oxidized LDL-
22.
Schalkwijk, C. G., Vermeer, M. A., Stehouwer, C. D.,
induced upregulation of heat shock factor-1 and
te Koppele, J., Princen, H. M., and van Hinsbergh,
plasminogen activator inhibitor-1 in vascular endo-
V. W. (1998) Effect of methylglyoxal on the physico-
thelial cells, Am. J. Physiol. Endocrinol. Metab., 297,
chemical and biological properties of low-density
E104-E111, doi: 10.1152/ajpendo.91023.2008.
lipoprotein, Biochim. Biophys. Acta, 1394, 187-198,
33.
Furman, C., Martin-Nizard, F., Fruchart, J. C.,
doi: 10.1016/s0005-2760(98)00112-x.
Duriez, P., and Teissier, E. (1999) Differential tox-
23.
Patel, R. P., and Darley-Usmar, V. (1999) Molecular
icities of air (mO-LDL) or copper-oxidized LDLs
mechanisms of the copper dependent oxidation of
(Cu-LDL) toward endothelial cells, J. Biochem.
low-density lipoprotein, Free Radic. Res., 30, 1-9,
Mol. Toxicol., 13, 316-323, doi: 10.1002/(sici)1099-
doi: 10.1080/10715769900300011.
0461(1999)13:6<316::aid-jbt5>3.0.co;2-o.
24.
Lankin, V. Z., Konovalova, G. G., Tikhaze, A. K.,
34.
Sangle, G. V., Zhao, R., and Shen, G. X. (2008)
Shumaev, K. B., Kumskova, E. M., and Viigimaa, M.
Transmembrane signaling pathway mediates oxi-
(2014) The initiation of the free radical peroxidation of
dized low-density lipoprotein-induced expression of
low-density lipoproteins by glucose and its metabolite
plasminogen activator inhibitor-1 in vascular endo-
methylglyoxal: a common molecular mechanism of
thelial cells, Am. J. Physiol. Endocrinol. Metab., 295,
vascular wall injures in atherosclerosis and diabetes,
E1243-E1254, doi: 10.1152/ajpendo.90415.2008.
Mol. Cell. Biochem., 395, 241-252, doi: 10.1007/
35.
Lankin, V. Z., Antonovsky, V. L., and Tikhaze, A. K.
s11010-014-2131-2.
(2004) Regulation of free radical lipoperoxidation and
25.
Caldiroli, A., Auxilia, A. M., Capuzzi, E., Clerici, M.,
organic peroxides metabolism during normal station
and Buoli, M. (2020) Malondialdehyde and bipolar
and pathologies, in Peroxides at the Beginning of the
disorder: A short comprehensive review of available
Third Millennium: Synthesis, Properties, Application,
literature, J. Affect Disord., 274, 31-37, doi: 10.1016/
Nova Science Publishers, Inc., NY, pp. 85-111.
j.jad.2020.05.001.
36.
Lankin, V. Z., Tikhaze, A. K., Kapel’ko, V. I.,
26.
Bilenko, M. V., Khil’chenko, A. V., Konovalova,
Shepel’kova, G. S., Shumaev, K. B., Panasenko, O. M.,
G. G., and Lankin, V. Z. (2003) Effect of antioxidant
Konovalova, G. G., and Belenkov, Y. N.
(2007)
probucol on cell-mediated LDL oxidation in vitro
Mechanisms of oxidative modification of low density
and in vivo, Bull. Exp. Biol. Med., 136, 126-128,
lipoproteins under conditions of oxidative and car-
doi: 10.1023/a:1026398319379.
bonyl stress, Biochemistry (Moscow), 72, 1081-1090,
27.
Tertov, V. V., Sobenin, I. A., Gabbasov, Z. A.,
doi: 10.1134/S0006297907100069.
Popov, E. G., Jaakkola, O., Solakivi, T., Nikkari,
37.
Lankin, V. Z., Tikhaze, A. K., Konovalova, G. G.,
T., Smirnov, V. N., and Orekhov, A. N. (1992) Mul-
Kumskova, E. M., and Shumaev, K. B. (2010) Al-
tiple-modified desialylated low density lipoproteins
dehyde-dependent modification of low density lipo-
that cause intracellular lipid accumulation. Isola-
proteins, in Handbook of Lipoprotein Research, Nova
tion, fractionation and characterization, Lab. Invest.,
Science Publishers, Inc., NY, pp. 85-107.
67, 665-675.
38.
Lankin, V. Z., Shumaev, K. B., Tikhaze, A. K., and
28.
Hara, A., and Radin, N. S. (1978) Lipid extraction
Kurganov, B. I. (2017) Influence of dicarbonyls on
of tissues with a low-toxicity solvent, Anal. Biochem.,
kinetic characteristics of glutathione peroxidase,
90, 420-426, doi: 10.1016/0003-2697(78)90046-5.
Dokl. Biochem. Biophys., 475, 287-290, doi: 10.1134/
29.
Lankin, V., Viigimaa, M., Tikhaze, A., Kumskova, E.,
S1607672917040123.
Konovalova, G., Abina, J., Zemtsovskaya, G.,
39.
Sharapov, M. G., Gudkov, S. V., Lankin, V. Z.,
Kotkina, T., Yanushevskaya, E., and Vlasik, T. (2011)
and Novoselov, V. I. (2021) Role of glutathione
Cholesterol-rich low density lipoproteins are also
peroxidases and peroxiredoxins in free radical-induced
more oxidized, Mol. Cell. Biochem., 355, 187-191,
pathologies, Biochemistry (Moscow), 86, 1418-1433,
doi: 10.1007/s11010-011-0853-y.
doi: 10.1134/S0006297921110067.
30.
Viigimaa, M., Abina, J., Zemtsovskaya, G., Tikhaze, A.,
40.
Lankin, V. Z., Konovalova, G. G., Tikhaze, A. K.,
Konovalova, G., Kumskova, E., and Lankin, V. (2010)
Shumaev, K. B., Belova (Kumskova), E. M., Grech-
БИОХИМИЯ том 88 вып. 11 2023
19*
2324
ЛАНКИН и др.
nikova, M. A., and Viigimaa, M. (2016) Aldehyde
48.
Akhmedov, A., Sawamura, T., Chen, C. H., Kraler, S.,
inhibition of antioxidant enzymes in the blood
Vdovenko, D., and Lüscher, T. F. (2021) Lectin - like
of diabetic patients, J. Diabetes,
8,
398-404,
oxidized low-density lipoprotein receptor-1 (LOX-1):
doi: 10.1111/1753-0407.12309.
a crucial driver of atherosclerotic cardiovascular
41.
Lankin, V. Z., Sharapov, M. G., Goncharov, R. G.,
disease, Eur. Heart J., 42, 1797-1807, doi: 10.1093/
Tikhaze, A. K., and Novoselov, V. I. (2019) Natural di-
eurheartj/ehaa770.
carbonyls inhibit peroxidase activity of peroxiredoxins,
49.
Duprat, F., Robles, C., Castillo, M. P., Rivas, Y.,
Dokl. Biochem. Biophys., 485, 132-134, doi: 10.1134/
Mondaca, M., Jara, N., Roa, F., Bertinat, R.,
S1607672919020157.
Toledo, J., Paz, C., and González-Chavarría, I.
42.
Yu, X. H., Fu, Y. C., Zhang, D. W., Yin, K., and
(2023) LOX-1 activation by oxLDL induces AR
Tang, C. K. (2013) Foam cells in atherosclerosis,
and AR-V7 expression via NF-κB and STAT3
Clin. Chim. Acta, 424, 245-252, doi: 10.1016/j.cca.
signaling pathways reducing enzalutamide cytotoxic
2013.06.006.
effects, Int. J.Mol. Sci., 24, 5082, doi: 10.3390/
43.
Estruch, M., Sanchez-Quesada, J. L., Ordonez
ijms24065082.
Llanos, J., and Benitez, S.
(2013) Electronega-
50.
Ланкин В. З., Шарапов М. Г., Гончаров Р. Г.,
tive LDL: a circulating modified LDL with a role
Антонова О. А., Коновалова Г. Г., Тихазе А. К.,
in inflammation, Mediat. Inflamm., 2013, 181324,
Косач В. Я.
(2023) Молекулярные механизмы
doi: 10.1155/2013/181324.
повреждения стенки сосудов и дисфункции эн-
44.
Puig, N., Montolio, L., Camps-Renom, P., Navarra, L.,
дотелия. Обоснование новых подходов к анти-
Jiménez-Altayó, F., Jiménez- Xarrié, E., Sánchez-
оксидантной терапии. Тезисы конф.
«Кардио-
Quesada, J. L., and Benitez, S. (2020) Electronegative
логия на марше», Кардиологический вестник (спец.
LDL promotes inflammation and triglyceride accu-
выпуск), 16-17.
mulation in macrophages, Cells, 9, 583, doi: 10.3390/
51.
Galvani, S., Coatrieux, C., Elbaz, M., Grazide, M. H.,
cells9030583.
Thiers, J. C., Parini, A., Uchida, K., Kamar, N.,
45.
Pirillo, A., Norata, G. D., and Catapano, A. L.
Rostaing, L., Baltas, M., Salvayre, R., and Nègre-
(2013) LOX-1, OxLDL, and atherosclerosis, Mediat.
Salvayre, A. (2008) Carbonyl scavenger and anti-
Inflamm., 2013, 152786, doi: 10.1155/2013/152786.
atherogenic effects of hydrazine derivatives, Free.
46.
Lubrano, V., and Balzan, S. (2014) LOX-1 and ROS,
Radic. Biol. Med.,
45,
1457-1467, doi:
10.1016/
inseparable factors in the process of endothelial dam-
j.freeradbiomed.2008.08.026.
age, Free Radic. Res., 48, 841-848, doi: 10.3109/
52.
Belkheiri, N., Bouguerne, B., Bedos-Belval, F.,
10715762.2014.929122.
Duran, H., Bernis, C., Salvayre, R., Nègre-
47.
Kattoor, A. J., Kanuri, S. H., and Mehta, J. L.
Salvayre, A., and Baltas, M. (2010) Synthesis and
(2019) Role of Ox-LDL and LOX-1 in atherogene-
antioxidant activity evaluation of a syringic hydra-
sis, Curr. Med. Chem., 26, 1693-1700, doi: 10.2174/
zones family, Eur. J. Med. Chem., 45, 3019-3026,
0929867325666180508100950.
doi: 10.1016/j.ejmech.2010.03.031.
DIFFERENCES IN STRUCTURAL CHANGES
AND PATHOPHYSIOLOGIC EFFECTS OF LOW-DENSITY LIPOPROTEINS
UPON ACCUMULATION OF ACYLHYDROPEROXY DERIVATIVES
IN THEIR OUTER PHOSPHOLIPID MONOLAYER
OR UPON CHEMICAL MODIFICATION OF APOPROTEIN B-100
BY NATURAL DICARBONYL
V. Z. Lankin*, A. K. Tikhaze, and G. G. Konovalova
National Medical Research Center of Cardiology
named after Academician E. I. Chazov, Ministry of Health of Russia,
121552 Moscow, Russia; e-mail: lankin0309@mail.ru
Nanoparticles of the lipid-transporting system of the organism - low-density lipoproteins (LDL) of blood
plasma are easily subjected to free radical peroxidation with formation of their main modified forms -
oxidized LDL itself (containing hydroperoxy-acyls in phospholipids of the outer layer of particles) and di-
carbonyl-modified LDL (apoprotein B-100 of which was chemically modified by the Maillard reaction).
Based on the study of free radical oxidation kinetics of LDL, it was found that the existing in the literature
БИОХИМИЯ том 88 вып. 11 2023
ЧТО ТАКОЕ «ОКИСЛЕННЫЕ» ЛИПОПРОТЕИДЫ?
2325
designation “oxidized lipoproteins” is incorrect because it does not reveal the nature of oxidative modifica-
tion of LDL. It is shown that “atherogenic” LDL (particles of which are actively captured by cultured mac-
rophages) are not the oxidized LDL (in which LOOH-derivatives of phospholipids are formed by enzymatic
oxidation of of C-15 lipoxygenase of rabbit reticulocytes), but dicarbonyl-modified LDL. The important
role of dicarbonyl-modified LDL in the molecular mechanisms of atherogenesis and endothelial dysfunc-
tion is discussed.
Keywords: oxidized low-density lipoproteins (LDL), dicarbonyl-modified LDL, free radical oxidation, “atherogenic”
LDL, oxidative stress, carbonyl stress
БИОХИМИЯ том 88 вып. 11 2023