БИОХИМИЯ, 2023, том 88, вып. 12, с. 2422 - 2434
УДК 577.12
РОЛЬ УБИКВИТИН-ПРОТЕАСОМНОЙ СИСТЕМЫ
В БИОЛОГИИ СТВОЛОВЫХ КЛЕТОК
Обзор
© 2023 А.В. Буров, А.А. Родин, В.Л. Карпов, А.В. Морозов*
Институт молекулярной биологии им. В.А. Энгельгардта РАН,
119991 Москва, Россия; электронная почта: runkel@inbox.ru
Поступила в редакцию 11.09.2023
После доработки 17.11.2023
Принята к публикации 18.11.2023
Селективная деградация клеточных белков с участием убиквитин-протеасомной системы является
одним из ключевых регуляторных механизмов в эукариотических клетках. Накапливающиеся дан-
ные свидетельствуют о том, что убиквитин-протеасомная система участвует в регуляции фунда-
ментальных процессов в стволовых клетках млекопитающих, включая пролиферацию, дифферен-
цировку, миграцию, старение и программируемую гибель клеток. Регуляция может осуществляться
либо путем протеолитической деградации ключевых транскрипционных факторов и белков сиг-
нальных путей, либо путем посттрансляционных модификаций белков-мишеней убиквитином
или другими убиквитинподобными модификаторами. Исследования молекулярных механизмов
поддержания протеостаза в стволовых клетках имеют большое значение для разработки новых
терапевтических подходов, направленных на лечение аутоиммунных, онкологических, нейро-
дегенеративных и других социально-значимых патологий. Данный обзор охватывает актуальные
данные о функции убиквитин-протеасомной системы в стволовых клетках.
КЛЮЧЕВЫЕ СЛОВА: стволовые клетки, убиквитин-протеасомная система, протеасома.
DOI: 10.31857/S0320972523120060, EDN: NKAUYX
ВВЕДЕНИЕ
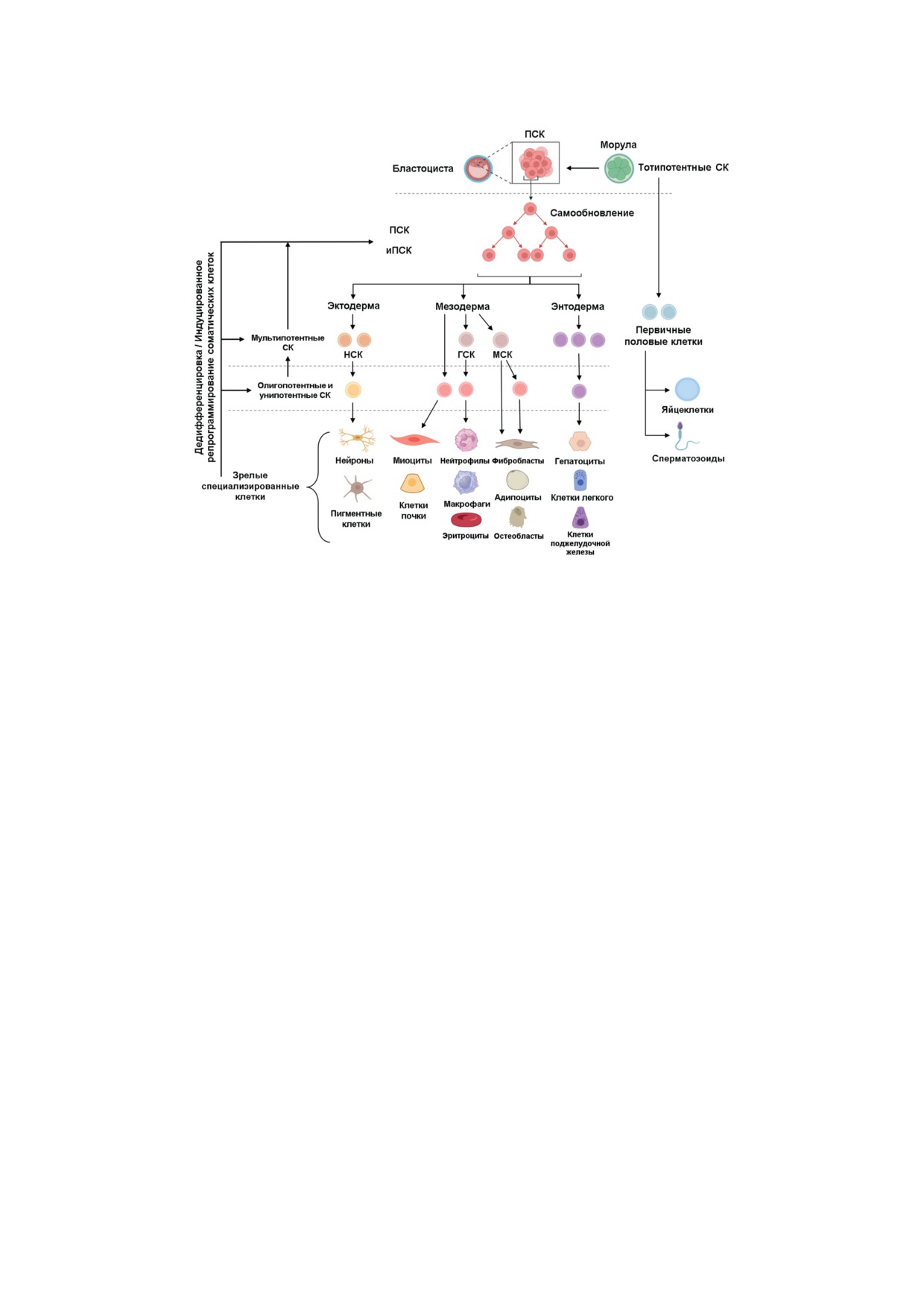
циализированное состояние (рис. 1) [2]. Таким
образом, на примере человека СК в организме
Стволовые клетки (СК) представляют со-
можно разделить на: тотипотентные стволо-
бой неспециализированные клетки организма,
вые клетки, плюрипотентные стволовые клет-
которые могут дифференцироваться в различ-
ки (ПСК), мультипотентные стволовые клетки
ные типы клеток в зависимости от условий
и унипотентные клетки, где тотипотентные и
среды (рис. 1). Это свойство СК позволяет
плюрипотентные стволовые клетки способны
как формироваться живым организмам в про-
превращаться в клетки любого типа зрелого
цессе эмбриогенеза, так и в процессе жизне-
организма, а унипотентные клетки - лишь в
деятельности обеспечивать самообновление
определенный тип клеток (рис. 1). При пато-
и регенерацию тканей и органов [1]. Стволо-
логии в организме могут возникать опухолевые
выми клетками обладают многие виды много-
стволовые клетки (ОСК), которые в контек-
клеточных организмов. Существует множе-
сте опухоли обладают свойствами нормаль-
ство видов СК, которые принято разделять по
ных СК, что позволяет поддерживать жизне-
потенциалу дифференцировки и способности
способность, стимулировать развитие новых,
к самообновлению, то есть количеству типов
а также влиять на лекарственную устойчивость
клеток, в которые они могут дифференциро-
новообразований. Также существует возмож-
ваться, и способности сохранять свое неспе- ность искусственного создания СК из зрелых
Принятые сокращения: ГКГС - главный комплекс гистосовместимости; ГСКС - гемопоэтические стволовые
клетки; МСК - мезенхимальные стволовые клетки; ОСК - опухолевые стволовые клетки; ПСК - плюрипотентные
стволовые клетки; иПСК - индуцированные плюрипотентные стволовые клетки; УПС - убиквитин-протеасомная
система; СК - стволовые клетки; ЭСК - эмбриональные стволовые клетки.
* Адресат для корреспонденции.
2422
РОЛЬ УБИКВИТИН-ПРОТЕАСОМНОЙ СИСТЕМЫ
2423
Рис. 1. Иерархия, виды и направления дифференцировки стволовых клеток, СК - стволовые клетки; ПСК - плюри-
потентные стволовые клетки; иПСК - индуцированные плюрипотентные стволовые клетки; МСК - мезенхимальные
стволовые клетки; НСК - нейральные стволовые клетки; ГСК - гемопоэтические стволовые клетки
клеток организма путем воздействия различ-
правлению клетки на путь дифференцировки.
ных генетических и химических факторов на
Данная регуляторная система имеет сложную
клетки; примером таких клеток являются инду-
организацию, поэтому определение четкой
цированные плюрипотентные стволовые клет-
роли УПС в биологии СК позволит вывести
ки (иПСК). Как и ПСК, иПСК способны да-
на новый уровень биоинженерные подходы к
вать начало большинству типов органов и тка-
изучению стволовых клеток и их применение
ней организма.
в медицине.
Характерной чертой СК являются актив-
ный метаболизм, высокий уровень транскрип-
ции и синтеза белка, что требует наличия
ДИФФЕРЕНЦИРОВОЧНЫЙ
высокоорганизованной протеолитической си-
ПОТЕНЦИАЛ СТВОЛОВЫХ КЛЕТОК
стемы. Данную функцию выполняют система
аутофагии и убиквитин-протеасомная систе-
СК обладают двумя универсальными
ма (УПС). Если система аутофагии преиму-
свойствами: способность к самообновлению и
щественно отвечает за утилизацию белковых
способность к преобразованию в специализи-
агрегатов и органелл, то УПС имеет более
рованные клетки, формирующие зрелые ткани
широкий функционал. Как и в других клетках
и органы, то есть способность к дифференци-
организма, в СК УПС активно участвует в ре-
ровке (рис. 1). Эти свойства проявляются СК
гуляции экспрессии генов, метаболических и
при делении двух типов: симметричном, когда
энергетических процессах, осуществляя пост-
СК лишь воспроизводят свои недифферен-
трансляционные модификации транскрипци-
цированные клоны, и асимметричном, когда
онных факторов, регулирует темп пролифе-
в процессе деления получается одна более
рации и переход клеток к апоптозу, участвует
специализированная клетка и одна недиффе-
в передаче внутриклеточных и межклеточных
ренцированная. Функциональное состояние
сигналов и др. [3].
и дифференцировочный потенциал СК отли-
В целом, УПС оказывает большое влияние
чается на разных стадиях развития организ-
на функциональный статус СК, в зависимости
ма. На начальных стадиях развития (стадия
от условий либо поддерживая недифферен-
зиготы и морулы) организм состоит из тоти-
цированное состояние, либо способствуя на-
потентных клеток, каждая из которых имеет
БИОХИМИЯ том 88 вып. 12 2023
2424
БУРОВ и др.
неограниченный потенциал к делению и спо-
венно регулируется внутриклеточными про-
собна в случае изоляции дать начало новому
теолитическими системами, в том числе убик-
организму. На эмбриональном этапе (стадия
витин-протеасомной системой. Данная си-
бластоцисты и последующие стадии форми-
стема работает и в цитоплазме, и в клеточном
рования зародыша) дифференцировочный по-
ядре, осуществляя селективный протеолиз
тенциал СК снижается. Эмбриональные ство-
белковых молекул. Неоднократно было пока-
ловые клетки (ЭСК) становятся плюрипо-
зано участие УПС в поддержании потентности
тентными, что означает лишь их способность
СК [8, 9], однако функции УПС в СК на этом
к универсальной дифференцировке в любой
не ограничиваются. УПС также активно уча-
из типов клеток зрелого организма [4]. В ходе
ствует в процессе дифференцировки, задавая
дальнейшего онтогенеза дифференцировоч-
вектор развития СК [10, 11]. Интенсивность
ный потенциал большинства ПСК ограничи-
протеолиза в СК с участием УПС и скорость
вается еще сильнее, они трансформируются в
дифференцировки зависит от концентрации
зрелые тканеспецифичные стволовые клетки
макроэргических субстратов в клетке, а также
(постнатальные СК). К таким зрелым стволо-
от баланса между анаэробными и аэробными
вым клеткам можно отнести мультипотентные
катаболическими процессами [12]. Хотя счи-
и унипотентные стволовые клетки. Приме-
тается, что в основном клетки используют
ром мультипотентных клеток могут служить
гликолиз, было показано, что in vitro для ЭСК
мезенхимальные стволовые клетки (МСК) и
характерен высокий уровень окислительного
гемопоэтические стволовые клетки (ГСК).
фосфорилирования и продукции ATP с уча-
ГСК способны давать начало всем видам
стием митохондрий [13]. Для МСК и ГСК в
миелоидных и лимфоидных клеток (рис. 1).
недифференцированном состоянии покоя ха-
МСК имеют возможность хондрогенной, ос-
рактерна высокая гликолитическая активность,
теогенной и адипогенной дифференцировки.
которая почти полностью обеспечивает клет-
Унипотентные стволовые клетки представля-
ки ATP [14]. ATP в комплексе с двухвалент-
ют собой тканеспецифичные клетки-предше-
ными ионами, в первую очередь ионами
ственники, их отличием является очень узкая
магния Mg2+, оказывает влияние на работу
возможность дифференцировки всего в один
УПС [15]. Поэтому в случае повреждения эле-
тип клеток и ограниченная возможность само-
ментов электронно-транспортной цепи мито-
обновления, то есть они делятся определенное
хондрий происходит снижение концентра-
количество раз [5]. Благодаря своим уникаль-
ции ATP в цитозоле, что приводит к снижению
ным свойствам в поддержании функцио-
ATP-зависимого протеолиза с участием УПС.
нального статуса ткани, иммуномодулирую-
Следствием этих молекулярных событий мо-
щим функциям, способности к хоумингу и др.
жет стать преждевременная дифференцировка
СК являются объектом пристального изучения
или даже старение и переход СК к апоптозу.
с целью применения в области регенератив-
Для более детального понимания работы УПС
ной медицины, тканевой инженерии и тера-
в СК необходимо рассмотреть ее основные
пии многих онкологических и нейродегенера-
функциональные элементы, непосредственно
тивных заболеваний [1, 6]. Особое внимание
осуществляющие протеолиз, а также механиз-
привлекает возможность получения иПСК из
мы, регулирующие этот процесс.
соматических клеток путем искусственного
репрограммирования (рис. 1). Такой подход
позволяет получить СК, обладающие диффе-
УБИКВИТИН-ПРОТЕАСОМНАЯ
ренцировочным потенциалом и свойствами,
СИСТЕМА
аналогичными ПСК, и использовать их как
для изучения in vitro в качестве универсально-
Поддержание динамического равновесия в
го модельного объекта, так и для применения
протеоме является необходимым условием для
в медицинской практике, например, транс-
нормального метаболизма и долгосрочного
плантологии [2, 7]. Подобная пластичность СК
обеспечения жизнедеятельности любого типа
была бы невозможна без сложной внутри-
клеток и органов [16]. В клетках эукариот эту
клеточной системы контроля пролиферации.
функцию выполняет УПС.
Баланс между процессами дифференцировки,
УПС - высокоорганизованная система,
старения и клеточной гибели поддерживается
включающая в себя множество макромолеку-
в первую очередь за счет скоординированной
лярных компонентов. Результат согласованных
работы большого количества транскрипцион-
взаимодействий этих молекул проявляется в
ных факторов. При этом уровень экспрессии
избирательном мечении и последующей дегра-
генов многих факторов транскрипции кос-
дации белков [17]. Селективность протеолиза
БИОХИМИЯ том 88 вып. 12 2023
РОЛЬ УБИКВИТИН-ПРОТЕАСОМНОЙ СИСТЕМЫ
2425
обеспечивается убиквитинированием - пост-
мов [28]. 20S-Протеасома эукариот представ-
трансляционной модификацией белков, пред-
ляет собой симметричную бочка-подобную
ставляющей собой ковалентное присоедине-
структуру (М = 700 кДа), состоящую из че-
ние молекулы убиквитина.
тырех уложенных друг на друга гептамерных
Убиквитин - это белок массой 8,5 кДа,
колец [29]. Каждое из двух внешних колец
который играет важнейшую роль в регуля-
включает в себя α-субъединицы (α1-α7), вы-
ции таких процессов, как прохождение кле-
полняющие структурную функцию, а также
точного цикла, клеточная дифференцировка,
предотвращающие случайный доступ субстра-
апоптоз, репарация ДНК и др. [18] В процессе
та во внутреннюю протеолитическую камеру,
убиквитинирования задействованы 3 группы
образованную двумя кольцами β-субъединиц
специфических ферментов: Е1
- убикви-
(β1-β7) [27, 29, 30]. По три из семи β-субъеди-
тин-активирующий фермент, Е2 - убикви-
ниц в каждом из внутренних колец протеасом
тин-сопрягающие ферменты и Е3 - убикви-
эукариот обладают специфической каталити-
тин-лигазы, осуществляющие перенос молекул
ческой активностью за счет наличия активного
убиквитина на конкретные субстраты [19].
остатка треонина на N-конце полипептидной
В ходе убиквитинирования белок обретает мо-
цепи [31]. В составе конститутивной 20S-про-
лекулярную метку, чаще всего представляющую
теасомы β1-субъединица осуществляет гидро-
собой полиубиквитиновую цепь, мономеры
лиз пептидной связи после кислых остатков
которой соединены между собой изопептид-
(каспазаподобная активность), β2-субъедини-
ными связями. Следует отметить, что наличие
ца - после основных (трипсинподобная ак-
специфической полиубиквитиновой цепи на
тивность), а β5-субъединица - после гидро-
молекуле белка далеко не всегда приводит к
фобных остатков (химотрипсинподобная ак-
его протеолизу [20, 21]. Тем не менее присо-
тивность) [17, 32].
единение большинства типов убиквитиновых
Убиквитин-зависимый протеолиз подразу-
цепей, в том числе и моноубиквитинирование,
мевает ассоциацию 20S-протеасомы с одним
так или иначе опосредует деградацию бел-
или двумя 19S-регуляторами, такой комплекс
ка [22]. Помимо убиквитиновой метки, в со-
называют 26S-протеасомой [33]. Субъединицы
ставе белка для его эффективной деградации
регулятора осуществляют распознавание, де-
должен присутствовать неструктурированный
убиквитинирование, разворачивание молеку-
участок - дегрон [23].
лы субстрата и ее протаскивание в каталитиче-
Дальнейшие химические преобразования
скую камеру 20S-протеасомы [34, 35]. Помимо
субстрата обеспечиваются работой протеа-
19S-регулятора, обратимо присоединяться к
сом - макромолекулярных белковых комплек-
внешним кольцам α-субъединиц 20S-протеа-
сов, обладающих протеолитической актив-
сомы может и ряд других регуляторов, таких
ностью. Протеасомы осуществляют протеолиз
как РА28αβ, РА28γ, РА200 и РI31. Причем
белковых субстратов с образованием коротких
не исключено одновременное присоединение
пептидов, которые в дальнейшем с участием
двух различных регуляторов к одной 20S-про-
пептидаз могут разрушаться до отдельных
теасоме, и в этом случае образуется так назы-
аминокислот [24] либо могут выполнять функ-
ваемая гибридная протеасома [36, 37]. В целом,
ции биологически активных сигнальных моле-
функция протеасомных регуляторов заключа-
кул как внутри, так и вне клетки [25, 26]. Про-
ется в обеспечении субстратной специфично-
теасомы являются основной функциональной
сти и облегчении доступа субстратов в протео-
единицей УПС, так как непосредственно осу-
литическую камеру протеасомы [38].
ществляют протеолиз, однако для них харак-
У большинства челюстноротых (за исклю-
терно высокое структурное разнообразие. Это
чением птиц), помимо наличия или отсутствия
разнообразие обеспечивается встраиванием
ассоциированного регулятора, структура и ак-
в протеасому альтернативных каталитических
тивность 20S-протеасом может изменяться за
субъединиц, взаимодействием с различными
счет встраивания неканонических каталитиче-
регуляторными белковыми комплексами, а
ских субъединиц, которые являются гомолога-
также посттрансляционными модификациями
ми конститутивных субъединиц [39]. В опре-
ее компонентов [27].
деленных типах клеток (например, иммунных
Основным структурным элементом в
клетках) постоянно экспрессируются так назы-
составе протеасомного комплекса является
ваемые иммунные субъединицы β1i (LMP2),
20S-протеасома. Это высококонсервативный
β2i (MECL-1) и β5i (LMP7) [40]. При сборке
белковый комплекс, наличие которого в клет-
протеасомы они могут встраиваться в оба
ках характерно как для эукариотических, так
β-кольца вместо своих конститутивных гомоло-
и для некоторых прокариотических организ-
гов, образуя тем самым иммунопротеасомы [40].
БИОХИМИЯ том 88 вып. 12 2023
2426
БУРОВ и др.
При этом в клетках, которые в норме не экс-
нальных биохимических путей. В то же время
прессируют иммунные субъединицы, воз-
высокий уровень организации УПС сопря-
можна индукция их экспрессии под действием
жен с риском развития различных патологий
таких провоспалительных цитокинов, как ин-
в случае нарушения работы протеолитической
терферон гамма (ИФН-γ) и фактор некроза
системы. Мутации в генах УПС могут приво-
опухоли альфа (ФНО-α) [41-43]. Субъеди-
дить к развитию онкологических, нейродеге-
ница β2i проявляет трипсинподобную актив-
неративных, аутоиммунных и метаболических
ность, а субъединицы β1i и β5i - химотрип-
заболеваний [52]. Учитывая вышесказанное,
синподобную [44]. Соответственно, в отличие
неудивительно, что УПС в СК принимает уча-
от конститутивной 20S-протеасомы, иммуно-
стие в регуляции дифференцировки. На сего-
протеасома обладет существенно сниженной
дняшний день активно исследуется то, как
каспазаподобной активностью, при этом про-
именно и за счет протеолиза каких белковых
являет повышенную химотрипсинподобную
молекул протеасомы влияют на интенсивность
активность. Поэтому, по сравнению с консти-
пролиферации и реализацию дифференциро-
тутивными протеасомами, иммунопротеасо-
вочного потенциала СК.
мы более эффективно продуцируют пептиды,
С-конец которых представлен аминокисло-
той с гидрофобным радикалом. Это позволяет
ФУНКЦИИ УПС
данным пептидам впоследствии связываться с
В СТВОЛОВЫХ КЛЕТКАХ
молекулами главного комплекса гистосовме-
стимости (ГКГС) первого класса, что является
Поддержание недифференцированного со-
ключевым этапом на пути презентации анти-
стояния СК. Регуляция процесса дифферен-
гена на поверхности клетки и обусловливает
цировки СК и возможность получения иПСК
важную роль иммунопротеасом при воспали-
путем репрограммирования соматических кле-
тельных процессах и инфекциях [45].
ток давно привлекают внимание научного
Помимо иммунопротеасом, также суще-
сообщества. Несмотря на активное изучение
ствует ряд других неканонических форм про-
этого вопроса и попытки выявить генетиче-
теасом, образующихся за счет комбинаторно-
ские и эпигенетические закономерности раз-
го встраивания альтернативных субъединиц.
вития СК [53], универсальные механизмы,
Важной характеристикой тотального пула про-
определяющие пролиферативный статус СК,
теасом в клетке является процентное содер-
остаются не до конца понятными. Во многом
жание и относительная активность той или
дифференцировка СК зависит от взаимодей-
иной формы 20S-протеасом. При этом данный
ствий белков внутри клетки, в том числе от
показатель является динамичным, и пул про-
убиквитинирования и селективного протео-
теасом меняется в ходе онтогенеза, в том числе
лиза ряда транскрипционных факторов. Так,
и при дифференцировке СК [46]. По всей ве-
убиквитинирование и протеасомная дегра-
роятности, вариантные формы протеасом вы-
дация ключевых транскрипционных факто-
полняют специфические функции, при этом
ров NANOG, OCT-3/4, SOX2, KLF4, C-MYC,
некоторые из них привязаны к определенному
LIN28 в СК определяют судьбу клеток, под-
типу ткани в организме [47]. Так, например,
держание недифференцированного состояния
тимопротеасомы можно найти в эпителиаль-
и запуск процесса дифференцировки [9, 11, 54,
ных клетках кортикального слоя тимуса [48].
55] (таблица). Селективный протеолиз тран-
Такие протеасомы, помимо β1i и β2i, включают
скрипционных факторов - не единственный
в свой состав также уникальную каталитиче-
механизм, реализуемый УПС в регуляции под-
скую субъединицу β5t и играют важную роль
держания потентности СК. УПС также ис-
в положительной селекции Т-лимфоцитов [41,
полняет роль главной системы контроля каче-
48-50]. Было показано, что de novo экспрессия
ства при накоплении в клетке поврежденных
тимопротеасом в МСК значительно увеличи-
и неправильно свернутых белков. Показано,
вает их терапевтический потенциал в качестве
что в ЭСК активность убиквитин-зависимо-
противоопухолевой вакцины, активирующей
го протеолиза повышена и зависит от уровня
CD8+ T-лимфоциты [51].
экспрессии гена PSMD11, который кодиру-
Очевидно, что такая вариативность в
ет одну из субъединиц 19S-регулятора про-
структуре, возможность присоединения регу-
теасом, что может иметь значение для защи-
ляторов обеспечивают высокую функциональ-
ты клеток от протеотоксического стрес-
ную мобильность УПС. Это подтверждается
са (таблица) [56]. При этом при дифференци-
тем, что протеасомы осуществляют протео-
ровке уровень экспрессии PSMD11 и актив-
литическую регуляцию огромного числа сиг-
ность протеасом существенно снижались [56].
БИОХИМИЯ том 88 вып. 12 2023
РОЛЬ УБИКВИТИН-ПРОТЕАСОМНОЙ СИСТЕМЫ
2427
Для зрелых мышечных СК в условиях ис-
ренцировки [62]. Таким образом, во многих
кусственного нокаута другой субъединицы
ПСК смещение баланса между процессами
19S-регулятора (Rpt3) была показана утрата
убиквитинирования и деубиквитинирования
способности участвовать в регенерации по-
отражается на статусе этих клеток, зачастую
врежденной мышечной ткани (таблица) [57].
приводя к их дифференцировке.
Более того, для ПСК, по сравнению с их бо-
Все это указывает на важную роль убик-
лее дифференцированными потомками, ха-
витин-зависимого протеолиза, однако в слу-
рактерен более высокий уровень экспрессии
чае общего нарушения протеостаза активно
генов таких Е3-убиквитинлигаз, как HERC2,
функционируют и свободные 20S-протеасомы,
UBE3A, UBR7 и RNF181 (таблица) [58], что,
осуществляя убиквитин-независимый протео-
по-видимому, играет роль в поддержании ба-
лиз [63]. Также было показано, что воздействие
ланса содержания эндогенных регуляторных
на МСК специфического ингибитора протеа-
белков. Для поддержания гомеостаза клеткой
сом Mg132 приводит к ускоренному старению
непрерывный процесс убиквитинирования
клеток, что, в свою очередь, обычно является
белков должен быть сбалансирован обратным
причиной снижения дифференцировочного
процессом - деубиквитинированием. Действи-
потенциала СК, что, например, может про-
тельно, активность деубиквитинирующих фер-
являться в утрате остеогенного и хондроген-
ментов также влияет на поддержание потент-
ного потенциала и усилении адипогенной
ности СК и процесс их дифференцировки.
дифференцировки у старых МСК [64, 65]. Это
Так, например, было показано, что в ЭСК де-
подтверждается данными, указывающими на
убиквитинирование и, как следствие, стабили-
то, что в МСК снижение пролиферативного
зация транскрипционного фактора NANOG,
потенциала сопряжено с падением актив-
приводит к поддержанию недифференцирован-
ности и уровня экспрессии конститутивных
ного состояния клеток [59]. В нейральных
протеасом [66]. Таким образом, нарушения в
стволовых клетках (НСК) активность деуби-
работе УПС приводят к быстрому клеточному
квитиназы USP7 предотвращает деградацию
старению и, в случае СК, к снижению диффе-
транскрипционного фактора REST, участвую-
ренцировочного потенциала.
щего в поддержании потентности. Нокаут
В целом, стабильная работа УПС необхо-
гена, кодирующего USP7, приводит к быстрой
дима для поддержания потентности всех типов
убиквитин-зависимой протеолитической де-
СК, от ЭСК до зрелых прогениторных клеток,
градации REST и немедленной дифференци-
а УПС-зависимое поддержание протеостаза -
ровке НСК [60]. Также была показана роль
одно из главных условий нормального функ-
деубиквитиназы USP44 в поддержании плюри-
ционирования стволовых клеток [8].
потентного состояния ЭСК [61]. USP44 пред-
Роль УПС в дифференцировке СК. УПС
отвращает накопление убиквитинированных
принимает активное участие в дифферен-
гистонов H2B в ядрах ЭСК, что позволяет
клеткам оставаться в плюрипотентном состо-
янии. Переход к дифференцировке сопряжен
с падением экспрессии USP44 и повышени-
ем количества убиквитинированного гисто-
на Н2В [61]. Данный пример указывает на то,
что деубиквитинирующие ферменты могут ре-
гулировать процесс дифференцировки не толь-
ко за счет прямого взаимодействия с тран-
скрипционными факторами, а также за счет
модификации гистонов в областях, ассоции-
рованных с промоторами транскрипционных
факторов. Еще одним подтверждением дан-
ной гипотезы служит участие деубиквитина-
зы USP21 в экспрессии генов, регулируемых
NANOG [59], а также USP22 - в экспрессии
гена, кодирующего ключевой фактор плю-
рипотентности (SOX2). USP22 специфично
связывается и осуществляет деубиквитини-
рование гистонов в промоторных областях
гена SOX2, тем самым снижая уровень тран-
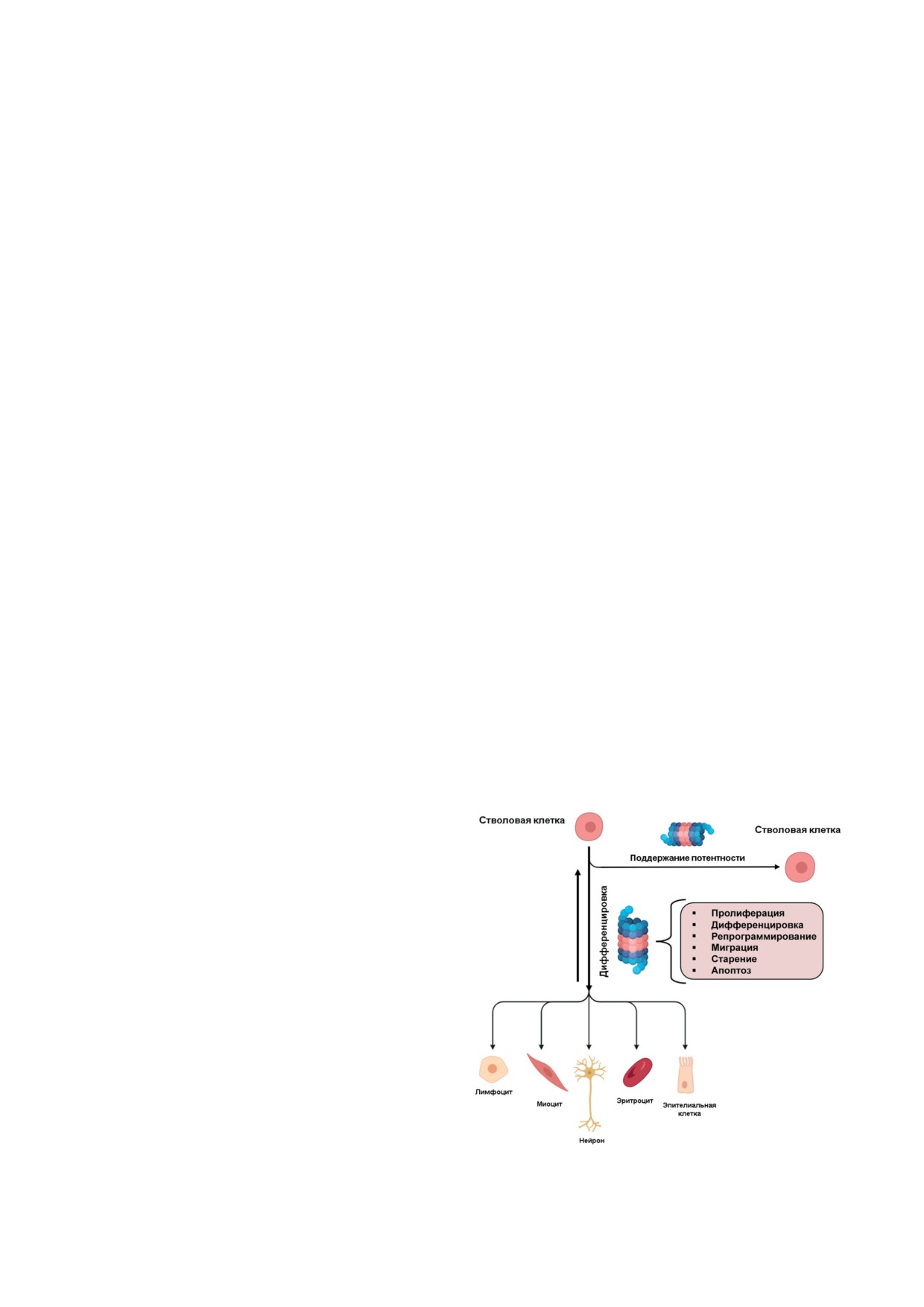
Рис. 2. Роль протеасом в дифференцировке и поддержа-
скрипции гена, стимулируя процесс диффе-
нии потентности СК
БИОХИМИЯ том 88 вып. 12 2023
2428
БУРОВ и др.
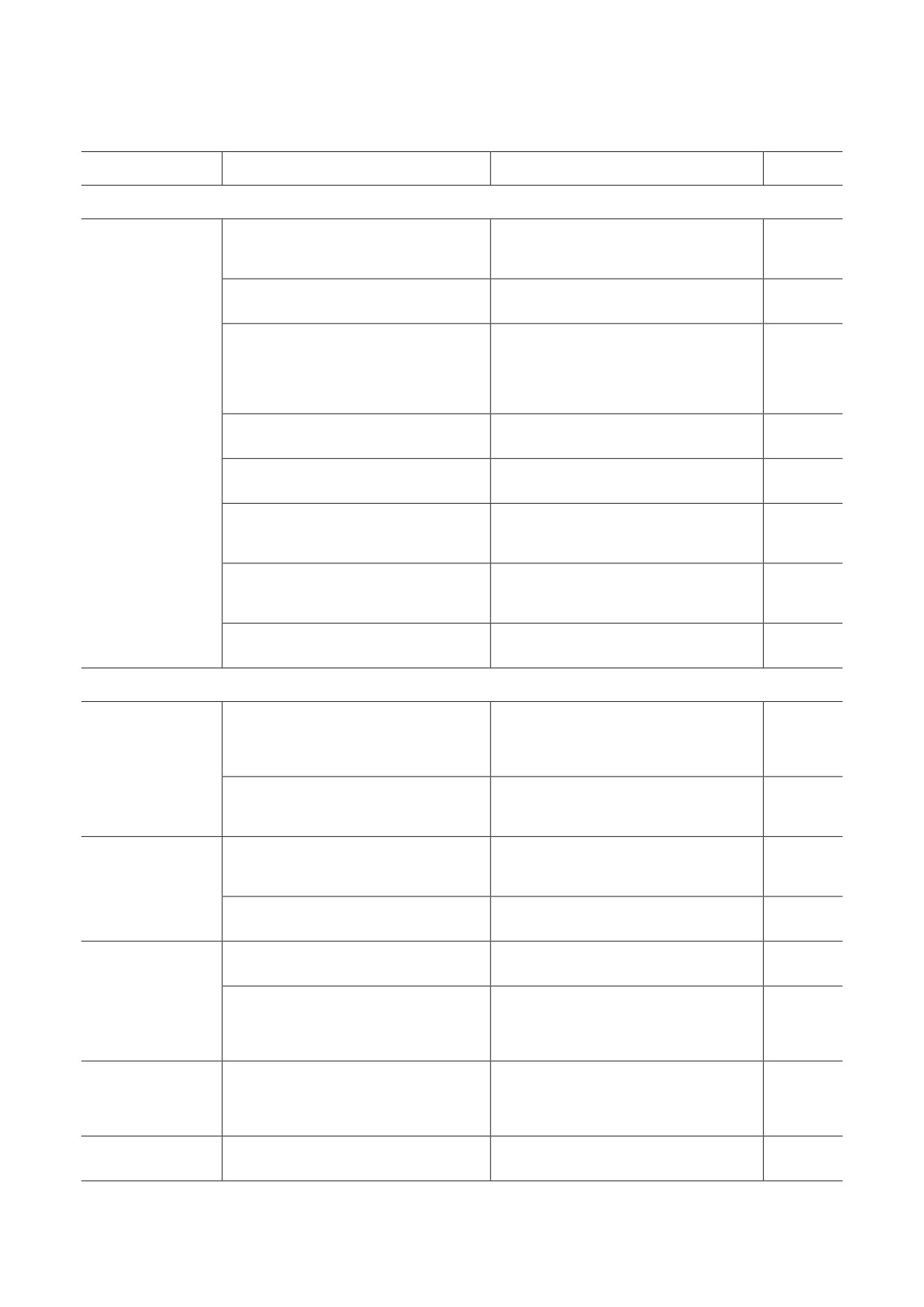
Функции различных компонентов УПС в стволовых клетках
Тип клеток
Компонент УПС
Функция
Ссылка
Плюрипотентные
субъединицы 19S-регулятора
поддержание плюрипотентного
протеасом Rpn11/Rpn6
состояния/индукция
[9, 54-56]
и Е3-убиквитинлигазы FBXW7, FBXW8
дифференцировки
субъединица 19S-регулятора
поддержание протеостаза
[56]
протеасом Rpn6 (PSMD11)
и контроль пролиферации
поддержание стабильного общего
HECT - E3-убиквитинлигазы
уровня синтеза белка, созревания
(HERC2, UBE3A)
рРНК, контроль работы теломеразы
[58]
и RING - E3-убиквитинлигазы
и регуляция гликолитического
(UBR7, RNF181)
метаболизма в клетке
деубиквитинирование гистона Н2В,
деубиквитинирующий фермент USP44
[61]
ЭСК/иПСК
модуляция экспресии OCT4 и NANOG
стабилизация NANOG,
деубиквитинирующий фермент USP21
[59]
деубиквитинирование гистона Н2А
деубиквитинирование гистона Н2В,
деубиквитинирующий фермент USP22
ассоциированного с промотором
[60]
гена SOX2
убиквитинирование гистона Н2В,
Е3-убиквитинлигаза RNF20
негативная регуляция экспрессии
[61, 71]
генов, кодирующих C-FOS и C-MYC
регулятор протеасом РА28αβ,
деградация окисленных
[72, 77]
иммунные протеасомы
и поврежденных белков
Мультипотентные и унипотентные
стимуляция самообновления, контроль
активности транскрипционных
субъединицы 20S-протеасом β5/β2
[66]
факторов, определяющих
плюрипотентное состояние СК
МСК
убиквитинирование гистона Н2В,
Е3-убиквитинлигаза RNF40
позитивная регуляция экспрессии
[70]
генов дифференцировки
контроль эффективности
иммунная субъединица протеасом β5i
презентации антигенов в составе
[76]
ГКГС первого класса
ГСК
убиквитинирование транскрипционных
Е3-убиквитинлигаза c-Cbl
[68]
факторов NOTCH, C-KIT и STAT5
убиквитин-модифицирующий
дифференцировка мотонейронов
[10]
фермент UBA1
НСК
предотвращение протеолитической
деградации транскрипционного
деубиквитинирующий фермент USP7
[60]
фактора REST и перехода
к дифференцировке
поддержание высокой активности
субъединица 19S-регулятора
убиквитин-зависимого протеолиза,
мышечные СК
[57]
протеасом Rpt3
обеспечение выживания СК
и эффективной дифференцировки
убиквитинирование β-катенина
эпидермальные СК
Е3-убиквитинлигаза Smurf2
[69]
и модуляция дифференцировки
БИОХИМИЯ том 88 вып. 12 2023
РОЛЬ УБИКВИТИН-ПРОТЕАСОМНОЙ СИСТЕМЫ
2429
цировке СК (рис. 2). Гомеостаз на тканевом
УПС, ОПУХОЛЕВЫЕ СК
уровне требует постоянного обновления со-
И РЕГЕНЕРАТИВНАЯ МЕДИЦИНА
старившихся и поврежденных клеток. Эту
функцию на себя берут соответствующие зре-
Биология СК тесно связана с биологией
лые резидентные СК. Чтобы находиться в
злокачественных опухолей, поскольку форми-
балансе между пролиферацией, дифференци-
рование опухоли всегда начинается с локаль-
ровкой, старением и апоптозом, эти СК дол-
ной группы клеток, которые претерпевают
жны иметь систему, способную интегрировать
злокачественную трансформацию и впослед-
все сигналы внутренней и внешней среды и
ствии дают начало всем остальным клеткам
трансформировать их в соответствующие ре-
опухоли. Такие клетки называют опухолевыми
гуляторные молекулярные преобразования.
стволовыми клетками. Метаболизм ОСК пред-
УПС принимает непосредственное участие
ставляет особый интерес, поскольку именно
в этом процессе и здесь также большую роль
эти клетки могут выжить в ходе цитостатиче-
играет убиквитинирование транскрипцион-
ской терапии и стать причиной рецидива, дав
ных факторов [67]. Так, например, в ГСК по-
начало вторичной опухоли [73]. Как и в нор-
вышение уровня экспрессии гена, кодирую-
мальных СК, в ОСК убиквитин-протеасом-
щего Е3-лигазу c-Cbl, сопряжено с перехо-
ная система играет важную роль, однако было
дом к дифференцировке. Данная Е3-лигаза
показано, что в ОСК, по сравнению с другими
убиквитинирует и направляет на протеасом-
клетками опухоли, активность протеасом сни-
ную деградацию транскрипционные факторы
жена и не так активно идет селективный убик-
NOTCH, C-KIT и STAT5, которые предот-
витин-зависимый протеолиз [74, 75]. По-види-
вращают выход из недифференцированного
мому, это общая черта для ОСК в различных
состояния (таблица) [68]. В эпидермальных
типах опухолей. Изучение механизмов регу-
СК Е3-лигаза SMURF2 модулирует диффе-
ляции пролиферации ОСК с участием УПС
ренцирову клеток путем убиквитинирования
может пролить свет на закономерности фор-
β-катенина [69]. Помимо убиквитинирования
мирования опухолей и помочь в разработке
транскрипционных факторов, важную роль в
соответствующих терапевтических подходов.
запуске дифференцировки также играют со-
Перспективным применением СК является
ответствующие модификации гистонов. Так,
регенеративная медицина и клеточная тера-
например, в МСК по ходу дифференцировки
пия, подразумевающая трансплантацию СК.
возрастает уровень экспрессии Е3-лигазы
Данный подход используют для замещения
RNF40, которая катализирует присоединение
поврежденных тканей и регенерации отдель-
убиквитина к гистону Н2В [70]. Внесение этой
ных органов пациентов. Этот метод применял-
модификации приводит к формированию от-
ся неоднократно и показал многообещающие
крытого хроматина и повышению уровня экс-
результаты на этапе клинических испытаний в
прессии генов дифференцировки. То же самое
случае таких заболеваний, как сахарный диа-
происходит с участием Е3-лигазы RNF20, но
бет, хронический миелоидный лейкоз, цирроз
она при дифференцировке негативно регу-
печени и легочный фиброз [1]. Однако есть
лирует экспрессию протоонкогенов C-FOS и
ряд ограничений, не позволяющих повсемест-
C-MYC (таблица) [61, 71].
но применять методы регенеративной медици-
Помимо динамических изменений в ра-
ны. Во-первых, трансплантация СК в случае
боте Е3-лигаз, по ходу дифференцировки мо-
нарушения молекулярных механизмов кон-
жет изменяться уровень убиквитинирования
троля пролиферации в пересаженных клет-
компонентов УПС. Было показано, что в ходе
ках может привести к формированию опухоли
дифференцировки иПСК в мотонейроны в
в теле реципиента [1]. Во-вторых, пересадка
клетках значительно возрастает количество
чужеродных клеток может вызывать у реци-
убиквитинированного белка UBA1 (Е1), а об-
пиента иммунную реакцию, что также может
работка клеток специфическим ингибитором
быть связано с протеолитической активностью
UBA1 приводит к снижению эффективности
иммунопротеасом. В СК иммунопротеасомы
дифференцировки и выживаемости мотоней-
участвуют в процессе презентации антигенов в
ронов (таблица) [10]. Стоит также отметить,
составе ГКГС первого класса, а полиморфизм
что в мышиных ЭСК при дифференцировке
генов иммунных субъединиц (в частности,
было выявлено повышение экспрессии им-
гена PSMB8, кодирующего β5i-субъединицу)
мунных протеасом, а также протеасом, несу-
может влиять на эффективность трансплан-
щих регулятор РА28αβ, что было связано с
тации ГСК и вызывать аутоимммунные реак-
уменьшением количества окисленных и по-
ции (таблица) [76]. При этом в ходе диффе-
врежденных белков [72].
ренцировки в некоторых СК экспрессия генов
БИОХИМИЯ том 88 вып. 12 2023
2430
БУРОВ и др.
иммунных субъединиц, а также активность
от условий. С одной стороны, эффект может
самих иммунных протеасом повышаются,
проявиться в негативной регуляции факторов
однако не до конца ясно, что здесь является
стволовости и активации факторов, направ-
причиной, а что - следствием [72, 77]. Так или
ляющих СК на путь дифференцировки, с дру-
иначе, стволовые клетки являются важным
гой стороны, метаболизм клетки может сильно
инструментом для изучения органогенеза и
пострадать и вместо дифференцировки при-
регенеративных способностей организма. Они
ведет к преждевременному старению и апоп-
также являются хорошей моделью для изуче-
тозу СК. В этой связи необходимо иметь ясное
ния патогенетических механизмов развития
представление о том, за счет каких молекуляр-
множества заболеваний и дают возможность
ных механизмов в СК поддерживается данный
разработки биологических моделей для изуче-
баланс. Это также позволит более детально
ния новых фармакологических препаратов.
изучить биологию СК, включая ОСК, и найти
новые подходы к терапии социально-значи-
мых заболеваний. Понимание роли УПС в це-
ЗАКЛЮЧЕНИЕ
лом и ее компонентов по отдельности в репро-
граммировании и трансдифференцировке СК
Разные типы СК обладают различным по-
позволит добиться значительного прогресса в
тенциалом к пролиферации и дифференци-
прикладных областях медицины, включая ре-
ровке. УПС является неотъемлемым элемен-
генеративную медицину, заместительную кле-
том метаболизма любой клетки, в том числе
точную терапию и скрининг лекарственных
и СК, однако особый интерес представляет ее
препаратов.
функциональная нагрузка в недифференци-
рованных СК. УПС в СК участвует в сохра-
Вклад авторов. А.В. Буров, А.А. Родин -
нении недифференцированного состояния,
написание текста; А.В. Морозов, В.Л. Кар-
а также поддерживает хрупкий баланс между
пов - редактирование текста статьи.
пролиферацией, дифференцировкой, старени-
Финансирование. Работа выполнена при
ем и апоптозом. В СК УПС осуществляет де-
финансовой поддержке Министерства науки и
градацию большинства белков (в том числе
высшего образования РФ, Соглашение № 075-
окисленных и поврежденных), регулирует
15-2020-773.
клеточный цикл и активность транскрипци-
Конфликт интересов. Авторы заявляют об
онных факторов с помощью Е3-убиквитинли-
отсутствии конфликта интересов.
газ, а также деубиквитинирующих ферментов.
Соблюдение этических норм. Настоящая
В связи с двоякой функцией УПС ингибиро-
статья не содержит описания каких-либо ис-
вание активности протеасом в СК может при-
следований с участием людей или животных
вести к разным последствиям в зависимости
в качестве объектов.
СПИСОК ЛИТЕРАТУРЫ
1. Kolios, G., and Moodley, Y. (2013) Introduction to
6. Lim, S. K., and Khoo, B. Y. (2021) An overview of
stem cells and regenerative medicine, Respiration,
mesenchymal stem cells and their potential therapeutic
85, 3-10, doi: 10.1159/000345615.
benefits in cancer therapy, Oncol. Lett., 22, 785,
2. Zakrzewski, W., Dobrzyński, M., Szymonowicz, M.,
doi: 10.3892/ol.2021.13046.
and Rybak, Z. (2019) Stem cells: past, present, and
7. Apostolou, E., Blau, H., Chien, K., Lancaster, M. A.,
future, Stem Cell Res. Ther., 10, 68, doi: 10.1186/
Tata, P. R., Trompouki, E., Watt, F. M., Zeng, Y. A.,
s13287-019-1165-5.
and Zernicka-Goetz, M. (2023) Progress and chal-
3. Selenina, A. V., Tsimokha, A. S., and Tomilin, A. N.
lenges in stem cell biology, Nat. Cell Biol., 25, 203-
(2017) Proteasomes in protein homeostasis of pluripo-
206, doi: 10.1038/s41556-023-01087-y.
tent stem cells, Acta Naturae, 9, 39-47, doi: 10.32607/
8. Naujokat, C., and Sarić, T. (2007) Concise review:
20758251-2017-9-3-39-47.
role and function of the ubiquitin-proteasome system
4. Chagastelles, P. C., and Nardi, N. B. (2011) Biology
in mammalian stem and progenitor cells, Stem Cells,
of stem cells: an overview, Kidney Int. Suppl., 1, 63-67,
25, 2408-2418, doi: 10.1634/stemcells.2007-0255.
doi: 10.1038/kisup.2011.15.
9. Okita, Y., and Nakayama, K. I.
(2012) UPS
5. Preston, S. L., Alison, M. R., Forbes, S. J., Direkze,
delivers pluripotency, Cell Stem Cell, 11, 728-730,
N. C., Poulsom, R., and Wright, N. A.
(2003)
doi: 10.1016/j.stem.2012.11.009.
The new stem cell biology: something for everyone,
10. Bax, M., McKenna, J., Do-Ha, D., Stevens, C. H.,
Mol. Pathol., 56, 86-96, doi: 10.1136/mp.56.2.86.
Higginbottom, S., Balez, R., Cabral-da-Silva, M. E. C.,
БИОХИМИЯ том 88 вып. 12 2023
РОЛЬ УБИКВИТИН-ПРОТЕАСОМНОЙ СИСТЕМЫ
2431
Farrawell, N. E., Engel, M., Poronnik, P., Yerbury,
(2016) Numerous proteins with unique characteristics
J. J., Saunders, D. N., and Ooi, L. (2019) The ubiquitin
are degraded by the
26S proteasome following
proteasome system is a key regulator of pluripotent
monoubiquitination, Proc. Natl. Acad. Sci. USA, 113,
stem cell survival and motor neuron differentiation,
E4639-E4647, doi: 10.1073/pnas.1608644113.
Cells, 8, 581, doi: 10.3390/cells8060581.
23.
Collins, G. A., and Goldberg, A. L. (2017) The logic of
11.
Choi, J., and Baek, K. H. (2018) Cellular functions
the 26S proteasome, Cell, 169, 792-806, doi: 10.1016/
of stem cell factors mediated by the ubiquitin-
j.cell.2017.04.023.
proteasome system, Cell. Mol. Life Sci., 75, 1947-1957,
24.
Reits, E., Griekspoor, A., Neijssen, J., Groothuis, T.,
doi: 10.1007/s00018-018-2770-7.
Jalink, K., Van Veelen, P., Janssen, H., Calafat, J.,
12.
Hu, C., Fan, L., Cen, P., Chen, E., Jiang, Z., and
Drijfhout, J. W., and Neefjes, J. (2003) Peptide
Li, L. (2016) Energy metabolism plays a critical role in
diffusion, protection, and degradation in nuclear and
stem cell maintenance and differentiation, Int. J. Mol.
cytoplasmic compartments before antigen presentation
Sci., 17, 253, doi: 10.3390/ijms17020253.
by MHC class I, Immunity, 18, 97-108, doi: 10.1016/
13.
Birket, M. J., Orr, A. L., Gerencser, A. A., Madden,
s1074-7613(02)00511-3.
D. T., Vitelli, C., Swistowski, A., Brand, M. D., and
25.
De Araujo, C. B., Heimann, A. S., Remer, R. A.,
Zeng, X. (2011) A reduction in ATP demand and
Russo, L. C., Colquhoun, A., Forti, F. L., and Ferro,
mitochondrial activity with neural differentiation of
E. S. (2019) Intracellular peptides in cell biology and
human embryonic stem cells, J. Cell. Sci., 124, 348-
pharmacology, Biomolecules, 9, 150, doi: 10.3390/
358, doi: 10.1242/jcs.072272.
biom9040150.
14.
Fillmore, N., Huqi, A., Jaswal, J. S., Mori, J.,
26.
Ramachandran, K. V., and Margolis, S. S. (2017)
Paulin, R., Haromy, A., Onay-Besikci, A., Ionescu, L.,
A mammalian nervous-system-specific plasma mem-
Thébaud, B., Michelakis, E., and Lopaschuk,
brane proteasome complex that modulates neuro-
G. D. (2015) Effect of fatty acids on human bone
nal function, Nat. Struct. Mol. Biol., 24, 419-430,
marrow mesenchymal stem cell energy metabolism
doi: 10.1038/nsmb.3389.
and survival, PLoS One, 10, e0120257, doi: 10.1371/
27.
Finley, D., Chen, X., and Walters, K. J. (2016) Gates,
journal.pone.0120257.
channels, and switches: elements of the protea-
15.
Morozov, A., Astakhova, T., Erokhov, P., and
some machine, Trends Biochem. Sci., 41, 77-93,
Karpov, V. (2022) The ATP/Mg2+ balance affects the
doi: 10.1016/j.tibs.2015.10.009.
degradation of short fluorogenic substrates by the 20S
28.
Humbard, M. A., and Maupin-Furlow, J. A. (2013)
proteasome, Methods Protoc., 5, 15, doi: 10.3390/
Prokaryotic proteasomes: nanocompartments of
mps5010015.
degradation, J. Mol. Microbiol. Biotechnol.,
23,
16.
Dikic, I. (2017) Proteasomal and autophagic degra-
321-334, doi: 10.1159/000351348.
dation systems, Annu. Rev. Biochem., 86, 193-224,
29.
Budenholzer, L., Cheng, C. L., Li, Y., and
doi: 10.1146/annurev-biochem-061516-044908.
Hochstrasser, M. (2017) Proteasome structure and
17.
Cohen-Kaplan, V., Livneh, I., Avni, N., Cohen-
assembly, J. Mol. Biol., 429, 3500-3524, doi: 10.1016/
Rosenzweig, C., and Ciechanover, A. (2016) The ubiq-
j.jmb.2017.05.027.
uitin-proteasome system and autophagy: coordinated
30.
Groll, M., Ditzel, L., Löwe, J., Stock, D., Bochtler, M.,
and independent activities, Int. J. Biochem. Cell Biol.,
Bartunik, H. D., and Huber, R. (1997) Structure
79, 403-418, doi: 10.1016/j.biocel.2016.07.019.
of 20S proteasome from yeast at 2.4 A resolution,
18.
Finley, D., and Varshavsky, A. (1985) The ubiqui-
Nature, 386, 463-471, doi: 10.1038/386463a0.
tin system: functions and mechanisms, Trends Bio-
31.
Glickman, M. H., and Ciechanover, A.
(2002)
chem. Sci.,
10,
343-347, doi:
10.1016/0968-0004
The ubiquitin-proteasome proteolytic pathway: de-
(85)90108-2.
struction for the sake of construction, Physiol. Rev.,
19.
Ciechanover, A., and Kwon, Y. (2015) Degradation
82, 373-428, doi: 10.1152/physrev.00027.2001.
of misfolded proteins in neurodegenerative diseases:
32.
Rousseau, A., and Bertolotti, A. (2018) Regulation
therapeutic targets and strategies, Exp. Mol. Med., 47,
of proteasome assembly and activity in health and
e147, doi: 10.1038/emm.2014.117.
disease, Nat. Rev. Mol. Cell Biol.,
19,
697-712,
20.
Yau, R., and Rape, M.
(2016) The increasing
doi: 10.1038/s41580-018-0040-z.
complexity of the ubiquitin code, Nat. Cell Biol., 18,
33.
Tanaka, K.
(2009) The proteasome: overview of
579-586, doi: 10.1038/ncb3358.
structure and functions, Proc. Jpn. Acad. Ser. B Phys.
21.
Swatek, K. N., and Komander, D. (2016) Ubiquitin
Biol. Sci., 85, 12-36, doi: 10.2183/pjab.85.12.
modifications, Cell Res., 26, 399-422, doi: 10.1038/
34.
Lu, Y., Lee, B. H., King, R. W., Finley, D., and
cr.2016.39.
Kirschner, M. W. (2015) Substrate degradation by
22.
Braten, O., Livneh, I., Ziv, T., Admon, A., Kehat, I.,
the proteasome: a single-molecule kinetic analysis,
Caspi, L. H., Gonen, H., Bercovich, B., Godzik, A.,
Science, 348, 1250834, doi: 10.1126/science.1250834.
Jahandideh, S., Jaroszewski, L., Sommer, T., Kwon,
35.
Liu, C. W., and Jacobson, A. D. (2013) Functions
Y. T., Guharoy, M., Tompa, P., and Ciechanover, A.
of the
19S complex in proteasomal degradation,
БИОХИМИЯ том 88 вып. 12 2023
2432
БУРОВ и др.
Trends Biochem. Sci.,
38,
103-110, doi:
10.1016/
46.
Rodin, A., Morozov, A., Andreeva, N., Funikov, S.,
j.tibs.2012.11.009.
Burov, A., Belyavsky, A., and Karpov, V. (2021) Re-
36.
Blickwedehl, J., Agarwal, M., Seong, C., Pandita,
organization of the proteasome pool in mesenchymal
R. K., Melendy, T., Sung, P., Pandita, T. K., and
stem cellsduring aging in culture. Abstract, FEBS Open
Bangia, N. (2008) Role for proteasome activator
Bio, 11, 345, doi: 10.1002/2211-5463.13205.
PA200 and postglutamyl proteasome activity in
47.
Kniepert, A., and Groettrup, M. (2014) The unique
genomic stability, Proc. Natl. Acad. Sci. USA, 105,
functions of tissue-specific proteasomes, Trends Bio-
16165-16170, doi: 10.1073/pnas.0803145105.
chem. Sci., 39, 17-24, doi: 10.1016/j.tibs.2013.10.004.
37.
Bochmann, I., Ebstein, F., Lehmann, A.,
48.
Murata, S., Sasaki, K., Kishimoto, T., Niwa, S.,
Wohlschlaeger, J., Sixt, S. U., Kloetzel, P. M.,
Hayashi, H., Takahama, Y., and Tanaka, K. (2007)
and Dahlmann, B. (2014) T lymphocytes export
Regulation of CD8+ T cell development by thymus-
proteasomes by way of microparticles: a possible
specific proteasomes, Science,
316,
1349-1353,
mechanism for generation of extracellular proteasomes,
doi: 10.1126/science.1141915.
J. Cell Mol. Med., 18, 59-68, doi: 10.1111/jcmm.12160.
49.
Kincaid, E. Z., Murata, S., Tanaka, K., and Rock,
38.
Morozov, A. V., and Karpov, V. L. (2018) Biological
K. L. (2016) Specialized proteasome subunits have an
consequences of structural and functional proteasome
essential role in the thymic selection of CD8+ T cells,
diversity, Heliyon, 4, e00894, doi: 10.1016/j.heliyon.
Nat Immunol., 17, 938-945, doi: 10.1038/ni.3480.
2018.e00894.
50.
Widjaja, C. E., Olvera, J. G., Metz, P. J., Phan,
39.
Ferrington, D. A., and Gregerson, D. S.
(2012)
A. T., Savas, J. N., de Bruin, G., Leestemaker, Y.,
Immunoproteasomes: structure, function, and antigen
Berkers, C. R., de Jong, A., Florea, B. I., Fisch, K.,
presentation, Prog. Mol. Biol. Transl. Sci., 109, 75-112,
Lopez, J., Kim, S. H., Garcia, D. A., Searles, S., Bui,
doi: 10.1016/B978-0-12-397863-9.00003-1.
J. D., Chang, A. N., Yates, J. R., Goldrath, A. W.,
40.
Kammerl, I. E., and Meiners, S. (2016) Proteasome
Overkleeft, H. S., Ovaa, H., and Chang, J. T. (2017)
function shapes innate and adaptive immune
Proteasome activity regulates CD8+ T lymphocyte
responses, Am. J. Physiol. Lung Cell Mol. Physiol.,
metabolism and fate specification, J. Clin. Invest., 127,
311, L328-L336, doi: 10.1152/ajplung.00156.2016.
3609-3623, doi: 10.1172/JCI90895.
41.
Murata, S., Takahama, Y., Kasahara, M., and
51.
Bikorimana, J. P., El-Hachem, N., El-Kadiry, A. E.,
Tanaka, K. (2018) The immunoproteasome and thy-
Abusarah, J., Salame, N., Shammaa, R., and Rafei, M.
moproteasome: functions, evolution and human
(2021) Thymoproteasome-expressing mesenchymal
disease, Nat. Immunol., 19, 923-931, doi: 10.1038/
stromal cells confer protective anti-tumor immunity via
s41590-018-0186-z.
cross-priming of endogenous dendritic cells, Front. Im-
42.
Kimura, H., Caturegli, P., Takahashi, M., and
munol., 11, 596303, doi: 10.3389/fimmu.2020.596303.
Suzuki, K. (2015) New Insights into the function
52.
Ciechanover, A. (2005) Intracellular protein degra-
of the immunoproteasome in immune and
dation: from a vague idea thru the lysosome and the
nonimmune cells, J. Immunol. Res., 2015, 541984,
ubiquitin-proteasome system and onto human diseases
doi: 10.1155/2015/541984.
and drug targeting, Cell Death Differ., 12, 1178-1190,
43.
Lundh, M., Bugliani, M., Dahlby, T., Chou, D. H.,
doi: 10.1038/sj.cdd.4401692.
Wagner, B., Ghiasi, S. M., De Tata, V., Chen, Z.,
53.
Yamanaka, S. (2012) Induced pluripotent stem cells:
Lund, M. N., Davies, M. J., Marchetti, P., and
past, present, and future, Cell Stem Cell, 10, 678-684,
Mandrup-Poulsen, T. (2017) The immunoproteasome
doi: 10.1016/j.stem.2012.05.005.
is induced by cytokines and regulates apoptosis in hu-
54.
Kim, S. H., Kim, M. O., Cho, Y. Y., Yao, K., Kim,
man islets, J. Endocrinol., 233, 369-379, doi: 10.1530/
D. J., Jeong, C. H., Yu, D. H., Bae, K. B., Cho, E. J.,
JOE-17-0110.
Jung, S. K., Lee, M. H., Chen, H., Kim, J. Y., Bode,
44.
Johnston-Carey, H. K., Pomatto, L. C., and Davies,
A. M., and Dong, Z. (2014) ERK1 phosphorylates
K. J. (2015) The immunoproteasome in oxidative
Nanog to regulate protein stability and stem cell
stress, aging, and disease, Crit. Rev. Biochem. Mol.
self-renewal, Stem Cell Res., 13, 1-11, doi: 10.1016/
Biol.,
51,
268-281, doi:
10.3109/10409238.2016.
j.scr.2014.04.001.
1172554.
55.
Buckley, S. M., Aranda-Orgilles, B., Strikoudis, A.,
45.
Ebstein, F., Textoris-Taube, K., Keller, C., Golnik, R.,
Apostolou, E., Loizou, E., Moran-Crusio, K., Farns-
Vigneron, N., Van den Eynde, B. J., Schuler-
worth, C. L., Koller, A. A., Dasgupta, R., Silva, J. C.,
Thurner, B., Schadendorf, D., Lorenz, F. K., Uckert, W.,
Stadtfeld, M., Hochedlinger, K., Chen, E. I., and
Urban, S., Lehmann, A., Albrecht-Koepke, N.,
Aifantis, I. (2012) Regulation of pluripotency and cellular
Janek, K., Henklein, P., Niewienda, A., Kloetzel,
reprogramming by the ubiquitin-proteasome system, Cell
P. M., and Mishto, M. (2016) Proteasomes generate
Stem Cell, 11, 783-798, doi: 10.1016/j.stem.2012.09.011.
spliced epitopes by two different mechanisms and as
56.
Vilchez, D., Boyer, L., Morantte, I., Lutz, M.,
efficiently as non-spliced epitopes, Sci. Rep., 6, 24032,
Merkwirth, C., Joyce, D., Spencer, B., Page, L.,
doi: 10.1038/srep24032.
Masliah, E., Berggren, W. T., Gage, F. H., and Dillin,
БИОХИМИЯ том 88 вып. 12 2023
РОЛЬ УБИКВИТИН-ПРОТЕАСОМНОЙ СИСТЕМЫ
2433
A. (2012) Increased proteasome activity in human
66.
Kapetanou, M., Chondrogianni, N., Petrakis, S.,
embryonic stem cells is regulated by PSMD11, Nature,
Koliakos, G., and Gonos, E. S. (2017) Proteasome
489, 304-308, doi: 10.1038/nature11468.
activation enhances stemness and lifespan of human
57.
Kitajima, Y., Suzuki, N., Nunomiya, A., Osana, S.,
mesenchymal stem cells, Free Radic. Biol. Med., 103,
Yoshioka, K., Tashiro, Y., Takahashi, R., Ono, Y.,
226-235, doi: 10.1016/j.freeradbiomed.2016.12.035.
Aoki, M., and Nagatomi, R. (2018) The ubiquitin-pro-
67.
Strikoudis, A., Guillamot, M., and Aifantis, I.
teasome system is indispensable for the maintenance
(2014) Regulation of stem cell function by protein
of muscle stem cells, Stem Cell Rep., 11, 1523-1538,
ubiquitylation, EMBO Rep., 15, 365-382, doi: 10.1002/
doi: 10.1016/j.stemcr.2018.10.009.
embr.201338373.
58.
Saez, I., Koyuncu, S., Gutierrez-Garcia, R.,
68.
Rathinam, C., Thien, C. B., Langdon, W. Y., Gu, H.,
Dieterich, C., and Vilchez, D. (2018) Insights into the
and Flavell, R. A. (2008) The E3 ubiquitin ligase c-Cbl
ubiquitin-proteasome system of human embryonic
restricts development and functions of hematopoietic
stem cells, Sci. Rep., 8, 4092, doi: 10.1038/s41598-018-
stem cells, Genes Dev., 22, 992-997, doi: 10.1101/
22384-9.
gad.1651408.
59.
Jin, J., Liu, J., Chen, C., Liu, Z., Jiang, C., Chu, H.,
69.
Han, G., Li, A. G., Liang, Y. Y., Owens, P., He, W.,
Pan, W., Wang, X., Zhang, L., Li, B., Jiang, C., Ge, X.,
Lu, S., Yoshimatsu, Y., Wang, D., Ten Dijke, P.,
Xie, X., and Wang, P. (2016) The deubiquitinase
Lin, X., and Wang, X. J. (2006) Smad7-induced be-
USP21 maintains the stemness of mouse embryonic
ta-catenin degradation alters epidermal appendage
stem cells via stabilization of Nanog, Nat. Commun.,
development, Dev. Cell, 11, 301-312, doi: 10.1016/
7, 13594, doi: 10.1038/ncomms13594.
j.devcel.2006.06.014.
60.
Huang, Z., Wu, Q., Guryanova, O. A., Cheng, L.,
70.
Karpiuk, O., Najafova, Z., Kramer, F., Hennion, M.,
Shou, W., Rich, J. N., and Bao, S. (2011) Deubiqui-
Galonska, C., König, A., Snaidero, N., Vogel, T.,
tylase HAUSP stabilizes REST and promotes mainte-
Shchebet, A., Begus-Nahrmann, Y., Kassem, M.,
nance of neural progenitor cells, Nat. Cell. Biol., 13,
Simons, M., Shcherbata, H., Beissbarth, T., and
142-152, doi: 10.1038/ncb2153.
Johnsen, S. A. (2012) The histone H2B monoubiquiti-
61.
Fuchs, G., Shema, E., Vesterman, R., Kotler, E.,
nation regulatory pathway is required for differentia-
Wolchinsky, Z., Wilder, S., Golomb, L., Pribluda, A.,
tion of multipotent stem cells, Mol. Cell, 46, 705-713,
Zhang, F., Haj-Yahya, M., Feldmesser, E., Brik, A.,
doi: 10.1016/j.molcel.2012.05.022.
Yu, X., Hanna, J., Aberdam, D., Domany, E., and
71.
Shema, E., Tirosh, I., Aylon, Y., Huang, J., Ye, C.,
Oren, M. (2015) RNF20 and USP44 regulate stem
Moskovits, N., Raver-Shapira, N., Minsky, N.,
cell differentiation by modulating H2B monoubiq-
Pirngruber, J., Tarcic, G., Hublarova, P., Moyal, L.,
uitylation, Mol. Cell.,
46,
662-673, doi:
10.1016/
Gana-Weisz, M., Shiloh, Y., Yarden, Y., Johnsen,
j.molcel.2012.05.023.
S. A., Vojtesek, B., Berger, S. L., and Oren, M. (2008)
62.
Sussman, R. T., Stanek, T. J., Esteso, P., Gearhart,
The histone H2B-specific ubiquitin ligase RNF20/
J. D., Knudsen, K. E., and McMahon, S. B. (2013)
hBRE1 acts as a putative tumor suppressor through
The epigenetic modifier ubiquitin-specific protease 22
selective regulation of gene expression, Genes Dev., 22,
(USP22) regulates embryonic stem cell differentiation
2664-2476, doi: 10.1101/gad.1703008.
via transcriptional repression of sex-determining
72.
Hernebring, M., Fredriksson, Å., Liljevald, M.,
region Y-box 2 (SOX2), J. Biol. Chem., 288, 24234-
Cvijovic, M., Norrman, K., Wiseman, J., Semb, H.,
24246, doi: 10.1074/jbc.M113.469783.
and Nyström, T. (2013) Removal of damaged proteins
63.
Raynes, R., Pomatto, L. C., and Davies, K. J.
during ES cell fate specification requires the protea-
(2016) Degradation of oxidized proteins by the
some activator PA28, Sci. Rep., 3, 1381, doi: 10.1038/
proteasome: distinguishing between the 20S, 26S, and
srep01381.
immunoproteasome proteolytic pathways, Mol. Aspects
73.
Balayan, V., and Guddati, A. K. (2022) Tumor dor-
Med., 50, 41-55, doi: 10.1016/j.mam.2016.05.001.
mancy: biologic and therapeutic implications, World J.
64.
Lu, L., Song, H. F., Zhang, W. G., Liu, X. Q.,
Oncol., 13, 8-19, doi: 10.14740/wjon1419.
Zhu, Q., Cheng, X. L., Yang, G. J., Li, A., and Xiao,
74.
Lenos, K. J., and Vermeulen, L. (2016) Cancer
Z. C. (2012) Potential role of 20S proteasome in main-
stem cells don’t waste their time cleaning-low pro-
taining stem cell integrity of human bone marrow stro-
teasome activity, a marker for cancer stem cell func-
mal cells in prolonged culture expansion, Biochem.
tion, Ann. Transl. Med., 4, 519, doi: 10.21037/atm.
Biophys. Res. Commun., 422, 121-127, doi: 10.1016/
2016.11.81.
j.bbrc.2012.04.119.
75.
Voutsadakis, I. A. (2017) Proteasome expression and ac-
65.
Vacanti, V., Kong, E., Suzuki, G., Sato, K., Canty,
tivity in cancer and cancer stem cells, Tumour Biol., 39,
J. M., and Lee, T. (2005) Phenotypic changes of adult
1010428317692248, doi: 10.1177/1010428317692248.
porcine mesenchymal stem cells induced by prolonged
76.
Mossallam, G. I., Fattah, R. A., Bokhary, M.,
passaging in culture, J. Cell. Physiol., 205, 194-201,
Moneer, M., and Mahmoud, H. K. (2021) LMP7
doi: 10.1002/jcp.20376.
polymorphism may modify the presentation and clin-
6
БИОХИМИЯ том 88 вып. 12 2023
2434
БУРОВ и др.
ical impact of minor histocompatibility antigens in
77. Schröter, F., and Adjaye, J. (2014) The proteasome
matched related hematopoietic stem cell transplan-
complex and the maintenance of pluripotency: sustain
tation, Cell Immunol., 364, 104329, doi: 10.1016/
the fate by mopping up? Stem Cell Res. Ther., 5, 24,
j.cellimm.2021.104329.
doi: 10.1186/scrt413.
ROLE OF UBIQUITIN-PROTEASOME SYSTEM
IN STEM CELL BIOLOGY
Review
A. V. Burov, A. A. Rodin, V. L. Karpov, and A. V. Morozov*
Engelhardt Institute of Molecular Biology, Russian Academy of Sciences,
119991 Moscow, Russia; e-mail: runkel@inbox.ru
Selective degradation of cellular proteins by the ubiquitin -proteasome system is one of the key regulatory mechanisms
in eukaryotic cells. Accumulating data indicate that the ubiquitin - proteasome system is involved in the regulation
of fundamental processes in mammalian stem cells, including proliferation, differentiation, cell migration, aging
and programmed cell death. Regulation can be carried out either by proteolytic degradation of key transcription
factors and signaling pathway proteins, or by posttranslational modifications of target proteins with ubiquitin or
other ubiquitin-like modifiers. Studies of the molecular mechanisms of proteostasis maintenance in stem cells are
of great importance for the development of new therapeutic approaches aimed at the treatment of autoimmune and
neurodegenerative diseases, cancer and other socially significant pathologies. This review covers current data on the
function of the ubiquitin-proteasome system in stem cells.
Keywords: stem cells, ubiquitin-proteasome system, proteasome
БИОХИМИЯ том 88 вып. 12 2023