БИОХИМИЯ, 2023, том 88, вып. 2, с. 228 - 242
УДК 577.352.4
ВЛИЯНИЕ АКТИВАТОРА КАЛЬЦИЙ-ЗАВИСИМОГО
К+-КАНАЛА NS1619 НА ФУНКЦИЮ МИТОХОНДРИЙ
В СЕРДЦЕ ДИСТРОФИН-ДЕФИЦИТНЫХ МЫШЕЙ
© 2023 М.В. Дубинин1*, В.С. Старинец2, Ю.А. Челядникова1, Н.В. Белослудцева2,
И.Б. Михеева2, Д.К. Пенкина1, А.Д. Игошкина1, Е.Ю. Таланов2,
И.И. Киреев3, Д.Б. Зоров3, К.Н. Белослудцев1,2
1 ФГБОУ ВО «Марийский государственный университет»,
424000 Республика Марий Эл, Йошкар-Ола; электронная почта: dubinin1989@gmail.com
2 ФГБУН Институт теоретической и экспериментальной биофизики РАН,
192290 Пущино, Московская обл., Россия
3 Московский государственный университет имени М.В. Ломоносова,
НИИ физико-химической биологии имени А.Н. Белозерского, 119991 Москва, Россия
Поступила в редакцию 13.11.2022
После доработки 15.01.2023
Принята к публикации 15.01.2023
Дистрофин-дефицитная врожденная мышечная дистрофия (дистрофия Дюшенна) характеризуется
нарушением ионного гомеостаза, важную роль в котором играют митохондрии. В настоящей работе
на модели дистрофин-дефицитных mdx-мышей выявлено снижение эффективности транспорта
ионов калия и общего содержания этого иона в митохондриях сердца. Оценено влияние на струк-
туру и функцию органелл и состояние сердечной мышцы хронического введения производного
бензимидазола NS1619, являющегося активатором Са2+-активируемого К+-канала большой прово-
димости (mitoBKCa). Показано, что NS1619 способствует улучшению транспорта K+ и увеличению
содержания иона в митохондриях сердца mdx-мышей, однако это не связано с изменением уровня
белка mitoBKCa и экспрессии кодирующего его гена. Действие NS1619 сопровождается снижением
интенсивности окислительного стресса, оцененного по уровню продуктов перекисного окисления
липидов (МДА-продуктов), и нормализацией ультраструктуры митохондрий в сердце mdx-мышей.
Кроме того, нами выявлены положительные изменения в ткани, выражающиеся в снижении уровня
фиброза в сердце дистрофин-дефицитных животных, получавших NS1619. Отмечено, что NS1619
не оказывал существенного влияния на структуру и функцию митохондрий сердца животных «ди-
кого типа». Обсуждаются механизмы влияния NS1619 на функцию митохондрий сердца мышей
в условиях мышечной дистрофии Дюшенна и перспективы применения подхода для коррекции
данной патологии.
КЛЮЧЕВЫЕ СЛОВА: дистрофия Дюшенна, сердце, митохондрии, NS1619, кальций-активируемый
калиевый канал, BKCa.
DOI: 10.31857/S0320972523020045, EDN: QFYBNW
ВВЕДЕНИЕ
ков, крайне редко клинические проявления
обнаруживаются у гетерозиготных девочек [1,
Мышечная дистрофия Дюшенна (МДД) -
2]. Отличительной чертой этого заболевания
наиболее распространенная среди
9 типов
является прогрессирующая мышечная сла-
наследственных мышечных дистрофий. Эта
бость, которая характерна уже для ранних эта-
рецессивная, сцепленная с X-хромосомой,
пов развития патологии. С возрастом разви-
нервно-мышечная патология встречается в
вается дыхательная недостаточность, когнитив-
среднем у 1 из 3500 новорожденных мальчи- ная дисфункция, а также кардиомиопатия [3].
Принятые сокращения: АФК - активные формы кислорода; ДНФ - 2,4-динитрофенол; МДА - малоновый диаль-
дегид; МДД - мышечная дистрофия Дюшенна; мтДНК - митохондриальная ДНК; яДНК - ядерная ДНК; MPT-пора -
переходная пора проницаемости митохондрий; mitoBKCa - митохондриальный, активируемый ионами Ca2+, калиевый
канал.
* Адресат для корреспонденции.
228
NS1619 И МИТОХОНДРИАЛЬНАЯ ДИСФУНКЦИЯ ПРИ МДД
229
Более чем у 90% пациентов мужского пола,
тии миопатий и, в частности, дилатационной
страдающих МДД, в возрасте 18 лет наблюда-
кардиомиопатии различной этиологии
[22-
ются признаки сердечной недостаточности [4],
24], которая характерна также для мышеч-
которая на поздних этапах чаще всего стано-
ной дистрофии Дюшенна. Более того, недав-
вится основной причиной смерти [4-6].
но нами выявлено снижение эффективности
Известно, что мутации в одном из самых
транспорта ионов калия и общего уровня этого
больших и сложно организованных генов чело-
иона в митохондриях скелетных мышц дистро-
века, дистрофине, являются причиной МДД.
фин-дефицитных мышей [25, 26]. Известно,
Кодируемый этим геном одноименный белок
что внутренняя мембрана митохондрий содер-
играет ключевую роль в обеспечении связи ци-
жит целый ряд переносчиков K+ [27]. Более
тоскелета мышечных клеток с внеклеточным
того, согласно последним представлениям,
матриксом, поддерживая структурную целост-
транспорт ионов калия в митохондриях может
ность ткани и ее функциональную активность,
осуществляться с участием АТР-синтазы [28-
и его отсутствие сопровождается прогресси-
30]. Учитывая значительное нарушение функ-
рующей дестабилизацией мышечного волок-
ционирования кальций-зависимых процес-
на [3]. Это проявляется в многочисленных
сов, в настоящей работе мы уделили внимание
вторичных нарушениях и, прежде всего, в раз-
митохондриальному, активируемому ионами
витии окислительного стресса, нарушениях
кальция, калиевому каналу (mitoBKCa), чья
гомеостаза Ca2+ и продукции АТР [7]. Много-
активация обладает кардиопротекторным
численные исследования свидетельствуют о
эффектом и защищает клетки от избыточно-
том, что важную роль в развитии этих про-
го производства АФК и митохондриальной
цессов играет митохондриальная дисфункция.
дисфункции [31]. Действительно, ранее было
Действительно, известно, что при дистрофии
показано, что активация mitoBKCa, вызван-
Дюшенна для митохондрий скелетных мышц
ная производным бензимидазола NS1619,
характерно снижение активности окислительного
защищает клетки сердца при ишемии/ре-
фосфорилирования, гиперпродукция активных
перфузии [32]. В настоящей работе мы оце-
форм кислорода (АФК), а также нарушение
нили влияние этого агента на состояние сер-
способности аккумулировать большое коли-
дечной мускулатуры дистрофин-дефицитных
чество ионов кальция в матриксе вследствие
mdx-мышей и функциональную активность
снижения устойчивости органелл к индукции
митохондрий сердца, включая интенсивность
MPT-поры (переходной поры проницаемости
окислительного фосфорилирования, скорость
митохондрий) и перестроек кальций-транс-
транспорта и уровень ионов калия, устойчи-
портирующих систем [8-14]. Подобные изме-
вость к индукции кальций-зависимой MPT-
нения наблюдаются и в митохондриях серд-
поры, интенсивность окислительного стресса
ца [15-17]. В то же время на ранних этапах
и ультраструктуру органелл. Ранее нами было
развития МДД, когда дисфункция биоэнерге-
показано, что NS1619 улучшает структуру и
тического аппарата скелетных мышц уже ярко
функционирование митохондрий скелетных
выражена, в митохондриях сердца, напротив,
мышц mdx-мышей и смягчает развитие де-
отмечаются адаптационные явления, которые
структивных процессов в ткани [26]. Результа-
проявляются в увеличении эффективности
ты настоящей работы подтверждают положи-
окислительного фосфорилирования и улучше-
тельное влияние этого агента и на сердечную
нии способности транспортировать и удержи-
патологию при МДД.
вать ионы кальция в матриксе органелл [18-21].
Тем не менее это сопровождается гипертрофией
сердца и электрофизиологическими наруше-
МАТЕРИАЛЫ И МЕТОДЫ
ниями [21]. При этом нами было показано, что
модуляция митохондриальной функции с по-
Работа с использованием животных. В ра-
мощью ингибитора MPT-поры алиспоривира
боте использованы 8-недельные дистрофин-
(неиммуносупрессорный аналог циклоспори-
дефицитные мыши линии C57BL/10ScSn-
на А) приводит к некоторому улучшению пока-
Dmdmdx и мыши линии C57BL/10 дикого
зателей функции сердечной мышцы и устране-
типа. Животные были приобретены в НПП
нию гипертрофии [21].
«Питомник лабораторных животных» ФИБХ
Одной из возможных терапевтических ми-
РАН (Пущино). Мыши были разделены
шеней для коррекции митохондриальных дис-
на 4 группы (n = 10 в каждой группе): 1) мыши
функций является гомеостаз ионов калия.
дикого типа (контроль); 2) контроль + NS1619;
Нарушение функционирования К+-каналов
3) mdx-мыши и 4) mdx-мыши, получавшие
митохондрий играет важную роль в разви-
NS1619 (mdx
+ NS1619). NS1619
(5 мг/мл,
БИОХИМИЯ том 88 вып. 2 2023
230
ДУБИНИН и др.
«Sigma-Aldrich», США) растворяли в смеси
ного обеспечения Image Tool 3.0. Для морфо-
этанола и стерильного физиологического рас-
метрического анализа выбирали только такие
твора (7,4 : 92,6 (v/v)) и вводили в объеме 150-
митохондрии, через которые срез проходил
200 мкл (0,5 мг/кг массы тела) на мышь внут-
по их короткой оси. Использовали рутинный
рибрюшинно ежедневно в течение 4 недель.
способ измерения, требующий ручного конту-
Контрольные группы получали инъекции рас-
рирования поперечных сечений митохондрий
творителя в те же сроки и в том же объеме.
по их наружной мембране [33]. Всего для ана-
Гистологическое исследование. Для из-
лиза было отобрано до 200 профилей попереч-
учения степени выраженности гистологи-
ных сечений митохондрий для каждой группы
ческих изменений образцы ткани сердца
животных. Статистический анализ результатов
(по 3 образца в каждой экспериментальной
проводили с помощью стандартного пакета
группе) фиксировали в нейтральном забуфе-
программ GraphPad Prism 7.
ренном 10%-ном формалине и пропитыва-
Выделение митохондрий и оценка функци-
ли в парафине. Парафиновые блоки разре-
ональных параметров. Сразу после извлечения
зали на микротоме МС-2 («Точмедприбор»,
сердца и отбора образцов для вышеуказанных
Украина) на серийные срезы толщиной 5 мкм.
исследований проводили выделение митохон-
Предметные стекла, полученные из каждо-
дрий общепринятым методом дифференциаль-
го образца, окрашивали гематоксилином по
ного центрифугирования, детальная методика
Ван-Гизону (HvG) [26]. Исследования препа-
и состав сред выделения приведены в преды-
ратов проводили с использованием системы
дущих работах [19, 21]. Полученная суспензия
визуализации EVOS M5000 («Thermo Fisher
митохондрий содержала 15-20 мг/мл мито-
Scientific», США). Все гистологические изо-
хондриального белка, концентрацию которо-
бражения были проанализированы с исполь-
го определяли по Бредфорду [34]. Скорость
зованием программного обеспечения ImageJ.
потребления О2 митохондриями оценивали с
Уровень фиброза в сердцах мышей оцени-
помощью респирометра высокого разрешения
вали как процентную долю участков, окра-
Oxygraph-2k («Oroboros Instruments», Австрия)
шенных HvG (розовые), которые содержали
[35]. Среда инкубации содержала 120 мМ KCl,
коллаген и другие элементы соединительной
5 мМ NaH2PO4,
2,5 мМ малата калия,
ткани в общей области ткани на гистологиче-
2,5 мМ глутамата калия и 10 мМ Hepes/KOH
ских предметных стеклах; при этом анализи-
(pH 7,4). Уровень липидных перекисей оцени-
ровали не менее 10 срезов для каждого образца
вали по взаимодействию с тиобарбитуровой
органа.
кислотой [36]. Транспорт К+ в митохондриях
Электронная микроскопия. Для электрон-
определяли по скорости
2,4-динитрофенол
ной микроскопии отбирали кусочки серд-
(ДНФ)-индуцированного выхода К+ из орга-
ца (левый желудочек, два образца в каждой
нелл с помощью К+-селективного электрода,
группе). Образцы фиксировали в течение 2 ч
а общее содержание К+ в митохондриях опре-
в 2,5%-ном растворе глутарового альдегида
делялось путем последующей солюбилизации
в 0,1 М PBS (pH 7,4) и 4 ч - в 2%-ном растворе
0,1%-ным (w/v) Triton X-100 [26]. Среда инку-
тетраокиси осмия, обезвоживали в возрастаю-
бации содержала 180 мМ сахарозы, 70 мМ ман-
щих концентрациях спирта и ацетона и зали-
нита, 5 мМ NaH2PO4, 1 мкг/мл олигомицина и
вали в эпоновую смолу. Из полученных эпо-
10 мМ Tris-HCl (рН 7,4). Концентрация мито-
новых блоков получали ультратонкие срезы
хондриального белка составляла 0,25 мг/мл. По-
(60-70 нм), используя ультрамикротом Leica
глощение Са2+ митохондриями регистрировали
EM UC6 («Leica», Германия), которые впо-
с помощью колориметрического индикатора
следствии контрастировали раствором ура-
арсеназо III и планшетного спектрофотометра
нилацетата и цитратом свинца. Электронно-
Tecan Spark 10M («Tecan», Швейцария) [12].
микроскопическую визуализацию проводили с
Среда инкубации содержала 210 мМ маннита,
помощью электронного микроскопа JEM-1400
70 мМ сахарозы, 1 мМ KH2PO4, 2,5 мМ малата,
(«JEOL», Япония) на базе ЦКП «Субдифрак-
2,5 мМ глутамата, 10 мМ ЭГТА, 50 мкМ арсена-
ционная микроскопия»» НИИ ФХБ имени
зо III и 10 мМ Hepes/KOH (pH 7,4). Суммарное
А.Н. Белозерского МГУ. Для каждой груп-
количество добавленных ионов Са2+ (пульсо-
пы животных фотографировали не менее
вые добавки 5 мкМ CaCl2 каждые 90 c), вызы-
40 непересекающихся полей зрения при уве-
вающее их спонтанное высвобождение из ми-
личении 5000×. В результате получали элек-
тохондрий вследствие индукции MPT-поры,
тронно-микроскопические образцы (файл с
отражало кальциевую емкость органелл.
расширением tif, 2808 × 2264 пикселей, 16 бит),
ПЦР в реальном времени. Уровень экспрес-
которые анализировали с помощью программ-
сии гена, кодирующего mitoBKCa, определяли
БИОХИМИЯ том 88 вып. 2 2023
NS1619 И МИТОХОНДРИАЛЬНАЯ ДИСФУНКЦИЯ ПРИ МДД
231
методом ПЦР в реальном времени с этапом
для количественного определения содержания
обратной транскрипции [26]. Тотальную РНК
белка. Образцы разводили в буфере Лэмм-
получали из 100 мг ткани сердца с помощью ре-
ли («Bio-Rad») с последующим электрофоре-
актива ExtractRNA («Евроген», Россия), соглас-
тическим разделением в 12,5%-ном SDS-ПААГ
но протоколу производителя. ПЦР в реальном
(10 мкг белка на дорожку) и переносом на
времени проводили с помощью амплифика-
нитроцеллюлозную мембрану
(«Amersham»,
тора QuantStudio 1 («Thermo Fisher Scientific»)
Германия). После блокирования обезжирен-
с использованием набора qPCRmix-HS SYBR
ным молоком мембраны инкубировали с со-
(«Евроген»), где в качестве флуоресцентного
ответствующими первичными антителами.
интеркалирующего красителя используется
Использовали поликлональные антитела anti-
SYBR Green II. Выбор и анализ ген-специфич-
KCNMA1 («Thermo Fisher Scientific») и anti-
ных праймеров проводили с использованием
COX IV («Abcam», США). Вторичные антитела
Primer-BLAST [37] (последовательность оли-
были конъюгированы с пероксидазой хрена
гонуклеотидов представлена в табл. 1). Норми-
(«Cell Signaling technology Inc.», США). Актив-
рование проводили относительно гена Rplp2.
ность пероксидазы определяли с помощью хе-
Проводили вычисление параметра 2-ΔCt, где
милюминесцентных реагентов ECL («Pierce»,
значение ΔCt рассчитывали по формуле
США). Относительные уровни обнаруженных
ΔCt = Ct (исследуемый ген) - Ct (Rplp2) [38].
белков визуализировали с помощью системы
Количественная оценка митохондриальной
LI-COR («LI-COR», США) с последующей нор-
ДНК. Тотальную ДНК (ядерную (яДНК) и ми-
мализацией на уровень COX IV. Измерения
тохондриальную (мтДНК)) выделяли из 10 мг
оптической плотности проводили с помощью
ткани сердца с использованием набора ДНК-
программного обеспечения LI-COR Image
Экстран 2 («Синтол», Россия) в соответствии
Studio.
с протоколом производителя. Для проведения
Статистическая обработка. Статистиче-
реакции использовали 1 нг общей ДНК. Оцен-
скую обработку полученных данных выпол-
ку содержания мтДНК в ткани сердца прово-
няли с помощью GraphPad Prism 8.0.1 и одно-
дили методом ПЦР, как описано ранее [39],
факторного дисперсионного анализа (one-way
и выражали как отношение мтДНК/яДНК.
ANOVA). Для последующего сравнения сред-
В анализе оценивали уровни транскрипции
них дисперсионного комплекса использова-
гена ND4, кодируемого митохондриальным ге-
ли тест Tukey. Результаты представляли в виде
номом, и гена GAPDH, кодируемого ядерным
среднего значения
± стандартная ошибка
геномом (последовательность олигонуклео-
среднего.
тидов представлена в табл. 1), что дает воз-
можность оценить отношение количества ко-
пий мтДНК к количеству копий яДНК.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Иммуноблоттинг. Экстракты общего бел-
ка готовили из 10 мг замороженной сердечной
NS1619 улучшает транспорт ионов калия
мышцы. Для недопущения деградации белков
и увеличивает содержания K+ в митохондриях
использовали коктейли ингибиторов проте-
сердца дистрофин-дефицитных мышей. Недав-
аз и фосфатаз («Sigma-Aldrich», США) в кон-
но нами было показано, что в митохондри-
центрациях 100 мкл/мл, а также PMSF (1 мМ),
ях скелетных мышц дистрофин-дефицитных
Na3VO4 (1 мМ), ЭГТА (1 мМ) и ЭДТА (1 мМ).
мышей отмечается снижение эффективности
Белки выделяли с использованием буфера
транспорта ионов калия и общего содержания
RIPA («Millipore», США). Quick Start Bradford
ионов калия в матриксе [25, 26]. В настоящей
Protein Assay («Bio-Rad», США) использовали
работе подобная картина выявлена и в случае
Таблица 1. Список ген-специфичных праймеров
Ген
Forward (5′→3′)
Reverse (5′→3′)
BKCa-DEC
GGTTTACAGATGAGCCGGATA
CATCTTCAACTTCTCTGATTGG
Rplp2
CGGCTCAACAAGGTCATCAGTGA
AGCAGAAACAGCCACAGCCCCAC
Nd4
ATTATTATTACCCGATGAGGGAACC
ATTAAGATGAGGGCAATTAGCAGT
Gapdh
GTGAGGGAGATGCYCAGTGT
CTGGCATTGCTCTCAATGAC
БИОХИМИЯ том 88 вып. 2 2023
232
ДУБИНИН и др.
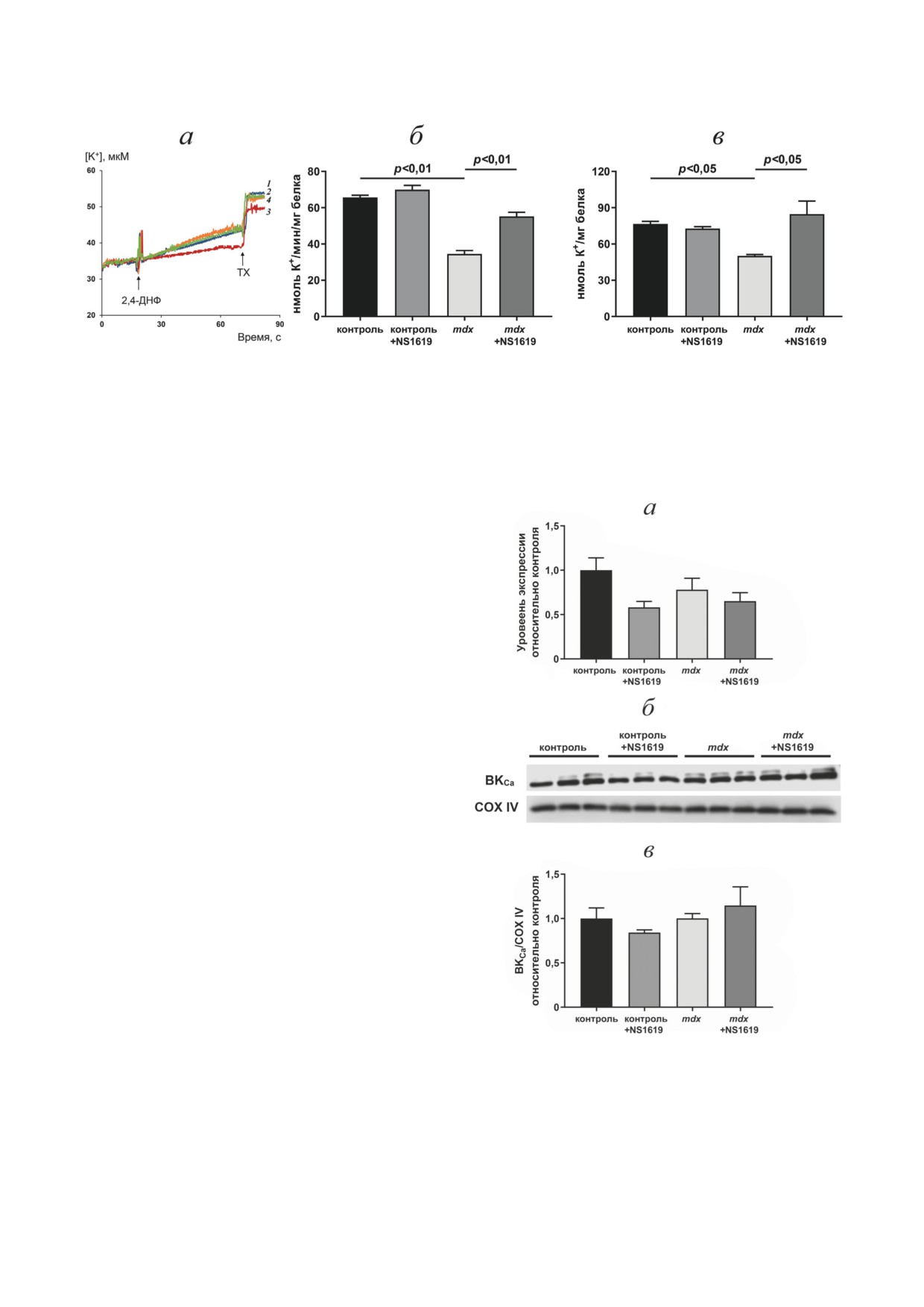
Рис. 1. Влияние NS1619 на скорость транспорта и уровень K+ в митохондриях сердца экспериментальных групп
мышей. а - ДНФ-индуцированный выход К+ из митохондрий сердца мышей группы контроль (кривая
1),
контроль + NS1619 (кривая 2), mdx (кривая 3) и mdx + NS1619 (кривая 4), измеренный при помощи К+-селективно-
го электрода. Представлены данные типичного эксперимента, полученные на одном препарате митохондрий. Анало-
гичные результаты были получены еще в двух независимых экспериментах. Максимальный выход К+ из митохондрий
индуцирован внесением Triton X-100 (ТХ). Скорость ДНФ-индуцированного выхода ионов калия из митохондрий
сердца мышей (б) и общий уровень иона (в). Представлены средние значения ± стандартная ошибка среднего (n = 3)
митохондрий сердца (рис. 1, а). Можно ви-
деть, что в митохондриях, выделенных из серд-
ца mdx-мышей, обнаруживается достоверное
(в 1,9 раза) снижение скорости выхода K+ в
ответ на добавление ДНФ (рис. 1, б) по срав-
нению с митохондриями сердца мышей дико-
го типа. В этом случае общий уровень K+ сни-
жался в 1,5 раза по сравнению с контролем, и
это снижение также было статистически зна-
чимым (рис. 1, в). Мы оценили влияние акти-
ватора mitoBKCa NS1619 на скорость транспор-
та и содержание ионов калия в митохондриях
двух групп мышей. Установлено, что этот агент
не влияет на скорость транспорта и общий
уровень K+ в митохондриях мышей дикого
типа. В то же время в митохондриях сердца
мышей группы mdx + NS1619 наблюдается до-
стоверное увеличение как скорости транспор-
та K+, так и общего уровня этого иона.
NS1619 в микромолярных концентрациях
является активатором mitoBKCa [40]. Мы оце-
нили, связано ли влияние этого агента на ско-
рость транспорта и содержание ионов калия с
изменением уровня mitoBKCa в митохондри-
ях сердца и экспрессии кодирующего его гена.
Известно, что митохондриальный BK-канал в
сердце кодируется сплайс-вариантом (VEDEC)
гена Kcnma1, содержащего информацию о
структуре цитоплазматического BKCa-канала
[41]. Из рис. 2, а видно, что уровень экспрессии
Рис. 2. Влияние NS1619 на уровень mitoBKCa в сердце
гена VEDEC не различается в сердечной муску-
мышей. а - Относительный уровень мРНК BK-VEDEC
латуре mdx-животных и мышей дикого типа,
(кодирует mitoBKCa) в сердце экспериментальных жи-
при этом NS1619 не оказывает влияния на этот
вотных. Представлены средние значения ± стандартная
параметр. Эти результаты подтверждаются дан-
ошибка среднего (n = 6). б - Данные иммуноблоттинга
mitoBKCa и COX IV, полученные на изолированных мито-
ными иммуноблоттинга - уровень mitoBKCa,
хондриях сердца мышей. в - Относительное содержание
оцененный в изолированных митохондриях
mitoBKCa в митохондриях сердца мышей. Представлены
(вследствие наличия BK-каналов цитоплазма-
средние значения ± стандартная ошибка среднего (n = 3)
БИОХИМИЯ том 88 вып. 2 2023
NS1619 И МИТОХОНДРИАЛЬНАЯ ДИСФУНКЦИЯ ПРИ МДД
233
тической и ядерной мембран в гомогенате тка-
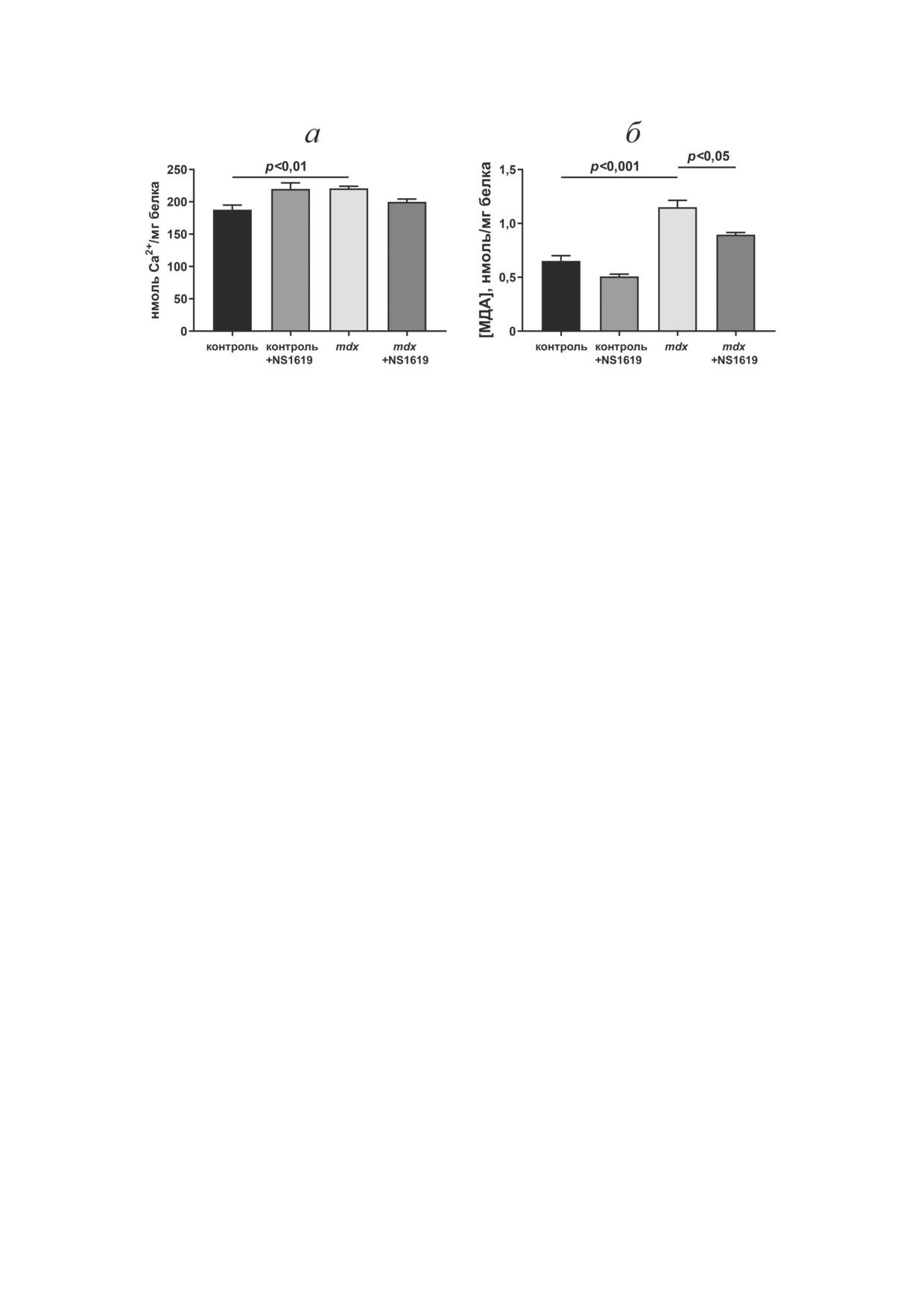
Ранее было показано, что кардиопротек-
ни), также не различается между эксперимен-
торное действие NS1619, обусловленное ак-
тальными группами животных (рис. 2, б и в).
тивацией mitoBKCa, может быть связано с уве-
Таким образом, снижение эффективности
личением устойчивости митохондрий сердца
транспорта K+ и общего уровня иона в мито-
к индукции кальций-зависимой MPT-поры,
хондриях сердца mdx-мышей не связано с изме-
а также снижением интенсивности окисли-
нением уровня mitoBKCa в органеллах; и увели-
тельного стресса [41, 42]. Митохондрии сердца
чение скорости транспорта и уровня этого иона
mdx-мышей обладают большей кальциевой ем-
в митохондриях под действием NS1619 также не
костью, что позволяет сделать вывод о большей
является следствием изменения уровня белка.
устойчивости митохондрий этих животных к
NS1619 не влияет на дыхание митохондрий
открытию MPT-поры (рис. 3, а). Это, как пред-
сердца mdx-мышей и кальциевую емкость, но
положено нами ранее, может способствовать
снижает уровень перекисного окисления липидов.
адаптации тканей сердца к перегрузке ионами
В следующей части работы мы оценили влия-
кальция, наблюдаемой вследствие дисфункции
ние NS1619 на параметры дыхания и окисли-
саркоплазматического ретикулума - основно-
тельного фосфорилирования митохондрий
го депо ионов кальция в кардиомиоцитах [19].
сердца экспериментальных групп мышей. Ранее
С другой стороны, ранее нами была отмече-
нами было показано, что митохондрии серд-
на гиперпродукция АФК и продуктов пере-
ца молодых mdx-мышей возрастом до 12 не-
кисного окисления липидов в митохондриях
дель характеризуются увеличением параметров
сердца дистрофин-дефицитных животных [19,
дыхания и окислительного фосфорилирова-
21]. В настоящей работе мы также выявили
ния [21]. Такая же картина обнаруживается и в
достоверное увеличение продукции одного из
настоящей работе (табл. 2). Можно видеть, что
маркеров окислительного стресса, малоново-
в митохондриях сердца дистрофин-дефицит-
го диальдегида (МДА), в митохондриях серд-
ных животных, окисляющих субстраты ком-
ца mdx-мышей по сравнению с животными
плекса I дыхательной цепи - 2,5 мМ глутамат
дикого типа (рис 3, б). В этом случае в мито-
и 2,5 мМ малат, наблюдается увеличение ско-
хондриях сердца мышей, получавших NS1619,
рости ADP-стимулированного дыхания (со-
наблюдается тенденция к снижению кальцие-
стояние 3) в 1,9 раза, а также максимальной
вой емкости, а в митохондриях контрольных
скорости дыхания в присутствии разобщите-
животных этот показатель, напротив, досто-
ля ДНФ (состояние 3UДНФ) в 1,8 раза по срав-
верно увеличивается. При этом нами выявле-
нению с митохондриями из животных дикого
но достоверное снижение уровня МДА-про-
типа. Это также сопровождается увеличением
дуктов в митохондриях сердца мышей группы
параметров дыхательного контроля и ADP/O
mdx + NS1619, что говорит об антиоксидант-
в 1,3 раза. При этом NS1619 не оказывает влия-
ном влиянии этого агента.
ния на изучаемые параметры дыхания орга-
NS1619 нормализует ультраструктуру мито-
нелл как в группе дистрофин-дефицитных жи-
хондрий сердца mdx-мышей. Известно, что на-
вотных, так и у мышей дикого типа.
рушение функционирования митохондрий при
Таблица 2. Влияние NS1619 на параметры дыхания и окислительного фосфорилирования митохондрий сердца
экспериментальных животных
Состояние 3
Состояние 4
Состояние 3UДНФ
Животные (n = 4)
ДК, отн.ед.
ADP/О, отн.ед.
нмоль O2/мин/мг белка митохондрий
Контроль
41,0 ± 4,4
17,0 ± 2,1
41,2 ± 3,7
2,4 ± 0,1
1,6 ± 0,1
Контроль+NS1619
48,6 ± 4,3
19,0 ± 1,8
41,6 ± 2,6
2,6 ± 0,1
1,8 ± 0,1
mdx
78,2 ± 8,5*
24,3 ± 2,7
72,7 ± 10,4*
3,2 ± 0,1*
2,1 ± 0,1*
mdx + NS1619
75,6 ± 9,9*
23,7 ± 3,5
70,8 ± 8,9*
3,3 ± 0,1*
2,3 ± 0,1*
Примечание. Состав среды инкубации: 120 мМ KCl, 5 мМ NaH2PO4, 10 мМ Hepes/KOH (pH 7,4). В качестве субстра-
та использовали 2,5 мМ глутамат и 2,5 мМ малат. Дыхание митохондрий в состоянии 3 инициировалось добавлением
200 мкМ ADP. Митохондриальное дыхание в состоянии 3UДНФ инициировалось 50 мкМ ДНФ. ДК - дыхательный кон-
троль, оцененный как соотношение дыхания в состояниях 3 и 4. Приведены средние значения ± стандартная ошибка
среднего. * p < 0,05 против контрольных животных.
5
БИОХИМИЯ том 88 вып. 2 2023
234
ДУБИНИН и др.
Рис. 3. Влияние NS1619 на кальциевую емкость, n = 4 (а) и уровень МДА-продуктов, n = 3 (б) в митохондриях сердца
мышей. Представлены средние значения ± стандартная ошибка среднего
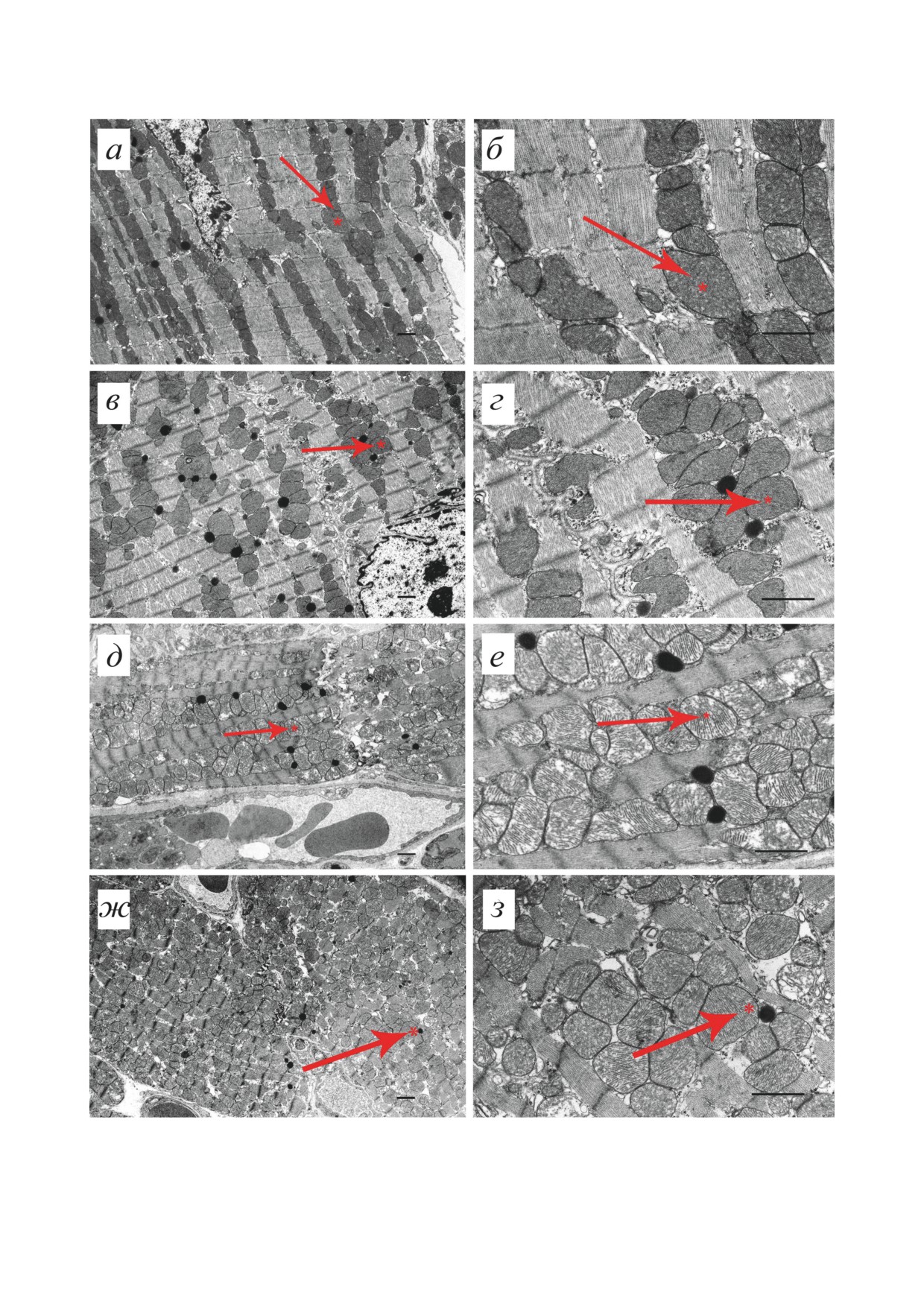
дистрофии Дюшенна также сопровождается
их числа по сравнению с другими группами
изменением их ультраструктуры, что характер-
животных (рис. 5, а). В то же время содержа-
но как для тканей скелетных мышц, так и для
ние мтДНК в сердце не различается между все-
сердца [19, 21]. На рис. 4 представлены мик-
ми экспериментальными группами (рис. 5, в).
рофотографии кардиомиоцитов четырех экс-
Мы также оценили влияние NS1619 на размер
периментальных групп животных при малом
митохондрий сердца мышей (рис. 5, б). Можно
и большом увеличении. В контрольной группе
видеть, что животные контрольной группы и
большая часть митохондрий имела продолго-
мыши mdx не различаются по периметру орга-
ватую или овальную форму. Они были ориен-
нелл. При этом NS1619 оказывает противопо-
тированы вдоль продольной оси клетки и рас-
ложное влияние на этот параметр, увеличивая
полагались между миофибриллами. Основная
его в сердце мышей дикого типа и, напротив,
часть митохондрий имела четко очерченную
снижая в кардиомиоцитах mdx-мышей.
наружную мембрану, электронно-плотный
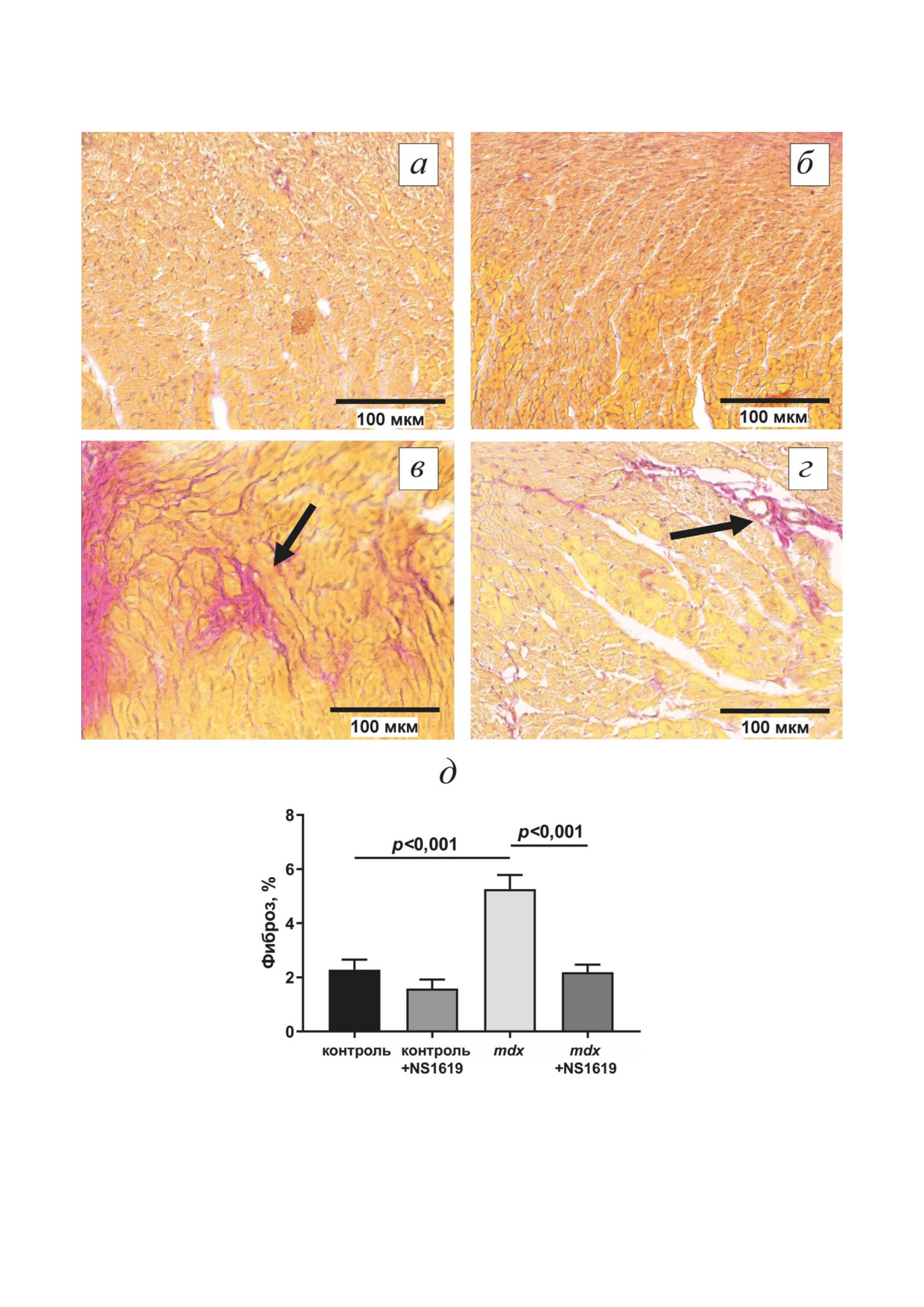
NS1619 снижает уровень фиброза в сердце
матрикс и многочисленные параллельно ори-
mdx-мышей. Известно, что при МДД функци-
ентированные плотно упакованные кристы
ональная мышечная ткань замещается соеди-
(рис. 4, б и рис. П1, а в Приложении). Между
нительной тканью - развивается фиброз, что
собой митохондрии соединялись хорошо вы-
характерно как для скелетной мускулатуры,
раженными межмитохондриальными контакт-
так и для сердца [43]. Действительно, гистоло-
ными структурами. Структура межфибрилляр-
гический анализ по окрашиванию гематокси-
ных митохондриальных компартментов группы
лином по Ван-Гизону показывает (рис. 6), что
контроль + NS1619 была сходна с группой кон-
для сердца mdx-мышей характерно достоверное
троля (рис. 4, г и рис. П1, б в Приложении).
увеличение площади соединительной ткани
В кардиомиоцитах группы mdx обнаруживались
по сравнению с животными дикого типа, что
митохондрии со значительным разнообразием
свидетельствует о более интенсивном разви-
ультраструктурной организации. В этих клетках
тии фиброза. Мы оценили, влияют ли мито-
митохондрии с электронно-плотным матриксом
хондриальные эффекты NS1619 на состояние
отсутствовали. Митохондрии характеризовались
ткани сердца дистрофин-дефицитных мышей.
нерегулярной организацией митохондриаль-
Результаты показывают, что для mdx-мышей,
ных крист и локальными зонами просветлен-
получавших NS1619, характерно достоверное
ного матрикса (рис. 4, е и рис. П1, в в Прило-
снижение площади фиброза до уровня кон-
жении). В области соединения митохондрий
трольных животных (рис. 6). Таким образом
межмитохондриальные контакты были слабо
NS1619 может смягчать развитие патологии,
выражены.
способствуя снижению интенсивности фибро-
В свою очередь, межфибриллярные мито-
за в сердце mdx-мышей.
хондрии в группе mdx + NS1619 имели струк-
туру, приближающуюся к структуре митохон-
дрий контрольной группы (рис. 4, з и рис. П1, г
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
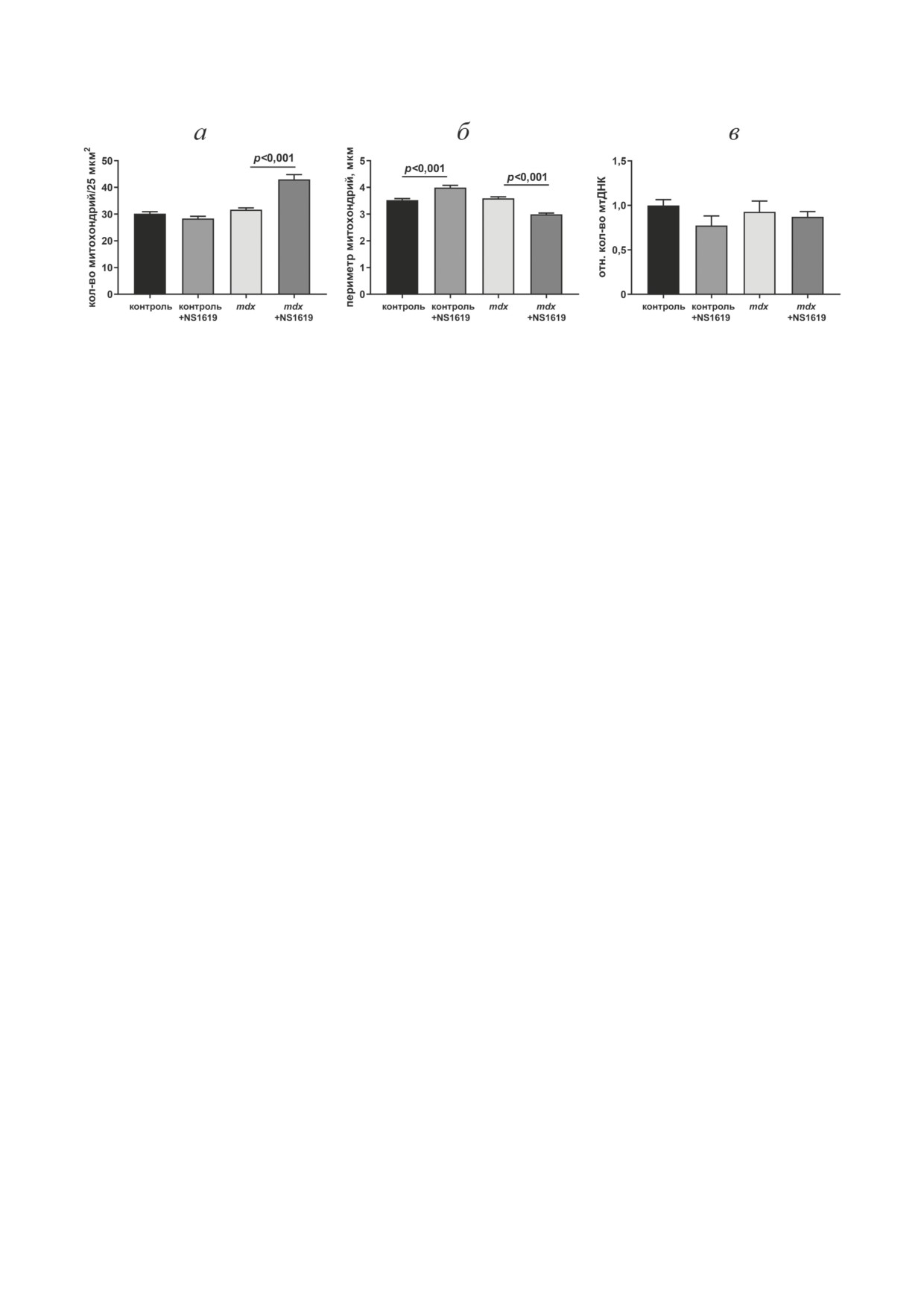
в Приложении). Можно отметить, что количе-
ство митохондрий в исследуемых полях зрения
Мышечная дистрофия Дюшенна является
изменяется лишь в группе mdx + NS1619, в этом
одной из наиболее распространенных нейро-
случае нами отмечено достоверное увеличение
мышечных патологий, которая характеризуется
БИОХИМИЯ том 88 вып. 2 2023
NS1619 И МИТОХОНДРИАЛЬНАЯ ДИСФУНКЦИЯ ПРИ МДД
235
Рис. 4. Типичные электронные микрофотографии (при малом и большом увеличении) митохондриального аппарата
кардиомиоцитов мышей группы контроль (а и б), контроль + NS1619 (в и г), mdx (д и е) и mdx + NS1619 (ж и з). Стрел-
ками отмечена межфибриллярная популяция митохондрий. Звездочкой отмечены одни и те же митохондрии при малом
и большом увеличении. Шкала - 1 мкм
БИОХИМИЯ том 88 вып. 2 2023
5*
236
ДУБИНИН и др.
Рис. 5. Влияние NS1619 на количество митохондрий (а), периметр органелл (б) и уровень мтДНК относительно
яДНК (в) в сердце экспериментальных групп мышей. Количество исследуемых полей зрения в группах - не менее
40 (а и б). Представлены средние значения ± стандартная ошибка среднего (n = 6)
быстро прогрессирующей мышечной слабо-
лительного стресса и деструктивных процес-
стью и истощением вследствие дегенерации
сов в скелетной мускулатуре животных [26].
скелетной мускулатуры и ее замещением со-
Однако встает вопрос: насколько эффективна
единительной тканью. Основными причина-
такая терапия при коррекции сердечной пато-
ми смерти пациентов, страдающих этой па-
логии? Для ответа на него мы оценили влия-
тологией, являются дыхательная и сердечная
ние NS1619 на функционирование и структуру
недостаточность [1-6]. В условиях отсутствия
митохондрий сердца мышей mdx, представляю-
эффективной и безопасной генной терапии, по-
щих собой приближенную патологическую
зволяющей восстановить нормальную экспрес-
модель болезни Дюшенна и состояние органа
сию дистрофина, основное внимание уделяется
в эксперименте in vivo путем сравнения нор-
коррекции вторичных эффектов МДД, прежде
мальных и трансгенных животных в условиях
всего нарушения Ca2+-гомеостаза, ассоцииро-
нормы и коррекции.
ванного с увеличением уровня АФК, характери-
Как показано в настоящей работе, в мито-
зующих наличие окислительного стресса, а так-
хондриях сердца mdx-мышей, так же как в
же хронического воспаления и фиброза [7].
митохондриях скелетных мышц, наблюдается
В качестве одной из мишеней для тера-
достоверное снижение скорости транспорта
пии МДД рассматриваются митохондрии. Это
и содержания K+ в матриксе (рис. 1), а при-
неудивительно, так как развитие патологии
менение NS1619 приводит к улучшению этих
скелетных мышц сопровождается существен-
параметров в митохондриях. При этом такое
ным нарушением структуры и функции этих
изменение не связано с изменением уровня
органелл, в том числе регуляции ионного го-
белка mitoBKCa и/или экспрессии гена, коди-
меостаза [8-14]. Показано, что нормализация
рующего этот белок (рис. 2). Это позволяет
гомеостаза Са2+ в митохондриях скелетных
предположить, что наблюдаемые изменения ми-
мышц дистрофин-дефицитных mdx-мышей пу-
тохондриального гомеостаза K+ в кардиомио-
тем увеличения кальциевой емкости и вос-
цитах mdx-мышей могут быть обусловлены
становления чувствительности к индукции
изменением активности имеющихся белковых
кальций-зависимой MPT-поры способствует
субъединиц mitoBKCa или же влиянием это-
смягчению деструктивных процессов в ске-
го агента на другие переносчики ионов калия
летной мускулатуре животных [10, 44, 45].
во внутренней митохондриальной мембране,
Подобная картина выявлена нами недавно и
что мы не можем исключать. Интересно, что
в случае митохондриального гомеостаза ионов
в случае скелетных мышц mdx-мышей ранее
калия. Было установлено, что митохондрии
нами выявлено снижение экспрессии гена,
скелетных мышц mdx-мышей характеризуют-
кодирующего mitoBKCa, которое устраня-
ся снижением эффективности транспорта K+
лось NS1619 [26]. Это указывает на выражен-
через внутреннюю мембрану органелл, а так-
ное развитие патологии на уровне скелетных
же снижением общего содержания иона [25,
мышц mdx-мышей, которое отражает измене-
26]. В этом случае применение активато-
ния на генном уровне.
ра mitoBKCa NS1619 способствовало норма-
Интересно отметить, что, несмотря на
лизации этих параметров, и такой эффект
снижение скорости транспорта и содержа-
сопровождался улучшением ультраструктуры
ния K+, в митохондриях сердца mdx-мышей
органелл, снижением интенсивности окис-
нами вновь отмечено ускорение дыхания и
БИОХИМИЯ том 88 вып. 2 2023
NS1619 И МИТОХОНДРИАЛЬНАЯ ДИСФУНКЦИЯ ПРИ МДД
237
Рис. 6. Типичные гистологические изображения ткани сердца (для сравнения представлены участки левого желудочка)
мышей группы контроль (а), контроль + NS1619 (б), mdx (в) и mdx + NS1619 (г). Отдельные участки соединительной
ткани розового цвета отмечены стрелкой. На панели д представлены количественные данные, демонстрирующие уро-
вень фиброза в сердце экспериментальных групп мышей, который оценивали, как процентное отношение площади
окрашивания гематоксилином по Ван-Гизону к общей площади ткани, при этом для каждого образца анализировали
не менее 10 срезов. Представлены средние значения ± стандартная ошибка среднего
БИОХИМИЯ том 88 вып. 2 2023
238
ДУБИНИН и др.
окислительного синтеза АТР по сравнению с
фрагментации и окислительного стресса, в
митохондриями контрольных животных (табл. 2),
данных условиях сопровождается уменьшени-
что наблюдалось и в предыдущих работах [19,
ем выраженности окислительного стресса, ас-
21]. Это также сопровождается увеличением
социированного с фрагментацией.
способности митохондрий сердца транспорти-
В предыдущей работе мы показали, что
ровать и удерживать ионы кальция в матрик-
в целом благоприятное влияние NS1619 на
се органелл (рис. 3, а). Ранее нами и другими
структуру и функцию митохондриального
коллективами было показано, что такая кар-
аппарата скелетных мышц mdx-мышей спо-
тина может маскировать дисфункцию био-
собствует снижению интенсивности дегене-
энергетического аппарата кардиомиоцитов
ративных процессов в скелетной мускула-
при развитии мышечной дистрофии [17-21].
туре и уровня фиброза [26]. Можно видеть,
При этом можно видеть, что в условиях in vivo
что в случае сердечной мышцы дистрофин-
NS1619 не влияет на параметры дыхания и
дефицитных мышей также наблюдается до-
окислительного фосфорилирования, а также
стоверное увеличение площади, занимаемой
кальциевую емкость митохондрий сердца обе-
соединительной тканью, по сравнению со
их групп мышей.
здоровыми животными (рис. 6), однако раз-
Известно, что улучшение калиевого го-
личия не столь выражены, как в случае ске-
меостаза митохондрий, в том числе путем ак-
летных мышц, что в целом соответствует дан-
тивации mitoBKCa, способствует снижению
ным литературы [47] и подтверждает тезис об
продукции АФК митохондриями и снижает
отстроченном развитии деструктивных яв-
интенсивность окислительного стресса
[31].
лений в тканях сердца. Тем не менее и в этом
Важно отметить, что такие эффекты описа-
случае действие NS1619 сопровождается до-
ны для активатора mitoBKCa NS1619, и они,
стоверным снижением уровня фиброза в серд-
как предполагается, лежат в основе известно-
це mdx-мышей до уровня животных дикого
го кардиопротекторного действия этого агента
типа (рис. 6).
и достигаются уже при однократном введении
Таким образом, полученные в настоящей
препарата [32, 46]. Недавно нами показано, что
работе результаты свидетельствуют о том, что
хроническое введение NS1619 приводит к сни-
активатор mitoBKCa NS1619, наряду с облег-
жению уровня АФК в митохондриях скелетных
чением патологии скелетных мышц дистро-
мышц дистрофин-дефицитных мышей
[26].
фин-дефицитных mdx-мышей, также спо-
В настоящей работе мы выяснили, что такой
собствует улучшению состояния сердечной
эффект наблюдается и в случае митохондрий
мышцы. Это, по всей видимости, также обу-
сердца - уровень МДА, одного из маркеров
словлено активацией транспорта ионов калия
окислительного стресса, повышенный при
в митохондриях сердца, что ведет к снижению
дистрофии Дюшенна, достоверно снижается в
продукции АФК органеллами и улучшению
митохондриях сердца дистрофин-дефицитных
их ультраструктуры. Важно отметить практи-
животных, получавших NS1619 (рис. 3, б).
чески полное отсутствие влияния NS1619 на
Наряду с улучшением митохондриаль-
структуру и функцию митохондрий сердца жи-
ного гомеостаза K+ и снижением уровня про-
вотных дикого типа, что может свидетельство-
дуктов перекисного окисления, что можно
вать об отсутствии серьезных побочных эф-
интерпретировать как снижение уровня окис-
фектов такой терапии. Наряду с этим, следует
лительного стресса, применение NS1619 так-
понимать, что эффекты NS1619 могут быть
же сопровождается тенденцией к улучшению
обусловлены также его влиянием на BK-кана-
ультраструктуры органелл mdx-животных, о
лы, расположенные в ядерной и цитоплазма-
чем свидетельствуют данные электронной
тической мембране [31], которые имеют схо-
микроскопии сердечной мускулатуры (рис. 4
жие биофизические свойства и роль которых
и рис. П1 в Приложении). Положительное
в развитии патологий, включая дистрофию
влияние этого агента на структуру митохон-
Дюшенна, только предстоит исследовать. Кро-
дрий отмечено нами ранее и в случае патоло-
ме того, важной задачей является выяснение
гии скелетных мышц [26]. В сердечной ткани
влияния этого агента на функциональные па-
mdx-мышей действие NS1619 также сопровож-
раметры работы сердца при МДД, что позво-
далось достоверным увеличением количества
лит подтвердить перспективность его приме-
митохондрий и снижением периметра орга-
нения для коррекции кардиомиопатии.
нелл (рис. 5). Это можно трактовать как не-
каноническое увеличение митохондриальной
Вклад авторов. М.В. Дубинин и К.Н. Бе-
фрагментации, которое, в отличие от показан-
лослудцев - концепция и руководство рабо-
ных ранее случаев положительной ассоциации
той; М.В. Дубинин, В.С. Старинец, Ю.А. Че-
БИОХИМИЯ том 88 вып. 2 2023
NS1619 И МИТОХОНДРИАЛЬНАЯ ДИСФУНКЦИЯ ПРИ МДД
239
лядникова, Н.В. Белослудцева, И.Б. Михеева,
ракционная микроскопия» НИИ ФХБ имени
Д.К. Пенкина, А.Д. Игошкина, Е.Ю. Таланов,
А.Н. Белозерского МГУ
И.И. Киреев - проведение экспериментов;
Конфликт интересов. Авторы заявляют об
М.В. Дубинин, К.Н. Белослудцев, Д.Б. Зоров -
отсутствии конфликта интересов.
обсуждение результатов исследования; М.В. Ду-
Соблюдение этических норм. Работу с ла-
бинин - написание текста; М.В. Дубинин,
бораторными животными выполняли в соот-
К.Н. Белослудцев, Д.Б. Зоров - редактирова-
ветствии с Европейской конвенцией о защите
ние текста статьи.
позвоночных животных (Страсбург, 1986) и с
Финансирование. Работа выполнена при
принципами Хельсинкской декларации (2000).
поддержке Российского научного фонда (грант
Все протоколы были одобрены Комиссией
№ 20-75-10006).
по биологической безопасности и биоэтике
Благодарности.
Электронная микро-
МарГУ (протокол № 1/2021 от 18.10.2021).
скопия образцов выполнена при поддерж-
Дополнительные материалы. Приложение к
ке Программы развития МГУ (ПНР 5.13) и
статье опубликовано на сайте журнала «Био-
Центра коллективного пользования «Субдиф-
СПИСОК ЛИТЕРАТУРЫ
1.
Emery, A. E.
(1991) Population frequencies of
9.
Vila, M. C., Rayavarapu, S., Hogarth, M., van der
inherited neuromuscular diseases - A world survey,
Meulen, J. H., Horn, A., Defour, A., Takeda, S.,
Neuromuscul. Disord., 1, 19-29, doi: 10.1016/0960-
Brown, K. J., Hathout, Y., Nagaraju, K., and Jaiswal, J. K.
8966(91)90039-u.
(2017) Mitochondria mediate cell membrane repair
2.
Mavrogeni, S., Markousis-Mavrogenis, G., Papa-
and contribute to Duchenne muscular dystrophy, Cell
vasiliou, A., and Kolovou, G.
(2015) Cardiac
Death Differ., 24, 330-342, doi: 10.1038/cdd.2016.127.
involvement in Duchenne and Becker muscular
10.
Schiavone, M., Zulian, A., Menazza, S., Petronilli,
dystrophy, World J. Cardiol., 7, 410-414, doi: 10.4330/
V., Argenton, F., Merlini, L., Sabatelli, P., and Ber-
wjc.v7.i7.410.
nardi, P. (2017) Alisporivir rescues defective mito-
3.
Ignatieva, E., Smolina, N., Kostareva, A., and
chondrial respiration in Duchenne muscular dys-
Dmitrieva, R. (2021) Skeletal muscle mitochondria
trophy, Pharmacol. Res., 125, 122-131, doi: 10.1016/
dysfunction in genetic neuromuscular disorders
j.phrs.2017.09.001.
with cardiac phenotype, Int. J. Mol. Sci., 22, 7349,
11.
Hughes, M. C., Ramos, S. V., Turnbull, P. C.,
doi: 10.3390/ijms22147349.
Rebalka, I. A., Cao, A., Monaco, C. M., Varah, N. E.,
4.
Kamdar, F., and Garry, D. J. (2016) Dystrophin-
Edgett, B. A., Huber, J. S., Tadi, P., Delfinis, L. J.,
deficient cardiomyopathy, J. Am. Coll. Cardiol.,
Schlattner, U., Simpson, J. A., Hawke, T. J., and
67, 2533-2546, doi: 10.1016/j.jacc.2016.02.081.
Perry, C. G. R. (2019) Early myopathy in Duchenne
5.
D’Amario, D., Amodeo, A., Adorisio, R., Tiziano,
muscular dystrophy is associated with elevated
F. D., Leone, A. M., Perri, G., Bruno, P., Massetti, M.,
mitochondrial H2O2 emission during impaired
Ferlini, A., Pane, M., Niccoli, G., Porto, I., D’Angelo,
oxidative phosphorylation, J. Cachexia Sarcopenia
G. A., Borovac, J. A., Mercuri, E., and Crea, F. (2017)
Muscle, 10, 643-661, doi: 10.1002/jcsm.12405.
A current approach to heart failure in Duchenne mus-
12.
Dubinin, M. V., Talanov, E. Y., Tenkov, K. S.,
cular dystrophy, Heart, 103, 1770-1779, doi: 10.1136/
Starinets, V. S., Mikheeva, I. B., Sharapov, M. G.,
heartjnl-2017-311269.
and Belosludtsev, K. N. (2020) Duchenne muscular
6.
Ware, S. M. (2017) Genetics of paediatric cardiomyop-
dystrophy is associated with the inhibition of calcium
athies, Curr. Opin. Pediatr., 29, 534-540, doi: 10.1097/
uniport in mitochondria and an increased sensitivity
MOP.0000000000000533.
of the organelles to the calcium-induced permeability
7.
Angelini, G., Mura, G., and Messina, G.
(2022)
transition, Biochim. Biophys. Acta Mol. Basis Dis.,
Therapeutic approaches to preserve the musculature
1866, 165674, doi: 10.1016/j.bbadis.2020.165674.
in Duchenne muscular dystrophy: The importance of
13.
Dubinin, M. V., Talanov, E. Y., Tenkov, K. S.,
the secondary therapies, Exp. Cell Res., 410, 112968,
Starinets, V. S., Belosludtseva, N. V., and Beloslud-
doi: 10.1016/j.yexcr.2021.112968.
tsev, K. N. (2020) The effect of deflazacort treatment
8.
Rybalka, E., Timpani, C., Cooke, M. B., Williams, A.,
on the functioning of skeletal muscle mitochondria in
and Hayes, A. (2014) Defects in mitochondrial ATP
Duchenne muscular dystrophy, Int. J. Mol. Sci., 21,
synthesis in dystrophin-deficient mdx skeletal muscles
8763, doi: 10.3390/ijms21228763.
may be caused by complex I insufficiency, PLoS One,
14.
Mareedu, S., Million, E. D., Duan, D., and
9, e115763, doi: 10.1371/journal.pone.0115763.
Babu, G. J. (2021) Abnormal calcium handling in
БИОХИМИЯ том 88 вып. 2 2023
240
ДУБИНИН и др.
Duchenne muscular dystrophy: mechanisms and
23.
Farid,T.A.,Nair,K.,Massé, S.,Azam,M.A.,Maguy,A.,
potential therapies, Front. Physiol.,
12,
647010,
Lai, R. F., Umapathy, K., Dorian, P., Chauhan, V.,
doi: 10.3389/fphys.2021.647010.
Varró, A., Al-Hesayen, A., Waxman, M., Nattel, S.,
15.
Zhang, W., ten Hove, M., Schneider, J. E., Stuck-
and Nanthakumar, K. (2011) Role of KATP channels
ey, D. J., Sebag-Montefiore, L., Bia, B. L., Radda, G. K.,
in the maintenance of ventricular fibrillation in
Davies, K. E., Neubauer, S., and Clarke, K. (2008)
cardiomyopathic human hearts, Circ. Res., 109, 1309-
Abnormal cardiac morphology, function and energy
1318, doi: 10.1161/CIRCRESAHA.110.232918.
metabolism in the dystrophic mdx mouse: An MRI
24.
Graciotti, L., Becker, J., Granata, A. L., Procopio, A. D.,
and MRS study, J. Mol. Cell. Cardiol., 45, 754-760,
Tessarollo, L., and Fulgenzi, G. (2011) Dystrophin
doi: 10.1016/j.yjmcc.2008.09.125.
is required for the normal function of the cardio-
16.
Kyrychenko, V., Poláková, E., Janíček, R., and
protective K(ATP) channel in cardiomyocytes, PLoS
Shirokova, N.
(2015) Mitochondrial dysfunctions
One, 6, e27034, doi: 10.1371/journal.pone.0027034.
during progression of dystrophic cardiomyopathy, Cell
25.
Dubinin, M. V., Starinets, V. S., Belosludtseva, N. V.,
Calcium, 58, 186-195, doi: 10.1016/j.ceca.2015.04.006.
Mikheeva, I. B., Chelyadnikova, Y. A., Penkina, D. K.,
17.
Willi, L., Abramovich, I., Fernandez-Garcia, J.,
Vedernikov, A. A., and Belosludtsev, K. N. (2022)
Agranovich, B., Shulman, M., Milman, H., Baskin, P.,
The effect of uridine on the state of skeletal muscles
Eisen, B., Michele, D. E., Arad, M., Binah, O., and
and the functioning of mitochondria in Duchenne
Gottlieb, E. (2022) Bioenergetic and metabolic im-
dystrophy, Int. J. Mol. Sci., 23, 10660, doi: 10.3390/
pairments in induced pluripotent stem cell-derived
ijms231810660.
cardiomyocytes generated from Duchenne muscu-
26.
Dubinin, M. V., Starinets, V. S., Belosludtseva, N. V.,
lar dystrophy patients, Int. J. Mol. Sci., 23, 9808,
Mikheeva, I. B., Chelyadnikova, Y. A., Igoshkina, A. D.,
doi: 10.3390/ijms23179808.
Vafina, A. B., Vedernikov, A. A., and Belosludtsev, K. N.
18.
Ascah, A., Khairallah, M., Daussin, F., Bourcier-
(2022) BKCa activator NS1619 improves the struc-
Lucas, C., Godin, R., Allen, B. G., Petrof, B. J.,
ture and function of skeletal muscle mitochondria
Rosiers, C. D., Burelle, Y. (2011) Stress-induced
in Duchenne dystrophy, Pharmaceutics, 14, 2336,
opening of the permeability transition pore in the dys-
doi: 10.3390/ijms231810660.
trophin-deficient heart is attenuated by acute treatment
27.
Checchetto, V., Leanza, L., De Stefani, D., Rizzuto, R.,
with sildenafil, Am. J. Physiol. Heart Circ. Physiol.,
Gulbins, E., and Szabo, I. (2021) Mitochondrial K+
300, H144-H153, doi: 10.1152/ajpheart.00522.2010.
channels and their implications for disease mecha-
19.
Dubinin, M. V., Talanov, E. Y., Tenkov, K. S., Stari-
nisms, Pharmacol. Ther., 227, 107874, doi: 10.1016/
nets, V. S., Mikheeva, I. B., and Belosludtsev, K. N.
j.pharmthera.2021.107874.
(2020) Transport of Ca2+ and Ca2+-dependent perme-
28.
Zorov, D. B. (2022) A window to the potassium
ability transition in heart mitochondria in the early
world. The evidence of potassium energetics in the
stages of Duchenne muscular dystrophy, Biochim.
mitochondria and identity of the mitochondrial ATP-
Biophys. Acta Bioenerg., 1861, 148250, doi: 10.1016/
dependent K+ channel, Biochemistry (Moscow), 87,
j.bbabio.2020.148250.
683-688, doi: 10.1134/S0006297922080016.
20.
Angebault, C., Panel, M., Lacôte, M., Rieusset, J.,
29.
Juhaszova, M., Kobrinsky, E., Zorov, D. B., Nuss, H. B.,
Lacampagne, A., and Fauconnier, J. (2021) Met-
Yaniv, Y., Fishbein, K. W., de Cabo, R., Montoliu, L.,
formin reverses the enhanced myocardial SR/ER-
Gabelli, S. B., Aon, M. A., Cortassa, S., and Sollott, S. J.
mitochondria interaction and impaired complex I-driv-
(2021) ATP Synthase K+- and H+-fluxes drive ATP
en respiration in dystrophin-deficient mice, Front. Cell
synthesis and enable mitochondrial K+-“Uniporter”
Dev. Biol., 8, 609493, doi: 10.3389/fcell.2020.609493.
function: I. Characterization of ion fluxes, Function
21.
Dubinin, M. V., Starinets, V. S., Talanov, E. Y.,
(Oxf), 3, zqab065, doi: 10.1093/function/zqab065.
Mikheeva, I. B., Belosludtseva, N. V., Serov, D. A.,
30.
Juhaszova, M., Kobrinsky, E., Zorov, D. B., Nuss, H. B.,
Tenkov, K. S., Belosludtseva, E. V., and Beloslud-
Yaniv, Y., Fishbein, K. W., de Cabo, R., Montoliu, L.,
tsev, K. N. (2021) Effect of the non-immunosup-
Gabelli, S. B., Aon, M. A., Cortassa, S., and Sollott, S. J.
pressive MPT pore inhibitor alisporivir on the func-
(2022) ATP synthase K+- and H+-fluxes drive ATP syn-
tioning of heart mitochondria in dystrophin-defi-
thesis and enable mitochondrial K+-“Uniporter” func-
cient mdx mice, Biomedicines, 9, 1232, doi: 10.3390/
tion: II. Ion and ATP synthase flux regulation, Function
biomedicines9091232.
(Oxf), 3, zqac001, doi: 10.1093/function/zqac001.
22.
Bienengraeber, M., Olson, T. M., Selivanov, V. A.,
31.
González-Sanabria, N., Echeverría, F., Segura, I.,
Kathmann, E. C., O’Cochlain, F., Gao, F., Karger, A. B.,
Alvarado-Sánchez, R., and Latorre, R. (2021) BK
Ballew, J. D., Hodgson, D. M., Zingman, L. V.,
in double-membrane organelles: A biophysical,
Pang, Y. P., Alekseev, A. E., and Terzic, A. (2004)
pharmacological, and functional survey, Front.
ABCC9 mutations identified in human dilated
Physiol., 12, 761474, doi: 10.3389/fphys.2021.761474.
cardiomyopathy disrupt catalytic KATP channel
32.
Wang, X., Yin, C., Xi, L., and Kukreja, R. C. (2004)
gating, Nat. Genet., 36, 382-387, doi: 10.1038/ng1329.
Opening of Ca2+-activated K+ channels triggers
БИОХИМИЯ том 88 вып. 2 2023
NS1619 И МИТОХОНДРИАЛЬНАЯ ДИСФУНКЦИЯ ПРИ МДД
241
early and delayed preconditioning against I/R injury
40.
Szewczyk, A., Skalska, J., Głąb, M., Kulawiak, B.,
independent of NOS in mice, Am. J. Physiol. Heart
Malińska, D., Koszela-Piotrowska, I., and Kunz, W. S.
Circ. Physiol.,
287, H2070-H2077, doi:
10.1152/
(2006) Mitochondrial potassium channels: from
ajpheart.00431.2004.
pharmacology to function, Biochim. Biophys. Acta,
33.
Lam, J., Katti, P., Biete, M., Mungai, M.,
1757, 715-720, doi: 10.1016/j.bbabio.2006.05.002.
AshShareef, S., Neikirk, K., Garza Lopez, E., Vue, Z.,
41.
Singh, H., Rong, L., Bopassa, J., Meredith, A.,
Christensen, T. A., Beasley, H. K., Rodman, T. A.,
Stefani, E., and Toro, L. (2013) MitoBK-Ca is encoded
Murray, S. A., Salisbury, J. L., Glancy, B., Shao, J.,
by the KCNMA1 gene, and a splicing sequence defines
Pereira, R. O., Abel, E. D., and Hinton, A. (2021)
its mitochondrial location, Proc. Natl. Acad. Sci. USA,
A universal approach to analyzing transmission
110, 10836-10841, doi: 10.1073/pnas.1302028110.
electron microscopy with ImageJ, Cells, 10, 2177,
42.
Heinen, A., Aldakkak, M., Stowe, D. F., Rhodes, S. S.,
doi: 10.3390/cells10092177.
Riess, M. L., Varadarajan, S. G., and Camara, A. K.
34.
Bradford, M. M.
(1976) A rapid and sensitive
(2007) Reverse electron flow-induced ROS production
method for the quantitation of microgram quantities
is attenuated by activation of mitochondrial Ca2+-sen-
of protein utilizing the principle of protein-dye
sitive K+ channels, Am. J. Physiol. Heart Circ. Physiol.,
binding, Anal. Biochem., 72, 248-254, doi: 10.1006/
293, H1400-H1407, doi: 10.1152/ajpheart.00198.2007.
abio.1976.9999.
43.
Kharraz, Y., Guerra, J., Pessina, P., Serrano, A. L., and
35.
Dubinin, M. V., Semenova, A. A., Ilzorkina, A. I.,
Muñoz-Cánoves, P. (2014) Understanding the process
Markelova, N. Y., Penkov, N. V., Shakurova, E. R.,
of fibrosis in Duchenne muscular dystrophy, Biomed.
Belosludtsev, K. N., and Parfenova, L. V. (2021) New
Res. Int., 2014, 965631, doi: 10.1155/2014/965631.
quaternized pyridinium derivatives of betulin: Syn-
44.
Wissing, E. R., Millay, D. P., Vuagniaux, G., and
thesis and evaluation of membranotropic properties
Molkentin, J. D. (2010) Debio-025 is more effective
on liposomes, pro- and eukaryotic cells, and isolat-
than prednisone in reducing muscular pathology
ed mitochondria, Chem. Biol. Interact., 349, 109678,
in mdx mice, Neuromuscul. Disord., 20, 753-760,
doi: 10.1016/j.cbi.2021.109678.
doi: 10.1016/j.nmd.2010.06.016.
36.
Belosludtseva, N. V., Starinets, V. S., Pavlik, L. L.,
45.
Dubinin, M. V., Starinets, V. S., Talanov, E. Y.,
Mikheeva, I. B., Dubinin, M. V., and Beloslud-
Mikheeva, I. B., Belosludtseva, N. V., and Belosludt-
tsev, K. N. (2020) The effect of S-15176 difumarate salt
sev, K. N. (2021) Alisporivir Improves mitochondrial
on ultrastructure and functions of liver mitochondria
function in skeletal muscle of mdx mice but suppresses
of C57BL/6 mice with streptozotocin/high-fat diet-
mitochondrial dynamics and biogenesis, Int. J. Mol.
induced type 2 diabetes, Biology, 9, 309, doi: 10.3390/
Sci., 22, 9780, doi: 10.3390/ijms22189780.
biology9100309.
46.
Dai, H., Wang, M., Patel, P. N., Kalogeris, T., Liu, Y.,
37.
Ye, J., Coulouris, G., Zaretskaya, I., Cutcutache, I.,
Durante, W., and Korthuis, R. J. (2017) Precondition-
Rozen, S., and Madden, T. L.
(2012) Primer-
ing with the BKCa channel activator NS-1619 prevents
BLAST: A tool to design target-specific primers for
ischemia-reperfusion-induced inflammation and mu-
polymerase chain reaction, BMC Bioinform., 13, 134,
cosal barrier dysfunction: Roles for ROS and heme
doi: 10.1186/1471-2105-13-134.
oxygenase-1, Am. J. Physiol. Heart Circ. Physiol., 313,
38.
Schmittgen, T. D., and Livak, K. J. (2008) Analyzing
H988-H999, doi: 10.1152/ajpheart.00620.2016.
real-time PCR data by the comparative CT method,
47.
Li, Y., Zhang, S., Zhang, X., Li, J., Ai, X., Zhang, L.,
Nat. Protoc., 3, 1101-1108, doi: 10.1038/nprot.2008.73.
Yu, D., Ge, S., Peng, Y., and Chen, X. (2014) Blunted
39.
Quiros, P. M., Goyal, A., Jha, P., and Auwerx, J.
cardiac beta-adrenergic response as an early indication
(2017) Analysis of mtDNA/nDNA ratio in mice, Curr.
of cardiac dysfunction in Duchenne muscular dystrophy,
Protoc. Mouse Biol., 7, 47-54, doi: 10.1002/cpmo.21.
Cardiovasc. Res., 103, 60-71, doi: 10.1093/cvr/cvu119.
EFFECT OF THE LARGE-CONDUCTANCE CALCIUM-DEPENDENT
K+ CHANNEL ACTIVATOR NS1619 ON THE FUNCTION
OF MITOCHONDRIA IN THE HEART
OF DYSTROPHIN-DEFICIENT MICE
M. V. Dubinin1*, V. S. Starinets2, Y. A. Chelyadnikova1, N. V. Belosludtseva2,
I. B. Mikheeva2, D. K. Penkina1, A. D. Igoshkina1, E. Y. Talanov2, I. I. Kireev3,
D. B. Zorov3, and K. N. Belosludtsev1,2
БИОХИМИЯ том 88 вып. 2 2023
242
ДУБИНИН и др.
1 Mari State University,
424001 Yoshkar-Ola, Mari El, Russia; E-mail: dubinin1989@gmail.com
2 Institute of Theoretical and Experimental Biophysics, Russian Academy of Sciences,
142290 Pushchino, Moscow Region, Russia
3 Belozersky Institute of Physico-Chemical Biology, Lomonosov Moscow State University,
119991 Moscow, Russia.
Dystrophin-deficient muscular dystrophy (Duchenne dystrophy) is characterized by impaired ion
homeostasis, in which mitochondria play an important role. In the present work, using a model of dystrophin-
deficient mdx mice, we revealed a decrease in the efficiency of potassium ion transport and the total content
of this ion in heart mitochondria. We evaluated the effect of chronic administration of the benzimidazole
derivative NS1619, which is an activator of the large-conductance Ca2+-dependent K+ channel (mitoBKCa)
on the structure and function of organelles and the state of the heart muscle. It was shown that NS1619
improves K+ transport and increases the content of the ion in the heart mitochondria of mdx mice, but this
is not associated with changes in the level of the mitoBKCa protein and the expression of the encoding gene.
The effect of NS1619 was accompanied by a decrease in the intensity of oxidative stress, assessed by the level
of lipid peroxidation products (MDA products) and normalization of the mitochondrial ultrastructure in the
heart of mdx mice. In addition, we found positive changes in the tissue, expressed in a decrease in the level
of fibrosis in the heart of dystrophin-deficient animals treated with NS1619. It was noted that NS1619 had
no significant effect on the structure and function of heart mitochondria in wild-type animals. The paper
discusses the mechanisms of influence of NS1619 on the function of mouse heart mitochondria in Duchenne
muscular dystrophy and the prospects for applying this approach to correct pathology.
Keywords: Duchenne dystrophy, heart, mitochondria, NS1619, calcium-activated potassium channel, BKCa
БИОХИМИЯ том 88 вып. 2 2023