БИОХИМИЯ, 2023, том 88, вып. 3, с. 388 - 408
УДК 543.51
ПРОТЕАСОМНЫЙ ИНТЕРАКТОМ
И ЕГО РОЛЬ В МЕХАНИЗМАХ ПЛАСТИЧНОСТИ МОЗГА
Обзор
© 2023 О.А. Бунеева, А.Т. Копылов, А.Е. Медведев*
НИИ биомедицинской химии имени В.Н. Ореховича,
119121 Москва, Россия; электронная почта: professor57@yandex.ru
Поступила в редакцию 20.10.2022
После доработки 29.11.2022
Принята к публикации 29.11.2022
Протеасомы - высококонсервативные мультиферментные комплексы, ответственные за рас-
щепление короткоживущих, регуляторных, неправильно свернутых и поврежденных белков. Они
играют важную роль в процессах пластичности мозга, и снижение их функциональной активности
сопровождается развитием нейродегенеративной патологии. Исследования, выполненные в раз-
ных лабораториях как на культивируемых клетках млекопитающих и человека, так и на препаратах
коры мозга крысы и мозга кролика, выявили большое количество белков, ассоциированных с про-
теасомами. Поскольку идентифицированные белки принадлежат к определенным метаболическим
путям, многократное обогащение фракции протеасом этими белками свидетельствует о важной
роли последних для функционирования протеасом. Если экстраполировать на мозг человека дан-
ные, полученные на различных биологических объектах, можно предположить, что ассоцииро-
ванные с протеасомами белки составляют не менее 28% протеома мозга человека. Протеасомный
интерактом мозга содержит большое количество белков, принимающих участие в сборке этих над-
молекулярных комплексов, регуляции функционирования и внутриклеточной локализации, кото-
рая может меняться при изменении условий (например, при окислительном стрессе) или в раз-
личные фазы клеточного цикла. В контексте молекулярных функций Gene Ontology (GO) Pathways
белки протеасомного интерактома обеспечивают взаимодействие компонентов более 30 метаболи-
ческих путей, аннотированных в терминах GO. Главным итогом этих взаимодействий, по-види-
мому, является связывание адениновых и гуаниновых нуклеотидов, которые, очевидно, обеспе-
чивают реализацию нуклеотид-зависимых функций 26S- и 20S-протеасом. Поскольку развитие
нейродегенеративной патологии чаще всего связано с региоселективным сниженим функциональ-
ной активности протеасом, положительный терапевтический эффект, очевидно, будут оказывать
факторы, способствующие повышению активности протеасом. В любом случае фармакологиче-
ская регуляция протеасом мозга, по-видимому, реализуется через изменение состава и/или актив-
ности белков, ассоциированных с ними (деубиквитиназы, PKA, CaMKIIα и др.).
КЛЮЧЕВЫЕ СЛОВА: протеасомы, мозг, 20S-субчастица, 19S-субчастица, субклеточная локализация
и функции, ассоциированные с протеасомами белки, протеасомный протеом и интерактом.
DOI: 10.31857/S032097252303003X, EDN: QWFWPM
ВВЕДЕНИЕ
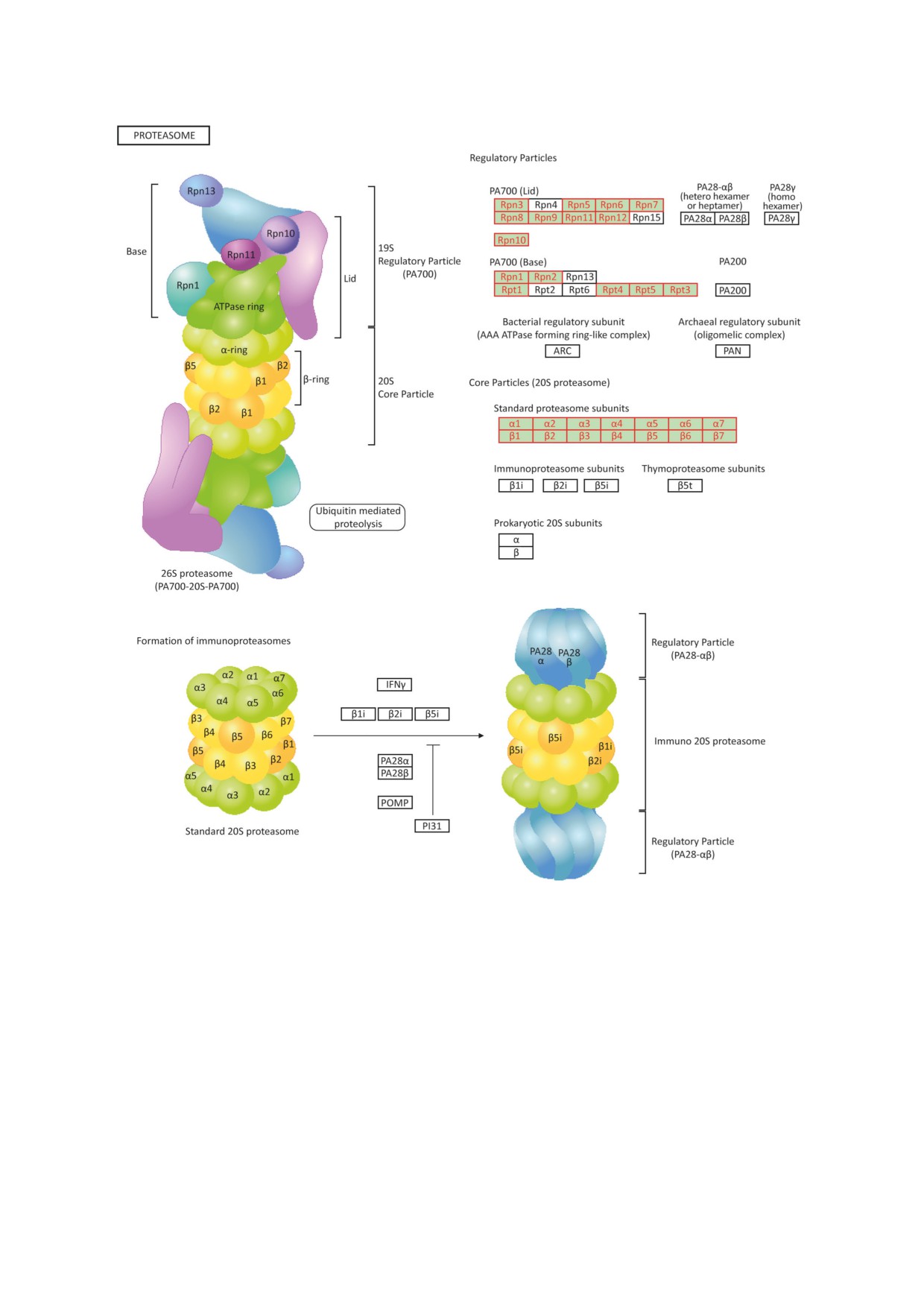
Протеолитическая коровая (сердцевинная)
и
Протеасомы
- высококонсервативные
регуляторная субчастицы протеасом, а также
мультиферментные комплексы, присутствую-
протеасома, содержащая обе субчастицы, по-
щие во всех прокариотических и эукариотиче-
лучили названия 20S-, 19S- и 26S-протеасом
ских клетках и осуществляющие расщепление
в соответствии с их коэффициентами седи-
короткоживущих, регуляторных, неправиль-
ментации. Протеасомы играют важную роль
но свернутых и поврежденных белков [1-3]. в процессах пластичности мозга, и снижение
Принятые сокращения: УПС - убиквитин-протеасомная система; Ecm29 - регулятор окислительного стресса;
PA28 - 11S-субчастица; PKA - cAMP-зависимая протеинкиназа; Rpn - субъединицы, не обладающие АТPазной актив-
ностью; Rpt - субъединицы, обладающие АТPазной активностью.
* Адресат для корреспонденции.
388
ПРОТЕАСОМНЫЙ ИНТЕРАКТОМ МОЗГА
389
их функциональной активности сопровожда-
щие АТPазной активностью, - Rpn (Rpn -
ется развитием нейродегенеративной патоло-
regulatory particle non-triphosphatase). Помимо
гии [2, 3].
19S-субчастиц (РА700), которые могут при-
В большинстве случаев подлежащие про-
соединяться к коровой части протеасомы с
теасомной деградации белки сначала подверга-
одной стороны или с двух сторон сразу, есть
ются убиквитинированию - АТР-зависимому
и другие регуляторы протеасомы. PA28 (или
присоединению остатков убиквитина, белка с
11S-субчастица) существует в двух основных
молекулярной массой около 8,5 кДа. Мечен-
формах: PA28αβ и PA28γ (или REGγ). PA28αβ
ные таким образом полиубиквитинированные
экспрессируется в цитоплазме, состоит из двух
белки узнаются рецепторами 19S-субчастицы
субъединиц α и β массой по 28 кДа, индуциру-
протеасомы. В ней под действием деубикви-
ется γ-интерфероном и усиливает способность
тиназ происходит отщепление убиквитино-
20S-протеасомы расщеплять короткие пеп-
вой метки, а подлежащие протеолитической
тиды и окисленные субстраты [15, 16]. Актива-
деградации белки поступают в 20S-протеа-
тор протеасомы PA28γ экспрессируется в ядре;
сому [4, 5]. Помимо такого пути доставки бел-
присоединяясь к коровой части протеасомы,
ков для деградации в протеасомах, известного
действует, подобно молекулярному ситу, от-
как АТР- и убиквитин-зависимый [6], белки
бирая белки для деградации непосредственно
могут подвергаться деградации в протеасомах
в коровой части протеасомы по АТР- и убик-
АТР- и убиквитин-независимым путем [7-11].
витин-независимому пути. PA28γ принимает
В последнем случае одной из основных струк-
участие в регуляции таких важных клеточных
турных предпосылок такой деградации белков
процессов, как клеточный рост и пролифера-
является наличие неструктурированных обла-
ция, апоптоз, репарация ДНК, иммунный от-
стей, которые и обеспечивают взаимодействие
вет, метаболизм, таким образом, поддерживая
с 20S-протеасомой [12].
гомеостаз клетки [17].
19S-регуляторная субчастица ответственна
за распознавание полиубиквитинированных
СТРОЕНИЕ И ФУНКЦИИ ПРОТЕАСОМ
субстратов, их разворачивание, деубиквити-
нирование и направление во внутреннее про-
20S-протеасома (20S-субчастица). 20S-про-
странство коровой части, где они расщепля-
теасома представляет собой цилиндр, состоя-
ются до олигопептидов. Активный транспорт
щий из четырех гептамерных колец, каждое
субстратов в каталитическую область осуще-
из которых образовано семью α- или семью
ствляется с использованием энергии гидроли-
β-субъединицами, кодируемыми четырнадца-
за АТP. Шесть субъединиц «основания» 19S-ре-
тью различными генами. Два внешних кольца
гуляторной субчастицы (Rpt1-Rpt6) относятся
цилиндра, состоящие из субъединиц α-типа,
к АТРазам семейства ААА (ATPases associated
во-первых, выполняют функцию «ворот», че-
with various cellular activities). Эти субъединицы
рез которые белки-субстраты попадают во внут-
образуют кольцо, как и четыре субъединицы,
реннюю каталитическую область, и, во-вто-
не обладающие АТРазной активностью (Rpn1,
рых, отвечают за ассоциацию 20S-протеасомы
Rpn2, Rpn10 и Rpn13) [18]. Субъединицы Rpn1,
с регуляторными субчастицами [13]. Два внут-
Rpn10 и Rpn13 служат рецепторами убиквити-
ренних кольца образованы β-субъединицами,
на, распознавая субстраты, меченные для эли-
из которых субъединицы β1, β2, β5 обладают
минации в протеасоме [19-22]. Субъединицы -
соответственно каспазоподобной, трипсино-
убиквитиновые рецепторы - различаются по
подобной и химотрипсиноподобной активно-
своему сродству к разным полиубиквитиновым
стями [14, 15] (рис. 1).
цепям [23, 24]. «Крышка» представлена девятью
19S-протеасома (19S-субчастица) и другие
различными субъединицами (Rpn3, Rpn5-9,
регуляторы протеасом. 19S-субчастица. Регу-
Rpn11, Rpn12 и Rpn15), которые формируют
ляторная 19S-субчастица, известная также как
подковообразную структуру
[25-27]. Основ-
активатор протеасомы 700 (РА700; Рroteasome
ная функция «крышки» - деубиквитинирова-
activator 700), состоит из двух субкомплек-
ние субстратов, осуществляемое при помощи
сов: «крышки» (lid) и «основания» (base) и
нескольких деубиквитиназ (одна из них - соб-
включает в себя до 20 различных субъединиц,
ственный компонент протеасомы Rpn11) [28-
обладающих или не обладающих АТPазной
30]. Энергия АТР необходима для стабилиза-
активностью (рис. 1). Субъединицы, облада-
ции комплекса регуляторной и каталитической
ющие АТPазной активностью, обозначаются
субчастиц протеасомы и главное - для измене-
как Rpt-субъединицы (Rpt - regulatory particle
ний конформации субъединиц, позволяющих
triphosphatase), а субъединицы, не обладаю-
открыть «ворота» протеолитической полости
БИОХИМИЯ том 88 вып. 3 2023
390
БУНЕЕВА и др.
Рис. 1. Строение протеасом (см. пояснения в тексте). Изображение (map03050) адаптировано и взято из открытого
ресурса KEGG (Kyoto Encyclopedia of Genes and Genomes; Kanehisa Laboratory) [15] с разрешения правообладателя
для прохождения внутрь белковых субстра-
модействовать с 26S-протеасомой, образуя 19S-
тов [31]. Энергия гидролиза АТР используется
20S-РА200 гибридную протеасому. РА200 уча-
также и для разворачивания субстратов во
ствует в ключевых сигнальных путях клетки,
время перемещения их в протеолитическую
играет роль в репарации ДНК, обеспечивая
область [32, 33].
стабильность генома. Экспрессия этого фактора
Другие регуляторы протеасомы. Активатор
резко увеличивается в случае опухолевых про-
протеасомы РА200 - фосфопротеин, широко
цессов и, наоборот, подавляется при нейроде-
представленный в клетке в виде пула, свобод-
генеративных заболеваниях. В настоящее время
ного от протеасом. В случае стрессовых условий
этому фактору уделяется пристальное внимание
РА200 рекрутируется протеасомами. При при-
как возможной терапевтической мишени [34].
соединении к 20S-протеасоме - усиливает ее
У высших позвоночных стимуляция клет-
пептидазную активность; способен также взаи- ки γ-интерфероном или другими противо-
БИОХИМИЯ том 88 вып. 3 2023
ПРОТЕАСОМНЫЙ ИНТЕРАКТОМ МОЗГА
391
воспалительными цитокинами приводит к
микроскопии. Сборка коровой части у эука-
тому, что при формировании протеасомы из
риот может быть условно разделена на три
15S-препротеасомного комплекса образуется
этапа: формирование α-кольца, формирова-
иммунопротеасома, содержащая вместо субъ-
ние β-кольца, димеризация полупротеасомы и
единиц β1, β2, β5 альтернативные каталитиче-
дозревание. Эти этапы обеспечиваются пятью
ские субъединицы β1i, β2i, β5i и обладающая
шаперонами, которые носят названия Pba1-
видоизмененной протеолитической актив-
Pba4 (proteasome biogenesis associated 1-4) и
ностью и субстратной специфичностью [35,
Ump1 (underpinning maturation of proteasome 1)
36] (рис. 1). В настоящее время накапливается
у дрожжей и соответственно РАС1-РАС4
все больше данных, свидетельствующих о роли
(proteasome assembly chaperone 1-4) и РОМР
иммунопротеасом не только в случае иммун-
(proteasome maturation protein) - в случае про-
ного ответа, но и при окислительном стрессе,
теасом человека [41, 42].
канцерогенезе и нейродегенеративных заболе-
Сборка регуляторной субчастицы - также
ваниях, таких как болезни Паркинсона, Альц-
многостадийный процесс; два ее субкомплек-
геймера, Гентингтона, боковой амиотрофиче-
са - «крышка» и «основание» - могут соби-
ский склероз, аутоиммунные заболевания (в
раться независимо друг от друга. В сборке
частности, рассеянный склероз) [37, 38].
«основания» участвуют пять шаперонов (соот-
Регулятор Ecm29 играет ключевую роль
ветственно у дрожжей и у человека): Nas2 (р27),
в защите клетки от окислительного стресса.
Nas6 (р28), Hsm3 (S5b), Rpn14 (PAAF1)
Было показано, что при окислительном стрес-
(proteasomal ATPase associated factor
1) и
се происходит резкое увеличение количества
Adc17 (ATPase dedicated chaperone of 17 kDa).
20S-протеасом в клетке не только в результате
Было предложено две модели сборки «основа-
регуляции транскрипции, но и благодаря дис-
ния» регуляторной субчастицы протеасомы.
социации 26S-протеасомных комплексов. Это
Согласно одной из них, сборка «основания» не
необходимо для скорейшей элиминации по-
зависит от коровой части; другая модель пред-
врежденных белков убиквитин- и АТР-незави-
полагает, что 20S-субчастица служит «платфор-
симым способами. Регулятор Ecm29 ускоряет
мой» для формирования «основания» 19S-суб-
процесс диссоциации 26S-протеасом в ответ
частицы [41, 42].
на окислительный стресс, по-видимому, вы-
«Крышка» может собираться в отсутствии
зывая конформационные изменения и влияя
«основания» 19S-субчастицы и коровой части
на белок-белковые взаимодействия между 19S-
протеасомы. На первом этапе образуются два
и 20S-субкомплексами [39].
интермедиата: один состоит из субъединиц
Протеасомный регулятор PI31 (Proteasomal
Rpn5-6, Rpn8, Rpn9 и Rpn11, другой - из субъ-
Inhibitor of 31 kDa) был первоначально открыт
единиц Rpn3, Rpn7 и Rpn15. После ассоциации
как ингибитор гидролиза пептидов 20S-про-
этих интермедиатов присоединяется последняя
теасомой in vitro. Позже оказалось, что in vivo
субъединица Rpn12, что является триггером
он, напротив, способствует протеасомному
для конформационных изменений, позволяю-
расщеплению белков. Рибозилирование PI31
щих «крышке» присоединиться к «основанию»
способствует сборке 26S-протеасомы. Не так
19S-субчастицы. В ассоциации коровой и ре-
давно обнаружили, что этот фактор также ра-
гуляторной части протеасомы принимают уча-
ботает как адаптер протеасомного транспорта в
стие шаперон Nas6 (р28) и субъединицы «крыш-
нейроны. В опытах на мутантных мышах было
ки» Rpn5 и Rpn6 [41, 43].
показано, что «выключение» этого фактора в
На сборку протеасом может влиять функ-
спинальных мотонейронах и в клетках Пур-
циональное состояние митохондрий [44]. Де-
кинье вызывает аксонопатию, дегенерацию
фекты дыхательного комплекса I ухудшают
нейронов, спинальную и мозжечковую невро-
сборку 26S-протеасомы, нарушения которой
логические дисфункции. Авторы предполага-
менее заметны в присутствии пирувата или
ют, что протеасомный регулятор PI31 может
аспартата [44].
играть ключевую роль в гомеостазе белков и
Компартментализация протеасом. Чтобы
функции синапсов и, соответственно, его дис-
элиминировать соответствующие белки в нуж-
функции могут приводить к развитию нейро-
ный момент в нужном месте, протеасомам
дегенеративных заболеваний у человека [40].
необходимо быть динамичными не только в
Сборка протеасом. Сборка протеасом
аспекте их структуры, но и в аспекте компарт-
представляет собой сложный регулируемый
ментализации. Поэтому субклеточная локализа-
процесс; в настоящее время она достаточно
ция протеасом может меняться при изменении
хорошо изучена (на примере протеасом дрож-
условий (например, при окислительном стрес-
жей и человека) благодаря криоэлектронной
се) или в различные фазы клеточного цикла.
БИОХИМИЯ том 88 вып. 3 2023
392
БУНЕЕВА и др.
Протеасомы содержатся в цитоплазме, часть
В нейронах обнаружен новый 20S-про-
их ассоциирована с цитоскелетом и мембра-
теасомный комплекс, локализованный в плаз-
нами эндоплазматического ретикулума. В то
матической мембране и экспонированный во
же время большое количество протеасом нахо-
внеклеточное пространство [56, 57]. Образу-
дится в ядре. Более того, в опытах на эмбрио-
ющиеся в результате работы этого комплекса
нальных фибробластах мыши было показано,
пептиды могут стимулировать кальциевую
что новосинтезированные протеасомы нахо-
сигнализацию нейронов.
дятся именно в ядре, тогда как трехдневные
Посттрансляционные модификации протеа-
протеасомы в основном обнаруживались в ци-
сом. Среди посттрансляционных модификаций
топлазме, что свидетельствует о поступлении
протеасом наиболее изучено фосфорилиро-
новосинтезированных протеасом из ядра в ци-
вание. Согласно базе данных PhosphoSitePlus,
топлазму [45]. Примечательно, что белки, реа-
известно более 450 фосфосайтов на 26S-про-
лизующие ядерные функции (циклины, инги-
теасоме человека, которые были обнаружены
биторы циклин-зависимых киназ, факторы
на каждой субъединице протеасом [58]. Окру-
транскрипции NF-κB, IκB, p53), были одними
жающие фосфосайты протеасом аминокис-
из первых идентифицированных физиологи-
лотные последовательности соответствуют
ческих протеасомных субстратов [46-48].
мотивам узнавания различных протеинкиназ
Недавно у млекопитающих (в трех различ-
(MAPK, CDK, CaMK, GSK3 и некоторых дру-
ных клеточных линиях) был обнаружен белок
гих) [58]. Это предполагает участие различных
AKIRIN2 - адаптер импорта в ядро зрелых ко-
протеинкиназ в регуляции функции протеасом
ровых частиц. AKIRIN2 обеспечивает наличие
(и протеинфосфатаз, осуществляющих обрати-
у зрелой коровой частицы специальной после-
мость такой регуляции путем дефосфорилиро-
довательности, необходимой для транспорта в
вания). Результаты нескольких исследований
ядро, и способствует связыванию транспорт-
свидетельствуют в пользу того, что фосфори-
ного рецептора импортина 9. AKIRIN2 инги-
лирование Rpn6-субъединицы 19S-протеасом
бирует коровую субчастицу и расщепляется
cAMP-зависимой протеинкиназой (PKA) по-
при попадании ее в ядро [49]. Механизмы
вышает активность протеасом и увеличивает
импорта протеасом в ядро у дрожжей и мле-
деградацию токсических белков. Активация
копитающих схожи тем, что 20S-субчастица
PKA in vivo путем увеличения уровня внутри-
проходит через ядерные поровые комплексы
клеточного сАМР снижала накопление фос-
в ингибированном либо незрелом состоянии,
форилированного тау-белка и улучшала когни-
вероятно, для того чтобы избежать деградации
тивные функции у мышей с таупатией [59].
белков ядерных пор, богатых неупорядочен-
Стимуляция активности 26S-протеасомы при
ными последовательностями.
фосфорилировании cGMP-зависимой протеин-
На клетках млекопитающих и дрожжей
киназой также способствовала увеличению
было показано, что различные стрессовые
протеасомной деградации белков (включая
факторы (ингибирование протеасом, окисли-
белки, вовлеченные в развитие нейродегенера-
тельный стресс и другие) вызывают аккумуля-
тивных заболеваний) [60].
цию протеасом в ядерных или околоядерных
Помимо фосфорилирования, есть сооб-
локусах (так называемых специфических «без-
щения об О-связанном N-ацетилглюкозами-
мембранных органеллах»). Как только стрес-
нировании [61], ADP-рибозилировании [62],
совые факторы перестают действовать, наблю-
ацетилировании и миристилировании [63, 64].
дается «демонтаж» этих «органелл» [50-53].
О-связанное N-ацетилглюкозаминирование
Если аберрантные белки вовремя не эли-
приводит к торможению ATPазной активности
минируются в ядре из-за протеасомных дис-
26S-комплекса и ингибирует протеолитиче-
функций, они могут аккумулироваться в
скую активность протеасом. У млекопитаю-
PML-тельцах (ядерные тельца промиелоци-
щих этому типу модификации (как in vitro,
тарной лейкемии), заполняя «protein quality
так и in vivo) подвергается Rpt2-субъединица
compartments» в ответ на стресс [54]. Протеа-
19S-протеасом
[61]. ADP-рибозилирование
сомы рекрутируются в PML-тельца для де-
способствует активности 26S-протеасом как в
градации белков, однако в неблагоприятных
клетках дрозофилы, так и в клетках человека.
условиях, например, при недостатке АТР, убик-
Танкираза - фермент ADP-рибозилтрансфе-
витин-протеасомная система не может рабо-
раза, а также шапероны dp27 и dS5b, участвую-
тать в полную силу. В этом случае PML-тельца
щие в сборке 19S-протеасомы, связываются с
с избытком протеасом становятся токсичны-
регулятором протеасомы PI31. ADP-рибози-
ми; это может приводить к нейродегенератив-
лирование последнего снижает его сродство к
ным заболеваниям [55].
α-субъединицам протеасомы 20S. Это снижает
БИОХИМИЯ том 88 вып. 3 2023
ПРОТЕАСОМНЫЙ ИНТЕРАКТОМ МОЗГА
393
действие PI31 на коровую субчастицу (20S).
(2) Белки-шапероны, участвующие в ассо-
Кроме того, модификация PI31 увеличивает
циации/диссоциации протеасом, в разделении
связывание и секвестрацию dp27 и dS5b из
плотно упакованных убиквитинированных
регуляторных частиц
19S, способствуя тем
субстратов в ходе подготовки к их протеолизу,
самым сборке 26S. Протеомное профилиро-
а также во взаимодействии с развернутыми
вание 26S-протеасом сердца мыши выявило
(или неправильно свернутыми) белками-ми-
N-концевое ацетилирование пяти субъединиц
шенями для последующей протеолитической
19S-протеасом (Rpn1, Rpn5, Rpn6, Rpt3 и Rpt6)
деградации.
и пяти субъединиц 20S-протеасом (α2, α5, α7,
(3) Разнообразные белки, участвующие в
β3 и β4), а также N-концевое миристилиро-
регуляции транскрипции и трансляции, а так-
вание Rpt2-субъединицы 19S-протеасом [63].
же в функционировании цитоскелета, метабо-
Увеличение ацетилирования субъединиц
лизме РНК, делении клеток, проведении сиг-
коровой части (20S) повышало протеолити-
налов и метаболизме.
ческую активность протеасом мыши и чело-
(4) Белки рибосом и гликолитические
века [65, 66]. У дрожжей миристилированная
ферменты. С учетом данных о том, что не ме-
Rpt2-субъединица направляет протеасомы для
нее трети всех новосинтезированных белков
осуществления контроля качества ядерных
клеток млекопитающих подвергаются про-
белков. Мутации, блокирующие эту модифи-
теасомной деградации в течение нескольких
кацию, приводят к нарушению внутриклеточ-
минут после трансляции
[79], ассоциация
ной локализации протеасом [64].
белоксинтезирующей машины и УПС имеет
Окислительная модификация сульфгид-
важное значение в немедленной ликвидации
рильных групп
20S-протеасомы (окисление
аберрантных белков. К тому же реакции суб-
остатков цистеина Cys-SH до цистеинсульфе-
стратного фосфорилирования, в которых уча-
новой кислоты Cys-SOH) приводит к после-
ствуют гликолитические ферменты, создают
дующему S-глутатионилированию (Cys-S-SG).
потенциальные возможности образования
Это сопровождается частичной потерей химо-
дополнительных количеств АТР, оказывающих
трипсиноподобной активности [67]. В усло-
влияние на нуклеотид-чувствительное взаимо-
виях in vitro глутаредоксин 2 проявлял де-
действие белков с протеасомами, а также на
глутатионлигазную активность, удаляя глута-
функционирование субъединиц регуляторной
тион из глутатионилированных in vivo и
19S-субчастицы, проявляющих АТРазную ак-
in vitro
20S-протеасом. Аналогичным обра-
тивность (Rpt1-6).
зом действовали и другие цитоплазматиче-
Условность такого деления белков, ассо-
ские редокс-белки тиоредоксин 1 и тиоредок-
циированных с протеасомами, очевидна, осо-
син 2 [67].
бенно когда речь заходит о трех последних
классах. Многофункциональные белки, напри-
мер гликолиза, помимо своих классических
БЕЛКИ, АССОЦИИРОВАННЫЕ
биохимических функций, едва ли не с равным
С ПРОТЕАСОМАМИ
успехом могут рассматриваться и как шапе-
роны (например, глицеральдегид-3-фосфат-
Помимо собственно протеасомных белков,
дегидрогеназа (ГАФД)), и как белки, предна-
фракции протеасом, выделенные при помощи
значенные для деградации в протеасомах. То же
различных методов из разных источников (от
самое относится к регуляторам и компонентам
дрожжей до клеток и тканей высших позвоноч-
трансляционной машины (рибосомные бел-
ных и человека), содержат существенное коли-
ки). Участие белков этих групп в конкретных
чество ассоциированных с этими частицами
метаболических путях, включая протеасомную
белков [68-78].
деградацию, определяется их структурными
В одной из первых работ, посвященных
особенностями в данный конкретный момент
анализу белкового состава очищенных 19S-,
времени. Например, уже упоминавшийся выше
20S- и 26S-протеасом дрожжей, все иденти-
фермент гликолиза - ГАФД - может выполнять
фицированные белки были разделены на не-
шаперонные функции, защищая новосинте-
сколько классов (по терминологии авторов
зированный белок, высвобожденный с рибо-
работы) [70].
сом, от протеасомной деградации [80]. Однако
(1) Субъединицы протеасом, а также
при окислении остатка цистеина (Cys247) ГАФД
компоненты убиквитин-протеасомной си-
теряет способность выполнять функцию шапе-
стемы (УПС), взаимодействующие с ними.
рона [80], и шаперон Hsp70, связываясь с окис-
К числу последних относятся убиквитиназы,
ленной ГАФД, защищает клетку от агрегации
деубиквитиназы и т.д.
этого белка [81].
БИОХИМИЯ том 88 вып. 3 2023
394
БУНЕЕВА и др.
Исследования, выполненные как на куль-
показатель был в диапазоне 200-680 ед. [76].
тивируемых клетках млекопитающих и челове-
Для ряда белков вышеприведенных функ-
ка [68, 70-75], так и на препаратах коры мозга
циональных групп представленность пре-
крысы [69], мозга и печени кролика [76, 77],
вышала обнаруженные для собственно про-
также выявили большое количество белков,
теасомных субъединиц диапазоны. Например:
ассоциированных с протеасомами (таблица).
(I) цитоплазматический актин (P29751 Actin,
Белки, не являющиеся собственно компо-
cytoplasmic)
- 1777,6 ед.; (II) белок теп-
нентами УПС, относятся к различным функ-
лового шока (G1T9M9 Heat shock protein
циональным группам, включающим: (I) ком-
family A (Hsp70) member
8)
- 509,2 ед.;
поненты цитоскелета и белки, вовлеченные в
(III) кальмодулин (P62160 Calmodulin)
-
транспортировку внутриклеточных
«грузов»;
1386,3 ед.; (IV) гетерогенный ядерный рибо-
(II) защитные белки; (III) сигнальные белки
нуклеопротеин К (O19049 Heterogeneous nu-
и регуляторы активности ферментов; (IV) ре-
clear ribonucleoprotein K)
-
468,5 ед.;
гуляторы экспрессии генов, стабильности
(V) ГАФД (P46406 glyceraldehyde-3-phosphate
генома и дифференцировки клеток; (V) мета-
dehydrogenase) - 952,8 ед. [76]. С учетом того,
болические ферменты, в том числе мульти-
что абсолютное количество приведенных бел-
функциональные белки. Примечательно, что
ков в мозге [82] отличается от их представ-
представленность ряда ассоциированных с
ленности во фракции протеасом, все это,
протеасомами белков была не ниже и даже
очевидно, свидетельствует о том, что выделяе-
превышала представленность белков, фор-
мые вместе с фракцией протеасом белки не
мирующих структуру протеасом [69, 76, 77].
являются контаминантными, а представляют
Уровень протеасомных субъединиц, форми-
собой компоненты протеасомных протеомов.
рующих коровую часть протеасомы, варьиро-
В пользу этого же свидетельствует и много-
вал в диапазоне 400-1000 ед. (условные еди-
кратное обогащение выделенных протеасом
ницы, arbitrary units of spectrum counting); для
мозга белками, принадлежащими к определен-
субъединиц регуляторной субчастицы этот
ным метаболическим путям (рис. 2).
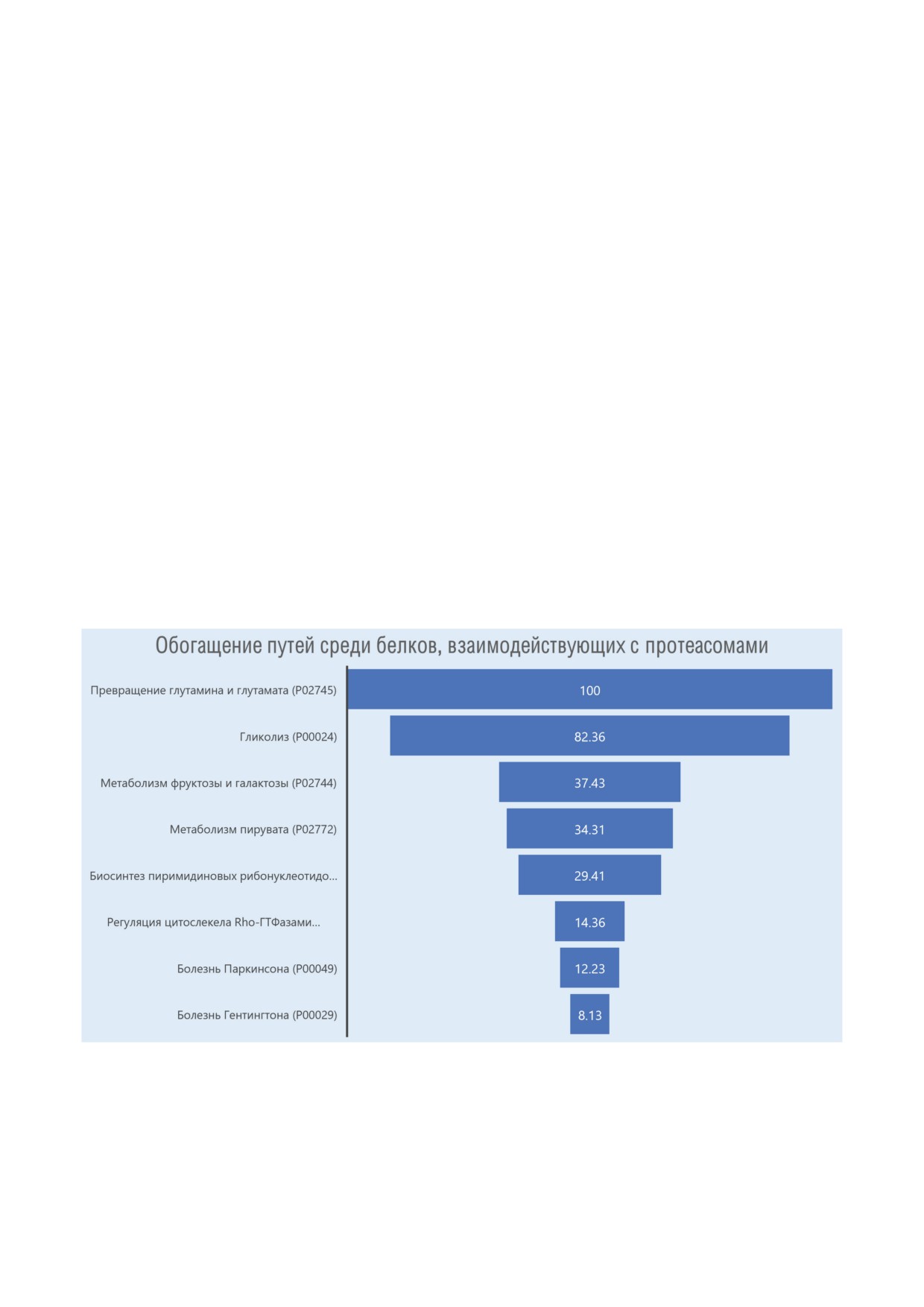
Рис. 2. Обогащение протеасом определенными группами белков, идентифицированных в мозге [76, 77]. Анализ дан-
ных ресурсом Quick GO по базе Explore Biology показал распределение обнаруженных белков по нескольким метабо-
лическим путям. По отношению к полноразмерному протеому человека наибольшее обогащение обнаружено в случае
белков, участвующих в метаболизме глутамина и глутамата (Р02747; 100-кратное обогащение в субпротеоме связанных
с протеасомами белков), гликолиза (Р00024; 82-кратное обогащение), метаболизма фруктозы (Р02744; 37-кратное обо-
гащение), метаболизм пирувата (Р02772; 34-кратное обогащение) и т.д. Заметное обогащение выявлено для метаболи-
ческих путей, вовлеченных в развитие болезни Паркинсона (P00049; 12-кратное обогащение) и болезни Гентингтона
(P00029; 8-кратное обогащение). Идентификаторы метаболических путей представлены в соответствии с номенклату-
БИОХИМИЯ том 88 вып. 3 2023
ПРОТЕАСОМНЫЙ ИНТЕРАКТОМ МОЗГА
395
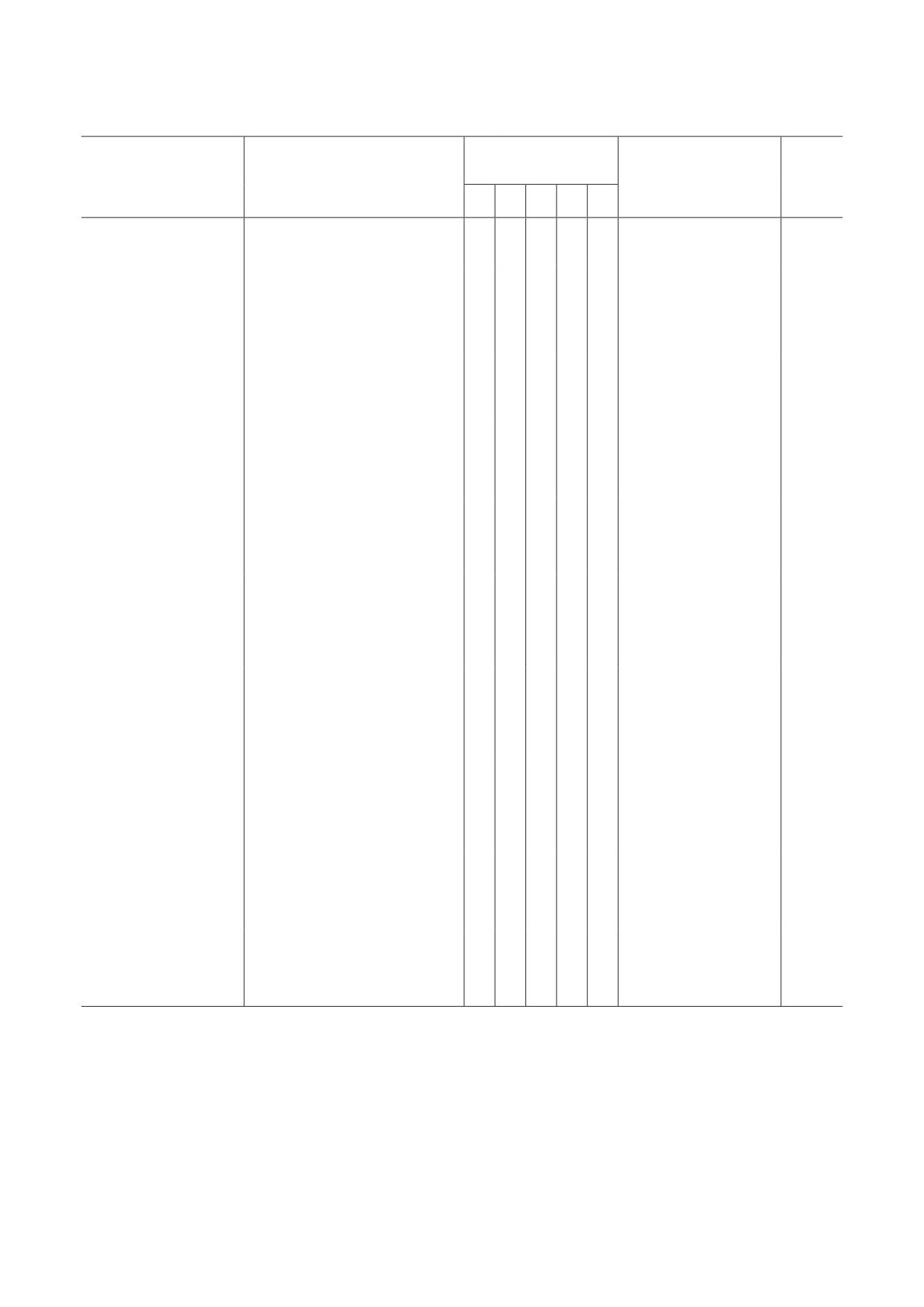
Функциональные группы белков, ассоциированных с протеасомами
Функциональные
Метод избирательной
группы белков
Источник протеасом
Метод выделения
валидации взаимодей-
Ссылка
ствия с протеасомой
I
II
III
IV
V
аффинная очистка
Saccharomyces cerevisiae
+
+
+
+
+
[70]
на основе anti-Flag M2* агарозы
изотопное мечение,
сшивка in vivo и тандемная
обратная коочистка
S. cerevisiae
аффинная очистка SILAC**,
+
+
+
+
+
[72]
и иммуноблоттинг
количественный анализ
QTAX***
Homo sapiens,
аффинная очистка
клетки
с применением сшивки
+
+
+
+
[74]
293HF-UbR/Rpn11-TB
in vivo XBAP****
аффинная очистка
H. sapiens,
на основе комплекса биотин-
+
+
+
+
[75]
клетки линия K562
стрептавидин с применением
протеазы TEV *****
H. sapiens,
центрифугирование
внеклеточные
в градиенте концентрации
коочистка
+
+
[73]
26S-протеасомы
сахарозы и ионообменная
и иммуноблоттинг
клеточной линии К562
хроматография
H. sapiens,
26S-протеасомы
аффинная очистка
клеток hec 293,
+
+
+
+
[68]
MAP******-SILAC
экспрессирующих
меченную Rpn11-HTBH
аффинная очистка
Rattus norvegicus,
с использованием глутатион-
цитозоль
коочистка
сефарозы, GST (glutathione
+
+
+
+
[69]
и синаптосомы коры
и иммуноблоттинг
S-transferase) и мечения UBL
больших полушарий
(ubiquitin-like domain)
аффинная очистка
с использованием глутатион-
R. norvegicus,
сефарозы, GST (glutathione
+
+
+
+
+
[78]
скелетные мышцы
S-transferase) и мечения UBL
(ubiquitin-like domain)
высокоскоростное
оптический биосенсор
Oryctolagus cuniculus,
ультрацентрифугирование,
+
+
+
+
+
(поверхностный плаз-
[77]
печень
фракционирование
монный резонанс)
сульфатом аммония
высокоскоростное
оптический биосенсор
O. cuniculus,
ультрацентрифугирование,
+
+
+
+
+
(поверхностный плаз-
[76, 77]
головной мозг
фракционирование
монный резонанс)
сульфатом аммония
Примечание. Белки, принадлежащие к данным функциональным группам, не являются ни собственно протеасомными
белками, ни компонентами убиквитин-протеасомной системы (убиквитиназы, деубиквитиназы и пр.). Они были иден-
тифицированы в количестве нескольких десятков с помощью масс-спектрометрических методов во фракциях протеа-
сом, выделенных из различных источников, и в ряде случаев их взаимодействие с протеасомами было подтверждено
независимыми методами.
Функциональные группы ассоциированных с протеасомами белков:
I - компоненты цитоскелета и белки, вовлеченные в транспортировку внутриклеточных «грузов»;
II - защитные белки;
III - сигнальные белки и регуляторы активности ферментов;
IV - регуляторы экспрессии генов, стабильности генома и дифференцировки;
БИОХИМИЯ том 88 вып. 3 2023
396
БУНЕЕВА и др.
Примечание к таблице (окончание).
V - метаболические ферменты, преимущественно мультифункциональные белки.
* Моноклональные антитела к FLAG-эпитопу.
** Stable isotope labeling of amino acids in cell culture.
*** Quantitative analysis of tandem-affinity purified cross-linked (x) protein complexes.
**** In vivo cross-linking (X) assisted bimolecular tandem affinity purification strategy.
***** Использовали клетки, экспрессирующие beta 7 субъединицу 20S-протеасомы, меченной C-концевым HTBH-
пептидом, содержащим два His(6)-фрагмента, специфический сайт протеазы TEV (Tobacco Etch Virus), биотинилиро-
вание in vivo, метод нековалентного связывания с образованием комплекса биотин-стрептавидин с последующей элю-
цией с применением протеазы TEV.
****** Смешивание по-разному меченных проб (МАР, Mixing after purification).
Фракционирование 26S-протеасом мозга
Поскольку субъединица Rpn10
19S-протеа-
оказывает существенное влияние на профиль
сом играет важную роль в узнавании субстра-
связанных с коровой субчастицей (20S) бел-
тов, предназначенных для протеолитической
ков. Число индивидуальных белков, иденти-
деградации в протеасомах [96, 97], это согла-
фицированных во фракции
20S-протеасом
суется с представлениями о том, что именно
мозга кролика, практически удваивается по
субъединицы 19S-протеасом определяют упо-
сравнению с фракцией 26S-протеасом моз-
рядоченное поступление белков, подвергаю-
га [76, 77] преимущественно за счет метабо-
щихся протеолитической деградации в коро-
лических ферментов, белков, участвующих
вой субчастице. При этом нельзя не отметить
в передаче сигнала и регуляции активности
тот факт, что вопреки общепринятому пред-
ферментов, защитных белков и белков-регу-
ставлению о том, что протеасомные рецепторы
ляторов экспрессии генов, клеточного деления
убиквитина - субъединицы Rpn10 и Rpn13 -
и дифференцировки [77]. При фракциониро-
взаимозаменяемы в контексте функциониро-
вании 26S-протеасом печени кролика число
вания протеасом [25], профили белков мозга,
индивидуальных белков во фракции 20S-про-
связывающихся Rpn10- и Rpn13-субъедини-
теасом практически не изменяется по сравне-
цами in vitro, существенно различались [98].
нию с фракцией 26S. Следует подчеркнуть, что
Это согласуется с результатами, полученными
сопоставление субпротеомов белков фракций
другими авторами на дрожжах [72]. По их дан-
26S- и 20S-протеасом мозга и печени кролика
ным, профили белков, взаимодействующих с
выявило их высокую органную специфич-
субъединицами 19S-протеасомы Rpn1, Rpn10,
ность. Пул общих белков (n = 35) в основном
Rpn11 и Rpt15, не полностью идентичны.
представлен метаболическими и защитными
В контексте известных данных о внутри-
белками, на долю которых приходится более
клеточном трафике протеасом и их транс-
70% белков. Примечательно, что из 35 ассо-
локации в различные компартменты клетки
циированных с протеасомами белков, об-
в зависимости от функционального состоя-
щих для всех четырех фракций (фракции 26S
ния клетки [42-45] существование большого
и 20S мозга и печени), 10 принадлежат к так
числа белков, взаимодействующих с протеасо-
называемым мультифункциональным белкам.
мами и формирующих протеасомный интер-
Среди них: ГАФД [84], α-енолаза [85, 86], фак-
актом, вполне объяснимо.
тор элонгации 1-α 1 [87], альдолаза [88, 89], глу-
Краткая характеристика групп белков, взаи-
татионпероксидаза [90, 91], белок теплового
модействующих с протеасомами. Будучи широ-
шока Hsp60
[92], лактатдегидрогеназа
[93],
ко представленным надмолекулярным ком-
триозофосфатизомераза
[94]. Существенное
плексом в клетках мозга и периферических
расширение репертуара белков, связанных
тканей [64, 99], протеасомы обнаруживаются
с коровой субчастицей протеасом (20S) моз-
в ядре и в цитоплазме, где они связаны с раз-
га, после удаления белков
19S-субчастицы,
личными субклеточными структурами, вклю-
указывает на то, что компонентам послед-
чая хроматин, цитоскелет, ядерную оболочку,
ней принадлежит важная роль в формиро-
плазматическую мембрану, цитозольную мем-
вании протеасомного интерактома и его
брану. При этом их распределение в клетках
регуляции. Во всяком случае, профили мито-
неравномерно, и конкретная субклеточная
хондриальных белков мозга крысы, связы-
локализация протеасом часто зависит от типа
вающихся с субъединицей Rpn10
19S-суб-
клеток, статуса роста и динамически меняю-
частицы протеасом, существенно различа-
щихся регуляторных стимулов [64, 100]. В кон-
лись при введении животным нейротоксина
тексте молекулярных механизмов пластич-
1-метил-4-фенил-1,2,3,6-тетрагидропириди-
ности мозга локализация компонентов УПС
на (МФТП) и нейропротектора изатина [95].
служит важным регулятором синаптической
БИОХИМИЯ том 88 вып. 3 2023
ПРОТЕАСОМНЫЙ ИНТЕРАКТОМ МОЗГА
397
функции, а нейрональные протеасомы могут
растущих терминалей аксонов, который регу-
взаимодействовать с внутриклеточными мем-
лировался посредством фосфорилирования
бранными структурами, включая синаптиче-
адаптерного белка протеасом Ecm29, взаимо-
ские везикулы, везикулы аппарата Гольджи,
действующего с динеином [104].
митохондрии и лизосомы [101]. Локальные на-
(II ) Защитные белки. Помимо участия в
рушения протеасомной деградации вовлечены
сборке протеасом, клеточные шапероны уча-
в развитие многих нейродегенеративных забо-
ствуют в протеолитической деградации бел-
леваний [102, 103].
ков протеасомами. Члены семейства Hsp70
(I ) Компоненты цитоскелета и белки, вовле-
непосредственно вовлечены в процессы де-
ченные в транспортировку внутриклеточных
градации белков путем доставки белковых
«грузов», и их роль в локализации протеасом в раз-
субстратов к протеасоме. При этом участие
личных компартментах клетки. Один из моле-
Hsc70/Hsp70 в деградации белков 26S-протеа-
кулярных моторов - динеиновый комплекс -
сомой опосредует кошаперон CHIP (carboxyl
играет ключевую роль в подвижности протеасом
terminus of Hsc70 interacting protein). Он дей-
в аксонах [104, 105].
ствует как убиквитинлигаза, а белок BAG1
Перераспределение 26S-протеасом в ней-
(BCL2-associated athanogene) координирует
ронах и других типах клеток обеспечивается
связывание Hsp70-субстратного комплекса с
путем взаимодействия с компонентами цито-
26S-протеасомой [112-114]. В случае протео-
скелета, который, в свою очередь, подвер-
литической элиминации окисленных белков
гается ремоделированию при участии про-
протеасомами клетки используют протеолити-
теасом [106]. Для размещения протеасом в
ческие возможности 20S-протеасомы, осуще-
синапсах нейроны используют зависимые от
ствляя диссоциацию 26S-протеасомы. В этом
микротрубочек молекулярные моторы.
процессе важная роль принадлежит белку теп-
В нейронах дрозофилы компонентами
лового шока 70 (Hsp70), который способствует
зависимого от микротрубочек протеасомного
увеличению количества свободных 20S-про-
транспорта служат белки легкой цепи динеи-
теасом и предотвращает накопление окис-
на (DYNLL1/2) [105].
ленных белков в клетках в условиях окисли-
В связывании протеасом с белка-
тельного стресса [115]. В ходе формирования
ми DYNLL1/2 важную адаптерную роль играет
клеточного ответа на окислительный стресс
консервативный связывающий протеасомы
Hsp70 может взаимодействовать и с окислен-
белок PI31 [107, 108]. Фосфорилирование с
ными белками, и с 20S-протеасомой, которая,
помощью p38 MAPK увеличивало связыва-
в отличие от 26S-протеасомы, способна распо-
ние PI31 с DYNLL1/2, стимулировало обра-
знавать и расщеплять развернутые белки АТР-
зование комплексов протеасома-DYNLL1/2
и убиквитин-независимым способом
[116].
и способствовало направленному движе-
Протеасома 20S узнает свои субстраты по их
нию протеасом в аксонах [108]. Инактива-
неструктурированным гидрофобным участ-
ция PI31 нарушала взаимодействие легких
кам, экспонированным наружу в результате
цепей динеина с протеасомами и транспорт
разворачивания белковой молекулы
[7-11].
последних в аксоны. Это приводило к измене-
При этом протеасома 20S значительно более
нию пресинаптических зон и способствовало
устойчива к окислительному стрессу, чем про-
развитию дефектов белкового гомеостаза на
теасома 26S [117, 118]. Устойчивости 20S-про-
периферии нейронов. Кроме того, PI31 проч-
теасомы к окислительному повреждению
но связывается с F-box-белком Ntc/FBXO7/
способствует Hsp90 [119]. Hsp90 также связы-
PARK15 [107, 108], мутации которого сопро-
вается с окисленным кальмодулином [120],
вождаются нарушением функций протеасом
представленность которого в протеасомах моз-
и вызывают развитие ювенильной формы
га превышает уровень ряда субъединиц про-
болезни Паркинсона [109]. Другой адаптер-
теасом [76], и способствует деградации этого
ный белок, Ecm29, связываясь с миозинами
регуляторного белка 20S-субчастицей.
и кинезинами, способствует взаимодействию
(III ) Сигнальные белки и регуляторы актив-
протеасом с различными компартментами
ности ферментов. Фосфорилирование играет
клеток [110]. Нокдаун тяжелой цепи мотор-
важную роль в регуляции протеасом и их суб-
ного белка кинезина 1 (KIF5B) приводит к
клеточной локализации. Ретроградный транс-
нарушению дендритного транспорта, процес-
порт протеасом зависит от стадии развития
сов обучения и памяти [111] и антероградного
нейрона и увеличивается по мере роста аксо-
движения протеасом к аксонам [101]. Факто-
нов [104]. Это процесс стимулируют сАМР и
ры, способствующие росту аксонов, стимули-
мозговой нейротрофический фактор (BDNF),
ровали ретроградный транспорт протеасом из
не влияя на антероградное направление.
БИОХИМИЯ том 88 вып. 3 2023
398
БУНЕЕВА и др.
Регуляторный механизм включает BDNF/
роль этой киназы, которую некоторые авторы
сАМР-зависимую активацию PKA и фосфори-
называют протеасомной протеинкиназой [58],
лирование адаптерного белка 26S-протеасомы
в пластичности мозга пока остается невыяс-
Ecm29, которое усиливает взаимодействие
ненной. Известно, что ингибирование этого
протеасомы с динеином. В качестве главного
фермента блокирует прогрессию клеточного
регулятора (так называемого master regula-
цикла при некоторых глиомах [127].
tor) синапсов рассматривают α-субъединицу
Кальмодулин - активатор Ca2+/кальмоду-
Ca2+/кальмодулин-зависимой протеинкиназы II
лин-зависимой протеинкиназы II - обнару-
(CaMKIIα) [58], которая в мозге ассоциирова-
живается при протеомном профилировании
на с протеасомами [121]. Транслокация этого
фракций 26S- и 20S-протеасом мозга [76, 77].
фермента в синапс способствует накоплению
С учетом известных данных о диссоциации
протеасом в шипиках и их постсинаптическо-
кальмодулина от CaMKII [128] обнаружение
му перераспределению. Автофосфорилирова-
этого белка в протеасомах может свидетель-
ние CaMKIIα усиливает связывание с протеа-
ствовать о его потенциальной роли в качестве
сомами и мобилизацию последних в шипики.
регулятора CaMKII и, возможно, других каль-
Действие CaMKIIα на протеасомы осуще-
модулин-зависимых ферментов, связанных
ствляется посредством некаталитического и
с протеасомами. Нельзя исключить также и
каталитического механизмов. В первом слу-
поступление этого белка к месту протеолити-
чае активированная (автофосфорилирован-
ческой деградации. В пользу последнего пред-
ная) CaMKIIα эффективнее связывается с
положения свидетельствует тот факт, что сво-
протеасомами, способствуя их мобилизации
бодный кальмодулин, лишенный ионов Са2+,
к шипикам. Во втором случае CaMKIIα сти-
подвергается деградации, не требующей убик-
мулирует активность протеасом, фосфорили-
витинирования как 26S-, так и 20S-протеасо-
руя остаток серина (Ser120) субъединицы Rpt6.
мами [120, 129].
Однако для деградации полиубиквитиниро-
(IV ) Регуляторы экспрессии генов, стабиль-
ванных белков шипиков важное значение
ности генома и дифференцировки клеток. Зна-
имеет именно транслокация CaMKIIα, а не
чительное количество протеасом находится в
ее киназная активность [121]. Тем не менее,
ядре, где они играют ключевую роль в регуля-
по данным других авторов, блокада этого
ции клеточного цикла, транскрипции, ремо-
фосфорилирования у мутантного белка с
делирования хроматина, эпигенетического
аминокислотной заменой S120A или ингиби-
контроля, сплайсинга РНК, восстановления
рование CaMKIIα снижают синаптическую
повреждений ДНК и контроля качества ядер-
активность и рост шипиков [122, 123]. Конди-
ных белков [64, 130]. В связи с этим регуля-
ционирование страха сопровождалось увели-
торы экспрессии генов, стабильности генома
чением фосфорилирования Ser120 Rpt6-cубъ-
и дифференцировки, обнаруживаемые во
единицы регуляторной субчастицы протеасом
фракции протеасом, могут рассматриваться
и активности протеасом в миндалевидном теле
в качестве потенциальных субстратов, под-
крыс Лонг-Эванс (Long Evans) [124]. Введе-
лежащих протеолитической деградации. Фак-
ние специфического ингибитора CaMKII -
тор элонгации eEF1A, играющий важную роль
myr-AIP (myristoylated autocamtide-2 related
в долговременной синаптической пластич-
inhibitory peptide) - приводило к значитель-
ности [131], связывается с протеасомами [76,
ному снижению индуцированного обуче-
77, 132]. Уровень этого белка снижен в гип-
нием увеличения фосфорилирования Ser120
покампе пациентов с болезнью Альцгейме-
Rpt6-cубъединицы и активности протеасом,
ра [133]. С другой стороны, есть сообщения
не влияя на уровни полиубиквитинирования
о том, что фактор элонгации eEF1A связы-
белков. Специфический ингибитор PKA та-
вает аберрантные белки, высвобождающиеся
ким действием не обладал. Эти и другие дан-
с рибосом, и доставляет их в протеасомы для
ные свидетельствует в пользу того, что CaMKII
последующей деградации [132]. eEF1A взаимо-
участвует в формировании памяти, регулируя
действует преимущественно с Rpt1-субъеди-
фосфорилирование Rpt6 и функцию протеа-
ницей регуляторной 19S-субчастицы, а также
сом [124, 125].
с убиквитинированными белками [132]. Наи-
Полоподобная протеинкиназа 1 (polo-like
более сильное взаимодействие отмечено при
kinase 1 - фермент семейства серин-треони-
истощении АТР; при делеции гена, кодирую-
новых киназ, участвующий в регуляции кле-
щего Rpt1-субъединицу, связывание eEF1A
точного цикла, ответов клетки на поврежде-
с протеасомой снижалось, но не исчезало
ние ДНК и др.) активирует 20S-протеасому,
совсем [132]. Это свидетельствует о том, что
фосфорилируя α-субъединицы [126]. Однако
eEF1A может связываться и с другими компо-
БИОХИМИЯ том 88 вып. 3 2023
ПРОТЕАСОМНЫЙ ИНТЕРАКТОМ МОЗГА
399
нентами протеасом. Последнее, по-видимому,
неканонические функции, действуя, напри-
объясняет тот факт, что в мозге eEF1A обнару-
мер, в качестве шаперонов или белков-инги-
живается как во фракции 26S-протеасом, так и
биторов 20S-протеасомы [134]. С другой сто-
во фракции 20S-протеасом [76, 77].
роны, субъединицы лактатдегидрогеназы [76,
(V ) Метаболические ферменты. Метабо-
77], входящие в состав лактатоксидазного
лические ферменты, ассоциированные с про-
комплекса, обнаруженного в нейронах мозга
теасомами и обнаруженные в протеасомах,
крыс [135], могут служить одним из связующих
выделенных из различных биологических объ-
звеньев между компонентами протеасомного
ектов [69, 70, 72, 73, 75-78], вовлечены прак-
интерактома и митохондриями.
тически во все виды обмена. При этом только
гликолитические ферменты, обнаруженные в
протеасомах (рис. 3) и снабжающие их энерги-
ЗАКЛЮЧЕНИЕ
ей АТР в реакциях субстратного фосфорилиро-
вания, по-видимому, могут рассматриваться в
Протеасомный интерактом содержит
качестве функционально значимых. Во всяком
большое количество белков, которые прини-
случае, субъединицам митохондриального АТР-
мают участие в сборке этих надмолекулярных
синтазного комплекса [73, 78] или транспорт-
комплексов, регуляции функционирования и
ных АТРаз [76, 77] трудно «предложить работу
внутриклеточной локализации. При экстра-
по специальности» в протеасомах. По-види-
поляции на мозг человека данных, получен-
мому, часть этих ферментов (например, уже
ных на различных биологических объектах,
упоминавшаяся ранее ГАФД), не подлежащая
ассоциированные с протеасомами белки со-
деградации в протеасомах, может выполнять
ставляют не менее 28% протеома мозга чело-
века (рис. 4).
В контексте молекулярных функций Gene
Ontology (GO) Pathways белки протеасомного
интерактома обеспечивают взаимодействие
компонентов более 30 метаболических путей,
аннотированных в терминах GO (рис. 5) [136].
Главным итогом этих взаимодействий, по-ви-
димому, является связывание адениновых и
гуаниновых нуклеотидов, которые, очевидно,
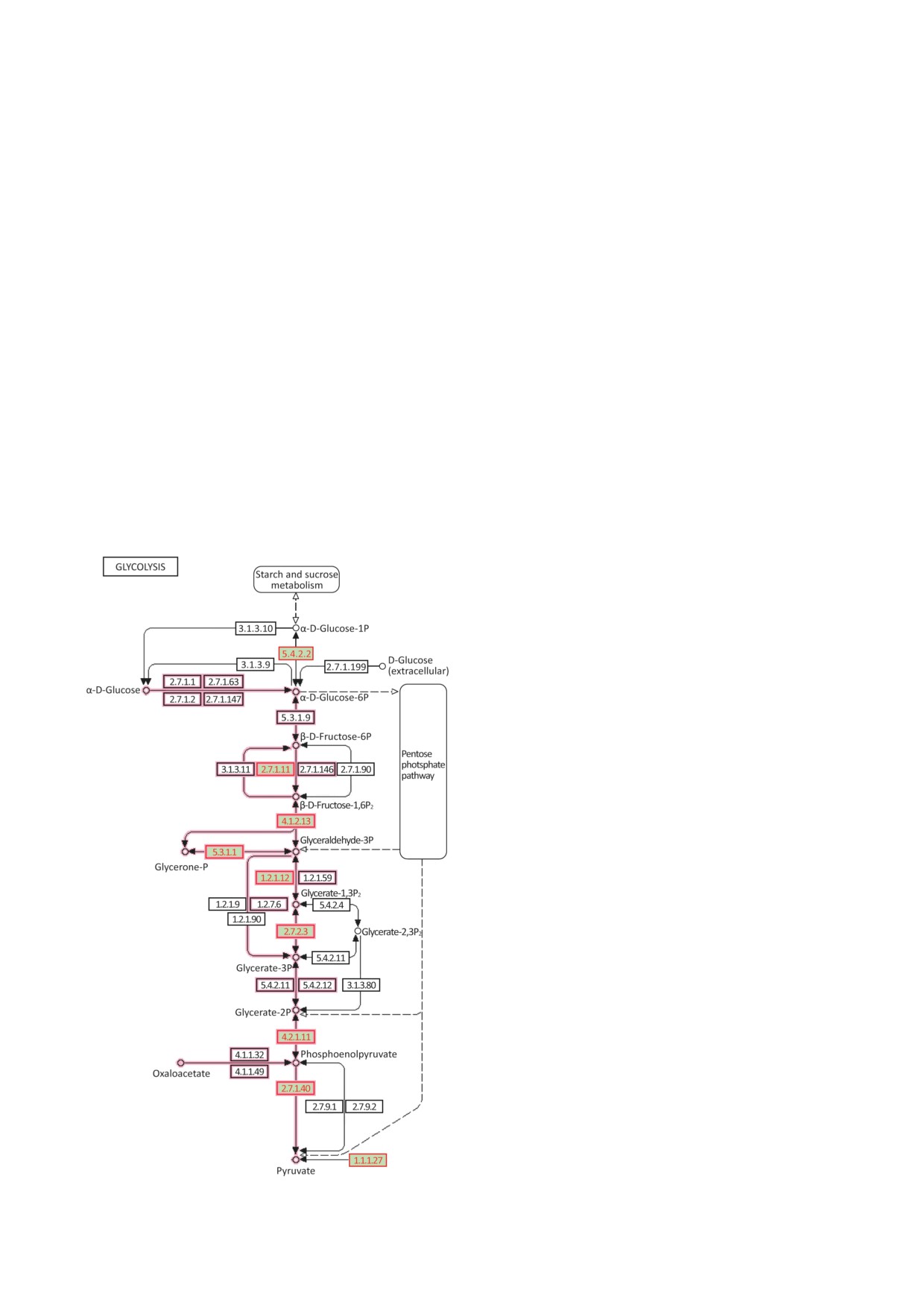
Рис. 3. Обогащение протеасом ферментами гликолиза,
идентифицированными в мозге кролика [76, 77]. Крас-
ным цветом обозначены те реакции гликолиза, участ-
никами которых являются обнаруженные белки. Блоки,
заполненные зеленым цветом, показывают идентифици-
рованные белки, которые обозначены номерами в класси-
фикации ферментов, а также идентификаторами KEGG
и UniProtKB: фосфоглюкомутаза-1 (EC 5.4.2.2; иденти-
фикатор KEGG - K01835, идентификатор UniProtKB -
P36871), АТР-зависимая
6-фосфофруктокиназа (EC
2.7.1.11; идентификатор KEGG - K00850, идентификатор
UniProtKB - P308237), фруктозобисфосфатальдолаза А
(ЕС 4.1.2.13, идентификатор KEGG - K01623, иденти-
фикатор UniProtKB - P04075), триозофосфатизомераза
(EC 5.3.1.1; идентификатор KEGG - K01803, идентифи-
катор UniProtKB - P60174), глицеральдегид-3-фосфатде-
гидрогеназа (EC 1.2.1.12; идентификатор KEGG - K00134,
идентификатор UniProtKB - P04406), фосфоглицерат-
киназа 2 (EC 2.7.2.3; идентификатор KEGG - K00927,
идентификатор UniProtKB
- P07205), альфа-енолаза
(EC 4.2.1.11; идентификатор KEGG - K01689, иденти-
фикатор UniProtKB
- P06733), пируваткиназа PKM
(EC 2.7.1.40; идентификатор KEGG - K00873, иденти-
фикатор UniProtKB - P14618), L-лактатдегидрогеназа
(EC 1.1.1.27; идентификатор KEGG - K00016, идентифи-
катор UniProtKB - P00338). Изображение адаптировано
и взято из открытого ресурса KEGG (Kyoto Encyclopedia
of Genes and Genomes; Kanehisa Laboratory) с разрешения
правообладателя. Идентификатор оригинальной карты
гликолиза KEGG - map00010 [15]
БИОХИМИЯ том 88 вып. 3 2023
400
БУНЕЕВА и др.
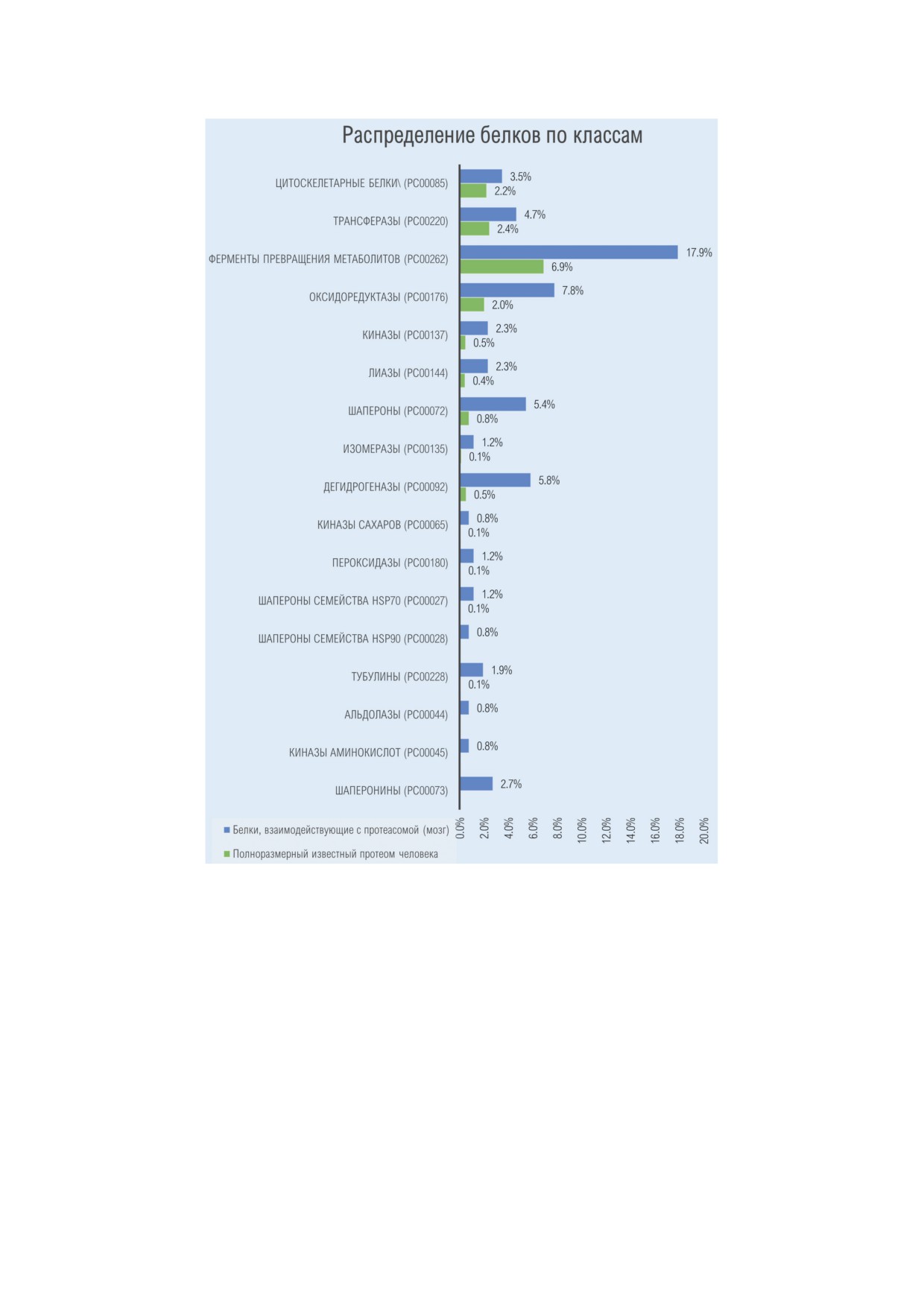
Рис. 4. Функциональные классы (Protein Classes) ассоциированных с протеасомами белков, идентифицированных
в мозге кролика [76, 77] и экстраполированных на протеом человека. Белки, ассоциированные с протеасомой, под-
разделяются на несколько функциональных классов в соответствии с данными анализа ресурса GO Slims https://www.
ebi.ac.uk/QuickGO. Синим цветом обозначен вклад белков в идентифицированном субпротеоме, ассоциированном
с протеасомами, зеленым цветом отмечен вклад идентичного функционального класса в полноразмерном человече-
ском протеоме. Функциональные классы белков (обозначены в скобках) приведены в номенклатуре ресурса Quick GO
Explore Biology
и обеспечивают реализацию нуклеотид-зави-
Хотя в данной области преобладает явный
симых функций 26S- и 20S-протеасом [31, 137,
интерес к разработке и применению инги-
138] в клетках центральной нервной системы и
биторов протеасом для лечения различных
периферических тканей.
видов рака, фармакологической регуляции
Участие протеасом в патогенезе различных
функциональной активности протеасом мозга
заболеваний центральной нервной системы и
также уделяется определенное внимание. По-
периферических тканей делают эти надмоле-
скольку развитие нейродегенеративной пато-
кулярные комплексы привлекательным объек-
логии чаще всего связано с региоселектив-
том таргетной фармакологической регуляции.
ным сниженим функциональной активности
БИОХИМИЯ том 88 вып. 3 2023
ПРОТЕАСОМНЫЙ ИНТЕРАКТОМ МОЗГА
401
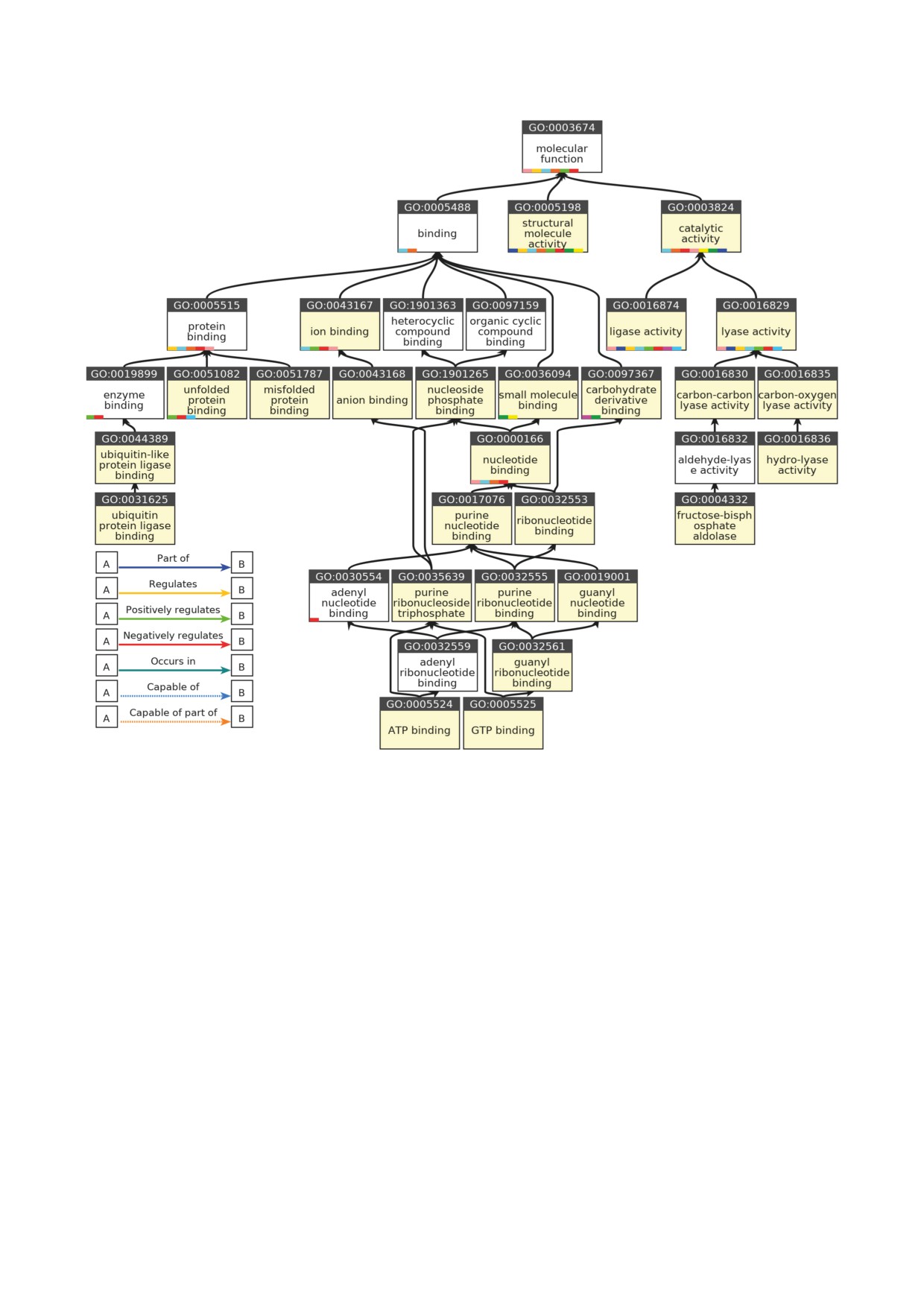
Рис. 5. Молекулярные функции белков мозга [76, 77], ассоциированных с протеасомами. Дерево распределения и взаи-
мосвязи функциональных классов, соответствующих белкам, ассоциированным с протеасомами, реконструировано с
использованием ресурса PANTHER™ Protein Class (версия 17.0, дата обновления 2022-02-22; http://pantherdb.org/) [136].
Анализ группировки функциональных классов выполнен с поправкой FDR < 0,001 против полноразмерного протеома
человека. Желтым цветом выделены блоки классов, к которым принадлежат обнаруженные белки, ассоциированные с
протеасомой; белым цветом отмечены блоки функциональных классов, отвечающих или сопряженных с функциональ-
ными активностями белков, ассоциированными с протеасомами. Идентификаторы молекулярных функций приведены
в номенклатуре Gene Ontology. Цветовые индикаторы в блоках отражают направление воздействия (активности) сосед-
них или связанных блоков
протеасом, положительный терапевтический
CaMKIIα и др.) [139]. В любом случае фар-
эффект, очевидно, будут оказывать факторы,
макологическая регуляция протеасом мозга,
способствующие повышению активности про-
по-видимому, реализуется через изменение
теасом. В качестве одного из основных под-
состава и/или активности белков, ассоцииро-
ходов в настоящее время рассматривается воз-
ванных с протеасомами. Результаты исследо-
можность фармакологического торможения
ваний, проведенных на модельных объектах
активности деубиквитиназ [109]. Блокада этих
in vitro и in vivo [139], внушают определенный
ферментов способствует поступлению убикви-
оптимизм в плане реализуемости данного
тинированных субстратов в протеасомы для
подхода.
последующей протеолитической деградации.
Другой подход, предполагающий посттранс-
Вклад авторов. О.А. Бунеева - анализ соб-
ляционную модификацию субъединиц про-
ственных и литературных данных по теме, на-
теасомного комплекса, связан с рядом ком-
писание глав обзора; А.Т. Копылов - биоин-
понентов протеасомного субпротеома (PKA,
форматический анализ массивов протеомных
4
БИОХИМИЯ том 88 вып. 3 2023
402
БУНЕЕВА и др.
данных, подготовка иллюстративного материа-
Конфликт интересов. Авторы заявляют об
ла, участие в написании глав обзора по ассоции-
отсутствии конфликта интересов.
рованным с протеасомами белкам; А.Е. Медве-
Соблюдение этических норм. Данная работа
дев - концепция обзора, написание отдельных
не предполагала использования людей и жи-
глав обзора, научное редактирование.
вотных в качестве объектов исследования. Ис-
Финансирование. Работа выполнена в
следования авторов оригинальных работ, ре-
рамках Программы фундаментальных науч-
зультаты которых обобщены в данном обзоре,
ных исследований в Российской Федера-
были выполнены с одобрения соответствую-
ции на долгосрочный период (2021-2030 гг.)
щих комитетов по этике, указанных в каждой
(№ 122030100170-5).
процитированной статье.
СПИСОК ЛИТЕРАТУРЫ
1.
Tanaka, K.
(2009) The proteasome: overview of
Биомед. Хим.,
64,
134-148, doi:
10.18097/
structure and functions, Proc. Jpn. Acad. Ser. B Phys.
PBMC20186402134.
Biol. Sci., 85, 12-36, doi: 10.2183/pjab.85.12.
12.
Uversky, V. N., Oldfield, C. J., and Dunker, A. K.
2.
Schmidt, M., and Finley, D.
(2014) Regulation
(2005) Showing your ID: intrinsic disorder as an
of proteasome activity in health and disease,
ID for recognition, regulation and cell signaling,
Biochim. Biophys. Acta, 1843, 13-25, doi: 10.1016/
J. Mol. Recognit.,
18,
343-384, doi:
10.1002/
j.bbamcr.2013.08.012.
jmr.747.
3.
Goldberg, A. L.
(2003) Protein degradation and
13.
Sharon, M., Witt, S., Felderer, K., Rockel, B.,
protection against misfolded or damaged proteins,
Baumeister, W., and Robinson, C. V.
(2006)
20S
Nature, 426, 895-899, doi: 10.1038/nature02263.
proteasomes have the potential to keep substrates in
4.
Hershko, A., and Ciechanover, A. (1992) The ubiq-
store for continual degradation, J. Biol. Chem., 281,
uitin system for protein degradation, Annu. Rev.
9569-9575, doi: 10.1074/jbc.M511951200.
Biochem.,
61,
761-807, doi:
10.1146/annurev.bi.61.
14.
Bard, J. A. M., Goodall, E. A., Greene, E. R.,
070192.003553.
Jonsson, E., Dong, K. C., and Martin, A. (2018)
5.
Driscoll, J., and Goldberg, A. L. (1990) The prote-
Structure and function of the
26S proteasome,
asome (multicatalytic protease) is a component of
Annu. Rev. Biochem.,
87,
697-724, doi:
10.1146/
the 1500-kDa proteolytic complex which degrades
annurev-biochem-062917-011931.
ubiquitin-conjugated proteins, J. Biol. Chem., 265,
15.
Kanehisa, M., Sato, Y., and Kawashima, M. (2022)
4789-4792, doi: 10.1016/S0021-9258(19)34041-4.
KEGG mapping tools for uncovering hidden features
6.
Schwartz, A. L., and Ciechanover, A. (2009) Tar-
in biological data, Protein Sci., 31, 47-53, doi: 10.1002/
geting proteins for destruction by the ubiquitin sys-
pro.4172.
tem: implications for human pathobiology, Annu.
16.
Pickering, A. M., and Davies, K. J. A. (2012) Differen-
Rev. Pharmacol. Toxicol., 49, 73-96, doi: 10.1146/
tial roles of proteasome and immunoproteasome regu-
annurev.pharmtox.051208.165340.
lators Pa28 alpha beta, Pa28 gamma and Pa200 in the
7.
Ben-Nissan, G., and Sharon, M. (2014) Regulating the
degradation of oxidized proteins, Arch. Biochem. Bio-
20S proteasome ubiquitin-independent degradation
phys., 523, 181-190, doi: 10.1016/j.abb.2012.04.018.
pathway, Biomolecules,
4,
862-884, doi:
10.3390/
17.
Funderburk, K. E., Kang, J., and Li, H. J. (2022)
biom4030862.
Regulation of life & death by REGγ, Cells, 11, 2281,
8.
Orlowski, M., and Wilk, S.
(2003) Ubiquitin-
doi: 10.3390/cells11152281.
independent proteolytic functions of the proteasome,
18.
Díaz-Villanueva, J. F., Díaz-Molina, R., and García-
Arch. Biochem. Biophys.,
415,
1-5, doi:
10.1016/
González, V. (2015) Protein folding and mechanisms
s0003-9861(03)00197-8.
of proteostasis, Int. J. Mol. Sci., 16, 17193-17230,
9.
Erales, J., and Coffino, P.
(2014) Ubiquitin-
doi: 10.3390/ijms160817193.
independent proteasomal degradation, Biochim.
19.
Fu, H., Sadis, S., Rubin, D. M., Glickman, M., van
Biophys. Acta,
1843,
216-221, doi:
10.1016/
Nocker, S., Finley, D., and Vierstra, R. D. (1998)
j.bbamcr.2013.05.008.
Multiubiquitin chain binding and protein degradation
10.
Sánchez-Lanzas, R., and Castaño, J. G.
(2014)
are mediated by distinct domains within the 26 S
Proteins directly interacting with mammalian 20S
proteasome subunit Mcb1, J. Biol. Chem., 273, 1970-
proteasomal subunits and ubiquitin-independent
1981, doi: 10.1074/jbc.273.4.1970.
proteasomal degradation, Biomolecules, 4, 1140-1154,
20.
Schreiner, P., Chen, X., Husnjak, K., Randles, L.,
doi: 10.3390/biom4041140.
Zhang, N., Elsasser, S., Finley, D., Dikic, I., Wal-
11.
Бунеева О. А., Медведев А. Е. (2018) Убиквитин-
ters, K. J., and Groll, M. (2008) Ubiquitin dock-
независимая деградация белков в протеасомах,
ing at the proteasome through a novel pleckstrin-
БИОХИМИЯ том 88 вып. 3 2023
ПРОТЕАСОМНЫЙ ИНТЕРАКТОМ МОЗГА
403
homology domain interaction, Nature, 453, 548-552,
32.
Gallastegui, N., and Groll, M.
(2010) The
26S
doi: 10.1038/nature06924.
proteasome: assembly and function of a destructive
21.
Husnjak, K., Elsasser, S., Zhang, N., Chen, X.,
machine, Trends Biochem. Sci.,
35,
634-642,
Randles, L., Shi, Y., Hofmann, K., Walters, K. J.,
doi: 10.1016/j.tibs.2010.05.005.
Finley, D., and Dikic, I. (2008) Proteasome subunit
33.
Kleijnen, M. F., Roelofs, J., Park, S., Hathaway, N. A.,
Rpn13 is a novel ubiquitin receptor, Nature, 453, 481-
Glickman, M., King, R. W., and Finley, D. (2007)
488, doi: 10.1038/nature06926.
Stability of the proteasome can be regulated
22.
Shi, Y., Chen, X., Elsasser, S., Stocks, B. B., Tian, G.,
allosterically through engagement of its proteolytic
Lee, B. H., Shi, Y., Zhang, N., de Poot, S. A. H.,
active sites, Nat. Struct. Mol. Biol., 14, 1180-1188,
Tuebing, F., Sun, S., Vannoy, J., Tarasov, S. G.,
doi: 10.1038/nsmb1335.
Engen, J. R., Finley, D., and Walters, K. J. (2016)
34.
Yazgili, A. S., Ebstein, F., and Meiners, S. (2022)
Rpn1 provides adjacent receptor sites for substrate
The proteasome activator PA200/PSME4: an emerging
binding and deubiquitination by the proteasome,
new player in health and disease, Biomolecules, 12,
Science, 351, 6275, doi: 10.1126/science.aad9421.
1150, doi: 10.3390/biom12081150.
23.
Martinez-Fonts, K., Davis, C., Tomita, T., Elsas-
35.
Griffin, T. A., Nandi, D., Cruz, M., Fehling, H. J.,
ser, S., Nager, A. R., Shi, Y., Finley, D., and Matous-
Kaer, L. V., Monaco, J. J., and Colbert, R. A. (1998)
chek, A. (2020) The proteasome 19S cap and its ubiq-
Immunoproteasome assembly: cooperative incorpo-
uitin receptors provide a versatile recognition platform
ration of interferon gamma (IFN-gamma)-inducible
for substrates, Nat. Commun., 11, 477, doi: 10.1038/
subunits, J. Exp. Med., 187, 97-104, doi: 10.1084/
s41467-019-13906-8.
jem.187.1.97.
24.
Liu, Z., Dong, X., Yi, H. W., Yang, J., Gong, Z.,
36.
Kloetzel, P. M., and Ossendorp, F. (2004) Proteasome
Wang, Y., Liu, K., Zhang, W. P., and Tang, C. (2019)
and peptidase function in MHC-class-I-mediated
Structural basis for the recognition of K48-linked Ub
antigen presentation, Curr. Opin. Immunol., 16, 76-81,
chain by proteasomal receptor Rpn13, Cell. Discov., 5,
doi: 10.1016/j.coi.2003.11.004.
19, doi: 10.1038/s41421-019-0089-7.
37.
Johnston-Carey, H. K., Pomatto, L. C., and Davies, K. J.
25.
Kish-Trier, E., and Hill, C. P. (2013) Structural
(2015) The immunoproteasome in oxidative stress,
biology of the proteasome, Annu. Rev. Biophys., 42,
aging, and disease, Crit. Rev. Biochem. Mol. Biol., 51,
29-49, doi: 10.1146/annurev-biophys-083012-130417.
268-281, doi: 10.3109/10409238.2016.1172554.
26.
Da Fonseca, P. C., and Morris, E. P.,
(2008)
38.
Ferrington, D. A., and Gregerson, D. S. (2012) Im-
Structure of the human 26S proteasome: subunit
munoproteasomes: structure, function, and an-
radial displacements open the gate into the proteolytic
tigen presentation, Prog. Mol. Biol. Transl. Sci.,
core, J. Biol. Chem., 283, 23305-23314, doi: 10.1074/
109,
75-112, doi:
10.1016/B978-0-12-397863-9.
jbc.M802716200.
00003-1.
27.
Sahu, I., and Glickman, M. H. (2021) Proteasome in
39.
Wang, X., Chemmama, I. E., Yu, C., Huszagh, A.,
action: substrate degradation by the 26S proteasome,
Xu, Y., Viner, R., Block, S. A., Cimermancic, P.,
Biochem. Soc. Trans., 49, 629-644, doi: 10.1042/
Rychnovsky, S. D., Ye, Y., Sali, A., and Huang, L.
BST20200382.
(2017) The proteasome-interacting Ecm29 protein dis-
28.
Leggett, D. S., Hanna, J., Borodovsky, A., Crosas, B.,
assembles the 26S proteasome in response to oxidative
Schmidt, M., Baker, R. T., Walz, T., Ploegh, H., and
stress, J. Biol. Chem., 292, 16310-16320, doi: 10.1074/
Finley, D. (2002) Multiple associated proteins regulate
jbc.M117.803619.
proteasome structure and function, Mol. Cell, 10, 495-
40.
Minis, A., Rodriguez, J. A., Levin, A., Liu, K.,
507, doi: 10.1016/s1097-2765(02)00638-x.
Govek, E. E., Hatten, M. E., and Steller, H. (2019)
29.
Lander, G. C., Estrin, E., Matyskiela, M. E.,
The proteasome regulator PI31 is required for protein
Bashore, C., Nogales, E., and Martin, A.
(2012)
homeostasis, synapse maintenance, and neuronal
Complete subunit architecture of the proteasome
survival in mice, Proc. Natl. Acad. Sci. USA, 116,
regulatory particle, Nature, 482, 186-191, doi: 10.1038/
24639-24650, doi: 10.1073/pnas.1911921116.
nature10774.
41.
Budenholzer, L., Cheng, C. L., Li, Y., and Hoch-
30.
Guterman, A., and Glickman, M. H. (2004) Comple-
strasser, M. (2017) Proteasome structure and as-
mentary roles for Rpn11 and Ubp6 in deubiquitination
sembly, J. Mol. Biol., 429, 3500-3524, doi: 10.1016/
and proteolysis by the proteasome, J. Biol. Chem., 279,
j.jmb.2017.05.027.
1729-1738, doi: 10.1074/jbc.M307050200.
42.
Livneh, I., Cohen-Kaplan, V., Cohen-Rosenzweig,
31.
Smith, D. M., Chang, S. C., Park, S., Finley, D.,
C., Avni, N., and Ciechanover, A. (2016) The life cycle
Cheng, Y., and Goldberg, A. L. (2007) Docking
of the 26S proteasome: from birth, through regulation
of the proteasomal ATPases’ carboxyl termini in
and function, and onto its death, Cell Res., 26, 869-
the 20S proteasome’s alpha ring opens the gate for
885, doi: 10.1038/cr.2016.86.
substrate entry, Mol. Cell., 27, 731-744, doi: 10.1016/
43.
Rousseau, A., and Bertolotti, A.
(2018) Regula-
j.molcel.2007.06.033.
tion of proteasome assembly and activity in health
БИОХИМИЯ том 88 вып. 3 2023
4*
404
БУНЕЕВА и др.
and disease, Nat. Rev. Mol. Cell Biol., 19, 697-712,
53.
Gu, Z. C., Wu, E., Sailer, C., Jando, J., Styles, E.,
doi: 10.1038/s41580-018-0040-z.
Eisenkolb, I., Kuschel, M., Bitschar, K., Wang, X.,
44.
Meul, T., Berschneider, K., Schmitt, S., Mayr, C. H.,
Huang, L., Vissa, A., Yip, C.M., Yedidi. R.S.,
Mattner, L. F., Schiller, H. B., Yazgili, A. S., Wang, X.,
Friesen, H., and Enenkel, C. (2017) Ubiquitin orches-
Lukas, C., Schlesser, C., Prehn, C., Adamski, J.,
trates proteasome dynamics between proliferation and
Graf, E., Schwarzmayr, T., Perocchi, F., Kukat, A.,
quiescence in yeast, Mol. Biol. Cell, 28, 2479-2491,
Trifunovic, A., Kremer, L., Prokisch, H., Popper, B.,
doi: 10.1091/mbc.E17-03-0162.
von Toerne, C., Hauck, S. M., Zischka, H., and
54.
Fabunmi, R. P., Wigley, W. C., Thomas, P. J., and
Meiners, S. (2020) Mitochondrial regulation of the
DeMartino, G. N. (2001) Interferon gamma regulates
26S proteasome, Cell Rep., 32, 108059, doi: 10.1016/
accumulation of the proteasome activator PA28 and
j.celrep.2020.108059.
immunoproteasomes at nuclear PML bodies, J. Cell
45.
Enenkel, C., Kang, R. W., Wilfling, F., and Ernst, O. P.
Sci., 114, 29-36, doi: 10.1242/jcs.114.1.29.
(2022) Intracellular localization of the proteasome
55.
Mediani, L., Guillen-Boixet, J., Vinet, J., Franz-
in response to stress conditions, J. Biol. Chem., 298,
mann, T. M., Bigi, I., Mateju, D., Carrà, A.D.,
102083, doi: 10.1016/j.jbc.2022.102083.
Morelli, F.F., Tiago, T., Poser, I., Alberti, S., and
46.
Herter, J. R., and Fuchs, S. Y. (2002) Recognition of
Carra, S.
(2019) Defective ribosomal products
substrate and Skp1 by the Homologue of Slimb (HOS)
challenge nuclear function by impairing nuclear
ubiquitin ligase receptor D role of the F-box, Med. Sci.
condensate dynamics and immobilizing ubiquitin,
Monit., 8, BR283-BR288.
EMBO J., 38, 101341, doi: 10.15252/embj.2018101341.
47.
Dawson, S., Hastings, R., Takayanagi, K., Reyn-
56.
Ramachandran, K. V., and Margolis, S. S. (2017)
olds, S., Low, P., Billett, M., and Mayer, R. J.
A mammalian nervous-system-specific plasma mem-
(1997) The
26S-proteasome: regulation and sub-
brane proteasome complex that modulates neuro-
strate recognition, Mol. Biol. Rep.,
24,
39-44,
nal function, Nat. Struct. Mol. Biol., 24, 419-430,
doi: 10.1023/a:1006800522814.
doi: 10.1038/nsmb.3389.
48.
Devine, T., and Dai, M. S. (2013) Targeting the
57.
Türker, F., Cook, E. K., and Margolis, S. S. (2021)
ubiquitin-mediated proteasome degradation of p53
The proteasome and its role in the nervous system,
for cancer therapy, Curr. Pharm. Des., 19, 3248-3262,
Cell. Chem. Biol., 28, 903-917, doi: 10.1016/j.chembiol.
doi: 10.2174/1381612811319180009.
2021.04.003.
49.
de Almeida, M., Hinterndorfer, M., Brunner, H.,
58.
Guo, X., Huang, X., and Chen, M. J. (2017) Reversible
Grishkovskaya, I., Singh, K., Schleiffer, A., Jude, J.,
phosphorylation of the 26S proteasome, Protein Cell,
Deswal, S., Kalis, R., Vunjak, M., Lendl, T., Imre, R.,
8, 255-272, doi: 10.1007/s13238-017-0382-x.
Roitinger, E., Neumann, T., Kandolf, S., Schutz-
59.
Myeku, N., Clelland, C. L., Emrani, S., Kukush-
bier, M., Mechtler, K., Versteeg, G. A., Haselbach, D.,
kin, N. V., Yu, W. H., Goldberg, A. L., and Duff, K. E.
and Zuber, J. (2021) AKIRIN2 controls the nuclear
(2016) Tau-driven 26S proteasome impairment and
import of proteasomes in vertebrates, Nature, 599,
cognitive dysfunction can be prevented early in disease
491-496, doi: 10.1038/s41586-021-04035-8.
by activating cAMP-PKA signaling, Nat. Med., 22, 46-
50.
Uriarte, M., Sen Nkwe, N., Tremblay, R., Ahmed, O.,
53, doi: 10.1038/nm.4011.
Messmer, C., Mashtalir, N., Barbour, H., Masclef, L.,
60.
VerPlank, J. J. S., Tyrkalska, S. D., Fleming, A., Ru-
Voide, M., Viallard, C., Daou, S., Abdelhadi, D.,
binsztein, D. C., and Goldberg, A. L. (2020) CGMP
Ronato, D., Paydar, M., Darracq, A., Boulay, K.,
via PKG activates 26S proteasomes and enhances deg-
Desjardins-Lecavalier, N., Sapieha, P., Masson J.-Y.,
radation of proteins, including ones that cause neuro-
Sergeev, M., Kwok, B. H., Hulea, L., Mallette F. A.,
degenerative diseases, Proc. Natl. Acad. Sci. USA, 117,
Milot, E., Larrivée, B., Wurtele, H., and Affar, E. B.
14220-14230, doi: 10.1073/pnas.2003277117.
(2021) Starvation-induced proteasome assemblies in
61.
Zhang, F., Su, K., Yang, X., Bowe, D. B., Pater-
the nucleus link amino acid supply to apoptosis, Nat.
son, A. J., and Kudlow, J. E. (2003) O-GlcNAc
Commun., 12, 6984, doi: 10.1038/s41467-021-27306-4.
modification is an endogenous inhibitor of the
51.
Yasuda, S., Tsuchiya, H., Kaiho, A., Guo, Q.,
proteasome, Cell, 115, 715-725, doi: 10.1016/S0092-
Ikeuchi, K., Endo, A., Arai N, Ohtake, F., Murata, S.,
8674(03)00974-7.
Inada, T., Baumeister, W., Fernández-Busnadiego, R.,
62.
Cho-Park, P. F., and Steller, H. (2013) Proteasome
Tanaka, K., and Saeki, Y.
(2020) Stress- and
regulation by ADP-ribosylation, Cell, 153, 614-627,
ubiquitylation-dependent phase separation of the
doi: 10.1016/j.cell.2013.03.040.
proteasome, Nature,
578,
296-300, doi:
10.1038/
63.
Gomes, A. V., Zong, C., Edmondson, R. D., Li, X.,
s41586-020-1982-9.
Stefani, E., Zhang, J., Jones, R. C., Thyparambil, S.,
52.
Kaganovich, D., Kopito, R., and Frydman, J. (2008)
Wang, G. W., Qiao, X., Bardag-Gorce, F., and Ping, P.
Misfolded proteins partition between two distinct
(2006) Mapping the murine cardiac 26S proteasome
quality control compartments, Nature, 454, 1088-
complexes, Circ. Res., 99, 362-371, doi: 10.1161/
1095, doi: 10.1038/nature07195.
01.RES.0000237386.98506.f7.
БИОХИМИЯ том 88 вып. 3 2023
ПРОТЕАСОМНЫЙ ИНТЕРАКТОМ МОЗГА
405
64.
Guo, X. (2022) Localized proteasomal degradation:
acterization of dynamic UbR-proteasome subcom-
from the nucleus to cell periphery, Biomolecules, 12,
plexes by in vivo cross-linking (X) assisted bimolecular
229, doi: 10.3390/biom12020229.
tandem affinity purification (XBAP) and label-free
65.
Wang, D., Fang, C., Zong, N. C., Liem, D. A.,
quantitation, Mol. Cell. Proteomics, 15, 2279-2292,
Cadeiras, M., Scruggs, S. B., Yu, H., Kim, A. K.,
doi: 10.1074/mcp.M116.058271.
Yang, P., Deng, M., Lu, H., and Ping, P. (2013)
75.
Артамонова Т. О., Ходорковский М. А., Цимо-
Regulation of acetylation restores proteolytic function
ха А. С. (2014) Масс-спектрометрический ана-
of diseased myocardium in mouse and human, Mol.
лиз аффинно-очищенных протеасом из кле-
Cell. Proteomics, 12, 3793-3802, doi: 10.1074/mcp.
ток миелогенной лейкемии человека линии
M113.028332.
К562, Биоорг. Химия, 40, 720-734, doi: 10.1134/
66.
Bi, M., Du, X., Jiao, Q., Chen, X., and Jiang, H.
s1068162014060041.
(2021) Expanding the role of proteasome homeostasis
76.
Buneeva, O., Kopylov, A., Kaloshina, S., Zgoda, V.,
in Parkinson’s disease: beyond protein breakdown, Cell
and Medvedev, A. (2021) 20S and 26S proteasome-
Death Dis., 12, 154, doi: 10.1038/s41419-021-03441-0.
binding proteins of the rabbit brain: a proteomic
67.
Silva, G. M., Netto, L. E., Discola, K. F., Piassa-
dataset, Data Brief, 38, 107276, doi: 10.1016/j.dib.
Filho, G. M., Pimenta, D. C., Bárcena, J. A., and
2021.107276.
Demasi, M.
(2008) Role of glutaredoxin
2 and
77.
Бунеева О. А., Копылов А. Т., Згода В. Г., Гнеден-
cytosolic thioredoxins in cysteinyl-based redox
ко О. В., Калошина С. А., Медведева М. В., Ива-
modification of the 20S proteasome, FEBS J., 275,
нов А. С., Медведев А. Е. (2022) Сравнительный
2942-2955, doi: 10.1111/j.1742-4658.2008.06441.
анализ белков, ассоциированных с 26S и 20S про-
68.
Wang, X., Chen, C. F., Baker, P. R., Chen, P. L.,
теасомами мозга и печени кролика, Биомед. Хим.,
Kaiser, P., and Huang, L. (2007) Mass spectrometric
68, 18-31, doi: 10.18097/PBMC20226801018.
characterization of the affinity-purified human 26S
78.
Besche, H. C., Haas, W., Gygi, S. P., and Gold-
proteasome complex, Biochemistry, 46, 3553-3565,
berg, A. L. (2009) Isolation of mammalian 26S pro-
doi: 10.1021/bi061994u.
teasomes and p97/VCP complexes using the ubiq-
69.
Tai, H. C., Besche, H., Goldberg, A. L., and
uitin-like domain from HHR23B reveals novel
Schuman, E. M. (2010) Characterization of the brain
proteasome-associated proteins, Biochemistry,
48,
26S proteasome and its interacting proteins, Front.
2538-2549, doi: 10.1021/bi802198q.
Mol. Neurosci., 3, 12, doi: 10.3389/fnmol.2010.00012.
79.
Schubert, U., Antón, L. C., Gibbs, J., Norbury, C. C.,
70.
Verma, R., Chen, S., Feldman, R., Schieltz, D.,
Yewdell, J. W., and Bennink, J. R. (2000) Rapid
Yates, J., Dohmen, J., and Deshaies, R. J. (2000)
degradation of a large fraction of newly synthesized
Proteasomal proteomics: identification of nucleo-
proteins by proteasomes, Nature,
404,
770-774,
tide-sensitive proteasome-interacting proteins by mass
doi: 10.1038/35008096.
spectrometric analysis of affinity-purified protea-
80.
Jia, J., Arif, A., Willard, B., Smith, J. D., Stuehr, D. J.,
somes, Mol. Biol. Cell, 11, 3425-3439, doi: 10.1091/
Hazen, S. L., and Fox, P. L. (2012) Protection of
mbc.11.10.3425.
extraribosomal RPL13a by GAPDH and dysregulation
71.
Guerrero, C., Tagwerker, C., Kaiser, P., and
by S-nitrosylation, Mol. Cell,
47,
656-663,
Huang, L. (2006) An integrated mass spectrometry-
doi: 10.1016/j.molcel.2012.06.006.
based proteomic approach: quantitative analysis of
81.
Lazarev, V. F., Nikotina, A. D., Mikhaylova, E. R.,
tandem affinity-purified in vivo cross-linked protein
Nudler, E., Polonik, S. G., Guzhova, I. V., and
complexes (QTAX) to decipher the 26 S proteasome-
Margulis, B. A. (2016) Hsp70 chaperone rescues
interacting network, Mol. Cell. Proteomics, 5, 366-378,
C6 rat glioblastoma cells from oxidative stress by
doi: 10.1074/mcp.M500303-MCP200.
sequestration of aggregating GAPDH, Biochem.
72.
Guerrero, C., Milenkovic, T., Przulj, N., Kaiser, P.,
Biophys. Res. Commun., 470, 766-771, doi: 10.1016/
and Huang, L. (2008) Characterization of the pro-
j.bbrc.2015.12.076.
teasome interaction network using a QTAX-based
82.
Ishihama, Y., Oda, Y., Tabata, T., Sato, T., Nagasu, T.,
tag-team strategy and protein interaction network an-
Rappsilber, J., and Mann, M. (2005) Exponentially
alysis, Proc. Natl. Acad. Sci. USA, 105, 13333-13338,
modified protein abundance index (emPAI) for
doi: 10.1073/pnas.0801870105.
estimation of absolute protein amount in proteomics
73.
Зайкова Ю. Я., Куличкова В. А., Ермолаева Ю. Б.,
by the number of sequenced peptides per protein,
Боттрилл А., Барлев Н. А., Цимоха А. С. (2013)
Mol. Cell. Proteomics, 4, 1265-1272, doi: 10.1074/mcp.
Характеристика внеклеточных протеасом и ассо-
M500061-MCP200.
циированных с ними белков методом iTRAQ-
83.
Binns, D., Dimmer, E., Huntley, R., Barrell, D.,
масс-спектрометрии, Цитология,
55,
111-122,
O’Donovan, C., and Apweiler, R. (2009) QuickGO:
doi: 10.1134/S1990519X13030139.
a web-based tool for gene ontology searching, Bioin-
74.
Yu, C., Yang, Y., Wang, X., Guan, S., Fang, L., Liu, F.,
formatics, 25, 3045-3046, doi: 10.1093/bioinformatics/
Walters, K. J., Kaiser, P., and Huang, L. (2016) Char-
btp536.
БИОХИМИЯ том 88 вып. 3 2023
406
БУНЕЕВА и др.
84.
Kohr, M. J., Murphy, E., and Steenbergen, C. (2014)
96. Deveraux, Q., Ustrell, V., Pickart, C., and Rech-
Glyceraldehyde-3-phosphate dehydrogenase acts as a
steiner, M. (1994) A 26S protease subunit that binds
mitochondrial trans-S-nitrosylase in the heart, PLoS
ubiquitin conjugates, J. Biol. Chem., 269, 7059-7061.
One, 9, 111448, doi: 10.1371/journal.pone.0111448.
97. Hamazaki, J., Sasaki, K., Kawahara, H., Hisanaga, S.,
85.
Qiao, G., Wu, A., Chen, X., Tian, Y., and Lin, X.
Tanaka, K., and Murata, S. (2007) Rpn10-mediated
(2021) Enolase 1, a moonlighting protein, as a potential
degradation of ubiquitinated proteins is essential for
target for cancer treatment, Int. J. Biol. Sci., 17, 3981-
mouse development, Mol. Cell. Biol., 19, 6629-6638,
3992, doi: 10.7150/ijbs.63556.
doi: 10.1128/MCB.00509-07.
86.
Didiasova, M., Schaefer, L., and Wygrecka, M. (2019)
98. Buneeva, O. A., Kopylov, A. T., and Medvedev, A. E.
When place matters: shuttling of enolase-1 across
(2020) Qualitative difference of mitochondrial sub-
cellular compartments, Front. Cell Dev. Biol., 7, 61,
proteoms of brain RPN10- and RPN13-binding pro-
doi: 10.3389/fcell.2019.00061.
teins, Biomed. Khim., 66, 138-144, doi: 10.18097/
87.
Ejiri, S. (2002) Moonlighting functions of polypeptide
PBMC20206602138.
elongation factor 1: from actin bundling to zinc finger
99. Asano, S., Fukuda, Y., Beck, F., Aufderheide, A.,
protein R1-associated nuclear localization, Biosci.
Förster, F., Danev, R., and Baumeister, W. (2015)
Biotechnol. Biochem., 66, 1-21, doi: 10.1271/bbb.66.1.
Proteasomes. A molecular census of 26S proteasomes
88.
Pirovich, D. B., Da’dara, A. A., and Skelly, P. J. (2021)
in intact neurons, Science, 347, 439-442, doi: 10.1126/
Multifunctional fructose
1,6-bisphosphate aldolase
science.1261197.
as a therapeutic target, Front. Mol. Biosci., 8, 719678,
100. Wójcik, C., and DeMartino, G. N. (2003) Intracellular
doi: 10.3389/fmolb.2021.719678.
localization of proteasomes, Int. J. Biochem. Cell Biol.,
89.
Gizak, A., Wiśniewski, J., Heron, P., Mamczur, P.,
35, 579-589, doi: 10.1016/s1357-2725(02)00380-1.
Sygusch, J., and Rakus, D.
(2019) Targeting a
101. Otero, M. G., Alloatti, M., Cromberg, L. E., Almenar-
moonlighting function of aldolase induces apoptosis
Queralt, A., Encalada, S. E., Pozo Devoto, V. M.,
in cancer cells, Cell Death Dis., 10, 712, doi: 10.1038/
Bruno, L., Goldstein, L. S., and Falzone, T. L.
s41419-019-1968-4.
(2014) Fast axonal transport of the proteasome
90.
Conrad, M., Schneider, M., Seiler, A., and Born-
complex depends on membrane interaction and
kamm, G. W. (2007) Physiological role of phospholipid
molecular motor function, J. Cell Sci., 127, 1537-1549,
hydroperoxide glutathione peroxidase in mammals,
doi: 10.1242/jcs.140780.
Biol Chem., 388, 1019-1025, doi: 10.1515/BC.2007.130.
102. Oddo, S. (2008) The ubiquitin-proteasome system in
91.
Haraguchi, C. M., Mabuchi, T., Hirata, S., Shoda, T.,
Alzheimer’s disease, J. Cell. Mol. Med., 12, 363-373,
Yamada, A. T., Hoshi, K., and Yokota, S. (2003)
doi: 10.1111/j.1582-4934.2008.00276.x.
Spatiotemporal changes of levels of a moonlighting
103. Yi, J. J., and Ehlers, M. D. (2007) Emerging roles
protein, phospholipid hydroperoxide glutathione per-
for ubiquitin and protein degradation in neuronal
oxidase, in subcellular compartments during sper-
function, Pharmacol. Rev., 59, 14-39, doi: 10.1124/
matogenesis in the rat testis, Biol. Reprod., 69, 885-
pr.59.1.4.
895, doi: 10.1095/biolreprod.102.013524.
104. Hsu, M. T., Guo, C. L., Liou, A. Y., Chang, T. Y.,
92.
Jeffery, C. J. (2018) Protein moonlighting: what is it,
Ng, M. C., Florea, B. I., Overkleeft, H. S., Wu, Y. L.,
and why is it important? Philos. Trans. R. Soc. Lond. B
Liao, J. C., and Cheng, P. L. (2015) Stage-dependent
Biol Sci., 373, 20160523, doi: 10.1098/rstb.2016.0523.
axon transport of proteasomes contributes to axon
93.
Brighenti, E., Carnicelli, D., Brigotti, M., and Fiume, L.
development, Dev. Cell, 35, 418-431, doi: 10.1016/
(2017) The inhibition of lactate dehydrogenase A hin-
j.devcel.2015.10.018.
ders the transcription of histone 2B gene independent-
105. Kreko-Pierce, T., and Eaton, B. A (2017) The Dro-
ly from the block of aerobic glycolysis, Biochem.
sophila LC8 homolog cut up specifies the axonal trans-
Biophys. Res. Commun., 485, 742-745, doi: 10.1016/
port of proteasomes, J. Cell Sci., 130, 3388-3398,
j.bbrc.2017.02.119.
doi: 10.1242/jcs.207027.
94.
Auer, J., Camoin, L., Courtot, A. M., Hotellier, F.,
106. Ibañez-Vega, J., Del Valle Batalla, F., Saez, J. J.,
and De Almeida, M. (2004) Evidence that P36, a
Soza, A., and Yuseff, M. I.
(2019) Proteasome
human sperm acrosomal antigen involved in the
dependent actin remodeling
facilitates antigen
fertilization process is triosephosphate isomerase, Mol.
extraction at the immune synapse of B cells, Front.
Reprod. Dev., 68, 515-523, doi: 10.1002/mrd.20107.
Immunol., 10, 225, doi: 10.3389/fimmu.2019.00225.
95.
Медведев А. Е., Бунеева О. А., Копылов А. Т., Ти-
107. Bader, M., Benjamin, S., Wapinski, O. L.,
хонова О. В., Медведева М. В., Неробкова Л. Н.,
Smith, D. M., Goldberg, A. L., and Steller, H. (2011)
Капица И. Г., Згода В. Г. (2017) Митохондриальный
A conserved F box regulatory complex controls pro-
субпротеом Rpn10-связывающих белков мозга и
teasome activity in Drosophila, Cell, 145, 371-382,
его изменения, индуцированные нейротоксином
doi: 10.1016/j.cell.2011.03.021.
МФТП и нейропротектором изатином, Биохимия,
108. Liu, K., Jones, S., Minis, A., Rodriguez, J., Molina, M.,
82, 470-480, doi: 10.1134/S0006297917030117.
and Steller, H. (2019) PI31 is an adaptor protein
БИОХИМИЯ том 88 вып. 3 2023
ПРОТЕАСОМНЫЙ ИНТЕРАКТОМ МОЗГА
407
for proteasome transport in axons and required
of oxidized calmodulin by the 20 S proteasome,
for synaptic development, Dev. Cell, 50, 509-524,
J. Biol. Chem., 279, 46135-46142, doi: 10.1074/jbc.
doi: 10.1016/j.devcel.2019.06.009.
M406048200.
109. Buneeva, O., and Medvedev, A.
(2022) Atypical
121. Bingol, B., Wang, C. F., Arnott, D., Cheng, D.,
ubiquitination and Parkinson’s disease, Int. J. Mol.
Peng, J., and Sheng, M. (2010) Autophosphorylated
Sci., 23, 3705, doi: 10.3390/ijms23073705.
CaMKIIα acts as a scaffold to recruit proteasomes
110. Gorbea, C., Pratt, G., Ustrell, V., Bell, R.,
to dendritic spines, Cell, 140, 567-578, doi: 10.1016/
Sahasrabudhe, S., Hughes, R. E., and Rechsteiner, M.
j.cell.2010.01.024.
(2010) A protein interaction network for Ecm29
122. Djakovic, S. N., Marquez-Lona, E. M., Jakawich, S. K.,
links the 26 S proteasome to molecular motors and
Wright, R., Chu, C., Sutton, M. A., and Patrick, G.
endosomal components, J. Biol. Chem., 285, 31616-
N. (2012) Phosphorylation of Rpt6 regulates synaptic
31633, doi: 10.1074/jbc.M110.154120.
strength in hippocampal neurons, J. Neurosci., 32,
111. Zhao, J., Fok, A. H. K., Fan, R., Kwan, P.Y.,
5126-5131, doi: 10.1523/JNEUROSCI.4427-11.2012.
Chan, H. L., Lo, L. H., Chan, Y. S., Yung, W. H.,
123. Hamilton, A. M., Oh, W. C., Vega-Ramirez, H.,
Huang, J., Lai, C. S. W., and Lai, K. O. (2020)
Stein, I. S., Hell, J. W., Patrick, G. N., and Zito, K.
Specific depletion of the motor protein KIF5B leads to
(2012) Activity-dependent growth of new dendritic
deficits in dendritic transport, synaptic plasticity and
spines is regulated by the proteasome, Neuron, 74,
memory, eLife, 9, e53456, doi: 10.7554/eLife.53456.
1023-1030, doi: 10.1016/j.neuron.2012.04.031.
112. Kundrat, L., and Regan, L. (2010) Balance between
124. Jarome, T. J., Kwapis, J. L., Ruenzel, W. L., and
folding and degradation for Hsp90-dependent client
Helmstetter, F. J. (2013) CaMKII, but not protein ki-
proteins: a key role forCHIP, Biochemistry, 49, 7428-
nase A, regulates Rpt6 phosphorylation and protea-
7438, doi: 10.1021/bi100386w.
some activity during the formation of long-term mem-
113. Luders, J., Demand, J., and Hohfeld, J. (2000) The
ories, Front. Behav. Neurosci., 7, 115, doi: 10.3389/
ubiquitin-related BAG-1 provides a link between the
fnbeh.2013.00115.
molecular chaperones Hsc70/Hsp70 and the prote-
125. Jarome, T. J., Ferrara, N. C., Kwapis, J. L., and Helm-
asome, J. Biol. Chem., 275, 4613-4617, doi: 10.1074/
stetter, F. J. CaMKII regulates proteasome phosphor-
jbc.275.7.4613.
ylation and activity and promotes memory destabiliza-
114. Murata, S., Minami, Y., Minami, M., Chiba, T., and
tion following retrieval, Neurobiol. Learn. Mem., 128,
Tanaka, K. (2001) CHIP is a chaperone-dependent E3
103-109, doi: 10.1016/j.nlm.2016.01.001.
ligase that ubiquitylates unfolded protein, EMBO Rep.,
126. Feng, Y., Longo, D. L., and Ferris, D. K. (2001) Polo-
2, 1133-1138, doi: 10.1093/embo-reports/kve246.
like kinase interacts with proteasomes and regulates
115. Reeg, S., Jung, T., Castro, J. P., Davies, K. J. A.,
their activity, Cell Growth Differ., 12, 29-37.
Henze, A., and Grune, T. (2016) The molecular
127. Metselaar, D. S., du Chatinier, A., Meel, M. H.,
chaperone Hsp70 promotes the proteolytic removal
Ter Huizen, G., Waranecki, P., Goulding, J. R.,
of oxidatively damaged proteins by the proteasome,
Bugiani, M., Koster, J., Kaspers, G. J. L., and
Free Radic. Biol. Med., 99, 153-166, doi: 10.1016/
Hulleman, E. (2022) AURKA and PLK1 inhibition
j.freeradbiomed.2016.08.002.
selectively and synergistically block cell cycle progres-
116. Davies, K. J. (2001) Degradation of oxidized proteins
sion in diffuse midline glioma, iScience, 25, 104398,
by the
20S proteasome, Biochimie,
83,
301-310,
doi: 10.1016/j.isci.2022.104398.
doi: 10.1016/s0300-9084(01)01250-0.
128. Colbran, R. J., and Brown, A. M. (2004) Calcium/
117. Reinhecke, T., Sitte, N., Ullrich, O., Kuckelkorn, U.,
calmodulin-dependent protein kinase II and synaptic
Davies, K. J., and Grune, T. (1998) Comparative
plasticity, Curr. Opin. Neurobiol.,
14,
318-327,
resistance of the 20S and 26S proteasome to oxidative
doi: 10.1016/j.conb.2004.05.008.
stress, Biochem. J.,
335,
637-642, doi:
10.1042/
129. Tarcsa, E., Szymanska, G., Lecker, S., O’Con-
bj3350637.
nor, C. M., and Goldberg, A. L. (2000) Ca2+-free
118. Reinheckel, T., Ullrich, O., Sitte, N., and Grune, T.
calmodulin and calmodulin damaged by in vitro aging
(2000) Differential impairment of
20S and
26S
are selectively degraded by 26 S proteasomes with-
proteasome activities in human hematopoietic K562
out ubiquitination, J. Biol. Chem., 275, 20295-20301,
cells during oxidative stress, Arch. Biochem. Biophys.,
doi: 10.1074/jbc.M001555200.
377, 65-68, doi: 10.1006/abbi.2000.1717.
130. Kito, Y., Matsumoto, M., Hatano, A., Takami, T.,
119. Conconi, M., Petropoulos, I., Emod, I., Turlin, E.,
Oshikawa, K., Matsumoto, A., and Nakayama, K. I.
Biville, F., and Friguet, B. (1998) Protection from
(2020) Cell cycle-dependent localization of the
oxidative inactivation of the
20S proteasome by
proteasome to chromatin, Sci. Rep.,
10,
5801,
heat-shock protein 90, Biochem. J., 333, 407-415,
doi: 10.1038/s41598-020-62697-2.
doi: 10.1042/bj3330407.
131. Beckelman, B. C., Day, S., Zhou, X., Donohue, M.,
120. Whittier, J. E., Xiong, Y., Rechsteiner, M. C., and
Gouras, G. K., Klann, E., Keene, C. D., and Ma, T.
Squier, T. C. (2004) Hsp90 enhances degradation
(2016) Dysregulation of elongation factor
1A
БИОХИМИЯ том 88 вып. 3 2023
408
БУНЕЕВА и др.
expression is correlated with synaptic plasticity
stration of an essential component of brain lactate
impairments in Alzheimer’s disease, J. Alzheimers Dis.,
shuttles, PLoS One, 3, e2915, doi: 10.1371/journal.
54, 669-678, doi: 10.3233/JAD-160036.
pone.0002915.
132. Chuang, S. M., Chen, L., Lambertson, D., Anand, M.,
136. Thomas, P.D., Ebert, D., Muruganujan, A.,
Kinzy, T. G., and Madura, K. (2005) Proteasome-
Mushayahama, T., Albou, L.P., and Mi, H. (2022)
mediated degradation of cotranslationally damaged
PANTHER: Making genome-scale phylogenetics
proteins involves translation elongation factor 1A,
accessible to all, Protein Sci., 31, 8-22, doi: 10.1002/
Mol. Cell. Biol., 25, 403-413, doi: 10.1128/MCB.25.1.
pro.4218.
403-413.2005.
137. Rabl, J., Smith, D. M., Yu, Y., Chang, S. C.,
133. Beckelman, B. C., Zhou, X., Keene, C. D., and Ma, T.
Goldberg, A. L., and Cheng, Y. (2008) Mechanism of
(2016) Impaired eukaryotic elongation factor
1A
gate opening in the 20S proteasome by the proteasomal
expression in Alzheimer’s disease, Neurodegener. Dis.,
ATPases, Mol Cell,
30,
360-368, doi:
10.1016/
16, 39-43, doi: 10.1159/000438925.
j.molcel.2008.03.004.
134. Olshina, M. A., Arkind, G., Deshmukh, F. K.,
138. Smith, D. M., Fraga, H., Reis, C., Kafri, G., and
Fainer, I., Taranavsky, M., Hayat, D., Ben-Dor, S.,
Goldberg, A. L. (2011) ATP binds to proteasomal
Ben-Nissan, G., and Sharon, M. (2020) Regulation
ATPases in pairs with distinct functional effects,
of the 20S proteasome by a novel family of inhibitory
implying an ordered reaction cycle, Cell, 144, 526-538,
proteins, Antioxid. Redox Signal.,
32,
636-655,
doi: 10.1016/j.cell.2011.02.005.
doi: 10.1089/ars.2019.7816.
139. Myeku, N., and Duff K. E. (2018) Targeting the
135. Hashimoto, T., Hussien, R., Cho, H. S., Kaufer, D.,
26S proteasome to protect against proteotoxic
and Brooks, G. A. (2008) Evidence for the mitochon-
diseases, Trends Mol. Med., 24, 18-29, doi: 10.1016/
drial lactate oxidation complex in rat neurons: demon-
j.molmed.2017.11.006.
THE PROTEASOME INTERACTOME
AND ITS ROLE IN THE MECHANISMS OF BRAIN PLASTICITY
Review
O. A. Buneeva, A. T. Kopylov, and A. E. Medvedev*
Institute of Biomedical Chemistry, 119121 Moscow, Russia; E-mail: professor57@yandex.ru
Proteasomes are highly conserved multienzyme complexes responsible for the proteolytic degradation of
short-lived, regulatory, misfolded, and damaged proteins. They play an important role in the processes of
brain plasticity, and the decrease in their function is accompanied by the development of neurodegenerative
pathology. Studies performed in different laboratories both on cultured mammalian and human cells and on
preparations of the rat and rabbit brain cortex revealed a large number of proteasome-associated proteins.
Since the identified proteins belong to certain metabolic pathways, multiple enrichment of the proteasome
fraction with these proteins indicates their important role the proteasome functioning. Extrapolation of the
experimental data, obtained on various biological objects, to the human brain, suggests that proteasome-
associated proteins account for at least 28% of the human brain proteome. The proteasome interactome of
the brain contains a large number of proteins involved in the assembly of these supramolecular complexes,
regulation of their functioning, and intracellular localization, which can be changed at different conditions
(for example, during oxidative stress) or in different phases of the cell cycle. In the context of the molecular
functions of the Gene Ontology (GO) Pathways, the proteins of the proteasome interactome mediate cross-
talk between components of more than 30 metabolic pathways annotated in terms of GO. The main result
of these interactions is the binding of adenine and guanine nucleotides, crucial for realization of the nucleo-
tide-dependent functions of the 26S and 20S proteasomes. Since the development of neurodegenerative pa-
thology is often associated with a regioselective decrease in the functional activity of proteasomes, a positive
therapeutic effect will obviously be provided by factors increasing the proteasomal activity. In any case, the
pharmacological regulation of brain proteasomes seems to be realized through changes in the composition
and/or activity of proteins associated with proteasomes (deubiquitinase, PKA, CaMKIIα, etc.).
Keywords: proteasomes, brain, 20S subunit, 19S subunit, subcellular localization and functions, proteasome-
associated proteins, proteasome proteome and interactome
БИОХИМИЯ том 88 вып. 3 2023