БИОХИМИЯ, 2023, том 88, вып. 3, с. 409 - 428
УДК 577.115;577.115.3;577.125
РОЛЬ ЛИПИДОВ В РЕГУЛЯЦИИ
НЕЙРОГЛИАЛЬНЫХ ВЗАИМОДЕЙСТВИЙ
Обзор
© 2023 О.В. Галкина1*, О.В. Ветровой1,2, И.Е. Красовская1, Н.Д. Ещенко1
1 ФГБОУ ВО Санкт-Петербургский государственный университет, биологический факультет,
кафедра биохимии, 199034 Санкт-Петербург, Россия; электронная почта: o.v.galkina@spbu.ru
2 ФГБУН Институт физиологии им. И.П. Павлова РАН, 199034 Санкт-Петербург, Россия
Поступила в редакцию 17.10.2022
После доработки 24.01.2023
Принята к публикации 26.01.2023
Липиды представляют собой чрезвычайно гетерогенную группу соединений, что обусловливает
большое разнообразие выполняемых ими биологических функций. Традиционное представление
о липидах, как о важных структурных компонентах клетки и соединениях, играющих трофическую
роль, в настоящее время дополняется сведениями о возможном участии липидов в сигналинге,
причём не только внутриклеточном, но и межклеточном. В обзорной статье рассматривают-
ся современные данные о роли липидов и их метаболитов, образующихся в глиальных клетках
(астроциты, олигодендроциты, микроглия), в коммуникации этих клеток с нейронами. Помимо
специфики метаболических превращений липидов в каждом типе глиальных клеток, отдельное
внимание обращено на сигнальные молекулы липидной природы (фосфатидная кислота, арахидо-
новая кислота и её метаболиты, холестерин и др.) и возможность их участия в реализации синап-
тической пластичности, а также в других возможных механизмах, связанных с реализацией фено-
мена нейропластичности. Обобщение этих новых данных может существенно расширить знания
о регуляторных функциях липидов в нейроглиальных взаимоотношениях.
КЛЮЧЕВЫЕ СЛОВА: ЦНС, головной мозг, синаптическая пластичность, нейроны, астроциты, олиго-
дендроциты, микроглия, нейроглиальные взаимодействия, липиды, метаболизм липидов.
DOI: 10.31857/S0320972523030041, EDN: QWGKTA
ВВЕДЕНИЕ
торов в постсинаптической мембране, а также
проводимости ионных каналов и пр. Ремоде-
Нейропластичность
- фундаментальное
лирование синапсов происходит в различных
свойство нервной системы, которое реализует-
областях мозга на протяжении всей жизни.
ся на различных уровнях и с помощью разных
Помимо разных типов нейронов, цен-
механизмов. В настоящее время наибольшее
тральная нервная система (ЦНС) содержит
внимание привлекает изучение синаптической
морфологически и функционально различные
пластичности. Под синаптической пластич-
популяции глиальных клеток, количественно
ностью понимают способность образовывать
преобладающих над нейронами в головном
новые связи, контакты, увеличивать проводи-
мозге млекопитающих и составляющих по
мость между нейронами. Механизмы, под-
массе от 33 до 66%. Глиальные клетки подраз-
держивающие синаптическую пластичность,
деляются на основные разновидности - астро-
включают в себя реорганизацию или новообра-
циты, олигодендроциты, микроглию, эпенди-
зование синаптических структур, изменение
мальные клетки (рис. 1). Существуют также
количества выбрасываемого нейромедиатора и
некоторые вариации внутри каждой из групп.
эффективности ответа на этот нейромедиатор,
Важно отметить, что каждый тип клеток вы-
заключающиеся в модуляции плотности рецеп- полняет специализированные функции [1, 2].
Принятые сокращения: АК - арахидоновая кислота; ДГК - диглицеролкиназа; ГАМК - гамма-аминомасляная
кислота; ЛП - липопротеины; ОЛ - олигодендроциты; ФК - фосфатидная кислота; Apo - аполипопротеин.
* Адресат для корреспонденции.
409
410
ГАЛКИНА и др.
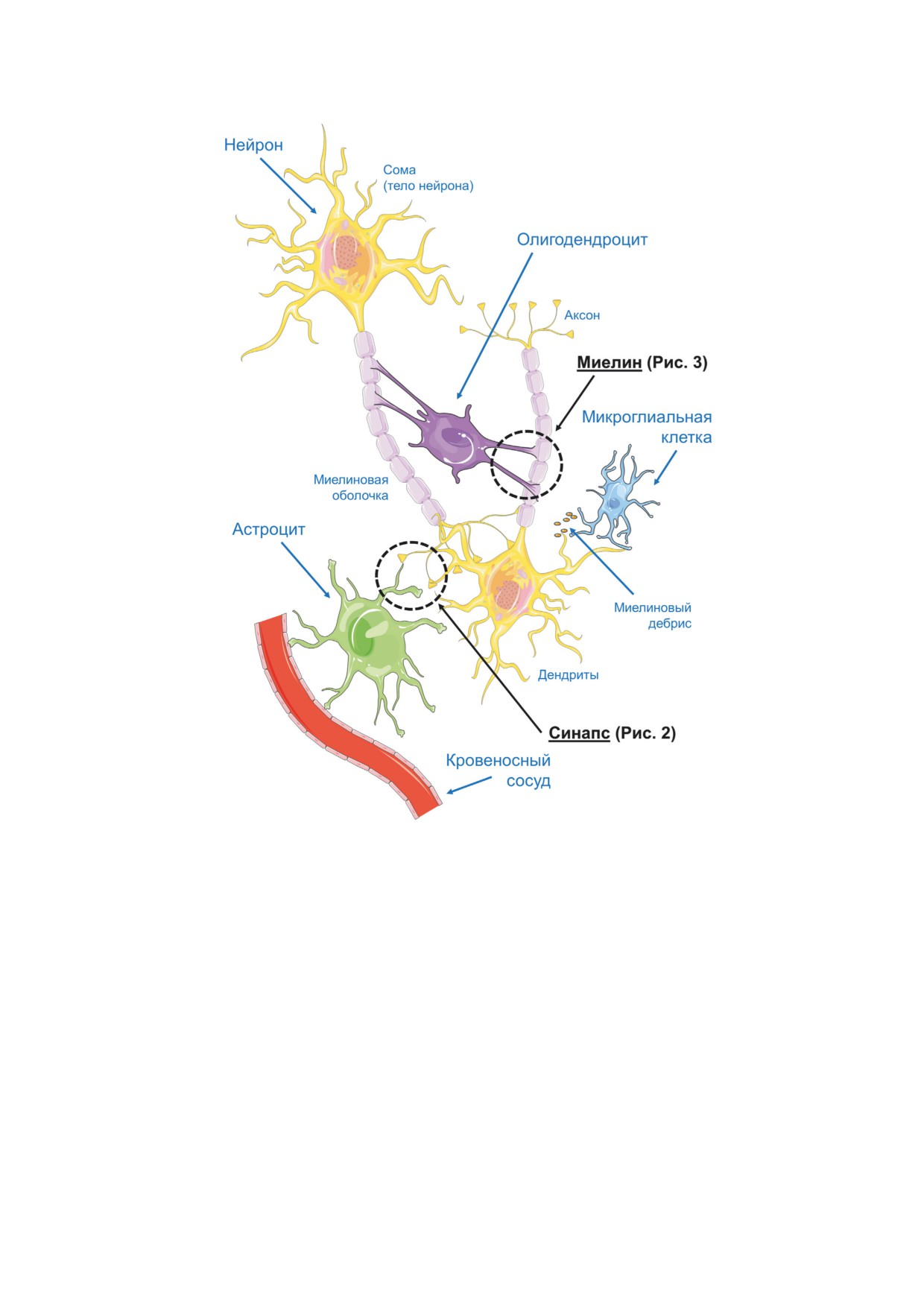
Рис. 1. Схема взаимодействия нейрона и глиальных клеток (астроцита, олигодендроцита, микроглиальной клетки).
Кружками обведены места, которые более подробно представлены на рис. 2 и 3. Шаблоны, использованные для созда-
При этом из всех глиальных клеток аст-
ме того, показана существенная роль микро-
роциты наиболее тесно взаимодействуют со
глиальных клеток в обеспечении контроля над
всеми участками нейронов (с телом клетки,
формированием синаптических контактов во
дендритами, аксонами и синаптическими окон-
время созревания мозга. Эпендимальные клет-
чаниями). Олигодендроциты связаны главным
ки (эпендима) выстилают стенки желудочков
образом с аксоном (в обонятельной лукови-
головного мозга и спинномозгового канала и
це имеются миелинизированные дендриты),
способствуют выработке спинномозговой жид-
обеспечивая высокую скорость проведения
кости. Базальная мембрана этих клеток контак-
нервного импульса за счёт формирования мие-
тирует с астроцитами, а зрелые нейроны в ос-
линовой оболочки; в периферической нервной
новном не вступают в прямое взаимодействие с
системе за формирование миелина отвечает
клетками эпендимы, за исключением участков
разновидность олигодендроцитов
- шван-
внутри и вокруг субэпендимальных зон [3].
новские клетки. Без участия клеток микро-
Таким образом, тесная кооперация между
глии было бы невозможно полноценное про-
нейронами и глиальными клетками, наряду
текание процессов апоптоза, митофагии. Кро-
с компартментализацией отдельных этапов
БИОХИМИЯ том 88 вып. 3 2023
ЛИПИДЫ И НЕЙРОГЛИАЛЬНЫЕ ВЗАИМОДЕЙСТВИЯ
411
метаболизма между ними, необходимы для
ВЗАИМОДЕЙСТВИЕ АСТРОЦИТОВ
обеспечения правильного функционирования
С НЕЙРОНАМИ
мозга. К настоящему времени накапливается
И ДРУГИМИ КЛЕТКАМИ ЦНС
всё больше доказательств важной роли липи-
дов в коммуникации между нейронами и гли-
Функции астроцитов. Астроциты, наиболее
альными клетками при обеспечении механиз-
хорошо изученные специализированные гли-
мов пластичности мозга, нарушение которых
альные клетки, являются, по мнению многих
сопряжено с широким спектром неврологи-
авторов, преобладающим типом во взрослом
ческих расстройств и нейродегенеративных
мозге [5], хотя ряд исследователей указывает,
заболеваний. Роль липидов в функционирова-
что соотношение нейронов и астроцитов мо-
нии нейронов была описана нами ранее [4].
жет сильно отличаться в различных структурах
При изучении роли липидов в нейрогли-
мозга [6].
альных взаимоотношениях внимание иссле-
Астроциты выполняют многочисленные
дователей стала привлекать не только трофи-
функции в головном мозге, включая регу-
ческая поддержка нейронов, но и выявление
ляцию целостности гематоэнцефалического
новых функций отдельных липидов - сигналь-
барьера [7], внеклеточной концентрации ней-
ных и регуляторных. В этом отношении боль-
ротрансмиттеров (особенно глутамата и гамма-
ше всего сведений получено на астроцитах,
аминомасляной кислоты (ГАМК)) [8], гомеоста-
в то время как сигнальные функции липидов
за воды и ионов [9, 10], а также метаболическую
других глиальных клеток изучены фрагментар-
и трофическую поддержку нейронов, которая
но. Работа в этом направлении представляет
реализуется при контакте между эндотелиаль-
большой интерес и перспективна.
ными клетками, астроцитами и нейронами [11,
Следует подчеркнуть, что для липидов, в
12]. Взаимодействие нейрон-астроцит суще-
отличие от других классов соединений, весь-
ственно не только для функционирования зре-
ма сложно разграничить «метаболические» и
лого мозга [13, 14], но и имеет большое значение
сигнальные функции. Многие «сигнальные»
для развивающегося мозга, когда астроциты
липиды обычно являются продуктами фер-
оказывают влияние на рост и развитие нейро-
ментативного расщепления или превращения
нов, образование синаптических контактов [12,
«структурных» липидов плазматической мем-
15, 16]. В последние годы появляется всё больше
браны или образуются в ходе метаболических
данных, подтверждающих, что астроциты игра-
превращений, то есть процессы метаболизма
ют непосредственную роль в обработке инфор-
липидов и их сигнальные функции тесно свя-
мации в ЦНС. Это привело к появлению поня-
заны. Более того, выраженная компартмента-
тий «трёхстороннего синапса» (tripartite synapse)
лизация отдельных этапов метаболизма липи-
и «глиотрансмиссии» [17]. Трёхсторонний си-
дов между разными типами клеток нервной
напс служит ярким примером межклеточной
системы ещё более осложняет разграничение
интеграции в ЦНС и представляет собой струк-
метаболических и сигнальных/регуляторных
туру, где отростки астроцитов активно взаи-
функций липидов.
модействуют с пре- и постсинаптическими
Несмотря на возросший интерес к дан-
нейронами в области синапса. В настоящее
ной теме и её актуальность, в литературе всё
время такая кооперация установлена для глу-
ещё мало экспериментальных данных о по-
таматных, ГАМК и ацетилхолиновых синап-
тенциальных перекрёстных взаимодействиях
сов, однако достоверных подтверждений её
в области метаболизма липидов между клет-
существования в дофаминергической и серо-
ками ЦНС. Такая коммуникация с участием
тонинергической системах пока не найдено.
липидов и их метаболитов может служить ещё
Высвобождение нейротрансмиттеров из пре-
одним примером того, как глиальные клетки
синаптического окончания активирует метабо-
регулируют деятельность нейрона.
тропные рецепторы на астроцитах, которые
Цель данной работы - охарактеризовать
реагируют повышением уровня внутриклеточ-
вклад липидов различных глиальных клеток
ного кальция. Это, в свою очередь, стимулирует
(астроцитов, олигодендроцитов, микроглии) в
высвобождение химических медиаторов (на-
регуляцию деятельности нейронов. В отличие
пример, глутамата, ГАМК, ATP, D-серина), на-
от ряда обзоров по сходной тематике, в этой
званных
«глиотрансмиттерами», посредством
статье мы попытались дополнительно учесть
различных механизмов, которые до сих пор
компартментализацию отдельных этапов ме-
остаются предметом дискуссий [18, 19]. Глио-
таболизма липидов и работу многочисленных
трансмиттеры могут стимулировать или подав-
систем, обеспечивающих трафик липидов и их
лять синаптическую передачу в зависимости от
производных.
типа медиатора [20-22]. Помимо глиотранс-
БИОХИМИЯ том 88 вып. 3 2023
412
ГАЛКИНА и др.
миттеров, астроциты способны высвобождать
Внутриклеточное образование ФК мо-
множество факторов, влияющих на нейроны,
жет регулироваться несколькими фермента-
в том числе большие везикулы, содержащие
ми: фосфолипазой D (гидролиз мембранных
функционирующие митохондрии и липидные
фосфолипидов), диглицеролкиназой (фосфо-
капли, электронно-плотные везикулы, содер-
рилирование диацилглицерола), ацилтранс-
жащие нейропептид Y и другие нейропептиды,
феразой (присоединение жирной кислоты к
осуществлять транспорт глюкозы и лактата,
лизофосфатидату), а также при участии фер-
а также выделять другие сигнальные молеку-
ментов биосинтеза фосфолипидов de novo.
лы [23, 24]. В совокупности весь массив таких
Дефекты различных ферментов, участвую-
данных послужил обоснованием концепции
щих в образовании ФК, приводят к развитию
«активной среды» (active milieu) [25], когда в эту
многих нейропатологий, что подтверждает
интеграцию включены другие глиальные клет-
важную роль ФК как регуляторного факто-
ки, сосуды и внеклеточное пространство.
ра [31]. В экспериментах на мышах с нокаутом
Таким образом, функциональная взаи-
гена Fmr1, связанным с торможением экспрес-
мосвязь между астроцитами и нейронами,
сии диглицеролкиназы, обнаружено измене-
а также другими клетками является строго
ние соотношения уровней диацилглицерола
регулируемым процессом и имеет решающее
и ФК в нейронах [32]. Следствием этого дис-
значение для поддержания нормальной работы
баланса может быть нарушение передачи сиг-
мозга. В данном разделе мы подробнее остано-
налов от ФК, необходимых для созревания
вимся на тех соединениях липидной природы,
дендритных шипиков, в частности сигналов,
которые могут участвовать в реализации раз-
стимулирующих полимеризацию актина, необ-
личных механизмов нейропластичности, осо-
ходимую для стабилизации структуры шипика.
бенно синаптической пластичности.
Имеющиеся данные свидетельствуют о
Роль астроцитарных липидов в межклеточных
том, что фосфолипаза D и диглицеролкина-
взаимодействиях. Липиды - не только структур-
за (ДГК), подвергающиеся сложной и жёсткой
ные компоненты клеток ЦНС, но и важнейшие
регуляции, являются двумя основными фер-
соединения, обеспечивающие функциональную
ментами, участвующими в образовании ФК,
активность нейронов. Содержание липидов в
используемой для сигнальных процессов [33-
мозге является одним из самых высоких среди
35]. Например, было показано, что среди
всех органов и тканей, за исключением жиро-
10 известных изоформ диацилглицеролкиназ
вой ткани [26]. Особенности состава липидов
6 участвуют в некоторых формах синаптиче-
(количество представителей основных клас-
ской пластичности [34-36]. Так, ДГКβ может
сов липидов и их соотношение) и их функцио-
быть вовлечена в процессы роста дендритов
нальная роль в нейронах обсуждались нами
и синаптогенеза в клетках гиппокампа [37],
ранее [4, 27]. Гораздо меньше известно о функ-
ДГКβ и ДГКζ, расположенные в области пост-
циях липидов в самих астроцитах, однако за
синаптической плотности, участвуют в фор-
последние годы интерес к этой теме значитель-
мировании долговременной потенциации,
но вырос [24, 28].
лежащей в основе памяти и обучения [38, 39].
Как уже упоминалось выше, астроциты
Кроме того, ДГКα является уникальной изо-
оказывают влияние на рост и ветвление ней-
формой ДГК из-за её экспрессии в глиальных
ритов, а также на образование синапсов, то
клетках - этот фермент локализуется в олиго-
есть на процессы, непосредственно вовлечён-
дендроцитах [40].
ные в реализацию феномена синаптической
Механизмы, посредством которых реа-
пластичности. Такое влияние может осуще-
лизуются биологические эффекты ФК, могут
ствляться за счёт секреции астроцитами раз-
быть различны и до сих пор интенсивно изуча-
личных сигнальных молекул [23], в том числе
ются. Прежде всего, благодаря конусообразной
липидной природы, синтезируемых этими гли-
пространственной конфигурации молекулы
альными клетками. Ярким примером сигналь-
ФК способствует искривлению мембраны и
ных функций липидов является фосфатидная
изменению её структуры, что необходимо как
кислота (ФК), образующаяся в астроцитах
для слияния везикул, так и для взаимодей-
в основном при действии фосфолипазы D1.
ствия с мембраной некоторых растворимых
Нокдаун гена этого фермента в астроцитах
белков. Например, ФК связывается с белком
снижал ветвление дендритов в смешанной
синтаксин-1A в комплексе SNARE [41]. Кроме
культуре клеток гиппокампа [29]. Кроме того,
того, ФК может действовать как мессенджер,
нарушение роста нейритов при болезни Альц-
напрямую взаимодействуя со специфиче-
геймера также ассоциируется с дисфункцией
скими лигандами [42]. При связывании ФК с
фосфолипазы D1 [30].
белком возможно изменение каталитической
БИОХИМИЯ том 88 вып. 3 2023
ЛИПИДЫ И НЕЙРОГЛИАЛЬНЫЕ ВЗАИМОДЕЙСТВИЯ
413
активности фермента или присоединение бел-
вазоконстриктирующего метаболита АК [19].
ка к мембране. Был идентифицирован ряд ми-
В некоторых исследованиях на переживающих
шеней ФК, включающих белки, участвующие
срезах мозга и изолированной сетчатке увели-
в фосфорилировании и дефосфорилировании
чение уровня внутриклеточного Ca2+ в астро-
белков и липидов, в регуляции рецепторов,
цитах также приводило к вазоконстрикции.
связанных с G-белками, а также в везикуляр-
Оказалось, что этот эффект связан с окисле-
ном транспорте и метаболизме [43-45]. Не сто-
нием арахидоната до 20-гидроксиэйкозатетра-
ит забывать, что ФК является ключевым про-
еновой кислоты (20-HETE) в гладкомышеч-
межуточным соединением при биосинтезе
ных клетках сосудов [50, 51]. Таким образом,
фосфолипидов и источником других сигналь-
регуляция кровоснабжения мозга метаболита-
ных молекул, таких как диацилглицерол, лизо-
ми АК, выделяющимися из астроцитов, явля-
фосфатидная кислота, свободные жирные
ется ещё одним механизмом, связанным с пла-
кислоты, фосфатидилинозитол-4,5-дифосфа-
стичностью мозга.
та (PI4,5P2). Всё это делает ФК жизненно важ-
Астроциты принимают участие в работе
ным регулятором нейротрансмиссии и синап-
эндоканнабиноидной системы в головном
тической пластичности. По всей видимости,
мозге. Эти глиальные клетки имеют канна-
немаловажное значение имеет также, какой
биноидные рецепторы типа CB1R, которые
именно молекулярный вид ФК образуется [46].
связывают анандамид и 2-арахидоноилглице-
Взаимодействуя с различными белками
рин (эндогенные лиганды, образующиеся из
(киназами, фосфатазами, фосфолипазами,
N-ацилфосфатидилэтаноламина и диацил-
G-белками и др.), ФК может регулировать та-
глицерола соответственно), выделяемые пост-
кие процессы, как пролиферация клеток, транс-
синаптическими нейронами. Активация ре-
порт везикул, организация цитоскелета и, таким
цепторов CB1R приводит к Ca2+-зависимому
образом, играть существенную роль в развитии
высвобождению глутамата астроцитами в
нейронов. Механизм действия внеклеточной
области трёхстороннего синапса [52] (рис. 2).
ФК в данном случае может быть опосредо-
Особо следует подчеркнуть, что высвобождение
ван рецепторами, связанными с G-белками и
глиотрансмиттеров (глутамата, ATP и др.) мо-
дальнейшей активацией протеинкиназы А и
жет происходить не только в области трёхсто-
соответствующих сигнальных путей в нейро-
роннего синапса, но и в дистальных участках
нах [29] (рис. 2).
астроцита, удалённых от источника эндокан-
Среди сигнальных молекул липидной при-
набиноидов, регулируя, таким образом, актив-
роды, выделяемых астроцитами, также необ-
ность синапсов других нейронов. Следова-
ходимо упомянуть сфингозин-1-фосфат, эйко-
тельно, с помощью такого механизма передачи
заноиды, холестерин [22]. Эйкозаноиды, обра-
каннабиноидного сигнала астроциты могут
зующиеся из арахидоновой кислоты (в част-
вызывать как временные регуляторные эф-
ности простагландины), служат важными
фекты, так и контролировать длительные из-
медиаторами в ЦНС. Они могут участвовать
менения в нескольких синапсах, что важно для
в регуляции синаптической передачи, вос-
процессов синаптической пластичности [53].
палительных реакций, в контроле скорости
Высказываются предположения о взаимосвязи
кровотока в мозге [47-49]. Так, высвобожде-
эндоканнабиноидной и эйкозаноидной сиг-
ние глутамата из нейронов, помимо передачи
нальных систем, поскольку их метаболические
межнейронального сигнала, также приводит
пути (биосинтез при участии АК, пути окис-
к активации астроцитарных метаботропных
ления при участии циклооксигеназы и липок-
рецепторов глутамата, сопровождающейся повы-
сигеназы, взаимные превращения) тесно
шением уровня внутриклеточного Ca2+ и сти-
переплетаются [54]. По нашему мнению, эти
муляцией фосфолипазы А2, что ведёт к образо-
исследования находятся только в самом нача-
ванию свободной арахидоновой кислоты (АК)
ле, и многое ещё предстоит выяснить.
(рис. 2) [50]. Увеличение количества АК стиму-
Хорошо известно, что астроциты обеспе-
лирует, в свою очередь, образование её метабо-
чивают метаболическую поддержку нейронов.
литов, которые оказывают вазодилатирующий
Поскольку нейроны имеют самую высокую
эффект на близлежащие артериолы. Просто-
потребность в энергии и обычно не содержат
гландин Е2 обеспечивает расширение артериол
значительного пула глюкозы, гликогена или
путём связывания с рецептором на гладко-
липидных капель, то в условиях высокой ак-
мышечных клетках стенки артериол. Эпокси-
тивности энергетические субстраты должны
эйкозатриеновая кислота тоже может вы-
поступать в эти клетки извне. Считается, что
зывать расширение сосудов, но уже посред-
астроциты участвуют в поглощении и рас-
ством ингибирования рецепторов тромбоксана,
пределении многих соединений головного
БИОХИМИЯ том 88 вып. 3 2023
414
ГАЛКИНА и др.
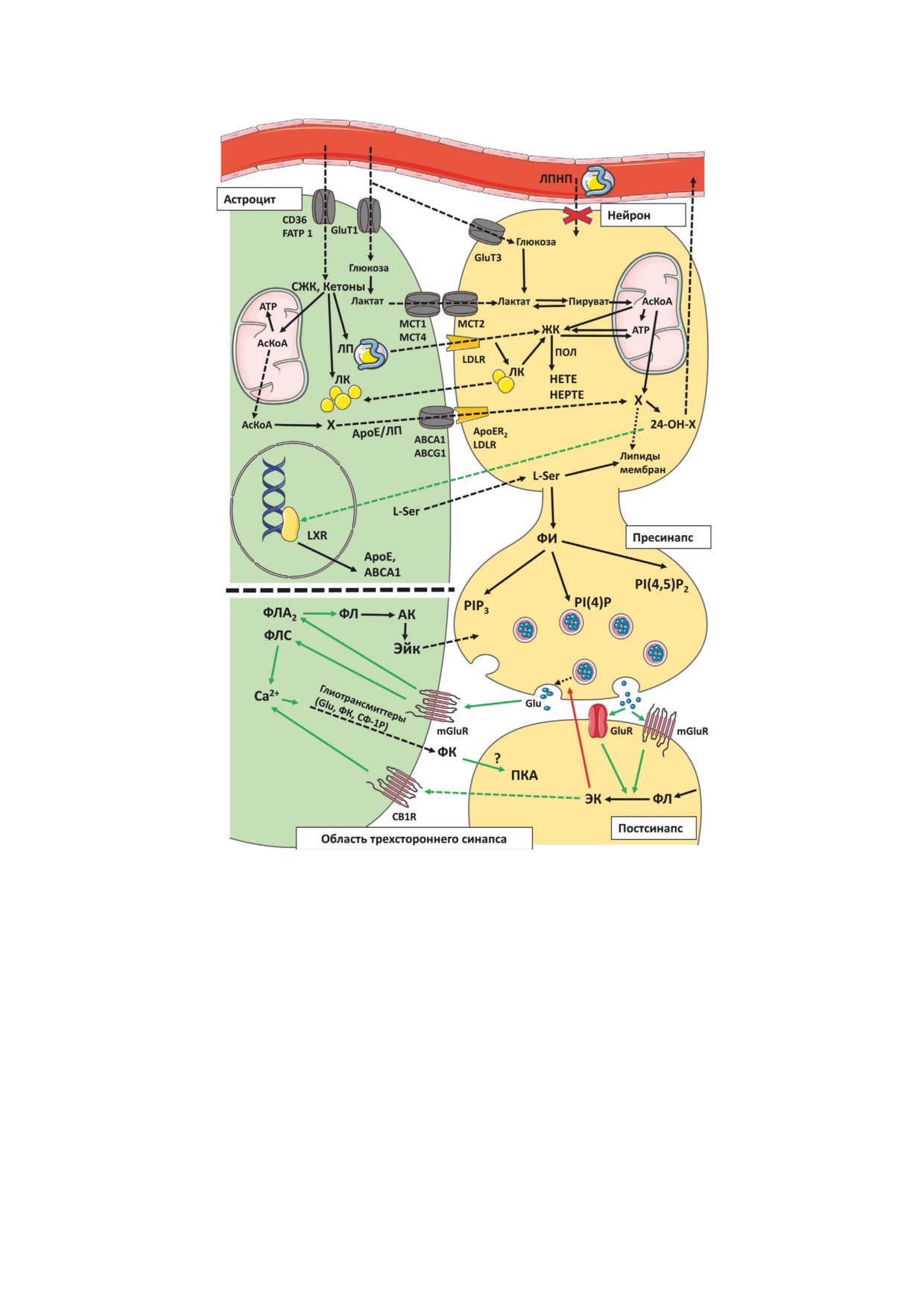
Рис. 2. Схема участия липидов и их метаболитов во взаимодействии астроцит-нейрон, в том числе в области трёх-
стороннего синапса. Показан метаболизм и транспорт метаболитов липидов между различными частями астроцита
и нейрона. Сплошными стрелками показаны пути превращения соединений, пунктирными - пути транспорта со-
единений; зелёные стрелки - активирующие пути, красные - ингибирующие пути. Шаблоны, использованные для
АК - арахидоновая килота; ЖК - жирные кислоты; ЛК - липидные капли; ЛП - липопротеины; ЛПНП - липо-
протеины низкой плотности; ПКА - протеинкиназа А; СЖК - свободные жирные кислоты; СФ-1-P - сфинго-
зин-1-фосфат; ФИ - фосфоинозитиды (в том числе PI(4)P, PI(4,5)P2, PIP3); ФК - фосфатидная кислота; ФЛ - фос-
фолипиды; ФЛА2 - фосфолипаза А2; ФЛС - фосфолипаза С; Х - холестерин; 24-ОН-Х - 24-гидроксихолестерин;
ЭК - эндоканнабиноиды; ABCA, ABCG - транспортёры, члены семейства ATP-binding cassette transporter; ApoE -
аполипопротеин Е; CB1R - рецептор каннабиноидов, тип 1; CD36 - транспортёр жирных кислот; FATP - белок,
транспортирующий жирные кислоты; Glu - глутамат; GluR - ионотропные рецепторы глутамата (NMDA, AMPA);
GLUT - транспортёр глюкозы; HEPTE - гидроперокситетраеновые кислоты; HETE - гидроксиэйкозатетраеновые
кислоты; LDL-R - рецептор ЛП низкой плотности; LXR - Х-рецептор печени, транскрипционный фактор; МСT -
транспортёры монокарбоновых кислот; mGluR - метаботропные рецепторы глутамата
мозга [55, 56]. Интересно, что L-серин синте-
Нейроны, не способные к синтезу этого соеди-
зируется и высвобождается во внеклеточное
нения, используют астроцитарный L-серин
пространство только астроцитами, а также
для биосинтеза таких липидов, как фосфати-
сходными с ними клетками радиальной глии.
дилсерин и гликосфинголипиды [57].
БИОХИМИЯ том 88 вып. 3 2023
ЛИПИДЫ И НЕЙРОГЛИАЛЬНЫЕ ВЗАИМОДЕЙСТВИЯ
415
В астроцитах более интенсивно, чем в
цитах [71-73]. Содержание этого липида не-
нейронах, протекает метаболизм липидов [58,
обычайно высоко в головном мозге, при этом
59]. Такие процессы, как β-окисление жир-
максимальное его количество обнаружено в
ных кислот и кетогенез, осуществляются в
миелине, о чём речь пойдёт ниже [74].
основном в астроцитах, а образующиеся в
Астроциты
- основные клетки взрос-
результате метаболиты (ацетил-КоА, NADH,
лого мозга, которые синтезируют холестерин
FADH2, кетоны) поступают в нейроны для
и поставляют его в нейроны в составе липо-
последующего синтеза ATP [60-62]. Низкий
протеинов [68, 71]. Будучи важным структур-
уровень β-окисления в нейронах связан c не-
ным компонентом липидного бислоя, этот
высокой скоростью переноса длинноцепочеч-
липид активно используется нейронами для
ных КоА-производных жирных кислот через
формирования мембран в ходе синаптогене-
внутреннюю митохондриальную мембрану и
за как в развивающемся, так и во взрослом
низкой активностью самих ферментов β-окис-
мозге, и в больших концентрациях присут-
ления [61]. Предполагается, что процесс окис-
ствует в синаптических пузырьках [75, 76]. Эти
ления жирных кислот может сопровождаться
факты позволяют рассматривать холестерин
возникновением окислительного стресса [62].
как астроцитарный фактор, способствующий
Периодам интенсивной нейрональной актив-
синаптогенезу.
ности также сопутствует повышение уровня
Интересно отметить, что астроциты и
активных форм кислорода, накопление гидро-
нейроны используют разные постсквалено-
перекисей жирных кислот и развитие окисли-
вые этапы биосинтеза холестерина [68], в ходе
тельного стресса, к которому нейроны очень
которых, помимо холестерина, образуются
чувствительны. Защита нейронов от токсиче-
разные промежуточные метаболиты, обладаю-
ского действия гидроперекисей, т.е. нейро-
щие разной биологической активностью [77].
протекторная функция, осуществляется астро-
В частности, в астроцитах такие промежуточ-
цитами, которые аккумулируют окисленные
ные метаболиты используются в синтезе ней-
жирные кислоты в своих липидных каплях [63,
ростероидных гормонов [78].
64]. Их транспорт происходит с участием
Биосинтез холестерина и жирных кислот
аполипопротеин-содержащих липопротеинов
в клетках находится под контролем семейства
(рис. 2). Липидные капли в астроцитах, по-
транскрипционных факторов SREBP (sterol
мимо гидроперекисей жирных кислот, содер-
regulatory element binding protein), которые ре-
жат большой пул липидов, необходимый для
гулируют синтез белков, участвующих в мета-
обеспечения нейронов энергией. Предпо-
болизме этих липидов [79]. Снижение актив-
лагается, что в периоды интенсивной актив-
ности SREBP в астроцитах мутантных мышей
ности или длительного стресса нейроны могут
(за счёт инактивации гена, кодирующего белок
индуцировать образование липидных капель в
SCAP (SREBP cleavage-activating protein - ак-
соседних астроцитах [65]. В то же время стоит
тиватора SREBP)) приводило к замедлению
подчеркнуть, что в норме в клетках головного
секреции холестерина и фосфолипидов этими
мозга взрослых животных липидные капли
клетками, что сопровождалось нарушением
присутствуют в очень незначительных коли-
функций пресинаптических структур ближай-
чествах, однако их накопление, в основном в
ших нейронов in vivo [59]. Это неудивительно,
астроцитах и микроглие, наблюдается в ходе
поскольку известно, что холестерин связыва-
развития мозга, при старении и при некоторых
ется с синаптофизином при образовании си-
патологических состояниях, таких как нейро-
наптических пузырьков в пресинапсе [80, 81].
дегенеративные заболевания [64, 66].
Кроме того, холестерин является важным ком-
Астроциты интенсивно синтезируют и
понентом липидных рафтов, присутствие его
секретируют молекулы различных липидов,
необходимо для кластеризации и обеспечения
включая стеролы, жирные кислоты и три-
стабильности рецепторов нейромедиаторов,
глицериды; синтезируют глицеро- и сфинго-
ростовых факторов и других биологически
липиды [59, 67-69]. Важно, что именно астро-
активных соединений в постсинаптической
циты являются основным источником в ЦНС
мембране, что, несомненно, является важным
докозагексаеновой и арахидоновой кислот,
фактором, обеспечивающим феномен синап-
которые образуются в этих клетках путём
тической пластичности [81-83].
удлинения незаменимых жирных кислот,
Как мы видим, транспорт липидов имеет
поступающих через гематоэнцефалический
большое значение для нейроглиальных взаи-
барьер [70].
модействий. Многочисленные исследования,
Достаточно много работ посвящено из-
проведённые за последние годы, демонстри-
учению метаболизма холестерина в астро-
руют роль этих процессов как в ходе развития
БИОХИМИЯ том 88 вып. 3 2023
416
ГАЛКИНА и др.
нервной системы, так и в поддержании когни-
цессов обучения и памяти [91, 92]. Интересно,
тивных функций мозга во взрослом состоянии.
что усиленная экспрессия гена ApoE4, по-ви-
Процессы транспорта липидных молекул осу-
димому, связана с повышенным риском воз-
ществляются разнообразными межклеточны-
никновения болезни Альцгеймера, поскольку
ми и внутриклеточными переносчиками [84].
обнаружено, что ApoE4 может связываться с
Нейроны и астроциты взрослого мозга экс-
β-амилоидным пептидом, способствуя обра-
прессируют несколько мембранных перенос-
зованию фибриллярных структур
[93-95].
чиков жирных кислот, таких как FATP1 (fatty
Важную роль в транспорте липидов и нейро-
acid transport protein), FATP4, CD36(FAT), а
глиальных взаимодействиях играет также бе-
астроциты и клетки-предшественники олиго-
лок ApoD [96].
дендроцитов - ещё и FABP7 [64, 85, 86]. FABP
Если транспорт липидов из астроцитов в
(fatty acid binding proteins) контролируют по-
нейроны может осуществляться как аполипо-
ступление и внутриклеточное распределение
протеинами, так и в составе ЛП, то нейроны
жирных кислот, а следовательно, участвуют
выводят избыток холестерина с помощью ЛП,
в метаболизме липидов, трансдукции сигна-
превращая его в 24(S)-гидроксихолестерин [58].
лов и регуляции активности генов. Синтез
Эта реакция катализируется холестерин-24(S)-
FABP7 в мозге взрослых животных необходим
гидроксилазой (CYP46A1), которая экспрес-
для регуляции работы астроцитарных рафтов
сируется исключительно в нейронах [97]. Ней-
(через изменение экспрессии кавеолина-1)
роны и астроциты синтезируют также разные
и ответа на внешние стимулы этими глиаль-
мембранные переносчики холестерина, регу-
ными клетками, что, в свою очередь, обеспе-
лирующие его отток из клеток: в астроцитах
чивает нормальное функционирование нейро-
преобладают ABCA1 и ABCG1, а в нейронах -
нов [87]. Было показано, что дефицит FABP7
ABCG4 [58].
у мышей с нокаутом гена Fabp7 приводит к
Таким образом, не только образующиеся в
изменению морфологии дендритных шипиков
астроцитах сигнальные молекулы липидов или
и снижению количества возбуждающих си-
их производных, но и процессы метаболизма
напсов [88]. Стимулируемый астроцитарным
и транспорта липидов играют существенную
лактатом биосинтез жирных кислот в нейро-
роль во взаимодействии астроцитов и нейро-
нах сопровождается их последующим транс-
нов, о чём свидетельствует развитие целого
портом в астроциты при участии FATP1 или
ряда патологий ЦНС при нарушении этих
FATP4 и запасанием в липидных каплях [89].
процессов [26, 98, 99].
Эти транспортёры также участвуют в переносе
синтезированных жирных кислот (например,
ключевых докозагексаеновой и арахидоновой)
ВЗАИМОДЕЙСТВИЕ
из астроцитов, что в дальнейшем стимулирует
ОЛИГОДЕНДРОЦИТОВ С НЕЙРОНАМИ
их использование для включения в фосфоли-
пиды нейрональных мембран [64].
Функции олигодендроцитов. Миелинизи-
В транспорте липидов в головном мозге
рующие клетки глии - олигодендроциты (ОЛ)
участвуют липопротеины (ЛП). ЛП, циркули-
и шванновские клетки также чрезвычайно
рующие в кровяном русле, не способны про-
важны для поддержания взаимосвязи клеток
никать через гематоэнцефалический барьер,
и их функционирования в нервной системе.
за исключением липопротеинов высокой плот-
Олигодендроциты - это разветвлённые круп-
ности, таким образом, они должны вырабаты-
ные глиальные клетки, которые образуют спе-
ваться непосредственно в клетках центральной
цифическую многослойную липидно-белко-
нервной системы. Считается, что астроциты
вую структуру - миелиновую оболочку вокруг
являются основным местом синтеза и сбор-
аксона. Один олигодендроцит способен мие-
ки собственных ЛП в головном мозге [90].
линизировать до
50-60 сегментов аксонов.
К наиболее распространённым аполипо-
Миелиновая оболочка не только обеспечивает
протеинам (Apo) в составе ЛП нервной тка-
быстрое скачкообразное проведение импуль-
ни относятся ApoE и ApoJ. ApoE участвует в
сов по аксону, но и выполняет трофическую
транспорте жирных кислот и холестерина из
функцию, поддерживая целостность и выжи-
астроцитов в нейроны, связываясь с предста-
вание аксона, что необходимо для реализации
вителями семейства рецепторов липопротеи-
феномена нейропластичности [100].
нов низкой плотности или рецептором аполи-
Помимо зрелых ОЛ, в последнее время вы-
попротеина Е2 (ApoER2) [58, 89]. Нокаут генов
деляют отдельную популяцию клеток-предше-
этих рецепторов у мышей приводит к сниже-
ственников олигодендроцитов - NG2-глию,
нию количества синапсов и нарушению про-
составляющую около 5% от общего количества
БИОХИМИЯ том 88 вып. 3 2023
ЛИПИДЫ И НЕЙРОГЛИАЛЬНЫЕ ВЗАИМОДЕЙСТВИЯ
417
глиальных клеток. Эта популяция глиальных
ствуют в довольно постоянном соотношении
клеток сохраняется в ЦНС взрослых живот-
(около 2/2/1). Всего идентифицировано около
ных и продолжает генерировать зрелые миели-
20 классов липидов, при этом преобладающи-
низирующие ОЛ на протяжении всей жизни,
ми являются холестерин, галактозилцерамиды
однако их функции во взрослом мозге ещё
и этаноламинплазмалогены. В миелине при-
выяснены не до конца [2, 101]. Наиболее ин-
сутствуют уникальные молекулярные виды ли-
тересным фактом является то, что эти клетки
пидов, которых нет в соседних нейрональных
способны образовывать функциональные си-
или глиальных клетках, что обеспечивает плот-
напсы с нейронами [102].
ность упаковки этих мембран. В целом липиды
Олигодендроциты и NG2-клетки экспрес-
миелина содержат меньше полиненасыщенных
сируют потенциал-зависимые ионные каналы
жирных кислот и больше представителей, име-
(Nav, Kv, Cav) и различные рецепторы нейро-
ющих очень длинные ацильные цепи [105, 107].
медиаторов. Ключевой особенностью является
Качественные и/или количественные изме-
присутствие калиевых каналов, среди которых
нения соотношений молекулярных видов или
особое значение имеет преобладающий под-
классов липидов всегда связаны с дисфункцией
тип - обращённые К+-каналы (Kir4.1) [103].
миелина.
Нейромедиаторы и К+, высвобождаемые си-
Относительно недавно было высказано
наптическими окончаниями аксонов, действу-
предположение, что жирные кислоты с очень
ют на ионные каналы и рецепторы ОЛ, таким
длинной цепью (ДЦЖК) могут окисляться в
образом, нейроны могут оказывать влияние на
пероксисомах, расположенных в отростках
процесс миелинизации. Активность и количе-
олигодендроцитов, примыкающих к аксонам
ство ионных каналов и рецепторов меняется
(адаксональный слой миелина). Образовав-
как во время развития, регулируя процессы
шиеся укороченные жирные кислоты могут
миелинизации, так и при патологических (де-
транспортироваться в аксоны и использо-
миелинизирующих) состояниях [101, 104].
ваться как субстраты для митохондриального
Помимо образования миелина, ОЛ секре-
β-окисления [108]. Таким образом, ОЛ, наря-
тируют различные факторы, осуществляя, на-
ду с астроцитами, могут обеспечивать аксоны
ряду с астроцитами, метаболическую поддержку
субстратами для получения энергии или сиг-
нейронов и участвуя в стабилизации цитоске-
нальными молекулами. С другой стороны, ме-
лета аксонов. Олигодендроциты поставляют
таболиты, образующиеся в аксонах, могут под-
лактат, который транспортируется через пере-
держивать процессы миелинизации в ОЛ. Так,
носчик МСТ1 в периаксональное пространство,
N-ацетил-аспартат (NAc-Asp), образующийся
откуда он поглощается аксонами с участием
в аксональных митохондриях, транспортирует-
МСТ2 [101]. Такое дополнительное поступление
ся в ОЛ и там расщепляется аспартатацилазой
энергетического субстрата способствует беспе-
до ацетата и аспартата [109]. Эти соединения
ребойной работе Na+/К+-ATPазы для восста-
могут использоваться как непосредственно
новления ионной асимметрии в области пере-
для синтеза липидов (ацетат), так и опосредо-
хватов Ранвье.
вать увеличение экспрессии генов (аспартат
Роль липидов олигодендроцитов в межкле-
через ряд промежуточных метаболитов), уча-
точных взаимодействиях. Уникальной характе-
ствующих в синтезе сульфатидов и сфингомие-
ристикой, которая отличает миелин от других
лина (рис. 3).
биологических мембран, является необычайно
Одним из наиболее изученных липидов, в
высокое содержание липидов, которое доходит
связи с его ролью в формировании миелина,
до 70-80% от сухого веса миелина. Согласно
является холестерин. На долю этого липида
недавним исследованиям, липидом миелина
в миелине мозга взрослых животных прихо-
ЦНС человека насчитывает около 700 различ-
дится до 80% от общего липидного состава, а
ных представителей липидов [105], структура
доступность холестерина определяет скорость
и соотношение которых меняются в процессе
и своевременность миелинизации. Скорость
развития головного мозга [106].
биосинтеза холестерина de novo в олигоден-
Дифференцировка и созревание ОЛ сопро-
дроцитах максимальна именно в период ин-
вождаются повышенной экспрессией фермен-
тенсивной миелинизации [81, 110, 111]. Отсут-
тов синтеза липидов. Считается, что к оконча-
ствие синтеза холестерина в ОЛ у мышей с
нию периода миелинизации ОЛ синтезируют
нокаутами генов ферментов этого процесса
около 40% от общего количества липидов в моз-
(скваленсинтазы, 3-гидрокси-3-метилглутарил
ге человека. Основные классы липидов зрелого
КoA синтазы I) приводит к отсроченному
(компактного) миелина - холестерин, глицеро-
началу миелинизации [110, 112]. Кроме того,
фосфолипиды и гликосфинголипиды, присут-
определённую роль в формировании пула
5
БИОХИМИЯ том 88 вып. 3 2023
418
ГАЛКИНА и др.
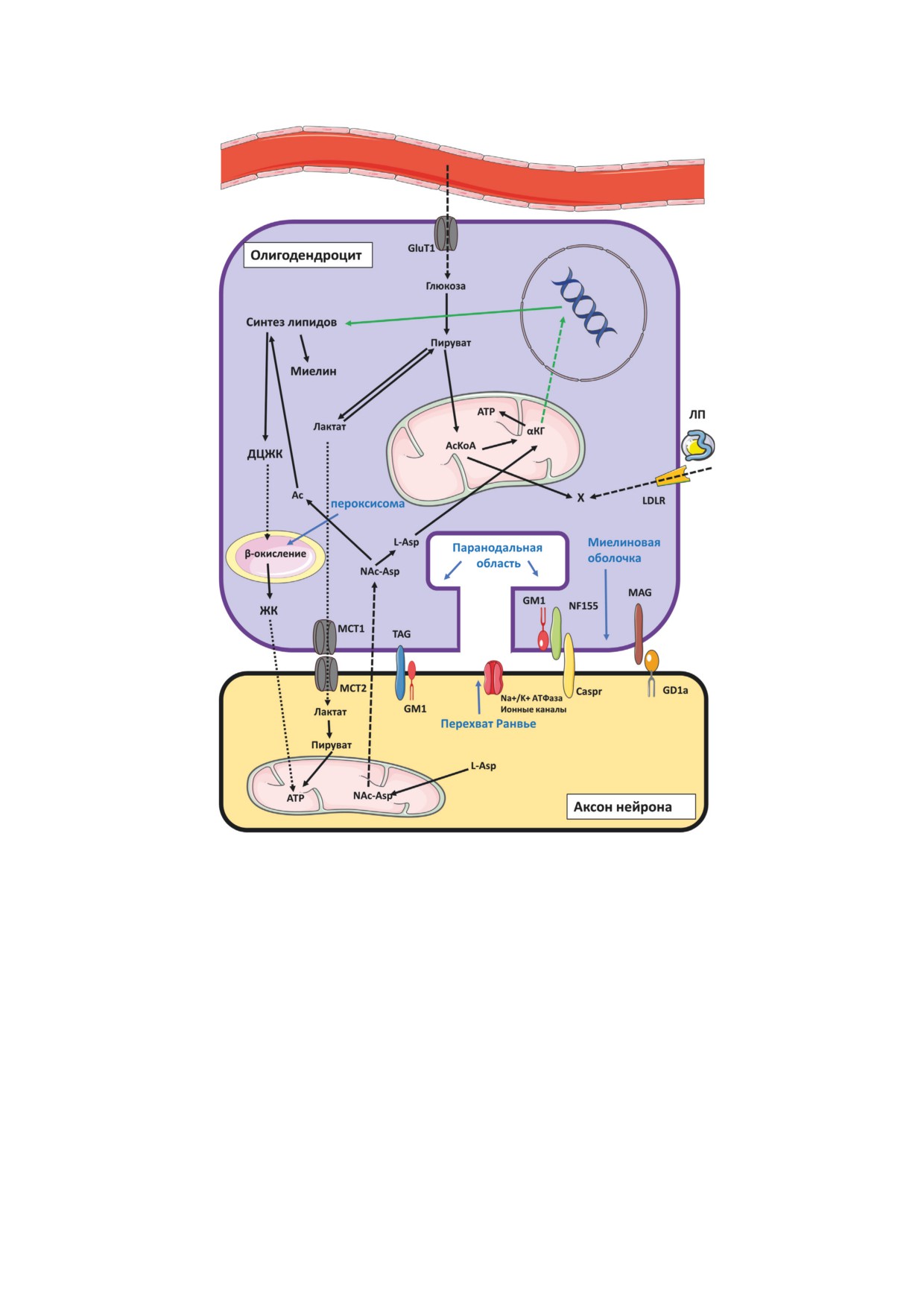
Рис. 3. Схема участия липидов и их метаболитов во взаимодействии олигодендроцит-нейрон, в том числе в стабилиза-
ции миелинового слоя (адаксональный слой миелина). Сплошными стрелками показаны пути превращения соедине-
ний, пунктирными - пути транспорта соединений; зелёные стрелки - активирующие пути. Шаблоны, использованные
ния: ДЦЖК - длинноцепочечные жирные кислоты; ЖК - жирные кислоты; αКГ - альфа-кетоглутарат; ЛП - липо-
протеины; Х - холестерин; Ac - ацетил; GLUT - транспортёр глюкозы; GM1, GD1a - ганглиозиды; LDL-R - рецеп-
тор ЛП низкой плотности; MAG - миелин-ассоциированный гликопротеин; МСT - монокарбоновые транспортёры;
NAc-Asp - N-ацетил-аспартат; белки клеточной адгезии: TAG (Transient Axonal Glycoprotein), NF155 (Neurofascin),
Caspr (Contactin-associated protein)
холестерина ОЛ в процессе миелинизации
разования миелина и даже остановке созрева-
могут играть астроциты, поставляя холесте-
ния олигодендроцитов [114].
рин в составе ЛП [113]. Важным участником
Влияя на жидкостность мембраны и взаи-
внутриклеточного транспорта холестерина,
модействуя с белками, холестерин способствует
посредством которого он мобилизуется из ЛП
сборке миелина и более плотной упаковке ли-
в эндолизосомальной системе, является транс-
пидов в этой мембранной структуре. Холесте-
мембранный белок Нимана-Пика С1 (Npc1).
рин необходим не только для формирования
Делеция гена Npc1 как в нейронах, так и в
миелиновых мембран, но и, возможно, участ-
олигодендроцитах приводит к нарушению об-
вует в передаче сигнала внутрь олигодендро-
БИОХИМИЯ том 88 вып. 3 2023
ЛИПИДЫ И НЕЙРОГЛИАЛЬНЫЕ ВЗАИМОДЕЙСТВИЯ
419
цита, активируя сигнальные пути, стимулирую-
По всей видимости, ганглиозиды GM3,
щие процесс миелинизации. Составляя основу
GM1, GD1b и GD3 могут модулировать распо-
рафтов, холестерин может обеспечивать сборку
ложение в мембранном рафте другой молекулы
белковых комплексов в этих микродоменах.
адгезии, TAG-1 (transient-axonal glycoprotein 1),
В экспериментах на рыбках Danio было показа-
которая экспрессируется как в нейронах, так
но, что присутствие холестерина облегчает пе-
и в олигодендроцитах [123, 124]. Этот белок в
редачу сигналов, опосредованную сигнальным
основном находится в юкстапаранодальных
каскадом PI3K/Akt/mTOR (одним из основ-
областях, где необходим для правильной лока-
ных факторов миелинизации) в клетках-пред-
лизации и компартментализации калиевых ка-
шественниках олигодендроцитов. Поскольку
налов (в частности Kv1.1/1.2). Однако особен-
киназа mTOR также контролирует экспрессию
ности взаимодействия этой молекулы адгезии
генов, необходимых для синтеза холестерина,
с ганглиозидами и его участия в стабилизации
то этот факт может указывать на существование
миелина ещё предстоит изучить.
петли положительной обратной связи, регули-
Нарушения синтеза гликолипидов, играю-
рующей процесс миелинизации [115].
щих важную роль в формировании и под-
Таким образом, липиды являются не только
держании структуры миелина, приводит к
важными структурными компонентами миели-
развитию различных демиелинизирующих за-
новых мембран, они также определяют локали-
болеваний [117].
зацию белков в клеточной мембране ОЛ, влияя
Таким образом, рассмотренные данные,
на их функции. Ключевая роль липидов в ли-
подтверждая значимость олигодендроцитар-
пид-белковых взаимодействиях наиболее ярко
ных липидов в обеспечении функциональной
проявляется в период начала интенсивной мие-
активности ЦНС, указывают на перспектив-
линизации, когда растущий ОЛ должен всту-
ность дальнейших исследований этих сложных
пить в контакт с аксоном. При этом в процессах
аспектов межклеточной коммуникации.
межклеточной адгезии и узнавания основная
роль среди липидов отводится ганглиозидам и
сульфоцереброзидам [24, 116, 117]. Установле-
ВЗАИМОДЕЙСТВИЕ МИКРОГЛИАЛЬНЫХ
но, что ганглиозид GM1, расположенный в па-
КЛЕТОК С НЕЙРОНАМИ
ранодальных областях миелиновой оболочки,
имеет решающее значение для взаимодействия
Функции микроглии. Ещё один тип гли-
глиального белка нейрофасцина-155 (NF155)
альных клеток
- микроглия
- составляет
и аксонального комплекса контактин/Caspr1
около 10-15% от популяции клеток голов-
(контактин-ассоциированный белок 1) (рис. 3).
ного мозга взрослых животных и представляет
Это белки клеточной адгезии, взаимодействие
собой фагоцитирующие и иммунокомпетент-
которых необходимо для сохранения цитоархи-
ные клетки нервной системы, функционально
тектоники паранодальных регионов. У мутант-
отличные от аналогичных клеток перифери-
ных мышей с нарушением синтеза GM1 или
ческих тканей. На ранних стадиях развития в
сульфоцереброзидов наблюдается снижение
мозге присутствует множество различных суб-
уровня Caspr и NF155 в рафтах, а также измене-
популяций микроглии, однако с возрастом эта
ние количества и локализации ионных каналов
гетерогенность снижается [125]. Эти клетки
в паранодальных областях около перехватов
играют важную роль в развитии ЦНС и под-
Ранвье [118, 119].
держивают гомеостаз как в развивающемся,
Со своей стороны, ганглиозиды нейронов, в
так и во взрослом мозге. В функции микро-
частности GM1, GD1a и GT1b, также участвуют
глиальных клеток входит удаление апоптоти-
в стабилизации миелиновых мембран. GD1a
ческих и некротических клеток, несвёрнутых
и GT1b, два наиболее распространённых ган-
белков (например β-амилоида), а также мие-
глиозида аксональных мембран, взаимодейству-
линового дебриса. На ранних этапах развития
ют с миелин-ассоциированным гликопротеи-
мозга микроглия поддерживает выживание
ном (MAG), являясь его рецепторами [120-122].
нейронов и ОЛ, способствует апоптотической
Передача сигналов между ганглиозидами аксона
гибели избыточных нейронов-предшествен-
и иммуноглобулиновыми доменами MAG с
ников и дифференцировке клеток-предше-
участием Fak1-киназы определяет расстояние
ственников ОЛ. В постнатальный период эти
между аксоном и самой внутренней (адаксо-
клетки участвуют в поддержании пула клеток-
нальной) мембраной миелина, контролирует
предшественников ОЛ, созревании синапсов
образование миелина, а также ингибирует рост
и ремоделировании нейронных сетей, таким
нейритов в развивающемся мозге или регенера-
образом, активно участвуя в процессах, обес-
цию аксона во взрослом мозге [122].
печивающих пластичность мозга.
БИОХИМИЯ том 88 вып. 3 2023
5*
420
ГАЛКИНА и др.
Являясь важной частью врождённой им-
запуск фагоцитоза клетками микроглии [134].
мунной системы, клетки микроглии активи-
Поглощение фрагментов миелина опосреду-
руются при различного рода воспалительных
ется появлением на поверхности микрогли-
процессах в ЦНС, что является характерным
альных клеток основного фагоцитарного ре-
признаком нейровоспаления и нейродегенера-
цептора CD36 (транслоказа жирных кислот), в
ции [126, 127]. Таким образом, микроглиаль-
свою очередь, поступление миелина увеличи-
ные клетки могут взаимодействовать с ней-
вает экспрессию CD36, усиливая дальнейший
ронами, астроцитами и олигодендроцитами,
захват миелинового дебриса [135]. С одной
оказывая влияние на их функционирование.
стороны, поглощение миелина, содержащего
Медиаторами такого взаимодействия служат
большое количество холестерина, требует его
внеклеточные везикулы и липопротеины [128,
элиминации, поскольку накопление этого
129]. Нарушение взаимодействия между ней-
липида и продуктов его метаболизма способ-
ронами и микроглией оказывает негативное
ствуют нейровоспалению [127, 136]. С другой
действие на функции ЦНС, включая память и
стороны, холестерин является также биологи-
некоторые типы поведения [130].
чески активным соединением, которое спо-
Роль липидов микроглии в межклеточных
собствует выживанию микроглиальных клеток
взаимодействиях. В литературе накоплен боль-
в культуре и поставляется из астроцитов [133].
шой массив данных об участии про- и анти-
Установлено, что в условиях демиелинизации
воспалительных факторов, хемокинов и дру-
микроглия начинает синтезировать десмо-
гих соединений, выделяемых микроглией, в
стерол, непосредственный предшественник
межклеточных взаимоотношениях в ЦНС.
в биосинтезе холестерина и агонист Х-рецеп-
Значительно меньше сведений о липидах мик-
торов печени (LXR), тем самым способствуя
роглии и об их возможной роли во взаимо-
ремиелинизации [137]. В целом, баланс между
действии этих клеток с нейронами, астроци-
поступлением холестерина и его оттоком мо-
тами и олигодендроцитами. В последние годы
жет играть важную роль в функционировании
эти вопросы всё больше стали привлекать
этих глиальных клеток и представлять собой
внимание, такие исследования весьма инте-
ещё один вариант проявления нейропластич-
ресны и перспективны. Однако точная роль
ности, а также играть роль в развитии нейро-
липидов микроглии и конкретные механизмы
воспалительных заболеваний.
всё ещё остаются мало изученными.
Одной из особенностей микроглии явля-
Важно отметить, что клетки микроглии
ется её высокая чувствительность к факто-
могут как сами синтезировать липиды, так
рам внешней среды, связанная в том числе и
и получать их извне (транспорт при участии
с экспрессией широкого спектра рецепторов.
ApoE и ApoJ) и накапливать [127, 129, 131].
Всё больше данных свидетельствует о том, что
Липидный состав микроглии характеризу-
жирные кислоты пищи уникальным образом
ется высоким содержанием сфинголипидов, в
изменяют метаболизм микроглиальных кле-
частности сфингомиелинов, с преобладанием
ток и изменяют их «фенотип» (стимулируют
молекулярных видов, которые не встречают-
их превращение в другую субпопуляцию) [131,
ся в других клетках ЦНС [26]. В публикациях
132, 138]. В недавних исследованиях было по-
появляются данные, указывающие на то, что
казано, что микроглия может реагировать на
процессы метаболизма липидов в клетках мик-
избыточное потребление насыщенных жиров,
роглии участвуют в активации этих клеток,
вызывая дисфункцию нейронов в медиаба-
вызывая миграцию, фагоцитоз и запуск вос-
зальном гипоталамусе - области мозга, кон-
палительных реакций и, таким образом, опо-
тролирующей энергетический метаболизм, и
средованно влияя на функции нейронов и дру-
таким образом влиять на гипоталамический
гих глиальных клеток [131, 132]. Кроме того,
контроль метаболизма в других тканях [129].
скорость метаболизма липидов изменяется
в процессе развития клеток микроглии и при
переходе из одного состояния в другое - для
ЗАКЛЮЧЕНИЕ
взрослой микроглии [125, 131, 133].
Традиционно ключевая роль микроглии
Таким образом, совокупность рассмо-
отводится фагоцитозу богатого липидами
тренных литературных данных, накопленных
миелинового дебриса или олигодендроцитов,
за последние годы, убедительно доказывает,
находящихся в стадии апоптоза (рис. 1). При
что многие липиды служат межклеточными и
нейровоспалительных заболеваниях разруше-
внутриклеточными сигнальными молекулами,
ние миелиновых оболочек приводит к накоп-
участвующими в нейроглиальных взаимодей-
лению остатков миелина, что стимулирует
ствиях, регулирующими различные функции
БИОХИМИЯ том 88 вып. 3 2023
ЛИПИДЫ И НЕЙРОГЛИАЛЬНЫЕ ВЗАИМОДЕЙСТВИЯ
421
головного мозга и способствующими реали-
Интересным направлением, на наш взгляд,
зации нейропластичности на разных уровнях.
является изучение роли астроцитов в защите
Как уже говорилось выше, сигнальные функ-
нейрона от окислительного стресса и участие в
ции липидов тесно связаны с их метаболи-
этом липидных капель. Мало изученной обла-
ческими превращениями, поскольку многие
стью остаётся вклад ганглиозидов в процессы
«сигнальные» липиды обычно являются про-
взаимодействия между аксоном и примыкаю-
дуктами ферментативного расщепления или
щей к нему миелиновой мембраной. Отдель-
превращения «структурных» липидов плазма-
ного направления исследований заслуживают
тической мембраны. В то же время в мозге на-
процессы транспорта липидов между глиаль-
блюдается выраженная компартментализация
ными клетками.
отдельных этапов метаболизма липидов между
разными типами клеток нервной системы.
Вклад авторов. О.В. Галкина, О.В. Ветро-
Так, процессы окисления жирных кислот
вой, И.Е. Красовская, Н.Д. Ещенко - напи-
и биосинтеза холестерина во взрослом мозге
сание текста статьи; О.В. Галкина - анализ
в основном связаны с астроцитами, в то вре-
литературных данных; Н.Д. Ещенко, О.В. Вет-
мя как в олигодендроцитах биосинтез холе-
ровой - существенный вклад в концепцию и
стерина и гексозилцерамидов имеет самую
дизайн статьи; О.В. Галкина, О.В. Ветровой -
высокую интенсивность на ранних этапах раз-
подготовка наглядного материала; И.Е. Кра-
вития мозга. Пути превращения арахидоно-
совская - редактирование текста статьи.
вой кислоты - жирной кислоты, вовлечённой
Финансирование. Работа выполнена при фи-
в передачу сигналов воспаления - в основ-
нансовой поддержке Минобрнауки РФ (согла-
ном осуществляются в микроглиальных клет-
шение № 075-15-2020-921 от 13.11.2020) в рамках
ках, обеспечивающих иммунные реакции и
проекта НЦМУ Павловский центр «Интегра-
гомеостаз мозга. Тем не менее роль липидов
тивная физиология - медицине, высокотехно-
в регуляции функций микроглиальных кле-
логичному здравоохранению и технологиям
ток и взаимоотношений их с другими клет-
стрессоустойчивости», направление: «Биологи-
ками нервной ткани пока ещё мало изучена и
ческие и социальные основы инклюзии».
представляется весьма перспективным нап-
Конфликт интересов. Авторы заявляют об
равлением исследований. Роли липидов аст-
отсутствии конфликта интересов.
роцитарных и олигодендроцитарных клеток
Соблюдение этических норм. Настоящая
в межклеточных взаимодействиях уделено в
статья не содержит описания каких-либо ис-
современной литературе больше внимания,
следований с участием людей или животных в
однако здесь также остаётся много вопросов.
качестве объектов.
СПИСОК ЛИТЕРАТУРЫ
1. Barres, B. A. (2008) The mystery and magic of glia: a
neurons and glial cells in the human brain: A review of
perspective on their roles in health and disease, Neuron,
150 years of cell counting, J. Comp. Neurol., 524, 3865-
60, 430-440, doi: 10.1016/j.neuron.2008.10.013.
3895, doi: 10.1002/cne.24040.
2. Jakel, S., and Dimou, L. (2017) Glial cells and their
7. Abbott, N. J., Ronnback, L., and Hansson, E. (2006)
function in the adult brain: a journey through the
Astrocyte-endothelial interactions at the blood-brain bar-
history of their ablation, Front. Cell Neurosci., 11, 24,
rier, Nat. Rev. Neurosci., 7, 41-53, doi: 10.1038/nrn1824.
doi: 10.3389/fncel.2017.00024.
8. Rothstein, J. D., Dykes-Hoberg, M., Pardo, C. A.,
3. Hatton, G. I. (2002) Glial-neuronal interactions in the
Bristol, L. A., Jin, L., Kuncl, R. W., Kanai, Y., Hedi-
mammalian brain, Adv. Physiol. Educ., 26, 225-237,
ger, M. A., Wang, Y., Schielke, J. P., and Welty, D. F.
doi: 10.1152/advan.00038.2002.
(1996) Knockout of glutamate transporters reveals
4. Galkina, O. V., Vetrovoy, O. V., and Eschenko, N.
a major role for astroglial transport in excitotoxici-
D. (2021) The role of lipids in implementing specific
ty and clearance of glutamate, Neuron, 16, 675-686,
functions in the central nervous system, Russ. J.
doi: 10.1016/s0896-6273(00)80086-0.
Bioorg. Chem., 47, 1004-1013.
9. Simard, M., and Nedergaard, M. (2004) The neuro-
5. Sofroniew, M. V., and Vinters, H. V. (2010) Astrocytes:
biology of glia in the context of water and ion ho-
biology and pathology, Acta Neuropathol., 119, 7-35,
meostasis, Neuroscience, 129, 877-896, doi: 10.1016/
doi: 10.1007/s00401-009-0619-8.
j.neuroscience.2004.09.053.
6. Von Bartheld, C. S., Bahney, J., and Herculano-
10. Butt, A. M., and Kalsi, A. (2006) Inwardly rectifying
Houzel, S. (2016) The search for true numbers of
potassium channels (Kir) in central nervous system
БИОХИМИЯ том 88 вып. 3 2023
422
ГАЛКИНА и др.
glia: a special role for Kir4.1 in glial functions, J. Cell
24.
Barber, C. N., and Raben, D. M. (2019) Lipid
Mol. Med., 10, 33-44, doi: 10.1111/j.1582-4934.2006.
metabolism crosstalk in the brain: glia and neurons,
tb00289.x.
Front. Cell Neurosci.,
13,
212, doi:
10.3389/
11.
Hewett, J. A. (2009) Determinants of regional and
fncel.2019.00212.
local diversity within the astroglial lineage of the
25.
Semyanov, A., and Verkhratsky, A. (2021) Astrocytic
normal central nervous system, J. Neurochem., 110,
processes: from tripartite synapses to the active
1717-1736, doi: 10.1111/j.1471-4159.2009.06288.x.
milieu, Trends Neurosci., 44, 781-792, doi: 10.1016/
12.
Allen, N. J., and Eroglu, C. (2017) Cell biology of
j.tins.2021.07.006.
astrocyte-synapse interactions, Neuron, 96, 697-708,
26.
Fitzner, D., Bader, J. M., Penkert, H., Bergner, C. G.,
doi: 10.1016/j.neuron.2017.09.056.
Su, M., Weil, M. T., Surma, M. A., Mann, M.,
13.
Pannasch, U., Vargová, L., Reingruber, J., Ezan, P.,
Klose, C., and Simons, M. (2020) Cell-type- and
Holcman, D., Giaume, C., Syková, E., and Rouach, N.
brain-region-resolved mouse brain lipidome, Cell
(2011) Astroglial networks scale synaptic activity and
Rep., 32, 108132, doi: 10.1016/j.celrep.2020.108132.
plasticity, Proc. Natl. Acad. Sci. USA, 108, 8467-8472,
27.
Galkina, O. V., Putilina, F. E., and Eshchenko, N. D.
doi: 10.1073/pnas.1016650108.
(2014) Changes in the lipid composition of the brain
14.
Varcianna, A., Myszczynska, M. A., Castelli, L. M.,
during early onthogenesis, Neurochem. J., 8, 83-88,
O’Neill, B., Kim, Y., Talbot, J., Nyberg, S., Nyamali, I.,
doi: 10.1134/S1819712414020044.
Heath, P. R., Stopford, M. J., Hautbergue, G. M., and
28.
Lee, J. A., Hall, B., Allsop, J., Alqarni, R., and
Ferraiuolo, L. (2019) Micro-RNAs secreted through
Allen, S. P. (2021) Lipid metabolism in astrocytic
astrocyte-derived extracellular vesicles cause neuronal
structure and function, Semin. Cell Dev. Biol., 112,
network degeneration in C9orf72 ALS, EBioMedicine,
123-136, doi: 10.1016/j.semcdb.2020.07.017.
40, 626-635, doi: 10.1016/j.ebiom.2018.11.067.
29.
Zhu, Y. B., Gao, W., Zhang, Y., Jia, F., Zhang, H. L.,
15.
Ullian, E. M., Sapperstein, S. K., Christopherson, K. S.,
Liu, Y. Z., Sun, X. F., Yin, Y., and Yin, D. M. (2016)
and Barres, B. A. (2001) Control of synapse num-
Astrocyte-derived phosphatidic acid promotes den-
ber by glia, Science, 291, 657-661, doi: 10.1126/
dritic branching, Sci. Rep., 6, 21096, doi: 10.1038/
science.291.5504.657.
srep21096.
16.
Hu, R., Cai, W. Q., Wu, X. G., and Yang, Z. (2007)
30.
Cai, D., Zhong, M., Wang, R., Netzer, W.J.,
Astrocyte-derived estrogen enhances synapse forma-
Shields, D., Zheng, H., Sisodia, S. S., Foster, D. A.,
tion and synaptic transmission between cultured neo-
Gorelick, F. S., Xu, H., and Greengard, P. (2006)
natal rat cortical neurons, Neuroscience, 144, 1229-
Phospholipase D1 corrects impaired betaAPP traf-
1240, doi: 10.1016/j.neuroscience.2006.09.056.
ficking and neurite outgrowth in familial Alzheimer’s
17.
Araque, A.
(1999) Tripartite synapses: glia, the
disease-linked presenilin-1 mutant neurons, Proc.
unacknowledged partner, Trends Neurosci., 22, 208-
Nat. Acad. Sci. USA, 103, 1936-1940, doi: 10.1073/
215, doi: 10.1016/s0166-2236(98)01349-6.
pnas.0510710103.
18.
Harada, K., Kamiya, T., and Tsuboi, T.
(2016)
31.
Tanguy, E., Wang, Q., Moine, H., and Vitale, N.
Gliotransmitter release from astrocytes: functional,
(2019) Phosphatidic acid: from pleiotropic functions
developmental, and pathological implications in
to neuronal pathology, Front. Cell Neurosci., 13, 2,
the brain, Front. Neurosci., 9, 499, doi: 10.3389/
doi: 10.3389/fncel.2019.00002.
fnins.2015.00499.
32.
Tabet, R., Moutin, E., Becker, J. A., Heintz, D.,
19.
Haydon, P. G., and Carmignoto, G. (2006) Astrocyte
Fouillen, L., Flatter, E., Krężel, W., Alunni, V.,
control of synaptic transmission and neurovascular
Koebel, P., Dembélé, D., Tassone, F., Bardoni, B.,
coupling, Physiol. Rev., 86, 1009-1031, doi: 10.1152/
Mandel, J. L., Vitale, N., Muller, D., Le Merrer, J.,
physrev.00049.2005.
and Moine, H. (2016) Fragile X Mental Retardation
20.
Fellin, T., and Carmignoto, G. (2004) Neurone-to-
Protein (FMRP) controls diacylglycerol kinase
astrocyte signalling in the brain represents a distinct
activity in neurons, Proc. Natl. Acad. Sci. USA, 113,
multifunctional unit, J. Physiol., 559 (Pt
1), 3-15,
E3619-E3628, doi: 10.1073/pnas.1522631113.
doi: 10.1113/jphysiol.2004.063214.
33.
Huang, P., Altshuller, Y. M., Hou, J. C., Pessin, J. E.,
21.
Hamilton, N. B., and Attwell, D. (2010) Do astrocytes
and Frohman, M. A. (2005) Insulin-stimulated plasma
really exocytose neurotransmitters? Nat. Rev. Neurosci.,
membrane fusion of Glut4 glucose transporter-
11, 227-238, doi: 10.1038/nrn2803.
containing vesicles is regulated by phospholipase vD1,
22.
Petrelli, F., and Bezzi, P. (2016) Novel insights into
Mol. Biol. Cell,
16,
2614-2623, doi:
10.1091/
gliotransmitters, Curr. Opin. Pharmacol., 26, 138-145,
mbc.e04-12-1124.
doi: 10.1016/j.coph.2015.11.010.
34.
Shirai, Y., and Saito, N. (2014) Diacylglycerol kinase
23.
Baldwin, K. T., and Eroglu, C. (2017) Molecular
as a possible therapeutic target for neuronal diseases,
mechanisms of astrocyte-induced synaptogenesis,
J. Biomed. Sci., 21, 28, doi: 10.1186/1423-0127-21-28.
Curr. Opin. Neurobiol., 45, 113-120, doi: 10.1016/
35.
Lee, D., Kim, E., Tanaka-Yamamoto, K.
(2016)
j.conb.2017.05.006.
Diacylglycerol kinases in the coordination of synaptic
БИОХИМИЯ том 88 вып. 3 2023
ЛИПИДЫ И НЕЙРОГЛИАЛЬНЫЕ ВЗАИМОДЕЙСТВИЯ
423
plasticity, Front. Cell Dev. Biol., 4, 92, doi: 10.3389/
Grant, N. J., and Vitale, N. (2017) Comparative
fcell.2016.00092.
characterization of phosphatidic acid sensors and
36.
Barber, C. N., and Raben, D. M. (2020) Roles of
their localization during frustrated phagocytosis,
DGKs in neurons: postsynaptic functions? Adv. Biol.
J. Biol. Chem.,
292,
4266-4279, doi:
10.1074/
Regul., 75, 100688, doi: 10.1016/j.jbior.2019.100688.
jbc.M116.742346.
37.
Hozumi, Y., Watanabe, M., Otani, K., and Goto, K.
47.
Sang, N., Zhang, J., Marcheselli, V., Bazan, N. G.,
(2009) Diacylglycerol kinase beta promotes dendritic
and Chen, C. (2005) Postsynaptically synthesized
outgrowth and spine maturation in developing
prostaglandin E2 (PGE2) modulates hippocampal
hippocampal neurons, BMC Neurosci.,
10,
99,
synaptic transmission via a presynaptic PGE2 EP2
doi: 10.1186/1471-2202-10-99.
receptor, J. Neurosci., 25, 9858-9870, doi: 10.1523/
38.
Shirai, Y., Kouzuki, T., Kakefuda, K., Moriguchi, S.,
JNEUROSCI.2392-05.2005.
Oyagi, A., Horie, K., Morita, S. Y., Shimazawa, M.,
48.
Lima, I. V., Bastos, L. F., Limborço-Filho, M.,
Fukunaga, K., Takeda, J., Saito, N., and Hara, H.
Fiebich, B. L., and de Oliveira, A. C. (2012) Role of
(2010) Essential role of neuron-enriched diacylglycerol
prostaglandins in neuroinflammatory and neuro-
kinase (DGK), DGKbeta in neurite spine formation,
degenerative diseases, Mediators Inflamm.,
2012,
contributing to cognitive function, PLoS One, 5,
946813, doi: 10.1155/2012/946813.
e11602, doi: 10.1371/journal.pone.0011602.
49.
Pedersen, A. L., and Saldanha, C. J. (2017) Reciprocal
39.
Seo, J., Kim, K., Jang, S., Han, S., Choi, S. Y., and
interactions between prostaglandin E2- and estradiol-
Kim, E. (2012) Regulation of hippocampal long-
dependent signaling pathways in the injured zebra
term potentiation and long-term depression by
finch brain, J. Neuroinflamm., 14, 262, doi: 10.1186/
diacylglycerol kinase ζ, Hippocampus, 22, 1018-1026,
s12974-017-1040-1.
doi: 10.1002/hipo.20889.
50.
Attwell, D., Buchan, A. M., Charpak, S., Laurit-
40.
Goto, K., Watanabe, M., Kondo, H., Yuasa, H.,
zen, M., Macvicar, B. A., and Newman, E. A. (2010)
Sakane, F., and Kanoh, H. (1992) Gene cloning,
Glial and neuronal control of brain blood flow, Nature,
sequence, expression and in situ localization of 80 kDa
468, 232-243, doi: 10.1038/nature09613.
diacylglycerol kinase specific to oligodendrocyte
51.
Liu, Y., Zhang, H., Wu, C. Y., Yu, T., Fang, X.,
of rat brain, Brain Res. Mol. Brain Res., 16, 75-87,
Ryu, J. J., Zheng, B., Chen, Z., Roman, R. J., and
doi: 10.1016/0169-328x(92)90196-i.
Fan, F. (2021) 20-HETE-promoted cerebral blood
41.
Wheeler, S. E., Stacey, H. M., Nahaei, Y., Hale, S. J.,
flow autoregulation is associated with enhanced
Hardy, A. B., Reimann, F., Gribble, F. M., Larrau-
pericyte contractility, Prostaglandins Other Lipid
fie, P., Gaisano, H. Y., and Brubaker, P. L. (2017)
Mediat., 154, 106548, doi: 10.1016/j.prostaglandins.
The SNARE protein syntaxin-1a plays an essential
2021.106548.
role in biphasic exocytosis of the incretin hormone
52.
Navarrete, M., Perea, G., Maglio, L., Pastor, J.,
glucagon-like peptide 1, Diabetes, 66, 2327-2338,
García de Sola, R., and Araque, A. (2013) Astrocyte
doi: 10.2337/db16-1403.
calcium signal and gliotransmission in human brain
42.
Tanguy, E., Kassas, N., and Vitale, N.
(2018)
tissue, Cereb. Cortex, 23, 1240-1246, doi: 10.1093/
Protein-phospholipid interaction motifs: a focus on
cercor/bhs122.
phosphatidic acid, Biomolecules, 8, 20, doi: 10.3390/
53.
Navarrete, M., Díez, A., and Araque, A.
(2014)
biom8020020.
Astrocytes in endocannabinoid signalling, Philos.
43.
Limatola, C., Schaap, D., Moolenaar, W. H., and van
Trans. R. Soc. Lond. Ser. B Biol. Sci., 369, 20130599,
Blitterswijk, W. J. (1994) Phosphatidic acid activation
doi: 10.1098/rstb.2013.0599.
of protein kinase C-zeta overexpressed in COS cells:
54.
Rouzer, C. A., and Marnett, L. J. (2011) Endocanna-
comparison with other protein kinase C isotypes and
binoid oxygenation by cyclooxygenases, lipoxygenases,
other acidic lipids, Biochem. J., 304 (Pt 3), 1001-1008,
and cytochromes P450: cross-talk between the eicosa-
doi: 10.1042/bj3041001.
noid and endocannabinoid signaling pathways, Chem.
44.
Jang, J.-H., Lee, C. S., Hwang, D., and Ryu, S. H.
Rev., 111, 5899-5921, doi: 10.1021/cr2002799.
(2012) Understanding of the roles of phospholipase D
55.
Mergenthaler, P., Lindauer, U., Dienel, G. A.,
and phosphatidic acid through their binding
and Meisel, A. (2013) Sugar for the brain: the role
partners, Prog. Lipid Res., 51, 71-81, doi: 10.1016/
of glucose in physiological and pathological brain
j.plipres.2011.12.003.
function, Trends Neurosci., 36, 587-597, doi: 10.1016/
45.
Park, C., Kang, D. S., Shin, G. H., Seo, J., Kim, H.,
j.tins.2013.07.001.
Suh, P. G., Bae, C. D., and Shin, J. H.
(2015)
56.
Falkowska, A., Gutowska, I., Goschorska, M.,
Identification of novel phosphatidic acid-binding
Nowacki, P., Chlubek, D., and Baranowska-Bosiacka, I.
proteins in the rat brain, Neurosci. Lett., 595, 108-113,
(2015) Energy metabolism of the brain, including the
doi: 10.1016/j.neulet.2015.04.012.
cooperation between astrocytes and neurons, especially
46.
Kassas, N., Tanguy, E., Thahouly, T., Fouillen, L.,
in the context of glycogen metabolism, Int. J. Mol. Sci.,
Heintz, D., Chasserot-Golaz, S., Bader, M. F.,
16, 25959-25981, doi: 10.3390/ijms161125939.
БИОХИМИЯ том 88 вып. 3 2023
424
ГАЛКИНА и др.
57.
Furuya, S.T., Tabata, J., Mitoma, K., Yamada, M.,
68.
Nieweg, K., Schaller, H., and Pfrieger, F. W.
Yamasaki, A., Makino, A., Yamamoto, T., Wata-
(2009) Marked differences in cholesterol synthesis
nabe, M., Kano, M., and Hirabayashi, Y.
(2000)
between neurons and glial cells from postnatal rats,
L-Serine and glycine serve as major astroglia-derived
J. Neurochem., 109, 125-134, doi: 10.1111/j.1471-4159.
trophic factors for cerebellar Purkinje neurons, Proc.
2009.05917.x.
Natl. Acad. Sci. USA, 97, 11528-11533, doi: 10.1073/
69.
Garcia Corrales, A. V., Haidar, M., Bogie, J. F. J.,
pnas.200364497.
and Hendriks, J. J. A. (2021) Fatty acid synthesis
58.
Chen, J., Zhang, X., Kusumo, H., Costa, L. G., and
in glial cells of the CNS, Int. J. Mol. Sci., 22, 8159,
Guizzetti, M. (2013) Cholesterol efflux is differentially
doi: 10.3390/ijms22158159.
regulated in neurons and astrocytes: Implications for
70.
Aizawa, F., Nishinaka, T., Yamashita, T., Nakamoto, K.,
brain cholesterol homeostasis, Biochim. Biophys. Acta,
Koyama, Y., Kasuya, F., and Tokuyama, S. (2016)
1831, 263-275, doi: 10.1016/j.bbalip.2012.09.007.
Astrocytes release polyunsaturated fatty acids by
59.
Van Deijk, A. F., Camargo, N., Timmerman, J.,
lipopolysaccharide stimuli, Biol. Pharm. Bull., 39,
Heistek, T., Brouwers, J. F., Mogavero, F.,
1100-1106, doi: 10.1248/bpb.b15-01037.
Mansvelder, H. D., Smit, A. B., and Verheijen, M. H.
71.
Pfrieger, F. W., and Ungerer, N. (2011) Cholesterol
(2017) Astrocyte lipid metabolism is critical for synapse
metabolism in neurons and astrocytes, Progr. Lipid
development and function in vivo, Glia, 65, 670-682,
Res., 50, 357-371, doi: 10.1016/j.plipres.2011.06.002.
doi: 10.1002/glia.23120.
72.
Orth, M., and Bellosta, S. (2012) Cholesterol: its
60.
McPherson, P.A., and McEneny, J. (2012) The bio-
regulation and role in central nervous system disorders,
chemistry of ketogenesis and its role in weight man-
Cholesterol, 2012, 292598, doi: 10.1155/2012/292598.
agement, neurological disease and oxidative stress,
73.
Zhang, J., and Liu, Q. (2015) Cholesterol metabolism
J. Physiol. Biochem., 68, 141-151, doi: 10.1007/s13105-
and homeostasis in the brain, Protein Cell, 6, 254-264,
011-0112-4.
doi: 10.1007/s13238-014-0131-3.
61.
Schonfeld, P., and Reiser, G. (2013) Why does brain
74.
Dietschy, J. M., and Turley, S. D. (2004) Cholesterol
metabolism not favor burning of fatty acids to provide
metabolism in the central nervous system during early
energy? Reflections on disadvantages of the use of
development and in the mature animal, J. Lipid Res.,
free fatty acids as fuel for brain, J. Cereb. Blood Flow
45, 1375-1397, doi: 10.1194/jlr.R400004-JLR200.
Metab., 33, 1493-1499, doi: 10.1038/jcbfm.2013.128.
75.
Mauch, D. H., Nägler, K., Schumacher, S., Göritz, C.,
62.
Speijer, D., Manjeri, G. R., and Szklarczyk, R.
Müller, E. C., Otto, A., and Pfrieger, F. W. (2001)
(2014) How to deal with oxygen radicals stemming
CNS synaptogenesis promoted by glia-derived cho-
from mitochondrial fatty acid oxidation, Philos.
lesterol, Science,
294,
1354-1357, doi:
10.1126/
Trans. R. Soc. Lond. Ser. B Biol. Sci., 369, 20130446,
science.294.5545.1354.
doi: 10.1098/rstb.2013.0446.
76.
Göritz, C., Mauch, D. H., Nägler, K., and
63.
Bailey, A. P., Koster, G., Guillermier, C., Hirst, E. M.,
Pfrieger, F. W. (2002) Role of glia-derived cholesterol
MacRae, J. I., Lechene, C. P., Postle, A. D., and
in synaptogenesis: new revelations in the synapse-glia
Gould, A. P. (2015) Antioxidant role for lipid droplets
affair, J. Physiol. Paris, 96, 257-263, doi: 10.1016/
in a stem cell niche of Drosophila, Cell, 163, 340-353,
s0928-4257(02)00014-1.
doi: 10.1016/j.cell.2015.09.020.
77.
Moutinho, M., Nunes, M. J., and Rodrigues, E. (2017)
64.
Smolič, T., Zorec, R., and Vardjan, N.
(2021)
The mevalonate pathway in neurons: It’s not just about
Pathophysiology of lipid droplets in neuroglia,
cholesterol, Exp. Cell Res., 360, 55-60, doi: 10.1016/
Antioxidants, 11, 22, doi: 10.3390/antiox11010022.
j.yexcr.2017.02.034.
65.
Ioannou, M. S., Jackson, J., Sheu, S. H., Chang, C. L.,
78.
Lloyd-Evans, E., and Waller-Evans, H.
(2020)
Weigel, A. V., Liu, H., Pasolli, H. A., Xu, C. S.,
Biosynthesis and signalling functions of central and
Pang, S., Matthies, D., Hess, H. F., Lippincott-
peripheral nervous system neurosteroids in health and
Schwartz, J., and Liu, Z.
(2019) Neuron-astro-
disease, Essays Biochem., 64, 591-606, doi: 10.1042/
cyte metabolic coupling protects against activity-
EBC20200043.
induced fatty acid toxicity, Cell, 177, 1522-1535.e14,
79.
Camargo, N., Brouwers, J. F., Loos, M., Gut-
doi: 10.1016/j.cell.2019.04.001.
mann, D. H., Smit, A. B., and Verheijen, M. H. (2012)
66.
Yang, D., Wang, X., Zhang, L., Fang, Y., Zheng, Q.,
High-fat diet ameliorates neurological deficits caused
Liu, X., Yu, W., Chen, S., Ying, J., and Hua, F. (2022)
by defective astrocyte lipid metabolism, FASEB J.,
Lipid metabolism and storage in neuroglia: role in
26, 4302-4315, doi: 10.1096/fj.12-205807.
brain development and neurodegenerative diseases,
80.
Thiele, C., Hannah, M. J., Fahrenholz, F., and Hut-
Cell Biosci., 12, 106, doi: 10.1186/s13578-022-00828-0.
tner, W. B. (2000) Cholesterol binds to synaptophysin
67.
Moore, S. A.
(2001) Polyunsaturated fatty acid
and is required for biogenesis of synaptic vesicles, Nat.
synthesis and release by brain-derived cells in vitro,
Cell Biol., 2, 42-49, doi: 10.1038/71366.
J. Mol. Neurosci., 16, 195-200, discussion 215-221,
81.
Petrov, A. M., Kasimov, M. R., and Zefirov, A. L.
doi: 10.1385/JMN:16:2-3:195.
(2016) Brain cholesterol metabolism and its
БИОХИМИЯ том 88 вып. 3 2023
ЛИПИДЫ И НЕЙРОГЛИАЛЬНЫЕ ВЗАИМОДЕЙСТВИЯ
425
defects: linkage to neurodegenerative diseases
synaptic plasticity and learning, J. Biol. Chem., 277,
and synaptic dysfunction, Acta Naturae, 8, 58-73,
39944-39952, doi: 10.1074/jbc.M205147200.
doi: 10.32607/20758251-2016-8-1-58-73.
93.
Castellano, J. M., Kim, J., Stewart, F. R., Jiang, H.,
82.
Allen, J. A., Halverson-Tamboli, R. A., and
DeMattos, R. B., Patterson, B. W., Fagan, A. M.,
Rasenick, M. M. (2007) Lipid raft microdomains and
Morris, J. C., Mawuenyega, K. G., Cruchaga, C.,
neurotransmitter signalling, Nat. Rev. Neurosci., 8,
Goate, A. M., Bales, K. R., Paul, S. M., Bate-
128-140, doi: 10.1038/nrn2059.
man, R. J., and Holtzman, D. M. (2011) Human
83.
Delle Bovi, R. J., Kim, J., Suresh, P., London, E.,
apoE isoforms differentially regulate brain amyloid-
and Miller, W. T. (2019) Sterol structure depen-
beta peptide clearance, Sci. Transl. Med., 3, 89ra57,
dence of insulin receptor and insulin-like growth
doi: 10.1126/scitranslmed.3002156.
factor 1 receptor activation, Biochim. Biophys. Acta
94.
Jones, P. B., Adams, K. W., Rozkalne, A., Spires-
Biomembr., 1861, 819-826, doi: 10.1016/j.bbamem.
Jones, T. L., Hshieh, T. T., Hashimoto, T., von
2019.01.009.
Armin, C. A., Mielke, M., Bacskai, B. J., and
84.
Tracey, T. J., Steyn, F. J., Wolvetang, E. J., and
Hyman, B. T.
(2011) Apolipoprotein E: isoform
Ngo, S. T. (2018) Neuronal lipid metabolism: multiple
specific differences in tertiary structure and interaction
pathways driving functional outcomes in health and
with amyloid-beta in human Alzheimer brain, PLoS
disease, Front. Mol. Neurosci., 11, 10, doi: 10.3389/
One, 6, e14586, doi: 10.1371/journal.pone.0014586.
fnmol.2018.00010.
95.
Yamazaki, Y., Zhao, N., Caulfield, T. R., Liu, C. C.,
85.
Bruce, K. D., Zsombok, A., and Eckel, R. H.
and Bu, G. (2019) Apolipoprotein E and Alzheimer
(2017) Lipid processing in the brain: a key regulator
disease: pathobiology and targeting strategies, Nat.
of systemic metabolism, Front. Endocrinol., 8, 60,
Rev. Neurol.,
15,
501-518, doi:
10.1038/s41582-
doi: 10.3389/fendo.2017.00060.
019-0228-7.
86.
Killoy, K. M., Harlan, B. A., Pehar, M., and
96.
Yin, J., Spillman, E., Cheng, E. S., Short, J., Chen, Y.,
Vargas, M. R. (2020) FABP7 upregulation induces a
Lei, J., Gibbs, M., Rosenthal, J. S., Sheng, C.,
neurotoxic phenotype in astrocytes, Glia, 68, 2693-
Chen, Y. X., Veerasammy, K., Choetso, T., Abzal-
2704, doi: 10.1002/glia.23879.
imov, R., Wang, B., Han, C., He, Y., and Yuan, Q.
87.
Kagawa, Y., Yasumoto, Y., Sharifi, K., Ebrahimi, M.,
(2021) Brain-specific lipoprotein receptors interact
Islam, A., Miyazaki, H., Yamamoto, Y., Sawada, T.,
with astrocyte derived apolipoprotein and mediate
Kishi, H., Kobayashi, S., Maekawa, M., Yoshika-
neuron-glia lipid shuttling, Nat. Commun., 12, 2408,
wa, T., Takaki, E., Nakai, A., Kogo, H., Fujimoto, T.,
doi: 10.1038/s41467-021-22751-7.
and Owada, Y. (2015) Fatty acid-binding protein 7
97.
Cartocci, V., Servadio, M., Trezza, V., and Pallotti-
regulates function of caveolae in astrocytes through ex-
ni, V. (2017) Can cholesterol metabolism modulation
pression of caveolin-1, Glia, 63, 780-794, doi: 10.1002/
affect brain function and behavior? J. Cell Physiol.,
glia.22784.
232, 281-286, doi: 10.1002/jcp.25488.
88.
Ebrahimi, M., Yamamoto, Y., Sharifi, K., Kida, H.,
98.
Alecu, I., and Bennett, S.
(2019) Dysregulated
Kagawa, Y., Yasumoto, Y., Islam, A., Miyazaki, H.,
lipid metabolism and its role in α-synucleinopathy
Shimamoto, C., Maekawa, M., Mitsushima, D.,
in Parkinson’s disease, Front. Neurosci., 13, 328,
Yoshikawa, T., and Owada, Y. (2016) Astrocyte-
doi: 10.3389/fnins.2019.00328.
expressed FABP7 regulates dendritic morphology and
99.
Adibhatla, R. M., and Hatcher, J. F. (2007) Role of
excitatory synaptic function of cortical neurons, Glia,
lipids in brain injury and diseases, Fut. Lipidol., 2, 403-
64, 48-62, doi: 10.1002/glia.22902.
422, doi: 10.2217/17460875.2.4.403.
89.
Liu, L., MacKenzie, K. R., Putluri, N., Maletić-
100. Nave, K. A. (2010) Myelination and the trophic
Savatić, M., and Bellen, H. J. (2017) The glia-neuron
support of long axons, Nat. Rev. Neurosci., 11, 275-
lactate shuttle and elevated ros promote lipid synthesis
283, doi: 10.1038/nrn2797.
in neurons and lipid droplet accumulation in glia via
101. Butt, A. M., Papanikolaou, M., and Rivera, A. (2019)
APOE/D, Cell Metab., 26, 719-737.e6, doi: 10.1016/
Physiology of oligodendroglia, Adv. Exp. Med. Biol.,
j.cmet.2017.08.024.
1175, 117-128, doi: 10.1007/978-981-13-9913-8_5.
90.
Wang, H., and Eckel, R. H. (2014) What are lipopro-
102. Sakry, D., Karram, K., and Trotter, J. (2011) Synapses
teins doing in the brain? Trends Endocrinol. Metab.,
between NG2 glia and neurons, J. Anat., 219, 2-7,
25, 8-14, doi: 10.1016/j.tem.2013.10.003.
doi: 10.1111/j.1469-7580.2011.01359.x.
91.
Evola, M., Hall, A., Wall, T., Young, A., and
103. Papanikolaou, M., Butt, A. M., and Lewis, A. (2020)
Grammas, P. (2010) Oxidative stress impairs learning
A critical role for the inward rectifying potassium
and memory in apoE knockout mice, Pharm. Biochem.
channel Kir7.1 in oligodendrocytes of the mouse optic
Behav., 96, 181-186, doi: 10.1016/j.pbb.2010.05.003.
nerve, Brain Struct. Funct., 225, 925-934, doi: 10.1007/
92.
Weeber, E. J., Beffert, U., Jones, C., Christian, J. M.,
s00429-020-02043-4.
Forster, E., Sweatt, J. D., and Herz, J. (2002) Reelin
104. Cherchi, F., Bulli, I., Venturini, M., Pugliese, A. M.,
and ApoE receptors cooperate to enhance hippocampal
and Coppi, E. (2021) Ion channels as new attractive
БИОХИМИЯ том 88 вып. 3 2023
426
ГАЛКИНА и др.
targets to improve re-myelination processes in the
115. Mathews, E. S., and Appel, B. (2016) Cholesterol
brain, Int. J. Mol. Sci., 22, 7277, doi: 10.3390/
biosynthesis supports myelin gene expression and axon
ijms22147277.
ensheathment through modulation of P13K/Akt/mTor
105. Gopalakrishnan, G., Awasthi, A., Belkaid, W., De
signaling, J. Neurosci., 36, 7628-7639, doi: 10.1523/
Faria, O. Jr., Liazoghli, D., Colman, D. R., and
JNEUROSCI.0726-16.2016.
Dhaunchak, A. S. (2013) Lipidome and proteome map
116. Posse de Chaves, E., and Sipione, S.
(2010)
of myelin membranes, J. Neurosci. Res., 91, 321-334,
Sphingolipids and gangliosides of the nervous system
doi: 10.1002/jnr.23157.
in membrane function and dysfunction, FEBS Lett.,
106. Löhmann, C., Schachmann, E., Dandekar, T.,
584, 1748-1759, doi: 10.1016/j.febslet.2009.12.010.
Villmann, C., and Becker, C. M. (2010) Developmental
117. Bonetto, G., and Di Scala, C. (2019) Importance
profiling by mass spectrometry of phosphocholine
of lipids for nervous system integrity: cooperation
containing phospholipids in the rat nervous system
between gangliosides and sulfatides in myelin
reveals temporo-spatial gradients, J. Neurochem., 114,
stability, J. Neurosci., 39, 6218-6220, doi: 10.1523/
1119-1134, doi: 10.1111/j.1471-4159.2010.06836.x.
JNEUROSCI.0377-19.2019.
107. Montani, L. (2021) Lipids in regulating oligodendrocyte
118. Susuki, K., Baba, H., Tohyama, K., Kanai, K., Ku-
structure and function, Semin. Cell Dev. Biol., 112,
wabara, S., Hirata, K., Furukawa, K., Furukawa, K.,
114-122, doi: 10.1016/j.semcdb.2020.07.016.
Rasband, M. N., and Yuki, N. (2007) Gangliosides
108. Kassmann, C. M. (2014) Myelin peroxisomes - es-
contribute to stability of paranodal junctions and ion
sential organelles for the maintenance of white mat-
channel clusters in myelinated nerve fibers, Glia, 55,
ter in the nervous system, Biochimie, 98, 111-118,
746-757, doi: 10.1002/glia.20503.
doi: 10.1016/j.biochi.2013.09.020.
119. Ishibashi, T., Dupree, J. L., Ikenaka, K., Hirahara, Y.,
109. Singhal, N. K., Huang, H., Li, S., Clements, R.,
Honke, K., Peles, E., Popko, B., Suzuki, K., Nishi-
Gadd, J., Daniels, A., Kooijman, E. E., Bannerman, P.,
no, H., and Baba, H. (2002) A myelin galactolipid,
Burns, T., Guo, F., Pleasure, D., Freeman, E.,
sulfatide, is essential for maintenance of ion channels
Shriver, L., and McDonough, J. (2017) The neuronal
on myelinated axon but not essential for initial cluster
metabolite NAA regulates histone H3 methylation
formation, J. Neurosci., 22, 6507-6514, doi: 10.1523/
in oligodendrocytes and myelin lipid composition,
JNEUROSCI.22-15-06507.2002.
Exp. Brain Res., 235, 279-292, doi: 10.1007/s00221-
120. Yang, L. J., Zeller, C. B., Shaper, N. L., Kiso, M.,
016-4789-z.
Hasegawa, A., Shapiro, R. E., and Schnaar, R. L.
110. Saher, G., Brügger, B., Lappe-Siefke, C., Möbius, W.,
(1996) Gangliosides are neuronal ligands for myelin-
Tozawa, R., Wehr, M. C., Wieland, F., Ishibashi, S.,
associated glycoprotein, Proc. Natl. Acad. Sci. USA,
and Nave, K. A. (2005) High cholesterol level is
93, 814-818, doi: 10.1073/pnas.93.2.814.
essential for myelin membrane growth, Nat. Neurosci.,
121. Vinson, M., Strijbos, P. J., Rowles, A., Facci, L.,
8, 468-475, doi: 10.1038/nn1426.
Moore, S. E., Simmons, D. L., and Walsh, F. S. (2001)
111. Saher, G., and Stumpf, S. K. (2015) Cholesterol in
Myelin-associated glycoprotein interacts with ganglio-
myelin biogenesis and hypomyelinating disorders, Bio-
side GT1b. A mechanism for neurite outgrowth inhi-
chim. Biophys. Acta, 1851, 1083-1094, doi: 10.1016/
bition, J. Biol. Chem., 276, 20280-20285, doi: 10.1074/
j.bbalip.2015.02.010.
jbc.M100345200.
112. Mathews, E. S., Mawdsley, D. J., Walker, M.,
122. Pronker, M., Lemstra, S., Snijder, J., Heck, A. J.,
Hines, J. H., Pozzoli, M., and Appel, B.
(2014)
Thies-Weesie, D. M., Pasterkamp, R. J., and Jans-
Mutation of 3-hydroxy-3-methylglutaryl CoA syn-
sen, B. J. (2016) Structural basis of myelin-associated
thase I reveals requirements for isoprenoid and
glycoprotein adhesion and signalling, Nat. Commun.,
cholesterol synthesis in oligodendrocyte migra-
7, 13584, doi: 10.1038/ncomms13584.
tion arrest, axon wrapping, and myelin gene ex-
123. Kasahara, K., Watanabe, K., Takeuchi, K., Kane-
pression, J. Neurosci., 34, 3402-3412, doi: 10.1523/
ko, H., Oohira, A., Yamamoto, T., and Sanai, Y.
JNEUROSCI.4587-13.2014.
(2000) Involvement of gangliosides in glycosylphos-
113. Camargo, N., Goudriaan, A., van Deijk, A. F.,
phatidylinositol-anchored neuronal cell adhesion mol-
Otte, W. M., Brouwers, J. F., Lodder, H., Gut-
ecule TAG-1 signaling in lipid rafts, J. Biol. Chem.,
mann, D. H., Nave, K. A., Dijkhuizen, R. M., Mans-
275, 34701-34709, doi: 10.1074/jbc.M003163200.
velder, H. D., Chrast, R., Smit, A. B., and Verhei-
124. Loberto, N., Prioni, S., Prinetti, A., Ottico, E.,
jen, M. H. G. (2017) Oligodendroglial myelination
Chigorno, V., Karagogeos, D., and Sonnino, S.
requires astrocyte-derived lipids, PLoS Biol.,
15,
(2003) The adhesion protein TAG-1 has a ganglioside
e1002605, doi: 10.1371/journal.pbio.1002605.
environment in the sphingolipid-enriched membrane
114. Yu, T., and Lieberman, A. P. (2013) Npc1 acting
domains of neuronal cells in culture, J. Neurochem.,
in neurons and glia is essential for the formation
85, 224-233, doi: 10.1046/j.1471-4159.2003.01655.x.
and maintenance of CNS myelin, PLoS Genet., 9,
125. Hammond, T. R., Dufort, C., Dissing-Olesen, L.,
e1003462, doi: 10.1371/journal.pgen.1003462.
Giera, S., Young, A., Wysoker, A., Walker, A. J.,
БИОХИМИЯ том 88 вып. 3 2023
ЛИПИДЫ И НЕЙРОГЛИАЛЬНЫЕ ВЗАИМОДЕЙСТВИЯ
427
Gergits, F., Segel, M., Nemesh, J., Marsh, S. E.,
towski, A. J. (2019) Distinct metabolic patterns during
Saunders, A., Macosko, E., Ginhoux, F., Chen, J.,
microglial remodeling by oleate and palmitate, Biosci.
Franklin, R. J. M., Piao, X., McCarroll, S. A., and
Rep., 39, BSR20190072, doi: 10.1042/BSR20190072.
Stevens, B.
(2019) Single-cell RNA sequencing
133. Bohlen, C. J., Bennett, F. C., Tucker, A. F., Col-
of microglia throughout the mouse lifespan and
lins, H. Y., Mulinyawe, S. B., and Barres, B. A. (2017)
in the injured brain reveals complex cell-state
Diverse requirements for microglial survival, spec-
changes, Immunity,
50,
253-271.e6, doi:
10.1016/
ification, and function revealed by defined-medi-
j.immuni.2018.11.004.
um cultures, Neuron, 94, 759-773.e8, doi: 10.1016/
126. Li, Q., and Barres, B.
(2018) Microglia and
j.neuron.2017.04.043.
macrophages in brain homeostasis and disease, Nat.
134. Kopper, T. J., and Gensel, J. C. (2018) Myelin as
Rev. Immunol., 18, 225-242, doi: 10.1038/nri.2017.125.
an inflammatory mediator: myelin interactions
127. Loving, B. A., and Bruce, K. D. (2020) Lipid and
with complement, macrophages, and microglia in
lipoprotein metabolism in microglia, Front. Physiol.,
spinal cord injury, J. Neurosci. Res., 96, 969-977,
11, 393, doi: 10.3389/fphys.2020.00393.
doi: 10.1002/jnr.24114.
128. Lombardi, M., Parolisi, R., Scaroni, F., Bonfanti, E.,
135. Grajchen, E., Wouters, E., van de Haterd, B., Haidar, M.,
Gualerzi, A., Gabrielli, M., Kerlero de Rosbo, N.,
Hardonnière, K., Dierckx, T., Van Broeckhoven, J.,
Uccelli, A., Giussani, P., Viani, P., Garlanda, C.,
Erens, C., Hendrix, S., Kerdine-Römer, S., Hen-
Abbracchio, M. P., Chaabane, L., Buffo, A.,
driks, J. J. A., and Bogie, J. F. J. (2020) CD36-me-
Fumagalli, M., and Verderio, C. (2019) Detrimental
diated uptake of myelin debris by macrophages and
and protective action of microglial extracellular
microglia reduces neuroinflammation, J. Neuroin-
vesicles on myelin lesions: astrocyte involvement in
flammation, 17, 224, doi: 10.1186/s12974-020-01899-x.
remyelination failure, Acta Neuropathol., 138, 987-
136. Cantuti-Castelvetri, L., Fitzner, D., Bosch-
1012, doi: 10.1007/s00401-019-02049-1.
Queralt, M., Weil, M.-T., Su, M., and Sen, P. (2018)
129. Folick, A., Koliwad, S. K., and Valdearcos, M.
Defective cholesterol clearance limits remyelination
(2021) Microglial lipid biology in the hypothalamic
in the aged central nervous system, Science, 359, 684,
regulation of metabolic homeostasis, Front.
doi: 10.1126/science.aan4183.
Endocrinol. (Lausanne), 12, 668396, doi: 10.3389/
137. Berghoff, S. A., Spieth, L., Sun, T., Hosang, L.,
fendo.2021.668396.
Schlaphoff, L., Depp, C., Düking, T., Winchen-
130. Zhan, Y., Paolicelli, R. C., Sforazzini, F., Weinhard, L.,
bach, J., Neuber, J., Ewers, D., Scholz, P., van der
Bolasco, G., Pagani, F., Vyssotski, A. L., Bifone, A.,
Meer, F., Cantuti-Castelvetri, L., Sasmita, A. O.,
Gozzi, A., Ragozzino, D., and Gross, C. T. (2014)
Meschkat, M., Ruhwedel, T., Möbius, W., San-
Deficient neuron-microglia signaling results in
kowski, R., Prinz, M., Huitinga, I., Sereda, M. W.,
impaired functional brain connectivity and social
Odoardi, F., Ischebeck, T., Simons, M., Stadelmann-
behavior, Nat. Neurosci., 17, 400-406, doi: 10.1038/
Nessler, C., Edgar, J. M., Nave, K. A., and
nn.3641.
Saher, G. (2021) Microglia facilitate repair of de-
131. Chausse, B., Kakimoto, P. A., and Kann, O. (2021)
myelinated lesions via post-squalene sterol synthe-
Microglia and lipids: how metabolism controls brain
sis, Nat. Neurosci., 24, 47-60, doi: 10.1038/s41593-
innate immunity, Semin. Cell Dev. Biol., 112, 137-144,
020-00757-6.
doi: 10.1016/j.semcdb.2020.08.001.
138. Leyrolle, Q., Layé, S., and Nadjar, A.
(2019)
132. Chausse, B., Kakimoto, P. A., Caldeira-da-Silva, C. C.,
Direct and indirect effects of lipids on microglia
Chaves-Filho, A. B., Yoshinaga, M. Y., Yoshina-
function, Neurosci. Lett., 708, 134348, doi: 10.1016/
ga, M. Y., da Silva, R. P., Miyamoto, S., and Kowal-
j.neulet.2019.134348.
THE ROLE OF LIPID IN THE REGULATION
OF NEUROGLIAL INTERACTIONS
Review
O. V. Galkina1*, O. V. Vetrovoy1,2, I. E. Krasovskaya1, and N. D. Eschenko1
1 Biochemistry Department, Faculty of Biology, Saint-Petersburg State University,
199034 St. Petersburg, Russia; e-mail: o.v.galkina@spbu.ru
2 Pavlov Institute of Physiology, Russian Academy of Sciences, 199034 St. Petersburg, Russia
БИОХИМИЯ том 88 вып. 3 2023
428
ГАЛКИНА и др.
Lipids are an extremely heterogeneous group of compounds, resulting in a wide variety of biological func-
tions they perform. The traditional view of lipids as important structural components of the cell and com-
pounds playing a trophic role is currently being supplemented by information on the possible participation
of lipids in signaling, not only intracellular, but also intercellular. The review article discusses current data
on the role of lipids and their metabolites formed in glial cells (astrocytes, oligodendrocytes, microglia) in
the communication of these cells with neurons. In addition to the metabolic transformations of lipids in
each type of glial cells, special attention is paid to the lipid signal molecules (phosphatidic acid, arachidonic
acid and its metabolites, cholesterol, etc.) and the possibility of their participation in the implementation of
the synaptic plasticity, as well as in other possible mechanisms associated with the realization of the neu-
roplasticity. The generalization of these new data can significantly expand knowledge about the regulatory
functions of lipids in neuroglial relationships.
Keywords: central nervous system, brain, synaptic plasticity, neurons, astrocytes, oligodendrocytes, microglia,
neuronal-glial interactions, lipids, lipid metabolism
БИОХИМИЯ том 88 вып. 3 2023