БИОХИМИЯ, 2023, том 88, вып. 3, с. 443 - 454
УДК 612.816.2-7
СИМПАТИЧЕСКАЯ ИННЕРВАЦИЯ И ЭНДОГЕННЫЕ
КАТЕХОЛАМИНЫ В НЕРВНО-МЫШЕЧНЫХ ПРЕПАРАТАХ
МЫШЦ РАЗНОГО ФУНКЦИОНАЛЬНОГО ПРОФИЛЯ
© 2023 С.А. Дмитриева1, С.Г. Вологин2, А.Н. Ценцевицкий1, А.Ю. Архипов1,
В.Ф. Хузахметова1, Г.В. Сибгатуллина1, Э.А. Бухараева1*
1 Казанский институт биохимии и биофизики, ФИЦ КазНЦ РАН,
420111 Казань, Россия; электронная почта: elbukhara@gmail.com
2 Татарский научно-исследовательский институт сельского хозяйства, ФИЦ КазНЦ РАН,
420059 Казань, Россия
Поступила в редакцию 18.10.2022
После доработки 29.11.2022
Принята к публикации 29.11.2022
Влияние симпатической нервной системы на работу сократительного аппарата скелетной муску-
латуры в настоящее время не вызывает сомнений. Однако до недавнего времени не было дока-
зательств того, что окончания симпатических нервов могут располагаться в непосредственной
близости к нервно-мышечному синапсу. Также нет достоверных данных о том, какое количество
эндогенных адреналина и норадреналина может содержаться вблизи синаптического контакта
в скелетных мышцах. В настоящем исследовании на изолированных нервно-мышечных препа-
ратах трёх скелетных мышц разного функционального профиля, содержащих мышечные волокна
разных типов, с помощью флуоресцентного анализа, иммуногистохимического метода и иммуно-
ферментного анализа показан близкий контакт между симпатическими и моторными холинерги-
ческими нервными окончаниями и наличие в этой области тирозингидроксилазы - фермента,
участвующего в синтезе катехоламинов. Определены концентрации эндогенных адреналина и нор-
адреналина в растворе, перфузирующем нервно-мышечный препарат, при разных режимах его
функционирования. Сопоставлены эффекты блокаторов α- и β-адренорецепторов, оказываемые
на процессы квантовой секреции ацетилхолина из двигательных нервных окончаний. Получен-
ные данные представляют доказательства наличия эндогенных катехоламинов в области нервно-
мышечного синапса и их роли в модуляции синаптической функции.
КЛЮЧЕВЫЕ СЛОВА: нервно-мышечное соединение, симпатическая иннервация, тирозингидроксилаза,
эндогенные катехоламины, блокаторы адренорецепторов.
DOI: 10.31857/S0320972523030065, EDN: QWOOGC
ВВЕДЕНИЕ
ных волокон [6, 7]. Относительно недавно с
помощью современных методов иммунофлуо-
Почти 100 лет назад было открыто, что
ресцентной микроскопии и маркеров тиро-
адреналин (АД) может усиливать сокращения
зингидроксилазы, фермента, участвующего в
скелетной мускулатуры [1, 2]. Последующие
синтезе катехоламинов, было показано, что в
многочисленные исследования показали, что
некоторых препаратах скелетных мышц, таких
при возрастании сократительной активности
как диафрагмальная мышца и длинный раз-
мышцы, а также при стрессовых ситуациях в
гибатель пальца, варикозы симпатических нер-
плазме крови человека и животных повыша-
вов находятся в непосредственной близости
ется уровень эндогенных катехоламинов: АД
от нервно-мышечного контакта [8, 9]. Много-
и норадреналина (НА) [3-5]. Увеличение со-
численные данные свидетельствуют о влия-
кратительной способности скелетной муску-
нии экзогенных активаторов адренорецепто-
латуры связывали с воздействием эндогенных
ров (АДР) на нервно-мышечные соединения в
катехоламинов на свойства мембраны мышеч- скелетных мышцах [8, 10-14]. Тесный контакт
Принятые сокращения: АД - адреналин; АДР - адренорецепторы; НА - норадреналин; НМП - нервно-мышечный
препарат; m. LAL - мышца levator auris longus; m. SOL - мышца soleus, m. DIA - диафрагма.
* Адресат для корреспонденции.
443
444
ДМИТРИЕВА и др.
между тирозингидроксилазой, ферментом, уча-
и 12 ч темноты; вода и еда были предостав-
ствующим в синтезе НА [15], АДР и холин-
лены в свободном доступе. Все эксперимен-
ергическим нервно-мышечным синапсом в
ты проводились согласно протоколу ухода за
передней большеберцовой мышце, камбало-
животными и требованиям Директивы Со-
видной мышце и поднимателе уха свидетель-
вета Европейского сообщества 86/609/ЕЕС,
ствует о возможности участия эндогенных
а также были одобрены локальным этическим
катехоламинов в регуляции синаптических
комитетом Казанского медицинского универ-
функций [8, 9]. Ранее с помощью вестерн-
ситета (протокол № 10 от 20 декабря 2016 г.).
блота мы показали, что в нервно-мышечных
После декапитации выделяли НМП из ске-
препаратах (НМП) диафрагмы мыши присут-
летных мышц разного функционального про-
ствуют АДР подтипов α1A, α1B, α2A, α2B, α2C
филя, содержащих мышечные волокна разного
и β1 [16, 17]. Активация разных подтипов АДР
типа - «быстрого» (m. levator auris longus -
с помощью соответствующих специфических
n. facialis, m. LAL), «медленного» (m. soleus -
агонистов приводила к различным измене-
n. tibialis, m. SOL) и смешанного (m. diaphrag-
ниям работы синаптического аппарата в си-
ma - n. phrenicus, m. DIA). После выделения
напсах мышц разного функционального про-
НМП несколько раз тщательно отмывали
филя, содержащих мышечные волокна разных
от крови и помещали в экспериментальную
типов. Так, в НМП диафрагмы, которая со-
ванночку объёмом 3 мл, содержащую рас-
держит мышечные волокна как «быстрого»,
твор Рингера для теплокровных животных
так и «медленного» типа, активация α2-АДР
следующего состава: 150 мМ NaCl; 5 мМ KCl;
приводила к снижению интенсивности кван-
2 мМ CaCl2; 1 мМ MgCl2; 11 мМ глюкозы;
товой секреции и повышению степени не-
5 мМ HEPES; pH 7,2-7,4. Все эксперимен-
синхронности выделения квантов ацетилхоли-
ты проводили при комнатной температуре
на [16, 17]. В НМП мышцы levator auris longus
(+21 ± 2 °С).
(m. LAL), относящейся к «быстрому» типу,
Локализация симпатических нервов с помо-
агонист β2-АДР вызывал повышение количе-
щью флуоресцентного маркера. Для визуали-
ства освобождаемых квантов нейромедиатора
зации симпатических нервов использовали
и гиперполяризацию мембраны мышечного
флуоресцентный краситель FFN511 («Abcam»,
волокна [18], в НМП «медленной» мышцы
Великобритания), который является ложным
soleus (m. SOL) АД вызывал повышение уров-
нейромедиатором, не опосредующим физио-
ня квантовой секреции и степени синхрон-
логические эффекты и загружающимся в си-
ности выделения квантов [19]. Эти данные, а
наптические везикулы [25]. Для визуализации
также результаты других исследований [20-24]
холинергического нервно-мышечного синап-
свидетельствуют о том, что изменение актив-
са использовали краситель FM1-43 (7 мкМ,
ности АДР оказывает модулирующее влияние
«Thermo Fisher Scientific», Финляндия), ко-
на работу синаптического аппарата. В связи
торый обратимо связывается с пресинап-
с этим возникает вопрос: может ли в области
тической мембраной и затем захватывается
синаптического контакта находиться какое-то
посредством эндоцитоза в синаптическую ве-
количество эндогенных катехоламинов, кото-
зикулу, маркируя её [26, 27]. Загрузку краси-
рые могут выделяться из окончаний симпати-
теля FM1-43 в НМП производили стимуля-
ческих нервов и изменять функции НМП? По-
цией с частотой 20 Гц в течение 4 мин. После
этому целью настоящего исследования явилось
отмывки красителя НМП инкубировали с
установление пространственного расположе-
флуоресцентным ложным нейромедиатором
ния симпатических нервов и холинергических
FFN511 (10 мкМ) при стимуляции с частотой
окончаний двигательного нерва, выявление
2 Гц в течение 15 мин, а затем отмывали пре-
фермента тирозингидроксилазы в области си-
парат бескальциевым раствором в течение
наптического контакта и определение концен-
30 мин для удаления красителя с поверхности
траций АД и НА в растворе, омывающем НМП
НМП. Флуоресценцию FFN511 детектировали
мышц разного функционального профиля.
при возбуждении УФ и эмиссионном филь-
тре 450-510 нм; для FM1-43, соответственно,
при 480-535 нм. Для фиксирования и ана-
МАТЕРИАЛЫ И МЕТОДЫ
лиза изображений использовали микроскоп
BX51WI
(«Olympus», Япония), оснащённый
НМП, растворы. Исследования проводили
вращающимся диском, осветителем CoolLED
на изолированных НМП лабораторных мышей
pE-300white («CoolLED Ltd.», Великобрита-
линии balb/c (20-23 г, возраст 2-3 мес.) обоих
ния) и sCMOS-камерой Dhyana 400BSI V2
полов, содержавшихся в условиях 12 ч света
(«Tucsen», Китай) под управлением программ-
БИОХИМИЯ том 88 вып. 3 2023
ЭНДОГЕННЫЕ КАТЕХОЛАМИНЫ В НЕРВНО-МЫШЕЧНОМ СИНАПСЕ
445
ного обеспечения Mosaic («Tucsen»). Область
в физиологических условиях [30]. Для НМП
интереса ROI (region of interest) визуализи-
«медленной» m. SOL частота стимуляции была
ровали с помощью объектива UPLANSapo
20 Гц, для НМП «быстрой» m. LAL - 70 Гц,
60× («Olympus») и двухканального обходного
для НМП «смешанной» m. DIA - 50 Гц. Об-
разделителя изображения Optosplit II («Cairn
разцы раствора объёмом 1 мл забирали из экс-
Research», Великобритания). Для анализа изо-
периментальной ванночки, в которой нахо-
бражений использовали программу ImagePro
дился НМП, затем немедленно фиксировали в
(«Media Cybernetics», США) [28].
жидком азоте в пробирках, содержащих 5 мМ
Иммуногистохимическое окрашивание тиро-
ЭДТА в качестве консерванта, и хранили при
зингидроксилазы в НМП. НМП фиксировали
температуре -80 °С до анализа содержания
30 мин в 4%-ном (m/v) параформальдегиде
катехоламинов. Количество АД и НА опреде-
(«Sigma», США), приготовленном на 0,1 М фос-
ляли методом ИФА с помощью коммерческого
фатно-солевом буфере, pH 7,4 (PBS, «Sigma»).
набора CatCombi ELISA («IBL», Германия),
Затем их отмывали PBS в течение 15 мин, три-
который обладает высокой специфичностью
жды меняя раствор, после чего инкубировали
и чувствительностью [31]. Экстракцию и кон-
30 мин в 0,5%-ном (m/v) Triton X-100 («Sigma»).
центрирование катехоламинов из раствора
Для блокирования неспецифических сайтов
осуществляли на боронат-аффинном геле в
связывания антител препараты выдерживали
присутствии буфера для экстракции в тече-
в 5%-ной (v/v) нормальной ослиной сыворот-
ние 30 мин при качании 900 об./мин. В лунки
ке («Abcam») в течение 30 мин при комнатной
планшета, покрытого козьими антикроличь-
температуре. Инкубацию с моноклональны-
ими антителами к одному из эпитопов АД и
ми первичными антителами к тирозингидро-
НА [29], добавляли свежеприготовленный рас-
ксилазе
(1
: 200; «Millipore», США) произ-
твор катехол-о-метилтрансферазы, вносили
водили в течение 15 ч при 4 °С в присутствии
образцы и добавляли растворы кроличьих
1%-ного БСА. После промывки в 0,5%-ном
биотинилированных антител к другому эпи-
Triton X-100 (3 раза по 10 мин) препараты
топу молекул АД или НА, планшет инкуби-
инкубировали со вторичными антителами,
ровали при 600 об./мин в течение 2 ч. В ходе
конъюгированными с Alexa647 («Invitrogen»,
инкубации антиген образца связывается од-
США), в разведении 2 : 200 и после очередной
ним сайтом с антителами, адсорбированными
отмывки инкубировали с маркером ацетил-
на лунках планшета, а вторым - с биотини-
холиновых рецепторов тетраметилродамин-
лированными антителами к другому эпитопу
α-бунгаротоксином («Sigma») в концентрации
антигена. Затем в лунки планшета добавляли
20 мкг/мл 30 мин в темноте при комнатной
раствор свежеприготовленного ферментного
температуре. После завершающей отмывки
конъюгата и инкубировали при комнатной
препараты помещали на предметные стёкла и
температуре при 600 об./мин в течение 1 ч.
заключали в фиксирующий раствор «Surgipath
В качестве ферментного конъюгата был ис-
SubX» («Leica Microsystems CMS GmbH», Гер-
пользован стрептавидин, конъюгированный
мания). Флуоресценцию регистрировали с
с щелочной фосфатазой, который связыва-
помощью конфокального микроскопа Leica
ется с биотинилированными антителами. Все
TCS SP5 («Leica Microsystems CMS GmbH»)
несвязавшиеся компоненты реакций на каж-
при возбуждении аргоновым лазером с дли-
дом этапе экстракции и проведения ИФА уда-
ной волны возбуждения 633 нм и регистра-
ляли из лунок планшета четырёхкратной про-
ции при 653-695 нм для Alexa647 и длиной
мывкой буфером с помощью автоматического
волны возбуждения 514 нм и регистрации при
промывателя иммунологических планшетов
550-590 нм для тетраметилродамин-α-бунга-
HydroFlex («Tecan», Австрия). Затем планшеты
ротоксина. Обрботку полученных изображений
инкубировали при 400 об./мин при комнат-
проводили с помощью лицензионного про-
ной температуре с раствором p-нитрофенил
граммного пакета LASX («Leica Microsystems
фосфата (pNPP), являющимся субстратом
CMS GmbH»).
для щелочной фосфатазы и катализирующим
ИФА содержания катехоламинов. Для опре-
превращение бесцветного pNPP в жёлтый па-
деления концентрации эндогенных АД и НА в
ра-нитрофенол. Через 40 мин реакцию оста-
НМП скелетных мышц c помощью ИФА [29]
навливали с помощью стоп-раствора, содер-
использовали образцы физиологического рас-
жащего 1 M NaOH. Оптическую плотность
твора, в котором находились НМП в контроле
растворов в лунках определяли при длине вол-
(30 мин), а также после стимуляции двига-
ны 405 нм с помощью многоканального фото-
тельного нерва в течение 10 мин с частотой,
метра Multiscan FC («Thermo Fisher Scientific»).
характерной для работы данного типа мышцы
Концентрацию катехоламинов рассчитывали
БИОХИМИЯ том 88 вып. 3 2023
446
ДМИТРИЕВА и др.
после измерения веса мышцы и нормирования
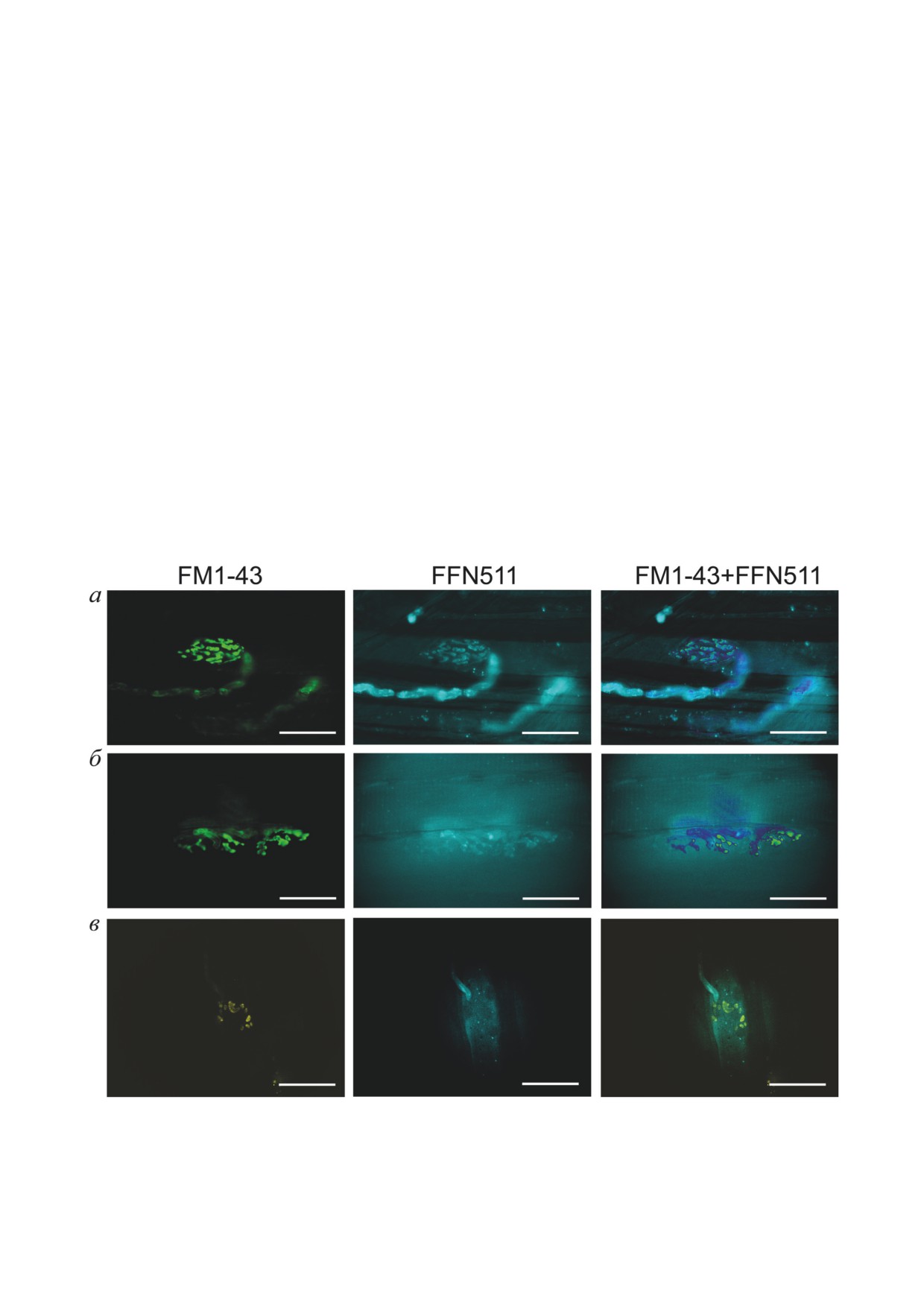
НМП, флуоресцентного красителя FM1-43
на эту величину по калибровочной кривой, ко-
после кратковременной стимуляции двига-
торую строили на основании прилагаемых гото-
тельного нерва приводило к загрузке красите-
вых стандартов. Каждый образец анализировали
ля в двигательное нервное окончание, т.к. кра-
в двух аналитических повторностях.
ситель взаимодействовал с пресинаптической
Статистический анализ. Данные представ-
мембраной и в ходе стимуляции посредством
лены в виде средних значений ± среднеква-
эндоцитоза проникал в синаптические вези-
дратичное отклонение. Статистическую зна-
кулы, окрашивая их (рис. 1, а).
чимость различий оценивали при помощи
Добавление в раствор флуоресцентного
непараметрического критерия Манна-Уитни
красителя FFN511, который является ложным
(критерий числа инверсий). Различия прини-
нейромедиатором и взаимодействует с везику-
мали значимыми при p < 0,05; количество экс-
лярным переносчиком моноаминов, привело
периментальных животных - n ≥ 3.
к окрашиванию синаптических везикул в сим-
патических нервах (рис. 1, средний столбец).
Полученные в ходе наложения изображения
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
(рис. 1, правый столбец) отчётливо показали
наличие тесного контакта холинергических
Доказательства наличия симпатической ин-
нервных окончаний двигательного нерва, ви-
нервации нервно-мышечного соединения в мыш-
зуализированных FM1-43, и симпатических
цах разного функционального профиля. Добав-
нервов, где краситель FFN511 локализован не
ление в экспериментальную камеру с физио-
только в области синаптического контакта, но
логическим раствором, в которой находился
и по ходу двигательного нерва.
Рис. 1. Окрашивание НМП с помощью флуоресцентного красителя FM1-43, загружающегося в синаптические вези-
кулы холинергического нервного окончания (левый столбец); флуоресцентного ложного нейромедиатора FFN511,
визуализирующего симпатические варикозы (средний столбец); оценка расположения флуоресцентных сигналов отно-
сительно друг друга при совмещении каналов красителей (правый столбец) в НМП разных типов мышц: а - m. LAL,
б - m. SOL, в - m. DIA. Масштаб - 20 мкм
БИОХИМИЯ том 88 вып. 3 2023
ЭНДОГЕННЫЕ КАТЕХОЛАМИНЫ В НЕРВНО-МЫШЕЧНОМ СИНАПСЕ
447
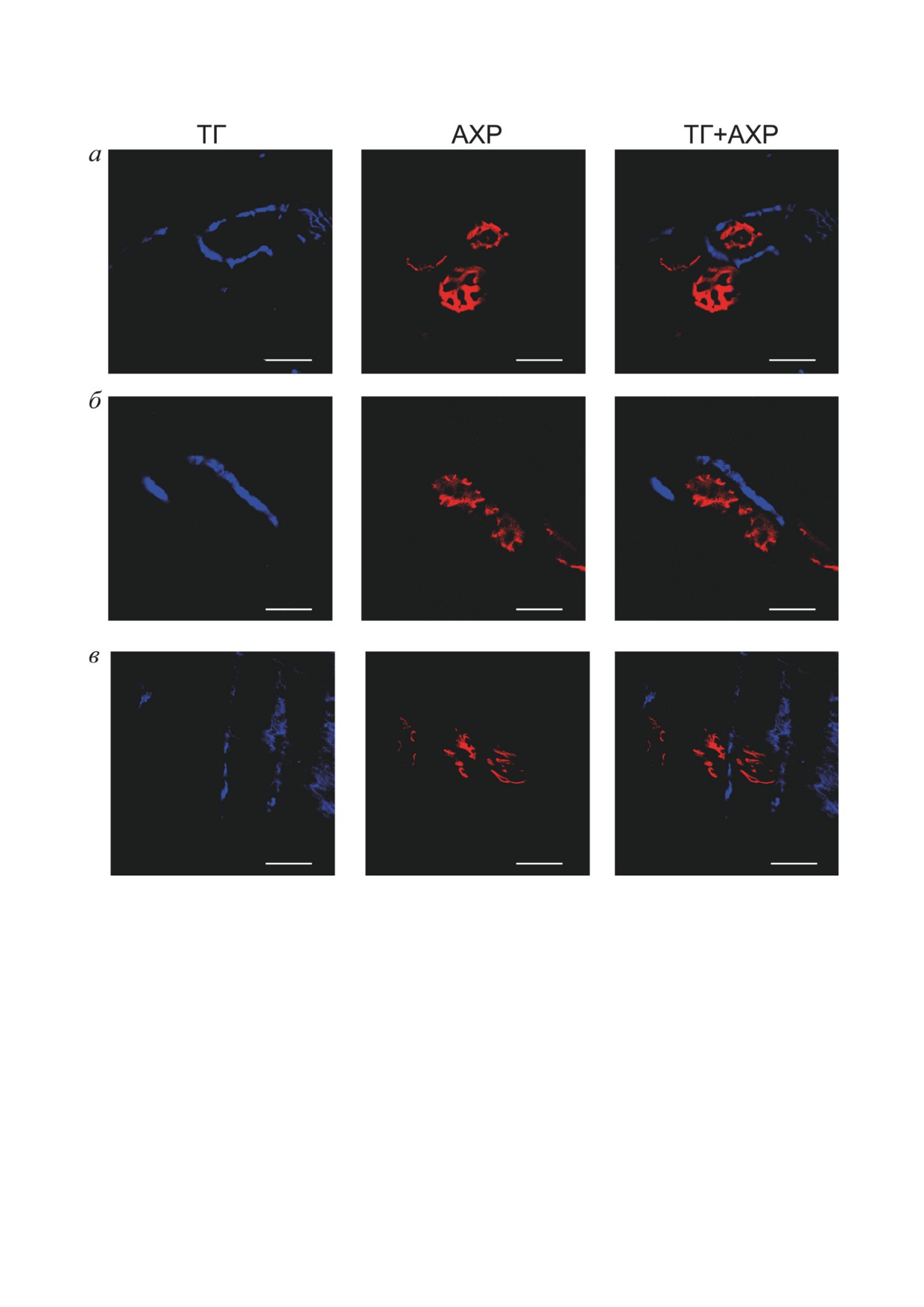
Рис. 2. Идентификация тирозингидроксилазы (ТГ) на гистологических срезах мышц мышей: а - m. LAL, б - m. SOL,
в - m. DIA. Конфокальная микроскопия, масштаб - 20 мкм. Препараты окрашивали специфическими антителами
к тирозингидроксилазе (ТГ, левый столбец), области синапсов визуализировали с помощью маркера ацетилхолино-
вых рецепторов (АХР, средний столбец), расположение флуоресцентных сигналов относительно друг друга оценивали
при совмещении каналов красителей (правый столбец)
Локализация фермента синтеза катехолами-
гаротоксина, специфического агента для ви-
нов, тирозингидроксилазы, вблизи нервно-мышеч-
зуализации постсинаптических ацетилхолино-
ного синапса. Тирозингидроксилаза является
вых рецепторов в НМП, показало, что в непо-
ключевым ферментом биосинтеза катехолами-
средственной близости к нервно-мышечному
нов [15, 32]. Поэтому до решения вопроса об
синапсу в препаратах всех трёх типов мышц
определении эндогенных катехоламинов в об-
наблюдается окрашивание антителами к тиро-
ласти НМП был проведён иммуногистохими-
зингидроксилазе (рис. 2). Это наблюдение по-
ческий анализ для определения данного фер-
зволяет заключить, что в области синаптиче-
мента в области синаптического контакта.
ского контакта может содержаться эндогенный
Использование специфических антител к ти-
НА и/или АД, поскольку показано наличие
розингидроксилазе и флуоресцентного α-бун-
фермента, участвующего в их синтезе.
БИОХИМИЯ том 88 вып. 3 2023
448
ДМИТРИЕВА и др.
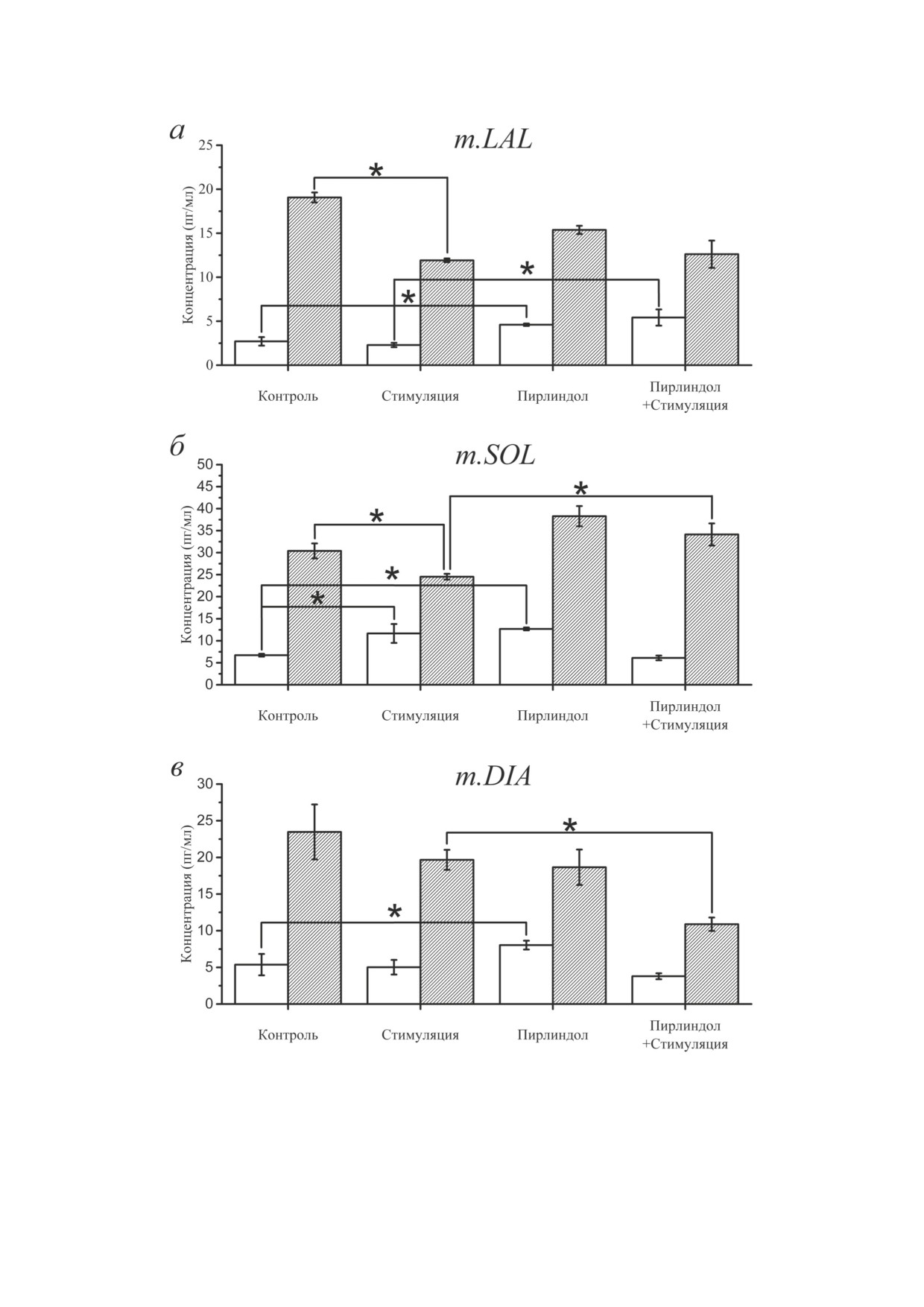
Рис. 3. Соотношение концентраций АД (белые столбцы) и НА (штрихованные столбцы) в образцах перфузионного
раствора для трёх мышц и в разных условиях: а - m. LAL, контроль (30 мин); после стимуляции (10 мин) с частотой
70 Гц; после добавления пирлиндола; после стимуляции в присутствии пирлиндола; б - m. SOL, контроль (30 мин);
после стимуляции (10 мин) с частотой 20 Гц; после добавления пирлиндола; после стимуляции в присутствии пирлин-
дола; в - m. DIA, контроль (30 мин); после стимуляции (10 мин) с частотой 50 Гц; после добавления пирлиндола; после
стимуляции в присутствии пирлиндола. Представлены средние значения ± среднеквадратичное отклонение (n = 6).
По оси ординат - концентрация катехоламинов в пг/мл. Во всех сериях концентрации НА достоверно выше, чем кон-
центрации АД (р < 0,05). Различия считали статистически значимыми на уровне 0,05
БИОХИМИЯ том 88 вып. 3 2023
ЭНДОГЕННЫЕ КАТЕХОЛАМИНЫ В НЕРВНО-МЫШЕЧНОМ СИНАПСЕ
449
Иммуноферментное определение концентра-
данные свидетельствуют о наличии в раство-
ции АД и НА в растворе, омывающем НМП, при
ре, омывающем НМП всех трёх типов мышц,
разных режимах его активности. Для определе-
эндогенных АД и НА, концентрация которых
ния концентраций эндогенных АД и НА в
может меняться в зависимости от ритмической
растворе, омывающем НМП, образцы пер-
активности.
фузионного раствора в объёме 1 мл отбирали
из экспериментальной камеры, в которой в
состоянии покоя НМП находился в течение
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
30 мин. Другой НМП после 30 мин нахождения
в контрольных условиях стимулировали, раз-
Существует два основных пула катехолами-
дражая двигательный нерв в течение 10 мин с
нов в периферической нервной системе, управ-
частотой, характерной для данного типа мыш-
ляющей мышечными сокращениями. Это,
цы [30]. В третьем наборе образцов в раствор
во-первых, функциональный пул, представ-
до стимуляции добавляли 50 мкМ пирлиндо-
ленный катехоламинами, которые освобожда-
ла - ингибитора моноаминоксидазы (МАО),
ются из мозгового вещества надпочечников, и
которая обеспечивает деградацию катехолами-
НА из окончаний симпатических нервов [34].
нов [33]. После сбора образцов и проведения
Второй - тканевый пул, находящийся в ком-
ИФА с учётом нормирования на массу НМП
партментах синтеза и хранения в соме и аксо-
были определены концентрации АД и НА. По-
нах симпатических нейронов. В настоящем
лученные данные представлены на рис. 3.
исследовании мы впервые показали, что сим-
Оказалось, что в состоянии покоя для всех
патические нервы, в которых везикулы в сим-
трёх типов мышц содержание НА в несколько
патических нервных окончаниях загружены
раз (от 4 до 7) превышало концентрацию АД.
ложным нейромедиатором FFN511, и нервно-
Диапазон концентраций АД составил от 2,7 ±
мышечные синапсы, в которых двигательные
± 0,5 пг/мл в m. LAL до 6,7 ± 0,3 пг/мл в m. SOL,
нервные окончания загружены специфическим
тогда как концентрации НА составили от 19,1 ±
красителем FM1-43, находятся в непосред-
± 0,6 пг/мл (m. LAL) до 30 ± 1,7 пг/мл (m. SOL)
ственной близости в НМП трёх исследованных
(рис. 3, а, б). Наиболее высокие концентрации
скелетных мышц разного функционального
АД и НА были обнаружены в НМП мышцы
профиля: «быстрой» мышцы поднимателя уха,
«медленного» типа, наименьшие - в «быстрой»,
m. LAL, «медленной» постуральной мышцы,
а для m. DIA «смешанного» типа наблюдались
m. SOL, и «смешанной» дыхательной мышцы
промежуточные значения.
диафрагмы, m. DIA. Фермент, участвующий в
При стимуляции двигательного нерва с ча-
синтезе катехоламинов - тирозингидроксилаза -
стотой, характерной для каждого типа мышц,
также был выявлен в области синаптического
достоверное увеличение содержания АД на
контакта в синапсах всех трёх типов мышц.
74,6 ± 10,7% (n = 6, p < 0,001) наблюдалось для
Полученные нами данные о тесной колокали-
НМП «медленной» m. SOL, при этом уровень
зации тирозингидроксилазы с областью синап-
НА снижался на 45,9 ± 12,6% (n = 6, p < 0,01)
тического контакта в целом НМП согласуются
(рис. 3, б). В НМП двух других мышц сред-
с результатами работы Straka et al. 2018 г. [9],
ние значения концентраций АД и НА досто-
показавшими близкое расположение фермента
верно не изменялись, поскольку были получе-
синтеза катехоламинов и синапса на выделен-
ны разнонаправленные изменения содержания
ных мышечных волокнах.
эндогенных катехоламинов в разных образцах.
Наличие ферментов, участвующих в син-
После добавления пирлиндола - ингибитора
тезе катехоламинов вблизи нервных оконча-
МАО [33] - концентрация АД увеличилась в
ний, дало основания для попытки определить
НМП всех трёх типов мышц, тогда как повы-
концентрации эндогенных АД и НА в рас-
шение НА наблюдалось только в «медленной»
творе, омывающем НМП в условиях покоя и
m. SOL (рис. 3, б). После стимуляции двига-
после стимуляции двигательного нерва с ча-
тельного нерва и добавления пирлиндола дос-
стотами, характерными для физиологического
товерно увеличилась концентрация АД на
режима активности мышц данного профиля.
36,2 ± 9,3% (n = 6, p < 0,05) в «быстрой» m. LAL.
Результаты показали, что в НМП всех трёх
В стимулированной «медленной» m. SOL на
типов мышц содержание НА многократно пре-
39,2 ± 10,0% (n = 6, p < 0,05) выросло содержа-
вышало концентрацию АД. Источниками эн-
ние НА в присутствии пирлиндола (для сравне-
догенных катехоламинов, как известно, явля-
ния рис. 3, а и б), тогда как в образцах m. DIA
ются мозговое вещество надпочечников для
концентрации АД и НА после стимуляции на
АД и окончания симпатических нервов для НА
фоне пирлиндола снижались. Полученные
[35, 36]. Поэтому неудивительно, что результаты
7
БИОХИМИЯ том 88 вып. 3 2023
450
ДМИТРИЕВА и др.
показывают более чем
4-кратное превыше-
не наблюдалось. В НМП двух других мышц
ние концентрации НА по сравнению с коли-
не было обнаружено достоверных изменений
чеством АД, т.к. установлено наличие тесного
содержания АД и НА после стимуляции нерва,
контакта окончаний симпатических нервов, из
поскольку имели место разнонаправленные
которых высвобождается НА, в непосредствен-
изменения концентраций АД и НА. Одним из
ной близости к нервно-мышечным синапсам.
возможных вариантов объяснения такого яв-
Полученные с помощью метода ИФА значе-
ления может быть предположение об усилении
ния концентраций АД и НА в диапазоне от
при стимуляции активности системы, которая
2 пг/мл до 30 пг/мл по порядку величин совпа-
участвует в деградации катехоламинов и обес-
дают со значениями, определяемыми в плазме
печении их низкой концентрации. Она пред-
крови другими методами - радиоэнзимати-
ставлена ферментами МАО, локализованной в
ческим методом, а также с помощью ВЭЖХ.
митохондриях, и катехол-О-метилтрансфера-
Концентрация АД, полученная этими мето-
зой, находящейся в симпатических нейронах
дами, составляла
5-19 пг/мл, концентра-
и синаптической щели [40, 41]. Для того чтобы
ция НА - 10-34 пг/мл [37, 38]. Анализ содер-
проверить эту гипотезу, было проведено изме-
жания НА в образцах, взятых из трёхглавой
рение концентраций АД и НА после добав-
мышцы голени крысы с помощью микродиа-
ления обратимого ингибитора МАО пирлин-
лизного зонда, вставленного между мышеч-
дола. Ожидаемое увеличение концентрации АД
ными волокнами, показал концентрацию НА
в 2,3 раза наблюдалось в НМП «быстрой»
2,12 ± 0,06 нМ, что соответствует 0,7 нг/мл [38].
m. LAL и концентрации НА на 39% в «медлен-
Очевидно, что различия в наблюдаемых значе-
ной» m. SOL. Интересно, что концентрация
ниях концентраций могут быть обусловлены
НА во внеклеточной жидкости гиппокампа в
множеством разных факторов, таких как харак-
состоянии покоя составляла приблизительно
теристики животных (возраст, пол, физическая
14 нМ, при этом добавление блокатора обрат-
активность) и экспериментальные условия, в
ного захвата дезипрамина так же, как и в НМП
которых проводились измерения.
диафрагмы, не оказывало существенного влия-
Учитывая, что эффекты катехоламинов
ния на содержание НА [42]. Эти наблюдения
вследствие представительства разных подтипов
подчёркивают тот факт, что, по-видимому,
АДР могут существенно различаться в мыш-
может существовать несколько регуляторных
цах, содержащих разные типы мышечных во-
механизмов, которые влияют на уровень кате-
локон [39], для анализа были выбраны НМП
холаминов во внеклеточной жидкости.
трёх разных скелетных мышц мыши, которые
Эффекты блокаторов АДР на функции НМП.
отличаются как составом мышечных волокон,
Если эндогенные АД и НА находятся в непо-
так и функциями, которые они выполняют.
средственной близости к синаптическому
Мышца-подниматель уха, m. LAL, состоящая
контакту, а активация АДР разных подтипов
преимущественно из
«быстрых» мышечных
изменяет его функции, то блокирование этих
волокон (тип II), служит для быстрых изме-
рецепторов также должно приводить к изме-
нений положения уха грызуна, для которого
нению работы синапса. Действительно, ра-
тонкое восприятие слуховых сигналов являет-
нее нами было показано, что блокирование
ся жизненно важным. «Медленная» камбало-
α2-АДР с помощью SKF 86466 и β2-АДР с
видная мышца, m. SOL, с типом I мышечных
помощью ICI 118,551 уменьшало спонтанное
волокон необходима для обеспечения позы.
высвобождение ацетилхолина в НМП диа-
Диафрагмальная мышца, m. DIA, участвую-
фрагмы [17]. Действие антагониста α2-АДР
щая в процессе дыхания, содержит оба типа
йохимбина приводило к снижению кванто-
волокон и относится к мышцам «смешанно-
вого состава ПКП и возрастанию несинхрон-
го» типа. Согласно результатам проведённого
ности выделения квантов нейромедиатора.
анализа, наиболее высокие концентрации как
Блокада β1-АДР атенололом вызывала, напро-
АД, так и НА зафиксированы в НМП мышцы
тив, синхронизацию секреторного процесса.
m. SOL. Как видно из рис. 1, б, в синапсе этой
Ранее Lim и Muir (1983) также показали, что
мышцы флуоресцентный краситель, загру-
в нервно-мышечных синапсах диафрагмы
жаемый в везикулы окончания симпатиче-
крыс йохимбин вызывал снижение квантовой
ского нерва, находится практически непосред-
секреции ацетилхолина [43]. В синапсах «бы-
ственно вблизи холинергического нервного
строй» m. LAL блокада β2-АДР с помощью ICI
окончания. Стимуляция двигательного нерва с
118,551 вызывала гиперполяризацию мембра-
частотой, характерной для данного типа мыш-
ны мышечного волокна [18]. Все эти данные
цы (20 Гц), привела к повышению содержа-
указывают на присутствие эндогенных кате-
ния АД на 73%, увеличения концентрации НА
холаминов в синаптической щели и их участие
БИОХИМИЯ том 88 вып. 3 2023
ЭНДОГЕННЫЕ КАТЕХОЛАМИНЫ В НЕРВНО-МЫШЕЧНОМ СИНАПСЕ
451
в модуляции работы НМП. Исследования, в
ными синапсами скелетной мускулатуры и
которых иммунофлуоресценция, конфокаль-
участвуют в регуляции работы синаптического
ная микроскопия и вестерн-блоттинг про-
контакта, выделяя эндогенные катехоламины,
демонстрировали близость окончаний сим-
которые влияют на высвобождение нейроме-
патических нейронов к нервно-мышечным
диатора ацетилхолина и, таким образом, могут
синапсам в диафрагме, длинном разгибателе
изменять сократительную функцию скелетной
пальца, передней большеберцовой и камбало-
мускулатуры.
видной мышцах, подтвердили наличие такого
контакта [8, 9, 44]. Кроме того, последствия
Вклад авторов. Э.А. Бухараева - концеп-
симпатэктомии вызывали значительное сни-
ция и руководство работой, написание тек-
жение силы непрямого мышечного сокра-
ста; С.А. Дмитриева, С.Г. Вологин - ИФА;
щения [24] и уменьшение квантового высво-
А.Н. Ценцевицкий, А.Ю. Архипов, В.Ф. Хуз-
бождения ацетилхолина
[43], демонстрируя
ахметова - набор экспериментальных НМП;
высокую вероятность влияния эндогенных
Г.В. Сибгатуллина - иммуногистохимический
катехоламинов на синаптическую передачу в
анализ.
НМП. В подтверждение важной функциональ-
Финансирование. Работа выполнена при
ной роли эндогенных катехоламинов было
финансовой поддержке Российского научного
показано, что прямая стимуляция симпати-
фонда (грант № 18-15-0046). Иммунофермент-
ческих нейронов усиливала нервно-мышеч-
ный анализ, пробоподготовка и анализ данных
ную передачу у молодых мышей посредством
выполнены Дмитриевой С.А. и Вологиным С.Г.
высвобождения катехоламинов из симпатиче-
при поддержке госзаданием ФИЦ КазНЦ РАН.
ских аксонов, которые действуют на β-АДР,
Благодарности. Авторы благодарят д.б.н.
экспрессирующиеся в мотонейронах [9, 44].
Петрова А.М. за критическое рассмотрение
Эффекты симпатэктомии, оказываемые на
рукописи и полезные рекомендации.
нервно-мышечную передачу, включают дез-
Конфликт интересов. Авторы не имеют
организацию цитоскелета в аксонах двига-
конфликта интересов.
тельных нейронов, дефекты миелинизации,
Соблюдение этических норм. Все процеду-
уменьшение диаметра аксона и уменьшение
ры, выполненные в исследованиях с участием
площади поперечного сечения мышц
[24].
животных, соответствовали этическим стан-
В целом можно сделать вывод, что элементы
дартам учреждения, в котором проводились
симпатической нервной системы находятся в
исследования, и утверждённым правовым
непосредственном контакте с нервно-мышеч-
актам РФ и международных организаций.
СПИСОК ЛИТЕРАТУРЫ
1. Corkill, A. B., and Tiegs, O. W. (1933) The effect
6. Zouhal, H., Jacob, C., Delamarche, P., and Gratas-
of sympathetic nerve stimulation on the power of
Delamarche, A.
(2008) Catecholamines and the
contraction of skeletal muscle, J. Physiol., 78, 161-185,
effects of exercise, training and gender, Sports Med.,
doi: 10.1113/jphysiol.1933.sp002995.
38,
401-423, doi:
10.2165/00007256-200838050-
2. Brown, G. L., Bülbring, E., and Burns, B. D. (1948)
00004.
The action of adrenaline on mammalian skeletal
7. Andersson, D. C., Betzenhauser, M. J., Reiken, S.,
muscle, J. Physiol.,
107,
115-128, doi:
10.1113/
Umanskaya, A., Shiomi, T., and Marks, A. R. (2012)
jphysiol.1948.sp004255.
Stress-induced increase in skeletal muscle force
3. Steiner, J. L., Johnson, B. R., Hickner, R. C., Ormsbee,
requires protein kinase A phosphorylation of the
M. J., Williamson, D. L., and Gordon, B. S. (2021)
ryanodine receptor, J. Physiol., 590, 6381-6387, doi:
Adrenal stress hormone action in skeletal muscle during
10.1113/jphysiol.2012.237925.
exercise training: An old dog with new tricks? Acta
8. Khan, M. M., Lustrino, D., Silveira, W. A., Wild, F.,
Physiol. (Oxf), 231, e13522, doi: 10.1111/apha.13522.
Straka, T., Issop, Y., O’Connor, E., Cox, D.,
4. Kvetnansky, R., Lu, X., and Ziegler, M. G.
Reischl, M., Marquardt, T., Labeit, D., Labeit, S.,
(2013)
Stress-triggered changes in peripheral
Benoit, E., Molgó, J., Lochmüller, H., Witzemann, V.,
catecholaminergic systems, Adv. Pharmacol., 68, 359-
Kettelhut, I. C., Navegantes, L. C., Pozzan, T., and
397, doi: 10.1016/B978-0-12-411512-5.00017-8.
Rudolf, R. (2016) Sympathetic innervation controls
5. Tank, A. W., and Lee Wong, D. (2015) Peripheral and
homeostasis of neuromuscular junctions in health and
central effects of circulating catecholamines, Compr.
disease, Proc. Natl. Acad. Sci. USA, 113, 746-750, doi:
Physiol., 5, 1-15, doi: 10.1002/cphy.c140007.
10.1073/pnas.1524272113.
БИОХИМИЯ том 88 вып. 3 2023
7*
452
ДМИТРИЕВА и др.
9.
Straka, T., Vita, V., Prokshi, K., Hörner, S. J., Khan,
Schmiedebergs. Arch. Pharmacol., 338, 133-137, doi:
M. M., Pirazzini, M., Williams, M. P. I., Hafner, M.,
10.1007/bf00174860.
Zaglia, T., and Rudolf, R. (2018) Postnatal devel-
20.
Bukcharaeva, E. A., Kim, K. C., Moravec, J.,
opment and distribution of sympathetic innervation
Nikolsky, E. E., and Vyskočil, F. (1999) Noradrenaline
in mouse skeletal muscle, Int. J. Mol. Sci., 19, 1935,
synchronizes evoked quantal release at frog
doi: 10.3390/ijms19071935.
neuromuscular junctions, J. Physiol., 517, 879-888,
10.
Kim, J., Grotegut, C. A., Wisler, J. W., Li, T., Mao, L.,
doi: 10.1111/j.1469-7793.1999.0879s.x.
Chen, M., Chen, W., Rosenberg, P. B., Rockman, H. A.,
21.
Kuba, K.
(1970) Effects of catecholamines on
and Lefkowitz, R. J. (2018) β-arrestin 1 regulates β2-
the neuromuscular junction in the rat diaphragm,
adrenergic receptor-mediated skeletal muscle hyper-
J. Physiol.,
211,
551-570, doi:
10.1113/jphysiol.
trophy and contractility, Skelet. Muscle, 8, 39, doi:
1970.sp009293.
10.1186/s13395-018-0184-8.
22.
Kuba, K., and Tomita, T. (1971) Noradrenaline action
11.
Williams, R. S., Caron, M. G., and Daniel, K.
on nerve terminal in the rat diaphragm, J. Physiol.,
(1984) Skeletal muscle beta-adrenergic receptors:
217, 19-31, doi: 10.1113/jphysiol.1971.sp009557.
variations due to fiber type and training, Am. J.
23.
Rodrigues, A. Z., Wang, Z. M., Messi, M. L., and
Physiol.,
246,
160-167, doi:
10.1152/ajpendo.1984.
Delbono, O. (2019) Sympathomimetics regulate neuro-
246.2.E160.
muscular junction transmission through TRPV1, P/Q-
12.
Hinkle, R. T., Hodge, K. M. B., Cody, D. B.,
and N-type Ca2+ channels, Mol. Cell. Neurosci., 95,
Sheldon, R. J., Kobilka, B. K., and Isfort, R. J. (2002)
59-70, doi: 10.1016/j.mcn.2019.01.007.
Skeletal muscle hypertrophy and anti-atrophy effects
24.
Gubernator, N. G., Zhang, H., Staal, R. G.,
of clenbuterol are mediated by the beta2-adrenergic
Mosharov, E. V., Pereira, D. B., Yue, M., Balsanek, V.,
receptor, Muscle Nerve, 25, 729-734, doi: 10.1002/
Vadola, P. A., Mukherjee, B., Edwards, R. H.,
mus.10092.
Sulzer, D., and Sames, D. (2009) Fluorescent false
13.
Lynch, G. S., and Ryall, J. G. (2008) Role of beta-
neurotransmitters visualize dopamine release from
adrenoceptor signaling in skeletal muscle: implications
individual presynaptic terminals, Science, 324, 1441-
for muscle wasting and disease, Physiol. Rev., 88, 729-
1444, doi: 10.1126/science.1172278.
767, doi: 10.1152/physrev.00028.2007.
25.
Betz, W. J., and Bewick, G. S. (1992) Optical analysis
14.
Tsentsevitsky, A., Kovyazina, I., and Bukharaeva, E.
of synaptic vesicle recycling at the frog neuromuscular
(2019) Diverse effects of noradrenaline and adrenaline
junction, Science,
255,
200-203, doi:
10.1126/
on the quantal secretion of acetylcholine at the mouse
science.1553547.
neuromuscular junction, Neuroscience, 423, 162-171,
26.
Reid, B., Slater, C. R., Bewick, G. S. (1999) Synaptic
doi: 10.1016/j.neuroscience.2019.10.049.
vesicle dynamics in rat fast and slow motor nerve
15.
Nagatsu, T., Levitt, M., and Udenfriend, S.
terminals, J. Neurosci., 19, 2511-2521, doi: 10.1523/
(1964) Tyrosine hydroxylase. The initial step in
JNEUROSCI.19-07-02511.1999.
norepinephrine biosynthesis, J. Biol. Chem., 239,
27.
Petrov, A., Zakirjanova, G., Kovyazina, I., Tsentse-
2910-2917, doi: 10.1016/S0021-9258(18)93832-9.
vitsky, A., and Bukharaeva, E. (2022) Adrenergic re-
16.
Tsentsevitsky, A., Nurullin, L., Tyapkina, O., and
ceptors control frequency-dependent switching of the
Bukharaeva, E.
(2020) Sympathomimetics regu-
exocytosis mode between “full-collapse” and “kiss-
late quantal acetylcholine release at neuromuscu-
and-run” in murine motor nerve terminal, Life Sci.,
lar junctions through various types of adrenorecep-
296, 120433, doi: 10.1016/j.lfs.2022.120433.
tors, Mol. Cell. Neurosci., 108, 103550, doi: 10.1016/
28.
Murphy, J. F., Davies, D. H., and Smith, C. J. (1992)
j.mcn.2020.103550.
The development of enzyme-linked immunosorbent
17.
Arkhipov, A., Khuzakhmetova, V., Petrov, A. M., and
assays (ELISA) for the catecholamines adrenalin
Bukharaeva, E. A. (2022) Catecholamine-dependent
and noradrenalin, J. Immunol. Meth., 154, 89-98,
hyperpolarization of the junctional membrane via
doi: 10.1016/0022-1759(92)90216-g.
β2-adrenoreceptor/Gi-protein/α2-Na-K-ATPase
29.
Slater, C. R. (2015) The functional organization of
pathway, Brain Res., 1795, 148072, doi: 10.1016/
motor nerve terminals, Prog Neurobiol., 134, 55-103,
j.brainres.2022.148072.
doi: 10.1016/j.pneurobio.2015.09.004.
18.
Khuzakhmetova, V., and Bukharaeva, E.
(2020)
30.
Westermann, J., Hubl, W., Kaiser, N., and Salewski, L.
Adrenaline facilitates synaptic transmission by
(2002) Simple, rapid and sensitive determination of
synchronizing release of acetylcholine quanta from
epinephrine and norepinephrine in urine and plasma
motor nerve endings, Cell. Mol. Neurobiol., 41, 395-
by non-competitive enzyme immunoassay, compared
401, doi: 10.1007/s10571-020-00840-3.
with HPLC method, Clin Lab., 48, 61-71.
19.
Anderson, A. J., and Harvey, A. L. (1988) Effects
31.
Tekin, I., Roskoski, R. Jr., Carkaci-Salli, N., and
of the facilitatory compounds catechol, guanidine,
Vrana, K. E. (2014) Complex molecular regulation of
noradrenaline and phencyclidine on presynaptic
tyrosine hydroxylase, J. Neural. Transm., 121, 1451-
currents of mouse motor nerve terminals, Naunyn.
1481, doi: 10.1007/s00702-014-1238-7.
БИОХИМИЯ том 88 вып. 3 2023
ЭНДОГЕННЫЕ КАТЕХОЛАМИНЫ В НЕРВНО-МЫШЕЧНОМ СИНАПСЕ
453
32.
Bruhwyler, J., Liégeois, J. F., and Géczy, J. (1997)
39. Dorszewska, J., Prendecki, M., Oczkowska, A.,
Pirlindole: a selective reversible inhibitor of mono-
Rozycka, A., Lianeri, M., and Kozubski, W. (2013)
amine oxidase A. A review of its preclinical prop-
Polymorphism of the COMT, MAO, DAT, NET and
erties, Pharmacol. Res.,
36,
23-33, doi:
10.1006/
5-HTT genes, and biogenic amines in Parkinson’s
phrs.1997.0196.
disease, Curr. Genomics, 14, 518-533, doi: 10.2174/
33.
Peyrin, L., and Dalmaz, Y. (1975) Peripheral secre-
1389202914666131210210241.
tion and inactivation of catecholamines (adrenaline,
40. Goldstein, D. S. (2020) The “sick-but-not-dead”
noradrenaline, dopamine) [In French], J. Physiol., 70,
phenomenon applied to catecholamine deficiency in
353-433.
neurodegenerative diseases, Semin. Neurol., 40, 502-
34.
Eisenhofer, G., Kopin, I., and Goldstein, D. (2004)
514, doi: 10.1055/s-0040-1713874.
Catecholamine metabolism: a contemporary view with
41. Abercrombie, E. D., Keller, R. W. Jr, and Zigmond, M. J.
implications for physiology and medicine, Pharmacol.
(1988) Characterization of hippocampal norepineph-
Rev., 56, 331-349, doi: 10.1124/pr.56.3.1.
rine release as measured by microdialysis perfusion:
35.
Hjemdahl, P., Daleskog, M., and Kahan, T. (1979)
pharmacological and behavioral studies, Neuroscience,
Determination of plasma catecholamines by high
27, 897-904, doi: 10.1016/0306-4522(88)90192-3.
performance liquid chromatography with electro-
42. Lim, S. P., and Muir, T. C. (1983) Microelectrode
chemical detection: comparison with a radioenzy-
recording of the effects of agonists and antagonists on
matic method, Life Sci., 25, 131-138, doi: 10.1016/
alpha-adrenoceptors on rat somatic nerve terminals,
0024-3205(79)90384-9.
Br. J. Pharmacol., 80, 41-46, doi: 10.1111/j.1476-5381.
36.
Liao, Y. T., Wang, S. M., Wang, J. R., Yu, C. K., and
1983.tb11047.x.
Liu, C. C. (2015) Norepinephrine and epinephrine
43. Wang, Z. M., Rodrigues, A. C. Z., Messi, M. L., and
enhanced the infectivity of enterovirus, PLoS One, 10,
Delbono, O. (2020) Aging blunts sympathetic neuron
e0135154, doi: 10.1371/journal.pone.0135154.
regulation of motoneurons synaptic vesicle release
37.
Li, J., King, N. C., and Sinoway, L. I.
(2005)
mediated by β1- and α2B-adrenergic receptors in
Interstitial ATP and norepinephrine concentrations
geriatric mice, J. Gerontol. A Biol. Sci. Med. Sci., 75,
in active muscle, Circulation, 111, 2748-2751, doi:
1473-1480, doi: 10.1093/gerona/glaa022.
10.1161/CIRCULATIONAHA.104.510669.
44. Rodrigues, A. C. Z., Messi, M. L., Wang, Z. M.,
38.
Martin, W. H., Murphree, S. S., and Saffitz, J. E.
Abba, M. C., Pereyra, A., Birbrair, A., Zhang, T.,
(1989) Beta-adrenergic receptor distribution among
O’Meara, M., Kwan, P., and Lopez, E. I. S. (2019) The
muscle fiber types and resistance arterioles of white,
sympathetic nervous system regulates skeletal muscle
red, and intermediate skeletal muscle, Circ. Res., 64,
motor innervation and acetylcholine receptor stability,
1096-1105, doi: 10.1161/01.res.64.6.1096.
Acta Physiol., 225, 13195, doi: 10.1111/apha.13195.
SYMPATHETIC INNERVATION AND ENDOGENOUS
CATECHOLAMINES IN NEUROMUSCULAR PREPARATIONS
OF MUSCLES OF DIFFERENT FUNCTIONAL PROFILES
S. A. Dmitrieva1, S. G. Vologin2, A. N. Tsentsevitsky1, A. Y. Arkhipov1,
V. F. Khuzakhmetova1, G. V. Sibgatullina1, and E. A. Bukharaeva1*
1 Kazan Institute of Biochemistry and Biophysics, FRC “Kazan Scientific Center of RAS”,
420111 Kazan, Russia; e-mail: elbukhara@gmail.com
2 Tatar Research Institute of Agriculture, FRC “Kazan Scientific Center of RAS”,
420059 Kazan, Russia
Influence of the sympathetic nervous system on the work of skeletal muscles contractile apparatus is now
beyond doubt. However, until recently there was no evidence that the endings of sympathetic nerves can be
located in close proximity to the neuromuscular synapses, and there is also no reliable data on how much
endogenous adrenaline and noradrenaline can be contained near the synaptic contact in skeletal muscles.
In this research, using fluorescent analysis, immunohistochemical and enzyme immunoassays the isolated
neuromuscular preparations of three skeletal muscles of different functional profiles and containing differ-
ent types of muscle fibers were examined. Close contact between the sympathetic and motor cholinergic
nerve endings and the presence of tyrosine hydroxylase in this area were demonstrated. Concentrations of
endogenous adrenaline and noradrenaline in the solution perfusing the neuromuscular preparation were
БИОХИМИЯ том 88 вып. 3 2023
454
ДМИТРИЕВА и др.
determined under different modes of its functioning. The effects of α and β adrenoreceptor blockers on
the processes of acetylcholine quantal secretion from the motor nerve endings were compared. The data
obtained provide evidence for the presence of endogenous catecholamines in the neuromuscular junction
region and their role in the modulation of the synaptic function.
Keywords: neuromuscular junction, sympathetic innervation, tyrosine hydroxylase, endogenous catecholamines,
adrenoreceptor blockers
БИОХИМИЯ том 88 вып. 3 2023