БИОХИМИЯ, 2023, том 88, вып. 3, с. 455 - 476
УДК 577.17
ПЕРСПЕКТИВЫ ИСПОЛЬЗОВАНИЯ ИНТРАНАЗАЛЬНО
ВВОДИМЫХ ИНСУЛИНА И ИНСУЛИНОПОДОБНОГО
ФАКТОРА РОСТА-1 ПРИ ЦЕРЕБРАЛЬНОЙ ИШЕМИИ
Обзор
© 2023 И.И. Зорина*, Н.Ф. Аврова, И.О. Захарова, А.О. Шпаков
ФГБУН Институт эволюционной физиологии и биохимии им. И.М. Сеченова РАН,
194223 Санкт-Петербург, Россия; электронная почта: zorina.inna.spb@gmail.com
Поступила в редакцию 11.10.2022
После доработки 07.11.2022
Принята к публикации 07.11.2022
В настоящее время подходы, применяемые для лечения инсульта, имеют существенные ограниче-
ния, а нейропротекторная терапия малоэффективна. В связи с этим поиск эффективных нейро-
протекторов и разработка новых нейропротективных стратегий при церебральной ишемии
по-прежнему актуальны. Инсулин и инсулиноподобный фактор роста-1 (IGF-1) играют важную
роль в функционировании мозга, вовлечены в регуляцию роста, дифференцировки и выживае-
мости нейронов, нейрональной пластичности, пищевого поведения, контролируют перифери-
ческий метаболизм и эндокринные функции. Они оказывают комплексное воздействие на мозг,
в том числе демонстрируют нейропротекторное действие при церебральной ишемии и инсульте.
В экспериментах на животных и клеточных культурах показано, что инсулин и IGF-1 в условиях
гипоксии улучшают энергетический обмен в нейронах и глиальных клетках, оказывают положи-
тельное влияние на микроциркуляцию крови в мозге, восстанавливают функции нервных клеток
и процессы нейропередачи, оказывают противовоспалительное и антиапоптотическое действие
на клетки мозга. Наибольший интерес для клиники представляет интраназальный путь введения
инсулина и IGF-1, поскольку он позволяет дозированно доставлять их непосредственно в мозг,
минуя гематоэнцефалический барьер. Интраназально вводимый инсулин демонстрирует выражен-
ный положительный эффект при коррекции когнитивных нарушений у пожилых людей с нейроде-
генеративными и метаболическими расстройствами. Инсулин и IGF-1, вводимые интраназально,
повышают выживаемость животных с ишемическим инсультом. В обзоре обсуждаются данные
литературы и результаты собственных исследований о механизмах нейропротекторного действия
интраназально вводимых инсулина и IGF-1 при церебральной ишемии и перспективы их приме-
нения для нормализации функций ЦНС и снижения нейродегенеративных изменений при этой
патологии.
КЛЮЧЕВЫЕ СЛОВА: интраназальный инсулин, инсулиноподобный фактор роста-1, ишемия головного
мозга, реперфузия, нейропротекторный эффект, окислительный стресс.
DOI: 10.31857/S0320972523030077, EDN: QWRRGY
ВВЕДЕНИЕ
играя ключевую роль в контроле глюкозного
гомеостаза. Длительное время общепринятой
После открытия инсулина Бантингом и
была точка зрения, что функции инсулина
Бестом в 1921 г. было установлено, что этот
ограничиваются в основном контролем мета-
гормон, продуцируемый панкреатическими
болизма углеводов и жиров, и мозг при этом
β-клетками, при введении в организм оказы-
не рассматривался как его возможная мишень.
вает выраженный гипогликемический эффект, Обнаружение инсулина и его сигнальной
Принятые сокращения: ГЭБ - гематоэнцефалический барьер; ИВИ - интраназально вводимый инсулин; ПОЛ -
перекисное окисление липидов; eNOS - эндотелиальная NO-синтаза; GSK3β - киназа-3β гликогенсинтазы; IGF-1 -
инсулиноподобный фактор роста-1; IGF1R - рецептор IGF-1; INSR - инсулиновый рецептор; IRS-белки - белки-
субстраты рецептора инсулина; MAPK - митогенактивируемые протеинкиназы; MCAO - модель окклюзии средней
мозговой артерии; PI3K - фосфатидилинозитол-3-киназа; tPA - активатор тканевого плазминогена.
* Адресат для корреспонденции.
455
456
ЗОРИНА и др.
системы в структурах мозга, а также иссле-
ATP-чувствительных калиевых каналов, функ-
дования регуляторных эффектов инсулина
ционально активных в нейронах и β-клетках [8].
на функции ЦНС кардинально изменили эту
В нейронах и глиальных клетках голов-
точку зрения и показали, что инсулин важен
ного мозга присутствуют все компоненты ин-
как для функционирования мозга, так и пери-
сулиновой системы, включая INSR [9]. В ходе
ферических тканей [1]. Было показано, что
альтернативного сплайсинга гена Insr генери-
центральные механизмы действия присущи
руются две изоформы рецептора - укорочен-
структурному гомологу инсулина - инсулино-
ная (INSR-A) и полноразмерная (INSR-B),
подобному фактору роста-1 (IGF-1), который,
которые, несмотря на сходство структурно-
как и инсулин, относится к семейству инсули-
функциональной организации, имеют ряд
новых пептидов и имеет сходный с ним сиг-
различий [10]. Несмотря на то что в большин-
нальный каскад.
стве тканей экспрессируются обе изоформы
INSR, соотношение INSR-A/INSR-B в мозге
значительно выше, чем на периферии, вслед-
ИНСУЛИН
ствие чего INSR-A часто называют нейро-
И ЕГО СИГНАЛЬНЫЕ ПУТИ В МОЗГЕ
нальной изоформой INSR. INSR-A и INSR-B
представляют собой α2β2-гетеротетрамеры,
Инсулин в мозге впервые был обнаружен
в которых внеклеточные α-субъединицы и
Havrankova et al. [2], после чего встал вопрос
трансмембранные β-субъединицы соединены
о его источнике в ЦНС. Были получены до-
между собой дисульфидными связями [11, 12].
казательства, что циркулирующий в крово-
α-Субъединица и N-концевая часть β-субъ-
токе панкреатический инсулин впоследствии
единицы образуют внеклеточную часть INSR
через гематоэнцефалический барьер (ГЭБ)
и ответственны за высокоаффинное связыва-
поступает в мозг. Его транспорт может реа-
ние инсулина. В цитоплазматической части
лизовываться как с участием инсулиновых
β-субъединицы локализован высококонсерва-
рецепторов (INSR) с помощью рецептор-опо-
тивный тирозинкиназный домен, активность
средуемого эндоцитоза [3], так и без образова-
которого стимулируется в результате связыва-
ния инсулин-рецепторного комплекса - путем
ния гормона с α-субъединицей рецептора [11].
пассивного проникновения через фенестри-
После взаимодействия инсулина с α-субъ-
рованные капилляры и эпендимные клетки
единицей INSR ее конформация меняется, что
срединного возвышения гипоталамуса или
вызывает изменение конформации β-субъеди-
посредством транспорта из спинномозговой
ницы и активирует тирозинкиназный домен,
жидкости с участием таницитов [4]. Однако
вызывая аутофосфорилирование INSR по трем
расшифровка транспортных путей поступле-
остаткам тирозина (Tyr1158, Tyr1162, Tyr1163). После
ния инсулина в мозг не позволяет объяснить
аутофосфорилирования β-субъединица стано-
его высокий уровень в мозге в неонаталь-
вится мишенью для белков-субстратов рецеп-
ный период развития, когда инсулин-проду-
тора инсулина (IRS-белков) и ряда других ре-
цирующая функция поджелудочной железы
гуляторных и адаптерных молекул, имеющих
отсутствует или еще недостаточна для син-
в своей структуре фосфотирозинсвязываю-
теза значимых количеств гормона. Это остав-
щие участки. Взаимодействие с ними активи-
ляет открытым вопрос о возможности синтеза
рует сразу несколько сигнальных путей [13].
инсулина в ЦНС, по крайней мере на ранних
Нокаут гена Insr в гиппокампе и амигдале
стадиях онтогенеза. В пользу этого свидетель-
мышей как отдельно, так и вместе с нокау-
ствует обнаружение мРНК для проинсулина
том гена, который кодирует родственный ему
в гипоталамусе, CA1- и CA3-областях гиппо-
рецептор IGF-1 (IGF1R), приводит к когни-
кампа, зубчатой извилине, обонятельной лу-
тивным и поведенческим нарушениям, что
ковице у эмбрионов крыс, новорожденных
указывает на участие инсулина в контроле
крысят и кроликов [5, 6], а также в первичной
функций ЦНС [1].
культуре нейронов, полученных из различных
Среди известных в настоящее время 6 изо-
областей эмбрионального мозга кроликов [7].
форм IRS-белков ведущую роль в инсулино-
Необходимо отметить, что как нейроны, так и
вом пути играют IRS-1 и IRS-2, которые об-
панкреатические β-клетки являются электри-
наруживаются почти во всех типах клеток и
чески возбудимыми и отвечают деполяриза-
тканей. В их N-концевой части располагаются
цией и экзоцитозом на гормональные стиму-
плекстрингомологичный и фосфотирозин-
лы и повышение уровня глюкозы. Это важно
связывающий домены, необходимые для ассо-
для синтеза и секреции инсулина, поскольку
циации IRS-белков с мембраной и с молеку-
оба этих процесса требуют деполяризации
лой INSR. В С-концевой части IRS-1 и IRS-2
БИОХИМИЯ том 88 вып. 3 2023
ИНТРАНАЗАЛЬНЫЕ ИНСУЛИН И IGF-1 ПРИ ЦЕРЕБРАЛЬНОЙ ИШЕМИИ
457
располагается домен, отвечающий за взаимо-
зависимая протеинкиназа (DNA-PK) фосфо-
действие с белками, содержащими SH2-доме-
рилируют AKT по остатку Ser473, локализован-
ны, которые являются основными эффекто-
ному в С-концевом домене AKT [21]. Таким
рами инсулиновой сигнальной системы [14].
образом, фосфорилирование AKT сразу по
К белкам, содержащим SH2-домены, относят-
двум сайтам ведет к полной ее активации, в
ся: (1) фосфатидилинозитол-3-киназа (PI3K),
результате чего AKT фосфорилирует значи-
ключевой компонент 3-фосфоинозитидного пути;
тельное число эффекторных нижележащих
(2) адаптерный GRB2-белок, который опосре-
белков - опосредует активацию фосфодиэсте-
дует активацию митогенактивируемых протеин-
разы 3b, фосфоенолпируваткарбоксикиназы 1
киназ (MAPK); (3) протеинфосфотирозинфос-
и эндотелиальной NO-синтазы (eNOS) и ин-
фатаза SHP2; (4) нерецепторная тирозинкина-
гибирование PGC1α, p21kip, киназы-3β глико-
за Fyn; (5) супрессоры цитокинового сигна-
генсинтазы (GSK3β) и проапоптотического
линга [13]. Между IRS-1 и IRS-2 имеются
белка BAD. Вызванное AKT фосфорилиро-
существенные различия - IRS-1 опосредует
вание транскрипционных факторов FOXO1
функции инсулина в основном на перифе-
и FOXK1 инактивирует их и выключает из
рии, в то время как IRS-2 в большей степени
процесса транскрипции генов [13]. AKT играет
вовлечен в реализацию эффектов инсулина
важную роль в контроле жизнедеятельности
в ЦНС [15].
клеток, участвуя в регуляции экспрессии ге-
Основным механизмом негативной регу-
нов, ответственных за протекание ростовых и
ляции инсулиного сигналинга является изме-
метаболических процессов, клеточную выжи-
нение статуса фосфорилирования рецептора
ваемость, ангиогенез и дифференцировку кле-
и IRS-белков. Индуцированное c-Jun N-кон-
ток. Одним из ключевых инсулин-опосредуе-
цевой киназой-1 (JNK1) фосфорилирование
мых эффектов AKT является транслокация в
IRS-1 и IRS-2 по остаткам Ser и Thr приводит
плазматическую мембрану транспортера глю-
к их инактивации, что может служить одной
козы GLUT4, что обеспечивает ее захват клет-
из причин периферической и центральной
ками [22].
инсулиновой резистентности [16]. В свою оче-
Сигнальный путь, опосредуемый через AKT,
редь, тирозиновое дефосфорилирование акти-
вовлечен в регуляцию метаболизма гликогена.
вированных гормоном INSR и IRS-белков с
Активированная форма AKT фосфорилирует
помощью тирозиновых фосфатаз - протеин-
киназу GSK3 по Ser21 в случае изоформы
фосфотирозинфосфатазы 1B (PTP1B) и T-кле-
GSK3α или по Ser9 - в случае GSK3β, что ве-
точной фосфатазы - вызывает их инактивацию
дет к ее инактивации. Таким образом, AKT
и подавляет трансдукцию инсулинового сигна-
блокирует GSK3-опосредуемую регуляцию ак-
ла [17, 18].
тивности гликогенсинтетазы - ключевого фер-
IRS-белки связываются с фосфотирозин-
мента синтеза гликогена [23]. В последние годы,
связывающим доменом регуляторной субъ-
помимо синтеза гликогена, изучаются и иные
единицы PI3K, которая катализирует синтез
функции GSK3, среди которых патогенез са-
вторичного посредника - фосфатидилинози-
харного диабета, нейродегенеративных и онко-
тол-3,4,5-трифосфата (PI-3,4,5-P3) [19]. Его об-
логических заболеваний. AKT-индуцирован-
разование индуцирует транслокацию 3-фосфа-
ное ингибирование GSK3 подавляет ее влия-
тидилинозитол-зависимых протеинкиназ 1-го
ние на активность множества транскрипци-
и 2-го типов (PDK1/2), белка SIN1, компонен-
онных факторов и их регуляторов, включая
та комплекса mTORC2, и протеинкиназы AKT
NF-κB, Snail, Notch, BAD, транскрипционные
(протеинкиназа B) к плазматической мембра-
факторы FOX-семейства, что обусловливает
не [13]. Активация AKT является одним их клю-
ключевую роль каскада IRS/PI3K/AKT/GSK3
чевых событий в трансдукции инсулинового
в реализации эффектов инсулина на генную
сигнала. Этот фермент представлен тремя изо-
экспрессию, апоптоз, аутофагию, клеточную
формами: AKT1, AKT2 и AKT3, экспрессия
дифференцировку [23-25].
которых в ЦНС зависит от области мозга и
Другой важной мишенью инсулина явля-
специфична для определенного типа нейронов
ется каскад MAPK. На начальном этапе ком-
и глиальных клеток. AKT1 и AKT3 в основном
плекс GRB2-SOS взаимодействует с IRS-бел-
представлены в нейронах, в том числе минда-
ками или с адаптерным белком SHC-1. Ком-
лины, гиппокампа и коры больших полуша-
плекс GRB2-SOS опосредует GDP/GTP-об-
рий, в то время как AKT2 - в астроцитах [20].
мен малого G-белка p21ras, вызывая актива-
После связывания с мембраной про-
цию каскада MAPK: Ras-белок→Raf-киназа→
теинкиназа PDK1 фосфорилирует AKT по
→MEK-киназа→ERK1/2-киназа. ERK1/2 сти-
остатку Thr308 (для AKT1). mTORC2 и ДНК-
мулирует активность различных транскрип-
БИОХИМИЯ том 88 вып. 3 2023
458
ЗОРИНА и др.
ционных факторов и белков, в том числе
рецепторы являются частью эволюционно
рибосомального белка S6, NF-κB, протеин-
древней высококонсервативной сигнальной
фосфатазы-1 PP1, фактора MYT1, белка Elk-1,
системы у позвоночных, которая вовлечена в
cAMP-регулируемого транскрипционного фак-
контроль метаболизма, роста и дифференци-
тора CREB, протоонкогенов c-Fos и c-Jun,
ровки клеток [35]. IGF1R и различные изо-
транскрипционных факторов STAT-семей-
формы INSR способны образовывать гомоди-
ства [13, 26]. Способность инсулина активиро-
мерные, гетеродимерные и гетероолигомерные
вать MAPK-каскад обеспечивает кросс-взаи-
комплексы, которые могут активироваться и
модействие инсулиновой системы с другими
инсулином, и IGF-1, хотя и с различной эф-
сигнальными путями, включающими компо-
фективностью. Большинство пострецептор-
ненты каскада MAPK.
ных компонентов в сигнальных путях инсулина
Инсулин стимулирует синтез белка посред-
и IGF-1 в мозге являются сходными, что ука-
ством регуляции ключевых факторов инициа-
зывает на согласованные влияния этих гормо-
ции и элонгации трансляции через активацию
нов на функции нейронов и глиальных кле-
как MAPK, так и mTORC1-комплекса. Акти-
ток и свидетельствует об их способности по
вированная AKT фосфорилирует адаптерный
крайней мере частично заменять друг друга в
белок TSC1/2, негативный регулятор mTORC1,
процессе сигнальной трансдукции [36]. Среди
отменяя блокирующее влияние TSC1/2 на ки-
общих блоков для инсулина и IGF-1 следует
назную активность комплекса и вызывая его
выделить все основные компоненты 3-фосфо-
активацию. mTORC1, в свою очередь, инги-
инозитидного пути (IRS1/2, PI3K, AKT-кина-
бирует факторы, индуцирующие аутофагию, и
зы) и компоненты каскада MAPK. Влияние
стимулирует рибосомальную p70-S6-киназу и
IGF-1 на пролиферацию клеток опосредовано
транскрипционный фактор инициации транс-
Raf/MEK/ERK-сигнальным путем, в то вре-
ляции eIF4E, что вносит значимый вклад в
мя как в регуляцию дифференциации клеток
регуляцию биогенеза рибосом, процессы тран-
вовлечены пути, направленные на активацию
скрипции, трансляции и деградации белков.
AKT [37]. Для развития и надлежащего функ-
Активация mTORC1 также усиливает син-
ционирования ЦНС необходимо взаимодей-
тез липидов посредством активации фактора
ствие IGF-1-регулируемых каскадов с сиг-
SREBP1 [13, 27, 28].
нальными путями, регулируемыми другими
ростовыми факторами - фактором роста фиб-
робластов (FGF), эпидермальным фактором
ИНСУЛИНОПОДОБНЫЙ
роста (EGF), фактором роста эндотелия сосу-
ФАКТОР РОСТА-1
дов (VEGF) и нейротрофическими фактора-
И ЕГО СИГНАЛЬНЫЕ ПУТИ В МОЗГЕ
ми, в том числе BDNF [32]. Показано, что сиг-
нальные пути IGF-1 вовлечены в нейрогенез и
IGF-1 - полипептид, состоящий из 70 а.о.,
аксоногенез во взрослом мозге [38].
который вырабатывается в основном гепато-
IGF-1, как и инсулин, способен оказывать
цитами и затем секретируется в кровоток.
нейромодуляторное, нейротрофическое, нейро-
Циркулирующий в крови IGF-1 проникает
протекторное действие на нейроны головного
через ГЭБ в мозг, где он регулирует рост и
мозга, и, как следствие, нарушения в IGF-1-сиг-
развитие нейронов и глиальных клеток [29].
нальной системе мозга являются одним из пато-
В кровяном русле и в мозге IGF-1 расщепляет-
генетических механизмов развития нейродеге-
ся, что генерирует укороченную форму IGF-1
неративных заболеваний и других расстройств
и N-концевой трипептид Gly-Pro-Glu, наде-
ЦНС [39]. IGF-1 оказывает множественное дей-
ленные биологической активностью [30-32].
ствие, и его экспрессия наблюдается на протя-
Некоторые ткани, включая мозг, способны ло-
жении всего онтогенеза - от раннего постна-
кально экспрессировать и секретировать IGF-1,
тального периода до зрелого возраста. IGF-1
вследствие чего IGF-1 можно рассматривать
играет важную роль в обеспечении нормального
как паракринный и аутокринный регуля-
протекания эмбрионального периода развития
тор [32], причем в мозге он синтезируется как
мозга, в контроле миелинизации, образования
нейронами, так и глиальными клетками [33].
синапсов, развитии нервной системы в пост-
В мозге идентифицирован рецептор IGF-1
натальный период и в регуляции нейрогенеза
(IGF1R), который специфично связывает IGF-1
и нейротрансмиссии [32, 40]. Подобно другим
и структурно и функционально близок INSR
ростовым факторам, IGF-1 оказывает мощ-
[34]. Сходство INSR с IGF1R объясняется тем,
ный антиапоптотический эффект и выполняет
что кодирующие их гены (Insr и Igf1r) произо-
функции нейропротектора при нейровоспале-
шли от общего анцестрального гена, а сами
нии, повышая выживаемость нейронов.
БИОХИМИЯ том 88 вып. 3 2023
ИНТРАНАЗАЛЬНЫЕ ИНСУЛИН И IGF-1 ПРИ ЦЕРЕБРАЛЬНОЙ ИШЕМИИ
459
ФУНКЦИОНАЛЬНЫЕ НАРУШЕНИЯ
является деполяризация клеточных мембран
В МОЗГЕ ПРИ ЦЕРЕБРАЛЬНОЙ
с необратимым повреждением клеток и раз-
ИШЕМИИ И ПУТИ ИХ КОРРЕКЦИИ
витием некроза тканей. В тканях, окружаю-
щих «коровую» область, в так называемой зоне
Ишемия тканей, в том числе головного
ишемической тени или пенумбры, патологиче-
мозга, при различных по этиологии и пато-
ские процессы менее выражены. Клетки здесь
генезу заболеваниях и состояниях (хирургиче-
находятся в неактивном состоянии, поскольку
ские вмешательства, черепно-мозговая травма,
им не хватает энергетических субстратов для
асфиксия, геморрагия, эмболия, инфаркт мио-
адекватного функционирования. При раннем
карда, острые кровопотери, гипотензия и др.)
возобновлении кровотока нейроны в области
является комплексным патологическим про-
пенумбры способны к восстановлению своих
цессом. Тяжесть повреждения мозга и даль-
функций в отличие от клеток, локализованных
нейшая гибель нейронов обусловлены рядом
в «коровой» области [44].
факторов: выраженностью нарушений крово-
Нарушение мозгового кровотока приводит
снабжения ткани мозга, его длительностью,
к запуску цепи событий на молекулярном и
площадью пораженной зоны, метаболическим
клеточном уровнях, результатом чего явля-
состоянием мозга и организма в целом перед
ется истощение запасов энергии и следующая
развитием эпизода ишемии.
за этим гибель клеток. Снижение кровоснаб-
При фокальной ишемии головного мозга,
жения тканей сопровождается нарушением
т.е. при наличии локальной окклюзии сосу-
функций митохондрий, образованием актив-
дов, выраженность снижения скорости мозго-
ных форм кислорода и азота, развитием окис-
вого кровотока в различных структурах мозга
лительного повреждения биомолекул, эксайто-
сильно различается. В центре очага, в «коро-
токсичностью, ингибированием синтеза белка,
вой» области, наблюдается полное его пре-
развитием стресса эндоплазматического рети-
кращение, в то время как по направлению к
кулума и активацией процессов воспаления
периферии скорость кровотока в значитель-
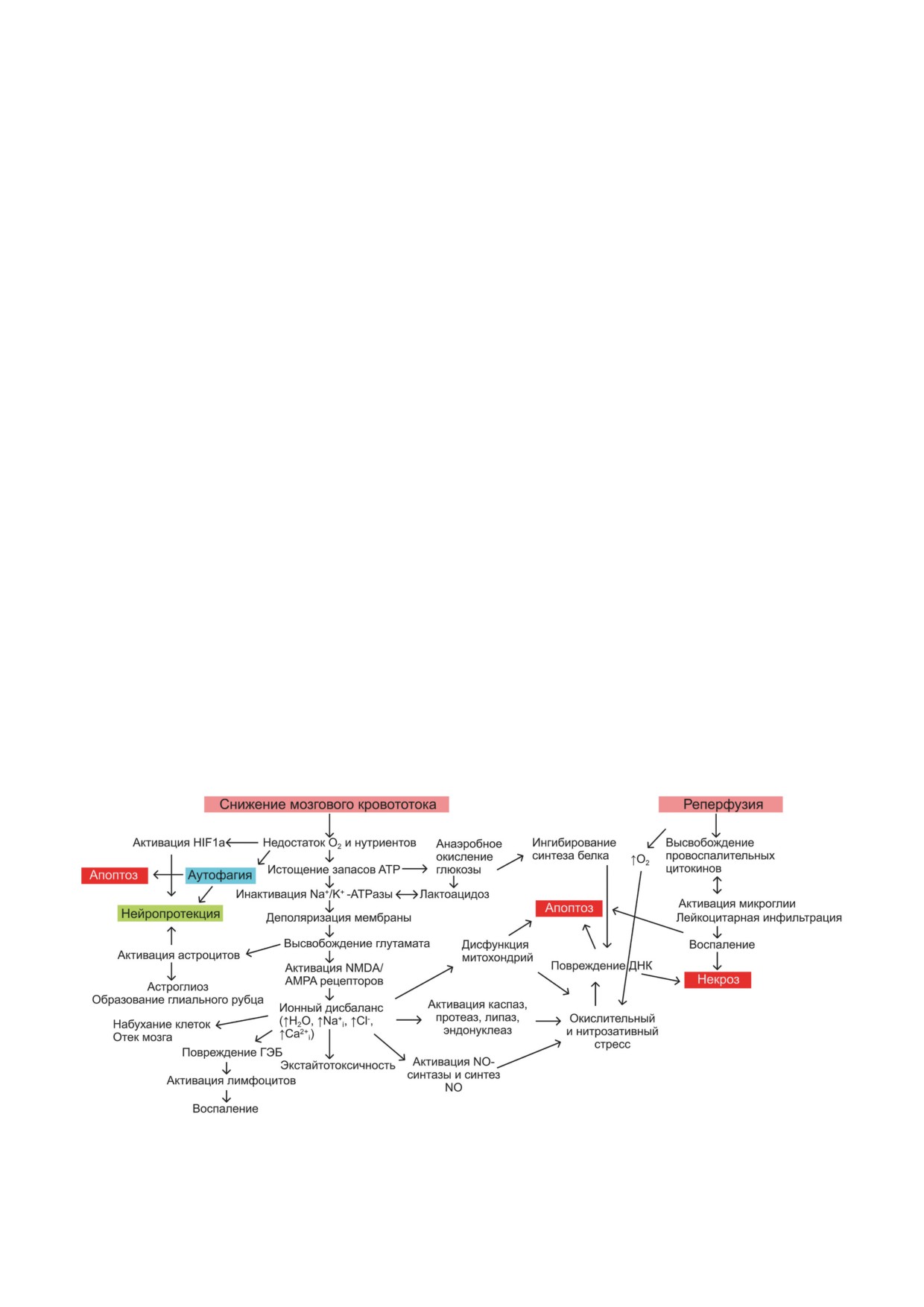
[44, 45]. На рис. 1 в общем виде отражены ос-
ной степени восстанавливается, достигая его
новные процессы, происходящие при сниже-
значений в норме [41]. Прекращение или рез-
нии кровотока и реперфузии тканей.
кое снижение кровоснабжения в «коровой»
Деполяризация клеток в ходе церебраль-
зоне сопровождается выраженным энерге-
ной ишемии приводит к высвобождению глу-
тическим дефицитом. В клетках нарушаются
тамата, что, в свою очередь, вызывает актива-
функции транспортных ATPаз, что приводит
цию ионных каналов и приводит к нарушению
к дестабилизации ионного градиента, к потере
ионного баланса как в митохондриях, так и в
внутриклеточного пула K+ и к значительному
цитозоле. Избыточный вход ионов кальция в
увеличению [Ca2+]i [42, 43]. Следствием этого
клетку и их выход из внутренних депо приводит
Рис. 1. Основные патологические каскады при ишемии и реперфузии головного мозга. AMPA-рецептор - рецептор
глутамата, селективно связывающий α-амино-3-гидрокси-5-метил-4-изоксазолпропионовую кислоту; ГЭБ - гемато-
энцефалический барьер; HIF1a - фактор, индуцируемый гипоксией 1-alpha; NMDA-рецептор - рецептор глутамата,
селективно связывающий N-метил-D-аспартат
БИОХИМИЯ том 88 вып. 3 2023
460
ЗОРИНА и др.
к активации большого числа протеаз, липаз,
Все вышесказанное свидетельствует о том,
эндонуклеаз, сигнальных протеинкиназ и
что при развивающихся в ходе ишемии-репер-
фосфатаз, а также к стимуляции продукции
фузии компенсаторных и патофизиологических
активных форм кислорода, что является триг-
процессах активируются различные сигналь-
гером каскадов, вызывающих гибель клет-
ные пути, вследствие чего их целенаправленная
ки [46]. В то же время стимуляция глутаматом
регуляция, в том числе пептидами инсулиново-
синаптических NMDA-рецепторов вызывает
го семейства, может служить многообещающей
активацию PI3K/AKT-сигнального пути, кото-
стратегией для лечения ишемических повре-
рый способствует выживаемости клеток мозга,
ждений мозга.
оказывая тем самым нейропротекторное дей-
Во время реперфузии, т.е. при восстанов-
ствие, что продемонстрировано в эксперимен-
лении кровоснабжения, отмечается дальней-
тах с клеточными культурами и на животных
шее прогрессирование индуцированных в ходе
моделях [47-49]. После активации AKT-кина-
ишемии процессов, в том числе усиление окис-
зы она осуществляет фосфорилирование ниже-
лительного стресса, накопление продуктов
лежащих мишеней, в том числе киназы-3β
перекисного окисления липидов (ПОЛ), окис-
гликогенсинтазы, проапоптотических бел-
лительная инактивация транспортных моле-
ков BAD, BAX и p53, что приводит к ингиби-
кул, включая ключевой для жизнеспособности
рованию их проапоптотической активности и
клеток фермент Na+/K+-ATPазу [45]. Одной
тем самым способствует выживаемости кле-
из причин усиления окислительного стресса
ток [50]. Несмотря на запуск антиапоптоти-
и запуска «реакции несвернутых белков», как
ческих каскадов, как компенсаторных меха-
индуктора стресса эндоплазматического рети-
низмов, препятствующих нейродегенерации,
кулума, является нарушение функциональ-
длительное воздействие ишемии на структуры
ной активности ферментов антиоксидантной
мозга приводит к дезинтеграции и необра-
системы, которые исключительно важны для
тимым изменениям в сигнальных каскадах,
обеспечения выживания нейронов и глиаль-
отвечающих за выживаемость и функцио-
ных клеток в постишемический период [55].
нальную активность нейронов и глиальных
В настоящее время существует несколько
клеток, результатом чего является их гибель
подходов для лечения инсульта, которые осно-
путем апоптоза, некроза или аутофагии [50].
ваны на необходимости восстановить кровоток
Более подробно с молекулярными механизма-
в зоне ишемического повреждения и повысить
ми повреждения клеток мозга при недостатке
выживаемость клеток в зоне пенумбры, окру-
церебрального кровоснабжения можно озна-
жающей очаг ишемии. Среди них тромболити-
комиться в обзорных статьях [50, 51].
ческая терапия, которая должна быть проведе-
Важную роль в противодействии ишемии
на в течение первых 4,5 ч после возникновения
и гипоксии головного мозга играет тран-
симптомов ишемического инсульта [56]. Ком-
скрипционный фактор HIF-1 (фактор-1, ин-
плексная антитромбоцитарная и нейропро-
дуцируемый гипоксией), состоящий из двух
текторная терапия способствует снижению
субъединиц: O2-чувствительной HIF-1α и кон-
негативных последствий инсульта [57]. Пред-
ститутивно-экспрессируемой HIF-1β. В усло-
отвращение образования тромбов в сосудах го-
виях пониженного содержания кислорода
ловного мозга при ишемическом инсульте мо-
происходит стабилизация HIF-1α с дальней-
жет быть осуществлено путем использования
шей активацией экспрессии HIF-1-зависи-
препаратов активатора тканевого плазмино-
мых генов. Установлено, что HIF-1α усиливает
гена (tPA), таких как алтеплаза, которые рас-
экспрессию генов, которые кодируют белки,
творяют тромбы и улучшают приток крови к
помогающие клеткам и тканям мозга адап-
структурам мозга [56]. Наряду с фармакологи-
тироваться к условиям гипоксии, такие как
ческими, используют хирургические подходы,
VEGF и эритропоэтин [52]. Наряду с этим,
в первую очередь механическую тромбэкто-
наблюдается повышение экспрессии и актива-
мию, которая направлена на удаление тромба,
ция белков, обеспечивающих пролиферацию и
локализованного в кровеносном сосуде [58].
выживаемость клеток, усиливается синтез гли-
При геморрагическом инсульте остановка кро-
колитических ферментов и других регулято-
вотечения хирургическим путем является един-
ров метаболизма, а также интенсифицируется
ственным способом эффективного лечения.
обмен железа [53]. Установлено, что уровень
Однако все эти подходы имеют серьезные огра-
HIF-1α в клетках повышается под действием
ничения, а терапевтическое окно для их при-
целого ряда гормонов и ростовых факторов, в
менения является очень узким. Так, препараты
том числе инсулина, IGF-1, эпидермального
tPA являются эффективными только в течение
фактора роста [54].
первых 3-4 ч после начала инсульта [58].
БИОХИМИЯ том 88 вып. 3 2023
ИНТРАНАЗАЛЬНЫЕ ИНСУЛИН И IGF-1 ПРИ ЦЕРЕБРАЛЬНОЙ ИШЕМИИ
461
Нейропротекторная терапия включает
ными гипергликемией окислительным стрес-
использование различных по механизму дей-
сом и нейровоспалением, а также интенсифика-
ствия препаратов, среди которых «депротеини-
цией неферментативного гликирования белков
зированный гемодериват крови телят» или ак-
в условиях персистентного повышения уровня
товегин, винпоцетин, АКТГ и родственные ему
глюкозы [64]. Существуют убедительные дока-
пептидные регуляторы, а также препараты, со-
зательства, что высокий уровень глюкозы в
держащие метаболиты и биологически актив-
острой фазе инсульта является независимым
ные вещества (инозин + никотинамид + ри-
предиктором увеличения размера инфаркта,
бофлавин + янтарная кислота, ЦДФ-холин,
неблагоприятного функционального исхода и
альфосцерат холина, сукцинат этилметил-
более высокой смертности [65]. Гиперглике-
гидроксипиридина) [57]. Актовегин обладает
мия также ассоциирована с менее благоприят-
выраженным стимулирующим действием на
ным исходом у пациентов с острым геморраги-
клеточный метаболизм [59]. Винпоцетин спо-
ческим инсультом и церебральным венозным
собствует вазодилатации, снижая агрегацию
тромбозом [66].
тромбоцитов и оказывая противовоспалитель-
ное действие [60]. Интраназально вводимый
негормональный аналог АКТГ и другие нона-
ПРИМЕНЕНИЕ ИНСУЛИНА И IGF-1
пептиды обладают выраженными противо-
ДЛЯ ПРЕДОТВРАЩЕНИЯ ПОСЛЕДСТВИЙ
воспалительным, нейротрофическим и нейро-
ИШЕМИЧЕСКОГО ИНСУЛЬТА
регенеративным действиями [61]. Однако с
позиций доказательной медицины назначение
Поскольку гипергликемия усугубляет те-
нейропротекторных препаратов при терапии
чение инсульта и ассоциирована с тяжелым
ишемического инсульта не является в полной
состоянием больного, то нормализация уров-
мере подтвержденным, и в настоящее время
ня глюкозы у пациентов с гипергликемией
отсутствуют оптимальные протоколы для такой
является одним из подходов для предотвра-
терапии [57]. Патофизиология инсульта сложна
щения и лечения инсульта. Инсулин, оказы-
и включает нарушения во многих сигнальных
вающий мощный гипогликемический эффект,
путях, поэтому комбинации нейропротектор-
в этом отношении рассматривается как пре-
ных агентов или препарат с множественным
парат первой линии выбора для предотвра-
действием могут быть более эффективными,
щения инсульта у диабетических пациентов с
поскольку препятствуют развитию сразу не-
сильно выраженной гипергликемией. Однако
скольких патологических процессов. Таким об-
в этом случае речь идет о способности инсу-
разом, разработка новых фармакологических
лина нормализовать уровень глюкозы в крови
подходов для лечения ишемического инсульта
и глюкозный гомеостаз в целом, в то время
по-прежнему остается актуальной задачей.
как центральные механизмы действия гормона
Почти полвека назад было установлено,
остаются «за скобками». В последнее время все
что у пациентов с сахарным диабетом, имею-
больший интерес прикован к нейропротектор-
щих нарушенную толерантность к глюкозе и
ному действию гормона и его способности не-
постпрандиальную гипергликемию, вероят-
посредственно влиять на структуры мозга, под-
ность развития инсульта в 2-4 раза выше,
вергнувшиеся ишемическому повреждению.
чем у пациентов с нормальным уровнем глю-
Первые сообщения об инсулине как потен-
козы [62]. У гипергликемических пациентов
циальном нейропротекторе при ишемическом
намного медленнее проходит восстановление
поражении мозга появились на рубеже 1980-
после инсульта и существенно ухудшается
1990-х гг. [67-69]. В дальнейшем изучали за-
неврологический исход заболевания. Обнару-
щитное действие инсулина при моделировании
жено, что гипергликемия выявляется у 28% па-
ишемии как на здоровых животных, так и при
циентов с инсультом даже при отсутствии в
экспериментальном диабете. Так, в 1992 г. было
анамнезе сахарного диабета, причем уровень
установлено, что при подкожном введении ин-
гипергликемии положительно коррелирует с
сулина диабетическим животным еще до ин-
тяжестью инсульта, а смертность у пациентов
дукции у них ишемии не только нормализуется
с сильно выраженной гипергликемией значи-
уровень глюкозы в крови, но и существенно
тельно выше, чем у пациентов с нормальным
улучшается исход ишемического эпизода [70].
уровнем глюкозы [62]. Впоследствии взаимо-
Положительное влияние обработки инсулином
связь между симптоматическими проявления-
на исход ишемии было продемонстрировано
ми гипергликемии и исходом инсульта была
при различных инъекционных способах вве-
подтверждена другими исследователями [63].
дения гормона - внутривенном [71], подкож-
Это, как полагают, обусловлено индуцирован-
ном [72-74] и внутрибрюшинном [75, 76].
БИОХИМИЯ том 88 вып. 3 2023
462
ЗОРИНА и др.
Важным вкладом в понимание роли ин-
гают, может предотвратить или по крайней
сулина в мозге, как нейропротектора, стала
мере снизить гибель нейронов и глиальных
работа Voll и Auer [77], в которой авторы по-
клеток [90, 91]. При изучении последствий
казали, что инсулин при периферическом
инсульта у людей было обнаружено, что уро-
введении уменьшает повреждение мозга, и
вень IGF-1 в момент верификации инсульта
этот эффект определяется не только его спо-
(1-10 дней после ишемического эпизода) и
собностью ослаблять гипергликемию, но и
через 3 месяца после перенесенного инсульта
непосредственным воздействием на структуры
положительно коррелирует с кратко- и долго-
мозга. В дальнейшем, основываясь на предпо-
срочным восстановлением функционального
ложении о том, что инсулин оказывает нейро-
состояния пациентов, в том числе с нормали-
протекторное воздействие на нейроны, неза-
зацией у них когнитивных функций [92]. При
висимо от его влияния на уровень глюкозы в
моделировании одностороннего повреждения
крови, были предприняты исследования по
головного мозга в результате ишемии-гипо-
изучению эффектов центрально вводимого
ксии у крыс показано, что IGF-1 накаплива-
инсулина при ишемических повреждениях
ется в поврежденном полушарии в течение 5 ч
головного мозга. Было установлено, что при
после воздействия, а через 3 дня наблюдается
церебральной ишемии интрацеребровентри-
повышенная экспрессия IGF-1 в микроглии и
кулярное введение инсулина эффективно в
IGFBP2 - в астроцитах, причем по всему по-
той же степени, что и периферическое введе-
врежденному полушарию [90].
ние, но, в отличие от последнего, не приводит
При интрацеребровентрикулярном вве-
к нежелательным гипогликемическим эпизо-
дении за 1 ч или через 2 ч после проведения
дам [78-80]. В модели ишемии переднего моз-
односторонней временной гипоксии-ишемии
га центральное введение инсулина не только
IGF-1 значимо снижал размер инфаркта и
снижало размер инфаркта мозга, но и улуч-
предотвращал массовую гибель нейронов у
шало когнитивные способности животных,
взрослых крыс [78]. Установлено также, что
нарушенные в результате ишемического пора-
IGF-1 в суточной дозе 50 мкг на крысу, вво-
жения [79]. Изучение молекулярных механиз-
димый в желудочки мозга в течение 7 дней,
мов защитного действия инсулина на нейроны
уменьшал повреждение гиппокампа после тран-
и глиальные клетки показало, что ключевую
зиторной ишемии переднего мозга крыс, про-
роль в них играет антиапоптотический сиг-
водимой путем окклюзии сонных артерий [79].
нальный путь PI3K/AKT. Активируя AKT, ин-
В модели гипоксической ишемии на ново-
сулин ингибировал выход цитохрома c из ми-
рожденных крысятах, которым сразу после
тохондрий, предотвращая перемещение к ним
воздействия интрацеребровентрикулярно вво-
проапоптического белка Bax [81-83] и усили-
дили 50 мкг IGF-1 с последующими ежеднев-
вая синтез белков, в том числе ферментов ан-
ными инъекциями IGF-1 в дозе 50 мкг на кры-
тиоксидантной защиты [84, 85], в результате
су, зона индуцированного ишемией инфаркта
чего повышалась выживаемость нейронов и
была существенно меньше, чем у животных
восстанавливались когнитивные функций у
без обработки IGF-1 [93]. IGF-1 также снижал
животных, перенесших ишемию мозга [82].
индуцированный ишемией-реперфузией апоп-
По имеющимся данным, инсулин спосо-
тоз и некроз в мозге диабетических крыс [94].
бен выполнять функции вазоактивного гор-
Совокупность этих данных свидетельствует о
мона, вовлеченного в регуляцию мозгового
том, что повреждение, вызванное ишемиче-
кровотока, что иллюстрируется способностью
ским инфарктом головного мозга, может быть
гормона вызывать как расширение [86], так и
ослаблено или в значительной степени пред-
сужение сосудов [87]. Активация AKT под дей-
отвращено при неотложном лечении ише-
ствием инсулина приводит к повышению экс-
мизированных животных с помощью различ-
прессии eNOS в клетках эндотелия сосудов и,
ных доз IGF-1.
как результат, усиливает продукцию NO, важ-
Нейропротекторные эффекты IGF-1 ин-
нейшего вазодилататора, что особенно важно
тенсивно изучаются в условиях повреждения
при дефиците NO в условиях нейродегенера-
белого вещества мозга, которое ассоциировано
тивных и метаболических расстройств [88, 89].
с тяжелыми неврологическими последствиями
В контексте предотвращения послед-
после перенесенной гипоксии-ишемии, осо-
ствий ишемии головного мозга в настоящее
бенно у новорожденных. Основной мише-
время широко изучается и IGF-1. Церебраль-
нью гипоксии-ишемии становятся незрелые
ная ишемия и другие повреждения мозга
олигодендроциты, которые участвуют в мие-
индуцируют экспрессию IGF-1 и IGF-1-свя-
линизации нервных волокон. Интрацеребро-
зывающих белков (IGF1BP), и это, как пола-
вентрикулярное введение IGF-1 крысятам,
БИОХИМИЯ том 88 вып. 3 2023
ИНТРАНАЗАЛЬНЫЕ ИНСУЛИН И IGF-1 ПРИ ЦЕРЕБРАЛЬНОЙ ИШЕМИИ
463
подвергнутым постнатальной гипоксии-ише-
IGF-1, подобно инсулину, может прояв-
мии, существенно снижало гибель незрелых
лять нейропротекторные свойства при остром
олигодендроцитов, подавляя активность про-
ишемическом инсульте благодаря влиянию
апоптотических каспазных путей, а также
на окислительный стресс, а также присущему
улучшало миелинизацию и пролиферацию
ему сосудорасширяющему, противовоспали-
клеток, что в конечном итоге восстанавли-
тельному и антитромботическому действию.
вало неврологические функции, нарушенные
Наряду с этим, IGF-1 и инсулин, действуя
у крысят раннего возраста вследствие воздей-
синергично через сходные сигнальные каска-
ствия [95]. Хотя популяция незрелых олиго-
ды, способны улучшать функциональные взаи-
дендроцитов в белом веществе взрослого чело-
мосвязи между нейронами, их метаболизм,
века относительно невелика, но имеющийся
сигнальные функции и процесс ремиелиниза-
пул клеток играет важную роль в ремиелини-
ции нервных волокон [85, 101-104].
зации после травмы или ишемии. В процессе
Таким образом, полученные данные ука-
онтогенетического развития мозга незрелые
зывают на то, что инсулин и IGF-1 положи-
олигодендроциты мигрируют из вентрикуляр-
тельно влияют на выживаемость, рост и диф-
ной зоны к конечному месту назначения, где
ференцировку нейронов и глиальных клеток,
дифференцируются с образованием миелино-
нейрональную пластичность и контролируе-
вых оболочек. Однако после черепно-мозговой
мые ими функции ЦНС, а также способны
травмы они могут мигрировать к поврежден-
предотвратить нейродегенерацию и другие па-
ному участку, где способствуют восстановле-
тологические процессы в мозге, развивающие-
нию миелина [96]. В этом отношении стимуля-
ся после ишемии и ишемического инсульта.
ция миграции клеток с помощью IGF-1 может
Это является несомненным преимуществом
быть весьма эффективной.
инсулина и IGF-1 по сравнению со многими
Поддержание функций глиальных клеток
другими препаратами, кандидатами на роль
и их защита также рассматриваются, как пер-
нейропротекторов при церебральной ишемии.
спективный нейропротекторный подход при
В отличие от инсулина и IGF-1, которые дей-
инсульте, поскольку деструктивные процессы
ствуют комплексно, мишенями других нейро-
затрагивают и их в условиях ишемии. Астро-
протекторов, как правило, являются отдель-
циты выполняют защитную роль при недо-
ные звенья ишемического каскада, что, как
статке кровоснабжения, окислительном стрес-
полагают, и обусловливает их низкую эффек-
се и эксайтотоксичности. При патологическом
тивность или отсутствие восстанавливающего
изменении ионного состава межклеточной
эффекта на функции ЦНС при ишемическом
жидкости астроциты выступают в качестве
повреждении мозга во время клинических ис-
буфера ионов и возбуждающих аминокислот,
пытаний. Однако в случае инсулина и IGF-1
глутамата и аспартата [97]. IGF-1 оказывает
сохраняются существенные проблемы в адрес-
протекторное действие на глиальные клетки.
ной доставке препаратов в зону ишемического
Снижение уровня IGF-1 или блокирование
поражения. Так, инсулин, как правило, вводят
IGF1R в астроцитах приводит к уменьшению
пациентам с помощью внутривенных инъек-
скорости захвата глутамата при одновремен-
ций и только в условиях выраженной гипер-
ном усилении высвобождения нейромедиа-
гликемии. Однако кровоток в зоне инфаркта
тора [98]. Подобные процессы, которые могут
сильно нарушен, и это не позволяет гормону
наблюдаться при инсулиновой резистентно-
в достаточных количествах поступить в пов-
сти, приводят к образованию эксайтотоксич-
режденную область мозга. В дополнение к это-
ного микрокружения вокруг нейронов, что в
му инсульт часто ассоциирован с метаболиче-
конечном итоге способствует повреждению
скими расстройствами с характерной для них
тканей при инсульте. Нарушение IGF-1-опо-
инсулиновой резистентностью. Поскольку зна-
средуемого сигналинга влечет за собой дис-
чительная часть инсулина поступает в мозг
баланс гомеостаза глюкозы в астроцитах, что
через ГЭБ с помощью рецептор-опосредуе-
отрицательно влияет на нейротрансмиссию
мого транспорта, то в условиях инсулиновой
и метаболическую активность нейронов, по-
резистентности такой транспорт нарушен, что
скольку эти процессы зависят от поступаю-
приводит к снижению уровня инсулина в моз-
щих из астроцитов метаболитов, глутамина и
ге и ослаблению проникновения в него инъ-
лактата [99]. Введение IGF-1 оказывает также
екционного инсулина. Так, ранее нами было
противовоспалительное действие при ишемии
показано, что уровень инсулина в ЦНС в усло-
мозга, снижая высвобождение фактора некро-
виях инсулиновой резистентности при ожире-
за опухолей-α и интерлейкина-1β и экспрес-
нии и метаболическом синдроме сильно сни-
сию индуцибельной NO-синтазы [100].
жен [105, 106]. Интрацеребровентрикулярные
БИОХИМИЯ том 88 вып. 3 2023
464
ЗОРИНА и др.
инъекции инсулина и IGF-1 в условиях клини-
рованная в конце 2000-х гг. эффективность
ки неприемлемы вследствие травматичности.
интраназально вводимого IGF-1 животным,
В соответствии с этим наиболее значимой
подвергнутым ишемии-реперфузии [95, 109],
и практически реализуемой альтернативой
является косвенным доказательством фарма-
является интраназальное введение инсулина
кологической безопасности и эффективности
и IGF-1.
интраназально вводимых пептидов инсулино-
вой группы.
Сравнительно недавно были описаны
ПЕРСПЕКТИВЫ ИСПОЛЬЗОВАНИЯ
фармакокинетика и фармакодинамика ИВИ
ИНТРАНАЗАЛЬНО ВВОДИМЫХ
у грызунов [110-112]. После распыления в
ИНСУЛИНА И IGF-1
носовой полости инсулин попадает на сли-
ДЛЯ ПРЕДОТВРАЩЕНИЯ
зистую оболочку носа, где он транспортиру-
ИШЕМИЧЕСКОГО ИНСУЛЬТА
ется в мозг внутриклеточным путем с помо-
щью рецептор-опосредованного эндоцитоза,
Интраназальный способ введения препа-
а также параклеточным или трансклеточным
ратов в настоящее время стал широко приме-
путями. Все эти пути объединяет способность
няться, в том числе в клинике для доставки
инсулина распространяться вдоль обонятель-
гормонов, ростовых факторов, синтетических
ного и тройничного нервов, по которым гор-
фармакологических препаратов, нуклеиновых
мон быстро распределяется в вентральном и
кислот и даже стволовых клеток [107]. Пре-
дорсальном направлениях. Максимальные зна-
имуществом интраназального введения является
чения концентрации инсулина через 15-30 мин
адресная доставка в мозг веществ, не имею-
после его введения обнаруживаются в обоня-
щих возможности эффективно проникать че-
тельных луковицах, стриатуме, черной суб-
рез ГЭБ вследствие размера, заряда или иных
станции, стволе мозга, мозжечке и в мень-
физико-химических особенностей их молекул,
ших количествах
- в гиппокампе и коре
а также имеющих низкую устойчивость в кро-
мозга [110, 111]. Содержание инсулина в мозге
ви, высокую иммуногенность, склонность к
постепенно снижается, но остается значимо
агрегации. Интраназальное введение обеспе-
повышенным через 6 ч после введения [110].
чивает высокую биодоступность препаратов
Увеличение концентрации инсулина законо-
для структур мозга, быстрое достижение тера-
мерно обнаруживается в спинномозговой жид-
певтического эффекта, обусловленного воз-
кости, при этом ИВИ заметно не снижает
действием на нейроны и глиальные клетки,
уровень глюкозы на периферии, т.е. лишен
отсутствие травматизации кожных покровов
выраженного гипогликемического эффекта,
и сосудов и удобство в применении по срав-
характерного для инъекционных форм гормо-
нению с пероральным и инъекционными спо-
на [111, 112].
собами введения. Важной особенностью ин-
Попадая в ЦНС, инсулин связывается
траназального введения является отсутствие
с INSR, что приводит к активации каскада
прохождения через печеночный барьер, что
IRS/PI3K/AKT и других сигнальных путей.
позволяет использовать существенно более низ-
Об этом свидетельствует увеличение содержа-
кие дозы препаратов и тем самым снижает их
ния Ser473-фосфорилированной формы AKT в
побочные эффекты [107]. Несомненным пре-
обонятельных луковицах, коре мозга, гиппо-
имуществом можно считать лояльность паци-
кампе и черной субстанции через 15-30 мин
ента к такой терапии, что особенно важно для
после интраназального введения гормона, за
пациентов пожилого возраста и для людей с
которым, однако, уже через 60 мин следует
когнитивными нарушениями.
снижение содержания активированной фор-
В настоящее время накоплено достаточно
мы AKT [110, 111].
данных по длительному применению интра-
В ряде исследований продемонстрирован
назально вводимого инсулина (ИВИ) у здоро-
защитный эффект интраназального введения
вых людей, и результаты проведенных иссле-
IGF-1 животным с очаговой и глобальной ише-
дований не вызывают опасений в отношении
мией [95, 113-118]. Их результаты обобщены
возможных нежелательных эффектов такой
в таблице. Так, Liu et al. [113, 114, 118] изучали
терапии. Напротив, большинство результатов
эффект различных доз интраназально вво-
указывает на положительное влияние ИВИ
димого IGF-1 (37,5; 75 и 150 мкг) на крысах с
на когнитивные функции и память [108, 109].
моделью окклюзии средней мозговой арте-
Длительная клиническая история примене-
рии (MCAO). IGF-1 был наиболее эффекти-
ния инсулина также является несомненным
вен в дозе 150 мкг, его введение вызывало
преимуществом. Более того, продемонстри-
уменьшение объема инфаркта мозга, улучшало
БИОХИМИЯ том 88 вып. 3 2023
ИНТРАНАЗАЛЬНЫЕ ИНСУЛИН И IGF-1 ПРИ ЦЕРЕБРАЛЬНОЙ ИШЕМИИ
465
Эффекты интраназально вводимых инсулина и IGF-1 при ишемии головного мозга
№
Схема введения
Вид животного
Эффекты
Ссылка
инсулин
инсулин (1,0 Ед./мышь) снижал смертность,
(0,5; 1,0 и 2,0 Ед./мышь)
мыши C57BL/6J
улучшал неврологические функции,
1
вводили дважды в день
(самцы,
уменьшал отек мозга и проницаемость
[122]
с 1-го дня после операции
6-8 недель)
гематоэнцефалического барьера,
и до конца
ослаблял постишемическую нейродегенерацию
0,5 Ед. инсулина/крыса
крысы Wistar
нормализация экспрессии генов каталазы,
2
однократно
(самцы,
супероксиддисмутазы 1-го и 2-го типов
[123]
за 1 ч до ишемии
3-4 месяца)
в коре мозга крыс после ишемии-реперфузии
инсулин (0,5 Ед./крыса) снижал показатели
крысы Wistar
0,25-0,5 Ед. инсулина/крыса
перекисного окисления липидов (ПОЛ),
3
(самцы,
[124]
однократно за 1 ч до ишемии
предотвращал снижение активности
3-4 месяца)
Na+/K+-ATPазы в коре мозга крыс
крысы Wistar
снижение показателей ПОЛ, увеличение уровня
0,5 Ед. инсулина/крыса
4
(самцы,
общего глутатиона в коре мозга контрольных
[125]
однократно за 1 ч до ишемии
3-4 месяца)
и ишемизированных крыс
снижение уровня оснований Шиффа,
крысы Wistar
повышение активности Na+/K+-ATPазы
0,25 Ед. инсулина/крыса
5
(самцы,
и экспрессии α2-субъединицы фермента
[126, 127]
однократно за 1 ч до ишемии
3-4 месяца)
в коре мозга крыс; инсулин и альфа-токоферол
усиливают защитное действие друг друга
крысы
37,5 и 150 мкг IGF-1/крыса,
обработка крыс 150 мкг IGF-1 снижала размер
Sprague-Dawley,
6
10 мин, 24 ч и 48 ч
инфаркта, улучшала моторные, сенсорные
[113]
(самцы, масса
после MCAO
и вестибулярные функции
250-303 г)
крысы
75 мкг/крыса IGF-1,
введение 75 мкг IGF-1 (суммарно 225 мкг IGF-1
Sprague-Dawley,
7
10 мин, 24 ч и 48 ч
в течение 48 ч) снижало объем инфаркта и отек
[114]
(самцы, масса
после MCAO
мозга и улучшало неврологические функции
243-280 г)
150 мкг/крыса IGF-1,
введение IGF-1 снижало размеры инфаркта
крысы
однократно
мозга через 2 и 4 ч после MCAO; введение
Sprague-Dawley,
8
через 2, 4 и 6 ч после MCAO.
через 6 ч после инсульта снижало некроз клеток;
[118]
(самцы, масса
Вторая доза - через 24 ч;
установлен размер терапевтического окна
242-290 г)
третья доза - через 48 ч
для интраназального IGF-1
введение IGF-1 сразу после и через 1 ч
50 мкг/крыса IGF-1
крысята
после гипоксии-ишемии снижало повреждение
сразу после гипоксии-
Sprague-Dawley
9
мозга, улучшало неврологические функции,
[95]
ишемии, через 1 или
7-го дня
выявлены антиапоптотический
через 2 ч
жизни (P7)
и пролиферативный эффекты
улучшение соматосенсорных и локомоторных
функций; при интраназальном пути доставки
показаны самые высокие концентрации
1 мкг/мышь IGF-1 сразу
мыши C57BL/6
10
и самые ранние пиковые концентрации
[115]
после начала реперфузии
(самцы, 20-25 г)
в мозге по сравнению с другими типами инъекций;
эритропоэтин и IGF-1 усиливали
действие друг друга
усиление нейрогенеза и ангиогенеза,
500 нг/мышь IGF-1 вводили
улучшение локального мозгового кровотока;
мыши C57BL/6
11
на 3, 5 и 7 дни после
IGF-1 усиливал действие мезенхимальных
[117]
(самцы)
окклюзии
стволовых клеток костного мозга
при их совместном интраназальном введении
Примечание. ПОЛ - перекисное окисление липидов; MCAO - модель окклюзии средней мозговой артерии (middle
cerebral artery occlusion).
8
БИОХИМИЯ том 88 вып. 3 2023
466
ЗОРИНА и др.
моторные, сенсорные, рефлекторные и вести-
Изучая нейропротекторные свойства ИВИ
буломоторные функции у крыс после двух-
при ишемии, китайские ученые осуществляли
часовой MCAO. В другой работе те же авторы
оптимизацию доз ИВИ, которые позволяют с
показали, что интраназальное введение IGF-1
наибольшей эффективностью восстанавливать
в суммарной дозе 225 мкг в течение 48 ч также
функции мозга при геморрагическом инсульте у
способствует уменьшению объема инфаркта
мышей [122]. Обнаружено, что ИВИ эффекти-
и отека полушарий, предотвращая неврологи-
вен в дозе 1,0 Ед./мышь, в то время как в более
ческий дефицит в условиях MCAO [114]. При
высокой дозе (2,0 Ед./мышь) он не продемон-
этом защитное действие IGF-1 сохранялось в
стрировал значимого ослабления нейродегене-
течение 6 ч после MCAO, что позволило оце-
ративных процессов. Защитный эффект инсу-
нить размер терапевтического окна для интра-
лина при ишемии был обусловлен активацией
назально вводимого IGF-1 [118].
им 3-фосфоинозитидного пути, включающего
Примечательно, что уровни IGF-1 в кро-
AKT и нижележащую GSK3β. Было высказано
ви и тканях снижаются с возрастом. В соот-
предположение, что инсулин регулирует крово-
ветствии с этим, основываясь на данных об
ток в сосудах головного мозга дозозависимо, и
отрицательной корреляции между уровнями
чрезмерное расширение сосудов в зоне гемор-
циркулирующего в крови IGF-1 и частотой
рагии при использовании его высоких доз мо-
инсульта головного мозга [119], можно предпо-
жет только усилить повреждение тканей мозга.
ложить, что неинвазивное введение IGF-1 по-
В этой связи необходимо отметить, что инсу-
жилым пациентам будет весьма эффективным
лин может оказывать на тонус сосудов разнона-
для предотвращения инсульта и ослабления
правленные влияния, выступая в качестве вазо-
его негативных последствий. Следует, однако,
дилататора [86] и вазоконстриктора [87].
отметить, что IGF-1, являясь мощным стиму-
Нами были проведены системные иссле-
лятором пролиферации клеток, характеризу-
дования эффективности ИВИ при ишемии
ется высоким онкогенным потенциалом и воз-
мозга, в том числе в условиях двухсторонней
можные последствия от его применения мало
глобальной ишемии переднего мозга [123-127].
изучены, в отличие от таковых для ИВИ.
Впервые было установлено, что ИВИ оказывает
Описанное положительное влияние интра-
антиоксидантное и нейропротекторное воздей-
назально вводимого IGF-1 на функции ЦНС
ствие на мозг ишемизированных крыс в дозах
у животных, подвергнутых ишемии-реперфу-
0,25 и 0,5 Ед. на крысу, а также предотвращает
зии, позволило высказать гипотезу о том, что
окислительную инактивацию Na+/K+-ATPазы,
нейропротекторный эффект в условиях ише-
препятствуя накоплению продуктов ПОЛ и по-
мического инсульта будет проявлять также
вышая уровень общего глутатиона в коре мозга
ИВИ [102]. Это предположение базируется как
крыс, перенесших ишемию-реперфузию. Анти-
на выявлении нейропротекторных, антиапоп-
оксидантное действие ИВИ на ткани мозга
тотических и противовоспалительных эффек-
осуществлялось на уровне регуляции экспрес-
тов ИВИ, полученных при его использовании
сии генов, кодирующих ферменты антиокси-
у животных с экспериментальными моделями
дантной защиты, что выражалось в ИВИ-инду-
нейродегенерации и в условиях клиники при
цированном повышении экспрессии генов,
лечении пациентов с болезнью Альцгейме-
кодирующих каталазу и супероксиддисмутазы
ра [120, 121], так и на сходстве молекулярных
1-го и 2-го типов в коре головного мозга [123].
механизмов и мишеней действия инсулина
Нормализация процесса ПОЛ может быть опо-
и IGF-1 в ЦНС [107]. Несмотря на обосно-
средована повышением под влиянием ИВИ
ванность и логичность этого предположения,
уровня общего глутатиона в мозге, который иг-
до настоящего времени работы, в которых
рает ключевую роль в антиоксидантной защите
изучали влияние ИВИ и его нейропротектор-
нейронов и глиальных клеток [125]. В пользу
ный эффект при ишемии головного мозга,
этого свидетельствует то, что в опытах in vitro
единичны. Среди них выполненное в 2022 г.
на первичной культуре нейронов коры мозга
исследование Zhu et al. [122], в котором ис-
другими авторами было показано, что инсу-
пользовали ИВИ для коррекции ишемиче-
лин способен повышать уровень общего глута-
ских повреждений при геморрагическом ин-
тиона как в контрольных клетках, так и в клет-
сульте у мышей, и наши работы 2018-2022 гг.,
ках, подвергнутых окислительному стрессу,
в которых изучалась способность ИВИ нор-
и в основе этого лежит усиление активности
мализовать метаболические процессы и
глутатионредуктазы и снижение активности
ослаблять окислительный стресс при двухсто-
глутатионпероксидазы [128]. Сходная ситуация
ронней глобальной ишемии переднего мозга
может реализовываться в мозге грызунов при
у крыс [123-127] (таблица).
ишемии-реперфузии головного мозга.
БИОХИМИЯ том 88 вып. 3 2023
ИНТРАНАЗАЛЬНЫЕ ИНСУЛИН И IGF-1 ПРИ ЦЕРЕБРАЛЬНОЙ ИШЕМИИ
467
В изученной нами модели ишемии-репер-
кожным или внутрибрюшинным способами
фузии выраженным защитным действием
введения IGF-1 [115]. Эти данные свидетель-
обладал инсулин в минимальной дозе 0,25 Ед.
ствуют о высокой биодоступности различных
на крысу [124, 126, 127], что значительно ниже
отделов мозга при интраназальном введении
эффективной дозы ИВИ, описанной в работе
пептидов инсулиновой группы, а также о более
Zhu et al. (1,0 Ед. на мышь) [122]. Стоит под-
высокой эффективности такого способа до-
черкнуть, что при внутривенном или подкож-
ставки инсулиновых пептидов в мозг в сравне-
ном введении инсулина его защитный эффект
нии с инъекционными способами.
проявлялся при значительно более высоких
дозах, составляющих 4 или даже 12 Ед./живот-
ное [89]. Используемые нами эффективные
ЗАКЛЮЧЕНИЕ
дозы ИВИ сопоставимы с таковыми при ин-
трацеребровентрикулярном введении гор-
Ишемия тканей головного мозга может
мона. В этой связи необходимо упомянуть тот
возникнуть при различных по этиологии и
факт, что ИВИ в дозах 0,25-0,5 Ед. на крысу
патогенезу заболеваниях и состояниях. Рез-
отчетливо восстанавливал метаболические и
кое снижение кровоснабжения и энергетиче-
гормональные показатели, а также когнитив-
ский дефицит в ткани мозга приводят к запу-
ные функции при экспериментальном са-
ску множества компенсаторных механизмов,
харном диабете [129-131] и метаболическом
направленных на поддержание, хотя бы вре-
синдроме [132].
менное, жизнеспособности нейронов и сни-
Исследования последних лет направлены
жение интенсивности провоспалительных и
на изучение возможного аддитивного дей-
апоптотических процессов в ЦНС. Важную
ствия ИВИ и интраназально вводимого IGF-1
роль в них играют сигнальные каскады, инду-
с другими потенциальными нейропротекто-
цированные широким спектром гормонов,
рами. Нами показано, что при совместном
ростовых факторов, цитокинов, наделенных
применении с α-токоферолом, биоактивным
свойствами нейропротекторов и нейромоду-
компонентом витамина Е, нейропротектор-
ляторов. Инсулин и IGF-1 можно рассматри-
ный эффект ИВИ усиливается, и это указывает
вать в качестве ключевых кандидатов на роль
на синергичность действия препаратов [126].
нейропротекторных и нейротрофических фак-
Иллюстрацией этого является значитель-
торов, защищающих мозг от повреждений и
ное повышение антиоксидантного эффекта
последующей лавинообразной нейродегене-
ИВИ в присутствии α-токоферола. Экспе-
рации при инсульте. Плейотропные эффекты,
рименты in vivo были подкреплены данными
реализуемые инсулином и IGF-1 в ЦНС, де-
in vitro по взаимному усилению нейропротек-
лают их участниками целого ряда патологиче-
торных эффектов инсулина и α-токоферола
ских и регенерационных процессов, которые
в первичной культуре кортикальных нейро-
разворачиваются сразу после ишемического
нов, подвергнутых окислительному стрессу,
инсульта. Характерная для инсулина и IGF-1
индуцированному перекисью водорода [126].
множественность действий становится их не-
Fletcher et al. [115] показали, что интраназаль-
оспоримым преимуществом по сравнению со
но вводимый цитокин эритропоэтин оказы-
многими другими нейропротекторами, дей-
вает мощный нейропротекторный эффект на
ствие которых направлено на конкретные зве-
структуры мозга в случае его совместного при-
нья патологических процессов и регуляторных
менения с IGF-1 при ишемическом инсульте.
каскадов. Вследствие этого применение та-
Об этом свидетельствует значимое уменьшение
ких узконаправленных, высокоспецифичных
объема инфаркта мозга и улучшение невроло-
нейропротекторов характеризуется их низкой
гической функции у мышей в течение 90 дней
эффективностью в условиях, когда вследствие
после окклюзии средней мозговой артерии.
массовой гибели нейронов и глиальных кле-
Изучение распределения [125I] IGF-1 после его
ток после ишемии нарушаются множествен-
интраназального введения в ишемизирован-
ные интегративные взаимосвязи между раз-
ном мозге позволило установить, что этот ро-
личными сигнальными путями и процессами,
стовой фактор обнаруживается в ишемической
а запуск программы восстановления функций
зоне мозга всего через 20 мин после введения
ЦНС требуют согласованной их коррекции.
и в дальнейшем накапливается в ней. И, что
Можно полагать, что инсулин и его функцио-
особенно важно, при интраназальном введе-
нальный гомолог IGF-1 в этом случае могут
нии достигается более высокий уровень IGF-1
стать незаменимыми.
в мозге как здоровых, так и ишемизированных
Инсулин и IGF-1 присутствуют в ЦНС на
животных по сравнению с внутривенным, под-
протяжении всего онтогенеза и даже, в случае
БИОХИМИЯ том 88 вып. 3 2023
8*
468
ЗОРИНА и др.
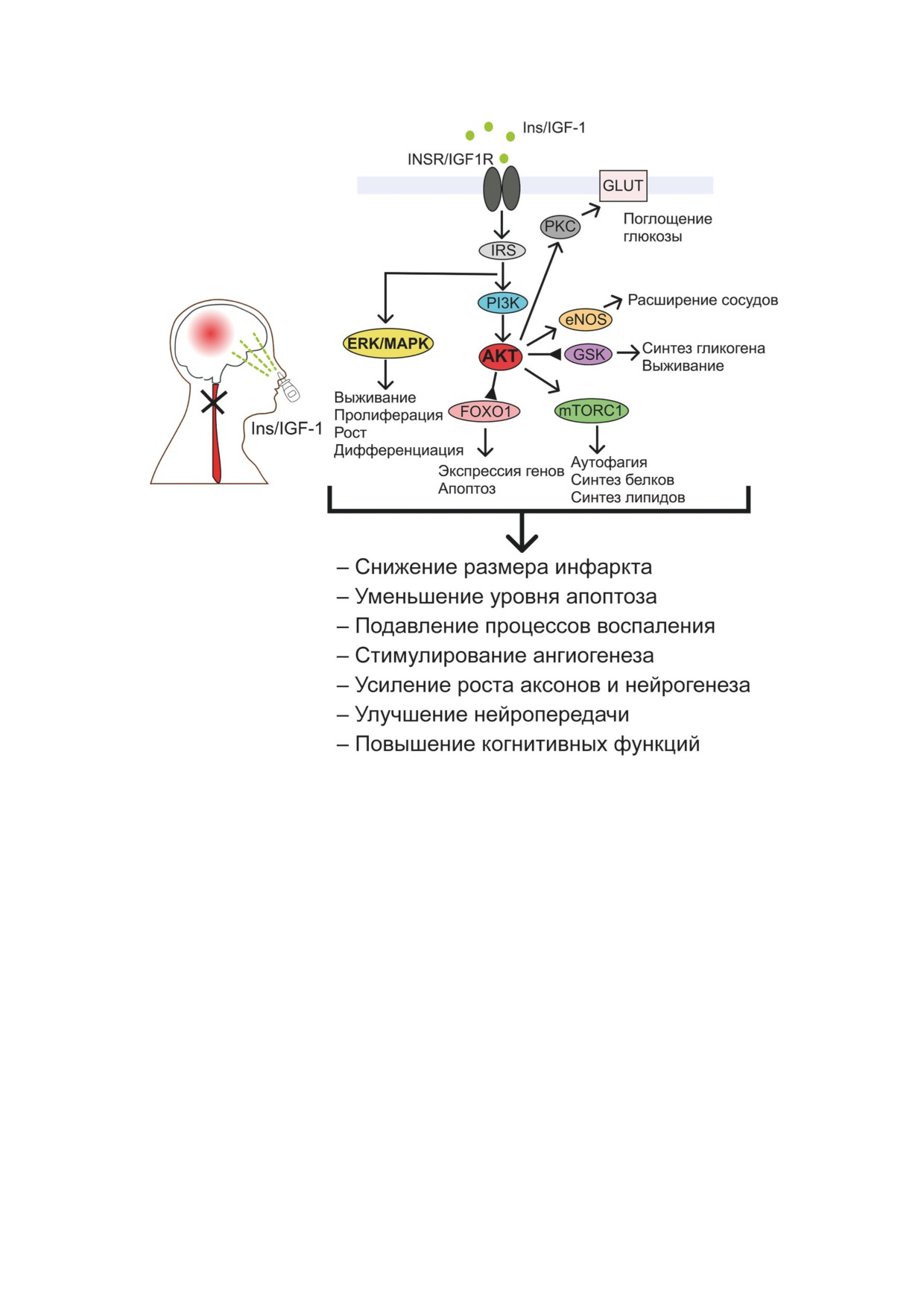
Рис. 2. Молекулярные и физиологические эффекты интраназально вводимых инсулина и IGF-1 при ишемии голов-
ного мозга. Ins - инсулин; IGF-1 - инсулиноподобный фактор роста-1; INSR - рецептор инсулина; IGF1R - рецептор
IGF-1; IRS - белки-субстраты рецептора инсулина; PI3K - фосфатидилинозитол-3-киназа; PKC - протеинкиназа С;
GLUT - инсулин-зависимый глюкозный транспортер; AKT - протеинкиназа B; GSK3 - киназа-3 гликогенсинтазы;
FOXO1 - транскрипционный фактор O1 семейства Forkhead; mTORC1 - мишень рапамицинового комплекса 1 млеко-
питающих; ERK/MAPK - митогенактивируемые протеинкиназы; eNOS - эндотелиальная форма NO-синтазы
инсулина, могут вырабатываться в мозге на
Естественность и безопасность терапии
ранних стадиях развития организма. Тем са-
ИВИ основывается на большом положитель-
мым они не являются чужеродными молеку-
ном опыте его применения при лечении бо-
лами для мозга, и потому их введение можно
лезни Альцгеймера и некоторых других нейро-
рассматривать как естественный процесс вос-
дегенеративных заболеваний, а также при
становления зависимых от них физиологиче-
коррекции сахарного диабета, травм головно-
ских процессов, в отличие, например, от вве-
го мозга и других патологических состояниях
дения многих регуляторных молекул, в том
нервной системы. Преимуществами интра-
числе синтетических, которые могут взаимо-
назального способа доставки является безбо-
действовать с нецелевыми мишенями и тем
лезненность, отсутствие необходимости в спе-
самым необратимо менять жизненно важные
циальном оборудовании или стерилизации.
функции мозга. Одним из наиболее эффек-
Интраназальное введение позволяет доста-
тивных способов доставки инсулина и IGF-1
вить препарат непосредственно в мозг неин-
в мозг является интраназальный способ их
вазивно и быстрее, чем при периферическом
введения (рис. 2).
способе введения. Такое введение улучшает
БИОХИМИЯ том 88 вып. 3 2023
ИНТРАНАЗАЛЬНЫЕ ИНСУЛИН И IGF-1 ПРИ ЦЕРЕБРАЛЬНОЙ ИШЕМИИ
469
проникновение препарата в ЦНС, минуя ГЭБ,
торных препаратов для лечения инсульта [133].
а предотвращение биодеградации препарата
Эти рекомендации включают изучение дозо-
в печени и почках, а также отсутствие риска
зависимого эффекта препаратов и длитель-
иммунной реакции на него заметно снижают
ности терапевтического окна, необходимость
фармакологически релевантную дозу и умень-
проверки на различных моделях ишемии и
шают вероятность побочных эффектов [107].
ишемии-реперфузии, использование несколь-
При интраназальном пути доставки не наблю-
ких видов животных (грызуны, кошки, при-
дается проникновения препарата в системный
маты), изучение влияния возраста, пола и
кровоток, что особенно важно при использо-
других факторов. Таким образом, в настоящее
вании инсулина, поскольку позволяет пред-
время существует значимый пробел в области
отвратить риск развития опасной для жизни
фармакологии и фармакокинетики ИВИ и
гипогликемии [108, 110]. В случае IGF-1 ин-
интраназально вводимого IGF-1 при лечении
траназальное введение позволяет избежать не-
инсульта, несмотря на их потенциальную эф-
посредственного воздействия этого мощного
фективность и безопасность. Именно поэтому
митогена на периферические ткани и тем са-
необходимы дальнейшие исследования на жи-
мым минимизирует его возможный онкоген-
вотных моделях, которые позволят получить
ный потенциал.
убедительные доказательства эффективности
Cуществующие исследования ИВИ и ин-
ИВИ и интраназально вводимого IGF-1 в ка-
траназально вводимого IGF-1, однако, не ли-
честве нейропротекторов при инсульте и ише-
шены недостатков. Большинство из них про-
мии головного мозга.
ведены с использованием здоровых взрос-
лых, не сенильного возраста, не имеющих
Вклад авторов. И.И.З., И.О.З. - анализ лите-
коморбидных заболеваний, не страдающих
ратуры, написание текста статьи, подготовка ил-
атеросклерозом, сахарным диабетом или
люстраций; А.О.Ш., Н.Ф.А. - концептуализация,
гипертонией, т.е. не имеющих выраженной
редактирование текста статьи, руководство.
предрасположенности к инсульту. Как отме-
Финансирование. Работа выполнена в рам-
чалось выше, имеется положительная взаимо-
ках государственного задания ИЭФБ РАН
связь между тяжестью и продолжительностью
№ 075-00967-23-00.
этих патологических состояний и повышен-
Конфликт интересов. Авторы заявляют об
ным риском возникновения инсульта
[45].
отсутствии конфликта интересов.
Ассоциацией STAIR (Stroke Treatment Acad-
Соблюдение этических норм. Настоящая
emic Industry Roundtable) опубликованы ре-
статья не содержит описания каких-либо ис-
комендации, которых необходимо придержи-
следований с участием людей или животных в
ваться при поиске и валидации нейропротек-
качестве объектов.
СПИСОК ЛИТЕРАТУРЫ
1. Soto, M., Cai, W., Konishi, M., and Kahn, C. R.
5. Devaskar, S. U., Giddings, S. J., Rajakumar, P. A.,
(2019) Insulin signaling in the hippocampus and
Carnaghi, L. R., Menon, R. K., and Zahm, D. S.
amygdala regulates metabolism and neurobehavior,
(1994) Insulin gene expression and insulin synthesis in
Proc. Natl. Acad. Sci. USA,
116,
6379-6384,
mammalian neuronal cells, J. Biol. Chem., 269, 8445-
doi: 10.1073/pnas.1817391116.
8454, doi: 10.1016/S0021-9258(17)37214-9.
2. Havrankova, J., Roth, J., and Brownstein, M. J. (1979)
6. Devaskar, S. U., Singh, B. S., Carnaghi, L. R.,
Concentrations of insulin and insulin receptors in the
Rajakumar, P. A., and Giddings, S. J. (1993) In-
brain are independent of peripheral insulin levels.
sulin II gene expression in rat central nervous sys-
Studies of obese and streptozotocin-treated rodents,
tem, Regul. Pept., 48, 5563, doi: 10.1016/0167-0115
J. Clin. Invest., 64, 636-642, doi: 10.1172/JCI109504.
(93)90335-6.
3. Rhea, E. M., and Banks, W. A. (2019) Role of the
7. Schechter, R., Whitmire, J., Wheet, G.S., Beju, D.,
blood-brain barrier in central nervous system insulin
Jackson, K. W., Harlow, R., and Gavin, J. R., 3rd
resistance, Front. Neurosci., 13, 521, doi: 10.3389/
(1994) Immunohistochemical and in situ hybridization
fnins.2019.00521.
study of an insulin-like substance in fetal neuron
4. Beddows, C. A., and Dodd, G. T. (2021) Insulin on
cell cultures, Brain Res., 636, 9-27, doi: 10.1016/
the brain: The role of central insulin signalling in
0006-8993(94)90170-8.
energy and glucose homeostasis, J. Neuroendocrinol.,
8. Gerozissis, K.
(2008) Brain insulin, energy and
33, e12947, doi: 10.1111/jne.12947.
glucose homeostasis; genes, environment and
БИОХИМИЯ том 88 вып. 3 2023
470
ЗОРИНА и др.
metabolic pathologies, Eur. J. Pharmacol., 585, 38-49,
20.
Levenga, J., Wong, H., Milstead, R. A., LaPlante, L. E.,
doi: 10.1016/j.ejphar.2008.01.050.
Hoeffer, C. A. (2021) Immunohistological examination
9.
Havrankova, J., Roth, J., and Brownstein, M. (1978)
of AKT isoforms in the brain: cell-type specificity that
Insulin receptors are widely distributed in the central
may underlie AKT’s role in complex brain disorders
nervous system of the rat, Nature, 272, 827-829,
and neurological disease, Cereb. Cortex Commun., 2,
doi: 10.1038/272827a0.
tgab036, doi: 10.1093/texcom/tgab036.
10.
Escribano, O., Beneit, N., Rubio-Longás, C., López-
21.
Manning, B. D., and Toker, A. (2017) AKT/PKB
Pastor, A. R., and Gómez-Hernández, A.
(2017)
signaling: navigating the network, Cell, 169, 381-405,
The role of insulin receptor isoforms in diabetes and its
doi: 10.1016/j.cell.2017.04.001.
metabolic and vascular complications, J. Diabetes Res.,
22.
Hemmings, B. A., and Restuccia, D. F. (2012) PI3K-
2017, 1403206, doi: 10.1155/2017/1403206.
PKB/Akt pathway, Cold Spring Harb. Perspect. Biol.,
11.
De Meyts, P. (2008) The insulin receptor: a proto-
4, a011189, doi: 10.1101/cshperspect.a011189. Erratum
type for dimeric, allosteric membrane receptors?
in: (2015) Cold Spring Harb. Perspect. Biol., 7, a026609,
Trends Biochem. Sci.,
33,
376-384, doi:
10.1016/
doi: 10.1101/cshperspect.a026609.
j.tibs.2008.06.003.
23.
McCubrey, J. A., Steelman, L. S., Bertrand, F. E.,
12.
Belfiore, A., Frasca, F., Pandini, G., Sciacca, L.,
Davis, N. M., Sokolosky, M., Abrams, S. L., Mon-
and Vigneri, R. (2009) Insulin receptor isoforms and
talto, G., D’Assoro, A. B., Libra, M., Nicoletti, F.,
insulin receptor/insulin-like growth factor receptor
Maestro, R., Basecke, J., Rakus, D., Gizak, A.,
hybrids in physiology and disease, Endocr. Rev., 30,
Demidenko, Z. N., Cocco, L., Martelli, A. M., and
586-623, doi: 10.1210/er.2008-0047.
Cervello, M. (2014) GSK-3 as potential target for ther-
13.
White, M. F., and Kahn, C. R. (2021) Insulin action at
apeutic intervention in cancer, Oncotarget, 5, 2881-
a molecular level - 100 years of progress, Mol. Metab.,
2911, doi: 10.18632/oncotarget.2037.
52, 101304, doi: 10.1016/j.molmet.2021.101304.
24.
Beurel, E., Grieco, S. F., and Jope, R. S.
(2015)
14.
Copps, K. D., and White, M. F. (2012) Regulation of
Glycogen synthase kinase-3 (GSK3): regulation,
insulin sensitivity by serine/threonine phosphoryla-
actions, and diseases, Pharmacol. Ther., 148, 114-131,
tion of insulin receptor substrate proteins IRS1 and
doi: 10.1016/j.pharmthera.2014.11.016.
IRS2, Diabetologia,
55,
2565-2582, doi:
10.1007/
25.
Brown, A. K., and Webb, A. E. (2018) Regulation of
s00125-012-2644-8.
FOXO factors in mammalian cells, Curr. Top. Dev.
15.
Razzini, G., Ingrosso, A., Brancaccio, A.,
Biol., 127, 165-192, doi: 10.1016/bs.ctdb.2017.10.006.
Sciacchitano, S., Esposito, D. L., and Falasca, M.
26.
Ghasemi, R., Haeri, A., Dargahi, L., Mohamed, Z.,
(2000)
Different subcellular localization and
and Ahmadiani, A. (2013) Insulin in the brain: sources,
phosphoinositides binding of insulin receptor
localization and functions, Mol. Neurobiol., 47, 145-
substrate protein pleckstrin homology domains,
171, doi: 10.1007/s12035-012-8339-9.
Mol. Endocrinol.,
14,
823-836, doi:
10.1210/
27.
Wang, X., and Proud, C. G. (2006) The mTOR
mend.14.6.0486.
pathway in the control of protein synthesis,
16.
Aguirre, V., Werner, E. D., Giraud, J., Lee, Y. H.,
Physiology (Bethesda),
21,
362-369, doi:
10.1152/
Shoelson, S. E., and White, M. F. (2002) Phosphor-
physiol.00024.2006.
ylation of Ser307 in insulin receptor substrate-1 blocks
28.
Stoica, L., Zhu, P. J., Huang, W., Zhou, H.,
interactions with the insulin receptor and inhibits insu-
Kozma, S. C., and Costa-Mattioli, M. (2011) Selective
lin action, J. Biol. Chem., 277, 1531-1537, doi: 10.1074/
pharmacogenetic inhibition of mammalian target
jbc.M101521200.
of Rapamycin complex I (mTORC1) blocks long-
17.
Bakke, J., and Haj, F. G. (2015) Protein-tyrosine
term synaptic plasticity and memory storage, Proc.
phosphatase 1B substrates and metabolic regulation,
Natl. Acad. Sci. USA, 108, 3791-3796, doi: 10.1073/
Semin. Cell Dev. Biol.,
37,
58-65, doi:
10.1016/
pnas.1014715108.
j.semcdb.2014.09.020.
29.
Trueba-Saiz, A., Fernandez, A. M., Nishijima, T.,
18.
Dodd, G. T., Xirouchaki, C. E., Eramo, M., Mitch-
Mecha, M., Santi, A., Munive, V., and Aleman, I. T.
ell, C. A., Andrews, Z. B., Henry, B. A., Cow-
(2017) Circulating insulin-like growth factor I regulates
ley, M. A., and Tiganis, T. (2019) Intranasal target-
its receptor in the brain of male mice, Endocrinology,
ing of hypothalamic PTP1B and TCPTP reinstates
158, 349-355, doi: 10.1210/en.2016-1468.
leptin and insulin sensitivity and promotes weight loss
30.
Baker, A. M., Batchelor, D. C., Thomas, G. B.,
in obesity, Cell Rep., 28, 2905-2922.e5, doi: 10.1016/
Wen, J. Y., Rafiee, M., Lin, H., and Guan, J. (2005)
j.celrep.2019.08.019.
Central penetration and stability of N-terminal
19.
Vanhaesebroeck, B., Guillermet-Guibert, J., Grau-
tripeptide of insulin-like growth factor-I, glycine-
pera, M., and Bilanges, B. (2010) The emerging
proline-glutamate in adult rat, Neuropeptides, 39, 81-
mechanisms of isoform-specific PI3K signalling,
87, doi: 10.1016/j.npep.2004.11.001.
Nat. Rev. Mol. Cell Biol., 11, 329-341, doi: 10.1038/
31.
Guan, J. (2011) Insulin-like growth factor-1 (IGF-1)
nrm2882.
derived neuropeptides, a novel strategy for the
БИОХИМИЯ том 88 вып. 3 2023
ИНТРАНАЗАЛЬНЫЕ ИНСУЛИН И IGF-1 ПРИ ЦЕРЕБРАЛЬНОЙ ИШЕМИИ
471
development of pharmaceuticals for managing
penumbral tissues in rats subjected to transient middle
ischemic brain injury, CNS Neurosci. Ther., 17, 250-
cerebral artery occlusion, Exp. Brain Res., 120, 503-
255, doi: 10.1111/j.1755-5949.2009.00128.x.
509, doi: 10.1007/s002210050424.
32.
Lewitt, M. S., and Boyd, G. W. (2019) The role
44.
Dirnagl, U., Iadecola, C., and Moskowitz, M. A.
of insulin-like growth factors and insulin-like
(1999) Pathobiology of ischaemic stroke: an integrated
growth factor-binding proteins in the nervous
view, Trends Neurosci., 22, 391-397, doi: 10.1016/
system, Biochem. Insights,
12,
1178626419842176,
s0166-2236(99)01401-0.
doi: 10.1177/1178626419842176.
45.
Khoshnam, S. E., Winlow, W., Farzaneh, M.,
33.
Rotwein, P., Burgess, S. K., Milbrandt, J. D., and
Farbood, Y., and Moghaddam, H. F.
(2017)
Krause, J. E. (1988) Differential expression of insulin-
Pathogenic mechanisms following ischemic stroke,
like growth factor genes in rat central nervous system,
Neurol. Sci.,
38,
1167-1186, doi:
10.1007/s10072-
Proc. Natl. Acad. Sci. USA, 85, 265-269, doi: 10.1073/
017-2938-1.
pnas.85.1.265.
46.
George, P. M., and Steinberg, G. K. (2015) Novel
34.
Whittaker, J., Groth, A. V., Mynarcik, D. C., Plu-
stroke therapeutics: unraveling stroke pathophysiology
zek, L., Gadsbøll, V. L., and Whittaker, L. J. (2001)
and its impact on clinical treatments, Neuron, 87,
Alanine scanning mutagenesis of a type 1 insulin-
297-309, doi: 10.1016/j.neuron.2015.05.041.
like growth factor receptor ligand binding site,
47.
Zhang, F. X., Rubin, R., and Rooney, T. A. (1998)
J. Biol. Chem.,
276,
43980-43986, doi:
10.1074/
N-methyl-D-aspartate inhibits apoptosis through
jbc.M102863200.
activation of phosphatidylinositol 3-kinase in cere-
35.
Drakas, R., Tu, X., and Baserga, R. (2004) Control of
bellar granule neurons - a role for insulin receptor
cell size through phosphorylation of upstream binding
substrate-1 in the neurotrophic action of N-meth-
factor 1 by nuclear phosphatidylinositol 3-kinase, Proc.
yl-D-aspartate and its inhibition by ethanol, J. Biol.
Natl. Acad. Sci. USA, 101, 9272-9276, doi: 10.1073/
Chem.,
273,
26596-26602, doi:
10.1074/jbc.273.
pnas.0403328101.
41.26596.
36.
Shpakov, A. O., Derkach, K. V., and Berstein, L. M.
48.
Endo, H., Nito, C., Kamada, H., Nishi, T., and
(2015) Brain signaling systems in the type 2 diabetes
Chan, P. H. (2006) Activation of the Akt/GSK3beta
and metabolic syndrome: promising target to treat
signaling pathway mediates survival of vulnerable
and prevent these diseases, Future Sci. OA, 1, FSO25,
hippocampal neurons after transient global cerebral
doi: 10.4155/fso.15.23.
ischemia in rats, J. Cereb. Blood Flow Metab., 26,
37.
Yuan, H., Chen, R., Wu, L., Chen, Q., Hu, A.,
1479-1489, doi: 10.1038/sj.jcbfm.9600303.
Zhang, T., Wang, Z., and Zhu, X. (2015) The regulatory
49.
Soriano, F. X., Papadia, S., Hofmann, F., Harding-
mechanism of neurogenesis by IGF-1 in adult
ham, N. R., Bading, H., and Hardingham, G. E.
mice, Mol. Neurobiol., 51, 512-522, doi: 10.1007/
(2006) Preconditioning doses of NMDA promote neu-
s12035-014-8717-6.
roprotection by enhancing neuronal excitability, J. Neu-
38.
Agis-Balboa, R. C., and Fischer, A. (2014) Generating
rosci.,
26,
4509-4518, doi:
10.1523/JNEUROSCI.
new neurons to circumvent your fears: the role of IGF
0455-06.2006.
signaling, Cell Mol. Life Sci., 71, 21-42, doi: 10.1007/
50.
Qin, C., Yang, S., Chu, Y. H., Zhang, H., Pang, X. W.,
s00018-013-1316-2.
Chen, L., Zhou, L. Q., Chen, M., Tian, D. S.,
39.
Gubbi, S., Quipildor, G. F., Barzilai, N., Huff-
and Wang, W. (2022) Signaling pathways involved
man, D. M., and Milman, S. (2018) 40 YEARS of
in ischemic stroke: molecular mechanisms and
IGF1: IGF1: the Jekyll and Hyde of the aging brain,
therapeutic interventions, Signal Transduct. Target.
J. Mol. Endocrinol., 61, T171-T185, doi: 10.1530/
Ther.,
7,
215, doi:
10.1038/s41392-022-01064-1.
JME-18-0093.
Erratum in: Signal Transduct. Target. Ther., 7, 278.
40.
Wrigley, S., Arafa, D., and Tropea, D. (2017) Insulin-
51.
Ahad, M. A., Kumaran, K. R., Ning, T., Mansor, N. I.,
like growth factor
1: at the crossroads of brain
Effendy, M. A., Damodaran, T., Lingam, K., Wa-
development and aging, Front. Cell Neurosci., 11, 14,
hab, H. A., Nordin, N., Liao, P., Müller, C. P., and
doi: 10.3389/fncel.2017.00014.
Hassan, Z. (2020) Insights into the neuropathology of
41.
Memezawa, H., Minamisawa, H., Smith, M. L., and
cerebral ischemia and its mechanisms, Rev. Neurosci.,
Siesjö, B. K. (1992) Ischemic penumbra in a model of
31, 521-538, doi: 10.1515/revneuro-2019-0099.
reversible middle cerebral artery occlusion in the rat,
52.
Semenza, G. L. (2009) Regulation of oxygen homeo-
Exp. Brain Res., 89, 67-78, doi: 10.1007/BF00229002.
stasis by hypoxia-inducible factor 1, Physiology (Bethes-
42.
Gidö, G., Kristián, T., and Siesjö, B. K.
(1997)
da), 24, 97-106, doi: 10.1152/physiol.00045.2008.
Extracellular potassium in a neocortical core area
53.
Sharp, F., and Bernaudin, M. (2004) HIF1 and oxygen
after transient focal ischemia, Stroke, 28, 206-210,
sensing in the brain, Nat. Rev. Neurosci., 5, 437-448,
doi: 10.1161/01.str.28.1.206.
doi: 10.1038/nrn1408.
43.
Kristián, T., Gidö, G., Kuroda, S., Schütz, A., and
54.
Zhang, Z., Yao, L., Yang, J., Wang, Z., and Du, G.
Siesjö, B. K. (1998) Calcium metabolism of focal and
(2018) PI3K/Akt and HIF 1 signaling pathway in
БИОХИМИЯ том 88 вып. 3 2023
472
ЗОРИНА и др.
hypoxia ischemia (Review), Mol. Med. Rep., 18, 3547-
65.
Piironen, K., Putaala, J., Rosso, C., and Samson, Y.
3554, doi: 10.3892/mmr.2018.9375.
(2012) Glucose and acute stroke: evidence for
55.
Sanderson, T. H., Reynolds, C. A., Kumar, R.,
an interlude, Stroke,
43,
898-902, doi:
10.1161/
Przyklenk, K., and Hüttemann, M. (2013) Molecular
STROKEAHA.111.631218.
mechanisms of ischemia-reperfusion injury in
66.
Saxena, A., Anderson, C. S., Wang, X., Sato, S.,
brain: pivotal role of the mitochondrial membrane
Arima, H., Chan, E., Muñoz-Venturelli, P., Del-
potential in reactive oxygen species generation,
court, C., Robinson, T., Stapf, C., Lavados, P. M.,
Mol. Neurobiol.,
47,
9-23, doi:
10.1007/s12035-
Wang, J., Neal, B., Chalmers, J., and Heeley, E.
012-8344-z.
(2016) INTERACT2 Investigators. Prognostic signif-
56.
Wardlaw, J. M., Murray, V., Berge, E., and del Zoppo,
icance of hyperglycemia in acute intracerebral hemor-
G. J. (2014) Thrombolysis for acute ischaemic stroke,
rhage: The INTERACT2 study, Stroke, 47, 682-688,
Cochrane Database Syst. Rev.,
2014, CD000213,
doi: 10.1161/STROKEAHA.115.011627.
doi: 10.1002/14651858.CD000213.pub3.
67.
Voll, C. L., and Auer, R. N. (1988) The effect of
57.
Федеральные клинические рекомендации по веде-
postischemic blood glucose levels on ischemic
нию больных (2022) Ишемический инсульт и тран-
brain damage in the rat, Ann. Neurol., 24, 638-646,
зиторная ишемическая атака у взрослых, Москва.
doi: 10.1002/ana.410240508.
58.
Emberson, J., Lees, K. R., Lyden, P., Blackwell, L.,
68.
Voll, C. L., Whishaw, I. Q., and Auer, R. N. (1989)
Albers, G., Bluhmki, E., Brott, T., Cohen, G., Davis, S.,
Postischemic insulin reduces spatial learning deficit
Donnan, G., Grotta, J., Howard, G., Kaste, M.,
following transient forebrain ischemia in rats, Stroke,
Koga, M., von Kummer, R., Lansberg, M., Lindley, R. I.,
20, 646-651, doi: 10.1161/01.str.20.5.646. Erratum in:
Murray, G., Olivot, J. M., Parsons, M., Tilley, B.,
(1989), Stroke, 20, 1118.
Toni, D., Toyoda, K., Wahlgren, N., Wardlaw, J.,
69.
Hamilton, M. G., Tranmer, B. I., and Auer, R. N.
Whiteley, W., del Zoppo, G. J., Baigent, C., Sander-
(1995) Insulin reduction of cerebral infarction due to
cock, P., and Hacke, W. (2014) Stroke Thrombolysis
transient focal ischemia, J. Neurosurg., 82, 262-268,
Trialists’ Collaborative Group. Effect of treatment
doi: 10.3171/jns.1995.82.2.0262.
delay, age, and stroke severity on the effects of intra-
70.
Warner, D. S., Gionet, T. X., Todd, M. M.,
venous thrombolysis with alteplase for acute isch-
and McAllister, A. M.
(1992) Insulin-induced
aemic stroke: a meta-analysis of individual patient
normoglycemia improves
ischemic outcome in
data from randomised trials, Lancet, 384, 1929-1935,
hyperglycemic rats, Stroke, 23, 1775-1780, discussion
doi: 10.1016/S0140-6736(14)60584-5.
1781, doi: 10.1161/01.str.23.12.1775.
59.
Guekht, A., Skoog, I., Edmundson, S., Zakharov, V.,
71.
Guyot, L. L., Diaz, F. G., O’Regan, M. H., Ren,
and Korczyn, A. D. (2017) ARTEMIDA Trial (a
J., and Phillis, J. W. (2000) The effect of intrave-
Randomized Trial of Efficacy, 12 Months International
nous insulin on accumulation of excitotoxic and
Double-Blind Actovegin): A randomized controlled
other amino acids in the ischemic rat cerebral cor-
trial to assess the efficacy of actovegin in poststroke
tex, Neurosci. Lett.,
288,
61-65, doi:
10.1016/
cognitive impairment, Stroke,
48,
1262-1270,
s0304-3940(00)01168-x.
doi: 10.1161/STROKEAHA.116.014321.
72.
Fukuoka, S., Yeh, H., Mandybur, T. I., and Tew, J.
60.
Zhang, C., and Yan, C. (2020) Updates of recent
M. Jr. (1989) Effect of insulin on acute experimental
vinpocetine research in treating cardiovascular
cerebral ischemia in gerbils, Stroke, 20, 396-399,
diseases, J. Cell Immunol., 2, 211-219, doi: 10.33696/
doi: 10.1161/01.str.20.3.396.
immunology.2.045.
73.
Meden, P., Andersen, M., Overgaard, K., Rasmus-
61.
Gusev, E. I., Skvortsova, V. I., and Chukanova, E. I.
sen, R. S., and Boysen, G. (2002) The effects of early
(2005) Semax in prevention of disease progress
insulin treatment combined with thrombolysis in rat
and development of exacerbations in patients with
embolic stroke, Neurol. Res., 24, 399-404, doi: 10.1179/
cerebrovascular insufficiency
[in Russian], Zhurn.
016164102101200096.
Nevrol. Psikhiatr. Im. S. S. Korsakova, 105, 35-40.
74.
Huang, S. S., Lu, Y. J., Huang, J. P., Wu, Y. T.,
62.
Melamed, E.
(1976) Reactive hyperglycaemia in
Day, Y. J., and Hung, L. M. J. (2014) The essen-
patients with acute stroke, J. Neurol. Sci., 29, 267-275,
tial role of endothelial nitric oxide synthase activa-
doi: 10.1016/0022-510x(76)90176-3.
tion in insulin-mediated neuroprotection against is-
63.
Capes, S. E., Hunt, D., Malmberg, K., Pathak, P.,
chemic stroke in diabetes, Vasc. Surg., 59, 483-491,
and Gerstein, H. C. (2001) Stress hyperglycemia
doi: 10.1016/j.jvs.2013.03.023.
and prognosis of stroke in nondiabetic and diabetic
75.
Izumi, Y., Pinard, E., Roussel, S., and Seylaz, J. (1992)
patients: a systematic overview, Stroke, 32, 2426-2432,
Insulin protects brain tissue against focal ischemia
doi: 10.1161/hs1001.096194.
in rats, Neurosci. Lett., 144, 121-123, doi: 10.1016/
64.
Zhang, Z., Yan, J., and Shi, H. (2013) Hyperglycemia
0304-3940(92)90730-u.
as a risk factor of ischemic stroke, J. Drug Metab.
76.
Fanne, R. A., Nassar, T., Heyman, S. N., Hijazi, N.,
Toxicol., 4, 153, doi: 10.4172/2157-7609.1000153.
and Higazi, A. A. (2011) Insulin and glucagon share
БИОХИМИЯ том 88 вып. 3 2023
ИНТРАНАЗАЛЬНЫЕ ИНСУЛИН И IGF-1 ПРИ ЦЕРЕБРАЛЬНОЙ ИШЕМИИ
473
the same mechanism of neuroprotection in diabetic
Biochim. Biophys. Acta, 1862, 983-991, doi: 10.1016/j.
rats: role of glutamate, Am. J. Physiol. Regul. Integr.
bbadis.2015.11.013.
Comp. Physiol.,
301, R668-R673, doi:
10.1152/
87.
Muniyappa, R., and Yavuz, S.
(2013) Metabolic
ajpregu.00058.2011.
actions of angiotensin II and insulin: a microvascular
77.
Voll, C. L., and Auer, R. N.
(1991) Insulin
endothelial balancing act, Mol. Cell Endocrinol., 378,
attenuates ischemic brain damage independent of its
59-69, doi: 10.1016/j.mce.2012.05.017.
hypoglycemic effect, J. Cereb. Blood Flow Metab., 11,
88.
McKay, M. K., and Hester, R. L. (1996) Role of
1006-1014, doi: 10.1038/jcbfm.1991.168.
nitric oxide, adenosine, and ATP-sensitive potassium
78.
Guan, J., Williams, C., Gunning, M., Mallard, C., and
channels in insulin-induced vasodilation, Hypertension,
Gluckman, P. (1993) The effects of IGF-1 treatment
28, 202-208, doi: 10.1161/01.hyp.28.2.202.
after hypoxic-ischemic brain injury in adult rats,
89.
Hung, L. M., Huang, J. P., Liao, J. M., Yang, M. H.,
J. Cereb. Blood Flow Metab., 13, 609-616, doi: 10.1038/
Li, D. E., Day, Y. J., and Huang, S. S. (2014) Insulin
jcbfm.1993.79.
renders diabetic rats resistant to acute ischemic stroke
79.
Zhu, C. Z., and Auer, R. N. (1994) Intraventricular
by arresting nitric oxide reaction with superoxide
administration of insulin and IGF-1 in transient
to form peroxynitrite, J. Biomed. Sci.,
21,
92,
forebrain ischemia, J. Cereb. Blood Flow Metab., 14,
doi: 10.1186/s12929-014-0092-0.
237-242, doi: 10.1038/jcbfm.1994.30.
90.
Beilharz, E. J., Russo, V. C., Butler, G., Baker, N. L.,
80.
Russo, V., Candeloro, P., Malara, N., Perozziello, G.,
Connor, B., Sirimanne, E. S., Dragunow, M.,
Iannone, M., Scicchitano, M., Mollace, R., Muso-
Werther, G. A., Gluckman, P. D., Williams, C. E., and
lino, V., Gliozzi, M., Carresi, C., Morittu, V. M.,
Scheepens, A. (1998) Co-ordinated and cellular spe-
Gratteri, S., Palma, E., Muscoli, C., Di Fabrizio, E.,
cific induction of the components of the IGF/IGFBP
and Mollace, V. (2019) Key role of cytochrome C
axis in the rat brain following hypoxic-ischemic injury,
for apoptosis detection using Raman microimag-
Brain Res. Mol. Brain Res., 59, 119-134, doi: 10.1016/
ing in an animal model of brain ischemia with in-
s0169-328x(98)00122-3.
sulin treatment, Appl. Spectrosc.,
73,
1208-1217,
91.
Schober, M. E., Ke, X., Xing, B., Block, B. P.,
doi: 10.1177/0003702819858671.
Requena, D. F., McKnight, R., and Lane, R. H.
81.
Sanderson, T. H., Kumar, R., Sullivan, J. M., and
(2012) Traumatic brain injury increased IGF-1B
Krause, G. S. (2008) Insulin blocks cytochrome c re-
mRNA and altered IGF-1 exon 5 and promoter
lease in the reperfused brain through PI3-K signal-
region epigenetic characteristics in the rat pup hippo-
ing and by promoting Bax/Bcl-XL binding, J. Neu-
campus, J. Neurotrauma, 29, 2075-2085, doi: 10.1089/
rochem.,
106,
1248-1258, doi:
10.1111/j.1471-4159.
neu.2011.2276.
2008.05473.x.
92.
Åberg, D., Jood, K., Blomstrand, C., Jern, C., Nils-
82.
Sanderson, T. H., Kumar, R., Murariu-Dobrin, A. C.,
son, M., Isgaard, J., and Aberg, N. D. (2011) Serum
Page, A. B., Krause, G. S., and Sullivan, J. M.
IGF-I levels correlate to improvement of function-
(2009) Insulin activates the PI3K-Akt survival path-
al outcome after ischemic stroke, J. Clin. Endocrinol.
way in vulnerable neurons following global brain
Metab., 96, E1055-E1064, doi: 10.1210/jc.2010-2802.
ischemia, Neurol. Res., 31, 947-958, doi: 10.1179/
93.
Brywe, K. G., Mallard, C., Gustavsson, M., Hedt-
174313209X382449.
järn, M., Leverin, A. L., Wang, X., Blomgren, K.,
83.
Sanderson, T. H., Mahapatra, G., Pecina, P., Ji, Q.,
Isgaard, J., and Hagberg, H. (2005) IGF-I neuro-
Yu, K., Sinkler, C., Varughese, A., Kumar, R.,
protection in the immature brain after hypoxia-
Bukowski, M. J., Tousignant, R. N., Salomon, A. R.,
ischemia, involvement of Akt and GSK3beta? Eur. J.
Lee, I., and Hüttemann, M. (2013) Cytochrome C is
Neurosci., 21, 1489-1502, doi: 10.1111/j.1460-9568.
tyrosine 97 phosphorylated by neuroprotective insulin
2005.03982.x.
treatment, PLoS One, 8, e78627, doi: 10.1371/journal.
94.
Rizk, N. N., Rafols, J. A., and Dunbar, J. C. (2006)
pone.0078627.
Cerebral ischemia-induced apoptosis and necrosis
84.
Duarte, A. I., Santos, P., Oliveira, C. R., Santos, M. S.,
in normal and diabetic rats: effects of insulin and
and Rego, A. C. (2008) Insulin neuroprotection against
C-peptide, Brain Res., 1096, 204-212, doi: 10.1016/
oxidative stress is mediated by Akt and GSK-3beta
j.brainres.2006.04.060.
signaling pathways and changes in protein expression,
95.
Lin, S., Fan, L. W., Rhodes, P. G., and Cai, Z.
Biochim. Biophys. Acta, 1783, 994-1002, doi: 10.1016/
(2009) Intranasal administration of IGF-1 attenu-
j.bbamcr.2008.02.016.
ates hypoxic-ischemic brain injury in neonatal rats,
85.
Duarte, A. I., Moreira, P. I., and Oliveira, C. R.
Exp. Neurol., 217, 361-370, doi: 10.1016/j.expneurol.
(2012) Insulin in central nervous system: more than
2009.03.021.
just a peripheral hormone, J. Aging Res., 2012, 384017,
96.
Nishiyama, A., Komitova, M., Suzuki, R., and Zhu, X.
doi: 10.1155/2012/384017.
(2009) Polydendrocytes (NG2 cells): multifunctional
86.
Hughes, T. M., and Craft, S. (2016) The role of insulin
cells with lineage plasticity, Nat. Rev. Neurosci., 10,
in the vascular contributions to age-related dementia,
9-22, doi: 10.1038/nrn2495.
БИОХИМИЯ том 88 вып. 3 2023
474
ЗОРИНА и др.
97. Storm-Mathisen, J., Danbolt, N. C., Rothe, F., Torp, R.,
107. Gänger, S., and Schindowski, K. (2018) Tailoring
Zhang, N., Aas, J. E., Kanner, B. I., Langmoen, I.,
formulations for intranasal nose-to-brain delivery: a
and Ottersen, O. P. (1992) Ultrastructural immuno-
review on architecture, physico-chemical character-
cytochemical observations on the localization, me-
istics and mucociliary clearance of the nasal olfac-
tabolism and transport of glutamate in normal and
tory mucosa, Pharmaceutics, 10, 116, doi: 10.3390/
ischemic brain tissue, Prog. Brain Res., 94, 225-241,
pharmaceutics10030116.
doi: 10.1016/s0079-6123(08)61753-7.
108. Craft, S., Baker, L. D., Montine, T. J., Minoshima, S.,
98. Prabhu, D., Khan, S. M., Blackburn, K., Mar-
Watson, G. S., Claxton, A., Arbuckle, M., Callaghan, M.,
shall, J. P., and Ashpole, N. M. (2019) Loss of insu-
Tsai, E., Plymate, S. R., Green, P. S., Leverenz, J.,
lin-like growth factor-1 signaling in astrocytes disrupts
Cross, D., and Gerton, B. (2012) Intranasal insulin
glutamate handling, J. Neurochem., 151, 689-702,
therapy for Alzheimer disease and amnestic mild
doi: 10.1111/jnc.14879.
cognitive impairment: a pilot clinical trial, Arch.
99. Logan, S., Pharaoh, G. A., Marlin, M. C., Masser, D. R.,
Neurol., 69, 29-38, doi: 10.1001/archneurol.2011.233.
Matsuzaki, S., Wronowski, B., Yeganeh, A., Parks, E. E.,
109. Kooijman, R., Sarre, S., Michotte, Y., and De Keyser, J.
Premkumar, P., Farley, J. A., Owen, D. B., Hum-
(2009) Insulin-like growth factor I: a potential neu-
phries, K. M., Kinter, M., Freeman, W. M., Szwe-
roprotective compound for the treatment of acute
da, L. I., Van Remmen, H. , and Sonntag, W. E. (2018)
ischemic stroke? Stroke, 40, e83-e88, doi: 10.1161/
Insulin-like growth factor receptor signaling regulates
STROKEAHA.108.528356.
working memory, mitochondrial metabolism, and am-
110. Fan, L. W., Carter, K., Bhatt, A., and Pang, Y. (2019)
yloid-β uptake in astrocytes, Mol. Metab., 9, 141-155,
Rapid transport of insulin to the brain following
doi: 10.1016/j.molmet.2018.01.013.
intranasal administration in rats, Neural Regen. Res.,
100. Grinberg, Y. Y., Dibbern, M. E., Levasseur, V. A.,
14, 1046-1051, doi: 10.4103/1673-5374.250624.
and Kraig, R. P. (2013) Insulin-like growth factor-1
111. Picone, P., Sabatino, M. A., Ditta, L. A., Amato, A.,
abrogates microglial oxidative stress and TNF-α
San Biagio, P. L., Mulè, F., Giacomazza, D.,
responses to spreading depression, J. Neurochem., 126,
Dispenza, C., and Di Carlo, M. (2018) Nose-to-
662-672, doi: 10.1111/jnc.12267.
brain delivery of insulin enhanced by a nanogel
101. Lee, C. C., Huang, C. C., and Hsu, K. S. (2011) In-
carrier, J. Control Release, 270, 23-36, doi: 10.1016/
sulin promotes dendritic spine and synapse formation
j.jconrel.2017.11.040.
by the PI3K/Akt/mTOR and Rac1 signaling path-
112. Lochhead, J. J., Kellohen, K. L., Ronaldson, P. T.,
ways, Neuropharmacology, 61, 867-879, doi: 10.1016/
and Davis, T. P.
(2019) Distribution of insulin
j.neuropharm.2011.06.003.
in trigeminal nerve and brain after intranasal
102. Lioutas, V. A., Alfaro-Martinez, F., Bedoya, F.,
administration, Sci. Rep., 9, 2621, doi: 10.1038/s41598-
Chung, C. C., Pimentel, D. A., and Novak, V. (2015)
019-39191-5.
Intranasal insulin and insulin-like growth factor
1
113. Liu, X. F., Fawcett, J. R., Thorne, R. G., DeFor, T. A.,
as neuroprotectants in acute ischemic stzroke,
and Frey, W. H. 2nd (2001) Intranasal administration
Transl. Stroke Res., 6, 264-275, doi: 10.1007/s12975-
of insulin-like growth factor-I bypasses the blood-brain
015-0409-7.
barrier and protects against focal cerebral ischemic
103. Yu, L. Y., and Pei, Y. (2015) Insulin neuroprotection
damage, J. Neurol. Sci., 187, 91-97, doi: 10.1016/
and the mechanisms, Chin. Med. J. (Engl.), 128,
s0022-510x(01)00532-9.
976-981, doi: 10.4103/0366-6999.154323.
114. Liu, X. F., Fawcett, J. R., Thorne, R. G., and
104. Lioutas, V. A., and Novak, V. (2016) Intranasal insulin
Frey, W. H.
2nd
(2001) Non-invasive intranasal
neuroprotection in ischemic stroke, Neural Regen.
insulin-like growth factor-I reduces infarct volume and
Res., 11, 400-401, doi: 10.4103/1673-5374.179040.
improves neurologic function in rats following middle
105. Romanova, I. V., Derkach, K. V., Mikhrina, A. L.,
cerebral artery occlusion, Neurosci. Lett., 308, 91-94,
Sukhov, I. B., Mikhailova, E. V., and Shpakov, A. O.
doi: 10.1016/s0304-3940(01)01982-6.
(2018) The leptin, dopamine and serotonin receptors
115. Fletcher, L., Kohli, S., Sprague, S. M., Scran-
in hypothalamic POMC-neurons of normal and obese
ton, R. A., Lipton, S. A., Parra, A., Jimenez, D. F.,
rodents, Neurochem. Res., 43, 821-837, doi: 10.1007/
and Digicaylioglu, M. (2009) Intranasal delivery of
s11064-018-2485-z.
erythropoietin plus insulin-like growth factor-I for
106. Derkach, K., Zakharova, I., Zorina, I., Bakhtyukov, A.,
acute neuroprotection in stroke. Laboratory inves-
Romanova, I., Bayunova, L., and Shpakov, A.
tigation, J. Neurosurg., 111, 164-170, doi: 10.3171/
(2019) The evidence of metabolic-improving ef-
2009.2.JNS081199.
fect of metformin in Ay/a mice with genetically-
116. Lin, S., Rhodes, P. G., and Cai, Z. (2011) Whole
induced melanocortin obesity and the contri-
body hypothermia broadens the therapeutic window
bution of hypothalamic mechanisms to this
of intranasally administered IGF-1 in a neonatal rat
effect, PLoS One, 14, e0213779, doi: 10.1371/journal.
model of cerebral hypoxia-ischemia, Brain Res., 1385,
pone.0213779.
246-256, doi: 10.1016/j.brainres.2011.02.013.
БИОХИМИЯ том 88 вып. 3 2023
ИНТРАНАЗАЛЬНЫЕ ИНСУЛИН И IGF-1 ПРИ ЦЕРЕБРАЛЬНОЙ ИШЕМИИ
475
117. Shen, H., Gu, X., Wei, Z. Z., Wu, A., Liu, X., and
occlusion model of rat forebrain ischemia followed
Wei, L. (2021) Combinatorial intranasal delivery of
by reperfusion, J. Evol. Biochem. Phys., 55, 333-335,
bone marrow mesenchymal stem cells and insulin-like
doi: 10.1134/S0022093019040094.
growth factor-1 improves neurovascularization and
126. Zakharova, I. O., Bayunova, L. V., Zorina, I. I.,
functional outcomes following focal cerebral ischemia
Sokolova, T. V., Shpakov, A. O., and Avrova, N. F.
in mice, Exp. Neurol., 337, 113542, doi: 10.1016/
(2021) Insulin and α-tocopherol enhance the
j.expneurol.2020.113542.
protective effect of each other on brain cortical neurons
118. Liu, X. F., Fawcett, J. R., Hanson, L. R., and
under oxidative stress conditions and in rat two-vessel
Frey, W. H. 2nd (2004) The window of opportunity
forebrain ischemia/reperfusion injury, Int. J. Mol. Sci.,
for treatment of focal cerebral ischemic damage
22, 11768, doi: 10.3390/ijms222111768.
with noninvasive intranasal insulin-like growth
127. Zakharova, I. O., Bayunova, L. V., Zorina, I. I.,
factor-I in rats, J. Stroke Cerebrovasc. Dis., 13, 16-23,
Shpakov, A. O., and Avrova, N. F. (2022) Insulin and
doi: 10.1016/j.jstrokecerebrovasdis.2004.01.005.
brain gangliosides prevent metabolic disorders caused
119. Saber, H., Himali, J. J., Beiser, A. S., Shoamanesh, A.,
by activation of free radical reactions after two-vessel
Pikula, A., Roubenoff, R., Romero, J. R., Kase,
ischemia-reperfusion injury to the rat forebrain,
C. S., Vasan, R. S., and Seshadri, S. (2017) Serum
J. Evol. Biochem. Phys., 58, 279-291, doi: 10.1134/
insulin-like growth factor 1 and the risk of ischemic
S0022093022010240.
stroke: The framingham study, Stroke, 48, 1760-1765,
128. Duarte, A. I., Santos, M. S., Oliveira, C. R., and
doi: 10.1161/STROKEAHA.116.016563.
Rego, A. C. (2005) Insulin neuroprotection against
120. Iravanpour, F., Dargahi, L., Rezaei, M., Haghani, M.,
oxidative stress in cortical neurons - involvement
Heidari, R., Valian, N., and Ahmadiani, A. (2021)
of uric acid and glutathione antioxidant defenses,
Intranasal insulin improves mitochondrial function
Free Radic. Biol. Med., 39, 876-889, doi: 10.1016/
and attenuates motor deficits in a rat 6-OHDA model
j.freeradbiomed.2005.05.002.
of Parkinson’s disease, CNS Neurosci. Ther., 27,
129. Derkach, K. V., Bogush, I. V., Berstein, L. M., and
308-319, doi: 10.1111/cns.13609.
Shpakov, A. O. (2015) The influence of intranasal
121. Kim, B. H., Kelschenbach, J., Borjabad, A., Hadas, E.,
insulin on hypothalamic-pituitary-thyroid axis in
He, H., Potash, M. J., Nedelcovych, M. T., Rais, R.,
normal and diabetic rats, Horm. Metab. Res., 47,
Haughey, N. J., McArthur, J. C., Slusher, B. S., and
916-924, doi: 10.1055/s-0035-1547236.
Volsky, D. J. (2019) Intranasal insulin therapy reverses
130. Derkach, K. V., Bondareva, V. M., and Shpakov, A. O.
hippocampal dendritic injury and cognitive impair-
(2019) Regulatory effects of intranasal C-peptide
ment in a model of HIV-associated neurocognitive
and insulin on thyroid and androgenic status of
disorders in EcoHIV-infected mice, AIDS, 33, 973-
male rats with moderate type 1 diabetes mellitus,
984, doi: 10.1097/QAD.0000000000002150.
J. Evol. Biochem. Physiol., 55, 493-496, doi: 10.1134/
122. Zhu, Y., Huang, Y., Yang, J., Tu, R., Zhang, X., He, W. W.,
S0022093019060073.
Hou, C. Y., Wang, X. M., Yu, J. M., and Jiang, G. H.
131. Sukhov, I. B., Derkach, K. V., Chistyakova, O. V.,
(2022) Intranasal insulin ameliorates neurological
Bondareva, V. M., and Shpakov, A. O.
(2016)
impairment after intracerebral hemorrhage in mice,
Functional state of hypothalamic signaling systems
Neural Regen. Res.,
17,
210-216, doi:
10.4103/
in rats with type 2 diabetes mellitus treated with
1673-5374.314320.
intranasal insulin, J. Evol. Biochem. Physiol., 52,
123. Zorina, I. I., Saveleva, L. O., Bakhtyukov, A. A.,
204-216, doi: 10.1134/S0022093016030030.
and Shpakov, A. O. (2018) Intranasal insulin adminis-
132. Derkach, K. V., Ivantsov, A. O., Chistyakova, O. V.,
tration normalizes the gene expression of antioxidant
Sukhov, I. B., Buzanakov, D. M., Kulikova, A. A.,
enzymes in the two-vessel ischemia and reperfusion
and Shpakov, A. O. (2017) Intranasal insulin re-
in the rat brain, in BIOMEMBRANES 2018: Interna-
stores metabolic parameters and insulin sensitiv-
tional Conference 1-5 October 2018 Book of Abstracts,
ity in rats with metabolic syndrome, Bull. Exp.
J. Bioenerg. Biomembr., 50, 467-603, doi: 10.1007/
Biol. Med.,
163,
184-189, doi:
10.1007/s10517-
s10863-018-9775-7.
017-3762-6.
124. Zorina, I. I., Zakharova, I. O., Bayunova, L. V., and
133. Albers, G. W., Goldstein, L. B., Hess, D. C.,
Avrova, N. F. (2018) Insulin administration prevents
Wechsler, L. R., Furie, K. L., Gorelick, P. B.,
accumulation of conjugated dienes and trienes and in-
Hurn, P., Liebeskind, D. S., Nogueira, R. G.,
activation of Na+, K+-ATPase in the rat cerebral cortex
and Saver, J. L. (2011) STAIR VII Consortium.
during two-vessel forebrain ischemia and reperfusion,
Stroke Treatment Academic Industry Roundtable
J. Evol. Biochem. Phys., 54, 246-249, doi: 10.1134/
(STAIR) recommendations for maximizing the use of
S0022093018030109.
intravenous thrombolytics and expanding treatment
125. Zorina, I. I., Galkina, O. V., Bayunova, L. V., and
options with intra-arterial and neuroprotective
Zakharova, I. O. (2019) Effect of insulin on lipid
therapies, Stroke,
42,
2645-2650, doi:
10.1161/
peroxidation and glutathione levels in a two-vessel
STROKEAHA.111.618850.
БИОХИМИЯ том 88 вып. 3 2023
476
ЗОРИНА и др.
PROSPECTS FOR THE USE OF INTRANASALLY ADMINISTERED
INSULIN AND INSULIN-LIKE GROWTH FACTOR-1
IN CEREBRAL ISCHEMIA
Review
I. I. Zorina*, N. F. Avrova, I. O. Zakharova, and A. O. Shpakov
Sechenov Institute of Evolutionary Physiology and Biochemistry of the Russian Academy of Sciences,
194223 Saint-Petersburg, Russia; e-mail: zorina.inna.spb@gmail.com
Currently, the approaches used to treat stroke have significant limitations, and neuroprotective therapy is
ineffective. In this regard, the search for effective neuroprotectors and the development of new neuropro-
tective strategies in cerebral ischemia are still relevant. Insulin and insulin-like growth factor-1 (IGF-1) play
a key role in the functioning of the brain, are involved in the regulation of growth, differentiation and sur-
vival of neurons, neuronal plasticity, food intake, control peripheral metabolism and endocrine functions.
They have a complex effect on the brain, including neuroprotective effects in cerebral ischemia and stroke.
Experiments on animals and cell cultures have shown that insulin and IGF-1 under hypoxic conditions
improve energy metabolism in neurons and glial cells, have a positive effect on blood microcirculation in
the brain, restore nerve cell functions and neurotransmission processes, and have anti-inflammatory and
antiapoptotic effects on brain cells. Of greatest interest to the clinic is the intranasal route of administra-
tion of insulin and IGF-1, since it allows dosed delivery of these hormones directly to the brain, bypass-
ing the blood-brain barrier. Intranasally administered insulin demonstrates a pronounced positive effect in
the correction of cognitive impairment in elderly people with neurodegenerative and metabolic disorders.
Insulin and IGF-1 administered intranasally improve increase the survival of animals with ischemic stroke.
The review discusses literature data and the results of our own studies on the mechanisms of the neuropro-
tective action of intranasally administered insulin and IGF-1 in cerebral ischemia and the prospects for
their use to normalize CNS functions and reduce neurodegenerative changes in this pathology.
Keywords: intranasal insulin, insulin-like growth factor-1, cerebral ischemia, reperfusion, neuroprotective effect,
oxidative stress
БИОХИМИЯ том 88 вып. 3 2023