БИОХИМИЯ, 2023, том 88, вып. 3, с. 477 - 490
УДК 612.822.3
СВОЙСТВА ПРЕСИНАПТИЧЕСКОЙ ПЛАСТИЧНОСТИ
В ЗАВИСИМОСТИ ОТ ПОЛИМЕРИЗАЦИИ АКТИНА
© 2023 И.В. Кудряшова
Институт высшей нервной деятельности и нейрофизиологии РАН,
117485 Москва, Россия; электронная почта: iv_kudryashova@mail.ru
Поступила в редакцию 03.10.2022
После доработки 12.12.2022
Принята к публикации 13.12.2022
На переживающих срезах гиппокампа крыс методом парной стимуляции исследовали изменение
свойств пресинаптической кратковременной пластичности на фоне блокады деполимеризации
и активации полимеризации актина. Тестирование синаптической передачи СА3-СА1 в режиме
парной стимуляции с межстимульным интервалом 70 мс производилось до и на фоне джасплаки-
нолида, ингибитора деполимеризации, применяемого также для индукции полимеризации акти-
на. Увеличение амплитуды ответа при аппликации джасплакинолида сопровождалось снижением
фасилитации при парной стимуляции (PPF), что свидетельствует о пресинаптических механизмах
потенциации. Эффект усиливался пропорционально величине исходной PPF. Учитывая известные
механизмы, лежащие в основе PPF, можно предположить, что при низкой вероятности выброса
медиатора дополнительная полимеризация актиновых филаментов способствует её увеличению.
Иначе изменялись менее типичные для поля СА1 реакции на парную стимуляцию (PPF около 1
или даже парная депрессия), и джасплакинолид увеличивал амплитуду второго, но не первого
в паре ответа, так что соотношение амплитуд второго и первого ответа даже увеличивалось в сред-
нем с 0,8 до 1. Предполагается, что, помимо основного эффекта, на фоне джасплакинолида снижа-
ется влияние факторов, способствующих парной депрессии. Так или иначе, полимеризация актина
приводит к потенциации синаптических реакций, хотя паттерн активации может различаться
в зависимости от исходных свойств пресинаптической пластичности. В заключение: комплексный
эффект джасплакинолида, помимо увеличения вероятности выброса медиатора, включает и другие
зависимые от полимеризации актина механизмы, в том числе лежащие в основе кратковременной
синаптической депрессии при парной стимуляции.
КЛЮЧЕВЫЕ СЛОВА: гиппокамп, пресинаптическая пластичность, кратковременная фасилитация
при парной стимуляции, кратковременная депрессия при парной стимуляции, полимеризация актина,
джасплакинолид.
DOI: 10.31857/S0320972523030089, EDN: QWVKJP
ВВЕДЕНИЕ
Структура синапса поддерживается высо-
каций, и для эффективной консолидации не-
кодинамичным
«молекулярным ансамблем»,
обходима реорганизация и обновление синап-
включающим скелетные, каркасные (scaffold)
тических структур или даже синапсов [2, 3].
и якорные белки, которые являются основой
Молекулярной основой структурной пла-
для встраивания и поддержания сигнальных
стичности синапсов является реорганизация
и регуляторных белков, определяющих эф-
актинового цитоскелета [4-6]. В частности,
фективность синапса и в том числе секрецию
зависимые от актина модификации обнару-
медиатора [1]. Простое увеличение эффек-
жены при исследовании долговременной си-
тивности проведения, которое, согласно кон-
наптической потенциации (LTP), в том числе
цептуальным представлениям, может быть
и в СА1 [7]. Многочисленные эксперименталь-
основой обучения и памяти, является лишь
ные данные свидетельствуют о том, что поли-
начальным этапом долговременных модифи- меризация актина после высокочастотного
Принятые сокращения: LTP - долговременная потенциация; PPD - кратковременная депрессия при парной
стимуляции; PPF - кратковременная фасилитация при парной стимуляции; PPR - соотношение амплитуд второго
и первого ответа.
477
478
КУДРЯШОВА
раздражения значительно улучшает эффектив-
изменения амплитуды синаптических потен-
ность поддержания LTP [7-11]. Большинство
циалов на фоне джасплакинолида. Согласно
этих работ сообщают о полимеризации акти-
гипотезе остаточного кальция, феномен PPF
на постсинаптического компартмента, тогда
имеет преимущественно пресинаптическую
как потенциальный вклад пресинаптического
природу, и этот тест часто используется для
компартмента никак не обсуждается. Между
определения изменения вероятности выброса
тем об участии актина в пресинаптических мо-
медиатора [27, 30, 31]. Чтобы оценить, может
дификациях свидетельствуют эксперименты
ли полимеризация актина приводить к преси-
на беспозвоночных животных [12, 13]. Учиты-
наптическим модификациям в синапсах гип-
вая достаточно обоснованные представления
покампа, на переживающих срезах гиппокам-
об эволюционно консервативных механизмах
па крыс сравнивали соотношение амплитуд
регуляции, аналогичные зависимые от актина
CA3-CA1 второй и первой реакций на парную
перестройки могут быть обнаружены и в си-
стимуляцию (PPR) до и на фоне инкубации с
напсах позвоночных животных, включая пре-
джасплакинолидом, применяемым in vitro для
синаптические модификации [1, 5, 14, 15, 16].
индукции полимеризации актина [32]. Чтобы
Наряду с постсинаптическими механиз-
минимизировать вклад других пресинаптиче-
мами LTP, высокочастотное раздражение си-
ских и постсинаптических механизмов, вклю-
наптических входов может приводить к уве-
чая суммацию с бисинаптическим тормозным
личению пресинаптического высвобождения
постсинаптическим потенциалом (ТПСП),
медиатора [17-20]. Известно, что LTP синап-
которые, наряду с зависимой от остаточного
сов CA3-CA1 в равной степени зависит от
кальция пресинаптической фасилитацией
постсинаптических и пресинаптических мо-
моносинаптических возбуждающих входов,
дификаций [21-24]. Конкретные механизмы
способны изменять реакцию на парную сти-
неизвестны, однако очевидно, что реоргани-
муляцию регистрируемых в поле СА1 экстра-
зация синаптических контактов подразумевает
клеточных потенциалов, парная стимуляция
скоординированность структурных модифика-
производилась с межстимульным интервалом
ций пресинаптического и постсинаптического
70 мс. В данной работе представлен детальный
компартмента [3]. Ранее было обнаружено, что
корреляционный анализ эффектов джаспла-
поддержание LTP улучшается при условии пост-
кинолида с учётом всех характеристик, вклю-
тетанического снижения PPF [25], что, как
чая особенности изменения амплитуды пер-
известно, считается признаком увеличения ве-
вого и второго в паре ответа, их соотношения
роятности выброса медиатора [26, 27]. Вполне
и их исходно разную величину.
вероятно, что полимеризация пресинаптичес-
кого актина, так же как и в постсинапсе, может
иметь отношение к процессам консолидации.
МАТЕРИАЛЫ И МЕТОДЫ
Роль реполимеризации актина в регуля-
ции пресинаптических функций достаточно
Животные. Крысы Wistar были получены
хорошо изучена в экспериментах на куль-
из питомника «Столбовая» РАМН (Москов-
туре нервных клеток, включая исследования
ская обл.) и содержались в институтском вива-
синапсов гиппокампа [14, 15, 28, 29]. Однако
рии по 4-5 животных в каждой клетке. Живот-
использование ингибиторов полимеризации
ные имели неограниченный доступ к пище и
и деполимеризации в электрофизиологиче-
воде, световая фаза суточного цикла продол-
ских экспериментах на срезах и in vivo не все-
жалась с 8:00 до 20:00. В работе использовали
гда приводит к однозначным результатам, и
14 животных 1-1,5-месячного возраста весом
наблюдаемые при этом пресинаптические мо-
100-150 г.
дификации зачастую не соответствуют теоре-
Процедура изготовления срезов. После бы-
тическим ожиданиям. Это означает, что в эф-
строй декапитации черепную кость подрезали
фекты ингибиторов вмешивается множество
с затылочной стороны и отгибали в сторону.
дополнительных факторов, каждый из кото-
Острым лезвием кору надрезали по направле-
рых необходимо контролировать в отдельно-
нию от глаза к середине мозжечка. С помощью
сти. Предполагается, что одним из существен-
ручного слайсера извлекали несколько сре-
ных факторов разнообразия эффектов может
зов перпендикулярно продольной оси гиппо-
быть исходное состояние синапса.
кампа. Вся процедура от начала декапитации
Для данного корреляционного исследо-
до помещения срезов в перфузионную среду
вания в качестве контролируемого фактора
занимала не более 1,5-2 минут. Состав пер-
был выбран показатель, позволяющий оце-
фузионной среды (мМ): NaCl - 124; KCl - 5;
нить вклад пресинаптического компонента в
MgSO4 × 7H2O - 1,3; CaCl2 - 2,5; NaH2PO4 - 1;
БИОХИМИЯ том 88 вып. 3 2023
АКТИН В ПРЕСИНАПТИЧЕСКОЙ ПЛАСТИЧНОСТИ
479
NaHCO3 - 26; D-глюкоза - 10; карбоген -
включающих реакции с исходно низкими или
95% O2 и 5% CO2; pН 7,3-7,4, температура 32 °С.
высокими значениями PPR, после разделения
В каждом эксперименте было использовано
выборки утративших соответствие нормаль-
3-4 среза. Для стабилизации срезы одновре-
ному распределению, использовали критерий
менно инкубировали в экспериментальной
Вилкоксона для связанных пар наблюдений.
камере в течение 1,5 часов без предъявления
Связь всех исследуемых показателей с их изме-
тестирующих раздражений.
нением на фоне джасплакинолида (ΔA1, ΔA2,
Стимуляция и регистрация. Для регистра-
ΔPPR) определяли с помощью вычисления
ции фокальных потенциалов в пирамидном
коэффициентов корреляции Пирсона. Ста-
слое поля CА1 использовали стеклянные мик-
тистическая обработка данных производи-
роэлектроды, заполненные 0,33 M раствором
лась с помощью программного обеспечения
хлористого натрия. Раздражающие биполяр-
STATISTICA12 («StatSoft», США).
ные электроды устанавливали в радиальном
слое на коллатерали Шаффера. Тестирование
фокальных потенциалов в течение всего вре-
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
мени регистрации производилось парными
стимулами с межстимульным интервалом 70 мс.
При сравнении средних величин по всей
Чтобы увеличить разнообразие исходных PPF
выборке в целом было обнаружено, что ампли-
в срезах гиппокампа одного и того же живот-
туда первого в паре ответа на фоне джаспла-
ного, использовалась переменная интенсив-
кинолида постепенно увеличивалась. Судя по
ность раздражения с поочерёдным тестирова-
изменению средних амплитуд, через 20 мин
нием реакций с амплитудой 50%, а также 30%
после начала подведения, например, тех, ко-
и/или 70% от максимальной величины.
торые составляют половину от максималь-
Используемые препараты. После стабили-
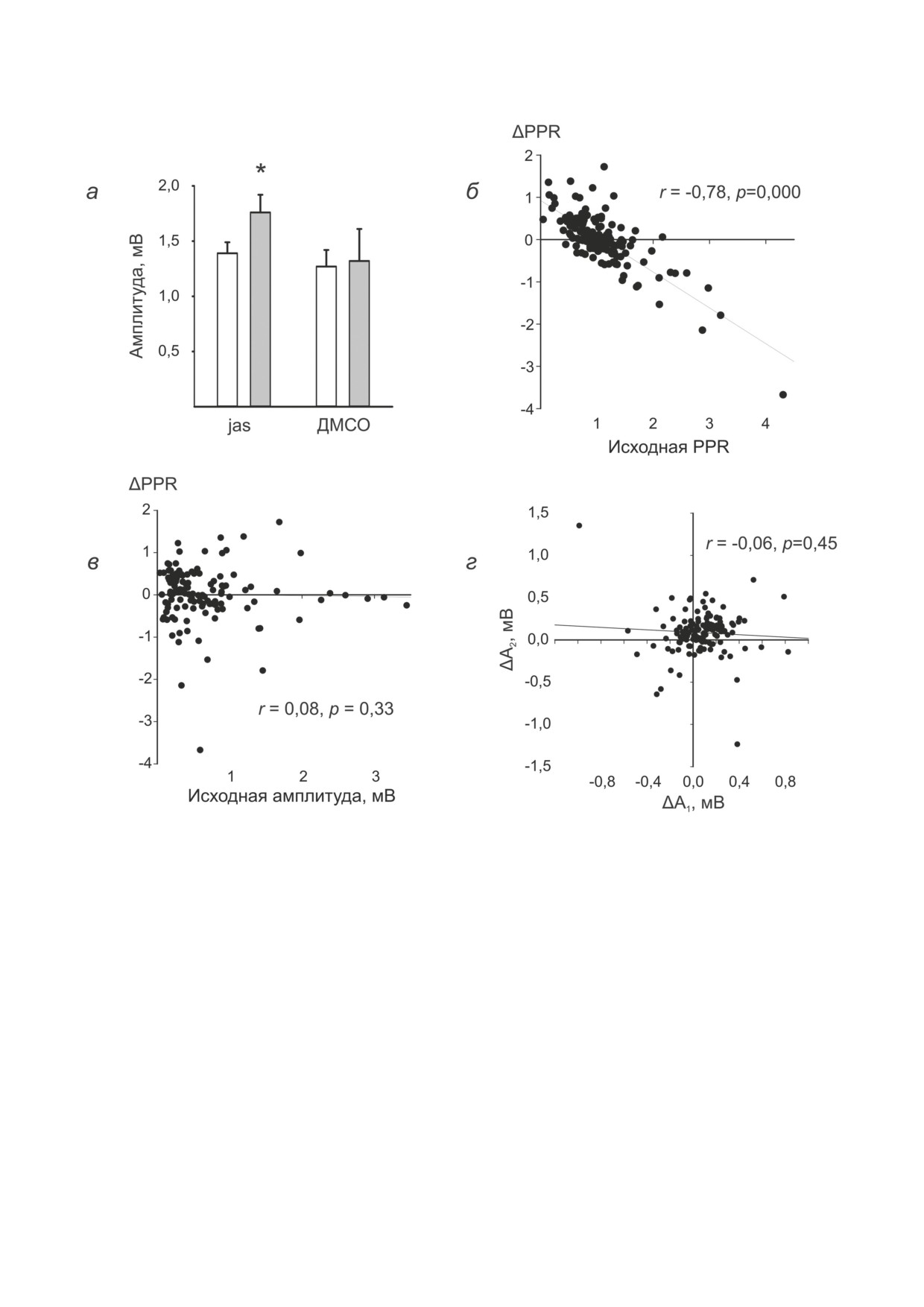
ной величины (рис. 1, а, n = 14, 1,39 ± 0,1 мВ
зации и контрольного тестирования повторное
до и 1,76 ± 0,16 мВ после начала подведения,
тестирование в каждом из срезов производи-
t = 2,33, p = 0,03 для зависимых выборок; для
лось на фоне аппликации джасплакинолида -
сравнения: 1,27 ± 0,15 мВ до и 1,32 ± 0,29 мВ
проникающего через мембрану пептида, стаби-
после подведения ДМСО, n = 11, t = 0,27, p =
лизирующего актиновые филаменты («Sigma»,
= 0,79 для зависимых выборок), чаще преобла-
США, Cat# J4580). Аликвоты исходного рас-
дала потенциация, хотя результаты индивиду-
твора замораживали при -20 °C и непосред-
альных тестов сильно различались. Поэтому
ственно перед употреблением растворяли в
основная часть исследования была направлена
стандартном перфузионном растворе до ко-
на поиск факторов, определяющих индивиду-
нечной концентрации 0,2 мкM. Не прекращая
альную вариабельность реакций на подведе-
тестирования, этот раствор постепенно под-
ние джасплакинолида. Сравнение зависимости
водили к одному из срезов непосредственно в
амплитуды ответа от входных характеристик до
область регистрации в течение 20 мин с помо-
и на фоне джасплакинолида не выявило значи-
щью программируемого микроинъектора без
мого влияния фактора интенсивности тестирую-
отключения основного протока. Такой способ
щего раздражения на характер модификаций.
подведения позволяет минимизировать эф-
Следовательно, разнообразие и нестабильность
фект смены протока. Каждый следующий срез
эффектов джасплакинолида определяется дру-
инкубировали индивидуально. Порядок тести-
гими факторами. В частности, оказалось, что
рования зависел от расположения среза в экс-
даже в одном и том же гиппокампе эффект
периментальной камере, начиная с наиболее
потенциации больше зависел от особенностей
удалённого по ходу основного протока.
исходных реакций на парную стимуляцию.
Статистический анализ. Измеряли ампли-
Поскольку потенциация на фоне джаспла-
туду популяционного спайка первого в паре
кинолида сопровождалась снижением PPF, да-
ответа (A1) и усредняли по всем срезам в со-
лее представлен более детальный анализ этих
ответствии с моментом от начала апплика-
результатов. Учитывая возможность интерфе-
ции. Результаты выражены в виде M ± SEM.
ренции пресинаптической потенциации с дру-
Дополнительно измеряли амплитуду второго
гими зависимыми от актина механизмами,
в паре ответа (A2) и вычисляли соотноше-
необходимо было контролировать любую несо-
ние амплитуд второго и первого в паре ответа
гласованность изменения амплитуды первого и
A2/A1 (PPR). Для определения статистиче-
второго ответа и их соотношения. Корреляци-
ской значимости влияния джасплакинолида
онный анализ показал, что главным фактором,
был использован t-критерий Стьюдента для
определяющим различия в эффектах джаспла-
зависимых переменных. В подгруппах данных,
кинолида, является величина исходной PPR.
БИОХИМИЯ том 88 вып. 3 2023
480
КУДРЯШОВА
Рис. 1. Закономерности изменения величины PPR при аппликации джасплакинолида. а: Потенциация первого в паре
ответа (n = 14). Ордината - амплитуда первого в паре ответа при средней интенсивности раздражения (половина
от максимальной до подведения джасплакинолида). В качестве контроля представлены результаты аппликации ДМСО.
Светлые столбики - до, тёмные столбики - через 20 мин после начала подведения. Результаты представлены в виде
M ± SEM. Отмечены значимые (* p < 0,05) отклонения относительно среднего контрольного уровня. б, в : Изменения
PPR (ордината: ΔPPR = PPRдж - PPRдо) в зависимости от исходных параметров (абсцисса, б: исходные PPR, в: ам-
плитуда первого в паре ответа до аппликации). г: Разница между величиной амплитуд до и после аппликации. Первая
(абсцисса, ΔA1 = A1дж - A1до) и вторая (ордината, ΔA2 = A2дж - A2до) амплитуды меняются независимо
Точечная диаграмма на рис. 1, б иллюстри-
PPR не зависели от исходной амплитуды от-
рует достаточно чёткую зависимость изме-
вета (r = 0,08, p = 0,33, n = 139, рис. 1, в). Сле-
нения PPR от величины PPR до аппликации.
довательно, сам по себе уровень активации, в
По всей выборке в целом коэффициент кор-
частности, создаваемый балансом возбужде-
реляции между исходной PPR и величиной её
ния и торможения, вряд ли имеет отношение
снижения составил r = -0,78, p = 0,000, n =
к разнообразию эффектов, и дефицит преси-
= 139. Очевидно, что чем больше исходная
наптической потенциации синапсов с исход-
вероятность выброса медиатора приближает-
но высокой вероятностью выброса медиатора
ся к максимальной, тем меньше возможность
может быть единственным объяснением обна-
пресинаптической потенциации и, соответ-
руженной в эксперименте корреляционной
ственно, снижения PPF. При этом изменения
зависимости.
БИОХИМИЯ том 88 вып. 3 2023
АКТИН В ПРЕСИНАПТИЧЕСКОЙ ПЛАСТИЧНОСТИ
481
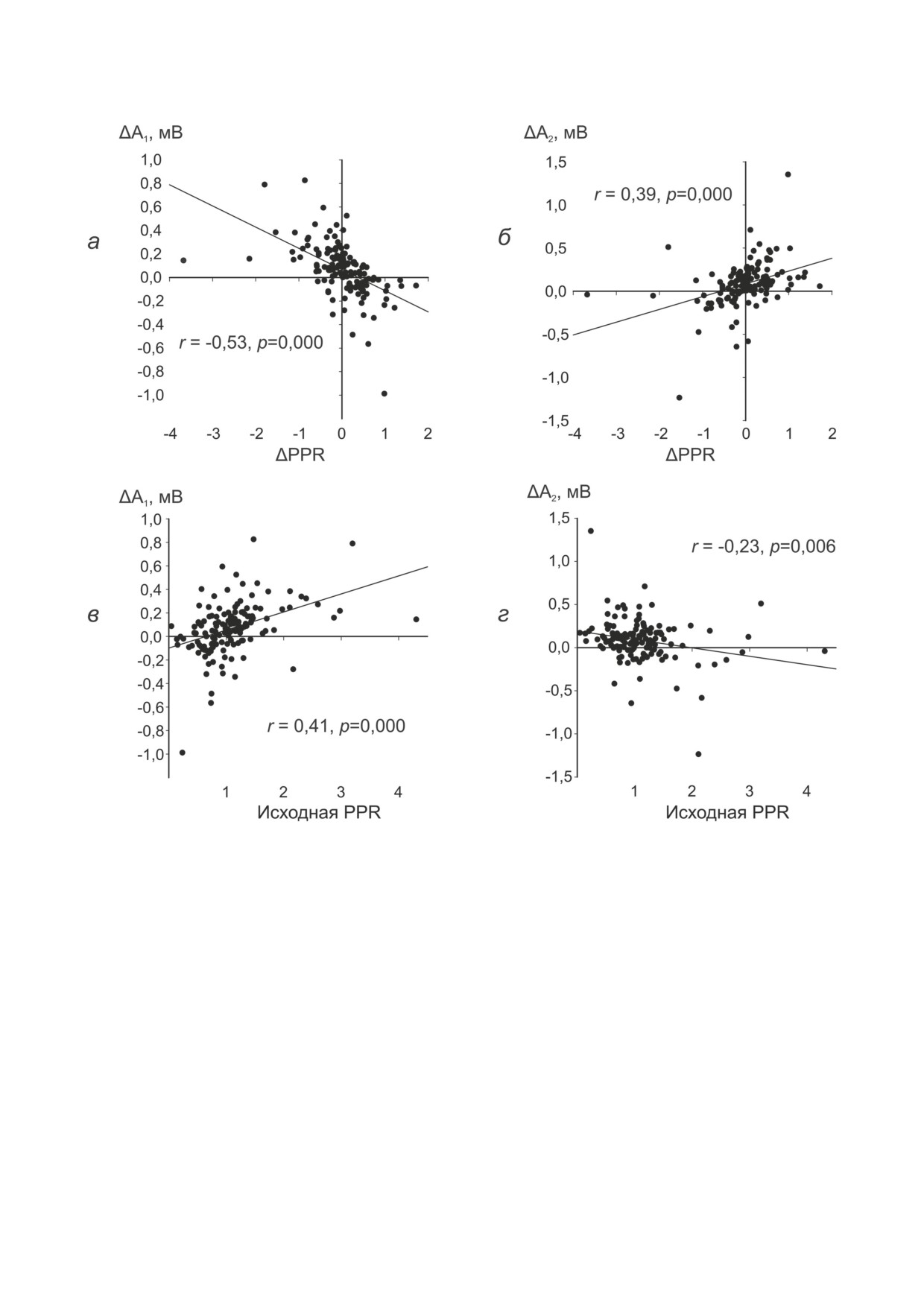
Рис. 2. Изменения первого и второго в паре ответа и их обратная связь с другими характеристиками. Абсцисса -
изменения PPR (PPRдж - PPRдо, а и б) и исходные PPR (в и г). Ордината - изменения первой (а и в, ΔA1 = A1дж - A1до)
и второй (б и г, ΔA2 = A2дж - A2до) амплитуды в ответ на аппликацию джасплакинолида
Необходимо отметить, что определение ве-
та (r = -0,53, p = 0,000, n = 139, рис. 2, а), что
роятности выброса медиатора с помощью PPF-
свидетельствует в пользу увеличения вероят-
теста существенно усложняется в некоторых
ности выброса медиатора. Однако потенциа-
экспериментах из-за увеличения амплитуды
ция второго в паре ответа сопровождалась
второго в паре ответа. Действительно, неболь-
увеличением PPR (r = 0,39, p = 0,000, n = 139,
шая, но значимая корреляция между измене-
рис. 2, б). Если сравнивать с модификациями
нием амплитуды второго ответа и PPR под-
амплитуды первого ответа, соответствующие
тверждается статистически (r = 0,38, p = 0,000,
коэффициенты корреляции достоверно раз-
n = 139). Существенно, что при парной стиму-
личались (p < 0,001) и были противоположны
ляции первый и второй потенциалы по-раз-
по знаку (рис. 2, а, б). Так или иначе, полиме-
ному реагировали на подведение джасплаки-
ризация актина в основном приводит к потен-
нолида (r = -0,06, p = 0,45, n = 139, рис. 1, г).
циации синаптических реакций, но паттерн
Снижение величины PPF сопровождалось
активации может меняться в зависимости от
увеличением амплитуды первого в паре отве-
исходной величины PPR. На рис. 2, в видно,
9
БИОХИМИЯ том 88 вып. 3 2023
482
КУДРЯШОВА
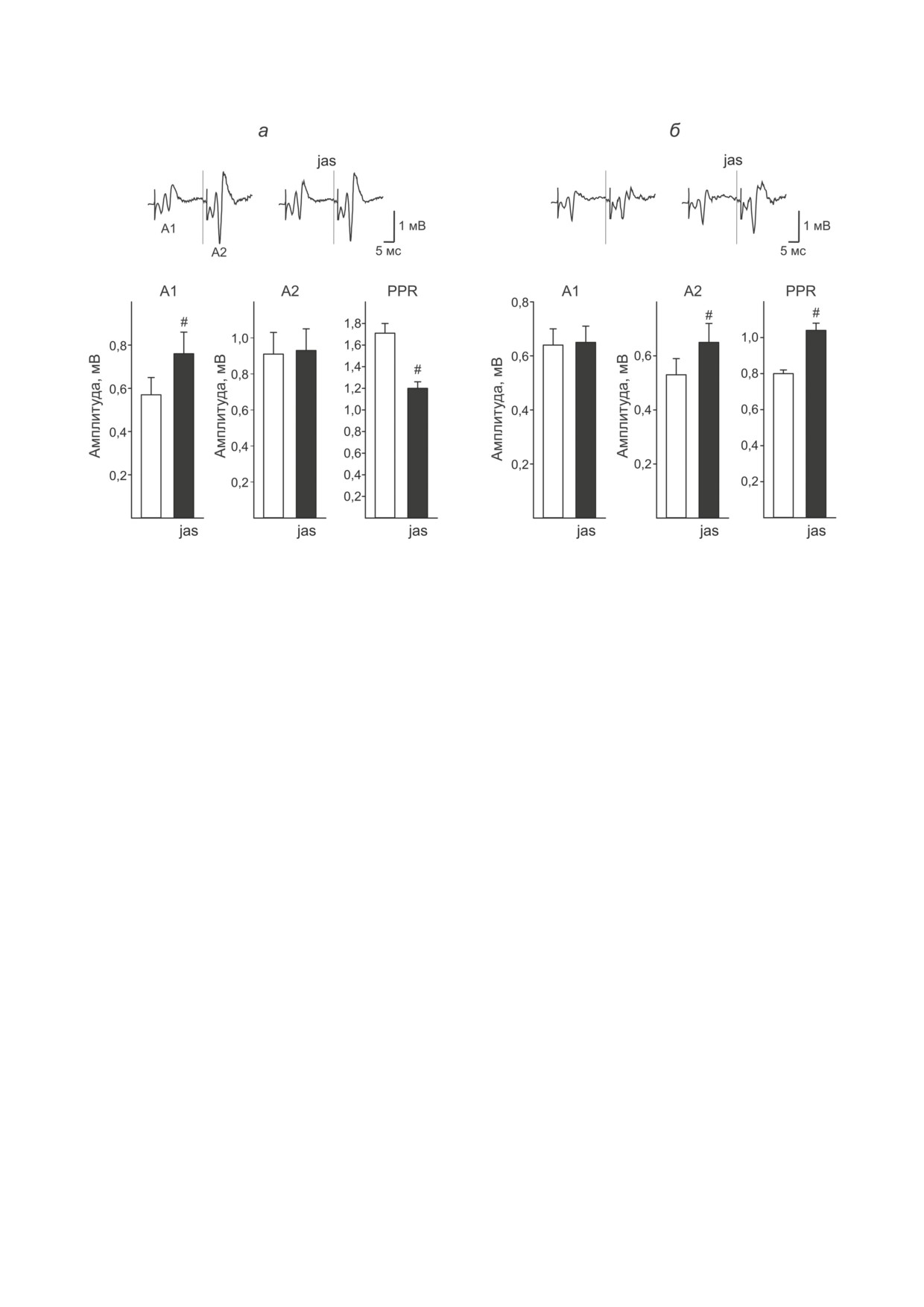
Рис. 3. Особенности влияния джасплакинолида на реакции с исходно высокими (а, n = 45) и низкими (б, n = 94) пока-
зателями PPR. Ордината - амплитуда первого (A1), второго (A2) в паре ответа и их соотношение (PPR). Результаты
представлены в виде M ± SEM. Светлые и тёмные столбики - амплитуда до и после аппликации джасплакинолида со-
ответственно. Звёздочкой отмечена статистическая значимость каждого из эффектов джасплакинолида (тест Вилкок-
сона, а - подгруппа с исходно высокими значениями: A1 - p < 0,007, A2 - p = 0,13, PPR - p < 0,000007; б - подгруппа
с исходно низкими значениями PPR: A1 - p = 0,07, A2 - p < 0,0007, PPR - p < 0,007). Примеры экспериментальных
записей иллюстрируют типичные для соответствующей подгруппы реакции на парную стимуляцию с межстимуль-
ным интервалом 70 мс до и после аппликации джасплакинолида. Для удобства восприятия часть записи между пер-
вым и вторым предъявлением удалялась программой непосредственно при регистрации. Момент включения второго
экрана отмечен вертикальной линией
что рост амплитуды первого в паре ответа на
Результаты корреляционного анализа по-
фоне джасплакинолида усиливался пропор-
казывают, что по результатам всей выборки в
ционально величине исходной PPR (r = 0,41,
целом сравнение средних величин до и после
p =0,000, n = 139, рис. 2, в). Значимая корреля-
аппликации джасплакинолида может приво-
ция является ещё одним аргументом в пользу
дить к неправильным выводам из-за неодно-
того, что суммарная потенциация снижается
родности исходных условий его применения.
за счёт дефицита пресинаптической потен-
На этом основании при статистическом ана-
циации синапсов с исходно высокой вероят-
лизе в данной работе было необходимо ис-
ностью выброса медиатора. Вместе с тем
пользовать исходную величину PPR в качестве
различия в исходной вероятности выброса
одного из группирующих факторов. Крите-
медиатора не могут объяснить всех эффектов
рием для разделения выборки служила вели-
джасплакинолида и, в частности, увеличения
чина исходной PPR = 1,2. В соответствии с
амплитуды второго в паре ответа. В отличие
этим критерием данные были сгруппированы
от позитивной корреляции, обнаруженной
в две отдельные выборки в зависимости от
для потенциации первого ответа (r = 0,41, p =
исходной величины PPR. Более типичной для
= 0,000, n = 139, рис. 2, в), обращает на себя
CA3-CA1-синапсов реакцией на парную сти-
внимание обратная зависимость прироста
муляцию является, как правило, достаточно
амплитуды второго в паре ответа от исходной
хорошо выраженная PPF. Примеры таких ре-
величины PPR (r = -0,23, p = 0,006, n = 139,
акций на парную стимуляцию с межстимуль-
рис. 2, г). Таким образом, в основе потенциа-
ным интервалом 70 мс до и на фоне джаспла-
ции первого и второго ответа, скорее всего,
кинолида представлены на рис. 3, а. В ответ на
лежат разные механизмы, и их преобладание
аппликацию джасплакинолида такие реакции
зависит от исходных условий аппликации джас-
демонстрировали увеличение амплитуды перво-
плакинолида.
го в паре ответа с высокой степенью достовер-
БИОХИМИЯ том 88 вып. 3 2023
АКТИН В ПРЕСИНАПТИЧЕСКОЙ ПЛАСТИЧНОСТИ
483
ности (в среднем по подгруппе с 0,57 ± 0,08 мВ
влияние джасплакинолида на амплитуду пер-
до 0,76 ± 0,1 мВ, t = 6,14, p = 0,0000 для зави-
вого (F(1,137) = 27,25, p = 0,000001) и второго
симых выборок при сравнении амплитуд до
ответа (F(1,137) = 8,71, p = 0,003) и снижение
и после аппликации). Амплитуда второго в
PPR (F(1,137) = 7,04, p = 0,0008) по всей вы-
паре ответа при этом оставалась неизмен-
борке в целом, но и зависимость эффектов
ной (в среднем по подгруппе 0,91 ± 0,12 мВ до
джасплакинолида от исходной величины PPR
и 0,93 ± 0,12 мВ после аппликации, t = 0,33,
(взаимодействие факторов F(1,137) = 20,40, p =
p = 0,74 для зависимых выборок). В соответ-
= 0,00001, F(1,137) = 5,52, p = 0,02 и F(1,137) =
ствии с этим происходило значимое снижение
= 54,88, p = 0,000000 при оценке изменения А1,
PPF (в среднем по подгруппе с 1,71 ± 0,09 до
А2 и PPR соответственно).
1,2 ± 0,06, t = 4,54, p = 0,00004 для зависимых
выборок), что свидетельствует в пользу уча-
стия полимеризации актина в регуляции ве-
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
роятности выброса медиатора в типичных для
поля СА1 условиях. Такого же снижения PPF
Полученные результаты показывают, что
не наблюдалось после инкубации с ДМСО
полимеризация актина сама по себе может
(1,77 ± 0,23 до и 2,36 ± 0,59 после подведения,
стимулировать развитие синаптических моди-
n = 11, t = 1,6, p = 0,13 для зависимых выбо-
фикаций в срезах гиппокампа относительно
рок), хотя все срезы относились к подгруппе с
взрослых крыс. В отличие от предполагаемых
исходно высокими значениями PPF.
механизмов, объясняющих способность джас-
Менее типичным для поля СА1 является
плакинолида предотвращать депотенциацию
отсутствие PPF или даже кратковременная
LTP в гиппокампе взрослых крыс [7, 11], про-
депрессия (PPD). Примеры таких реакций
стое тестирование вряд ли может вызывать
представлены на рис. 3, б. В этих условиях
структурные изменения. Не исключено, что в
джасплакинолид не оказывал заметного влия-
основе наблюдаемых на фоне джасплакино-
ния на амплитуду первого в паре ответа (в сред-
лида изменений лежит гомеостатическая регу-
нем 0,64 ± 0,06 мВ до и 0,65 ± 0,06 мВ после
ляция синаптических функций, которая обес-
аппликации, t = 0,6, p = 0,55 для зависимых
печивает восстановление оптимального уровня
выборок). При этом амплитуда второго отве-
нейронной активности [33-36]. Такая возмож-
та неожиданно увеличивалась в среднем с
ность частично подтверждается при исполь-
0,53 ± 0,06 мВ до 0,65 ± 0,07 мВ (t = 4,94, p =
зовании дестабилизирующих актин препара-
= 0,000003), так что соотношение амплитуд
тов [14, 28]. Примечательно, что и полимери-
второго и первого ответа даже увеличивалось
зация, и деполимеризация не влекут за собой
в среднем с 0,8 ± 0,02 до 1,04 ± 0,04 (t = 5,34,
однозначных модификаций определённого типа
p = 0,000001 для зависимых выборок). Неиз-
[14, 29, 37, 38]. В частности, полимеризация
менность амплитуды первого ответа свиде-
актина на фоне джасплакинолида может уси-
тельствует о том, что рост PPR не может быть
ливать или ослаблять синаптическую актив-
связан со снижением вероятности выброса
ность [7, 28, 38, 39]. Может быть, поэтому
медиатора. Из этого следует, что на фоне джас-
изменения не всегда выявляются при реги-
плакинолида существенно снижается влияние
страции суммарной активности [8, 14, 40] из-за
факторов, способствующих парной депрессии.
одновременной потенциации и депрессии в
В целом, этот эффект тем меньше, чем больше
разных синапсах регистрируемой популяции
исходная PPR. Слабая, хотя и значимая кор-
нейронов [36, 41]. Соответственно, сравне-
реляция (r = -0,23, p = 0,006) демонстрирует,
ние средних амплитуд до и после аппликации
что, с одной стороны, влияние джасплакино-
джасплакинолида, как показывают наши экс-
лида на механизмы PPD может быть ограни-
перименты, может быть малоэффективным в
чено из-за отсутствия тормозного компонента
зависимости от преобладания того или иного
ещё до аппликации, а с другой стороны, чёт-
эффекта. Корреляционный анализ в наших
кая зависимость нарушается сопутствующими
экспериментах демонстрирует, что вызывае-
факторами, главным из которых, по-видимо-
мая джасплакинолидом потенциация проис-
му, является изменение вероятности выброса
ходит преимущественно при условии исходно
медиатора. Действительно, после разделения
высокой PPF и, следовательно, низкой вероят-
всей выборки на подгруппы с разной вели-
ности выброса медиатора. Вполне допустимо
чиной PPR и использования их в качестве
предположить, что реполимеризация актина
одного из группирующих факторов статисти-
лишь создаёт предпосылки для начала моди-
ческий анализ (ANOVA для повторных изме-
фикаций, и их характер соответствует «моле-
рений) подтвердил не только активирующее
кулярному профилю» синапса [29, 33].
БИОХИМИЯ том 88 вып. 3 2023
9*
484
КУДРЯШОВА
В наших экспериментах потенциация низ-
отвечают за транспорт и заякоривание везикул
коэффективных синапсов после аппликации
и секреторных белков, выступают в качестве
джасплакинолида сопровождалась снижением
барьера [5, 13, 15, 38, 43, 48, 49]. К сожалению,
величины PPF. В другой работе этот эффект
мало известно об участии актина в регуляции
также не был обнаружен при сравнении сред-
секреции медиатора в зрелых синапсах позво-
них PPF, однако авторы не учитывали инди-
ночных животных [14-16]. Необходимость ре-
видуальную вариабельность реакций на под-
полимеризации актина для рециркуляции и
ведение джасплакинолида [7]. Наши данные
активного транспорта везикул и секреторных
свидетельствуют о том, что изменения PPR
белков в активную зону пресинапса предпола-
могут иметь противоположную направлен-
гает, что реорганизация актинового цитоске-
ность в зависимости от исходной величины, и
лета может влиять на пресинаптическую пла-
поэтому в среднем полученные эффекты могут
стичность [13, 29, 34] и вероятность выброса
колебаться, если выборка имеет разный со-
медиатора [13, 28].
став, в частности, по исходной величине PPR.
Дестабилизация синапсов способствует кон-
К тому же в большинстве экспериментальных
солидации долговременных перестроек [3], но
исследований, в отличие от нашей работы,
реполимеризация актина сама по себе не га-
чаще всего отбирают для регистрации наи-
рантирует специфичности модификаций [14,
более стандартные срезы. Различия в эффек-
16, 38]. По сути такие же, как в нашей работе,
тах могут быть в какой-то степени связаны с
результаты, в частности, снижение PPR, были
используемым в нашей работе более щадящим
представлены в исследованиях на культуре
изготовлением срезов.
нейронов гиппокампа, но при деполимериза-
Тот факт, что потенциация на фоне джас-
ции актина в ответ на подведение латрукули-
плакинолида сопровождается снижением PPF,
на А [14]. Джасплакинолид и другие активаторы
согласуется с представлениями об участии по-
полимеризации актина, включая естественные,
лимеризации актина в регуляции вероятности
демонстрируют большое разнообразие эффек-
выброса медиатора. Зависимость пресинап-
тов [7, 29, 37]. Учитывая данные других авто-
тической пластичности от полимеризации и
ров [13, 35, 36], снижение PPF после под-
деполимеризации актина обнаружена в иссле-
ведения джасплакинолида можно объяснить
дованиях на нервной системе беспозвоноч-
стабилизацией F-актина, образованного вслед-
ных животных [12, 38, 42] и развивающихся
ствие гомеостатической потенциации низкоэф-
синапсах позвоночных животных, особенно
фективных реакций. У позвоночных животных
в культуре нейронов гиппокампа [14, 15, 28,
такой механизм явно имеет отношение к пла-
29, 43]. В зрелых нейронах гиппокампа оче-
стичности шипиков, что послужило развитию
видного влияния полимеризации актина на
представлений о роли полимеризации актина
пресинаптические функции пока не обнару-
в стабилизации первоначально лабильного со-
жено [15, 28, 43]. Тем не менее невозможно
стояния потенциированных синапсов [7].
полностью исключить, что зависимые от по-
Вероятность выброса медиатора опреде-
лимеризации актина модификации могут про-
ляется композиционным составом активной
исходить локально при реорганизации отдель-
зоны [13, 33, 47, 50-54] с непосредственным
ных синапсов, например, при долговременной
участием тесно взаимодействующих с актином
пластичности. Очевидно, что активация по-
белков [29, 45, 51, 52]. В активной зоне при-
лимеризации может быть менее заметна на
сутствуют в том числе стимулирующие поли-
фоне высокого содержания базового F-акти-
меризацию белки [14, 42, 47, 51, 55-57], что
на [15, 28], тем более что пресинаптический
обеспечивает локальные перестройки по ходу
компартмент центральной нервной системы
активации [5, 13, 36, 38, 58-61]. Джасплакино-
позвоночных животных в силу некоторых ме-
лид способствует образованию актиновых фи-
тодических ограничений менее доступен для
ламентов [62, 63], причём пресинаптические
исследования.
терминали в культуре нейронов гиппокампа
В свете представлений об эволюционной
демонстрируют прирост даже в отсутствие
консервативности организации секреторного
какой-либо дополнительной активации [15],
аппарата [34, 35, 44], данные о пресинапти-
что может влиять на изменение вероятности
ческих функциях актина в нервной системе
выброса медиатора при парной стимуля-
позвоночных животных, включая централь-
ции [5, 13, 29, 38].
ные синапсы, скорее всего, не отличаются
Необходимо отметить, что выявление моди-
от тех, которые получены более доступными
фикаций, непосредственно связанных с изме-
методами [5, 13, 14, 34, 45-47]. Образован-
нением вероятности выброса медиатора, ослож-
ные F-актином пресинаптические филаменты
няется суммацией с бисинаптическим ТПСП.
БИОХИМИЯ том 88 вып. 3 2023
АКТИН В ПРЕСИНАПТИЧЕСКОЙ ПЛАСТИЧНОСТИ
485
Представленные в работе данные трудно ин-
ответа, однако аппликация джасплакинолида
терпретировать без привлечения гипотезы об
приводит к потенциации либо первого, либо
увеличении вероятности выброса медиатора.
второго в паре ответа, причём в зависимости от
Потенциальная возможность влияния на пре-
исходной вероятности выброса медиатора.
синаптическую пластичность подтверждается
Можно предположить, что действие джас-
литературными данными [64]. Вместе с тем
плакинолида направлено на одни и те же меха-
влияние тормозного компонента, как правило,
низмы, которые определяют вероятность вы-
усиливается при увеличении интенсивности
броса медиатора и фасилитацию при парной
тестирующего раздражения и, соответственно,
стимуляции. К ним относятся механизмы регу-
амплитуды ответа, и влияние этих факторов,
ляции входящего в пресинапс кальция, который,
несомненно, выявлялось бы корреляционным
собственно, и стимулирует выброс медиато-
анализом, чего не наблюдается в экспери-
ра [30, 50, 51, 85-87]. В то же время остаточный
менте: изменения PPF зависели от их исход-
кальций взаимодействует с Ca2+-сенсорами, спо-
ной величины, но не от исходной амплитуды
собными усиливать фасилитацию при парной
или интенсивности раздражения. Безусловно,
стимуляции [30, 51, 54, 55, 68, 88, 89]. Оба меха-
эффекты джасплакинолида не ограничивают-
низма, а также величина доступного пула медиа-
ся избирательным влиянием исключительно
тора реагируют на увеличение проводимости
на возбуждающую или тормозную передачу.
пресинаптических кальциевых каналов [68, 72,
Более подробный анализ изменений ТПСП
88-93], хотя и в разной степени в зависимости
представлен в другой работе [65].
от наличия реагирующих на остаточный каль-
В рамках этих представлений определён-
ций Ca2+-сенсоров [54, 85, 88, 92, 94]. Взаимо-
ные затруднения вызывает интерпретация
действие F-актина с регуляторными субъедини-
модификаций второго в паре ответа. Мало-
цами кальциевых каналов [29, 95] не исключает
вероятно, что даже при исходно высокой ве-
возможного влияния джасплакинолида.
роятности секреции фасилитация при парной
стимуляции может быть ограничена по причи-
не истощения запасов медиатора [51, 66-68].
ЗАКЛЮЧЕНИЕ
Необходимо, однако, отметить, что зависи-
мое от актина пополнение запасов медиатора
Детальный анализ кратковременной пла-
[5, 12, 14, 16, 29, 46, 49, 57, 69-72] вполне под-
стичности при парной стимуляции в пере-
ходит для объяснения эффектов джасплакино-
живающих срезах гиппокампа, инкубирован-
лида, связанных с увеличением второго в паре
ных с активатором полимеризации актина
ответа, тем более что полимеризация актина
джасплакинолидом, дополняет данные других
имеет отношение к механизмам мобилизации
исследований об участии актина в пресинап-
доступных для высвобождения синаптических
тических функциях. PPF-тест выявил разнона-
везикул активной зоны пресинапса [29, 46, 51,
правленные модификации PPR в зависимости
58, 60, 72]. Взаимодействие актиновых фила-
от характера пресинаптической активности
ментов с пресинаптическими везикулами опос-
до аппликации. Величина PPF в основном об-
редовано синапсином [42, 70, 74]. Принуди-
ратно пропорциональна вероятности выброса
тельная полимеризация актина и, как след-
медиатора, и предполагаемое на этом основа-
ствие, изменение опосредованных синапсином
нии увеличение вероятности выброса медиа-
функций рециркуляции синаптических вези-
тора изначально низкоэффективных синапсов
кул [55, 56] может влиять на свойства кратко-
может быть связано либо с непосредственным
временной пластичности, в том числе при пар-
активирующим действием джасплакинолида за
ной стимуляции [51, 75-77]. Известны также
счёт образования дополнительных филаментов,
и некоторые другие интерферирующие с PPF
либо со стабилизацией тех модификаций, кото-
механизмы, обеспечивающие дополнительный
рые происходят вследствие гомеостатической
прирост [53, 54, 78] или подавление [54, 79-81]
регуляции пресинаптических функций [5, 38,
следующего постсинаптического потенциала,
49, 90]. Однако это не может объяснить увели-
но их связь с полимеризацией актина пока не
чения PPR в предположительно «высокоэффек-
обнаружена. Неясно также, по какой причине
тивных» синапсах, тем более что неизменная
упомянутые выше зависимые от актина меха-
амплитуда первого ответа на фоне джасплаки-
низмы активации PPF [14, 37, 53, 82-84] могли
нолида свидетельствует против снижения веро-
бы реагировать на подведение джасплакино-
ятности выброса медиатора. Соответственно,
лида только при условии более очевидной де-
потенциация второго ответа может быть опосре-
прессии второго в паре ответа. При постсинап-
дована влиянием джасплакинолида на зависи-
тической потенциации увеличивались бы оба
мые от F-актина механизмы кратковременной
БИОХИМИЯ том 88 вып. 3 2023
486
КУДРЯШОВА
пластичности при парной стимуляции, напри-
Вклад автора. И.В. Кудряшова - концеп-
мер, величину пула доступного медиатора или
ция, проведение экспериментов и написание
активность пресинаптических кальциевых ка-
текста статьи.
налов [29, 54]. Оба эффекта доминируют в зави-
Финансирование. Работа выполнена в рам-
симости от фоновой активности до аппликации
ках государственного задания Министерства
джасплакинолида и имеют противоположную
образования и науки Российской Федерации
направленность, что, скорее всего, связано с
на 2021-2023 гг. (АААА-А17-117092040002-6).
асимптотическим ограничением прироста имею-
Дополнительное внешнее финансирование
щих исходно высокие значения показателей.
отсутствует.
Так или иначе, актиновые филаменты обес-
Конфликт интересов. Автор заявляет об от-
печивают транспорт, заякоривание и другие
сутствии конфликта интересов.
вспомогательные функции [51]. Интерпретация
Соблюдение этических норм. Эксперимен-
наших результатов в рамках представлений о
ты с животными выполнены в соответствии с
роли F-актина в качестве существенного ком-
требованиями международного и националь-
понента сигнального комплекса активной зоны
ного законодательства в области защиты и ис-
пресинапса приводит к заключению о влиянии
пользования животных в экспериментальных
джасплакинолида на компенсаторные модифи-
исследованиях. Протокол эксперимента утвер-
кации при активации девиантных синапсов.
ждён Этической комиссией ИВНД и НФ РАН.
СПИСОК ЛИТЕРАТУРЫ
1.
Choquet, D., and Triller, A. (2013) The dynamic
9.
Kramar, E. A., Lin, B., Rex, C. S., Gall, C. M., and
synapse, Neuron,
80,
691-703, doi:
10.1016/
Lynch, G. (2006) Integrin-driven actin polymerization
j.neuron.2013.10.013.
consolidates long-term potentiation, Proc. Natl.
2.
Meyer, D., Bonhoeffer, T., and Scheuss, V. (2014)
Acad. Sci. USA, 103, 5579-5584, doi: 10.1073/pnas.
Balance and stability of synaptic structures during
0601354103.
synaptic plasticity, Neuron, 82, 430-443, doi: 10.1016/
10.
Messaoudi, E., Kanhema, T., Soule, J., Tiron, A.,
j.neuron.2014.02.031.
Dagyte, G., et al.
(2007) Sustained Arc/Arg3.1
3.
Kudryashova, I. V. (2019) The molecular basis of
synthesis controls long-term potentiation consolidation
destabilization of synapses as a factor of structural
through regulation of local actin polymerization in the
plasticity, Neurochem. J.,
13,
3-13, doi:
10.1134/
dentate gyrus in vivo, J. Neurosci., 27, 10445-10455,
S1819712419010136.
doi: 10.1523/JNEUROSCI.2883-07.2007.
4.
Dillon, C., and Goda, Y.
(2005) The actin
11.
Galvez, B., Gross, N., and Sumikawa, K.
(2016)
cytoskeleton: integrating form and function at the
Activation of α7 nicotinic acetylcholine receptors
synapse, Annu. Rev. Neurosci., 28, 25-55, doi: 10.1146/
protects potentiated synapses from depotentiation
annurev.neuro.28.061604.135757.
during theta pattern stimulation in the hippocampal
5.
Cingolani, L. A., and Goda, Y. (2008) Actin in action:
CA1 region of rats, Neuropharmacology, 105, 378-387,
the interplay between the actin cytoskeleton and
doi: 10.1016/j.neuropharm.2016.02.008.
synaptic efficacy, Nat. Rev. Neurosci., 9, 344-356,
12.
Shupliakov, O., Bloom, O., Gustafsson, J. S.,
doi: 10.1038/nrn2373.
Kjaerulff, O., Low, P., et al. (2002) Impaired re-
6.
Ramachandran, B., and Frey, J. U. (2009) Interfering
cycling of synaptic vesicles after acute perturbation
with the actin network and its effect on long-term
of the presynaptic actin cytoskeleton, Proc. Natl.
potentiation and synaptic tagging in hippocampal CA1
Acad. Sci. USA, 99, 14476-14481, doi: 10.1073/pnas.
neurons in slices in vitro, J. Neurosci., 29, 12167-12173,
212381799.
doi: 10.1523/JNEUROSCI.2045-09.2009.
13.
Böhme, M. A., McCarthy, A. W., Grasskamp, A. T.,
7.
Rex, C. S., Gavin, C. F., Rubio, M. D., Kramar, E. A.,
Beuschel, C. B., Goel, P., et al.
(2019) Rapid
Chen, L. Y., et al. (2010) Myosin IIB regulates actin
active zone remodeling consolidates presynaptic
dynamics during synaptic plasticity and memory
potentiation, Nat. Commun., 10, 1085, doi: 10.1038/
formation, Neuron,
67,
603-617, doi:
10.1016/
s41467-019-08977-6.
j.neuron.2010.07.016.
14.
Morales, M., Colicos, M. A., and Goda, Y. (2000) Ac-
8.
Krucker, T., Siggins, G. R., and Halpain, S. (2000)
tin-dependent regulation of neurotransmitter release at
Dynamic actin filaments are required for stable
central synapses, Neuron, 27, 539-550, doi: 10.1016/
long-term potentiation (LTP) in area CA1 of the
s0896-6273(00)00064-7.
hippocampus, Proc. Natl. Acad. Sci. USA,
97,
15.
Sankaranarayanan, S., Atluri, P. P., and Ryan, T. A.
6856-6861, doi: 10.1073/pnas.100139797.
(2003) Actin has a molecular scaffolding, not propul-
БИОХИМИЯ том 88 вып. 3 2023
АКТИН В ПРЕСИНАПТИЧЕСКОЙ ПЛАСТИЧНОСТИ
487
sive, role in presynaptic function, Nat. Neurosci., 6,
aptic involvement in long-term potentiation, J. Neu-
127-135, doi: 10.1038/nn1002.
rosci.,
14,
5325-5337, doi:
10.1523/JNEUROSCI.
16.
Rust, M. B., and Maritzen, T. (2015) Relevance of
14-09-05325.1994.
presynaptic actin dynamics for synapse function
28.
Yao, J., Qi, J., and Chen, G. (2006) Actin-dependent
and mouse behavior, Exp. Cell Res., 335, 165-171,
activation of presynaptic silent synapses contributes
doi: 10.1016/j.yexcr.2014.12.020.
to long-term synaptic plasticity in developing
17.
Malinow, R., and Tsien, R. W. (1990) Presynaptic
hippocampal neurons, J. Neurosci., 26, 8137-8147,
enhancement shown by whole-cell recordings of long-
doi: 10.1523/JNEUROSCI.1183-06.2006.
term potentiation in hippocampal slices, Nature, 46,
29.
Guzman, G. A., Guzman, R. E., Jordan, N., and
177-180, doi: 10.1038/346177a0.
Hidalgo, P. A. (2019) A tripartite interaction among
18.
Malgaroli, A., Ting, A. E., Wendland, B., Berga-
the calcium channel α1- and β-subunits and F-actin
maschi, A., Villa, A., et al. (1995) Presynaptic com-
increases the readily releasable pool of vesicles and its
ponent of long-term potentiation visualized at individ-
recovery after depletion, Front. Cell Neurosci., 13, 125,
ual hippocampal synapses, Science, 268, 1624-1628,
doi: 10.3389/fncel.2019.00125.
doi: 10.1126/science.7777862.
30.
Zucker, R. S., and Regehr, W. G. (2002) Short-term
19.
Nicoll, R. A., and Malenka, R. C. (1995) Contrasting
synaptic plasticity, Annu. Rev. Physiol., 64, 355-405,
properties of two forms of long-term potentiation
doi: 10.1146/annurev.physiol.64.092501.114547.
in the hippocampus, Nature,
377,
115-118,
31.
Fioravante, D., and Regehr, W. G. (2011) Short-term
doi: 10.1038/377115a0.
forms of presynaptic plasticity, Curr. Opin. Neurobiol.,
20.
Blundon, J. A., and Zakharenko, S. S. (2008) Dis-
21, 269-274, doi: 10.1016/j.conb.2011.02.003.
secting the components of long-term potentia-
32.
Bubb, M. R., Spector, I., Beyer, B. B., and Fosen, K. M.
tion, Neuroscientist,
14,
598-608, doi:
10.1177/
(2000) Effects of jasplakinolide on the kinetics of
1073858408320643.
actin polymerization. An explanation for certain in
21.
Sokolov, M. V., Rossokhin, A. V., Astrelin, A. V.,
vivo observations, J. Biol. Chem., 275, 5163-5170,
Frey, J. U., and Voronin, L. L. (2002) Quantal
doi: 10.1074/jbc.275.7.5163.
analysis suggests strong involvement of presynaptic
33.
Lazarevic, V., Pothula, S., Andres-Alonso, M., and
mechanisms during the initial maintenance of
Fejtova, A. (2013) Molecular mechanisms driving
long-term potentiation in rat hippocampal CA1
homeostatic plasticity of neurotransmitter release,
area in vitro, Brain Res., 957, 61-75, doi: 10.1016/
Front. Cell Neurosci.,
7,
244, doi:
10.3389/
s0006-8993(02)03600-4.
fncel.2013.00244.
22.
Emptage, N. J., Reid, C. A., Fine, A., and Bliss, T. V.
34.
Davis, G. W., and Muller, M. (2015) Homeostatic
(2003) Optical quantal analysis reveals a presynaptic
control of presynaptic neurotransmitter release,
component of LTP at hippocampal Schaffer-
Annu. Rev. Physiol.,
77,
251-270, doi:
10.1146/
associational synapses, Neuron,
38,
797-804,
annurev-physiol-021014-071740.
doi: 10.1016/s0896-6273(03)00325-8.
35.
Ortega, J. M., Genç, Ö., and Davis, G. W. (2018)
23.
Stanton, P. K., Winterer, J., Zhang, X. L., and Muller, W.
Molecular mechanisms that stabilize short term
(2005) Imaging LTP of presynaptic release of
synaptic plasticity during presynaptic homeo-
FM1-43 from the rapidly recycling vesicle pool of
static plasticity, eLife,
7, e40385, doi:
10.7554/
Schaffer collateral-CA1 synapses in rat hippocampal
eLife.40385.
slices, Eur. J. Neurosci., 22, 2451-2461, doi: 10.1111/
36.
Goel, P., Bergeron, D. D., Böhme, M. A., Nunnelly, L.,
j.1460-9568.2005.04437.x.
Lehmann, M., et al. (2019) Homeostatic scaling
24.
Bayazitov, I. T., Richardson, R. J., Fricke, R. G.,
of active zone scaffolds maintains global synaptic
and Zakharenko, S. S. (2007) Slow presynaptic and
strength, J. Cell Biol., 18, 1706-1724, doi: 10.1083/
fast postsynaptic components of compound long-
jcb.201807165.
term potentiation, J. Neurosci.,
27,
11510-11521,
37.
Ivanov, A., Esclapez, M., Pellegrino, Ch., Shirao, T.,
doi: 10.1523/JNEUROSCI.3077-07.2007.
and Ferhat, L. (2009) Drebrin A regulates dendritic
25.
Kudryashova, I. V., Onufriev, M. V., and Gulyaeva, N. V.
spine plasticity and synaptic function in mature
(2014) Caspase-3 and calpain: differently directed in-
cultured hippocampal neurons, J. Cell Sci., 122, 524-
volvement in presynaptic long-term plasticity, Neuro-
534, doi: 10.1242/jcs.033464.
chem. J., 8, 162-167, doi: 10.1134/S181971241403009X.
38.
Bleckert, A., Photowala, H., and Alford, S. (2012)
26.
Kuhnt, U., and Voronin, L. L. (1994) Interaction
Dual pools of actin at presynaptic terminals, J. Neuro-
between paired-pulse facilitation and long-term po-
physiol., 107, 3479-3492, doi: 10.1152/jn.00789.2011.
tentiation in area CA1 of guinea-pig hippocampal slic-
39.
Andrade, A. L., and Rossi, D. J. (2010) Simulated
es: application of quantal analysis, Neuroscience, 62,
ischaemia induces Ca2+-independent glutamatergic
391-397, doi: 10.1016/0306-4522(94)90374-3.
vesicle release through actin filament depolymerization
27.
Schulz, P. E., Cook, E. P., and Johnston, D. (1994)
in area CA1 of the hippocampus, J. Physiol., 588,
Changes in paired-pulse facilitation suggest presyn-
1499-1514, doi: 10.1113/jphysiol.2010.187609.
БИОХИМИЯ том 88 вып. 3 2023
488
КУДРЯШОВА
40.
Rex, C. S., Chen, L. Y., Sharma, A., Liu, J., Baba-
and short-term synaptic plasticity? Front. Synapt.
yan, A. H., et al. (2009) Different Rho GTPase-
Neurosci., 11, 7, doi: 10.3389/fnsyn.2019.00007.
dependent signaling pathways initiate sequential steps
54.
Mochida, S. (2019) Presynaptic calcium channels, Int.
in the consolidation of long-term potentiation, J. Cell
J. Mol. Sci., 20, 2217, doi: 10.3390/ijms20092217.
Biol., 186, 85-97, doi: 10.1083/jcb.200901084.
55.
Leal-Ortiz, S., Waites, C. L., Terry-Lorenzo, R.,
41.
Gaviño, M. A., Ford, K. J., Archila, S., and Davis, G. W.
Zamorano, P., Gundelfinger, E. D., et al.
(2008)
(2015) Homeostatic synaptic depression is achieved
Piccolo modulation of synapsin1a dynamics regulates
through a regulated decrease in presynaptic calcium
synaptic vesicle exocytosis, J. Cell Biol., 181, 831-846,
channel abundance, eLife, 4, e05473, doi: 10.7554/
doi: 10.1083/jcb.200711167.
eLife.05473.
56.
Waites, C. L., Leal-Ortiz, S. A., Andlauer, T. F.,
42.
Bloom, O., Evergren, E., Tomilin, N., Kjaerulff, O.,
Sigrist, S. J., and Garner, C. C. (2011) Piccolo
Low, P., et al. (2003) Colocalization of synapsin and
regulates the dynamic assembly of presynaptic
actin during synaptic vesicle recycling, J. Cell Biol.,
F-actin, J. Neurosci., 31, 14250-14263, doi: 10.1523/
161, 737-747, doi: 10.1083/jcb.200212140.
JNEUROSCI.1835-11.2011.
43.
Zhang, W., and Benson, D. L. (2001) Stages of
57.
Dason, J. S., Smith, A. J., Marin, L., and Charl-
synapse development defined by dependence on
ton, M. P. (2014) Cholesterol and F-actin are required
F-actin, J. Neurosci., 21, 5169-5181, doi: 10.1523/
for clustering of recycling synaptic vesicle proteins in
JNEUROSCI.21-14-05169.2001.
the presynaptic plasma membrane, J. Physiol., 592,
44.
Ackermann, F., Waites, C. L., and Garner, C. C.
621-633, doi: 10.1113/jphysiol.2013.265447.
(2015) Presynaptic active zones in invertebrates and
58.
Sakaba, T., and Neher, E. (2003) Involvement of actin
vertebrates, EMBO Rep., 16, 923-938, doi: 10.15252/
polymerization in vesicle recruitment at the calyx of
embr.201540434.
Held synapse, J. Neurosci., 23, 837-846, doi: 10.1523/
45.
Südhof, T. C. (2012) The presynaptic active zone,
JNEUROSCI.23-03-00837.2003.
Neuron, 75, 11-25, doi: 10.1016/j.neuron.2012.06.012.
59.
Gundelfinger, E. D., and Fejtova, A. (2012) Molecular
46.
Lee, J. S., Ho, W. K., Neher, E., and Lee, S. H.
organization and plasticity of the cytomatrix at the
(2013) Superpriming of synaptic vesicles after their
active zone, Curr. Opin. Neurobiol., 22, 423-430,
recruitment to the readily releasable pool, Proc. Natl.
doi: 10.1016/j.conb.2011.10.005.
Acad. Sci. USA, 110, 15079-15084, doi: 10.1073/
60.
Lee, J. S., Ho, W. K., and Lee, S. H. (2012) Actin-
pnas.1314427110.
dependent rapid recruitment of reluctant synaptic
47.
Ghelani, T., and Sigrist, S. J.
(2018) Coupling
vesicles into a fast-releasing vesicle pool, Proc. Natl.
the structural and functional assembly of synaptic
Acad. Sci. USA,
109, E765-E774, doi:
10.1073/
release sites, Front. Neuroanat., 12, 81, doi: 10.3389/
pnas.1114072109.
fnana.2018.00081.
61.
Engholm-Keller, K., Waardenberg, A. J., Müller, J. A.,
48.
Halpain, S. (2003) Actin in a supporting role, Nat.
Wark, J. R., Fernando, R. N., et al. (2019) The tem-
Neurosci., 6, 101-102, doi: 10.1038/nn0203-101.
poral profile of activity-dependent presynaptic
49.
Miki, T., Malagon, G., Pulido, C., Llano, I., Neher, E.,
phospho-signalling reveals long-lasting patterns of
et al. (2016) Actin- and myosin- dependent vesicle
poststimulus regulation, PLoS Biol., 17, e3000170,
loading of presynaptic docking sites prior to exocy-
doi: 10.1371/journal.pbio.3000170.
tosis, Neuron, 91, 808-823, doi: 10.1016/j.neuron.
62.
Okamoto, K., Nagai, T., Miyawaki, A., and Ha-
2016.07.033.
yashi, Y. (2004) Rapid and persistent modulation of
50.
Holderith, N., Lorincz, A., Katona, G., Rózsa, B.,
actin dynamics regulates postsynaptic reorganization
Kulik, A., et al. (2012) Release probability of hippo-
underlying bidirectional plasticity, Nat. Neurosci., 7,
campal glutamatergic terminals scales with the size
1104-1112, doi: 10.1038/nn1311.
of the active zone, Nat. Neurosci.,
15,
988-997,
63.
Holzinger, A. (2009) Jasplakinolide: an actin-spe-
doi: 10.1038/nn.3137.
cific reagent that promotes actin polymerization,
51.
Körber, Ch., and Kuner, Th.
(2016) Molecular
Meth. Mol. Biol., 586, 71-87, doi: 10.1007/978-1-
machines regulating the release probability of synaptic
60761-376-3_4.
vesicles at the active zone, Front. Synapt. Neurosci., 8,
64.
Kudryashova, I. V.
(2021) The reorganization of
5, doi: 10.3389/fnsyn.2016.00005.
the actin matrix as a factor of presynaptic plas-
52.
Bruckner, J. J., Zhan, H., Gratz, S. J., Rao, M.,
ticity, Neurochem. J.,
15,
217-225, doi:
10.1134/
Ukken, F., et al. (2017) Fife organizes synaptic vesicles
S1819712421030089.
and calcium channels for high-probability neurotrans-
65.
Kudryashova, I. V. (2022) Inhibitory control of short-
mitter release, J. Cell Biol., 216, 231-246, doi: 10.1083/
term plasticity during paired pulse stimulation depends
jcb.201601098.
on actin polymerization, Neurochem. J., 16, 136-146,
53.
Gustafsson, B., Ma, R., and Hanse, E. (2019) The
doi: 10.1134/S1819712422020106.
small and dynamic pre-primed pool at the release site;
66.
Sun, H. Y., Li, Q., Bartley, A. F., and Dobrunz, L. E.
A useful concept to understand release probability
(2018) Target-cell-specific short-term plasticity
БИОХИМИЯ том 88 вып. 3 2023
АКТИН В ПРЕСИНАПТИЧЕСКОЙ ПЛАСТИЧНОСТИ
489
reduces the excitatory drive onto CA1 interneurons
79.
Rozov, A., and Burnashev, N. (1999) Polyamine-
relative to pyramidal cells during physiologically-
dependent facilitation of postsynaptic AMPA receptors
derived spike trains, Neuroscience, 388, 430-447, doi:
counteracts paired-pulse depression, Nature,
401,
10.1016/j.neuroscience.2018.07.051.
594-598, doi: 10.1038/44151.
67.
Sullivan, J. M. (2007) A simple depletion model of
80.
Brody, D. L., and Yue, D. T. (2000) Release-inde-
the readily releasable pool of synaptic vesicles cannot
pendent short-term synaptic depression in cultured
account for paired-pulse depression, J. Neurophysiol.,
hippocampal neurons, J. Neurosci., 20, 2480-2494,
97, 948-950, doi: 10.1152/jn.00554.2006.
doi: 10.1523/JNEUROSCI.20-07-02480.2000.
68.
Catterall, W. A., Leal, K., and Nanou, E.
(2013)
81.
Nanou, E., and Catterall, W. A. (2018) Calcium
Calcium channels and short-term synaptic plasticity,
channels, synaptic plasticity, and neuropsychi-
J. Biol. Chem.,
288,
10742-10749, doi:
10.1074/
atric disease, Neuron, 98, 466-481, doi: 10.1016/
jbc.R112.411645.
j.neuron.2018.03.017.
69.
Kaksonen, M., Toret, C. P., and Drubin, D. G. (2006)
82.
Chamberland, S., Evstratova, A., and Toth, K.
Harnessing actin dynamics for clathrin-mediated
(2014) Interplay between synchronization of mul-
endocytosis, Nat. Rev. Mol. Cell Biol., 7, 404-414,
tivesicular release and recruitment of additional
doi: 10.1038/nrm1940.
release sites support short-term facilitation at hip-
70.
Verstegen, A. M., Tagliatti, E., Lignani, G., Marte, A.,
pocampal mossy fiber to CA3 pyramidal cells syn-
Stolero, T., et al. (2014) Phosphorylation of synapsin I
apses, J. Neurosci., 34, 11032-11047, doi: 10.1523/
by cyclin-dependent kinase-5 sets the ratio between
JNEUROSCI.0847-14.2014.
the resting and recycling pools of synaptic vesicles at
83.
Rajappa, R., Gauthier-Kemper, A., Böning, D.,
hippocampal synapses, J. Neurosci., 34, 7266-7280,
Hüve, J., and Klingauf, J. (2016) Synaptophysin 1
doi: 10.1523/JNEUROSCI.3973-13.2014.
clears synaptobrevin 2 from the presynaptic active
71.
Wu, X. S., Lee, S. H., Sheng, J., Zhang, Z.,
zone to prevent short-term depression, Cell Rep., 14,
Zhao, W. D., et al. (2016) Actin is crucial for all ki-
1369-1381, doi: 10.1016/j.celrep.2016.01.031.
netically distinguishable forms of endocytosis at
84.
Hruska, M., Henderson, N., Le Marchand, S. J., Jafri, H.,
synapses, Neuron,
92,
1020-1035, doi:
10.1016/
and Dalva, M. B. (2018) Synaptic nanomodules un-
j.neuron.2016.10.014.
derlie the organization and plasticity of spine synaps-
72.
Kaeser, P. S., and Regehr, W. G. (2017) The readily
es, Nat. Neurosci., 21, 671-682, doi: 10.1038/s41593-
releasable pool of synaptic vesicles, Curr. Opin.
018-0138-9.
Neurobiol., 43, 63-70, doi: 10.1016/j.conb.2016.12.012.
85.
Catterall, W. A., and Few, A. P. (2008) Calcium
73.
Bourne, J., Morgan, J. R., and Pieribone, V. A.
channel regulation and presynaptic plasticity, Neuron,
(2006) Actin polymerization regulates clathrin coat
59, 882-901, doi: 10.1016/j.neuron.2008.09.005.
maturation during early stages of synaptic vesicle
86.
Eggermann, E., Bucurenciu, I., Goswami, S. P., and
recycling at lamprey synapses, J. Comp. Neurol., 497,
Jonas, P. (2012) Nanodomain coupling between Ca2+
600-609, doi: 10.1002/cne.21006.
channels and sensors of exocytosis at fast mammalian
74.
Bahler, M., and Greengard, P. (1987) Synapsin I
synapses, Nat. Rev. Neurosci., 13, 7-21, doi: 10.1038/
bundles F-actin in a phosphorylation- dependent
nrn3125.
manner, Nature, 326, 704-707, doi: 10.1038/326704a0.
87.
Scimemi, A., and Diamond, J. S. (2012) The number
75.
Rosahl, T. W., Geppert, M., Spillane, D., Herz, J.,
and organization of Ca2+ channels in the active zone
Hammer, R. E., et al. (1993) Short-term synaptic
shapes neurotransmitter release from schaffer collateral
plasticity is altered in mice lacking synapsin I, Cell, 75,
synapses, J. Neurosci., 32, 18157-18176, doi: 10.1523/
661-670, doi: 10.1016/0092-8674(93)90487-b.
JNEUROSCI.3827-12.2012.
76.
Vasileva, M., Horstmann, H., Geumann, C., Gitler, D.,
88.
Yan, J., Leal, K., Magupalli, V. G., Nanou, E.,
and Kuner, T. (2012) Synapsin- dependent reserved
Martinez, G. Q., et al. (2014) Modulation of CaV2.1
pool of synaptic vesicles supports replenishment
channels by neuronal calcium sensor-1 induces short-
of the readily releasable pool under intense synap-
term synaptic facilitation, Mol. Cell Neurosci., 63, 124-
tic transmission, Eur. J. Neurosci., 36, 3005-3020,
131, doi: 10.1016/j.mcn.2014.11.001.
doi: 10.1111/j.1460-9568.2012.08225.x.
89.
Nanou, E., Sullivan, J. M., Scheuer, T., and
77.
Orlando, M., Lignani, G., Maragliano, L., Fassio, A.,
Catterall, W. A. (2016) Calcium sensor regulation of
Onofri, F., et al. (2014) Functional role of ATP binding
the CaV2.1 Ca2+ channel contributes to short-term
to synapsin I in synaptic vesicle trafficking and release
synaptic plasticity in hippocampal neurons, Proc.
dynamics, J. Neurosci., 34, 14752-14768, doi: 10.1523/
Natl. Acad. Sci. USA, 113, 1062-1067, doi: 10.1073/
JNEUROSCI.1093-14.2014.
pnas.1524636113.
78.
Watanabe, S., Rost, B. R., Camacho-Perez, M.,
90.
Mochida, S.
(2011) Activity-dependent regulation
Davis, M. W., Sohl-Kielczynski, B., et al.
(2013)
of synaptic vesicle exocytosis and presynaptic short-
Ultrafast endocytosis at mouse hippocampal synapses,
term plasticity, Neurosci. Res., 70, 16-23, doi: 10.1016/
Nature, 504, 242-247, doi: 10.1038/nature12809.
j.neures.2011.03.005.
БИОХИМИЯ том 88 вып. 3 2023
490
КУДРЯШОВА
91. Zhao, C., Dreosti, E., and Lagnado, L. (2011) Ho-
ly-releasable pool, J. Neurosci., 33, 4625-4633, doi:
meostatic synaptic plasticity through changes in pre-
10.1523/JNEUROSCI.4031-12.2013.
synaptic calcium influx, J. Neurosci., 31, 7492-7496,
94. Lee, A., Westenbroek, R. E., Haeseleer, F., Palczewski, K.,
doi: 10.1523/JNEUROSCI.6636-10.2011.
Scheuer, T., et al. (2002) Differential modulation of
92. Leal, K., Mochida, S., Scheuer, T., and Catterall, W. A.
CaV2.1 channels by calmodulin and Ca2+-binding pro-
(2012) Fine-tuning synaptic plasticity by modulation
tein 1, Nat Neurosci., 5, 210-217, doi: 10.1038/nn805.
of CaV2.1 channels with Ca2+ sensor proteins, Proc.
95. Magupalli, V. G., Mochida, S., Yan, J., Jiang, X.,
Natl. Acad. Sci. USA, 109, 17069-17074, doi: 10.1073/
Westenbroek, R. E., et al. (2013) Ca2+-independent
pnas.1215172109.
activation of Ca2+/calmodulin-dependent protein ki-
93. Thanawala, M. S., and Regehr, W. G. (2013) Presyn-
nase II bound to the C-terminal domain of CaV2.1
aptic calcium influx controls neurotransmitter release
calcium channels, J. Biol. Chem., 288, 4637-4648,
in part by regulating the effective size of the readi-
doi: 10.1074/jbc.M112.369058.
PRESYNAPTIC PLASTICITY IS ASSOCIATED
WITH ACTIN POLYMERIZATION
I. V. Kudryashova
Laboratory of Functional Biochemistry of the Nervous System,
Institute of Higher Nervous Activity and Neurophysiology, Russian Academy of Sciences,
117485 Moscow, Russia; e-mail: iv_kudryashova@mail.ru
Modifications of presynaptic short-term plasticity as a result of actin polymerization were tested in rat
hippocampal slices using a paired-pulse paradigm. Paired-pulse stimulation of Schaffer collaterals with
70 ms interpulse interval was continuously presented every 30 s before and during perfusion with jasplakino-
lide, an activator of actin polymerization. Jasplakinolide application resulted in the potentiation of
CA3-CA1 responses accompanied by paired-pulse facilitation decrease, these effects suggesting presyn-
aptic modifications. The jasplakinolide-induced potentiation significantly depended on the initial paired-
pulse facilitation values. These data indicate that jasplakinolide-mediated changes in actin polymerization
may promote high probability of release. Less typical for CA3-CA1 synapses responses with very low initial
paired-pulse facilitation or paired-pulse depression (close to 1 or even lower) demonstrated the potentiation
of the second, but not the first amplitude in a pair, paired-pulse ratio significantly increasing from 0.8 to 1.0
in average. This may suggest a negative impact of jasplakinolide on the mechanisms underlying paired-pulse
depression. Nonetheless, actin polymerization promotes potentiation, though patterns of this activation may
differ depending on initial input characteristics. We conclude that in addition to increased neurotransmitter
release probability other mechanisms known to suppress paired pulse facilitation may be also involved in
effects of jasplakinolide.
Keywords: hippocampus, presynaptic plasticity, paired-pulse facilitation, paired-pulse depression, actin
polymerization, jasplakinolide
БИОХИМИЯ том 88 вып. 3 2023