БИОХИМИЯ, 2023, том 88, вып. 4, с. 558 - 568
УДК 577.17.05
НЕЙРОНАЛЬНЫЕ ЭКЗОСОМЫ
КАК НОВАЯ СИСТЕМА СИГНАЛИНГА
Обзор
© 2023 А.А. Яковлев1,2
1 Институт высшей нервной деятельности и нейрофизиологии РАН,
117485 Москва, Россия; электронная почта: al_yakovlev@ihna.ru
2 Научно-практический психоневрологический центр им. З.П. Соловьева,
Департамент здравоохранения Москвы, 115419 Москва, Россия
Поступила в редакцию 07.11.2022
После доработки 01.03.2023
Принята к публикации 03.03.2023
С каждым годом изучению нейрональных экзосом посвящается все больше и больше работ. Суще-
ственно исследован потенциал экзосом как диагностических маркеров для нейродегенеративных
заболеваний, и похожие схемы поиска маркеров заимствованы для исследования психиатрических
патологий. Выяснены основы биогенеза экзосом в разных типах клеток, активно идет исследова-
ние физиологического значения экзосом, проясняются многие аспекты сигналинга с их участием.
При этом накоплены данные, указывающие на роль экзосомального сигналинга как на важный
элемент межнейрональной коммуникации. Достаточно ли у нас оснований, чтобы назвать экзосо-
мы новым неканоническим нейротрансмиттером в головном мозге? Ответу на этот вопрос посвя-
щена данная дискуссионная работа, в которой автор представляет на суд научной общественности
концепцию о возможной роли экзосом мозга как сигнальной системы.
КЛЮЧЕВЫЕ СЛОВА: экзосомы, экстраклеточные везикулы, нейроны, деполяризация, кальций, малые
ГТФазы Rab, комплекс SNARE.
DOI: 10.31857/S0320972523040024, EDN: AKCJBZ
ВВЕДЕНИЕ
нято говорить о размере и/или плотности ве-
зикул, не вдаваясь в подробности. Например,
Под термином «экстраклеточные везику-
вполне допустимо говорить о малых экстра-
лы» понимаются любые секретируемые клет-
клеточных везикулах только на основании раз-
кой в экстраклеточное пространство мембран-
мера (до 200 нм) вне зависимости от природы
ные везикулы [1]. Экстраклеточные везикулы
везикулы.
принято классифицировать на три основные
Экзосомы характеризуются несколькими
группы в зависимости от механизма их обра-
характерными белковыми маркерами. Это тет-
зования. Экзосомы имеют размер 50-150 нм
распанины (CD81, CD9, CD63) и характер-
и являются продуктом эндолизосомальной
ные мембранные белки эндолизосомальной
системы. Микровезикулы (100-1000 нм), ина-
системы (например, Alix, TSG101, HSC 70).
че называемые микрочастицы или эктосомы,
Список маркеров экзосом постоянно попол-
являются результатом отшнуровывания мем-
няется по мере появления новых эксперимен-
бранных везикул непосредственно от плазма-
тальных данных, но актуальное положение дел
тической мембраны. Апоптотические тельца
всегда можно найти в общедоступных базах
(400-4000 нм) являются остатками клеток,
погибших в результате апоптоза. Между экзо-
сомы образуются в результате отшнуровыва-
сомами, микровезикулами и апоптотическими
ния везикул с цитоплазматическим содержи-
тельцами могут быть как сходства, так и раз-
мым внутрь поздних эндосом. Собственно,
личия по внутривезикулярному составу [2].
после слияния образованного этим способом
Зачастую истинное происхождение экстра-
мультивезикулярного тельца с плазматической
клеточных везикул неизвестно или даже не
мембраной содержащиеся в нем интралюме-
может быть установлено, в таком случае при-
нальные везикулы становятся экзосомами.
558
НЕЙРОНАЛЬНЫЕ ЭКЗОСОМЫ КАК НОВАЯ СИСТЕМА СИГНАЛИНГА
559
В настоящее время принято считать, что та-
них стадий нейродегенеративных заболева-
ким способом клетка не только избавляется от
ний, а также маркеров, позволяющих следить
ненужных внутриклеточных компонентов, но
за прогрессированием заболеваний. Высокий
и обменивается информацией с другими клет-
потенциал экзосом как диагностического ин-
ками организма. Последнему обстоятельству с
струмента для нейродегенеративных заболе-
каждым годом находится все больше и больше
ваний определяется несколькими причинами.
подтверждений, так что в некотором смысле
Первое, состав экзосом изменяется с течением
можно говорить об экзосомальной системе сиг-
заболевания. Второе, экзосомы проникают
налинга [3]. За многие годы изучения не было
через гематоэнцефалический барьер, причем
обнаружено клеток, не способных к секреции
в обоих направлениях. Третье, существование
экзосом, так что, видимо, стоит заключить,
методов выделения экзосом мозга в крови,
что все клетки секретируют экзосомы. В част-
основанных на поверхностных маркерах экзо-
ности, в нервной системе нейроны, олиго-
сом [6, 9, 10]. Специфичными маркерами эк-
дендроциты, астроциты и микроглия секре-
зосом нейронов являются белки клеточной ад-
тируют экзосомы, передающие информацию
гезии L1CAM (он же CD171) и NCAM, а также
как между клетками мозга, так и за гематоэн-
субъединицы GluR2/3 АМРА-рецептора глута-
цефалический барьер [4, 5]. Характерной осо-
мата [11]. Транспортер возбуждающих амино-
бенностью экзосом является их стабильность.
кислот ЕААТ-1 (он же GLAST) специфиче-
Отчасти эта стабильность объясняется нали-
ски содержится на экзосомах астроцитов [12].
чием сигнала «свой/не ешь меня» на мембране
Олигодендроглиальные экзосомы специфиче-
экзосом, что защищает от поглощения экзо-
ски характеризуются протеолипидным белком
сом фагоцитирующими клетками.
миелина (PLP) и олигодендроцитарным гли-
Экзосомы обнаружены во всех исследован-
копротеином миелина (MOG) [13].
ных биологических жидкостях, среди которых
есть и кровь, и цереброспинальная жидкость.
Экзосомы содержат все характерные типы био-
СЕКРЕЦИЯ ЭКЗОСОМ
логических макромолекул: белки, липиды и
НЕЙРОНАМИ
нуклеиновые кислоты. Кроме того, в экзосомах
переносятся некоторые метаболиты. Согласно
Секреция экзосом нейронами головного
базам данных, в экзосомах человеческих кле-
мозга была показана на нескольких моделях
ток разных типов к настоящему времени было
нейронов в культуре. В культуре первичных
идентифицировано что-то около 6000 белков,
кортикальных нейронов (Е19 DIV9) можно
сотни микроРНК и сотни липидов.
видеть секрецию экзосом [11]. На базальном
С каждым годом растет интерес к иссле-
уровне секреция экзосом нейронами проис-
дованию экзосом при нейродегенеративных
ходит постоянно, и нейрональные экзосомы
заболеваниях. В первую очередь работы по-
содержат как белки, характерные для экзо-
священы поиску экзосомальных маркеров для
сом из других типов клеток, так и белки, спе-
диагностики ранних стадий нейродегенера-
цифичные для нейронов. Среди общих экзо-
ции, но также и выяснению роли экзосом в
сомальных белков идентифицированы актин,
распространении нейродегенеративной пато-
тубулин, клатрин, Alix, TSG101, HSC 70 и
логии и возможному применению экзосом в
некоторые другие, ожидаемые, широко рас-
терапии [6-8]. Еще раз стоит отметить, что в
пространенные экзосомальные белки из са-
реальных экспериментах не всегда удается вы-
мых разных типов клеток. Идентифициро-
яснить биогенез исследуемых экстраклеточных
ваны и отличительные белки нейрональных
везикул, поэтому сказанное про экзосомы,
экзосом - это белок клеточной адгезии L1,
наверное, в некоторой степени может отно-
он же CD171, субъединицы GluR2 и GluR3
ситься не к экзосомам, а, например, к мик-
AMPA-рецептора глутамата, специфичная
ровезикулам. Четких маркеров, позволяющих
для мозга форма церулоплазмина и прионный
однозначно разделить разные типы везикул,
белок PrPc [11]. Самой важной находкой ран-
пока не существует. Тем не менее, опираясь
них исследований экзосомального сигналинга
на совокупность приведенных в публикациях
в нейронах стало открытие драматического
характеристик везикул (размер, плотность,
влияния деполяризации на секрецию экзосом
наличие маркеров белковой природы), мож-
нейронами в культуре. Деполяризация явля-
но полагать, что основная масса работ все же
ется абсолютно необходимой составляющей
имеет дело с экзосомами.
функционирования нейронов и совершенно
В настоящее время идет интенсивный
точно отличает нейроны от подавляющего боль-
поиск экзосомальных маркеров самых ран-
шинства клеток других типов. И деполяризация
БИОХИМИЯ том 88 вып. 4 2023
560
ЯКОВЛЕВ
вызывает многократное усиление и секреции
о защитном избавлении нейронов от неко-
экзосом, и секреции GluR2/3-субъединиц AMPA-
торых рецепторов с помощью экзосом, но
рецептора глутамата в составе экзосом [11].
делает интерпретацию не столь однозначной.
Заметна гетерогенность экзосом, секретируе-
В такой парадигме совершенно неясно, зачем
мых нейронами в культуре, по плотности, по
же вместе с глутаматными рецепторами ней-
размеру, по представленным в составе экзо-
рон избавляется, например, от церуллоплаз-
сом антигенам. Этому факту стоит отдельно
мина и PrPc. Таким образом, предположение
уделить несколько строк. Дело в том, что пред-
об экзосомах, как о средстве избавления от
ставленные в крови экзосомы характеризу-
ненужных рецепторов, вполне имеет право
ются большой гетерогенностью практически
на существование, но, судя по всему, точно
по всем своим характеристикам [14]. Оказы-
не является единственной возможной интер-
вается, что даже очень похожие друг на друга
претацией.
клетки одного типа секретируют экзосомы,
Вообще, сокращение (как и увеличение)
различающиеся по многим своим основным
числа AMPA-рецепторов в синапсе является
характеристикам. Причины такой гетероген-
большой частью физиологии нейрона. Самы-
ности пока не известны.
ми исследованными примерами вовлечения
Деполяризация в нейронах вызывает силь-
AMPA-рецептора в работу нейрона являются
ное увеличение концентрации внутриклеточ-
долговременная депрессия и долговременная
ного кальция. Судя по всему, именно кальций
потенциация [26]. Считается, что увеличение
является индуктором секреции экзосом как
числа AMPA-рецепторов в синапсе приводит к
в нейронах, так и в других клетках [15-18].
долговременной потенциации, а уменьшение
Можно попробовать ответить на вопрос, по-
их числа - к долговременной депрессии [27].
чему при деполяризации происходит усиление
Известно, что синаптическая активность при-
секреции экзосом нейронами. Продолжитель-
водит к интернализации GluR2- и GluR3-, но
ная деполяризация является признаком дли-
не GluR1-субъединиц AMPA-рецептора [28].
тельной активности нейрона. Может быть, се-
В самых ранних экспериментальных работах
креция в экзосомах субъединиц глутаматного
по этой теме было показано, что GluR2-субъ-
рецептора призвана избавить нейрон от даль-
единица AMPA-рецептора, интернализован-
нейшей деполяризации? Хорошо известно, что
ная в нейроне, колокализуется с мембранным
длительное повышение концентрации кальция
белком LAMP1, и совершенно логично был
в нейроне может привести к его гибели [19-
сделан вывод, что GluR2 в этой ситуации рас-
24]. Известны основные эффекторы кальция
щепляется в лизосомах [28]. В настоящее вре-
в клетке и основные схемы, приводящие к ги-
мя известно, что LAMP1 является не только
бели клетки после повышения концентрации
маркером лизосомальной мембраны, но также
кальция [19, 20]. С этой точки зрения, избав-
и секретируется в составе экзосом [29]. Таким
ление от глутаматных рецепторов посредством
образом, при физиологических состояниях,
их секреции в составе экзосом предотвращает
таких как продолжительная синаптическая
дальнейшее повышение концентрации внут-
активность, субъединицы AMPA-рецептора
риклеточного кальция и является для ней-
интернализуются внутрь клетки, а затем могут
рона защитной стратегией. Дополнительной
быть секретированы в составе экзосом [11].
убедительности этому предположению прида-
На модели первичных нейронов в культуре
ют особенности строения нейрона. А именно,
(E19 DIV15) результаты подтверждают все пре-
синапсы лишены лизосом и, соответственно,
дыдущие находки [30]. А именно, деполяриза-
избавиться от рецепторов путем их деграда-
ция вызывает существенное (в 5-10 раз) уси-
ции локально в синапсе нейроны не способ-
ление секреции экзосом нейронами. В составе
ны, тогда как мультивезикулярные тела есть и
экзосом в этой ситуации также обнаружены
в аксонах, и в дендритах [25]. Таким образом,
GluR2- и GluR3-субъединицы AMPA-рецепто-
структура в очередной раз может подсказать
ра. Повышение концентрации внутриклеточ-
функцию. Синапс, лишенный лизосом, может
ного кальция с помощью ионофора вызывает
избавляться от рецепторов посредством их се-
секрецию экзосом, а кальциевый хелатор пред-
креции с помощью мультивезикулярных телец.
отвращает секрецию. С помощью электрон-
С другой стороны, секреции в составе экзосом
ной микроскопии установлено, что секреция
NR1-субъединицы NMDA-рецептора глута-
происходит из соматодендритного компарт-
мата не происходит ни на базальном уровне,
мента нейронов. Если усиление синаптиче-
ни при деполяризации нейронов [11]. Есте-
ской активности вызывает секрецию экзосом,
ственно, этот факт не опровергает предпо-
то ее угнетение предотвращает секрецию, при
ложение, выдвинутое в работе Fauré et al. [11]
том что увеличение секреции экзосом зависит
БИОХИМИЯ том 88 вып. 4 2023
НЕЙРОНАЛЬНЫЕ ЭКЗОСОМЫ КАК НОВАЯ СИСТЕМА СИГНАЛИНГА
561
от активности и AMPA-, и NMDA-рецепторов.
секреция экзосом из пресинаптических тер-
Все эти обстоятельства указывают на то, что
миналей является активным физиологическим
секреция экзосом является частью нормаль-
процессом.
ной физиологии нейрона.
Кальций принципиально важен для си-
К настоящему времени секреция экзо-
наптической передачи. В частности, высво-
сом показана для нейронов на разных стадиях
бождение нейромедиатора зависит от повыше-
созревания в культуре (от DIV3 до DIV15) [11,
ния концентрации кальция в пресинапсе [35].
30, 31]. Довольно неожиданно, в модели на
Если и секреция экзосом из пресинапса зави-
нейронах, полученных при индукции плюри-
сит от кальция, то мы должны видеть одновре-
потентных стволовых клеток, деполяризация
менную секрецию и экзосом, и нейромедиа-
не вызывает увеличения секреции экзосом,
тора при повышении концентрации кальция.
при этом авторы предполагают существенное
Так в действительности и происходит [33].
различие в условиях проведения эксперимен-
Через несколько минут после деполяризации
тов [32]. При этом очевидно, что первичные
синаптосом из коры головного мозга мышей
нейроны в культуре в существенной степени
в кальцийсодержащей среде происходит и се-
отличаются от дифференцированных в нейро-
креция экзосом, и секреция основного возбуж-
нальный фенотип стволовых клеток, но ка-
дающего медиатора этих клеток - глутамата.
кой (-ие) конкретно фактор (-ы) определя-
Важное различие между этими двумя процес-
ет (-ют) различие в характере секреции экзосом
сами заключается в их чувствительности к ре-
при деполяризации, остается неизвестным.
гуляторным синаптическим механизмам. При
Секреция экзосом показана не только из
деполяризации на фоне кальция агонисты
постсинаптического компартмента. В простой
пресинаптических ГАМК-рецепторов пред-
модели in vitro на синаптосомах коры голов-
отвращают высвобождение глутамата из си-
ного мозга мыши показана секреция экзо-
наптосом, тогда как секреция экзосом в этих
сом из пресинаптического компартмента [33].
условиях не меняется [33]. Механизм такого
Синаптосомы представляют собой экспери-
различия между двумя кальций-зависимыми
ментальный объект, в живом мозге не суще-
процессами еще предстоит выяснить.
ствующий, это замкнутые окончания аксонов,
Нейроны - не единственные клетки моз-
полученные при гомогенизации головного
га, которые обмениваются информацией ме-
мозга. Несмотря на несколько искусственную
жду собой с помощью экзосом. Под действи-
природу, синаптосомы зарекомендовали себя
ем кальция происходит секреция экзосом из
как полезный экспериментальный объект, с
олигодендроцитов [13]. Повышение кальция
помощью которого можно моделировать до-
в олигодендроцитах происходит в ответ на се-
вольно сложные физиологические процессы,
крецию глутамата нейронами, а секретирован-
например, выброс медиатора в ответ на деполя-
ные олигодендроглиальные экзосомы погло-
ризацию [34]. По крайней мере, синаптосомы
щаются нейронами [15]. Нейроны в культуре
содержат все характерные пресинаптические
секретируют ростовые факторы VEGF и FGF-2
структуры, необходимые для работы реаль-
в составе экстраклеточных везикул [36]. Эти
ного синапса, а также ферменты и сигнальные
факторы являются индукторами роста эндо-
белки, необходимые для синаптических про-
телиальных клеток. Деполяризация приводит к
цессов [33]. Оказывается, синаптосомы также
секреции экзосом из нейритного компартмен-
содержат белки, являющиеся маркерами экзо-
та клетки [37]. Секретируемые экзосомы обо-
сом (TSG101, флотиллин-1, CD9, CD63) [33].
гащены микроРНК, специфичными для мозга.
Видимо, следует сделать вывод, что в норме
Также эти экзосомы содержат белки, специ-
экзосомы содержатся в окончаниях аксонов
фичные для дендритного компартмента клет-
нейронов коры головного мозга [33]. Эти дан-
ки. Экспрессия астроглиального транспортера
ные подтверждаются электронной микроско-
глутамата GLT-1 (иначе называемого EAAT2)
пией [33]. Высвобождение экзосом из синап-
индуцируется такими нейрональными экзо-
тосом происходит в базальных условиях и
сомами [38]. Высвобождение экзосом усилива-
усиливается под действием деполяризующего
ется при деполяризации нейронов. Экзосомы
стимула [33]. При этом, по данным электрон-
поглощаются селективно глиальными клет-
ной микроскопии, происходит истощение
ками, при этом хорошо известно, что астро-
синаптосомального пула мультивезикулярных
глиальный белок GLT-1 играет основную роль
телец. Ключевым для стимуляции секреции
в удалении экстраклеточного глутамата.
является наличие в среде кальция, как и для
Клетки смешанной культуры гиппо-
других экспериментов по экзосомальной се-
кампальных клеток (нейроны и астроглия)
креции [33]. Этот факт наводит на мысль, что
проявляют избирательность в поглощении
3
БИОХИМИЯ том 88 вып. 4 2023
562
ЯКОВЛЕВ
секретированных кортикальными нейронами
напсах. Всего Alix обнаруживается примерно
экзосом [39]. Экзосомы кортикальных нейро-
в 80% работающих пресинапсов, но практи-
нов были предусмотрительно помечены GFP,
чески не обнаруживается в постсинапсах, по
после чего количественный анализ поглоще-
колокализации с синапсином и PSD95 соот-
ния экзосом клетками стал легко решаемой за-
ветственно [41]. На срезах из мозга мышей, не
дачей. Оказалось, что экзосомы кортикальных
экспрессирующих Alix, гораздо хуже выраба-
нейронов колокализуются только в MAP2-по-
тывается долговременная потенциация, ве-
зитивных клетках, то есть в нейронах, и ни в
роятно, из-за сниженной площади синапти-
каких других [39]. Специально было показано,
ческих контактов. Насколько Alix важен для
что с GFAP-позитивными клетками, то есть
секреции экзосом из пресинапса, и чем важны
астроглией, экзосомы кортикальных нейронов
эти экзосомы для работы нейрона, остается
не колокализуются, видимо не взаимодейству-
пока невыясненным.
ют. Электронная микроскопия подтверждает,
что экзосомы связываются с поверхностью
нейронов, при этом важно отметить, что не
АППАРАТ СЕКРЕЦИИ
каждый нейрон, и не вся поверхность ней-
рона принимают участие во взаимодействии с
Хорошо известно, что регулируемая секре-
экзосомами. Конкретными участками связы-
ция в клетках происходит при участии белков
вания экзосом с поверхностью нейронов ока-
семейства SNARE. Это семейство представле-
зались пресинаптические сайты (синаптофи-
но десятками гомологичных белков эукарио-
зин-позитивные), расположенные напротив
тических организмов, от дрожжей до человека.
постсинаптических сайтов (PSD95-позитив-
Механизм участия белков SNARE в секреции
ных), хотя экзосомы и связывались далеко не
везикул заключается в узнавании друг друга
с каждым таким сайтом. Отдельно было пока-
представителем этого семейства, локализо-
зано, что экзосомы из культуральной жид-
ванным на мембране везикулы (v-SNARE) и
кости клеток нейробластомы неселективно
представителем этого же семейства, заякорен-
связываются с клетками в гиппокампальной
ным изнутри клетки на плазматической мем-
культуре, не проявляя предпочтения ни к ней-
бране (t-SNARE). Взаимодействие v-SNARE и
ронам, ни к астроглии, более-менее равно-
t-SNARE приводит к заякориванию везикулы
мерно взаимодействуя с поверхностью клеток
в плазматической мембране, слиянию мем-
без какого-либо предпочтения в участках свя-
бран и секреции содержимого везикулы во
зывания [39]. В какой степени эта находка в
внеклеточное пространство. В том, что белки
эксперименте на культуре клеток приложима к
семейства SNARE необходимы для регулируе-
функционирующему мозгу, остается неизвест-
мой секреции, убеждают результаты генетиче-
ным, но если мы вправе проводить аналогию,
ских исследований. У дрожжей нокаут по не-
то можем сказать, что нейрональные экзосомы
которым из генов, кодирующих белки SNARE,
специфически связываются с пресинаптиче-
летален, а подавление экспрессии белков
скими терминалями нейронов, но не с астро-
SNARE у дрозофилы, нематоды или мыши
глиальными клетками.
подавляет и нейротрансмиссию, и секрецию
Синапсы содержат как морфологические
в ненейрональных клетках [42-46]. Конечно,
структуры, необходимые для секреции экзо-
не все представители семейства SNARE в оди-
сом [24], так и белки, необходимые для био-
наковой степени необходимы для регулируе-
генеза экзосом [40]. Важным структурным и
мой секреции, но в целом хотя бы несколько
функциональным компонентом для биогенеза
представителей семейства SNARE обязательно
экзосом является белок Alix, представленный
являются необходимым звеном механизма се-
в синапсах [41]. В нейронах коры головного
креции в конкретной клетке.
мозга крысы Alix накапливается в пресинапсе
Еще одним необходимым звеном регули-
по мере созревания этих клеток, и, более того,
руемой секреции является внутриклеточный
концентрация Alix в пресинапсе возрастает
направленный трафик везикул. За этот процесс
двукратно после стимуляции (деполяризация
в клетке отвечают белки семейства Rab. Это
бикукулином/4-аминопиридином) зрелых ней-
представители малых ГТФаз, причем их наи-
ронов (DIV15). Этот процесс зависит от кон-
более представленная группа - в геноме эука-
центрации кальция. Флуоресцентно меченный
риот. Направление трафика везикулы внутри
Alix в норме распределен более-менее равно-
клетки зависит от того, какой из белков Rab
мерно по цитоплазме, но уже после двух минут
локализован на мембране этой везикулы,
деполяризации Alix концентрируется в работаю-
например, Rab3 на мембране везикулы при-
щих (секретирующих нейромедиатор) преси-
водит к ее секреции, а Rab7 приведет везикулу
БИОХИМИЯ том 88 вып. 4 2023
НЕЙРОНАЛЬНЫЕ ЭКЗОСОМЫ КАК НОВАЯ СИСТЕМА СИГНАЛИНГА
563
в лизосому [47]. Нарушение работы белков се-
и в пространстве повышению концентрации
мейства Rab нарушает экзоцитоз в клетках са-
ионов кальция, что, в свою очередь, приводит
мых разных типов различных организмов [48-
к слиянию мембраны секреторной везикулы
53]. Белки семейства Rab столь же незаменимы
с плазматической мембраной и секреции со-
в регулируемой секреции везикул, как и пред-
держимого везикулы во внеклеточное про-
ставители SNARE, выполняя функции сорти-
странство. Второе, в секреторных везикулах
ровщиков везикул разного генеза внутри клетки.
должен содержаться секретируемый продукт
Имея в виду универсальное вовлечение
в концентрированном виде, а самих везикул
белков Rab и SNARE в трафик и секрецию ве-
должно быть много. И последнее, секреторные
зикул, неудивительно будет узнать, что и меха-
везикулы, как правило, хранятся в виде неко-
низм слияния мультивезикулярного тельца с
торого запаса вблизи мест высвобождения,
плазматической мембраной включает в себя
это обстоятельство может и не наблюдаться,
взаимодействие белков SNARE и зависит от
например, в результате длительной активности
активности малых ГТФаз семейства Rab, то
и расходованию запаса секреторных везикул.
есть происходит по хорошо известному сцена-
Если речь идет о привычной синаптиче-
рию регулируемой секреции [54-56]. Несмо-
ской секреции нейромедиатора, то под секре-
тря на то что хорошие доказательства участия
торной везикулой подразумевается синапти-
именно этих механизмов в секреции мульти-
ческая везикула, а в случае экзосомального
везикулярных телец получены на ненейро-
сигналинга секреторной везикулой является
нальных клетках, по большому счету, нет со-
мультивезикулярное тельце. Таким образом,
мнений, что у нейронов процесс происходит
для того чтобы секрецию можно было назвать
в общем-то также. Вероятно, только такой ва-
регулируемой, клетки (нейроны) должны син-
риант и можно предполагать, зная сколь уни-
тезировать, упаковывать и хранить специаль-
версальны системы Rab и SNARE в секреции
ные секреторные везикулы, а также быстро
везикул, так что зависимая от Rab и SNARE
высвобождать их после специфической для
секреция экзосом лишь подтверждает универ-
данной клетки физиологической стимуляции.
сальность такого сценария.
Таким образом, выше изложены и на ри-
сунке представлены все формальные обстоя-
тельства, на основании которых секреция
ПОПЫТКА ОБОБЩЕНИЯ
экзосом нейронами является регулируемой
секрецией, а сами экзосомы являются нейро-
Для дальнейших обобщений полезно
медиаторами. Данный факт ни в коем слу-
будет отталкиваться от нескольких фор-
чае не является ни новой экспериментальной
мальных определений, прекрасно изложен-
находкой, ни плодом расшифровки сложно-
ных в настольной книге нейрохимика, «Basic
интерпретируемых результатов. Скорее, речь
Neurochemistry»
[57]. Классическое опреде-
идет о полезном для дальнейшего развития
ление нейромедиатора включает три положе-
области давно назревшем обобщении. Взгляд
ния. Нейромедиатор должен быть в составе
на секрецию экзосом, как на избавление клет-
везикул, должен высвобождаться в ответ на
кой от ненужных белков, устаревал постепен-
повышение внутриклеточной концентрации
но, начиная с момента появления, и сейчас
кальция, и его экзогенная аппликация должна
экзосомы - часть богатой области межклеточ-
производить тот же эффект, что и высвобож-
ной коммуникации вместе с нейротрансмит-
дение в физиологическом процессе. Нетрудно
терами и гормонами [3]. Но место экзосом в
заметить, что экзосомы формально попадают
межклеточной коммуникации пока выглядит
под определение нейромедиатора.
неопределенным, поэтому сейчас самое время
Конститутивная секреция является общей
попытаться сформулировать новый взгляд на
особенностью всех эукариотических клеток.
экзосомный сигналинг. А именно, экзосомы
Если секреторная везикула сливается с плаз-
представляют собой новый неканонический
матической мембраной, высвобождая содер-
нейротрансмиттер в головном мозге. Но к чему
жимое без внешнего стимула, то этот процесс
этот маневр - назвать давно известную вещь
и будет называться конститутивной секрецией
новым именем? Смысл такого переназывания
или неспецифическим экзоцитозом. Регули-
в том, чтобы начать поиск эффекторов экзо-
руемая секреция отличима от конститутивной
сом в мозге по аналогии с классическими ней-
секреции в силу двух с половиной основных
ротрансмиттерами. Принципиальной можно
обстоятельств. Первое, регулируемая секре-
считать лишь разницу в размерах, так как все
ция зависит от экстраклеточного стимула, ко-
классические нейротрансмиттеры имеют ха-
торый приводит к ограниченному по времени
рактерную молекулярную массу 0,5-50 кДа,
БИОХИМИЯ том 88 вып. 4 2023
3*
564
ЯКОВЛЕВ
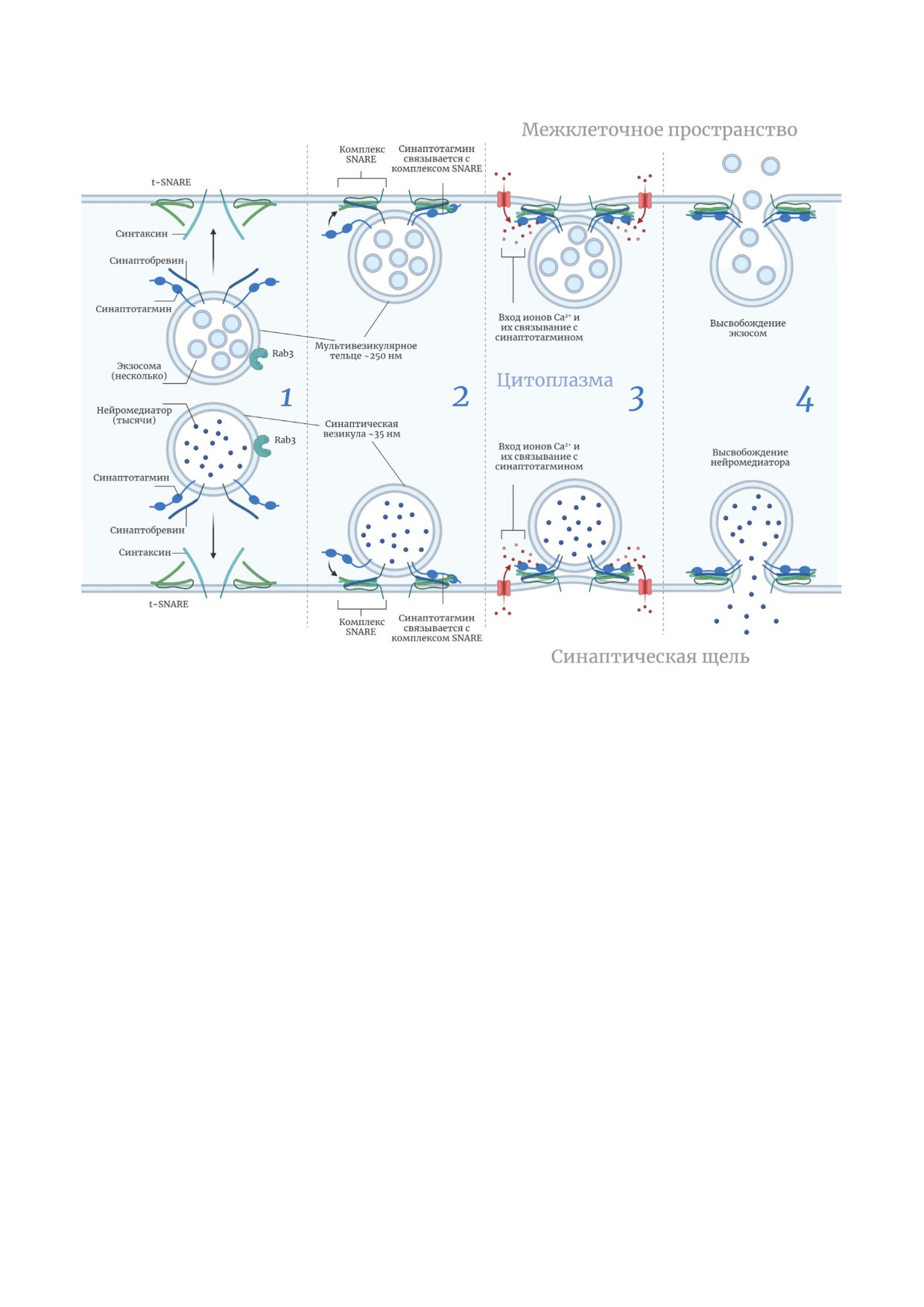
Иллюстрация процессов, происходящих в пресинаптическом компартменте, подчеркивающая параллели между секре-
цией нейромедиатора и секрецией экзосом. 1 - В неактивном состоянии в пресинапсе находятся загруженные нейро-
медиатором синаптические пузырьки и загруженные интралюменальными везикулами мультивезикулярные тельца.
2 - Подготовленное к секреции состояние синаптических пузырьков и мультивезикулярных телец (характерная при-
мембранная локализация). 3 - Вход ионов кальция в клетку запускает каскад секреции. 4 - Слияние внутриклеточных
компартментов с плазматической мембраной и высвобождение их содержимого во внеклеточное пространство
а экзосомы, конечно, значительно больше -
Финансирование. Работа выполнена при
десятки МДа. Но при этом многие системы
поддержке Российского научного фонда (грант
сигналинга экзосом могут быть похожи на
№ 21-75-20112).
сигналинг нейротрансмиттеров - от вызывае-
Конфликт интересов. Автор заявляет об от-
мого изменения концентрации ионов до фено-
сутствии конфликта интересов.
менов долговременной потенциации сигнала.
Соблюдение этических норм. Настоящая
По крайней мере, характерные структурно-
статья не содержит описания выполненных ав-
функциональные особенности экзосом мозга
тором исследований с участием людей или ис-
позволяют предположить именно это.
пользованием животных в качестве объектов.
СПИСОК ЛИТЕРАТУРЫ
1. Théry, C., Witwer, K. W., Aikawa, E., Alcaraz, M. J.,
Bobis-Wozowicz, S., Boilard, E., Boireau, W.,
Anderson, J. D., Andriantsitohaina, R., Antoniou, A.,
Bongiovanni, A., Borràs, F. E., Bosch, S., Boulanger,
Arab, T., Archer, F., Atkin-Smith, G. K., Ayre, D. C.,
C. M., Breakefield, X., Breglio, A. M., Brennan, M. Á.,
Bach, J. M., Bachurski, D., Baharvand, H., Balaj, L.,
Brigstock, D. R., Brisson, A., Broekman, M. L.,
Baldacchino, S., Bauer, N. N., Baxter, A. A., Bebawy,
Bromberg, J. F., Bryl-Górecka, P., Buch, S.,
M., Beckham, C., Bedina Zavec, A., Benmoussa, A.,
Buck, A. H., Burger, D., Busatto, S., Buschmann, D.,
Berardi, A. C., Bergese, P., Bielska, E., Blenkiron, C.,
Bussolati, B., Buzás, E. I., Byrd, J. B., Camussi, G.,
БИОХИМИЯ том 88 вып. 4 2023
НЕЙРОНАЛЬНЫЕ ЭКЗОСОМЫ КАК НОВАЯ СИСТЕМА СИГНАЛИНГА
565
Carter, D. R., Caruso, S., Chamley, L. W., Chang,
Ortiz, L. A., Osteikoetxea, X., Østergaard, O.,
Y. T., Chen, C., Chen, S., Cheng, L., Chin, A. R.,
Ostrowski, M., Park, J., Pegtel, D. M., Peinado, H.,
Clayton, A., Clerici, S. P., Cocks, A., Cocucci, E.,
Perut, F., Pfaffl, M. W., Phinney, D. G., Pieters,
Coffey, R. J., Cordeiro-da-Silva, A., Couch, Y.,
B. C., Pink, R. C., Pisetsky, D. S., Pogge von
Coumans, F. A., Coyle, B., Crescitelli, R., Criado, M. F.,
Strandmann, E., Polakovicova, I., Poon, I. K.,
D’Souza-Schorey, C., Das, S., Datta Chaudhuri, A.,
Powell, B. H., Prada, I., Pulliam, L., Quesenberry, P.,
de Candia, P., De Santana, E. F., De Wever, O., Del
Radeghieri, A., Raffai, R. L., Raimondo, S., Rak, J.,
Portillo, H. A., Demaret, T., Deville, S., Devitt, A.,
Ramirez, M. I., Raposo, G., Rayyan, M. S., Regev-
Dhondt, B., Di Vizio, D., Dieterich, L. C., Dolo, V.,
Rudzki, N., Ricklefs, F. L., Robbins, P. D., Roberts,
Dominguez Rubio, A. P., Dominici, M., Dourado, M. R.,
D. D., Rodrigues, S. C., Rohde, E., Rome, S.,
Driedonks, T. A., Duarte, F. V., Duncan, H. M.,
Rouschop, K. M., Rughetti, A., Russell, A. E.,
Eichenberger, R. M., Ekström, K., El Andaloussi, S.,
Saá, P., Sahoo, S., Salas-Huenuleo, E., Sánchez, C.,
Elie-Caille, C., Erdbrügger, U., Falcón-Pérez, J. M.,
Saugstad, J. A., Saul, M. J., Schiffelers, R. M.,
Fatima, F., Fish, J. E., Flores-Bellver, M., Försönits, A.,
Schneider, R., Schøyen, T. H., Scott, A., Shahaj, E.,
Frelet-Barrand, A., Fricke, F., Fuhrmann, G.,
Sharma, S., Shatnyeva, O., Shekari, F., Shelke, G. V.,
Gabrielsson, S., Gámez-Valero, A., Gardiner, C.,
Shetty, A. K., Shiba, K., Siljander, P. R., Silva, A. M.,
Gärtner, K., Gaudin, R., Gho, Y. S., Giebel, B.,
Skowronek, A., Snyder, O. L. 2nd., Soares, R. P.,
Gilbert, C., Gimona, M., Giusti, I., Goberdhan, D. C.,
Sódar, B. W., Soekmadji, C., Sotillo, J., Stahl, P. D.,
Görgens, A., Gorski, S. M., Greening, D. W.,
Stoorvogel, W., Stott, S. L., Strasser, E. F., Swift, S.,
Gross, J. C., Gualerzi, A., Gupta, G. N., Gustafson, D.,
Tahara, H., Tewari, M., Timms, K., Tiwari, S.,
Handberg, A., Haraszti, R. A., Harrison, P.,
Tixeira, R., Tkach, M., Toh, W. S., Tomasini, R.,
Hegyesi, H., Hendrix, A., Hill, A. F., Hochberg,
Torrecilhas, A. C., Tosar, J. P., Toxavidis, V.,
F. H., Hoffmann, K. F., Holder, B., Holthofer, H.,
Urbanelli, L., Vader, P., van Balkom, B. W., van der
Hosseinkhani, B., Hu, G., Huang, Y., Huber, V.,
Grein, S. G., Van Deun, J., van Herwijnen, M. J., Van
Hunt, S., Ibrahim, A. G., Ikezu, T., Inal, J. M.,
Keuren-Jensen, K., van Niel, G., van Royen, M. E.,
Isin, M., Ivanova, A., Jackson, H. K., Jacobsen, S.,
van Wijnen, A. J., Vasconcelos, M. H., Vechetti, I. J. Jr.,
Jay, S. M., Jayachandran, M., Jenster, G., Jiang, L.,
Veit, T. D., Vella, L. J., Velot, É., Verweij, F. J.,
Johnson, S. M., Jones, J. C., Jong, A., Jovanovic-
Vestad, B., Viñas, J. L., Visnovitz, T., Vukman, K. V.,
Talisman, T., Jung, S., Kalluri, R., Kano, S. I.,
Wahlgren, J., Watson, D. C., Wauben, M. H.,
Kaur, S., Kawamura, Y., Keller, E. T., Khamari, D.,
Weaver, A., Webber, J. P., Weber, V., Wehman, A. M.,
Khomyakova, E., Khvorova, A., Kierulf, P., Kim,
Weiss, D. J., Welsh, J. A., Wendt, S., Wheelock, A. M.,
K. P., Kislinger, T., Klingeborn, M., Klinke, D. J. 2nd,
Wiener, Z., Witte, L., Wolfram, J., Xagorari, A.,
Kornek, M., Kosanović, M. M., Kovács, Á. F.,
Xander, P., Xu, J., Yan, X., Yáñez-Mó, M., Yin, H.,
Krämer-Albers, E. M., Krasemann, S., Krause, M.,
Yuana, Y., Zappulli, V., Zarubova, J., Žėkas, V., Zhang,
Kurochkin, I. V., Kusuma, G. D., Kuypers, S.,
J. Y., Zhao, Z., Zheng, L., Zheutlin, A. R., Zickler,
Laitinen, S., Langevin, S. M., Languino, L. R.,
A. M., Zimmermann, P., Zivkovic, A. M., Zocco, D.,
Lannigan, J., Lässer, C., Laurent, L. C., Lavieu, G.,
and Zuba-Surma, E. K. (2018) Minimal information
Lázaro-Ibáñez, E., Le Lay, S., Lee, M. S., Lee, Y. X. F.,
for studies of extracellular vesicles 2018 (MISEV2018):
Lemos, D. S., Lenassi, M., Leszczynska, A., Li, I. T.,
a position statement of the International Society for
Liao, K., Libregts, S. F., Ligeti, E., Lim, R., Lim, S. K.,
Extracellular Vesicles and update of the MISEV2014
Linē, A., Linnemannstöns, K., Llorente, A., Lombard,
guidelines, J. Extracell. Vesicles, 7, 1535750, doi: 10.1080/
C. A., Lorenowicz, M. J., Lörincz, Á. M., Lötvall, J.,
20013078.2018.1535750.
Lovett, J., Lowry, M. C., Loyer, X., Lu, Q., Lukom-
2.
Kalluri, R., and LeBleu, V. S. (2020) The biology,
ska, B., Lunavat, T. R., Maas, S. L., Malhi, H.,
function, and biomedical applications of exosomes,
Marcilla, A., Mariani, J., Mariscal, J., Martens-
Science, 367, doi: 10.1126/science.aau6977.
Uzunova, E. S., Martin-Jaular, L., Martinez, M. C.,
3.
Van Niel, G., Carter, D. R. F., Clayton, A., Lambert,
Martins, V. R., Mathieu, M., Mathivanan, S.,
D. W., Raposo, G., and Vader, P. (2022) Challenges
Maugeri, M., McGinnis, L. K., McVey, M. J.,
and directions in studying cell-cell communication
Meckes, D. G. Jr., Meehan, K. L., Mertens, I.,
by extracellular vesicles, Nat. Rev. Mol. Cell. Biol., 23,
Minciacchi, V. R., Möller, A., Møller Jørgensen, M.,
369-382, doi: 10.1038/s41580-022-00460-3.
Morales-Kastresana, A., Morhayim, J., Mullier, F.,
4.
Khaspeckov, L. G., and Yakovlev, A. A. (2023) Per-
Muraca, M., Musante, L., Mussack, V., Muth, D. C.,
spectives for the use of small extracellular vesicles as
Myburgh, K. H., Najrana, T., Nawaz, M., Nazarenko, I.,
a transport vehicle through the blood-brain barrier,
Nejsum, P., Neri, C., Neri, T., Nieuwland, R.,
Neurochem. J., 39, 1-18.
Nimrichter, L., Nolan, J. P., Nolte-’t, Hoen, E. N.,
5.
Yakovlev, A. A. (2022) Neuroprotective effects of
Noren Hooten, N., O’Driscoll, L., O’Grady, T.,
astrocyte extracellular vesicles in stroke, Neurochem. J.,
O’Loghlen, A., Ochiya, T., Olivier, M., Ortiz, A.,
16, 121-129, doi: 10.1134/s1819712422020143.
БИОХИМИЯ том 88 вып. 4 2023
566
ЯКОВЛЕВ
6.
Jia, L., Zhu, M., Kong, C., Pang, Y., Zhang, H.,
15.
Savina, A., Furlán, M., Vidal, M., and Colombo, M. I.
Qiu, Q., Wei, C., Tang, Y., Wang, Q., Li, Y., Li, T.,
(2003) Exosome release is regulated by a calcium-
Li, F., Wang, Q., Li, Y., Wei, Y., and Jia, J. (2021)
dependent mechanism in K562 cells, J. Biol. Chem.,
Blood neuro-exosomal synaptic proteins predict
278, 20083-20090, doi: 10.1074/jbc.M301642200.
Alzheimer’s disease at the asymptomatic stage,
16.
Emmanouilidou, E., Melachroinou, K., Roumeli-
Alzheimer’s Dement., 17, 49-60, doi: 10.1002/alz.12166.
otis, T., Garbis, S. D., Ntzouni, M., Margaritis, L. H.,
7.
Wang, Y., Balaji, V., Kaniyappan, S., Krüger, L.,
Stefanis, L., and Vekrellis, K. (2010) Cell-produced
Irsen, S., Tepper, K., Chandupatla, R., Maetzler, W.,
α-synuclein is secreted in a calcium-dependent
Schneider, A., Mandelkow, E., and Mandelkow, E.
manner by exosomes and impacts neuronal
M. (2017) The release and trans-synaptic transmission
survival, J. Neurosci., 30, 6838-6851, doi: 10.1523/
of Tau via exosomes, Mol. Neurodegener., 12, 5,
JNEUROSCI.5699-09.2010.
doi: 10.1186/s13024-016-0143-y.
17.
Frühbeis, C., Fröhlich, D., Kuo, W. P., Amphornrat, J.,
8.
Xin, H., Li, Y., Cui, Y., Yang, J. J., Zhang, Z. G.,
Thilemann, S., Saab, A. S., Kirchhoff, F., Möbius, W.,
and Chopp, M. (2013) Systemic administration of
Goebbels, S., Nave, K. A., Schneider, A., Simons, M.,
exosomes released from mesenchymal stromal cells
Klugmann, M., Trotter, J., and Krämer-Albers, E. M.
promote functional recovery and neurovascular
(2013) Neurotransmitter-triggered transfer of exosomes
plasticity after stroke in rats, J. Cereb. Blood Flow
mediates oligodendrocyte-neuron communication,
Metab., 33, 1711-1715, doi: 10.1038/jcbfm.2013.152.
PLoS Biol., 11, e1001604, doi: 10.1371/journal.pbio.
9.
Goetzl, E. J., Kapogiannis, D., Schwartz, J. B.,
1001604.
Lobach, I. V., Goetzl, L., Abner, E. L., Jicha, G. A.,
18.
Kapustin, A. N., Chatrou, M. L., Drozdov, I., Zheng, Y.,
Karydas, A. M., Boxer, A., and Miller, B. L. (2016)
Davidson, S. M., Soong, D., Furmanik, M., Sanchis, P.,
Decreased synaptic proteins in neuronal exosomes
De Rosales, R. T., Alvarez-Hernandez, D., Shroff, R.,
of frontotemporal dementia and Alzheimer’s disease,
Yin, X., Muller, K., Skepper, J. N., Mayr, M.,
FASEB J., 30, 4141-4148, doi: 10.1096/fj.201600816R.
Reutelingsperger, C. P., Chester, A., Bertazzo, S.,
10.
Winston, C. N., Goetzl, E. J., Akers, J. C.,
Schurgers, L. J., and Shanahan, C. M. (2015) Vascular
Carter, B. S., Rockenstein, E. M., Galasko, D.,
smooth muscle cell calcification is mediated by
Masliah, E., and Rissman, R. A. (2016) Prediction
regulated exosome secretion, Circ. Res., 116, 1312-
of conversion from mild cognitive impairment to
1323, doi: 10.1161/CIRCRESAHA.116.305012.
dementia with neuronally derived blood exosome
19.
Wang, H. G., Pathan, N., Ethell, I. M., Krajewski, S.,
protein profile, Alzheimer’s Dement.,
3,
63-72,
Yamaguchi, Y., Shibasaki, F., McKeon, F., Bobo, T.,
doi: 10.1016/j.dadm.2016.04.001.
Franke, T. F., and Reed, J. C. (1999) Ca2+-induced
11.
Fauré, J., Lachenal, G., Court, M., Hirrlinger, J.,
apoptosis through calcineurin dephosphorylation
Chatellard-Causse, C., Blot, B., Grange, J.,
of BAD, Science,
284,
339-343, doi:
10.1126/
Schoehn, G., Goldberg, Y., Boyer, V., Kirchhoff, F.,
science.284.5412.339.
Raposo, G., Garin, J., and Sadoul, R.
(2006)
20.
Lee, M. S., Kwon, Y. T., Li, M., Peng, J., Friedlander,
Exosomes are released by cultured cortical neurons,
R. M., and Tsai, L. H. (2000) Neurotoxicity induces
Mol. Cell. Neurosci.,
31,
642-648, doi:
10.1016/
cleavage of p35 to p25 by calpain, Nature, 405,
J.MCN.2005.12.003.
360-364, doi: 10.1038/35012636.
12.
Gosselin, R.-D., Meylan, P., and Decosterd, I.
21.
White, B. C., Sullivan, J. M., DeGracia, D. J., O’Neil,
(2013) Extracellular microvesicles from astrocytes
B. J., Neumar, R. W., Grossman, L. I., Rafols, J. A.,
contain functional glutamate transporters: regulation
and Krause, G. S.
(2000) Brain ischemia and
by protein kinase C and cell activation, Front. Cell.
reperfusion: molecular mechanisms of neuronal
Neurosci., 7, 251, doi: 10.3389/FNCEL.2013.00251.
injury, J. Neurol. Sci.,
179,
1-33, doi:
10.1016/
13.
Krämer-Albers, E. M., Bretz, N., Tenzer, S.,
S0022-510X(00)00386-5.
Winterstein, C., Möbius, W., Berger, H., Nave, K. A.,
22.
Hardingham, G. E., Fukunaga, Y., and Bading, H. (2002)
Schild, H., and Trotter, J. (2007) Oligodendrocytes
Extrasynaptic NMDARs oppose synaptic NMDARs by
secrete exosomes containing major myelin and
triggering CREB shut-off and cell death pathways,
stress-protective proteins: trophic support for axons?
Nat. Neurosci., 5, 405-414, doi: 10.1038/nn835.
Proteomics Clin. Appl., 1, 1446-1461, doi: 10.1002/
23.
Szydlowska, K., and Tymianski, M. (2010) Calcium,
prca.200700522.
ischemia and excitotoxicity, Cell Calcium, 47, 122-129,
14.
Kowal, J., Arras, G., Colombo, M., Jouve, M.,
doi: 10.1016/j.ceca.2010.01.003.
Morath, J. P., Primdal-Bengtson, B., Dingli, F.,
24.
Berridge, M. J., Lipp, P., and Bootman, M. D.
Loew, D., Tkach, M., and Théry, C. (2016) Proteomic
(2000) The versatility and universality of calcium
comparison defines novel markers to characterize
signalling, Nat. Rev. Mol. Cell Biol.,
1,
11-21,
heterogeneous populations of extracellular vesicle
doi: 10.1038/35036035.
subtypes, Proc. Natl. Acad. Sci. USA, 113, E968-E977,
25.
Cooney, J. R., Hurlburt, J. L., Selig, D. K., Harris, K. M.,
doi: 10.1073/pnas.1521230113.
and Fiala, J. C. (2002) Endosomal compartments
БИОХИМИЯ том 88 вып. 4 2023
НЕЙРОНАЛЬНЫЕ ЭКЗОСОМЫ КАК НОВАЯ СИСТЕМА СИГНАЛИНГА
567
serve multiple hippocampal dendritic spines from
36.
Schiera, G., Proia, P., Alberti, C., Mineo, M.,
a widespread rather than a local store of recycling
Savettieri, G., and di Liegro, I. (2007) Neurons
membrane, J. Neurosci., 22, 2215-2224, doi: 10.1523/
produce FGF2 and VEGF and secrete them at
jneurosci.22-06-02215.2002.
least in part by shedding extracellular vesicles,
26.
Malinow, R., and Malenka, R. C. (2002) AMPA
J. Cell. Mol. Med.,
11,
1384-1394, doi:
10.1111/
receptor trafficking and synaptic plasticity, Annu.
j.1582-4934.2007.00100.x.
Rev. Neurosci., 25, 103-126, doi: 10.1146/annurev.
37.
Goldie, B. J., Dun, M. D., Lin, M., Smith, N. D.,
neuro.25.112701.142758.
Verrills, N. M., Dayas, C. V., and Cairns, M. J. (2014)
27.
Bredt, D. S., and Nicoll, R. A. (2003) AMPA receptor
Activity-associated miRNA are packaged in Map1b-
trafficking at excitatory synapses, Neuron, 40, 361-379,
enriched exosomes released from depolarized neurons,
doi: 10.1016/S0896-6273(03)00640-8.
Nucleic Acids Res.,
42,
9195-9208, doi:
10.1093/
28.
Lee, S. H., Simonetta, A., and Sheng, M. (2004)
nar/gku594.
Subunit rules governing the sorting of internalized
38.
Morel, L., Regan, M., Higashimori, H., Ng, S. K.,
AMPA receptors in hippocampal neurons, Neuron, 43,
Esau, C., Vidensky, S., Rothstein, J., and Yang, Y.
221-236, doi: 10.1016/j.neuron.2004.06.015.
(2013)
Neuronal exosomal miRNA-dependent
29.
Mathieu, M., Névo, N., Jouve, M., Valenzuela, J. I.,
translational regulation of astroglial glutamate
Maurin, M., Verweij, F. J., Palmulli, R., Lankar, D.,
transporter GLT1, J. Biol. Chem., 288, 7105-7116,
Dingli, F., Loew, D., Rubinstein, E., Boncompain, G.,
doi: 10.1074/JBC.M112.410944.
Perez, F., and Théry, C.
(2021) Specificities of
39.
Chivet, M., Javalet, C., Laulagnier, K., Blot, B.,
exosome versus small ectosome secretion revealed
Hemming, F. J., and Sadoul, R. (2014) Exosomes
by live intracellular tracking of CD63 and CD9,
secreted by cortical neurons upon glutamatergic
Nat. Commun., 12, 1-18, doi: 10.1038/s41467-021-
synapse activation specifically interact with neurons,
24384-2.
J. Extracell. Vesicles,
3,
24722, doi:
10.3402/
30.
Lachenal, G., Pernet-Gallay, K., Chivet, M.,
jev.v3.24722.
Hemming, F. J., Belly, A., Bodon, G., Blot, B.,
40.
Baietti, M. F., Zhang, Z., Mortier, E., Melchior, A.,
Haase, G., Goldberg, Y., and Sadoul, R.
(2011)
Degeest, G., Geeraerts, A., Ivarsson, Y., Depoortere, F.,
Release of exosomes from differentiated neurons
Coomans, C., Vermeiren, E., Zimmermann, P., and
and its regulation by synaptic glutamatergic activity,
David, G. (2012) Syndecan-syntenin-ALIX regulates
Mol. Cell. Neurosci.,
46,
409-418, doi:
10.1016/
the biogenesis of exosomes, Nat. Cell. Biol., 14, 677-
j.mcn.2010.11.004.
685, doi: 10.1038/ncb2502.
31.
Ghidoni, R., Paterlini, A., Albertini, V., Glionna, M.,
41.
Laporte, M. H., Chi, K.Il, Caudal, L.C., Zhao, N.,
Monti, E., Schiaffonati, L., Benussi, L., Levy, E.,
Schwarz, Y., Rolland, M., Martinez-Hernandez, J.,
and Binetti, G. (2011) Cystatin C is released in
Martineau, M., Chatellard, C., Denarier, E.,
association with exosomes: a new tool of neuronal
Mercier, V., Lemaître, F., Blot, B., Moutaux, E.,
communication which is unbalanced in Alzheimer’s
Cazorla, M., Perrais, D., Lanté, F., Bruns, D.,
disease, Neurobiol. Aging, 32, 1435-1442, doi: 10.1016/
Fraboulet, S., Hemming, F. J., Kirchhoff, F., and
j.neurobiolaging.2009.08.013.
Sadoul, R.
(2022) Alix is required for activity-
32.
Karttunen, J., Heiskanen, M., Joki, T., Hyysalo, A.,
dependent bulk endocytosis at brain synapses,
Navarro-Ferrandis, V., Miettinen, S., Narkilahti, S.,
PLoS Biol.,
20, e3001659, doi:
10.1371/journal.
and Pitkänen, A. (2022) Effect of cell culture media
pbio.3001659.
on extracellular vesicle secretion from mesenchymal
42.
Washbourne, P., Thompson, P. M., Carta, M.,
stromal cells and neurons, Eur. J. Cell Biol., 101,
Costa, E. T., Mathews, J. R., Lopez-Benditó, G.,
151270, doi: 10.1016/j.ejcb.2022.151270.
Molnár, Z., Becher, M. W., Valenzuela, C. F.,
33.
Olivero, G., Cisani, F., Marimpietri, D., Di Paolo, D.,
Partridge, L. D., and Wilson, M. C. (2002) Genetic
Gagliani, M. C., Podestà, M., Cortese, K., and
ablation of the t-SNARE SNAP-25 distinguishes
Pittaluga, A. (2021) The depolarization-evoked, Ca2+-
mechanisms of neuroexocytosis, Nat. Neurosci., 5, 19-
dependent release of exosomes from mouse cortical
26, doi: 10.1038/NN783.
nerve endings: new insights into synaptic transmission,
43.
Schulze, K. L., Broadie, K., Perin, M. S., and
Front. Pharmacol.,
12,
670158, doi:
10.3389/
Bellen, H. J. (1995) Genetic and electrophysiological
fphar.2021.670158.
studies of Drosophila syntaxin-1A demonstrate its role
34.
Pittaluga, A. (2019) Acute functional adaptations in
in nonneuronal secretion and neurotransmission, Cell,
isolated presynaptic terminals unveil synaptosomal
80, 311-320, doi: 10.1016/0092-8674(95)90414-X.
learning and memory, Int. J. Mol. Sci., 20, 3641,
44.
Schoch, S., Deák, F., Königstorfer, A., Mozhayeva, M.,
doi: 10.3390/ijms20153641.
Sara, Y., Südhof, T. C., and Kavalali, E. T. (2001)
35.
Südhof, T. C. (2004) The synaptic vesicle cycle, Annu.
SNARE function analyzed in synaptobrevin/VAMP
Rev. Neurosci., 27, 509-547, doi: 10.1146/annurev.
knockout mice, Science, 294, 1117-1122, doi: 10.1126/
neuro.26.041002.131412.
SCIENCE.1064335.
БИОХИМИЯ том 88 вып. 4 2023
568
ЯКОВЛЕВ
45.
Nonet, M. L., Saifee, O., Zhao, H., Rand, J. B., and
52. Holz, R. W., Brondyk, W. H., Senter, R. A.,
Wei, L. (1998) Synaptic transmission deficits in Caenor-
Kuizon, L., and Macara, I. G. (1994) Evidence
habditis elegans synaptobrevin mutants, J. Neurosci., 18,
for the involvement of Rab3A in Ca2+-dependent
70-80, doi: 10.1523/JNEUROSCI.18-01-00070.1998.
exocytosis
from adrenal chromaffin
cells,
46.
Gerst, J. E. (1999) SNAREs and SNARE regulators in
J. Biol. Chem.,
269,
10229-10234, doi:
10.1016/
membrane fusion and exocytosis, Cell. Mol. Life Sci.,
S0021-9258(17)34051-6.
55, 707-734, doi: 10.1007/S000180050328.
53. Doussau, F., Clabecq, A., Henry, J.-P., Darchen, F.,
47.
Stenmark, H. (2009) Rab GTPases as coordinators of
and Poulain, B. (1998) Calcium-dependent regulation
vesicle traffic, Nat. Rev. Mol. Cell Biol., 10, 513-525,
of Rab3 in short-term plasticity, J. Neurosci., 18, 3147-
doi: 10.1038/nrm2728.
3157, doi: 10.1523/jneurosci.18-09-03147.1998.
48.
Shirakawa, R., Yoshioka, A., Horiuchi, H., Nishi-
54. Ostrowski, M., Carmo, N. B., Krumeich, S., Fanget, I.,
oka, H., Tabuchi, A., and Kita, T. (2000) Small
Raposo, G., Savina, A., Moita, C. F., Schauer, K.,
GTPase Rab4 regulates Ca2+-induced α-granule se-
Hume, A. N., Freitas, R. P., Goud, B., Benaroch, P.,
cretion in platelets, J. Biol. Chem., 275, 33844-33849,
Hacohen, N., Fukuda, M., Desnos, C., Seabra, M. C.,
doi: 10.1074/jbc.M002834200.
Darchen, F., Amigorena, S., Moita, L. F., and Thery, C.
49.
Raffaniello, R. D., Lin, J., and Raufman, J.-P. (1996)
(2010) Rab27a and Rab27b control different steps of the
Actions and expression of RAB-GDP dissociation
exosome secretion pathway, Nat. Cell Biol., 12, 19-30,
inhibitor in dispersed chief cells from guinea pig
doi: 10.1038/ncb2000.
stomach, Biochem. Biophys. Res. Commun., 225, 232-
55. Savina, A., Fader, C. M., Damiani, M. T., and
237, doi: 10.1006/bbrc.1996.1159.
Colombo, M. I. (2005) Rab11 promotes docking
50.
Regazzi, R., Ravazzola, M., Iezzi, M., Lang, J.,
and fusion of multivesicular bodies in a calcium-
Zahraoui, A., Andereggen, E., Morel, P., Takai, Y.,
dependent manner, Traffic, 6, 131-143, doi: 10.1111/
and Wollheim, C. B. (1996) Expression, localization
j.1600-0854.2004.00257.x.
and functional role of small GTPases of the Rab3
56. Sun, C., Wang, P., Dong, W., Liu, H., Sun, J., and
family in insulin-secreting cells, J. Cell Sci., 109, 2265-
Zhao, L. (2020) LncRNA PVT1 promotes exosome
2273, doi: 10.1242/jcs.109.9.2265.
secretion through YKT6, RAB7, and VAMP3 in
51.
Smith, J., Thompson, N., Thompson, J., Armstrong, J.,
pancreatic cancer, Aging, 12, 10427, doi: 10.18632/
Hayes, B., Crofts, A., Squire, J., Teahan, C., Upton, L.,
AGING.103268.
and Solari, R. (1997) Rat basophilic leukaemia (RBL)
57. Brady, S. T., Siegel, G. J., Albers, R. W., and
cells overexpressing Rab3a have a reversible block
Price, D. L. (2011) Basic Neurochemistry: Principles of
in antigen-stimulated exocytosis, Biochem. J., 323,
Molecular, Cellular, and Medical Neurobiology, Eighth
321-328, doi: 10.1042/bj3230321.
Edition, doi: 10.1016/C2009-0-00066-X.
NEURONAL EXOSOMES AS A NEW SIGNALING SYSTEM
Review
A. A. Yakovlev1,2
1 Institute of Higher Nervous Activity and Neurophysiology, Russian Academy of Science,
117485 Moscow, Russia; e-mail: al_yakovlev@ihna.ru
2 Scientific and Practical Psychoneurological Center named after Z. P. Solovy’ov,
Moscow Healthcare Department, 115419 Moscow, Russia
Every year more and more works are devoted to the study of neuronal exosomes. The potential of exosomes
as diagnostic markers for neurodegenerative diseases has been significantly explored., and similar marker
search patterns have been adopted for the study of psychiatric pathologies. The fundamentals of exosome
biogenesis in different cell types have been elucidated., the physiological significance of exosomes is being
actively studied., and many aspects of signaling with their participation are being elucidated. At the same
time., data have been accumulated pointing to the role of exosomal signaling as an important element of
interneuronal communication. Do we have enough evidence to call exosomes a new non-canonical neuro-
transmitter in the brain? This discussion work is devoted to answering this question., in which the author
presents to the scientific community the concept of the possible role of brain exosomes as a signaling system.
Keywords: exosomes, extracellular vesicles, neurons, depolarization, calcium, Rab small GTPases, SNARE complex
БИОХИМИЯ том 88 вып. 4 2023