БИОХИМИЯ, 2023, том 88, вып. 5, с. 725 - 736
УДК 577;616-006
РЕКОМБИНАНТНЫЙ ЦИКЛОФИЛИН А ЧЕЛОВЕКА
В КОМБИНАЦИИ С АДОПТИВНОЙ Т-КЛЕТОЧНОЙ ТЕРАПИЕЙ
УСИЛИВАЕТ ЭФФЕКТИВНОСТЬ ПРОТИВООПУХОЛЕВОЙ
ИММУНОТЕРАПИИ В ЭКСПЕРИМЕНТАЛЬНЫХ МОДЕЛЯХ in vivo
© 2023 А.А. Калинина*, Д.Б. Казанский, Л.М. Хромых
ФГБУ «Национальный медицинский исследовательский центр онкологии им. Н.Н. Блохина»
Минздрава России, 115478 Москва, Россия; электронная почта: aakalinina89@gmail.com
Поступила в редакцию 15.12.2022
После доработки 08.02.2023
Принята к публикации 08.02.2023
Адоптивная Т-клеточная терапия (АКТ) успешно внедряется в лечение онкологических заболе-
ваний. Основные ограничения эффективности АКТ обусловлены низкой жизнеспособностью,
коротким временем персистенции и потерей функциональной активности Т-клеток после адоп-
тивного переноса. Поиск новых иммуномодуляторов, способных улучшить выживаемость, экс-
пансию и функции Т-лимфоцитов при адоптивном переносе с минимальным развитием побоч-
ных эффектов, позволит создать более успешные и безопасные стратегии АКТ. Особый интерес в
этом отношении представляет рекомбинантный циклофилин А человека (рчЦфА), который обла-
дает плейотропным иммуномодулирующим действием, направленным на стимуляцию врожден-
ного и адаптивного противоопухолевого иммунитета. В настоящей работе изучали влияние рчЦфА
на эффективность АКТ. В исследованиях использовали ранее разработанную экспериментальную
систему адоптивной терапии лимфомы EL-4 мыши, в которой источником опухолеспецифических
Т-клеток для АКТ служили лимфоциты трансгенных мышей 1D1a с врожденным пулом Т-лим-
фоцитов, способных распознавать антигены данной опухоли. В моделях иммунокомпетентных
и иммунодефицитных трансгенных мышей было показано, что 3-дневное введение рчЦфА значи-
тельно стимулировало отторжение лимфомы EL-4 и улучшало выживаемость животных-опухоле-
носителей после адоптивного переноса лимфоцитов трансгенных мышей 1D1a в сниженных дозах.
Наши исследования показали, что рчЦфА способен значительно повышать эффективность АКТ
посредством усиления эффекторных функций опухолеспецифических цитотоксических Т-лимфо-
цитов. Полученные результаты открывают широкие перспективы для разработки новых подходов
адоптивной Т-клеточной иммунотерапии злокачественных новообразований с использованием
рчЦфА как альтернативы существующей цитокиновой терапии.
КЛЮЧЕВЫЕ СЛОВА: циклофилин А, адоптивная клеточная терапия, цитокиновая терапия, противо-
опухолевая терапия, Т-клеточный рецептор, цитотоксический Т-лимфоцит, иммунодефицит, трансгенез.
DOI: 10.31857/S0320972523050020, EDN: AXIUIK
ВВЕДЕНИЕ
ванные Т-клеточными рецепторами (ТКР) или
химерными антигенными рецепторами (CAR),
Адоптивная клеточная терапия (АКТ) -
специфичными к антигенам опухоли [1-4].
это перспективный, активно развивающийся
Многочисленные клинические данные под-
подход иммунотерапии онкологических забо-
твердили эффективность АКТ с использова-
леваний, который предполагает введение па-
нием ТКР-модифицированных Т-клеток при
циенту аутологичных опухолеспецифических
лечении различных солидных опухолей (ме-
Т-лимфоцитов [1, 2]. Их источником могут
ланомы, синовиальной саркомы, карциномы
служить опухоль-инфильтрирующие лимфо-
толстой кишки и др.) и CAR-Т-клеток при те-
циты или Т-клетки, генетически модифициро- рапии В-клеточных лимфом [3, 4].
Принятые сокращения: АКТ - адоптивная клеточная терапия; ТКР - Т-клеточный рецептор; ЦфА - циклофилин А;
рчЦфА - рекомбинантный циклофилин А человека; ЦТЛ - цитотоксические лимфоциты; Kb - молекула главного ком-
плекса гистосовместимости H2-Kb.
* Адресат для корреспонденции.
725
726
КАЛИНИНА и др.
Основными ограничениями АКТ являются
данной опухоли [20]. Используя разработан-
низкая жизнеспособность и короткое время
ные ранее модели отторжения лимфомы EL-4
персистенции Т-клеток в организме пациента
у мышей дикого типа B10.D2(R101) [15, 20] и
после адоптивного переноса [5, 6], а также по-
трансгенных мышей 1D1b [21], мы показали,
теря их функциональной активности в супрес-
что рчЦфА способен значительно повышать
сорном микроокружении опухоли [7, 8]. Разра-
эффективность АКТ посредством усиления
ботка стратегий, позволяющих поддерживать
эффекторных функций опухолеспецифиче-
эффективность адоптивно перенесенных Т-лим-
ских цитотоксических Т-лимфоцитов.
фоцитов, остается актуальной практической
задачей развития АКТ.
В ряде клинических испытаний АКТ со-
МАТЕРИАЛЫ И МЕТОДЫ
лидных опухолей в протоколы лечения вклю-
чена курсовая терапия интерлейкином-2 (ИЛ-2)
Животные. Мышей инбредной линии
[9-11]. ИЛ-2 стал первым цитокином, высо-
B10.D2(R101) (KdI-AdI-EdDb) получали из
кая эффективность которого была показана
экспериментально-биологической лаборато-
при лечении онкологических заболеваний, что
рии НИИ экспериментальной диагностики
обусловлено его иммуномодулирующим дей-
и терапии опухолей (ФГБУ «НМИЦ онко-
ствием, направленным на стимуляцию про-
логии им. Н.Н. Блохина» Минздрава России,
лиферации, дифференцировки и активации
Москва, Россия). В работе также использо-
Т-клеток и естественных киллеров (NK-кле-
вали мышей трансгенной линии 1D1a [20]
ток) [12, 13]. Между тем введение пациентам
и трансгенной линии 1D1b [21], выведенных
высоких доз ИЛ-2 сопряжено с развитием тя-
на генетической основе B10.D2(R101), из соб-
желых токсических эффектов (анемии, цито-
ственной коллекции лаборатории механизмов
пении, гипотонии, почечной недостаточности
регуляции иммунитета (ФГБУ «НМИЦ онко-
и др.), вплоть до летальных исходов [12, 14].
логии им. Н.Н. Блохина» Минздрава России).
Поиск новых иммуномодуляторов, способных
Экспериментальные протоколы одобрены
улучшить выживаемость, экспансию и функ-
этической комиссией ФГБУ «НМИЦ онко-
циональную активность Т-лимфоцитов при
логии им. Н.Н. Блохина» Минздрава России.
адоптивном переносе с минимальным раз-
В работе использовали самцов и самок, 18-20 г
витием побочных эффектов, позволит создать
(6-8-недельного возраста). Эксперименталь-
более успешные и безопасные стратегии АКТ.
ные группы состояли из 6-18 животных.
Ранее в нашей лаборатории было показа-
Анализ наличия трансгенных α- и β-це-
но, что рекомбинантный циклофилин А чело-
пей ТКР. Наличие трансгена в геноме мы-
века (рчЦфА) обладает иммуностимулирующим
шей 1D1a и 1D1b анализировали методом ПЦР,
действием, направленным на усиление про-
как описано ранее [20, 21]. 1D1 α-цепь при-
тивоопухолевого иммунного ответа за счет
надлежит к семейству Va11.3, к которому нет
активации врожденного и адаптивного имму-
доступных коммерческих антител [20]. По этой
нитета [15]. ЦфА (18 кДа) - белок из семейства
изомераз, в секреторной форме выполняющий
функции провоспалительного фактора [16] и
хемоаттрактанта для незрелых гемопоэтиче-
ских клеток [17], гранулоцитов, макрофагов,
дендритных клеток и активированных Т-лим-
фоцитов [18]. Кроме того, ЦфА регулирует
продукцию и функции других хемокинов и
провоспалительных факторов [19]. Учитывая
плейотропность иммуномодулирующего дей-
ствия ЦфА, мы предположили, что данный фак-
тор также способен влиять на функциональную
активность Т-клеток при адоптивном переносе.
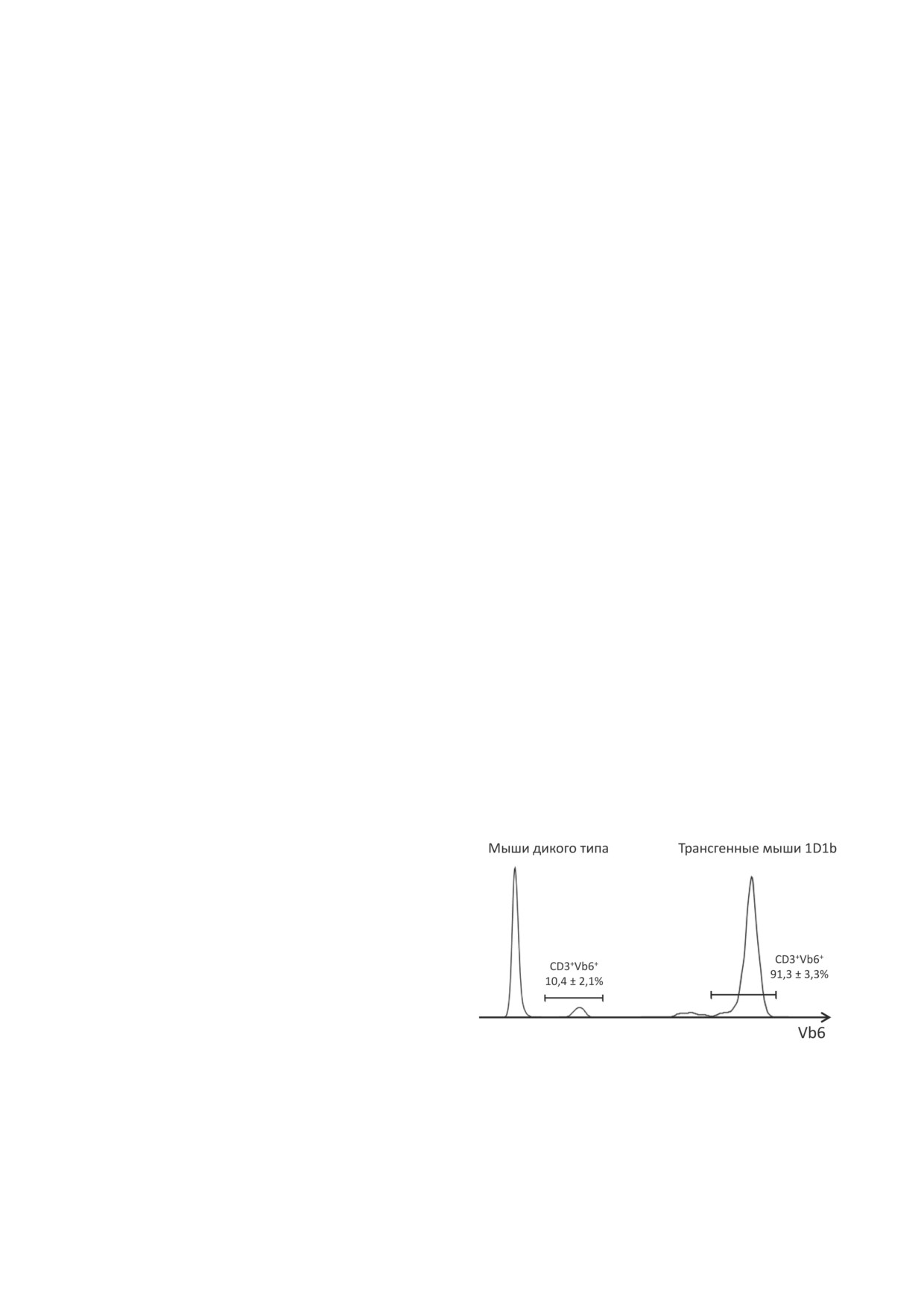
Рис. 1. Анализ экспрессии трансгенной β-цепи ТКР в
В настоящей работе исследовали влияние
Т-лимфоцитах мышей 1D1b. Цитофлуориметрический
рчЦфА на эффективность АКТ в эксперимен-
анализ Т-клеток периферической крови мышей линии
тальной модели лимфомы EL-4 мыши. В каче-
B10.D2(R101) (дикий тип) и трансгенной линии 1D1b.
стве источника опухолеспецифических Т-кле-
Экспрессию трансгенной β-цепи определяли окраши-
ванием антителами к семейству Vb6. Относительное
ток использовали спленоциты трансгенных
количество (%) СD3+Vb6+ Т-клеток анализировали в по-
мышей 1D1a, которые врожденно имеют пул
пуляции живых одиночных лимфоцитов. Данные пред-
Т-клеток, способных распознавать антигены
ставлены как m ± SEM (n = 6-9)
БИОХИМИЯ том 88 вып. 5 2023
РчЦфА УСИЛИВАЕТ ЭФФЕКТИВНОСТЬ АКТ
727
причине прямая оценка популяций Т-лимфо-
5,0 × 106 вводили в/б мышам B10.D2(R101)
цитов мышей 1D1a, экспрессирующих транс-
и 1D1b в 500 мкл PBS одновременно с транс-
генную α-цепь ТКР, оказалась невозможной.
плантацией клеток EL-4.
Экспрессию трансгенной 1D1 β-цепи в пери-
РчЦфА, схема введения. РчЦфА полу-
ферических лимфоцитах мышей 1D1b под-
чали, как описано ранее [22, 23]. РчЦфА вво-
тверждали методом проточной цитофлуори-
дили в/б мышам B10.D2(R101) и 1D1b в дозе
метрии. Относительное количество Т-клеток,
100 мкг/мышь 1 раз в день в течение 3 дней,
экспрессирующих трансгенную ТКРβ, в пе-
начиная через 3 ч после трансплантации кле-
риферической крови мышей 1D1b составило
ток EL-4 и адоптивного переноса. Для оценки
91,3 ± 3,3% (рис. 1), что соответствует ранее
противоопухолевого эффекта рчЦфА у им-
полученным данным [21].
мунодефицитных мышей 1D1b исследуемый
Клеточные линии. Клетки лимфомы EL-4
белок вводили в/б в дозе 100 мкг/мышь в тече-
(H2-Kb) получены из коллекции ФГБУ «НМИЦ
ние 10 дней, начиная через 3 ч после прививки
онкологии им. Н.Н. Блохина» Минздрава Рос-
лимфомы EL-4. Контрольным животным ана-
сии. EL-4 прививали внутрибрюшинно (в/б)
логично вводили PBS.
сингенным мышам C57BL/6 (3,0-5,0 × 106 кле-
Антитела. В работе использовали моно-
ток/мышь) и наращивали в асцитной форме
клональные антитела: анти-CD3/FITC (клон
10-14 дней. Опухолевые клетки стерильно вы-
145-2C11) и анти-CD8/Pacific blue (клон 53-6.7)
деляли из брюшного асцита и 3 раза отмывали
фирмы
«BD Pharmingen»; анти-CD44/APC
в фосфатно-солевом буфере (PBS; pH 7,4) цен-
(клон IM7), анти-Vb6/PE (клон RR4-7) и анти-
трифугированием (200 g, 5 мин, 4 °C). Жизне-
CD62L/APC-Cy7 (клон MEL-14) фирмы «eBio-
способные клетки подсчитывали в смеси три-
science», США, а также анти-Kb/FITC (клон
панового синего и эозина в камере Горяева.
AF6-88.5) фирмы «BioLegend», США.
Прививка EL-4. Клетки лимфомы EL-4
Цитофлуориметрический анализ. Пробы кле-
прививали мышам B10.D2(R101) и 1D1b в/б
ток
(5,0 × 105) инкубировали с блокирую-
в дозе 3,0 × 105 клеток/мышь в 500 мкл PBS.
щими антителами Fc block (клон
2.4G2,
Подготовка клеточных суспензий. Образ-
«BD Pharmingen») (10 мин, 4 °C) и окрашивали
цы крови мышей дикого типа B10.D2(R101) и
флуоресцентно меченными антителами (40 мин,
трансгенных мышей 1D1b отбирали из ретро-
4 °C). Анализ проводили на проточном цито-
орбитального синуса и инкубировали в лизи-
флуориметре FACS Canto II («BD Bioscience»)
рующем буфере («BD Pharmingen», США) для
в программе FACSDiva 6.0 («BD Bioscience»).
удаления эритроцитов. Затем образцы дважды
Лейкоциты выделяли по показателям прямо-
промывали PBS при 200 g, 5 мин при 4 °C и
го (FSC-A) и бокового (SSC-A) светорассея-
окрашивали флуоресцентно меченными анти-
ния с последующим выделением одиночных
телами для последующего анализа методом
клеток по показателям FSC-H против FSC-A
проточной цитофлуориметрии. Интактных мы-
(FSC-H - параметр прямого светорассеяния
шей линий B10.D2(R101) и 1D1a умерщвляли
клетки, характеризующий высоту (H - height)
методом цервикальной дислокации, стерильно
пика, FSC-A - параметр, учитывающий пло-
извлекали селезенки и осторожно выдавлива-
щадь под пиком (A - area). Мертвые клетки
ли клетки из стромы органа в гомогенизаторе
исключали из анализа по включению йодида
Поттера в 3 мл PBS. Эритроциты лизировали
пропидия («BD Bioscience»). Анализ экспрес-
в лизирующем буфере, лейкоциты промыва-
сии поверхностных маркеров проводили в
ли и подсчитывали, как описано выше. Полу-
популяции живых одиночных лейкоцитов. При
ченные суспензии спленоцитов использова-
анализе образцов клеток крови, лаважа и селе-
ли для адоптивного переноса мышам ли-
зенки трансгенных мышей 1D1b относительное
ний B10.D2(R101) и 1D1b. Мышей-реципиен-
количество Т-лимфоцитов, экспрессирующих
тов B10.D2(R101) выводили из эксперимента
трансгенную ТКРβ, оценивали по окрашива-
на 6 день после прививки клеток EL-4 и из-
нию анти-Vb6 антителами (семейство Vβ, к ко-
влекали лаваж брюшной полости. Для этого в
торому принадлежит трансгенная β-цепь 1D1b).
брюшную полость животных вводили шпри-
Относительное количество опухолевых клеток
цем 2 мл ледяного PBS и отбирали 1 мл кле-
EL-4 в брюшной полости экспериментальных
точной суспензии. У мышей 1D1b извлекали
животных определяли по экспрессии моле-
клетки лаважа и селезенки на 12 день после
кулы главного комплекса гистосовместимости
трансплантации лимфомы EL-4 и использо-
H2-Kb (Kb). Анализ популяций Т-лимфоцитов
вали для цитофлуориметрического анализа.
проводили после исключения Kb-позитивных
Адоптивный перенос. Спленоциты мышей
клеток. Обработку данных проводили в про-
линий B10.D2(R101) и 1D1a в дозе 2,5 × 106 и
грамме Flow Jo 7.6 («TreeStar Inc.», США).
БИОХИМИЯ том 88 вып. 5 2023
728
КАЛИНИНА и др.
Статистический анализ. Данные пред-
1D1a мышам дикого типа B10.D2(R101) при-
ставлены как среднее ± стандартная ошибка
водит к быстрой элиминации клеток лимфомы
среднего (m ± SEM). Статистический ана-
EL-4 в организме реципиента [20]. Для оцен-
лиз проводили с использованием программ-
ки влияния рчЦфА на эффективность АКТ
ного обеспечения Statistica for Windows
6.0
в разработанной экспериментальной модели
(«StatSoft», США) и непарного критерия
для адоптивного переноса использовали две
Стьюдента. Предварительно проводили про-
дозы лимфоцитов мышей 1D1a - 2,5 × 106 и
верку нормальности распределения выборок с
5,0 × 106 клеток/мышь, что в 4 и 2 раза ниже
использованием критерия Шапиро-Уилка для
установленной эффективной дозы соответ-
подтверждения корректности использования
ственно. РчЦфА вводили животным один раз
t-критерия Стьюдента. Различия признавали
в день в течение 3 дней, т.е. по схеме, макси-
значимыми при p ≤ 0,05.
мально приближенной к клиническим прото-
колам для ИЛ-2 [14].
Влияние рчЦфА на динамику отторжения
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
лимфомы EL-4 при адоптивном переносе лим-
фоцитов
1D1a в дозе 2,5 × 106 клеток/мышь.
Ранее мы показали, что адоптивный пере-
Анализ клеток брюшной полости эксперимен-
нос 1 × 107 спленоцитов трансгенных мышей тальных животных на 6 день после трансплан-
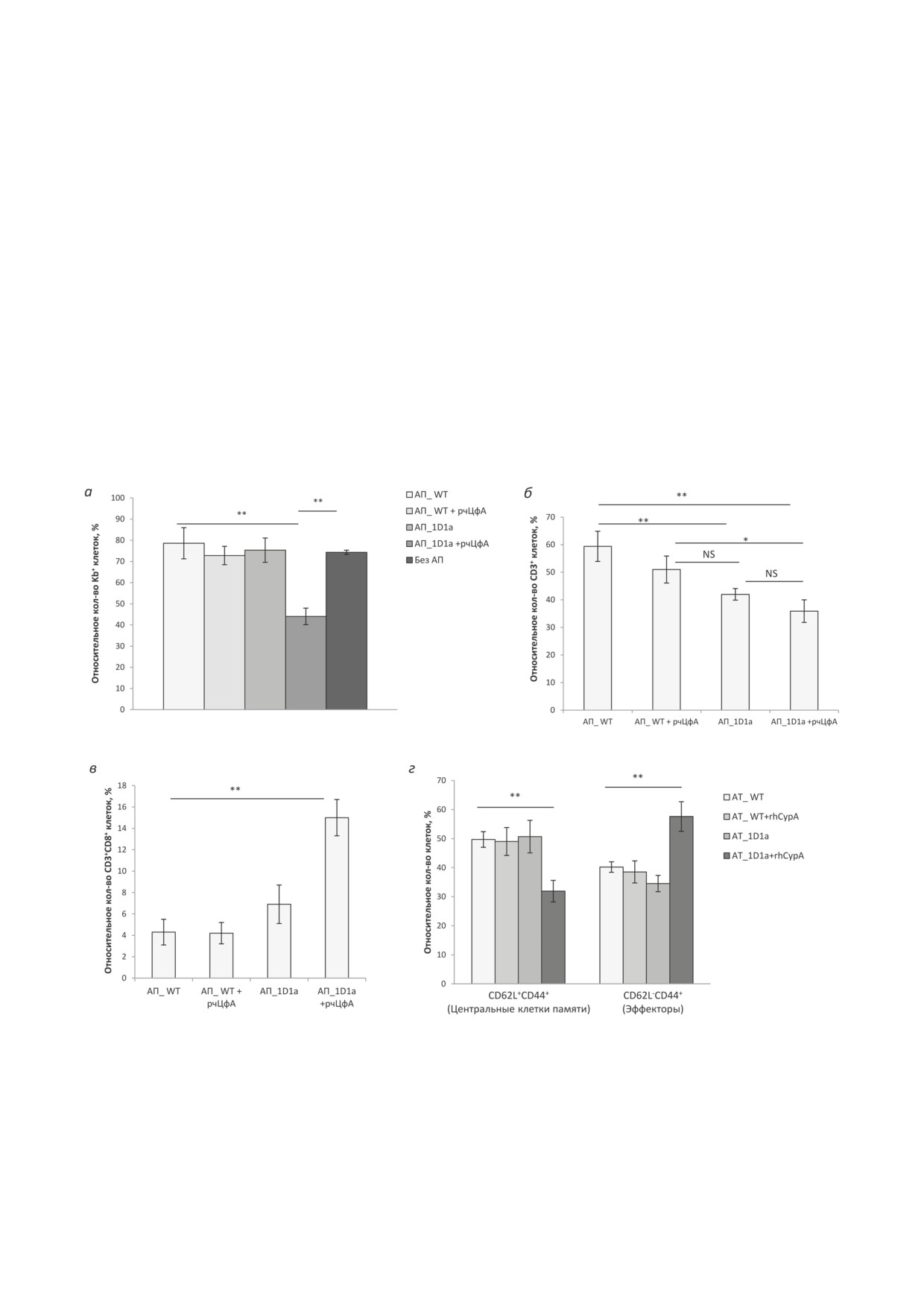
Рис. 2. Влияние рчЦфА на эффективность адоптивной клеточной терапии при дозе 2,5 × 106 лимфоцитов 1D1a/мышь.
Мышам B10.D2(R101) в/б вводили спленоциты трансгенных мышей 1D1a (АП_1D1a) или мышей B10.D2(R101)
(АП_WT) в дозе 2,5 × 106 клеток/мышь одновременно с в/б трансплантацией клеток EL-4. В качестве контроля ис-
пользовали мышей B10.D2(R101), аналогично привитых EL-4, но без адоптивного переноса (без АП). РчЦфА вво-
дили в/б в дозе 100 мкг/мышь в течение 3 дней. Контрольным животным аналогично вводили PBS. Анализ клеток
брюшной полости проводили методом проточной цитофлуориметрии на 6 день после трансплантации опухолевых
клеток и адоптивного переноса. Относительное количество (%) клеток EL-4 (а), Т-клеток (CD3+) (б), цитотоксиче-
ских Т-клеток (CD3+CD8+) (в) и Т-лимфоцитов CD3+CD8+ с фенотипом центральных клеток памяти (CD62L+CD44+)
и эффекторов (CD62L-CD44+) (г). Данные получены в трех независимых экспериментах и представлены как m ± SEM
(n = 6-9). NS - различия не достоверны; * р ≤ 0,05; ** р ≤ 0,01 (непарный критерий Стьюдента)
БИОХИМИЯ том 88 вып. 5 2023
РчЦфА УСИЛИВАЕТ ЭФФЕКТИВНОСТЬ АКТ
729
тации клеток EL-4 и адоптивного переноса
наблюдалось менее интенсивное накопление
лимфоцитов трансгенных мышей 1D1a в дозе
Т-клеток (рис. 2, б): относительное количе-
2,5 × 106 клеток/мышь показал, что под дей-
ство лимфоцитов CD3+ было ниже в 1,4 раза
ствием рчЦфА произошло снижение относи-
(р ≤ 0,01) по сравнению с группой адоптив-
тельного количества Kb+-клеток в 1,7 раза по
ного переноса контрольных спленоцитов
сравнению со всеми контрольными группами
(АП_WT). Под действием рчЦфА произошло
(р ≤ 0,01; рис. 2, а). При этом без введения
дальнейшее снижение относительного количе-
рчЦфА адоптивный перенос 2,5 × 106 транс-
ства Т-клеток в 1,6 раза по сравнению с груп-
генных клеток не повлиял на скорость оттор-
пой АП_WT (р ≤ 0,01) и в 1,4 раза - по срав-
жения EL-4 в организме реципиентов как
нению с группой АП_WT+рчЦфА (р ≤ 0,05).
по сравнению с животными без адоптивного
Однако стоит отметить, что по данному пока-
переноса, так и с группами адоптивного пере-
зателю не было достоверных различий между
носа контрольных лимфоцитов (рис. 2, а). Это
группами адоптивного переноса трансгенных
указывает на неэффективность данной дозы
лимфоцитов (рис. 2, б). Введение рчЦфА при
трансгенных лимфоцитов для АКТ в этой
трансфузии контрольных спленоцитов не вы-
экспериментальной системе. Стоит особо от-
звало изменения в содержании CD3+-клеток в
метить, что под действием рчЦфА скорость
брюшной полости экспериментальных живот-
элиминации лимфомы после адоптивного
ных при сравнении с группой АП_WT.
переноса лимфоцитов мышей дикого типа
Анализ доли цитотоксических лимфоци-
(АП_WT) была без изменений (рис. 2, а).
тов (CD3+CD8+, ЦТЛ) в популяции Т-клеток
При адоптивном переносе трансгенных
брюшной полости реципиентов показал, что
лимфоцитов в брюшной полости реципиентов введение рчЦфА после адоптивного переноса
Рис. 3. Влияние рчЦфА на эффективность адоптивной клеточной терапии при дозе 5,0 × 106 лимфоцитов 1D1a/мышь.
Мышам B10.D2(R101) в/б вводили спленоциты трансгенных мышей 1D1a (АП_1D1a) или мышей B10.D2(R101)
(АП_WT) в дозе 5,0 × 106 клеток/мышь одновременно с в/б трансплантацией клеток EL-4. РчЦфА вводили в/б в дозе
100 мкг/мышь в течение 3 дней. Контрольным животным аналогично вводили PBS. Анализ клеток брюшной полости
проводили методом проточной цитометрии на 6 день после трансплантации опухолевых клеток и адоптивного пере-
носа. Относительное количество (%) клеток EL-4 (а), Т-клеток (CD3+) и цитотоксических Т-клеток (CD3+CD8+) (б),
Т-лимфоцитов CD3+CD8+ с фенотипом центральных клеток памяти (CD62L+CD44+) и эффекторов (CD62L-CD44+) (в).
Данные получены в трех независимых экспериментах и представлены как m ± SEM (n = 6-9). * р ≤ 0,05; ** р ≤ 0,01
(непарный критерий Стьюдента)
БИОХИМИЯ том 88 вып. 5 2023
730
КАЛИНИНА и др.
трансгенных лимфоцитов увеличило долю ЦТЛ
Влияние рчЦфА на развитие противоопухо-
в 2,2 раза по сравнению с группой АП_1D1a и
левого иммунного ответа у иммунодефицитных
в 3,6 раза - по сравнению с обеими группами
трансгенных мышей
1D1b. Для подтвержде-
адоптивного переноса контрольных клеток
ния способности рчЦфА повышать эффектив-
(р ≤ 0,01; рис. 2, в). Данный эффект рчЦфА
ность разработанной экспериментальной АКТ в
отсутствовал при трансфузии спленоцитов мы-
дальнейшей работе использовали трансгенных
шей дикого типа (рис. 2, в). Собственно адоп-
мышей 1D1b, которые не способны развивать
тивный перенос лимфоцитов мышей 1D1a не
полноценный иммунный ответ и отторгать ал-
вызывал изменения относительного количества
логенную лимфому EL-4 вследствие суженного
ЦТЛ в брюшной полости экспериментальных
репертуара ТКР у этих мышей [21, 24].
животных.
Ранее мы показали, что под действием
Кроме того, исключительно после введения
рчЦфА у трансгенных мышей 1D1b в ответе на
рчЦфА в группе мышей-реципиентов транс-
лимфому EL-4 значительно увеличивается пул
генных спленоцитов наблюдалось локальное
эффекторных CD8+-клеток, экспрессирующих
накопление эффекторных ЦТЛ, доля которых
трансгенную β-цепь ТКР (ТКРβ) [15]. В на-
была увеличена в 1,7 раза по сравнению со все-
стоящей работе мы более детально изучили
ми контрольными группами (р ≤ 0,01; рис. 2, г)
влияние рчЦфА на развитие противоопухоле-
за счет пропорционального снижения отно-
вого иммунного ответа у этих иммунодефицит-
сительного количества Т-клеток с фенотипом
ных животных. Для этого исследуемый белок
центральных клеток памяти (рис. 2, г).
вводили в течение 10 дней после транспланта-
Влияние рчЦфА на динамику отторжения
ции клеток лимфомы EL-4 и на 12 день анали-
лимфомы EL-4 при адоптивном переносе лимфо-
зировали популяции клеток брюшной полости
цитов 1D1a в дозе 5,0 × 106 клеток/мышь. При
(рис. 4, а и б) и селезенки (рис. 4, в-д).
адоптивном переносе
5,0 × 106 лимфоцитов
Исследование клеток брюшной полости
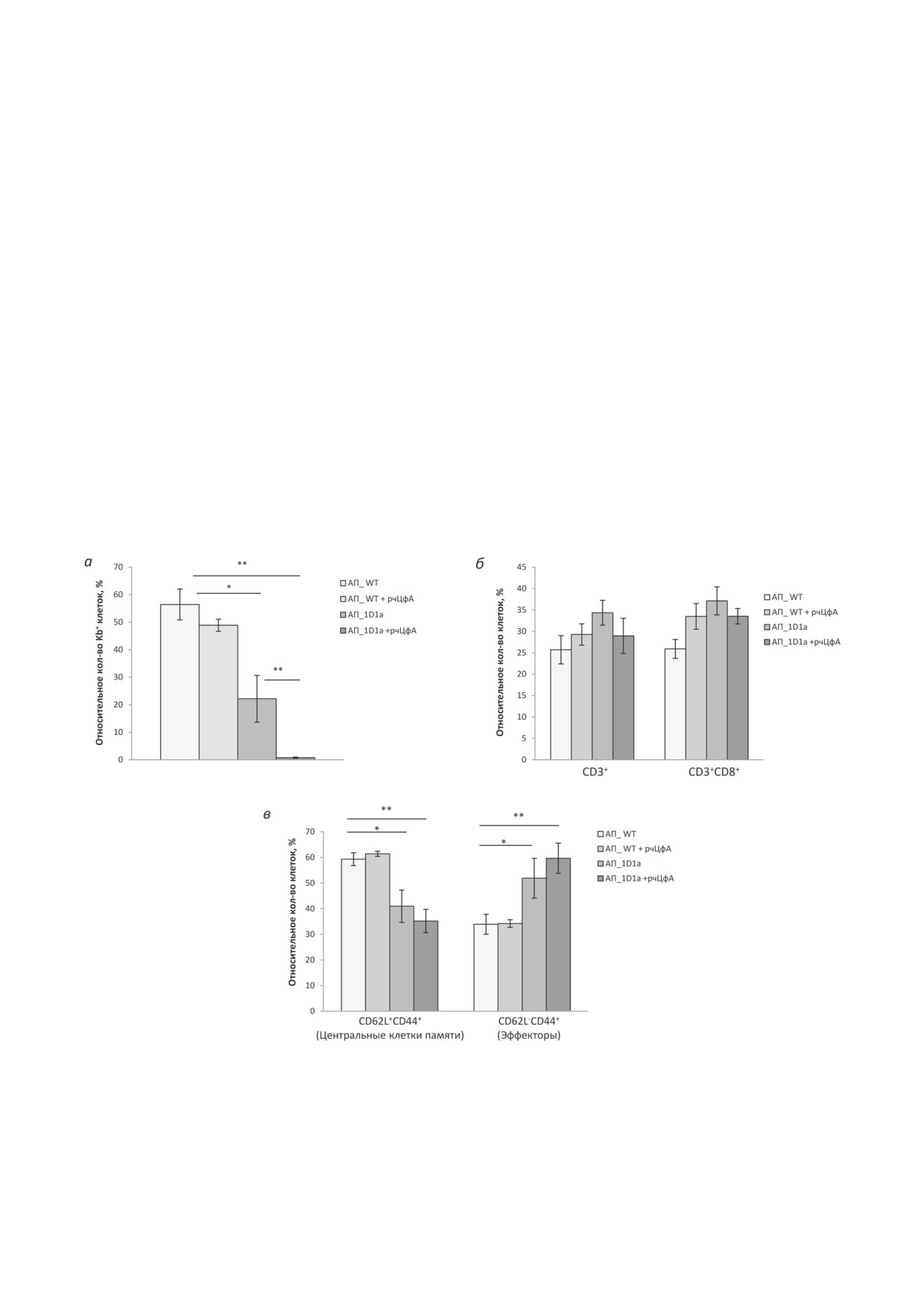
трансгенных мышей 1D1a наблюдалось сни-
мышей 1D1b показало, что курсовое введе-
жение относительного количества клеток лим-
ние рчЦфА способствовало достоверному
фомы EL-4 в брюшной полости реципиентов
(в 1,8 раза; р ≤ 0,05) снижению абсолютного
в 2,5 раза по сравнению с контрольной груп-
количества опухолевых клеток по сравнению
пой адоптивного переноса АП_WT (р ≤ 0,05;
с контролем к 12 дню после трансплантации
рис. 3, а), что указывает на частичную эффек-
лимфомы EL-4 (рис. 4, а). Это сопровождалось
тивность данной дозы трансгенных клеток.
увеличением доли Т-клеток почти в 3,0 раза по
При этом введение рчЦфА способствовало уси-
сравнению с контрольной группой без рчЦфА
лению эффективности АКТ и привело к прак-
и интактными мышами без опухоли (рис. 4, б).
тически полной элиминации опухолевых кле-
Стоит отметить, что при этом достоверно сни-
ток из организма мышей-реципиентов к 6 дню
зилось относительное количество Т-клеток
после трансплантации EL-4 (рис. 3, а). Данный
с трансгенной ТКРβ (р ≤ 0,05; рис. 4, б). Эти
эффект рчЦфА не наблюдался после адоптив-
данные указывают на то, что под действием
ного переноса лимфоцитов мышей дикого типа
рчЦфА индуцируется инфильтрация опухоли
(АП_WT; рис. 3, а).
Т-лимфоцитами, экспрессирующими как транс-
При анализе относительного количества
генную, так и эндогенные β-цепи ТКР.
Т-лимфоцитов (CD3+) и ЦТЛ (CD3+CD8+) в
В селезенке мышей 1D1b после введения
брюшной полости мышей-реципиентов не было
рчЦфА отмечалось достоверное увеличение от-
выявлено достоверных различий ни в одной ис-
носительного количества ЦТЛ (р ≤ 0,05; рис. 4, в)
следуемой группе (рис. 3, б). Однако адоптив-
без изменения соотношения Vb6+/Vb6- CD8+-
ный перенос трансгенных лимфоцитов 1D1a
лимфоцитов (рис. 4, г). При этом наблюдалось
привел к увеличению доли CD8+-эффекторов
увеличение доли эффекторных ЦТЛ в популя-
(CD62L-CD44+) в 1,5-1,7 раза по сравнению
ции Т-лимфоцитов, экспрессирующих транс-
с группами адоптивного переноса контроль-
генную ТКРβ (в 4,0 раза по сравнению с
ных спленоцитов (рис. 3, в). Стоит отметить,
контролями), в основном за счет снижения
что у реципиентов трансгенных клеток на фоне
относительного количества наивных клеток
введения рчЦфА доля эффекторных ЦТЛ в
(р ≤ 0,01; рис. 4, д, 1-3). Аналогичным образом
брюшной полости не отличалась от значений
введение рчЦфА привело к достоверному повы-
в контрольной группе АП_1D1a (рис. 3, в),
шению относительного количества эффекторов
что может указывать на начало контракции
среди Т-клеток с эндогенными β-цепями ТКР
эффекторной фазы иммунного ответа ввиду
(р ≤ 0,05 по сравнению с контрольными группа-
полной элиминации специфического антиге-
ми; рис. 4, д, 4-6). Это согласуется с результата-
на (рис. 3, а).
ми анализа клеток брюшной полости (рис. 4, б)
БИОХИМИЯ том 88 вып. 5 2023
РчЦфА УСИЛИВАЕТ ЭФФЕКТИВНОСТЬ АКТ
731
Рис. 4. Анализ клеток брюшной полости и селезенки мышей 1D1b после трансплантации лимфомы EL-4. Мышам
трансгенной линии 1D1b в/б трансплантировали 3,0 × 105 клеток EL-4 и в/б вводили рчЦфА в дозе 100 мкг/мышь в
течение 10 дней. Контрольным животным аналогично вводили PBS. На 12 день анализировали клеточный состав в
лаваже брюшной полости (а и б) и селезенке (в-д) экспериментальных животных. а - Абсолютное количество опу-
холевых клеток (× 106). б - Относительное количество (%) Т-клеток (CD3+) и Т-клеток, экспрессирующих транс-
генную β-цепь ТКР (CD3+Vb6+); в - относительное количество (%) цитотоксических Т-лимфоцитов (CD3+CD8+);
г - относительное количество (%) CD3+CD8+ Т-клеток селезенки, экспрессирующих трансгенную β-цепь ТКР (Vb6+);
д - относительное количество (%) CD3+CD8+ Т-клеток селезенки с фенотипом наивных клеток (CD62L+CD44-),
центральных клеток памяти (CD62L+CD44+) и эффекторов (CD62L-CD44+). Индивидуальный анализ популяций
CD3+CD8+ Т-клеток, экспрессирующих трансгенную β-цепь ТКР (CD8+Vb6+) (д, 1-3) или эндогенные β-цепи ТКР
(CD8+Vb6-) (д, 4-6). Данные получены в трех независимых экспериментах и представлены как m ± SEM (n = 7-8).
* р ≤ 0,05; ** р ≤ 0,01 (непарный критерий Стьюдента)
и подтверждает вовлечение обеих субпопуля-
Влияние рчЦфА на эффективность адоп-
ций Т-клеток, экспрессирующих трансген-
тивной клеточной терапии в трансгенной мо-
ную ТКРβ (Vb6+) или эндогенные варианты
дели
1D1b. При оценке влияния рчЦфА на
ТКРβ (Vb6-), в ответ на клетки EL-4 под дей-
эффективность АКТ в модели иммунодефи-
ствием рчЦфА.
цитных мышей 1D1b для адоптивного перено-
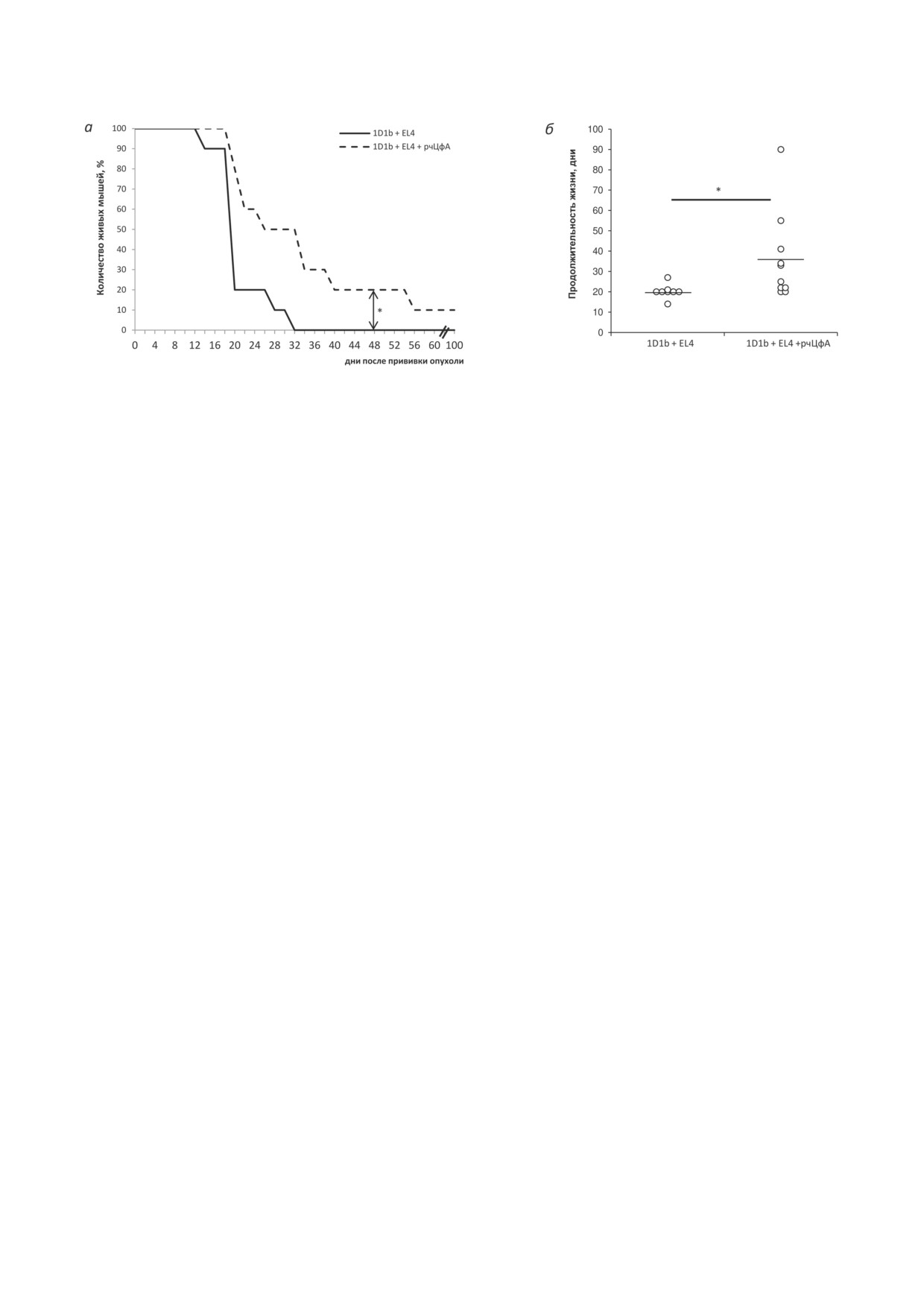
Курсовое введение рчЦфА также при-
са использовали спленоциты трансгенных мы-
вело к достоверному увеличению продолжи-
шей 1D1a в обеих исследуемых дозах (2,5 × 106
тельности жизни мышей 1D1b с привитой
и 5,0 × 106 клеток/мышь).
лимфомой EL-4 (30,2 ± 3,9 дней по сравне-
Инфузия трансгенных лимфоцитов мы-
нию с 20,2 ± 1,2 днями в контрольной группе;
шам 1D1b в дозе 2,5 × 106 клеток/мышь досто-
р ≤ 0,05; рис. 5). Более того, под действием
верно увеличила продолжительность жизни
рчЦфА у 10% трансгенных мышей произошло
реципиентов с привитой лимфомой EL-4 по
полное отторжение лимфомы EL-4 без при-
сравнению со всеми контрольными группами
знаков роста опухоли при наблюдении более
(р ≤ 0,05; рис. 6, а). Курсовое (3-дневное) вве-
100 дней (рис. 5).
дение рчЦфА значительно улучшило эффек-
БИОХИМИЯ том 88 вып. 5 2023
732
КАЛИНИНА и др.
Рис. 5. Влияние рчЦфА на продолжительность жизни трансгенных мышей 1D1b после прививки клеток лим-
фомы EL-4. Мышам трансгенной линии 1D1b в/б трансплантировали 3,0 × 105 клеток EL-4 и в/б вводили рчЦфА
в дозе 100 мкг/мышь в течение 10 дней. Контрольным животным аналогично вводили PBS. а - Динамика гибели
животных. б - Продолжительность жизни животных (n = 10). * р ≤ 0,05 (непарный критерий Стьюдента)
тивность АКТ, повысив срок жизни мышей
ноциты трансгенных мышей 1D1a служили
1D1b в
1,5 раза по сравнению с группой
источником опухолеспецифических Т-клеток
AП_1D1a (44,0 ± 1,1 дня и 28,8 ± 1,5 дня соот-
[20], использовали в настоящей работе для
ветственно; рис. 6, а). При этом продолжи-
исследования влияния рчЦфА на эффектив-
тельность жизни мышей-реципиентов после
ность АКТ.
инъекций рчЦфА увеличилась в 2,0 раза по
Было показано, что курсовое введение
сравнению с животными без терапии и груп-
рчЦфА при адоптивном переносе трансген-
пами адоптивного переноса контрольных лим-
ных 1D1a лимфоцитов в количестве в 2-4 раза
фоцитов (рис. 6, а).
ниже эффективной дозы [20] значительно сти-
Адоптивный перенос 5,0 × 106 лимфоцитов
мулирует отторжение специфической опухоли в
мышей 1D1a трансгенным мышам 1D1b увели-
организме реципиентов (рис. 2, а и 3, а). Этот
чил продолжительность жизни реципиентов
эффект был обусловлен локальным накоплени-
в 2,0 раза по сравнению со всеми контроль-
ем эффекторных ЦТЛ посредством дифферен-
ными группами животных (рис. 6, б). Кроме
цировки из Т-лимфоцитов с фенотипом цен-
того, около 20% мышей 1D1b (4 из 18) пол-
тральных клеток памяти (рис. 2, г). Полученные
ностью отторгли лимфому EL-4 без призна-
данные согласуются с результатами нашего пре-
ков роста опухоли при наблюдении более
дыдущего исследования, в котором было пока-
120 дней (рис. 6, в). После курсового введе-
зано, что у трансгенных мышей 1D1a в ответе
ния рчЦфА количество выживших реципиен-
на EL-4 именно центральные клетки памяти
тов увеличилось почти вдвое (38,8%; 7 из 18)
становятся источником эффекторных ЦТЛ [20].
по сравнению с группой AП_1D1a (рис. 6, в),
Для подтверждения наблюдаемых эффек-
что свидетельствует об усилении эффективно-
тов рчЦфА мы использовали трансгенных
сти АКТ при использовании данной дозы лим-
мышей 1D1b - уникальную модель иммуно-
фоцитов мышей 1D1a.
дефицитного состояния, обусловленного сокра-
щением разнообразия репертуара ТКР вслед-
ствие экспрессии трансгенной β-цепи ТКР [24].
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Было показано, что β-цепь 1D1b не определяет
антигенную специфичность исходного рецеп-
Ранее в нашей лаборатории была получена
тора [20, 24] и в комплексе c эндогенными α-це-
трансгенная линия мышей 1D1a, Т-лимфоци-
пями формирует узкий репертуар ТКР с огра-
ты которых экспрессируют α-цепь цепецентри-
ниченным количеством клонотипов, способных
ческого ТКР клеток памяти, распознающего
распознавать специфический антиген (моле-
молекулу MHC I класса H2-Kb [20]. Вследствие
кулу MHC I класса H2-Kb). Вследствие этого
этого трансгенные мыши
1D1a врожденно
Т-клетки, экспрессирующие трансгенную ТКРβ,
имеют пул Т-клеток, специфичных к H2-Kb, и
образуют небольшое количество эффекторов в
способны ускоренно отторгать лимфому EL-4,
ответ на клетки аллогенной лимфомы EL-4, не-
экспрессирующую данный аллоантиген [20].
сущей H2-Kb [21, 24]. В организме трансгенных
Экспериментальную модель, в которой спле-
мышей 1D1b формируется также минорный
БИОХИМИЯ том 88 вып. 5 2023
РчЦфА УСИЛИВАЕТ ЭФФЕКТИВНОСТЬ АКТ
733
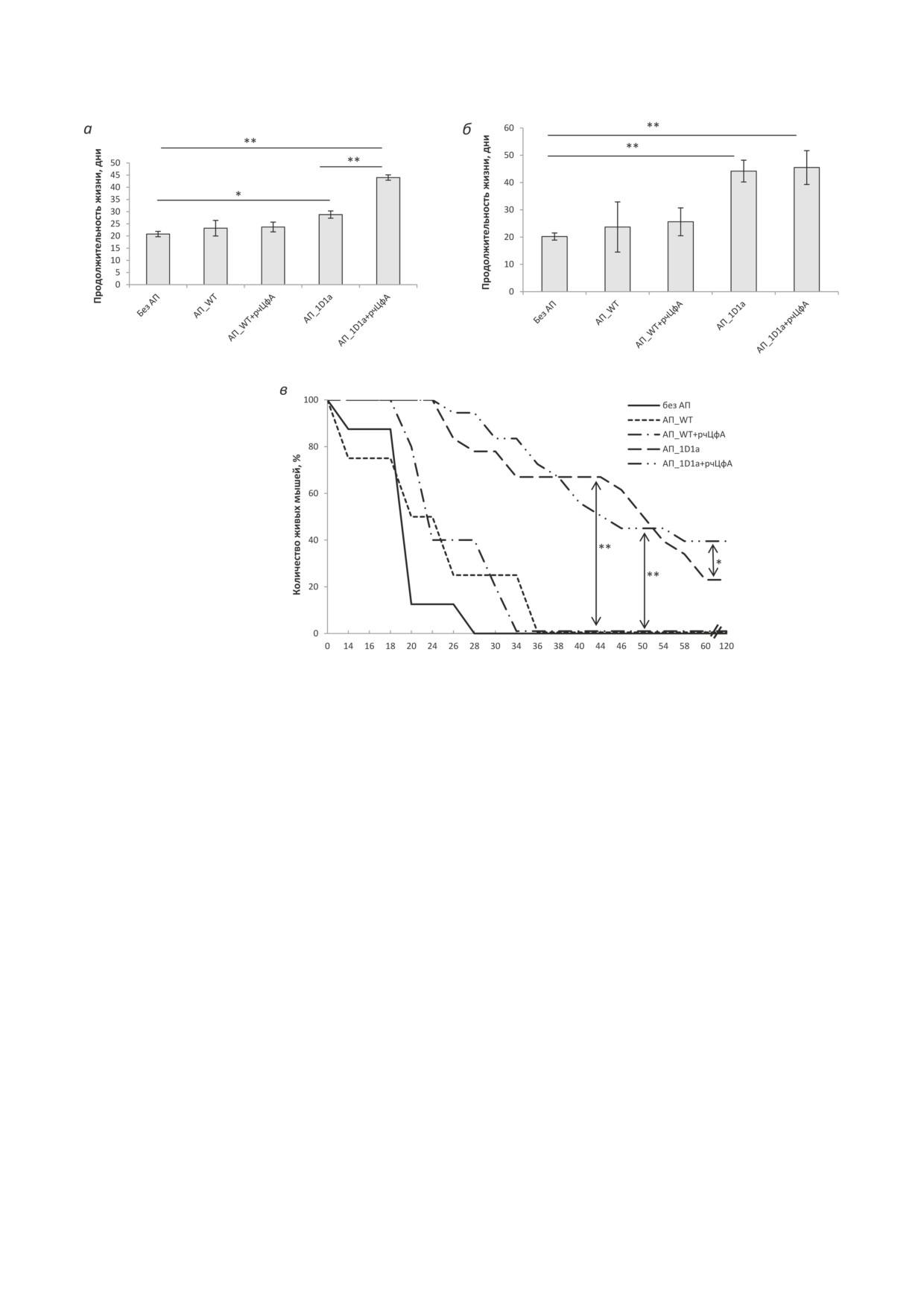
Рис. 6. Влияние рчЦфА на эффективность адоптивной клеточной терапии в модели иммунодефицитных мышей 1D1b.
Мышам трансгенной линии 1D1b в/б вводили спленоциты трансгенных мышей 1D1a (АП_1D1a) или мышей
B10.D2(R101) (АП_WT) в дозе 2,5 × 106 клеток/мышь (а) и 5,0 × 106 клеток/мышь (б и в) одновременно с в/б транс-
плантацией клеток EL-4. В/б инъекции рчЦфА в дозе 100 мкг/мышь проводили в течение 3 дней. Контрольным
животным аналогично вводили PBS. а и б - Продолжительность жизни животных (n = 7-18). в - Динамика гибели
животных (n = 10-18). * р ≤ 0,05; ** р ≤ 0,01 (непарный критерий Стьюдента)
пул Т-клеток (~10%) с эндогенными β-цепями,
стью отторгнув опухоль, что в 2 раза выше пока-
разнообразие которых не ограничено, и, следо-
зателя для АКТ без введения рчЦфА (рис. 6, в).
вательно, он способен распознавать EL-4. Од-
Полученные данные указывают на спо-
нако из-за низкой численности этих клоноти-
собность рчЦфА стимулировать эффекторные
пов их оказывается недостаточно для развития
функции опухолеспецифических цитотокси-
полноценного иммунного ответа и элиминации
ческих Т-лимфоцитов, таким образом значи-
опухолевых клеток [24]. Таким образом, имму-
тельно повышая эффективность АКТ. Учиты-
нодефицитные трансгенные мыши 1D1b явля-
вая отсутствие токсических эффектов рчЦфА
ются удобной моделью для оценки эффективно-
в широком диапазоне доз
[25], результаты
сти АКТ, так как эта экспериментальная система
настоящей работы открывают широкие пер-
позволяет минимизировать вклад иммунитета
спективы для оптимизации протоколов АКТ,
реципиента в ответ на опухолевые клетки.
исключая необходимость длительного и трудо-
В данной экспериментальной системе было
емкого наращивания in vitro требуемого коли-
показано, что курсовое (3-дневное) введение
чества Т-лимфоцитов для адоптивного перено-
рчЦфА значительно повышает терапевтиче-
са, и разработки более успешных и безопасных
ский эффект адоптивного переноса опухоле-
стратегий адоптивной иммунотерапии зло-
специфических Т-лимфоцитов мышам 1D1b,
качественных новообразований с использова-
в 2 раза увеличивая продолжительность жизни
нием рчЦфА как альтернативы существующим
животных с привитой лимфомой EL-4 (рис. 6).
подходам цитокиновой терапии [11, 14].
Более того, под действием рчЦфА около
Кроме того, в модели иммунодефицит-
40% реципиентов выживает после АКТ, полно- ных трансгенных мышей 1D1b без АКТ было
БИОХИМИЯ том 88 вып. 5 2023
734
КАЛИНИНА и др.
показано, что рчЦфА, как хемоаттрактант, сти-
ванных клеток, снизить темпы иммуноредакти-
мулирует накопление Т-лимфоцитов по месту
рования опухоли и формирования супрессорно-
локализации опухоли, при этом большую часть
го микроокружения. Продемонстрированный
составляют Т-клетки с эндогенными ТКРβ
в настоящем исследовании иммуностимули-
(60%; рис. 4, б), т.е. с более широким диапа-
рующий эффект рчЦфА может потенциально
зоном специфичностей. Также под влиянием
использоваться для коррекции противоопухо-
рчЦфА у мышей 1D1b в ответе на клетки лим-
левого ответа иммунодефицитных пациентов
фомы EL-4 системно (в селезенке) накаплива-
на ранних стадиях развития опухоли.
ются как эффекторы, экспрессирующие транс-
генную ТКРβ, так и эффекторы с эндогенными
Вклад авторов. А.А. Калинина, Л.М. Хро-
вариантами ТКРβ (рис. 4, д). Это позволяет
мых, Д.Б. Казанский - концепция; Л.М. Хро-
предположить, что под действием рчЦфА огра-
мых, Д.Б. Казанский - руководство работой;
ниченное количество клонотипов Т-клеток
А.А. Калинина - проведение экспериментов;
мыши 1D1b, способных распознавать антиге-
А.А. Калинина, Л.М. Хромых, Д.Б. Казан-
ны лимфомы EL-4, подвергаются клональной
ский - обсуждение результатов исследования;
экспансии и формируют более эффективный
А.А. Калинина - написание текста статьи;
пул ЦТЛ. Это обусловливает интенсивное от-
Л.М. Хромых, Д.Б. Казанский, А.А. Калини-
торжение опухолевых клеток на ранних сроках
на - редактирование текста статьи; А.А. Кали-
и достоверное увеличение продолжительно-
нина - получение финансирования. Все авторы
сти жизни трансгенных мышей-опухоленоси-
прочитали и одобрили окончательный вариант
телей (рис. 5).
статьи.
Сокращенный репертуар ТКР и низкая чис-
Финансирование. Работа выполнена при
ленность клонотипов Т-клеток, способных рас-
поддержке Российского научного фонда
познавать опухолевые антигены, служат серьез-
ным препятствием для развития полноценного
22-75-00004/.
адаптивного противоопухолевого иммунного
Конфликт интересов. Авторы заявляют об
ответа, позволяя опухоли избежать иммуноло-
отсутствии конфликта интересов.
гического контроля и быстро прогрессировать.
Соблюдение этических норм. Все примени-
Терапия, направленная на активацию и экспан-
мые международные, национальные и/или ин-
сию опухолеспецифических Т-клеток, может
ституциональные принципы ухода и использо-
повысить скорость элиминации трансформиро-
вания животных были соблюдены.
СПИСОК ЛИТЕРАТУРЫ
1. Met, Ö., Jensen, K., Chamberlain, C., Donia, M.,
6. William, Y., Ho, C., and Greenberg, P.
(2002)
and Svane, I. (2019) Principles of adoptive T cell
Adoptive therapy with CD8+ T cells: it may get by with
therapy in cancer, Semin. Immunopathol., 41, 49-58,
a little help from its friends, J. Clin. Invest., 110, 1415-
doi: 10.1007/s00281-018-0703-z.
1417, doi: 10.1172/JCI17214.
2. Zhang, H., and Chen, J. (2018) Current status and
7. Srivastava, S., and Riddell, S. (2018) Chimeric antigen
future directions of cancer immunotherapy, J. Cancer.,
receptor T cell therapy: challenges to bench-to-bedside
9, 1773-1781, doi: 10.7150/jca.24577.
efficacy, J. Immunol., 200, 459-468, doi: 10.4049/
3. Zhao, Q., Jiang, Y., Xiang, S., Kaboli, P., Shen, J.,
jimmunol.1701155.
Zhao, Y., Wu, X., Du, F., Li, M., Cho, C., Li, J.,
8. Yamamoto, T., Lee, P., Vodnala, S., Gurusamy, D.,
Wen, Q., Liu, T., Yi, T., and Xiao, Z. (2021) Engi-
Kishton, R., Yu, Z., Eidizadeh, A., Eil, R., Fioravanti, J.,
neered TCR-T cell immunotherapy in anticancer pre-
Gattinoni, L., Kochenderfer, J., Fry, T., Aksoy, B.,
cision medicine: pros and cons, Front. Immunol., 12,
Hammerbacher, J., Cruz, A., Siegel, R., Restifo, N.,
658753, doi: 10.3389/fimmu.2021.658753.
and Klebanoff, C. (2019) T cells genetically engineered
4. June, C., O’Connor, R., Kawalekar, O., Ghassemi, S.,
to overcome death signaling enhance adoptive cancer
and Milone, M. (2018) CAR T cell immunotherapy for
immunotherapy, J. Clin. Invest.,
129,
1551-1565,
human cancer, Science, 359, 1361-1365, doi: 10.1126/
doi: 10.1172/JCI121491.
science.aar6711.
9. Chandran, S., Somerville, R., Yang, J., Sherry, R.,
5. Mescher, M., Popescu, F., Gerner, M., Hammerbeck, C.,
Klebanoff, C., Goff, S., Wunderlich, J., Danforth, D.,
and Curtsinger, J. (2007) Activation-induced non-
Zlott, D., Paria, B., Sabesan, A., Srivastava, A., Xi, L.,
responsiveness (anergy) limits CD8 T cell responses
Pham, T., Raffeld, M., White, D., Toomey, M.,
to tumors, Semin. Cancer Biol.,
17,
299-308,
Rosenberg, S., and Kammula, U. (2017) Treatment of
doi: 10.1016/j.semcancer.2007.06.008.
metastatic uveal melanoma with adoptive transfer of
БИОХИМИЯ том 88 вып. 5 2023
РчЦфА УСИЛИВАЕТ ЭФФЕКТИВНОСТЬ АКТ
735
tumour-infiltrating lymphocytes: a single-centre, two-
17.
Khromykh, L., Kulikova, N., Anfalova, T., Muranova, T.,
stage, single-arm, phase 2 study, Lancet Oncol., 18,
Abramov, V., Vasiliev, A., Khlebnikov, V., and
792-802, doi: 10.1016/S1470-2045(17)30251-6.
Kazansky, D. (2007) Cyclophilin A produced by thy-
10.
Veatch, J., Lee, S., Fitzgibbon, M., Chow, I., Jesernig, B.,
mocytes regulates the migration of murine bone mar-
Schmitt, T., Kong, Y., Kargl, J., Houghton, A.,
row cells, Cell. Immunol., 249, 46-53, doi: 10.1016/
Thompson, J., McIntosh, M., Kwok, W., and Riddell, S.
j.cellimm.2007.11.002.
(2018) Tumor-infiltrating BRAFV600E-specific CD4+
18.
Xu, Q., Leiva, M., Fischkoff, S., Handschumacher, R.,
T cells correlated with complete clinical response
and Lyttle, C. (1992) Leukocyte chemotactic activity
in melanoma, J. Clin. Invest.,
128,
1563-1568,
of cyclophilin, J. Biol. Chem., 267, 11968-11971.
doi: 10.1172/JCI98689.
19.
Dawar, F., Xiong, Y., Khattak, M., Li, J., Lin, L.,
11.
Berraondo, P., Sanmamed, M., Ochoa, M., Etxeberria, I.,
Mei, J. (2017) Potential role of cyclophilin A in
Aznar, M., Pérez-Gracia, J., Rodríguez-Ruiz, M.,
regulating cytokine secretion, J. Leukoc. Biol., 102,
Ponz-Sarvise, M., Castañón, E., and Melero, I. (2019)
989-992, doi: 10.1189/jlb.3RU0317-090RR.
Cytokines in clinical cancer immunotherapy, Br. J.
20.
Zamkova, M., Kalinina, A., Silaeva, Y., Persiyan-
Cancer, 120, 6-15, doi: 10.1038/s41416-018-0328-y.
tseva, N., Bruter, A., Deikin, A., Khromykh, L.,
12.
Choudhry, H., Helmi, N., Abdulaal, W., Zeyadi, M.,
and Kazansky, D.
(2019) Dominant role of the
Zamzami, M., Wu, W., Mahmoud, M., Warsi, M.,
α-chain in rejection of tumor cells bearing a specific
Rasool, M., and Jamal, M. (2018) Prospects of IL-2
alloantigen in TCRα transgenic mice and in in vitro
in cancer immunotherapy, Biomed. Res. Int., 2018,
experiments, Oncotarget, 10, 4808-4821, doi: 10.18632/
9056173, doi: 10.1155/2018/9056173.
oncotarget.27093.
13.
Rosenberg, S., Yang, J., White, D., and Steinberg, S.
21.
Silaeva, Y., Kalinina, A., Vagida, M., Khromykh, L.,
(1998) Durability of complete responses in patients with
Deikin, A., Ermolkevich, T., Sadchikova, E.,
metastatic cancer treated with high-dose interleukin-2:
Goldman, I., and Kazansky, D. (2013) Decrease
identification of the antigens mediating response,
in pool of T lymphocytes with surface phenotypes
Ann. Surg., 228, 307-319, doi: 10.1097/00000658-
of effector and central memory cells under
199809000-00004.
influence of TCR transgenic β-chain expression,
14.
Nguyen, L., Saibil, S., Sotov, V., Le, M., Khoja, L.,
Biochemistry (Moscow), 78, 549-559, doi: 10.1134/
Ghazarian, D., Bonilla, L., Majeed, H., Hogg, D.,
S0006297913050143.
Joshua, A., Crump, M., Franke, N., Spreafico, A.,
22.
Kalinina, A., Kolesnikov, A., Kozyr, A.,
Hansen, A., Al-Habeeb, A., Leong, W., Easson, A.,
Kulikova, N., Zamkova, M., Kazansky, D., and
Reedijk, M., Goldstein, D., McCready, D., Yasufuku, K.,
Khromykh, L. (2022) Preparative production and
Waddell, T., Cypel, M., Pierre, A., Zhang, B., Boross-
purification of recombinant human Cyclophilin A,
Harmer, S., Cipollone, J., Nelles, M., Scheid, E.,
Biochemistry (Moscow), 87, 259-268, doi: 10.1134/
Fyrsta, M., Lo, C., Nie, J., Yam, J., Yen, P., Gray, D.,
S0006297922030063.
Motta, V., Elford, A., DeLuca, S., Wang, L., Effendi, S.,
23.
Khromykh, L. M., Kalinina, A. A., Kozyr, A. V.,
Ellenchery, R., Hirano, N., Ohashi, P., and Butler, M.
Kolesnikov, A. V., Silaeva, Yu. Yu., and Kazansky, D. B.
(2019) Phase II clinical trial of adoptive cell therapy
Patent № 2603283, Russian Federation, 2015.
for patients with metastatic melanoma with autologous
24.
Silaeva, Y., Grinenko, T., Vagida, M., Kalinina, A.,
tumor-infiltrating lymphocytes and low-dose inter-
Khromykh, L., and Kazansky, D. (2014) Immune
leukin-2, Cancer Immunol. Immunother., 68, 773-785,
selection of tumor cells in TCR β-chain transgenic
doi: 10.1007/s00262-019-02307-x.
mice, J. Immunotoxicol., 11, 393-399, doi: 10.3109/
15.
Kalinina, A., Silaeva, Yu., Kazansky, D., and Khro-
1547691X.2013.861548.
mykh, L. (2019) The role of recombinant human Cyclo-
25.
Kalinina, A., Zamkova, M., Antoshina, E.,
philin A in the antitumor immune response, Acta Natu-
Trukhanova, L., Gorkova, T., Kazansky, D., and
rae, 11, 63-67, doi: 10.32607/20758251-2019-11-2-63-67.
Khromykh, L. (2019) Analyses of the toxic properties
16.
Nigro, P., Pompilio, G., and Capogrossi, M. (2013)
of recombinant human Cyclophilin A in mice, J. Im-
Cyclophilin A: a key player for human disease, Cell
munotoxicol., 16, 182-190, doi: 10.1080/1547691X.
Death Dis., 4, e888, doi: 10.1038/cddis.2013.410.
2019.1665597.
RECOMBINANT HUMAN CYCLOPHILIN A IN COMBINATION
WITH ADOPTIVE T CELL THERAPY IMPROVES THE EFFICACY
OF CANCER IMMUNOTHERAPY IN EXPERIMENTAL MODELS in vivo
A. A. Kalinina*, D. B. Kazansky, and L. M. Khromykh
БИОХИМИЯ том 88 вып. 5 2023
736
КАЛИНИНА и др.
N.N. Blokhin National Medical Research Center of Oncology, Ministry of Health of the Russian Federation,
115478 Moscow, Russia; E-mail: aakalinina89@gmail.com
Adoptive T-cell therapy (ACT) is successfully applied in cancer treatment, however, its efficiency can be
limited by a low viability, short persistence time, and loss of functional activity of T cells after adoptive
transfer. The search for novel immunomodulators that can improve the viability, expansion, and functions
of T cells after their infusion with the minimal side effects could contribute to the development of more
efficient and safe ACT strategies. Recombinant human cyclophilin A (rhCypA) is of particular interest in
this respect, as it exhibits pleiotropic immunomodulatory activity and stimulates both innate and adaptive
anti-tumor immunity. Here, we evaluated the effect of rhCypA on the efficacy of ACT in the mouse EL4
lymphoma model. Lymphocytes from transgenic 1D1a mice with an inborn pool of EL4-specific T cells
were used as a source of tumor-specific T cells for ACT. In models of immunocompetent and immunodefi-
cient transgenic mice, the course (3 days) rhCypA administration was shown to significantly stimulate EL4
rejection and prolong the overall survival of tumor-bearing mice after adoptive transfer of lowered doses of
transgenic 1D1a cells. Our studies showed that rhCypA significantly improved the efficacy of ACT by en-
hancing the effector functions of tumor-specific cytotoxic T cells. These findings open up the prospects for
the development of innovative strategies of adoptive T-cell immunotherapy for cancer using rhCypA as an
alternative to existing cytokine therapies.
Keywords: cyclophilin A, adoptive cell therapy, cytokine therapy, anti-cancer therapy, T-cell receptor, cytotoxic
T lymphocyte, immunodeficiency, transgenesis
БИОХИМИЯ том 88 вып. 5 2023