БИОХИМИЯ, 2023, том 88, вып. 5, с. 737 - 747
УДК 577.151.42
О-АЦЕТИЛГОМОСЕРИНСУЛЬФГИДРИЛАЗА ИЗ Clostridioides difficile:
РОЛЬ ОСТАТКОВ ТИРОЗИНА АКТИВНОГО ЦЕНТРА
© 2023 В.В. Куликова*, С.В. Ревтович, А.Д. Лыфенко,
Е.А. Морозова, В.С. Коваль, Н.П. Бажулина,
Т.В. Демидкина
Институт молекулярной биологии им. В.А. Энгельгардта РАН,
119991 Москва, Россия; электронная почта: vitviku@yandex.ru
Поступила в редакцию 28.11.2022
После доработки 10.02.2023
Принята к публикации 10.02.2023
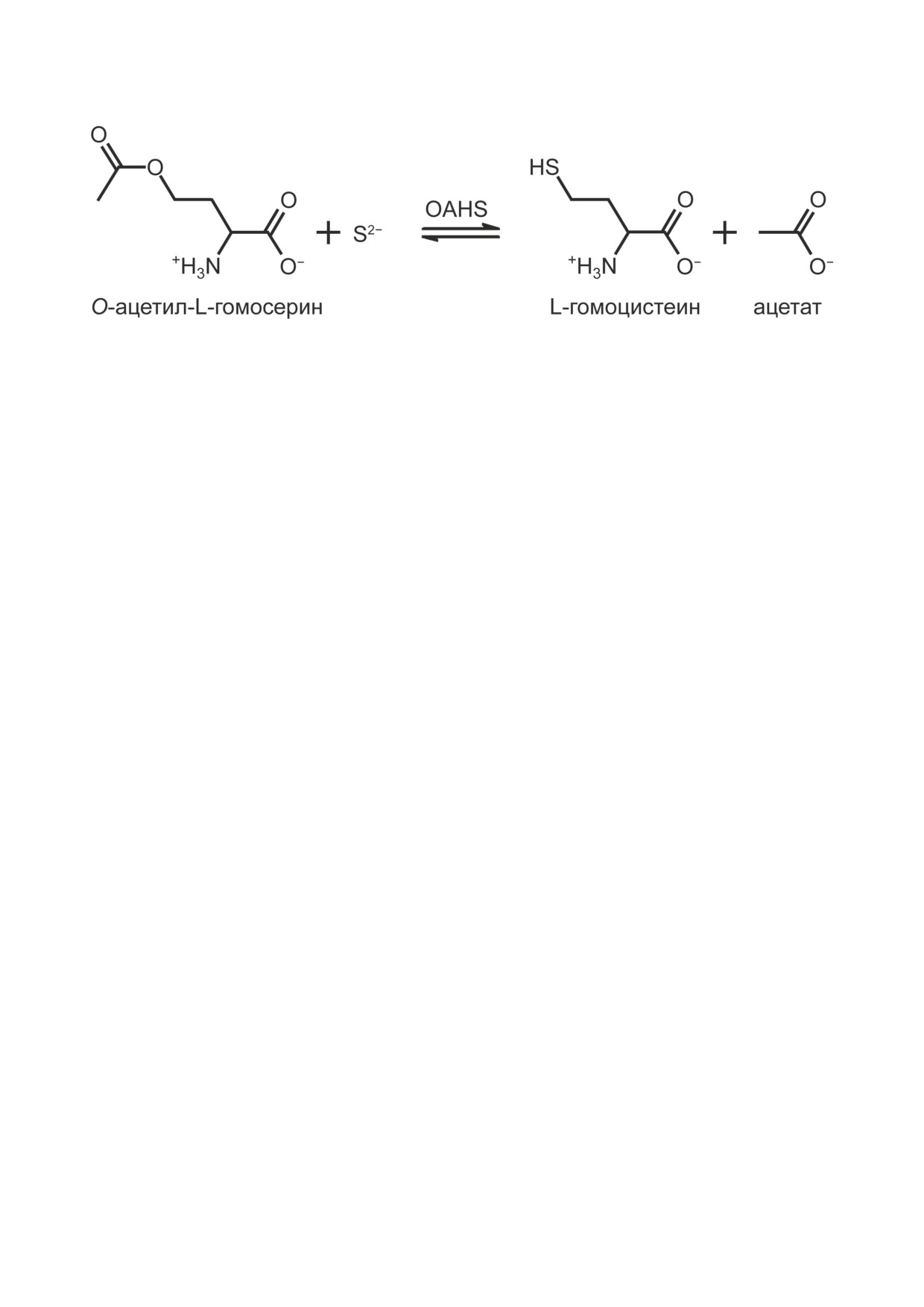
О-ацетилгомосеринсульфгидрилаза является одним из ключевых ферментов в биосинтезе метио-
нина в Clostridioides difficile. Механизм реакции γ-замещения О-ацетил-L-гомосерина, катализи-
руемой этим ферментом, наименее изучен среди пиридоксаль-5′-фосфат-зависимых ферментов,
участвующих в метаболизме цистеина и метионина. Для выяснения роли остатков активного
центра Tyr52 и Tyr107 получены четыре мутантные формы фермента с заменами на фенилаланин
и аланин. Исследованы каталитические и спектральные свойства мутантных форм. Скорость реак-
ции γ-замещения, катализируемой мутантными формами с заменой остатка Tyr52, уменьшилась
более чем на три порядка по сравнению с ферментом дикого типа. Мутантные формы Tyr107Phe
и Tyr107Ala практически не катализировали данную реакцию. Замены остатков Tyr52 и Tyr107
привели к уменьшению сродства апофермента к кофактору на три порядка и изменениям ионного
состояния внутреннего альдимина фермента. Полученные результаты позволили сделать пред-
положение, что остаток Tyr52 участвует в обеспечении оптимального положения каталитическо-
го кофактор-связывающего остатка лизина на стадиях отрыва С-α-протона и элиминирования
боковой группы субстрата. Остаток Tyr107 может выполнять роль общего кислотного катализатора
на стадии элиминирования ацетата.
КЛЮЧЕВЫЕ СЛОВА: О-ацетилгомосеринсульфгидрилаза, пиридоксаль-5′-фосфат, реакция γ-заме-
щения, сайт-направленный мутагенез.
DOI: 10.31857/S0320972523050032, EDN: AXKFQQ
ВВЕДЕНИЕ
следованы его биохимические свойства [2].
Данные о характеристиках ПЛФ-зависимых
Пиридоксаль-5′-фосфат (ПЛФ)-зависимая
ферментов из патогенных микроорганизмов
О-ацетилгомосеринсульфгидрилаза (OAHS,
становятся все более актуальными, поскольку
КФ 2.5.1.49) участвует в биосинтезе метиони-
некоторые из них не присутствуют в клетках
на, катализируя реакцию γ-замещения О-аце-
млекопитающих и поэтому являются перспек-
тил-L-гомосерина (OAH), приводящую к
тивными мишенями для создания новых анти-
образованию предшественника метионина -
биотиков.
L-гомоцистеина (рис. 1). Фермент обнаружен
Механизм многостадийной реакции γ-за-
в некоторых микроорганизмах, включая пато-
мещения, катализируемой OASH, является
генные бактерии класса Clostridia [1, 2]. Одни-
одним из самых сложных и неисследованных
ми из самых распространенных и агрессивных
в ПЛФ-зависимом катализе превращений
возбудителей внутрибольничных инфекций в
аминокислот. Первые очень ограниченные
последние годы стали антибиотикорезистент-
биохимические характеристики OASH были
ные штаммы Clostridioides difficile. Ранее нами
получены для ферментов, выделенных из
был клонирован и экспрессирован в клетках
Neurospora [3], Saccharomyces cerevisiae [4] и
Escherichia сoli ген OAHS из C. difficile, полу-
Corynebacterium ethanolaminophilum [5]. Боль-
чены гомогенные препараты фермента и ис- шинство публикаций, в которых упомина-
Принятые сокращения: ПЛФ - пиридоксаль-5′-фосфат; ОАH - О-ацетил-L-гомосерин; ОАHS - О-ацетилгомосерин-
сульфгидрилаза.
* Адресат для корреспонденции.
737
4
738
КУЛИКОВА и др.
Рис. 1. Схема реакции γ-замещения, катализируемой O-ацетилгомосеринсульфгидрилазой
ются OAHS, относится к исследованиям путей
Для остатка Tyr58 метионин-γ-лиазы из C. fre-
синтеза метионина в бактериях, грибах и
undii, гомологичного остатку Tyr52 OAHS,
дрожжах. Этот вопрос наиболее изучен для
было сделано предположение, что он необ-
рода Corynebacterium, для некоторых бакте-
ходим для оптимального положения боковой
рий которого были показаны два пути синтеза
аминогруппы каталитического ПЛФ-связы-
метионина [6]. Единственный путь прямого
вающего остатка Lys210 метионин-γ-лиазы на
сульфгидрилирования, обусловливающий важ-
стадиях отрыва C-α- и C-β-протонов [16].
ность ОАНS для микроорганизма, был уста-
Целью настоящей работы было выясне-
новлен для Pseudomonas aeruginosa [7] и Lepto-
ние роли остатков Tyr52 и Tyr107 OAHS из
spira meyeri [8]. В наших предыдущих работах
C. difficile. Для этого были сконструированы
мы также предположили, что в С. difficile и
четыре плазмиды с геном OAHS из C. difficile,
Clostridium novyi используется один путь био-
содержащие единичные замены консерватив-
синтеза метионина - путь прямого сульфгид-
ных остатков тирозина активного центра на
рилирования, в котором OASH играет ключе-
фенилаланин и аланин. Мутантные формы
вую роль [1, 2].
фермента были экспрессированы в клетках
В настоящее время определены про-
E. coli, получены очищенные препараты, про-
странственные структуры OAHS с доказан-
анализировано влияние замен на каталитиче-
ной субстратной специфичностью из Thermus
ские и спектральные свойства фермента.
thermophilus (PDB 1ULQ, 2CTZ) [9], Wolinella
succinogenes (PDB 3RI6) [10, 11] и Thermotoga
maritima (PDB 7KB0, 7KB1) [12]. Сравнение
МАТЕРИАЛЫ И МЕТОДЫ
этих структур со структурами ПЛФ-зависи-
мых ферментов, катализирующих реакции
Сайт-направленный мутагенез. Сайт-направ-
превращений серосодержащих аминокислот,
ленный мутагенез проводили методом поли-
показало, что OAHS принадлежит к струк-
меразной цепной реакции (ПЦР). В качестве
турному классу I, подклассу цистатионин-β-
матрицы использовали плазмиду, полученную
лиазы
[13]. Выравнивание аминокислотных
клонированием гена ОАНS в вектор Blue-
последовательностей OAHS и ферментов под-
script II SK(+/-) («Agilent», США). Последова-
класса цистатионин-β-лиазы и анализ имею-
тельности праймеров, использованных для за-
щихся пространственных структур выявили
мены Tyr52Phe, Tyr52Ala, Tyr107Phe и Tyr107Ala
консервативность двух остатков тирозина их
(«Синтол», Россия), представлены в табл. 1.
активных центров [1]. В структуре OAHS из
После проведения ПЦР из реакционных
T. maritima остаток Tyr58, соответствующий
смесей выделяли ампликоны c использованием
остатку Tyr52 OAHS из C. difficile, образует
набора для выделения ДНК («Fermentas», Лат-
водородную связь с фосфатной группой ПЛФ,
вия). Очищенные препараты ДНК обрабаты-
остаток Tyr107 находится в π-стэкинге с пири-
вали эндонуклеазами рестрикции NcoI и XhoI
диновым кольцом ПЛФ, обеспечивая электро-
и лигировали с плазмидой pET28a («Novagen»,
ноакцепторные свойства кофактора. Остат-
Германия), обработанным этими же фермен-
ки Tyr114 и Tyr113 метионин-γ-лиазы из Pseudo-
тами. Полученные смеси трансформировали
monas putida и Citrobacter freundii, гомологичные
электропорацией в клетки E. coli DH10B и
остатку Tyr107, предположительно, выполняют
выращивали на твердой среде (1,8% (w/v) агар
роль общего кислотного катализатора на ста-
на среде Лурия-Бертани (LB)) с 50 мкг/мл ка-
дии элиминирования γ-заместителя [14, 15].
намицина. Выращенные колонии переносили
БИОХИМИЯ том 88 вып. 5 2023
РОЛЬ ОСТАТКОВ Tyr АКТИВНОГО ЦЕНТРА ОАHS
739
Таблица 1. Последовательности праймеров, использованных для сайт-направленного мутагенеза
Вариант замены
Последовательность праймеров 5’→3’
Tyr52Phe
GGATTGCTTATTCTTGAAAATATATGTCCATCAACTT
Tyr52Ala
GGATTGCTTATTCTTGATGCTATATGTCCATCAACTT
Tyr107Phe
GTAAATTGAATGTTCCTCCAAATACTTTTGAAGAACAAAGT
Tyr107Ala)
GTAAATTGAATGTTCCTCCTGCTACTTTTGAAGAACAAAGT
Примечание. Кодоны, в которые были внесены замены, подчеркнуты.
в жидкую среду LB с добавлением канамицина
5 мин. Спектры 1Н-ЯМР записывали с исполь-
и растили в течение 16-18 ч. Плазмидную ДНК
зованием спектрометра Bruker AMXIII-400
выделяли с использованием набора для выде-
(«Bruker», США) c рабочей частотой 400 МГц.
ления плазмид («Thermo Scientific», США) и
Сигналы С-α-протона аминокислоты инте-
идентифицировали путем аналитической ре-
грировали с помощью модифицированной
стрикции. Фрагменты, содержащие замены,
программы автоматизации enzkin, входящей в
были переклонированы в плазмиду pET28a.
состав программ XWIN_NMR.
Точность клонирования контролировали пу-
Получение холоферментов и апоферментов.
тем секвенирования вставок ДНК («Геном»,
Для получения холофермента к раствору бел-
Москва). Клетки E. coli BL21(DE3) трансфор-
ка (10-20 мг/мл) в 0,05 М калий-фосфатном
мировали плазмидами, содержащими вставки.
буфере (рН 7,5) добавляли 50-кратный моляр-
Выращивание бактериальной массы и очист-
ный избыток ПЛФ и инкубировали в тече-
ка ферментов. Выращивание клеток E. coli
ние 1 ч при комнатной температуре. Избыток
BL21(DE3), содержащих плазмиды с генами
ПЛФ удаляли диализом против буфера того
мутантных форм, и очистку ферментов прово-
же состава при +4 °С. Для получения апофер-
дили, как описано ранее для фермента дикого
мента к 0,2 мМ раствору белка в 0,05 М калий-
типа [2]. Концентрацию очищенных препара-
фосфатном буфере (рН 7,5) добавляли 20 мМ
тов фермента определяли по методу Бредфор-
раствор D, L-пеницилламина. Раствор инку-
да [17]. Гомогенность препаратов проверяли
бировали при комнатной температуре в тече-
при помощи ПААГ-электрофореза в денату-
ние 1 ч, затем избыток D, L-пеницилламина
рирующих условиях [18].
удаляли диализом при +4 °С против буфера
Кинетические исследования. Реакцию γ-за-
того же состава.
мещения, катализируемую OAHS, проводили
Спектральные исследования. Для получе-
при 25 °C, как описано ранее [2]. Реакцион-
ния спектров поглощения мутантных форм
ная смесь (200 мкл) содержала 0,05 МKH2PO4/
холоферментов и их комплексов с ингибито-
/0,05 М K2HPO4 (pH 7,5); 0,1 мМ ПЛФ; 10 мM
рами использовали спектрофотометр Cary-50
OAH и 5 мM Na2S. Реакцию инициировали до-
(«Varian», США). Спектры регистрировали в
бавлением 10-100 мкг белка. Количество об-
0,1 М калий-фосфатном буфере (рН 7,5) при
разовавшегося гомоцистеина рассчитывали по
концентрации фермента 0,5-2 мг/мл и 100 мМ
методу Kredich и Becker [19]. За единицу фер-
L-метионина или D, L-пропаргилглицина.
ментативной активности принимали количе-
Содержание ПЛФ в холоферментах опреде-
ство фермента, катализирующее образование
ляли, используя коэффициент поглощения
1 мкмоль гомоцистеина в минуту.
ПЛФ ɛ = 6600 М-1·см-1 в 0,1 М NaOH при
Изотопный обмен C-α-протона субстрата
390 нм [20]. Для определения ионного состоя-
в комплексах с ферментом. Кинетику реакции
ния внутренних альдиминов мутантных форм
обмена C-α-протона OAH на дейтерий, ката-
спектры поглощения были разложены мето-
лизируемой мутантными формами, регистри-
дом логнормального разложения на полосы
ровали при помощи 1H-ЯМР-спектроскопии.
отдельных электронных переходов их тауто-
Изотопный обмен протонов аминокислот про-
меров и конформеров [21].
водили в 0,5 мл D2O, содержащей 0,05 М ка-
Определение константы диссоциации (Kd)
лий-фосфат (pD = 7,1); 0,1 мM ПЛФ; 100 мМ
комплекса фермента с ПЛФ. К растворам апо-
OAH и 5 мг фермента. Через 24 ч после инку-
фермента (0,02 мМ) в 50 мМ калий-фосфат-
бации при 25 °C фермент инактивировали
ном буфере (рН 7,5), содержащем 1 мМ ДТТ,
нагреванием (90 °C, 5 мин) и отделяли центри-
добавляли аликвоты раствора ПЛФ
(0,2-
фугированием при 9660 g (rср = 6 см) в течение
200 мМ). После 30 мин инкубации при 30 °С
БИОХИМИЯ том 88 вып. 5 2023
4*
740
КУЛИКОВА и др.
растворы помещали в центрифужный концен-
Спектральные исследования. В спектрах по-
тратор (30 000 Da, «Sartorius», Германия) и цен-
глощения холоферментов Tyr107Phe, Tyr107Ala,
трифугировали при 2795 g (rср = 10 см) в течение
Tyr52Phe и Tyr52Ala имеются полосы погло-
5 мин для освобождения от несвязанного ПЛФ.
щения с максимумами в области 325-340 нм
Содержание ПЛФ в холоферментах опреде-
и 410-416 нм, которые при данных условиях
ляли, как описано выше. Полученные данные
эксперимента (pH 7,5) могут соответствовать
обрабатывали в координатах Скэтчарда [22].
одному из ионных состояний внутреннего
альдимина - катионному или нейтральному
(рис. 2). Для определения ионного состояния
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
внутреннего альдимина мутантных форм было
применено логнормальное разложение спек-
Кинетические исследования. Замена остат-
тров поглощения на полосы, соответствующие
ков тирозина активного центра OAHS привела
отдельным электронным переходам альдими-
к значительным изменениям каталитических
нов ПЛФ с аминокислотами, используя две
параметров фермента. Мутантные формы с за-
модели: катионную и нейтральную (рис. 2).
меной Tyr52 катализировали реакцию γ-заме-
Основным критерием корректности использо-
щения OAH со скоростями, более чем на три
ванных моделей для описания спектров было
порядка меньшими, чем фермент дикого типа,
соответствие количества таутомеров и кон-
значения Km OAH увеличились в несколько
формеров количеству связанного ПЛФ. Ана-
раз (табл. 2). Для мутантных форм Tyr107Phe
лиз данных разложения спектров поглощения
и Tyr107Ala не удалось обнаружить образова-
всех четырех мутантных форм показал, что
ние L-гомоцистеина, продукта реакции γ-за-
при использовании нейтральной модели коли-
мещения. При инкубации мутантных форм с
чество ПЛФ, связанного с ферментом, соот-
OAH в D2O в спектрах 1Н-ЯМР наблюдалось
ветствует суммарному количеству найденных
уменьшение интенсивности сигнала С-α-про-
таутомеров и конформеров. Поэтому для раз-
тона субстрата (табл. 2), что свидетельствовало
ложения спектров поглощения холофермен-
о том, что мутантные формы cвязывали суб-
тов всех четырех мутантных форм нейтраль-
страт и катализировали отрыв С-α-протона из
ная модель является наиболее адекватной, и,
внешнего альдимина.
следовательно, внутренний альдимин в актив-
Сродство к кофактору. Ухудшение сродства
ных центрах мутантных ферментов находится
к кофактору наблюдалось во всех мутантных
в нейтральной форме, содержащей таутомеры
формах: величина константы диссоциации
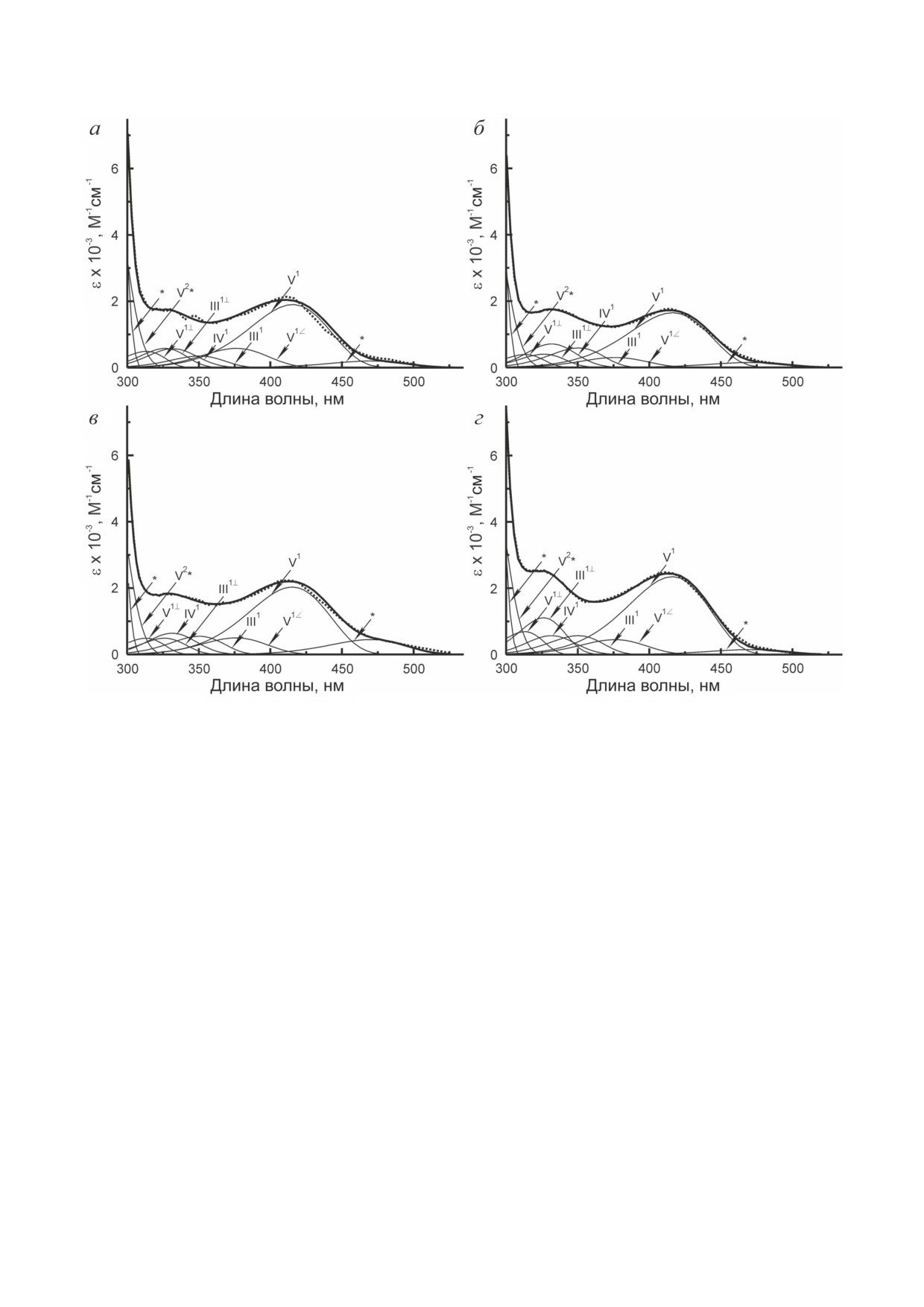
III, IV, V, и конформеры форм III и V. На рис. 3
комплекса фермента с ПЛФ (Kd) увеличилась
представлено разложение спектров погло-
на три порядка по сравнению с величиной, по-
щения мутантных форм холофермента при
лученной для фермента дикого типа (табл. 3).
рН 7,5 в соответствии с нейтральной моделью.
Таблица 2. Кинетические параметры реакции γ-замещения OAH
Степень обмена
Фермент
Km, мМ
kcat, с-1
kcat/Km, М-1·с-1
С-α-протона OAH
в D2O за 24 ч
Tyr52Phe
4,4 ± 0,3
0,05 ± 0,003
11
40%
Tyr52Ala
3,2 ± 0,2
0,06 ± 0,003
19
50%
Tyr107Phe
н/о
н/о
н/о
35%
Tyr107Ala
н/о
н/о
н/о
20%
Дикий тип*
0,60 ± 0,05
94,12 ± 1,88
1,6 × 105
90%
Примечание. * Литературные данные [2]. н/о - не определено.
Таблица3. Сродство фермента к ПЛФ
Параметры
OAHS дикого типа*
Tyr52Phe
Tyr52Ala
Tyr107Phe
Tyr107Ala
Kd, М
(1,3 ± 0,1) × 10-5
(2,7 ± 0,2) × 10-2
(2,9 ± 0,2) × 10-2
(1,6 ± 0,1) × 10-2
(1,4 ± 0,1) × 10-2
ΔG, ккал/моль
-6,64
-2,13
-2,06
-2,44
-2,51
Примечание. * Литературные данные [2].
БИОХИМИЯ том 88 вып. 5 2023
РОЛЬ ОСТАТКОВ Tyr АКТИВНОГО ЦЕНТРА ОАHS
741
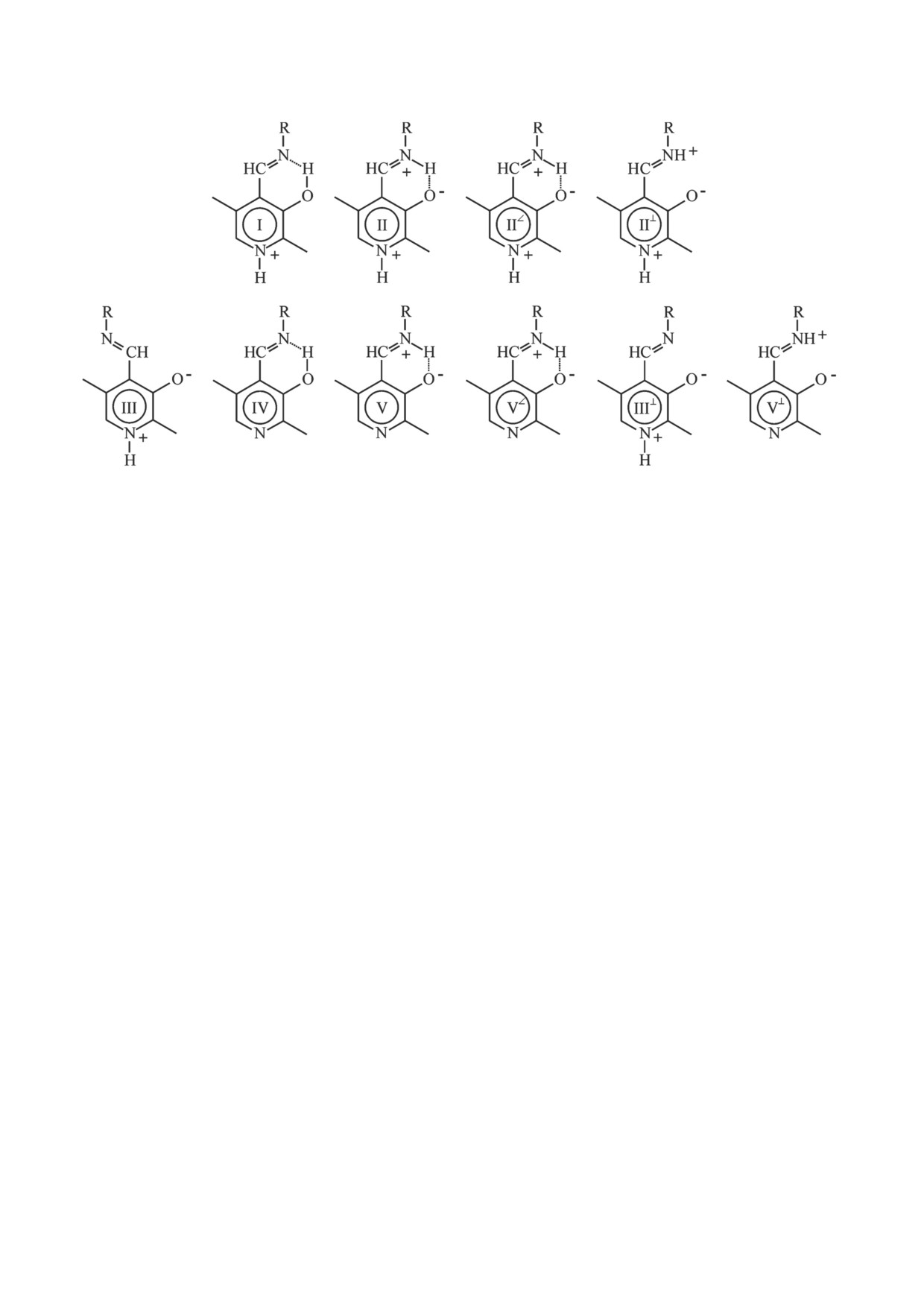
Рис. 2. Ионные формы внутреннего альдимина. I-II - cтруктуры, относящиеся к катионной форме кофактора,
III-V - cтруктуры, относящиеся к нейтральной форме кофактора. Обозначение структур II∠ и V∠ относится к конфор-
мерам соответствующих ионных форм, у которых альдиминная группа частично выведена из плоскости пиридинового
цикла, но при этом сохраняется водородная связь с атомом кислорода пиридинового кольца. Структуры II⊥, III⊥ и V⊥
обозначают конформеры с альдиминной группой, полностью выведенной из сопряжения с пиридиновым циклом
Экспериментальные параметры полос погло-
нов ПЛФ с аминокислотами. Как нами было
щения таутомерных и конформерных структур
показано ранее, внутренний альдимин OAHS
представлены в табл. 4.
дикого типа находится в катионной форме [2],
Для четырех мутантных форм сняты спек-
содержащей два таутомера - кетоенамин (струк-
тры поглощения комплексов с ингибитора-
тура II) и енолимин (структура I), а также два
ми фермента дикого типа L-метионином и
конформера кетоенамина (структуры II∠ и II⊥)
D, L-пропаргилглицином. На рис. 4 приве-
(рис. 2). Наши результаты позволяют сделать
дены спектры для Tyr52Ala мутантной формы
вывод, что внутренние альдимины мутантных
фермента в сравнении со спектрами фермента
форм OAHS при рН 7,5 существуют в виде
дикого типа. Спектры поглощения для осталь-
нейтральной формы с преобладанием кетоен-
ных мутантных форм имели аналогичный вид.
амина V, у которого атом пиридинового азота
депротонирован. В ферменте дикого типа
активной формой является кетоенамин II с
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
положительно заряженным атомом пириди-
нового азота, электроноакцепторные свой-
Ионное состояние внутренних альдиминов в
ства которого облегчают нуклеофильную атаку
мутантных формах. В спектрах поглощения му-
аминогруппы субстрата на C4’-атом кофер-
тантных холоферментов OAHS при рН 7,5 на-
мента. У нейтрального кетоенамина V отсут-
блюдались полосы в областях 330 нм и 416 нм,
ствует положительный заряд на атоме пири-
характерные для внутренних альдиминов ПЛФ-
динового азота, поэтому он обладает меньшей
зависимых ферментов (рис. 3). Первой ста-
реакционной способностью к образованию
дией любой реакции, катализируемой ПЛФ-
внешнего альдимина по сравнению с кетоен-
зависимыми ферментами, является образова-
амином II.
ние внешнего альдимина, как результат транс-
Взаимодействие с ингибиторами. Для фер-
альдиминирования между внутренним альд-
мента дикого типа было показано ингиби-
имином и аминокислотой-субстратом. Знание
рование реакции конечным продуктом био-
того, в какой ионной и таутомерной форме
синтетического пути
- L-метионином, и
находится внутренний альдимин, необходимо
специфическим ингибитором ПЛФ-зависи-
для понимания механизма реакции. С этой
мых ферментов, участвующих в метаболизме
целью было проведено разложение спектров
цистеина и метионина - D, L-пропаргилгли-
поглощения на полосы, соответствующие
цином [2]. Значительное снижение скорости
отдельным электронным переходам альдими-
реакции, катализируемой мутантными фор-
БИОХИМИЯ том 88 вып. 5 2023
742
КУЛИКОВА и др.
Рис. 3. Разложение спектров поглощения внутренних альдиминов мутантных форм OAHS (a - Tyr107Phe; б - Tyr107Ala;
в - Tyr52Phe; г - Tyr52Ala) при рН 7,5 на полосы отдельных электронных переходов их таутомеров и конформеров:
точки - экспериментальные данные, жирные линии - расчетные данные, тонкие линии - полосы, соответствующие
отдельным электронным переходам. Обозначение структур соответствует данным рис. 2 и табл. 4. Надстрочные индек-
сы (1, 2) относятся к первому и второму электронным переходам соответствующих структур. Надстрочный индекс (∠)
относится к конформеру структуры V, у которого альдиминная группа частично выведена из сопряжения с пири-
диновым циклом, но сохраняется водородная связь между альдиминным атомом азота и оксигруппой кофактора.
Надстрочный индекс (⊥) относится к конформерам структур III и V, у которых альдиминная группа полностью
выведена из сопряжения с пиридиновым циклом и находится в плоскости, перпендикулярной плоскости пиридино-
вого кольца. Полосы, о которых нет или недостаточно информации, указаны стрелками, помеченными * и V2*
мами OAHS, не позволило провести исследо-
Каталитические свойства мутантных фер-
вание ингибирования реакции γ-замещения
ментов. ПЛФ-зависимые ферменты, участвую-
этими ингибиторами. Спектральные характе-
щие в биосинтезе метионина в бактериях,
ристики комплексов мутантных форм с инги-
образуют эволюционно родственное семей-
биторами (рис. 4) в основном сходны с характе-
ство [23] и имеют много общего в строении
ристиками, полученными для фермента дикого
активных центров и механизмах катализируе-
типа [2]. Уменьшение максимума поглощения
мых реакций [13, 24]. На рис. 6 представлен
в области 416 нм и увеличение поглощения в
предполагаемый механизм реакции γ-замеще-
области 330 нм в комплексах мутантных форм
ния, катализируемой OAHS. После образова-
с L-метионином и D, L-пропаргилглицином,
ния внешнего альдимина между коферментом
скорее всего, свидетельствует об изменении
и субстратом происходит отрыв С-α-протона
равновесия между таутомерными формами
с образованием хиноидного интермедиата,
внешнего альдимина (рис. 5). Кроме того, в
затем - протонирование С4′-атома кофактора
этой области могут поглощать промежуточные
с образованием кетимина. Дальнейший отрыв
продукты реакции с тетраэдрическим С4′-ато-
С-β-протона приводит к отщеплению ацетиль-
мом углерода (рис. 6, интермедиаты 4 и 5).
ной группы субстрата. Присоединение сульфид-
БИОХИМИЯ том 88 вып. 5 2023
РОЛЬ ОСТАТКОВ Tyr АКТИВНОГО ЦЕНТРА ОАHS
743
Таблица 4. Параметры, полученные при разложении спектров поглощения мутантных форм OAHS на полосы отдельных
переходов
Мутантная
ν × 10-3
ε × 10-3
W × 10-3
Структуры
E (эВ)
λ (нм)
ρ
f
n (%)
форма OAHS
(см-1)
(М-1⋅см-1
)
(см-1)
V1 (кетоенамин)
2,98
24,06
415,5
1,90
3,95
1,50
0,07
24
V1∠ (кетоенамин)
3,30
26,58
376,2
0,65
3,87
1,37
0,02
8
III1 (енолимин)
3,54
28,53
350,5
0,35
3,65
1,45
0,01
3
IV1 (кетоенамин)
3,74
30,14
331,8
0,57
3,68
1,22
0,02
10
Tyr107Phe
III1⊥ (енолимин)
3,80
30,64
326,4
0,58
3,53
1,36
0,02
7
V1⊥
3,96
31,92
313,3
0,49
3,47
1,47
0,02
8
V2*
4,40
35,49
281,8
7,00
4,78
1,32
0,30
*
4,44
35,81
279,3
25,20
4,30
1,56
0,98
V1 (кетоенамин)
2,98
24,02
416,3
1,65
4,00
1,53
0,06
21
V1∠ (кетоенамин)
3,30
26,58
376,2
0,30
3,87
1,37
0,01
4
III1 (енолимин)
3,54
28,53
350,5
0,59
3,65
1,45
0,02
6
IV1 (кетоенамин)
3,74
30,14
331,8
0,71
3,68
1,22
0,02
10
Tyr107Ala
III1⊥ (енолимин)
3,80
30,64
326,4
0,40
3,53
1,36
0,01
3
V1⊥
3,96
31,92
313,3
0,39
3,47
1,47
0,01
4
V2*
4,40
35,49
281,8
6,20
4,78
1,32
0,26
*
4,44
35,81
279,3
23,50
4,30
1,56
0,91
V1 (кетоенамин)
2,98
24,06
415,5
2,03
3,95
1,50
0,07
24
V1∠ (кетоенамин)
3,30
26,58
376,2
0,50
3,87
1,37
0,02
8
III1 (енолимин)
3,54
28,53
350,5
0,55
3,65
1,45
0,02
6
IV1 (кетоенамин)
3,74
30,14
331,8
0,64
3,68
1,22
0,02
10
Tyr52Phe
III1⊥ (енолимин)
3,80
30,64
326,4
0,49
3,53
1,36
0,02
7
V1⊥
3,96
31,92
313,3
0,49
3,47
1,47
0,02
8
V2*
4,40
35,49
281,8
7,20
4,78
1,32
0,31
*
4,44
35,81
279,3
22,20
4,30
1,56
0,87
V1 (кетоенамин)
2,98
24,02
416,3
2,35
4,00
1,53
0,08
28
V1∠ (кетоенамин)
3,30
26,58
376,2
0,45
3,87
1,37
0,02
8
III1 (енолимин)
3,54
28,53
350,5
0,57
3,65
1,45
0,02
7
IV1 (кетоенамин)
3,74
30,14
331,8
0,57
3,68
1,22
0,02
10
Tyr52Ala
III1⊥ (енолимин)
3,80
30,64
326,4
1,11
3,53
1,36
0,03
10
V1⊥
3,96
31,92
313,3
0,69
3,47
1,47
0,02
8
V2*
4,40
35,49
281,8
7,40
4,78
1,32
0,31
*
4,44
35,81
279,3
23,80
4,30
1,56
0,92
Примечание. * Экспериментальная информация об этих полосах недостаточна.
Надстрочные индексы (1, 2) относятся к первому и второму электронным переходам структуры V. Надстрочный ин-
декс (∠) относится к конформеру структуры V, у которого альдиминная группа частично выведена из сопряжения
с пиридиновым циклом, но сохраняется водородная связь между альдиминным атомом азота и окси группой кофер-
мента. Надстрочный индекс (⊥) относятся к конформерам структур III и V, у которых альдиминная группа полностью
выведена из сопряжения с пиридиновым циклом и находится в плоскости, перпендикулярной плоскости пиридино-
вого цикла.
Е - энергия электронного перехода; ν - волновое число; λ - длина волны; ε - коэффициент молярного поглощения;
W - полуширина; ρ - асимметрия; f - сила осциллятора; n % - содержание таутомеров и конформеров, соответствую-
щее содержанию ПЛФ в растворах мутантных ферментов: Tyr107Phe, Tyr107Ala, Tyr52Phe, Tyr52Ala - 60%, 48%, 63%,
71% соответственно.
иона к β,γ-ненасыщенному кетимину и после-
катализа на стадии элиминирования γ-заме-
дующий перенос протонов приводят к обра-
стителя.
зованию второго хиноидного интермедиата,
Замена остатков Tyr52 и Tyr107 суще-
С-α-положение которого протонируется с
ственно повлияла на ионное состояние кофер-
образованием продукта. Протекание реакции
мента в активном центре, что отразилось на
должно обеспечиваться путем вовлечения ка-
эффективности катализа реакции γ-замеще-
талитического основания на стадиях отрыва
ния. Снижение эффективности катализа реак-
C-α- и C-β-протонов субстрата и кислотного
ции (kcat/Km) мутантными формами Tyr52Phe
БИОХИМИЯ том 88 вып. 5 2023
744
КУЛИКОВА и др.
и Tyr52Ala более чем на три порядка является
главным образом результатом уменьшения
скорости реакции, а также снижения срод-
ства мутантных форм фермента к субстра-
ту (табл. 2). Скорость обмена С-α-протона в
комплексах мутантных форм фермента с суб-
стратом уменьшилась по сравнению с фермен-
том дикого типа (табл. 2). В метионин-γ-лиазе
гомологичный остаток Tyr58 обеспечивает оп-
тимальное положение каталитического остат-
ка Lys210 на стадии отрыва C-α-протона [16].
Полученные данные могут свидетельствовать
о сходной роли остатка Tyr52 в OAHS.
Поскольку мутантные формы Tyr107Phe
и Tyr107Ala не катализируют образование гомо-
цистеина в реакции γ-замещения, но катали-
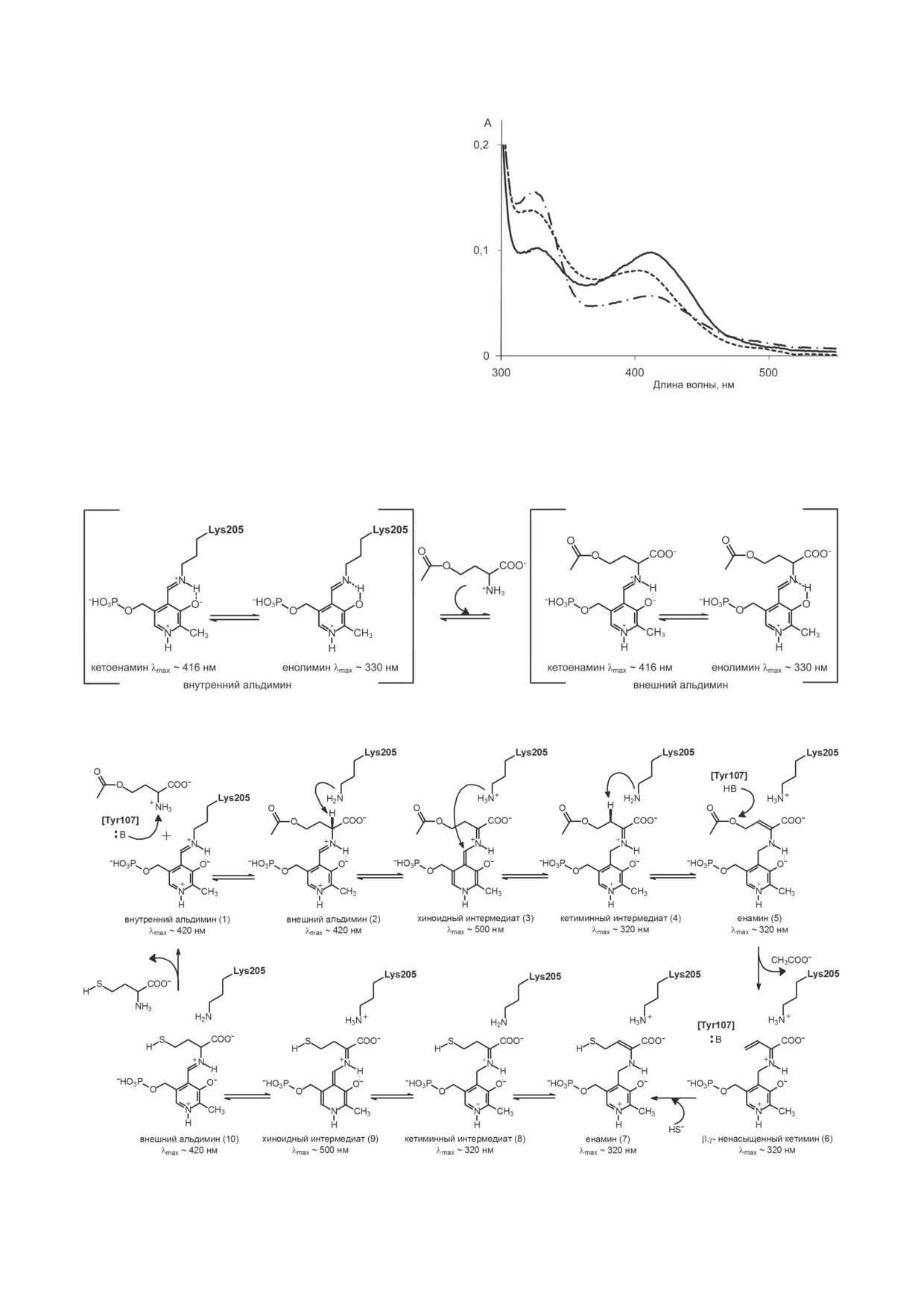
Рис. 4. Спектры поглощения комплексов Tyr52Ala му-
тантной формы OAHS с ингибиторами в 50 мМ калий-
зируют обмен C-α-протона OAH на дейтерий,
фосфатном буфере (рН 7,5). Холофермент - непрерывная
мы предполагаем, что остаток Tyr107 может
линия, комплекс с L-метионином - штриховая линия,
выполнять функцию кислотного катализатора комплекс с D, L-пропаргилглицином - пунктирная линия
Рис. 5. Равновесие таутомерных форм внутреннего и внешнего альдиминов OAHS
Рис. 6. Предполагаемый механизм реакции γ-замещения, катализируемой OAHS, согласно данным Brzović et al. [24]
БИОХИМИЯ том 88 вып. 5 2023
РОЛЬ ОСТАТКОВ Tyr АКТИВНОГО ЦЕНТРА ОАHS
745
на стадии элиминирования ацетата в OAHS из
ствия консервативного в ферментах структур-
C. difficile. Наши данные согласуются с выво-
ного класса I остатка аспарагиновой кислоты с
дами, сделанными для этого консервативного
положительно заряженным атомом азота пири-
остатка в ферментах подкласса цистатионин-
динового кольца кофермента в мутантных фор-
β-лиазы, в которых он был предложен в каче-
мах тирозин-фенол-лиазы и аспартатамино-
стве общего кислотного катализатора на ста-
трансферазы с заменой аспарагиновой кислоты
дии элиминирования заместителя [14, 15, 25].
также приводило к значительному снижению
Помимо того, что стэкинг-взаимодействие аро-
сродства кофактора с аналогичной разницей в
матической группы остатка Tyr107 с пиридино-
свободной энергии связывания [27, 28]. Ана-
вым кольцом ПЛФ обеспечивает стабилизацию
логичная замена Tyr114 на Phe в C-S-лиазе
положения кофермента в активном центре,
из Corynebacterium diphtheriae вызвала только
дестабилизация кофактора при заменах Tyr107
16-кратное снижение сродства к ПЛФ (раз-
привела, как свидетельствуют данные разложе-
ница в свободной энергии - 1,6 ккал/моль),
ния спектра поглощения холофермента мутант-
что позволило авторам сделать предположение
ной формы, к нарушению водородной связи
о незначительном влиянии данной замены на
пиридинового атома азота ПЛФ с боковой
стэкинг с пиридиновым фрагментом кофак-
группой Asp180, которая обеспечивает электро-
тора [29]. Полученные результаты свидетель-
ноакцепторные свойства кофермента. Данный
ствуют о том, что остатки Tyr52 и Tyr107 ста-
остаток Asp является строго консервативным в
билизируют положение кофактора в активном
ПЛФ-зависимых ферментах структурного клас-
центре OAHS из C. difficile.
са I и играет ключевую роль в стабилизации
Таким образом, замена одной амино-
положительного заряда атома азота пиридино-
кислоты во всех четырех мутантных фор-
вого кольца, что увеличивает отток электронов
мах, вероятно, не привела к кардинальному
во внешнем и внутреннем альдиминах к атому
изменению общей структуры фермента, что
азота пиридинового фрагмента кофермента.
следует из данных по обмену С-α-протона,
Нарушение связи карбоксильной группы Asp c
показавших, что образуется комплекс мутант-
N1-атомом ПЛФ должно приводить к пониже-
ных форм фермента с субстратом. В пользу
нию нуклеофильности С4′-атома внутреннего
данного утверждения свидетельствуют также
и внешнего альдиминов и, следовательно, к
спектры поглощения мутантных форм с ана-
замедлению стадии трансальдиминирования и
логами субстрата. На основании полученных
уменьшению кислотности С-α-протона внеш-
данных было сделано предположение, что
него альдимина, образуемых мутантными фор-
остаток Tyr52 участвует в обеспечении опти-
мами Tyr107Ala и Tyr107Phe.
мального положения каталитического кофак-
Влияние замены остатков тирозина на свя-
тор-связывающего остатка лизина на стадиях
зывание кофактора. Значения Kd, полученные
отрыва С-α-протона и элиминирования боко-
для мутантных форм Tyr52Ala и Tyr52Phe, ока-
вой группы субстрата, а остаток Tyr107 может
зались на три порядка выше, чем для фермен-
выполнять роль общего кислотного катализа-
та дикого типа (табл. 3). Уменьшение сродства
тора на стадии элиминирования ацетата.
к кофактору соответствует разнице ~4,5 ккал/
моль в свободной энергии связывания ПЛФ
Вклад авторов. В.В. Куликова проводила
между мутантными формами и ферментом ди-
кинетические и спектральные исследования,
кого типа (табл. 3). Эта величина соответствует
писала статью; С.В. Ревтович выделяла фер-
энергии водородной связи между заряженным
менты; А.Д. Лыфенко выращивала биомассу;
и нейтральным атомами [26], то есть между
Е.А. Морозова делала мутагенез; В.С. Коваль
анионом фосфатной группы кофермента и
проводил исследования реакции изотопного
гидроксильной группой остатка Tyr52 OASH.
обмена; Н.П. Бажулина анализировала спек-
В мутантных формах Tyr107Ala и Tyr107Phe
тры методом логнормального разложения;
сродство к кофактору также уменьшилось на
Т.В. Демидкина координировала все работы.
три порядка по сравнению с ферментом дикого
Финансирование. Работа выполнена при
типа, значения ΔG снизились на 4,1-4,2 ккал/
финансовой поддержке Российского научного
моль (табл. 3). Такая значительная разница в
фонда (грант № 22-24-00255).
свободной энергии по сравнению с ферментом
Конфликт интересов. Авторы заявляют об
дикого типа может объясняться отсутствием
отсутствии конфликта интересов.
водородной связи между атомом азота пири-
Соблюдение этических норм. Настоящая
динового кольца кофактора и карбоксильной
статья не содержит описания каких-либо ис-
группой остатка Asp180. Отсутствие водород-
следований с участием людей или животных в
ной связи и электростатического взаимодей-
качестве объектов.
БИОХИМИЯ том 88 вып. 5 2023
746
КУЛИКОВА и др.
СПИСОК ЛИТЕРАТУРЫ
1.
Kulikova, V. V., Anufrieva, N. V., Kotlov, M. I.,
11.
Tran, T. H., Krishnamoorthy, K., Begley, T. P.,
Morozova, E. A., Koval, V. S., Belyi, Y. F., Revtovich,
and Ealick, S. E. (2011) A novel mechanism of
S. V., and Demidkina, T. V. (2021) O-acetylhomoserine
sulfur transfer catalyzed by O-acetylhomoserine
sulfhydrylase from Clostridium novyi. Cloning,
sulfhydrylase in the methionine-biosynthetic pathway
expression of the gene and characterization of
of Wolinella succinogenes, Acta Cryst., D67, 831-838,
the enzyme, Protein Expr. Purif.,
180,
105810,
doi: 10.1107/S0907444911028010.
doi: 10.1016/j.pep.2020.105810.
12.
Brewster, J. L., Pachl, P., McKellar, J. L., Selmer, M.,
2.
Kulikova, V. V., Revtovich, S. V., Bazhulina, N. P.,
Squire, C. J., and Patrick, W. M. (2021) Structures
Anufrieva, N. V., Kotlov, M. I., Koval, V. S., Morozova,
and kinetics of Thermotoga maritima MetY reveal new
E. A., Hayashi, H., Belyi, Y. F., and Demidkina,
insights into the predominant sulfurylation enzyme of
T. V. (2019) Identification of O-acetylhomoserine
bacterial methionine biosynthesis, J. Biol. Chem., 296,
sulfhydrylase, a putative enzyme responsible for
100797, doi: 10.1016/j.jbc.2021.100797.
methionine biosynthesis in Clostridioides difficile:
13.
Messerschmidt, A., Worbs, M., Steegborn, C., Wahl,
Gene cloning and biochemical characterizations,
M. C., Huber, R., Laber, B., and Clausen, T. (2003)
IUBMB Life, 71, 1815-1823, doi: 10.1002/iub.2139.
Determinants of enzymatic specificity in the Cys-Met-
3.
Kerr, D. S. (1971) O-Acetylhomoserine sulfhydrylase
metabolism PLP-dependent enzymes family: crystal
from Neurospora. Purification and consideration
structure of cystathionine γ-lyase from yeast and
of its function in homocysteine and methionine
intrafamiliar structure comparison, Biol. Chem., 384,
synthesis, J. Biol. Chem., 246, 95-102, doi: 10.1016/
373-386, doi: 10.1515/BC.2003.043.
S0021-9258(18)62537-2.
14.
Inoue, H., Inagaki, K., Adachi, N., Tamura, T.,
4.
Yamagata, S.
(1971) Homocysteine synthesis in
Esaki, N., Soda, K., and Tanaka, H. (2000) Role of
yeast. Partial purification and properties of O-acetyl-
tyrosine
114 of L-methionine gamma-lyase from
homoserine sulfhydrylase, J. Biochem., 70, 1035-1045,
Pseudomonas putida, Biosci. Biotechnol. Biochem., 64,
doi: 10.1093/oxfordjournals.jbchem.a129712.
2336-2343, doi: 10.1271/bbb.64.2336.
5.
Murooka, Y., Kakihara, K., Miwa, T., Seto, K., and
15.
Revtovich, S. V., Faleev, N. G., Morozova, E. A.,
Harada, T. (1977) O-alkylhomoserine synthesis cata-
Anufrieva, N. V., Nikulin, A. D., and Demidkina, T.
lyzed by O-acetylhomoserine sulfhydrylase in micro-
V. (2014) Crystal structure of the external aldimine of
organisms, J. Bacteriol., 130, 62-73, doi: 10.1128/
Citrobacter freundii methionine γ-lyase with glycine
jb.130.1.62-73.1977.
provides insight in mechanisms of two stages of
6.
Lee, H., and Hwang, B.
(2003) Methionine
physiological reaction and isotope exchange of α- and
biosynthesis and its regulation in Corynebacterium
β-protons of competitive inhibitors, Biochimie, 101,
glutamicum: parallel pathways of transsulfuration and
161-167, doi: 10.1016/j.biochi.2014.01.007.
direct sulfhydrylation, Appl. Microbiol. Biotechnol., 62,
16.
Anufrieva, N. V., Faleev, N. G., Morozova, E. A.,
459-467, doi: 10.1007/s00253-003-1306-7.
Bazhulina, N. P., Revtovich, S. V., Timofeev, V. P.,
7.
Foglino, M., Borne, F., Bally, M., Ball, G., and
Tkachev, Y. V., Nikulin, A. D., and Demidkina,
Patte, J. (1995) A direct sulfhydrylation pathway is
T. V. (2015) The role of active site tyrosine 58 in
used for methionine biosynthesis in Pseudomonas
Citrobacter freundii methionine γ-lyase, Biochim.
aeruginosa, Microbiology, 141, 431-439, doi: 10.1099/
Biophys. Acta, 1854, 1220-1228, doi: 10.1016/j.bbapap.
13500872-141-2-431.
2014.12.027.
8.
Belfaiza, J., Martel, A., Margarita, D., and Saint
17.
Bradford, M. M.
(1976) A rapid and sensitive
Girons, I. (1998) Direct sulfhydrylation for methionine
method for the quantitation of microgram quantities
biosynthesis in Leptospira meyeri, J. Bacteriol., 180,
of protein utilizing the principle of protein-dye
250-255, doi: 10.1128/jb.180.2.250-255.
binding, Anal. Biochem., 72, 248-254, doi: 10.1016/
9.
Shimizu, H., Yamagata, S., Masui, R., Inoue, Y.,
0003-2697(76)90527-3.
Shibata, T., Yokoyama, S., Kuramitsu, S., and
18.
Laemmli, U. K. (1970) Cleavage of structural proteins
Iwama, T. (2001) Cloning and overexpression of
during the assembly of the head of bacteriophage T4,
the oah1 gene encoding O-acetyl-L-homoser-
Nature, 227, 680-685, doi: 10.1038/227680a0.
ine sulfhydrylase of Thermus thermophilus HB8
19.
Kredich, N. M., and Becker, M. A. (1971) Cysteine
and characterization of the gene product, Bio-
biosynthesis: serine transacetylase and O-acetylserine
chim. Biophys. Acta,
1549,
61-72, doi:
10.1016/
sulfhydrylase, Methods Enzymol., 17 B, 459-470,
s0167-4838(01)00245-x.
doi: 10.1016/0076-6879(71)17082-6.
10.
Krishnamoorthy, K., and Begley, T.P. (2011) Protein
20.
Peterson, E. A., and Sober, H. A. (1954) Prepara-
thiocarboxylate-dependent methionine biosynthesis
tion of crystalline phosphorylated derivatives of vita-
in Wolinella succinogenes, J. Am. Chem. Soc., 133,
min B6, J. Am. Chem. Soc., 76, 169-175, doi: 10.1021/
379-386, doi: 10.1021/ja107424t.
ja01630a045.
БИОХИМИЯ том 88 вып. 5 2023
РОЛЬ ОСТАТКОВ Tyr АКТИВНОГО ЦЕНТРА ОАHS
747
21. Bazhulina, N. P., Morozov, Y. V., Papisova, A. I., and
26. Fersht, A. R., Shi, J. P., Knill-Jones, J., Lowe,
Demidkina, T. V. (2000) Pyridoxal 5′-phoshate schiff
D. M., Wilkinson, A. J., Blow, D. M., Brick, P.,
base in Citrobacter freundii tyrosine phenol-lyase.
Carter, P., Waye, M. M., and Winter, G.
(1985)
Ionic and tautomeric equilibria, Eur. J. Biochem., 267,
Hydrogen bonding and biological specificity analysed
1830-1836, doi: 10.1046/j.1432-1327.2000.01185.x.
by protein engineering, Nature,
314,
235-238,
22. Scatchard, G. (1949) The attraction of proteins for
doi: 10.1038/314235a0.
small molecules and ions, Ann. NY Acad. Sci., 51,
27. Yano, T., Kuramitsu, S., Tanase, S., Morino, Y.,
660-672, doi: 10.1111/j.1749-6632.1949.tb27297.x.
and Kagamiyama, H. (1992) Role of Asp222 in the
23. Käck, H., Sandmark, J., Gibson, K., Schneider, G.,
catalytic mechanism of Escherichia coli aspartate
and Lindqvist, Y. (1999) Crystal structure of diami-
aminotransferase: the amino acid residue which
nopelargonic acid synthase: evolutionary relation-
enhances the function of the enzyme-bound coenzyme
ships between pyridoxal-5′-phosphate-dependent
pyridoxal 5′-phosphate, Biochemistry, 31, 5878-5887,
enzymes, J. Mol. Biol., 291, 857-876, doi: 10.1006/
doi: 10.1021/bi00140a025.
jmbi.1999.2997.
28. Demidkina, T. V., Faleev, N.G., Papisova, A. I.,
24. Brzović, P., Holbrook, E. L., Greene, R. C., and
Bazhulina, N. P., Kulikova, V. V., Gollnick, P.D., and
Dunn, M. F. (1990) Reaction mechanism of Escherich-
Phillips, R. S. (2006) Aspartic acid 214 in Citrobacter
ia coli cystathionine gamma-synthase: direct evidence
freundii tyrosine phenol-lyase ensures sufficient
for a pyridoxamine derivative of vinylglyoxylate as a key
C-H-acidity of the external aldimine intermediate
intermediate in pyridoxal phosphate dependent gamma-
and proper orientation of the cofactor at the active
elimination and gamma-replacement reactions, Bio-
site, Biochim. Biophys. Acta,
1764,
1268-1276,
chemistry, 29, 442-451, doi: 10.1021/bi00454a020.
doi: 10.1016/j.bbapap.2006.05.001.
25. Steegborn, C., Laber, B., Messerschmidt, A., Huber, R.,
29. Astegno, A., Allegrini, A., Piccoli, S., Giorgetti, A.,
and Clausen, T. (2001) Crystal structures of cystathi-
and Dominici, P. (2015) Role of active-site residues
onine γ-synthase inhibitor complexes rationalize the
Tyr55 and Tyr114 in catalysis and substrate specificity
increased affinity of a novel inhibitor, J. Mol. Biol.,
of Corynebacterium diphtheriae C-S lyase, Proteins,
311, 789-801, doi: 10.1006/jmbi.2001.4880.
83, 78-90, doi: 10.1002/prot.24707.
O-ACETYLHOMOSERINE SULFHYDRYLASE FROM Clostridioides difficile:
THE ROLE OF TYROSINE RESIDUES OF THE ACTIVE CENTER
V. V. Kulikova*, S. V. Revtovich, A. D. Lyfenko, E. A. Morozova,
V. S. Koval, N. P. Bazhulina, and
T. V. Demidkina
Engelhardt Institute of Molecular Biology, Russian Academy of Sciences,
119991 Moscow, Russia; e-mail: vitviku@yandex.ru
O-acetylhomoserine sulfhydrylase is one of the key enzymes in the biosynthesis of methionine in
Clostridioides difficile. The mechanism of the γ-substitution reaction of O-acetyl-L-homoserine catalyzed
by this enzyme is the least studied among pyridoxal-5′-phosphate-dependent enzymes involved in the
metabolism of cysteine and methionine. To clarify the role of the active site residues Tyr52 and Tyr107,
four mutant forms of the enzyme with replacements for phenylalanine and alanine were obtained.
The catalytic and spectral properties of mutant forms were investigated. The rate of the γ-substitution
reaction catalyzed by mutant forms with the replacement of the Tyr52 residue decreased by more than
three orders of magnitude compared to the wild-type enzyme. Tyr107Phe and Tyr107Ala mutant forms
practically did not catalyze this reaction. Replacements of the residues Tyr52 and Tyr107 led to a decrease
in the affinity of the apoenzyme to the coenzyme by three orders of magnitude and changes in the ionic state
of the internal aldimine of the enzyme. The obtained results allowed us to assume that Tyr52 is involved
in ensuring the optimal position of the catalytic coenzyme-binding lysine residue at the stages of C-α-proton
elimination and elimination of the side group of the substrate. Tyr107 can act as a general acid catalyst
at the stage of acetate elimination.
Keywords: O-acetylhomoserine sulfhydrylase, pyridoxal-5′-phosphate, γ-substitution reaction, site-directed
mutagenesis
БИОХИМИЯ том 88 вып. 5 2023