БИОХИМИЯ, 2023, том 88, вып. 5, с. 748 - 760
УДК 577.112.7
ВЛИЯНИЕ НЕЙРОДЕГЕНЕРАТИВНЫХ МУТАЦИЙ
В ГЕНЕ NEFL НА ТЕПЛОВУЮ ДЕНАТУРАЦИЮ БЕЛКА
ЛЁГКОЙ ЦЕПИ НЕЙРОФИЛАМЕНТОВ
© 2023 В.В. Нефёдова1*, Д.С. Ямпольская1, С.Ю. Клейменов1,2,
Н.А. Чеботарева1, А.М. Матюшенко1, Д.И. Левицкий1
1 Федеральный исследовательский центр «Фундаментальные основы биотехнологии» РАН,
119071 Москва, Россия; электронная почта: victoria.v.nefedova@mail.ru
2 Институт биологии развития им. Н.К. Кольцова РАН, 119334 Москва, Россия
Поступила в редакцию 04.01.2023
После доработки 02.03.2023
Принята к публикации 02.03.2023
Проведено исследование влияния аминокислотных замен E90K, N98S и A149V на структуру и теп-
ловую денатурацию молекулы белка лёгкой цепи нейрофиламентов (NFL). Методом кругового
дихроизма показано, что данные замены не приводят к изменению в спиральной структуре NFL,
однако оказывают заметное влияние на стабильность молекулы. Методом дифференциальной ска-
нирующей калориметрии были идентифицированы калориметрические домены в структуре NFL
и показано, что внесение замены E90K приводит к исчезновению низкотемпературного теплово-
го перехода (домен 1). Внесение всех аминокислотных замен приводит к изменениям энтальпии
плавления доменов NFL, а также к существенным изменениям температуры плавления некоторых
калориметрических доменов. Таким образом, несмотря на то что все указанные аминокислотные
замены, вызванные мутациями в гене NEFL, связаны с развитием нейропатии Шарко-Мари-
Тута, а две из них даже располагаются очень близко друг к другу в суперспиральном участке 1A,
они оказывают различное влияние на структуру и стабильность молекулы NFL.
КЛЮЧЕВЫЕ СЛОВА: промежуточные филаменты, нейрофиламенты, суперспиральные белки, спектро-
скопия кругового дихроизма, дифференциальная сканирующая калориметрия.
DOI: 10.31857/S0320972523050044, EDN: AXKJLT
ВВЕДЕНИЕ
coil [3, 4]. За образование суперспиральных
участков отвечает rod-домен ПФ, первичная
Промежуточные филаменты (ПФ) явля-
структура которого организована в гептадные
ются важным компонентом цитоскелета, на-
повторы, в которых аминокислотные остат-
равне с микротрубочками и микрофиламен-
ки обозначаются латинскими буквами a-g.
тами. Для человека описано около 70 генов,
При этом в положениях a и d часто находятся
кодирующих белки ПФ [1, 2]. Все белки се-
гидрофобные остатки, участвующие в образо-
мейства ПФ имеют сходные черты строения,
вании гидрофобного кора, что позволяет rod-
в частности - наличие центрального α-спи-
доменам образовывать структуру coiled-coil.
рального домена (так называемый rod-домен).
Димеры ПФ взаимодействуют антипараллельно
Для структуры ПФ характерны общие черты
и образуют тетрамер [3, 4]. Процесс полимери-
строения: наличие трёх α-спиральных участков
зации ПФ от димеров до зрелых филаментов
(1А, 1В и 2), участвующих в образовании супер-
проходит в три этапа [5-7]. На первом этапе
спиральных (coiled-coil) доменов, разделён-
происходит быстрое образование тетраме-
ных α-спиральными линкерными участками,
ров ПФ, затем за счёт латеральных взаимодей-
которые не вовлечены в образование coiled- ствий происходит их сборка в ULF-частицы
Принятые сокращения: ДСК - дифференциальная сканирующая калориметрия; КД - круговой дихроизм; нейро-
патия ШМТ - нейропатия Шарко-Мари-Тута; ПФ - промежуточные филаменты; ΔHcal - калориметрическая энталь-
пия; NFL, NFM и NFH - белки лёгкой, средней и тяжёлой цепей нейрофиламентов; NFL WT - белок NFL дикого типа;
Tm - температура максимума теплового перехода; ULF - нити единичной длины, единичные протофиламенты.
* Адресат для корреспонденции.
748
НЕЙРОДЕГЕНЕРАТИВНЫЕ МУТАЦИИ В NFL
749
(Unit Length Filaments, нити единичной длины)
генный виментин, было показано образование
или единичные протофиламенты, диаметр ко-
филаментоподобных структур, сформирован-
торых превышает 10 нм, и, наконец, на послед-
ных белком NFL [14]. В то же время для пол-
нем этапе происходит удлинение филаментов,
ноценной экспрессии NFL в нейронах необ-
их компактизация и уменьшение диаметра до
ходимы белки NFM и NFH [15].
стандартных 10 нм [7]. Принципы организации
В настоящей работе мы сконцентрирова-
белков семейства ПФ в целом универсальны,
лись на изучении физико-химических свойств
однако для отдельных его представителей ха-
основного представителя нейрофиламентов -
рактерны уникальные свойства. Так, например,
белка NFL. В гене NEFL, кодирующем этот бе-
ламины не способны к латеральной полимери-
лок, было обнаружено большое количество му-
зации. Ввиду сложной организации белковых
таций, приводящих к развитию наследственной
комплексов ПФ точечные аминокислотные
нейропатии Шарко-Мари-Тута (ШМТ) [16].
замены даже в одном домене могут приводить
Данное заболевание представляет группу па-
к серьёзным изменениям, вплоть до потери
тологий, которые делятся на два типа: демие-
мутантным белком способности полимеризо-
линизирующую и аксональную формы
[16,
ваться или к избирательному блокированию
17]. Для нейропатии первого типа (ШМТ 1)
полимеризации на стадии ULF (замена Y117L -
характерно снижение проводимости нервного
у виментина [8]). Наиболее изученными пред-
волокна, а второго типа (ШМТ 2) - дегенера-
ставителями семейства ПФ являются вимен-
тивные процессы в аксоне без снижения про-
тин, десмин и кератины, для которых получены
водимости импульса [18]. Известные мутации
кристаллические структуры отдельных супер-
в гене NEFL можно разделить на несколько
спиральных участков, в том числе участков,
групп: 1) по месту их локализации в струк-
ответственных за взаимодействие димеров и
туре белка NFL или 2) по типу заболевания
тетрамеров между собой [3, 4, 9]. На основании
Шарко-Мари-Тута, которое они вызывают:
гомологии между ПФ можно предположить,
демиелинизирующую (1F) или аксональную
что для нейрофиламентов будет характерен по-
(2Е) формы [17, 19, 20]. Для ряда мутантных
хожий принцип организации.
белков NFL (P8Q, E90K, N98S, A149V) в кле-
В зрелых нейронах экспрессируются пять
точных линиях была продемонстрирована
белков ПФ - триада белков нейрофиламен-
агрегация, которую в большинстве случаев
тов: белок лёгкой (NFL), средней (NFM) и
удавалось устранить, коэкспрессируя в клет-
тяжёлой (NFH) цепей, а также периферин и
ках NFL и NFM [21-24]. При этом для трёх
α-интернексин. Основное отличие трёх белков
мутантных белков (N98S, Q332P, E397K) для
нейрофиламентов друг от друга определяется
предотвращения агрегации была необходима
их С-концевыми доменами, которые разли-
экспрессия сразу трёх белков промежуточных
чаются как по длине, так и по наличию важ-
филаментов (NFL, NFM и периферина) [22].
ных участков фосфорилирования. Для бел-
Для белка NFL c заменой N98S было показа-
ков NFM и NFH характерно наличие длинных
но нарушение сборки филаментов и образо-
С-концевых доменов, которые содержат KSP-
вание агрегатов белка как в культурах клеток,
повторы (Lys-Ser-Pro), являющиеся участками
так и в нейронах мышей [23]. Помимо этого,
фосфорилирования (например, Erk1,2 кина-
на мышиной модели гетерозиготной особи
зами) [10,11]. В ранних работах по изучению
N98S/WT наблюдался выраженный тремор и
структуры нейрофиламентов в нейронах было
накопление агрегатов в мозжечке и спинном
показано, что в клетках соотношение белков
мозге. В то же время в некоторых работах не
составляет 7/3/2 в расчёте на мономер NFL/
наблюдали патологической агрегации мутант-
NFM/NFH соответственно
[10]. При этом
ных белков внутри клеток, но детектировали
структурно белки представлены гомодимера-
заметное уменьшение миелиновой оболочки
ми NFL/NFL, а также гетеродимерами NFL/
аксонов [25]. Противоречия в накопленных
NFM и NFL/NFH [12, 13]. По сравнению с
данных поднимают ряд вопросов. Так, неоче-
другими ПФ нейрофиламенты отличает их
видно, является ли образование агрегатов след-
гетероолигомерная (гетеродимерная) струк-
ствием нарушения сворачивания белка или это
тура, а также значительная протяжённость по
вызвано нарушениями в его взаимодействии с
всей длине аксона, которая требует развитой
белками-партнерами?
системы их транспорта. Однако in vitro толь-
В качестве объектов исследования в на-
ко изолированный NFL может образовывать
стоящей работе были выбраны белки, содер-
фибриллы, а изолированные NFM и NFH не
жащие аминокислотные замены в α-спира-
способны полимеризоваться. In vivo в клетках
ли 1A (E90K и N98S) и в α-спирали 1B (A149V)
линии SW13 Vim-, не экспрессирующих эндо-
(рис. 1). Для данных мутантных форм NFL
БИОХИМИЯ том 88 вып. 5 2023
750
НЕФЁДОВА и др.
Таблица 1. Последовательности праймеров,
ранее было показано нарушение сборки по-
использованных в работе
лимеров in vivo [21, 22, 24], выражающееся в
образовании очень коротких полимеров или
Название
Последовательность праймеров 5′→3′
агрегатов белка в клетках. Для изучения при-
праймера
чин патогенных свойств данных аминокис-
лотных замен в NFL необходимо определить,
F1
GACCTCAGTGACCGCTTCGCCAGCT
какое влияние они оказывают на структуру
R1
CTGGAGCTGCGCCTTCTCCTGCGT
белка. Положение аминокислотных остатков
в гептадах определяет структуру и свойства
F2
ACGCAGAAGAAGGCGCAGCTCCAGGA
суперспиральных белков, в том числе стабиль-
ность структуры coiled-coil, что, в свою оче-
R2
GCGGATGGACTTGAGGTCGTTGCTGA
редь, может оказывать влияние и на свойства
олигомеров NFL. Учитывая, что исследуемые
F3
CTGGTGGCGGAAGATGCCACC
замены расположены в гептадных повторах
в положениях d (E90K), e (N98S) и g (A149V),
R3
GCGCAGGTCGCGGATCTCCTG
т.е. в тех положениях, в которых находящиеся
Примечание. Кодоны, в которые были внесены мутации,
там остатки могут оказывать влияние на ста-
подчёркнуты.
бильность двойной спирали, можно предполо-
жить, что замены E90K, N98S и A149V (рис. 1)
могут приводить к изменениям структуры
NFL дикого типа (NFL WT) и мутантные
coiled-coil NFL. В пользу такого предположе-
формы были клонированы в вектор EV («Кло-
ния говорят полученные ранее данные о том,
нинг фасилити», Россия). Для внесения точеч-
что замены аминокислотных остатков не толь-
ных аминокислотных замен был использован
ко в положениях a и d гептадных повторов, но
Q5-site directed mutagenesis kit («NEB», США)
и в положениях e и g могут оказывать серьёз-
и подобранные наборы праймеров. Для вне-
ное влияние на стабильность (термостабиль-
сения замены N98S использовали праймеры
ность) двойной спирали молекулы тропомио-
F1 и R1; для внесения замены E90K исполь-
зина [26-31]. Проверка этого предположения
зовали праймеры F2 и R2; для внесения за-
и явилась главной задачей данной работы.
мены A149V использовали праймеры F3 и R3.
Для этого мы исследовали влияние этих за-
Последовательности праймеров
(«Евроген»,
мен на характер тепловой денатурации бел-
Россия) представлены в табл. 1.
ка NFL методами кругового дихроизма (КД)
Все полученные конструкции были исполь-
и дифференциальной сканирующей калори-
зованы для бактериальной экспрессии белков в
метрии (ДСК).
клетках Escherichia coli штамма C41. Выделение
и очистку всех рекомбинантных белков NFL
проводили из фракции телец включения.
МАТЕРИАЛЫ И МЕТОДЫ
После разрушения клеток ультразвуком тельца
включения осаждали центрифугированием при
Получение белков. Все препараты бел-
18 000 g. Осадок телец включения, содержащий
ков NFL, использованные в данной работе,
белок NFL WT или его мутантные формы, рас-
были рекомбинантными белками, продук-
творяли в 20 мМ Tris-HCl (pH 8,0), содержа-
тами гена NEFL человека (UniProt P07196).
щем 8 M мочевину, 2 мМ EGTA, 15 мМ β-ME,
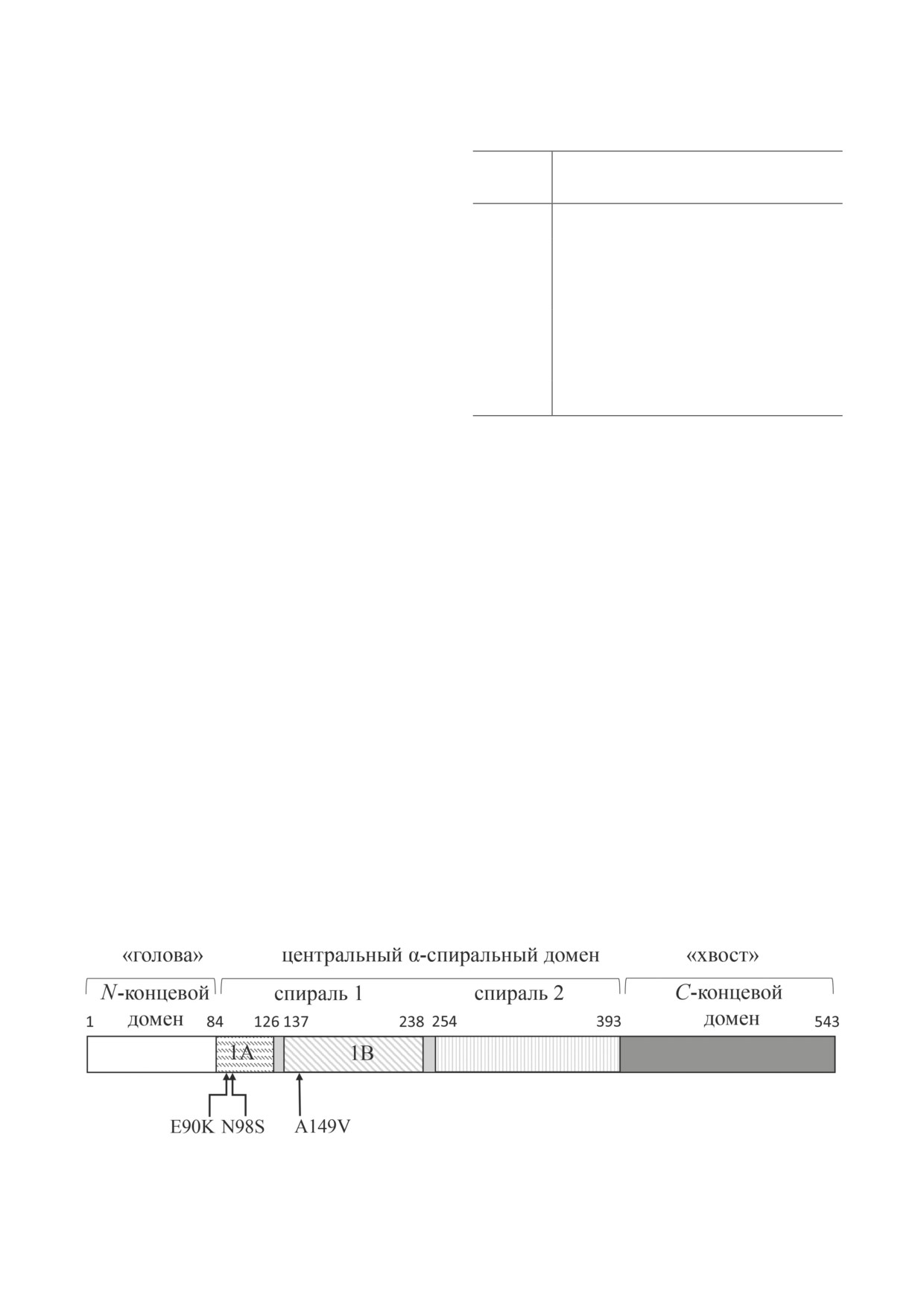
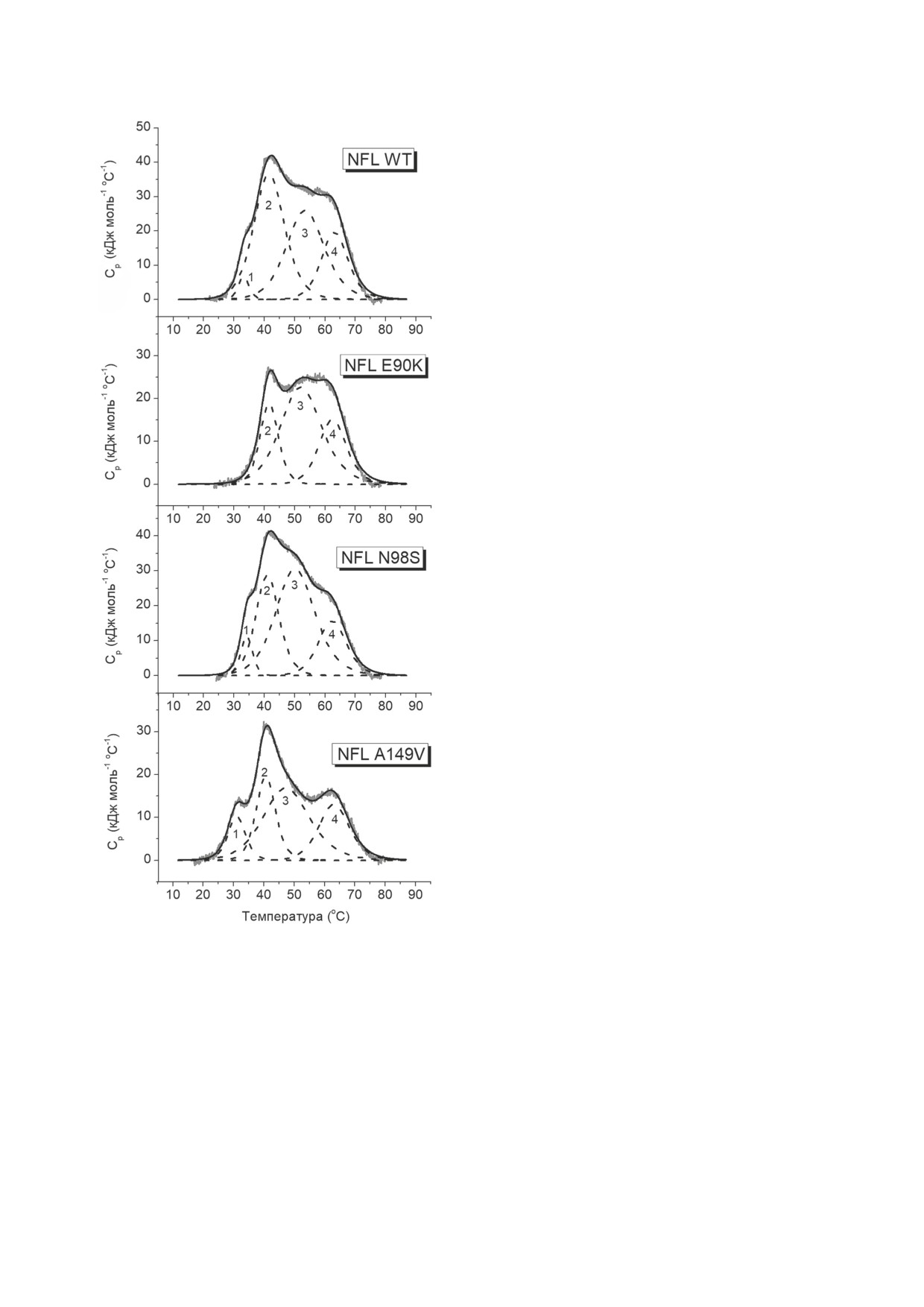
Рис. 1. Схема строения молекулы NFL. Стрелками отмечены положения аминокислотных замен E90K, N98S и A149V
в спиральных участках 1A и 1B
БИОХИМИЯ том 88 вып. 5 2023
НЕЙРОДЕГЕНЕРАТИВНЫЕ МУТАЦИИ В NFL
751
Метод спектроскопии кругового дихроизма.
Спектры КД белков NFL регистрировали в
диапазоне 190-280 нм при 5 °C на спектро-
метре Chirascan CD («Applied Photophysics»,
Англия) при длине оптического пути 0,02 см.
Время регистрации сигнала для каждой длины
волны составляло 5 сек. Для каждого препа-
рата было получено не менее 5 записей спек-
тров КД. Все эксперименты проводили при
концентрации белков 1 мг/мл в 5 мМ Hepes
(pH
8,0), содержащем
0,5 мМ EGTA и
2 мМ DTT. Температурные зависимости теп-
ловой денатурации белков регистрировали при
постоянном нагреве со скоростью 1 °С/мин в
диапазоне 5-85 °С при длине волны 222 нм.
Метод дифференциальной сканирующей ка-
лориметрии. Эксперименты методом ДСК про-
водили с использованием дифференциального
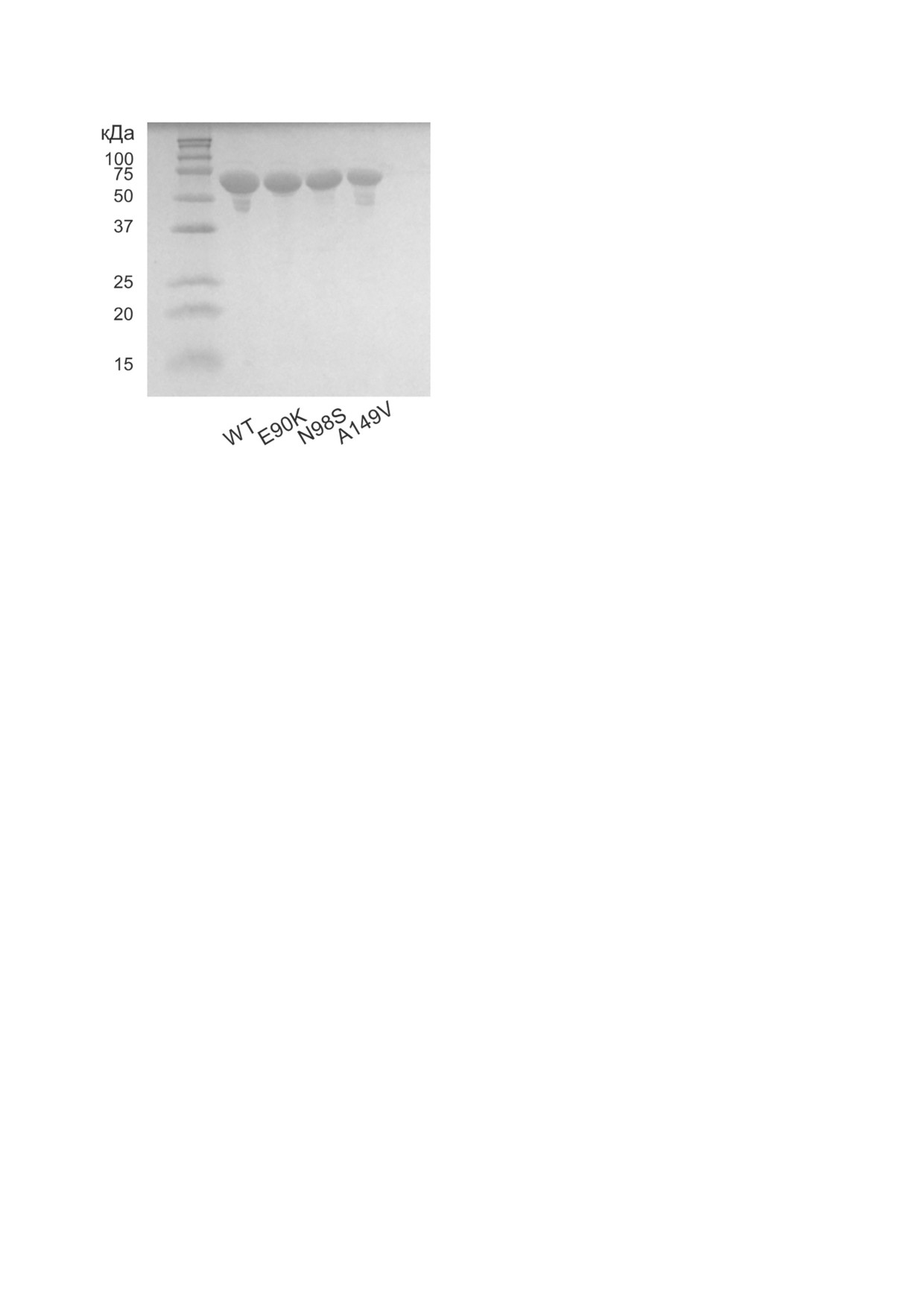
Рис. 2. Анализ чистоты полученных препаратов NFL WT
сканирующего микрокалориметра MicroCal
и мутантных форм методом SDS-электрофореза в ПААГ
VP-Capillary («Malvern Instruments», США) с
капиллярными измерительными ячейками.
Нагрев образцов проводили с постоянной ско-
0,1 мМ PMSF (буфер А), и подвергали ультра-
ростью 1 °С/мин от 10 до 85 °С. Все экспери-
центрифугированию при
105 000 g. Супер-
менты проводили при концентрации белков
натант наносили на колонку HiTrap Q («GE
2 мг/мл в 5 мМ Hepes (pH 8,0), содержащем
Healthcare», США), уравновешенную буфе-
0,5 мМ EGTA и 2 мМ DTT. Для всех препара-
ром А. Элюцию проводили линейным гради-
тов было произведено не менее трёх прогревов.
ентом NaCl в диапазоне 0-0,7 M NaCl. Кон-
Для изучения обратимости денатурации препа-
центрацию белков определяли спектрометри-
раты подвергали двум последовательным про-
ческим методом, используя коэффициент экс-
гревам. Процедуру деконволюции, т.е. разло-
тинкции A1% при 280 нм, равный 5,9 см-1.
жения кривых теплопоглощения на отдельные
Полученные препараты хранили при -80 °С.
тепловые переходы (калориметрические доме-
Чистота полученных препаратов составила не
ны), проводили в программе Origin 7.0 путём
менее 95% (рис. 2).
подгонки данных к модели для анализа мульти-
Ренатурацию белков проводили перед
доменных белков (non-two-state model) [33].
экспериментами путём диализа против 5 мМ
Этот математический подход, основанный
Hepes/NaOH (pH 8,0), содержащего 0,5 мМ
на классической работе Freire и Biltonen [33],
EGTA и 2 мМ DTТ в течение ночи при 4 °С.
был заложен в используемый нами программ-
Аналитическое ультрацентрифугирование
ный пакет «Origin 7.0» как «модуль ДСК». Этот
(AUC). Эксперименты по скоростной седимен-
модуль позволяет проводить не только декон-
тации (SV) проводили в аналитической уль-
волюцию кривых ДСК, полученных для обра-
трацентрифуге, модель E («Beckman», США),
тимо денатурирующих белков, но и целый ряд
оснащённой абсорбционной оптикой, фото-
иных важных процедур обработки этих кри-
электрическим сканером, монохроматором и
вых. Так, к примеру, он позволяет построить
компьютером в режиме онлайн. Аналитиче-
(и впоследствии вычесть из кривой тепло-
ское ультрацентрифугирование проводили при
поглощения) так называемую
«химическую
концентрации белка 1 мг/мл в 5 мМ Tris-HCl
базовую линию» (chemical baseline), соеди-
(pH 8,0), содержащем 0,5 мМ EGTA и 2 мМ
няющую состояния нативного и полностью
DTT. В опытах использовали титановый ротор
денатурированного белка. Он также позволяет
An-G Ti и двухсекторные ячейки. Седимента-
точно определить температуру максимума теп-
ционные профили регистрировали путём из-
лового перехода (Tm) для каждого теплового
мерения оптического поглощения при 280 нм.
перехода и его калориметрическую энталь-
Все ячейки сканировались одновременно c
пию (ΔHcal), представляющую интеграл избы-
интервалом в
2,5 мин. Дифференциальные
точной теплоёмкости по температуре в пре-
распределения по коэффициентам седимента-
делах температурного диапазона денатурации
ции [ls-g*(s) vs s] были определены при 25 °C с
одного калориметрического домена или целой
помощью программы SEDFIT [32].
молекулы.
БИОХИМИЯ том 88 вып. 5 2023
752
НЕФЁДОВА и др.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Белок NFL относится к семейству бел-
ков ПФ и имеет характерные для белков этого
семейства суперспиральные участки. Однако
отличительной особенностью именно бел-
ков ПФ является их способность к полимери-
зации и образованию различных олигомерных
структур. Ранее для бычьего белка NFL было
показано формирование низкомолекулярных
олигомеров - тетрамеров - в буферном рас-
творе с низкой ионной силой [34]. Коэффици-
ент седиментации олигомеров белка NFL WT
человека, полученный в аналогичных усло-
виях методом скоростной седиментации, со-
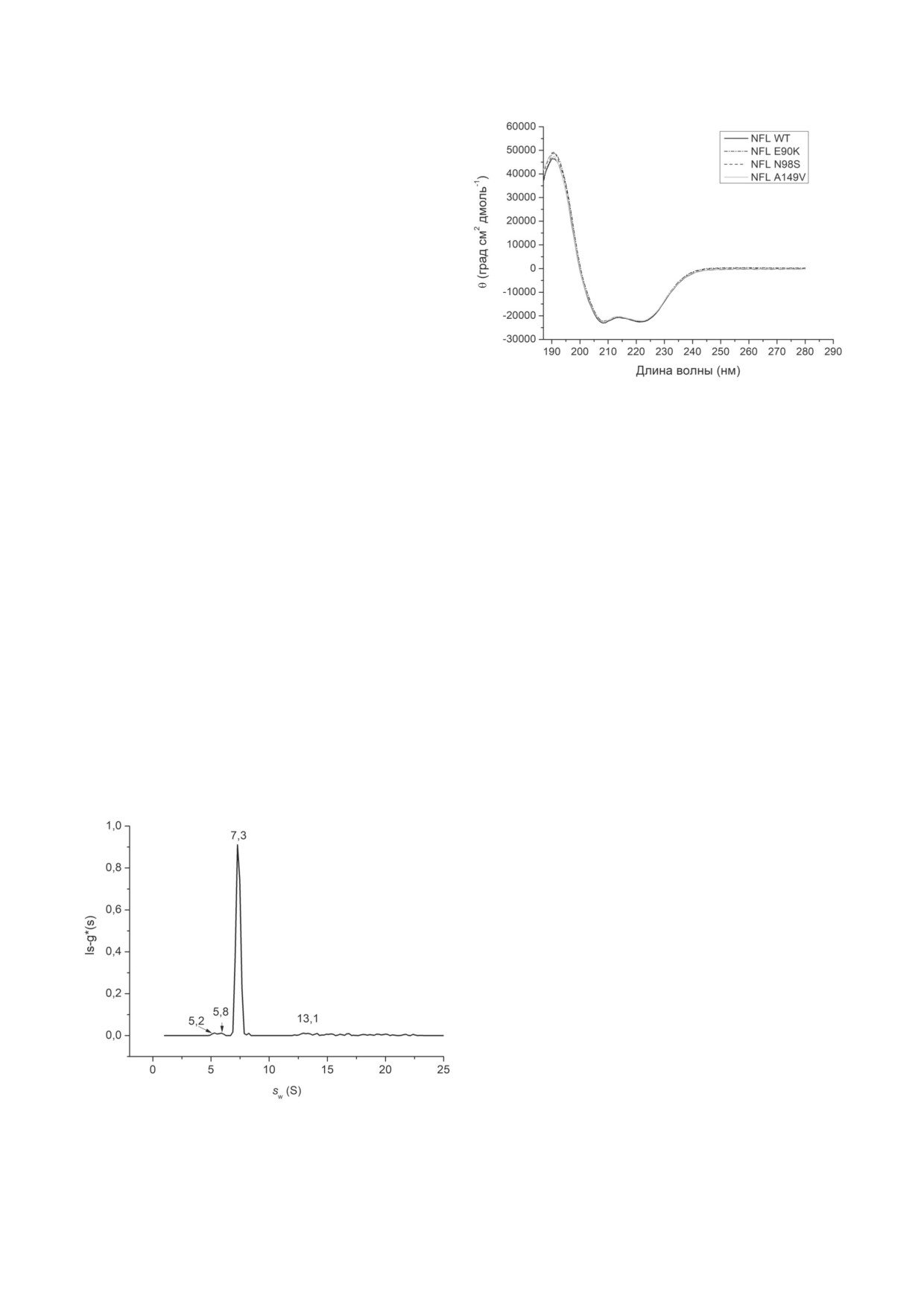
Рис. 4. Спектры кругового дихроизма NFL WT и мутант-
ставил 7,3 S (рис. 3). Ранее с использованием
ных белков NFL с заменами E90K, N98S и A149V, зареги-
стрированные при 5 °С
равновесного ультрацентрифугирования было
проведено определение молекулярной массы
олигомеров других ПФ - виментина и дес-
не отличался от значения 7,3 S, определённого в
мина, полученных в похожих условиях [35],
нашей работе для NFL, концентрация которого
и показано, что при низкой ионной силе
составляла 1 мг/мл (рис. 3).
(5 мМ Tris-HCl) образуются олигомеры, моле-
Учитывая преобладание главного пика 7,3 S
кулярная масса которых соответствует тетра-
на распределении ls-g*(s) NFL WT (рис. 3),
мерам этих белков, однако коэффициенты се-
можно заключить, что в используемых усло-
диментации тетрамеров виментина и десмина
виях этот белок находился преимущественно
существенно зависят от рН, что указывало на
в форме олигомеров, соответствующих тетра-
разную степень жёсткости, размер или фор-
мерам белка NFL. В минорных количествах
му образуемых олигомеров. При рН 8 коэф-
присутствовали также другие олигомерные фор-
фициент седиментации тетрамеров вимен-
мы с коэффициентами седиментации 5,2; 5,8
тина составил 4,7 S, а при рН 7,5 - 5,5 S [35].
или 13,2 S (каждая форма < 2%). В настоящее
В последующей работе тех же авторов было
время мы можем лишь предположить, что тетра-
показано, что при изменении условий (в част-
мерное состояние сохраняется и для мутантных
ности, при повышении концентрации белка
форм NFL (для убедительного доказательства
до 0,5 мг/мл и проведении эксперимента в при-
этого предположения требуются дополнитель-
сутствии EDTA) коэффициент седиментации
ные эксперименты, которые в дальнейшем пла-
виментина повышался до 7,2 S [36], т.е. почти
нируется провести). Тем не менее мы можем до-
статочно уверенно утверждать, что ни NFL WT,
ни его мутантные формы в используемых усло-
виях не образовывали высокомолекулярных
олигомеров (ULF и филаментов), что подтвер-
ждалось полным отсутствием осадков после
высокоскоростного (при 105 000 g) препаратив-
ного центрифугирования препаратов (данные
не приведены). Важно отметить, что тетрамер-
ная форма ПФ может существовать не только
in vitro, но и in vivo [37], что позволяет рассма-
тривать её как минимальную структуру для из-
учения свойств NFL.
Регистрация спектров КД NFL WT и всех
мутантных белков показала наличие характер-
ных для α-спиральных белков отрицательных
максимумов молярной эллиптичности при 208
и 222 нм (рис. 4), при этом, по данным расчёта
Рис. 3. Анализ олигомерного состояния белка дикого
типа NFL WT (1 мг/мл) методом аналитического ультра-
bbk.ac.uk/html/home.shtml), структура NFL при-
центрифугирования. Показано распределение по коэф-
фициентам седиментации ls-g*(s). Скорость вращения
мерно на 52-56% представлена α-спиральными
ротора - 48 000 об./мин
участками.
БИОХИМИЯ том 88 вып. 5 2023
НЕЙРОДЕГЕНЕРАТИВНЫЕ МУТАЦИИ В NFL
753
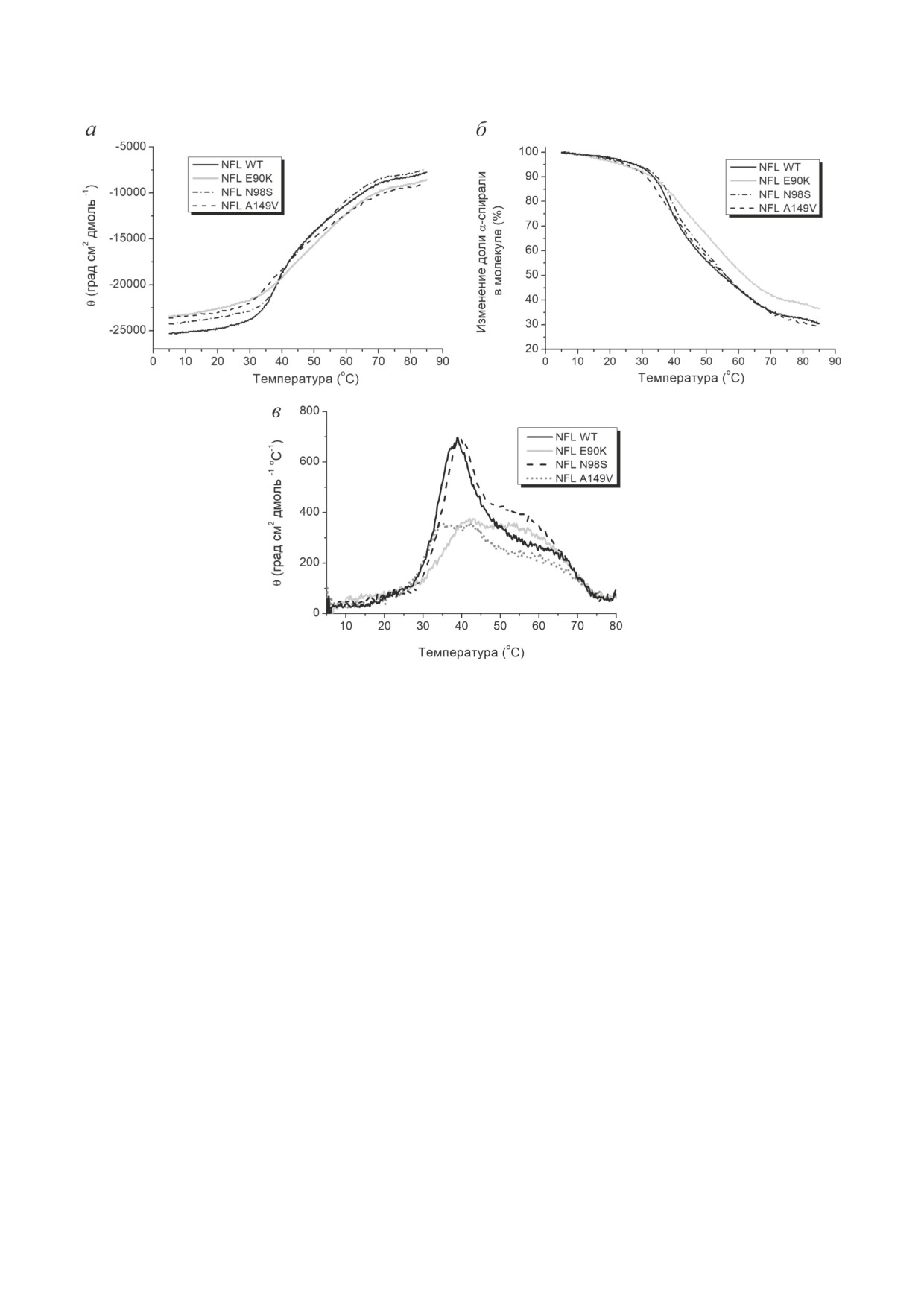
Рис. 5. Тепловая денатурация белка NFL WT и его мутантных форм E90K, N98S и A149V, измеренная методом КД.
а - Температурные зависимости изменения молярной эллиптичности NFL WT и мутантных белков, зарегистриро-
ванные при 222 нм. б - Температурные зависимости изменения доли α-спирали в молекуле NFL. За 100% принята
спиральность молекулы NFL при 5 оС, соответствующая ~ 50% спиральности белка. в - Первые производные темпера-
турных зависимостей эллиптичности, представленных на панели (а)
В первую очередь мы исследовали тепло-
денатурации: после нагрева и последующего
вую денатурацию целой молекулы NFL WT и
охлаждения спектры КД этих белков демон-
её мутантных форм, регистрируя изменение
стрировали всё те же отрицательные максиму-
молярной эллиптичности при 222 нм в диа-
мы при 208 и 222 нм, характерные для α-спи-
пазоне температур 5-85 °С (рис. 5, а). Ока-
ральных белков.
залось, что плавление молекулы NFL WT
Для того чтобы провести точную иден-
происходит постепенно и имеет несколько
тификацию тепловых переходов в молеку-
выраженных тепловых переходов (рис. 5, а-в).
ле NFL, мы использовали метод ДСК, кото-
С использованием первой производной зави-
рый позволяет регистрировать температур-
симости, представленной на рис. 5, а, было по-
ные зависимости избыточного теплопоглоще-
казано наличие теплового перехода при ~ 38 °С,
ния молекулы белка при его тепловой дена-
а также более высокотемпературного «плеча»
турации. Плавление NFL было полностью
(рис. 5, в). Тепловая денатурация мутантного
обратимо, что позволило нам провести ком-
белка с заменой N98S очень похожа на тако-
пьютерную деконволюцию кривых избыточ-
вую для белка дикого типа и также имеет выра-
ного теплопоглощения NFL WT и его мутант-
женный переход при ~ 39 °С. Методом КД для
ных форм, т.е. разложение этих кривых на
мутантного белка с заменой E90K были обна-
отдельные тепловые переходы (калориметри-
ружены тепловые переходы при ~ 42 °С и ~ 55-
ческие домены), отражающие денатурацию
57 °С. Для белка NFL с заменой A149V были
различных участков белка, которые плавятся
обнаружены тепловые переходы при ~ 35 °С
кооперативно и независимо друг от друга.
и ~ 42 °С (рис. 5, в). При этом для всех бел-
Полученные данные представлены на рис. 6
ков NFL характерна обратимость тепловой
и в табл. 2.
5
БИОХИМИЯ том 88 вып. 5 2023
754
НЕФЁДОВА и др.
Таблица 2. Калориметрические параметры, полученные методом ДСК для индивидуальных тепловых переходов
(калориметрических доменов) белка NFL дикого типа и его мутантных форм*
ΔHcal§
ΔHcal
Общая ΔHcal
NFL
Нумерация доменов
Tm# (°C)
(кДж моль-1)
(% от общей ΔHcal)
(кДж моль-1)
Домен 1
33,2
35
3
Домен 2
41,7
495
42
NFL WT
1190
Домен 3
53,6
430
36
Домен 4
63,2
230
19
Домен 2
41,6
150
20
NFL E90K
Домен 3
52,2
4
10
55
745
Домен 4
62,6
185
25
Домен 1
34,2
60
6
Домен 2
41,0
295
27
NFL N98S
1080
Домен 3
50,4
530
49
Домен 4
62,5
195
18
Домен 1
31,1
80
10
Домен 2
40,7
170
22
NFL A149V
770
Домен 3
47,5
345
45
Домен 4
63,2
175
23
Приложение. * Параметры получены на основании данных, представленных на рис. 6.
# Погрешность приведённых значений температуры калориметрических доменов (Tm) не превышала ± 0,2 °C.
§ Погрешность приведённых значений калориметрической энтальпии (ΔHcal) не превышала 10%.
По результатам деконволюции для NFL WT
аминокислотные замены расположены в спи-
были определены 4 калориметрических домена
ральных участках 1A и 1B (рис. 1), перераспре-
с температурами полупереходов при 33,2 °С,
деление калориметрических доменов произо-
41,7 °С,
53,6 °С и
63,2 °С. Формы графиков
шло только в случае одной аминокислотной
первой
производной изменения молярной
замены - E90K. Поскольку эта замена распо-
эллиптичности при 222 нм (рис. 5, в) и темпе-
ложена в спиральном участке 1A (рис. 1), можно
ратурных зависимостей избыточного теплопо-
предположить, что калориметрический домен 1
глощения белка NFL WT и его мутантов (рис. 6)
отражает денатурацию этого участка молеку-
в целом очень похожи и демонстрируют нали-
лы NFL. При внесении двух других замен (N98S
чие одинаковых тепловых переходов. Метод КД
и A149V) происходили изменения энтальпии
позволяет регистрировать денатурацию α-спи-
отдельных калориметрических доменов, но их
ралей NFL, в то время как метод ДСК - раз-
количество не менялось. Наименьшие изме-
рушение структуры coiled-coil. Схожесть тем-
нения температуры полуперехода мы наблю-
пературных зависимостей, полученных этими
дали для доменов 2 и 4. Для белков NFL WT и
двумя методами, указывает на то, что разруше-
его мутантов значение Tm домена 2 находится
ние структуры coiled-coil происходит одновре-
в диапазоне 40,7-41,7 °С, а домена 4 - в диа-
менно с плавлением α-спиралей.
пазоне 62,5-63,2 °С. В то же время внесение
Для всех мутантных белков, кроме NFL
мутаций привносит заметные изменения в
E90K, также были определены 4 калориметри-
калориметрический домен 3. Так, значение Tm
ческих домена. Для мутантного белка NFL E90K
этого домена в случае белка дикого типа состав-
было показано отсутствие калориметрического
ляет 53,6 °С, тогда как для мутантного белка с
домена 1 (рис. 6, табл 2). Важно отметить, что,
заменой A149V оно гораздо ниже и составля-
несмотря на то что все исследованные в работе
ет 47,5 °С.
БИОХИМИЯ том 88 вып. 5 2023
НЕЙРОДЕГЕНЕРАТИВНЫЕ МУТАЦИИ В NFL
755
ний, которые могут происходить при внесении
аминокислотных замен в NFL, обратимся к
структуре ПФ.
Первичная структура α-спиральных участ-
ков белков семейства ПФ демонстрирует клас-
сическое для всех таких белков распределение
аминокислотных остатков в гептадных повто-
рах [26]. При этом каждый аминокислотный
остаток выполняет конкретную роль в стаби-
лизации суперспиральной структуры [26, 38].
Для белка виментина ранее были получены
кристаллические структуры отдельных фраг-
ментов и показано распределение аминокис-
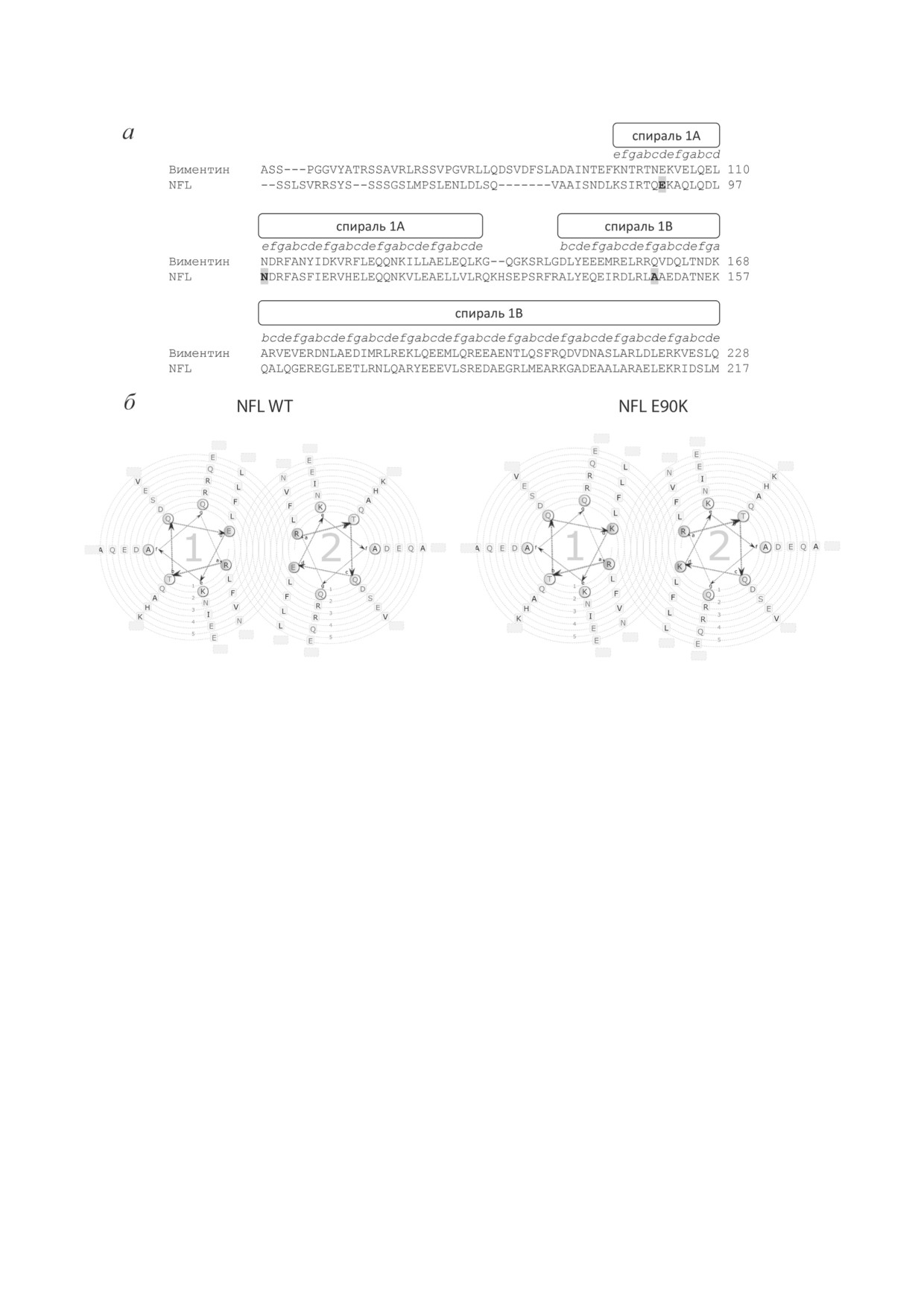
лотных остатков в спиралях 1A и 1B (рис. 7) [3].
Выравнивание первичных структур виментина
и NFL показало, что спирали 1A и 1B демон-
стрируют высокую степень гомологии, на
основании чего мы предположили, что ами-
нокислотным остаткам в гептадах суперспи-
ральных участков NFL будут соответствовать
те же положения (a-g), что и в виментине.
Если это так, то E90 находится в положении d,
N98 находится в положении e, а A149 - в поло-
жении g (рис. 7). Замена E90K, обнаруженная
у пациентов с нейропатией Шарко-Мари-
Тута, приводит к исчезновению калориметри-
ческого домена 1 на термограмме NFL (рис. 6,
табл. 2), что может указывать на изменения в
структуре суперспирального участка 1A, на-
пример, на его чрезмерную стабилизацию или,
наоборот, дестабилизацию. Традиционно счи-
тается, что в положениях а и d суперспираль-
ных белков должны находиться гидрофобные
аминокислотные остатки, стабилизирующие
суперспиральную структуру, однако для мно-
гих белков промежуточных филаментов (ви-
ментина, глиального фибриллярного белка,
периферина, десмина) в положении, гомо-
логичном E90 в NFL, также находится остаток
глутамина [3]. При этом для остальных остат-
ков в спирали 1A соблюдается правило, что в
положениях а и d должны находиться гидро-
фобные аминокислотные остатки (рис. 7, а).
Несмотря на то что аминокислотный оста-
Рис. 6. Температурные зависимости избыточного тепло-
ток E90 не является гидрофобным, по-види-
поглощения белка NFL WT и его точечных мутантов,
полученные методом ДСК. Сплошными линиями обозна-
мому, он также играет важную роль в стабили-
чены оригинальные записи кривых избыточного тепло-
зации суперспиральной структуры домена 1A
поглощения, а пунктирными линиями - калориметри-
за счёт электростатических взаимодействий,
ческие домены, выявленные путём деконволюции этих
так как в положении d в гидрофобной коре
кривых. Нумерация доменов соответствует их нумерации
в табл. 2
ему соответствует R86 (рис. 7, б). Внесение за-
мены E90K должно приводить к локальному
расхождению двух α-спиралей за счёт появле-
Таким образом, основные изменения в
ния дополнительного положительного заря-
тепловой денатурации NFL при внесении
да K90 и дестабилизации этого участка струк-
аминокислотных замен затрагивают калори-
туры. Важно отметить, что для представителей
метрические домены 1 и 3. Для объяснения
семейства ПФ характерна полимеризация, и в
возможных причин тех структурных измене-
ряде работ высказывается мнение, что именно
БИОХИМИЯ том 88 вып. 5 2023
5*
756
НЕФЁДОВА и др.
Рис. 7. Анализ положения аминокислотных остатков в гептадных повторах белка NFL. а - Сравнение первичных
структур виментина (UniProt P08670) и белка NFL (UniProt P07196). Серым цветом обозначены аминокислотные
замены в белке NFL, вызывающие развитие нейропатии Шарко-Мари-Тута. Положение аминокислот в гептадах
обозначено латинскими буквами a-g и определено на основании статьи Chernyatina et al. [3]. б - Анализ положения
аминокислотных остатков в гептадах NFL WT и NFL E90K в программе Waggawagga [43]. Номерами 1-5 обозначены
различные гептады
спираль 1A играет важную роль в продольной
что данный белок образует тонкие короткие
полимеризации ПФ (т.е. образовании протя-
филаменты, в отличие от белка дикого типа,
жённых филаментов). Для данного спирально-
который в этих же условиях образует длинные
го участка белков ПФ была обнаружена самая
протяжённые филаменты [21]. Сопоставление
низкая температура плавления, составляю-
этих данных литературы [21] с полученными
щая ~ 30 °С, и высказано предположение, что
нами результатами (рис. 6, табл. 2) указыва-
именно низкая термостабильность домена 1A
ет на то, что изменения термостабильности,
важна для полимеризации ПФ [39-41]. Для ви-
индуцированные заменой E90K, происходят,
ментина ранее была обнаружена единичная
по-видимому, как раз в той зоне (спиральный
аминокислотная замена, расположенная в на-
участок 1A, рис. 1), которая отвечает за поли-
чале линкера 1 (K139C), из-за которой полиме-
меризацию NFL и образование филаментов.
ризация виментина становилась зависимой от
Следует отметить, однако, что в случае ПФ
температуры. Так, белок с заменой K139C при
важно также учитывать их способность к лате-
температурах 21 °С и 37 °С одинаково быстро
ральной полимеризации, которая достигается
образовывал ULF-частицы, однако при 21 °С -
за счёт антипараллельного взаимодействия ди-
не был способен образовывать протяжённые
меров. Для ПФ было обнаружено несколько
фибриллы [35]. В таком случае можно ожидать,
видов взаимодействия димеров в тетрамере:
что аминокислотные замены, которые влияют
А11, А12 и А22 [36, 38], которые отличаются взаи-
на термостабильность NFL, также могут ока-
модействующими спиральными участками (на-
зывать влияние и на его способность поли-
пример, в случае А11 димеры взаимодействуют
меризоваться. Исследования полимеризации
антипараллельно посредством спирали
1B).
NFL E90K в клетках SW13 Vim- показали,
Несмотря на то что в зрелом филаменте ПФ
БИОХИМИЯ том 88 вып. 5 2023
НЕЙРОДЕГЕНЕРАТИВНЫЕ МУТАЦИИ В NFL
757
присутствуют все три вида взаимодействия,
либо к уменьшению числа калориметрических
на начальных стадиях полимеризации, вплоть
доменов, выявляемых методом ДСК, как в
до ULF, взаимодействие по типу А11 является
случае замены E90K, либо к заметному изме-
преобладающим [35]. Основную роль в обра-
нению температуры максимума (Tm) калори-
зование тетрамеров ПФ играет спираль 1B,
метрического домена 3, либо к изменениям
однако спираль 1A и начало спирали 2 также
калориметрической энтальпии (ΔHcal) доменов.
важны для образования тетрамеров ПФ [3,
В целом, полученные данные указывают
42]. Данный факт может объяснять изменения
на то, что замена E90K приводит, по-види-
значения Tm, затрагивающие калориметриче-
мому, к дестабилизации α-спирального участ-
ские домены 1 и 3, а также изменения энталь-
ка 1A в молекуле NFL. Что касается замен
пии (ΔHcal) всех калориметрических доменов
N98S и A149V, то можно предположить, что
при внесении точечных аминокислотных за-
они оказывают влияние не столько на струк-
мен. Аминокислотные замены N98S и A149V
туру суперспирали, сколько на другие уровни
приводили к изменениям в тепловой денатура-
организации молекул NFL.
ции NFL, однако в обоих этих случаях сохра-
нялись все четыре калориметрических домена,
Вклад авторов. А.М. Матюшенко и В.В. Не-
что, по-видимому, указывает на то, что данные
фёдова - концепция и руководство работой;
замены оказывают не столь серьёзное влияние
Д.С. Ямпольская и В.В. Нефёдова - получение
на стабилизацию суперспиралей NFL. Веро-
препаратов NFL; C.Ю. Клейменов - выпол-
ятно, это связано с тем, что данные амино-
нение экспериментов методом ДСК; Н.А. Че-
кислотные остатки находятся в положениях e
ботарева - проведение экспериментов мето-
и g гептадных повторов, т.е. располагаются на
дом аналитического ультрацентрифугирования;
поверхности суперпиралей. Патогенные свой-
В.В. Нефёдова и Д.И. Левицкий - написание
ства данных аминокислотных замен NFL,
первоначального текста статьи. Все авторы
по-видимому, выражаются в нарушении взаи-
принимали участие в обсуждении результатов
модействия между тетрамерами при образо-
исследования и редактировании окончатель-
вании ULF и филаментов. В частности, для
ной версии статьи.
белка N98S ранее была показана агрегация в
Финансирование. Работа выполнена при
клетках SW13 Vim [21].
финансовой поддержке Министерства науки
и высшего образования Российской Феде-
рации в рамках Государственных заданий
ЗАКЛЮЧЕНИЕ
№ 122041100022-3 (В.В.Н., Д.С.Я., Н.А.Ч.,
А.М.М., Д.И.Л.) и № 0088-2021-0009 (С.Ю.К.).
По результатам проведённых эксперимен-
Благодарности. При проведении измере-
тов можно заключить, что точечные амино-
ний КД использовалось оборудование Центра
кислотные замены в белке NFL, обнаруженные
коллективного пользования «Промышленные
у пациентов с периферической нейропатией
биотехнологии» Федерального государствен-
Шарко-Мари-Тута, не влияют на способность
ного учреждения ФИЦ
«Фундаментальные
этого белка формировать суперспиральную
основы биотехнологии» РАН.
структуру. Для всех исследованных мутантных
Конфликт интересов. Авторы заявляют об
белков с заменами E90K, N98S и A149V мето-
отсутствии конфликта интересов.
дом КД было показано наличие α-спиральной
Соблюдение этических норм. Настоящая
структуры. В то же время данные аминокис-
статья не содержит описания каких-либо ис-
лотные замены влияют на стабильность и теп-
следований с участием людей или животных в
ловую денатурацию молекулы NFL, приводя
качестве объектов.
СПИСОК ЛИТЕРАТУРЫ
1. Herrmann, H., and Aebi, U. (2004) Intermediate fila-
intermediate filament proteins, FEBS Lett., 589 (19
ments: molecular structure, assembly mechanism, and
Pt A), 2464-2476, doi: 10.1016/j.febslet.2015.07.024.
integration into functionally distinct intracellular Scaf-
3. Chernyatina, A. A., Nicolet, S., Aebi, U., Herrmann, H.,
folds, Annu. Rev. Biochem., 73, 749-789, doi: 10.1146/
and Strelkov, S. V. (2012) Atomic structure of the vi-
annurev.biochem.73.011303.073823.
mentin central α-helical domain and its implications for
2. Kornreich, M., Avinery, R., Malka-Gibor, E., Laser-
intermediate filament assembly, Proc. Natl. Acad. Sci.
Azogui, A., and Beck, R. (2015) Order and disorder in
USA, 109, 13620-13625, doi: 10.1073/pnas.1206836109.
БИОХИМИЯ том 88 вып. 5 2023
758
НЕФЁДОВА и др.
4.
Eldirany, S., Ho, M., Hinbest, A. J., Lomakin, I. B.,
16.
Houlden, H., and Reilly, M. M. (2006) Molecu-
and Bunick, C. G. (2019) Human keratin 1/10-1B
lar genetics of autosomal-dominant demyelinating
tetramer structures reveal a knob-pocket mechanism
Charcot-Marie-Tooth disease, Neuromolecular Med.,
in intermediate filament assembly, EMBO J., 38,
8, 43-62, doi: 10.1385/nmm:8:1-2:43.
e100741, doi: 10.15252/embj.2018100741.
17.
Yang, Y., Li-Qiang, Gu, Burnette, W. B., and Li, J.
5.
Strelkov, S. V., Herrmann, H., and Aebi, U., (2003)
(2016) N98S mutation in NEFL gene is dominant-
Molecular architecture of intermediate filaments,
ly inherited with a phenotype of polyneuropathy
Bioessays, 25, 243-251, doi: 10.1002/bies.10246.
and cerebellar atrophy, J. Neurol. Sci., 365, 46-47,
6.
Block, J., Schroeder, V., Pawelzyk, P., Willen-
doi: 10.1016/j.jns.2016.04.007.
bacher, N., and Koster, S. (2015) Physical properties
18.
Rossor, A. M., Polke, J. M., Houlden, H., and Reilly,
of cytoplasmic intermediate filaments, Biochim.
M. M. (2013) Clinical implications of genetic advances
Biophys. Acta,
1853,
3053-3064, doi:
10.1016/
in Charcot-Marie-Tooth disease, Nat. Rev. Neurol.,
j.bbamcr.2015.05.009.
9, 562-571, doi: 10.1038/nrneurol.2013.179.
7.
Herrmann, H., Haner, M., Brettel, M., Ku, N. O.,
19.
Stone, E. J., Kolb, S. J., and Brown, A.
(2021)
and Aebi, U. (1999) Characterization of distinct early
A review and analysis of the clinical literature on
assembly units of different intermediate filament
Charcot-Marie-Tooth disease caused by mutations
proteins, J. Mol. Biol., 286, 1403-1420, doi: 10.1006/
in neurofilament protein L, Cytoskeleton, 78, 97-110,
jmbi.1999.2528.
doi: 10.1002/cm.21676.
8.
Brennich, M.E., Vainio, U., Wedig, T., Bauch, S.,
20.
Brownlees, J., Ackerley, S., Grierson, A. J., Jacobsen,
Herrmann, H., and Köster, S. (2019) Mutation-in-
N. J. O., Shea, K., Anderton, B. H., Nigel Leigh, P.,
duced alterations of intra-filament subunit organi-
Shaw, C. E., and Miller, C. C. J. (2002) Charcot-
zation in vimentin filaments revealed by SAXS, Soft
Marie-Tooth disease neurofilament mutations
Matter, 15, 1999-2008, doi: 10.1039/c8sm02281j.
disrupt neurofilament assembly and axonal transport,
9.
Lee, C.-H., Kim, M.-S., Li, S., Leahy, D. J., and
Hum. Mol. Genet.,
11,
2837-2844, doi:
10.1093/
Coulombe, P. A. (2020) Structure-function analyses of
hmg/11.23.2837.
a keratin heterotypic complex identify specific keratin
21.
Perez-Olle, R., Jones, S. T., and Liem, R. K. H.
regions involved in intermediate filament assembly,
(2004) Phenotypic analysis of neurofilament light gene
Structure, 28, 1-8, doi: 10.1016/j.str.2020.01.002.
mutations linked to Charcot-Marie-Tooth disease in
10.
Laser-Azogui, A., Kornreich, M., Malka-Gibor, E.,
cell culture models, Hum. Mol. Genet., 13, 2207-2220,
and Beck, R. (2015) Neurofilament assembly and
doi: 10.1093/hmg/ddh236.
function during neuronal development, Curr. Opin.
22.
Stone, E. J., Uchida, A., and Brown, A.
(2019)
Cell Biol., 32, 92-101, doi: 10.1016/j.ceb.2015.01.003.
Charcot-Marie-Tooth disease type 2E/1F mutant
11.
Veeranna, Amin, N. D., Ahn, N. G., Jaffe, H.,
neurofilament proteins assemble into neurofilaments,
Winters, C. A., Grant, P., and Pant, H. C. (1998)
Cytoskeleton (Hoboken), 76, 423-439, doi: 10.1002/
Mitogen-activated protein kinases (Erk1,2) phos-
cm.21566.
phorylate Lys-Ser-Pro (KSP) repeats in neuro-
23.
Adebola, A. A., Gastri, T. D., He, C.-Z., Salvatierra,
filament proteins NF-H and NF-M, J. Neuros-
L. A., Zhao, J., Brown, K., Lin, C.-S., Worman,
ci.,
18,
4008-4021, doi:
10.1523/JNEUROSCI.
H. J., and Liem, R. K. H. (2014) Neurofilament light
18-11-04008.1998.
polypeptide gene N98S mutation in mice leads to
12.
Athlan, E. S., and Mushynski, W. E. (1997) Hetero-
neurofilament network abnormalities and a Charcot-
dimeric associations between neuronal intermediate
Marie-Tooth type 2E phenotype, Hum. Mol. Genet.,
filament proteins, J. Biol. Chem., 272, 31073-31078,
24, 2163-2174, doi: 10.1093/hmg/ddu736.
doi: 10.1074/jbc.272.49.31073.
24.
Lee, I.-B., Kim, S.-K., Chung, S.-H., Kim, H., Kwon,
13.
Garden, M. J., and Eagles, P. A. (1986) Chemical
T. K., Min, D. S., and Chang, J.-S. (2008) The effect
cross-linking analyses of ox neurofilaments, Bio-
of rod domain A148V mutation of neurofilament light
chem. J., 234, 587-591, doi: 10.1042/bj2340587.
chain on filament formation, BMB Rep., 41, 868-874,
14.
Sasaki, T., Gotow, T., Shiozaki, M., Sakaue, F.,
doi: 10.5483/bmbrep.2008.41.12.868.
Saito, T., Julien, J.-P, Uchiyama, Y., and Hisanaga,
25.
Jordanova, A., De Jonghe, P., Boerkoel, C. F.,
S.-I. (2006) Aggregate formation and phosphorylation
Takashima, H., De Vriendt, E., Ceuterick, C., Martin,
of neurofilament-L Pro22 Charcot-Marie-Tooth
J.-J., Butler, I. J., Mancias, P., Papasozomenos,
disease mutants, Hum. Mol. Genet., 15, 943-952,
S. Ch., Terespolsky, D., Potocki, L., Brown, C.W.,
doi: 10.1093/hmg/ddl011.
Shy, M., Rita, D. A., Tournev, I., Kremensky, I.,
15.
Yuan, A., Rao, M. V., Julien, J.-P., and Nixon, R.
Lupski, J. R., and Timmerman, V. (2003) Mutations
A.
(2003) Neurofilament transport in vivo mini-
in the neurofilament light chain gene (NEFL)
mally requires hetero-oligomer formation, J. Neu-
cause early onset severe Charcot-Marie-Tooth
rosci., 23, 9452-9458, doi: 10.1523/JNEUROSCI.
disease, Brain,
126,
590-597, doi:
10.1093/brain/
23-28-09452.2003.
awg059.
БИОХИМИЯ том 88 вып. 5 2023
НЕЙРОДЕГЕНЕРАТИВНЫЕ МУТАЦИИ В NFL
759
26.
Nevzorov, I. A., and Levitsky, D. I. (2011) Tropo-
35.
Mücke, N., Wedig, T., Bürer, A., Marekov, L. N.,
myosin: double helix from the protein world, Bio-
Steinert, P. M., Langowski, J., Aebi, U., and
chemistry (Moscow),
76,
1507-1527, doi:
10.1134/
Herrmann, H.
(2004) Molecular and biophysical
S0006297911130098.
characterization of assembly-starter units of human
27.
Nevzorov, I. A., Nikolaeva, O. P., Kainov, Y. A.,
vimentin, J. Mol. Biol., 340, 97-114, doi: 10.1016/
Redwood, C. S., and Levitsky, D. I. (2011) Conserved
j.jmb.2004.04.039.
noncanonical residue Gly-126 confers instability
36.
Wickert, U., Mücke, N., Wedig, T., Müller, S. A.,
to the middle part of the tropomyosin molecule,
Aebi, U., and Herrmann, H. (2005) Characterization
J. Biol. Chem.,
286,
15766-15772, doi:
10.1074/
of the in vitro co-assembly process of the intermediate
jbc.M110.209353.
filament proteins vimentin and desmin: mixed poly-
28.
Kremneva, E., Boussouf, S., Nikolaeva, O., Maytum, R.,
mers at all stages of assembly, Eur. J. Cell Biol., 84,
Geeves, M. A., and Levitsky, D. I. (2004) Effects of
379-391, doi: 10.1016/j.ejcb.2005.01.004.
two familial hypertrophic cardiomyopathy mutations in
37.
Soellner, P., Quinlan, R. A., and Franke, W. W.
α-tropomyosin, Asp175Asn and Glu180Gly, on the ther-
(1985) Identification of a distinct soluble subunit of
mal unfolding of actin-bound tropomyosin, Biophys. J.,
an intermediate filament protein: tetrameric vimentin
87, 3922-3933, doi: 10.1529/biophysj.104.048793.
from living cells, Proc. Natl. Acad. Sci. USA, 82, 7929-
29.
Matyushenko, A. M., Shchepkin, D. V., Kopylova,
7933, doi: 10.1073/pnas.82.23.7929.
G. V., Popruga, K. E., Artemova, N. V., Pivovarova,
38.
Minin, A. A., and Moldaver, M. V. (2008) Interme-
A. V., Bershitsky, S. Y., and Levitsky, D. I. (2017)
diate vimentin filaments and their role in intracellu-
Structural and functional effects of cardiomyopathy-
lar organelle distribution, Biochemistry (Moscow), 73,
causing mutations in troponin T-binding region of
1453-1466, doi: 10.1134/s0006297908130063.
cardiac tropomyosin, Biochemistry,
56,
250-259,
39.
Meier, M., Padilla, G. P., Herrmann, H., Wedig, T.,
doi: 10.1021/acs.biochem.6b00994.
Hergt, M., Patel, T. R., Stetefeld, J., Aebi, U., and
30.
Matyushenko, A. M., Artemova, N. V., Sluchanko,
Burkhard, P. (2009) Vimentin coil 1A - a molecu-
N. N., and Levitsky, D. I. (2015) Effects of two
lar switch involved in the initiation of filament elon-
stabilizing substitutions, D137L and G126R, in
gation, J. Mol. Biol., 390, 245-261, doi: 10.1016/
the middle part of α-tropomyosin on the domain
j.jmb.2009.04.067.
structure of its molecule, Biophys. Chem., 196, 77-85,
40.
Vermeire, P.-J., Stalmans, G., Lilina, A. V., Fiala, J.,
doi: 10.1016/j.bpc.2014.10.001.
Novak, P., Herrmann, H., and Strelkov, S. V. (2021)
31.
Nevzorov, I., Redwood, C., and Levitsky, D. (2008)
Molecular interactions driving intermediate filament
Stability of two β-tropomyosin isoforms: effects of
assembly, Cells, 10, 2457, doi: 10.3390/cells10092457.
mutation Arg91Gly, J. Muscle Res. Cell Motil., 29, 173-
41.
Lilina, A. V., Leekens, S., Hashim, H. M., Vermeire,
176, doi: 10.1007/s10974-009-9171-3.
P.-J., Harvey, J. N., Strelkov, S. V. (2022) Stability
32.
Schuck, P., and Rossmanith, P. (2000) Determination
profile of vimentine rod domain, Protein Sci., 31,
of the sedimentation coefficient distribution by
e4505, doi: 10.1002/pro.4505.
least-squares boundary modeling, Biopolymers,
42.
Premchandar, A., Mücke, N., Poznański, J., Wedig, T.,
54, 328-341, doi: 10.1002/1097-0282(20001015)54:5
Kaus-Drobek, M., Herrmann, H., and Dadlez, M.
<328::AID-BIP40>3.0.CO;2-P.
(2016) Structural dynamics of the vimentin coiled-
33.
Freire, E., and Biltonen, R. L. (1978) Statistical me-
coil contact regions involved in filament assem-
chanical deconvolution of thermal transitions in mac-
bly as revealed by hydrogen-deuterium exchange,
romolecules. I. Theory and application to homoge-
J. Biol. Chem.,
291,
24931-24950, doi:
10.1074/
neous systems, Biopolymers, 17, 463-479, doi: 10.1002/
jbc.M116.748145.
bip.1978.360170212.
43.
Simm, D., Hatje, K., and Kollmar, M.
(2015)
34.
Nefedova, V. V., Sudnitsyna, M. V., and Gusev, N. B.
Waggawagga: comparative visualization of coiled-coil
(2017) Interaction of small heat shock proteins with light
predictions and detection of stable single α-helices
component of neurofilaments (NFL), Cell Stress Chap-
(SAH domains), Bioinformatics,
31,
767-769,
erones, 22, 467-479, doi: 10.1007/s12192-016-0757-6.
doi: 10.1093/bioinformatics/btu700.
EFFECT OF NEURODEGENERATIVE MUTATIONS
IN NEFL GENE ON THERMAL DENATURATION
OF THE NEUROFILAMENT LIGHT CHAIN PROTEIN
V. V. Nefedova1*, D. S. Yampolskaya1, S. Y. Kleymenov1,2, N. A. Chebotareva1,
A. M. Matyushenko1, and D. I. Levitsky1
БИОХИМИЯ том 88 вып. 5 2023
760
НЕФЁДОВА и др.
1 Research Centre of Biotechnology of the Russian Academy of Sciences,
119071 Moscow, Russia; e-mail: victoria.v.nefedova@mail.ru
2 Koltzov Institute of Developmental Biology, Russian Academy of Sciences, Moscow 119334, Russia
The effects of amino acid substitutions E90K, N98S and A149V in the light chain of neurofilaments (NFL)
on the structure and thermal denaturation of the NFL molecule was investigated. By using the circular di-
chroism spectroscopy, it was shown that these substitutions do not lead to a changes in the α-helical struc-
ture of NFL, but they caused a noticeable effects on the stability of the molecule. We also identified calori-
metric domains in the NFL structure by using the differential scanning calorimetry. It was shown that the
E90K replacement lead to the disappearance of the low-temperature thermal transition (domain 1). The
mutations lead to changes in the enthalpy of melting of NFL domains, as well as lead to significant changes
in the melting temperatures (Tm) of some calorimetric domains. Thus, despite the fact that all these amino
acid substitutions are associated with the development of Charcot-Marie-Tooth neuropathy, and two of
them are even located very close to each other in the coiled-coil domain 1A, they differently effects on the
structure and stability of the NFL molecule.
Keywords: intermediate filaments, neurofilaments, coiled-coil proteins, circular dichroism spectroscopy, differential
scanning calorimetry
БИОХИМИЯ том 88 вып. 5 2023