БИОХИМИЯ, 2023, том 88, вып. 5, с. 803 - 816
УДК 577.29
ИСПОЛЬЗОВАНИЕ БИОХИМИЧЕСКИХ ОСОБЕННОСТЕЙ
СПЕРМАТОЗОИДОВ, НЕСУЩИХ X- ИЛИ Y-ХРОМОСОМУ,
ДЛЯ ИХ РАЗДЕЛЕНИЯ НА КЛЕТКИ ОДНОГО ТИПА
Обзор
© 2023 Д.В. Поздышев1*, Н.А. Комбарова2, В.И. Муронец1,3
1 НИИ физико-химической биологии имени А.Н. Белозерского,
Московский государственный университет имени М.В. Ломоносова,
119992 Москва, Россия; электронная почта: denispoz@gmail.com
2 Головной центр по воспроизводству сельскохозяйственных животных,
142143 пос. Быково, Московская обл., Россия
3 Московский государственный университет имени М.В. Ломоносова,
факультет биоинженерии и биоинформатики, 119234 Москва, Россия
Поступила в редакцию 15.12.2022
После доработки 10.02.2023
Принята к публикации 20.02.2023
В обзоре собрана информация о биохимических особенностях сперматозоидов, несущих X- или
Y-хромосому, которые позволяют получить фракцию спермы с определённой половой хромосомой.
Практически единственная используемая на сегодняшний день технология такого разделения
(сексирования) основана на сортировке сперматозоидов по содержанию ДНК методом проточ-
ной цитофлуориметрии. Помимо прикладных аспектов, эта технология дала возможность про-
водить анализ свойств изолированных популяций сперматозоидов, несущих X- или Y-хромосому.
В последние годы появился ряд работ, доказавший существование различий между этими популя-
циями на уровне транскриптома и протеома. Примечательно, что эти различия связаны главным
образом с энергетическим метаболизмом и структурными белками жгутика. На различиях в по-
движности между сперматозоидами с разными половыми хромосомами основаны новые методы
обогащения спермы клетками с X- или Y-хромосомой. Сегодня сексирование спермы является
важной составной частью протокола искусственного осеменения коров с использованием крио-
консервированного семени, позволяющего увеличить долю потомства нужного пола. Кроме того,
успехи в разделении X- и Y-сперматозоидов могут позволить применять этот подход в медицине
в тех случаях, когда необходимо избежать опасных заболеваний, сцепленных c полом.
КЛЮЧЕВЫЕ СЛОВА: X/Y-сперматозоиды, подвижность сперматозоидов, сексирование.
DOI: 10.31857/S0320972523050081, EDN: AYEUEB
ВВЕДЕНИЕ
сированию спермы человека не существует, во
многом потому, что при медицинских показа-
Искусственное воспроизведение потомства
ниях отбор проводят на стадии преимпланта-
определённого пола у млекопитающих является
ционного тестирования эмбриона. При этом,
интересной задачей, привлекавшей внимание
как будет сказано ниже, эксперименты по
исследователей на протяжении многих веков.
разделению сперматозоидов, несущих X- или
Но только в последнее время появилась воз-
Y-хромосому, проводятся достаточно эффек-
можность влиять на этот процесс с помощью
тивно, и эта процедура весьма востребована в
разделения сперматозоидов на популяции,
животноводстве. Известно, что разные отрасли
несущие X- или Y-хромосому (сексирование).
животноводства имеют разные предпочтения
Хотя, в принципе, предопределить пол потом-
к полу потомства. Например, при разведе-
ства можно и у человека, протоколов по сек- нии мясных пород крупного рогатого скота
Принятые сокращения: TLR7/8 - Toll-подобные рецепторы 7/8.
* Адресат для корреспонденции.
803
8*
804
ПОЗДЫШЕВ и др.
предпочтительно получать бычков, а молоч-
различиях X- и Y-сперматозоидов часто бы-
ных пород - тёлок. Технологии сексирования
вала получена на млекопитающих, представ-
способны значимо улучшить эффективность
ляющих более распространённые модельные
производства. На сегодняшний день искус-
системы.
ственное осеменение в сочетании с техно-
логией криоконсервации семени - это основ-
ной метод в разведении крупного рогатого
ФАКТОРЫ,
скота в развитых странах. Для мелких жвач-
ОПРЕДЕЛЯЮЩИЕ ОСОБЕННОСТИ
ных животных, таких как овцы и козы, искус-
ПОДВИЖНОСТИ СПЕРМАТОЗОИДА
ственное осеменение не так распространено,
но протоколы вспомогательных репродуктив-
Эволюция сперматозоида была направлена
ных технологий активно внедряются и для
на возможность доставлять генетический ма-
этих животных [1]. В таких условиях вопрос
териал к ооциту. Зрелый сперматозоид состоит
предопределения пола во многом сводится к
из головки, несущей в себе гаплоидное ядро,
вопросу обогащения инсеминационной дозы
и жгутика, предопределяющего его способ-
сперматозоидами, несущими предпочтитель-
ность к перемещению [6]. Большая часть ци-
ную половую хромосому. Наиболее изучен-
топлазмы элиминируется при его созревании,
ным методом обогащения спермы одним ти-
и сохраняются лишь некоторые из органелл.
пом гамет является проточная сортировка с
До слияния с ооцитом сперматозоид пре-
флуоресцентным мечением ДНК (FACS) [2].
терпевает ряд значительных изменений, при
Указанная технология имеет ряд недостатков
этом тип подвижности постоянно меняется.
и ограничений, таких как высокая стоимость
Мужские гаметы не обладают прогрессивной
оборудования и обслуживания, относительно
подвижностью сразу после отделения от кле-
низкая скорость сортировки, плохая масшта-
ток Сертоли в просвет семенного канальца
бируемость производства, пониженные пока-
и приобретают способность двигаться после
затели фертильности [3]. При этом точность
прохождения придатка яичка [7]. После эяку-
сортировки таким методом достигает 90% [4],
ляции жгутик становится активным в репро-
что делает его «золотым стандартом» в сек-
дуктивных путях самки, однако на этом этапе
сировании семени. Высокая чистота отбора
механические характеристики биения жгутика
клеток была получена благодаря использова-
непостоянны. В экспериментах in vivo при на-
нию специальной запатентованной системы
блюдении активных сперматозоидов выделяют
позиционирования сперматозоидов в потоке
как минимум два типа биения жгутика с раз-
сортера. И хотя эта технология, основанная
ной амплитудой [8]. In vitro можно отличить
на разнице в содержании ДНК в X- и Y-спер-
четыре типа биения: симметричное биение
матозоидах, активно улучшается, наличие
жгутика с маленькой амплитудой, асимметрич-
патентных ограничений заставляет сосре-
ное биение с большой амплитудой, промежуточ-
доточить внимание многих исследователь-
ный тип подвижности, а также биение сред-
ских групп на других методах сексирования
него участка, приводящее к закручиванию
спермы. Кроме того, сортировка с проточной
жгутика [9]. Каждый тип подвижности жгути-
флуориметрией дала возможность проводить
ка определяет характерную траекторию движе-
анализ транскриптомов и протеомов разделён-
ния сперматозоида, что связано с его локализа-
ных популяций спермы, что выявило новые
цией и степенью капацитации [10]. Известно,
различия между ними. В настоящее время
что для успешного оплодотворения эта высо-
опубликован ряд обзоров, охватывающих все
коспециализированная клетка быстро реаги-
существующие подходы к сексированию, на-
рует на изменения среды, обладает хемо-,
пример, работа Vishwanath et al. [5]. В данном
термо- и реотаксисом [11]. На последнем этапе
обзоре подробно рассмотрены исследования,
пути химический сигнал вокруг яйцеклетки
посвящённые только методам обогащения спер-
усиливает движение сперматозоида, приводя
мы гаметами с определённой половой хромо-
его в состояние гиперактивации, что является
сомой, основанным на особенностях их по-
необходимым условием для проникновения
движности, а также биологические причины
мужской гаметы в ооцит [12].
таких особенностей. Так как прикладной ас-
Достижение ооцита сперматозоидом опре-
пект данного вопроса сегодня актуален глав-
деляется системой регуляции, обеспечивающей
ным образом для крупного рогатого скота,
направление и адекватный паттерн подвиж-
экспериментальные данные по методам обога-
ности, а также успешным снабжением клетки
щения собраны главным образом для быков, в
энергией. Регуляция траектории и подвиж-
то время как информация о фундаментальных
ности происходит за счёт многокомпонентных
БИОХИМИЯ том 88 вып. 5 2023
БИОХИМИЧЕСКИЕ ОСОБЕННОСТИ X/Y-СПЕРМАТОЗОИДОВ
805
процессов, обзорно рассмотренных, например,
ние жизненного цикла сперматозоида остаётся
в статье Vyklicka et al. [13]. Интересно, что даже
открытым.
внутри класса млекопитающих сигнальные
пути, регулирующие подвижность, значитель-
но отличаются [14]. Но среди универсальных
БИОХИМИЧЕСКИЕ ОТЛИЧИЯ
регуляторных событий можно отметить Ca2+-
СПЕРМАТОЗОИДОВ, НЕСУЩИХ
сигнал и сигнальные пути, ассоциированные
X- ИЛИ Y-ХРОМОСОМУ,
с cAMP-зависимой протеинкиназой А [15].
АССОЦИИРОВАННЫЕ
В общем виде регуляция биения жгутика осу-
С ПОДВИЖНОСТЬЮ
ществляется передачей внешнего сигнала
через элементы плазматической мембраны,
При наличии на пути сперматозоидов к
такие, например, как ионные каналы CatSper
ооциту большого количества потенциально се-
или TRPV4, к регуляторным белковым ком-
лектирующих этапов первичное соотношение
плексам цитоскелета. Как полагают, управ-
полов для быков статистически не отличается
ление размером и формой изгиба жгутика
от соотношения 1 : 1 [23, 24]. Как показывают
определяется комплексом центральных пар
полевые исследования, вторичное соотноше-
микротрубочек и радиальных спиц его струк-
ние полов также даёт близкую к равной вероят-
турной основы - аксонемы, в то время как ко-
ность рождения самцов и самок для основных
лебательное движение осуществляется за счёт
сельскохозяйственных животных
[25]. При-
периферических дуплетов микротрубочек [16].
мечательно, что при этом для сперматозоидов,
Что касается энергетического метабо-
несущих X- или Y-хромосому, показаны биохи-
лизма сперматозоида, то изгибание жгутика
мические отличия, потенциально ассоцииро-
обеспечивается фосфорилированием внешних
ванные с подвижностью. Учитывая схему спер-
динеиновых ручек дуплетов микротрубочек,
матогенеза, эти отличия могут закладываться,
что сопровождается гидролизом ATP. Это при-
начиная с этапа мейотического деления спер-
водит к скольжению микротрубочек аксонемы
матоцитов, на котором появляются гаплоид-
и инициирует биение. Гликолиз, пентозо-
ные сперматиды [26]. Во время мейоза проис-
фосфатный путь и окислительное фосфори-
ходит транскрипционный сайленсинг половых
лирование могут отвечать за накопление ATP
хромосом, но после деления клетки их тран-
в сперматозоиде на разных этапах [17]. Мито-
скрипционная активность частично восстанав-
хондрии, в которых происходит окислительное
ливается [27]. Несмотря на то, что сперматиды
фосфорилирование, находятся исключительно
вплоть до завершения спермиогенеза созрева-
в среднем отделе жгутика, и не совсем ясно,
ют в составе синцитиев, где цитоплазма клеток
как осуществляется доставка ATP на всём его
активно обменивается белками и РНК в соста-
протяжении. На сегодняшний день полага-
ве хроматоидных тел [28], для большого класса
ют, что для млекопитающих ATP, обеспечи-
генов млекопитающих их мРНК накапливается
вающий биение жгутика, образуется преиму-
преимущественно в клетках, в которых при-
щественно в ходе гликолиза [18]. Некоторые
сутствует соответствующий аллель, и это каса-
белки гликолиза входят в состав фиброзного
ется в том числе генов половых хромосом [29].
слоя - особой структуры цитоскелета жгутика,
Другими словами, разница в содержании ДНК
которая позволяет вырабатывать ATP непо-
для X- и Y-популяции сперматозоидов может
средственно в основном отделе жгутика [19].
приводить к фенотипическим отличиям этих
Речь идёт о спермоспецифических изофор-
групп. Информация об исследованиях таких
мах гексокиназы, глицеральдегид-3-фосфат-
отличий на уровне транскриптома и протеома
дегидрогеназы, фосфофруктокиназы и лак-
для бычьей спермы собрана в табл. 1.
татдегидрогеназы [20], некоторые из которых
Разница между сперматозоидами, несу-
обладают повышенной стабильностью в срав-
щими X- или Y-хромосому, подтверждается
нении с соматическими паралогами
[21].
в ряде исследований, в которых проводили
Стоит отметить, что описаны также и факты
дифференциальный анализ таких клеток, раз-
против определяющей роли гликолиза в по-
делённых с помощью проточной цитофлуоро-
движности сперматозоидов - так, спермато-
метрии или методом секвенирования РНК
зоиды многих видов могут оставаться подвиж-
одиночных клеток. Так, для сперматид было
ными в течение длительного периода времени
найдено 150 генов, транскрипция которых была
в среде без субстратов гликолиза [22]. С учётом
ассоциирована с определённой половой хромо-
того, что на разных этапах источник ATP мо-
сомой в клетке [29]. Среди них интересно отме-
жет быть разным, вопрос вклада окислитель-
тить гены, кодирующие гомолог белка, взаи-
ного фосфорилирования и гликолиза в тече-
модействующего с фиброзным слоем (Fsip2l),
БИОХИМИЯ том 88 вып. 5 2023
806
ПОЗДЫШЕВ и др.
Таблица 1. Биохимические различия между популяциями бычьих сперматозоидов, несущих Х- и Y-хромосому
Основные методы исследования
Обнаруженные различия
Ссылка
повышенное накопление мРНК 104 генов
Секвенирование РНК
X-хромосомы и 46 генов Y-хромосомы
[29]
одиночных клеток
в сперматидах с соответствующей половой
хромосомой
Вычитающая подавляющая гибридизация,
кДНК-чип, валидация результатов
31 ген с дифференциальной транскрипцией
[30]
количественной ПЦР
Секвенирование РНК, валидация
3 и 9 микроРНК накапливаются в больших
результатов количественной ПЦР
количествах в Х- и Y-сперматозоидах
[31]
с обратной транскрипцией
соответственно
Двумерный гель-электрофорез,
42 белка имеют разную представленность
масс-спектрометрия, валидация
[32]
в Х- и Y-сперматозоидах
вестерн-блот анализом
Сверхэффективная жидкостная
17 белков имеют разную представленность
хроматография, совмещённая
[33]
в Х- и Y-сперматозоидах
с масс-спектрометрией
8 белков имеют разную представленность
Масс-спектрометрия
[34]
в Х- и Y-сперматозоидах
получены поликлональные антитела,
Иммунологический анализ
обладающие специфичностью только
кроличьей сыворотки против
[35]
к Х- или Y-сперматозоидам, проведена
сексированной спермы
иммунопреципитация антигена
Жидкостная хроматография,
270 белков имеют разную представленность
совмещённая с масс-спектрометрией,
[36]
в Х- и Y-сперматозоидах
валидация вестерн-блот анализом
Биоинформатический анализ
Toll-подобные рецепторы 7/8 представлены
транскрипции половых хромосом,
[37]
в больших количествах на Х-сперматозоидах
иммуноцитохимия
Жидкостная хроматография,
13 белков имеют разную представленность
[38]
совмещённая с масс-спектрометрией
в Х- и Y-сперматозоидах
Иммунологический анализ
получены моноклональные антитела,
мышиной сыворотки против
обладающие специфичностью только
[39]
сексированной спермы
к Y-сперматозоидам
получены поликлональные антитела,
Иммунологический анализ
обладающие специфичностью только
козьей сыворотки против
[40]
к Y-сперматозоидам с белком SRY
сексированной спермы
в качестве антигена
Жидкостная хроматография,
54 белка имеют разную представленность
[41]
совмещённая с масс-спектрометрией
в Х- и Y-сперматозоидах
одну из изоформ киназы пируватдегидрогена-
спермы [30]. В частности, Х-сперматозоиды
зы (Pdk3) и 6-фосфофрукто-2-киназы (Pfkfb1),
несли больше мРНК, кодирующих митохон-
транскрипция которых ассоциирована с
дриальные белки CYTB и ISCU. CYTB - это
X-хромосомой и которые потенциально могут
субъединица комплекса bc1, а ISCU - белок,
быть связаны с подвижностью.
взаимодействующий с Fe-S-кластерами, оба
В работе, в которой проводилось срав-
играют ключевую роль в окислительном фос-
нение транскрипционных профилей бычьих
форилировании. Разница в экспрессии мито-
сперматозоидов, разделённых по полу, мето-
хондриальных генов может быть ассоцииро-
дом вычитающей гибридизации были иденти-
вана с изменениями в характере подвижности,
фицированы гены с дифференциальной экс-
как было показано ранее на других экспери-
прессией в Y- или X-обогащённых популяциях
ментальных моделях. Так, подвижность спер-
БИОХИМИЯ том 88 вып. 5 2023
БИОХИМИЧЕСКИЕ ОСОБЕННОСТИ X/Y-СПЕРМАТОЗОИДОВ
807
матозоида хряка менялась с прогрессивной на
равным распределением в Х- и Y-обогащённой
непрогрессивную при инкубации с D-хлорам-
сперме [34]. Примечательно, что митохондри-
фениколом, который ингибирует трансляцию
альные белки, такие как цитохром с-оксидаза
митохондриальных генов [42]. Интересно, что
и ацетил-CоА-карбоксилаза, также детектиру-
в упомянутой работе среди РНК, для которых
ются в большем количестве в мужских гаметах
была показана разная представленность в Y- и
с Х-хромосомой.
X-сперматозоидах, найдено значительное чис-
Сравнение протеомов X- и Y-сперматозои-
ло некодирующих РНК [30]. Важность неко-
дов быков с помощью жидкостной хромато-
дирующих РНК в отличиях исследуемых групп
графии с масс-спектрометрией показало, что
клеток была подтверждена и в других иссле-
27 белков накапливались в большем количестве
дованиях. Были идентифицированы 3 микро-
в Х-сперме, 3 белка - в Y-сперме, в то время
РНК, которые накапливаются преимуществен-
как 24 белка были обнаружены только в одном
но в мужских гаметах с X-хромосомой, а также
типе сперматозоидов [41]. Среди потенциально
9 микроРНК, специфичных для мужских гамет
ассоциированных с подвижностью белков мож-
с Y-хромосомой [31]. Интересно, что некото-
но отметить фосфоглицератмутазу и кальмоду-
рые из таких микроРНК были среди наиболее
лин, которые детектируются только в гаметах с
представленных при сравнении некодирующе-
Х-хромосомой. Для другого дифференциально-
го транскриптома высоко- и малоподвижных
экспрессируемого белка из данного списка -
популяций бычьей спермы [43]. Приведённые
ARMC12 - также была показана связь с актив-
выше факты говорят о потенциальном участии
ностью биения жгутика [46].
этого типа РНК в регуляции подвижности
Хотя некоторые из упомянутых омикс-
мужских половых клеток.
ных данных требуют верификации, можно
С тех пор, как была показана транскрип-
отметить значительные различия между Х- и
ция генов половых хромосом в сперматидах,
Y-сперматозоидами, которые связаны с орга-
долгое время общепринятым считалось, что
низацией цитоскелета и энергетическим мета-
межклеточные мостики позволяют выравнять
болизмом клеток, что, в свою очередь, может
количество синтезируемых белков в гаметах,
быть связано с особенностями подвижности.
несущих Х- или Y-хромосому [44]. Однако с
Исторически большие надежды возлага-
распространением FACS-технологии разделе-
лись на иммунологические способы сексиро-
ния спермы были получены доказательства
вания сперматозоидов. Методы, основанные
существования белков, накапливаемых только
на свойствах H-Y-антигена, были одними
в одном типе сексированных сперматозои-
из первых попыток разделить по полу сперму
дов. Целая группа работ представляет сравне-
млекопитающих, однако не доказали своей
ние бычьих сперматозоидов, несущих X- или
эффективности [47]. Недавно появился ряд ра-
Y-хромосому, на уровне протеома.
бот, продолжающих это направление, которые
С помощью двумерного гель-электрофо-
посвящены поиску отличий в белках плазмати-
реза были найдены 42 белка с дифференци-
ческой мембраны для X- и Y-сперматозоидов.
альной экспрессией в рассматриваемых груп-
Так, при сравнении сексированных фракций
пах сперматозоидов [32]. Среди находок было
спермы быков восемь белков были обнаружены
много белков энергетического метаболизма,
в больших количествах в сперматозоидах, несу-
таких как субъединица комплекса bc1, субъ-
щих Х-хромосому, и 23 белка - в клетках, несу-
единица β ATP-синтазы, субъединица α изо-
щих Y-хромосому [36]. Интересно, что среди
цитратдегидрогеназы и другие. Также было
белков, детектируемых только в одной популя-
обнаружено неравное количество белков ци-
ции сперматозоидов, оказалась группа белков,
тоскелета; так, в сперматозоидах, несущих
относящихся к регуляции сигнального пути
Х-хромосому, было больше α- и β-тубулина.
Т-клеточных рецепторов. Это соотносится с
Сравнительный анализ сексированных фрак-
исследованиями, в которых было показано, что
ций спермы быка методом сверхэффективной
Toll-подобные рецепторы 7/8 (TLR7/8) обнару-
жидкостной хроматографии, совмещённой
живаются преимущественно на Х-сперматозои-
с масс-спектрометрией, также выявил диф-
дах [37]. Более того, было показано, что актива-
ференциальное накопление белков цитоске-
ция этого рецептора приводит к классическому
лета и ферментов гликолиза [33]. В частности,
сигнальному каскаду - в клетке растёт число
в Х-сперматозоидах детектировали больше
фосфорилированных форм киназы гликоген-
β-тубулина и глицеральдегид-3-фосфатдегид-
синтазы 3 α/β и транскрипционного фактора
рогеназы, для которой ранее была показана
NF-κB. Это ведёт к снижению митохондриаль-
связь с подвижностью [45]. В ещё одном иссле-
ного дыхания, количества ATP и уменьшению
довании протеома было найдено 8 белков с не-
подвижности сперматозоидов [48].
БИОХИМИЯ том 88 вып. 5 2023
808
ПОЗДЫШЕВ и др.
Ещё одно исследование разницы в составе
определённой стадии капацитации [54]. Пока-
белков плазматической мембраны спермато-
зано, что сексированная указанным способом
зоидов с разными половыми хромосомами
сперма имеет отличный по сравнению с несор-
выявило два белка, менее представленных в
тированным образцом состав белков энерге-
Y-сперме, а также 4 и 7 белков, детектируемых в
тического метаболизма, структурных белков
клетках только с Х- или только с Y-хромосомой
жгутика, белков, вовлечённых в капацитацию
соответственно [38]. Среди белков, специфич-
и акросомную реакцию [55]. То есть некото-
ных для X-сперматозоидов, можно отметить ке-
рые из находок, описанных в таблице 1, могут
ратин двух типов: кератин 19 (тип I) и кератин 5
относиться не к природе X- или Y-спермато-
(тип II). Кератины синтезируются в течение
зоидов, а, например, к артефактным особенно-
сперматогенеза и обнаруживаются в составе
стям сильно или слабо флуоресцирующей при
фиброзного слоя и наружных плотных фи-
окраске Хёхст 33342 популяции клеток.
брилл жгутика сперматозоида. На уровне белка
в сперматозоидах быка ранее был обнаружен
кератин 19 (тип I) [49], также в бычьих сперма-
РАЗМЕРЫ И КИНЕТИЧЕСКИЕ
тозоидах показано наличие мРНК кератина 8
ПАРАМЕТРЫ СПЕРМАТОЗОИДОВ,
(тип II) [50]. О функции и регуляции этих бел-
НЕСУЩИХ X- И Y-ХРОМОСОМЫ
ков известно немного. Что касается связи этих
белков с подвижностью, то показано, что кера-
Цитофлуорометрический метод сортиров-
тин 1 (тип II) накапливается в больших коли-
ки спермы основан на том, что X-сперматозои-
чествах в жгутиках сперматозоидов мужчин с
ды быков содержат в среднем на 3,9% больше
астенозооспермией [51]. Также известно, что
ДНК, чем клетки, несущие Y-хромосому [56].
для мышей мутация гена, кодирующего кера-
При этом информация о разнице в размере
тин 9 (тип I), приводит к формированию спер-
головки Х- и Y-сперматозоида противоречива.
матозоидов с дефектными жгутиками [52].
Согласно одним исследованиям, объём голов-
Для поиска отличий в белковом составе
ки Х-сперматозоида быков также больше на
сперматозоидов с разными половыми хромо-
3,5-4% [57, 58], другие работы такой разницы
сомами применялись также иммунологические
не подтверждают [59]. Исследование с помо-
подходы. Так, была получена сыворотка кроли-
щью атомно-силовой микроскопии, позво-
ка с антителами против сексированной бычьей
ляющей получить информацию о трёхмерной
спермы двух типов. Результаты иммунофлуорес-
структуре клеток и их поверхности по 23 пара-
центной окраски сперматозоидов с помощью
метрам, не выявило значимых отличий в раз-
полученных антител и проточной цитофлуори-
мере сперматозоидов быков
[60]. Похожая
метрии подтвердили их специфичность по отно-
ситуация с вопросом о сравнении размеров
шению к клеткам с определённым типом поло-
сперматозоидов, несущих разные половые хро-
вой хромосомы [35]. Похожая стратегия поиска
мосомы, складывалась и для человека - при
привела к изоляции антитела к Y-сперматозои-
том, что долгое время считалось, что разница
ду из мышиной сыворотки [39]. Интересно, что
существует [61], последние работы на основе
полученные антитела удалось использовать для
данных фазово-контрастной микроскопии это-
сексирования бычьей спермы с помощью им-
го не подтверждают [62].
муномагнитной сепарации [53]. Также иммуно-
В любом случае доказанная разница в со-
логический подход позволил идентифицировать
держании ДНК заставляет исследователей ис-
белок SRY в качестве специфичного маркера
кать и другие особенности этих клеток, в том
Y-несущих сперматозоидов [40].
числе в характеристиках подвижности. Значи-
Упомянутые в данном разделе отличия в
мые отличия показаны только для их средне-
протеоме сперматозоидов, несущих Y- или
го углового перемещения и прямолинейности
Х-хромосому быков, найдены с использова-
пути. Так, было показано, что траектория дви-
нием сортированной спермы. При этом стоит
жения Х-несущих сперматозоидов более ли-
учитывать, что ряд изменений в белковом со-
нейная по сравнению с Y-несущими [63]. При
ставе мог произойти вследствие самой про-
исследовании подвижности сортированных
точной цитофлуорометрической сортировки.
сперматозоидов быков в объёме Y-спермато-
Эти изменения могут быть результатом необ-
зоиды имели бо льшую склонность к спираль-
ходимых для разделения процедур, таких как
ным траекториям [64].
окраска ядер интеркалирующим красителем
Общее количество прогрессивно-подвиж-
Хёхст 33342, воздействие лазера, смена буфера,
ных клеток в замороженной-оттаянной сорти-
или результатом отбора популяции спермато-
рованной сперме быков, обогащённой Y- или
зоидов определённого состояния, например,
X-несущими клетками, статистически неот-
БИОХИМИЯ том 88 вып. 5 2023
БИОХИМИЧЕСКИЕ ОСОБЕННОСТИ X/Y-СПЕРМАТОЗОИДОВ
809
личимо [65], однако отобранная на сортере
ток. После публикации об обогащении челове-
популяция Y-сперматозоидов дольше сохра-
ческой спермы Y-несущими гаметами при цен-
няет подвижность в экспериментах in vitro [66],
трифугировании в градиенте альбумина [69],
что может быть связано с упомянутыми ранее
результаты которой были оспорены позднее,
особенностями энергетического метаболизма.
началась эра исследований, посвящённых раз-
Интересно, что для интактной спермы соотно-
работке протокола, позволяющего отделить X-
шение сперматозоидов, несущих Х- и Y-хромо-
и Y-сперматозоиды, используя особенности их
сому, не меняется в течение продолжительной
подвижности. В следующем разделе приведены
инкубации при физиологических значениях
результаты экспериментов, опубликованные не
рН, что было показано для хряка и для челове-
более чем в последние 20 лет, и касающиеся ука-
ка [67]. Это, как было отмечено ранее, говорит
занных методов сексирования семени быков.
о том, что не все свойства отобранных с помо-
щью проточной цитофлуорометрии популя-
ций присущи всем сперматозоидам с X- или
МЕТОДЫ СЕКСИРОВАНИЯ СПЕРМЫ,
Y-хромосомой. Важно отметить, что в тестах
ОСНОВАННЫЕ НА ПОДВИЖНОСТИ
на подвижность с хемотаксисом, индуцирован-
СПЕРМАТОЗОИДОВ
ным прогестероном, сортированная и несорти-
рованная популяция бычьих сперматозоидов
Классические методы, позволяющие разде-
ведёт себя одинаково [68].
лить клетки с разной подвижностью, сводятся к
Методы, основанные на подвижности спер-
разделению в градиенте плотности и разделению
матозоидов, первоначально использовались для
методом всплытия «swim-up». Существуют и
очистки и селекции активно-подвижных кле-
другие методы, основанные на подвижности,
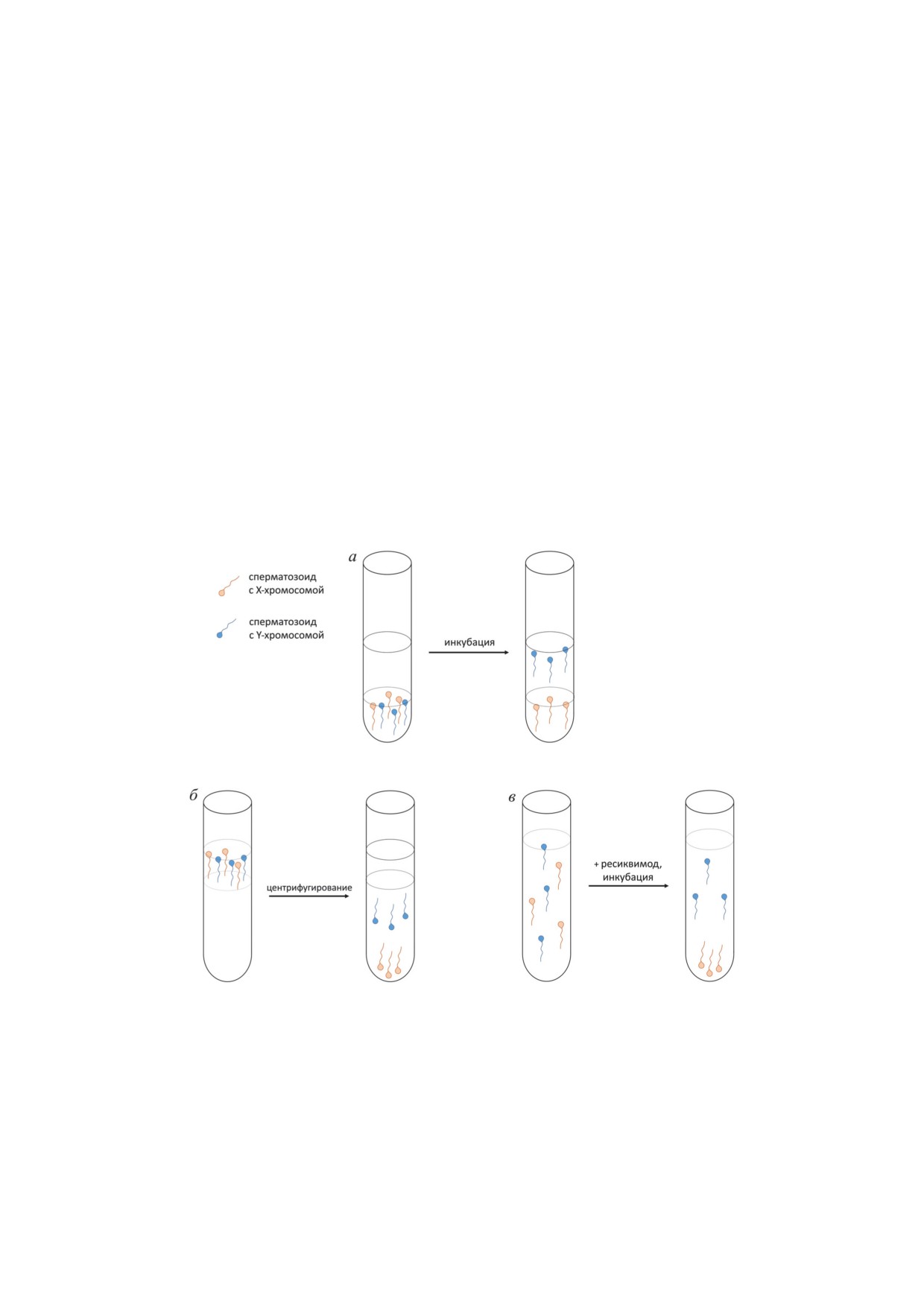
Схема основных методов разделения спермы на фракции, обогащённые сперматозоидами с X- или Y-хромосомой,
основанные на особенностях подвижности этих клеток. а - Метод всплытия или swim-up метод. На сперму наслаива-
ется специальная среда, в которую в течение инкубации выходят преимущественно Y-сперматозоиды. Большая часть
Х-сперматозоидов остаётся в нижнем слое. Метод может быть дополнен центрифугированием на начальном этапе
для осаждения клеток на дно пробирки. б - Метод разделения в градиенте плотности. Сперма наслаивается на бу-
фер с градиентом концентрации коллоидных частиц (например, Percoll) с повышением плотности ко дну пробирки.
Центрифугирование приводит к миграции клеток с Х-хромосомой в нижние слои, в то время как Y-сперматозоиды
концентрируются в средних слоях. Метод может быть модифицирован повторным центрифугированием собранных
фракций. в - Метод специфического подавления подвижности сперматозоидов с помощью активации рецептора
TLR8. В буфер со спермой добавляют ресиквимод, активирующий TLR8 на поверхности Х-сперматозоидов, что при-
водит к их обездвиживанию; после инкубации верхние слои обогащены Y-сперматозоидами. И нижняя, и верхняя
фракция после отмывки пригодны к оплодотворению in vitro. Метод может быть дополнен swim-up процедурой после
добавления ресиквимода
БИОХИМИЯ том 88 вып. 5 2023
810
ПОЗДЫШЕВ и др.
Таблица 2. Исследования, в ходе которых были описаны методы разделения спермы на фракции, обогащённые
сперматозоидами с X- или Y-хромосомой, основанные на особенностях подвижности
Метод обогащения спермы
Метод определения
Соотношение X : Y
сперматозоидами
соотношения X : Y
после обогащения
Ссылка
с X- или Y-хромосомой
после процедуры обогащения
(максимальный результат)
флуоресцентная гибридизация
Swim-up метод
in situ (FISH) сперматозоидов
38 : 62
[74]
в колонках длиной 30 см
и эмбрионов
пол потомства после
Центрифугирование
искусственного осеменения
71,4 : 28,6
[75]
в градиенте плотности Percoll
и переноса эмбриона
Двойное центрифугирование
пол потомства после
66,7 : 33,3
[76]
в градиенте плотности Percoll
искусственного осеменения
Комбинация swim-up метода
и центрифугирования
ПЦР эмбрионов
60,6 : 39,4
[77]
в градиенте плотности Percoll
Центрифугирование
FISH сперматозоидов
55,7 : 44,3
[78]
в градиенте плотности Percoll
Центрифугирование
ПЦР эмбрионов
63 : 37
[79]
в градиенте плотности Percoll
Swim-up метод
41,6 : 58,4
ПЦР эмбрионов
[80]
Центрифугирование
63,4 : 36,6
в градиенте плотности Percoll
Двойной swim-up метод
ПЦР сперматозоидов
67 : 33
[81]
с добавлением гепарина
Центрифугирование
ПЦР сперматозоидов
62 : 38
[82]
в градиенте плотности Percoll
и эмбрионов
Swim-up метод
Есть смещение
ПЦР сперматозоидов
[83]
в колонках длиной 30 см
в сравнении с контролем
Swim-up метод
23 из 23 самцы
[84]
пол потомства после
Центрифугирование
искусственного осеменения
4 : 96
в градиенте плотности Percoll
Модифицированный swim-up
ПЦР эмбрионов
7,1 : 92,9
[85]
метод (добавление ресиквимода)
среди которых можно выделить микрофлюид-
сти и нежелательные клеточные включения
ные технологии [70] и метод селекции на ко-
остаются в верхних слоях, а зрелые спермато-
лонках из стекловолокна [71], стеклянных гра-
зоиды с нормальной морфологией проходят
нул или декстранового геля.
в более плотные слои, причём более подвиж-
Разделение при центрифугировании в гра-
ные сперматозоиды способны ориентировать
диенте плотности осуществляется наслаива-
головку вдоль действия центрифужной силы и
нием спермы на буфер с градиентом концен-
достигать дна пробирки. Существуют модифи-
трации коллоидных частиц (например, Percoll)
кации метода, позволяющие масштабировать
или какого-либо инертного растворимого ве-
данную процедуру [72].
щества (например, сахарозы) в центрифужной
Метод всплытия или swim-up метод не
пробирке (рис. 1, б). При центрифугировании
обязательно включает в себя этап центри-
лейкоциты, макромолекулы семенной жидко-
фугирования, что, как полагают, позволяет
БИОХИМИЯ том 88 вып. 5 2023
БИОХИМИЧЕСКИЕ ОСОБЕННОСТИ X/Y-СПЕРМАТОЗОИДОВ
811
избежать дополнительного повреждения кле-
её для оплодотворения in vitro. Помимо мы-
ток. Процедура осуществляется наслаиванием
шей и быков, такая процедура описана для
на сперму специальной среды, в которую в
спермы козла, что может говорить об универ-
течение определённого времени (до 60 мин)
сальном механизме регуляции подвижности
выходят морфологически нормальные актив-
через TLR8
[86]. Наличие переключателя,
но-подвижные сперматозоиды (рис. 1, а). Не-
специфически снижающего активность жгу-
желательные клеточные включения в данном
тика сперматозоида с определённой половой
случае остаются в нижнем слое пробирки. Оп-
хромосомой, может подарить второе дыхание
тимизация времени процедуры и масштабиро-
классическим методам отбора, основанным на
вание метода возможно с помощью специаль-
подвижности.
ных устройств, например, описанных в работе
Meitei et al. [73]. Возможны вариации метода,
когда осадок сперматозоидов, полученный
ЗАКЛЮЧЕНИЕ
после центрифугирования в градиенте плот-
ности, инкубируют в среде для всплытия, что
За долгую историю разработки методов,
позволяет увеличить чистоту и качество ото-
основанных на разделении сперматозоидов по
бранной популяции.
подвижности, так и не удалось получить надёж-
В табл. 2 приведены результаты экспери-
ный протокол, дающий значительное обогаще-
ментов, в которых указанными методами пред-
ние образца клетками с определённой половой
приняты попытки обогатить сперму быков X-
хромосомой. Это означает, что использование
или Y-сперматозоидами. В таблице отдельно
сексированной спермы в протоколах вспомога-
отмечены методы оценки результата отбора.
тельных репродуктивных технологий человека
Центрифугирование в градиенте плотно-
вряд ли возможно. При этом в животновод-
сти увеличивает процент активно-подвижных
стве применение сексированной спермы также
сперматозоидов в образце, а также позволяет
оправдано лишь при достижении определённо-
отобрать морфологически нормальные спер-
го уровня обогащения.
матозоиды, не повреждая геномную ДНК.
Новые данные по дифференциальной
Swim-up метод даёт более низкий выход, но
протеомике X- и Y-сперматозоидов позволя-
считается более мягким методом обогаще-
ют прогнозировать, что через избирательное
ния. Указанные факторы делают эти методы
влияние на подвижность этих клеток можно
привлекательными для сексирования, однако
добиться значительного изменения соотно-
маленький размер выборки в приведённых в
шения X- и Y-сперматозоидов в процессиро-
табл. 2 статьях, а также противоречивость не-
ванном образце, что может внести свой вклад
которых данных в настоящий момент позво-
в эффективность животноводства. Нельзя ис-
ляет давать лишь очень осторожный прогноз
ключать, что успехи в разделении X- и Y-спер-
для применения данных методов. Стоит также
матозоидов позволят применять этот подход
обратить внимание, что, помимо невысоких
и в медицине как альтернативу преимпланта-
уровней обогащения образцов сперматозоида-
ционному тестированию в тех случаях, когда
ми, несущими определённую половую хромо-
необходимо избежать генетических заболева-
сому, некоторые авторы отмечают, что резуль-
ний, сцепленных с полом.
таты обогащения сильно зависят от исходного
образца.
Вклад авторов. Д.В. Поздышев, В.И. Му-
Революционной для данной области вы-
ронец - концепция и руководство работой;
глядит технология, использующая разницу в
Д.В. Поздышев, В.И. Муронец - написание
количестве молекул рецептора TLR8 на по-
текста; Н.А. Комбарова - редактирование тек-
верхности X- или Y-сперматозоидов [85]. Было
ста статьи.
показано, что при добавлении его лиганда
Финансирование. Работа выполнена при
ресиквимода клетки, несущие X-хромосому,
финансовой поддержке Российского фонда
теряют подвижность, так как имеют значимо
фундаментальных исследований (проект № 20-
больше таких рецепторов на поверхности. Это
34-80009).
позволяет отбирать обогащённую Y-сперма-
Конфликт интересов. Авторы заявляют об
тозоидами фракцию и после отмывки от ли-
отсутствии конфликта интересов.
ганда проводить оплодотворение полученным
Соблюдение этических норм. Настоящая
образцом (рис. 1, в). Подвижность оставшейся
статья не содержит описания каких-либо ис-
в пробирке фракции, обогащённой Х-спер-
следований с участием людей или животных в
матозоидами, также позволяет использовать
качестве объектов.
БИОХИМИЯ том 88 вып. 5 2023
812
ПОЗДЫШЕВ и др.
СПИСОК ЛИТЕРАТУРЫ
1.
Morrell, J. M. (2011) Artificial Insemination: Current
14.
Kaupp, U. B., and Strünker, T. (2017) Signaling in
and Future Trends (Manafi, M., ed) InTechOpen,
sperm: more different than similar, Trends Cell Biol.,
London, doi: 10.5772/17943.
27, 101-109, doi: 10.1016/j.tcb.2016.10.002.
2.
Johnson, L. A., Welch, G. R., and Rens, W. (1999)
15.
Marquez, B., and Suarez, S. S. (2004) Different sig-
The Beltsville sperm sexing technology: high-speed
naling pathways in bovine sperm regulate capacitation
sperm sorting gives improved sperm output for in vitro
and hyperactivation, Biol. Reprod., 70, 1626-1633, doi:
fertilization and AI, J. Anim. Sci., 77, 213-220, doi:
10.1095/biolreprod.103.026476.
10.2527/1999.77suppl_2213x.
16.
Rudneva, S. A., and Chernykh, V. B. (2018) A mecha-
3.
Reese, S., Pirez, M. C., Steele, H., and Kölle, S.
nism of sperm cilia beating, Androl. Genital Surg., 19,
(2021) The reproductive success of bovine sperm after
15-26, doi: 10.17650/2070-9781-2018-19-3-15-26.
sex-sorting: a meta-analysis, Sci. Rep., 11, 17366, doi:
17.
Miki, K.
(2007) Energy metabolism and sperm
10.1038/s41598-021-96834-2.
function, Soc. Reprod. Fertil. Suppl., 65, 309-325.
4.
Seidel, G. E., Schenk, J. L., Herickhoff, L. A.,
18.
Mukai, C., and Okuno, M. (2004) Glycolysis plays a
Doyle, S. P., Brink, Z., Green, R. D., and Cran,
major role for adenosine triphosphate supplementation
D. G. (1999) Insemination of heifers with sexed
in mouse sperm flagellar movement, Biol. Reprod., 71,
sperm, Theriogenology, 52, 1407-1420, doi: 10.1016/
540-547, doi: 10.1095/biolreprod.103.026054.
s0093-691x(99)00226-5.
19.
Muronetz, V. I., Kuravsky, M. L., Barinova, K. V., and
5.
Vishwanath, R., and Moreno, J. F. (2018) Review:
Schmalhausen, E. V. (2015) Sperm-specific glyceral-
Semen sexing - current state of the art with emphasis
dehyde-3-phosphate dehydrogenase - an evolutionary
on bovine species, Animal, 12, s85-s96, doi: 10.1017/
acquisition of mammals, Biochemistry (Moscow), 80,
S1751731118000496.
1672-1689, doi: 10.1134/S0006297915130040.
6.
Gu, N.-H., Zhao, W.-L., Wang, G.-S., and Sun, F.
20.
Du Plessis, S. S., Agarwal, A., Mohanty, G., and van
(2019) Comparative analysis of mammalian sperm
der Linde, M. (2015) Oxidative phosphorylation versus
ultrastructure reveals relationships between sperm
glycolysis: what fuel do spermatozoa use? Asian J.
morphology, mitochondrial functions and motility,
Androl., 17, 230-235, doi: 10.4103/1008-682X.135123.
Reprod. Biol. Endocrinol., 17, 66, doi: 10.1186/s12958-
21.
Elkina, Y. L., Kuravsky, M. L., El’darov, M. A.,
019-0510-y.
Stogov, S. V., Muronetz, V. I., and Schmalhausen,
7.
Gervasi, M. G., and Visconti, P. E. (2017) Molecular
E. V.
(2010) Recombinant human sperm-specific
changes and signaling events occurring in spermatozoa
glyceraldehyde-3-phosphate dehydrogenase: structural
during epididymal maturation, Andrology, 5, 204-218,
basis for enhanced stability, Biochim. Biophys. Acta,
doi: 10.1111/andr.12320.
1804, 2207-2212, doi: 10.1016/j.bbapap.2010.09.002.
8.
Katz, D. F., and Vanagimachi, R. (1980) Movement
22.
Ford, W. C. (2006) Glycolysis and sperm motility:
characteristics of hamster spermatozoa within the
does a spoonful of sugar help the flagellum go round?
oviduct, Biol. Reprod., 22, 759-764, doi: 10.1095/
Hum. Reprod. Update, 12, 269-274, doi: 10.1093/
biolreprod22.4.759.
humupd/dmi053.
9.
Achikanu, C., Correia, J., Guidobaldi, H. A.,
23.
King, W. A., Yadav, B. R., Xu, K. P., Picard, L.,
Giojalas, L. C., Barratt, C. L. R., Da Silva, S. M.,
Sirard, M. A., Verini Supplizi, A., et al.
(1991)
and Publicover, S. (2019) Continuous behavioural
The sex ratios of bovine embryos produced in vivo
“switching” in human spermatozoa and its regulation
and in vitro, Theriogenology,
36,
779-788, doi:
by Ca2+-mobilising stimuli, Mol. Hum. Reprod., 25,
10.1016/0093-691x(91)90343-c.
423-432, doi: 10.1093/molehr/gaz034.
24.
Machado, G. M., Ferreira, A. R., Guardieiro, M. M.,
10.
Fraser, L. R. (1977) Motility patterns in mouse
Bastos, M. R., Carvalho, J. O., Lucci, C. M., et al.
spermatozoa before and after capacitation, J. Exp.
(2013) Morphology, sex ratio and gene expression of
Zool., 202, 439-444, doi: 10.1002/jez.1402020314.
Day 14 in vivo and in vitro bovine embryos, Reprod.
11.
Eisenbach, M., and Giojalas, L. C. (2006) Sperm
Fertil. Dev., 25, 600, doi: 10.1071/RD11282.
guidance in mammals - an unpaved road to the egg, Nat.
25.
Abecia, J.-A., Arrébola, F., and Palacios, C.
Rev. Mol. Cell Biol., 7, 276-285, doi: 10.1038/nrm1893.
(2017) Offspring sex ratio in sheep, cattle, goats
12.
Morisawa, M., and Yoshida, M. (2005) Activation
and pigs: influence of season and lunar phase at
of motility and chemotaxis in the spermatozoa: from
conception, Biol. Rhythm Res., 48, 417-424, doi:
invertebrates to humans, Reprod. Med. Biol., 4, 101-
10.1080/09291016.2016.1268325.
114, doi: 10.1111/j.1447-0578.2005.00099.x.
26.
Ellis, P. J. I., Yu, Y., and Zhang, S. (2011) Tran-
13.
Vyklicka, L., and Lishko, P. V. (2020) Dissecting the
scriptional dynamics of the sex chromosomes and
signaling pathways involved in the function of sperm
the search for offspring sex-specific antigens in
flagellum, Curr. Opin. Cell Biol., 63, 154-161, doi:
sperm, Reproduction,
142,
609-619, doi:
10.1530/
10.1016/j.ceb.2020.01.015.
REP-11-0228.
БИОХИМИЯ том 88 вып. 5 2023
БИОХИМИЧЕСКИЕ ОСОБЕННОСТИ X/Y-СПЕРМАТОЗОИДОВ
813
27.
Turner, J. M. A., Mahadevaiah, S. K., Ellis, P. J. I.,
proteins associated with plasma membrane in X- and/
Mitchell, M. J., and Burgoyne, P. S. (2006) Pachytene
or Y-chromosome bearing spermatozoa in indicus
asynapsis drives meiotic sex chromosome inactivation
cattle, Reprod. Dom. Anim., 56, 928-935, doi: 10.1111/
and leads to substantial postmeiotic repression in
rda.13936.
spermatids, Dev. Cell, 10, 521-529, doi: 10.1016/
39.
Thaworn, W., Hongsibsong, S., Thongkham, M.,
j.devcel.2006.02.009.
Mekchay, S., Pattanawong, W., and Sringarm, K.
28.
Ventelä, S., Toppari, J., and Parvinen, M.
(2003)
(2022) Production of single-chain fragment variable
Intercellular organelle traffic through cytoplasmic
(scFv) antibodies specific to plasma membrane
bridges in early spermatids of the rat: mechanisms
epitopes on bull Y-bearing sperm, Anim. Biotechnol.,
of haploid gene product sharing, Mol. Biol. Cell, 14,
33, 508-518, doi: 10.1080/10495398.2020.1811294.
2768-2780, doi: 10.1091/mbc.e02-10-0647.
40.
Soleymani, B., Parvaneh, S., and Mostafaie, A. (2019)
29.
Bhutani, K., Stansifer, K., Ticau, S., Bojic, L., Villani,
Goat polyclonal antibody against the sex determining
A.-C., Slisz, J., et al. (2021) Widespread haploid-
region Y to separate X- and Y-chromosome bearing
biased gene expression enables sperm-level natural
spermatozoa, Rep. Biochem. Mol. Biol., 8, 326-334.
selection, Science, 371, eabb1723, doi: 10.1126/science.
41.
Sharma, V., Verma, A. K., Sharma, P., Pandey, D.,
abb1723.
and Sharma, M. (2022) Differential proteomic profile
30.
Chen, X., Yue, Y., He, Y., Zhu, H., Hao, H.,
of X- and Y-sorted Sahiwal bull semen, Res. Vet. Sci.,
Zhao, X., et al. (2014) Identification and character-
144, 181-189, doi: 10.1016/j.rvsc.2021.11.013.
ization of genes differentially expressed in X and Y
42.
Zhu, Z., Umehara, T., Okazaki, T., Goto, M.,
sperm using suppression subtractive hybridization and
Fujita, Y., Hoque, S. A. M., et al. (2019) Gene
cDNA microarray, Mol. Reprod. Dev., 81, 908-917,
Expression and protein synthesis in mitochondria
doi: 10.1002/mrd.22386.
enhance the duration of high-speed linear motility
31.
Zhou, H., Liu, J., Sun, W., Ding, R., Li, X.,
in boar sperm, Front. Physiol., 10, 252, doi: 10.3389/
Shangguan, A., et al. (2020) Differences in small
fphys.2019.00252.
noncoding RNAs profile between bull X and Y sperm,
43.
Capra, E., Turri, F., Lazzari, B., Cremonesi, P.,
PeerJ, 8, e9822, doi: 10.7717/peerj.9822.
Gliozzi, T. M., Fojadelli, I., et al. (2017) Small RNA
32.
Chen, X., Zhu, H., Wu, C., Han, W., Hao, H.,
sequencing of cryopreserved semen from single
Zhao, X., et al. (2012) Identification of differen-
bull revealed altered miRNAs and piRNAs expres-
tially expressed proteins between bull X and Y sper-
sion between High- and Low-motile sperm popula-
matozoa, J. Proteomics,
77,
59-67, doi:
10.1016/
tions, BMC Genomics, 18, 14, doi: 10.1186/s12864-
j.jprot.2012.07.004.
016-3394-7.
33.
De Canio, M., Soggiu, A., Piras, C., Bonizzi, L.,
44.
Hendriksen, P. J. M. (1999) Do X and Y spermatozoa
Galli, A., Urbani, A., et al. (2014) Differential protein
differ in proteins? Theriogenology,
52,
1295-1307,
profile in sexed bovine semen: shotgun proteomics
doi: 10.1016/S0093-691X(99)00218-6.
investigation, Mol. Biosyst.,
10,
1264-1271, doi:
45.
Elkina, Y. L., Atroshchenko, M. M., Bragina, E. E.,
10.1039/c3mb70306a.
Muronetz, V. I., and Schmalhausen, E. V.
(2011)
34.
Scott, C., de Souza, F. F., Aristizabal, V. H. V.,
Oxidation of glyceraldehyde-3-phosphate dehydroge-
Hethrington, L., Krisp, C., Molloy, M., et al. (2018)
nase decreases sperm motility, Biochemistry (Moscow),
Proteomic profile of sex-sorted bull sperm evaluated
76, 268-272, doi: 10.1134/s0006297911020143.
by SWATH-MS analysis, Anim. Reprod. Sci., 198, 121-
46.
Shimada, K., Park, S., Miyata, H., Yu, Z.,
128, doi: 10.1016/j.anireprosci.2018.09.010.
Morohoshi, A., Oura, S., et al. (2021) ARMC12
35.
Sang, L., Yang, W. C., Han, L., Liang, A. X., Hua,
regulates spatiotemporal mitochondrial dynamics
G. H., Xiong, J. J., et al. (2011) An immunological
during spermiogenesis and is required for male
method to screen sex-specific proteins of bovine
fertility, Proc. Natl. Acad. Sci. USA, 118, e2018355118,
sperm, J. Dairy Sci., 94, 2060-2070, doi: 10.3168/
doi: 10.1073/pnas.2018355118.
jds.2010-3350.
47.
Hoppe, P. C., and Koo, G. C. (1984) Reacting mouse
36.
Shen, D., Zhou, C., Cao, M., Cai, W., Yin, H.,
sperm with monoclonal H-Y antibodies does not
Jiang, L., et al. (2021) Differential membrane protein
influence sex ratio of eggs fertilized in vitro, J. Reprod.
profile in bovine X- and Y-Sperm, J. Proteome Res.,
Immunol., 6, 1-9, doi: 10.1016/0165-0378(84)90036-6.
20, 3031-3042, doi: 10.1021/acs.jproteome.0c00358.
48.
Ren, F., Xi, H., Ren, Y., Li, Y., Wen, F., Xian, M.,
37.
Umehara, T., Tsujita, N., and Shimada, M. (2019)
et al.
(2021) TLR7/8 signalling affects X-sperm
Activation of Toll-like receptor 7/8 encoded by the
motility via the GSK3 α/β-hexokinase pathway for
X chromosome alters sperm motility and provides a
the efficient production of sexed dairy goat embryos,
novel simple technology for sexing sperm, PLoS Biol.,
J. Anim. Sci. Biotechnol.,
12,
89, doi:
10.1186/
17, e3000398, doi: 10.1371/journal.pbio.3000398.
s40104-021-00613-y.
38.
Laxmivandana, R., Patole, C., Sharma, T. R.,
49.
Hinsch, E., Boehm, J. G., Groeger, S., Mueller-
Sharma, K. K., and Naskar, S. (2021) Differential
Schloesser, F., and Hinsch, K. D. (2003) Identification
БИОХИМИЯ том 88 вып. 5 2023
814
ПОЗДЫШЕВ и др.
of cytokeratins in bovine sperm outer dense fibre
size of X and Y chromosome-bearing bovine sperm
fractions, Reprod. Domest. Anim., 38, 155-160, doi:
heads assessed by atomic force microscopy, PLoS One,
10.1046/j.1439-0531.2003.00408.x.
8, e59387, doi: 10.1371/journal.pone.0059387.
50.
Feugang, J. M., Rodriguez-Osorio, N., Kaya, A.,
61.
Cui, K. H., and Matthews, C. D. (1993) X larger than
Wang, H., Page, G., Ostermeier, G. C., et al. (2010)
Y, Nature, 366, 117-118, doi: 10.1038/366117b0.
Transcriptome analysis of bull spermatozoa: impli-
62.
Zavaczki, Z., Celik-Ozenci, C., Ovari, L., Jakab, A.,
cations for male fertility, Reprod. Biomed. Online, 21,
Sati, G. L., Ward, D. C., et al. (2006) Dimensional
312-324, doi: 10.1016/j.rbmo.2010.06.022.
assessment of X-bearing and Y-bearing haploid and
51.
Hashemitabar, M., Sabbagh, S., Orazizadeh, M.,
disomic human sperm with the use of fluorescence
Ghadiri, A., and Bahmanzadeh, M. (2015) A proteom-
in situ hybridization and objective morphometry,
ic analysis on human sperm tail: comparison between
Fertil. Steril., 85, 121-127, doi: 10.1016/j.fertnstert.
normozoospermia and asthenozoospermia, J. Assist.
2005.07.1295.
Reprod. Genet., 32, 853-863, doi: 10.1007/s10815-
63.
Penfold, L. M., Holt, C., Holt, W. V., Welch, G. R.,
015-0465-7.
Cran, D. G., and Johnson, L. A. (1998) Compar-
52.
Rivkin, E., Eddy, E. M., Willis, W. D., Goulding,
ative motility of X and Y chromosome-bearing bo-
E. H., Suganuma, R., Yanagimachi, R., et al. (2005)
vine sperm separated on the basis of DNA content
Sperm tail abnormalities in mutant mice withneor
by flow sorting, Mol. Reprod. Dev., 50, 323-327,
gene insertion into an intron of the keratin 9 gene, Mol.
doi: 10.1002/(SICI)1098-795(199807)50:3<323::AID-
Reprod. Dev., 72, 259-271, doi: 10.1002/mrd.20335.
MRD8>3.0.CO;2-L.
53.
Sringarm, K., Thongkham, M., Mekchay, S.,
64.
Daloglu, M. U., Lin, F., Chong, B., Chien, D.,
Lumsangkul, C., Thaworn, W., Pattanawong, W.,
Veli, M., Luo, W., et al. (2018) 3D imaging of sex-
et al. (2022) High-efficiency bovine sperm sexing
sorted bovine spermatozoon locomotion, head spin
used magnetic-activated cell sorting by coupling scFv
and flagellum beating, Sci. Rep.,
8,
15650, doi:
antibodies specific to Y-chromosome-bearing sperm
10.1038/s41598-018-34040-3.
on magnetic microbeads, Biology (Basel), 11, 715,
65.
Carvalho, J. O., Sartori, R., Machado, G. M., Mourão,
doi: 10.3390/biology11050715.
G. B., and Dode, M. (2010) Quality assessment of
54.
Bucci, D., Galeati, G., Tamanini, C., Vallorani, C.,
bovine cryopreserved sperm after sexing by flow
Rodriguez-Gil, J. E., and Spinaci, M. (2012) Effect
cytometry and their use in in vitro embryo pro-
of sex sorting on CTC staining, actin cytoskeleton
duction, Theriogenology, 74, 1521-1530, doi: 10.1016/
and tyrosine phosphorylation in bull and boar
j.theriogenology.2010.06.030.
spermatozoa, Theriogenology,
77,
1206-1216, doi:
66.
Holden, S. A., Murphy, C., Moreno, J. F., Butler,
10.1016/j.theriogenology.2011.10.028.
S. T., Cromie, A. R., Lonergan, P., et al. (2017) In
55.
Mostek, A., Janta, A., and Ciereszko, A. (2020) Pro-
vitro characterisation of fresh and frozen sex-sorted
teomic comparison of non-sexed and sexed (X-bear-
bull spermatozoa, Reprod. Fertil. Dev., 29, 1415-1425,
ing) cryopreserved bull semen, Anim. Reprod. Sci.,
doi: 10.1071/RD16086.
221, 106552, doi: 10.1016/j.anireprosci.2020.106552.
67.
Park, Y. J., Kwon, K. J., Song, W. H., Pang, W. K.,
56.
Garner, D. L., and Seidel Jr., G. E. (2003) Past,
Ryu, D. Y., Saidur Rahman, M., and Pang, M. G.
present and future perspectives on sexing sperm,
(2021) New technique of sex preselection for increas-
Can. J. Anim. Sci., 83, 375-384, doi: 10.4141/A03-022.
ing female ratio in boar sperm model, Reprod. Domest.
57.
Van Munster, E. B., Stap, J., Hoebe, R. A., te Meer-
Anim., 56, 333-341, doi: 10.1111/rda.13870.
man, G. J., and Aten, J. A. (1999) Difference in
68.
Dominguez, E. M., Moreno-Irusta, A., Guidobaldi,
volume of X- and Y-chromosome-bearing bovine
H. A., Tribulo, H., and Giojalas, L. C.
(2018)
sperm heads matches difference in DNA content,
Improved bovine in vitro embryo production with
Cytometry, 35, 125-128, doi: 10.1002/(sici)1097-0320
sexed and unsexed sperm selected by chemotaxis,
(19990201)35:2<125::aid-cyto3>3.0.co;2-h.
Theriogenology, 22, 1-8, doi: 10.1016/j.theriogenology.
58.
Santolaria, P., Pauciullo, A., Silvestre, M. A., Vicente-
2018.08.023.
Fiel, S., Villanova, L., Pinton, A., et al.
(2016)
69.
Ericsson, R. J., Langevin, C. N., and Nishino, M.
Computer-assisted sperm morphometry fluorescence-
(1973) Isolation of fractions rich in human Y sperm,
based analysis has potential to determine progeny
Nature, 246, 421-424, doi: 10.1038/246421a0.
sex, Asian J. Androl., 18, 858-862, doi: 10.4103/
70.
Neculai-Valeanu, A.-S., and Ariton, A. M. (2021)
1008-682X.187578.
Game-changing approaches in sperm sex-sorting: mi-
59.
Révay, T., Nagy, S., Kovács, A., Edvi, M. E., Hidas, A.,
crofluidics and nanotechnology, Animals, 11, 1182,
Rens, W., et al. (2004) Head area measurements of
doi: 10.3390/ani11041182.
dead, live, X- and Y-bearing bovine spermatozoa,
71.
Arzondo, M. M., Caballero, J. N., Marín-Briggiler,
Reprod. Fertil. Dev., 16, 681-687, doi: 10.1071/rd04013.
C. I., Dalvit, G., Cetica, P. D., and Vazquez-Levin,
60.
Carvalho, J. O., Silva, L. P., Sartori, R., and Dode, M.
M. H. (2012) Glass wool filtration of bull cryopreserved
A. N. (2013) Nanoscale differences in the shape and
semen: a rapid and effective method to obtain a high
БИОХИМИЯ том 88 вып. 5 2023
БИОХИМИЧЕСКИЕ ОСОБЕННОСТИ X/Y-СПЕРМАТОЗОИДОВ
815
percentage of functional sperm, Theriogenology, 78,
(2009) Effect of Percoll volume, duration and force of
201-209, doi: 10.1016/j.theriogenology.2012.02.001.
centrifugation, on in vitro production and sex ratio of
72.
Thys, M., Vandaele, L., Morrell, J., Mestach, J., Van
bovine embryos, Theriogenology, 71, 1289-1297, doi:
Soom, A., Hoogewijs, M., et al. (2009) In vitro fer-
10.1016/j.theriogenology.2009.01.002.
tilizing capacity of frozen-thawed bull spermatozoa
80.
Wolf, C. A., Brass, K., Rubin, M. I. B., Pozzobon,
selected by Single-layer (Glycidoxypropyltrimethox-
S. E., Mozzaquatro, F., and De la Côrte, F. D. (2008)
ysilane) silane-coated silica colloidal centrifugation,
The effect of sperm selection by Percoll or swim-up
Reprod. Domest. Anim., 44, 390-394, doi: 10.1111/
on the sex ratio of in vitro produced bovine embryos,
j.1439-0531.2008.01081.x.
Anim. Reprod., 5, 110-115.
73.
Meitei, H. Y., Uppangala, S., Sharan, K., Chandra-
81.
Madrid-Bury, N., Fernández, R., Jiménez, A., Pérez-
guthi, S. G., Radhakrishnan, A., Kalthur, G., et al.
Garnelo, S., Nuno Moreira, P., Pintado, B., et al.
(2021) A simple, centrifugation-free, sperm-sorting de-
(2003) Effect of ejaculate, bull, and a double swim-up
vice eliminates the risks of centrifugation in the swim-
sperm processing method on sperm sex ratio, Zygote,
up method while maintaining functional competence
11, 229-235, doi: 10.1017/S0967199403002272.
and DNA integrity of selected spermatozoa, Reprod.
82.
Resende, M. V., Lucio, A. C., Perini, A. P., Oliveira,
Sci., 28, 134-143, doi: 10.1007/s43032-020-00269-5.
L. Z., Almeida, A. O., Alves, B. C. A., et al. (2011)
74.
Azizeddin, A., Ashkar, F., King, W., and Revay, T.
Comparative validation using quantitative real-time
(2014) Enrichment of Y-chromosome-bearing bull
PCR (qPCR) and conventional PCR of bovine semen
spermatozoa by swim-up through a column, Reprod.
centrifuged in continuous density gradient, Arq.
Dom. Anim., 49, 1-4, doi: 10.1111/rda.12252.
Bras. Med. Vet. Zootec., 63, 544-551, doi: 10.1590/
75.
Promthep, K., Satitmanwiwat, S., Kitiyanant, N.,
S0102-09352011000300002.
Tantiwattanakul, P., Jirajaroenrat, K., Sitthigripong, R.,
83.
Asma-ul-Husna, Awan, M. A., Mehmood, A.,
et al. (2016) Practical use of percoll density gradient
Sultana, T., Shahzad, Q., Ansari, M. S., et al. (2017)
centrifugation on sperm sex determination in com-
Sperm sexing in Nili-Ravi buffalo through modi-
mercial dairy farm in Thailand, IJAR, 50, 310-313,
fied swim up: Validation using SYBR green real-time
doi: 10.18805/ijar.8427.
PCR, Anim. Reprod. Sci., 182, 69-76, doi: 10.1016/
76.
Bhat, Y., and Sharma, M. (2020) X-sperm enrichment
j.anireprosci.2017.04.011.
of bovine semen by Percoll density gradient method
84.
Meles, D. K., Mustofa, I., Hariadi, M., Wurlina, W.,
and its effect on semen quality, sex ratio and concep-
Susilowati, S., Amaliya, A., et al. (2022) The enriched
tion rate, IJAR, 54, 1181-1187.
Y-bearing sperm combined with delayed fixed-time
77.
Lucio, A. C., Resende, M. V., Dernowseck-Meirelles,
artificial insemination for obtaining male Simmental
J. A., Perini, A. P., Oliveira, L. Z., Miguel, M. C. V.,
crossbred offspring, Vet. World,
15,
102-109,
et al. (2012) Assessment of swim-up and discontinuous
doi: 10.14202/vetworld.2022.102-109.
density gradient in sperm sex preselection for bovine
85.
Umehara, T., Tsujita, N., Zhu, Z., Ikedo, M.,
embryo production, Arq. Bras. Med. Vet. Zootec., 64,
and Shimada, M.
(2020) A simple sperm-sexing
525-532, doi: 10.1590/S0102-09352012000300001.
method that activates TLR7/8 on X sperm for
78.
Kobayashi, J., Oguro, H., Uchida, H., Kohsaka, T.,
the efficient production of sexed mouse or cattle
Sasada, H., and Sato, E. (2004) Assessment of bovine
embryos,Nat.Protoc.,15,2645-2667,doi:10.1038/s41596-
X- and Y-bearing spermatozoa in fractions by dis-
020-0348-y.
continuous percoll gradients with rapid fluorescence
86.
Huang, M., Cao, X. Y., He, Q. F., Yang, H. W., Chen,
in situ hybridization, J. Reprod. Dev., 50, 463-469,
Y. Z., Zhao, J. L., et al. (2022) Alkaline semen diluent
doi: 10.1262/jrd.50.463.
combined with R848 for separation and enrichment of
79.
Machado, G. M., Carvalho, J. O., Filho, E. S.,
dairy goat X-sperm, J. Dairy Sci., 105, 10020-10032,
Caixeta, E. S., Franco, M. M., Rumpf, R., et al.
doi: 10.3168/jds.2022-22115.
BIOCHEMICAL FEATURES OF X OR Y CHROMOSOME BEARING
SPERMATOZOA FOR SPERM SEXING
Review
D. V. Pozdyshev1*, N. A. Kombarova2, and V. I. Muronetz1,3
1 Belozersky Institute of Physico-Chemical Biology, Lomonosov Moscow State University,
119992 Moscow, Russia; e-mail: denispoz@gmail.com
БИОХИМИЯ том 88 вып. 5 2023
816
ПОЗДЫШЕВ и др.
2 Head Center for Reproduction of Agricultural Animals,
142143 Bykovo, Moscow Region, Russia
3 Faculty of Bioengineering and Bioinformatics, Lomonosov Moscow State University,
119234 Moscow, Russia
This review presents information on the biochemical features of spermatozoa bearing an X or Y chromo-
some, enabling to obtain a sperm fraction with a pre-defined sex chromosome. Almost the only technology
currently used for such separation (called sexing) is based on sperm fluorescence-activated cell sorting in
regard to DNA content. Besides its applications, this technology made it possible to analyze the properties
of isolated populations of spermatozoa bearing an X or Y chromosome. In recent years, a number of works
have appeared proving the existence of differences between these populations at the transcriptome and pro-
teome level. It is noteworthy that these differences are primarily related to energy metabolism and structural
proteins of the flagellum. New methods of sperm enrichment with X or Y chromosome cells are based on
the differences in motility between spermatozoa with different sex chromosomes. Sperm sexing is a wide-
spread part of the protocol of artificial insemination of cows with cryopreserved semen, it allows to increase
the proportion of offspring of the required sex. In addition, advances in the separation of X and Y spermato-
zoa may allow this approach to be applied in clinical practice to avoid sex-linked diseases.
Keywords: X/Y spermatozoa, sperm motility, sexing
БИОХИМИЯ том 88 вып. 5 2023