БИОХИМИЯ, 2023, том 88, вып. 5, с. 832 - 840
УДК 577.2.08; 57.088
ОБНАРУЖЕНИЕ СПЕЦИФИЧЕСКИХ РНК-МИШЕНЕЙ
С ПОМОЩЬЮ МУЛЬТИМЕРИЗАЦИИ
© 2023 А.Р. Сахабутдинова, А.В. Чемерис, Р.Р. Гарафутдинов*
Институт биохимии и генетики
Уфимского федерального исследовательского центра Российской академии наук,
450054 Уфа, Башкортостан, Россия; электронная почта: garafutdinovr@gmail.com
Поступила в редакцию 22.11.2022
После доработки 26.02.2023
Принята к публикации 09.03.2023
Обнаружение специфических РНК-мишеней с помощью методов, основанных на амплификации,
широко используется в фундаментальных исследованиях и медицине ввиду высокой значимости
роли, которую молекулы РНК играют при реализации генетической информации и развитии забо-
леваний. В данной работе описан подход к обнаружению РНК-мишеней, в основе которого лежит
особый вид изотермической амплификации - реакция мультимеризации нуклеиновых кислот.
Предлагаемый метод требует использования только одного фермента - ДНК-полимеразы, обла-
дающей активностями обратной транскриптазы и ДНК-зависимой ДНК-полимеразы, а также
цепь-вытесняющей активностью. Определены условия реакции, обеспечивающие эффектив-
ную детекцию целевых РНК. Подход был апробирован на генетическом материале коронавируса
SARS-CoV-2, взятом в качестве модельной мишени. Реакция мультимеризации позволила с высо-
кой достоверностью дифференцировать SARS-CoV-2-положительные и SARS-CoV-2-отрицатель-
ные образцы. Предлагаемый способ позволяет обнаруживать РНК даже в образцах, подвергшихся
многократному замораживанию.
КЛЮЧЕВЫЕ СЛОВА: рибонуклеиновые кислоты (РНК), коронавирус SARS-CoV-2, молекулярная диа-
гностика, изотермическая амплификация, мультимеризация, сближенные праймеры.
DOI: 10.31857/S032097252305010X, EDN: AYYVQY
ВВЕДЕНИЕ
гностики инфекционных заболеваний, необхо-
димость надёжного обнаружения SARS-CoV-2
Амплификационно-опосредованный ана-
привела к разработке подходов, основанных
лиз РНК проводится при изучении экспрес-
на микрофлюидных и биосенсорных техноло-
сии генов и некодирующих РНК [1], а также
гиях, инструментах геномного редактирования
при обнаружении вирусных патогенов
[2].
(CRISPR/Cas) и др. [5-7].
В 2020 г. РНК-содержащий вирус SARS-CoV-2
Значительный прогресс был достигнут в
вызвал пандемию COVID-19, что актуализи-
развитии изотермических методов детекции
ровало необходимость постоянного монито-
специфических РНК [8-10], включая подходы,
ринга эпидемиологической ситуации по особо
не требующие стадии обратной транскрипции
опасным возбудителям [3]. В начале пандемии
(например, гибридизационная цепная реакция,
COVID-19 проблема «пропущенных» и бес-
дезоксирибозимное расщепление, лигирова-
симптомных пациентов высветила недостатки
ние на РНК-мишени с последующей ампли-
широко используемых методов амплификации
фикацией «катящимся кольцом» и др.) [11-13].
и выявила потребность в разработке новых,
В целом, изотермические методы являются
более быстрых, чувствительных и недорогих
отличной альтернативой ПЦР, не требуют до-
способов обнаружения патогенов [3, 4]. Хотя
рогостоящего оборудования для термоцикли-
ПЦР остаётся «золотым стандартом» и наи-
рования и применимы для анализа различных
более популярным методом молекулярной диа- биомолекул [13, 14]. Одним из перспективных
видов изотермической амплификации явля-
ется реакция мультимеризации (ММ)
[15].
Принятые сокращения: ДТТ - дитиотреит; ММ -
мультимеризация; НК - нуклеиновые кислоты; Tt - поро-
Было показано, что ММ может использо-
говое время.
ваться для определения РНК-мишеней [16].
* Адресат для корреспонденции.
Механизм [17, 18] и факторы, влияющие на ход
832
МЕТОД ДЕТЕКЦИИ РНК, ОСНОВАННЫЙ НА МУЛЬТИМЕРИЗАЦИИ
833
этой реакции [19-22], были подробно изучены.
Целью данной работы стала демонстрация
Так, согласно работе Wang et al. [17], ММ начи-
применимости мультимеризации, представ-
нается после образования псевдоциклических
ляющей собой новый тип изотермической ам-
ДНК-структур за счёт частичной денатурации
плификации, для прямого обнаружения специ-
ампликонов («дыхания ДНК») с последующим
фической РНК на примере РНК коронавируса
загибанием свободных
3′-концевых участ-
SARS-CoV-2 как модельной мишени.
ков цепей и их отжигом на противоположных
частях ДНК-дуплекса. Было показано, что ста-
билизация псевдоциклических ДНК-структур
МАТЕРИАЛЫ И МЕТОДЫ
происходит благодаря ионному взаимодействию
фосфатных групп синтезируемых цепей ДНК
Использованные реагенты. ДНК-полиме-
с поверхностными аминогруппами (лизина и
раза Bst 2.0 и изотермический буфер («New
аргинина) полимеразы [18]. ММ эффективно
England Biolabs», США), дезоксинуклеотиды
протекает только при определённых услови-
(дНТФ) («Биолабмикс», Россия), интеркали-
ях [19] и приводит к продуктам, представляю-
рующий краситель dsGreen («Lumiprobe», Рос-
щим собой тандемные нуклеотидные повторы,
сия), дитиотреит (ДТТ), персульфат аммония,
проявляющиеся в виде лестницы на электро-
акриламид, Tris, N,N′-метиленбисакриламид,
форетических гелях.
N,N,N′,N′-тетраметилэтилендиамин, натрие-
Как и в случае ПЦР, обнаружение специ-
вая соль N,N,N′,N′-этилендиаминтетрауксус-
фической РНК с помощью изотермических
ной кислоты («Sigma», США). Все растворы
методов требует использования РНК-зависи-
готовили с использованием воды высшей кате-
мых ДНК-полимераз (обратных транскриптаз)
гории качества (> 18 МОм, «Millipore», США).
для синтеза комплементарной ДНК (кДНК).
Нуклеиновые кислоты (НК). Генетиче-
Кроме того, из-за низкой стабильности моле-
ский материал коронавируса SARS-CoV-2 был
кул РНК работа с РНК-содержащими образ-
получен из носоглоточных мазков больных
цами требует соблюдения строгих правил.
COVID-19 (N = 60) с использованием набора
В случае с SARS-CoV-2 эти проблемы часто
М-Сорб-ООМ-96
(«Синтол», Россия). Диа-
приводили к получению недостоверных резуль-
гноз COVID-19 был подтверждён методом
татов [23-25]. Обнаружение РНК с помощью
ОТ-ПЦР с использованием набора ОТ-ПЦР-
изотермической амплификации с использова-
SARS-CoV-2 («Синтол»). В качестве контроля
нием ДНК-полимеразы Bst может упростить
использовались лизаты носоглоточных маз-
анализ и повысить его надёжность; обратно-
ков, для которых были получены сомнитель-
транскриптазная активность ДНК-полимера-
ные (N = 50) или отрицательные (N = 50)
зы Bst [26] делает её пригодной для прямого
результаты ПЦР-тестирования на SARS-CoV-2,
обнаружения РНК.
а также мазков от здоровых индивидов (N = 25).
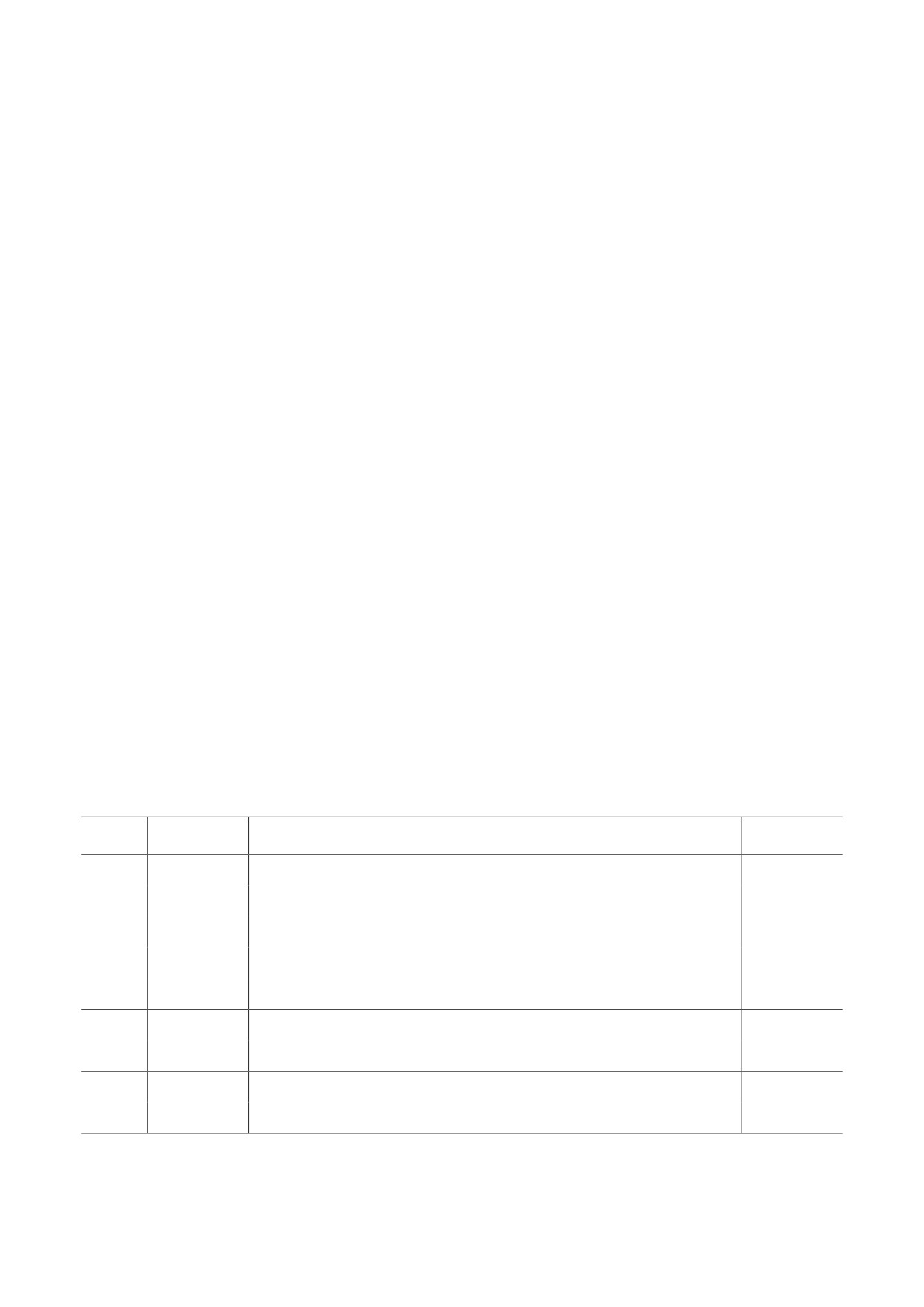
Олигонуклеотиды, использованные в работе
, 5′→3′
,
F-S1
GTTATCAGACTCAGACTAATTCTCCTC
27
R-S1
TTGACTAGCTACACTACGTGCCC
23
S
F-S2
GTCACAGACTCAGACTAATTCTCCTC*
26
R-S2
TGACTGACTAGCTACACTACGTGCCC
26
Qt
GTTaucagacucagacuaauucuccucggcgggcacguaguguagcuaguCAA**
53
F-N
TGACGCTTCAGCGTTCTTCGGAATGTC*
27
N
R-N
GTCAAGGTGTGACTTCCATGCCAATG
23
F-O
TGACAAAAGTATTCTACACTCCAGGGAC
28
ORF1a
R-O
GTCAAAATGACTCTTACCAGTACCAGGTG
27
* Жирным шрифтом выделены 5′-концевые нуклеотиды, не имеющие гомологии с нуклеотидной последовательно-
стью SARS-CoV-2.
** Прописные буквы - дезоксирибонуклеотиды, строчные - рибонуклеотиды.
10
БИОХИМИЯ том 88 вып. 5 2023
834
САХАБУТДИНОВА и др.
Путём смешивания по 20 соответствующих
Реакционные смеси объёмом 20 мкл содер-
лизатов объёмом 30 мкл каждый из указанных
жали по 5 пмоль каждого праймера, 0,25 мМ
групп были получены четыре типа образцов
дНТФ, 1× изотермический буфер, 0,2× интер-
Rmix: Rmix(+) (SARS-CoV-2-положительные),
калирующий краситель dsGreen, 10 мМ ДТТ,
Rmix(?) (SARS-CoV-2-сомнительные), Rmix(-)
3 ед. акт. ДНК-полимеразы Bst 2.0 и 1 мкл ли-
(SARS-CoV-2-отрицательные) и Rmix(H) (от
зата носоглоточных мазков (или образца Rmix,
здоровых индивидов). Rmix(+) был дополни-
или воды). Программа амплификации состоя-
тельно разделён на 5 аликвот, которые подвер-
ла из следующих этапов: 1) 70 °С, 30 с; 2) 65 °С,
гались 2-, 5-, 10- или 20-кратному заморажива-
60 с; 3) 60 °С, 3 ч. В ряде случаев результаты
нию при -20 °C и последующему оттаиванию.
амплификации анализировали с помощью
В результате были получены образцы Rmix0
электрофореза в 10%-ном ПААГ с последую-
(без замораживания), Rmix2, Rmix5, Rmix10 и
щим окрашиванием бромистым этидием и ви-
Rmix20 соответственно.
зуализацией в приборе GelDoc XR («Bio-Rad
Олигонуклеотиды. Олигонуклеотидные прай-
Laboratories»).
меры и искусственная РНК-мишень Qt (таб-
лица) были сконструированы с помощью он-
лайн-утилиты OligoAnalyzer («Integrated DNA
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Technologies», США) и приобретены в компа-
нии «Синтол». В качестве мишеней для ам-
Амплификация любой РНК начинается
плификации были выбраны нуклеотидные по-
с синтеза её ДНК-копии (кДНК) в ходе реак-
следовательности генов S, N и ORF1a корона-
ции обратной транскрипции, которую обычно
вируса SARS-CoV-2.
проводят до амплификации с помощью спе-
Реакция ММ. Все образцы для амплифи-
циального фермента (обратной транскрип-
кации готовили в ПЦР-боксе UVC/T-M-AR
тазы) при относительно низкой температуре.
(«Biosan», Латвия). Рабочее пространство, до-
Однако представляется удобным амплифици-
заторы и пластиковую посуду предварительно
ровать РНК без проведения отдельного этапа
облучали ультрафиолетом в течение 20 мин.
обратной транскрипции, т. е. с использованием
Амплификацию проводили в ДНК-ампли-
одного фермента, обладающего как обратно-
фикаторе iQ5 («Bio-Rad Laboratories», США).
транскриптазной, так и ДНК-полимеразной
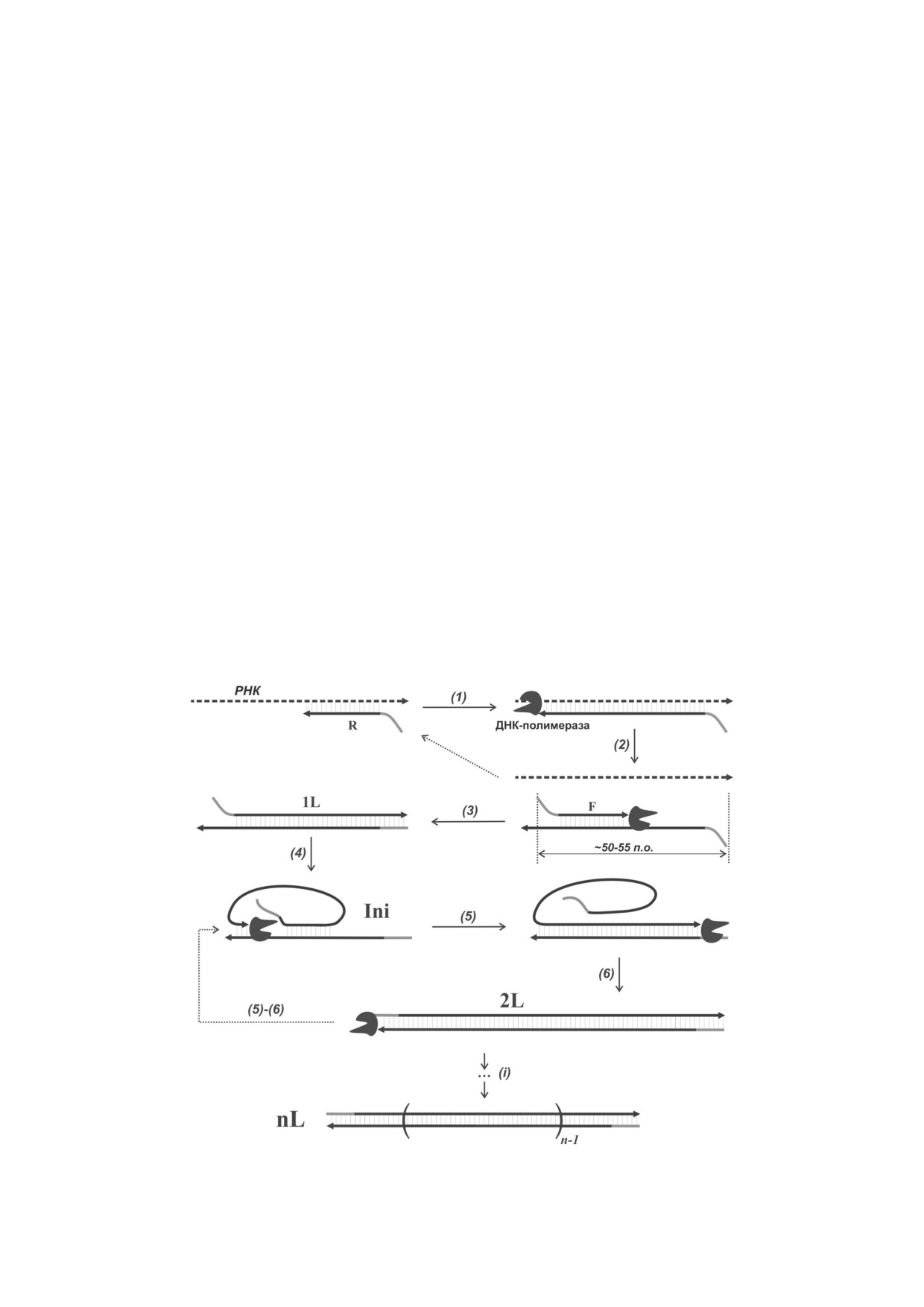
Рис. 1. Схема детекции РНК с помощью реакции мультимеризации. F и R - праймеры; Ini - инициаторный комплекс;
L - длина мономерного участка (повтора) двуцепочечной ДНК; (1)-(i) - этапы реакции
БИОХИМИЯ том 88 вып. 5 2023
МЕТОД ДЕТЕКЦИИ РНК, ОСНОВАННЫЙ НА МУЛЬТИМЕРИЗАЦИИ
835
активностью. Недавно было показано, что фер-
через 25-70 мин после начала реакции в зави-
мент Hemo KlenTaq, который позиционируется
симости от концентрации матрицы и условий
как ДНК-зависимая ДНК-полимераза, обла-
реакции (в данном случае протекает «специ-
дает обратно-транскриптазной активностью и
фическая» ММ) [19]. В отсутствие матрицы
обеспечивает успешную амплификацию РНК-
и димеров праймеров (т.е. для качественных
мишеней [27]. Для проведения изотермической
праймеров) продолжительность периода на-
амплификации интерес может представлять
копления таких продуктов составляет более
большой фрагмент ДНК-полимеразы Bst (Bst
100 мин; в данном случае можно говорить о
exo-) из-за сильной цепь-вытесняющей актив-
протекании «неспецифической» ММ. Также
ности, умеренной термостабильности и высо-
было показано, что наибольшая эффектив-
кой процессивности. Обратно-транскриптаз-
ность ММ наблюдается для ДНК-полимеразы
ная активность (проявляется вплоть до 72 °C)
Bst 2.0, ДНК-матриц длиной около 50 нт, при
заявляется производителем только для ДНК-
пониженной концентрации интеркалирующе-
го красителя SYBR Green [19]. Стоит отметить,
но, вероятно, такой активностью могут обладать
что 10 мМ ДТТ заметно увеличивает эффектив-
все коммерчески доступные формы Bst exo- [26].
ность ММ (собственные данные, не приведены).
Однозначное протекание реакции мульти-
Принимая во внимание механизм проте-
меризации при определённых условиях позво-
кания ММ [17, 18], повышения эффективно-
ляет использовать её для обнаружения НК-ми-
сти данной реакции можно добиться с помо-
шеней [16]. Так, если сконструировать пару
щью праймеров с определённой структурой.
специфичных сближенных праймеров, предна-
Так, было показано, что праймеры с компле-
значенных для обнаружения какой-либо одно-
ментарными
5′-концевыми мотивами уско-
цепочечной НК (например, РНК), можно ожи-
ряют ММ [16]. В данной работе были скон-
дать успешного протекания амплификации
струированы две модельные пары праймеров:
посредством мультимеризации, как показано
обычная пара F-S1/R-S1 и праймеры с компле-
на рис. 1.
ментарными четырехнуклеотидными 5′-конце-
На первой стадии реакции один из прай-
выми участками (F-S2/R-S2). Влияние струк-
меров (обозначен как R на рис. 1) отжигается
туры праймеров на ММ оценивали с помощью
на цепи РНК и удлиняется ДНК-полимеразой,
искусственной РНК-матрицы Qt, содержащей
обладающей обратно-транскриптазной активно-
по три дезоксирибонуклеотида на 5′- и 3′-кон-
стью, в результате чего образуется двуцепочеч-
цах соответственно, что обеспечивает более вы-
ный ДНК/РНК-гетеродуплекс. Затем за счёт
сокую устойчивость этой РНК к расщеплению
«дыхания» цепей появляется возможность от-
рибонуклеазами. Праймеры F-S1/R-S1 обеспе-
жига второго праймера (обозначенного как F)
чивали более низкую эффективность ММ (по-
на синтезированной цепи кДНК, что при-
роговое время, Tt, составило около 70 мин) по
водит к ампликону размером 1L (этапы 2 и 3).
сравнению с F-S2/R-S2 (Tt ~50 мин) (рис. 2, а,
Праймеры F и R имеют 5′-концевые последо-
кривые 1 и 3 соответственно).
вательности, не гомологичные РНК-мишени,
Оказалось, что ММ протекает быстрее с ис-
но комплементарные друг другу. Они способ-
кусственной РНК (рис. 2, а, кривые 1 и 2, или
ствуют повышению эффективности «дыхания»
3 и 4). Вероятно, это связано с тем, что олиго-
ДНК, облегчают образование инициаторного
рибонуклеотид Qt имеет конечную длину,
комплекса (Ini, шаг 4) и обеспечивают даль-
которая обеспечивает быстрое образование
нейшее накопление мультимерных продуктов
Ini и способствует более раннему началу ММ.
(шаги 5-i). Образование дуплексов длиной > 2L
Следует отметить, что по сравнению с ПЦР
переводит реакцию в экспоненциальный ре-
кривые мультимеризации демонстрируют мень-
жим за счёт увеличения числа мест отжига для
шую сходимость в повторах (рис. 2, а, кри-
обоих праймеров. Следует отметить, что моле-
вые 1, 2 и 4). Для ММ расхождение значений
кулы РНК хорошо подходят для запуска ММ,
Tt несколько увеличивается с уменьшением
поскольку являются одноцепочечными и обес-
числа копий мишени [16]. Это относитель-
печивают лёгкий отжиг первого (R) праймера.
ное отклонение от нелинейности объясняется
ММ начинается с образования Ini, однако
особенностью реакции ММ. Как было ска-
вероятность данного события крайне мала.
зано выше, начало ММ является случайным
Представляется, что для начала ММ доста-
событием, и по мере уменьшения количества
точно наличия любой двуцепочечной НК и
копий мишени требуется больше времени для
праймеров для её амплификации. Ранее нами
запуска реакции, в результате чего возникает
было показано, что накопление детектируе-
бóльшая разница между повторами в скорости
мого количества продуктов ММ начинается
начала экспоненциальной стадии реакции.
БИОХИМИЯ том 88 вып. 5 2023
10*
836
САХАБУТДИНОВА и др.
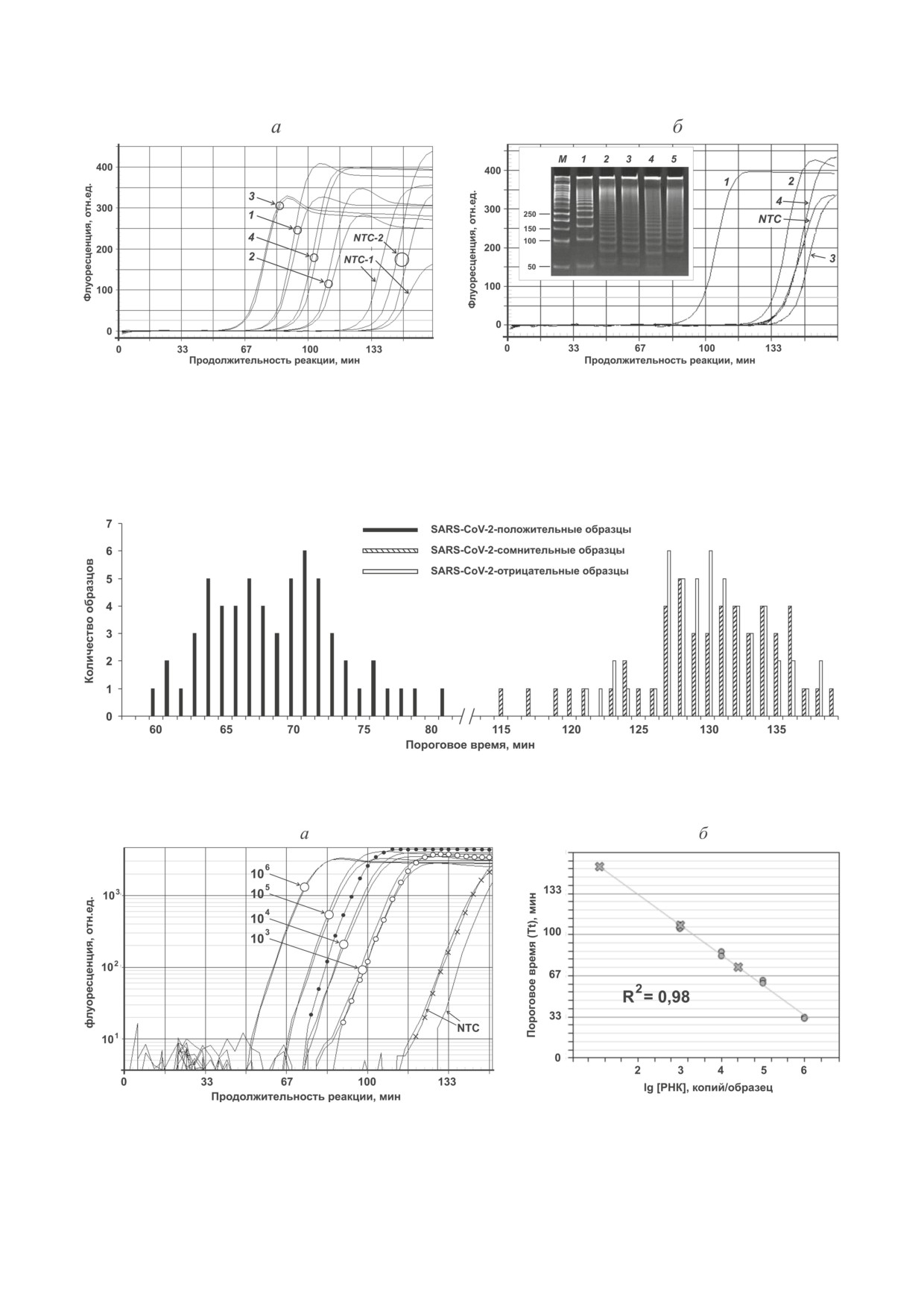
Рис. 2. Протекание реакции мультимеризации при использовании разных типов праймеров и РНК. a - Влияние
структуры праймеров и типа РНК-мишени на скорость мультимеризации: 1 - пара праймеров F-S1/R-S1 и искус-
ственная (Qt) РНК; 2 - F-S1/R-S1 и Rmix(+); 3 - пара праймеров F-S2/R-S2 и Qt; 4 - F-S2/R-S2 и Rmix(+); NTC-1 -
отрицательный контроль для F-S1/R-S1; NTC-2 - отрицательный контроль для F-S2/R-S2. б - Кривые амплификации
(данные для праймеров F-S2/R-S2; приведены только по одному из двух повторов): 1 - образец Rmix(+); 2 - Rmix(?);
3 - Rmix(-); 4 - Rmix(H); NTC - отрицательный контроль. Вставка - электрофоретический анализ образцов 1-4
(М - маркер длин фрагментов ДНК, дорожка 5 - образец NTC)
Рис. 3. Распределение значений Tt для SARS-CoV-2-положительных (N = 60), SARS-CoV-2-сомнительных (N = 50)
и SARS-CoV-2-отрицательных образцов (N = 50) (приведены данные для пары праймеров F-S2/R-S2)
Рис. 4. Чувствительность обнаружения вирусной РНК с помощью ММ (приведены данные для пары праймеров F-S2/
R-S2). a - Пример количественного анализа РНК коронавируса SARS-CoV-2 (пара праймеров F1/R1, логарифми-
ческая шкала): кривые амплификации для Rmix(+) (тёмные кружки), Rmix(?) (белые кружки) и Rmix(-) (крестики)
образцов и калибровочные образцы (сплошные линии), содержащие 103-106 копий мишени Qt. б - Калибровочный
график (калибровочные образцы содержали 103, 104, 105 и 106 копий/мкл)
БИОХИМИЯ том 88 вып. 5 2023
МЕТОД ДЕТЕКЦИИ РНК, ОСНОВАННЫЙ НА МУЛЬТИМЕРИЗАЦИИ
837
Таким образом, на основании ранее опуб-
тестирования (данные не представлены). Диа-
ликованных и полученных в этой работе дан-
пазоны значений Tt для SARS-CoV-2-положи-
ных можно рекомендовать следующие способы
тельных образцов и образцов, не содержавших
повышения эффективности «специфической»
РНК-мишень, не перекрывались, что позво-
ММ: 1) использование двух праймеров с ком-
ляет различать эти типы образцов и с высокой
плементарными друг другу 5′-концами, 2) обес-
достоверностью выявлять патогенную РНК.
печение образования праймерами первичного
Таким образом, значение Tt ≈110 мин можно
ампликона размером ~50-55 п.о., 3) использо-
считать порогом аналитической значимости
вание ДНК-полимеразы Bst 2.0 и её буфера, до-
(для использованных условий реакции).
бавление в реакционную смесь ДТТ (до 10 мМ)
Для оценки возможности количественного
и уменьшенного количества интеркалирующе-
определения РНК коронавируса с помощью
го красителя, проведение реакции при ~60 °С.
мультимеризации использовали Qt. Калибровоч-
Применимость ММ для обнаружения
ные образцы, содержавшие 103-106 копий Qt,
специфических РНК изучали на генетиче-
получали последовательными 10-кратными раз-
ском материале коронавируса SARS-CoV-2.
ведениями стокового раствора. Следует отме-
Использовались установленные по результа-
тить, что количество копий РНК-мишени в
там ПЦР-тестирования SARS-CoV-2-положи-
клинических образцах было неизвестно. Одна-
тельные, SARS-CoV-2-сомнительные, SARS-
ко ранее сообщалось, что экстракты носогло-
CoV-2-отрицательные образцы и образцы, по-
точных мазков COVID-19-положительных па-
лученные от здоровых индивидов. Для исклю-
циентов содержат в среднем около 104-105 копий
чения влияния первичной структуры мишеней
мишеней на 1 мкл раствора в зависимости от
на эффективность ММ были сконструиро-
типа биоматериала, вирусной нагрузки, способа
ваны три пары праймеров для амплификации
выделения РНК и метода её обнаружения [28-
трёх разных генов коронавируса SARS-CoV-2.
31]. Эксперименты позволили количественно
Все специфические пары праймеров содержа-
определить содержание РНК коронавируса в об-
ли комплементарные 5′-мотивы. Эксперимен-
разцах от SARS-CoV-2-положительных пациен-
ты не показали влияния мишени на протека-
тов. Для большинства образцов число копий ми-
ние ММ, поэтому далее приводятся результаты
шени находилось в диапазоне 104-105 (рис. 4, а).
только для пары праймеров F-S2/R-S2.
В целом, полученные результаты хорошо
При использовании препаратов группы
коррелируют с данными ОТ-ПЦР, проводи-
Rmix было обнаружено, что амплификация
мой без специфических флуорогенных зон-
происходит для всех образцов, как для SARS-
дов [3, 4, 32-34], и обеспечивают чувствитель-
CoV-2-положительных (Rmix(+)), так и для кон-
ность определения на уровне пикомолярных
тролей (Rmix(?), Rmix(-) и Rmix(H)). Однако
концентраций. Однако для образцов с очень
для Rmix(+) значения Tt находились в преде-
низкой вирусной нагрузкой обнаружение ми-
лах 60-90 мин от начала реакции, в то время
шени с помощью ММ можно считать полу-
как для остальных превышали 110-120 мин
количественным из-за недостаточно высокой
(рис. 2, б). Для Rmix(+) электрофоретиче-
сходимости значений Tt в повторах (рис. 4, б).
ский анализ показал образование характерных
Предлагаемый подход обладает рядом пре-
мультимерных продуктов - ДНК с размерами,
имуществ благодаря использованию сближен-
кратными ожидаемому (~55 п.н.). В остальных
ных праймеров, позволяющих амплифици-
образцах также образовались мультимерные
ровать короткие НК, такие как разрушенная
продукты, но их размер не соответствовал раз-
ДНК [35] или микроРНК [16], и обеспечиваю-
меру первичного ампликона, что указывает на
щих высокие уровни специфичности, чувстви-
протекание неспецифической ММ (рис. 2, б).
тельности анализа и достоверности результата.
Анализ данных, полученных при ампли-
Для молекул РНК деградация является более
фикации индивидуальных образцов (всего N =
актуальной проблемой по сравнению с ДНК
= 160), показывает возможность дифференциа-
из-за их меньшей стабильности. В этом случае
ции специфической и неспецифической ММ.
использование сближенных праймеров позво-
Значения Tt для SARS-CoV-2-положительных
ляет анализировать сохранившиеся относи-
образцов находились в пределах 60-80 мин;
тельно короткие фрагменты РНК, пригодные
в то же время для образцов из остальных групп
для амплификации. Кроме того, если ДНК-
значения Tt превышали 115 мин, что свидетель-
полимераза обладает слабой обратно-тран-
ствует об отсутствии в них мишени (рис. 3).
скриптазной активностью, предпочтительна
Полученные значения Tt хорошо корре-
амплификация более коротких РНК-последова-
лируют со значениями порогового цикла Ct,
тельностей. Для оценки применимости ММ для
найденными для этих же образцов после ПЦР-
анализа разрушенной РНК были приготовлены
БИОХИМИЯ том 88 вып. 5 2023
838
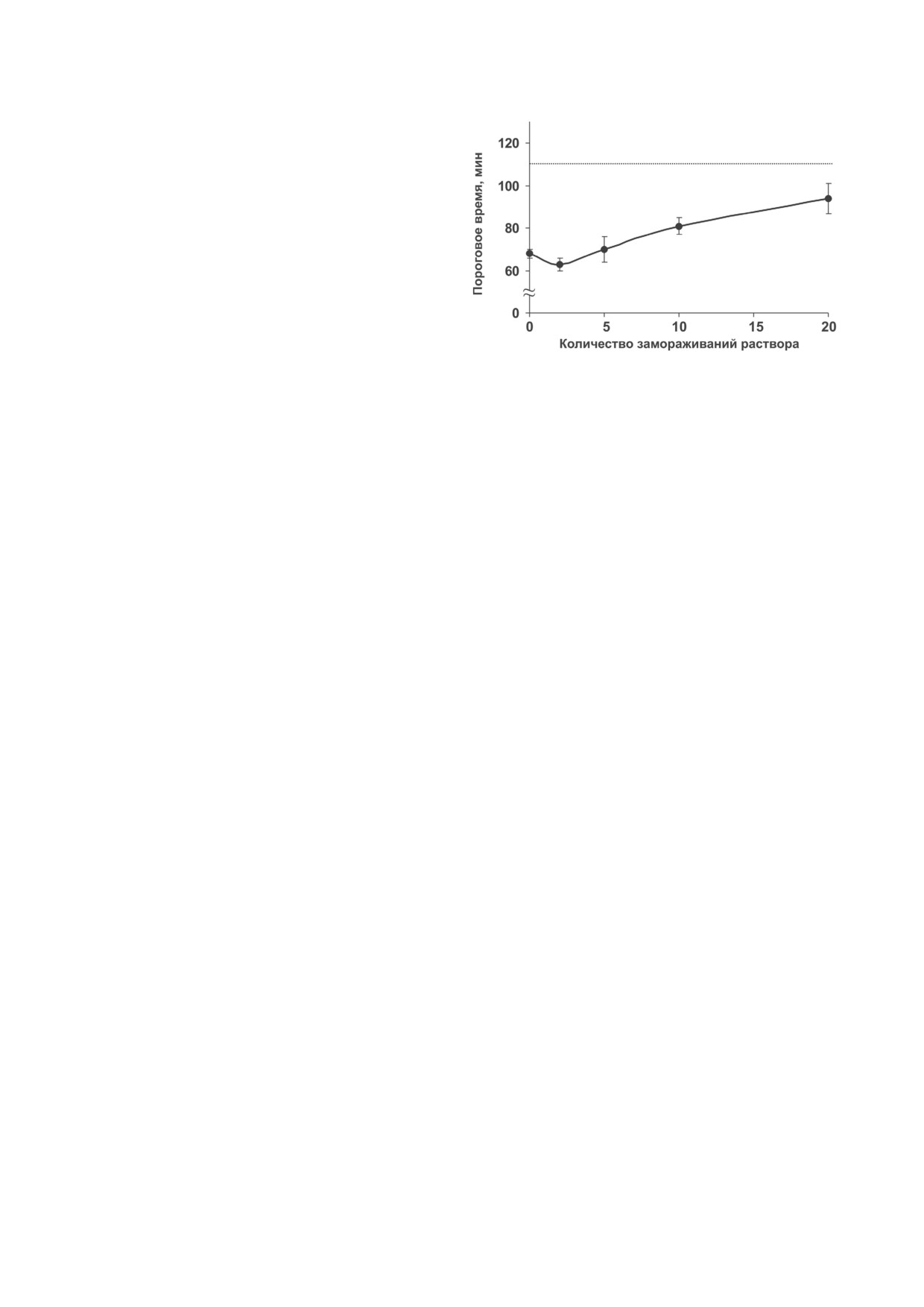
САХАБУТДИНОВА и др.
препараты РНК коронавируса путём много-
кратного замораживания-оттаивания образца
Rmix(+). Эксперименты в целом показали не-
большое увеличение значений Tt с ростом ко-
личества циклов замораживания-оттаивания,
что свидетельствует о снижении количества ам-
плифицируемых РНК-мишеней (рис. 5).
Неожиданным оказалось то, что для об-
разца Rmix2, подвергнутого двухкратному за-
мораживанию, наблюдалось незначительное
снижение значения Tt, что, вероятно, связано
с увеличением эффективности ММ за счёт
образования более коротких РНК-молекул.
Рис. 5. Влияние многократного замораживания раство-
Увеличение количества циклов заморажива-
ра Rmix(+) на скорость мультимеризации. Пунктирная
ния-оттаивания приводило к постепенному
линия при Tt = 110 мин соответствует порогу аналитиче-
увеличению Tt, но даже для образца Rmix20 Tt
ской значимости (приведены данные для пары праймеров
F-S2/R-S2)
не превысило 110 мин, что позволило с высо-
кой достоверностью выявить целевую РНК.
Таким образом, сближенное расположение
тельных. Предлагаемый подход основан на ис-
праймеров позволяет обнаруживать разрушен-
пользовании сближенных праймеров, которые
ную РНК и, соответственно, предъявлять бо-
обеспечивают эффективную амплификацию и
лее щадящие требования к транспортировке и
выявление РНК-мишени даже в образцах, под-
хранению РНК-содержащих материалов.
вергшихся многократному замораживанию.
Для образцов, содержащих низкое число копий
мишени, анализ с помощью мультимериза-
ЗАКЛЮЧЕНИЕ
ции можно считать полуколичественным из-за
меньшей сходимости значений Tt в повторах.
Полученные результаты показали, что ре-
акция мультимеризации может быть использо-
Вклад авторов. Сахабутдинова А.Р. - про-
вана для обнаружения вирусной РНК. Эффек-
ведение экспериментов, написание статьи;
тивность и специфичность ММ может быть
Чемерис А.В. - обсуждение результатов, ре-
повышена за счёт специальной конструкции
дактирование рукописи; Гарафутдинов Р.Р. -
праймеров, содержащих комплементарные
разработка концепции исследования, проведе-
5′-концевые мотивы, и использования опреде-
ние экспериментов, редактирование рукописи.
лённых реакционных компонентов, а именно
Финансирование. Работа выполнена при
ДНК-полимеразы Bst 2.0, ДТТ и уменьшенного
поддержке Российского научного фонда (грант
количества интеркалирующего красителя. Ам-
№ 22-24-00235).
плификация посредством ММ протекает в изо-
Благодарности. Авторы выражают благо-
термических условиях и исключает добавление
дарность проф. Мавзютову А.Р. за любезно
в реакционную смесь обычной обратной тран-
предоставленные образцы РНК коронавируса
скриптазы; необходим только один фермент с
SARS-CoV-2.
обратно-транскриптазной, ДНК-полимеразной
Соблюдение этических норм. Эта статья не
и цепь-вытесняющей активностями. ММ по-
содержит каких-либо исследований с участием
зволяет с высокой достоверностью отличить
людей или животных, выполненных кем-либо
РНК-положительные образцы от РНК-отрица-
из авторов.
СПИСОК ЛИТЕРАТУРЫ
1. Palazzo, A. F., and Lee, E. S. (2015) Non-coding
3. Vindeirinho, J. M., Pinho, E., Azevedo, N. F., and
RNA: what is functional and what is junk? Front.
Almeida, C. (2022) SARS-CoV-2 diagnostics based on
Genet., 6, 2, doi: 10.3389/fgene.2015.00002.
nucleic acids amplification: from fundamental concepts
2. Bukasov, R., Dossym, D., and Filchakova, O. (2021)
to applications and beyond, Front. Cell. Infect. Micro-
Detection of RNA viruses from influenza and HIV to
biol., 12, 799678, doi: 10.3389/fcimb.2022.799678.
Ebola and SARS-CoV-2: a review, Anal. Methods, 13,
4. Verna, R., Alallon, W., Murakami, M., Hayward,
34-55, doi: 10.1039/d0ay01886d.
C. P. M., Harrath, A. H., Alwasel, S. H., Sumita,
БИОХИМИЯ том 88 вып. 5 2023
МЕТОД ДЕТЕКЦИИ РНК, ОСНОВАННЫЙ НА МУЛЬТИМЕРИЗАЦИИ
839
N. M., Alatas, O., Fedeli, V., Sharma, P., Fuso, A.,
16.
Garafutdinov, R. R., Burkhanova, G. F., Maksimov, I. V.,
Capuano, D. M., Capalbo, M., Angeloni, A., and
and Sakhabutdinova, A. R. (2023) New method for
Bizzarri, M.
(2021) Analytical performance of
microRNA detection based on multimerization, Anal.
COVID-19 detection methods (RT-PCR): scientific
Biochem., 664, 115049, doi: 10.1016/j.ab.2023.115049.
and societal concerns, Life (Basel), 11, 660, doi:
17.
Wang, G., Ding, X., Hu, J., Wu, W., Sun, J., and
10.3390/life11070660.
Mu, Y. (2017) Unusual isothermal multimerization
5.
Thapa, S., Singh, K. R., Verma, R., Singh, J., and
and amplification by the strand-displacing DNA
Singh, R. P.
(2022) State-of-the-art smart and
polymerases with reverse transcription activities, Sci.
intelligent nanobiosensors for SARS-CoV-2 diagnosis,
Rep., 7, 13928, doi: 10.1038/s41598-017-13324-0.
Biosensors (Basel), 12, 637, doi: 10.3390/bios12080637.
18.
Sakhabutdinova, A. R., Kamalov, M. I., Salakhieva,
6.
Yin, B., Wan, X., Sohan, A. S. M. M. F., and Lin, X.
D. V., Mavzyutov, A. R., and Garafutdinov, R. R.
(2022) Microfluidics-based POCT for SARS-
(2021) Inhibition of nonspecific polymerase activity
CoV-2 diagnostics, Micromachines (Basel), 13, 1238,
using poly(aspartic) acid as a model anionic polye-
doi: 10.3390/mi13081238.
lectrolyte, Anal. Biochem., 628, 114267, doi: 10.1016/
7.
Zhang, L., Jiang, H., Zhu, Z., Liu, J., and Li, B.
j.ab.2021.114267.
(2022) Integrating CRISPR/Cas within isother-
19.
Garafutdinov, R. R., Gilvanov, A. R., and
mal amplification for point-of-care assay of nu-
Sakhabutdinova, A. R.
(2020) The influence of
cleic acid, Talanta,
243,
123388, doi:
10.1016/
reaction conditions on DNA multimerization during
j.talanta.2022.123388.
isothermal amplification with Bst DNA polymerase,
8.
Islam, M. M., and Koirala, D. (2022) Toward a next-
Appl. Biochem. Biotechnol., 190, 758-771, doi: 10.1007/
generation diagnostic tool: a review on emerging
s12010-019-03127-6.
isothermal nucleic acid amplification techniques for
20.
Garafutdinov, R. R., Gilvanov, A. R., Kupova, O. Y.,
the detection of SARS-CoV-2 and other infectious
and Sakhabutdinova, A. R. (2020) Effect of metal
viruses, Anal. Chim. Acta, 1209, 339338, doi: 10.1016/
ions on isothermal amplification with Bst exo- DNA
j.aca.2021.339338.
polymerase, Int. J. Biol. Macromol., 161, 1447-1455,
9.
Maiti, B., Anupama, K. P., Rai, P., Karunasagar, I.,
doi: 10.1016/j.ijbiomac.2020.08.028.
and Karunasagar, I. (2022) Isothermal amplification-
21.
Garafutdinov, R. R., Sakhabutdinova, A. R.,
based assays for rapid and sensitive detection of
Kupryushkin, M. S., and Pyshnyi, D. V.
(2020)
severe acute respiratory syndrome coronavirus
2:
Prevention of DNA multimerization during iso-
opportunities and recent developments, Rev. Med.
thermal amplification with Bst exo- DNA poly-
Virol., 32, e2274, doi: 10.1002/rmv.2274.
merase, Biochimie,
168,
259-267, doi:
10.1016/
10.
Chaouch, M. (2021) Loop-mediated isothermal am-
j.biochi.2019.11.013.
plification (LAMP): an effective molecular point-
22.
Sakhabutdinova, A. R., Mirsaeva, L. R., Garafutdinov,
of-care technique for the rapid diagnosis of corona-
R. R., Oscorbin, I. P., and Filipenko, M. L. (2020)
virus SARS-CoV-2, Rev. Med. Virol., 31, e2215, doi:
Elimination of DNA multimerization arising from
10.1002/rmv.2215.
isothermal amplification in the presence of Bst exo-
11.
Bi, S., Yue, S., and Zhang, S. (2017) Hybridization
DNA polymerase, Russ. J. Bioorg. Chem., 46, 52-59,
chain reaction: a versatile molecular tool for
doi: 10.1134/s1068162020010082.
biosensing, bioimaging, and biomedicine, Chem. Soc.
23.
Qasem, A., Shaw, A. M., Elkamel, E., and Naser,
Rev., 46, 4281-4298, doi: 10.1039/c7cs00055c.
S. A. (2021) Coronavirus disease 2019 (COVID-19)
12.
Yue, S., Li, Y., Qiao, Z., Song, W., and Bi, S. (2021)
diagnostic tools: a focus on detection technologies
Rolling circle replication for biosensing, bioimaging,
and limitations, Curr. Issues Mol. Biol., 43, 728-748,
and biomedicine, Trends Biotechnol., 39, 1160-1172,
doi: 10.3390/cimb43020053.
doi: 10.1016/j.tibtech.2021.02.007.
24.
Panchali, M. J. L., Oh, H. J., Lee, Y. M., Kim, C. M.,
13.
Garafutdinov, R. R., Sakhabutdinova, A. R., Gilvanov,
Tariq, M., Seo, J. W., Kim, D. Y., Yun, N. R., and
A. R., and Chemeris, A. V. (2021) Rolling circle
Kim, D. M. (2022) Accuracy of real-time polymerase
amplification as a universal method for the analysis of a
chain reaction in COVID-19 patients, Microbiol.
wide range of biological targets, Russ. J. Bioorg. Chem.,
Spectr., 10, e0059121, doi: 10.1128/spectrum.00591-21.
47, 1172-1189, doi: 10.1134/S1068162021060078.
25.
Meena, D. S., Kumar, B., Kachhwaha, A., Kumar, D.,
14.
Bodulev, O. L., and Sakharov, I. Y. (2020) Isothermal
Khichar, S., Bohra, G. K., Sharma, A., Kothari, N.,
nucleic acid amplification techniques and their use
Garg, P., Sureka, B., Banerjee, M., Garg, M. K., and
in bioanalysis, Biochemistry (Moscow), 85, 147-166,
Misra, S. (2022) Comparison of clinical characteristics
doi: 10.1134/S0006297920020030.
and outcome in RT-PCR positive and false-negative
15.
Hafner, G. J., Yang, I. C., Wolter, L. C., Stafford, M. R.,
RT-PCR for COVID-19: a retrospective analysis,
and Giffard, P. M. (2001) Isothermal amplification
Infez. Med., 30, 403-411, doi: 10.53854/liim-3003-8.
and multimerization of DNA by Bst DNA polymerase,
26.
Jackson, L. N., Chim, N., Shi, C., and Chaput, J. C.
BioTechniques, 30, 852-856, doi: 10.2144/01304rr03.
(2019) Crystal structures of a natural DNA polymerase
БИОХИМИЯ том 88 вып. 5 2023
840
САХАБУТДИНОВА и др.
that functions as an XNA reverse transcriptase, Nucleic
Viral load may impact the diagnostic performance
Acids Res., 47, 6973-6983, doi: 10.1093/nar/gkz513.
of nasal swabs in nucleic acid amplification test and
27. Sakhabutdinova, A. R., Gazizov, R. R., Chemeris,
quantitative antigen test for SARS-CoV-2 detection,
A. V., and Garafutdinov, R. R.
(2022) Reverse
J. Infect. Chemother., 28, 1590-1593, doi: 10.1016/
transcriptase-free detection of viral RNA using Hemo
j.jiac.2022.07.023.
KlenTaq DNA polymerase, Anal. Biochem.,
659,
32. Dutta, D., Naiyer, S., Mansuri, S., Soni, N., Singh, V.,
114960, doi: 10.1016/j.ab.2022.114960.
Bhat, K. H., Singh, N., Arora, G., and Mansuri, M. S.
28. Silva, A., Azevedo, M., Sampaio-Maia, B., and
(2022) COVID-19 diagnosis: a comprehensive review
Sousa-Pinto, B. (2022) The effect of mouthrinses on
of the RT-qPCR method for detection of SARS-
severe acute respiratory syndrome coronavirus 2 viral
CoV-2, Diagnostics (Basel), 12, 1503, doi: 10.3390/
load: A systematic review, J. Am. Dent. Assoc., 153,
diagnostics12061503.
635-648, doi: 10.1016/j.adaj.2021.12.007.
33. Ravina, Kumar, A., Manjeet, Twinkle, Subodh,
29. Hernández-Vásquez, A., Barrenechea-Pulache, A.,
Narang, J., and Mohan, H. (2022) Analytical per-
Comandé, D., and Azañedo, D. (2022) Mouthrinses
formances of different diagnostic methods for
and SARS-CoV-2 viral load in saliva: a living
SARS-CoV-2 virus - a review, Sens. Int., 3, 100197,
systematic review, Evid. Based Dent., doi: 10.1038/
doi: 10.1016/j.sintl.2022.100197.
s41432-022-0253-z.
34. Marando, M., Tamburello, A., Gianella, P.,
30. Tallmadge, R. L., Laverack, M., Cronk, B.,
Taylor, R., Bernasconi, E., Fusi-Schmidhauser, T.
Venugopalan, R., Martins, M., Zhang, X., Elvinger, F.,
(2022) Diagnostic sensitivity of RT-PCR assays on
Plocharczyk, E., and Diel, D. G. (2022) Viral RNA load
nasopharyngeal specimens for detection of SARS-
and infectivity of SARS-CoV-2 in paired respiratory
CoV-2 infection: a systematic review and meta-
and oral specimens from symptomatic, asymp-
analysis, Caspian J. Intern. Med.,
13,
139-147,
tomatic, or postsymptomatic individuals, Microbiol.
doi: 10.22088/cjim.13.0.139.
Spectr., 10, e0226421, doi: 10.1128/spectrum.02264-21.
35. Garafutdinov, R. R., Galimova, A. A., and
31. Fujiya, Y., Sato, Y., Katayama, Y., Nirasawa, S.,
Sakhabutdinova, A. R.
(2017) Polymerase chain
Moriai, M., Saeki, M., Yakuwa, Y., Kitayama, I.,
reaction with nearby primers, Anal. Biochem., 518,
Asanuma, K., Kuronuma, K., and Takahashi, S. (2022)
126-133, doi: 10.1016/j.ab.2016.11.017.
DETECTION OF SPECIFIC RNA TARGETS BY MULTIMERIZATION
A. R. Sakhabutdinova, A. V. Chemeris, and R. R. Garafutdinov*
Institute of Biochemistry and Genetics, Ufa Federal Research Center, Russian Academy of Sciences,
450054 Ufa, Bashkortostan, Russia; e-mail: garafutdinovr@gmail.com
Detection of specific RNA targets via amplification-mediated techniques is widely used in fundamental
studies and medicine due to an essential role of RNA in realization of genetic information and diseases
development. Here, we report on an approach for detection of RNA targets based on a particular type of
isothermal amplification, namely, reaction of nucleic acid multimerization. The proposed technique re-
quires only a single DNA polymerase possessing reverse transcriptase, DNA-dependent DNA polymerase
and strand-displacement activities. Reaction conditions that lead to efficient detection of the target RNAs
through multimerization mechanism were determined. The approach was approved using genetic material
of SARS-CoV-2 coronavirus as a model viral RNA. Reaction of multimerization allowed to differentiate
SARS-CoV-2 RNA-positive samples from SARS-CoV-2 negative samples with high reliability. The pro-
posed technique determines detection of RNA even in samples, which undergone multiple freezing.
Keywords: ribonucleic acids (RNA), coronavirus SARS-CoV-2, molecular diagnostics, isothermal amplification,
multimerization, nearby primers
БИОХИМИЯ том 88 вып. 5 2023