БИОХИМИЯ, 2023, том 88, вып. 5, с. 841 - 853
УДК 577.151
МЕХАНИЗМ ИНГИБИРОВАНИЯ D-ЦИКЛОСЕРИНОМ
ТРАНСАМИНАЗЫ D-АМИНОКИСЛОТ ИЗ Haliscomenobacter hydrossis
© 2023 А.К. Бакунова1*, И.О. Матюта1, А.Ю. Николаева1,2,
К.М. Бойко1, В.О. Попов1,3, Е.Ю. Безсуднова1*
1 Федеральный исследовательский центр «Фундаментальные основы биотехнологии» РАН,
Институт биохимии имени А.Н. Баха, 119071 Москва, Россия;
электронная почта: a.bakunova@fbras.ru, eubez@inbi.ras.ru
2 Национальный исследовательский центр «Курчатовский институт», 123182, Москва, Россия
3 Московский государственный университет имени М.В. Ломоносова,
биологический факультет, 119991 Москва, Россия
Поступила в редакцию 26.08.2022
После доработки 10.02.2023
Принята к публикации 11.02.2023
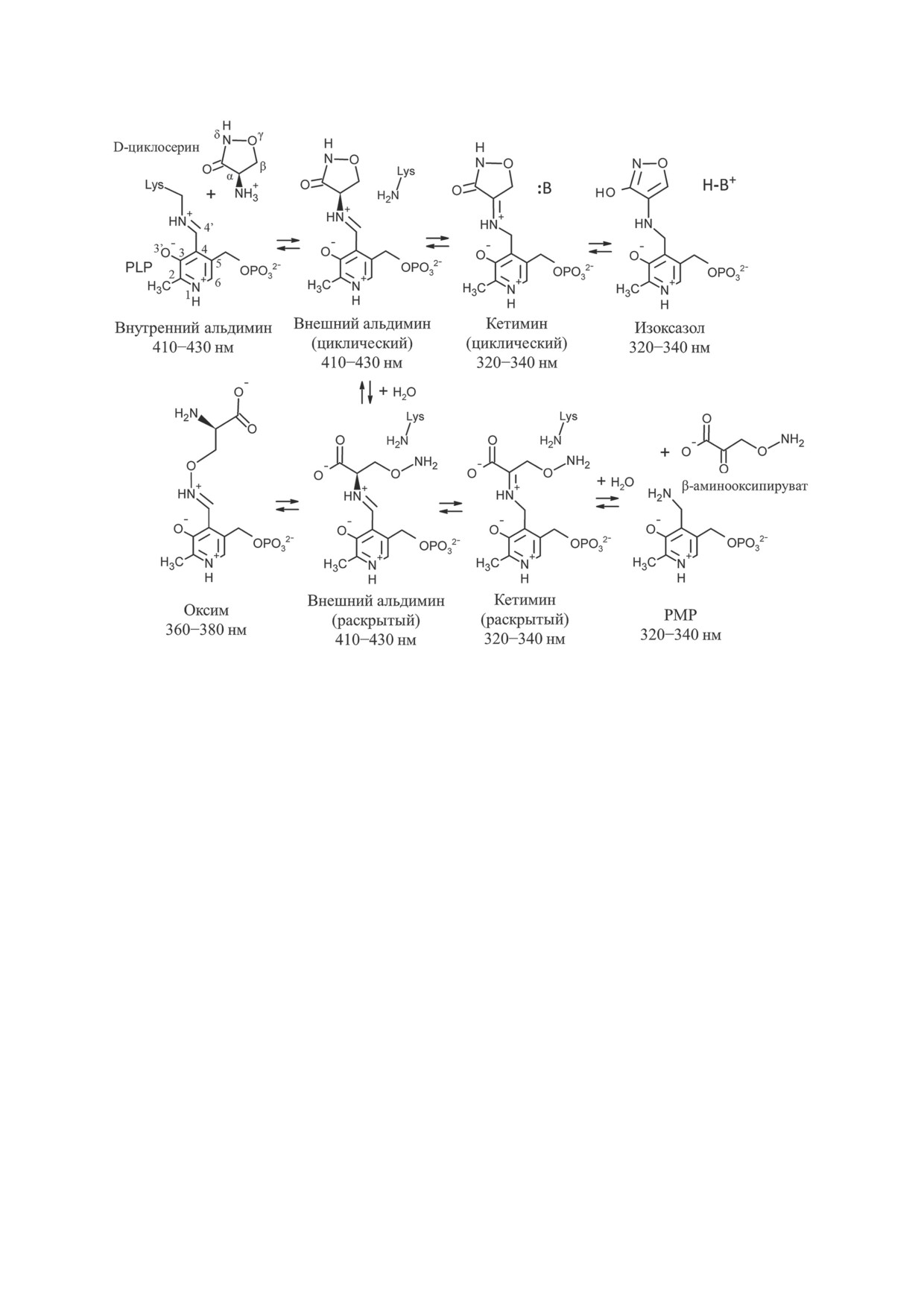
D-Циклосерин ингибирует пиридоксаль-5′-фосфат (PLP)-зависимые ферменты с различной
эффективностью в зависимости от организации активного центра фермента и механизма ката-
лизируемого превращения. D-Циклосерин взаимодействует с PLP-формой фермента подобно
субстратам (аминокислотам) и преимущественно обратимо. Известно несколько продуктов взаи-
модействия PLP c D-циклосерином, при этом для некоторых ферментов образование стабильного
ароматического гидроксиизоксазол-пиридоксамин-5′-фосфата при определённых значениях рН
приводит к необратимому ингибированию. Цель данной работы состояла в определении механиз-
ма ингибирования D-циклосерином PLP-зависимой трансаминазы D-аминокислот из бактерии
Haliscomenobacter hydrossis, которая характеризуется иной, чем у канонических трансаминаз D-ами-
нокислот, организацией активного центра. Спектральными методами обнаружено несколько про-
дуктов взаимодействия D-циклосерина и PLP в активном центре трансаминазы: оксим, образо-
ванный PLP и β-аминоокси-D-аланином; кетимин, образованный пиридоксамин-5′-фосфатом
и D-циклосерином в циклической форме; и пиридоксамин-5′-фосфат. Образование гидрокси-
изоксазол-пиридоксамин-5′-фосфата не установлено. Методом рентгеноструктурного анализа
получена пространственная структура комплекса трансаминазы с D-циклосерином. В активном
центре трансаминазы обнаружен кетимин, образованный пиридоксамин-5′-фосфатом и цикличе-
ской формой D-циклосерина. Кетимин находится в двух положениях, в которых он образует водо-
родные связи с разными остатками активного центра. Кинетическими и спектральными методами
показаны обратимость ингибирования D-циклосерином трансаминазы из H. hydrossis и восстанов-
ление активности фермента как избытком кетосубстрата, так и избытком кофактора. Полученные
результаты подтверждают взаимопревращение аддуктов D-циклосерина и PLP, а также обрати-
мость ингибирования D-циклосерином PLP-зависимых трансаминаз.
КЛЮЧЕВЫЕ СЛОВА: трансаминаза D-аминокислот, D-циклосерин, обратимое ингибирование, флуо-
ресценция, рентгеноструктурный анализ.
DOI: 10.31857/S0320972523050111, EDN: AYYWPB
ВВЕДЕНИЕ
серин применяется в терапии туберкулёза, как
ингибитор PLP-зависимой аланинрацемазы
D-Циклосерин, циклический аналог D-се-
у бактерии Mycobacterium tuberculosis (UniProt
рина, известен как ингибитор пиридоксаль-5′-
код: P9WQA9) [6]. Подобно субстратам (амино-
фосфат (PLP)-зависимых ферментов, включая
кислотам), D-циклосерин вступает в реакцию с
трансаминазы, декарбоксилазы и рацемазы [1-5].
кофактором PLP в активном центре фермента
D-Циклосерин относится к антибиотикам ши-
и образует внешний альдимин по механизму
рокого спектра действия, например, D-цикло- нуклеофильного замещения у С4′-атома PLP,
Принятые сокращения: PLP - пиридоксаль-5′-фосфат; PMP - пиридоксамин-5′-фосфат; ТА_Halhy - трансаминаза
D-аминокислот из бактерии Haliscomenobacter hydrossis.
* Адресат для корреспонденции.
841
842
БАКУНОВА и др.
Схема превращения D-циклосерина в активном центре PLP-зависимых ферментов с указанием максимумов поглоще-
ния образующихся соединений
далее протекает стереоселективный 1,3-пере-
фактора и β-аминооксипирувата, с последую-
нос протона при содействии аминогруппы
щим его разложением и накоплением PMP в
каталитического остатка лизина с образова-
активном центре трансаминазы [4]. На сегодня
нием кетимина - аддукта пиридоксамин-5′-
проведённые исследования позволяют пред-
фосфата (PMP) и кетопроизводного D-цикло-
ставить взаимодействие D-циклосерина и PLP
серина (схема). Кетимин далее превращается
в активном центре фермента в виде схемы, где
в стабильное ароматическое соединение - ад-
все стадии обратимы и образующиеся соедине-
дукт гидроксиизоксазола и PMP (изоксазол) -
ния переходят друг в друга.
путём отщепления протона от Сβ-атома [1-3].
В кристаллографических исследованиях
Ранее этот путь превращения считался необра-
комплексов PLP-зависимых ферментов с D-ци-
тимым [1-3], однако недавно методами ЯМР и
клосерином описаны разнообразные продукты
флуоресцентной спектроскопии установлено,
ингибирования: изоксазол; внешний альди-
что и в растворе, и в активном центре аланин-
мин, образованный PLP-формой кофактора и
рацемаз изоксазол со временем превращается в
циклической формой D-циклосерина (цикли-
оксим, образованный PLP-формой кофактора
ческий альдимин); кетимин, образованный
и β-аминоокси-D-аланином [7]. Образование
PMP-формой кофактора и циклической фор-
оксима происходит в результате внутримолеку-
мой кетопроизводного D-циклосерина (ци-
лярной перегруппировки, которой предшеству-
клический кетимин) и PMP. В большинстве
ет гидролиз D-циклосерина до β-аминоокси-
депонированных структур встречается изокса-
D-аланина (раскрытая форма D-циклосерина).
зол (PDB коды: 5U3F, 3E6E, 1VFS, 1EPV,
Кроме того, при изучении ингибирования ала-
2DAA) [1-3, 8, 9] или циклический альдимин
нин-глиоксалат-трансаминазы человека (Uni-
(PDB коды: 2RJH, 1I2L, 1D7S, 5FAJ, 3TCM,
prot код: P21549) D-циклосерином обнаружен
4D9F) [5, 10-13].
третий путь превращения D-циклосерина в
Среди PLP-зависимых трансаминаз инги-
активном центре фермента через образование
бирование D-циклосерином детально изучено
раскрытого кетимина, аддукта PMP-формы ко-
для трансаминазы разветвлённых L-аминокис-
БИОХИМИЯ том 88 вып. 5 2023
ИНГИБИРОВАНИЕ D-ЦИКЛОСЕРИНОМ ТРАНСАМИНАЗЫ ИЗ H. hydrossis
843
лот из M. tuberculosis (UniProt код: P9WQ75) [3],
ме того, для аланинглиоксилаттрансаминазы
для трансаминазы D-аминокислот из Bacillus sp.
человека наблюдается восстановление актив-
(Uniprot код: P19938) [1] и для аланин-глиок-
ности избытком субстрата [4]. Перечисленные
силат-трансаминазы человека
[4]. Фермен-
трансаминазы различаются укладкой PLP-свя-
тативное трансаминирование протекает по
зывающего домена и составом функциональ-
механизму последовательного двойного заме-
ных групп в активном центре.
щения, в реакции участвуют два субстрата
Настоящая работа является продолжени-
(аминокислота/амин и кетокислота/кетон),
ем исследований взаимодействия D-циклосе-
полная реакция трансаминирования является
рина с PLP-зависимыми трансаминазами. Объ-
суммой двух полуреакций. В первой полуре-
ектом исследования является трансаминаза
акции аминокислота/амин (субстрат амино-
D-аминокислот (EC 2.6.1.21) из бактерии Halis-
донор) реагирует с PLP в активном центре
comenobacter hydrossis (ТА_Halhy; UniProt код:
фермента, превращаясь в кетокислоту/кетон,
F4KWH0) [18]. ТА_Halhy активна в реакции
при этом кофактор переходит в PMP-форму.
трансаминирования с разнообразными кето-
Во второй полуреакции другая кетокислота/ке-
кислотами, наилучшим субстратом среди ами-
тон (субстрат аминоакцептор) превращается в
нокислот (субстратом аминодонором) является
новую аминокислоту/амин, исходная PLP-фор-
D-глутаминовая кислота. Функциональной еди-
ма кофактора регенерируется [14-16]. С транс-
ницей ТА_Halhy является гомодимер, содер-
аминазами D-циклосерин вступает в первую
жащий два симметричных активных центра.
полуреакцию (схема), продуктами которой мо-
Как и во всех трансаминазах, активный центр
гут быть изоксазол и циклический кетимин,
ТА_Halhy формируется остатками обеих субъ-
а в результате гидролиза D-циклосерина на-
единиц и молекулой PLP, ковалентно связан-
капливаются оксим, раскрытый кетимин и
ной с боковой группой остатка лизина (внут-
PMP [1, 3, 4]. Для ряда ферментов эффектив-
ренний альдимин). От известных канонических
ность ингибирования D-циклосерином растёт
трансаминаз D-аминокислот, включая транс-
во времени, что объясняется сходством меха-
аминазу D-аминокислот из Bacillus sp., ТА_Halhy
низмов взаимодействия ингибитора и субстрата
отличается составом функциональных групп в
аминокислоты с ферментом (первая полуре-
активном центре. Так, в активном центре ка-
акция). Если наблюдаемая константа скорости
нонических трансаминаз D-аминокислот при-
полуреакции между ферментом и D-цикло-
сутствует триада остатков аргинина, тирозина
серином значительно меньше наблюдаемой
и гистидина, боковые группы которых сбли-
константы скорости полуреакции фермента
жены в пространстве и образуют сайт связы-
со специфическим субстратом, то наибольшая
вания α-карбоксильной группы субстрата.
степень ингибирования достигается через не-
В активном центре ТА_Halhy нет канониче-
которое время [2-4].
ской триады, но имеются четыре положительно
Для трансаминаз описаны как обратимое,
заряженных остатка - три остатка аргинина и
так и необратимое ингибирование D-цикло-
один остаток лизина, которые, по-видимому,
серином. Например, активность трансаминаз
взаимодействуют с α-карбоксильной группой
из M. tuberculosis и Bacillus sp. необратимо
субстрата [18].
ингибируется D-циклосерином при рН 8,0-
Цель данной работы состояла в определении
8,5 [3, 17]. Однако активность трансаминазы из
механизма ингибирования ТА_Halhy D-цик-
Bacillus sp. восстанавливается при рН 6,5-7,5
лосерином. Детальное исследование взаимо-
в результате добавления PLP к ферменту [17].
действия D-циклосерина с ТА_Halhy прово-
О восстановлении активности трансаминазы
дили спектральными и кинетическими мето-
из M. tuberculosis сведений нет. Основным про-
дами. Методом рентгеноструктурного анализа
дуктом взаимодействия этих трансаминаз с
установлена пространственная структура ком-
D-циклосерином является изоксазол, образо-
плекса ТА_Halhy с D-циклосерином с раз-
вание которого подтверждено рентгенострук-
решением 1,4 Å и определены остатки, коор-
турным анализом комплексов ферментов с
динирующие молекулу ингибитора в активном
ингибитором [1, 3]. Для аланин-глиоксилат-
центре фермента. Проведённые исследования
трансаминазы человека ингибирование D-цик-
позволили изучить механизм ингибирования
лосерином является обратимым, образование
ТА_Halhy D-циклосерином, в том числе уста-
изоксазола не зафиксировано [4]. Спектраль-
новить обратимость ингибирования ТА_Halhy
ными методами показано образование оксима;
D-циклосерином, определить основные про-
рентгеноструктурным анализом в активном
дукты взаимодействия ТА_Halhy с D-циклосе-
центре комплекса фермента с D-циклосери-
рином и предложить способы восстановления
ном обнаружена PMP-форма кофактора. Кро-
активности ингибированного фермента.
БИОХИМИЯ том 88 вып. 5 2023
844
БАКУНОВА и др.
МАТЕРИАЛЫ И МЕТОДЫ
пературной инактивации ТА_Halhy при 40 °С
не наблюдалось [18]. Реакцию инициировали
Получение рекомбинантной ТА_Halhy. На-
добавлением α-кетоглутарата после инку-
работку и очистку ТА_Halhy проводили, как
бирования реакционной смеси с ТА_Halhy в
описано ранее [18]. Рекомбинантную ТА_Halhy
концентрации 0,35 мкг/мл (10 нМ) в течение
выделяли из биомассы штамма-продуцента
15 мин. D-Циклосерин к реакционной смеси
Escherichia coli BL21(DE3)pLys
(«Stratagene»,
добавляли вместе с α-кетоглутаратом.
США), несущего экспрессионный вектор pET_
Кинетические кривые аппроксимировали
21d_Halhy_2446. Рекомбинантную ТА_Halhy,
интегральным уравнением для медленно свя-
содержащую 6-His-фрагмент на C-конце, от-
зывающегося ингибитора (1) [19]:
деляли с помощью металл-хелатной аффинной
v0 - v′
хроматографии на колонке HisTrap HP («Cytiva»,
At = A0 - v′ × t -
× (1 - exp(-kинг × t)), (1)
kинг
США). Далее 6-His-фрагмент отщепляли TEV-
протеазой, ТА_Halhy отделяли от TEV-протеа-
где At - значение поглощения в момент време-
зы и продуктов протеолиза с помощью повтор-
ни t; A0 - значение поглощения в начальный
ной металл-хелатной аффинной хроматографии.
момент времени; v′ - скорость ферментативной
В заключение проводили гель-фильтрацию в
реакции после установления равновесия между
20 мМ HEPES/NaOH буфере (pH 7,5) с добав-
ферментом и ингибитором; v0 - начальная ско-
лением 150 мМ NaCl, 100 мкМ PLP и 1 мМ ди-
рость ферментативной реакции; kинг - наблю-
тиотреитола. Очищенную ТА_Halhy хранили
даемая константа скорости ингибирования.
в 50%-ном глицерине при -20 °C. Чистоту и
Параметры ингибирования рассчитывали
гомогенность препарата контролировали ДДС-
по уравнению (2) [19]:
ПААГ-электрофорезом. Концентрацию белка
[I]
определяли спектрофотометрически по погло-
kинг = kдисс × (1 +
каж
),
(2)
KI
щению при 280 нм.
PLP-форму ТА_Halhy получали инкубиро-
где kдисс - константа скорости диссоциации
ванием фермента в концентрации 2,5 мг/мл
комплекса фермент-ингибитор, [I] - концен-
(74 мкМ) с избытком PLP (700 мкМ) в присут-
трация ингибитора, Kкаж = kдисс/kасс - констан-
ствии 10 мМ α-кетоглутарата в течение 30 мин
та диссоциации комплекса фермент-инги-
при 40 °С. Кетосубстрат и несвязавшийся PLP
битор при заданной концентрации субстрата,
удаляли переводом в другой буфер, используя
kасс - константа скорости ассоциации фер-
колонку HiTrap Desalting («Cytiva»), уравнове-
мента с ингибитором. Каждое измерение про-
шенную 50 мМ K-фосфатным буфером (pH 8,0).
водили в трёх повторностях.
Кинетический анализ. Для анализа инги-
Спектральный анализ. Эксперименты про-
бирования TA_Halhy D-циклосерином были
водили в 50 мМ K-фосфатном буфере (pH 8,0)
получены полные кинетические кривые реак-
при 40 °С. К PLP-форме ТА_Halhy в концен-
ции трансаминирования между D-аланином
трации 0,85 мг/мл (25 мкМ) добавляли D-ци-
и α-кетоглутаратом в присутствии разных кон-
клосерин в концентрации 25 мМ и выдержива-
центраций D-циклосерина (3-50 мкМ) без
ли смесь в течение 30 мин. Белковую фракцию
предварительного инкубирования TA_Halhy c
отделяли от низкомолекулярных компонентов,
ингибитором. Накопление продукта реакции -
используя колонку HiTrap Desalting. Кроме
пирувата - определяли по убыли NADH в
того, фракцию низкомолекулярных компо-
сопряжённой ферментативной реакции с лак-
нентов получали ультрафильтрацией с ис-
татдегидрогеназой из мышцы кролика (LDH)
пользованием центрифужного концентратора
(«Sigma», США). Расходование NADH опре-
(30 кДа MWCO; «Millipore», США). Спектры
деляли спектрофотометрически при 340 нм
поглощения фракций регистрировали с помо-
(ε = 6,22 мМ-1⋅см-1) с использованием спек-
щью спектрофотометра Evolution 300 UV-Vis,
трофотометра Evolution 300 UV-Vis («Thermo
концентрация белка не превышала 0,85 мг/мл
Scientific», США). Реакцию трансаминирова-
(25 мкМ). Спектры флуоресценции фракций
ния, катализируемую ТА_Halhy, проводили в
регистрировали в диапазоне 345-600 нм при
50 мМ K-фосфатном буфере (pH 8,0) при 40 °C
длинах волн возбуждения 337 и 380 нм с по-
с субстратами D-аланином (5 мМ) и α-кето-
мощью спектрофлуориметра FluoroMax-4
глутаратом (2 мМ) с добавлением 30 мкМ PLP,
(«Horiba Scientific», Япония), концентра-
0,33 мМ NADH, 5 мкг/мл LDH (удельная ак-
ция белка не превышала 0,17 мг/мл (5 мкМ).
тивность препарата составляет 200 мкмоль/мин
За накоплением свободного PMP в растворе
на 1 мг белка). В условиях трансаминазной
при разложении продуктов взаимодействия
реакции препарат LDH был стабилен. Тем-
ТА_Halhy с D-циклосерином следили по убыли
БИОХИМИЯ том 88 вып. 5 2023
ИНГИБИРОВАНИЕ D-ЦИКЛОСЕРИНОМ ТРАНСАМИНАЗЫ ИЗ H. hydrossis
845
Параметры съёмки и данные кристаллографического
поглощения при 337 нм. За регенерацией PLP-
уточнения структуры комплекса ТА_Halhy c D-цикло-
формы ТА_Halhy при добавлении α-кетоглута-
серином
рата следили по росту поглощения при 416 нм.
Параметры съёмки
Для расчёта наблюдаемых констант скоростей
kнабл указанных процессов экспериментальные
Пространственная группа
C2
значения аппроксимировали уравнением ки-
нетики первого порядка (3):
86,9; 71,94;
a; b; c, Å
53,09
At = A∞ + (A0 - A∞) × exp (-kнабл × t),
(3)
90,00; 101,47;
α; β; γ, град
90,00
где At - значение поглощения в момент време-
Т, K
100
ни t, A∞ - предельное значение поглощения,
A0 - значение поглощения в начальный мо-
λ, Å
0,9
мент времени. Каждое измерение проводили в
42,52-1,41
трёх повторностях.
Разрешение, Å
(1,43-1,41)
Получение кристаллов комплекса ТА_Halhy
с D-циклосерином. Кристаллы комплекса
Число независимых рефлексов
61 465 (3027)
ТА_Halhy с D-циклосерином получали на-
Полнота набора, %
99,7 (99,9)
стаиванием. Для этого кристалл PLP-формы
ТА_Halhy, полученный как описано ранее [18],
I/σ (I)
6,5 (0,6)
вылавливали петлёй и помещали в раствор, со-
Rmeas, %
8,6 (4,7)
держащий, помимо компонентов противорас-
твора (0,1 M Na-ацетатного буфера (pH 4,8),
CC1/2, %
99,8 (94,6)
20% (v/v) PEG 3350), D-циклосерин в концен-
трации 10 мМ, до частичного обесцвечивания
Уточнение
кристалла (около 10 с).
Rfact, %
17,2
Сбор и обработка дифракционных данных.
Непосредственно перед рентгеноструктурным
Rfree, %
20,3
экспериментом кристаллы ТА_Halhy помеща-
Общий средний B-фактор
23,9
ли в криораствор, содержащий, помимо ком-
понентов противораствора, 25% (v/v) глице-
Средний B-фактор по белку
22,8
рина и D-циклосерин в концентрации 10 мМ,
Средний B-фактор по растворителю
32,8
после чего кристалл в петле замораживали
в парах азота. Дифракционные данные, со-
Средний B-фактор
25,3
бранные при температуре -173 °С на станции
по D-циклосерину
BL41XU синхротронного источника Spring8
Число неводородных атомов
(Япония), обрабатывали с использованием
программы Dials [20] из пакета CCP4 [21]. Ста-
Белок
2306
тистика собранного набора данных приведена
в таблице.
Растворитель
267
Решение и уточнение структуры. Решение
D-циклосерин
29
структуры проведено методом молекуляр-
ного замещения при помощи программы
Всего
2608
MOLREP [22]. В качестве стартовой модели
использовали структуру холоформы трансами-
Среднеквадратичные отклонения
назы D-аминокислот из H. hydrossis (PDB код:
Длины связей, Å
0,016
7P7X). Кристаллографическое уточнение струк-
туры проведено с использованием программ
Валентные углы, град
2,006
Refmac5 [23] и Coot [24] с использованием
изотропных тепловых факторов и атомов во-
График Рамачандрана
дорода в фиксированных положениях до до-
Наиболее благоприятные, %
97,9
стижения R-факторами значений: Rwork = 17,2%,
Rfree = 20,3% (таблица). В независимой части
Допустимые, %
2,1
кристалла комплекса ТА_Halhy c D-цикло-
Код PDB
8AHU
серином находится субъединица белка (283 ви-
Примечание. В скобках приведены значения для послед-
димых остатка), 267 молекул воды, одна мо-
него слоя.
лекула PLP в комплексе с D-циклосерином
БИОХИМИЯ том 88 вып. 5 2023
846
БАКУНОВА и др.
в двух положениях, а также одна молекула
ными методами и рентгеноструктурным ана-
глицерина из криораствора. Визуальный ана-
лизом.
лиз структурных данных проводили с исполь-
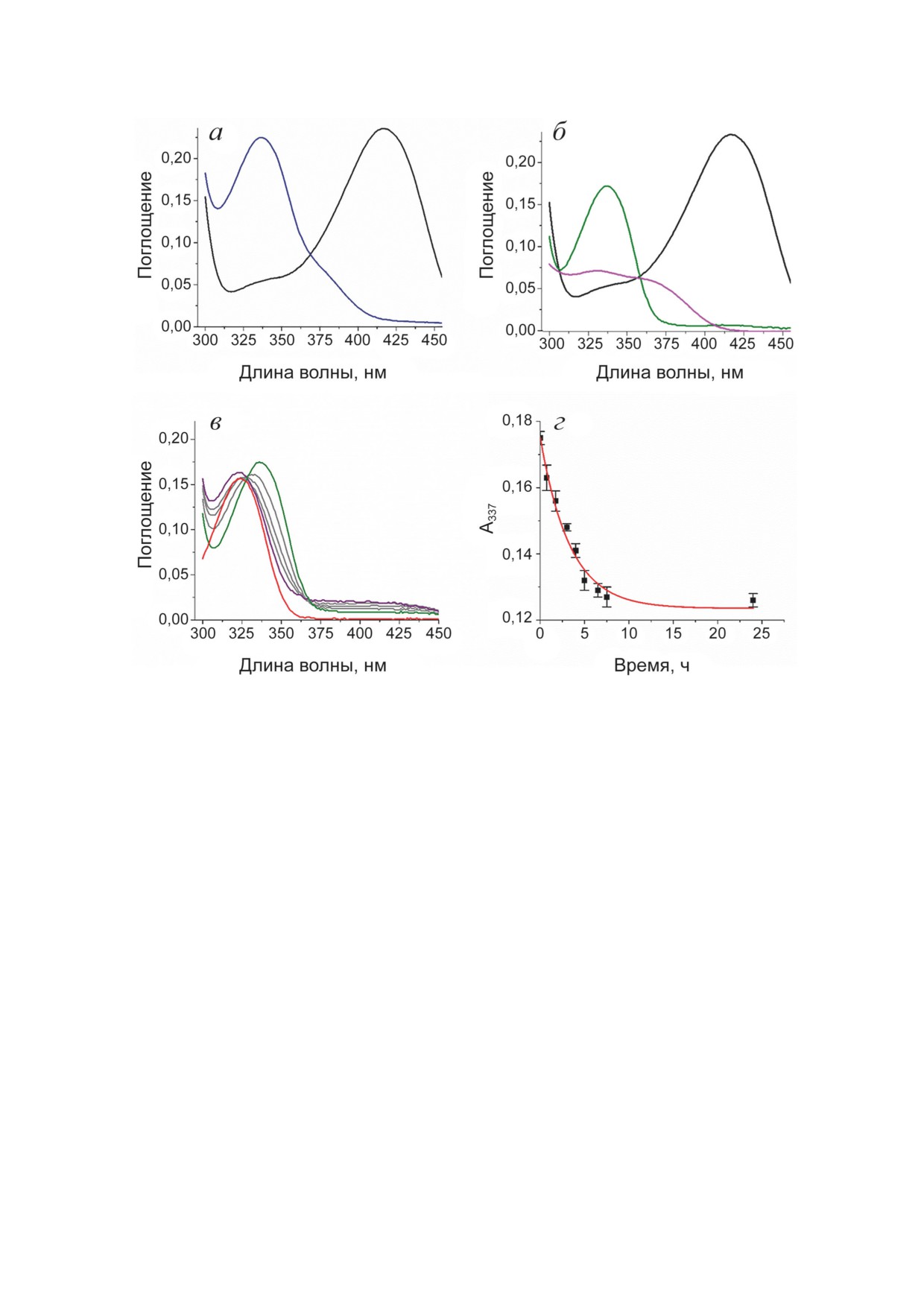
Спектральный анализ продуктов взаимодей-
зованием программ Coot и PyMOL Molecular
ствия ТА_Halhy с D-циклосерином. PLP-фор-
Graphics System, Version 4.6 («Schrödinger», USA).
ма Halhy имеет максимумы поглощения при
Сравнение структур проводили с использова-
280 нм и 416 нм (рис. 2, а), что соответствует
нием сервиса PDBeFOLD [25].
внутреннему альдимину ТА_Halhy. Выдержи-
вание 25 мкМ PLP-формы ТА_Halhy в 50 мМ
К-фосфатном буфере (pH 8,0), содержащем
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
25 мМ D-циклосерина, в течение 30 мин при
40 °С приводило к снижению поглощения
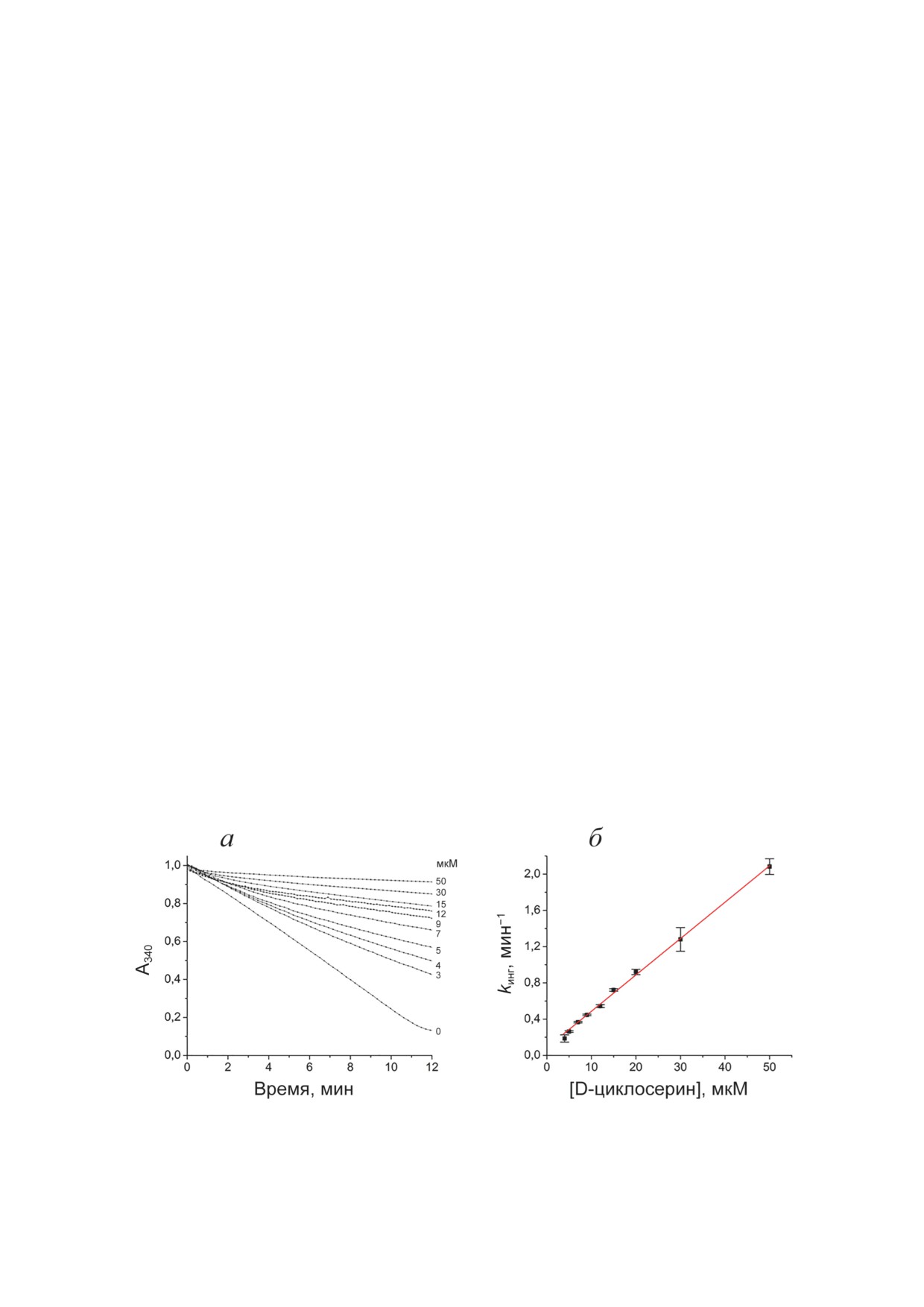
Ингибирование ТА_Halhy D-циклосерином.
при 416 нм и росту поглощения при 337 нм.
Вид полных кинетических кривых реакции
Конечный спектр имел максимумы поглоще-
трансаминирования, катализируемой ТА_Halhy,
ния при 280 нм и 337 нм с плечом при 380 нм
при разных концентрациях D-циклосерина со-
(рис. 2, а). Максимум при 337 нм указывал на
ответствовал росту эффективности ингибиро-
образование аддуктов кофактора и D-цикло-
вания ТА_Halhy D-циклосерином со време-
серина с sp3-гибридизацией С4′-атома кофак-
нем (рис. 1, а). Рассчитанные из кинетических
тора, а именно: циклического кетимина, рас-
кривых значения v0 не зависели от концен-
крытого кетимина, изоксазола и PMP [26, 27].
трации D-циклосерина, при этом константы
Плечо при 380 нм указывало на присутствие
скорости ингибирования линейно зависели от
среди продуктов оксима [28]. После перево-
концентрации ингибитора (рис. 1, б), что соот-
да в другой буфер спектр продуктов взаимо-
ветствовало одностадийному механизму обра-
действия ТА_Halhy с D-циклосерином имел
зования комплекса фермента с ингибитором:
максимумы при 280 нм и 337 нм, плеча при
E + I ↔ E [19]. Константа скорости ассоциа-
380 нм не наблюдалось, т.е. оксим в препара-
ции фермента с ингибитором (kасс) составила
те фермента отсутствовал (рис. 2, б). Спектр
0,040 ± 0,001 мин-1⋅мкМ-1, константа скоро-
низкомолекулярной фракции указывал на ча-
сти диссоциации (kдисс) - 0,086 ± 0,014 мин-1,
стичный выход в раствор продуктов взаимо-
кажущаяся константа диссоциации комплекса
действия кофактора и D-циклосерина, в том
фермент-ингибитор (Kкаж) - 2,1 ± 0,4 мкМ.
числе PMP и оксима (рис. 2, б). Дальнейшее
Проведённый кинетический анализ позво-
выдерживание препарата после смены буфера
лил количественно охарактеризовать про-
(рис. 2, в) привело к сдвигу максимума погло-
цессы образования и диссоциации комплекса
щения с 337 нм на 324 нм, что соответство-
фермента с ингибитором, дальнейшие пре-
вало разложению продуктов взаимодействия
вращения D-циклосерина в активном центре
до β-аминооксипирувата и PMP и их высво-
ТА_Halhy были проанализированы спектраль-
бождению из активного центра (спектр погло-
Рис. 1. Ингибирование D-циклосерином активности ТА_Halhy в реакции трансаминирования между D-аланином
(5 мМ) и α-кетоглутаратом (2 мМ) при 40 °С: а - кинетические кривые реакции, полученные при разных концентраци-
ях добавленного D-циклосерина (указаны справа); б - зависимость наблюдаемой константы скорости ингибирования
от концентрации D-циклосерина: экспериментальные значения показаны точками и представлены как среднее ± стан-
дартное отклонение, линейная аппроксимация показана красной линией
БИОХИМИЯ том 88 вып. 5 2023
ИНГИБИРОВАНИЕ D-ЦИКЛОСЕРИНОМ ТРАНСАМИНАЗЫ ИЗ H. hydrossis
847
Рис. 2. Взаимодействие PLP-формы ТА_Halhy (25 мкМ) с D-циклосерином в концентрации 25 мМ при 40 °С:
а - спектр поглощения PLP-формы TA_Halhy до (чёрный) и после 30 мин инкубирования с D-циклосерином (синий);
б - спектр поглощения PLP-формы ТА_Halhy до (чёрный) и после 30 мин инкубирования с D-циклосерином с после-
дующим переводом в новый буфер (зелёный), спектр поглощения низкомолекулярной фракции (розовый); в - изме-
нения в спектре поглощения продуктов взаимодействия PLP-формы ТА_Halhy с D-циклосерином после 30 мин инку-
бирования: сразу после смены буфера (зелёный), через 2, 4, 6 ч (серый) и через 24 ч (фиолетовый), спектр поглощения
свободного PMP в концентрации 25 мкМ (красный); г - зависимость поглощения при 337 нм от времени (из спектров
на рис. 2, в): экспериментальные значения показаны точками и представлены как среднее ± стандартное отклонение,
аппроксимация показана красной линией
щения PMP, связанного в активном центре
буждении на 337 нм имел максимумы при 390
ТА_Halhy, имеет максимум при 337 нм, спектр
и 450 нм, при возбуждении на 380 нм - имел
поглощения свободного PMP в K-фосфатном
максимум при 450 нм (рис. 3), что соответ-
буфере (pH 8,0) имеет максимум при 324 нм
ствовало оксиму [26]. Максимум при 390 нм
(рис. 2, в)). Наблюдаемая константа скоро-
принято относить к аддуктам PLP с низко-
сти накопления свободного PMP составила
молекулярными соединениями с sp3-гибри-
0,37 ± 0,07 ч-1 (рис. 2, г). Таким образом, в ре-
дизацией С4′-атома PLP (циклический кет-
зультате проведённого спектрального анализа
имин, раскрытый кетимин, изоксазол и PMP;
установлено взаимодействие D-циклосерина с
схема) [26, 27]. Спектр флуоресценции продук-
кофактором PLP в активном центре TA_Halhy,
тов взаимодействия после смены буфера при
определены продукты взаимодействия, их
возбуждении на 337 нм имел один максимум
постепенное разложение и, как следствие,
при 390 нм. Спектры флуоресценции низко-
накопление в растворе свободного PMP и апо-
молекулярной фракции при возбуждении
формы ТА_Halhy.
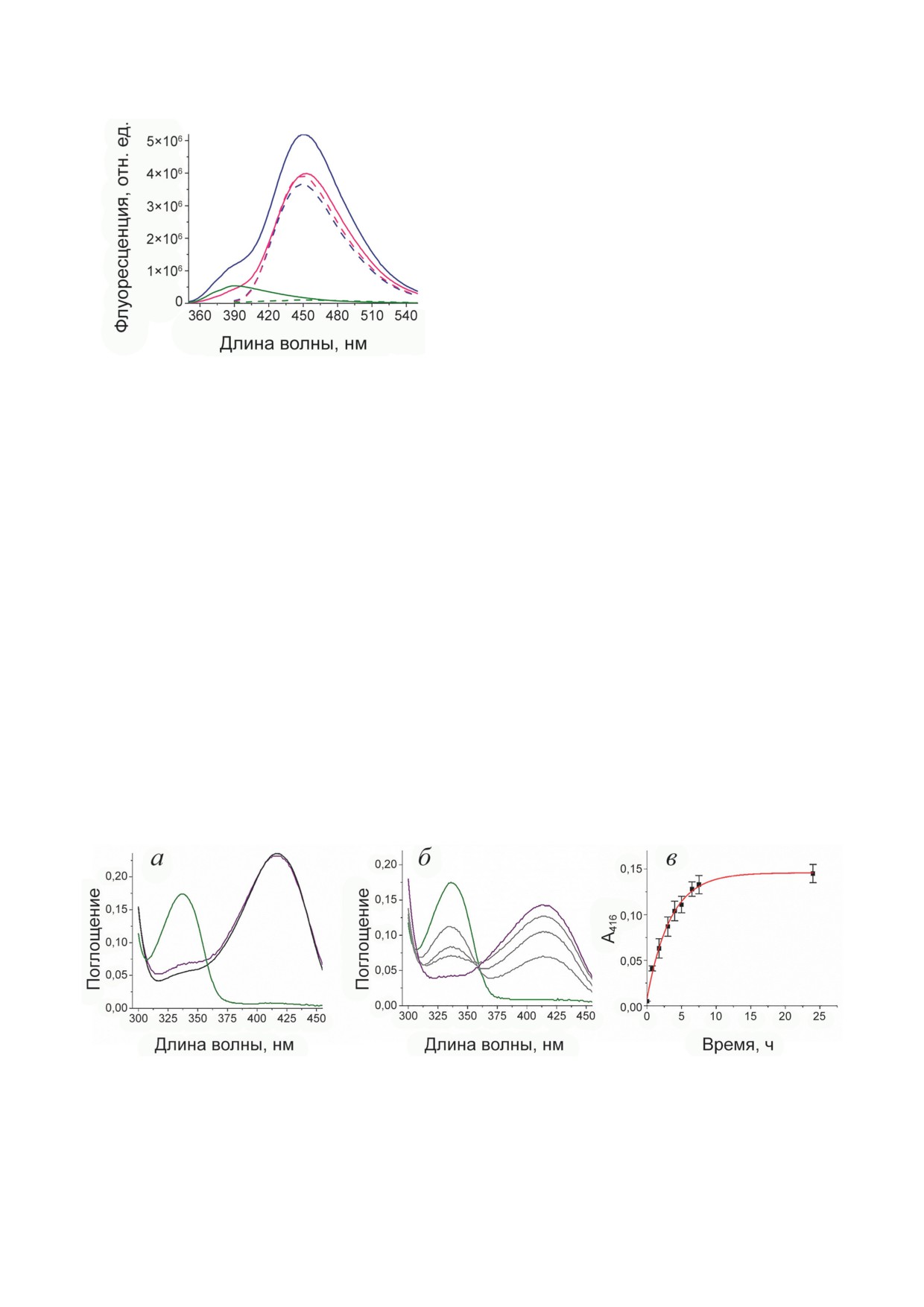
на 337 нм и 380 нм соответствовали несколь-
Анализ продуктов взаимодействия ТА_Halhy
ким продуктам: оксиму, характеризующемуся
с D-циклосерином провели методом флуо-
максимумом флуоресценции при 450 нм [26],
ресцентной спектроскопии. Спектр флуорес-
и аддуктам с sp3-гибридизацией С4′-атома, ха-
ценции продуктов взаимодействия при воз-
рактеризующимся максимумом флуоресценции
БИОХИМИЯ том 88 вып. 5 2023
848
БАКУНОВА и др.
буфер. К продуктам взаимодействия добавля-
ли свободный PLP в концентрации 250 мкМ,
что приводило в течение часа к полной регене-
рации PLP-формы фермента (рис. 4, а). Спек-
тральные изменения указывали на вытесне-
ние аддукта PLP и D-циклосерина молекулой
PLP в активном центре ТА_Halhy с образова-
нием внутреннего альдимина с максимумом
поглощения при 416 нм. При инкубировании
продуктов взаимодействия ТА_Halhy с D-цикло-
серином с субстратом α-кетоглутаратом в кон-
центрации 10 мМ в спектре продуктов исчезал
максимум поглощения при 337 нм и одновре-
Рис. 3. Спектры флуоресценции продуктов взаимодей-
менно увеличивалось поглощение при 416 нм,
ствия ТА_Halhy с D-циклосерином до (синий) и после
что указывало на регенерацию PLP-формы
смены буфера (зелёный), спектр флуоресценции низко-
фермента (рис. 4, б). Наблюдаемая константа
молекулярной фракции (розовый) при длинах волн воз-
буждения 337 нм (сплошная линия) и 380 нм (пунктир-
скорости регенерации PLP-формы ТА_Halhy
ная линия)
составила 0,32 ± 0,02 ч-1 (рис. 4, в). Поскольку
регенерация PLP-формы трансаминаз суб-
стратом α-кетоглутаратом возможна только в
при 390 нм [26, 27] (рис. 3). Таким образом,
полуреакции с PMP-формой фермента, то на-
проведённый анализ подтвердил наличие
блюдаемая регенерация субстратом PLP-формы
среди продуктов взаимодействия ТА_Halhy с
ТА_Halhy указывает на постепенное разложе-
D-циклосерином оксима и аддуктов с sp3-ги-
ние продуктов взаимодействия до β-амино-
бридизацией С4′-атома, причём оксим пол-
оксипирувата и PMP в активном центре фер-
ностью высвобождается из активного центра
мента (схема) и дальнейшее превращение РМР
фермента в раствор, а соединения с sp3-гибри-
в PLP в полуреакции с α-кетоглутаратом.
дизацией C4′-атома кофактора высвобожда-
Сходство величин наблюдаемых констант ско-
ются частично.
ростей регенерации PLP-формы фермента и
Анализ обратимости ингибирования. Обра-
накопления свободного PMP в растворе ука-
тимость ингибирования анализировали по ре-
зывает на общую лимитирующую стадию обо-
генерации PLP-формы ТА_Halhy при добавле-
их процессов - образование PMP в активном
нии к продуктам взаимодействия ТА_Halhy с
центре фермента.
D-циклосерином как PLP, так и субстрата α-ке-
Анализ структуры комплекса ТА_Halhy с D-цик-
тоглутарата. Для начала PLP-форму ТА_Halhy
лосерином. Кристаллы комплекса ТА_Halhy с
(25 мкМ) выдерживали с 25 мМ D-циклосери-
D-циклосерином принадлежат к пространствен-
ном в 50 мМ К-фосфатном буфере (рН 8,0)
ной группе C2. Пространственная структура
при 40 °С в течение 30 мин и далее обновляли
комплекса установлена с разрешением 1,4 Å
Рис. 4. Регенерация PLP-формы ТА_Halhy: а - спектр поглощения 25 мкМ PLP-формы ТА_Halhy до (чёрный) и после
30 мин инкубирования с D-циклосерином в концентрации 25 мМ с последующим обновлением буфера (зелёный),
после добавления PLP в концентрации 250 мкМ и повторной сменой буфера через 1 ч (фиолетовый); б - спектр по-
глощения 25 мкМ PLP-формы ТА_Halhy после 30 мин инкубирования с D-циклосерином в концентрации 25 мМ
с последующей сменой буфера (зелёный) и после добавления 10 мМ α-кетоглутарата через 2, 4, 6 ч (серый), и че-
рез 24 ч (фиолетовый); в - зависимость поглощения при 416 нм от времени (из спектров на рис. 4, б): эксперименталь-
ные значения показаны точками и представлены как среднее ± стандартное отклонение, аппроксимация показана
красной линией
БИОХИМИЯ том 88 вып. 5 2023
ИНГИБИРОВАНИЕ D-ЦИКЛОСЕРИНОМ ТРАНСАМИНАЗЫ ИЗ H. hydrossis
849
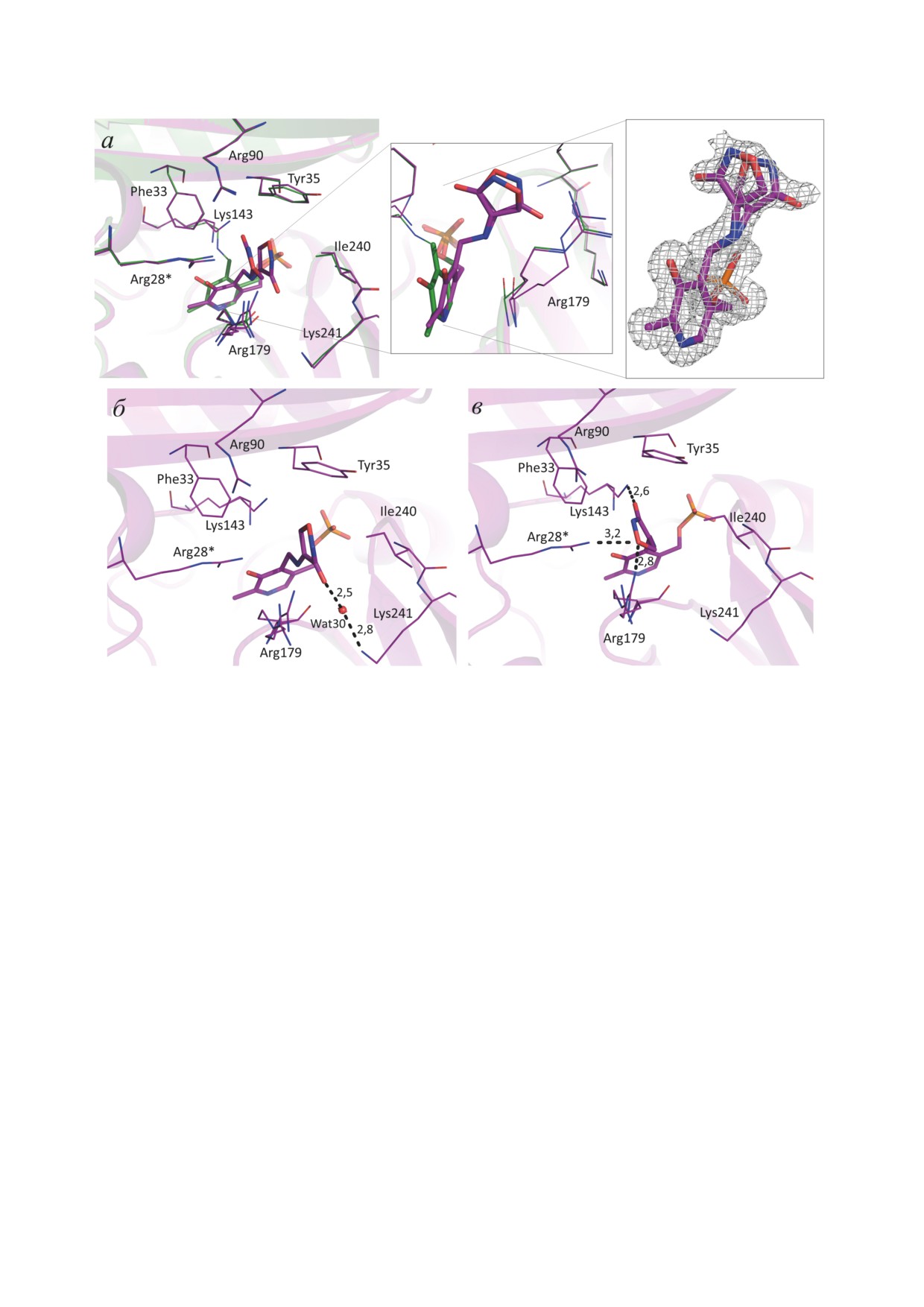
Рис. 5. Активный центр ТА_Halhy в комплексе с D-циклосерином: а - наложение структур комплекса ТА_Halhy
с D-циклосерином (розовый; PDB код: 8AHU) и холоформы ТА_Halhy (зелёный; PDB код: 7P7X), электронная плот-
ность 2Fo-Fc на уровне срезки 1,0 σ вокруг циклического кетимина; б и в - взаимодействие циклического кетимина
с остатками активного центра ТА_Halhy в двух положениях (б и в) с заселённостью 0,45 и 0,55 соответственно. Моле-
кула PLP и циклического кетимина представлены палочковой моделью, остатки активного центра представлены про-
волочной моделью, электронная плотность показана сетчатой поверхностью, водородные связи показаны чёрными
пунктирными линиями, длины водородных связей указаны в ангстремах. * Остатки соседней субъединицы гомодимера
и представляет собой гомодимер (PDB код:
лосерина с молекулой PLP, при этом кова-
8AHU), аналогичный гомодимеру холоформы
лентных связей аддукта с остатками активного
ТА_Halhy (PDB код: 7P7X), RMSD по Сα-ато-
центра ТА_Halhy не обнаружено (рис. 5, а).
мам не превышает 0,18 Å. Боковые группы
Карбонильные атомы кислорода двух конфор-
большинства остатков, формирующих актив-
маций аддукта ориентированы в противопо-
ный центр, при связывании D-циклосерина
ложные стороны (рис. 5, а). D-Циклосерин в
не поменяли своих положений, конформа-
аддукте сохранил циклическую форму, однако
ционные изменения наблюдались только для
его кольцо не является плоским, другими сло-
боковой группы Arg179, которая имеет два
вами, образование ароматического изоксазола
положения, и для боковой группы каталити-
не произошло. Детальный анализ положения
ческого Lys143, которая в структуре комплек-
аддукта в активном центре фермента показал,
са ТА_Halhy с D-циклосерином не образует
что плоскость пиридинового кольца молекулы
ковалентной связи с кофактором (рис. 5, а).
кофактора отклонилась от Lys143 в сторону
Таким образом, связывание D-циклосерина
Arg179 на угол около 20° относительно оси, про-
не приводит к реорганизации белковой гло-
ходящей по связи C6-N1 (рис. 5, а). Эти измене-
булы ТА_Halhy, наблюдаемые изменения огра-
ния подтверждают реакцию между PLP и D-цик-
ничиваются конформационными изменения-
лосерином, т.к. такое смещение кофактора
ми боковых групп в активном центре.
характерно для трансаминаз после разрыва
Электронная плотность, обнаруженная в
связи кофактора с каталитическим лизином
активном центре ТА_Halhy, соответствует двум
в ходе полуреакции с аминокислотой [29, 30].
конформациям аддукта циклического D-цик-
Двугранный угол С3-С4-C4A(С4′)-N в струк-
11
БИОХИМИЯ том 88 вып. 5 2023
850
БАКУНОВА и др.
туре комплекса ТА_Halhy с D-циклосерином
Активная PLP-форма ТА_Halhy может быть
составил ~84°, что указывает на переход С4′-
восстановлена двумя путями: избытком кофак-
атома PLP в sp3-гибридизацию, т.е. на образо-
тора PLP, в результате вытеснения аддуктoв
вание циклического кетимина. Данный угол в
PLP и D-циклосерина из активного центра
структурах ингибиторных комплексов транс-
фермента, и избытком α-кетоглутарата, в ре-
аминаз с sp2-гибридизацией С4′-атома PLP
зультате образования PMP и его последующего
составляет 0-40° [29, 31] и, таким образом, со-
перехода в PLP-форму в полуреакции с α-ке-
ответствует сопряжённой π-электронной си-
тоглутаратом. Следует отметить, что описан-
стеме между двойной связью С4′ = N и пири-
ная в данной работе регенерация PLP-формы
диновым кольцом, т.е. образованию внешнего
ТА_Halhy добавлением PLP в концентрации
альдимина или оксима. Изменение гибриди-
250 мкМ не имеет биологического смысла,
зации С4′-атома дополнительно подтвержда-
так как физиологическая концентрация PLP
ется обесцвечиванием кристаллов PLP-фор-
в клетке не превышает 1 мкМ [32]. Однако
мы ТА_Halhy при вымачивании в растворе
регенерация PLP-формы ТА_Halhy избытком
D-циклосерина. В активном центре ТА_Halhy
кетосубстрата α-кетоглутарата возможна и в
аддукт PLP и D-циклосерина координируется
клетке, так как разложение кетимина (как ци-
несколькими водородными связями, которые,
клического, так и раскрытого) с образованием
однако, различаются для каждого из двух по-
PMP-формы фермента протекает спонтанно,
ложений аддукта. Так, в одном положении
а концентрация свободного α-кетоглутарата в
атом кислорода карбонильной группы D-цик-
клетке достигает 2 мM [33].
лосерина координирован боковой группой
Опираясь на схему, механизм ингиби-
Lys241 через молекулу воды Wat30 (рис. 5, б).
рования ТА_Halhy D-циклосерином можно
Во втором положении боковые группы Arg28*
представить следующим образом: в активном
и Arg179 (* - остаток, принадлежащий сосед-
центре аминогруппа D-циклосерина заме-
ней субъединице) образуют две водородные
щает боковую группу каталитического лизина
связи с атомом Oγ, а Nε-атом боковой груп-
с образованием внешнего циклического альд-
пы каталитического остатка лизина образует
имина, который далее обратимо превращается
водородную связь с атомом кислорода карбо-
в циклический кетимин, а через раскрытый
нильной группы D-циклосерина (рис. 5, в).
альдимин - в оксим или раскрытый кетимин с
последующим разложением до PMP и β-амино-
оксипирувата с дальнейшим высвобождением
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
продуктов из активного центра фермента. Зна-
чение кажущейся константы диссоциации ком-
В результате проведённых эксперимен-
плекса ТА_Halhy с D-циклосерином составляет
тов установлено, что D-циклосерин обратимо
2,1 ± 0,4 мкМ и значительно ниже, чем значе-
ингибирует трансаминазу D-аминокислот из
ния используемых концентраций субстратов в
H. hydrossis, при этом D-циклосерин медлен-
трансаминазной реакции (5 мМ D-аланина и
но связывается с ферментом. Подтверждено
2 мМ α-кетоглутарата) и чем значения констант
образование трёх продуктов взаимодействия:
Михаэлиса для данных субстратов (Km состав-
оксима, циклического кетимина и PMP. Об-
ляет 23 ± 1 и 2,3 ± 0,2 мМ для D-аланина и
разование оксима не является необратимым
α-кетоглутарата соответственно [18]).
ингибированием для ТА_Halhy, так как обра-
Поскольку D-циклосерин взаимодействует
зующаяся в результате диссоциации оксима
с ферментом аналогично субстратам (D-ами-
апоформа фермента полностью переходит в
нокислотам), анализ положения циклического
активную PLP-форму при добавлении PLP.
кетимина в активном центре TA_Halhy позво-
Остальные соединения (циклический альди-
лил уточнить остатки, способные связывать
мин, раскрытый альдимин и раскрытый кет-
субстрат в активном центре фермента. В свя-
имин) также образуются в ходе взаимодей-
зывании D-циклосерина в активном центре
ствия, так как, согласно схеме, накопление
ТА_Halhy участвуют боковые группы четы-
PMP возможно только в результате превраще-
рёх остатков: Arg28*, Lys143, Arg179 и Lys241
ния этих соединений. Изоксазол среди про-
(* - остаток, принадлежащий соседней субъ-
дуктов взаимодействия не обнаружен. Тем не
единице). Для сравнения, в активном центре
менее, принимая во внимание подтверждён-
канонической трансаминазы из Bacillus sp.
ную недавно обратимость стадии превращения
D-циклосерин координирован боковыми груп-
циклического кетимина в изоксазол [7], обра-
пами остатков Tyr31, Arg98*, His100* канони-
тимое образование изоксазола из циклическо-
ческой триады, образующей сайт связыва-
го кетимина не исключено и для ТА_Halhy.
ния α-карбоксильной группы субстратов [1].
БИОХИМИЯ том 88 вып. 5 2023
ИНГИБИРОВАНИЕ D-ЦИКЛОСЕРИНОМ ТРАНСАМИНАЗЫ ИЗ H. hydrossis
851
Полученный комплекс ТА_Halhy c D-цикло-
Вклад авторов. А.К. Бакунова - планиро-
серином указывает на неканонический тип
вание экспериментов; Е.Ю. Безсуднова и
связывания α-карбоксильной группы в актив-
В.О. Попов - концепция и руководство рабо-
ном центре TA_Halhy с участием удалённых в
той; А.К. Бакунова, А.Ю. Николаева, И.О. Ма-
пространстве остатков Arg28*, Arg179 и Lys241.
тюта, К.М. Бойко - проведение эксперимен-
Участие каталитического Lys143 в связывании
тов; А.К. Бакунова, И.О. Матюта, К.М. Бойко,
D-циклосерина является результатом неза-
Е.Ю. Безсуднова - обсуждение результатов ис-
вершённости полуреакции и артефактом кри-
следования; А.К. Бакунова, Е.Ю. Безсуднова -
сталлизации.
написание текста; А.К. Бакунова, К.М. Бойко,
Таким образом, несмотря на отличную от
A.Ю. Николаева, Е.Ю. Безсуднова, В.О. По-
канонической организацию активного цен-
пов - редактирование текста статьи.
тра, трансаминаза D-аминокислот из H. hy-
Финансирование. Работа выполнена при
drossis ингибируется D-циклосерином. Свя-
поддержке Российского научного фонда (грант
зывание D-циклосерина в активном центре
№ 19-14-00164) в части проведения кинетиче-
фермента отличается от описанных ранее
ских экспериментов и кристаллизации ком-
вариантов связывания субстратов в активном
плекса, решения и уточнения структуры. Ра-
центре трансаминаз. D-Циклосерин является
бота выполнена при поддержке Министерства
эффективным, но обратимым ингибитором
науки и высшего образования Российской
трансаминазы из H. hydrossis. Обобщая, стоит
Федерации в части проведения спектральных
отметить, что наблюдаемая для разнообраз-
исследований. Рентгеноструктурный экспе-
ных PLP-зависимых ферментов обратимость
римент выполнен при поддержке Федераль-
ингибирования D-циклосерином и восстанов-
ного космического агентства (проект КЭ (ЦР)
ление их активности избытком кофактора или
«Кристаллизатор»).
субстрата снижает эффективность примене-
Конфликт интересов. Авторы заявляют об
ния D-циклосерина как антибактериального
отсутствии конфликта интересов.
препарата, однако не отменяет использование
Соблюдение этических норм. Настоящая
D-циклосерина как регулятора активности
статья не содержит описания выполненных ав-
ферментов в биохимических экспериментах и
торами исследований с участием людей или ис-
при разработке биотехнологических процессов.
пользованием животных в качестве объектов.
СПИСОК ЛИТЕРАТУРЫ
1. Peisach, D., Chipman, D. M., Van Ophem, P. W.,
5. Malashkevich, V. N., Strop, P., Keller, J. W.,
Manning, J. M., and Ringe, D. (1998) D-Cycloserine
Jansonius, J. N., and Toney, M. D. (1999) Crystal
inactivation of D-amino acid aminotransferase leads to
structures of dialkylglycine decarboxylase inhibitor
a stable noncovalent protein complex with an aromatic
complexes, J. Mol. Biol., 294, 193-200, doi: 10.1006/
cycloserine-PLP derivative, J. Am. Chem. Soc., 120,
jmbi.1999.3254.
2268-2274, doi: 10.1021/ja973353f.
6. Caminero, J. A., Sotgiu, G., Zumla, A., and Migliori,
2. Fenn, T. D., Stamper, G. F., Morollo, A. A., and
G. B. (2010) Best drug treatment for multidrug-
Ringe, D. (2003) A side reaction of alanine racemase:
resistant and extensively drug-resistant tuberculosis,
transamination of cycloserine, Biochemistry, 42, 5775-
Lancet. Infect. Dis.,
10,
621-629, doi:
10.1016/
5783, doi: 10.1021/bi02702 2d.
S1473-3099(10)70139-0.
3. Amorim Franco, T. M., Favrot, L., Vergnolle, O.,
7. De Chiara, C., Homšak, M., Prosser, G. A., Douglas,
and Blanchard, J. S.
(2017) Mechanism-based
H. L., Garza-Garcia, A., Kelly, G., Purkiss, A. G.,
inhibition of the Mycobacterium tuberculosis branched-
Tate, E. W., and de Carvalho, L. P. S.
(2020)
chain aminotransferase by d- and l-cycloserine,
D-Cycloserine destruction by alanine racemase and
ACS Chem. Biol.,
12,
1235-1244, doi:
10.1021/
the limit of irreversible inhibition, Nat. Chem. Biol.,
acschembio.7b00142.
16, 686-694, doi: 10.1038/s41589-020-0498-9.
4. Dindo, M., Grottelli, S., Annunziato, G., Giardina, G.,
8. Priyadarshi, A., Lee, E. H., Sung, M. W., Nam, K. H.,
Pieroni, M., Pampalone, G., Faccini, A., Cutruzzolà, F.,
Lee, W. H., Kim, E. E., and Hwang, K. Y. (2009)
Laurino, P., Costantino, G., and Cellini, B. (2019)
Structural insights into the alanine racemase from
Cycloserine enantiomers are reversible inhibitors of
Enterococcus faecalis, Biochim. Biophys. Acta, 1794,
human alanine:glyoxylate aminotransferase: implica-
1030-1040, doi: 10.1016/j.bbapap.2009.03.006.
tions for Primary Hyperoxaluria type 1, Biochem. J.,
9. Noda, M., Matoba, Y., Kumagai, T., and
476, 3751-3768, doi: 10.1042/BCJ20190507.
Sugiyama, M. (2004) Structural evidence that ala-
БИОХИМИЯ том 88 вып. 5 2023
11*
852
БАКУНОВА и др.
nine racemase from a D-cycloserine-producing mi-
20.
Winter, G., Waterman, D. G., Parkhurst, J. M.,
croorganism exhibits resistance to its own product,
Brewster, A. S., Gildea, R. J., Gerstel, M., Fuentes-
J. Biol. Chem., 279, 46153-46161, doi: 10.1074/jbc.
Montero, L., Vollmar, M., Michels-Clark, T., Young,
M404605200.
I. D., Sauter, N. K., and Evans, G. (2018) DIALS:
10.
Wu, D., Hu, T., Zhang, L., Chen, J., Du, J., Ding, J.,
implementation and evaluation of a new integration
Jiang, H., and Shen, X. (2008) Residues Asp164 and
package, Acta Crystallogr. Sect. D Struct. Biol., 74, 85-
Glu165 at the substrate entryway function potently in
97, doi: 10.1107/S2059798317017235.
substrate orientation of alanine racemase from E. coli:
21.
Collaborative Computational Project, N.
4
(1994)
enzymatic characterization with crystal structure
The CCP4 suite: programs for protein crystallography,
analysis, Protein Sci., 17, 1066-1076, doi: 10.1110/
Acta Crystallogr. Sect. D Biol. Crystallogr., 50, 760-763,
ps.083495908.
doi: 10.1107/S0907444994003112.
11.
Tassoni, R., van der Aart, L. T., Ubbink, M., van
22.
Vagin, A., and Teplyakov, A.
(1997) MOLREP:
Wezel, G. P., and Pannu, N. S. (2017) Structural
an automated program for molecular replacement,
and functional characterization of the alanine
J. Appl. Crystallogr., 30, 1022-1025, doi: 10.1107/
racemase from Streptomyces coelicolor A3(2), Biochem.
S0021889897006766.
Biophys. Res. Commun., 483, 122-128, doi: 10.1016/
23.
Murshudov, G. N., Skubák, P., Lebedev, A. A., Pannu,
j.bbrc.2016.12.183.
N. S., Steiner, R. A., Nicholls, R. A., Winn, M. D.,
12.
Duff, S. M. G., Rydel, T. J., McClerren, A. L.,
Long, F., and Vagin, A. A. (2011) REFMAC 5 for the
Zhang, W., Li, J. Y., Sturman, E. J., Halls, C.,
refinement of macromolecular crystal structures, Acta
Chen, S., Zeng, J., Peng, J., Kretzler, C. N., and
Crystallogr. Sect. D Biol. Crystallogr., 67, 355-367,
Evdokimov, A. (2012) The enzymology of alanine
doi: 10.1107/S0907444911001314.
aminotransferase (AlaAT) isoforms from Hordeum
24.
Emsley, P., and Cowtan, K. (2004) Coot: model-
vulgare and other organisms, and the HvAlaAT crystal
building tools for molecular graphics, Acta Crystallogr.
structure, Arch. Biochem. Biophys.,
528,
90-101,
Sect. D Biol. Crystallogr., 60, 2126-2132, doi: 10.1107/
doi: 10.1016/j.abb.2012.06.006.
S0907444904019158.
13.
Bharath, S. R., Bisht, S., Harijan, R. K., Savithri,
25.
Krissinel, E., and Henrick, K. (2004) Secondary-
H. S., and Murthy, M. R. N. (2012) Structural
structure matching (SSM), a new tool for fast
and mutational studies on substrate specificity and
protein structure alignment in three dimensions, Acta
catalysis of Salmonella typhimurium D-cysteine
Crystallogr. Sect. D Biol. Crystallogr., 60, 2256-2268,
desulfhydrase, PLoS One, 7, e36267, doi: 10.1371/
doi: 10.1107/S0907444904026460.
journal.pone.0036267.
26.
Beeler, T., and Churchich, J. E. (1976) Reactivity
14.
Braunstein, A. E. (1973) Amino group transfer, The
of the phosphopyridoxal groups of cystathionase,
enzymes, (Boyer, P., ed.) Academic Press, N.Y.,
J. Biol. Chem.,
251,
5267-5271, doi:
10.1016/
pp. 379-481, doi: 10.1016/S1874-6047(08)60122-5.
S0021-9258(17)33156-3.
15.
Eliot, A. C., and Kirsch, J. F. (2004) Pyridoxal phos-
27.
Honikel, K. O., and Madsen, N. B. (1972) Compar-
phate enzymes: mechanistic, structural, and evolu-
ison of the absorbance spectra and fluorescence be-
tionary considerations, Annu. Rev. Biochem., 73, 383-
havior of phosphorylase b with that of model pyridox-
415, doi: 10.1146/annurev.biochem.73.011303.074021.
al phosphate derivatives in various solvents, J. Biol.
16.
Toney, M. D. (2011) Controlling reaction specificity in
Chem.,
247,
1057-1064, doi:
10.1016/S0021-9258
pyridoxal phosphate enzymes, Biochim. Biophys. Acta.,
(19)45615-9.
1814, 1407-1418, doi: 10.1016/j.bbapap.2011.05.019.
28.
Delbaere, L. T. J., Kallen, J., Markovic-Housley, Z.,
17.
Soper, T. S., and Manning, J. M. (1981) Different
Khomutov, A. R., Khomutov, R. M., Karpeisky,
modes of action of inhibitors of bacterial D-amino
M. Y., and Jansonius, J. N. (1989) Complexes of as-
acid transaminase. A target enzyme for the design of
partate aminotransferase with hydroxylamine de-
new antibacterial agents, J. Biol. Chem., 256, 4263-
rivatives: spectral studies in solution and in the crys-
4268, doi: 10.1016/s0021-9258(19)69428-7.
talline state, Biochimie, 71, 449-459, doi: 10.1016/
18.
Bakunova, A. K., Nikolaeva, A. Y., Rakitina, T. V.,
0300-9084(89)90175-2.
Isaikina, T. Y., Khrenova, M. G., Boyko, K. M., Popov,
29.
Okada, K., Hirotsu, K., Hayashi, H., and Kaga-
V. O., and Bezsudnova, E. Y. (2021) The uncommon
miyama, H. (2001) Structures of Escherichia coli
active site of D-amino acid transaminase from
branched-chain amino acid aminotransferase and its
Haliscomenobacter hydrossis: biochemical and struc-
complexes with 4-methylvalerate and 2-methylleucine:
tural insights into the new enzyme, Molecules, 26,
induced fit and substrate recognition of the
5053, doi: 10.3390/molecules26165053.
enzyme, Biochemistry, 40, 7453-7463, doi: 10.1021/
19.
Morrison, J. F., and Walsh, C. T. (1998) The behavior
bi010384l.
and significance of slow-binding enzyme inhibitors,
30.
Peisach, D., Chipman, D. M., Van Ophem, P. W.,
Adv. Enzymol. Relat. Areas Mol. Biol., 61, 201-301,
Manning, J. M., and Ringe, D. (1998) Crystallographic
doi: 10.1002/9780470123072.ch5.
study of steps along the reaction pathway of D-amino
БИОХИМИЯ том 88 вып. 5 2023
ИНГИБИРОВАНИЕ D-ЦИКЛОСЕРИНОМ ТРАНСАМИНАЗЫ ИЗ H. hydrossis
853
acid aminotransferase, Biochemistry, 37, 4958-4967,
32. Di Salvo, M. L., Contestabile, R., and Safo, M. K.
doi: 10.1021/bi972884d.
(2011) Vitamin B(6) salvage enzymes: mechanism,
31. Marković-Housley, Z., Schirmer, T., Hohenester, E.,
structure and regulation, Biochim. Biophys. Acta, 1814,
Khomutov, A. R., Khomutov, R. M., Karpeisky,
1597-1608, doi: 10.1016/j.bbapap.2010.12.006.
M. Y., Sandmeier, E., Christen, P., and Jansonius,
33. Thirstrup, K., Christensen, S., Møller, H. A., Ritzén, A.,
J. N. (1996) Crystal structures and solution studies of
Bergström, A. L., Sager, T. N., and Jensen, H. S. (2011)
oxime adducts of mitochondrial aspartate aminotrans-
Endogenous 2-oxoglutarate levels impact potencies of
ferase, Eur. J. Biochem., 236, 1025-1032, doi: 10.1111/
competitive HIF prolyl hydroxylase inhibitors, Pharma-
j.1432-1033.1996.01025.x.
col. Res., 64, 268-273, doi: 10.1016/j.phrs.2011.03.017.
MECHANISM OF D-CYCLOSERINE INHIBITION
OF D-AMINO ACID TRANSAMINASE FROM Haliscomenobacter hydrossis
A. K. Bakunova1*, I. O. Matyuta1, A. Yu. Nikolaeva1,2, K. M. Boyko1,
V. O. Popov1,3, and E. Yu. Bezsudnova1*
1 Bach Institute of Biochemistry, Research Center of Biotechnology of the Russian Academy of Sciences,
119071 Moscow, Russia; e-mail: a.bakunova@fbras.ru, eubez@inbi.ras.ru
2 Kurchatov Complex of NBICS-Technologies, National Research Centre “Kurchatov Institute”,
123182 Moscow, Russia
3 Faculty of Biology, Lomonosov Moscow State University, 119991 Moscow, Russia
D-cycloserine inhibits pyridoxal-5′-phosphate (PLP)-dependent enzymes. The inhibition efficiency
depends on the organization of their active center and the mechanism of the catalyzed reaction. D-cyclos-
erine interacts with the PLP form of enzyme similarly to substrate amino donor, and the interaction is pre-
dominantly reversible. Inhibition products include hydroxyisoxazole-pyridoxamine-5′-phosphate, oxime
between PLP and β-aminooxy-D-alanine, ketimine between pyridoxamine-5′-phosphate and cyclic or
open forms of D-cycloserine, pyridoxamine-5′-phosphate, etc. For some enzymes the formation of a stable
aromatic product - hydroxyisoxazole can lead to irreversible D-cycloserine inhibition at certain pH value.
The aim of this work was to study the mechanism of D-cycloserine inhibition of PLP-dependent D-amino
acid transaminase from the bacterium Haliscomenobacter hydrossis. Spectral methods revealed several
products of the interaction of D-cycloserine with PLP in the active site of transaminase: oxime between
PLP and β-aminooxy-D-alanine, ketimine between pyridoxamine-5′-phosphate and cyclic or open forms
of D-cycloserine, pyridoxamine-5′-phosphate. The formation of hydroxyisoxazole-pyridoxamine-5′-
phosphate was not observed. The 3D structure of the complex of transaminase with D-cycloserine was
obtained by X-ray diffraction analysis. In the active site of transaminase, a ketimine adduct between pyr-
idoxamine-5′-phosphate and D-cycloserine in the cyclic form was found; the ketimine occupied two posi-
tions and was coordinated via hydrogen bonds with different active site residues. Using kinetic and spectral
methods we have shown that D-cycloserine inhibition is reversible, and the activity of transaminase from
H. hydrossis can be restored by adding an excess of keto substrate as well as by adding an excess of cofactor.
The results obtained confirm the reversibility of D-cycloserine inhibition and the conversion of various
adducts of D-cycloserine and PLP into each other.
Keywords: D-amino acid transaminase, D-cycloserine, reversible inhibition, fluorescence, X-ray diffraction analysis
БИОХИМИЯ том 88 вып. 5 2023