БИОХИМИЯ, 2023, том 88, вып. 5, с. 854 - 860
УДК 612.015;612.123;616.13-004.6;616.153.915;616.155.2;547.915.5;547.963
АДСОРБЦИЯ АЦИЛГИДРОПЕРОКСИ-ПРОИЗВОДНЫХ
ФОСФОЛИПИДОВ БИОМЕМБРАН
ЛИПОПРОТЕИДАМИ ПЛАЗМЫ КРОВИ
© 2023 В.З. Ланкин*, А.К. Тихазе, В.Я. Косач, Г.Г. Коновалова
ФГБУ «Национальный медицинский исследовательский центр кардиологии имени академика Е.И. Чазова»
Миздрава России, 121552 Москва, Россия; электронная почта: lankin0309@mail.ru
Поступила в редакцию 11.02.2023
После доработки 21.03.2023
Принята к публикации 21.03.2023
Установлено, что ацилгидроперокси-производные фосфолипидов окисленных митохондрий пе-
чени крысы при совместной инкубации с липопротеидами плазмы крови захватываются преиму-
щественно частицами липопротеидов низкой плотности (ЛНП), но не липопротеидов высокой
плотности (ЛВП), что опровергает ранее высказанную гипотезу об участии ЛВП в обратном транс-
порте окисленных фосфолипидов и подтверждает возможность различных механизмов накопле-
ния липогидропероксидов в ЛНП при окислительном стрессе.
КЛЮЧЕВЫЕ СЛОВА: окисленные фосфолипиды, трансмембранный перенос липопероксидов, липо-
протеиды низкой плотности (ЛНП), липопротеиды высокой плотности (ЛВП).
DOI: 10.31857/S0320972523050123, EDN: AZFLNP
ВВЕДЕНИЕ
ской модификации с участием низкомолеку-
лярных дикарбонилов, образующихся при сво-
Транспорт липидов в организме осущест-
боднорадикальном окислении полиеновых ли-
вляется липопротеидами плазмы крови, кото-
пидов (таких, как малоновый диальдегид - МДА)
рые представлены двумя основными класса-
и при ферментативном окислении или авто-
ми - липопротеиды низкой плотности (ЛНП) и
окислении глюкозы и других 6-атомных угле-
липопротеиды высокой плотности (ЛВП). Ча-
водов (таких, как глиоксаль и метилглиок-
стицы (наночастицы по размеру) этих классов
саль) [14-16]. Частицы дикарбонил-модифи-
липопротеидов существенно различаются по
цированных ЛНП опознаются scavenger-рецеп-
метаболическим функциям, а также по размеру
торами и захватываются клетками сосудистой
и химическому составу [1-4]. Частицы ЛВП со-
стенки, вследствие чего они превращаются в
держат апопротеины А1, С2 и Е [1-4], тогда как
обогащенные липидами «пенистые клетки» [11,
частицы больших по размеру ЛНП содержат
14-17]. Пенистые клетки образуют в стенке со-
только апопротеин В-100 [1-4]. ЛНП, обра-
судов первичные предатерогенные липоидоз-
зующиеся в печени, транспортируют липиды в
ные повреждения сосудов при атеросклерозе и
периферические ткани, а ЛВП осуществляют
диабете [11, 14-17]. Частицы окисленных ЛНП
обратный транспорт липидов в печень [5-8].
могут связываться также со scavenger-рецеп-
Показано, что накопление окисленных ЛНП яв-
тором LOX-1 эндотелиоцитов, что индуцирует
ляется основным событием, приводящим к воз-
экспрессию NADPH-оксидазы и генерирование
никновению и прогрессированию атеросклеро-
супероксидных анион-радикалов [15, 16, 18].
за [9-11]. В то же время высокий уровень ЛВП
Гиперпродукция активных форм кислоро-
защищает от развития атеросклероза [12, 13].
да (АФК) в конечном итоге стимулирует апоп-
Единственный белок частиц ЛНП (апо-
тоз и приводит к дисфункции эндотелия [15, 16,
протеин В-100) может подвергаться химиче-
18]. Таким образом, очевидно, что окислитель-
ные превращения липопротеидов могут играть
ведущую роль в молекулярных механизмах
Принятые сокращения: ЛНП - липопротеиды низкой
плотности; ЛВП - липопротеиды высокой плотности;
повреждения стенки сосудов при атерогенезе
LOOH - липогидропероксиды.
и диабетогенезе [14, 15]. Исходя из результа-
* Адресат для корреспонденции.
тов собственных исследований и литературных
854
АДСОРБЦИЯ ЛИПОПЕРОКСИДОВ БИОМЕМБРАН ЛИПОПРОТЕИДАМИ
855
данных, нами была сформулирована гипотеза
250-300 г) перфузировали охлажденным изо-
о едином механизме повреждения стенки со-
тоничным раствором KCl и гомогенизировали
судов при атеросклерозе и сахарном диабете,
(1 : 10, вес/объем) в гомогенизаторе Поттера
ведущую роль в котором играет накопление
с тефлоновым пестиком в среде, содержа-
дикарбонил-модифицированных ЛНП [15, 19].
щей 0,25 М раствор сахарозы, 10 мM МОРS
Частицы ЛНП весьма подвержены инициации
и 1 мМ ЭДТА [28]. Ядра и дебрис осаждали
свободнорадикального окисления в наружном
при 700 g в течение 10 мин в рефрижераторной
фосфолипидном монослое, тогда как частицы
центрифуге Eppendorf 5804 R («Eppendorf»,
ЛВП достаточно устойчивы к липоперокси-
Германия), и супернатант подвергали повтор-
дации [20]. Тем не менее было показано, что
ному центрифугированию при 8000 g в течение
частицы ЛВП могут не только ингибировать
10 мин для осаждения «тяжелых» митохон-
окисление ЛНП при совместной инкубации
дрий [28]. Осадок ресуспендировали в среде
этих частиц in vitro [21], но и осуществлять ан-
выделения без ЭДТА и дважды переосаждали
тиоксидантный эффект (подавлять окисление
митохондрии, после чего органеллы вновь ре-
ЛНП) в кровотоке in vivo [22, 23]. Кроме того,
суспендировали (1 мг белка/мл) в изотонич-
была высказана гипотеза о том, что частицы
ном K/Na-фосфатном буфере (рН 7,4). Сво-
ЛВП способны акцептировать окисленные
боднорадикальное окисление полиеновых фос-
фосфолипиды с надмолекулярных липид-
фолипидов митохондриальных мембран инду-
белковых комплексов (липопротеидов и био-
цировали внесением 0,5 мМ аскорбата для
мембран) и транспортировать их в печень, где
восстановления эндогенного железа. Кине-
происходит ферментативная детоксикация ли-
тику свободнорадикального окисления мито-
попероксидов [24]. К сожалению, эта гипоте-
хондрий в аэробных условиях измеряли по
за не получила строгого экспериментального
накоплению липогидропероксидов (LOOH),
подтверждения с использованием адекватных
содержащих конъюгированную двойную связь,
подходов и методов, позволяющих получить
по поглощению при 233 нм на спектрофотомет-
неопровержимые однозначные результаты [25,
ре UV-2600 («Shimadzu», Япония) c интегри-
26]. Исходя из вышесказанного, в настоящей
рующей сферой ISR-2600, позволяющей про-
работе с помощью оригинальной методологии
водить анализы в мутных средах. После 4-ча-
исследовали способность частиц ЛНП и ЛВП
совой инкубации (достижение плато на кине-
адсорбировать гидроперокси-производные фос-
тической кривой) окисление митохондрий
фолипидов с поверхности окисленных био-
ингибировали внесением ЭДТА до конечной
мембран.
концентрации 1 мМ.
Исследование переноса ацилгидроперокси-
производных фосфолипидов окисленных мем-
МАТЕРИАЛЫ И МЕТОДЫ
бран митохондрий в частицы липопротеидов при
их совместной инкубации. Осадок окисленных
Изолирование разных классов (ЛНП, ЛВП)
митохондрий ресуспендировали в среде, содер-
и субфракций (ЛВП2, ЛВП3) липопротеидов при
жащей изотоничный K/Na-фосфатный буфер
помощи препаративного ультрацентрифугирова-
(рН 7,4) и 1 мМ ЭДТА, дважды переосаждали
ния. Препаративное выделение ЛНП, общей
при 8000 g в течение 10 мин, и осадок вновь ре-
фракции ЛВП и подфракций ЛВП2 и ЛВП3,
суспендировали (1 мг белка/мл) в изотоничном
из плазмы крови практически здоровых доно-
K/Na-фосфатном буфере (рН 7,4), содержащем
ров проводили методом центрифугирования
1 мМ ЭДТА. После этого в среду с окисленны-
в градиенте плотности NaBr на ультрацен-
ми митохондриями вносили ЛНП, ЛВП или
трифуге Optima XPN-80 («Beckman», США) с
субфракции ЛВП2 и ЛВП3 (200 мкг белка/мл)
использованием ранее описанной процеду-
и проводили инкубацию в течение 6 ч. Через
ры [20, 27]. Выделение липопротеидов разных
определенные интервалы времени отбирали
классов проводили из трех образцов плазмы
аликвоты инкубационной среды, центрифуги-
крови, полученных от трех разных здоровых
ровали при 10 000 g в течение 15 мин для осаж-
доноров. Пробирки для отбора крови содержа-
дения митохондрий и фрагментов их мембран,
ли ЭДТА (1 мМ) в качестве антикоагулянта и
а затем в супернатанте, содержащем только ча-
антиоксиданта. Содержание белка в образцах,
стицы липопротеидов, по поглощению конъю-
изолированных и очищенных диализом липо-
гированных диенов при
233 нм, измеряли
протеидов [20], определяли по методу Лоури.
содержание LOOH. Эксперименты повторяли
Выделение митохондрий печени крысы и их
три раза, используя в каждом опыте липопро-
свободнорадикальное окисление. Для выделения
теиды, полученные от отдельных доноров.
митохондрий печень крыс (самцы линии WKY,
Разработанная нами методология позволила
БИОХИМИЯ том 88 вып. 5 2023
856
ЛАНКИН и др.
быстро отделять окисленные мембраны от
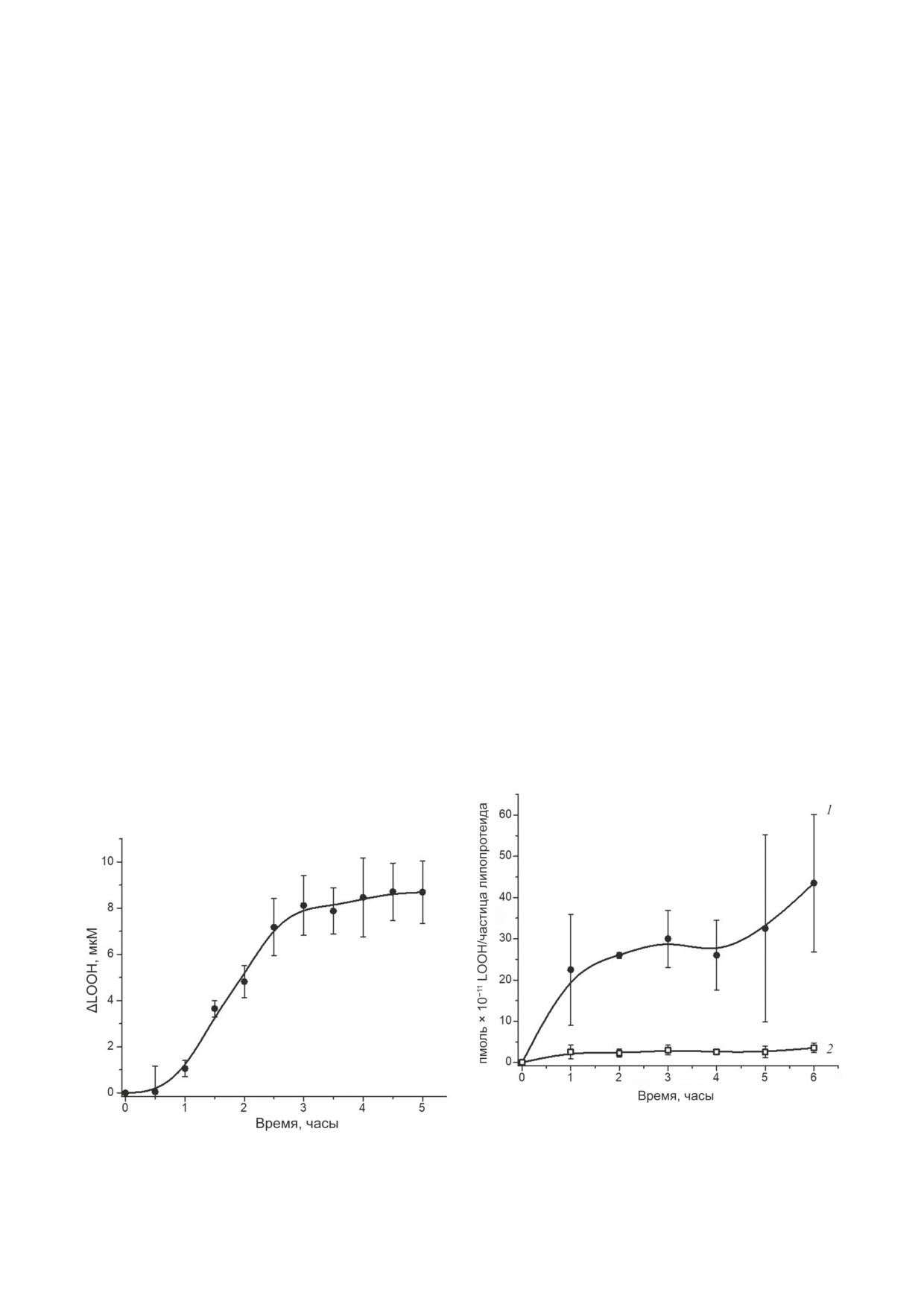
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
частиц липопротеидов и наблюдать кинетику
накопления LOOH в ЛНП и ЛВП. Расчеты ко-
Свободнорадикальное окисление наружных
личества LOOH на одну частицу ЛНП и ЛВП
мембран митохондрий печени крысы. Кинетика
проводили, исходя из определения в них апо-
свободнорадикального окисления наружных
протеида В-100 и апопротеида А-1 соответ-
мембран митохондрий печени крысы пред-
ственно, как описано ранее [20]. Содержание
ставлена на рис. 1. Как видно из рассмотрения
LOOH (ΔD233) в частицах ЛНП и ЛВП рассчи-
кинетической кривой, после 3-часовой инку-
тывали, используя коэффициент молярной
бации дальнейшего окисления полиеновых
экстинкции
22 000 М-1⋅см-1. Концентрацию
фосфолипидов митохондриальных мембран
LOOH на 1 частицу ЛНП и ЛВП рассчитывали,
практически не происходит (рис. 1).
исходя из содержания апопротеина B-100 в ча-
В связи с этим через 3 ч после начала инку-
стицах ЛНП и апопротеина А1 в частицах ЛВП
бации отбирали основное количество инкуба-
(каждый из этих апопротеинов присутствует
ционной среды, содержащей митохондрии, и их
в количестве 1 молекулы на частицу ЛНП и
окисление останавливали добавлением ЭДТА
ЛВП соответственно). Содержание апопротеи-
до конечной концентрации 1 мМ для связыва-
на В-100 и апопротеина А1 измеряли на хими-
ния катализирующих окисление ионов метал-
ческом анализаторе Architect C8000 («Abbott»,
лов переменной валентности. После 3-кратного
США) при использовании соответствующих
переосаждения окисленных митохондрий для
тест-наборов этой же фирмы [20].
удаления фрагментов мембран и растворимых
Статистический анализ. Статистический
низкомолекулярных продуктов окисления по-
анализ результатов исследования проводили с
лученные окисленные «тяжелые» митохондрии
помощью пакетов программного обеспечения
использовали для исследования абсорбции
STATISTICA 10 («Statsoft», США), MedCalc ver-
ацилгидроперокси-содержащих фосфолипидов
sion 12.7.0.0 («MedCalc Software», Бельгия) и
митохондриальных мембран изолированными
Microsoft Excel
2010, версия
14.0.7263.5000,
частицами неокисленных ЛНП и ЛВП.
представляя данные как среднее ± ошибка
Исследование кинетики абсорбции ацил-
среднего. Поскольку анализ данных показал,
гидроперокси-содержащих фосфолипидов мито-
что распределение признаков во всех случаях
хондриальных мембран частицами ЛНП и ЛВП.
отличается от нормального, для статистиче-
Результаты исследования возможности пере-
ского анализа применяли непараметрические
носа ацилгидроперокси-производных фосфо-
методы статистики. Анализ различий коли-
липидов с окисленных биомембран на части-
чественных показателей при межгрупповых
цы ЛНП и ЛВП представлены на рис. 2.
сравнениях выполняли с помощью непара-
Полученные данные свидетельствуют о том,
метрического критерия Манна-Уитни (Mann-
что нативные частицы ЛНП при совместной
Whitney U-test). Различия считали статистиче-
ски значимыми при р < 0,05.
Рис. 2. Кинетика встраивания ацилгидроперокси-произ-
водных фосфолипидов из подвергнутых свободноради-
Рис. 1. Кинетика свободнорадикального окисления наруж-
кальному окислению мембран митохондрий печени кры-
ных мембран митохондрий печени крысы. Условия экспе-
сы в частицы ЛНП (кривая 1) и ЛВП (кривая 2). Условия
римента приведены в разделе «Материалы и методы»
эксперимента приведены в разделе «Материалы и методы»
БИОХИМИЯ том 88 вып. 5 2023
АДСОРБЦИЯ ЛИПОПЕРОКСИДОВ БИОМЕМБРАН ЛИПОПРОТЕИДАМИ
857
совместной инкубации была продемонстри-
рована ранее [28] и не представляется чем-то
необычным. Многочасовое окисление теней
эритроцитов использовали и в других рабо-
тах [29], тем не менее при длительной инку-
бации с инициаторами свободнорадикального
окисления образуется большое количество вто-
ричных продуктов альдегидной природы [16],
наличие которых может быть источником арте-
фактов [16]. Необходимо отметить, что мембра-
ны эритроцитов не являются удачным объектом
для такого рода экспериментов, поскольку, в
отличие от микросом и митохондрий печени,
эритроциты весьма резистентны даже к фер-
ментативной липопероксидации [30]. В соот-
ветствии с полученными нами данными, ча-
стицы ЛНП, в отличие от ЛВП, способны не
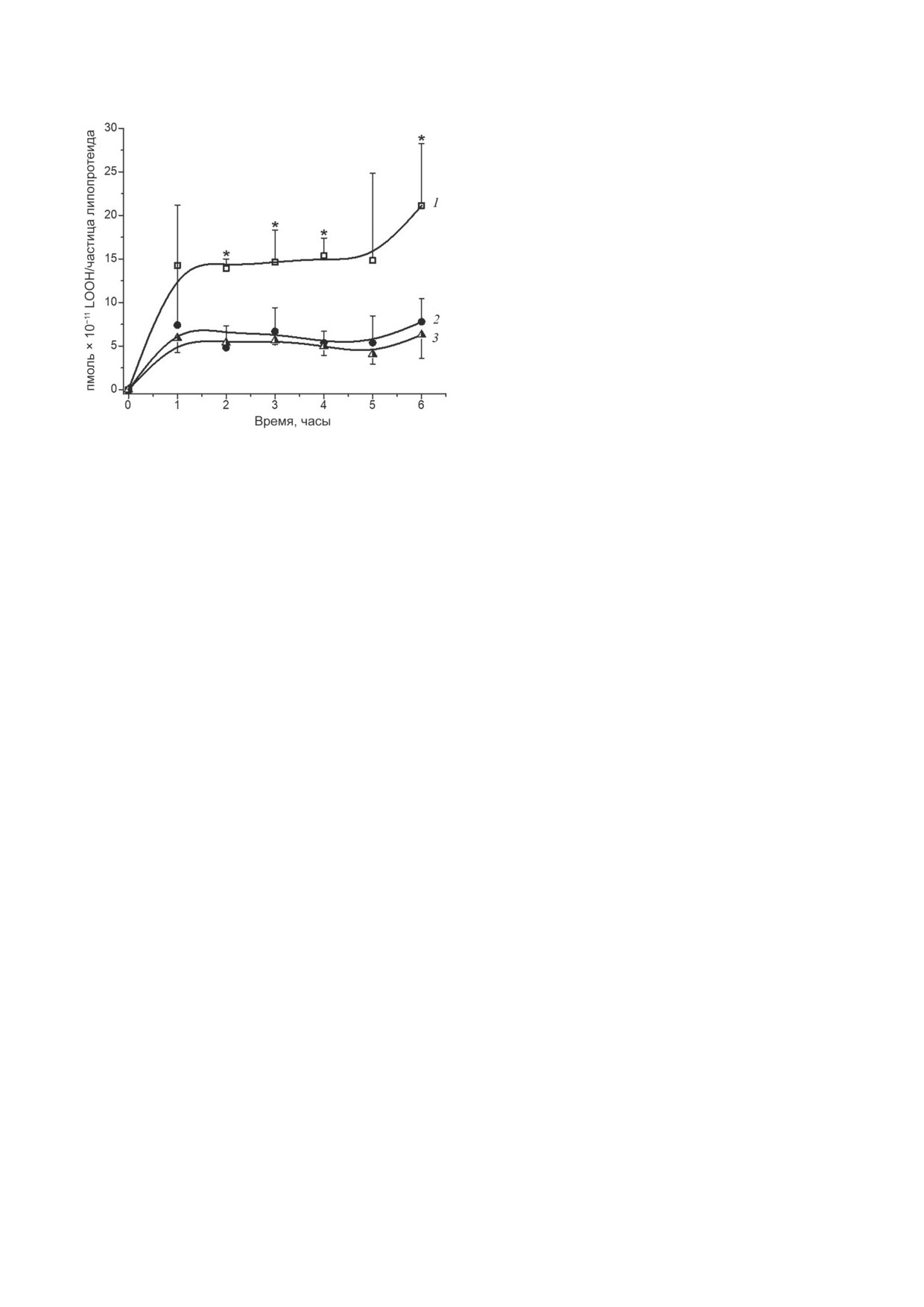
Рис. 3. Кинетика встраивания ацилгидроперокси-про-
только легко подвергаться эффективному сво-
изводных фосфолипидов из подвергнутых свободно-
боднорадикальному окислению [20], но и за-
радикальному окислению мембран митохондрий печени
крысы в общую фракцию частиц ЛВП (кривая 1), части-
хватывать окисленные фосфолипиды с других
цы ЛВП2 (кривая 2) и ЛВП3 (кривая 3). Отличия вели-
липид-белковых надмолекулярных комплексов
чин встраиваемых LOOH для частиц ЛВП2 и ЛВП3 ста-
при контакте с ними (рис. 2). Деструкция на-
тистически не достоверны на всех сроках наблюдения;
копленных в ЛНП гидроперокси-производных
* - отличия величин встраиваемых LOOH для общей
фракции ЛВП и ЛВП2 или ЛВП3 статистически значимы
фосфолипидов, несомненно, должна вызывать
при р < 0,05. Условия эксперимента приведены в разделе
атерогенную модификацию частиц ЛНП вто-
«Материалы и методы»
ричными продуктами окисления
- низко-
молекулярными дикарбонилами, такими как
инкубации с окисленными митохондриями пре-
4-гидрокси-2-ноненаль и МДА [14, 16, 17],
имущественно захватывают ацилгидроперокси-
что способствует прогрессированию атеро-
производные фосфолипидов (рис. 2, кривая 1),
генеза [14-17]. Тем не менее имеются данные о
тогда как скорость дрейфа окисленных фос-
возможности активного переноса окисленных
фолипидов с биомембран на частицы ЛВП
липидов из наружного фосфолипидного слоя
весьма незначительна (рис. 2, кривая 2). Кине-
частиц ЛНП в частицы ЛВП при их совмест-
тика абсорбции окисленных фосфолипидов
ной инкубации, при этом окисленные липиды
субфракциями ЛВП - ЛВП2 и ЛВП3 - приве-
из гидрофобного ядра частиц ЛНП в ЛВП не
дена на рис. 3.
транспортируются, причем окисленные ЛВП
Из рассмотрения рис. 3 можно сделать вы-
теряют способность адсорбировать липопер-
вод, что абсорбция ацилгидроперокси-произ-
оксиды окисленных ЛНП [31]. Действительно,
водных фосфолипидов окисленных митохон-
ацилгидроперокси-производные фосфолипидов
дриальных мембран частицами ЛВП2 и ЛВП3
наружного слоя частиц ЛНП являются зна-
достоверно не отличается (рис. 3, кривые 2 и 3),
чительно более полярными, чем неокислен-
но статистически значимо ниже абсорбции
ные фосфолипиды [32]. Гидропероксиацилы
окисленных фосфолипидов частицами общей
фосфолипидов вследствие этого «выдвинуты»
фракции ЛВП (рис. 3, кривая 1) на всех сроках
в водную фазу [32] и, вероятно, могут более
наблюдения.
эффективно обмениваться с другими липид-
белковыми надмолекулярными комплексами
при их контакте. Несмотря на то что именно
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
субфракциям ЛВП - ЛВП2 и ЛВП3 - припи-
сывают кардиопротекторный эффект [33-35],
Полученные нами результаты (рис. 2) про-
согласно полученным нами данным (рис. 3),
тиворечат высказанной ранее гипотезе о воз-
он, если и существует, по всей вероятности,
можности обратного транспорта окисленных
не связан с предполагавшейся способностью
липидов частицами ЛВП в печень [24]. Следует
этих липопротеидов [24-26] участвовать в де-
отметить, что принципиальная возможность
токсикации липогидропероксидов. При рас-
переноса ацилгидроперокси-производных фос-
смотрении рис. 3 видно, что суммарная аб-
фолипидов с окисленных мембран эритро-
сорбция LOOH субфракциями ЛВП2 и ЛВП3
цитов
(«теней» эритроцитов) на ЛНП при
ниже (кривые 2 и 3), чем абсорбция LOOH
БИОХИМИЯ том 88 вып. 5 2023
858
ЛАНКИН и др.
общей фракцией ЛВП (кривая 1). Это кажу-
ной литературе отсутствуют. Несомненно,
щееся противоречие может быть связано с
одно - обогащение частиц ЛНП окисленными
тем, что в общей фракции ЛВП количество
липидами, как показывают полученные нами
субфракций не исчерпывается только ЛВП2 и
результаты, может происходить как при их
ЛВП3 [33]. Кроме того, при процедуре препа-
интенсивном свободнорадикальном окисле-
ративного выделения ЛВП2 и ЛВП3 могут уда-
нии, так и при захвате окисленных липидов
ляться окисленные формы этих субфракций,
с мембран клеток крови (эритроцитов и т.д.).
присутствующие в общей фракции ЛВП [35].
Оба эти процесса должны способствовать уве-
личению атерогенности окислительно моди-
фицированных ЛНП, т.е. способствовать их
ЗАКЛЮЧЕНИЕ
вовлечению в процесс повреждения стенки
сосудов [14-16].
Полученные нами данные свидетельству-
ют о существовании различных механизмов,
Вклад авторов. Ланкин В.З. - руковод-
приводящих к обогащению «атерогенных» ча-
ство работой, обсуждение результатов; Тиха-
стиц ЛНП первичными продуктами свобод-
зе А.К. - написание и редактирование статьи;
норадикального окисления, что в конечном
Косач В.Я., Коновалова Г.Г. - проведение экс-
итоге лишний раз подтверждает опасность па-
периментов, подготовка статьи.
тогенетически важной окислительной транс-
Финансирование. Работа выполнена при
формации этих частиц in vivo [14-16]. «Анти-
финансовой поддержке Российского научного
оксидантное» действие ЛВП [36] может быть
фонда (грант № 22-15-00013).
связано с присутствием в частицах этих липо-
Благодарности. Авторы признательны
протеидов параоксоназы-1, способной вос-
А.В. Дорощуку за помощь в проведении от-
станавливать липопероксиды в частицах ЛНП
дельных экспериментов.
при их совместной инкубации с ЛВП [29, 37].
Конфликт интересов. Авторы заявляют об
Очевидно, что для доказательства этого меха-
отсутствии конфликта интересов.
низма утилизации липопероксидов в плазме
Соблюдение этических норм. Все процеду-
крови in vivo необходимы убедительные ре-
ры, выполненные в исследованиях с участием
зультаты, свидетельствующие об эффективном
животных, соответствовали этическим стан-
обмене окисленных фосфолипидов частиц
дартам учреждения, в котором проводились
ЛНП с частицами ЛВП. К сожалению, в на-
исследования, и утвержденным правовым ак-
стоящее время такого рода данные в доступ-
там РФ и международных организаций.
СПИСОК ЛИТЕРАТУРЫ
1. Tomkin, G. H. (2010) Atherosclerosis, diabetes and
cardiovascular disease, J. Clin. Endocrinol. Metab., 96,
lipoproteins, Expert Rev. Cardiovasc. Ther., 8, 1015-
1246-1257, doi: 10.1210/jc.2010-0163.
1029, doi: 10.1586/erc.10.45.
7. Hernáez, Á., Soria-Florido, M. T., Schröder, H.,
2. Arnao, V., Tuttolomondo, A., Daidone, M., and
Ros, E., Pintó, X., Estruch, R., Salas-Salvadó, J.,
Pinto, A. (2019) Lipoproteins in atherosclerosis pro-
Corella, D., Arós, F., Serra-Majem, L., Martínez-
cess, Curr. Med. Chem., 26, 1525-1543, doi: 10.2174/
González, Á. M., Fiol, M., Lapetra, J., Elosua, R.,
0929867326666190516103953.
Lamuela-Raventós, R. M., and Fitó, M.
(2019)
3. Getz, G. S., and Reardon, C. A. (2020) Atherosclerosis:
Role of HDL function and LDL atherogenicity on
cell biology and lipoproteins, Curr. Opin. Lipidol., 31,
cardiovascular risk: a comprehensive examination,
286-290, doi: 10.1097/MOL.0000000000000704.
PLoS One,
14, e0218533, doi:
10.1371/journal.
4. Wang, H. H., Garruti, G., Liu, M., Portincasa, P.,
pone.0218533.
Wang, D. H.
(2017) Cholesterol and lipoprotein
8. Carr, S. S., Hooper, A. J., and Sullivan, D. R.
metabolism and atherosclerosis: recent advances
(2019) Non-HDL-cholesterol and apolipoprotein B
in reverse cholesterol transport, Ann. Hepatol.,
16
compared with LDL-cholesterol in atherosclerotic
(Suppl. 1), s27-s42, doi: 10.5604/01.3001.0010.5495.
cardiovascular disease risk assessment, Pathology,
5. Lee, J. M. S., and Choudhury, R. P.
(2010)
51, 148-154, doi: 10.1016/j.pathol.2018.11.006.
Atherosclerosis
regression
and high-density
9. Steinberg, D., and Witztum, J. L. (2002) Is the
lipoproteins, Expert Rev. Cardiovasc. Ther., 8, 1325-
oxidative modifications hypothesis relevant to human
1334, doi: 10.1586/erc.10.108.
atherosclerosis? Do the antioxidant trials conducted
6. Brewer, H. B. Jr. (2011) Clinical review: the evolving
to date reflect the hypothesis? Circulation,
105,
role of HDL in the treatment of high-risk patients with
2107-2111, doi: 10.1161/01.CIR.0000014762.06201.06.
БИОХИМИЯ том 88 вып. 5 2023
АДСОРБЦИЯ ЛИПОПЕРОКСИДОВ БИОМЕМБРАН ЛИПОПРОТЕИДАМИ
859
10.
Parthasarathy, S., Santanam, N., and Auge, N.
21.
Raveh, O., Pinchuk, I., Fainaru, M., and
(1998) Oxidised low-density lipoprotein: a two-
Lichtenberg, D. (2001) Kinetics of lipid peroxidation
faced Janus in coronary artery disease? Biochem.
in mixtures of HDL and LDL, mutual effects, Free
Pharmacol., 56, 279-284, doi: 10.1016/S0006-2952
Radic. Biol. Med.,
31,
1486-1497, doi:
10.1016/
(98)00074-4.
s0891-5849(01)00730-4.
11.
Khatana, C., Saini, N. K., Chakrabarti, S., Saini, V.,
22.
Fumiaki, I., and Tomoyuki, I. (2020) High-density
Sharma, A., Saini, R.V., and Saini, A. K.
(2020)
lipoprotein (HDL) triglyceride and oxidized HDL:
Mechanistic insights into the oxidized low-density
new lipid biomarkers of lipoprotein-related athero-
lipoprotein induced atherosclerosis, Oxid. Med. Cell.
sclerotic cardiovascular disease, Antioxidants (Basel),
Longev., 2020, 1-14, doi: 10.1155/2020/5245308.
9, 362, doi: 10.3390/antiox9050362.
12.
Barter, P. J., and Rye, K. A. (1996) High-density
23.
Bowry, V. W., Stanley, K. K., and Stocker, R. (1992)
lipoproteins and coronary heart disease, Atherosclerosis,
High density lipoprotein is the major carrier of lipid
121, 1-12, doi: 10.1016/0021-9150(95)05675-0.
hydroperoxides in human blood plasma from fasting
13.
Rubins, H. B., Robins, S. J., Collins, D., Fye, C. L.,
donors, Proc. Natl. Acad. Sci. USA, 89, 10316-10320,
and Anderson, J. W. (1999) Gemfibrozil for the sec-
doi: 10.1073/pnas.89.21.10316.
ondary prevention of coronary heart disease in men
24.
Klimov, A. N., Nikiforova, A. A., Kuzmin, A. A.,
with low levels of high-density lipoprotein cholesterol.
Kuznetsov, A. S., and Mackness, M. I. (1998) Is
Veterans affairs high-density lipoprotein cholesterol
high density lipoprotein a scavenger for oxidized
intervention trial study group, N. Engl. J. Med., 341,
phospholipids of low density lipoprotein? In Advances
410-418, doi: 10.1056/NEJM199908053410604.
in Lipoprotein and Atherosclerosis Research, Diagnostics
14.
Lankin, V. Z., and Tikhaze, A. K. (2017) Role of ox-
and Treatment, Jena, Gustav Fisher Verlag, pp. 78-82.
idative stress in the genesis of atherosclerosis and di-
25.
Klimov, A. N., Kozhemyakin, L. A., Pleskov, V. M.,
abetes mellitus: a personal look back on 50 years of
and Andreeva, L. I. (1987) Antioxidative effect of high
research, Curr. Aging Sci., 10, 18-25, doi: 10.2174/
density lipoproteins in the oxidation of low density
1874609809666160926142640.
lipoproteins, Bull. Expt. Biol. Med., 103, 550-556,
15.
Lankin, V. Z., Tikhaze, A. K., and Melkumyants,
doi: 10.1007/BF00841817.
A. M.
(2022) Dicarbonyl-dependent modification
26.
Klimov, A. N., Gurevich, V. S., Nikiforova, A. A.,
of ldl as a key factor of endothelial dysfunction and
Shatilina, L. V., Kuzmin, A. A., Plavinsky, S. L.,
atherosclerotic vascular wall damage, Antioxidants, 11,
and Teryukova, N. P. (1993) Antioxidative activity of
1565, doi: 10.3390/antiox11081565.
high density lipoproteins in vivo, Atherosclerosis, 100,
16.
Lankin, V. Z., Tikhaze, A. K., and Melkumyants,
13-18, doi: 10.1016/0021-9150(93)90063-z.
A. M. (2023) Malondialdehyde as a important key
27.
Lindgren, F. T. (1975) Preparative ultracentrifugal
factor of molecular mechanisms of vascular wall
laboratory procedures and suggestions for lipoprotein
damage under heart diseases development, J. Int. Mol.
analysis, in Analysis of Lipids and Lipoproteins
Sci., 24, 128, doi: 10.3390/ijms24010128.
(Perkins, E. G., ed) Champaign: Amer. Oil. Chemists
17.
Lankin, V. Z., Tikhaze, A. K., and Kumskova, E. M.
Soc., pp. 204-224.
(2012) Macrophages actively accumulate malonyl-
28.
Vila, A., Korytowski, W., and Girotti, A. W. (2002)
dialdehyde-modified but not enzymatically oxidized
Spontaneous transfer of phospholipid and cholesterol
low density lipoprotein, Mol. Cell Biochem., 365, 93-
hydroperoxides between cell membranes and low-
98, doi: 10.1007/s11010-012-1247-5.
density lipoprotein: assessment of reaction kinetics
18.
Sun, Y., and Chen, X. (2011) Ox-LDL-induced LOX-1
and prooxidant effects, Biochemistry, 41, 13705-13716,
expression in vascular smooth muscle cells: role of
doi: 10.1021/bi026467z.
reactive oxygen species, Fundam. Clin. Pharmacol., 25,
29.
Mastorikou, M., Mackness, B., Liu, Y., and
572-579, doi: 10.1111/j.1472-8206.2010.00885.x.
Mackness, M. (2008) Glycation of paraoxonase-1
19.
Lankin, V. Z., Konovalova, G. G., Tikhaze, A. K.,
inhibits its activity and impairs the ability of high-
Shumaev, K. B., Kumskova, E. M., and Viigimaa, M.
density lipoprotein to metabolize membrane lipid
(2014) The initiation of the free radical peroxidation of
hydroperoxides, Diabetic Med.,
25,
1049-1055,
low-density lipoproteins by glucose and its metabolite
doi: 10.1111/j.1464-5491.2008.02546.x.
methylglyoxal: a common molecular mechanism of
30.
Lankin, V. (2003) The enzymatic systems in the
vascular wall injure in atherosclerosis and diabetes,
regulation of free radical lipid peroxidation, in “Free
Mol. Cell. Biochem., 395, 241-252, doi: 10.1007/
Radicals, Nitric Oxide, and Inflammation: Molecular,
s11010-014-2131-2.
Biochemical, and Clinical Aspects, Amsterdam etc.:
20.
Lankin, V. Z., Tikhaze, A. K., and Kosach, V. Ya.
IOS Press, 2003, NATO Science Series, 344, pp. 8-23.
(2022) Comparative susceptibility to oxidation of
31.
Rasmiena, A. A., Barlow, C. K., Ng, T. W., Tull, D.,
different classes of blood plasma lipoproteins, Bio-
and Meikle, P. J. (2016) High density lipoprotein
chemistry (Moscow),
87,
1335-1341, doi:
10.1134/
efficiently accepts surface but not internal oxidised
S0006297922110128.
lipids from oxidised low density lipoprotein,
БИОХИМИЯ том 88 вып. 5 2023
860
ЛАНКИН и др.
Biochim. Biophys. Acta, 1861, 69-77, doi: 10.1016/
and other lipoproteins in Gofman’s Livermore
j.bbalip.2015.11.002.
Cohort, Atherosclerosis, 214, 196-202, doi: 10.1016/
32. Lankin, V. Z., Tikhaze, A. K., and Osis, Yu. G. (2002)
j.atherosclerosis.2010.10.024.
Modeling the cascade of enzymatic reactions in lipo-
35. Honda, H., Hirano, T., Ueda, M., Kojima, S.,
somes including successive free radical peroxidation, re-
Mashiba, S., Hayase, Y., Michihata, T., and Shibata, T.
duction, and hydrolysis of phospholipid polyenoic acyls
(2016) High-density lipoprotein subfractions and their
for studying the effect of these processes on the structur-
oxidized subfraction particles in patients with chronic
al-dynamic parameters of the membranes, Biochemistry
kidney disease, J. Atheroscler. Thromb., 23, 81-94,
(Moscow), 67, 566-574, doi: 10.1023/a:1015502429453.
doi: 10.5551/jat.30015.
33. Superko, H. R., Pendyala, L., Williams, P. T.,
36. Mackness, B., and Mackness, M. (2012) The anti-
Momary, K. M., King, S. B., and Garrett, B. C.
oxidant properties of high-density lipoproteins in
(2012) High-density lipoprotein subclasses and their
atherosclerosis, Panminerva Med., 54, 83-90.
relationship to cardiovascular disease, J. Clin. Lipidol.,
37. Mackness, M., and Mackness, B. (2013) Target-
6, 496-523, doi: 10.1016/j.jacl.2012.03.001.
ing paraoxonase-1 in atherosclerosis, Expert Opin.
34. Williams, P. T., and Feldma, D. E. (2011) Prospective
Ther. Targets., 17, 829-837, doi: 10.1517/14728222.
study of coronary heart disease vs. HDL2, HDL3,
2013.790367.
ADSORPTION OF ACYLHYDROPEROXY-DERIVED PHOSPHOLIPIDS
FROM BIOMEMBRANES BY BLOOD PLASMA LIPOPROTEINS
V. Z. Lankin*, A. K. Tikhaze, V. Y. Kosach, and G. G. Konovalova
National Medical Research Center of Cardiology named after Academician E. I. Chazov,
Ministry of Health of the Russian Federation,
121552 Moscow, Russia; e-mail: lankin0309@mail.ru
It has been established that acylhydroperoxy derivatives of phospholipids of oxidized rat liver mitochondria
during co-incubation with blood plasma lipoproteins are captured predominantly by LDL particles but not
by HDL, which refutes the previously stated hypothesis about the involvement of HDL in the reverse trans-
port of oxidized phospholipids and confirms the possibility of different mechanisms of lipohydroperoxide
accumulation in LDL during oxidative stress.
Keywords: oxidized phospholipids, transmembrane transport of lipoperoxides, low-density lipoproteins (LDL), high-
density lipoproteins (HDL)
БИОХИМИЯ том 88 вып. 5 2023