БИОХИМИЯ, 2023, том 88, вып. 5, с. 861 - 874
УДК 577.34
ФЕМТОСЕКУНДНАЯ ЭКСИТОННАЯ РЕЛАКСАЦИЯ
В ХЛОРОСОМАХ ФОТОСИНТЕЗИРУЮЩЕЙ ЗЕЛЁНОЙ
БАКТЕРИИ Chloroflexus aurantiacus
© 2023 А.Г. Яковлев*, А.С. Таисова, З.Г. Фетисова
Московский государственный университет имени М.В. Ломоносова,
НИИ физико-химической биологии имени А.Н. Белозерского,
119992 Москва, Россия; электронная почта: yakov@belozersky.msu.ru
Поступила в редакцию 30.01.2023
После доработки 20.03.2023
Принята к публикации 31.03.2023
В зелёных бактериях Chloroflexus (Cfx.) aurantiacus процесс фотосинтеза начинается с поглощения
света хлоросомами - периферическими антеннами, состоящими из тысяч молекул бактериохло-
рофилла c (БХл c), объединённых в олигомерные структуры. При этом в БХл c образуются возбуж-
дённые состояния, энергия которых мигрирует по хлоросоме по направлению к базовой плас-
тинке и далее к реакционному центру, где происходит первичное разделение зарядов. Миграция
энергии сопровождается безызлучательными электронными переходами между многочисленны-
ми экситонными состояниями, то есть экситонной релаксацией. В настоящей работе мы изучали
динамику экситонной релаксации в хлоросомах Cfx. aurantiacus с помощью разностной фемто-
секундной спектроскопии при криогенной температуре (80 К). Хлоросомы возбуждались свето-
выми импульсами длительностью 20 фс на длинах волн в диапазоне от 660 до 750 нм, а разност-
ные (свет-темнота) кинетики поглощения измерялись на длине волны 755 нм. Математический
анализ полученных данных выявил кинетические компоненты с характерными временами 140, 220
и 320 фс, отвечающие за экситонную релаксацию. По мере уменьшения длины волны возбуждения
количество и относительный вклад этих компонент увеличивались. Теоретическое моделирование
полученных данных было проведено на основе представлений о цилиндрическом строении агрега-
тов БХл c. Безызлучательные переходы между группами экситонных полос описывались системой
кинетических уравнений. Наиболее адекватной оказалась модель, учитывающая энергетический
и структурный беспорядок хлоросом.
КЛЮЧЕВЫЕ СЛОВА: фотосинтез, зелёные бактерии, Chloroflexus aurantiacus, хлоросома, фемтосекундная
спектроскопия.
DOI: 10.31857/S0320972523050135, EDN: AZKOBQ
ВВЕДЕНИЕ
тры, где происходит разделение зарядов
[1].
Энергия разделённых зарядов используется да-
Фотосинтез отвечает за преобразование
лее для синтеза химических соединений. Кван-
солнечной энергии в химическую энергию
товая эффективность первичных стадий при-
стабильных соединений, что в конечном счё-
родного фотосинтеза близка к 100%, что пока
те обусловливает само существование живой
недостижимо для искусственных преобразова-
природы, производя кислород и органику на
телей солнечной энергии. Эта уникальная осо-
нашей планете. При всём многообразии фото-
бенность побуждает исследовать первичный
синтезирующих организмов первичный этап
фотосинтез на протяжении десятилетий.
фотосинтеза у них одинаковый - это погло-
Зелёные фотосинтезирующие бактерии оби-
щение солнечного света специальными пиг-
тают в условиях дефицита солнечного света, что
ментами, объединёнными в светособирающие
обусловливает огромные размеры и сложную
структуры, и передача энергии возбуждённых
структуру их светособирающих комплексов -
состояний этих пигментов в реакционные цен- хлоросом. Типичная хлоросома (рис. 1) состоит
Принятые сокращения: БХл - бактериохлорофилл; ΔA - разность поглощения (свет-темнота); τ1-6 - характерное
время кинетических компонент; λвозб. - длина волны возбуждения; λзонд. - длина волны зондирования.
* Адресат для корреспонденции.
861
862
ЯКОВЛЕВ и др.
из 104-105 молекул бактериохлорофилла (БХл)
длинной оси [13, 14]. Комбинируя эти данные
c, d, e и имеет форму эллипсоида размером
с данными спектроскопии, было предложено
100-200 × 40-100 × 10-30 нм, прикреплённого
несколько моделей пространственной струк-
к внутренней стороне цитоплазматической мем-
туры хлоросом [3, 9, 12, 15]. Согласно одной из
браны [2]. Многочисленные исследования по
них, хлоросома зелёной бактерии Chloroflexus
спектроскопии хлоросом с помощью разно-
(Cfx.) aurantiacus состоит из 10-20 полых ци-
образных методик показали сильную олигоме-
линдрических структур (рис. 1), каждая из
ризацию молекул БХл в них [3-6]. Было пока-
которых образована шестью параллельными
зано, что в основе пространственной структуры
цепями молекул БХл c [12]. Альтернативная
хлоросом лежат квазилинейные цепи молекул
модель предполагает наличие изогнутых па-
БХл [5]. Олигомеризация молекул основного
раллельных плоскостей (ламелл), образован-
пигмента в хлоросомах происходит в основ-
ных двумерными агрегатами БХл [16]. Ком-
ном благодаря образованию водородных связей
бинация методов направленного мутагенеза,
между соседними молекулами [7-8]. В отличие
спектроскопии одиночных хлоросом и крио-
от большинства других светособирающих ком-
электронной микроскопии привела к пред-
плексов, олигомеризация в хлоросомах проис-
ставлению о концентрических спиральных на-
ходит по принципу самоагрегации, то есть не
нотрубках, образованных слоями молекул БХл
требует наличия жёсткой белковой матрицы.
различной ориентации [17]. Ряд моделей пред-
Небольшое количество белка содержится толь-
полагает структуру молекулярных агрегатов
ко в оболочке хлоросом и в базовой пластинке,
в виде рулонов или полуцилиндров [18, 19].
соединяющей хлоросому с мембраной [2, 9].
Принимая во внимание гетерогенность опти-
Эта уникальная особенность хлоросом позво-
ческих свойств хлоросом, можно предполо-
ляет рассматривать их в качестве прообраза для
жить, что все из перечисленных выше типов
будущих искусственных преобразователей сол-
структур могут быть представлены в них.
нечной энергии. Базовая пластинка содержит
В результате поглощения света хлоросома-
молекулы БХл а, вмонтированные в белковую
ми образуются возбуждённые состояния оли-
матрицу. Хлоросомы также содержат неболь-
гомеров БХл. Теоретическое моделирование
шое количество каротиноидов, выполняющих
показало, что оптический спектр поглощения
важную роль фотопротекции [9]. Оказалось,
этих олигомеров состоит из большого коли-
что зелёные бактерии одного и того же вида,
чества экситонных полос, распределённых по
живущие при разных интенсивностях света,
нескольким группам [20]. Сильное перекры-
отличаются размерами хлоросом: чем меньше
тие этих полос приводит к гладкому профилю
световой поток, тем больше хлоросома [10, 11].
интенсивной Qy полосы поглощения хлоросом
Пространственная организация хлоросом
в красной области спектра. Миграция энергии
дебатируется на протяжении многих лет, однако
возбуждения по олигомерам БХл в хлоросомах
единого мнения пока не достигнуто [5, 12-19].
исследовалась в рамках различных экспери-
Определить координаты всех атомов хлоро-
ментальных и теоретических подходов [12, 20-
сом можно только с помощью рентгенострук-
30]. В цилиндрической модели хлоросом пере-
турного анализа кристаллов, однако получить
нос энергии внутри отдельных цилиндров и
такие кристаллы пока не удаётся. Данные
между соседними цилиндрами занимает око-
электронной микроскопии хлоросом указы-
ло 100 фс [30]. За 250 фс точечное возбужде-
вают на цилиндрические структуры диамет-
ние охватывает всю хлоросому, а через 500 фс
ром 5-10 нм, расположенные параллельно их
оно концентрируется в тех агрегатах, которые
Рис. 1. Упрощённая структурная схема хлоросомы Cfx. aurantiacus (поперечный разрез) согласно цилиндрической модели
БИОХИМИЯ том 88 вып. 5 2023
ФЕМТОСЕКУНДНАЯ ЭКСИТОННАЯ РЕЛАКСАЦИЯ
863
непосредственно примыкают к базовой пластин-
которая задаёт взаимное расположение моле-
ке. Таким образом, поток энергии направлен
кул пигмента. Оптимальная пространственная
к базовой пластинке перпендикулярно глав-
конфигурация этих молекул в хлоросоме полу-
ной оси хлоросомы и осям цилиндров. Далее
чается «сама собой» только благодаря олиго-
происходит перенос энергии на молекулы
меризации. В результате хлоросома по своим
БХл а базовой пластинки с характерным вре-
физическим свойствам в чём-то напоминает
менем от одной до нескольких десятков пс,
жидкий кристалл. Несомненно, воспроизведе-
зависящем от вида бактерий и размера их
ние уникальных свойств хлоросом в работах по
хлоросом. Перенос энергии к реакционному
искусственному фотосинтезу поможет в созда-
центру также происходит в пикосекундном
нии высокоэффективных преобразователей
диапазоне. Миграция энергии по хлоросоме
солнечной энергии. Актуальность изучения
сопровождается её релаксацией, которая но-
хлоросом не ограничивается тематикой искус-
сит сложный экситонно-колебательный ха-
ственного фотосинтеза. Построение адекват-
рактер и происходит с характерным временем
ной математической модели переноса энер-
от ≤ 100 до 300 фс [22, 27-29, 31, 32]. В хлоро-
гии в хлоросомах далеко от завершения, хотя
сомах Cfx. aurantiacus экситонная релаксация
отдельные стороны этого явления отражены
была обнаружена при криогенной [22] и ком-
теоретически достаточно полно (обзор в ра-
натной [28, 31, 32] температурах, хотя в более
боте Яковлева и соавт. [1]). Эта модель должна
ранней работе [21] сообщалось о неудачной
органично учитывать как экситонное взаимо-
попытке обнаружения этого довольно слабого
действие пигментов между собой, так и экси-
процесса. Отметим, что изучение процессов
тонно-колебательное взаимодействие пигмен-
релаксации энергии в хлоросомах важно для
тов с окружением. В этом контексте получение
углубления знаний о связи структуры и функ-
новой информации об экситонной релаксации
ции этих уникальных природных объектов.
в хлоросомах представляется актуальным.
Процессы миграции, переноса и транс-
В данной работе мы провели систематиче-
формации энергии отражаются в кинетиках
ское исследование фемтосекундных процессов
изменения поглощения (свет-темнота) хлоро-
экситонной релаксации в хлоросомах зелёной
сом, в которых представлены несколько компо-
фотосинтезирующей бактерии Cfx. aurantiacus.
нент, отличающихся по характерному времени.
Для возбуждения различных экситонных пе-
В хлоросомах Cfx. aurantiacus основная кине-
реходов длина волны импульсов возбуждения
тическая компонента полосы Qy БХл с имеет
варьировалась от 660 до 750 нм, что соответ-
время жизни порядка 10 пс и отражает перенос
ствует всей полосе поглощения Qy, включая
энергии БХл c → БХл a [12, 21, 33]. Кроме этой
протяжённое коротковолновое крыло. Длина
компоненты, указанные кинетики содержат
волны зондирования была 755 нм, что близко
несколько более быстрых компонент с харак-
к экситонному переходу с минимальной энер-
терными временами порядка 1-2 и 0,1 пс [21-
гией и максимальным временем жизни [4].
25]. Показано, что компонента 1-2 пс отража-
В кинетиках разностного (свет-темнота) по-
ет перенос энергии БХл c → БХл a. Что касается
глощения ΔA обнаружены слабые фемтосе-
самой быстрой компоненты 0,1 пс, то единого
кундные компоненты, отвечающие за экси-
мнения о её происхождении нет. Скорее всего,
тонную релаксацию. Оказалось, что количе-
эта компонента отражает некогерентную ми-
ство, относительный вклад и характерные вре-
грацию энергии между различными агрегатами
мена этих компонент зависят от длины волны
хлоросомы [30], однако не исключена и её ко-
возбуждения. Впервые экспериментально по-
герентная природа.
казано наличие экситонных переходов вдали
На примере хлоросомы зелёных бактерий
от центра полосы Qy, то есть в области сла-
природа демонстрирует изящный способ созда-
бого коротковолнового крыла при λ < 700 нм.
ния внешне простого устройства для высоко-
Показано, что при возбуждении этих пере-
эффективного улавливания и переноса свето-
ходов происходит быстрая релаксация энергии
вой энергии. Для этого требуется определённое
к её минимальному значению, соответствую-
количество однотипных молекул, способных
щему длине волны ~755 нм. Теоретическое
поглощать свет и одновременно способных к
моделирование кинетик ΔA показало, что в
самоагрегации. Экситонное взаимодействие
хлоросомах одновременно происходят безыз-
молекул пигмента обеспечивает высокую ско-
лучательные переходы между экситонными со-
рость миграции энергии, которая в конечном
стояниями с различной энергией. Изменение
счёте переносится на реакционный центр, где
энергии экситонов может быть обусловлено
происходит первичное разделение зарядов. При
как их взаимодействием с окружением, так и
этом в хлоросоме отсутствует жёсткая матрица,
миграцией по хлоросоме.
БИОХИМИЯ том 88 вып. 5 2023
864
ЯКОВЛЕВ и др.
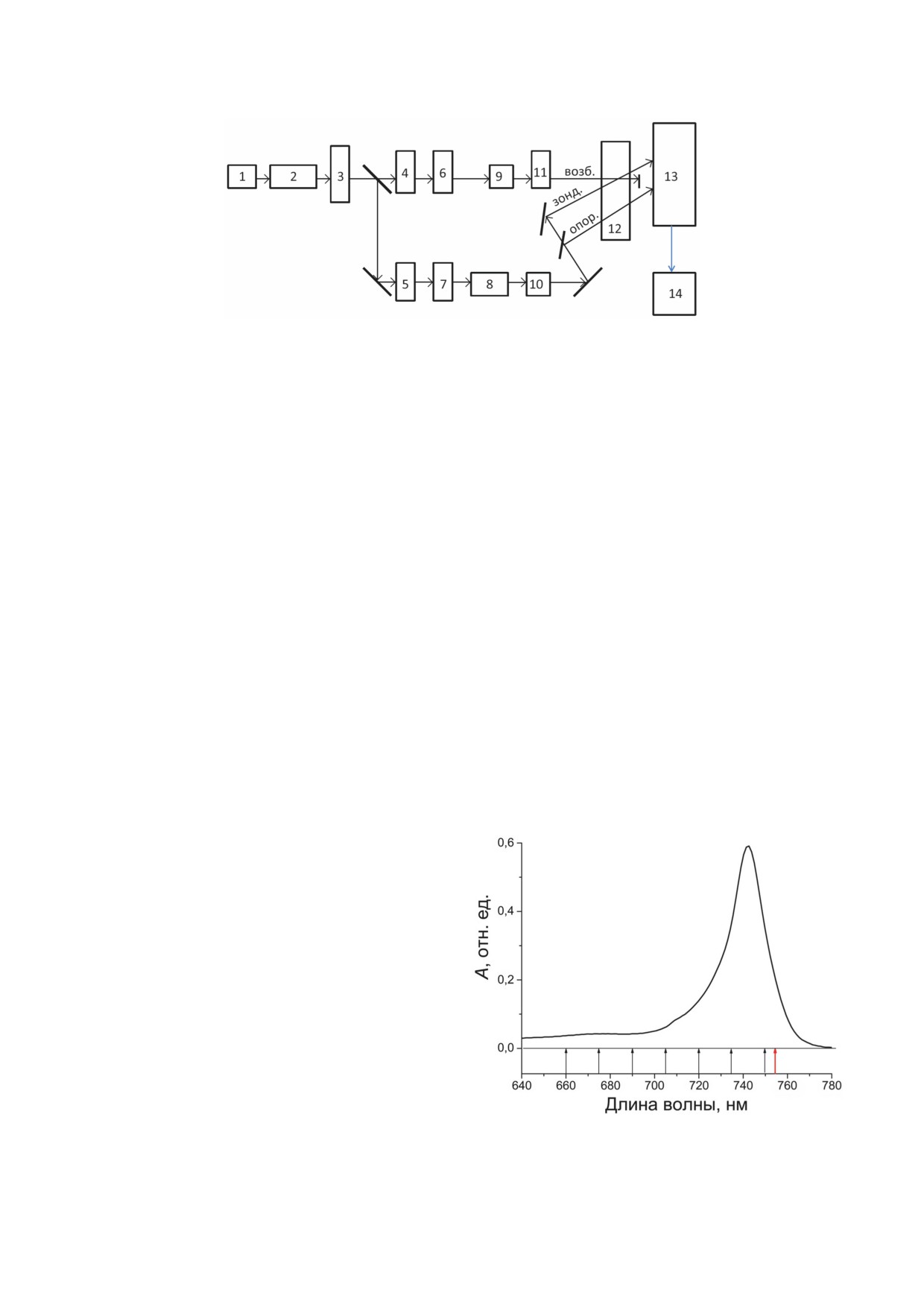
МАТЕРИАЛЫ И МЕТОДЫ
линейному режиму измерений и составляла
2-6 × 1012 фотонов/см2 за один импульс. Спек-
Культуры зелёной бактерии Cfx. aurantiacus
тральная ширина импульсов на входе в обра-
Ok-70-fl выращивали в анаэробных условиях
зец была ~15 нм. Угол между плоскостями по-
при 55 °C на стандартной среде [10] при посто-
ляризаций лучей возбуждения и зондирования
янном перемешивании и интенсивности света
составлял 54,7° (магический угол), что позво-
500 Вт/м2. Выделение хлоросом из клеток про-
ляло проводить изотропные (не зависящие от
водили в двух последовательных непрерывных
поляризации света) измерения. Коэффициент
градиентах концентраций (m/v) сахарозы (55-
поглощения образцов хлоросом составлял 0,5
20% и 45-15%) в присутствии 10 мМ аскорбата
на длине волны 740 нм в кювете толщиной 1 мм.
натрия и 2 мМ тиоционата натрия, как опи-
Для уменьшения уровня шумов проводили
сано ранее [34]. Фемтосекундные разностные
усреднение по 5000-15 000 измерений. Погреш-
(свет-темнота) кинетики поглощения (ΔA) из-
ность измерения кинетик ΔA составляла 0,4%.
меряли с помощью лазерного спектрометра
Изменение интервала времени между импуль-
(рис. 2), собранного на базе титан-сапфиро-
сами возбуждения и зондирования осуществля-
вого генератора световых импульсов («Spectra
лось с помощью оптической линии задержки
Physics», США). В качестве генератора исполь-
с точностью 1 фс. Задержка по времени ме-
зовался лазер с синхронизацией продольных
жду импульсами возбуждения и зондирова-
мод, работающий с частотой 76 МГц. В состав
ния варьировала в диапазоне от -0,2 до 2 пс
спектрометра также входил титан-сапфировый
с шагом 10 фс. Рабочая частота спектрометра
усилитель («Авеста», Россия) и многоканаль-
была 40 Гц. Измерения кинетик проводили
ный анализатор оптических спектров («Oriel»,
при температуре 80 К, для чего кювету с хло-
Франция). В процессе усиления световые им-
росомами помещали в криостат. При этом
пульсы проходили кристалл титан-сапфира
в образцы хлоросом добавляли глицерин в
8 раз. Перед усилением фемтосекундные им-
количестве 65% (v/v) для получения хорошей
пульсы растягивались до пикосекундной дли-
прозрачности. Для измерения стационарного
тельности для предотвращения оптического
спектра поглощения хлоросом при 80 К в ка-
пробоя кристалла. После усиления пикосе-
честве источника света использовалась лампа
кундные импульсы вновь сжимались до пер-
накаливания. Величины ΔA определялись как
воначальной фемтосекундной длительности.
разность значений поглощения образца с воз-
Разрешение по времени спектрометра состав-
буждением и без возбуждения:
ляло 20 фс. Выделение спектральных диапазо-
нов возбуждения и зондирования проводили
ΔAλ = log(I0/Iвозб.)λ - log(I0/Iбез возб.)λ,
(1)
с помощью интерференционных фильтров
из фемтосекундного континуума, для генера-
где I0 - энергия света на входе в образец
ции которого усиленные импульсы (энергия
(опорный свет), I - энергия прошедшего через
0,3 мДж, длина волны 805 нм, частота повто-
образец света. Аппроксимация эксперимен-
рения 40 Гц) фокусировали в плоскую струю
тальных кинетик ΔA проводилась суммой экс-
этиленгликоля толщиной 0,2 мм. Спектр конти-
поненциальных и тригонометрических функ-
нуума охватывал весь видимый диапазон, а так-
ций с учётом функции возбуждения J:
же часть ближнего ИК- и ближнего УФ-диа-
пазонов. Континуум разделялся на две части,
ΔA(t) = J×(B0 +∑(Biexp(-t/τi) +
меньшая из которых (~2%) после фильтрации
+ Cicos(-ωit)exp(-t/φi))),
(2)
использовалась для зондирования, а основ-
ная - для возбуждения образца. При необ-
где символ × означает свёртку, B0 - амплитуда
ходимости возбуждающий свет дополнительно
постоянной компоненты, Bi - амплитуда ком-
ослаблялся нейтральными светофильтрами.
поненты с характерным временем τi, Ci - ам-
Для отсечения рассеянного света континуума
плитуда осциллирующей компоненты с часто-
использовалось диафрагмирование с помо-
той ωi и характерным временем затухания φi.
щью пространственных фильтров. Спектраль-
Наличие компоненты B0 обусловлено медлен-
ная дисперсия импульсов возбуждения и зон-
ными процессами с характерными временами,
дирования оптимизировалась перед входом в
существенно превышающими временное окно
образец с помощью призменных компрессо-
измерений. В качестве функции возбужде-
ров. Возбуждение образцов проводили на дли-
ния J использовалась кросс-корреляционная
нах волн 660, 675, 690, 705, 720, 735 и 750 нм,
функция импульсов возбуждения и зондиро-
а зондирование - на длине волны 755 нм.
вания, которая измерялась при помощи кор-
Интенсивность возбуждения соответствовала
релятора на основе ниобата лития. Поскольку
БИОХИМИЯ том 88 вып. 5 2023
ФЕМТОСЕКУНДНАЯ ЭКСИТОННАЯ РЕЛАКСАЦИЯ
865
Рис. 2. Упрощённая блок-схема спектрометра. 1 - Титан-сапфировый лазер с синхронизацией мод; 2 - восьмипро-
ходный титан-сапфировый усилитель; 3 - струя этиленгликоля; 4, 5 - пространственные фильтры; 6, 7 - спектраль-
ные фильтры; 8 - линия задержки; 9, 10 - системы компрессии фемтосекундных импульсов; 11 - механический пре-
рыватель; 12 - образец хлоросом, помещённый в криостат; 13 - оптический многоканальный анализатор спектров;
14 - компьютер. 4, 6, 9, 11 - канал возбуждения; 5, 7, 8, 10 - канал зондирования, «опор» - опорный канал. Вспомога-
тельная и контрольная аппаратура не показана
длительность лазерных импульсов была много
к эффективному накоплению заселённости
меньше длительности изучаемых процессов,
возбуждённого состояния при экситонной ре-
вместо формулы (2) использовалось прибли-
лаксации. Длины волн возбуждения и зонди-
жённое выражение:
рования показаны вертикальными стрелками
на рис. 3. Возбуждение при λ ≥ 700 нм прихо-
ΔA(t) = F (B0 +∑(Biexp(-t/τi) +
дилось на центральную часть полосы Qy, а при
+ Cicos(-ωit)exp(-t/φi))),
(3)
λ ≤ 700 нм оно затрагивало коротковолновое
крыло. Зондирование при 755 нм даёт инфор-
где F = ∫Jdt есть инструментальная функция.
мацию о динамике экситонных переходов с
энергией, близкой к минимальной.
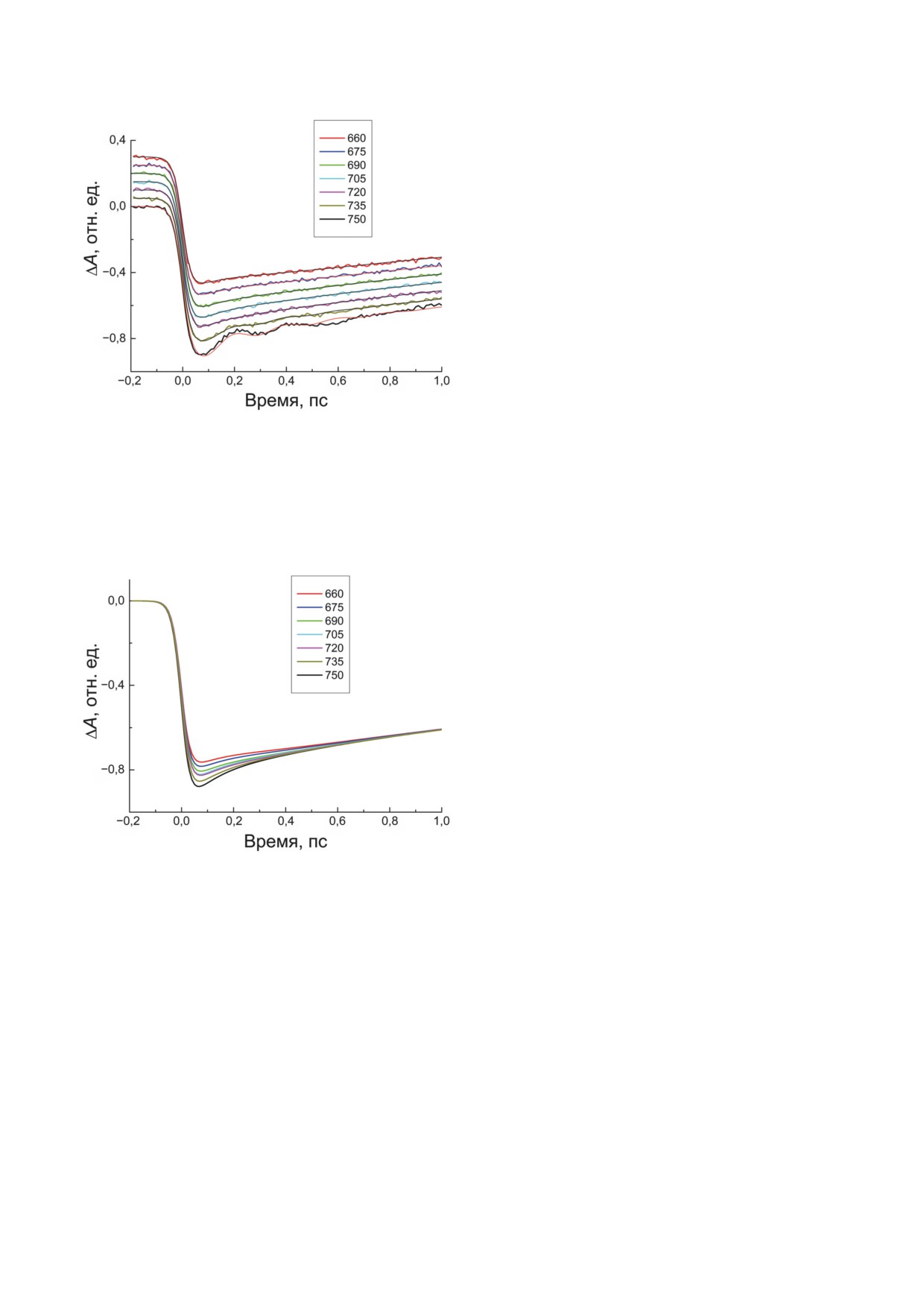
Кинетики ΔA (свет-темнота), измеренные
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
на длине волны 755 нм при разных длинах
волн возбуждения, показаны на рис. 4. Для на-
Стационарный спектр поглощения поло-
глядности кинетики нормированы и смещены
сы Qy хлоросом Cfx. aurantiacus, измеренный
по вертикали. Импульсное возбуждение при-
при температуре 80 К, показан на рис. 3. Поло-
водит к выцветанию поглощения хлоросом,
са Qy имеет максимум при 742 нм и асимметрич-
то есть к частичному опустошению основного
ную форму с крутым длинноволновым и поло-
состояния и заселению возбуждённых состоя-
гим коротковолновым спадом. При λ ≤ 700 нм
ний. Это соответствует отрицательному зна-
в спектре наблюдается небольшая, но очень
ку ΔA. Кроме того, импульсное зондирование
широкая подставка. Отметим, что при комнат-
ной температуре центральная часть спектра
полосы Qy становится несколько шире, однако
характерная асимметричная форма и коротко-
волновое крыло сохраняются. Полоса Qy хло-
росом значительно смещена в красную сто-
рону по сравнению с аналогичной полосой
мономерных молекул БХл с (максимум при
663 нм), что является следствием олигомери-
зации БХл с [35]. В хлоросомах Cfx. aurantiacus
экситонный переход с минимальной энер-
гией имеет длину волны поглощения ~752 нм,
то есть он заметно смещён в красную сторону
относительно максимума полосы Qy [4, 36].
Локализация этого перехода на шкале длин
была определена по выжиганию характер-
ного узкого провала в спектре поглощения
Рис. 3. Стационарный спектр поглощения полосы Qy
хлоросом при криогенной температуре [4, 36].
хлоросом Cfx. aurantiacus, измеренный при температу-
Сравнительно большое (пикосекундное) вре-
ре 80 К. Стрелками показаны длины волн возбуждения
мя жизни этого перехода может приводить
(чёрный цвет) и зондирования (красный цвет)
12
БИОХИМИЯ том 88 вып. 5 2023
866
ЯКОВЛЕВ и др.
сле возбуждения (см. кинетики при λвозб. = 750
и 735 нм). Согласно литературным данным,
Фурье-анализ осцилляций в хлоросомах пока-
зывает спектр характерных частот в области
10-400 см-1 [1, 21]. Среди этих частот домини-
руют две: 50 и 150 см-1, имеющие период около
600 и 200 фс соответственно. При аппрокси-
мации кинетик мы ограничились учётом этих
двух осцилляций в виде затухающих гармони-
ческих функций (см. формулу 2), что дало хо-
рошее качественное приближение (см. тонкие
линии на рис. 4). Математический анализ неко-
герентной части кинетик состоял в их аппрок-
симации суммой экспоненциальных функций
с различными характерными временами и
амплитудами. Результат этой аппроксимации
Рис. 4. Кинетики ΔA хлоросом Cfx. aurantiacus, измерен-
показан на рис. 5, а параметры аппроксими-
ные на длине волны 755 нм при возбуждении импульсом
рующих функций приведены в таблице. При
длительностью 20 фс на длинах волн 660, 675, 690, 705,
720, 735 и 750 нм. Кинетики нормированы и смещены
аппроксимации учитывалась инструменталь-
по вертикали для наглядности. Тонкими линиями даны
ная функция, дающая начальный спад всех
аппроксимирующие кривые. Подробности аппрокси-
кинетик в результате возбуждения хлоросом.
мации - в тексте. В рамке указаны цвета кинетических
При анализе кинетик мы стремились мини-
кривых
мизировать количество компонент и предпо-
читали варьировать их амплитуду, оставляя
неизменным характерное время. Погрешность
определения констант времени и амплитуд
компонент составляла около 10%.
Компоненты τ1-3 представляют для нас
наибольший интерес, поскольку имеют от-
рицательную амплитуду, то есть могут отра-
жать дополнительный рост заселённости воз-
буждённых состояний БХл c. Характерные
времена этих компонент составляют τ1 = 140,
τ2 = 220 и τ3 = 320 фс, то есть значительно
больше длительности импульса возбуждения.
При λвозб. = 750 нм данные компоненты отсут-
ствуют в кинетике ΔA. При λвозб. = 735 нм на-
блюдается одна компонента τ1, при λвозб. =720,
705 и 690 нм наблюдаются две компоненты,
τ1 и τ2, а при λвозб. = 675 и 660 нм в кинетиках
Рис. 5. Аппроксимирующие кривые кинетик ΔA, пред-
присутствуют три компоненты, τ1-3. Суммар-
ставленных на рис. 4, очищенные от осциллирующих
компонент. Кривые нормированы при задержке 2 пс ме-
ный вклад этих компонент возрастает от 4%
жду импульсами возбуждения и зондирования. Парамет-
при λвозб. = 735 нм до 14% при λвозб. = 660 нм,
ры аппроксимации находятся в таблице и тексте. В рамке
то есть остаётся относительно небольшим.
указаны цвета кинетических кривых
Таким образом, по мере удаления λвозб. от λзонд.
наблюдается увеличение как числа компонент,
создаёт вынужденное излучение из возбуждён-
так и их суммарного вклада. Наиболее вероят-
ных состояний, что ещё более смещает ΔA в
ной причиной возникновения компонент τ1-3
отрицательную сторону. После окончания им-
является экситонная релаксация, в результате
пульса возбуждения все кинетики демонстри-
которой энергия возбуждения передаётся от
руют уменьшение заселённости возбуждённых
коротковолновых к длинноволновым экси-
состояний в пикосекундном диапазоне в ос-
тонным уровням. Избыток энергии поглоща-
новном из-за переноса энергии БХл c → БХл a.
ется окружением, в качестве которого могут
Если длины волн возбуждения и зондирова-
выступать сами агрегаты БХл c. В этот процесс
ния достаточно близки, в кинетиках ΔA на-
могут быть вовлечены разные колебательные
блюдаются слабые когерентные осцилляции,
состояния, поэтому правильнее считать эту
полностью затухающие в течение 1-2 пс по-
релаксацию экситонно-колебательной.
БИОХИМИЯ том 88 вып. 5 2023
ФЕМТОСЕКУНДНАЯ ЭКСИТОННАЯ РЕЛАКСАЦИЯ
867
Параметры аппроксимирующих функций экспериментальных кинетик ΔA
λвозб.,
τ1, пс
τ2, пс
τ3, пс
τ4, пс
τ5, пс
τ6, пс
нм
0,1 ± 0,012
1,3 ± 0,05
11 ± 0,3
750
(+0,16 ± 0,01)
(+0,34 ± 0,006)
(+0,5 ± 0,008)
0,14 ± 0,03
0,1 ± 0,007
1,3 ± 0,06
11 ± 0,4
735
(-0,04 ± 0,006)
(+0,16 ± 0,01)
(+0,34 ± 0,005)
(+0,5 ± 0,008)
0,14 ± 0,023
0,22 ± 0,04
0,1 ± 0,008
1,3 ± 0,08
11 ± 0,3
720
(-0,07 ± 0,006)
(-0,01 ± 0,0023)
(+0,16 ± 0,012)
(+0,34 ± 0,007)
(+0,5 ± 0,01)
0,14 ± 0,022
0,22 ± 0,025
0,1 ± 0,008
1,3 ± 0,08
11 ± 0,4
705
(-0,04 ± 0,006)
(-0,04 ± 0,0045)
(+0,16 ± 0,013)
(+0,34 ± 0,005)
(+0,5 ± 0,007)
0,14 ± 0,02
0,22 ± 0,03
0,1 ± 0,01
1,3 ± 0,06
11 ± 0,4
690
(-0,05 ± 0,007)
(-0,05 ± 0,005)
(+0,16 ± 0,012)
(+0,34 ± 0,006)
(+0,5 ± 0,006)
0,14 ± 0,025
0,22 ± 0,0035
0,32 ± 0,04
0,1 ± 0,006
1,3 ± 0,07
11 ± 0,3
675
(-0,04 ± 0,005)
(-0,04 ± 0,004)
(-0,04 ± 0,004)
(+0,16 ± 0,015)
(+0,34 ± 0,005)
(+0,5 ± 0,008)
0,14 ± 0,02
0,22 ± 0,03
0,32 ± 0,03
0,1 ± 0,008
1,3 ± 0,1
11 ± 0,3
660
(-0,04 ± 0,005)
(-0,04 ± 0,003)
(-0,06 ± 0,005)
(+0,16 ± 0,012)
(+0,34 ± 0,006)
(+0,5 ± 0,01)
Примечание. λвозб. - длина волны возбуждения, τ1-6 - характерное время экспоненциальной компоненты. В скоб-
ках даны относительные амплитуды компонент. Знак «+» или «-» обозначает рост или спад величины ΔA с течением
времени
Компоненты τ4-6 имеют положительную
тике ΔA появляются новые субпикосекунд-
амплитуду, что соответствует уменьшению
ные компоненты, имеющие разный знак и
заселённости возбуждённых состояний. Ха-
значительно меняющие начальную динами-
рактерные времена и относительные вклады
ку ΔA [27]. В нашей работе оптическая плот-
этих компонент практически не зависят от
ность образцов при λ < 700 нм была в ~15 раз
длины волны возбуждения с точностью око-
меньше таковой в центре полосы Qy (рис. 3),
ло 10%. Мультиэкспоненциальный характер
а плотность возбуждения была в 3 раза боль-
распада возбуждённых состояний хлоросом
ше (2 × 1012 фотонов/см2 при λвозб. ≥ 700 нм и
Cfx. aurantiacus с характерными временами,
6 × 1012 фотонов/см2 при λвозб. ≤ 700 нм). Это
близкими к приведённым в таблице, отме-
означает, что начальная плотность экситонов
чается во многих работах [21-23, 28, 31, 32].
для кинетик, измеренных при λвозб ≤ 700 нм,
Компоненты τ5 = 1,3 пс и τ6 = 11 пс отражают
была в несколько раз меньше, чем таковая для
перенос энергии БХл c → БХл a, поскольку в
кинетик, измеренных при λвозб. ≥ 700 нм. Соот-
кинетиках ΔA БХл a наблюдаются зеркальные
ветственно, влияние аннигиляции экситонов
изменения с близкими временами. Компонен-
на кинетики, измеренные при λвозб. ≤ 700 нм,
та τ5 = 1,3 пс может также отражать миграцию
было меньше, чем на кинетики, измерен-
энергии между агрегатами БХл c. При измере-
ные при λвозб. ≥ 700 нм. Может показаться, что
ниях кинетик с задержкой более 100 пс выяв-
чем ближе λвозб. к центру полосы Qy, тем боль-
лен ряд слабых медленных компонент [21].
ше быстрых компонент в неосциллирующей
Природа компоненты τ4 = 0,1 пс до конца не
части экспериментальных кинетик (рис.
5).
выяснена. Данная компонента может быть
Сравнение кинетик, измеренных при разных
следствием процессов синглет-синглетной ан-
λвозб., показывает, что это не так. Кинетики,
нигиляции экситонов, которая присуща спек-
измеренные при λвозб. = 660, 675, 690 и 705 нм,
троскопическим измерениям в хлоросомах
имеют заметные отличия при t < 300 фс, то-
даже при очень низкой энергии возбужде-
гда как начальная плотность экситонов в
ния [26, 27]. Кроме того, компонента τ4 может
этих измерениях была примерно одинако-
иметь когерентную или артефактную природу.
вой. То же самое можно утверждать для не-
Аннигиляция экситонов может существен-
осциллирующих частей кинетик, измеренных
но исказить кинетики ΔA в хлоросомах. При
при λвозб. = 720 и 750 нм. Кинетика, измерен-
увеличении плотности возбуждения от ~1012
ная при λвозб. = 735 нм, имела самую большую
до ~1014 фотонов/см2 за один импульс в кине-
начальную плотность экситонов среди всех
БИОХИМИЯ том 88 вып. 5 2023
12*
868
ЯКОВЛЕВ и др.
кинетик, однако она демонстрирует более
ной плотности по агрегатам БХл [30]. Из этого
пологий подъем неосциллирующей части,
следует, что в общем случае безызлучательные
чем кинетика, измеренная при λвозб. = 750 нм
переходы между экситонными уровнями могут
(рис. 5). По-видимому, полностью избавиться
быть связаны как с потерями энергии, так и с
от аннигиляции невозможно даже при плот-
её миграцией. Трудность обнаружения кине-
ности возбуждения ~1011 фотонов/см2 за один
тических компонент ΔA, отвечающих экситон-
импульс [27]. Другим серьёзным фактором,
ной релаксации, связана с присутствием в этих
осложняющим анализ наших данных, явля-
кинетиках близких компонент, которые отра-
ются когерентные явления, возникающие при
жают иные процессы. В нашем случае компо-
фемтосекундном возбуждении хлоросом. От-
ненты τ1 = 0,14 пс и τ4 = 0,1 пс имеют разный
деление осцилляций, имеющих сложную фор-
знак и поэтому частично компенсируют друг
му, от неосциллирующей части кинетик всегда
друга. Отметим ещё раз, что серьёзным факто-
содержит неопределённость. Эта задача стано-
ром, затрудняющим анализ кинетик, является
вится неразрешимой при закритическом зату-
синглет-синглетная аннигиляция, присущая
хании когерентности. В этом случае перио-
молекулярным агрегатам [37]. В хлоросомах
дическая осцилляция превращается в набор
эта аннигиляция заметно искажает кинети-
экспоненциальных компонент и становится
ки ΔA, что заставляет применять импульсное
неотличимой от некогерентных вкладов.
возбуждение с очень низкой интенсивностью
Впервые экситонная релаксация в хлоро-
порядка 1011-1012 фотонов/см2 для минимиза-
сомах Cfx. aurantiacus наблюдалась при крио-
ции этого искажения [27]. Применение более
генной температуре [22]. В этой работе была
интенсивного возбуждения ускоряет началь-
обнаружена слабая кинетическая компонента
ный этап кинетик, что может привести к оши-
ΔA (τ = 300 фс) с отрицательной амплитудой
бочному выводу о наличии очень быстрых
при λвозб. = 731 нм и λзонд. = 758 нм. Позднее ки-
процессов переноса энергии. В нашей работе
нетические компоненты ΔA, присущие экси-
интенсивность возбуждения была 2 × 1012 фо-
тонной релаксации, были обнаружены в кине-
тонов/см2 при λвозб. ≥ 700 нм и 6 × 1012 фото-
тиках хлоросом Cfx. aurantiacus при комнатной
нов/см2 при λвозб. ≤ 700 нм, что соответствует
температуре [28, 31, 32]. В работе Martiskainen
относительно небольшой аннигиляции.
et al. [28] эта компонента имела характерное
Как отмечалось во Введении, имеется боль-
время 150 фс и наблюдалась при λвозб. = 685 нм
шое количество структурных моделей хлоро-
и λзонд. = 758 нм, но отсутствовала при λзонд. =
сом. Без точного знания атомных координат
= 742 нм. В работе Yakovlev et al. [31] обнару-
выбор в пользу той или иной модели невозмо-
жена очень слабая компонента с характерным
жен. Общим для всех моделей является пред-
временем 70 фс при λвозб. = 725 нм и λзонд. =
ставление о квазилинейных цепях молекул
= 755 нм. В работе Yakovlev et al. [32] при λвозб. =
БХл, которые могут образовывать более слож-
= 490 нм и λзонд. = 620-770 нм наблюдались,
ные трёхмерные структуры. Спектр поглоще-
среди прочих компонент, две компоненты ки-
ния хлоросом определяется в основном имен-
нетик ΔA с характерными временами 100-130 фс
но свойствами этих линейных цепей, и только
и 220-270 фс, которые можно объяснить экси-
в меньшей степени - взаимным расположени-
тонной релаксацией. В хлоросомах других фо-
ем цепей. Данное утверждение особенно вер-
тосинтезирующих бактерий также обнаружены
но для хлоросом Cfx. aurantiacus, в которых
явные признаки экситонной релаксации. Так,
относительно небольшая плотность упаковки
в кинетиках хлоросом бактерии Chlorobium
молекул БХл с приводит к тому, что среднее
phaeobacteroides, состоящей из агрегатов БХл е,
расстояние между соседними цепями (1-2 нм)
наблюдались компоненты экситонной релак-
исключает возможность образования водород-
сации с временами 200-500 фс [27]. В кине-
ных связей между молекулами из соседних це-
тиках хлоросом зелёных фотосинтезирую-
пей [12]. В этом случае слабое взаимодействие
щих бактерий Chlorobaculum tepidum и Pros-
цепей достигается за счёт сил Ван-дер-Ваальса.
thecochloris aestuarii при λвозб. = 685 нм и λзонд. =
Для теоретического моделирования экси-
= 758 нм были выделены компоненты с време-
тонной релаксации в хлоросоме Cfx. aurantiacus
нами 117-160 фс, которые были приписаны пе-
мы выбрали модель цилиндрических агрега-
реносу энергии между экситонными полосами
тов БХл с [12, 36]. Эта модель предполагает,
с различной энергией [29]. Подчеркнём, что
что линейные цепи молекул БХл объединены
пространственная миграция энергии внутри
в длинные полые цилиндры. В рамках этой
хлоросом неразрывно связана с релаксацией
модели типичная хлоросома Cfx. aurantiacus
энергии, поскольку каждая экситонная полоса
состоит из 10-20 таких цилиндров, распо-
имеет собственное распределение электрон-
ложенных в 1-3 слоя по несколько цилиндров
БИОХИМИЯ том 88 вып. 5 2023
ФЕМТОСЕКУНДНАЯ ЭКСИТОННАЯ РЕЛАКСАЦИЯ
869
в каждом слое. Каждый цилиндр состоит из
примерно 500 молекул БХл с и поделен на оди-
наковые элементарные блоки по 20-40 моле-
кул в каждом блоке. Для определённости мы
предположили, что элементарный блок состо-
ит из 6 линейных цепей, каждая из которых
состоит из нескольких молекул БХл с. Данная
модель хорошо объясняет экспериментальные
спектры стационарного поглощения и флуо-
ресценции при комнатной и криогенной тем-
пературе [36], спектры кругового дихроизма
и фемтосекундные спектры ΔA [38], а также
согласуется с данными количественного ана-
лиза хлоросом Cfx. aurantiacus [12]. Для ими-
тации разброса энергетических и структурных
параметров мы варьировали энергию взаимо-
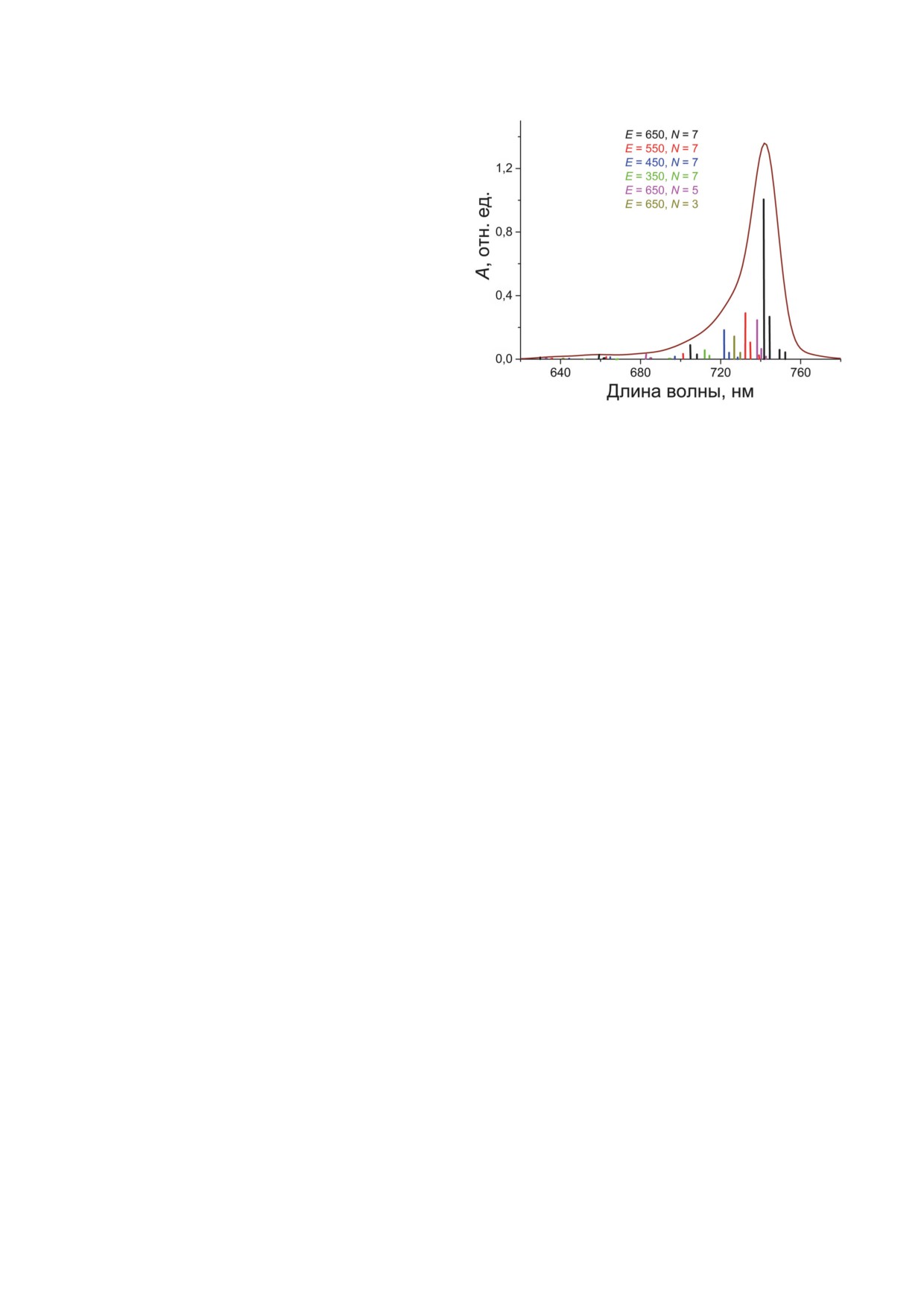
Рис. 6. Теоретический спектр стационарного поглоще-
действия соседних молекул БХл с и количество
ния полосы Qy хлоросом Cfx. aurantiacus, полученный
молекул в каждой цепи. Такой подход согласу-
на основе модели цилиндрического агрегата [12, 36, 38].
Амплитуды и центральные длины волн экситонных пере-
ется с экспериментами по спектроскопии оди-
ходов, дающих вклад в суммарный спектр, показаны вер-
ночных хлоросом [39] и широко применяется
тикальными линиями разной высоты. Слабые переходы
во многих теоретических работах. В расчётах
со вкладом менее 0,5% не показаны. Цветом выделены
переходы для различных энергий взаимодействия Е со-
мы использовали гауссовский профиль экси-
седних молекул БХл и различного количества молекул N
тонных переходов. Колебательная структура
в каждой цепи агрегата. Математические подробности
экситонных полос и эффект гиперхромизма
приведены в оригинальных теоретических работах
не учитывались.
Рассчитанный спектр полосы поглощения
полосы Qy представлен на рис. 6. Детали теоре-
рекрытия энергий соседних переходов, когда
тического моделирования можно найти в рабо-
невозможно селективное возбуждение и зон-
тах Fetisova et al. и Mauring et al. [12, 36]. Спектр
дирование отдельного перехода, но каждая
образован большим количеством экситонных
группа может возбуждаться селективно. Чис-
переходов. Теоретический спектр близок по
ло таких групп составило 7 в диапазоне 660-
форме к экспериментальному: он имеет асим-
750 нм в соответствии с набором из семи длин
метричную форму с растянутым коротковол-
волн возбуждения в эксперименте. Учитыва-
новым крылом. Это крыло протянулось вплоть
лись прямые и обратные переходы как между
до λ ~620 нм, при этом центральная длина
соседними группами на шкале энергий, так
волны поглощения мономерных молекул БХл с
и между более удалёнными по энергии груп-
полагалась равной 663 нм в соответствии с
пами (см. вставку на рис. 7). Отношение ско-
данными эксперимента [24]. Самый длинно-
ростей прямых и обратных переходов равня-
волновый переход находится при 752,4 нм,
лось фактору Больцмана [40]. Предполагалось,
а самый интенсивный - при 742 нм. Группа
что каждая группа реализует прямой пере-
интенсивных переходов образует центральную
нос БХл c → БХл a (потери энергии системы)
часть полосы Qy, а бо льшая часть слабых пере-
с одной одинаковой скоростью и независимо
ходов находится при λ ≤ 700 нм. Для получения
от других групп. Отметим, что так называемые
гладкого профиля полосы Qy ширина каждого
лестничные или каскадные модели, подобные
перехода полагалась много больше разности
нашей, широко применяются для моделиро-
энергий между соседними переходами.
вания различных процессов релаксации энер-
Для приближённого расчёта динамики
гии, в том числе для описания колебательной
релаксации энергии мы разделили все экси-
релаксации мономерных молекул [40, 41].
тонные переходы на несколько групп, распо-
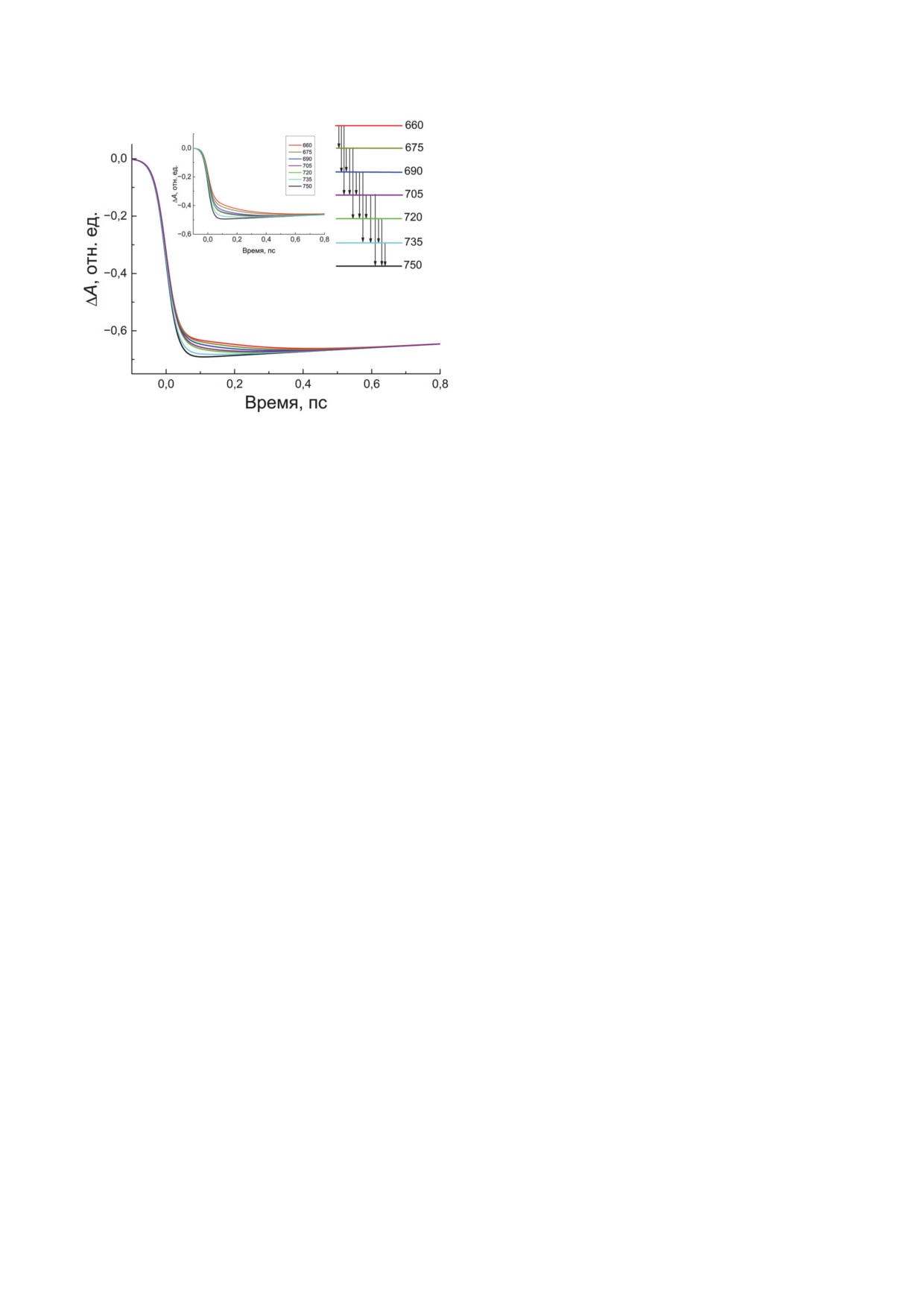
Результат моделирования кинетики груп-
ложенных последовательно на шкале энергий,
пы возбуждённых состояний с минимальной
и рассмотрели безызлучательные переходы ме-
энергией (длина волны 750 нм) представлен
жду возбуждёнными состояниями этих групп
на рис. 7. Для наглядности кинетики норми-
без детализации процессов, происходящих
рованы при задержке 2 пс. Оказалось, что хо-
внутри каждой группы (рис. 7, вставка спра-
рошее качественное согласие с эксперимен-
ва). Иными словами, каждая группа считалась
том (рис. 7, вставка слева) достигается, если
одним состоянием с определённой энергией.
характерное время безызлучательного пере-
Такой подход оправдан в случае сильного пе-
хода между соседними группами равно 140 фс,
БИОХИМИЯ том 88 вып. 5 2023
870
ЯКОВЛЕВ и др.
хлоросом, показывает, что делокализация и
релаксация экситонов происходят за время
около 100 фс [42]. К такому же выводу о том,
что диффузия экситонов происходит за время
≤ 100 фс, приводят данные по двумерной элек-
тронной спектроскопии хлоросом зелёных
серных бактерий [43].
Таким образом, данные нашей работы
показывают, что увеличение разности энер-
гий экситонных уровней приводит к общему
замедлению релаксационного переноса энер-
гии между ними в соответствии с теорией дис-
сипации энергии в открытых системах [40].
В простейшем случае двухуровневой системы
и слабой электронно-колебательной связи за-
висимость скорости релаксации от величины
Рис.
7.
Теоретические кинетики ΔA хлоросом
энергетического зазора приближённо описы-
Cfx. aurantiacus, рассчитанные на основе модели релакса-
вается экспоненциальной функцией. В нашем
ционных переходов между группами экситонных полос,
поглощающих на длинах волн 660, 675, 690, 705, 720, 735
случае эта зависимость качественно иная: с
и 750 нм (см. вставку справа). Цветом выделены кинети-
увеличением разности энергий между груп-
ки для соответствующих длин волн возбуждения. Длина
пами экситонных переходов возникают более
волны зондирования считалась равной 755 нм. Кривые
медленные компоненты релаксации, но ско-
нормированы при задержке 2 пс между импульсами воз-
буждения и зондирования. На вставке слева - аппрокси-
рости всех компонент практически не зависят
мирующие кинетики с рис. 5, из которых удалены компо-
от этой разности. Наличие нескольких релак-
ненты τ4 и τ5. Подробности - в тексте
сационных компонент можно объяснить мно-
жественностью путей миграции экситонов по
а между группами, разделёнными на шкале
хлоросоме. Экситоны могут возбуждаться в
энергий одной или двумя соседними группа-
разных частях хлоросомы и преодолевать раз-
ми, это время составило около 220 и 320 фс.
ные расстояния до момента перехода в базо-
Эти времена совпадают с эксперименталь-
вую пластинку. Чем больше времени длится
ными константами кинетических компо-
миграция экситона по хлоросоме, тем больше
нент (таблица). Возбуждение на длине волны
энергии он потеряет, и наоборот. С другой сто-
750 нм даёт кинетику, не содержащую релак-
роны, диссипация энергии экситонов может
сационных переходов. При λвозб. = 735 нм в
происходить с участием разных термостатов и,
кинетике появляется компонента экситонной
следовательно, иметь разную скорость. В про-
релаксации с константой времени 140 фс, со-
стейшем случае в качестве термостата мо-
ответствующая безызлучательному переходу в
жет выступать одна колебательная мода [44].
соседнюю группу. При λвозб. = 720 нм в кинети-
В этом случае безызлучательный переход ме-
ке появляется вторая компонента релаксации
жду двумя экситонными уровнями будет про-
с константой времени 220 фс, соответствую-
исходить по механизму внутренней конверсии.
щая безызлучательному переходу между груп-
Поскольку в хлоросомах отсутствует белковая
пами, поглощающими при 720 и 750 нм. Тре-
матрица [2], в качестве термостатирующего
тья компонента с константой времени 320 фс
окружения могут выступать различные груп-
соответствует безызлучательным переходам
пы атомов, принадлежащих молекулам БХл, а
типа 705 → 750, 690 → 735 и т. д. Эта компонента
также каротиноиды или белки и липиды, об-
становится заметной при λвозб. ≤ 690 нм.
разующие оболочку хлоросом.
К сожалению, даже при криогенной тем-
Аппроксимация спектра поглощения
пературе не удаётся селективно возбудить и
хлоросом Cfx. aurantiacus в рамках цилиндри-
зондировать отдельные экситонные пере-
ческой структурной модели даёт хороший ре-
ходы в хлоросомах. Можно предположить,
зультат (рис. 6). Тем не менее коротковолно-
что релаксационные переходы между сосед-
вое крыло экспериментального спектра может
ними экситонными уровнями в хлоросомах
содержать колебательные переходы, не учтён-
Cfx. aurantiacus происходят за время ≤ 100 фс.
ные нашей моделью. Спектроскопия вынуж-
Это предположение согласуется с результа-
денного комбинационного рассеяния хлоро-
тами ряда работ. Так, общая теория динамики
сом Cfx. aurantiacus выявила ряд колебательных
поляронов в двумерной молекулярной матри-
переходов, самые сильные из которых имеют
це, применённая к цилиндрической модели
частоты 94, 148, 272, 753, 1153 и 1540 см-1 [45].
БИОХИМИЯ том 88 вып. 5 2023
ФЕМТОСЕКУНДНАЯ ЭКСИТОННАЯ РЕЛАКСАЦИЯ
871
Фактор Хуана-Риса (Huang-Rhys) всех этих
спектры находятся между λвозб. и λзонд., прежде
мод очень мал: он варьирует от 0,008 для моды
чем он начнёт излучать вблизи λзонд.. Это неиз-
753 см-1 до 0,05 для моды 272 см-1. Для самого
бежно приведёт к его полному исчезновению,
сильного экситонного перехода (λ = 742 нм)
что и подтверждается отсутствием осцилляций
0-1 колебательный переход этих мод имеет
при λвозб. < 740 нм (рис. 4). При близких λвозб. и
длины волн в спектре поглощения при 737,
λзонд. могут возбуждаться и зондироваться одни
733, 727, 702, 683 и 666 нм соответственно.
и те же экситонные переходы, поэтому вол-
Возбуждение на длинах волн от 660 до 750 нм
новой пакет может успешно достичь области
в нашей работе могло привести к заселению
зондирования и остаться на первоначальной
первого уровня данных мод. Колебательная
потенциальной поверхности. Отметим, что ко-
релаксация в возбуждённом состоянии даёт
гда когерентные осцилляции имеют затухание
дополнительное изменение спектра ΔA в обла-
больше критического, они становятся аперио-
сти 0-0 перехода [41]. Величина этого изме-
дическими и могут быть ошибочно приняты за
нения не превышает нескольких процентов.
обычные кинетические компоненты. Детальное
Характерные времена колебательной релак-
исследование когерентных эффектов в хлоро-
сации мономерных хлорофиллов составляют
сомах может дать новую информацию о спектре
несколько сотен фс [44]. Аналогичные вре-
экситонных переходов и, следовательно, о про-
мена для хлоросом до сих пор не определены,
странственном строении хлоросом.
однако допускается, что при олигомеризации
В заключение отметим, что длинновол-
хлорофиллов эти времена могут дополнитель-
новые экситонные полосы с низкой энергией
но уменьшиться. Кроме того, олигомеризация
играют ключевую роль в процессе светосбора в
БХл с в хлоросомах Cfx. aurantiacus приводит
хлоросомах, эффективно накапливая энергию
к эффекту гиперхромизма, когда взаимодей-
перед её отправкой в базовую пластинку и далее
ствие Qy и Вх,у переходов приводит к тому, что
в реакционный центр. Широкополосный сол-
дипольный момент переходов Qy дополни-
нечный свет приводит к экситонным переходам
тельно усиливается за счёт ослабления перехо-
во всём видимом диапазоне, однако уже через
дов Вх,у [46]. Влияние этого эффекта на дина-
несколько сотен фс после поглощения очеред-
мику экситонов не исследовано.
ной порции фотонов их энергия преобразуется
В хлоросомах Cfx. aurantiacus фемтосекунд-
в энергию возбуждённых состояний, распо-
ное возбуждение приводит к появлению коге-
ложенных в красной области спектра (вблизи
рентных осцилляций при достаточной близо-
752 нм в хлоросомах Cfx. aurantiacus). Эта релак-
сти длин волн возбуждения и зондирования
сация энергии отражает миграцию экситонов
(рис. 4). Эти осцилляции затухают в течение
по хлоросоме к базовой пластинке. Для эффек-
1-2 пс после возбуждения и имеют частоты,
тивной передачи энергии в базовую пластинку
характерные для колебательной когерентно-
экситоны с низкой энергией локализуются на
сти, что подтверждается их близостью к часто-
агрегатах БХл, непосредственно примыкающих
там резонансного комбинационного рассеяния
к базовой пластинке. Таким образом, изучение
хлоросом [21, 47]. Первый, самый интенсив-
спектральной динамики экситонов раскрывает
ный пик этих осцилляций наблюдается сразу
их пространственную динамику.
после возбуждения и имеет характерную дли-
тельность порядка 100 фс и относительную
Благодарности. Авторы выражают глубо-
амплитуду до 10%. Когерентное возбуждение
кую признательность покойному академику
нескольких колебательных уровней формирует
В.А. Шувалову за общую поддержку и посто-
волновой пакет [48], который совершает осцил-
янное внимание к их работе.
лирующее движение по потенциальной поверх-
Вклад авторов. З.Г. Фетисова - общее руко-
ности возбуждённого электронного состояния.
водство работой, постановка задачи, обсужде-
При своём движении волновой пакет излучает,
ние результатов; А.Г. Яковлев - постановка
причём длина волны этого излучения меняется
задачи, проведение экспериментов и расчётов,
во времени. Теоретически каждый экситонный
обсуждение результатов, написание статьи;
уровень хлоросом имеет собственную потенци-
А.С. Таисова - приготовление образцов, напи-
альную поверхность. Переход волнового пакета
сание статьи.
с одной поверхности на другую (если таковой
Финансирование. Работа выполнена за счёт
возможен) сопровождается его деградацией.
средств госзадания «Фотобиофизика преобра-
При значительной разнице между λвозб. и λзонд.
зования солнечной энергии в живых системах»
волновой пакет должен совершить несколько
(№ АААА-А17-117120540070-0).
таких переходов и побывать на потенциальных
Конфликт интересов. Авторы заявляют об
поверхностях всех экситонных уровней, чьи
отсутствии конфликта интересов.
БИОХИМИЯ том 88 вып. 5 2023
872
ЯКОВЛЕВ и др.
Соблюдение этических норм. Настоящая следований с участием людей или животных в
статья не содержит описания каких-либо ис- качестве объектов.
СПИСОК ЛИТЕРАТУРЫ
1.
Яковлев А. Г., Таисова А. С., Фетисова З. Г. (2020)
12.
Fetisova, Z. G., Freiberg, A. M., Mauring, K.,
Перенос энергии в светособирающих аппаратах
Novoderezhkin, V. I., Taisova, A. S., and Timpmann,
природного фотосинтеза, Усп. совр. биол., 140,
K. E. (1996) Excitation energy transfer in chlorosomes
166-182, doi: 10.31857/S0042132420020088.
of green bacteria: Theoretical and experimental
2.
Frigaard, N.-U., and Bryant, D. (2006) Chlorosomes:
studies, Biophys. J.,
71,
995-1010, doi:
10.1016/
antenna organelles in green photosynthetic bacteria,
S0006-3495(96)79301-3.
in: Complex Intracellular Structures in Prokaryotes.
13.
Sprague, S., Staehelin, L., DiBartolomeis, M.,
Microbiology Monographs (Shively, J. M., ed),
and Fuller, R. (1981) Isolation and development of
Springer, Berlin, pp. 79-114, doi: 10.1007/7171_021.
chlorosomes in the green bacterium Chloroflexus
3.
Blankenship, R. E., Olson, J. M., and Miller, M.
aurantiacus, J. Bacteriol., 147, 1021-1031, doi: 10.1128/
(1995) Antenna complexes from green photosynthetic
jb.147.3.1021-1031.1981.
bacteria, in Anoxygenic Photosynthetic Bacteria
14.
Staehelin, L., Golecki, J., Fuller, R., and Drews, G.
(Blankenship, R. E., Madigan, M. T., Bauer, C. E., eds),
(1978) Visualization of the supramolecular architecture
Kluwer Academic Publishers, Dordrecht, pp. 399-435,
of chlorosomes (Chlorobium type vesicles) in freeze-
doi: 10.1007/0-306-47954-0_20.
fractured cells of Chloroflexus aurantiacus, Arch.
4.
Fetisova, Z., and Mauring, K. (1992) Experimental
Microbiol., 119, 269-277, doi: 10.1007/BF00405406.
evidence of oligomeric organization of antenna bac-
15.
Olson, J. M. (1980) Chlorophyll organization in green
teriochlorophyll c in green bacterium Chloroflexus au-
photosynthetic bacteria, Biochim. Biophys. Acta, 594,
rantiacus by spectral hole burning, FEBS Lett., 307,
33-51, doi: 10.1016/0304-4173(80)90012-9.
371-374, doi: 10.1016/0014-5793(92)80715-s.
16.
Psencik, J., Ikonen, T. P., Laurinmaki, P., Merckel,
5.
Fetisova, Z., Freiberg, A., and Timpmann, K. (1988)
M. C., Butcher, S. J., Serimaa, R. E., and Tuma, R.
Long-range molecular order as an efficient strategy for
(2004) Lamellar organization of pigments in chlo-
light harvesting in photosynthesis, Nature (London),
rosomes, the light harvesting complexes of green
334, 633-634, doi: 10.1038/334633a0.
photosynthetic bacteria, Biophys. J., 87, 1165-1172,
6.
Van Dorssen, R. J., Vasmel, H., and Amesz, J. (1986)
doi: 10.1529/biophysj.104.040956.
Pigment organization and energy transfer in the green
17.
Günther, L., Jendrny, M., Bloemsma, E., Tank, M.,
photosynthetic bacterium Chloroflexus aurantiacus.
Oostergetel, G., Bryant, D., Knoester, J., and
II. The chlorosome, Photosynth. Res.,
9,
33-45,
Köhler, J.
(2016) Structure of light-harvesting
doi: 10.1007/BF00029729.
aggregates in individual chlorosomes, J. Phys. Chem. B,
7.
Krasnovsky, A., and Bystrova, M. (1980) Self-assem-
120, 5367-5376, doi: 10.1021/acs.jpcb.6b03718.
bly of chlorophyll aggregated structures, BioSystems,
18.
Sawaya, N., Huh, J., Fujita, T., Saikin, S., and
12, 181-194, doi: 10.1016/0303-2647(80)90016-7.
Aspuru-Guzik, A. (2015) Fast delocalization leads to
8.
Smith, K., Kehres, L., and Fajer, J. (1983) Aggrega-
robust long-range excitonic transfer in a large quantum
tion of bacteriochlorophylls c, d and e. Models for the
chlorosome model, Nano Lett.,
15,
1722-1729,
antenna chlorophylls of green and brown photosyn-
doi: 10.1021/nl504399d.
thetic bacteria, J. Am. Chem. Soc., 105, 1387-1389,
19.
Fujita, T., Huh, J., Saikin, S., Brookes, J., and
doi: 10.1021/ja00343a062.
Aspuru-Guzik, A. (2014) Theoretical characterization
9.
Olson, J. M. (1998) Chlorophyll organization and
of excitation energy transfer in chlorosome light-har-
function in green photosynthetic bacteria, Photochem.
vesting antennae from green sulfur bacteria, Photosynth.
Photobiol., 67, 61-75, doi: 10.1111/j.1751-1097.1998.
Res., 120, 273-289, doi: 10.1007/s11120-014-9978-7.
tb05166.x.
20.
Prokhorenko, V. I., Steensgaard, D. B., and Holzwarth,
10.
Pierson, B., and Castenholz, R. (1974) Pigments
A. R. (2000) Exciton dynamics in the chlorosomal
and growth in Chloroflexus aurantiacus, a phototro-
antennae of the green bacteria Chloroflexus aurantiacus
phic filamentous bacterium, Arch. Microbiol., 100,
and Chlorobium tepidum, Biophys. J., 79, 2105-2120,
283-305, doi: 10.1007/BF00446324.
doi: 10.1016/S0006-3495(00)76458-7.
11.
Oelze, J. (1992) Light and oxygen regulation of
21.
Savikhin, S., Zhu, Y., Lin, S., Blankenship, R. E., and
the synthesis of bacteriochlorophyll a and bacteri-
Struve, W. S. (1994) Femtosecond spectroscopy of
ochlorophyll c in Chloroflexus aurantiacus, J. Bac-
chlorosome antennas from the green photosynthetic
teriol.,
174,
5021-5026, doi:
10.1128/jb.174.15.
bacterium Chloroflexus aurantiacus, J. Phys. Chem.,
5021-5026.1992.
98, 10322-10334, doi: 10.1021/j100091a056.
БИОХИМИЯ том 88 вып. 5 2023
ФЕМТОСЕКУНДНАЯ ЭКСИТОННАЯ РЕЛАКСАЦИЯ
873
22.
Savikhin, S., Zhu, Y., Blankenship, R. E., and Struve,
from the photosynthetic bacterium Chloroflexus
W. S. (1996) Intraband energy transfers in the BChl c
aurantiacus: Ultrafast excitation energy conversion and
antenna of chlorosomes from the green photosynthetic
transfer, Biochim. Biophys. Acta Bioenergetics, 1862,
bacterium Chloroflexus aurantiacus, J. Phys. Chem.,
148396, doi: 10.1016/j.bbabio.2021.148396.
100, 17978-17980, doi: 10.1021/jp961752b.
33.
Causgrove, T. P., Brune, D. C., Wang, J.,
23.
Savikhin, S., Buck, D. R., Struve, W. S., Blankenship,
Wittmershaus, B. P., and Blankenship, R. E. (1990)
R. E., Taisova, A. S., Novoderezhkin, V. I., and
Energy transfer kinetics in whole cells and isolated
Fetisova, Z. G. (1998) Excitation delocalization in the
chlorosomes of green photosynthetic bacteria,
bacteriochlorophyll c antenna of the green bacterium
Photosynth. Res., 26, 39-48, doi: 10.1007/BF00048975.
Chloroflexus aurantiacus as revealed by ultrafast
34.
Taisova, A. S., Keppen, O. I., Lukashev, E. P.,
pump-probe spectroscopy, FEBS Lett., 430, 323-326,
Arutyunyan, A. M., and Fetisova, Z. G. (2002) Study
doi: 10.1016/S0014-5793(98)00691-7.
of the chlorosomal antenna of the green mesophilic
24.
Yakovlev, A., Taisova, A., and Fetisova, Z. (2002)
filamentous bacterium Oscillochloris trichoides, Photo-
Light control over the size of an antenna unit building
synth. Res., 74, 73-85, doi: 10.1023/A:1020805525800.
block as an effecient strategy for light harvesting
35.
Mukamel, S. (1995) Principles of Nonlinear Optical
in photosynthesis, FEBS Lett.,
512,
129-132,
Spectroscopy, Oxford University Press, New York/
doi: 10.1016/s0014-5793(02)02238-x.
Oxford.
25.
Yakovlev, A., Novoderezhkin, V., Taisova, A., and
36.
Mauring, K., Novoderezhkin, V., Taisova, A., and
Fetisova, Z. (2002) Exciton dynamics in the chloroso-
Fetisova, Z. (1999) Exciton levels structure of antenna
mal antenna of the green bacterium Chloroflexus au-
bacteriochlorophyll c aggregates in the green bacteri-
rantiacus: experimental and theoretical studies of fem-
um Chloroflexus aurantiacus as probed by 1.8-293 K
tosecond pump-probe spectra, Photosynth. Res., 71,
fluorescence spectroscopy, FEBS Lett., 456, 239-242,
19-32, doi: 10.1023/A:1014995328869.
doi: 10.1016/s0014-5793(99)00953-9.
26.
Psencik, J., Ma, Y. Z., Arellano, J. B., Garcia-Gil, J.,
37.
May, V.
(2014) Kinetic theory of exciton-exci-
Holzwarth, A. R., and Gillbro, T. (2002) Excitation en-
ton annihilation, J. Chem. Phys., 140, 054103, doi:
ergy transfer in chlorosomes of Chlorobium phaeobac-
10.1063/1.4863259.
teroides strain CL1401: the role of carotenoids, Photo-
38.
Yakovlev, A., Taisova, A., Arutyunyan, A.,
synth. Res., 71, 5-18, doi: 10.1023/A:1014943312031.
Shuvalov, V., and Fetisova, Z.
(2017) Variability
27.
Psencik, J., Ma, Y. Z., Arellano, J. B., Hala, J.,
of aggregation extent of light-harvesting pigments
and Gillbro, T. (2003) Excitation energy transfer
in peripheral antenna of Chloroflexus aurantiacus,
dynamics and excited-state structure in chlorosomes
Photosynth. Res., 133, 343-356, doi: 10.1007/s11120-
of Chlorobium phaeobacteroides, Biophys. J., 84, 1161-
017-0374-y.
1179, doi: 10.1016/S0006-3495(03)74931-5.
39.
Jendrny, M., Aartsma, T. J., and Köhler, J. (2014)
28.
Martiskainen, J., Linnanto, J., Kananavičius, R.,
Insights into the excitonic states of individual chloro-
Lehtovuori, V., and Korppi-Tommola, J.
(2009)
somes from Chlorobaculum tepidum, Biophys. J., 106,
Excitation energy transfer in isolated chlorosomes
1921-1927, doi: 10.1016/j.bpj.2014.03.020.
from Chloroflexus aurantiacus, Chem. Phys. Lett., 477,
40.
Петров Э. Г. (1984) Физика переноса зарядов в био-
216-220, doi: 10.1016/j.cplett.2009.06.080.
системах, Наукова думка, Киев.
29.
Martiskainen, J., Linnanto, J., Aumanen, V.,
41.
Struve, W. S. (1995) Vibrational equilibration in ab-
Myllyperkiö, P., and Korppi-Tommola, J.
(2012)
sorption difference spectra of chlorophyll a, Bio-
Excitation energy transfer in isolated chlorosomes
phys. J.,
69,
2739-2744, doi:
10.1016/S0006-3495
from Chlorobaculum tepidum and Prosthecochloris
(95)80145-1.
aestuarii, Photochem. Photobiol.,
88,
675-683,
42.
Márquez, A. S., Chen, L., Sun, K., and Zhao, Y.
doi: 10.1111/j.1751-1097.2012.01098.x.
(2016) Probing ultrafast excitation energy transfer
30.
Linnanto, J. V., and Korppi-Tommola, J. E. I. (2013)
of the chlorosome with exciton-phonon variational
Exciton description of excitation energy transfer
dynamics, Phys. Chem. Chem. Phys.,
18,
20298,
in the photosynthetic units of green sulfur bacteria
doi: 10.1039/c5cp06491k.
and filamentous anoxygenic phototrophs, J. Phys.
43.
Dostál, J., Mančal, T., Augulis, R., Vácha, F.,
Chem. B, 117, 11144-11161, doi: 10.1021/jp4011394.
Pšenčík, J., and Zigmantas, D.
(2012) Two-
31.
Yakovlev, A. G., Taisova, A. S., Shuvalov, V. A., and
dimensional electronic spectroscopy reveals ultrafast
Fetisova, Z. G. (2019) Ultrafast excited-state dynamics
energy diffusion in chlorosomes, J. Am. Chem. Soc.,
in chlorosomes isolated from the photosynthetic
34, 11611-11617, doi: 10.1021/ja3025627.
filamentous green bacterium Chloroflexus aurantiacus,
44.
Dong, L.-Q., Niu, K., and Cong, S.-L.
(2007)
Physiologia Plantarum,
166,
12-21, doi:
10.1111/
Theoretical analysis of internal conversion pathways
ppl.12887.
and vibrational relaxation process of chlorophyll-a in
32.
Yakovlev, A. G., Taisova, A. S., and Fetisova, Z. G.
ethyl ether solvent, Chem. Phys. Lett., 440, 150-154,
(2021) Utilization of blue-green light by chlorosomes
doi: 10.1016/j.cplett.2007.04.021.
БИОХИМИЯ том 88 вып. 5 2023
874
ЯКОВЛЕВ и др.
45. Cherepy, N. J., Du, M., Holzwarth, A. R., and
47. Yakovlev, A. G., Taisova, A. S., Shuvalov, V. A.,
Mathies, R. A. (1996) Near-infrared resonance Raman
and Fetisova, Z. G. (2018) Estimation of the bacteri-
spectra of chlorosomes: probing nuclear coupling in
ochlorophyll c oligomerisation extent in Chloroflex-
electronic energy transfer, J. Phys. Chem., 100, 4662-
us aurantiacus chlorosomes by very low-frequency
4671, doi: 10.1021/jp952992e.
vibrations of the pigment molecules: A new ap-
46. Gülen, D.
(2006) Significance of the excitonic
proach, Biophys. Chem., 240, 1-8, doi: 10.1016/j.bpc.
intensity borrowing in the J-/H-aggregates of
2018.05.004.
bacteriochlorophylls/chlorophylls, Photosynth. Res.,
48. Соколов А. А., Тернов И. М. (1970) Квантовая ме-
87, 205-214, doi: 10.1007/s11120-005-8408-2.
ханика и атомная физика, Просвещение, Москва.
FEMTOSECOND EXCITON RELAXATION
IN CHLOROSOMES OF THE PHOTOSYNTHETIC
GREEN BACTERIUM Chloroflexus aurantiacus
A. G. Yakovlev*, A. S. Taisova, and Z. G. Fetisova
Lomonosov Moscow State University, Belozersky Institute of Physico-Chemical Biology,
119992 Moscow, Russia; e-mail: yakov@belozersky.msu.ru
In the green bacteria Chloroflexus (Cfx.) aurantiacus, the process of photosynthesis begins with the absorp-
tion of light by chlorosomes, peripheral antennas consisting of thousands of bacteriochlorophyll c (BChl c)
molecules combined into oligomeric structures. In this case, excited states are formed in BChl c, the energy
of which migrates along the chlorosome towards the baseplate and further to the reaction center, where the
primary charge separation occurs. Energy migration is accompanied by nonradiative electronic transitions
between numerous exciton states, that is exciton relaxation. In this work, we studied the dynamics of exciton
relaxation in Cfx. aurantiacus chlorosomes using difference femtosecond spectroscopy at cryogenic tem-
perature (80 K). Chlorosomes were excited by 20 fs light pulses at wavelengths from 660 to 750 nm, and the
difference (light-dark) kinetics were measured at a wavelength of 755 nm. Mathematical analysis of the data
obtained revealed the kinetic components with characteristic time constants of 140, 220, and 320 fs respon-
sible for the exciton relaxation. As the excitation wavelength decreased, the number of components and their
relative contribution increased. Theoretical modeling of the results obtained was carried out on the base
of the cylindrical model of BChl c aggregates. Nonradiative transitions between groups of exciton bands
were ascribed by the system of kinetic equations. The model in which the energetic and structural disorder
was taken into account turned out to be the most adequate.
Keywords: photosynthesis, green bacterium, Chloroflexus aurantiacus, chlorosome, femtosecond spectroscopy
БИОХИМИЯ том 88 вып. 5 2023