БИОХИМИЯ, 2023, том 88, вып. 5, с. 875 - 883
УДК 577.22
ДИСПЛЕЙ ОЛИГО-α-1,6-ГЛИКОЗИДАЗЫ Exiguobacterium sibiricum
НА ПОВЕРХНОСТИ КЛЕТОК Escherichia coli
© 2023 Л.Н. Шингарова1*, Л.Е. Петровская1, Е.А. Крюкова1, С.Ш. Гапизов1,2,
Д.А. Долгих1,2, М.П. Кирпичников1,2
1 ФГБУН Институт биоорганической химии
им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН,
117997 Москва, Россия; электронная почта: lshingarova@gmail.com
2 Московский государственный университет имени М.В. Ломоносова, биологический факультет,
119991 Москва, Россия
Поступила в редакцию 02.03.2023
После доработки 03.04.2023
Принята к публикации 04.04.2023
Олиго-α-1,6-гликозидазы широко применяются в биотехнологии для гидролиза крахмала. Кле-
точный дисплей, основанный на использовании якорных мотивов белков внешней мембраны,
позволяет экспонировать целевые пептиды и белки на поверхности микробных клеток, что спо-
собствует созданию технологически и экологически оптимальной среды для получения целевого
продукта. Ранее нами была получена и охарактеризована рекомбинантная олиго-α-1,6-гликозидаза
психротрофной бактерии Exiguobacterium sibiricum (EsOgl), демонстрирующая высокую каталити-
ческую активность. Было также показано, что аутотранспортер АТ877 Psychrobacter cryohalolentis
и его делеционные варианты эффективно экспонируют эстеразу EstPc и 10-й домен фибронектина
III-го типа на поверхности клеток Escherichia coli. Целью работы явилось получение системы
дисплея EsOgl на поверхности бактериальных клеток на основе АТ877. Сконструированы гены
гибридного аутотранспортера EsOgl877 и его делеционных мутантов EsOgl877Δ239 и EsOgl877Δ310.
Исследована ферментативная активность EsOgl877 и установлено, что клетки, экспрессирующие
этот белок, сохраняли около 90% максимальной активности в температурном диапазоне 15-35 °C.
Показано, что активность клеток, содержащих EsOgl877Δ239 и EsOgl877Δ310, была соответственно
в 2,7 и 2,4 раза выше, чем клеток, экспрессирующих полноразмерный АТ. Анализ клеток, экспрес-
сирующих укороченные варианты EsOgl877, после обработки протеиназой К показал, что пасса-
жирский домен во всех случаях локализован на клеточной поверхности. Полученные результаты
могут быть использованы для оптимизации систем дисплея олиго-α-1,6-гликозидазы и других
гетерологичных белков на поверхности клеток E. coli.
КЛЮЧЕВЫЕ СЛОВА: секреция, аутотранспортер, олиго-α-1,6-гликозидаза, бактериальный дисплей.
DOI: 10.31857/S0320972523050147, EDN: AZQUAN
ВВЕДЕНИЕ
Крахмал состоит из линейного полисаха-
рида амилозы и амилопектина, цепочки кото-
Крахмалосодержащие культуры составляют
рого соединены между собой α-1,6-связями в
важную часть рациона питания и основу для
точках разветвления. Низкая эффективность
производства различных биотехнологических
гидролиза таких связей ограничивает итого-
продуктов при помощи химической и фер-
вую концентрацию глюкозы в сиропе. С целью
ментативной обработки. Основным продук-
ее повышения используют ферменты, гидро-
том ферментативной переработки крахмала
лизующие α-1,6-гликозидные связи, в том
является глюкозный сироп, конечный выход
числе олиго-α-1,6-гликозидазы (EC 3.2.1.10),
которого определяется способностью исполь-
которые принадлежат к 31-му подсемейству
зуемых ферментов к эффективной конверсии
13-го семейства гликозилгидролаз. Эти фер-
олигосахаридов крахмала в глюкозу [1, 2].
менты широко распространены, в частности,
Принятые сокращения: АТ - аутотранспортер; EsOgl - олиго-α-1,6-гликозидаза Exiguobacterium sibiricum; 10Fn3 -
10-й домен фибронектина человека III-го типа; PBS - фосфатно-солевой буфер; pNPG - p-нитрофенил-α-D-глюко-
пиранозид.
* Адресат для корреспонденции.
875
876
ШИНГАРОВА и др.
в различных микроорганизмах
[3]. Описа-
был использован для дисплея эстеразы EstPc [19]
ны олиго-α-1,6-гликозидазы мезофильных
и 10-го домена фибронектина III-го типа чело-
(Bacillus cereus, [4]), термофильных и гипертер-
века (10Fn3) [20, 21]. Мы также предложили
мофильных (Bacillus coagulans, Bacillus thermo-
подходы для повышения эффективности полу-
glucosidasius [5, 6]) бактерий. Известно, что ис-
ченной системы, включая конструирование
пользование холодоактивных ферментов обла-
гибридных пассажирских доменов [20] и ис-
дает рядом преимуществ, в частности, позво-
пользование делеционных вариантов АТ [22].
ляет проводить реакции при более низких тем-
В данной работе мы поставили задачу скон-
пературах [7, 8]. Ранее нами была получена и
струировать систему дисплея EsOgl на поверх-
охарактеризована рекомбинантная олиго-α-1,6-
ности клеток E. coli на основе АТ877.
гликозидаза психротрофной бактерии Exiguo-
bacterium sibiricum (EsOgl), демонстрирующая
высокую каталитическую активность в широ-
МАТЕРИАЛЫ И МЕТОДЫ
ком температурном диапазоне, в том числе
при низких температурах [9].
В работе использованы реактивы
Клеточный дисплей, основанный на ис-
Coomassie R250
(«Bio-Rad», США), MgCl2
пользовании якорных мотивов белков внешней
(«Merck», США), ампициллин и глюкоза
мембраны, позволяет экспонировать целевые
(«Panreac», Испания), субстрат p-нитрофенил-
пептиды и белки на поверхности микробных
α-D-глюкопиранозид (pNPG; «Sigma», США),
клеток. Перспективы его применения в био-
компоненты сред для культивирования бакте-
технологии и промышленности включают раз-
рий, триптон и дрожжевой экстракт («Amresco»,
работку живых вакцин, конструирование и
США), органические растворители производ-
скрининг комбинаторных библиотек, а также
ства «Химмед» (Россия). Растворы готовили на
получение цельноклеточных биокатализато-
деионизованной воде MilliQ.
ров [10, 11]. Преимуществом таких биоката-
Клонирование рекомбинантных ДНК осу-
лизаторов является отсутствие необходимости
ществляли стандартными методами в клетках
выделения и очистки целевых ферментов, что
E. coli XL-1 Blue («Stratagene», США). Исполь-
существенно снижает их стоимость [12, 13].
зовали ферменты производства «Thermo Fisher
В литературе имеются сведения о биоката-
Scientific» (США). Олигонуклеотиды синтезиро-
лизаторах, полученных с помощью дисплея на
ваны фирмой «Евроген» (Россия). Ген EsOgl ам-
поверхности клеток бактерий и обладающих
плифицировали на матрице плазмидной ДНК
каталитической активностью в отношении раз-
pET28EsOgl с использованием праймеров 1739f
личных полисахаридов [13]. Так, β-амилаза ба-
и 1739r [9], обрабатывали NcoI и XhoI, после чего
тата была экспонирована на клетках Escherichia
клонировали ПЦР-фрагмент в вектор, получен-
coli при помощи белка Omp1 внешней мембра-
ный обработкой плазмиды pAT877 [19] рестрик-
ны Zymomonas mobilis и проявляла активность
тазами NcoI и SalGI. Для конструирования деле-
по отношению к растворимому крахмалу [14].
ционных вариантов EsOgl877 проводили ПЦР,
Комплексный биокатализатор, включающий
как описано в работе Shingarova et al. [22]. Фраг-
три фермента Clostridium cellulolyticum (эндо-
менты клонировали в вектор pET20b по сайтам
глюканазу Cel5A, экзоглюканазу Cel9E и β-глю-
NcoI и XhoI, аналогично гену исходного белка, и
козидазу), был сконструирован в результате
подтверждали последовательность вставки сек-
их объединения с якорным белком PgsA и ис-
венированием («Евроген»).
пользован для получения этанола [15]. Ауто-
Выделение мембранной фракции. Культуру
дисплей β-глюкозидазы BglC Thermobifida fusca
штамма E. coli С41(DE3), трансформированную
был достигнут благодаря использованию якор-
одной из плазмид, выращивали в LB с ампицил-
ных мотивов AIDA-I и липокалина [16, 17].
лином (100 мкг/мл) при 37 °С до значения ОП
Однако нам не удалось обнаружить опублико-
при 560 нм, равного 0,5-0,7, индуцировали до-
ванных данных о цельноклеточных биокатали-
бавлением 0,2 мМ изопропил-β-D-тиогалакто-
заторах, обладающих олиго-α-1,6-гликозидаз-
пиранозида (IPTG), после чего продолжали куль-
ной активностью.
тивирование в течение 1,5 ч при 25 °С в при-
Одним из популярных якорных мотивов
сутствии 5 мМ MgCl2. Клетки осаждали при
для клеточного дисплея является С-конце-
2700 g 10 мин при 5 °С, после чего осадок ре-
вой транслокаторный домен белков семейства
суспендировали в буфере, содержащем 50 мМ
аутотранспортеров (АТ), обладающий структу-
Tris-HCl (pH 8,0), 5 мМ EDTA, 20% сахарозы,
рой типа β-бочонка [11, 18]. Соответствующий
лизоцим (0,2 мг/мл), и разрушали ультразву-
домен ранее охарактеризованного нами ауто-
ком. Суспензию центрифугировали 30 мин при
транспортера АТ877 Psychrobacter cryohalolentis
6000 g. Полученный супернатант центрифугиро-
БИОХИМИЯ том 88 вып. 5 2023
ДИСПЛЕЙ ОЛИГО-α-1,6-ГЛИКОЗИДАЗЫ НА ПОВЕРХНОСТИ КЛЕТОК
877
вали 1 ч при 100 000 g и суспендировали осадок
сивность окрашивания измеряли при 450 нм с
мембранной фракции в 50 мМ Tris-HCl (pH 8,0).
помощью ридера Model 680 («Bio-Rad»).
Вестерн-блот-анализ. Разделенные гель-
Исследование ферментативной активности
электрофорезом в 10%-ном SDS-ПААГ по ме-
EsOgl877 проводили с использованием pNPG
тоду Лэммли белки переносили на нитроцел-
в качестве субстрата. Клетки после индукции
люлозную мембрану («Bio-Rad»). После инку-
центрифугировали (3000 g, 15 мин при 4 °C)
бации в растворе 1%-ного BSA в Tris-солевом
и дважды промывали PBS с добавлением
буфере (TBS, 20 мМ Tris-HCl, 150 мМ NaCl,
5 мМ MgCl2. Осадок клеток суспендировали
pH 8,0) в течение 1 ч при 37 °C мембрану выдер-
в реакционном буфере. К реакционной сме-
живали в растворе конъюгата моноклональных
си
(33 мМ К-фосфатного буфера (рН
7,0),
антител к His-тагу с пероксидазой (1 мкг/мл;
0,36 мМ субстрата) объемом 0,5 мл добавля-
«Invitrogen», США) в 1%-ном BSA в TBS в тече-
ли аликвоты очищенного фермента EsOgl (по-
ние 1 ч при комнатной температуре. Окраши-
ложительный контроль) или клеток. В каче-
вание мембраны проводили с использованием
стве отрицательного контроля использовали
преципитирующего
3,3′,5,5′-тетраметилбензи-
клетки, экспрессирующие гибридный АТ Fn877,
дина (TMB; «Clinical Science Products», США).
не обладающий ферментативной активностью.
Обработка протеиназой К. Индуцированные
Смесь инкубировали 15 мин при 25 °С, реак-
клетки С41(DE3), экспрессирующие EsOgl877
цию останавливали добавлением
100 мкл
или АТ877, центрифугировали (3000 g, 15 мин
1 М Na2CO3. После центрифугирования в те-
при 4 °С) и промывали дважды 1 мл фосфатно-
чение
5 мин в настольной центрифуге по
солевого буфера (PBS: 137 мМ NaCl, 2,7 мМ KCl,
200 мкл реакционной смеси раскапывали в
8 мМ Na2HPO4, 2 мМ KH2PO4, рН 7,4). После
лунки
96-луночного планшета
(«Deltalab»,
центрифугирования осадки суспендировали
Испания). Измеряли величину абсорбции при
в 1 мл буфера, содержащего 50 мМ Tris-HCl
405 нм на ридере Multiscan FC («Thermo Fisher
(pH 8,0) и 5 мМ CaCl2. Раствор протеиназы К
Scientific»). За единицу активности принимали
(«Qiagen», США) добавляли до конечной кон-
количество фермента, необходимое для высво-
центрации 150 мкг/мл, и суспензию инкубиро-
бождения 1 мкмоль п-нитрофенола за 1 мин.
вали в течение 1 ч при 37 °С и перемешивании.
Удельную активность определяли как количе-
Реакцию останавливали добавлением фенил-
ство единиц активности на 1 мг белка.
метилсульфонилфторида (PMSF) до конечной
Оптимальную температуру реакции опреде-
концентрации 5 мМ, смеси центрифугировали,
ляли путем измерения ферментативной актив-
дважды промывали PBS и суспендировали в
ности при различных температурах (5-35 °C).
1,5 мл буфера, содержащего 20 мМ Tris-HCl
Реакционную смесь инкубировали при каждой
(рН 8,0) и 200 мМ NaCl, после чего выделяли
температуре в течение 10 мин, после чего изме-
мембранную фракцию клеток, как описано
ряли активность, как описано выше.
выше.
Иммуноферментный анализ (ELISA). Куль-
туру клеток после индукции осаждали центри-
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
фугированием (2700 g 6 мин при 5 °С), дважды
промывали PBS с добавлением 5 мМ MgCl2
Конструирование и экспрессия гибридного
и центрифугировали при тех же условиях. До-
аутотранспортера EsOgl877. С целью экспо-
водили мутность суспензии до значения ОП
нирования целевых белков на поверхности
при 560 нм, равного 1, и наносили по 100 мкл
клеток проводят конструирование гибрид-
в лунки
96-луночного планшета
(«Costar,
ного гена, кодирующего сигнальную последо-
США) для ELISA в трех повторностях. Клетки
вательность (для экспорта в периплазматиче-
высушивали 20 ч в термостате при 37 °С, бло-
ское пространство), целевой белок и якорный
кировали 2%-ным BSA и промывали PBS.
мотив (для закрепления во внешней мембране
Для анализа экспонированности His-тага
клеток). В случае систем клеточного дисплея
использовали конъюгат моноклональных анти-
на основе АТ такими мотивами являются аль-
тел к His-тагу с пероксидазой. Конъюгат
фа-спиральный линкер и транслокаторный
добавляли в соотношении 1 : 10000 в PBS +
домен [11, 18]. Соответственно, для конструи-
+ 1% BSA, выдерживали 1 ч при 37 °С и пере-
рования системы клеточного дисплея ген EsOgl
мешивании. После удаления антител про-
был клонирован в вектор, содержащий коди-
мывали лунки 3 раза по 5 мин PBS. После
рующие последовательности сигнального
отмывки в лунки добавляли по 100 мкл TMB,
пептида PelB, альфа-спирального линкера и
выдерживали 4 мин, затем останавливали ре-
транслокаторного домена АТ877 под контро-
акцию добавлением 10%-ной H2SO4. Интен-
лем промотора T7lac, аналогично тому, как это
БИОХИМИЯ том 88 вып. 5 2023
878
ШИНГАРОВА и др.
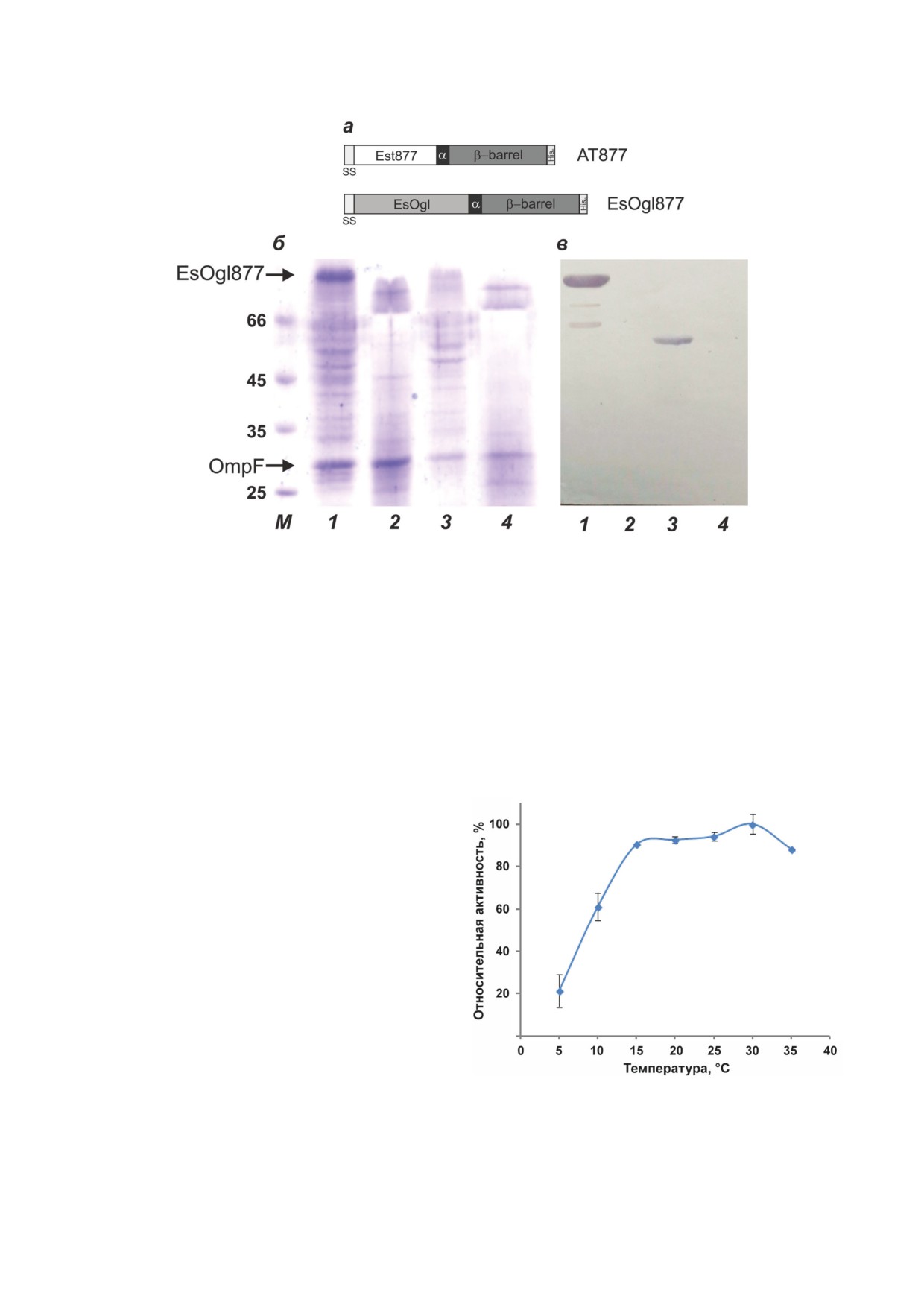
Рис. 1. Экспрессия EsOgl877 в клетках E. coli. а - Схемы строения АТ877 и EsOgl877. Ss - Сигнальная последова-
тельность PelB; α - альфа-спиральный линкер; β-barrel - транслокаторный домен AT877. б - Белковый электрофорез
в 10%-ном SDS-ПААГ. в - Вестерн-блот с анти-His конъюгатом образцов мембранной фракции клеток С41(DE3),
экспрессирующих EsOgl877 (дорожки 1 и 2) или АТ877 (дорожки 3 и 4); до (дорожки 1 и 3) и после (дорожки 2 и 4)
обработки клеток протеиназой К. М - маркеры молекулярной массы белков (кДа)
было сделано ранее в случае эстеразы EstPc
Ферментативная активность EsOgl877. Оли-
и 10Fn3 [19, 20]. Таким образом, был скон-
го-α-1,6-гликозидазную активность EsOgl877
струирован ген гибридного АТ EsOgl877, в ко-
исследовали, инкубируя интактные клетки в
тором природный пассажирский домен (эсте-
буфере с субстратом pNPG. Измерения, прове-
разу) заменили белком EsOgl (рис. 1, а).
денные при различных температурах, показали,
Экспрессию полученного гена осущест-
что температурный оптимум фермента, экспо-
вляли в клетках E. coli штамма С41(DE3). Для
нированного на поверхности клеток, состав-
определения локализации EsOgl877 проводили
анализ с помощью белкового электрофореза и
Вестерн-блота с антителами к гексагистиди-
новой последовательности. С помощью этих
методов установлено, что рекомбинантный
белок обнаруживается в мембранной фракции
клеток в значительных визуализированных ко-
личествах, при этом его электрофоретическая
подвижность соответствует расчетной моле-
кулярной массе (~101 кДа; рис. 1, дорожка 1
на панелях б и в).
Для подтверждения поверхностной экс-
прессии EsOgl877 клетки после индукции об-
рабатывали протеиназой К, после чего выде-
ляли мембранную фракцию и анализировали
ее аналогичным образом. Подобно клеткам,
экспрессирующим другие пассажирские доме-
Рис. 2. Зависимость ферментативной активности клеток
ны, такая обработка приводила к исчезнове-
E. coli, экспрессирующих EsOgl877, от температуры. Клет-
нию полос экспонированного целевого белка,
ки инкубировали в реакционной смеси, содержавшей
33 мМ К-фосфатного буфера (рН 7,0) и 0,36 мМ pNPG
в то время как полосы, соответствующие бел-
в течение 15 мин при указанной температуре. Активность
ку внешней мембраны OmpF, не изменились
при 30 °C принята за 100%. Представлены средние значе-
(рис. 1, дорожка 2 на панелях б и в).
ния трех опытов ± стандартное отклонение
БИОХИМИЯ том 88 вып. 5 2023
ДИСПЛЕЙ ОЛИГО-α-1,6-ГЛИКОЗИДАЗЫ НА ПОВЕРХНОСТИ КЛЕТОК
879
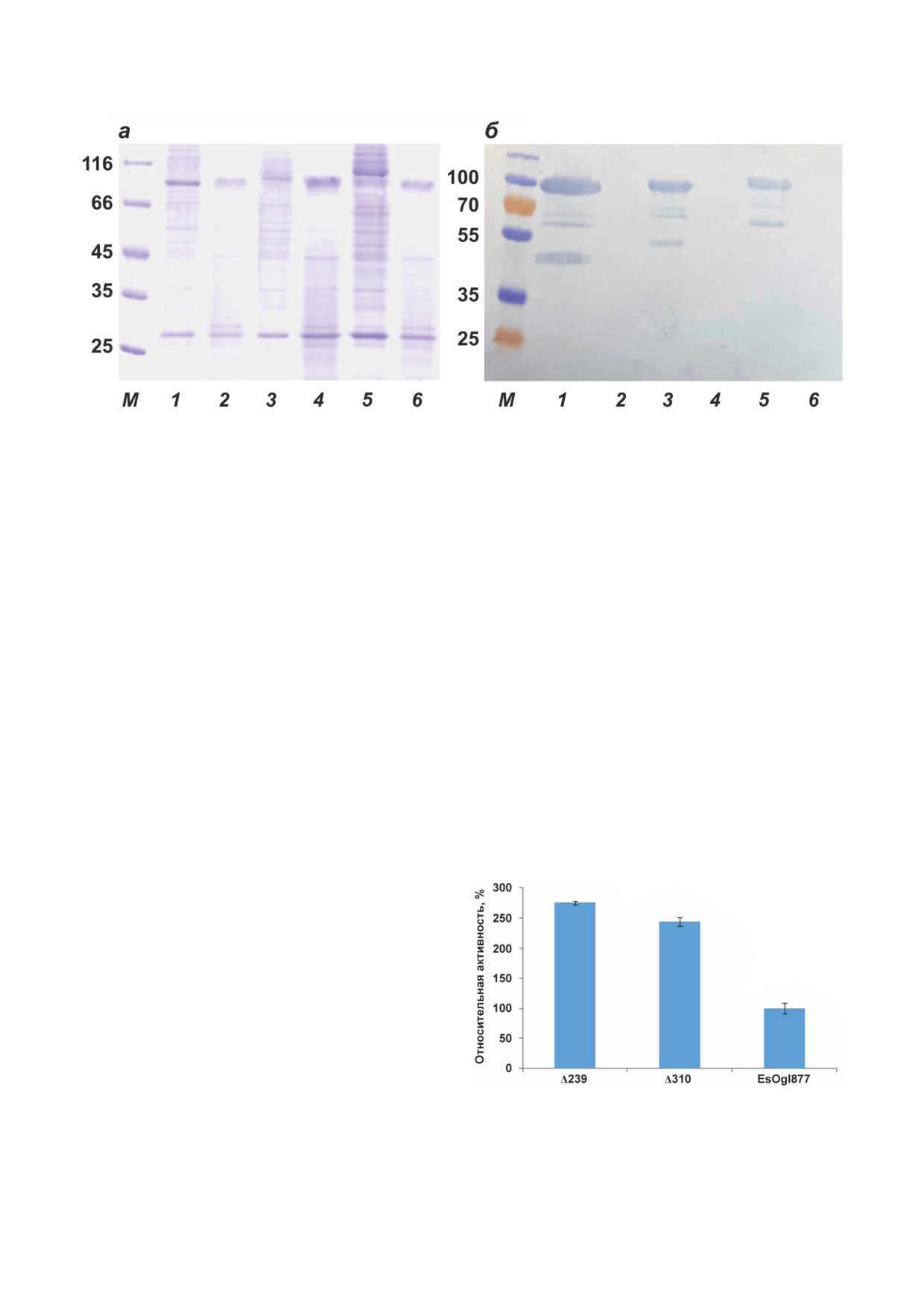
Рис. 3. Белковый электрофорез в 10%-ном SDS-ПААГ (а) и Вестерн-блот с анти-His конъюгатом (б) образцов мем-
бранной фракции клеток С41(DE3), экспрессирующих делеционные варианты EsOgl877. Дорожки 1 и 2 - Δ239;
дорожки 3 и 4 - Δ310; дорожки 5 и 6 - EsOgl877, до (дорожки 1, 3, 5) и после (дорожки 2, 4, 6) обработки клеток про-
теиназой К. М - маркеры молекулярной массы белков (кДа)
ляет 30 °C. Клетки, экспрессирующие EsOgl877,
после обработки протеиназой К показал, что
сохраняли около
90% ферментативной ак-
пассажирский домен во всех случаях локали-
тивности от максимальной (достигаемой при
зован на клеточной поверхности (рис. 3, б).
оптимальной температуре) в диапазоне 15-
Клетки E. coli, экспрессирующие делеци-
35 °C (рис. 2), что достаточно хорошо совпа-
онные варианты EsOgl877, демонстрировали
дает с температурным диапазоном активности
олиго-α-1,6-гликозидазную активность по от-
исходного фермента EsOgl [9].
ношению к pNPG (рис. 4). При этом удельная
Используя ранее полученные данные об
активность клеток, содержащих EsOgl877Δ239
удельной активности EsOgl [9], мы смогли
и EsOgl877Δ310, была соответственно в 2,7
примерно оценить число молекул фермента на
и 2,4 раза выше, чем клеток, экспрессирующих
поверхности одной клетки, которое составило
полноразмерный АТ. Расчетное число моле-
около 14 000.
кул фермента на поверхности одной клетки для
Оптимизация системы дисплея EsOgl с ис-
них составило соответственно 38 и 34 тысячи.
пользованием делеционных вариантов АТ877.
Для подтверждения интактности клеток в про-
Ранее нами было показано, что использование
цессе эксперимента был проведен их анализ
делеционных вариантов АТ877 позволяет повы-
методом ELISA с использованием антител к
сить уровень экспонирования пассажирского
гексагистидиновой последовательности. По-
домена 10Fn3 на поверхности клеток E. coli [22].
скольку эта последовательность располагается
Для оценки возможности использования дан-
ного подхода с целью оптимизации системы
дисплея EsOgl мы получили два делецион-
ных варианта гибридного аутотранспортера
EsOgl877Δ239 и EsOgl877Δ310, содержащие в
составе транслокаторного домена четыре и
семь бета-тяжей из двенадцати. Конструиро-
вание и экспрессию генов делеционных вари-
антов EsOgl877 проводили, как было описано
ранее для Fn877 [22]. Исследование мембран-
ных фракций клеток E. coli с помощью белко-
вого электрофореза и Вестерн-блота с антите-
лами к гексагистидиновой последовательности
продемонстрировало, что укороченные вари-
Рис. 4. Сравнительная ферментативная активность кле-
анты гибридного АТ обнаруживаются в мем-
ток С41(DE3), экспрессирующих EsOgl877 и его делеци-
онные варианты, по отношению к pNPG. Представлены
бранной фракции, подобно полноразмерному
средние значения трех повторностей ± относительное
EsOgl877 (рис. 3, а). Анализ клеток, экспрес-
стандартное отклонение. Активность клеток, экспресси-
сирующих укороченные варианты EsOgl877,
рующих EsOgl877, принималась за 100%
БИОХИМИЯ том 88 вып. 5 2023
880
ШИНГАРОВА и др.
на С-конце белка, который, предположительно,
В данной работе мы продемонстрировали,
ориентирован в периплазму, в случае сохране-
что гибридный АТ, содержащий холодоактив-
ния целостности мембраны она недоступна для
ную олиго-α-1,6-гликозидазу Exi. sibiricum,
связывания специфических антител. Действи-
также обеспечивает высокий уровень транс-
тельно, уровень сигнала, обеспечиваемый клет-
порта пассажирского домена на клеточную
ками с экспрессией полноразмерного EsOgl877
поверхность, что было показано с помощью
и его делеционных вариантов после обработки
анализа ферментативной активности и про-
лизоцимом или замораживания-оттаивания,
теолитической обработки целых клеток.
оказался примерно в 4 раза выше, чем у кле-
Клетки, экспрессирующие EsOgl на поверх-
ток, не подвергавшихся такой обработке (дан-
ности, демонстрируют высокую ферментатив-
ные не приведены), что доказывает отсутствие
ную активность при температуре
15-35 °С.
существенного лизиса.
Ранее мы показали, что EsOgl обладает мак-
симальной активностью при 25 °С, и при этом
сохраняет более 75% активности в диапазоне
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
10-40 °C
[9]. Дальнейшее повышение тем-
пературы приводит к быстрой инактивации
Использование структурных элементов АТ
фермента.
является популярной стратегией для конструи-
Анализ полученных результатов позволяет
рования систем клеточного дисплея [11, 18].
высказать предположение о высокой совме-
В большинстве случаев природный пассажир-
стимости со структурными элементами АТ и,
ский домен АТ может быть заменен целевым
как следствие, повышенной эффективности
белком, который в результате процесса после-
экспорта холодоактивных ферментов и других
довательного взаимодействия с компонентами
белков психрофильных организмов с исполь-
секреторного аппарата клеток и специализи-
зованием системы секреции V-типа. Безуслов-
рованного Bam-комплекса оказывается экс-
но, подтверждение данной гипотезы требует
понированным на клеточной поверхности [23,
проведения дополнительных исследований и
24]. При этом структура пассажирского домена
конструирования систем дисплея новых холо-
может оказывать непосредственное влияние
доактивных белков.
на эффективность дисплея. Для природных
Ранее мы показали, что использование
пассажирских доменов с β-спиральной про-
делеционных вариантов АТ877 позволяет по-
странственной структурой (пертактина, EspP
высить уровень экспорта пассажирского до-
и других) установлена зависимость эффектив-
мена на поверхность клеток [22]. Белок 10Fn3,
ности их экспорта на клеточную поверхность
который являлся пассажирским доменом в пре-
от наличия С-концевого аутошаперона, обла-
дыдущем исследовании, обладает высокой ско-
дающего повышенной скоростью сворачива-
ростью сворачивания в цитоплазме клеток.
ния [25-27]. В результате замены N-концевой
Соответственно, эффективность его транспор-
части пассажирского домена пертактина му-
та с использованием полноразмерного АТ877
тантными вариантами дигидрофолатредукта-
исходно была достаточно низкой [20]. Инте-
зы было показано, что мутанты, обладающие
ресно было проверить, позволит ли укороче-
меньшей стабильностью, способствуют уве-
ние транслокаторного домена АТ877 повысить
личению эффективности секреции по сравне-
уровень секреции EsOgl. Проведенные нами
нию с белком дикого типа [27, 28].
эксперименты показали, что делеции положи-
Известно, что холодоактивные ферменты
тельно повлияли на эффективность транспор-
обладают пониженной стабильностью, что яв-
та и в данном случае, что привело к повыше-
ляется следствием особенностей их первичной
нию ферментативной активности клеток в 2,7
и пространственной структуры [29-31]. Ранее
и 2,4 раза, причем клетки, экспрессирующие
мы показали, что холодоактивная эстераза
более короткий белок, обладали большей гли-
EstPc P. cryohalolentis, обладающая липолити-
козидазной активностью. Мы предполагаем,
ческой активностью в температурном диапа-
что это связано с увеличением числа молекул
зоне 10-35 °С [32], может быть эффективно
пассажирского домена (EsOgl) на поверхности
экспонирована на поверхности клеток E. coli
клеток, экспрессирующих делеционные вари-
с использованием сконструированной нами
анты гибридного АТ. В дальнейшем мы плани-
системы дисплея на основе АТ877 [19]. Кроме
руем продолжить работы по получению новых
того, расположение EstPc на N-конце пасса-
делеционных вариантов и исследованию их
жирского домена позволило повысить уровень
свойств.
секреции 10Fn3, обладающего более стабиль-
Таким образом, можно утверждать, что
ной структурой [20].
предложенная система клеточного дисплея на
БИОХИМИЯ том 88 вып. 5 2023
ДИСПЛЕЙ ОЛИГО-α-1,6-ГЛИКОЗИДАЗЫ НА ПОВЕРХНОСТИ КЛЕТОК
881
основе аутотранспортера АТ877 P. cryohalolentis
личению эффективности транспорта EsOgl
обладает достаточной универсальностью и
и повышению ферментативной активности
позволяет экспонировать на поверхности кле-
клеток в 2,7 и 2,4 раза, причем клетки, экс-
ток E. coli белки, обладающие различными
прессирующие самый короткий белок, обла-
ферментативными активностями, в том числе
дали максимальной активностью. Полученные
олиго-α-1,6-гликозидазной. В сочетании с дру-
нами результаты могут быть использованы для
гими цельноклеточными биокатализаторами
оптимизации систем дисплея на поверхности
полученный штамм может быть использован
клеток E. coli.
для эффективной биотехнологической пере-
работки крахмалосодержащего сырья. Разра-
Вклад авторов. Л.Н. Шингарова, Л.Е. Пе-
ботанные нами подходы к повышению эффек-
тровская, М.П. Кирпичников - концепция
тивности секреции белков семейства АТ могут
и руководство работой; Л.Н. Шингарова,
найти применение в конструировании систем
Е.А. Крюкова, С.Ш. Гапизов - проведение
бактериального дисплея других гетерологич-
экспериментов; Л.Н. Шингарова, Л.Е. Петров-
ных пассажирских доменов.
ская, Д.А. Долгих - обсуждение результатов
исследования; Л.Е. Петровская, Л.Н. Шинга-
рова - написание текста статьи.
ЗАКЛЮЧЕНИЕ
Финансирование. Работа выполнена в рам-
ках Госзадания ИБХ РАН № FMFM-2019-0007
В результате проделанной работы полу-
(0101-2019-0007).
чены гибридный АТ, содержащий холодо-
Конфликт интересов. Авторы заявляют об
активную олиго-α-1,6-гликозидазу, и два его
отсутствии конфликта интересов.
укороченных варианта. Все варианты обеспе-
Соблюдение этических норм. Настоящая
чивают высокий уровень транспорта пасса-
статья не содержит описания каких-либо ис-
жирского домена на клеточную поверхность.
следований с участием людей или животных
Следует отметить, что делеции привели к уве-
в качестве объектов.
СПИСОК ЛИТЕРАТУРЫ
1. Van der Maarel, M. J. E. C., van der Veen, B.,
6. Watanabe, K., Chishiro, K., Kitamura, K., and
Uitdehaag, J. C. M., Leemhuis, H., and Dijkhuizen, L.
Suzuki, Y. (1991) Proline residues responsible for
(2002) Properties and applications of starch-converting
thermostability occur with high frequency in the
enzymes of the α-amylase family, J. Biotechnol., 94,
loop regions of an extremely thermostable oligo-1,6-
137-155, doi: 10.1016/s0168-1656(01)00407-2.
glucosidase from Bacillus thermoglucosidasius KP1006,
2. Hua, X., and Yang, R. (2016) Enzymes in starch pro-
J. Biol. Chem.,
266,
24287-24294, doi:
10.1016/
cessing, in Enzymes in Food and Beverage Processing
S0021-9258(18)54226-5.
(Chandrasekaran, M. ed.) CRC Press, Boca Raton,
7. Feller, G. (2013) Psychrophilic enzymes: from folding
FL, USA, pp. 139-170.
to function and biotechnology, Scientifica,
2013,
3. Dong, Z., Tang, C., Lu, Y., Yao, L., and Kan, Y.
512840, doi: 10.1155/2013/512840.
(2020) Microbial oligo-α-1,6-glucosidase: current
8. Barroca, M., Santos, G., Gerday, C., and Collins,
developments and future perspectives, Starch Stärke,
T. (2017) Biotechnological Aspects of Cold-Active En-
72, 1900172, doi: 10.1002/star.201900172.
zymes, in Psychrophiles: From Biodiversity to Bio-
4. Watanabe, K., Hata, Y., Kizaki, H., Katsube, Y., and
technology (Margesin, R. ed.) Springer Internation-
Suzuki, Y. (1997) The refined crystal structure of
al Publishing, Cham, pp.
461-475, doi:
10.1007/
Bacillus cereus oligo-1,6-glucosidase at 2.0 Å resolution:
978-3-319-57057-0_19.
structural characterization of proline-substitution sites
9. Berlina, Y. Y., Petrovskaya, L. E., Kryukova, E. A.,
for protein thermostabilization, J. Mol. Biol., 269,
Shingarova, L. N., Gapizov, S. S., Kryukova, M. V.,
142-153, doi: 10.1006/jmbi.1997.1018.
Rivkina, E. M., Kirpichnikov, M. P., and Dolgikh, D. A.
5. Watanabe, K., Kitamura, K., and Suzuki, Y. (1996)
(2021) Engineering of Thermal stability in a cold-active
Analysis of the critical sites for protein thermostabi-
oligo-1,6-glucosidase from Exiguobacterium sibiricum
lization by proline substitution in oligo-1,6-gluco-
with unusual amino acid content, Biomolecules, 11,
sidase from Bacillus coagulans ATCC 7050 and the
1229, doi: 10.3390/biom11081229.
evolutionary consideration of proline residues, Appl.
10. Van Ulsen, P., ur Rahman, S., Jong, W. S., Daleke-
Environ. Microbiol.,
62,
2066-2073, doi:
10.1128/
Schermerhorn, M. H., and Luirink, J. (2014) Type V
aem.62.6.2066-2073.1996.
secretion: from biogenesis to biotechnology, Biochim.
13
БИОХИМИЯ том 88 вып. 5 2023
882
ШИНГАРОВА и др.
Biophys. Acta Mol. Cell Res., 1843, 1592-1611, doi:
mov, S., Dolgikh, D., and Kirpichnikov, M. (2018)
10.1016/j.bbamcr.2013.11.006.
Construction of artificial TNF-binding proteins based
11.
Nicolay, T., Vanderleyden, J., and Spaepen, S. (2015)
on the 10th human fibronectin type III domain using
Autotransporter-based cell surface display in Gram-
bacterial display, Biochemistry (Moscow), 83, 708-716,
negative bacteria, Crit. Rev. Microbiol., 41, 109-123,
doi: 10.1134/S0006297918060081.
doi: 10.3109/1040841X.2013.804032.
22.
Shingarova, L. N., Petrovskaya, L. E., Kryukova,
12.
De Carvalho, C. C. (2017) Whole cell biocatalysts:
E. A., Gapizov, S. S., Boldyreva, E. F., Dolgikh, D. A.,
essential workers from nature to the industry, Micr.
and Kirpichnikov, M. P. (2022) Deletion variants
Biotechnol., 10, 250-263, doi: 10.1111/1751-7915.12363.
of autotransporter from Psychrobacter cryohalolentis
13.
Schüürmann, J., Quehl, P., Festel, G., and Jose, J.
increase efficiency of 10FN3 exposure on the surface of
(2014) Bacterial whole-cell biocatalysts by surface
Escherichia coli cells, Biochemistry (Moscow), 87, 932-
display of enzymes: toward industrial application,
939, doi: 10.1134/S0006297922090061.
Appl. Microbiol. Biotechnol.,
98,
8031-8046, doi:
23.
Dalbey, R. E., and Kuhn, A. (2012) Protein traffic in
10.1007/s00253-014-5897-y.
Gram-negative bacteria - how exported and secreted
14.
He, M.-X., Feng, H., and Zhang, Y.-Z.
(2008)
proteins find their way, FEMS Microbiol. Rev., 36,
Construction of a novel cell-surface display system
1023-1045, doi: 10.1111/j.1574-6976.2012.00327.x.
for heterologous gene expression in Escherichia coli
24.
Kim, K. H., Aulakh, S., and Paetzel, M.
(2012)
by using an outer membrane protein of Zymomonas
The bacterial outer membrane beta-barrel assem-
mobilis as anchor motif, Biotechnol. Lett.,
30,
bly machinery, Prot. Sci., 21, 751-768, doi: 10.1002/
2111-2117, doi: 10.1007/s10529-008-9813-3.
pro.2069.
15.
Ryu, S., and Karim, M. N. (2011) A whole cell bio-
25.
Peterson, J. H., Tian, P., Ieva, R., Dautin, N., and
catalyst for cellulosic ethanol production from di-
Bernstein, H. D. (2010) Secretion of a bacterial
lute acid-pretreated corn stover hydrolyzates, Appl.
virulence factor is driven by the folding of a C-terminal
Microbiol. Biotechnol., 91, 529-542, doi: 10.1007/
segment, Proc. Nat. Acad. Sci. USA, 107, 17739-17744,
s00253-011-3261-z.
doi: 10.1073/pnas.1009491107.
16.
Muñoz-Gutiérrez, I., Oropeza, R., Gosset, G., and
26.
Junker, M., Besingi, R. N., and Clark, P. L. (2009)
Martinez, A. (2012) Cell surface display of a β-gluco-
Vectorial transport and folding of an autotransporter
sidase employing the type V secretion system on etha-
virulence protein during outer membrane secretion,
nologenic Escherichia coli for the fermentation of cel-
Mol. Microbiol.,
71,
1323-1332, doi:
10.1111/
lobiose to ethanol, J. Indust. Microbiol. Biotechnol., 39,
j.1365-2958.2009.06607.x.
1141-1152, doi: 10.1007/s10295-012-1122-0.
27.
Renn, J. P., Junker, M., Besingi, R. N., Braselmann, E.,
17.
Soma, Y., Inokuma, K., Tanaka, T., Ogino, C.,
and Clark, P. L. (2012) ATP-independent control of
Kondo, A., Okamoto, M., and Hanai, T. (2012) Direct
autotransporter virulence protein transport via the
isopropanol production from cellobiose by engineered
folding properties of the secreted protein, Chem. Biol.,
Escherichia coli using a synthetic pathway and a cell
19, 287-296, doi: 10.1016/j.chembiol.2011.11.009.
surface display system, J. Biosci. Bioeng., 114, 80-85,
28.
Braselmann, E., and Clark, P. L. (2012) Autotrans-
doi: 10.1016/j.jbiosc.2012.02.019.
porters: the Cellular environment reshapes a folding
18.
Van Ulsen, P., Zinner, K. M., Jong, W. S. P., and
mechanism to promote protein transport, J. Phys.
Luirink, J. (2018) On display: autotransporter secretion
Chem. Lett., 3, 1063-1071, doi: 10.1021/jz201654k.
and application, FEMS Microbiol. Lett., 365, fny165,
29.
Siddiqui, K. S., and Cavicchioli, R. (2006) Cold-
doi: 10.1093/femsle/fny165.
adapted enzymes, Annu. Rev. Biochem., 75, 403-433,
19.
Petrovskaya, L., Novototskaya-Vlasova, K., Kryukova, E.,
doi: 10.1146/annurev.biochem.75.103004.142723.
Rivkina, E., Dolgikh, D., and Kirpichnikov, M. (2015)
30.
Struvay, C., and Feller, G. (2012) Optimization to low
Cell surface display of cold-active esterase EstPc with
temperature activity in psychrophilic enzymes, Int. J.
the use of a new autotransporter from Psychrobacter
Mol. Sci., 13, 11643-11665, doi: 10.3390/ijms130911643.
cryohalolentis K5T, Extremophiles,
19,
161-170,
31.
Santiago, M., Ramírez-Sarmiento, C. A., Zamora,
doi: 10.1007/s00792-014-0695-0.
R. A., and Parra, L. P. (2016) Discovery, molecular
20.
Petrovskaya, L., Zlobinov, A., Shingarova, L.,
mechanisms, and industrial applications of cold-active
Boldyreva, E., Gapizov, S. S., Novototskaya-Vlasova, K.,
enzymes, Front. Microbiol., 7, 1408, doi: 10.3389/
Rivkina, E., Dolgikh, D., and Kirpichnikov, M. (2018)
fmicb.2016.01408.
Fusion with the cold-active esterase facilitates auto-
32.
Novototskaya-Vlasova, K., Petrovskaya, L., Yaki-
transporter-based surface display of the 10th human
mov, S., and Gilichinsky, D. (2012) Cloning, purifi-
fibronectin domain in Escherichia coli, Extremophiles,
cation, and characterization of a cold adapted esterase
22, 141-150, doi: 10.1007/s00792-017-0990-7.
produced by Psychrobacter cryohalolentis K5T from
21.
Shingarova, L., Petrovskaya, L., Zlobinov, A., Gapizov,
Siberian cryopeg, FEMS Microbiol. Ecol., 82, 367-375,
S. S., Kryukova, E., Birikh, K., Boldyreva, E., Yaki-
doi: 10.1111/j.1574-6941.2012.01385.x.
БИОХИМИЯ том 88 вып. 5 2023
ДИСПЛЕЙ ОЛИГО-α-1,6-ГЛИКОЗИДАЗЫ НА ПОВЕРХНОСТИ КЛЕТОК
883
DISPLAY OF OLIGO-α-1,6-GLYCOSIDASE
FROM Exiguobacterium sibiricum AT THE SURFACE
OF Escherichia coli CELLS
L. N. Shingarova1*, L. E. Petrovskaya1, E. A. Kryukova1, S. S. Gapizov1,2,
D. A. Dolgikh1,2, and M. P. Kirpichnikov1,2
1 Shemyakin and Ovchinnikov Institute of Bioorganic Chemistry, Russian Academy of Sciences,
117997 Moscow, Russia; e-mail: lshingarova@gmail.com
2 Faculty of Biology, Lomonosov Moscow State University, 119991 Moscow, Russia
Cell-surface display based on the use of anchor motifs of outer membrane proteins allows the exposure
of target peptides and proteins on the surface of microbial cells. Previously, we obtained and characterized
recombinant oligo-α-1,6-glycosidase of the psychrotrophic bacterium Exiguobacterium sibiricum (EsOgl)
which demonstrated high catalytic activity. It has also been shown that the autotransporter AT877 from
Psychrobacter cryohalolentis and its deletion variants effectively exhibit the 10th domain of type III fibro-
nectin (10Fn3) on the surface of Escherichia coli cells. The aim of the work was to obtain an EsOgl display
system on the surface of bacterial cells based on AT877. The genes of the hybrid autotransporter EsOgl877
and its deletion mutants EsOgl877Δ239 and EsOgl877Δ310 were constructed. The enzymatic activity of
EsOgl877 was investigated and it was found that the cells expressing this protein retained about 90% of the
maximum activity in the range of 15-35°C. It was shown that activity of the cells containing EsOgl877Δ239
and EsOgl877Δ310 was 2.7 and 2.4 times higher, respectively, than of the cells expressing full-sized AT.
Analysis of cells expressing shortened variants of EsOgl877 after treatment with proteinase K showed
that the passenger domain is also localized on the cell surface. The obtained results can be used for opti-
mization of the display systems of oligo-α-1,6-glycosidase and other heterologous proteins on the surface
of E. coli cells.
Keywords: secretion, autotransporter, oligo-α-1,6-glucosidase, bacterial display
БИОХИМИЯ том 88 вып. 5 2023
13*