БИОХИМИЯ, 2023, том 88, вып. 6, с. 913 - 932
УДК 577.218;577.29
РОЛЬ микроРНК В РЕГУЛЯЦИИ
КЛЕТОЧНОГО ОТВЕТА НА ГИПОКСИЮ
Обзор
© 2023 М.В. Силина1*, Д.Ш. Джалилова1, О.В. Макарова1,2
1 ФГБНУ «РНЦХ им. акад. Б.В. Петровского», НИИ морфологии человека им. акад. А.П. Авцына,
117418 Москва, Россия; электронная почта: marusyasilina99@yandex.ru
2 Московский государственный университет имени М.В. Ломоносова, биологический факультет,
119234 Москва, Россия
Поступила в редакцию 20.02.2023
После доработки 13.04.2023
Принята к публикации 13.04.2023
Воздействие гипоксии вызывает изменения транскрипции генов, способствующих адаптации кле-
ток к недостатку кислорода. Основным механизмом, регулирующим клеточный ответ на гипок-
сию, является активация группы транскрипционных индуцируемых гипоксией факторов семей-
ства HIF, включающих несколько изоформ и контролирующих экспрессию более тысячи генов.
Активность HIF регулируется на разных уровнях, в том числе с помощью молекул малых неко-
дирующих РНК, называемых микроРНК (мкРНК). При этом мкРНК осуществляют регуляцию
клеточного ответа на гипоксию путем влияния на активацию HIF, его деградацию и на трансля-
цию зависимых от него белков. В то же время HIF также оказывает влияние на биогенез мкРНК.
Данные по взаимосвязи той или иной изоформы HIF с мкРНК противоречивы, поскольку иссле-
дования выполняются с использованием разных клеточных линий, разных видов эксперименталь-
ных животных и клинического материала, а также при разной концентрации кислорода и разной
длительности гипоксического воздействия. Кроме того, на экспрессию HIF может влиять исходная
устойчивость организмов к недостатку кислорода, что не учитывается при проведении исследо-
ваний. В настоящем обзоре проанализированы данные о влиянии гипоксии на биогенез и функ-
ционирование мкРНК, а также действие самих мкРНК на мРНК генов, участвующих в адаптации
к недостатку кислорода. Понимание механизмов взаимосвязи HIF, гипоксии и мкРНК необходимо
для разработки новых подходов к персонализированной терапии заболеваний, сопровождающихся
недостатком кислорода.
КЛЮЧЕВЫЕ СЛОВА: гипоксия, микроРНК, HIF.
DOI: 10.31857/S0320972523060039, EDN: EEEYGM
ВВЕДЕНИЕ
Экспрессия кислородзависимой субъединицы
HIF-α регулируется главным образом посред-
Гипоксия является одним из основных фак-
ством гидроксилирования, отсутствие кото-
торов, регулирующих функциональное состоя-
рого в условиях гипоксии приводит к обра-
ние организма в физиологических условиях,
зованию комплекса с субъединицей HIF-β
при стрессорных воздействиях, адаптации и
в ядре [1]. Это ведет к активации экспрессии
различных заболеваниях. Главную роль в реак-
генов, регулирующих ангиогенез, метабо-
ции на дефицит кислорода играют транскрип-
лизм глюкозы и железа - фактора роста эндо-
ционные индуцируемые гипоксией факторы
телия сосудов (VEGF), эритропоэтина (EPO),
семейства HIF (Hypoxia-Inducible Factor). переносчика глюкозы GLUT1 и др.
[2-4].
Принятые сокращения: мкРНК - микроРНК; ЛПС - липополисахарид; AGO - белки семейства Argonaute; CTAD -
С-концевой домен трансактивации; FIH - фактор, ингибирующий HIF; HIF - индуцируемый гипоксией фактор;
HREs - отвечающие на гипоксию элементы; HUVEC - эндотелиальные клетки пупочной вены человека; mTOR -
мишень рапамицина у млекопитающих; NF-κB - ядерный фактор «каппа би»; NTAD - N-концевой домен трансакти-
вации; ODDD - домен кислород-зависимой деградации; PHDs - пролилгидроксилазы; pVHL - белок-онкосупрессор
фон Гиппеля-Линдау; VEGF - фактор роста эндотелия сосудов; RISC - RNA-Induced Silencing Complex.
* Адресат для корреспонденции.
913
914
СИЛИНА и др.
Гипоксия и активация HIF взаимосвязаны с
работ последних лет, однако в них не учиты-
увеличением активности ядерного фактора
вается индивидуальная исходная устойчивость
«каппа би» (NF-κB), регулирующего воспа-
организма к гипоксии. В настоящем обзоре
лительные процессы [5]. Показано, что суще-
систематизированы данные о роли мкРНК
ствуют индивидуальные различия в реакции
в реакции организма на недостаток кисло-
на гипоксическое воздействие, во многом
рода, а также о влиянии гипоксии на биогенез
обусловленные разным уровнем HIF
[6-8].
и функционирование мкРНК. Кроме того,
Организмы с разной устойчивостью к гипоксии
обсуждается роль мкРНК в воспалительных
отличаются по тяжести течения ряда воспалитель-
заболеваниях, таких как системный воспали-
ных заболеваний, в частности, системного воспа-
тельный ответ и язвенный колит, с учетом ин-
лительного ответа и язвенного колита [9-12].
дивидуальной устойчивости к гипоксии.
В регуляции функционирования HIF и
ответа на гипоксическое воздействие при-
нимают участие микроРНК (мкРНК) - малые
HIF
некодирующие молекулы РНК, состоящие из
18-25 нуклеотидов (наиболее часто встреча-
Структура молекул HIF. В настоящее время
ются 22), участвующие в регуляции экспрес-
у млекопитающих охарактеризованы 3 изо-
сии генов путем остановки трансляции или
формы HIF-α - HIF-1α, HIF-2α, HIF-3α и
разрушения мРНК. МкРНК обнаружены у ра-
белок HIF-1β. Для регуляции транскрипции
стений, животных и даже некоторых вирусов,
зависимых от HIF генов α- и β-субъедини-
а их последовательности локализуются либо
цы образуют гетеродимер
[14]. Особенно-
внутри интронов, либо в экзонах некодирую-
стью белков HIF-α и HIF-β является наличие
щих РНК [13]. Одновременно они способны
N-концевого ДНК-связывающего домена, со-
регулировать большое количество мРНК-ми-
держащего мотив
«спираль-петля-спираль»
шеней и, таким образом, влиять на активацию
перед PAS-доменом (Per-Arnt-Sim) [15]. Поми-
сразу нескольких сигнальных путей, контро-
мо этого, HIF-α имеет домен кислород-зави-
лирующих синтез белков. Определению роли
симой деградации (Oxygen Dependent Degra-
конкретных мкРНК в регуляции клеточного
dation Domain, ODDD), N-концевой домен
ответа на гипоксию посвящено множество
трансактивации (N-Terminal Transactivation
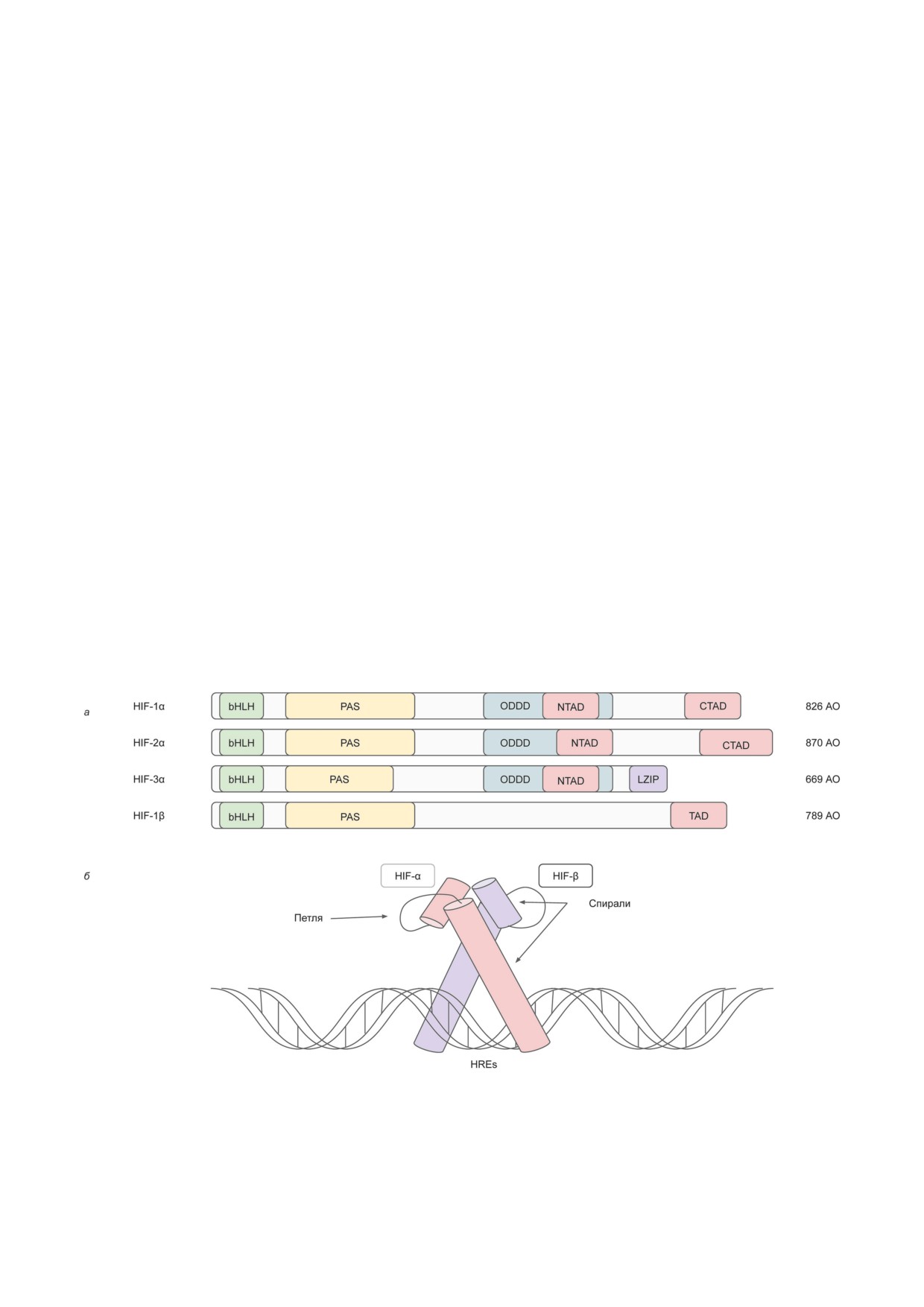
Рис. 1. а - Доменная структура изоформ HIF-1α, HIF-2α, HIF-3α и белка HIF-1β. б - Димеризация субъединиц HIF-α
и HIF-β и взаимодействие их ДНК-связывающих доменов с HREs. В этих доменах каждая из субъединиц HIF име-
ет 2 спирали и петлю между ними. Одна из спиралей содержит ДНК-связывающую область, а другая необходима для
осуществления гетеродимеризации. АО - аминокислотные остатки; bHLH - мотив «спираль-петля-спираль»; PAS -
домен Per-Arnt-Sim; ODDD - домен кислород-зависимой деградации; NTAD - N-концевой домен трансактивации;
CTAD - C-концевой домен трансактивации; TAD - домен трансактивации; LZIP - домен типа «лейциновая молния»;
HREs - элементы ДНК, отвечающие на гипоксию
БИОХИМИЯ том 88 вып. 6 2023
микроРНК И КЛЕТОЧНЫЙ ОТВЕТ НА ГИПОКСИЮ
915
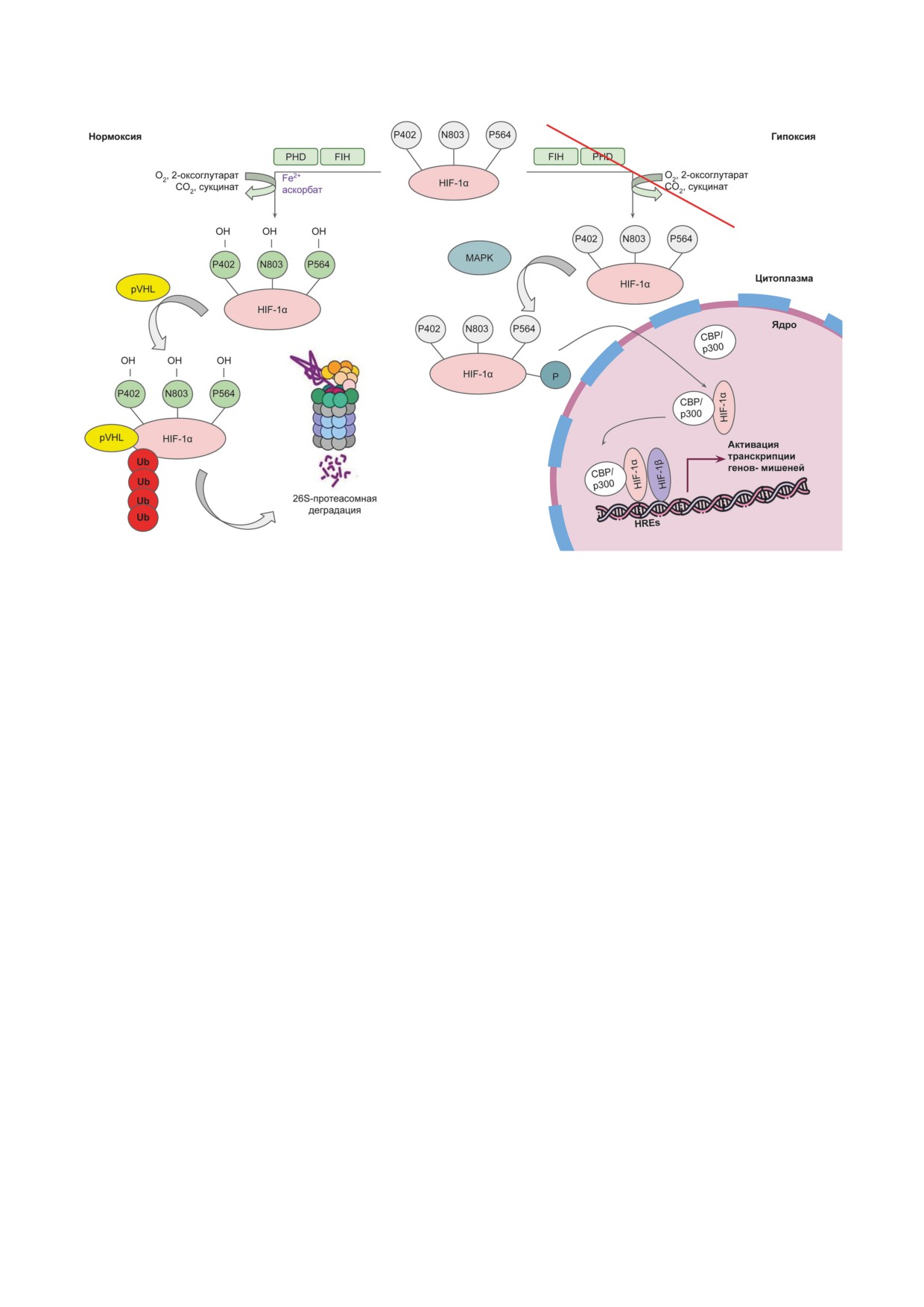
Рис. 2. Кислородзависимая регуляция стабилизации и трансактивации HIF-1α. В условиях нормоксии PHDs осущест-
вляют гидроксилирование HIF-1α по пролину в положениях 402 и 564, а FIH - по аспарагину в положении 803. В усло-
виях гипоксии происходит фосфорилирование и транслокация в ядро негидроксилированной субъединицы HIF-1α.
PHD - пролилгидроксилаза; FIH - фактор, ингибирующий HIF; pVHL - белок-онкосупрессор фон Гиппеля-Линдау;
Ub - убиквитин; MAPK - митоген-активируемая протеинкиназа; CBP/p300 - CREB (cAMP-Response Element-Binding
protein)-Binding Protein/E1A Binding Protein p300; HREs - элементы ДНК, отвечающие на гипоксию
Domain, NTAD) и С-концевой домен транс-
В условиях недостатка кислорода, который
активации (C-Terminal Transactivation Do-
является субстратом для PHDs и FIH, гид-
main, CTAD) [14]. Каждый из этих доменов
роксилирования не происходит. В результате
необходим для димеризации субъединиц HIF
субъединица HIF-α стабилизируется за счет
и связывания с отвечающими на гипоксию
фосфорилирования при участии протеин-
элементами ДНК (Hypoxia Response Elements,
киназы p38 Mitogen-Activated Protein Kinases
HREs), активации и взаимодействия с коакти-
(p38-MAPK), транслоцируется в ядро и гете-
ваторами транскрипции [16-18] (рис. 1).
родимеризуется с HIF-1β. Образующийся ком-
Регуляция активности HIF. При нормоксии
плекс, в свою очередь, активирует гены-мише-
субъединица HIF-α подвергается гидрокси-
ни путем связывания с HREs [19, 21, 22].
лированию по остаткам пролина в ODDD с
В ряде работ показано, что при воспали-
участием пролилгидроксилаз (PHDs) (рис. 2).
тельных и опухолевых процессах повышается
В качестве субстрата и косубстрата реакции
экспрессия мРНК и стабилизируется белок
используются кислород и 2-оксоглутарат, а в
HIF-α. Воспалительные процессы регулиру-
качестве кофакторов - аскорбат и ионы же-
ются ядерным фактором NF-κB [5, 23-26] на
леза [19]. Далее гидроксилированная субъеди-
транскрипционном и трансляционном уров-
ница HIF-α подвергается 26S-протеасомной
нях, в то время как катаболические процессы,
деградации при участии белка-онкосупрес-
в т.ч. аутофагия, зависят от активности про-
сора фон Гиппеля-Линдау (pVHL) [20]. Также
теинкиназы mTOR (mammalian Target Of Ra-
гидроксилирование может осуществляться по
pamycin) [27-29], являющейся мишенью рапа-
остаткам аспарагина в CTAD с участием дру-
мицина у млекопитающих.
гой гидроксилазы - фактора FIH (Factor In-
На мышах с дефицитом β-киназы IκB
hibiting HIF), ингибирующего HIF. В этом
(IKKβ) показано, что при гипоксическом воз-
случае нарушается взаимодействие HIF-α с
действии (8 ± 0,1% O2) в течение 24 ч проис-
коактиватором CBP/p300 (CREB (cAMP-Re-
ходит активация NF-κB, что приводит к уве-
sponse Element-Binding protein)-Binding Pro-
личению экспрессии мРНК HIF-1a благодаря
tein/E1A Binding Protein p300) [14].
наличию сайта связывания NF-κB в промоторе
БИОХИМИЯ том 88 вып. 6 2023
916
СИЛИНА и др.
этого гена
[5]. Эти два транскрипционных
поскольку гипоксия играет ключевую регуля-
фактора взаимосвязаны, поскольку экспрессия
торную роль в механизмах воспалительных, сер-
NF-κB активируется при низкой концентрации
дечно-сосудистых и опухолевых заболеваний.
кислорода, подобно HIF-1α. При нормоксии
Изоформы HIF-α. Экспрессия изоформ
с помощью PHD1 происходит гидроксилиро-
HIF зависит от видов тканей и клеток и пе-
вание субъединицы IKKβ, что приводит к ее
риода онтогенеза. Так, HIF-1α участвует в
убиквитинированию при участии pVHL [30].
эмбриональном развитии млекопитающих в
При длительной гипоксии происходит инакти-
качестве регулятора метаболизма, поэтому в
вация PHD1, что приводит к увеличению актив-
этот период онтогенеза он локализован во всех
ности IKKβ, деградации ингибитора α-субъ-
клетках и тканях [38]. HIF-2α имеет более се-
единицы NF-κB (IκBα) и повышению экспрес-
лективное распределение и экспрессируется
сии NF-κB [31]. После синтеза белка NF-κB он
преимущественно в эндотелиальных клетках,
транслоцируется в ядро, где, взаимодействуя с
клетках глии, пневмоцитах типа II, кардио-
сайтом связывания в гене HIF1A, увеличивает
миоцитах и фибробластах [39].
его экспрессию [5]. В последующем происходит
Активация изоформ HIF зависит от дли-
транскрипция генов, индуцированных гипок-
тельности гипоксического воздействия. На раз-
сией, а также некоторых генов, кодирующих
личных клеточных линиях человека пока-
провоспалительные белки. Лимитирующим фак-
зано, что HIF-1α регулирует ответ на острый
тором при активации путей NF-κB и HIF явля-
недостаток кислорода (инкубация клеток ме-
ется коактиватор CBP/p300, за который конку-
нее 2 ч при концентрации O2, равной 0,5%), а
рируют оба транскрипционных фактора [32].
HIF-2α - на длительный (инкубация клеток
Другой путь, влияющий на синтез белка
более 14 ч при концентрации O2, равной 0,5%).
HIF-α, опосредован серин/треониновой про-
Регуляция переключения HIF-1α и HIF-2α при
теинкиназой mTOR. Она имеет большое коли-
реализации ответа на недостаток кислорода во
чество мишеней и, соответственно, функций,
многом зависит от активности гидроксилаз.
среди которых участие в метаболизме глюко-
Показано, что PHD2 имеет большее сродство к
зы, особенно в условиях гипоксии и связан-
HIF-1α, а PHD3 - к HIF-2α [40], при этом сам
ных с ней патологических состояний, таких
HIF-2α гидроксилируется как PHDs, так и FIH
как канцерогенез. mTOR активирует HIF-1α,
менее эффективно, что приводит к стабили-
что стимулирует экспрессию гликолитических
зации данной изоформы в условиях высокого
ферментов и способствует переключению ме-
содержания кислорода [41].
таболизма углеводов с окислительного фосфо-
При исследовании первичной аминокис-
рилирования на гликолиз [33]. Белок mTOR
лотной последовательности между изоформами
осуществляет активацию транскрипции мРНК
HIF-1α и HIF-2α была обнаружена гомология,
зависимых генов за счет фосфорилирования
которая составила 48% [42]. Однако HIF-2α
эукариотического фактора инициации 4E-свя-
распределен в ядре в зонах активности РНК-
зывающего белка 1 (4E-BP1) и рибосомаль-
полимеразы, что обеспечивает лучший доступ
ной S6-киназы (S6K) [34]. На эндотелиальных
к промоторам генов-мишеней, в отличие от
клетках пупочной вены человека (HUVEC)
HIF-1α, который равномерно распределен в
и линии опухолевых клеток HeLa было пока-
ядре [43]. Более того, изоформа HIF-2α имеет
зано, что уровни экспрессии HIF-1α и HIF-2α
большие размеры и ряд специфических мише-
увеличиваются путем активации сигнального
ней для регуляции транскрипции и трансляции
пути mTOR [35], что доказывает его регулятор-
этой молекулы [42].
ную роль для HIF-1α и HIF-2α.
HIF-3α является наименее изученной изо-
Помимо канонического кислородзависи-
формой и имеет несколько разных вариантов,
мого пути регуляции, существуют дополни-
образующихся в процессе альтернативного
тельные механизмы, контролирующие реак-
сплайсинга. Ген HIF3A человека имеет 19 пред-
цию на гипоксическое воздействие, одним из
сказанных вариантов, однако установлено,
которых является РНК-интерференция при
что белок-кодирующими являются лишь 8 -
участии мкРНК [36]. Действие мкРНК позво-
HIF-3α1, HIF-3α2, HIF-3α3, HIF-3α4, HIF-3α5,
ляет клеткам быстро реагировать на изменение
HIF-3α7, HIF-3α8 и HIF-3α9 [44]. Выявлены
условий среды благодаря небольшому размеру,
значительные различия в уровнях экспрессии
высокой скорости синтеза и быстрому «вклю-
и тканеспецифичности вариантов HIF-3α [45].
чению» и «выключению» трансляции мРНК-
Варианты транскриптов HIF-3α обнаружены в
мишеней [37]. Понимание регуляторных меха-
различных органеллах клеток и в тканях серд-
низмов, участвующих в адаптации организма к
ца, головного мозга, плаценты, легких, пече-
дефициту кислорода, имеет важное значение,
ни, почек, поджелудочной железы, скелетных
БИОХИМИЯ том 88 вып. 6 2023
микроРНК И КЛЕТОЧНЫЙ ОТВЕТ НА ГИПОКСИЮ
917
Таблица 1. Особенности структуры, локализации, регуляции, функций и экспрессии изоформ HIF-α
HIF-1α
HIF-2α
HIF-3α
Структура
826 а.о.;
870 а.о.;
669 а.о.;
имеются ДНК-связывающий
имеются ДНК-связывающий
имеются ДНК-связывающий
домен, домены PAS, ODDD
домен, домены PAS, ODDD
домен, домены PAS, ODDD
(содержит 2 остатка пролина),
(содержит 2 остатка пролина),
(содержит 1 остаток пролина),
NTAD, CTAD (содержит
NTAD, CTAD (содержит 1 остаток
NTAD, LZIP [46, 47];
1 остаток аспарагина) [14, 15]
аспарагина) [14, 15]
выявлено 8 белок-кодирующих
сплайс-вариантов [44]
Локализация
экспрессируется преимущественно
экспрессируется в различных
в эндотелиальных клетках, клетках
органеллах клеток и в тканях
экспрессируется во всех клетках
глии, пневмоцитах типа II, кар-
сердца, головного мозга, пла-
и тканях [38]; равномерно
диомиоцитах и фибробластах [39];
центы, легких, печени, почек,
распределен в ядре клетки [43]
в ядре клетки локализуется в зонах
поджелудочной железы,
активности РНК-полимеразы [43]
скелетных мышц и хрящей [46]
Регуляция
в условиях нормоксии осуще-
в условиях нормоксии осуще-
в условиях нормоксии осуще-
ствляется гидроксилирование
ствляется гидроксилирование
ствляется гидроксилирование
по 2 остаткам пролина в ODDD
по 2 остаткам пролина в ODDD
по 1 остатку пролина в ODDD,
и по 1 остатку аспарагина -
и по 1 остатку аспарагина -
чего недостаточно для
в CTAD, что приводит к 26S-про-
в CTAD, что приводит к 26S-про-
26S-протеасомной деградации,
теасомной деградации [19, 20];
теасомной деградации [19, 20];
поэтому белок медленно
в условиях гипоксии осущест-
в условиях гипоксии осуществля-
накапливается в клетке [47];
вляется фосфорилирование,
ется фосфорилирование, трансло-
в условиях гипоксии продолжает
транслокация в ядро, гетеро-
кация в ядро, гетеродимеризация
накапливаться и реализует свой
димеризация с субъединицей
с субъединицей HIF-1β,
эффект при длительном
HIF-1β, распознавание HREs
распознавание HREs и активация
гипоксическом воздействии [53]
и активация транскрипции
транскрипции зависимых
зависимых генов [19, 21, 22]
генов [19, 21, 22]
Функции
активация транскрипции
активация транскрипции
негативный регулятор изоформ
генов VEGFA и переносчика
генов VEGFA и переносчика
HIF-1α и HIF-2α (нарушает
глюкозы 1 [48], генов, кодирую-
глюкозы 1 [48], генов, кодирующих
транслокацию в ядро и последую-
щих ферменты гликолиза, неко-
матриксные металлопротеиназы,
щую активацию транскрипции
торых проангиогенных генов,
гена эритропоэтина [50]
зависимых генов) [52];
генов, регулирующих pH [49];
усиливает экспрессию генов,
играет роль в передаче сигналов
участвующих в метаболизме
от рецептора инсулина, передаче
глюкозы и аминокислот, апоптозе,
сигналов MAPK и метаболизме
протеолизе, передаче сигналов
инозитолфосфата [55]
онкосупрессорного белка p53
и рецепторов PPAR;
усиливает экспрессию генов
в сигнальных путях Jak-STAT
и рецепторов NLR [55]
Экспрессия относительно времени гипоксического воздействия
экспрессия увеличивается
экспрессия увеличивается
экспрессия увеличивается
при кратковременной гипоксии
при длительном гипоксическом
при длительном гипоксическом
(менее 2 ч) или в первые часы
воздействии (более 14 ч) [40, 41]
воздействии и влияет
длительного гипоксического
на переключение изоформ HIF-1α
воздействия [40, 41]
и HIF-2α [52]
БИОХИМИЯ том 88 вып. 6 2023
918
СИЛИНА и др.
мышц и хрящей. Также показано, что у чело-
ветственно, активация HIF-3α представляет
века в антенатальном периоде активно экс-
собой петлю отрицательной обратной связи,
прессируется вариант HIF-3α4, в то время
что позволяет в условиях недостатка кисло-
как в постнатальном периоде экспрессия всех
рода регулировать функциональное состоя-
вариантов HIF-3α была выше, а преобладал
ние клеток и организма в целом [45]. Поэтому
вариант HIF-3α7 [46]. Варианты HIF-3α име-
варианты HIF-3α, действующие как негатив-
ют некоторые структурные особенности по
ные регуляторы изоформ HIF-1α и HIF-2α,
сравнению с HIF-1α и HIF-2α. В отличие от
должны быть своевременно активированы для
HIF-1α и HIF-2α, изоформа HIF-3α в ODDD
адаптации клеток к условиям среды, что реа-
имеет только 1 остаток пролина, который под-
лизуется за счет действия мкРНК [53].
вергается гидроксилированию, однако это-
Однако некоторые варианты HIF-3α имеют
го недостаточно для рекрутирования pVHL.
функции, частично перекрывающиеся с функ-
Поэтому в условиях нормоксии не происходит
циями HIF-1α, что может свидетельствовать о
протеасомной деградации HIF-3α [47]. Также
том, что HIF-3α - это не только негативный
варианты HIF-3α имеют домен типа «лейци-
регулятор [54]. Показано, что как HIF-3α, так
новая молния» (LZIP), участвующий в реали-
и HIF-1α могут повышать экспрессию генов,
зации белок-белковых взаимодействий, отли-
участвующих в метаболизме глюкозы и амино-
чающихся от тех, которые осуществляются
кислот, апоптозе, протеолизе, передаче сиг-
HIF-1α и HIF-2α [46]. Еще одним отличием от
налов онкосупрессорного белка p53 и рецеп-
HIF-1α и HIF-2α является то, что гидроксили-
торов PPAR (Peroxisome Proliferator-Activated
рование, опосредованное FIH, вероятнее все-
Receptor). HIF-3α, но не HIF-1α, увеличивает
го, не играет роли в регуляции HIF-3α, так как
экспрессию генов сигнальных путей Jak-STAT
в нем отсутствует CTAD, содержащий аспара-
(Janus kinase-Signal Transducer and Activator of
гин в изоформах HIF-1α и HIF-2α [45].
Transcription) и рецепторов NLR (Nucleotide
Изоформы HIF характеризуются функ-
oligomerization domain (NOD)-Like Receptors).
циональными различиями. В условиях гипок-
В отличие от HIF-3α, HIF-1α способен акти-
сии HIF-1α и HIF-2α связываются с одним
вировать ген VEGFA, передачу сигналов от
и тем же HIF-1β. При этом HIF-1α и HIF-2α
рецептора инсулина, сигналы MAPK и мета-
имеют как уникальные, так и схожие гены-
болизм инозитолфосфата
[55]. Необходимо
мишени [14, 15]. Общие мишени представлены
проведение дальнейших исследований, посвя-
генами VEGFA и переносчика глюкозы 1 [48].
щенных регуляторной роли различных изо-
HIF-1α также индуцирует экспрессию генов,
форм HIF в адаптации к условиям недостатка
кодирующих ферменты гликолиза, некоторых
кислорода и эффектов, к которым приводит их
проангиогенных генов и генов, регулирую-
взаимодействие.
щих pH [49]. HIF-2α стимулирует экспрессию
В работе Jaskiewicz et al. [56] показано, что
генов, кодирующих матриксные металлопро-
в эндотелиальных клетках человека в ответ
теиназы, и гена эритропоэтина [50]. Пока-
на длительную гипоксию (48 ч при 0,9% O2)
зано, что HIF-1α регулирует начальные этапы
повышается содержание HIF-3α2, что сопро-
ангиогенеза, а заключительные стадии ремо-
вождается накоплением каспазы-3/7. Однако
делирования и стабилизации сосудистой сети
молекулярные механизмы индукции гипок-
контролирует HIF-2α [51]. HIF-3α, в свою
сической гибели клеток HIF-3α не извест-
очередь, может играть разные и даже противо-
ны [56]. Обобщенная информация об особен-
положные роли в регуляции экспрессии зави-
ностях разных изоформ HIF-α представлена
симых генов благодаря разнообразию вариан-
в табл. 1.
тов. В работе Heikkilä et al. [52] были получены
Следует отметить, что переключение ак-
данные о взаимодействии HIF-3α с HIF-1α
тивности изоформ HIF сопровождается изме-
и HIF-2α. Показано, что взаимодействие лю-
нением уровней мкРНК, в т.ч. miR-210, что
бого из транскриптов HIF-3α и HIF-1α при-
будет подробнее обсуждаться ниже [57].
водит к нарушению транслокации обеих этих
изоформ в ядро и последующему ингибирова-
нию транскрипции зависимых генов. Тот же
мкРНК - БИОГЕНЕЗ,
эффект описан для взаимодействия HIF-3α
МЕХАНИЗМ ДЕЙСТВИЯ, ВЛИЯНИЕ HIF
и HIF-2α, однако, по результатам коиммуно-
преципитации, взаимодействие с изоформой
Биогенез и механизм действия мкРНК. Пер-
HIF-1α было намного сильнее. Таким образом,
воначально мкРНК транскрибируются как обыч-
HIF-3α выступает в роли негативного регуля-
ные мРНК и образуют при-мкРНК, содержащую
тора для изоформ HIF-1α и HIF-2α [52]. Соот-
в своем составе как минимум 1 шпильку [58].
БИОХИМИЯ том 88 вып. 6 2023
микроРНК И КЛЕТОЧНЫЙ ОТВЕТ НА ГИПОКСИЮ
919
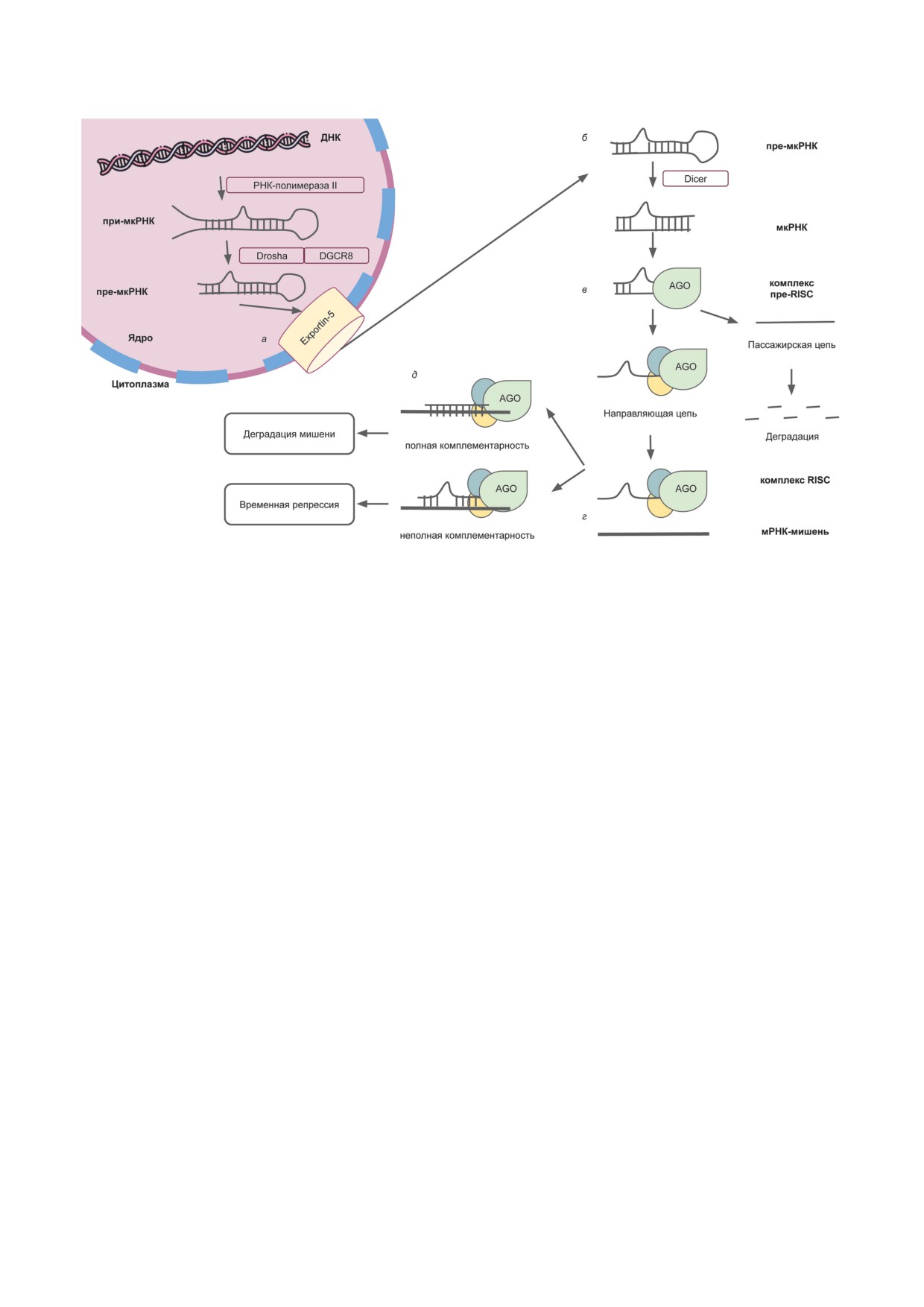
Рис. 3. Биогенез мкРНК. а - Формирование при- и пре-мкРНК с участием эндонуклеаз Drosha и DGCR8 и экспорт
из ядра; б - разрезание белком Diсer и образование зрелой мкРНК; в - объединение мкРНК с комплексом AGO
и отщепление пассажирской цепи; г - распознавание мРНК-мишени комплексом RISC; д - эффект, оказываемый
мкРНК на мРНК-мишень. DGCR8 - белок гена 8 критической области синдрома Ди Джорджи; AGO - белки семей-
ства Argonaute; RISC - RNA-Induced Silencing Complex
Далее микропроцессорный комплекс, главную
Для удобства работы с большим количе-
роль в работе которого играют эндонуклеаза
ством мкРНК была создана единая система
Drosha и белок, связывающий двухцепочечный
номенклатуры этих молекул - база данных
фрагмент РНК, называемый Pasha или DGCR8
miRbase [63, 64]. В соответствии с номенклату-
(белок гена 8 критической области синдрома
рой, каждой miR (microRNA) присваивается
Ди Джорджи) [59], отщепляет одноцепочеч-
номер в порядке обнаружения, который присое-
ные
«хвосты», а полученная пре-мкРНК
диняется к префиксу «miR» (например, miR-210).
транслоцируется в цитоплазму при участии
Перед префиксом часто используют еще 3 бук-
белка Exportin-5 [60] (рис. 3, а). В цитоплазме
вы, которые обозначют видовую принадлеж-
РНКаза III Dicer расщепляет предшествен-
ность (например, hsa-miR-210 для Homo sapiens).
ник мкРНК возле петли с образованием зре-
Степень созревания молекулы обозначают
лой малой двухцепочечной РНК (рис. 3, б).
«mir», если речь идет о гене или предшествен-
Дуплекс мкРНК связывается с белками се-
нике мкРНК (при-мкРНК или пре-мкРНК),
мейства Argonaute (AGO), и с одной из цепей
или «miR» - для обозначения зрелой мкРНК.
образуется комплекс RISC (RNA-Induced
Последовательности с одной или двумя заме-
Silencing Complex), а вторая цепь дегради-
нами оснований имеют специальный суф-
рует [61] (рис. 3, в). У млекопитающих каж-
фикс, следующий сразу после номера (напри-
дый из четырех белков подсемейства AGO
мер, miR-20a). Некоторые предшественники
(AGO1-4) может репрессировать трансляцию
мкРНК могут давать начало двум зрелым мо-
своих мРНК-мишеней, но только AGO2 спо-
лекулам, по одной из каждого плеча. В таком
собен расщеплять их. Вошедшая в состав ком-
случае к названию мкРНК может добавляться
плекса мкРНК играет роль матрицы для рас-
еще один суффикс - -3p или -5p (например,
познавания мРНК-мишени (рис. 3, г). При
miR-30a-3p).
полной комплементарности молекул AGO рас-
Эндонуклеазы Drosha и Dicer могут по-
щепляют мРНК-мишень, приводя к ее дегра-
разному разрезать одни и те же при- и пре-
дации, при неполной - «выключение» гена
мкРНК, что приводит к образованию мкРНК,
реализуется за счет временной остановки
которые имеют некоторые различия в нуклео-
трансляции [62] (рис. 3, д).
тидной последовательности и называются изо-
БИОХИМИЯ том 88 вып. 6 2023
920
СИЛИНА и др.
мирами [65]. Такие различия могут приводить
Влияние HIF на мкРНК. Показано, что на
к изменению мишеней, что расширяет воз-
биогенез мкРНК оказывает влияние HIF-1α,
можности регуляции и создает дополнитель-
экспрессия которого увеличивается в услови-
ные проблемы в изучении этих малых некоди-
ях недостатка кислорода
[69]. Активация
рующих мкРНК.
ответа на гипоксию приводит к снижению
На данный момент главной трудностью
синтеза белков DGCR8, Exportin
5, Dicer,
в исследованиях функционирования мкРНК
AGO1 и AGO2 [70]. Однако более поздние
является идентификация мишеней, так как
исследования свидетельствуют о том, что
каждая из последних может регулироваться
HIF-1α активирует пролил-4-гидроксилазу
несколькими мкРНК [13]. Для наиболее точ-
коллагена типа I (cP4HI), которая усиливает
ного определения необходимо использовать
пролилгидроксилирование и эндонуклеазную
комплексный подход - изучение генов и бел-
активность AGO2 [71]. Для другого члена под-
ков-мишеней, проведение полноэкзомного сек-
семейства белков AGO, AGO4, также опи-
венирования и использование методов биоин-
сана положительная регуляция эукариоти-
форматики.
ческим фактором инициации трансляции
Разработано несколько подходов для иден-
2C4 (EIF2C4), экспрессию которого усили-
тификации мРНК-мишеней. Одним из мето-
вает HIF-1α. Все эти события приводят к ин-
дов, применяемых для изучения мкРНК, яв-
дукции экспрессии таких мкРНК как miR-107,
ляется иммунопреципитация, в основе кото-
miR-155, miR-210 и др. [53].
рой лежит взаимодействие белков, ассоци-
Таким образом, данные исследований
ированных с комплексом RISC, содержащим
разных лет о влиянии активации HIF-1α на
направляющую цепь и мРНК-мишень, и специ-
мкРНК противоречивы. С одной стороны,
фичных к ним антител [66]. Иммунопреципи-
активация ответа на недостаток кислорода
тированные мкРНК и мРНК затем необходимо
ингибирует белки биогенеза мкРНК, но, по
анализировать с помощью высокопроизводи-
другим данным, наоборот, повышает их актив-
тельного секвенирования для идентификации
ность. Известно, что клетки различных тка-
потенциальных мишеней мкРНК.
ней организма имеют разную устойчивость
Другой метод исследования основан на
к гипоксии [72]. Возможно, возникшее про-
технологии SILAC (Stable Isotope Labelling with
тиворечие можно связать с тем, что в описан-
Amino acids in Cell culture). Клетки культиви-
ных выше работах не была проведена оценка
руют в питательной среде, содержащей неза-
исходной устойчивости к недостатку кисло-
менимые аминокислоты, меченные тяжелы-
рода, хотя известно, что активность белков,
ми изотопами, исследуют с помощью масс-
участвующих в адаптации к гипоксии (HIF-1α,
спектрометрического анализа и определяют
VEGF и др.), различается у высоко- и низко-
содержание меченых аминокислот за счет со-
устойчивых организмов. Данная гипотеза мо-
отношения интенсивностей пептидных пиков.
жет стать основой для будущих исследований
При изучении в культуре клеток HeLa был
взаимосвязи HIF и мкРНК. Кроме того, дан-
получен белковый профиль в ответ на нок-
ное противоречие может быть обусловлено
даун или сверхэкспрессию мкРНК в рамках
особенностями клеточной линии, на которой
всего протеома [67]. Данный метод позволяет
проводятся эксперименты, и концентрацией
проводить оценку возникающих вариаций
кислорода, используемой для гипоксического
вскоре после индукции изменений в экспрес-
воздействия.
сии мкРНК.
Помимо влияния на синтез белков биоге-
Одним из недавно описанных методов
неза мкРНК, изоформы HIF-α способны ока-
идентификации мкРНК-мишеней стал скри-
зывать действие на экспрессию самих мкРНК.
нинг мутагенеза 3′-нетранслируемой области
На сегодняшний день ключевой мкРНК ги-
на основе технологии CRISPR-Cas9, который
поксического ответа считается miR-210, так
описали Froehlich et al [68]. Данный подход по-
как ее уровень экспрессии изменяется в зави-
зволяет проводить одновременный анализ не-
симости от содержания кислорода в окружаю-
скольких регуляторных последовательностей,
щей среде. Она имеет элементы HREs, распо-
оценивая функциональность сайтов связыва-
ложенные на 400 п.н. выше своего основного
ния мкРНК на мРНК-мишени [68].
промотора. HREs высококонсервативны у раз-
Тем не менее, исходя из важной регулятор-
ных видов, что позволяет предположить, что
ной роли мкРНК для большого количества ге-
регуляция HIF-1α играет ключевую роль в
нов, вопрос изучения их биогенеза и функций
жизнедеятельности организмов [73]. В экс-
остается одним из актуальных для молекуляр-
перименте, проведенном на эндотелиальных
ной биологии в настоящее время.
клетках пупочной вены человека, подвергаю-
БИОХИМИЯ том 88 вып. 6 2023
микроРНК И КЛЕТОЧНЫЙ ОТВЕТ НА ГИПОКСИЮ
921
щихся действию 1%-ного кислорода в течение
УЧАСТИЕ мкРНК В РЕГУЛЯЦИИ
разных временных промежутков, было показа-
КЛЕТОЧНОГО ОТВЕТА НА ГИПОКСИЮ
но, что уровень miR-210 через 4 ч был в 35 раз
выше, чем в контрольной группе, а актива-
Адаптация к гипоксии, как один из важ-
ция miR-210 была обратно пропорциональна
нейших механизмов, необходимых для выжи-
парциальному давлению О2. Для оценки роли
вания организма, оказывает влияние на кле-
HIF в данной работе блокировали изофор-
точные процессы и зависит от различных фак-
мы HIF-1α и HIF-2α, однако ингибирование
торов
[74]. На сегодняшний день описано
синтеза только HIF-1α приводило к сниже-
более 100 мкРНК, участвующих в регуляции
нию индукции miR-210 [74]. Следовательно,
HIF-опосредованного ответа на гипоксию [78,
miR-210 является специфической мишенью
79]. К сожалению, не для всех идентифициро-
для HIF-1α.
ванных молекул проведено достаточно иссле-
В недавно проведенном исследовании по-
дований, чтобы подтвердить их участие в адап-
казано, что воздействие гипоксии (0,9% O2)
тации к недостатку кислорода. Далее будут
на HUVEC в течение 20 ч приводит к посте-
рассмотрены наиболее подробно изученные в
пенному накоплению и последующему мед-
настоящее время мкРНК, регулирующие ответ
ленному снижению экспрессии мкРНК, что
на гипоксию.
является результатом активации адаптивного
МкРНК, участвующие в регуляции кле-
ответа на недостаток кислорода. Наблюдалось
точного ответа на гипоксию, можно разделить
четкое деление репертуара экспрессируемых
на 3 группы. Во-первых, это молекулы, кото-
мкРНК при острой (2 ч) и длительной (16 ч)
рые оказывают воздействие на мРНК генов,
гипоксии, что соответствует периодам наи-
кодирующих HIF, и, таким образом, подав-
большей активности HIF-1α и HIF-2α соот-
ляют синтез его изоформ [80, 81]. Во-вторых,
ветственно. Для более детального изучения
это группа мкРНК, которая влияет на дегра-
была выбрана временная точка 8 ч, поскольку
дацию α-субъединиц HIF при нормоксии [82].
это был переходный момент времени между
И в-третьих, - мкРНК, влияющие на экспрес-
кратковременной и длительной гипоксией
сию белков, участвующих в реализации мета-
и временем, когда обе изоформы были ак-
болических путей при ответе на гипоксию -
тивны. После проведения секвенирования
гликолиз, окислительное фосфорилирование
и биоинформатической обработки данных
и др. [74, 83, 84] (рис. 4).
было идентифицировано
5 общих мкРНК-
К группе мкРНК, ингибирующих синтез
мишеней - miR-210, miR-520d-3p, miR-98-3p,
транскрипционных факторов семейства HIF,
miR-4745-5p и miR-139-5p [57]. Более того,
относятся miR-20a, miR-150, miR-155, miR-519c,
для ключевой мкРНК гипоксического ответа,
miR-153, miR-30c-2-3p, miR-30a-3p, miR-145,
miR-210, было найдено 12 и 18 HREs, специ-
miR-429 и miR-107. Общий механизм их дей-
фичных к HIF-1α и HIF-2α, что опровергает
ствия - комплементарное взаимодействие с
описанное ранее селективное действие HIF-1α
соответствующим сайтом связывания, приво-
на эту мкРНК [74].
дящее к временной репрессии трансляции или
HIF-зависимое повышение экспрессии
деградации мРНК одной из изоформ HIF.
miR-210 выявлено в опухолях молочной же-
HIF-1α, как главный регулятор ответа орга-
лезы, легких, толстой кишки, поджелудоч-
низма на недостаток кислорода, является ми-
ной железы [75]. Уровень экспрессии miR-210
шенью для мкРНК. Показано, что miR-20а [85],
коррелирует со стадией опухолевой прогрес-
miR-155 [86], miR-150 [87] и miR-519c [81] име-
сии, поэтому в перспективе его можно ис-
ют сайты связывания в 3′-нетранслируемой об-
пользовать в качестве прогностического био-
ласти HIF-1α и играют роль негативных регу-
маркера [76].
ляторов синтеза данной субъединицы.
Другой важной мкРНК, экспрессия кото-
На линии эндотелиальных клеток микро-
рой регулируется HIF-1α, является miR-122,
сосудов сетчатки человека (hRMECs) пока-
промотор которой имеет 2 HREs. В исследова-
зано, что в условиях
12-часовой гипоксии
нии, проведенном на клетках печени HepG2,
(5% CO2 и 95% N2), которая является стрессо-
было показано, что miR-122 является селек-
вым фактором для клеток, в эндоплазматиче-
тивной мишенью для HIF-1α, который взаи-
ском ретикулуме происходит накопление бел-
модействует с обоими HREs. Для HIF-2α та-
ков с неправильной конформацией в связи с
кой эффект показан не был [77]. Более того,
недостатком энергетических ресурсов и изме-
miR-122 так же влияет на адаптацию метабо-
нением окислительно-восстановительного по-
лизма клетки к условиям гипоксии, что будет
тенциала клетки [88] (рис. 5). Это приводит к
обсуждаться далее.
активации трансмембранных сенсоров, которая
3
БИОХИМИЯ том 88 вып. 6 2023
922
СИЛИНА и др.
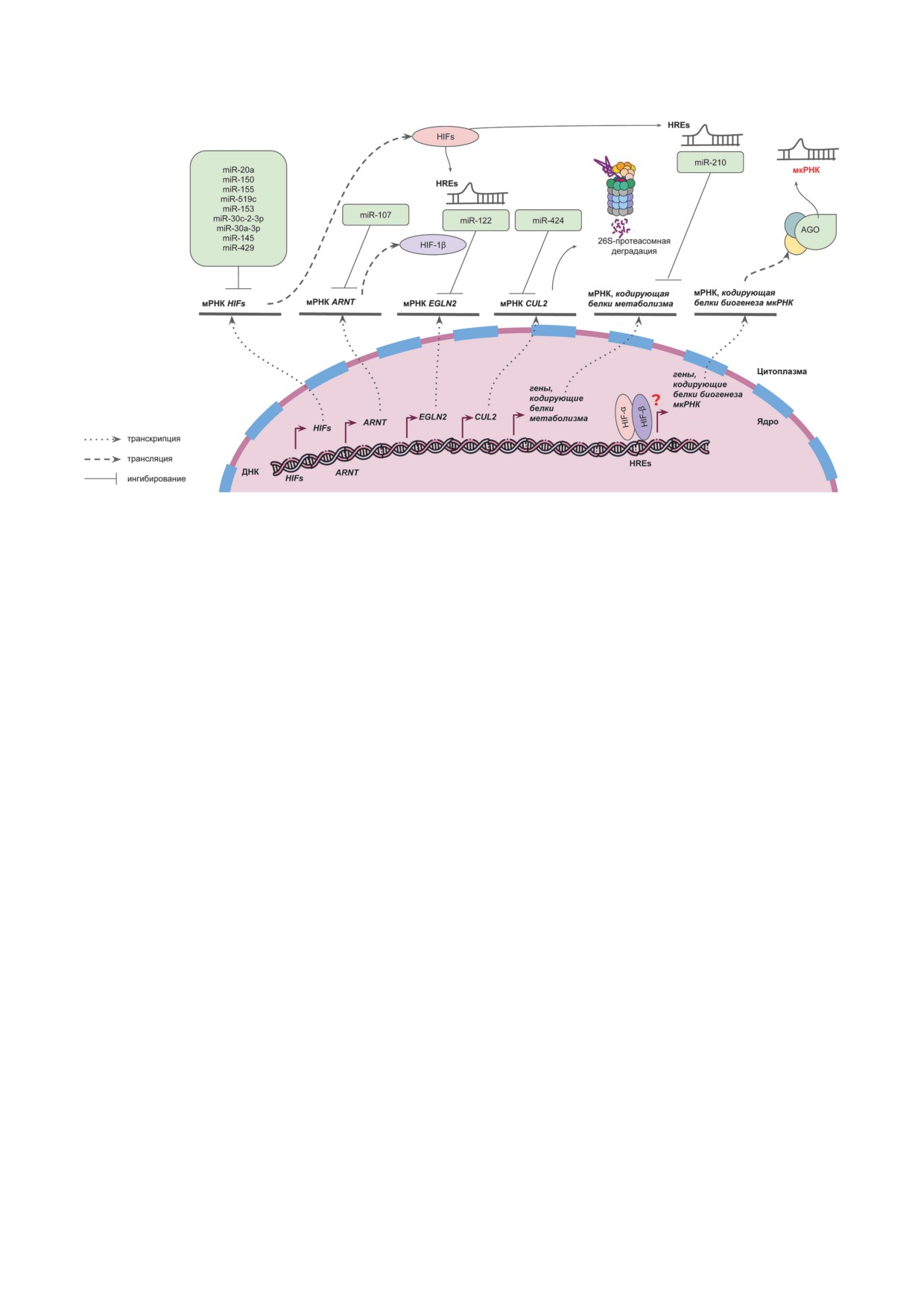
Рис. 4. Мишени некоторых мкРНК в регуляции клеточного ответа на гипоксию: miR-210 участвует в регуляции тран-
скрипции генов-мишеней HIF и зависит от HIF-1α; miR-424 влияет на белки, осуществляющие деградацию HIF
в условиях нормоксии; miR-20a, miR-150, miR-155, miR-153 и miR-519c охарактеризованы как регуляторы трансляции
HIF-1α; miR-30c-2-3p, miR-30a-3p и miR-145 - HIF-2α; miR-429 - HIF-3α; miR-107 - HIF-1β. HIFs - гены HIF1A,
EPAS1, HIF3A; HIFs - белки HIF-1α, HIF-2α, HIF-3α; HREs - элементы ДНК, отвечающие на гипоксию; AGO -
белки семейства Argonaute
определяет дальнейшую судьбу клетки при
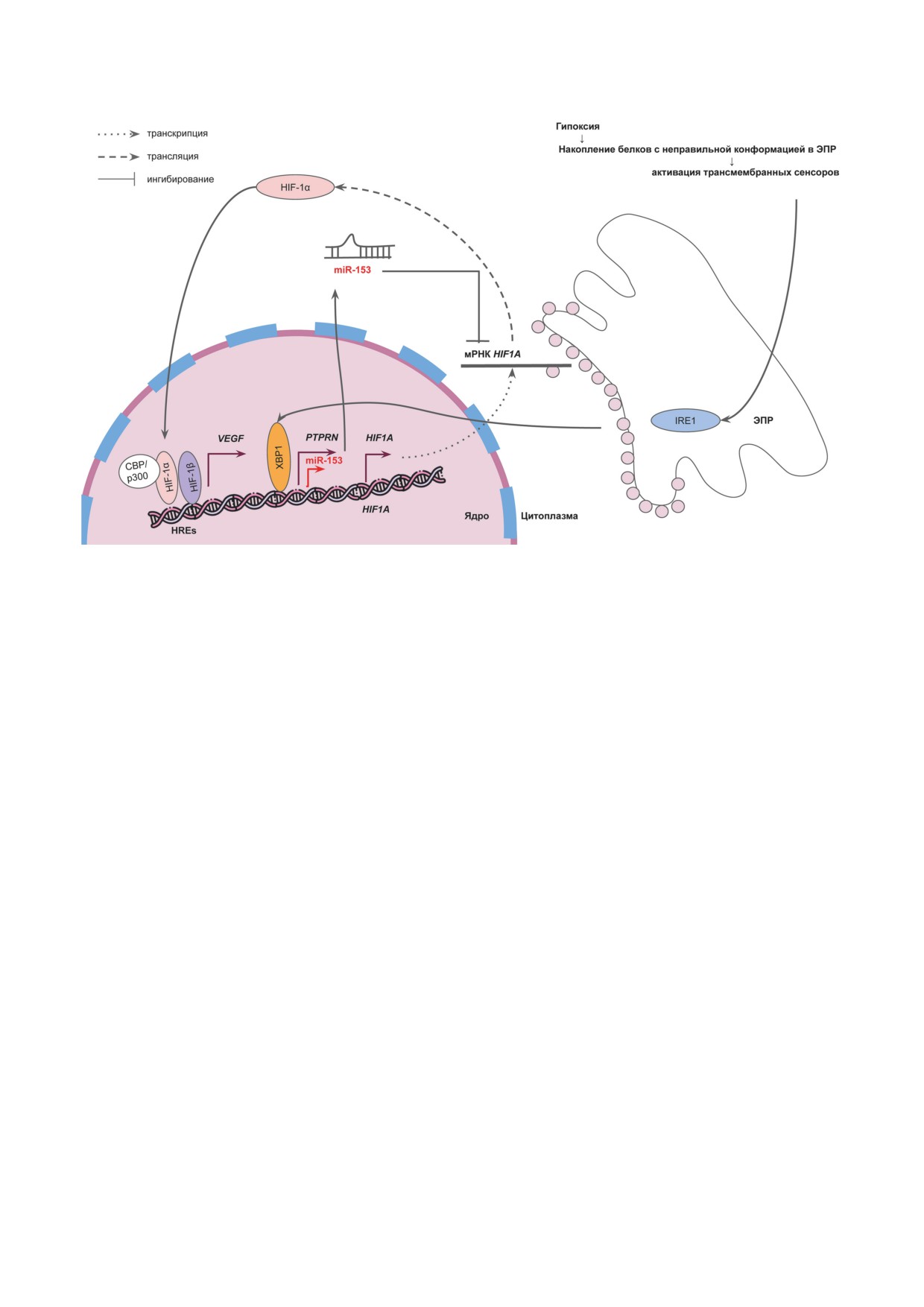
условиях гипоксии после связывания HIF-1α
длительном недостатке кислорода. Один из
с HREs, транслоцируется из ядра в цитоплаз-
них, IRE1 (Inositol-Requiring Enzyme 1), акти-
му, где, связываясь с мРНК HIF1A, вызывает
вирует белок XBP1 (X-Box Binding Protein 1),
ее деградацию, создавая петлю отрицательной
который является важным фактором тран-
обратной связи. Позже эта же группа исследо-
скрипции. Liang et al. [89] показали, что XBP1
вателей изучала влияние miR-429 на HIF-3α
индуцирует экспрессию miR-153 путем связы-
и обнаружила, что регуляция экспрессии дей-
вания с промотором PTPRN (Protein Tyrosine
ствительно существует, и она осуществляется
Phosphatase Receptor Type N) за счет того, что
через 3′-нетранслируемую область вариантов
промотор miR-153 расположен в этом же гене.
HIF-3α2 и HIF-3α3. Благодаря этому меха-
Далее эта мкРНК связывается с 3′-нетранслируе-
низму происходит переключение экспрессии
мой областью мРНК HIF1A, подавляя его син-
с HIF-1α на HIF-3α при длительной гипок-
тез и ингибируя VEGF-зависимый ангиогенез.
сии (48 ч при концентрации O2, равной 1%).
Идентифицировано несколько miR, регу-
Экспрессия HIF-1α блокируется miR-429, что
лирующих HIF-2α, в основном в линиях опу-
приводит к последующему снижению количе-
холевых клеток. Однако зависимость их регу-
ства самой мкРНК и накоплению HIF-3α, что
ляции от гипоксии изучена недостаточно.
позволяет организму выжить в условиях дли-
Показано, что miR-30c-2-3p и miR-30a-3p, свя-
тельного недостатка кислорода [54].
зываясь с 3′-нетранслируемой областью мРНК
HIF-1β, как и различные изоформы α-субъ-
гена EPAS1, кодирующего HIF-2α, подавляют
единицы, может регулироваться мкРНК.
его синтез без изменения уровня или активно-
Yamakuchi et al. [80] исследовали экспрессию
сти HIF-1α [90]. Zhang et al. [91] показали, что
мкРНК у больных раком толстой кишки с ис-
3′-нетранслируемая область мРНК EPAS1 так-
пользованием микрочипов и последующей био-
же содержит сайт связывания miR-145, повы-
информатической обработкой и обнаружили,
шение экспрессии которой в условиях нормо-
что miR-107 может быть мишенью для р53 и
ксии снижает уровни как мРНК, так и самого
регулятором HIF-1β. Белок p53 в организме
белка HIF-2α.
супрессирует образование опухолевых клеток
Изоформа HIF-3α также регулируется с
за счет ингибирования их пролиферации и
помощью мкРНК. Bartoszewska et al. [92] про-
стимуляции апоптоза. Однако мутации в p53
демонстрировали, что miR-429 активируется в
являются частой причиной нарушения этих
БИОХИМИЯ том 88 вып. 6 2023
микроРНК И КЛЕТОЧНЫЙ ОТВЕТ НА ГИПОКСИЮ
923
Рис. 5. Механизм действия гипоксии, как стрессового фактора, на экспрессию miR-153 с последующим ингибирова-
нием активации транскрипции VEGF. ЭПР - эндоплазматический ретикулум; IRE1 - Inositol-Requiring Enzyme 1;
XBP1 - X-Box Binding Protein 1; PTPRN - Protein Tyrosine Phosphatase Receptor Type N; VEGF - фактор роста эндо-
телия сосудов; HREs - элементы ДНК, отвечающие на гипоксию
механизмов, что индуцирует развитие опухо-
HIF-1α и HIF-2α. Для идентификации мише-
лей [93]. Показано, что 3′-нетранслируемая об-
ни этой мкРНК использовались алгоритмы,
ласть гена ARNT, кодирующего белок HIF-1β,
согласно которым были получены данные о
содержит сайт связывания miR-107, а оказывае-
том, что miR-424, действуя на 3′-нетрансли-
мое действие ведет к снижению синтеза VEGF
руемую область CUL2, дестабилизирует ком-
и, таким образом, нарушает адаптацию к недо-
плекс Е3, что ведет к нарушению деградации
статку кислорода. Эта работа была одним из
HIF-α, и, как следствие, адаптации клеток к
первых свидетельств того, что регуляция ответа
гипоксии [82].
на гипоксию зависит не только от HIF-1α, но
Как упоминалось выше, помимо того, что
и от HIF-1β [80]. Позже это было подтвержде-
miR-122 сама регулируется HIF-1α, она спо-
но Deng et al. [94] в ходе изучения регуляции
собна поддерживать выживаемость организма
ремоделирования сосудов при легочной гипер-
при гипоксии. Мишенью этой мкРНК является
тензии miR-103/107 посредством воздействия
3′-нетранслируемая область мРНК гена EGLN2,
на HIF-1β.
кодирующего PHD1, которая осуществляет
Другие мкРНК, в частности miR-424 и
гидроксилирование α-субъедицы HIF в усло-
miR-122, реализуют свои эффекты, влияя на
виях нормоксии. Соответственно, при взаимо-
синтез белков, участвующих в деградации HIF
действии miR-122 с мРНК EGLN2 происходит
при нормоксии.
нарушение синтеза фермента, что приводит к
Как упоминалось выше, α-субъединица
стабилизации HIF-1α и последующей реализа-
HIF в условиях нормоксии подвергается про-
ции зависимых от него эффектов [77].
теасомной деградации [45]. В комплекс убик-
Третья группа мкРНК включает miR-210,
витинлигазы Е3, помимо pVHL, входит каркас-
которая осуществляет ингибирование синтеза
ный белок CUL2 (Cullin-2), блокировка синте-
белков, участвующих в метаболической адап-
за которого приводит к дестабилизации ком-
тации к гипоксии, которая заключается в пе-
плекса и остановке разрушения HIF-α [95].
реключении с окислительного фосфорилиро-
При изучении профиля мкРНК в эндотели-
вания на гликолитический путь.
альных клетках человека в условиях гипоксии
Для miR-210, регулирующей гипоксиче-
наблюдалось увеличение экспрессии miR-424,
ский ответ, идентифицировано более 10 ми-
приводящее к повышению содержания белков
шеней, участвующих в ангиогенезе [74], диф-
БИОХИМИЯ том 88 вып. 6 2023
3*
924
СИЛИНА и др.
Таблица 2. Взаимодействие некоторых мкРНК и тран-
ференцировке остеобластов [96], изменении
скрипционных факторов семейства HIF
потребления кислорода митохондриями [83].
3′-Нетранслируемые области транскриптов
Ключевые мкРНК,
Ключевые мкРНК,
белков, участвующих в сборке железосерных
HIFs
на которые
ингибирующие
влияет HIF
синтез HIF
кластеров ISCU1 и ISCU2 (Iron-Sulfur Cluster
assembly proteins), были описаны как мишени
miR-210
miR-20a
для действия miR-210. Основная роль этих
miR-122
miR-150
белков - обеспечение транспорта электронов
miR-520d-3p
miR-155
HIF-1α
и окислительно-восстановительных реакций
miR-98-3p
miR-153
в метаболизме различных молекул [97]. Нару-
miR-4745-5p
miR-519c
miR-139-5p
miR-429
шение этих функций в результате подавления
miR-201 синтеза ISCU1 и ISCU2 приводит
miR-210
к блокировке митохондриального дыхания и
miR-520d-3p
miR-30c-2-3p
переключению на гликолиз («эффект Варбур-
HIF-2α
miR-98-3p
miR-30a-3p
га») [83], что необходимо для адаптации орга-
miR-4745-5p
miR-145
низма к условиям недостатка кислорода.
miR-139-5p
Благодаря большому разнообразию мкРНК,
HIF-3α
не установлены
miR-429
а тем более их потенциальных мишеней, про-
блема их участия в молекулярных механиз-
HIF-1β
не установлены
miR-107
мах гипоксии и ее контроля важна в изучении
адаптации к условиям среды, канцерогенеза,
воспалительных процессов и старения.
более тяжелым течением как локальных, так
Таким образом, на основании анализа лите-
и системных воспалительных процессов [9-
ратурных данных можно сделать заключение,
12]. В частности, при моделировании острого
что многие мкРНК взаимодействуют с тран-
язвенного колита с использованием декстран-
скрипционными факторами семейства HIF и
сульфата натрия (ДСН) у низкоустойчивых
регулируют адаптацию клеток и организма в
к гипоксии половозрелых самцов мышей
целом к условиям гипоксии (табл. 2).
C57Bl/6, по сравнению с высокоустойчивыми,
наблюдались более выраженные клинические
проявления (диарея и кровь в кале), стати-
РОЛЬ ИСХОДНОЙ УСТОЙЧИВОСТИ
стически значимое снижение всех популяций
К ГИПОКСИИ И мкРНК
лимфоцитов в периферической крови, а также
ПРИ ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЯХ
была выше распространенность язв в слизи-
стой оболочке толстой кишки [12]. При моде-
Особенности течения воспалительных забо-
лировании хронического язвенного колита с
леваний в зависимости от исходной устойчиво-
использованием той же экспериментальной
сти к гипоксии. Показано, что как у лабора-
модели у низкоустойчивых к гипоксии мышей
торных животных, так и у людей существуют
также наблюдались более выраженные клини-
различия в устойчивости к гипоксии, которая
ческие проявления заболевания на фоне более
зависит от пола, возраста, наличия сопут-
высокого уровня смертности животных, а также
ствующих заболеваний, а также суточных,
снижения всех популяций Т-лимфоцитов и уве-
сезонных и инфрадианных биоритмов [6, 7].
личения числа В-клеток в крови [11]. Эти иссле-
Устойчивость к гипоксии во многом опреде-
дования свидетельствуют о взаимосвязи исход-
ляется полиморфизмом генов HIF1A, VEGF и
ной устойчивости к гипоксии и тяжести течения
супероксиддисмутазы SOD2, регулирующих
воспалительных процессов в толстой кишке.
адаптивный ответ на гипоксию. Наибольшее
Кроме того, на половозрелых самцах крыс
значение имеет активация индуцируемого ги-
Вистар также показана взаимосвязь тяжести
поксией фактора HIF-1α. По данным литера-
течения системного воспалительного ответа,
туры, выявлено наличие обратной зависимо-
индуцированного введением липополисахари-
сти между базовым содержанием белка HIF-1α
да (ЛПС), и устойчивости животных к гипок-
в неокортексе и устойчивостью беспородных
сии. Низкоустойчивые к недостатку кислорода
самцов крыс к гипоксии: у низкоустойчивых
животные в ответ на введение ЛПС характери-
особей в нормоксических условиях содержа-
зуются более высокими уровнями экспрессии
ние белка HIF-1α было в 1,7 раза выше, чем
Nf-kb и Hif-1a в печени, бо льшим количеством
у высокоустойчивых [8]. Животные с низкой
нейтрофилов в межальвеолярных перегород-
устойчивостью к недостатку кислорода, в от-
ках легких и повышенным содержанием IL-1β
личие от высокоустойчивых, характеризуются
и С-реактивного белка в сыворотке крови [9].
БИОХИМИЯ том 88 вып. 6 2023
микроРНК И КЛЕТОЧНЫЙ ОТВЕТ НА ГИПОКСИЮ
925
В ответ на введение ЛПС для низкоустойчи-
последним данным, активация одной из свя-
вых к гипоксии животных характерно сме-
занных с гипоксией мкРНК - miR-210 - сопро-
щение баланса иммунных реакций в сторону
вождает развитие сепсиса, однако характерна
гуморальных, в то время как для высокоустой-
только для одного его подтипа.
чивых - в сторону клеточных [10].
Помимо исследований мкРНК в качестве
Точные механизмы, определяющие раз-
биомаркеров развития сепсиса, показано, что
личия в тяжести течения воспалительных
у пациентов с язвенным колитом и болезнью
заболеваний у животных с разной устойчиво-
Крона в периферической крови уровни экс-
стью к гипоксии, в настоящее время не уста-
прессии некоторых мкРНК повышены [101].
новлены. Очевидно, что функционирование
В частности, miR-155 имела более высокий
белка HIF-1α играет одну из главных ролей в
уровень экспрессии при язвенном колите, а
этих процессах. При этом регуляция синтеза
miR-107 - при болезни Крона [102]. Кроме
HIF-1α у высокоустойчивых и низкоустой-
того, по результатам экспериментального иссле-
чивых к гипоксии животных может осущест-
дования мкРНК с использованием трех моде-
вляться по-разному. Вероятно, в этом при-
лей язвенного колита у мышей, показано по-
нимают участие мкРНК, которые влияют как
вышение концентрации miR-150 в сыворот-
на ответ на гипоксическое воздействие, так и
ке крови [103]. В ходе данной работы ис-
на течение воспалительных процессов. Роль
пользовали модель острого колита, индуци-
мкРНК как в системных, так и в локальных
рованного ДСН [104], TLR5-дефицитных мы-
воспалительных процессах активно изучается
шей (TLR5-/-) [105] и IL-10-дефицитных мы-
в настоящее время. При поиске биомаркеров
шей (IL10-/-) [106]. Авторы пришли к выводу,
воспаления изучают преимущественно цир-
что повышение концентрации связанной с
кулирующие мкРНК, в то время как исследо-
гипоксией miR-150 является одним из специ-
вания тканевых мкРНК у экспериментальных
фических биомаркеров воспалительных забо-
животных позволяют установить механизмы
леваний кишечника, вызванных различными
воспалительных реакций. При этом показано,
этиологическими факторами.
что паттерны экспрессии мкРНК в тканях во
Таким образом, концентрации в сыворот-
многом перекрываются с мкРНК, циркули-
ке крови некоторых мкРНК, связанных с отве-
рующими в крови. Среди обсуждаемых нами
том на гипоксию, могут быть использованы в
ранее мкРНК, которые участвуют в регуля-
ходе неинвазивного исследования пациентов в
ции ответа на гипоксию при воспалительных
качестве маркеров для прогнозирования воз-
процессах, повышение экспрессии miR-210 и
можности возникновения и тяжести течения
miR-155 обнаружено как в тканях, так и в кро-
как локальных, так и системных воспалитель-
ви, а miR-107 и miR-150 - только в крови.
ных процессов.
Циркулирующие мкРНК, регулирующие от-
Тканевые мкРНК, регулирующие ответ на
вет на гипоксию при воспалительных процессах.
гипоксию при воспалительных процессах. На экс-
Согласно исследованиям Virga et al. [98] и Del
периментальных моделях ЛПС-индуцирован-
Mauro et al. [99], повышение уровня экспрессии
ного эндотоксин-септического шока, полими-
miR-210 в моноцитах крови человека положи-
кробного сепсиса, воспроизведенного мето-
тельно коррелирует с возможностью развития
дом перевязки и дальнейшей пункции слепой
сепсиса, а увеличение концентрации этой же
кишки, и паразитарной инфекции, вызванной
мкРНК в сыворотке крови - со смертностью.
Trypanosoma brucei у мышей, показано, что в
Однако позже проведено другое проспектив-
ответ на воздействие патогенов наблюдалась
ное когортное исследование miR-210 как воз-
активация miR-210 в моноцитах и макрофагах,
можного биомаркера сепсиса [100]. На осно-
которая сопровождалась увеличением концен-
вании клинических данных пациентов делили
трации HIF-1α в сыворотке крови. Активация
на группы в соответствии с одним из подтипов
miR-210 приводит к подавлению митохондри-
сепсиса (альфа, бета, гамма и дельта), которые
ального дыхания за счет остановки трансля-
различаются по исходу и ответу на лечение.
ции белков ISCU, мРНК которых является
В ходе этого исследования показано, что уро-
мишенью для этой мкРНК. В результате этих
вень циркулирующей miR-210 был увеличен
метаболических изменений наблюдалась по-
в 3,6 раза независимо от подтипа сепсиса. Од-
ляризация макрофагов по провоспалительно-
нако после поправок на искажающие факторы
му М1-фенотипу. При последующей делеции
(использование некоторых лекарственных пре-
miR-210 и воспроизведении всех описанных
паратов или искусственной вентиляции легких)
выше инфекционных моделей наблюдалось
наиболее выраженное увеличение наблюдалось
более легкое течение воспаления со снижением
только при дельта-форме. Таким образом, по
уровней провоспалительных цитокинов IL-6
БИОХИМИЯ том 88 вып. 6 2023
926
СИЛИНА и др.
и TNF-α и повышением противовоспалитель-
не входила в число значимых молекул, что не
ного - IL-10 [98]. Авторы предполагают, что
подтверждает ее участие в формировании то-
делеция miR-210 приводит к неполной поля-
лерантности к противоопухолевой терапии
ризации макрофагов по М1-фенотипу, что
данным препаратом [111]. Таким образом, из
объясняет более легкое течение воспаления и
мкРНК, регулирующих ответ на гипоксию,
повышение выживаемости организмов. Сле-
наиболее изучена роль miR-210 в развитии как
довательно, повышенная экспрессия miR-210
локальных, так и системных воспалительных
как в сыворотке крови, так и в тканях способ-
процессов. Тем не менее точные механизмы
ствует более тяжелому течению системного
участия miR-210 в регуляции воспаления не-
воспалительного ответа.
достаточно изучены, так как исследования
При изучении различий в экспрессии
проводили на экспериментальных моделях
мкРНК в тканях толстой кишки из зон язвен-
разных воспалительных заболеваний, при
ных поражений и вне их при язвенном колите
этом не учитывалась исходная устойчивость
и болезни Крона была охарактеризована про-
организмов к гипоксии.
странственная связь в паттернах экспрессии
мкРНК между этими зонами. В биоптатах
толстой кишки с воспалением по сравнению
ЗАКЛЮЧЕНИЕ
с нормальной тканью показано статистически
значимое повышение экспрессии miR-155 как
Таким образом, ответ организма на гипок-
при язвенном колите, так и при болезни Кро-
сию осуществляется при участии транскрип-
на [107]. Кроме того, показано, что экспрессия
ционных факторов семейства HIF. Реакция
этой мкРНК в биоптатах слизистой оболочки
клеток на кратковременное или длительное ги-
толстой кишки у пациентов с активной ста-
поксическое воздействие регулируется разны-
дией язвенного колита статистически значимо
ми изоформами HIF, в переключении которых
выше, чем у здоровых людей [108].
участвуют мкРНК. Роль мкРНК в регуляции
При воспалительных заболеваниях кишеч-
клеточного ответа на гипоксию обусловлена
ника, в том числе язвенном колите, возрастает
их воздействием на мРНК генов, кодирую-
частота развития рака толстой кишки. При
щих HIF, влиянием на деградацию α-субъеди-
воспалении происходит активация NF-κB, ко-
ниц HIF и экспрессию белков, реализующих
торый имеет сайты связывания в некоторых
метаболический ответ на гипоксию - гликолиз,
мкРНК. При исследовании спектра экспрес-
окислительное фосфорилирование и др. В то
сии мкРНК в клетках рака толстой кишки
же время HIF также оказывает влияние на био-
наблюдалось повышение уровней экспрессии
генез мкРНК. Данные по изменению экспрес-
miR-210, miR-155 и miR-21, что объясняется
сии той или иной изоформы HIF и зависимых
наличием сайтов связывания NF-κB в их про-
белков противоречивы, поскольку исследова-
моторных областях [109]. В течение десяти-
ния проводят на разных клеточных линиях и
летий стандартным химиотерапевтическим пре-
видах экспериментальных животных, при раз-
паратом первой линии при колоректальном
ной концентрации кислорода и разной дли-
раке (КРР) является
5-фторурацил
(5-ФУ).
тельности гипоксического воздействия. Кроме
Несмотря на то что возможности лечения зло-
того, на экспрессию HIF может влиять ис-
качественных опухолей расширились за счет
ходная устойчивость изучаемых организмов
появления терапии 5-ФУ в сочетании с дру-
к гипоксии, что не учитывается при проведе-
гими химиотерапевтическими препаратами,
нии исследований. В то время как взаимосвязь
резистентность опухоли остается серьезной
HIF-1α и мкРНК достаточно полно охаракте-
проблемой [110]. Nijhuis et al. [111] изучали
ризована, механизмы взаимодействия HIF-2α
возникновение резистентности к 5-ФУ на кле-
и HIF-3α, а также HIF-1β с мкРНК изучены
точных линиях КРР и роль мкРНК в этом про-
недостаточно. Понимание механизмов взаимо-
цессе. Исследование проводили в течение 48 ч
связи HIF, гипоксии и мкРНК необходимо для
в условиях нормоксии (20,9% O2) и в условиях
разработки новых подходов к персонализиро-
гипоксии разной тяжести (1,0% и 0,2% O2).
ванной терапии заболеваний, сопровождаю-
Показано, что при недостатке кислорода ак-
щихся недостатком кислорода.
тивировались 6 мкРНК - miR-21, miR-210,
miR-30d, miR-320a, miR-320b и miR-320c, сре-
Вклад авторов. М.В.С. - анализ данных
ди которых наиболее высокий уровень был у
литературы, подготовка текста обзора и рисун-
miR-210. Однако при исследовании репер-
ков, Д.Ш.Д. - обсуждение собранных данных
туара мкРНК в опухолях больных КРР, рези-
и редактирование текста, О.В.М. - финальное
стентных к лечению 5-фторурацилом, miR-210
редактирование текста.
БИОХИМИЯ том 88 вып. 6 2023
микроРНК И КЛЕТОЧНЫЙ ОТВЕТ НА ГИПОКСИЮ
927
Финансирование. Работа выполнена и
Конфликт интересов. Авторы заявляют об
финансировалась в рамках бюджетной темы
отсутствии конфликта интересов.
122030200530-6 «Клеточные и молекулярно-
Соблюдение этических норм. Настоящая ста-
биологические механизмы воспаления в раз-
тья не содержит описания каких-либо исследо-
витии социально значимых заболеваний че-
ваний с участием людей или животных в каче-
ловека».
стве объектов.
СПИСОК ЛИТЕРАТУРЫ
1.
Semenza, G. L., and Wang, G. L. (1992) A nuclear
10.
Dzhalilova, D. S., Kosyreva, A. M., Diatroptov,
factor induced by hypoxia via de novo protein synthesis
M. E., Zolotova, N. A., Tsvetkov, I. S., Mkhitarov,
binds to the human erythropoietin gene enhancer
V. A., Makarova, O. V., and Khochanskiy, D. N.
at a site required for transcriptional activation, Mol.
(2019) Morphological characteristics of the thymus
Cell. Biol., 12, 5447-5454, doi: 10.1128/mcb.12.12.
and spleen and the subpopulation composition of
5447-5454.1992.
lymphocytes in peripheral blood during systemic
2.
Kaelin, W. G., and Ratcliffe, P. J. (2008) Oxygen
inflammatory response in male rats with different
sensing by metazoans: the central role of the HIF
resistance to hypoxia, Int. J. Inflam., 1, 7584685,
hydroxylase pathway, Mol. Cell,
30,
393-402,
doi: 10.1155/2019/7584685.
doi: 10.1016/j.molcel.2008.04.009.
11.
Dzhalilova, D. Sh., Zolotova, N. A., Polyakova,
3.
Semenza, G. L. (2010) Oxygen homeostasis, WIREs
M. A., Diatroptov, M. E., Dobrynina, M. T., and
Syst. Biol. Med., 2, 336-361, doi: 10.1002/wsbm.69.
Makarova, O. V. (2018) Morphological features of
4.
Hirota, K. (2020) Basic biology of hypoxic respons-
the inflammatory process and subpopulation pattern
es mediated by the transcription factor HIFs and
of peripheral blood lymphocytes during chronic
its implication for medicine, Biomedicines, 8, 32,
colitis in mice exhibiting different responses to
doi: 10.3390/biomedicines8020032.
hypoxia [in Russian], Clin. Exp. Morphol., 28, 13-20,
5.
Rius, J., Guma, M., Schachtrup, C., Akassoglou, K.,
doi: 10.31088/2226-5988-2018-28-4-13-20.
Zinkernagel, A. S., Nizet, V., Johnson, R. S., Haddad,
12.
Dzhalilova, D. Sh., Polyakova, M. A., Diatroptov,
G. G., and Karin, M. (2008) NF-kappaB links innate
M. E., Zolotova, N. A., and Makarova, O. V. (2018)
immunity to the hypoxic response through transcrip-
Morphological changes in the colon and composition
tional regulation of HIF-1alpha, Nature, 453, 807-
of peripheral blood lymphocytes in acute colitis in
811, doi: 10.1038/NATURE06905.
mice with different resistance to hypoxia [in Russian],
6.
Kosyreva, A. M., Dzhalilova, D. S., Makarova, O. V.,
Mol. Med., 16, 46-50, doi: 10.29296/24999490-2018-
Tsvetkov, I. S., Zolotova, N. A., Diatroptova, M. A.,
06-08.
Ponomarenko, E. A., Mkhitarov, V. A., Khochanskiy,
13.
Lytle, J. R., Yario, T. A., and Steitz, J. A. (2007) Target
D. N., and Mikhailova, L. P. (2020) Sex differences of
mRNAs are repressed as efficiently by microRNA-
inflammatory and immune response in pups of Wistar
binding sites in the 5′ UTR as in the 3′ UTR, Proc.
rats with SIRS, Sci. Rep., 10, 15884, doi: 10.1038/
Natl. Acad. Sci. USA, 104, 9667-9672, doi: 10.1073/
s41598-020-72537-y.
pnas.0703820104.
7.
Dzhalilova, D., Kosyreva, A., Vishnyakova, P., Zo-
14.
Burtscher, J., Mallet, R. T., Burtscher, M., and
lotova, N., Tsvetkov, I., Mkhitarov, V., Mikhailova, L.,
Millet, G. P.
(2021) Hypoxia and brain aging:
Kakturskiy, L., and Makarova, O. (2021) Age-related
Neurodegeneration or neuroprotection? Ageing Res.
differences in hypoxia-associated genes and cytokine
Rev., 68, 101343, doi: 10.1016/j.arr.2021.101343.
profile in male Wistar rats, Heliyon,
7, e08085,
15.
Semenza, G. L. (2012) Hypoxia-inducible factors
doi: 10.1016/j.heliyon.2021.e08085.
in physiology and medicine, Cell, 148, 399-408,
8.
Kirova, Y. I., Germanova, E. L., and Lukyanova, L. D.
doi: 10.1016/j.cell.2012.01.021.
(2013) Phenotypic features of the dynamics of HIF-1α
16.
Ledent, V., and Vervoort, M. (2001) The basic helix-
levels in rat neocortex in different hypoxia regimens,
loop-helix protein family: Comparative genomics
Bull. Exp. Biol. Med., 154, 718-722, doi: 10.1007/
and phylogenetic analysis, Genome Res., 11, 754-770,
S10517-013-2038-Z.
doi: 10.1101/gr.177001.
9.
Dzhalilova, D. S., Kosyreva, A. M., Diatroptov, M. E.,
17.
Hu, C.-J., Sataur, A., Wang, L., Chen, H., and Simon,
Ponomarenko, E. A., Tsvetkov, I. S., Zolotova, N. A.,
M. C. (2007) The N-terminal transactivation domain
Mkhitarov, V. A., Khochanskiy, D. N., and Makaro-
confers target gene specificity of hypoxia-inducible
va, O. V. (2019) Dependence of the severity of the
factors HIF-1α and HIF-2α, Mol. Biol. Cell, 18, 4528-
systemic inflammatory response on resistance to hy-
4542, doi: 10.1091/mbc.e06-05-0419.
poxia in male Wistar rats, J. Inflamm. Res., 12, 73-86,
18.
Ema, M. (1999) Molecular mechanisms of transcrip-
doi: 10.2147/JIR.S194581.
tion activation by HLF and HIF1alpha in response to
БИОХИМИЯ том 88 вып. 6 2023
928
СИЛИНА и др.
hypoxia: their stabilization and redox signal-induced
Acta Pharm. Sin. B,
5,
378-389, doi:
10.1016/J.
interaction with CBP/p300, EMBO J., 18, 1905-1914,
APSB.2015.05.007.
doi: 10.1093/emboj/18.7.1905.
30.
Cummins, E. P., Berra, E., Comerford, K. M.,
19.
Jaakkola, P., Mole, D. R., Tian, Y. M., Wilson,
Ginouves, A., Fitzgerald, K. T., Seeballuck, F.,
M. I., Gielbert, J., Gaskell, S. J., von Kriegsheim, A.,
Godson, C., Nielsen, J. E., Moynagh, P., Pouyssegur, J.,
Hebestreit, H. F., Mukherji, M., Schofield, C. J.,
and Taylor, C. T. (2006) Prolyl hydroxylase-1 neg-
Maxwell, P. H., Pugh, C. W., and Ratcliffe, P. J.
atively regulates IkappaB kinase-beta, giving insight
(2001) Targeting of HIF-α to the von Hippel-
into hypoxia-induced NFkappaB activity, Proc. Natl.
Lindau ubiquitylation complex by O2-regulated prolyl
Acad. Sci. USA,
103,
18154-18159, doi:
10.1073/
hydroxylation, Science, 292, 468-472, doi: 10.1126/
PNAS.0602235103.
science.1059796.
31.
Korbecki, J., Simińska, D., Gąssowska-Dobrowolska, M.,
20.
Haase, V. H. (2017) HIF-prolyl hydroxylases as ther-
Listos, J., Gutowska, I., Chlubek, D., and Bara-
apeutic targets in erythropoiesis and iron metabolism,
nowska-Bosiacka, I.
(2021) Chronic and cycling
Hemodial. Int., 21, S110-S124, doi: 10.1111/hdi.12567.
hypoxia: drivers of cancer chronic inflammation
21.
Maxwell, P. H., Wlesener, M. S., Chang, G. W.,
through HIF-1 and NF-κB activation: a review of the
Clifford, S. C., Vaux, E. C., Cockman, M. E., Wykoff,
molecular mechanisms, Int. J. Mol. Sci., 22, 10701,
C. C., Pugh, C. W., Maher, E. R., and Ratcliffe, P. J.
doi: 10.3390/IJMS221910701.
(1999) The tumour suppressor protein VHL targets
32.
Bandarra, D., Biddlestone, J., Mudie, S., Müller,
hypoxia-inducible factors for oxygen-dependent
H. A. J., and Rocha, S. (2015) HIF-1α restricts NF-κB-
proteolysis, Nature, 399, 271-275, doi: 10.1038/20459.
dependent gene expression to control innate immunity
22.
Ivan, M., Kondo, K., Yang, H., Kim, W., Valiando, J.,
signals, Dis. Model. Mech., 8, 169-181, doi: 10.1242/
Ohh, M., Salic, A., Asara, J. M., Lane, W. S., and
DMM.017285.
Kaelin, W. G., Jr. (2001) HIFα targeted for VHL-
33.
Chun, Y., and Kim, J. (2021) AMPK-mTOR signaling
Mediated destruction by proline hydroxylation:
and cellular adaptations in hypoxia, Int. J. Mol. Sci.,
implications for O2 sensing, Science, 292, 464-468,
22, 9765, doi: 10.3390/IJMS22189765.
doi: 10.1126/science.1059817.
34.
Inoki, K., Corradetti, M. N., and Guan, K. L. (2005)
23.
Van Uden, P., Kenneth, N. S., and Rocha, S. (2008)
Dysregulation of the TSC-mTOR pathway in human
Regulation of hypoxia-inducible factor-1alpha by
disease, Nat. Genet., 37, 19-24, doi: 10.1038/ng1494.
NF-kappaB, Biochem. J., 412, 477-484, doi: 10.1042/
35.
Kietzmann, T., Mennerich, D., and Dimova, E. Y.
BJ20080476.
(2016) Hypoxia-inducible factors (HIFs) and
24.
Van Uden, P., Kenneth, N. S., Webster, R., Müller,
phosphorylation: Impact on stability, localization, and
H. A., Mudie, S., and Rocha, S. (2011) Evolutionary
transactivity, Front. Cell Dev. Biol., 4, 11, doi: 10.3389/
conserved regulation of HIF-1β by NF-κB, PLoS
fcell.2016.00011.
Genet., 7, e1001285, doi: 10.1371/JOURNAL.PGEN.
36.
Leaman, D., Po, Y. C., Fak, J., Yalcin, A., Pearce, M.,
1001285.
Unnerstall, U., Marks, D. S., Sander, C., Tuschl, T.,
25.
Moniz, S., Biddlestone, J., and Rocha, S.
(2014)
and Gaul, U. (2005) Antisense-mediated depletion
Grow2: the HIF system, energy homeostasis and
reveals essential and specific functions of microRNAs
the cell cycle, Histol. Histopathol.,
29,
589-600,
in Drosophila development, Cell, 121, 1097-1108,
doi: 10.14670/HH-29.10.589.
doi: 10.1016/j.cell.2005.04.016.
26.
Koyasu, S., Kobayashi, M., Goto, Y., Hiraoka, M.,
37.
Pocock, R.
(2011) Invited review: decoding the
and Harada, H. (2018) Regulatory mechanisms of
microRNA response to hypoxia, Pflugers Arch., 461,
hypoxia-inducible factor 1 activity: two decades of
307-315, doi: 10.1007/s00424-010-0910-5.
knowledge, Cancer Sci., 109, 560-571, doi: 10.1111/
38.
Ke, Q., and Costa, M. (2006) Hypoxia-inducible
CAS.13483.
factor-1 (HIF-1), Mol. Pharmacol., 70, 1469-1480,
27.
Treins, C., Giorgetti-Peraldi, S., Murdaca, J.,
doi: 10.1124/mol.106.027029.
Semenza, G. L., and van Obberghen, E.
(2002)
39.
Tian, H., Hammer, R. E., Matsumoto, A. M., Russell,
Insulin stimulates hypoxia-inducible factor 1 through
D. W., and McKnight, S. L. (1998) The hypoxia-
a phosphatidylinositol 3-kinase/target of rapamycin-
responsive transcription factor EPAS1 is essential for
dependent signaling pathway, J. Biol. Chem., 277,
catecholamine homeostasis and protection against
27975-27981, doi: 10.1074/JBC.M204152200.
heart failure during embryonic development, Genes
28.
Dodd, K. M., Yang, J., Shen, M. H., Sampson, J. R.,
Dev., 12, 3320-3324, doi: 10.1101/gad.12.21.3320.
and Tee, A. R. (2015) mTORC1 drives HIF-1α and
40.
Appelhoffl, R. J., Tian, Y. M., Raval, R. R., Turley, H.,
VEGF-A signalling via multiple mechanisms involving
Harris, A. L., Pugh, C. W., Ratcliffe, P. J., and
4E-BP1, S6K1 and STAT3, Oncogene, 34, 2239-2250,
Gleadle, J. M. (2004) Differential function of the
doi: 10.1038/onc.2014.164.
prolyl hydroxylases PHD1, PHD2, and PHD3 in the
29.
Masoud, G. N., and Li, W. (2015) HIF-1α pathway:
regulation of hypoxia-inducible factor, J. Biol. Chem.,
role, regulation and intervention for cancer therapy,
279, 38458-38465, doi: 10.1074/jbc.M406026200.
БИОХИМИЯ том 88 вып. 6 2023
микроРНК И КЛЕТОЧНЫЙ ОТВЕТ НА ГИПОКСИЮ
929
41.
Koivunen, P., Hirsilä, M., Günzler, V., Kivirikko,
53.
Serocki, M., Bartoszewska, S., Janaszak-Jasiecka, A.,
K. I., and Myllyharju, J. (2004) Catalytic properties
Ochocka, R. J., Collawn, J. F., and Bartoszewski, R.
of the asparaginyl hydroxylase (FIH) in the oxygen
(2018) miRNAs regulate the HIF switch during
sensing pathway are distinct from those of its prolyl
hypoxia: a novel therapeutic target, Angiogenesis, 21,
4-hydroxylases, J. Biol. Chem.,
279,
9899-9904,
183-202, doi: 10.1007/S10456-018-9600-2.
doi: 10.1074/jbc.M312254200.
54.
Janaszak-Jasiecka, A., Bartoszewska, S., Kochan, K.,
42.
Befani, C., and Liakos, P. (2018) The role of hypoxia-
Piotrowski, A., Kalinowski, L., Kamysz, W., Ochocka,
inducible factor-2 alpha in angiogenesis, J. Cell.
R. J., Bartoszewski, R., and Collawn, J. F. (2016)
Physiol., 233, 9087-9098, doi: 10.1002/JCP.26805.
MiR-429 regulates the transition between Hypoxia-
43.
Taylor, S. E., Bagnall, J., Mason, D., Levy, R., Fernig,
inducible factor (HIF)1A and HIF3A expression
D. G., and See, V. (2016) Differential sub-nuclear
in human endothelial cells, Sci. Rep.,
6,
22775,
distribution of hypoxia-inducible factors (HIF)-1 and -2
doi: 10.1038/srep22775.
alpha impacts on their stability and mobility, Open
55.
Zhang, P., Yao, Q., Lu, L., Li, Y., Chen, P.-J., and
Biol., 6, 160195, doi: 10.1098/RSOB.160195.
Duan, C. (2014) Hypoxia-inducible factor 3 is an
44.
Duan, C. (2016) Hypoxia-inducible factor 3 biology:
oxygen-dependent transcription activator and regulates
complexities and emerging themes, Am. J. Physiol.
a distinct transcriptional response to hypoxia, Cell
Cell Physiol., 310, C260-C269, doi: 10.1152/ajpcell.
Rep., 6, 1110-1121, doi: 10.1016/j.celrep.2014.02.011.
00315.2015.
56.
Jaśkiewicz, M., Moszyńska, A., Serocki, M.,
45.
Ravenna, L., Salvatori, L., and Russo, M. A. (2016)
Króliczewski, J., Bartoszewska, S., Collawn, J. F.,
HIF3α: the little we know, FEBS J., 283, 993-1003,
and Bartoszewski, R. (2022) Hypoxia-inducible factor
doi: 10.1111/febs.13572.
(hif)-3α2 serves as an endothelial cell fate executor
46.
Pasanen, A., Heikkilä, M., Rautavuoma, K., Hirsilä, M.,
during chronic hypoxia, EXCLI J., 21, 454-469,
Kivirikko, K. I., and Myllyharju, J. (2010) Hypoxia-
doi: 10.17179/excli2021-4622.
inducible factor (HIF)-3alpha is subject to extensive
57.
Moszyńska, A., Jaśkiewicz, M., Serocki, M., Cabaj, A.,
alternative splicing in human tissues and cancer cells
Crossman, D. K., Bartoszewska, S., Gebert, M.,
and is regulated by HIF-1 but not HIF-2, Int. J.
Dąbrowski, M., Collawn, J. F., and Bartoszewski, R.
Biochem. Cell Biol., 42, 1189-1200, doi: 10.1016/
(2022) The hypoxia-induced changes in miRNA-
J.BIOCEL.2010.04.008.
mRNA in RNA-induced silencing complexes and
47.
Maynard, M. A., Qi, H., Chung, J., Lee, E. H. L.,
HIF-2 induced miRNAs in human endothelial cells,
Kondo, Y., Hara, S., Conaway, R. C., Conaway, J. W.,
FASEB J., 36, e22412, doi: 10.1096/fj.202101987R.
and Ohh, M. (2003) Multiple splice variants of the
58.
Bhaskaran, M., and Mohan, M. (2014) MicroRNAs:
human HIF-3α locus are targets of the von Hippel-
history, biogenesis, and their evolving role in animal
Lindau E3 ubiquitin ligase complex, J. Biol. Chem.,
development and disease, Vet. Pathol., 51, 759-774,
278, 11032-11040, doi: 10.1074/jbc.M208681200.
doi: 10.1177/0300985813502820.
48.
Loboda, A., Jozkowicz, A., and Dulak, J.
(2010)
59.
Nguyen, H. M., Nguyen, T. D., Nguyen, T. L., and
HIF-1 and HIF-2 transcription factors -similar but
Nguyen, T. A. (2019) Orientation of human micropro-
not identical, Mol. Cells, 29, 435-442, doi: 10.1007/
cessor on primary microRNAs, Biochemistry, 58, 189-
S10059-010-0067-2.
198, doi: 10.1021/acs.biochem.8b00944.
49.
Kalinowski, L., Janaszak-Jasiecka, A., Siekierzycka, A.,
60.
Lund, E., Güttinger, S., Calado, A., Dahlberg, J. E.,
Bartoszewska, S., Woźniak, M., Lejnowski, D.,
and Kutay, U. (2004) Nuclear export of microRNA
Collawn, J. F., and Bartoszewski, R. (2016) Post-
precursors, Science,
303,
95-98, doi:
10.1126/
transcriptional and transcriptional regulation of
science.1090599.
endothelial nitric-oxide synthase during hypoxia:
61.
Bartel, D. P. (2018) Metazoan microRNAs, Cell, 173,
the role of microRNAs, Cell. Mol. Biol. Lett., 21, 16,
20-51, doi: 10.1016/j.cell.2018.03.006.
doi: 10.1186/S11658-016-0017-X.
62.
Kalla, R., Ventham, N. T., Kennedy, N. A., Quintana,
50.
Keith, B., Johnson, R. S., and Simon, M. C. (2011)
J. F., Nimmo, E. R., Buck, A. H., and Satsangi, J.
HIF1α and HIF2α: sibling rivalry in hypoxic tumour
(2015) MicroRNAs: new players in IBD, Gut, 64, 504-
growth and progression, Nat. Rev. Cancer, 12, 9-22,
513, doi: 10.1136/gutjnl-2014-307891.
doi: 10.1038/NRC3183.
63.
Ambros, V., Bartel, B., Bartel, D. P., Burge, C. B.,
51.
Koh, M. Y., and Powis, G. (2012) Passing the baton:
Carrington, J. C., Chen, X., Dreyfuss, G., Eddy,
the HIF switch, Trends Biochem. Sci., 37, 364-372,
S. R., Griffiths-Jones, S., Marshall, M., Matzke,
doi: 10.1016/J.TIBS.2012.06.004.
M., Ruvkun, G., and Tuschl, T. (2003) A uniform
52.
Heikkilä, M., Pasanen, A., Kivirikko, K. I., and
system for microRNA annotation, RNA, 9, 277-279,
Myllyharju, J. (2011) Roles of the human hypoxia-
doi: 10.1261/RNA.2183803.
inducible factor (HIF)-3α variants in the hypoxia
64.
Griffiths-Jones, S. (2004) The microRNA registry,
response, Cell. Mol. Life Sci.,
68,
3885-3901,
Nucleic Acids Res., 32, D109-D111, doi: 10.1093/
doi: 10.1007/s00018-011-0679-5.
NAR/GKH023.
БИОХИМИЯ том 88 вып. 6 2023
930
СИЛИНА и др.
65.
Zaporozhchenko, I. A., Rykova, E. Y., and Laktionov,
HIF-1α promotes the migration and invasion of
P. P. (2020) The fundamentals of miRNA biology:
cancer-associated fibroblasts by miR-210, Aging Dis.,
structure, biogenesis, and regulatory functions,
12, 1794, doi: 10.14336/AD.2021.0315.
Russ. J. Bioorg. Chem.,
46,
1-13, doi:
10.1134/
76.
Camps, C., Buffa, F. M., Colella, S., Moore, J.,
S106816202001015X.
Sotiriou, C., Sheldon, H., Harris, A. L., Gleadle,
66.
Brosnan, C. A., Palmer, A. J., and Zuryn, S. (2021)
J. M., and Ragoussis, J. (2008) hsa-miR-210 Is
Cell-type-specific profiling of loaded miRNAs from
induced by hypoxia and is an independent prognostic
Caenorhabditis elegans reveals spatial and temporal
factor in breast cancer, Clin. Cancer Res., 14, 1340-
flexibility in Argonaute loading, Nat. Commun., 12,
1348, doi: 10.1158/1078-0432.CCR-07-1755.
2194, doi: 10.1038/s41467-021-22503-7.
77.
Ju, C., Wang, M., Tak, E., Kim, B., Emontzpohl, C.,
67.
Selbach, M., Schwanhäusser, B., Thierfelder, N.,
Yang, Y., Yuan, X., Kutay, H., Liang, Y., Hall, D. R.,
Fang, Z., Khanin, R., and Rajewsky, N.
(2008)
Dar, W. A., Bynon, J. S., Carmeliet, P., Ghoshal, K.,
Widespread changes in protein synthesis induced
and Eltzschig, H. K. (2021) Hypoxia-inducible factor-
by microRNAs, Nature, 455, 58-63, doi: 10.1038/
1α-dependent induction of miR122 enhances hepatic
nature07228.
ischemia tolerance, J. Clin. Invest., 131, e140300,
68.
Froehlich, J. J., Uyar, B., Herzog, M., Theil, K.,
140300-140300, doi: 10.1172/JCI140300.
Glažar, P., Akalin, A., and Rajewsky, N.
(2021)
78.
Coronel-Hernández, J., Delgado-Waldo, I., Cantú de
Parallel genetics of regulatory sequences using
León, D., López-Camarillo, C., Jacobo-Herrera, N.,
scalable genome editing in vivo, Cell Rep., 35, 108988,
Ramos-Payán, R., and Pérez-Plasencia, C. (2022)
doi: 10.1016/j.celrep.2021.108988.
HypoxaMIRs: key regulators of hallmarks of colorectal
69.
Peng, X., Gao, H., Xu, R., Wang, H., Mei, J., and
cancer, Cells, 11, 1895, doi: 10.3390/CELLS11121895.
Liu, C. (2020) The interplay between HIF-1α and
79.
Ivanova, I. G., Park, C. V., and Kenneth, N. S. (2019)
noncoding RNAs in cancer, J. Exp. Clin. Cancer Res.,
Translating the hypoxic response - the role of HIF
39, 27, doi: 10.1186/S13046-020-1535-Y.
protein translation in the cellular response to low
70.
Camps, C., Saini, H. K., Mole, D. R., Choudhry, H.,
oxygen, Cells, 8, 114, doi: 10.3390/CELLS8020114.
Reczko, M., Guerra-Assunção, J. A., Tian, Y. M.,
80.
Yamakuchi, M., Lotterman, C. D., Bao, C., Hruban,
Buffa, F. M., Harris, A. L., Hatzigeorgiou, A. G.,
R. H., Karim, B., Mendell, J. T., Huso, D., and
Enright, A. J., and Ragoussis, J. (2014) Integrated
Lowenstein, C. J. (2010) P53-induced microRNA-107
analysis of microRNA and mRNA expression and
inhibits HIF-1 and tumor angiogenesis, Proc. Natl.
association with HIF binding reveals the complexity of
Acad. Sci. USA,
107,
6334-6339, doi:
10.1073/
microRNA expression regulation under hypoxia, Mol.
pnas.0911082107.
Cancer, 13, 28, doi: 10.1186/1476-4598-13-28.
81.
Cha, S. T., Chen, P. S., Johansson, G., Chu, C. Y.,
71.
Xiong, G., Stewart, R. L., Chen, J., Gao, T., Scott,
Wang, M. Y., Jeng, Y. M., Yu, S. L., Chen, J. S.,
T. L., Samayoa, L. M., O’Connor, K., Lane, A. N.,
Chang, K. J., Jee, S. H., Tan, C. T., Lin, M. T.,
and Xu, R. (2018) Collagen prolyl 4-hydroxylase 1
and Kuo, M. L. (2010) MicroRNA-519c suppress-
is essential for HIF-1α stabilization and TNBC
es hypoxia-inducible factor-1alpha expression and
chemoresistance, Nat. Commun., 9, 4456, doi: 10.1038/
tumor angiogenesis, Cancer Res.,
70,
2675-2685,
S41467-018-06893-9.
doi: 10.1158/0008-5472.CAN-09-2448.
72.
Dzhalilova, D. Sh., and Makarova, O. V.
(2021)
82.
Ghosh, G., Subramanian, I. V., Adhikari, N.,
HIF-Dependent mechanisms of relationship be-
Zhang, X., Joshi, H. P., Basi, D., Chandrashekhar,
tween hypoxia tolerance and tumor development,
Y. S., Hall, J. L., Roy, S., Zeng, Y., and Ramakrish-
Biochemistry (Moscow), 86, 1163-1180, doi: 10.1134/
nan, S. (2010) Hypoxia-induced microRNA-424 ex-
S0006297921100011.
pression in human endothelial cells regulates HIF-α
73.
Martinez, S. R., Ma, Q., Dasgupta, C., Meng, X.,
isoforms and promotes angiogenesis, J. Clin. Invest.,
and Zhang, L.
(2017) MicroRNA-210 suppresses
120, 4141-4154, doi: 10.1172/JCI42980.
glucocorticoid receptor expression in response to
83.
Chan, S. Y., Zhang, Y. Y., Hemann, C., Mahoney,
hypoxia in fetal rat cardiomyocytes, Oncotarget, 8,
C. E., Zweier, J. L., and Loscalzo, J.
(2009)
80249, doi: 10.18632/ONCOTARGET.17801.
MicroRNA-210 controls mitochondrial metabolism
74.
Fasanaro, P., D’Alessandra, Y., di Stefano, V.,
during hypoxia by repressing the iron-sulfur cluster
Melchionna, R., Romani, S., Pompilio, G., Capo-
assembly proteins ISCU1/2, Cell Metab., 10, 273-284,
grossi, M. C., and Martelli, F. (2008) MicroRNA-210
doi: 10.1016/j.cmet.2009.08.015.
modulates endothelial cell response to hypoxia and
84.
Hui, X., Al-Ward, H., Shaher, F., Liu, C. Y., and
inhibits the receptor tyrosine kinase ligand ephrin-A3,
Liu, N. (2020) The role of miR-210 in the biological
J. Biol. Chem.,
283,
15878-15883, doi:
10.1074/
system: a current overview, Hum. Hered., 84, 233-239,
jbc.M800731200.
doi: 10.1159/000509280.
75.
Yang, Y., Gu, J., Li, X., Xue, C., Ba, L., Gao, Y.,
85.
Taguchi, A., Yanagisawa, K., Tanaka, M., Cao, K.,
Zhou, J., Bai, C., Sun, Z., and Zhao, R. C. (2021)
Matsuyama, Y., Goto, H., and Takahashi, T. (2008)
БИОХИМИЯ том 88 вып. 6 2023
микроРНК И КЛЕТОЧНЫЙ ОТВЕТ НА ГИПОКСИЮ
931
Identification of hypoxia-inducible factor-1A as
genetic analysis of elongin B and C, Rbx1 and HIF-1α
a novel target for miR-17-92 microRNA cluster,
in renal cell carcinoma, Oncogene, 20, 5067-5074,
Cancer Res., 68, 5540-5545, doi: 10.1158/0008-5472.
doi: 10.1038/sj.onc.1204602.
CAN-07-6460.
96. Mizuno, Y., Tokuzawa, Y., Ninomiya, Y., Yagi, K.,
86.
Yang, D., Wang, J., Xiao, M., Zhou, T., and Shi, X.
Yatsuka-Kanesaki, Y., Suda, T., Fukuda, T., Katagiri,
(2016) Role of mir-155 in controlling HIF-1α level
T., Kondoh, Y., Amemiya, T., Tashiro, H., and Oka-
and promoting endothelial cell maturation, Sci. Rep.,
zaki, Y. (2009) miR-210 promotes osteoblastic differ-
6, 1-10, doi: 10.1038/srep35316.
entiation through inhibition of AcvR1b, FEBS Lett.,
87.
Li, Y., Su, J., Li, F., Chen, X., and Zhang, G. (2017)
583, 2263-2268, doi: 10.1016/j.febslet.2009.06.006.
MiR-150 regulates human keratinocyte proliferation
97. Rouault, T. A., and Tong, W. H. (2008) Iron-sulfur
in hypoxic conditions through targeting HIF-1α
cluster biogenesis and human disease, Trends Genet.,
and VEGFA: Implications for psoriasis treatment,
24, 398-407, doi: 10.1016/j.tig.2008.05.008.
PLoS One, 12, e0175459, doi: 10.1371/JOURNAL.
98. Virga, F., Cappellesso, F., Stijlemans, B., Henze, A. T.,
PONE.0175459.
Trotta, R., Van Audenaerde, J., Mirchandani, A. S.,
88.
Yang, B., Xu, Y., Hu, Y., Luo, Y., Lu, X., Tsui, C. K.,
Sanchez-Garcia, M. A., Vandewalle, J., Orso, F.,
Lu, L., and Liang, X. (2016) Madecassic acid protects
Riera-Domingo, C., Griffa, A., Ivan, C., Smits, E.,
against hypoxia-induced oxidative stress in retinal
Laoui, D., Martelli, F., Langouche, L., Van den
microvascular endothelial cells via ROS-mediated
Berghe, G., Feron, O., Ghesquière, B., Prenen, H.,
endoplasmic reticulum stress, Biomed. Pharmacother.,
Libert, C., Walmsley, S. R., Corbet, C., Van
84, 845-852, doi: 10.1016/J.BIOPHA.2016.10.015.
Ginderachter, J. A., Ivan, M., Taverna, D., and
89.
Liang, H., Xiao, J., Zhou, Z., Wu, J., Ge, F., Li, Z.,
Mazzone, M. (2021) Macrophage miR-210 induction
Zhang, H., Sun, J., Li, F., Liu, R., and Chen, C.
and metabolic reprogramming in response to pathogen
(2018) Hypoxia induces miR-153 through the IRE1α-
interaction boost life-threatening inflammation, Sci.
XBP1 pathway to fine tune the HIF1α/VEGFA axis in
Adv., 7, eabf0466, doi: 10.1126/sciadv.abf0466.
breast cancer angiogenesis, Oncogene, 37, 1961-1975,
99. Del Mauro, J. S., Prince, P. D., Santander Plantamura,
doi: 10.1038/s41388-017-0089-8.
Y., Allo, M. A., Parola, L., Fernandez Machulsky, N.,
90.
Mathew, L. K., Lee, S. S., Skuli, N., Rao, S.,
Morettón, M. A., Bin, E. P., González, G. E., Bertera,
Keith, B., Nathanson, K. L., Lal, P., and Simon,
F. M., Carranza, A., Berg, G., Taira, C. A., Donato, M.,
M. C. (2014) Restricted expression of miR-30c-2-3p
Chiappetta, D. A., Polizio, A. H., and Höcht, C.
and miR-30a-3p in clear cell renal cell carcinomas
(2021) Nebivolol is more effective than atenolol for
enhances HIF2α activity, Cancer Discov., 4, 53-60,
blood pressure variability attenuation and target organ
doi: 10.1158/2159-8290.CD-13-0291.
damage prevention in L-NAME hypertensive rats,
91.
Zhang, H., Pu, J., Qi, T., Qi, M., Yang, C.,
Hypertens. Res., 44, 791-802, doi: 10.1038/s41440-021-
Li, S., Huang, K., Zheng, L., and Tong, Q. (2012)
00630-4.
MicroRNA-145 inhibits the growth, invasion,
100. Powell, R. E., Tai, Y. Y., Kennedy, J. N., Seymour,
metastasis and angiogenesis of neuroblastoma cells
C. W., and Chan, S. Y. (2022) Circulating hypoxia-
through targeting hypoxia-inducible factor 2 alpha,
dependent miR-210 is increased in clinical sepsis
Oncogene, 33, 387-397, doi: 10.1038/onc.2012.574.
subtypes: A cohort study, J. Transl. Med., 20, 448,
92.
Bartoszewska, S., Kochan, K., Piotrowski, A.,
doi: 10.1186/s12967-022-03655-6.
Kamysz, W., Ochocka, R. J., Collawn, J. F., and
101. Alfaifi, J., Germain, A., Heba, A. C., Arnone, D.,
Bartoszewski, R.
(2015) The hypoxia-inducible
Gailly, L., Ndiaye, N. C., Viennois, E., Caron, B.,
miR-429 regulates hypoxia-inducible factor-1α ex-
Peyrin-Biroulet, L., and Dreumont, N. (2022) Deep
pression in human endothelial cells through a negative
dive into microRNAs in inflammatory bowel disease,
feedback loop, FASEB J., 29, 1467-1479, doi: 10.1096/
Inflamm. Bowel Dis., doi: 10.1093/ibd/izac250.
fj.14-267054.
102. Paraskevi, A., Theodoropoulos, G., Papaconstantinou, I.,
93.
Prives, C., and Hall, P. A. (1999) The p53 pathway,
Mantzaris, G., Nikiteas, N., and Gazouli, M. (2012)
J. Pathol., 187, 112-126, doi: 10.1002/(SICI)1096-9896
Circulating MicroRNA in inflammatory bowel
(199901)187:1<112::AID-PATH250>3.0.CO;2-3.
disease, J. Crohns Colitis, 6, 900-904, doi: 10.1016/
94.
Deng, B., Du, J., Hu, R., Wang, A. P., Wu,
j.crohns.2012.02.006.
W. H., Hu, C. P., Li, Y. J., and Li, X. H. (2016)
103. Viennois, E., Zhao, Y., Han, M. K., Xiao, B., Zhang,
MicroRNA-103/107 is involved in hypoxia-induced
M., Prasad, M., Wang, L., and Merlin, D. (2017)
proliferation of pulmonary arterial smooth muscle
Serum miRNA signature diagnoses and discriminates
cells by targeting HIF-1β, Life Sci., 147, 117-124,
murine colitis subtypes and predicts ulcerative colitis
doi: 10.1016/J.LFS.2016.01.043.
in humans, Sci. Rep., 7, 2520, doi: 10.1038/s41598-
95.
Clifford, S. C., Astuti, D., Hooper, L., Maxwell, P. H.,
017-02782-1.
Ratcliffe, P. J., and Maher, E. R. (2001) The pVHL-
104. Yan, Y., Kolachala, V., Dalmasso, G., Nguyen, H.,
associated SCF ubiquitin ligase complex: molecular
Laroui, H., Sitaraman, S. V., and Merlin, D. (2009)
БИОХИМИЯ том 88 вып. 6 2023
932
СИЛИНА и др.
Temporal and spatial analysis of clinical and molecular
colonic mucosa of patients with active ulcerative
parameters in dextran sodium sulfate induced
colitis, J. Gastroenterol. Hepatol.,
25, S129-S133,
colitis, PLoS One, 4, e6073, doi: 10.1371/journal.
doi: 10.1111/j.1440-1746.2009.06216.x.
pone.0006073.
109. Bakirtzi, K., Hatziapostolou, M., Karagiannides, I.,
105. Vijay-Kumar, M., Sanders, C. J., Taylor, R. T.,
Polytarchou, C., Jaeger, S., Iliopoulos, D., and
Kumar, A., Aitken, J. D., Sitaraman, S. V., Neish,
Pothoulakis, C. (2011) Neurotensin signaling activates
A. S., Uematsu, S., Akira, S., Williams, I. R., and
microRNAs-21 and -155 and Akt, promotes tumor
Gewirtz, A. T. (2007) Deletion of TLR5 results in
growth in mice, and is increased in human colon tu-
spontaneous colitis in mice, J. Clin. Invest., 117, 3909-
mors, Gastroenterology, 141, 1749-1761, doi: 10.1053/
3921, doi: 10.1172/JCI33084.
j.gastro.2011.07.038.
106. Kühn, R., Löhler, J., Rennick, D., Rajewsky, K.,
110. Temraz, S., Mukherji, D., Alameddine, R., and
and Müller, W. (1993) Interleukin-10-deficient mice
Shamseddine, A.
(2014) Methods of overcom-
develop chronic enterocolitis, Cell,
75,
263-274,
ing treatment resistance in colorectal cancer, Crit.
doi: 10.1016/0092-8674(93)80068-p.
Rev. Oncol. Hematol., 89, 217-230, doi: 10.1016/j.
107. Schaefer, J. S., Attumi, T., Opekun, A. R., Abraham, B.,
critrevonc.2013.08.015.
Hou, J., Shelby, H., Graham, D. Y., Streckfus, C., and
111. Nijhuis, A., Thompson, H., Adam, J., Parker, A.,
Klein, J. R. (2015) MicroRNA signatures differentiate
Gammon, L., Lewis, A., Bundy, J. G., Soga, T.,
Crohn’s disease from ulcerative colitis, BMC Immunol.,
Jalaly, A., Propper, D., Jeffery, R., Suraweera, N.,
16, 5, doi: 10.1186/s12865-015-0069-0.
McDonald, S., Thaha, M. A., Feakins, R., Lowe, R.,
108. Takagi, T., Naito, Y., Mizushima, K., Hirata, I.,
Bishop, C. L., and Silver, A. (2017) Remodelling of
Yagi, N., Tomatsuri, N., Ando, T., Oyamada, Y.,
microRNAs in colorectal cancer by hypoxia alters
Isozaki, Y., Hongo, H., Uchiyama, K., Handa, O.,
metabolism profiles and 5-fluorouracil resistance,
Kokura, S., Ichikawa, H., and Yoshikawa, T. (2010)
Hum. Mol. Genet.,
26,
1552-1564, doi:
10.1093/
Increased expression of microRNA in the inflamed
hmg/ddx059.
THE ROLE OF microRNA IN THE REGULATION
OF CELLULAR RESPONSES TO HYPOXIA
Review
M. V. Silina1*, D. Sh. Dzhalilova1, and O. V. Makarova1,2
1 Avtsyn Research Institute of Human Morphology, Petrovsky National Research Centre of Surgery,
117418 Moscow, Russia; e-mail: marusyasilina99@yandex.ru
2 Faculty of Biology, Lomonosov Moscow State University, 119234 Moscow, Russia
The impact of hypoxia causes changes in the transcription of genes that contribute to the adaptation of
cells to a lack of oxygen. The main mechanism regulating the cellular response to hypoxia is the activation
of a group of transcription factors of the HIF (Hypoxia-Inducible Factor) family, which include several
isoforms and control the expression of more than a thousand genes. HIF activity is regulated at various
levels, including by small non-coding RNA molecules called microRNAs (miRNAs). miRNAs regulate the
cellular response to hypoxia by influencing the activation of HIF, its degradation, and the translation of
proteins dependent on it. At the same time, HIF also affects miRNA biogenesis. Data on the relationship
of a particular HIF isoform with miRNA are contradictory, since studies are performed using different cell
lines, different types of experimental animals and clinical material, as well as at different oxygen concentra-
tions and different durations of hypoxic exposure. In addition, HIF expression may be affected by the initial
resistance of organisms to lack of oxygen, which is not taken into account in studies. This review ana-
lyzes data on the effect of hypoxia on the biogenesis and functioning of miRNAs, as well as the effect of
microRNAs on mRNAs of genes involved in adaptation to oxygen deficiency. Understanding the mech-
anisms of the relationship between HIF, hypoxia, and miRNA is necessary to develop new approaches
to personalized therapy for diseases accompanied by oxygen deficiency.
Keywords: hypoxia, microRNA, HIF
БИОХИМИЯ том 88 вып. 6 2023