БИОХИМИЯ, 2023, том 88, вып. 6, с. 933 - 946
УДК 577.25
ЭФФЕКТЫ ДЛИТЕЛЬНОГО КОМБИНИРОВАННОГО
ВВЕДЕНИЯ КЕТАНСЕРИНА И ФЛУОКСЕТИНА МЫШАМ
РЕКОМБИНАНТНОЙ ЛИНИИ B6.CBA-D13Mit76C,
ОТЛИЧАЮЩИМСЯ ИЗМЕНЁННОЙ ЧУВСТВИТЕЛЬНОСТЬЮ
5-НТ1А-РЕЦЕПТОРОВ
© 2023 А.С. Цыбко*#, Е.М. Кондаурова#, Е.А. Заливина, В.О. Благиня, В.С. Науменко
Федеральный исследовательский центр Институт цитологии и генетики СО РАН,
630090 Новосибирск, Новосибирская обл., Россия; электронная почта: antoncybko@mail.ru
Поступила в редакцию 15.03.2023
После доработки 11.04.2023
Принята к публикации 12.04.2023
Рекомбинантная линия мышей B6.CBA-D13Mit76C отличается изменённой чувствительностью
5-HT1A-рецепторов и усиленной транскрипцией кодирующего их гена. Недавно нами было обна-
ружено, что хроническое введение классического антидепрессанта флуоксетина мышам B6.CBA-
D13Mit76C оказывает про-депрессивный эффект в тесте «принудительное плавание». Поскольку
известно, что блокада 5-НТ2А-рецепторов может быть благотворной при терапии устойчивой
к антидепрессантам депрессии, мы оценили эффект длительного введения (14 дней внутрибрю-
шинно) селективного антагониста 5-НТ2А-рецепторов кетансерина (0,5 мг/кг), антидепрессанта
флуоксетина (20 мг/кг) или комбинации флуоксетин + кетансерин на поведение, функциональную
активность 5-НТ1А- и 5-НТ2А-рецепторов, обмен серотонина (5-HT) и транскрипцию ключевых
генов серотониновой системы в мозге мышей B6.CBA-D13Mit76C. Кетансерин не отменил про-
депрессивный эффект флуоксетина, хотя кетансерин, флуоксетин и их комбинация снизили функ-
циональную активность 5-НТ1А-рецепторов и транскрипцию гена Htr1a в гиппокампе и среднем
мозге. Кроме того, все использованные препараты снизили уровни мРНК Slc6a4 и Maoa в сред-
нем мозге. Эти изменения не сопровождались существенными изменениями в уровнях 5-HT и его
основного метаболита, 5-гидроксииндолуксусной кислоты. Однако кетансерин усилил активность
ключевого фермента синтеза 5-HT в мозге - триптофангидроксилазы-2 (ТПГ-2). Таким образом,
несмотря на некоторые позитивные эффекты (снижение транскрипции Htr1a, Slc6a4 и Maoa и уси-
ление активности ТПГ-2), длительная блокада 5-НТ2А-рецепторов не способна облегчить неблаго-
приятное действие классического антидепрессанта флуоксетина при аберрантном функциониро-
вании 5-НТ1А-рецепторов.
КЛЮЧЕВЫЕ СЛОВА: 5-HT1A-рецептор, 5-HT2A-рецептор, ТПГ-2, флуоксетин, кетансерин, устойчивость
к антидепрессантам.
DOI: 10.31857/S0320972523060040, EDN: EELHUV
ВВЕДЕНИЕ
ный ответ на классические антидепрессанты,
такие как селективные ингибиторы обратного
Сегодня одним из главных вызовов для
захвата серотонина (СИОЗС), обычно приме-
фармакотерапии большого депрессивного рас-
няемые в качестве лечения первой линии [1].
стройства является терапевтически резистент-
Устойчивость к СИОЗС имеет комплексную
ная депрессия (ТРД). По данным многочис-
природу, и серотониновая
(5-НТ) система,
ленных исследований, больше трети, если не
очевидно, играет здесь одну из важнейших
половина пациентов, демонстрирует неадекват- ролей. Помимо таких ключевых компонентов
Принятые сокращения: 5-ГИУК - 5-гидроксииндолуксусная кислота; СИОЗС - селективные ингибиторы обрат-
ного захвата серотонина; ТПГ-2 - триптофангидроксилаза-2; ТРД -терапевтически резистентная депрессия; 5-HT -
серотонин или гидрокситриптамин (5-hydroxytriptamine); 5-НТ1А - серотониновый рецептор 1А-подтипа; 5-НТ2А -
серотониновый рецептор 2А-подтипа.
* Адресат для корреспонденции.
# Авторы внесли равнозначный вклад в работу.
933
934
ЦЫБКО и др.
5-НТ системы, как триптофангидроксилаза-2
ковую активность в ответ на обработку 5-HT,
(ТПГ-2), транспортёр 5-HT (5-НТТ) и моно-
поскольку отличаются избыточной экспресси-
аминоксидаза А (МАОА), в механизмы нечув-
ей 5-HT2A-рецепторов [19]. Кетансерин (селек-
ствительности/устойчивости к СИОЗС также
тивный антагонист
5-HT2A-рецепторов) эф-
вовлечён серотониновый рецептор 1А-подтипа
фективно нормализует 5-HT-индуцированную
(5-HT1A) [2-4].
электрическую активность нейронов пациен-
Серотониновые рецепторы
2A-подтипа
тов с ТРД [19].
(5-HT2A) представляют отдельный интерес, по-
Неудивительно, что 5-HT2A-рецепторы рас-
скольку обладают свойствами, выделяющими
сматриваются в качестве важной мишени для
их на фоне остальных 5-НТ рецепторов. На-
фармакотерапии депрессивных расстройств.
пример, из-за локализации на различных ти-
Частью механизма действия СИОЗС является
пах нейронов 5-НТ2А-рецепторы способны ре-
связывание с 5-HT2A-рецепторами и их блока-
гулировать секрецию глутамата, дофамина и
да [20, 21]. Селективные антагонисты 5-HT2A-
гамма-аминомасляной кислоты (ГАМК) [5, 6].
рецепторов, такие как M100907, нефазодон и
Локализованные во фронтальной коре 5-НТ2А-
метерголин, демонстрируют антидепрессант-
рецепторы могут запускать механизм отри-
подобный эффект путём подавления обрат-
цательной обратной связи, ингибирующий
ного захвата 5-HT и модуляции секреции дру-
секрецию 5-НТ серотонинергическими нейро-
гих нейротрансмиттеров в префронтальной
нами дорсального шва [7]. Было установлено,
коре [22-24]. В ряде открытых и плацебо-кон-
что 5-НТ2А-рецепторы могут быть конститу-
тролируемых испытаний было показано, что
тивно активны и в таком состоянии активи-
антидепрессанты и антипсихотические препа-
руют внутриклеточные сигнальные каскады
раты, которые обладают способностью блоки-
в отсутствии стимулирующего лиганда
[8].
ровать 5-HT2A-рецепторы, усиливают клини-
Поскольку десенситизация
5-НТ2А-рецепто-
ческую эффективность СИОЗС у пациентов
ров может осуществляться не только агони-
с ТРД [21, 24-28].
стами, но также и антагонистами, фармако-
Для того чтобы преодолеть ограничения,
логические свойства данных рецепторов рез-
накладываемые клиническими испытаниями,
ко отличаются от таковых у остальных подти-
для изучения нейробиологической основы
пов [4, 9, 10]. Известно, что 5-HT2A-рецепторы
ТРД и проверки новых терапевтических стра-
образуют гетеромерные комплексы in vivo с
тегий следует активно прибегать к доклини-
5-HT2B-, 5-HT2C- [11], дофаминовыми D2- [12]
ческим моделям депрессивных расстройств.
и mGlu2-рецепторами [13]. 5-HT1A- и 5-HT2A-
Недавно нами была создана рекомбинантная
рецепторы способны модулировать функцио-
линия мышей B6.CBA-D13Mit76C (B6-M76C),
нальную активность друг друга [14], поэтому
полученная путём переноса дистального фраг-
существование гетеромерных комплексов ме-
мента хромосомы 13 (102,73-118,83 Mпн) из
жду этими рецепторами [15, 16] представляет
генома мышей CBA на генетический бэкграунд
особый интерес. Во фронтальной коре акти-
линии C57BL/6J [29, 30]. Полученная линия
вация 5-НТ2А-протомера снижает аффинность
характеризуется изменённой чувствительно-
5-НТ1А-рецептора к лиганду в гетеродимерах
стью 5-HT1A-рецепторов в ответ на хрониче-
5-НТ1А-5-НТ2А, что подчёркивает доминирую-
ское введение агониста рецептора 8-OH-DPAT
щее положение 5-НТ2А-рецепторов в подоб-
и большей транскрипцией гена Htr1a в гиппо-
ных комплексах in vivo [15].
кампе [29]. Кроме того, мыши B6-M76C де-
Растущее число свидетельств указывает
монстрируют замедленный катаболизм 5-HT в
на вовлечение 5-HT2A-рецепторов в патоге-
гиппокампе [29] и меньший объём стриатума,
нез ТРД. Недавний мета-анализ 42 исследова-
мозжечка и эпифиза [31]. Ранее нами было об-
ний показал, что полиморфизмы 1438A/G и
наружено, что хроническое введение СИОЗС
rs7997012G/A в гене HTR2A ассоциированы с
флуоксетина вызывает у мышей B6-M76C про-
ответом на антидепрессанты [17]. Ранее было
депрессивный эффект в тесте «принудительное
показано, что плотность 5-HT2A-рецепторов
плавание» (forced swim test) [30]. Эти резуль-
ниже в дорсальной префронтальной коре па-
таты вместе с данными о нарушенной функ-
циентов с ТРД по сравнению со здоровыми
циональной активности 5-HT1A-рецепторов в
субъектами и пациентами, не получавшими
мозге мышей B6-M76C предполагают исполь-
медикаментозного лечения [18]. С другой сто-
зование данных животных в качестве модели
роны, нейроны переднего мозга, полученные
устойчивости к антидепрессантам [30].
из индуцированных плюрипотентных ство-
Для проверки идеи о том, что блокада
ловых клеток пациентов, не отвечающих на
5-HT2A-рецептора может улучшить неблаго-
СИОЗС, демонстрируют повышенную спай-
приятное действие СИОЗС в модели ТРД,
БИОХИМИЯ том 88 вып. 6 2023
РОЛЬ 5-НТ1А-РЕЦЕПТОРОВ В ОТВЕТЕ НА АНТИДЕПРЕССАНТЫ
935
мы исследовали влияние хронического введе-
(9 мышей в группе), их комбинации (8 мышей
ния классического СИОЗС флуоксетина, се-
в группе) или физиологического раствора
лективного 5-НТ2А-антагониста кетансерина,
(9 мышей в группе) с целью получить образцы
одного или в комбинации с флуоксетином, на
мозга для анализа мРНК.
I) поведение в тестах «принудительное пла-
Функциональная активность 5-НТ1А-рецеп-
вание»,
«открытое поле» и
«тёмно-светлая
торов. Функциональную активность опреде-
камера»; II) обмен 5-HT и активность ТПГ-2;
ляли по выраженности гипотермического от-
и III) уровни мРНК генов Htr1a, Htr2a, Tph2,
вета на острое введение селективного агони-
Maoa и Slc6a4 в гиппокампе, фронтальной
ста 5-НТ1А-рецепторов 8-OH-DPAT [34-36].
коре и среднем мозге мышей B6-M76C.
8-OH-DPAT («Sigma-Aldrich») был разведён
в физиологическом растворе и введён в.б. в
дозировке 1 мг/кг. Температуру тела измеряли
МАТЕРИАЛЫ И МЕТОДЫ
до и через 20 мин после инъекции с помощью
ректального датчика для мышей («Phymep»,
Животные и препараты. В эксперименте
Франция), используя микрокомпьютер-тер-
были использованы взрослые самцы мышей
мометр («Hanna Instruments», Сингапур). Сте-
B6-M76C (возраст 10-12 недель, вес 23-26 г).
пень выраженности гипотермического ответа
Мыши содержались в стандартных лаборатор-
выражали как разницу конечной и начальной
ных условиях при естественном режиме свет/
температуры тела (Δ t, °C).
темнота (16 ч света и 8 ч темноты) со свобод-
Функциональная активность 5-НТ2А-рецеп-
ным доступом к воде и еде. В течение 14 дней
торов. Функциональную активность рецепто-
мышам вводили флуоксетин («Biokom», Рос-
ров определяли по завершении всех поведен-
сия), кетансерин («Sigma-Aldrich», США) или
ческих тестов по числу встряхиваний головой
их комбинацию. Препараты были растворе-
(head twitches) в ответ на введение селектив-
ны в физиологическом растворе и вводились
ного 5-HT2A-агониста 25CN-NBOH [37, 38].
внутрибрюшинно (в.б.) в дозировке 20 мг/кг
Препарат («Tocris Bioscience», Великобрита-
(флуоксетин; 9 мышей в группе), 0,5 мг/кг (ке-
ния) был разведён в физиологическом раство-
тансерин; 9 мышей в группе) или в комби-
ре и введён в.б. в концентрации 1 мг/кг. Число
нации 20 мг/кг флуоксетина + 0,5 мг/кг ке-
встряхиваний головой подсчитывали в тече-
тансерина
(9 мышей в группе). Дозировка
ние 20 мин, начиная через 5 мин после введе-
флуоксетина соответствует используемой в
ния препарата.
клинической практике и применялась нами в
Поведенческие тесты. Тест «открытое поле»
предыдущем исследовании
[30]. Выбранная
(open field) проводили в открытой круглой
дозировка кетансерина, согласно литератур-
арене (40 см в диаметре), окружённой стеной
ным данным, достаточна для эффективной
из белого пластика высотой 25 см и подсве-
блокады 5-НТ2А-рецепторов [32], но вместе с
ченной через матовый полупрозрачный пол
тем при длительном введении позволяет из-
двумя галогеновыми лампами 12 Вт каждая,
бежать потенциальной гипотензии, которая
расположенными в 40 см под дном арены [39].
может возникнуть при более высоких дозиров-
Мышь помещали поблизости от стены арены,
ках [33]. Контрольная группа (7 животных) по-
её перемещение регистрировалось в течение
лучала инъекции физиологического раствора.
5 мин цифровой камерой («Sony», Япония).
За день до тестирования поведения животные
После тестирования каждого животного аре-
были изолированы в индивидуальных клет-
ну тщательно отчищали. Видео анализиро-
ках для предотвращения группового эффек-
валось с помощью системы компьютерной
та. Во избежание острых эффектов от введе-
регистрации EthoStudio [40]. Горизонтальная
ния препаратов поведенческие тесты, а также
двигательная активность (общая пройденная
оценка функциональной активности 5-НТ1А- и
дистанция), исследованная площадь и время в
5-НТ2А-рецепторов проводились, начиная со
центре арены определялись автоматически.
следующего дня после последней инъекции.
Тест «тёмно-светлая камера» был выпол-
Образцы мозга данных животных были ис-
нен с помощью пластиковой установки, опи-
пользованы для проведения ВЭЖХ. Используя
санной ранее [36]. Животное помещали в тём-
ту же дозировку, временной интервал и усло-
ный отсек установки головой по направлению
вия содержания (изоляция в индивидуальные
к отверстию. Число переходов между тёмным
клетки после последней инъекции, хэндлинг
и светлым отсеками и время нахождения в
для имитации экспериментальных процедур),
светлом отсеке оценивали в течение 5 мин с
мы осуществили хроническое введение флу-
помощью программы EthoStudio. Установку
оксетина (10 мышей в группе), кетансерина
тщательно отчищали после каждого теста.
БИОХИМИЯ том 88 вып. 6 2023
936
ЦЫБКО и др.
В тесте «принудительное плавание» мышей
5-HT1A- и 5-HT2A-рецепторов, MAOA, ТПГ-2
помещали в стеклянный цилиндр (15 × 25 см),
и 5-НТТ, было оценено методом количествен-
заполненный водой, температура которой была
ной ПЦР на приборе LightCycler 480 («Roche
25 °C. Подвижность животных оценивалась в
Applied Science», Германия) с использованием
течение 4 мин (после 2 мин адаптации) с помо-
селективных праймеров (табл. 1), интеркали-
щью программы EthoStudio. Программа оце-
рующего красителя SYBER Green I (мастер-
нивала степень изменения силуэта животного,
микс R-414, «Синтол», Россия) и геномной
который определялся как изменение количе-
ДНК, полученной из печени самцов мышей
ства пикселей, связанных с животными, между
C57BL/6, в качестве внешнего стандарта.
двумя соседними кадрами [41].
Нами была использована серия разведений
Экстракция структур мозга. Мыши были
геномной ДНК с концентрацией 50, 100, 200,
декапитированы через 46-48 ч после тести-
400, 800, 1600, 3200 и 6400 копий на мкл. Не-
рования поведения или через 5 дней после
гативный контроль ставили в тех же условиях,
последней инъекции (в случае с забором ма-
но без добавления образца. Экспрессию ге-
териала для анализа мРНК). Мозг был извле-
нов представляли как отношение количества
чён в тот же день (12:00-14:00) на льду, целые
кДНК исследуемого гена к 100 копиям Polr2a,
средний мозг, гиппокамп и фронтальная кора
выполняющего функцию внутреннего стан-
были выделены в соответствии с онлайн-атла-
дарта [42-44]. Анализ кривой плавления вы-
полняли в конце каждого запуска для каждой
incf.org/mouse/ABA_v3), заморожены в жид-
пары праймеров, что позволило нам контро-
ком азоте и хранились при температуре -80 °C
лировать специфичность амплификации.
до процедур подготовки образцов к ВЭЖХ или
ВЭЖХ. Аликвота 50 мкл образца была
выделения РНК.
смешана с 0,6 M HClO4 («Sigma-Aldrich»), со-
Реакция обратной транскрипции и ПЦР в
держащей 200 нг/мл изопротеренола («Sigma-
реальном времени. Суммарная РНК была выде-
Aldrich») в качестве внутреннего стандарта.
лена с использованием реагента ExtractRNA
Гомогенат центрифугировали при 4 °C в тече-
(«Евроген», Россия) в соответствии с инструк-
ние 15 мин при 12 000 g до осаждения белка.
цией производителя, обработана свободной
Супернатанты разбавляли водой в 2 раза и филь-
от РНК ДНКазой («Promega», США) и раз-
тровали при помощи центрифужной пробир-
ведена до концентрации 0,125 мг/мкл в сте-
ки с 0,22 мкм ацетатцеллюлозным фильтром
рильной воде. 1 мкг суммарной РНК брали
(«Spin-X», США). Осадок хранился при тем-
для синтеза кДНК, смешивая её со случай-
пературе -20 °С до определения концентрации
ными гексануклеотидами [42, 43]. Число ко-
белка по Брэдфорду. В петлю системы ВЭЖХ
пий кДНК генов, кодирующих субъединицу А
вносилось 20 мкл отфильтрованного супер-
ДНК-зависимой РНК-полимеразы 2 (Polr2a),
натанта.
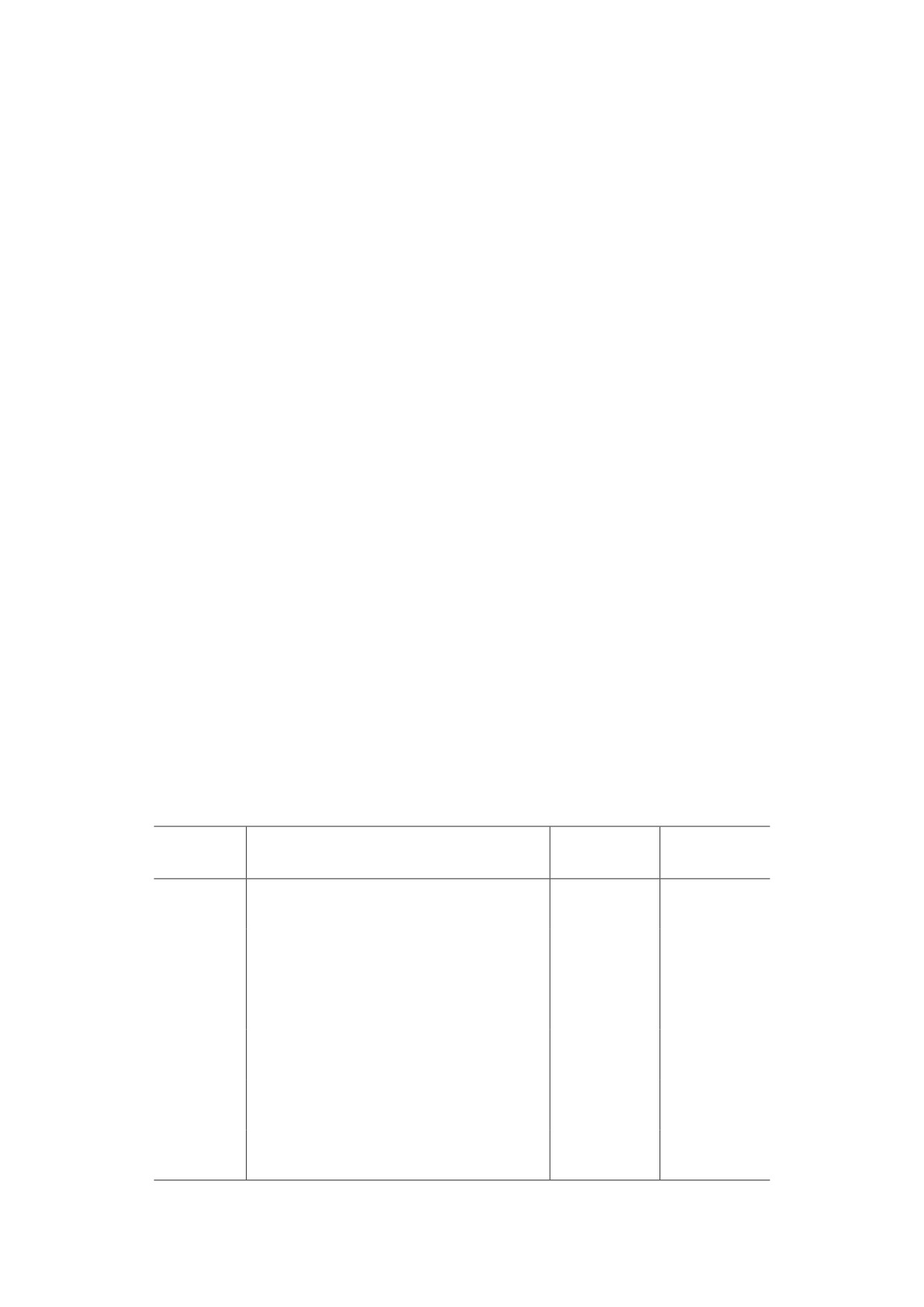
Таблица 1. Нуклеотидные последовательности и характеристики использованных праймеров
Температура
Длина
Ген
Нуклеотидная последовательность
отжига, °C
продукта, п.н.
F 5′-cattcctcgcacaattccagtcg-3′
Tph2
61
239
R 5′-cttgacatattcaactagacgctc-3′
F 5′-cgctctactacctcatctcctcc-3′
Slc6a4
63
101
R 5′-gtcctgggcgaagtagttgg-3′
F 5′-aatgaggatgttaaatgggtagatgttggt-3′
Maoa
61
138
R 5′-cttgacatattcaactagacgctc-3′
F 5′-ctgtgacctgtttatcgccctg-3′
Htr1a
62
200
R 5′-gtagtctatagggtcggtgattgc-3′
F 5′-agaagccaccttgtgtgtga-3′
Htr2a
61
169
R 5′-ttgctcattgctgatggact-3′
F 5′-gttgtcgggcagcagaatgtag-3′
Polr2a
61
188
R 5′-tcaatgagaccttctcgtcctcc-3′
БИОХИМИЯ том 88 вып. 6 2023
РОЛЬ 5-НТ1А-РЕЦЕПТОРОВ В ОТВЕТЕ НА АНТИДЕПРЕССАНТЫ
937
Анализ уровней 5-HT и 5-гидроксииндол-
Статистический анализ. Данные представ-
уксусной кислоты (5-ГИУК) был осуществлён
лены как m ± SEM. Для идентификации и
с помощью ВЭЖХ-системы, содержащей в себе
устранения экстремальных значений из вы-
следующие компоненты: проточная ячейка из
борки был использован Q-тест Диксона. После
стеклоуглерода (ячейка VT-03, 3 мм, GC sb;
проверки распределения по Гауссу с помощью
«Antec», Нидерланды), электрохимический де-
критерия нормальности Д'Агостино-Пирсона
тектор
(700 мВ, DECADE IITM;
«Antec»),
выборки сравнивались либо с помощью одно-
блок подачи растворителя LC-20AD, автома-
факторного дисперсионного анализа (ANOVA)
тический пробоотборник SIL-20A, систем-
с апостериорным сравнением по Фишеру,
ный контроллер CBM-20A и дегазатор DGU-
либо с помощью непараметрического крите-
20A5R («Shimadzu Corporation», США). Хро-
рия Краскела-Уоллиса с последующим мно-
матографическое разделение веществ про-
жественным сравнением по Данну (в случае
изводили изократическим элюированием на
ненормального распределения). Попарные срав-
колонке C18 (размер частиц 5 мкм, L × ID
нения проводили с помощью t-критерия Стью-
100 × 4,6 мм, Luna, «Phenomenex», США), за-
дента. Статистическая значимость была уста-
щищённой предколонкой-картриджем C8 («Phe-
новлена на уровне p < 0,05.
nomenex») при скорости потока 1 мл/мин.
Подвижная фаза представляла собой смесь из
50 мМ фосфатного буфера («Sigma-Aldrich»),
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
метанола класса ВЭЖХ
(«Fisher Chemical»,
США) и 300 мкг/л натриевой соли октансуль-
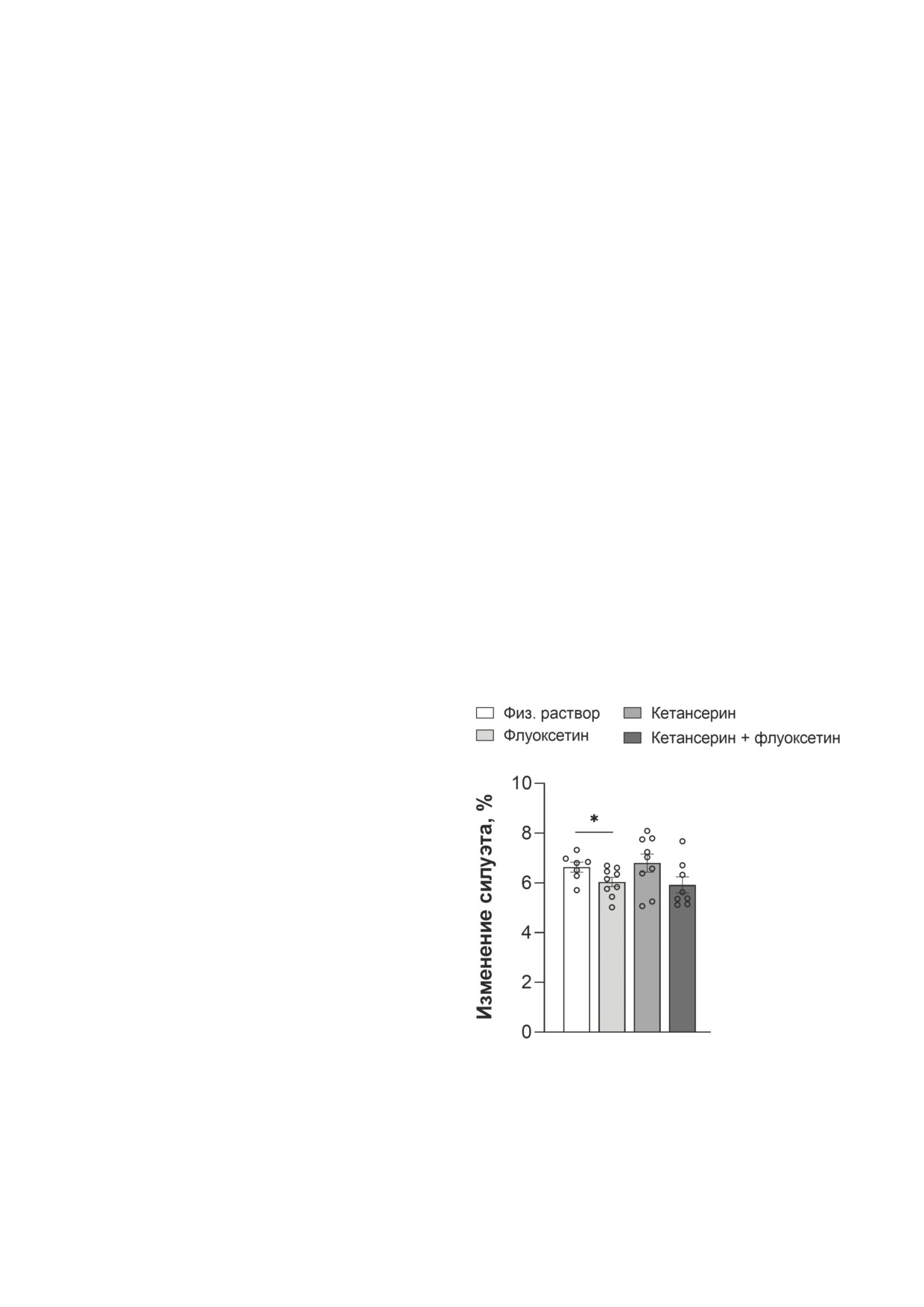
Поведенческие тесты. Хотя основной эф-
фоновой кислоты («Sigma-Aldrich»), pH 3,9.
фект введения препаратов на мобильность в
Температура колонки стабилизировалась при
тесте
«принудительное плавание» был слаб
40 °С. Концентрацию веществ выражали в
(F3,29 = 2,37; р = 0,09), согласно однофакторно-
нг/мг белка (определённого по методу Бред-
му ANOVA, попарное сравнение выявило зна-
форда).
чительно более низкую мобильность в группе,
Определение активности ТПГ-2. Активность
получавшей флуоксетин, по сравнению с кон-
ТПГ-2 была оценена в супернатанте гомогената
тролем (t = 2,17; р = 0,04; рис. 1).
среднего мозга. Из-за возможности деградации
Все использованные препараты не оказали
кофактора на свету реакцию проводили при
значимого эффекта на исследованную площадь
слабом рассеянном освещении. Реакционная
смесь общим объёмом 25 мкл содержала 0,05 M
Tris-HCl буфера (pH 7,6), 0,001 M дитиотреи-
тола («Sigma-Aldrich»), 15 мкл супернатанта,
0,3 мМ 6-метил-5,6,7,8-тетрагидроптеридина
в качестве кофактора («Sigma-Aldrich»), 25 ед.
каталазы («Sigma-Aldrich»), 0,5 мМ ингиби-
тора декарбоксилазы m-гидроксибензилгидра-
зина («Sigma-Aldrich») и 0,8 мМ L-трипто-
фана («Sigma-Aldrich»). Смесь инкубировали в
течение 15 мин при 37 °C. После этого реакция
была остановлена путём добавления 75 мкл
0,6 M HClO4. Первый контроль был без про-
бы, во втором реакцию после инкубирования
останавливали HClO4, после чего смесь по-
вторно ставили в термостат. После инкубации
образцы центрифугировали в течение 15 мин
при 14 000 g и температуре 4 °C до осаждения
белка. Супернатант был собран и разведён в
два раза водой MilliQ. Концентрацию 5-гид-
Рис. 1. Влияние хронического введения флуоксетина,
рокситриптофана (5-HTP) оценили с помощью
кетансерина или их комбинации на мобильность (оце-
ВЭЖХ, используя 5, 10 и 15 пмоль 5-HTP в ка-
ниваемую как скорость изменения силуэта животного)
честве соответствующего внешнего стандарта.
в тесте «принудительное плавание». Данные представ-
За единицу активности ТПГ-2 принимали ко-
лены как m ± SEM; n = 7 для группы «физ. раствор»;
n = 9 для группы «флуоксетин»; n = 9 для группы «кетан-
личество фермента, синтезирующего 1 пмоль
серин»; n = 8 для группы «кетансерин + флуоксетин».
5-HTP за 1 мин на мг белка (определённого по
* p < 0,05 по сравнению с группой «физ. раствор» (t-кри-
методу Бредфорда).
терий Стьюдента)
4
БИОХИМИЯ том 88 вып. 6 2023
938
ЦЫБКО и др.
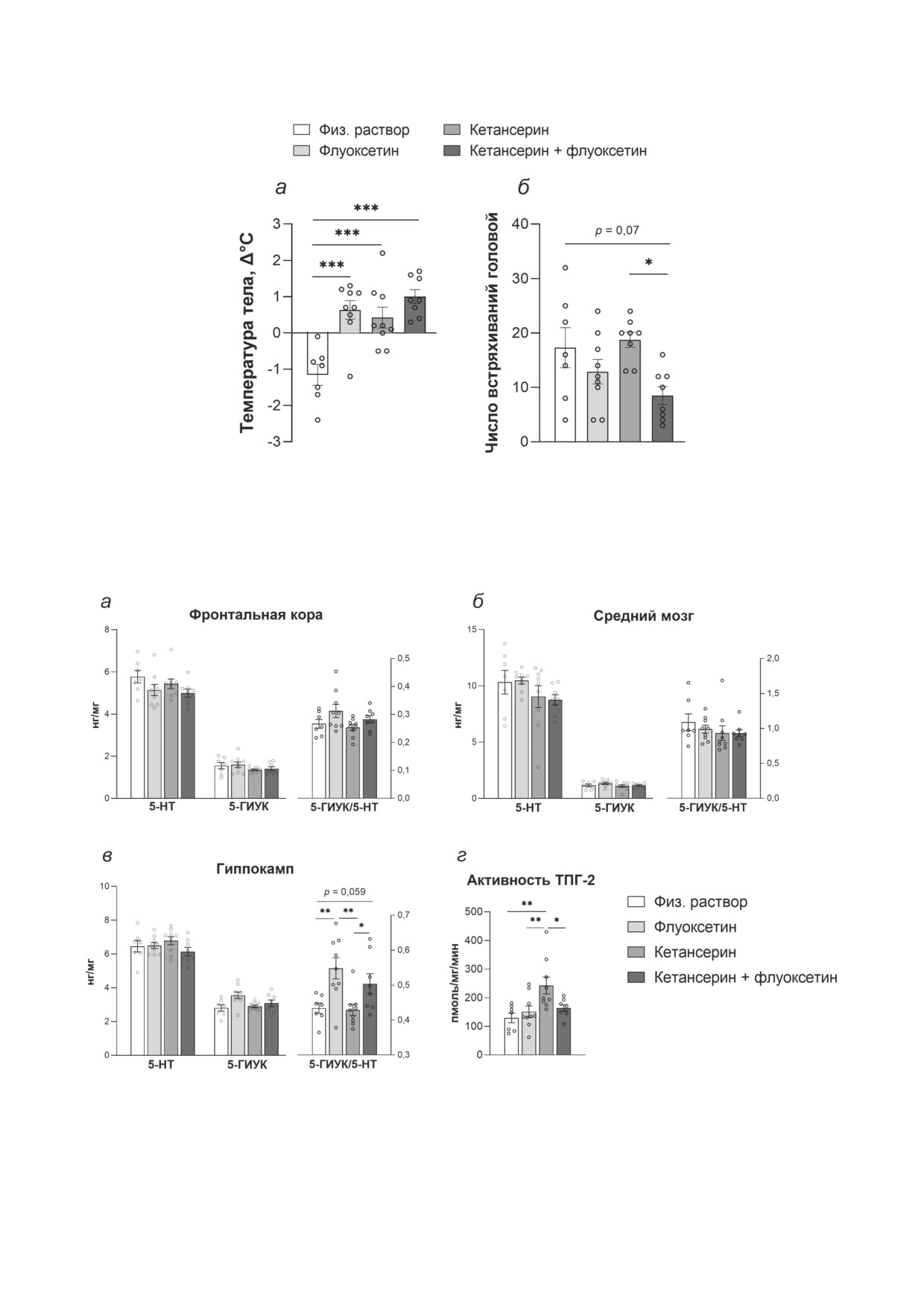
арены (H = 1,79; p = 0,61), пройденный путь
зили гипотермический ответ на инъекцию аго-
(F3,29 = 1,09; p = 0,36), время в центре арены
ниста 5-НТ1А-рецептора 8-OH-DPAT (F3,29 =
(F3,29 = 0,38; p = 0,76), число вертикальных сто-
= 11,83; р < 0,001), что говорит о десенситиза-
ек (F3,29 = 0,22; p = 0,88) и актов грумминга
ции 5-HT1A-рецепторов (рис. 2, а). Нами от-
(H = 3,9; p = 0,26) в тесте «открытое поле»
мечен значительный эффект введения препа-
(табл. 2).
ратов на число встряхиваний головой (F3,28 =
В тесте «тёмно-светлая камера» отсутство-
= 3,95; р = 0,01). Тем не менее апостериорное
вал эффект введения препаратов на время,
сравнение показало, что число встряхиваний
проведённое в тёмном (F3,29 = 1,36; p = 0,27)
головой было ниже только в группе «кетансе-
и светлом (F3,29 = 1,36; p = 0,27) отсеках, чис-
рин + флуоксетин» по сравнению с контролем
ло переходов между отсеками (F3,29 = 1,65; p =
(тенденция р = 0,07) и группой «кетансерин»
= 0,18) и число выглядываний из тёмного от-
(р = 0,02) (рис. 2, б).
сека (H = 1,79; p = 0,61) (табл. 3). Таким обра-
Обмен
5-НТ и активность ТПГ-2. Зна-
зом, хотя двигательная активность, тревож-
чительный эффект введения препаратов на
ность и исследовательское поведение не были
обмен 5-НТ был обнаружен только в гиппо-
затронуты введением препаратов, флуоксетин
кампе (F3,29 = 5,87; р = 0,002; рис. 3, в). В со-
усилил депрессивно-подобное поведение у
ответствии с апостериорным сравнением со-
мышей B6-M76C.
отношение 5-ГИУК/5-HT было выше в груп-
Функциональная активность рецепторов. Все
пах «флуоксетин» (р = 0,002) и «кетансерин +
использованные препараты значительно сни-
+ флуоксетин» (сильная тенденция p = 0,059).
Таблица 2. Эффект хронического введения физиологического раствора, флуоксетина (20 мг/кг), кетансерина (0,5 мг/кг)
или комбинации кетансерин + флуоксетин (0,5 и 20 мг/кг соответственно) на общую пройденную дистанцию, иссле-
дованную площадь, вертикальные стойки, акты грумминга и пребывание в центре арены в тесте «открытое поле»
Исследованная
Вертикальные
Общая
Время
Акты грумминга
Препарат
площадь арены
стойки
дистанция (м)
в центре (%)
(число)
(%)
(число)
Физ. раствор
9,27 ± 1,29
13,91 ± 2,81
91,42 ± 4,69
7,29 ± 2,82
1,57 ± 0,53
Флуоксетин
10,35 ± 0,80
14,53 ± 2,37
95,76 ± 1,81
7,89 ± 1,36
1,00 ± 0,33
Кетансерин
10,82 ± 1,05
14,31 ± 2,16
96,87 ± 1,32
7,11 ± 1,16
1,89 ± 0,31
Кетансерин +
12,50 ± 1,72
11,22 ± 2,66
94,86 ± 1,64
8,87 ± 1,41
1,37 ± 0,18
+ флуоксетин
Примечание. Данные представлены как m ± SEM; n = 7 для группы «физ. раствор»; n = 9 для группы «флуоксетин»;
n = 9 для группы «кетансерин»; n = 8 для группы «кетансерин + флуоксетин» (однофакторный ANOVA и критерий
Краскела-Уоллиса).
Таблица 3. Эффект хронического введения физиологического раствора, флуоксетина (20 мг/кг), кетансерина (0,5 мг/кг)
или комбинации кетансерин + флуоксетин (0,5 и 20 мг/кг соответственно) на пройденный путь, время нахождения
в светлом и тёмном отсеках, количество переходов между отсеками и число выглядываний из тёмного отсека в тесте
«тёмно-светлая камера»
Время
Время
Переходы между
Выглядывания
Препарат
в тёмном отсеке
в светлом отсеке
отсеками
из тёмного отсека
Путь (м)
(%)
(%)
(число)
(число)
Физ. раствор
87,03 ± 3,19
12,97 ± 3,19
3,00 ± 0,65
1,28 ± 0,52
6,52 ± 0,61
Флуоксетин
77,80 ± 2,03
22,20 ± 2,03
4,66 ± 0,66
1,66 ± 0,28
6,50 ± 0,29
Кетансерин
80,59 ± 3,37
19,41 ± 3,37
4,33 ± 0,68
1,56 ± 0,63
6,95 ± 0,50
Кетансерин +
84,41 ± 4,79
15,59 ± 4,79
2,62 ± 1,03
1,50 ± 0,46
6,12 ± 0,71
+ флуоксетин
Примечание. Данные представлены как m ± SEM; n = 7 для группы «физ. раствор»; n = 9 для группы «флуоксетин»;
n = 9 для группы «кетансерин»; n = 8 для группы «кетансерин + флуоксетин» (однофакторный ANOVA и критерий
Краскела-Уоллиса).
БИОХИМИЯ том 88 вып. 6 2023
РОЛЬ 5-НТ1А-РЕЦЕПТОРОВ В ОТВЕТЕ НА АНТИДЕПРЕССАНТЫ
939
Рис. 2. Гипотермический ответ на острое введение агониста 5-НТ1А-рецепторов 8-OH-DPAT (1 мг/кг) (а) и количе-
ство встряхиваний головой, вызванных инъекцией агониста 5-НТ2А-рецепторов 25CN-NBOH (1 мг/кг) (б) у мышей
B6-M76C, подвергавшихся хроническому введению флуоксетина, кетансерина или их комбинации. Данные представ-
лены как m ± SEM; n = 7 для группы «физ. раствор»; n = 9 для группы «флуоксетин»; n = 9 для группы «кетансерин»
(исключено одно экстремальное значение при анализе числа встряхиваний головой); n = 8 для группы «кетансерин +
+ флуоксетин». Тенденция: p = 0,07; ***p < 0,001 по сравнению с группой «физ. раствор»; *p < 0,05 по сравнению с
группой «кетансерин» (однофакторный ANOVA)
Рис. 3. Уровни 5-HT, 5-ГИУК и соотношение 5-ГИУК/5-HT во фронтальной коре (а), среднем мозге (б) и гиппо-
кампе (в), а также активность ТПГ-2 (г) в среднем мозге мышей B6-M76C, получавших хронические инъекции флуок-
сетина, кетансерина или их комбинации. Уровни 5-HT и 5-ГИУК представлены в нг/мг, активность ТПГ-2 выражена
в пмоль/мг/мин. Данные представлены как m ± SEM; n = 7 для группы «физ. раствор»; n = 9 для группы «флуоксетин»;
n = 9 для группы «кетансерин»; n = 8 для группы «кетансерин + флуоксетин». Тенденция: p = 0,059; * p < 0,05 по срав-
нению с группой «кетансерин»; ** p < 0,01 по сравнению с группами «физ. раствор» или «кетансерин» (однофактор-
ный ANOVA)
БИОХИМИЯ том 88 вып. 6 2023
4*
940
ЦЫБКО и др.
Хотя в среднем мозге не выявлено значитель-
ных изменений в продукции и катаболизме
5-НТ, нами отмечен значительный эффект,
оказанный препаратами на активность ключе-
вого фермента синтеза 5-HT в мозге - ТПГ-2
(F3,29 = 5,407; р = 0,004). Апостериорное срав-
нение показало, что активность ТПГ-2 была
значительно выше в группе «кетансерин», чем
в группах «физ. раствор» (р = 0,001), «флуок-
сетин» (р = 0,003) или «кетансерин + флуоксе-
тин» (р = 0,013; рис. 3, г).
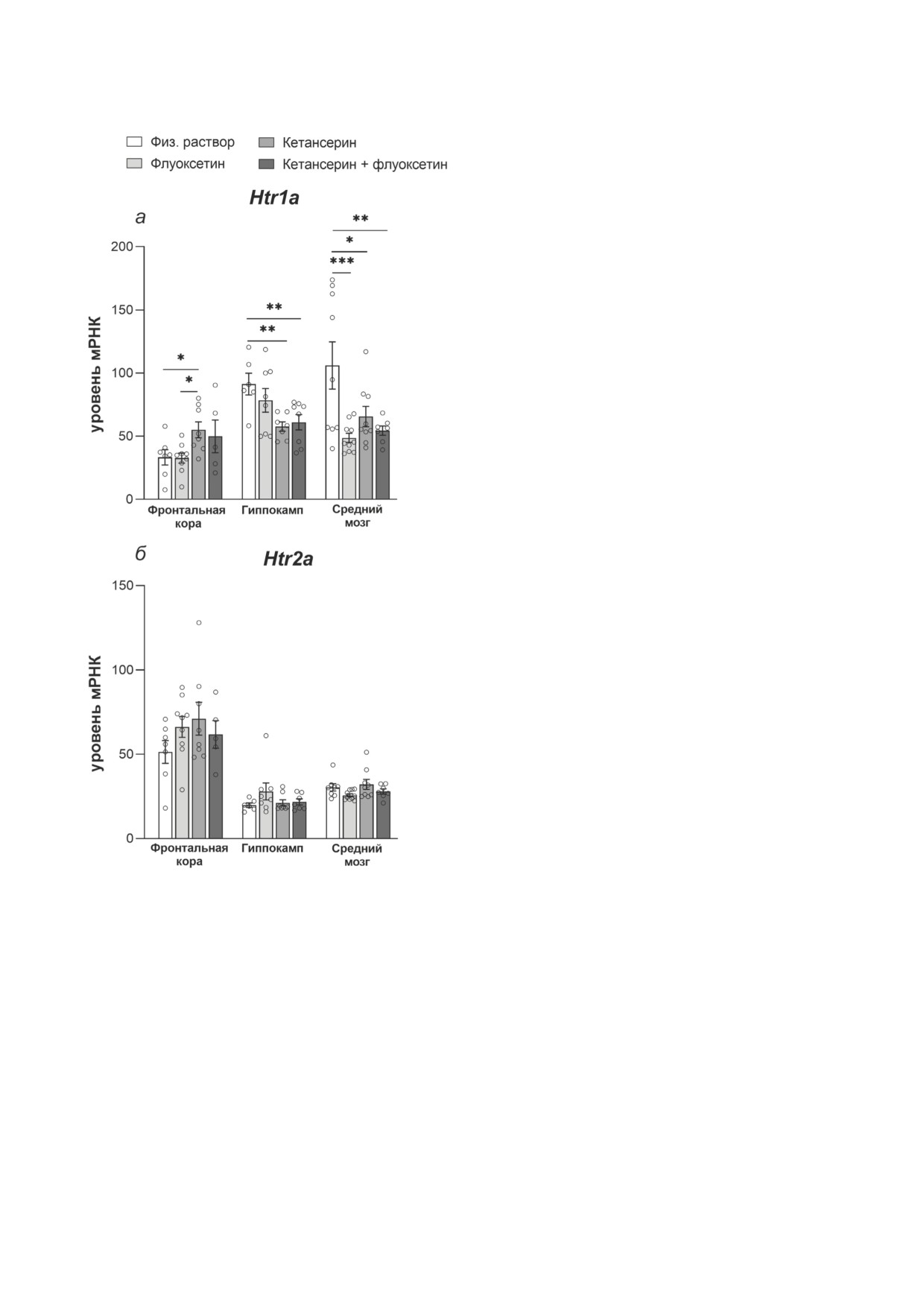
Уровни мРНК. Значительное воздействие
препаратов на уровень мРНК гена Htr1a было
обнаружено во фронтальной коре (F3,25 = 3,04;
р = 0,047), гиппокампе (F3,25 = 4,16; р = 0,016) и
среднем мозге (F3,31 = 5,92; р = 0,002; рис. 4, а).
В среднем мозге все использованные препа-
раты снизили уровень мРНК Htr1a (р < 0,001,
р = 0,011 и р < 0,003 для флуоксетина, кетан-
серина и комбинации кетансерин + флуоксе-
тин соответственно). В гиппокампе снижение
уровня мРНК Htr1a было обнаружено только
в группе «кетансерин» (р = 0,005) или «кетан-
серин + флуоксетин» (р = 0,009). С другой сто-
роны, введение кетансерина привело к повы-
шению уровня мРНК Htr1a во фронтальной
коре (р = 0,028 по сравнению с группой «физ.
раствор» и р = 0,017 по сравнению с группой
«флуоксетин»). Нами не обнаружено какого-
либо значимого эффекта введения препаратов
на уровни мРНК гена Htr2a во всех исследо-
ванных структурах мозга (F3,25 = 1,15; р = 0,34;
F3,25 = 1,05, р = 0,38 и F3,29 = 2,28; р = 0,1 для
фронтальной коры, гиппокампа и среднего
мозга соответственно; рис. 4, б).
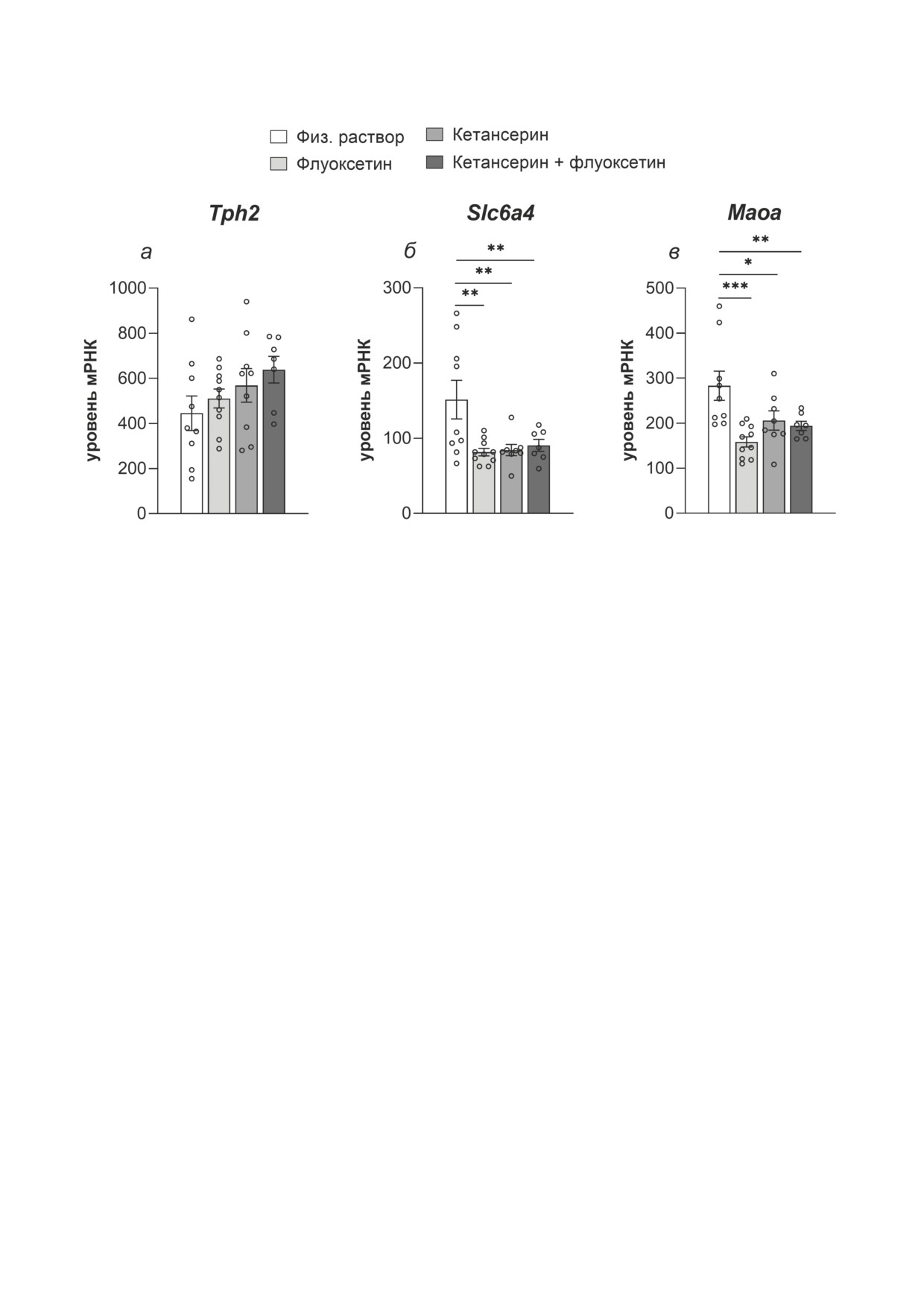
В среднем мозге введение всех использо-
ванных препаратов повлияло на уровни мРНК
генов Slc6a4 и Maoa (F3,30 = 5,29; р = 0,004 и
F3,30 = 6,51; р = 0,001 соответственно). Апо-
стериорное сравнение показало, что введение
всех препаратов снизило уровни мРНК Slc6a4
Рис. 4. Уровни мРНК Htr1a (а) и Htr2a (б) во фронталь-
(р = 0,001, р = 0,003 и р = 0,008 для групп «флу-
ной коре, гиппокампе и среднем мозге мышей B6-M76C,
оксетин», «кетансерин» и «кетансерин + флу-
получавших хронические инъекции флуоксетина, кетан-
оксетин» соответственно; рис. 5, б). Сходным
серина или их комбинации. Экспрессия представлена как
число копий кДНК искомого гена, отнесённое на 100 ко-
образом уровень мРНК Maoa был снижен при
пий кДНК Polr2a. Данные представлены как m ± SEM;
хроническом введении флуоксетина (р < 0,001),
во фронтальной коре n = 7 для группы «физ. раствор»,
кетансерина (р = 0,016) или комбинации ке-
n = 9 для группы «флуоксетин», n = 8 для группы «кетан-
тансерин + флуоксетин (р = 0,008; рис. 5, в).
серин», n = 5 для группы «кетансерин + флуоксетин»;
в гиппокампе n = 6 для группы «физ. раствор», n = 8 для
Не выявлено какого-либо значительного эф-
группы «флуоксетин», n = 8 для группы «кетансерин»
фекта, оказанного на уровень мРНК гена Tph2
(исключено одно экстремальное значение в выборке
(F3,31 = 1,49; р = 0,23; рис. 5, а).
Htr1a), n = 7 для группы «кетансерин + флуоксетин»;
в среднем мозге n = 9 для группы «физ. раствор» (исклю-
чено одно экстремальное значение в выборке Htr2a),
n = 10 для группы «флуоксетин», n = 9 для группы «ке-
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
тансерин», n = 7 для группы «кетансерин + флуоксетин».
* p < 0,01 по сравнению с группами «физ. раствор» или
«кетансерин»; ** p < 0,01 и *** p < 0,001 по сравнению
В данной работе мы продемонстрировали,
с группой «физ. раствор» (однофакторный ANOVA)
что хроническое введение флуоксетина сни-
БИОХИМИЯ том 88 вып. 6 2023
РОЛЬ 5-НТ1А-РЕЦЕПТОРОВ В ОТВЕТЕ НА АНТИДЕПРЕССАНТЫ
941
Рис. 5. Уровни мРНК генов Tph2 (а), Slc6a4 (б) и Maoa (в) в среднем мозге мышей B6-M76C, получавших хронические
инъекции флуоксетина, кетансерина и их комбинации. Экспрессия представлена как число копий кДНК искомого
гена, отнесённое на 100 копий кДНК Polr2a. Данные представлены как m ± SEM; n = 9 для группы «физ. раствор»;
n = 10 для группы «флуоксетин»; n = 9 для группы «кетансерин» (исключено по одному экстремальному значению
в выборках Slc6a4 и Maoa); n = 7 для группы «кетансерин + флуоксетин». * p < 0,01, ** p < 0,01 и *** p < 0,001 по сравне-
нию с группой «физ. раствор» (однофакторный ANOVA)
жает мобильность в тесте
«принудительное
активности 5-HT1A-рецепторов после хрониче-
плавание», указывая на про-депрессивный эф-
ского введения СИОЗС флуоксетина, вероят-
фект у мышей B6-M76C, что, в свою очередь,
но, вызвано повышением концентрации 5-HT
указывает на устойчивость мышей B6-M76C к
в синаптической щели, который, действуя на
действию СИОЗС и согласуется с нашими пре-
рецепторы длительное время, индуцировал
дыдущими наблюдениями [30]. Напротив, ан-
их десенситизацию. В основе эффекта кетан-
тидепрессантный эффект не был обнаружен у
серина может лежать антагонизм 5-НТ1А- и
мышей, получавших кетансерин. В литературе
5-НТ2А-рецепторов. К примеру, ранее мы уже
имеется достаточно данных, свидетельствую-
сообщали о значительном снижении гипотер-
щих об антидепрессивных свойствах антагони-
мического ответа у мышей после острого вве-
стов 5-НТ2А-рецепторов [27, 45-47]. Конкретно
дения кетансерина [14]. 5-HT1A/5-HT2A-антаго-
для кетансерина антидепрессантный эффект
низм может быть следствием физического
обнаруживался как при остром [48], так и при
взаимодействия между данными рецептора-
хроническом введении [49, 50] в различных
ми [15]. Так, в гетерорецепторных комплексах
моделях депрессивно-подобного поведения.
активация 5-HT2A-рецептора значительно сни-
Однако антидепрессантный эффект в ответ
жает связывание 5-HT1A-рецептора с лигандом
на введение кетансерина не был обнаружен у
в гиппокампе и фронтальной коре, в то время
мышей B6-M76C. Логично предположить, что
как блокада 5-НТ2А-рецептора кетансерином
наблюдаемое отсутствие антидепрессантного
восстанавливает их связывание
[15]. Более
эффекта кетансерина, как и про-депрессивный
того, нами выявлено существенное снижение
эффект флуоксетина, могут быть объяснены
уровня мРНК гена Htr1a в среднем мозге и
аномальной активностью 5-HT1A-рецепторов у
гиппокампе, что указывает на подлинную да-
мышей B6-M76C [29, 30].
ун-регуляцию 5-НТ1А-рецепторов.
Нами обнаружено, что функциональная
Было выявлено значительное снижение
активность 5-HT1A-рецепторов одинаково сни-
функциональной активности
5-HT2A-рецеп-
жалась после хронического введения флуоксе-
тора в ответ на хроническое введение флуок-
тина, кетансерина или комбинации этих препа-
сетина в комбинации с кетансерином. Напро-
ратов. Тем не менее в основе этого феномена
тив, хроническое введение одного кетансерина
могут лежать разные механизмы. Снижение
не привело к изменениям функциональной
БИОХИМИЯ том 88 вып. 6 2023
942
ЦЫБКО и др.
активности 5-НТ2А-рецепторов, что противо-
MAOA (фермент, разрушающий 5-HT до его
речит литературным данным, сообщающим
основного метаболита, 5-ГИУК) и транспор-
о снижении плотности
5-НТ2А-рецепторов
тёр 5-HT (5-HTT) в среднем мозге мышей всех
в ответ на хроническое введение антагони-
экспериментальных групп. Хорошо известно,
стов [9, 51]. Также нами не обнаружено при-
что через две недели введения флуоксетина
знаков снижения уровня мРНК гена Htr2a ни
экспрессия 5-HTT в среднем мозге существен-
в одной из исследованных структур, что не по-
но снижается [54, 55], поскольку 5-HTT явля-
зволяет предполагать даун-регуляцию 5-НТ2А-
ется основной мишенью для СИОЗС. Сниже-
рецепторов. Следует отметить, что связывание
ние уровня мРНК гена Maoa в мозге в ответ
5-HT2A-рецептора с антагонистом не обяза-
на введение флуоксетина ранее было пока-
тельно способствует интернализации рецепто-
зано только в контексте пренатального вве-
ра, а может приводить лишь к его диссоциации
дения СИОЗС [56]. В литературе отсутствуют
с G-белком [9]. Мы также не можем исклю-
упоминания о влиянии антагонистов 5-HT2A-
чить, что использованная дозировка кетансе-
рецептора (включая кетансерин) на экспрес-
рина (0,5 мг/кг) была недостаточной для де-
сию 5-HTT и MAOA в мозге. Таким образом,
сенситизации 5-HT2A-рецепторов. Например,
нами впервые показано, что хроническое вве-
значительная десенситизация рецептора с пос-
дение кетансерина, одного или в комбинации
ледующей даун-регуляцией при хроническом
с флуоксетином, снижает уровни мРНК генов
введении кетансерина была показана при
Slc6a4 и Maoa в среднем мозге мышей.
использовании препарата в концентрации
Кроме того, отмеченное нами повышение
10 мг/кг [51]. Когда кетансерин вводился вме-
активности ТПГ-2 (ключевого фермента био-
сте с флуоксетином, функциональная актив-
синтеза 5-HT в мозге) у мышей, получавших
ность
5-HT2A-рецепторов, вероятно, сни-
хронические инъекции кетансерина, согласу-
жалась из-за аддитивного эффекта блокады
ется с литературными данными, предполага-
рецепторов антагонистом и одновременной
ющими, что введение антагонистов 5-HT2A-
десенситизации из-за повышения количе-
рецептора (MDL 100907 либо ритансерина)
ства 5-HT в синаптической щели. Это пред-
оказывает влияние, противоположное ингиби-
положение соотносится со множеством дан-
рованию 5-HT нейронов, и восстанавливает их
ных, указывающих на снижение плотности
проводящую активность [57, 58]. Известно, что
5-HT2A-рецепторов при хроническом введении
5-HT2A-рецепторы локализованы на ГАМК-
СИОЗС [9, 52].
интернейронах в ядрах дорсального шва и об-
Повышение соотношения 5-ГИУК/5-HT
уславливают локальную ингибирующую петлю
в гиппокампе мышей, подвергнутых хрони-
отрицательной обратной связи [59]. Длитель-
ческому введению флуоксетина или комби-
ная блокада
5-HT2A-рецепторов у мышей
нации флуоксетина и кетансерина, указывает
B6-M76C могла привести к дезингибированию
на усиление обмена 5-HT. В наших прежних
5-HT нейронов. Возможно, данный эффект
работах отмечалось, что гиппокамп - одна из
был достаточен для значительного усиления
немногих структур мозга, в которых у мышей
продукции и/или секреции нейротрансмит-
B6-M76C снижен катаболизм 5-НТ [29, 30].
тера в гиппокамп. Ранее мы сообщали, что де-
Локальное усиление катаболизма 5-HT в гип-
сенситизация 5-HT2A-рецептора не только уси-
покампе, обнаруженное в настоящем исследо-
ливает активность ТПГ-2, но также вызывает
вании, может быть связано с даун-регуляцией
значительное увеличение концентрации 5-НТ
постсинаптических 5-HT1A-рецепторов, о чём
в среднем мозге [60].
можно судить по значительному снижению
уровня мРНК. Этот результат хорошо согла-
суется с ранее высказанным предположени-
ЗАКЛЮЧЕНИЕ
ем о том, что у мышей B6-M76C постсинап-
тические
5-HT1A-рецепторы подвергаются
Представленные данные показывают, что
более эффективной десенситизации [29]. Кро-
хроническое введение кетансерина (как по
ме того, в ряде работ указывается, что ингиби-
отдельности, так и в комбинации с флуоксе-
рование не только пре-, но и постсинаптиче-
тином) даёт некоторые преимущества мышам
ских 5-HT1A-рецепторов приводит к усилению
линии B6-M76C: I) повышает активность
секреции 5-HT, что является следствием дез-
ТПГ-2 и обмен 5-HT в гиппокампе, и II) сни-
ингибирования 5-HT нейронов [7, 53].
жает функциональную активность 5-НТ1А-ре-
В нашем исследовании изменения в мета-
цептора и уровни мРНК Htr1a, Slc6a4 и Maoa.
болизме 5-HT сопровождались значительным
Эти результаты согласуются с благотворными
снижением уровня мРНК генов, кодирующих
эффектами блокады 5-НТ2А-рецепторов при
БИОХИМИЯ том 88 вып. 6 2023
РОЛЬ 5-НТ1А-РЕЦЕПТОРОВ В ОТВЕТЕ НА АНТИДЕПРЕССАНТЫ
943
лечении депрессивных расстройств. В то же
Благодарности. Содержание животных
время наши данные показывают, что у живот-
было поддержано бюджетным проектом
ных линии B6-M76C с нарушенной чувстви-
№ FWNR-2022-0023. Разведение животных
тельностью 5-НТ1А-рецепторов длительная бло-
линии B6-M76C было осуществлено на базе
када
5-HT2A-рецепторов селективным анта-
Центра генетических ресурсов лабораторных
гонистом не позволяет достичь антидепрес-
животных Института цитологии и генетики
сантного эффекта ни при монотерапии, ни
Сибирского отделения Российской академии
в комбинации с флуоксетином. Полученные
наук (ИЦиГ СО РАН), поддержанного Ми-
данные позволяют предполагать, что нару-
нистерством науки и высшего образования
шение экспрессии и/или чувствительности
России (уникальный идентификационный но-
5-НТ1А-рецепторов является важным факто-
мер проекта RFMEFI62117X0015).
ром, который может не только значительно
Конфликт интересов. Авторы заявляют об
ухудшать терапевтический ответ при ТРД, но и
отсутствии конфликта интересов.
создавать препятствия для любых попыток его
Соблюдение этических норм. Все экспе-
коррекции.
риментальные процедуры были проведены
в соответствии с международными прави-
Вклад авторов. Е.М. Кондаурова - концеп-
лами обращения с животными (Руководство
ция, проведение экспериментов, анализ резуль-
по содержанию и использованию лаборатор-
татов; Е.А. Заливина, В.О. Благиня - проведе-
ных животных, восьмое издание, комиссия
ние экспериментов; А.С. Цыбко - написание
по обновлению Руководства по содержанию
текста; В.С. Науменко - редактирование текста
и использованию лабораторных животных;
статьи, общее руководство проектом.
Национальный Совет Исследователей, 2020,
Финансирование. Работа выполнена при
Национальная Академия Наук (США)) и одоб-
финансовой поддержке Российского научного
рены этическим комитетом ИЦиГ СО РАН
фонда (грант № 22-15-00011).
(заключение № 34 от 15 июня 2016 г.).
СПИСОК ЛИТЕРАТУРЫ
1. Papp, M., Cubala, W. J., Swiecicki, L., Newman-
border, Hippocampus, 26, 1107-1114, doi: 10.1002/
Tancredi, A., and Willner, P. (2022) Perspectives
hipo.22611.
for therapy of treatment-resistant depression, Br. J.
7. Sharp, T., Boothman, L., Raley, J., and Quérée, P.
Pharmacol., 179, 4181-4200, doi: 10.1111/bph.15596.
(2007) Important messages in the “post”: recent dis-
2. Kulikov, A. V., Gainetdinov, R. R., Ponimaskin,
coveries in 5-HT neurone feedback control, Trends
E., Kalueff, A. V., Naumenko, V. S., and Popova,
Pharmacol. Sci.,
28,
629-636, doi:
10.1016/j.tips.
N. K. (2018) Interplay between the key proteins
2007.10.009.
of serotonin system in SSRI antidepressants
8. Berg, K. A., Harvey, J. A., Spampinato, U., and
efficacy, Expert. Opin. Ther. Targets, 22, 319-330,
Clarke, W. P. (2008) Physiological and therapeu-
doi: 10.1080/14728222.2018.1452912.
tic relevance of constitutive activity of 5-HT 2A
3. Vahid-Ansari, F., Zhang, M., Zahrai, A., and Albert,
and 5-HT 2C receptors for the treatment of depres-
P. R. (2019) Overcoming resistance to selective sero-
sion, Prog. Brain Res., 172, 287-305, doi: 10.1016/
tonin reuptake inhibitors: targeting serotonin, sero-
S0079-6123(08)00914-X.
tonin-1A receptors and adult neuroplasticity, Front.
9. Van Oekelen, D., Luyten, W. H. M. L., and Leysen,
Neurosci., 13, 404, doi: 10.3389/fnins.2019.00404.
J. E.
(2003)
5-HT2A and 5-HT2C receptors and
4. Popova, N. K., Tsybko, A. S., and Naumenko, V. S.
their atypical regulation properties, Life Sci., 72,
(2022) The implication of 5-HT receptor family mem-
2429-2449, doi: 10.1016/s0024-3205(03)00141-3.
bers in aggression, depression and suicide: similarity
10. Aloyo, V. J., Berg, K. A., Spampinato, U., Clarke,
and difference, Int. J. Mol. Sci., 23, 8814, doi: 10.3390/
W. P., and Harvey, J. A. (2009) Current status of in-
ijms23158814.
verse agonism at serotonin2A (5-HT2A) and 5-HT2C re-
5. Alex, K. D., and Pehek, E. A. (2007) Pharmacologic
ceptors, Pharmacol. Ther., 121, 160-173, doi: 10.1016/
mechanisms of serotonergic regulation of dopamine
j.pharmthera.2008.10.010.
neurotransmission, Pharmacol. Ther., 113, 296-320,
11. Moutkine, I., Quentin, E., Guiard, B. P., Maro-
doi: 10.1016/j.pharmthera.2006.08.004.
teaux, L., and Doly, S. (2017) Heterodimers of serotonin
6. Wyskiel, D. R., and Andrade, R. (2016) Serotonin
receptor subtypes 2 are driven by 5-HT2C protomers,
excites hippocampal CA1 GABAergic interneurons at
J. Biol. Chem., 292, 6352-6368, doi: 10.1074/jbc.
the stratum radiatum-stratum lacunosum moleculare
M117.779041.
БИОХИМИЯ том 88 вып. 6 2023
944
ЦЫБКО и др.
12.
Lukasiewicz, S., Polit, A., Kędracka-Krok, S.,
20.
Leysen, J. E. (2004) 5-HT2 receptors, Curr. Drug
Wędzony, K., Maćkowiak, M., and Dziedzicka-
Targets CNS Neurol. Disord., 3, 11-26, doi: 10.2174/
Wasylewska, M.
(2010) Hetero-dimerization of
1568007043482598.
serotonin
5-HT2A and dopamine D(2) receptors,
21.
Celada, P., Puig, M., Amargós-Bosch, M., Adell, A.,
Biochim.
Biophys.
Acta,
1803,
1347-1358,
and Artigas, F. (2004) The therapeutic role of 5-HT1A
doi: 10.1016/j.bbamcr.2010.08.010.
and 5-HT2A receptors in depression, J. Psychiatry
13.
Moreno, J. L., Muguruza, C., Umali, A., Mortillo, S.,
Neurosci., 29, 252-265.
Holloway, T., Pilar-Cuéllar, F., Mocci, G., Seto, J.,
22.
Marek, G. J., Martin-Ruiz, R., Abo, A., and
Callado, L. F., Neve, R. L., Milligan, G., Sealfon,
Artigas, F. (2005) The selective 5-HT2A receptor
S. C., López-Giménez, J. F., Meana, J. J., Benson,
antagonist M100907 enhances antidepressant-like
D. L., and González-Maeso, J. (2012) Identification
behavioral effects of the SSRI fluoxetine, Neuro-
of three residues essential for 5-hydroxytryptamine
psychopharmacology,
30,
2205-2215, doi:
10.1038/
2A-metabotropic glutamate 2 (5-HT2A·mGlu2) re-
sj.npp.1300762.
ceptor heteromerization and its psychoactive behav-
23.
Pehek, E. A., Nocjar, C., Roth, B. L., Byrd, T. A., and
ioral function, J. Biol. Chem., 287, 44301-44319,
Mabrouk, O. S. (2006) Evidence for the preferential
doi: 10.1074/jbc.M112.413161.
involvement of 5-HT2A serotonin receptors in stress-
14.
Naumenko, V. S., Bazovkina, D. V., and Kondaurova,
and drug-induced dopamine release in the rat medial
E. M. (2015) On the functional cross-talk between
prefrontal cortex, Neuropsychopharmacology, 31, 265-
brain
5-HT1A and
5-HT2A receptors
[in Rus-
277, doi: 10.1038/sj.npp.1300819.
sian], Zhurn. Vyssh. Nerv. Deyat. Im I. P. Pavlova,
24.
Mestre, T. A., Zurowski, M., and Fox, S. H. (2013)
65, 240-247.
5-Hydroxytryptamine2A receptor antagonists as poten-
15.
Borroto-Escuela, D. O., Li, X., Tarakanov, A. O.,
tial treatment for psychiatric disorders, Expert Opin.
Savelli, D., Narváez, M., Shumilov, K., Andrade-
Investig. Drugs, 22, 411-421, doi: 10.1517/13543784.
Talavera, Y., Jimenez-Beristain, A., Pomierny, B.,
2013.769957.
Díaz-Cabiale, Z., Cuppini, R., Ambrogini, P.,
25.
McIntyre, R. S., Soczynska, J. K., Woldeyohannes,
Lindskog, M., and Fuxe, K. (2017) Existence of
H. O., Alsuwaidan, M., and Konarski, J. Z. (2007)
brain 5-HT1A-5-HT2A isoreceptor complexes with
A preclinical and clinical rationale for quetiapine in
antagonistic allosteric receptor-receptor interactions
mood syndromes, Expert Opin. Pharmacother., 8,
regulating 5-HT1A receptor recognition, ACS Omega,
1211-1219, doi: 10.1517/14656566.8.9.1211.
2, 4779-4789, doi: 10.1021/acsomega.7b00629.
26.
Sanford, M., and Keating, G. M. (2012) Quetiapine:
16.
Szlachta, M., Kuśmider, M., Pabian, P., Solich, J.,
a review of its use in the management of bipolar de-
Kolasa, M., Żurawek, D., Dziedzicka-Wasylewska, M.,
pression, CNS Drugs, 26, 435-460, doi: 10.2165/
and Faron-Górecka, A. (2018) Repeated clozapine
11203840-000000000-00000.
increases the level of serotonin 5-HT1AR heterodi-
27.
Wright, B. M., Eiland, E. H. 3rd, and Lorenz, R.
merization with 5-HT2A or dopamine D(2) receptors
(2013) Augmentation with atypical antipsychotics for
in the mouse cortex, Front. Mol. Neurosci., 11, 40,
depression: a review of evidence-based support from
doi: 10.3389/fnmol.2018.00040.
the medical literature, Pharmacotherapy, 33, 344-359,
17.
Wan, Y.-S., Zhai, X.-J., Tan, H.-A., Ai, Y. S., and
doi: 10.1002/phar.1204.
Zhao, L. B. (2021) Associations between the 1438A/G,
28.
Miranda, A. S., de Moreira, F. A., and Teixeira, A. L.
102T/C, and rs7997012G/A polymorphisms of HTR2A
(2017) The preclinical discovery and development
and the safety and efficacy of antidepressants in
of quetiapine for the treatment of mania and
depression: a meta-analysis, Pharmacogenomics J., 21,
depression, Expert Opin. Drug Discov., 12, 525-535,
200-215, doi: 10.1038/s41397-020-00197-2.
doi: 10.1080/17460441.2017.1304378.
18.
Baeken, C., De Raedt, R., and Bossuyt, A. (2012) Is
29.
Kulikova, E. A., Bazovkina, D. V., Akulov, A. E.,
treatment-resistance in unipolar melancholic depres-
Tsybko, A. S., Fursenko, D. V., Kulikov, A. V.,
sion characterized by decreased serotonin2A recep-
Naumenko, V. S., Ponimaskin, E., and Kondaurova,
tors in the dorsal prefrontal - anterior cingulate cor-
E. M. (2016) Alterations in pharmacological and
tex? Neuropharmacology, 62, 340-346, doi: 10.1016/
behavioural responses in recombinant mouse line
j.neuropharm.2011.07.043.
with an increased predisposition to catalepsy: role of
19.
Vadodaria, K. C., Ji, Y., Skime, M., Paquola, A.,
the 5-HT1A receptor, Br. J. Pharmacol., 13, 2147-2161,
Nelson, T., Hall-Flavin, D., Fredlender, C., Heard,
doi: 10.1111/bph.13484.
K. J., Deng, Y., Le, A. T., Dave, S., Fung, L., Li, X.,
30.
Kondaurova, E. M., Rodnyy, A. Y., Ilchibaeva, T. V.,
Marchetto, M. C., Weinshilboum, R., and Gage,
Tsybko, A. S., Eremin, D. V., Antonov, Y. V.,
F. H. (2019) Serotonin-induced hyperactivity in SSRI-
Popova, N. K., and Naumenko, V. S. (2020) Genetic
resistant major depressive disorder patient-derived
background underlying 5-HT1A receptor functioning
neurons, Mol. Psychiatry, 24, 795-807, doi: 10.1038/
affects the response to fluoxetine, Int. J. Mol. Sci., 21,
s41380-019-0363-y.
doi: 10.3390/ijms21228784.
БИОХИМИЯ том 88 вып. 6 2023
РОЛЬ 5-НТ1А-РЕЦЕПТОРОВ В ОТВЕТЕ НА АНТИДЕПРЕССАНТЫ
945
31.
Kulikova, E. A., Bazovkina, D. V., Antonov, Y. V.,
analysis of antidepressants’ effect in the forced swim
Akulov, A. E., Kulikov, A. V., and Kondaurova, E. M.
test, J. Neurosci. Methods, 191, 26-31, doi: 10.1016/
(2017) Alteration of the brain morphology and the re-
j.jneumeth.2010.06.002.
sponse to the acute stress in the recombinant mouse
42.
Kulikov, A. V., Naumenko, V. S., Voronova, I. P.,
lines with different predisposition to catalepsy, Neuro-
Tikhonova, M. A., and Popova, N. K.
(2005)
sci. Res., 117, 14-21, doi: 10.1016/j.neures.2016.11.009.
Quantitative RT-PCR assay of 5-HT1A and 5-HT2A
32.
Hervig, M. E.-S., Jensen, N. C. H., Rasmussen, N. B.,
serotonin receptor mRNAs using genomic DNA as an
Rydbirk, R., Olesen, M. V., Hay-Schmidt, A.,
external standard, J. Neurosci. Methods, 141, 97-101,
Pakkenberg, B., and Aznar, S. (2017) Involvement of
doi: 10.1016/j.jneumeth.2004.06.005.
serotonin 2A receptor activation in modulating medial
43.
Naumenko, V. S., and Kulikov, A. V. (2006) Quan-
prefrontal cortex and amygdala neuronal activation
titative assay of 5-HT1A serotonin receptor gene ex-
during novelty-exposure, Behav. Brain Res., 326, 1-12,
pression in the brain, Mol. Biol. (Mosk.), 40, 30-36,
doi: 10.1016/j.bbr.2017.02.050.
doi: 10.1134/S0026893306010067.
33.
Balasubramaniam, G., Lee, H. S., and Mah, S. C.
44.
Naumenko, V. S., Osipova, D. V., Kostina, E. V., and
(1993) Differences in the acute and chronic anti-
Kulikov, A. V. (2008) Utilization of a two-standard
hypertensive mechanism of action of ketanserin in
system in real-time PCR for quantification of gene
spontaneously hypertensive rats, J. Pharmacol. Exp.
expression in the brain, J. Neurosci. Methods, 170,
Ther., 264, 129-134.
197-203, doi: 10.1016/j.jneumeth.2008.01.008.
34.
Hjorth, S. (1985) Hypothermia in the rat induced by
45.
Carr, G. V., and Lucki, I. (2011) The role of serotonin
the potent serotoninergic agent 8-OH-DPAT, J. Neural
receptor subtypes in treating depression: a review of
Transm., 61, 131-135, doi: 10.1007/BF01253058.
animal studies, Psychopharmacology, 213, 265-287,
35.
O’Connell, M. T., and Curzon, G. (1996) A com-
doi: 10.1007/s00213-010-2097-z.
parison of the effects of 8-OH-DPAT pretreatment
46.
Muguruza, C., Miranda-Azpiazu, P., Díez-Alarcia, R.,
of different behavioural responses to 8-OH-DPAT,
Morentin, B., González-Maeso, J., Callado, L. F.,
Eur. J. Pharmacol.,
312,
137-143, doi:
10.1016/
and Meana, J. J. (2014) Evaluation of 5-HT2A and
0014-2999(96)00496-7.
mGlu2/3 receptors in postmortem prefrontal cortex of
36.
Popova, N. K., Naumenko, V. S., Cybko, A. S.,
subjects with major depressive disorder: effect of an-
and Bazovkina, D. V. (2010) Receptor-genes cross-
tidepressant treatment, Neuropharmacology, 86, 311-
talk: effect of chronic 5-HT1A agonist 8-hydroxy-2-
318, doi: 10.1016/j.neuropharm.2014.08.009.
(di-n-propylamino) tetralin treatment on the expres-
47.
Guiard, B. P., and Di Giovanni, G. (2015) Central se-
sion of key genes in brain serotonin system and on
rotonin2A (5-HT2A) receptor dysfunction in depression
behavior, Neuroscience, 169, 229-235, doi: 10.1016/
and epilepsy: the missing link? Front. Pharmacol., 6,
j.neuroscience.2010.04.044.
46, doi: 10.3389/fphar.2015.00046.
37.
Buchborn, T., Lyons, T., and Knöpfel, T.
(2018)
48.
Rajkumar, R., Pandey, D. K., Mahesh, R., and
Tolerance and tachyphylaxis to head twitches induced
Radha, R. (2009) 1-(m-Chlorophenyl)piperazine in-
by the 5-HT2A agonist 25CN-NBOH in mice, Front.
duces depressogenic-like behaviour in rodents by stim-
Pharmacol., 9, 17, doi: 10.3389/fphar.2018.00017.
ulating the neuronal 5-HT2A receptors: proposal of a
38.
Tsybko, A. S., Ilchibaeva, T. V., Filimonova, E. A.,
modified rodent antidepressant assay, Eur. J. Pharma-
Eremin, D. V., Popova, N. K., and Naumenko, V. S.
col., 608, 32-41, doi: 10.1016/j.ejphar.2009.02.041.
(2020) The chronic treatment with 5-HT2A receptor
49.
Pilar-Cuéllar, F., Vidal, R., and Pazos, A.
(2012)
agonists affects the behavior and the BDNF system in
Subchronic treatment with fluoxetine and ketanserin
mice, Neurochem. Res., 12, 3059-3075, doi: 10.1007/
increases hippocampal brain-derived neurotrophic
s11064-020-03153-5.
factor, β-catenin and antidepressant-like effects,
39.
Kulikov, A. V., Tikhonova, M. A., and Kulikov, V. A.
Br. J. Pharmacol.,
165,
1046-1057, doi:
10.1111/
(2008) Automated measurement of spatial preference
j.1476-5381.2011.01516.x.
in the open field test with transmitted lighting,
50.
Pandey, D. K., Bhatt, S., Jindal, A., and Gautam,
J. Neurosci. Methods, 170, 345-351, doi: 10.1016/
B.
(2014) Effect of combination of ketanserin
j.jneumeth.2008.01.024.
and escitalopram on behavioral anomalies after
40.
Khotskin, N. V., Plyusnina, A. V., Kulikova, E. A.,
olfactory bulbectomy: prediction of quick onset of
Bazhenova, E. Y., Fursenko, D. V., Sorokin, I. E.,
antidepressant action, Indian J. Pharmacol., 46, 639-
Kolotygin, I., Mormede, P., Terenina, E. E., Shevelev,
643, doi: 10.4103/0253-7613.144935.
O. B., and Kulikov, A. V. (2019) On association of the
51.
Yadav, P. N., Kroeze, W. K., Farrell, M. S., and
lethal yellow (A(Y)) mutation in the agouti gene with
Roth, B. L. (2011) Antagonist functional selectivity:
the alterations in mouse brain and behavior, Behav.
5-HT2A serotonin receptor antagonists differentially
Brain Res., 359, 446-456, doi: 10.1016/j.bbr.2018.11.013.
regulate 5-HT2A receptor protein level in vivo, J. Phar-
41.
Kulikov, A. V., Morozova, M. V., Kulikov, V. A.,
macol. Exp. Ther., 339, 99-105, doi: 10.1124/jpet.
Kirichuk, V. S., and Popova, N. K. (2010) Automated
111.183780.
БИОХИМИЯ том 88 вып. 6 2023
946
ЦЫБКО и др.
52. Yamauchi, M., Miyara, T., Matsushima, T., and
gene expression in mice, Brain Res., 1727, 146282,
Imanishi, T. (2006) Desensitization of 5-HT2A recep-
doi: 10.1016/j.brainres.2019.06.001.
tor function by chronic administration of selective se-
57. Martín-Ruiz, R., Puig, M. V., Celada, P., Shapiro,
rotonin reuptake inhibitors, Brain Res., 1067, 164-169,
D. A., Roth, B. L., Mengod, G., and Artigas, F. (2001)
doi: 10.1016/j.brainres.2005.10.075.
Control of serotonergic function in medial prefrontal
53. Popova, N. K., and Naumenko, V. S.
(2013)
cortex by serotonin-2A receptors through a glutamate-
5-HT1A receptor as a key player in the brain 5-HT
dependent mechanism, J. Neurosci., 21, 9856-9866,
system, Rev. Neurosci., 24, 191-204, doi: 10.1515/
doi: 10.1523/JNEUROSCI.21-24-09856.2001.
revneuro-2012-0082.
58. Boothman, L. J., Allers, K. A., Rasmussen, K., and
54. Dygalo, N. N., Shishkina, G. T., Kalinina, T. S.,
Sharp, T. (2003) Evidence that central 5-HT2A and
Yudina, A. M., and Ovchinnikova, E. S.
(2006)
5-HT2B/C receptors regulate 5-HT cell firing in
Effect of repeated treatment with fluoxetine on
the dorsal raphe nucleus of the anaesthetised rat,
tryptophan hydroxylase-2 gene expression in the rat
Br. J. Pharmacol.,
139,
998-1004, doi:
10.1038/
brainstem, Pharmacol. Biochem. Behav., 85, 220-227,
sj.bjp.0705328.
doi: 10.1016/j.pbb.2006.08.004.
59. Liu, R., Jolas, T., and Aghajanian, G. (2000) Sero-
55. Shishkina, G. T., Kalinina, T. S., and Dygalo, N. N.
tonin 5-HT(2) receptors activate local GABA in-
(2007) Up-regulation of tryptophan hydroxylase-2
hibitory inputs to serotonergic neurons of the dorsal
mRNA in the rat brain by chronic fluoxetine treatment
raphe nucleus, Brain Res, 873, 34-45, doi: 10.1016/
correlates with its antidepressant effect, Neuroscience,
s0006-8993(00)02468-9.
150, 404-412, doi: 10.1016/j.neuroscience.2007.09.017.
60. Naumenko, V. S., Tsybko, A. S., Bazovkina, D. V., and
56. Bond, C. M., Johnson, J. C., Chaudhary, V.,
Popova, N. K. (2012) Involvement of 5-HT2A receptors
McCarthy, E. M., McWhorter, M. L., and Woehrle,
in genetic mechanisms of autoregulation of brain
N. S. (2020) Perinatal fluoxetine exposure results
5-HT system, Mol. Biol., 46, 416-422, doi: 10.1134/
in social deficits and reduced monoamine oxidase
S0026893312020100.
EFFECTS OF CHRONIC COMBINED TREATMENT WITH KETANSERIN
AND FLUOXETINE IN B6.CBA-D13Mit76C RECOMBINANT MICE
WITH ABNORMAL 5-HT1A RECEPTOR FUNCTIONAL ACTIVITY
A. S. Tsybko*#, E. M. Kondaurova#, E. V. Zalivina, V. O. Blaginya, and V. S. Naumenko
Federal Research Center Institute of Cytology and Genetics, Siberian Branch of Russian Academy of Sciences,
630090 Novosibirsk, Russia; e-mail: antoncybko@mail.ru
The recombinant B6.CBA-D13Mit76C mouse strain is characterized by altered sensitivity of 5-HT1A recep-
tors and greater Htr1a gene transcription. Recently, we found that in B6.CBA-D13Mit76C mice, chronic
fluoxetine treatment produced pro-depressive effect in a forced swim test. Since 5-HT2A receptor block-
ade may be beneficial in treatment-resistant depression, we investigated the influence of chronic treatment
(14 days, intraperitoneally) with selective 5-HT2A antagonist ketanserin (0.5 mg/kg), fluoxetine (20 mg/kg),
or fluoxetine + ketanserin on the behavior, functional activity of 5-HT1A and 5-HT2A receptors, serotonin
turnover, and transcription of principal genes of the serotonin system in the brain of B6.CBA-D13Mit76C
mice. Ketanserin did not reverse the pro-depressive effect of fluoxetine. Fluoxetine, ketanserin, and fluoxe-
tine + ketanserin decreased functional activity of 5-HT1A receptors and Htr1a gene transcription in the mid-
brain and hippocampus. Additionally, all the tested drug regimens decreased mRNA levels of Slc6a4 and
Maoa in the midbrain. These changes were not accompanied by a significant shift in the levels of serotonin
and its metabolite 5-HIAA. Notably, ketanserin upregulated enzymatic activity of tryptophan hydroxylase 2
(TPH2). Thus, despite some benefits (reduced Htr1a, Slc6a4, and Maoa transcription and increased TPH2
activity), prolonged blockade of 5-HT2A receptors failed to ameliorate the adverse effect of fluoxetine during
abnormal functioning of 5-HT1A receptors.
Keywords: 5-HT1A receptor, 5-HT2A receptor, TPH2, fluoxetine, ketanserin, antidepressant resistance
БИОХИМИЯ том 88 вып. 6 2023