БИОХИМИЯ, 2023, том 88, вып. 6, с. 947 - 961
УДК 577.25
МОЛЕКУЛЯРНЫЕ ОСНОВЫ СИГНАЛЬНЫХ ПРОЦЕССОВ,
РЕГУЛИРУЕМЫХ СЕНСОРНЫМИ ФОТОРЕЦЕПТОРАМИ
КРИПТОХРОМАМИ У РАСТЕНИЙ
Обзор
© 2023 Г.Я. Фрайкин*, Н.С. Беленикина, А.Б. Рубин
Московский государственный университет имени М.В. Ломоносова,
119991 Москва, Россия; электронная почта: Gfraikin@yandex.ru
Поступила в редакцию 31.03.2023
После доработки 28.04.2023
Принята к публикации 02.05.2023
Сенсоры синего света, криптохромы, составляют широко распространённый класс флавопротеи-
новых фоторецепторов, которые у растений регулируют сигнальные процессы, лежащие в осно-
ве их развития, роста и метаболизма. У некоторых водорослей криптохромы могут действовать
не только как сенсорные фоторецепторы, но также как фотолиазы, катализирующие репарацию
УФ-индуцированных повреждений ДНК. Криптохромы связывают в качестве хромофора FAD
в гомологичном фотолиазе домене (photolyase homologous region, PHR) и содержат C-концевое
удлинение (cryptochrome C-terminal extension, CCE), отсутствующее у фотолиаз. Фотосенсорный
процесс в криптохроме инициируется фотохимическими превращениями хромофора, включаю-
щими образование редокс-форм FAD. В состоянии с восстановленным до нейтрального радикала
хромофором (FADH•) фоторецепторный белок подвергается фосфорилированию, конформацион-
ному изменению и разобщению PHR-домена и CCE с последующим формированием олигомеров
криптохромных молекул. Фотоолигомеризация - структурная основа функциональной активно-
сти криптохромов, определяющая формирование их комплексов с разнообразными сигнальными
белками, включая транскрипционные факторы и регуляторы транскрипции. Взаимодействия в
таких комплексах изменяют активность сигнальных белков, что приводит к регуляции экспрессии
генов и фотоморфогенезу растений. В последнее время опубликовано много работ с новой, более
детальной информацией о молекулярных механизмах отмеченных выше процессов. В настоящем
обзоре основное внимание сосредоточено на анализе данных этих публикаций, особенно касаю-
щихся структурных аспектов перехода криптохромов в фотоактивированное состояние и регуля-
торных сигнальных процессов, опосредуемых криптохромными фоторецепторами у растений.
КЛЮЧЕВЫЕ СЛОВА: фоторецепторы криптохромы, FAD-хромофор, фотосенсорный процесс, фото-
олигомеризация, сигнальные белки и механизмы, регуляция реагирующих на свет генов.
DOI: 10.31857/S0320972523060052, EDN: EEUGZP
ВВЕДЕНИЕ
солнца - ключевой стимул окружающей среды,
который воспринимается многочисленными
Свет УФ, видимой и ближней ИК-обла-
организмами из всех царств жизни. Для детек-
стей (290-800 нм) электромагнитного спектра тирования световых стимулов живые системы
Принятые сокращения: (6-4)PP - pyrimidine 6-4 pyrimidone photoproduct, пиримидин (6-4) пиримидоновый фото-
продукт; BICs - blue light inhibitors of CRYs, зависимые от синего света ингибиторы криптохромов растений; CCE -
cryptochrome C-terminal extension, C-концевое удлинение криптохрома; CIB - CRY-interacting bHLH; CO - CONSTANS,
транскрипционный фактор; COP1/SPA - (constitutive photomorphogenic 1)/(suppressor of PHYA-105 1) E3 ubiquitin ligase
complex, комплекс белков с активностью Е3-убиквитинлигазы; CPD - cyclobutane pyrimidine dimer, циклобутановый пи-
римидиновый димер; CPF - cryptochrome/photolyase family proteins, белки семейства криптохромов/фотолиаз; CPH1 -
Chlamydomonas photolyase homologous 1, plant-like pCRY protein, подобный криптохромам растений белок Chlamydomonas
reinhardtii; CraCRY - animal-like aCRY protein, подобный криптохромам животных белок C. reinhardtii; CRYs (CRY1/
CRY2) - cryptochromes, криптохромы растений; LRGs - light-responsive genes, реагирующие на свет гены; PHR - photolyase
homologous region, гомологичная фотолиазе область; PIFs - phytochrome-interacting factors, взаимодействующие с фито-
хромом факторы (регуляторы транскрипции); PPKs - photoregulatory protein kinases, фоторегуляторные протеинкиназы.
* Адресат для корреспонденции.
947
948
ФРАЙКИН и др.
развили ряд специализированных сенсорных
фоторецепторов [1-11], которые конвертируют
физический сигнал в биохимические сигналь-
ные каскады с последующими фотобиологи-
ческими ответами. Это позволяет организмам
реагировать на флуктуации многих парамет-
ров света и адаптироваться в условиях среды
обитания. Сенсорные фоторецепторные бел-
ки обычно содержат молекулы хромофоров,
чувствительных к фотонам разной энергии.
Поглощение фотона хромофором фоторецеп-
тора в адаптированном к темноте состоянии
инициирует серию фотохимических реакций
(фотоцикл), сопровождающихся переходом фо-
торецептора из «темнового» (неактивного) со-
стояния в адаптированное к свету, или «сигналь-
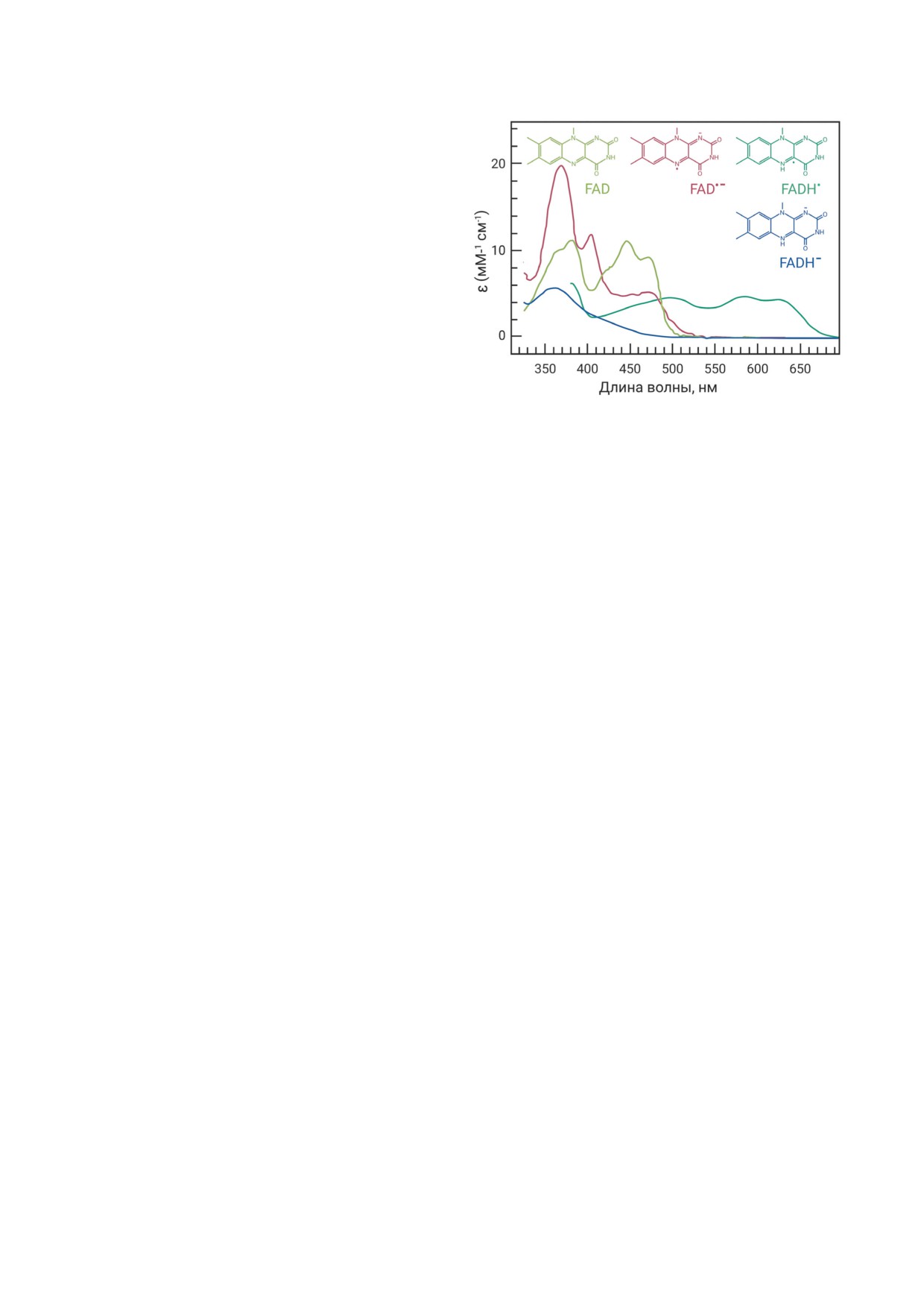
Рис. 1. Абсорбционные спектры редокс-форм FAD-хро-
мофора криптохромов
ное» конформационное состояние. Такой пере-
ход означает фотоактивацию фоторецептора.
Растения с наиболее развитыми системами
дикальной (FADH•) и анион-восстановленной
восприятия света, ответственными за разно-
(FADH-) (рис. 1).
образные фотоответы, обладают большим чис-
Все редокс-формы FAD имеют в спек-
лом регуляторных сенсорных фоторецепторов,
трах поглощения максимум в области УФА
которые, имея разную спектральную чувстви-
при 360-370 нм, причём у FADH- максимум
тельность, вместе контролируют все области
в этой области единственный. У окисленной
солнечного оптического спектра [12-20]. Мож-
формы FAD и анион-радикала FAD•- мак-
но также отметить, что растительные фото-
симумы расположены также в синей области
рецепторы функционально взаимосвязаны в
(400-500 нм). У FADH• максимумы сильно
запуске программ развития растений и коор-
сдвинуты в зелёную и красную области спек-
динации циркадных ритмов их физиологиче-
тра между 500 и 650 нм; это принципиаль-
ских функций с суточным солнечным циклом.
ное отличие нейтрального радикала от FAD и
Эти сенсорные фоторецепторы на основании
FAD•- [28, 29]. Приведённые данные показы-
конкретной природы и фотоцикла хромофо-
вают, что каждая редокс-форма FAD харак-
ра подразделяются на несколько различ-
теризуется специфическими максимумами в
ных классов. К ним относятся фитохромы -
спектрах поглощения, и поэтому абсорбци-
сенсоры красного/дальнего красного света
онные спектры предоставляют важную ин-
(600-750 нм) [21, 22], криптохромы [14, 23],
формацию о редокс-состояниях хромофора в
фототропины и другие белки: Light-Oxygen-
криптохромных белках.
Voltage (LOV) - сенсоры ультрафиолета А-об-
Первый криптохром (cryptochrome, CRY1)
ласти (УФА)/синего света (320-400 нм/400-
был открыт у растения Arabidopsis thaliana [30],
500 нм) [24], а также белок UV RESISTANCE
и было установлено, что этот белок, кодируе-
LOCUS 8 (UVR8) - сенсор фотонов ультрафио-
мый геном LONG HYPOCOTYL 4 (HY4), гомо-
лета В-области (УФВ, 290-320 нм) [25, 26]. За
логичен ДНК-фотолиазам - светочувствитель-
исключением белка UVR8, который не содер-
ным ферментам репарации повреждённой
жит специального хромофора, каждый фото-
УФ-излучением ДНК. Белок HY4, как и фото-
рецептор может быть функционально разделён
лиазы, содержал FAD, но у него отсутство-
на фотосенсорный модуль, содержащий хро-
вала ДНК-репарирующая ферментативная
мофор и обеспечивающий поглощение света, и
активность фотолиаз [31], и он проявлял ре-
эффекторный (сигнальный) модуль, опосреду-
гуляторные свойства сенсорного фоторецеп-
ющий трансдукцию сигнала и фотобиологиче-
тора. Через несколько лет у A. thaliana иден-
ский ответ. Фитохромы связывают билиновые
тифицировали второй криптохром (CRY2), а
хромофоры [27], а рецепторы синего света -
у Drosophila melanogaster открыли ещё один тип
флавиновые хромофоры; криптохромы в каче-
криптохрома - dCRY [32]. В настоящее время
стве хромофора связывают FAD [1].
криптохромы найдены во всех биологиче-
У криптохромов растений (CRYs) FAD
ских царствах и определяются на основе схо-
может существовать в четырёх редокс-фор-
жей двухдоменной структуры, включающей
мах: полностью окисленной форме (FAD),
N-концевой α/β-домен, содержащий β-лист,
анион-радикальной (FAD•-), нейтральной ра-
и C-концевой α-спиральный домен, связы-
БИОХИМИЯ том 88 вып. 6 2023
СИГНАЛЬНЫЕ ПРОЦЕССЫ, РЕГУЛИРУЕМЫЕ КРИПТОХРОМАМИ
949
вающий хромофор FAD. В совокупности они
ируются фотохимическими превращениями
составляют консервативную гомологичную
FAD-хромофора, которые индуцируют изме-
фотолиазе область (photolyase homologous
нения в хромофор-белковых взаимодействиях.
region, PHR), называемую также PHR-доме-
Возникающие конформационные переходы
ном, который состоит из примерно 500 остат-
в структуре белка, непосредственно окру-
ков. Дополнительно структура криптохро-
жающего хромофор, распространяются внут-
мов включает C-концевое удлинение (CRY
ри фоторецептора, приводя к разобщению
C-terminal extension, CCE), называемое также
PHR- и CCE-доменов, что сопровождается
CCE-доменом (у CRY1 и CRY2 он состоит из
формированием олигомеров криптохромных
180 и 110 остатков соответственно, а у фото-
молекул [41]. В этом состоянии криптохромы
лиаз отсутствует) [33, 34].
фосфорилируются фоторегуляторными про-
Большинство криптохромов действуют как
тенкиназами (photoregulatory protein kinases,
регуляторы экспрессии генов, особенно тран-
PPKs), становятся функционально активными
скрипции [23, 35]. Из двух CRYs CRY1 функ-
и образуют комплексы со многими сигнальны-
ционирует и в ядре, и в цитоплазме, тогда как
ми белками, включая транскрипционные фак-
CRY2, по-видимому, исключительно ядерный
торы и регуляторы экспрессии генов. Зависи-
белок, который завершает свой посттранс-
мые от синего света взаимодействия в таких
ляционный цикл в ядре [36, 37]. У растений
комплексах вызывают изменение активности
криптохромы регулируют множество фото-
сигнальных белков, определяющее их способ-
ответов, в том числе таких, как транскрипция
ность регулировать экспрессию реагирующих
геномов, ингибирование вытягивания гипоко-
на свет генов (light-responsive genes, LRGs) [11].
тиля, избежание тени, циркадные ритмы, ини-
Отмеченные процессы составляют молеку-
циация цветения, программированная кле-
лярную основу сигнальной активности крип-
точная смерть и светозависимый стресс [23].
тохромов в фотоморфогенетическом развитии
Кроме того, CRYs могут вовлекаться в маг-
растений. В настоящем обзоре рассмотрены
ниторецепцию [38], как это показано в отно-
и проанализированы недавние данные, полу-
шении криптохромов других организмов [39].
ченные при изучении сигнальных механизмов
Хотя CRYs могут независимо регулировать
фоторегуляторных процессов, опосредуемых
фотоморфогенез, опосредованные ими ответы
этими фоторецепторами.
часто антагонистически или избыточно регу-
лируются с вовлечением других фоторецепто-
ров, а именно фитохромов, UVR8 и LOV-бел-
БЕЛКИ CPF:
ков. Это объясняется тем, что криптохромы
ОБЩАЯ ХАРАКТЕРИСТИКА
индуцируют ответы на синий свет путём взаи-
модействия со многими сигнальными белка-
Гены родственных криптохромам белков
ми, некоторые из которых могут взаимодей-
найдены в геномах многих организмов из раз-
ствовать и с отмеченными фоторецепторными
ных филогенетических групп - бактерий, водо-
белками, вследствие чего может измениться
рослей, грибов и животных [1, 40, 42, 43]. Все
(позитивно или негативно) эффективность
криптохромные белки объединяет значитель-
сигнальных процессов, запускаемых CRYs [11].
ное структурное сходство с фотолиазами, ко-
В последнее десятилетие криптохромы так-
торые содержат кофактор FAD в основном со-
же широко изучаются у зелёных водорослей,
стоянии в форме FADH-. В фотовозбуждённом
содержащих подобные растениям и подобные
состоянии FADH- непосредственно вовлекает-
животным типы криптохромов, которые при-
ся в репарацию двух главных УФ-индуцирован-
надлежат к семейству криптохромов/фотолиаз
ных повреждений ДНК - циклобутановых пи-
(cryptochrome/photolyase family, CPF). Некото-
римидиновых димеров (cyclobutane pyrimidine
рые криптохромы водорослей отличаются от
dimers, CPDs) и пиримидин (6-4) пиримидоно-
криптохромов высших растений тем, что про-
вых фотопродуктов (pyrimidine (6-4) pyrimidone
являют бифункциональные свойства, действуя
photoproducts, 6-4PPs). Ферменты, репарирую-
и как транскрипционные регуляторы, и как
щие CPDs или 6-4PPs, названы соответственно
ДНК-фотолиазы. Кроме того, эти криптохро-
CPD-фотолиазами или (6-4)-фотолиазами [44].
мы могут реагировать на свет и опосредовать
Квантовый выход фоторепарации CPD-фото-
фотоответы водорослей в более широкой обла-
лиазами значительно превышает квантовый
сти спектра, чем CRYs, а именно в диапазоне
выход фоторепарации (6-4)-фотолиазами, не-
500-650 нм [40].
смотря на сходство структур двух типов фер-
По современным представлениям, фото-
ментов и первичной фотохимии их флави-
сенсорные процессы в криптохромах иници-
нового кофактора. Это объясняется тем, что
БИОХИМИЯ том 88 вып. 6 2023
950
ФРАЙКИН и др.
фоторепарация 6-4PP - более сложная реак-
новленном состоянии флавиновый хромофор
ция, чем фоторепарация CPD (подробнее этот
либо инициирует трансдукцию сигнала (FADH•),
вопрос рассматривается в следующем разделе).
либо после последующего поглощения фотона
Принято считать, что криптохромы эволю-
катализирует репарацию ДНК (FADH-). Бы-
ционировали от фотолиазного предшествен-
стрый перенос электрона с поверхности белка
ника. Подтверждением общих эволюционных
на FAD обеспечивается консервативной триа-
корней фотолиаз и криптохромов может слу-
дой триптофанов (Trp-триада). Этот внутри-
жить открытие у грибов, диатом и зелёных во-
молекулярный путь переноса электрона удли-
дорослей белков с двойной функцией - ДНК-
няется у CraCRY и криптохромов животных
репарирующей и регуляторной [10, 40, 45-47].
типа I (например, dCRY) за счёт четвёртого
Большинство криптохромов не способны ката-
ароматического остатка [49, 50] - тирозина
лизировать фоторепарацию ДНК. Однако от-
(CraCRY) или триптофана (dCRY). Удлинённый
дельные их представители, относящиеся к бел-
электрон-транспортный путь важен не толь-
кам CPF, сохраняют эту способность. Согласно
ко для реакций фотовосстановления FAD у
современной филогенетической и функцио-
белков aCRY, но и для функционирования
нальной классификации [10, 43], белки CPF
(6-4)-фотолиаз.
подразделяются на четыре класса. Среди них
У CRYs фотовосстановление FAD вызыва-
отметим два основных: растительные крипто-
ет высвобождение CCE-домена из ядра PHR-
хромы (CRYs) и подобные им белки (plant-like
домена, с которым CCE был сильно связан в
CRYs, pCRYs) и криптохромы животных и схо-
темноте. В результате CCE-домен переходит
жие с ними белки (animal-like CRYs, aCRYs).
в неупорядоченное состояние, и его деструк-
Криптохромы растений и зелёных водорос-
турированная часть из 80 остатков становится
лей, например, pCRY Chlamydomonas reinhardtii
доступной для взаимодействия с некоторыми
(Chlamydomonas photolyase homologous 1, CPH1),
белками - компонентами сигнальных путей
действуют в основном как сенсорные фото-
криптохромов. Поэтому ранее полагали, что у
рецепторы, тогда как криптохромы животных
CRY1 и CRY2 только CCE играет роль эффек-
могут выполнять функции либо фоторецепто-
торного домена. Однако полученные в послед-
ров (тип I), либо не реагирующих на свет ре-
нее время данные о физическом взаимодей-
гуляторов циркадных ритмов (тип II). Крипто-
ствии ряда сигнальных белков с PHR-доменом
хромы типа I найдены у насекомых (их прото-
этих криптохромов позволяют считать, что
типом считается криптохром дрозофилы dCRY),
PHR тоже может выполнять функцию эффек-
а криптохромы типа II - у млекопитающих.
торного домена [23].
Другой тип криптохромов идентифицирован
Впервые определённая кристаллическая
у птиц, рыб, земноводных и пресмыкающих-
структура PHR-домена CRY1 проявляет уди-
ся; эти белки содержат FAD и фотохимиче-
вительное сходство со структурой CPD-фото-
ски активны [48]. Несколько белков aCRYs
лиазы Escherichia coli, несмотря на их эволюци-
обнаружено вне царства животных - главным
онную отдалённость. Вместе с тем кристалли-
образом у фотосинтезирующих водорослей.
ческая структура растительного криптохрома
Зелёная водоросль C. reinhardtii содержит поми-
полной длины из-за технической трудности
мо белка pCRY (CPH1) белок aCRY (CraCRY),
кристаллизации белка с большим внутренне
который на 40-50% гомологичен по последо-
неупорядоченным CCE-доменом пока не по-
вательности белкам aCRYs из зелёной водорос-
лучена. У криптохрома дрозофилы dCRY со
ли Ostreococcus tauri и диатомы Phaeodactylum
сравнительно малым CCE-доменом удалось
tricornutum. Эти криптохромы водорослей яв-
определить не только кристаллическую струк-
ляются бифункциональными белками, про-
туру полной длины, но и его комплекса с сиг-
являющими активность (6-4)-фотолиазы и функ-
нальным белком. Результаты этого исследова-
цию регуляторов экспрессии генов. Интерес-
ния продемонстрировали центральную роль
но, что регуляторная функция белка CraCRY
FAD-связывающего кармана и физических
выявлена не только при действии синего света,
взаимодействий между PHR- и CCE-доменами
поглощаемого хромофором FAD в окисленной
в функционировании криптохромов живот-
форме, но и при действии красного света, по-
ных [51]. Существует общее согласие в том,
глощаемого FADH• [40].
что и у CRYs светозависимые изменения во
Почти все белки CPF подвергаются свето-
взаимодействии между PHR- и CCE-доменами
индуцированной реакции, называемой фото-
могут объяснить фотоиндуцированные кон-
активацией, в которой функционально неак-
формационные переходы. Однако конкретные
тивный FAD при фотовозбуждении отрывает
сайты взаимодействия между PHR и CCE ещё
электрон от соседнего триптофана. В восста-
предстоит идентифицировать.
БИОХИМИЯ том 88 вып. 6 2023
СИГНАЛЬНЫЕ ПРОЦЕССЫ, РЕГУЛИРУЕМЫЕ КРИПТОХРОМАМИ
951
Как отмечено выше, фотоактивация CRYs
восстанавливать CPD или 6-4PP для после-
начинается с поглощения фотона синего света
дующей их репарации фотолиазами. Вслед-
хромофором FAD и его фотовосстановления.
ствие переноса электрона от возбуждённого
Это приводит к конформационным изме-
FADH- к CPD или 6-4PP образуются комплек-
нениям, вызывающим разобщение PHR- и
сы с переносом заряда между нейтральным
CCE-доменов и последующий переход фото-
радикалом флавина (FADH•) и анион-радика-
рецептора из конформации с закрытым CCE-
лом CPD или 6-4PP. Далее в анион-радикале
доменом в конформацию с открытым CCE-
CPD происходит перераспределение электрон-
доменом. Такие изменения сопровождаются
ной плотности, вследствие чего циклобутано-
формированием олигомеров CRYs, которые
вое кольцо расщепляется на два исходных пи-
необходимы для образования их комплексов
римидина. Обратный перенос избыточного элек-
с различными сигнальными белками. Взаимо-
трона на FADH• восстанавливает его в актив-
действия в таких комплексах изменяют актив-
ную форму FADH-. По сравнению с репара-
ность сигнальных белков, обеспечивая тем
цией CPD репарация 6-4PP - более сложный
самым регуляцию ими экспрессии LRGs и
процесс. Это связано с тем, что для форми-
программ развития растений. При изучении
рования двух неповреждённых пиримидинов
перечисленных процессов в последние годы
анион-радикал 6-4PP должен быть предвари-
получены новые результаты, которые рассмат-
тельно конвертирован в другой интермедиат -
риваются в последующих разделах.
оксетан [16, 29, 52]. Согласно данным кристал-
лографического анализа структуры комплекса
PHR-домена CraCRY с фрагментом ДНК, со-
ФОТОХИМИЯ
держащим 6-4PP [53], механизм репарации ДНК
FAD-ХРОМОФОРА В CPF-БЕЛКАХ
(6-4)-фотолиазой предполагает поглощение
И ФОТОАКТИВАЦИЯ КРИПТОХРОМОВ
второго фотона для перехода от интермедиата
оксетана к двум исходным пиримидинам.
Фотохимические свойства флавинов опре-
Большинство данных по фотохимии крип-
деляются системой сопряжённых двойных
тохромов получено при изучении CRY1 и
связей их изоаллоксазинового кольца. При по-
CRY2 A. thaliana, CPH1 и CraCRY C. reinhardtii
глощении фотона УФА/синего света происхо-
и dCRY D. melanogaster [14, 50, 54-57]. В отли-
дит перераспределение заряда в изоаллоксази-
чие от фотолиаз, эти криптохромы в основ-
новом кольце и изменение редокс-потенциала
ном состоянии содержат FAD в полностью
флавина, что индуцирует его фотохимические
окисленной форме и обычно (за исключением
превращения, вовлекающие перенос элек-
CraCRY, который дополнительно встраивает хро-
трона/протона и образование радикальных
мофор 8-HDF) не связывают антенный хромо-
форм [16, 29]. Структурное сходство между
фор. Как следует из структур криптохромов,
PHR-доменом криптохромов и фотолиазами,
это обусловлено замещением ключевых ами-
особенно в белковом кармане, связывающем
нокислотных остатков в белковых карманах,
FAD, определяет общий принцип их реаги-
связывающих антенный хромофор, что пре-
рования на свет: у обоих типов белков фото-
пятствует его узнаванию и встраиванию.
индуцированное возбуждение хромофора
При исследовании CRY1 и CPH1 с при-
инициирует реакции переноса электрона. Од-
менением спектроскопии временного разре-
нако механизмы фотохимических процессов
шения в ИК-, УФ- и видимой области уста-
у криптохромов и фотолиаз фундаментально
новлено, что поглощение фотона синего света
различаются, и это, в частности, выражается в
хромофором FAD индуцирует реакцию его вос-
редокс-формах хромофора FAD в ходе его фо-
становления в анион-радикал (FAD•-) посред-
тоциклов.
ством переноса электрона от соседнего остатка
Активация светом фотолиаз происходит с
триптофана - компонента консервативной Trp-
участием двух хромофоров - каталитическо-
триады. Сверхбыстрые реакции переноса элек-
го FADH- и антенного хромофора, функцию
трона от триптофана (Trp1H) к FAD и между
которого у большинства фотолиаз выполняют
концевым триптофаном (Trp3Н) и Trp1H проис-
5,10-метенилтетрагидрофолат
(5,10-methenyl-
ходят за 0,4 пс и 31 пс соответственно. Форми-
tetrahydrofolate, MTHF) или 8-гидроксидезаза-
руемый при фотовосстановлении FAD анион-
флавин (8-hydroxydeazaflavin, 8-HDF). Антен-
радикал FAD•- протонируется у CRY1 и CPH1
ные хромофоры интенсивно поглощают фо-
в течение нескольких микросекунд и переходит
тоны в области УФА и по физическому резо-
в радикал FADH•. Донором протона в этой ре-
нансному механизму передают энергию воз-
акции может служить расположенный близко
буждения к FADH-, повышая его потенциал
к изоаллоксазиновому кольцу флавина остаток
БИОХИМИЯ том 88 вып. 6 2023
952
ФРАЙКИН и др.
аспарагиновой кислоты. В пользу этого пред-
Как уже было отмечено, сигнальная актив-
положения свидетельствуют данные, согласно
ность криптохромов обеспечивается их CCE-
которым замена аспарагиновой кислоты на
доменом, тогда как PHR-домен осуществляет
цистеин в PHR-домене CPH1 полностью бло-
регулируемый светом контроль над функцией
кирует перенос протона [58]. Важное след-
CCE. После фотоактивации CCE-домен выс-
ствие реакции протонирования - стабилиза-
вобождается и может затем взаимодействовать
ция радикала флавина в состоянии FADH•
с некоторыми сигнальными белками. Однако
и продление его времени жизни до несколь-
вопрос о том, как высвобождение CCE связано
ких миллисекунд in vitro и нескольких минут
с фотохимией криптохрома, оставался нере-
in vivo [54, 59]. Свойство FADH• поглощать
шённым. В исследовании с применением ИК-
свет в длинноволновой области спектра (500-
спектроскопии временного разрешения обна-
650 нм) способствовало установлению его
ружено, что после формирования сигнальной
роли как сигнальной формы флавинового хро-
формы FADH• в N-концевом α/β-субдомене
мофора у CRYs. Было показано, что добавле-
PHR фоторецептора CPH1 в течение 500 мкс
ние зелёного света подавляет контролируемые
происходит заметное изменение структуры
криптохромом ответы на синий свет. Антаго-
β-листа. Этот факт рассматривается как сви-
нистическое действие зелёного света коррели-
детельство ключевой роли β-листа во взаимо-
ровало с уменьшением концентрации FADH• в
действии PHR и CCE, а также в их разобщении
результате его фотовосстановления в неактив-
и последующей деструктуризации CCE [58].
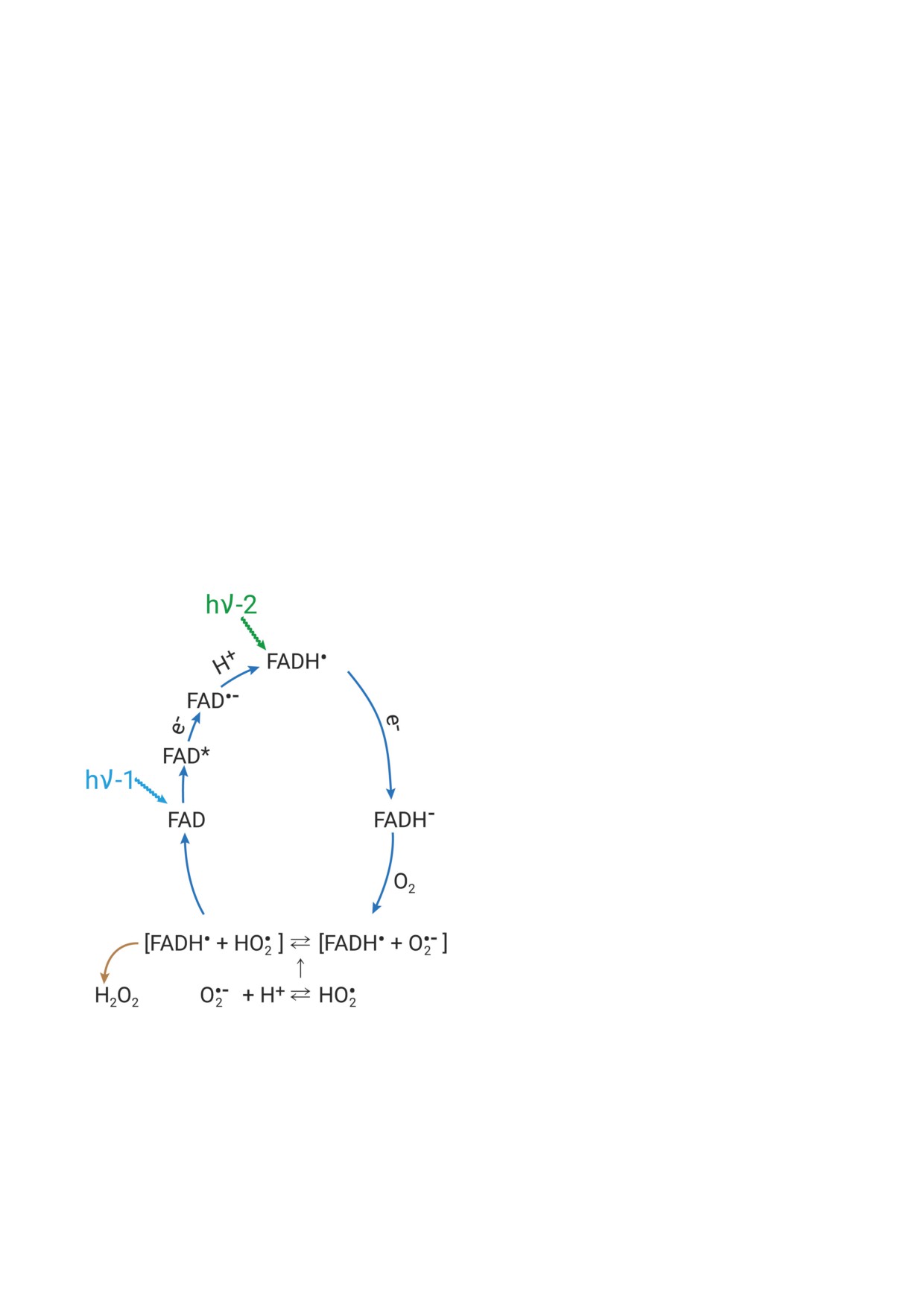
ную форму FADH- [14]. Редокс-фотоцикл FAD
В недавнем исследовании получены дополни-
завершается реакцией FADH- с кислородом
тельные данные, демонстрирующие, что ре-
и регенерацией исходной окисленной формы
организация именно β-листа вызывает дис-
FAD (рис. 2).
социацию CCE от PHR-домена фоторецепто-
ра CPH1 [61]. Интересно, что у CRY1 переход
CCE в неупорядоченное состояние проис-
ходит за время 100 мс после формирования
FADH•, т.е. намного позже. В предложенной
на основе полученных данных модели показа-
но, как структурные изменения синхронизи-
руются с фотохимией флавинового хромофора
у CRYs [58].
ФОТООЛИГОМЕРИЗАЦИЯ
КРИПТОХРОМОВ
И ИХ ВЗАИМОДЕЙСТВИЕ
С СИГНАЛЬНЫМИ БЕЛКАМИ:
СТРУКТУРНЫЕ АСПЕКТЫ
Структуры фотоолигомеров криптохромов.
Как отмечено выше, криптохромы с фотовос-
становленным FAD подвергаются конформа-
ционным изменениям, которые могут приво-
дить к разобщению PHR- и CCE-доменов [61].
Недавно было показано, что этот процесс мо-
жет вызывать изменения во взаимодействии
между молекулами криптохромов, сопрово-
ждаемые их гомоолигомеризацией. Фотоолиго-
Рис. 2. Фотоцикл хромофора FAD c последовательными
меризация требуется для функциональной ак-
его переходами в три редокс-формы. Цикл завершается
тивности CRYs, так как повышает их сродство
окислением FADH- кислородом в исходную форму FAD.
к сигнальным белкам [62]. К этим белкам отно-
На первой стадии окисления интермедиатом может быть
сятся транскрипционные регуляторы, такие
радикальная пара [FADH• + O2•-]. На второй стадии су-
пероксид O2•- заменяется на его протонированную форму
как CRY-interacting bHLHs (CIBs), взаимодей-
HO2•, с которой он находится в равновесии, и это при-
ствующие с фитохромом факторы - регуляторы
водит к окислению FADH• в FAD с выходом H2O2 [60];
транскрипции (phytochrome-interacting factors,
FAD* - фотовозбуждённый FAD, hν-1 - фотон синего
света, hν-2 - фотон длинноволнового видимого света в
PIFs, и CONSTANS, CO); регуляторы крипто-
области 500-650 нм
хромов, такие как PPKs и зависимые от сине-
БИОХИМИЯ том 88 вып. 6 2023
СИГНАЛЬНЫЕ ПРОЦЕССЫ, РЕГУЛИРУЕМЫЕ КРИПТОХРОМАМИ
953
го света ингибиторы CRYs (blue light inhibitors
Взаимодействие CRY-BIC: ингибирование
of CRYs, BICs), а также E3-лигазный ком-
фотоолигомеризации и активации криптохромов.
плекс constitutive photomorphogenic 1 (COP1)/
Инактивация фоторецепторов играет важную
suppressors of PHYA-105 1 (SPAs) [11, 23, 63].
роль в поддержании необходимого уровня их
В результате взаимодействия в комплексе гомо-
светозависимой функциональной активности
олигомера криптохрома с белками изменяется
и в предотвращении чрезмерной чувствитель-
их сигнальная активность, что приводит к изме-
ности клеток к воздействию света. Фотоакти-
нению экспрессии генов и регуляции программ
вированные криптохромы могут подвергаться
развития растений [64]. Следует отметить, что
инактивации по трём различным механизмам,
ключевые детали этой модели не были точно
включая спонтанную темновую реверсию го-
определены, особенно в отношении структур-
моолигомеров в мономеры, взаимодействие с
ных изменений в гомодимере криптохрома, на
ингибиторами (BICs) и убиквитин-зависимый
основании которых можно было бы его отли-
протеолиз. Среди этих механизмов только ин-
чить от структуры мономера. Для решения
гибирование криптохромов, вызываемое BICs,
этого вопроса проведено генетическое изуче-
является светочувствительным процессом. Поэто-
ние связи структура-функция у CRYs [65, 66].
му предполагается, что взаимодействие CRY-
Показано, что мутации остатков Trp-триады
BIC может играть более динамичную роль в
у CRY1 или CRY2 блокируют каскад переноса
регуляции активности криптохромов у расте-
электрона и фотовосстановление FAD in vitro,
ний, растущих на свету [68].
но не влияют на физиологическую активность
Анализ недавно полученной кристалличе-
мутантов in vivo. Некоторые мутанты (напри-
ской структуры комплекса PHR-домена CRY2
мер, W374A у CRY2) проявляют конститутив-
с BIC2 выявил два возможных механизма,
ную, т.е. независимую от света физиологиче-
проясняющих вопрос о том, как белки BIC
скую активность. Эти мутанты способствовали
могут инактивировать CRYs [69]. Во-первых,
определению структуры гомоолигомеров крип-
BIC может ингибировать фотовосстановление
тохромов. В отличие от дикого типа CRY2, ко-
FAD, поскольку связывание BIC2 с PHR уве-
торый подвергается фотоолигомеризации, му-
личивает расстояние между донором электро-
тант W374A CRY2 проявляет гомоолигомери-
на (W397) и акцептором (изоаллоксазиновое
зацию in vitro. Этот результат согласуется с дан-
кольцо FAD) на 1 Å, и это может затруднить
ными о том, что фотоолигомеризация требу-
перенос электрона. Кроме того, связывание
ется для функциональной активности CRY2, и
BIC2 с PHR может привести к вращению кар-
что его мутант W374A конститутивно активен
боксильной боковой цепи предполагаемого до-
in vivo [64]. В недавней работе с применением
нора протона (D393) на 50°, что увеличит рас-
низкотемпературной электронной микроско-
стояние между донором протона и акцептором
пии с визуализацией выявлены конфигурации
протона в хромофоре на 5 Å. Такое изменение
гомодимера и гомотетрамера мутанта W374A
делает протонирование маловероятным. Соот-
CRY2, у которого эти олигомеры формируют-
ветственно, BIC2 может блокировать фотовос-
ся посредством взаимодействий поверхностей
становление FAD в FAD•- и его протонирова-
PHR-доменов. Мутации в интерфейсе гомо-
ние c переходом в сигнальную форму FADH•.
димера приводили к уменьшению его срод-
Во-вторых, BICs могут действовать как ин-
ства к сигнальному белку CIB1. На основании
гибиторы гомоолигомеризации криптохромов.
этого факта предположили, что CIB1 взаимо-
В комплексе PHR-домена CRY2 с BIC2 струк-
действует с CRY2 в интерфейсе гомодимера,
тура фрагмента BIC2 определяет его способ-
и, вероятно, поэтому именно олигомеры, а
ность опоясывать паз между двумя субдоме-
не мономеры являются активными формами
нами PHR-домена. PHR и BIC2 имеют по
криптохромов [67].
16 остатков, которые вовлекаются в формиро-
Структурные изменения в олигомерах
вание комплекса между ними. Индивидуаль-
PHR-домена CRY2 продемонстрированы так-
ные мутации нескольких остатков в интерфей-
же в недавнем исследовании, проведённом с
се комплекса снижали выраженное сродство
кристаллическими структурами PHR-домена
между PHR и BIC2 in vitro. Интерфейсы гете-
в фотоактивном тетрамерном и неактивном
родимера CRY2-BIC2 и гомодимера CRY2-
мономерном состояниях [68]. Формирование
CRY2 содержат по два остатка CRY2, а имен-
тетрамера опосредуется динамичной петлёй,
но W349 и R208. На основании полученных
связывающей PHR- и CCE-домены, которая
данных предполагается, что связывание BICs
способствует перемещению определённых остат-
с CRYs конкурентно ингибирует фотоолиго-
ков в α-6 для их участия в формировании ак-
меризацию CRYs, блокируя тем самым актива-
тивного интерфейса в олигомерном состоянии.
цию фоторецепторов.
5
БИОХИМИЯ том 88 вып. 6 2023
954
ФРАЙКИН и др.
Взаимодействия CRY-CIB и CRY-PIF: пря-
(phytochrome B, phyB) опосредуют фотоответы
мая регуляция экспрессии LRGs. Белок CIB1
избежания тени [20, 74]. Известно, что phyB,
был первым CRY-взаимодействующим тран-
связываясь с PIF3, вызывает его фосфори-
скрипционным регулятором, идентифициро-
лирование и убиквитин-зависимую деграда-
ванным у растений. Как было установлено,
цию [75]. Однако в условиях затенения phyB-
CIB1 при взаимодействии с фотоактивиро-
индуцированная деградация PIF3 ослабляется,
ванным CRY2 индуцирует транскрипцию гена
и это способствует росту растения на слабом
FLOWERING LOCUS T (FT), который коди-
синем свету. Интересно, что в таких условиях
рует центральный регулятор инициации цве-
CRYs могут подавлять деградацию PIF1 [76].
тения [70]. Было также показано, что другие
Согласно выдвинутому предположению, при
CIB-белки (CIB2, CIB4 и CIB5) взаимодей-
низкой интенсивности синего света происхо-
ствуют с фотоактивированным CRY2 и свя-
дит уменьшение эффективности фотоолигоме-
зываются с FT-промотором [71]. Наиболее ве-
ризации криптохрома и ослабление CRY-PIF-
роятно, что CRY2 не влияет на сродство CIB-
взаимодействия с последующим накоплением
белков к ДНК или хроматину [70, 71], однако
PIF-белков. Следует отметить, что взаимодей-
они напрямую взаимодействуют с транскрип-
ствие CRY-PIF, как и CRY-CIB-взаимодей-
ционным фактором CO для инициации цве-
ствие, не влияет на сродство PIFs к ДНК или
тения
[72]. В соответствии с выдвинутым
хроматину, хотя изменяет их активность в ре-
предположением CRY2 может изменить CIB-
гуляции транскрипции.
CO-взаимодействие, обеспечивая тем самым
Фосфорилирование криптохромов PPKs. Хо-
последующую транскрипцию FT-гена. Вопрос
рошо известно, что CRY1 и CRY2 подверга-
о том, как именно CRY2/CIB1-комплекс опо-
ются светозависимому фосфорилированию в
средует регуляцию LRGs, остаётся пока невы-
растительных клетках [77, 78], причём фосфо-
ясненным.
рилирование CRY2 не только повышает актив-
Помимо CIB-белков, CRYs взаимодей-
ность фоторецептора, но также способствует
ствуют с другой группой транскрипционных
его деградации с участием Е3-убиквитинли-
факторов - PIF-белками, которые вовлекаются
газ [37, 77, 79, 80]. В изолированных CRY2-бел-
в фотоморфогенетические ответы, опосредо-
ках выявлено много разных фосфорилиро-
ванные фитохромами [17, 19, 22]. Фотоакти-
ванных остатков, включая семь основных
вированные CRY1 и CRY2 могут физически
фосфосеринов, и уровень фосфорилирования
взаимодействовать с PIF4 и PIF5 посредством
почти всех этих остатков возрастает в ответ
PHR-доменов CRYs и N-концевых доменов
на действие синего света. Мутант SCRY2D не
PIF-белков [73, 74]. Как было показано, в усло-
подвергается фосфорилированию и частично
виях затенения уменьшается не только соот-
утрачивает физиологические функции.
ношение интенсивностей красного/дальнего
Фосфорилирование CRY2 происходит пре-
красного света, но и интенсивность сине-
имущественно в ядре и повышает как его ак-
го света; при этом и CRYs, и фитохром B
тивность, так и дестабилизацию посредством
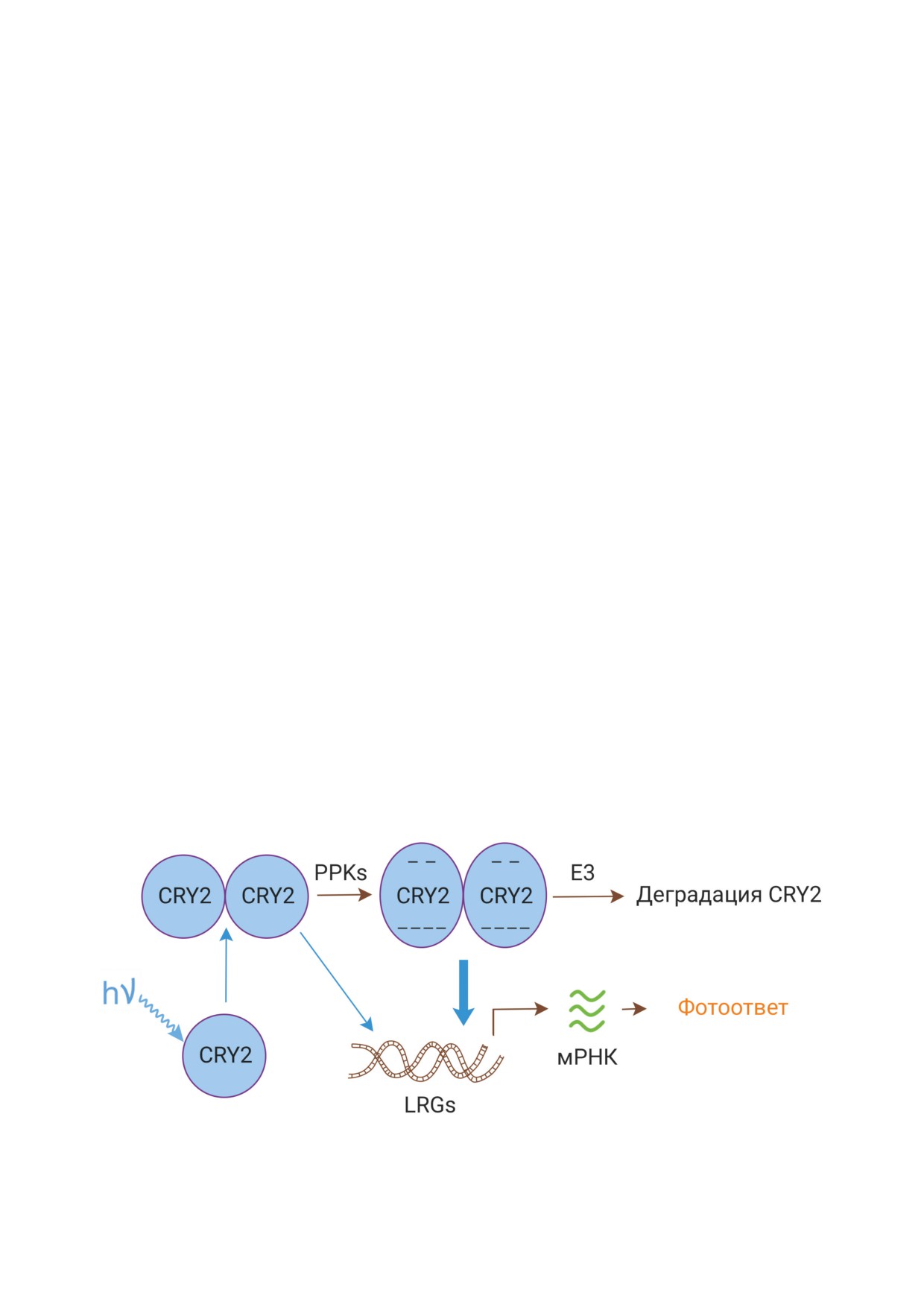
Рис. 3. CRY2 подвергается светозависимым процессам олигомеризации и фосфорилирования, катализируемого PPKs.
Это приводит к формированию полностью активного димера CRY2, который эффективно опосредует регуляцию LRGs,
что сопровождается транскрипцией мРНК и фотобиологическим ответом. Фосфорилированный CRY2 подвергается
также деградации с участием Е3-убиквитинлигазы; hν - фотон синего света
БИОХИМИЯ том 88 вып. 6 2023
СИГНАЛЬНЫЕ ПРОЦЕССЫ, РЕГУЛИРУЕМЫЕ КРИПТОХРОМАМИ
955
фотоиндуцированного изменения конфор-
торы метятся для убиквитинации. Белки SPA
мации фоторецептора [81]. Установлено, что
не требуются для ядерной локализации COP1,
четыре сходные PPKs, специфичные для ра-
однако в отсутствие SPA-белков COP1 не про-
стений, катализируют светозависимое фос-
являет активности [91]. Опознание транскрип-
форилирование CRY1 и CRY2 in vivo. Все
ционных факторов происходит посредством
PPKs взаимодействуют в основном с нефос-
C-концевых WD40-доменов COP1 и SPAs [90].
форилированными CRY-белками и с избыт-
Поскольку WD40-домен SPA1 может замещать
ком фосфорилируют их. Фосфорилирующая
WD40-домен у COP1, но не наоборот, функ-
активность в отношении CRY1 и CRY2 почти
ции этого домена у двух белков, вероятно,
отсутствует у тройных мутантов PPKs; кроме
сходны, но не идентичны [92]. Свет индуциру-
того, CRY2 не подвергается деградации эти-
ет релокализацию COP1 в цитозоль, и, как по-
ми мутантами, что свидетельствует о необ-
казано, это может содействовать стабилизации
ходимости фосфорилирования CRY2 для его
мишени COP1 в ядре - транскрипционного
последующего убиквитин-зависимого протео-
фактора LONG HYPOCOTYL 5 (HY5) [93].
лиза. Эти результаты подтверждают модель,
Установлено, что опосредованный фотоакти-
демонстрирующую, что фотоактивированные
вированным CRY1 выход COP1 из ядра не
CRYs фосфорилируются четырьмя структурно
зависит от SPAs, тогда как этот процесс, инду-
схожими PPKs, и это вызывает конформаци-
цированный дальним красным светом с уча-
онные изменения, повышающие физиологи-
стием фитохрома A, зависит от SPA-белков, а
ческую активность CRY1 и CRY2, а также де-
фитохром B, активированный красным све-
градацию CRY2 [81] (рис. 3).
том, менее эффективен в удалении COP1 из
Кроме криптохромов, у PPKs есть дру-
ядра [87]. Очевидные различия в инициации
гие субстраты, включая белок PIF3, который
фитохромами и CRY1 процесса выхода COP1
вовлекается в сигнальный путь фитохромов.
из ядра свидетельствуют о разных механизмах
На основании полученных данных предложен
участия этих фоторецепторов в светозависи-
механизм, обеспечивающий координацию со-
мой релокализации COP1 в цитозоль, однако
вместных действий криптохромов и фитохро-
конкретные сигнальные механизмы действия
мов в фотоморфогенезе растений в ответ на
каждого фоторецептора остаются пока невы-
разные длины волн света в естественных усло-
ясненными. Кроме того, неизвестно, проис-
виях [75, 81].
ходит ли также светозависимая релокализация
Взаимодействия криптохромов с комплексом
в цитозоль и SPA-белков.
COP1/SPA: непрямая регуляция транскрипции.
Помимо отделения COP1 от транскрип-
Общепринято, что COP1, который был пер-
ционных факторов, их стабилизация может
вым сигнальным белком, идентифицирован-
быть достигнута CRY-опосредованным раз-
ным у растений [82, 83], является централь-
рушением COP1-SPA-взаимодействий, сопро-
ным репрессором фотоморфогенеза, и это
вождаемым инактивацией убиквитинлигазной
подтверждено изучением разных сенсорных
активности COP1/SPA-комплекса. Как было
фоторецепторов
- криптохромов, фитохро-
показано, регуляция активности COP1/SPA
мов и UVR8 [84-87]. Структура COP1 вклю-
осуществляется светозависимым взаимодей-
чает N-концевой домен Really Interesting New
ствием CRY1 и CRY2 с белками SPA [94-96].
Gene (RING), домен coiled-coil и C-концевой
Интересно, что фоторецепторы CRY1 и CRY2
WD40-домен. COP1 действует in vivo в ком-
взаимодействуют с белком SPA1 разными
плексе с четырьмя подобными ему белками
структурными доменами. CRY1 посредством
SPA (SPA1-SPA4), отличие которых от COP1
CCE-домена взаимодействует с WD40-доме-
заключается в том, что в их доменной структу-
ном белка SPA1. Такое взаимодействие при-
ре RING-домен заменён на подобный киназе
водит к ослаблению связывания SPA1 с COP1
домен, проявляющий, как недавно было по-
с последующей диссоциацией и физическим
казано, киназную активность [88-90]. Тетра-
разделением белков. В результате подавля-
мерный COP1/SPA-комплекс из двух COP1- и
ется COP1/SPA-лигазная активность и стаби-
двух SPA-белков функционирует как Е3-убик-
лизируется транскрипционный фактор HY5,
витинлигаза и участвует в деградации тран-
регулирующий рост гипокотиля [87, 94, 95].
скрипционных факторов, которые вовлекают-
В противоположность этому N-концевой PHR-
ся в сигнальные пути фоторецепторов, регули-
домен CRY2 взаимодействует с N-концевым
рующих процессы фотоморфогенеза у расте-
подобным киназе доменом SPA1, что усили-
ний [86].
вает COP1-SPA-взаимодействия и повышает
В темноте COP1 находится преимуще-
стабильность комплекса. В этом состоянии
ственно в ядре, где транскрипционные фак-
COP1/SPA1 E3-убиквитинлигазная активность
БИОХИМИЯ том 88 вып. 6 2023
5*
956
ФРАЙКИН и др.
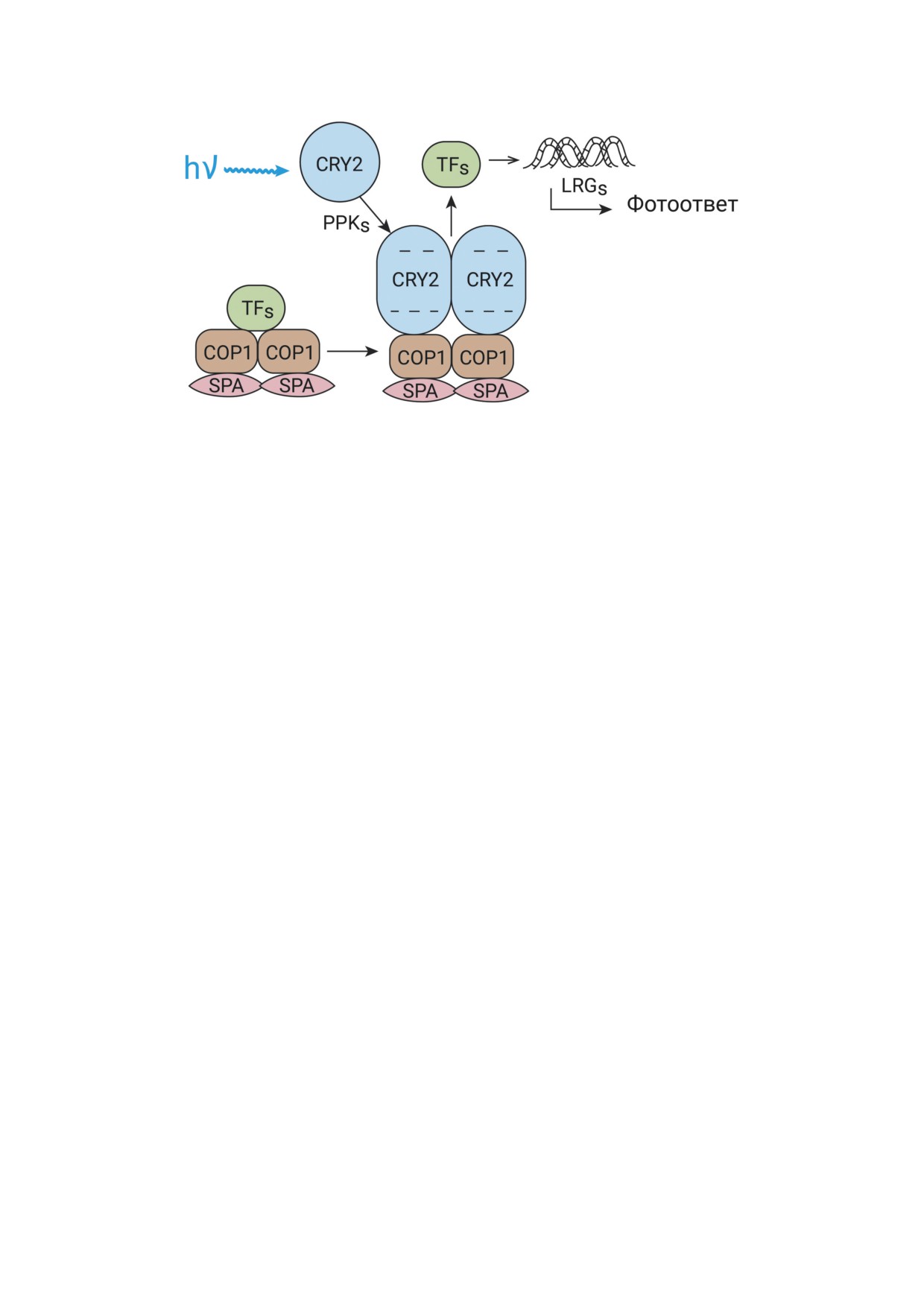
Рис. 4. Модель инактивации убиквитинлигазной активности COP1/SPA-комплекса, вовлекаемого в деградацию тран-
скрипционных факторов (transcription factors, TFs). Фотоактивированный CRY2 в олигомерном фосфорилированном
состоянии конкурирует с TFs за связывание с COP1 в комплексе COP1/SPA и вытесняет TFs из комплекса с последую-
щей их стабилизацией и участием в экспрессии LRGs; hν - фотон синего света
также уменьшается, и последующая стабили-
ЗАКЛЮЧЕНИЕ
зация транскрипционного фактора CO обес-
печивает инициацию им фотопериодического
Успехи в изучении молекулярных основ
цветения [96]. Вопрос о том, как в точности
сигнальных процессов, опосредуемых крипто-
взаимодействие CRY2 с белком SPA1 ингиби-
хромами у растений, связаны с идентифика-
рует активность COP1/SPA-комплекса, оста-
цией в последнее время разнообразных сиг-
ётся нерешённым.
нальных белков, которые образуют комплексы
Помимо взаимодействия с белками SPA,
с фотоактивированными олигомерами крипто-
CRYs C-концевыми доменами могут напря-
хромных молекул. Светозависимые взаимодей-
мую взаимодействовать с COP1 [82, 83], при-
ствия в таких комплексах изменяют активность
чём CRY1-COP1-взаимодействие зависит от
сигнальных белков, обеспечивая прямую (CIB-
SPA-белков, тогда как CRY2-COP1-взаимо-
и PIF-белки) или опосредованную (COP1/
действие от них не зависит [97]. Как продемон-
SPA-белки) регуляцию ими транскрипции
стрировано в недавних исследованиях, фото-
реагирующих на свет генов и процессов фото-
активированный CRY2 инактивирует COP1/
морфогенетического развития растений. Нега-
SPA-комплекс путём конкурентного вытесне-
тивные регуляторы криптохромов, белки BIC,
ния субстратов COP1, а именно, транскрип-
могут блокировать фотосенсорные процессы,
ционных факторов, которые взаимодействуют
запускаемые фотохимическими превращения-
с WD40-доменом COP1 [84, 98, 99]. Этот меха-
ми хромофора FAD, и препятствовать олиго-
низм основан на том, что структуры CRY2 и
меризации фоторецепторов. Механизмы дей-
субстратов COP1 содержат консервативный
ствия BICs недавно подтверждены кристалли-
Val-Pro (VP)-пептид. Как следует из анализа
ческой структурой комплекса BIC2 с PHR-до-
кристаллических структур COP1 с VP-содер-
меном CRY2. Также в недавних исследованиях
жащими пептидами и WD40-домена COP1 с
с привлечением кристаллографического анали-
VP-содержащим пептидом CRY2, CRY2 и суб-
за раскрыт механизм инактивации COP1/SPA-
страты COP1 взаимодействуют с WD40-доме-
комплекса, вовлекаемого в деградацию тран-
ном COP1 через свои соответствующие VP-
скрипционных факторов. Механизм подавле-
пептиды и могут конкурировать за связыва-
ния фотоактивированным CRY2 активности
ние с одним и тем же доменом COP1 [98]. Эти
COP1/SPA-комплекса основан на конкурент-
данные подтверждают механизм, в соответ-
ном связывании фоторецептора с COP1 и
ствии с которым инактивация COP1/SPA-ком-
вытеснении COP1-взаимодействующих тран-
плекса фотоактивированным CRY2 происходит
скрипционных факторов с последующей их
в результате конкурентного вытеснения суб-
стабилизацией. Вместе с тем детали структур-
стратов COP1. Последующее накопление тран-
ных основ взаимодействий криптохромов в
скрипционных факторов приводит к актива-
комплексах с другими сигнальными белками
ции экспрессии реагирующих на свет генов и
пока не выявлены. Ещё один важный вопрос,
процессов фотоморфогенеза растений (рис. 4).
требующий прояснения, относится к динамике
БИОХИМИЯ том 88 вып. 6 2023
СИГНАЛЬНЫЕ ПРОЦЕССЫ, РЕГУЛИРУЕМЫЕ КРИПТОХРОМАМИ
957
комплексов криптохромов с взаимодействую-
рисунков; А.Б. Рубин - обсуждение материала
щими сигнальными белками, а именно, какие
рукописи с соавторами.
точные механизмы могут обеспечивать регу-
Финансирование. Работа выполнена в рам-
ляцию формирования таких комплексов и их
ках научного проекта государственного зада-
диссоциации, и это, по-видимому, представля-
ния МГУ № 121032500058-7.
ет собой наиболее привлекательную задачу для
Конфликт интересов. Авторы заявляют об
дальнейших исследований.
отсутствии конфликта интересов.
Соблюдение этических норм. Настоящая
Вклад авторов. Г.Я. Фрайкин - концеп-
работа не содержит описания выполненных
ция, анализ публикаций, написание текста;
авторами исследований с участием людей и
Н.С. Беленикина - оформление рукописи и
использования животных в качестве объектов.
СПИСОК ЛИТЕРАТУРЫ
1.
Losi, A., and Gartner, W. (2012) The evolution of
11.
Wang, Q., and Lin, C.
(2020) Mechanisms of
flavin-binding photoreceptors: an ancient chromo-
cryptochrome-mediated photoresponses in plants,
phore serving trendy blue-light sensors, Annu. Rev.
Annu. Rev. Plant Biol., 71, 103-129, doi: 10.1146/
Plant Biol., 63, 49-72, doi: 10.1146/annurev-arplant-
annurev-arplant-050718-100300.
042811-105538.
12.
Fraikin, G.
(2017) Photobioregulatory Receptors,
2.
Fraikin, G. Ya., Strakhovskaya, M. G., and Rubin,
Lambert Academic Publishing, Saarbrucken.
A. B. (2013) Biological photoreceptors of light-depen-
13.
Sun, K., and Zhu, Z. (2018) Illuminating the nucleus:
dent regulatory processes, Biochemistry (Moscow), 78,
UVR8 interacts with more, Trends Plant Sci., 23,
1238-1253, doi: 10.1134/S0006297913110047.
279-281, doi: 10.1016/j.tplants.2018.03.002.
3.
Li, F.-W., and Mathews, S.
(2016) Evolutionary
14.
Ahmad, M. (2016) Photocycle and signaling mecha-
aspects of plant photoreceptors, J. Plant Res., 129,
nisms of plant cryptochromes, Curr. Opin. Plant Biol.,
115-122, doi: 10.1007/s10265-016-0785-4.
33, 108-115, doi: 10.1016/j.pbi.2016.06.013.
4.
Podolec, R., Demarsy, E., and Ulm, R. (2021) Percep-
15.
Christie, J. M., Blackwood, L., Petersen, J., and
tion and signaling of ultraviolet-B radiation in plants,
Sullivan, S. (2015) Plant flavoprotein photoreceptors,
Annu. Rev. Plant Biol., 72, 793-822, doi: 10.1146/
Plant Cell Physiol.,
56,
401-413, doi:
10.1093/
annurev-arplant-050718-095946.
pcp/pcu196.
5.
Inoue, K., Nishihama, R., and Kohchi, T. (2017)
16.
Фрайкин Г. Я., Рубин А. Б. (2022) В кн. Горизонты
Evolutionary origin of phytochrome responses and
биофизики. Т. 1 (под ред. Рубина А. Б.), Инсти-
signaling in land plants, Plant Cell Environ., 40, 2502-
тут компьютерных исследований, М.-Ижевск,
2508, doi: 10.1111/pce.12908.
с. 426-454.
6.
Fraikin, G. Ya., Strakhovskaya, M. G., Belenikina,
17.
Cheng, M. C., Kathare, P. K., Paik, I., and Huq, E.
N. S., and Rubin, A. B. (2015) Bacterial photosenso-
(2021) Phytochrome signaling networks, Annu.
ry proteins: regulatory functions and optogenetic ap-
Rev. Plant Biol., 72, 217-244, doi: 10.1146/annurev-
plications, Microbiology, 84, 461-472, doi: 10.1134/
arplant-080620-024221.
S0026261715040086.
18.
Bae, G., and Choi, G. (2008) Decoding of light signals
7.
Demarsy, E., Goldschmidt-Clemont, M., and Ulm, R.
by plant phytochromes and their interacting proteins,
(2018) Coping with “dark sides of the sun” through
Annu. Rev. Plant Biol., 59, 281-311, doi: 10.1146/
photoreceptor signaling, Trends Plant Sci., 23, 260-
annurev.arplant.59.032607.092859.
271, doi: 10.1016/j.tplants.2017.11.007.
19.
Franklin, K. A., and Quail, P. H. (2010) Phytochrome
8.
Фрайкин Г. Я. (2018) Белковые сенсоры света:
functions in Arabidopsis development, J. Exp. Bot., 61,
фотовозбуждённые состояния, сигнальные свой-
11-24, doi: 10.1093/jxb/erp304.
ства и применение в оптогенетике, АР-Консалт,
20.
Fraser, D. P., Hayes, S., and Franklin, K. A. (2016)
Москва.
Photoreceptor crosstalk in shade avoidance, Curr. Opin.
9.
Ponnu, J., and Hoecker, U.
(2022) Signaling
Plant Biol., 33, 1-7, doi: 10.1016/jpbi.2016.03.008.
mechanisms by Arabidopsis cryptochromes, Front.
21.
Chen, M., and Chory, J. (2011) Phytochrome sig-
Plant Sci., 13, 844714, doi: 10.3389/fpls.2022.844714.
naling mechanisms and the control of plant develop-
10.
Vechtomova, Y. L., Telegina, T. A., and Kritsky,
ment, Trends Cell Biol., 21, 664-671, doi: 10.1016/j.tcb.
M. S. (2020) Evolution of proteins of the DNA
2011.07.002.
photolyase/cryptochrome
family,
Biochemistry
22.
Pham, V. N., Kathare, P. K., and Huq, E. (2018) Phy-
(Moscow), 85 (Suppl. 1), S131-S153, doi: 10.1134/
tochromes and phytochrome interacting factors, Plant
S0006297920140072.
Physiol., 176, 1025-1038, doi: 10.1104/pp.17.01384.
БИОХИМИЯ том 88 вып. 6 2023
958
ФРАЙКИН и др.
23.
Wang, Q., Zuo, Z., Wang, X., Liu, Q., Gu, L.,
37.
Yu, X., Klejnot, J., Zhao, X., Shalitin, D., Maymon, M.,
Oka, Y., and Lin, C. (2018) Beyond the photocycle -
Yang, H., Lee, J., Liu, X., Lopez, J., and Lin, C.
how cryptochromes regulate photoresponses in plants?
(2007) Arabidopsis cryptochrome 2 completes its post-
Curr. Opin. Plant Biol., 45, 120-126, doi: 10.1016/
translational life cycle in the nucleus, Plant Cell, 19,
j.pbi.2018.05.014.
3146-3156, doi: 10.1105/tpc.107.053017.
24.
Demarsy, E., and Fankhauser, C. (2009) Higher plants
38.
Pooam, M., Arthaut, L.-D., Burdick, D., Link, J.,
use LOV to perceive blue light, Curr. Opin. Plant Biol.,
Martino, C. F., and Ahmad, M. (2019) Magnetic sen-
12, 69-74, doi: 10.1016/j.pbi.2008.09.002.
sitivity mediated by the Arabidopsis blue-light recep-
25.
Christie, J. M., Arvai, A. S., Baxter, K. J.,
tor cryptochrome occurs during flavin reoxidation in
Heilmann, M., Pratt, A. J., O’Hara, A., Kelly, S. M.,
the dark, Planta, 249, 319-332, doi: 10.1007/s00425-
Hothorn, M., Smith, B. O., Hitomi, K., Jenkins, G. I.,
018-3002-y.
and Getzoff, E. D. (2012) Plant UVR8 photoreceptor
39.
Zoltowski, B. D., Chelliah, Y., Wickramaratne, A.,
senses UV-B by tryptophan-mediated disruption of
Jarecha, L., Karki, N., Xu, W., Mouritsen, H., Hore,
cross-dimer salt bridges, Science, 335, 1492-1496,
P. J., Hibbs, R. E., Green, C. B., and Takahashi, J. S.
doi: 10.1126/science.1218091.
(2019) Chemical and structural analysis of a photo-
26.
Fraikin, G. Ya. (2018) Signaling mechanisms regu-
active vertebrate cryptochrome from pigeon, Proc.
lating diverse plant cell responses to UVB radiation,
Natl. Acad. Sci. USA, 116, 19449-19457, doi: 10.1073/
Biochemistry (Moscow), 83, 787-794, doi: 10.1134/
pnas.1907875116.
S0006297918070027.
40.
Petersen, J., Rredhi, A., Szyttenholm, J., Oldemeyer, S.,
27.
Rockwell, N. C., Shang, L., Martin, S. S., and
Kottke, T., and Mittag, M. (2021) The world of algae
Lagarias, J. C. (2009) Distinct classes of red/far-red
reveals a broad variety of cryptochrome properties and
photochemistry within the phytochrome superfamily,
functions, Front. Plant Sci., 12, 748760, doi: 10.3389/
Proc. Natl. Acad. Sci. USA, 106, 6123-6127, doi:
fpls.2021.766509.
10.1073/pnas.0902370106.
41.
Palayam, M., Ganapathy, J., Guercio, A. M., Tal, L.,
28.
Schwinn, K., Ferre, N., and Huix-Rotllant, M.
Deck, S. L., and Shabek, K. N. (2021) Structur-
(2020) UV-visible absorption spectrum of FAD and its
al insights into photoactivation of plant crypto-
reduced forms embedded in a cryptochrome protein,
chrome-2, Commun. Biol., 4, 28, doi: 10.1038/s42003-
Phys. Chem. Chem. Phys.,
22,
12447-12455, doi:
020-01531-x.
10.1039/d0cp01714k.
42.
Chaves, I., Pokorny, R., Byrdin, M., Hoang, N.,
29.
Fraikin, G. Ya. (2022) Photosensory and signaling
Ritz, T., Brettel, K., Essen, L.-O., van der Horst,
properties of cryptochromes, Mosc. Univ. Biol. Sci.
G. T., Batschauer, A., and Ahmad, M. (2011) The
Bull., 77, 54-63, doi: 10.3103/S0096392522020031.
cryptochromes: blue light photoreceptors in plants
30.
Ahmad, M., and Cashmore, A. R. (1993) HY4 gene of
and animals, Annu. Rev. Plant Biol., 62, 335-364,
A. thaliana encodes a protein with characteristics of a
doi: 10.1146/annurev-arplant-042110-103759.
blue-light photoreceptor, Nature, 366, 162-166, doi:
43.
Ozturk, N. (2017) Phylogenetic and functional classi-
10.1038/366162a0.
fication of the photolyase/cryptochrome family, Pho-
31.
Sancar, A. (2004) Photolyase and cryptochrome blue-
tochem. Photobiol., 93, 1-22, doi: 10.1111/php.12676.
light photoreceptors, Adv. Protein Chem., 69, 73-100,
44.
Zhang, M., Wang, L., and Zhong, D. (2017) Pho-
doi: 10.1016/S0065-3233(04)69003-6.
tolyase: dynamics and electron-transfer mechanisms
32.
Cashmore, A. R., Jarillo, J. A., Wu, Y. J., and Liu, D.
of DNA repair, Arch. Biochem. Biophys., 632, 158-174,
(1999) Cryptochromes: blue light receptors for plants
doi: 10.1016/j.abb.2017.08.007.
and animals, Science, 284, 760-765, doi: 10.1126/
45.
Bayram, O., Braus, G. H., Fischer, R., and Rodriguez-
science.284.5415.760.
Romero, J. (2010) Spotlight on Aspergillus nidulands
33.
Muller, M., and Carell, T. (2009) Structural biology
photosensory systems, Fungal Genet. Biol., 47, 900-
of DNA photolyases and cryptochromes, Curr. Opin.
908, doi: 10.1016/j.fgb.2010.05.008.
Struct. Biol., 19, 277-285, doi: 10.1016/j.sbi.2009.05.003.
46.
Konig, S., Juhas, M., Jager, S., Kottke, T., and
34.
Zoltowski, B. D. (2015) Resolving cryptic aspects of
Buchel, C. (2017) The cryptochrome-photolyase pro-
cryptochrome signaling, Proc. Natl. Acad. Sci. USA,
tein family in diatoms, J. Plant Physiol., 217, 15-19,
112, 8811-8812, doi: 10.1073/pnas.1511092112.
doi: 10.1016/j.plph.2017.06.015.
35.
Takahashi, J. S. (2017) Transcriptional architecture of
47.
Kottke, T., Oldemeyer, S., Wenzel, S., Zou, Y., and
the mammalian circadian clock, Nat. Rev. Genet., 18,
Mittag, M. (2017) Cryptochrome photoreceptors in
164-179, doi: 10.1038/nrg.2016.150.
green algae: unexpected versatility of mechanisms and
36.
Wu, G., and Spalding, E. P. (2007) Separate functions
functions, J. Plant Physiol., 217, 4-14, doi: 10.1016/
for nuclear and cytoplasmic cryptochrome 1 during
j.plph.2017.05.021.
photomorphogenesis of Arabidopsis seedlings, Proc.
48.
Michael, A. K., Fribourgh, J. L., Van Gelder, R. N.,
Natl. Acad. Sci. USA, 104, 18813-18818, doi: 10.1073/
and Partch, C. L. (2017) Animal cryptochromes: di-
pnas.0705082104.
vergent roles in light perception, circadian timekeeping
БИОХИМИЯ том 88 вып. 6 2023
СИГНАЛЬНЫЕ ПРОЦЕССЫ, РЕГУЛИРУЕМЫЕ КРИПТОХРОМАМИ
959
and beyond, Photochem. Photobiol., 93, 128-140, doi:
cryptochrome signaling states in vivo, Plant J., 74,
10.1111/php.12677.
583-592, doi: 10.1111/tpj.12144.
49.
Oldemeyer, S., Franz, S., Wenzel, S., Essen, L.-O.,
60.
Muller, P., and Ahmad, M. (2011) Light-activated
Mittag, M., and Kottke, T. (2016) Essential role of
cryptochrome reacts with molecular oxygen to form
an unusual long-lived tyrosil radical in the response
a flavin-superoxide radical pair consistent with
to red light of the animal-like cryptochrome aCRY,
magnetoreception, J. Biol. Chem., 286, 21033-21040,
J. Biol. Chem.,
291,
14062-14071, doi:
10.1074/
doi: 10.1074/jbc.M111.228940.
jbc.M116.726976.
61.
Goett-Zink, L., Toschke, A. L., Petersen, J.,
50.
Paulus, B., Bajzath, C., Melin, F., Heidinger, L.,
Mittag, M., and Kottke, T.
(2021) C-terminal
Kromm, V., Herkersdorf, C., Benz, U., Mann, L.,
extension of plant cryptochrome dissociates from the
Stehle, P., Hellwig, P., Weber, S., and Schleicher, E.
β-sheet of the flavin-binding domain, J. Phys. Chem.
(2015) Spectroscopic characterization of radicals and
Lett., 12, 5558-5563, doi: 10.1021/acs.jpclett.1c00844.
radical pairs in fruit fly cryptochrome - protonated
62.
Liu, Q., Su, T., He, W., Ren, H., Liu, S., Chen, Y.,
and nonprotonated flavin radical-states, FEBS J., 282,
Gao, L., Hu, X., Lu, H., Cao, S., Huang, Y., Wang, X.,
3175-3189, doi: 10.1111/febs.13299.
Wang, Q., and Lin, C. (2020) Photooligomerization
51.
Zoltowski, B. D., Vaidya, A. T., Top, D., Widom, J.,
determines photosensitivity and photoreactivity of
Young, M. W., and Crane, B. R. (2011) Structure of
plant cryptochromes, Mol. Plant., 13, 398-413, doi:
full-length Drosophila cryptochrome, Nature, 480,
10.1016/j.molp.2020.01.002.
396-399, doi: 10.1038/nature10618.
63.
Yang, Z., Liu, B., Su, J., Liao, J., Lin, C., and Oka, Y.
52.
Sancar, A. (2008) Structure and function of pho-
(2017) Cryptochromes orchestrate transcription regu-
tolyase and in vivo enzymology: 50th anniversa-
lation of diverse blue light responses in plants, Photo-
ry, J. Biol. Chem., 283, 32153-32157, doi: 10.1074/
chem. Photobiol., 93, 112-127, doi: 10.1111/php.12663.
jbc.R800052200.
64.
Wang, Q., and Lin, C. (2020) A structural view of
53.
Franz, S., Ignatz, E., Wenzel, S., Zielosko, H., Putu, E.,
plant CRY2 photoactivation and inactivation, Nat.
Maestre-Reyna, M., Tsai, M.-D., Yamomoto, J.,
Struct. Mol. Biol., 27, 401-403, doi: 10.1038/s41594-
Mittag, M., and Essen, L.-O. (2018) Structure of the
020-0432-6.
bifunctional cryptochrome aCRY from Chlamydo-
65.
Gao, J., Wang, X., Zhang, M., Bian, M., Deng, W.,
monas reinhardtii, Nucleic Acids Res., 46, 8010-8022,
Zuo, Z., Yang, Z., Zhong, D., and Lin, C. (2015)
doi: 10.1093/nar/gky621.
Trp triad-dependent rapid photoreduction is not re-
54.
Hense, A., Herman, E., Oldemeyer, S., and Kottke, T.
quired for the function of Arabidopsis CRY1, Proc.
(2015) Proton transfer to flavin stabilizes the signaling
Natl. Acad. Sci. USA, 112, 9135-9140, doi: 10.1073/
state of the blue light receptor plant cryptochrome,
pnas.1504404112.
J. Biol. Chem.,
290,
1743-1751, doi:
10.1074/
66.
Liu, H., Su, T., He, W., Wang, G., and Lin, C. (2020)
jbc.M114.606327.
The universally conserved residues are not universally
55.
Lacombat, F., Espagne, A., Dozova, N., Plaza, P.,
required for stable protein expression or functions
Muller, P., Brettel, K., Franz-Badur, S., and Essen, L.-O.
of cryptochromes, Mol. Biol. Evol., 37, 327-340,
(2019) Ultrafast oxidation of a tyrosine by proton-
doi: 10.1093/molbev/msz217.
coupled electron transfer promotes light activation of
67.
Shao, K., Zhang, X., Li, X., Hao, Y., Huang, X.,
an animal-like cryptochrome, J. Am. Chem. Soc., 141,
Ma, M., Zhang, M., Yu, F., Liu, H., and Zhang, P.
13394-13409, doi: 10.1021/jacs.9b03680.
(2020) The oligomeric structures of plant crypto-
56.
Oldemeyer, S., Haddat, A. Z., and Fleming, G. R.
chromes, Nat. Struct. Mol. Biol., 27, 480-488, doi:
(2020) Interconnection of the antenna pigment
10.1038/s41594-020-0420-x.
8-HDF and flavin facilitates red-light reception in bi-
68.
Wang, Q., Zuo, Z., Wang, X., Gu, L., Koshizumi, T.,
functional animal-like cryptochrome, Biochemistry,
Yang, Z., Yang, L., Liu, Q., Liu, W., Han, Y. J., Kim,
59, 594-604, doi: 10.1021/acs.biochem.9b00875.
J. I., Liu, B., Wohlschlegel, J. A., Matsui, M., Oka, Y.,
57.
Goett-Zink, L., and Kottke, T.
(2021) Plant
and Lin, C. (2016) Photoactivation and inactivation
cryptochromes
illuminated:
a
spectroscopic
of Arabidopsis cryptochrome 2, Science, 354, 343-347,
perspective on the mechanism, Front. Chem.,
9,
doi: 10.1126/science.aaf9030.
780199, doi: 10.3389/fchem.2021.780199.
69.
Ma, L., Wang, X., Guan, Z., Wang, L., Wang, Y.,
58.
Thoing, C., Oldemeyer, S., and Kottke, T. (2015)
Zheng, L., Gong, Z., Shen, C., Wang, J., Zhang, D.,
Microsecond deprotonation of aspartic acid and
Liu, Z., and Yin, P. (2020) Structural insight into BIC-
response of the α/β subdomain precede C-terminal
mediated inactivation of Arabidopsis cryptochrome 2,
signaling in the blue light sensor plant cryptochrome,
Nat. Struct. Mol. Biol., 27, 472-479, doi: 10.1038/
J. Am. Chem. Soc., 137, 5990-5999, doi: 10.1021/
s41594-020-0410-z.
jacs.5b01404.
70.
Liu, H., Yu, X., Li, K., Klejnot, J., Yang, H.,
59.
Herbel, V., Orth, C., Wenzel, R., Ahmad, M., Bittl, R.,
Lisiero, D., and Lin, C. (2008) Photoexcited CRY2
and Batschauer, A. (2013) Lifetimes of Arabidopsis
interacts with CIB1 to regulate transcription and floral
БИОХИМИЯ том 88 вып. 6 2023
960
ФРАЙКИН и др.
initiation in Arabidopsis, Science, 322, 1535-1539, doi:
phosphorylation of Arabidopsis cryptochrome 2, Nat.
10.1126/science.1163927.
Commun., 8, 15234, doi: 10.1038/ncomms15234.
71.
Liu, Y., Li, X., Li, K., Lin, H., and Lin, C. (2013)
82.
Wang, H., Ma, L. G., Li, G. M., Zhao, H. Y.,
Multiple bHLH proteins form heterodimers to mediate
and Deng, X. W.
(2001) Direct interaction of
CRY2-dependent regulation of flowering-time in
Arabidopsis cryptochromes with COP1 in light control
Arabidopsis, PLoS Genet., 9, e1003861, doi: 10.1371/
development, Science, 294, 154-158, doi: 10.1126/
journal.pgen.1003861.
science.1063630.
72.
Liu, Y., Li, X., Ma, D., Chen, Z., Wang, J.-W., and
83.
Yang, H.-Q., Tang, R.-H., and Cashmore, A. R.
Liu, H. (2018) CIB and CO interact to mediate CRY2-
(2001) The signaling mechanism of Arabidopsis CRY1
dependent regulation of flowering, EMBO Rep., 19,
involves direct interaction with COP1, Plant Cell, 13,
e45762, doi: 10.15252/embr.2018.45762.
2573-2587, doi: 10.1105/tpc.010367.
73.
Ma, D., Li, X., Guo, Y., Chu, J., Fang, S., Yan, C.,
84.
Ponnu, J. (2020) Molecular mechanisms suppressing
Noel, J. P., and Liu, H. (2016) Cryptochrome 1 inter-
COP1/SPA E3 ubiquitin ligase activity in blue light,
acts with PIFs to regulate high temperature-mediated
Physiol. Plant, 169, 418-429, doi: 10.1111/ppl.13103.
hypocotyl elongation in response to blue light, Proc.
85.
Heijde, M., and Ulm, R. (2012) UV-B photoreceptor-
Natl. Acad. Sci. USA, 113, 224-229, doi: 10.1073/
mediated signaling in plants, Trends Plant Sci., 17,
pnas.1511437113.
230-237, doi: 10.1016/j.tplants.2012.01.007.
74.
Pedmale, U. V., Huang, S. C., Zander, M., Cole,
86.
Hoecker, U. (2017) The activities of the E3 ubiquitin
B. J., Herzel, J., Nery, J. R., and Ecker, J. R. (2016)
ligase COP1/SPA, a key repressor in light signaling,
Cryptochromes interact directly with PIFs to control
Curr. Opin. Plant Biol., 37, 63-69, doi: 10.1016/j.pbi.
plant growth in limiting blue light, Cell, 164, 233-245,
2017.03.015.
doi: 10.1016/j.cell.2015.12.018.
87.
Podolec, R., and Ulm, R. (2018) Photoreceptor-
75.
Ni, W., Xu, S.-L., Gonzalez-Grandio, E., Chalkley,
mediated regulation of the COP1/SPA E3 ubiquitin
R. J., Huhmer, A. F. R., Burlingame, A. L., Wang,
ligase, Curr. Opin. Plant Biol., 45, 18-25, doi: 10.1016/
Z.-Y., and Qual, P. H. (2017) PPKs mediate direct
j.pbi.2018.04.018.
signal transfer from phytochrome photoreceptors to
88.
Paik, I., Chen, F., Ngoc Pham, V., Zhu, L., Kim,
transcription factor PIF3, Nat. Commun., 8, 15236,
J. I., and Huq, E. (2019) A phyB-PIF1-SPA1 kinase
doi: 10.1038/ncomms15236.
regulatory complex promotes photomorphogenesis in
76.
Castillon, A., Shen, H., and Huq, E. (2009) Blue light
Arabidopsis, Nat. Commun., 10, 4216, doi: 10.1038/
induces degradation of the negative regulator phyto-
s41467-019-12110-y.
chrome interacting factor 1 to promote photomorpho-
89.
Wang, W., Paik, I., Kim, J., Hou, X., Sung, S., and
genic development of Arabidopsis seedlings, Genetics,
Huq, E. (2021) Direct phosphorylation of HY5 by
182, 161-171, doi: 10.1534/genetics.108.099887.
SPA kinases to regulate photomorphogenesis in
77.
Shalitin, D., Yang, H., Mockler, T. C., Maymon, M.,
Arabidopsis, New Phytol., 230, 2311-2326, doi: 10.1111/
Guo, H., Whitelam, G. C., and Lin, C. (2002) Regu-
nph.17332.
lation of Arabidopsis cryptochrome 2 by blue-light-de-
90.
Ponnu, J., and Hoecker, U. (2021) Illuminating the
pendent phosphorylation, Nature, 417, 763-767, doi:
COP1/SPA ubiquitin ligase: fresh insight into its
10.1038/nature00815.
structure and functions during plant photomorpho-
78.
Shalitin, D., Yu, X., Maymon, M., Mockler, T., and
genesis, Front. Plant Sci., 12, 662793, doi: 10.3389/
Lin, C. (2003) Blue-light-dependent in vivo and in vitro
fpls.2021.662793.
phosphorylation of Arabidopsis cryptochrome 1, Plant
91.
Balzerowicz, M., Kemer, K., Schenkel, C., and
Cell, 15, 2421-2429, doi: 10.1105/tpc.013011.
Hoecker, U. (2017) SPA proteins affect the sub-cellular
79.
Weidler, G., zur Oven-Krockhaus, S., Heunemann, M.,
localization of COP1 in the COP1/SPA ubiquitin
Orth, C., Schleifenbaum, F., Harter, K., Hoecker, U.,
ligase complex during photomorphogenesis, Plant
and Batschauer, A. (2012) Degradation of Arabidopsis
Physiol., 174, 1314-1321, doi: 10.1104/pp.17.00488.
CRY2 is regulated by SPA proteins and phytochrome A,
92.
Kerner, K., Nagano, S., Lubbe, A., and Hoecker, U.
Plant Cell, 24, 2610-2623, doi: 10.1105/tpc.112.098210.
(2021) Functional comparison of the WD-repeat do-
80.
Liu, Q., Wang, Q., Liu, B., Wang, W., Wang, X., Park, J.,
mains of SPA1 and COP1 in suppression of photo-
Yang, Z., Du, X., Bian, M., and Lin, C.
(2016)
morphogenesis, Plant Cell Environ., 44, 3273-3282,
The blue-light-dependent polyubiquitination and
doi: 10.1111/pce.14128.
degradation of Arabidopsis cryptochrome 2 requires
93.
Pacin, M., Legris, M., and Casal, J. J. (2014) Rapid
multiple E3 ubiquitin ligases, Plant Cell Physiol., 57,
decline in nuclear constitutive photomorphogenesis 1
2175-2186, doi: 10.1093/pcp/pcw134.
abundance anticipates the stabilization of its target
81.
Liu, Q., Wang, Q., Deng, W., Wang, X., Piao, M.,
ELONGATED hypocotyl 5 in the light, Plant Physiol.,
Cai, D., Li, Y., Barshop, W. D., Yu, X., Zhou, T.,
164, 1134-1138, doi: 10.1104/pp.113.234245.
Liu, B., Oka, Y., Wohlschlegel, J., Zuo, Z., and Lin, C.
94.
Lian, H. L., He, S. B., Zhang, Y. C., Zhu, D. M., Zhang,
(2017) Molecular basis for blue light-dependent
J. Y., Jia, K. P., San, S. X., Li, L., and Yang, H. Q.
БИОХИМИЯ том 88 вып. 6 2023
СИГНАЛЬНЫЕ ПРОЦЕССЫ, РЕГУЛИРУЕМЫЕ КРИПТОХРОМАМИ
961
(2011) Blue-light-dependent interaction of cryptochrome
tochrome
1 with COP1 requires SPA proteins
1 with SPA1 defines a dynamic signaling mechanism,
during Arabidopsis light signaling, PLoS Genet., 13,
Genes Dev., 25, 1023-1028, doi: 10.1101/gad.2025111.
e1007044, doi: 10.1371/journal.pgen.1007044.
95. Liu, B., Zuo, Z., Liu, H., Liu, X., and Lin, C. (2011)
98. Lau, K., Podolec, R., Chappuis, R., Ulm, R., and
Arabidopsis cryptochrome 1 interacts with SPA1 to
Hothorn, M. (2019) Plant photoreceptors and their
suppress COP1 activity in response to blue light, Genes
signaling components compete for COP1 binding
Dev., 25, 1029-1034, doi: 10.1101/gad.2025011.
via VP peptide motifs, EMBO J.,
38, e102140,
96. Zuo, Z., Liu, H., Liu, B., Liu, X., and Lin, C. (2011)
doi: 10.15252/embj.2019102140.
Blue light-dependent interaction of CRY2 with
99. Ponnu, J., Riedel, T., Penner, E., Schrader, A., and
SPA1 regulates COP1 activity and floral initiation in
Hoecker, U. (2019) Cryptochrome 2 competes with
Arabidopsis, Curr. Biol., 21, 841-847, doi: 10.1016/
COP1-substrates to repress COP1 ligase activity
j.cub.2011.03.048.
during Arabidopsis photomorphogenesis, Proc. Natl.
97. Holtkotte, X., Ponnu, J., Ahmad, M., and Hoecker, U.
Acad. Sci. USA, 116, 27133-27141, doi: 10.1073/pnas.
(2017) The blue light-induced interaction of cryp-
1909181116.
MOLECULAR BASES OF SIGNALING PROCESSES REGULATED
BY CRYPTOCHROME SENSORY PHOTORECEPTORS IN PLANTS
Review
G. Ya. Fraikin*, N. S. Belenikina, and A. B. Rubin
Lomonosov Moscow State University, 119991 Moscow, Russia; e-mail: Gfraikin@yandex.ru
The blue-light sensors cryptochromes compose the widespread class of flavoprotein photoreceptors, regu-
lating in plants signaling processes underlying their development, growth, and metabolism. In several algae
cryptochromes may act not only as sensory photoreceptors but also as photolyases, catalyzing the repair of
UV-induced DNA lesions. Cryptochromes bind FAD as the chromophore in the photolyase homologous
region (PHR) domain and contain the cryptochrome C-terminal extension (CCE), which lacks in photo-
lyases. Photosensory process in cryptochrome is initiated by photochemical chromophore conversions, in-
cluding the formation of FAD redox forms. In a state with the chromophore reduced to neutral radical
(FADH•), photoreceptory protein undergoes phosphorylation, conformational changes, and disengage-
ment of the PHR domain and CCE with the subsequent formation of oligomers of cryptochrome molecules.
Photooligomerization is a structural basis of functional activity of cryptochromes, which determines the
formation of their complexes with variety of signaling proteins, including transcriptional factors and tran-
scription regulators. Interactions in such complexes change the protein signaling activity, leading to gene
expression regulation and plant photomorphogenesis. In recent years, multiple papers, reporting novel,
more detailed information about molecular mechanisms of above-mentioned processes were published.
The present review largely focuses on the analysis of data contained in these publications, particularly re-
garding structural aspects of cryptochrome transitions into photoactivated states and regulatory signaling
processes mediated by cryptochrome photoreceptors in plants.
Keywords: cryptochrome photoreceptors, FAD chromophore, photosensory process, photo oligomerization, signaling
proteins and mechanisms, light-responsive gene regulation
БИОХИМИЯ том 88 вып. 6 2023