БИОХИМИЯ, 2023, том 88, вып. 6, с. 962 - 972
УДК 547.857.7; 576.32/.36; 577.152.2
ПРИРОДНЫЕ ПРОИЗВОДНЫЕ ГУАНИНА ОКАЗЫВАЮТ
PARP-ИНГИБИТОРНОЕ И ЦИТОПРОТЕКТОРНОЕ ДЕЙСТВИЕ
НА МОДЕЛИ ПОВРЕЖДЕНИЯ КАРДИОМИОЦИТОВ
ПРИ ОКИСЛИТЕЛЬНОМ СТРЕССЕ
© 2023 С.И. Шрам1*, Т.А. Щербакова2, Т.В. Абрамова3, Э.Ц. Барадиева1,
А.С. Ефремова4, М.С. Смирновская5, В.Н. Сильников3, В.К. Швядас2,6, Д.К. Нилов2*
1 Институт молекулярной генетики
Национального исследовательского центра «Курчатовский институт»,
123182 Москва, Россия; электронная почта: shram-si.img@yandex.ru
2 Московский государственный университет имени М.В. Ломоносова,
НИИ физико-химической биологии имени А.Н. Белозерского,
119992 Москва, Россия; электронная почта: nilovdm@gmail.com
3 Институт химической биологии и фундаментальной медицины Сибирского отделения РАН,
630090 Новосибирск, Россия
4 Медико-генетический научный центр им. академика Н.П. Бочкова, 115522 Москва, Россия
5 Московский государственный университет имени М.В. Ломоносова,
химический факультет, 119991 Москва, Россия
6 Московский государственный университет имени М.В. Ломоносова,
факультет биоинженерии и биоинформатики, 119234 Москва, Россия
Поступила в редакцию 13.12.2022
После доработки 27.03.2023
Принята к публикации 27.03.2023
Ингибиторы поли(ADP-рибозо)полимеразы (PARP) человека рассматриваются в качестве пер-
спективных агентов для лечения сердечно-сосудистых, неврологических и других заболеваний, со-
провождающихся воспалением и окислительным стрессом. Ранее была продемонстрирована спо-
собность природных соединений 7-метилгуанина (7mGua) и 8-гидрокси-7-метилгуанина (8h7mGua)
подавлять активность рекомбинантного белка PARP. В представленной работе мы исследовали
возможность PARP-ингибиторного и цитопротекторного действия 7mGua и 8h7mGua в отноше-
нии культур недифференцированных и дифференцированных кардиомиобластов крысы Н9с2.
Установлено, что 7mGua и 8h7mGua быстро проникают в клетки и эффективно подавляют сти-
мулированную H2O2 активацию PARP (IC50 = 270 и 55 мкМ соответственно). Выраженное цито-
протекторное действие 7mGua и 8h7mGua показано на клеточной модели окислительного стресса,
причём 8h7mGua превзошёл по эффективности классический ингибитор PARP 3-аминобензамид.
Полученные данные свидетельствуют о перспективности разработки ингибиторов PARP на основе
производных гуанина и их тестирования в отношении моделей ишемия-реперфузионного повреж-
дения тканей.
КЛЮЧЕВЫЕ СЛОВА: 7-метилгуанин, 8-гидрокси-7-метилгуанин, поли(ADP-рибозо)полимераза, инги-
битор, кардиомиоциты, окислительный стресс, цитопротекторное действие.
DOI: 10.31857/S0320972523060064, EDN: EFCJHN
ВВЕДЕНИЕ
крови и моче человека [1-6]. 7mGua образу-
ется при деградации ДНК и матричной РНК,
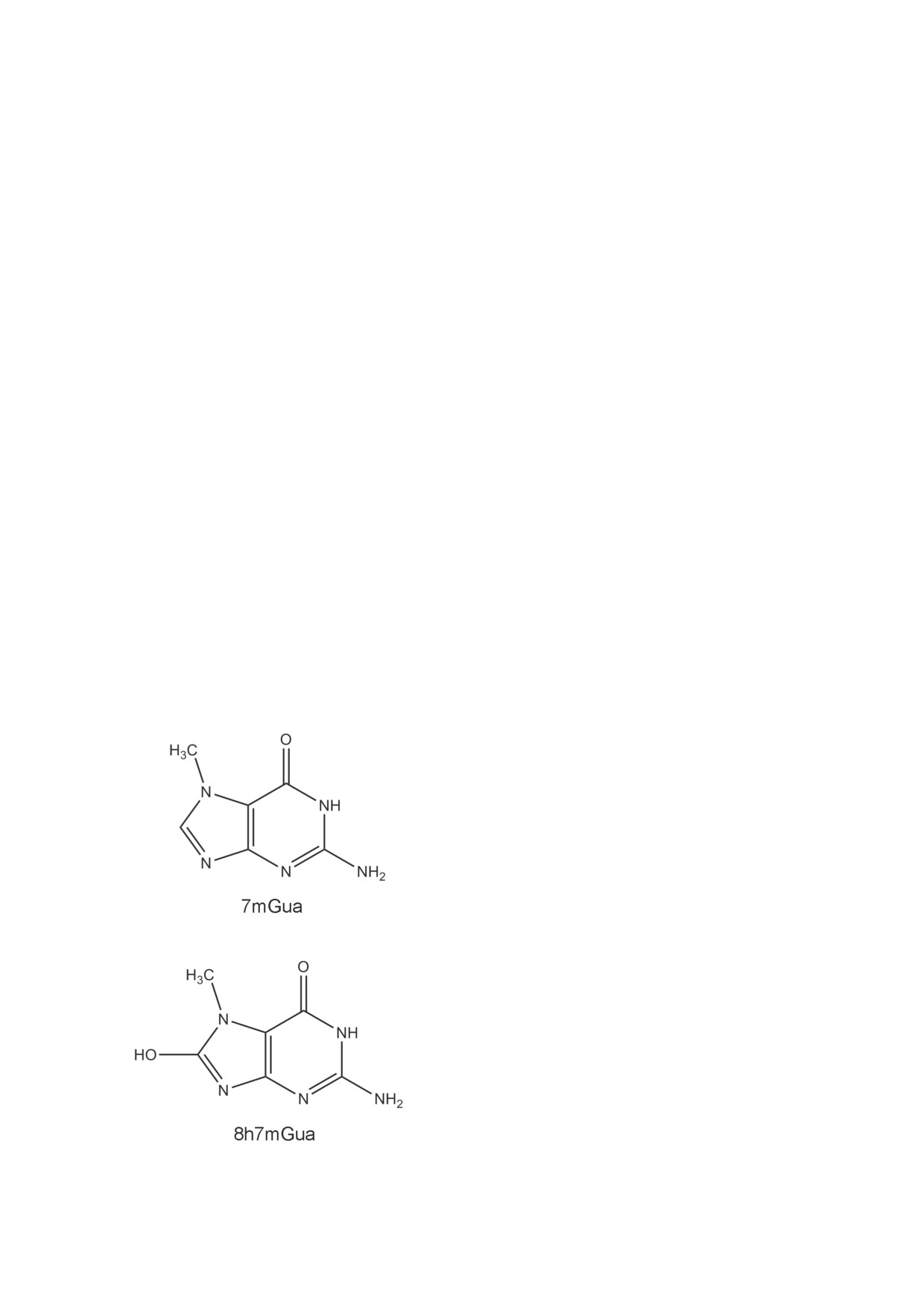
Природные соединения
7-метилгуанин
а
8h7mGua является продуктом окисления
(7mGua) и 8-гидрокси-7-метилгуанин (8h7mGua,
7mGua [7-10]. Ранее мы показали, что данные
рис. 1) являются метаболитами нуклеиновых
метаболиты ингибируют фермент поли(ADP-
кислот и в малом количестве обнаружены в рибозо)полимеразу (PARP), взаимодействуя
Принятые сокращения: 3-AB - 3-аминобензамид; 7mGua - 7-метилгуанин; 8h7mGua - 8-гидрокси-7-метилгуанин;
PAR - поли(ADP-рибоза); PARP - поли(ADP-рибозо)полимераза.
* Адресат для корреспонденции.
962
PARP-ИНГИБИТОРНОЕ ДЕЙСТВИЕ ПРОИЗВОДНЫХ ГУАНИНА
963
с остатками глицина и тирозина на участке
низма [30-34]. Патогенез этих заболеваний,
связывания субстрата NAD+. Ингибиторная
как правило, связан с развитием острого или
способность была продемонстрирована в раз-
хронического окислительного стресса и вос-
личных экспериментах с очищенным реком-
паления. На различных моделях in vivo про-
бинантным ферментом, а также с помощью
демонстрировано терапевтическое действие
молекулярного моделирования [11-14].
ингибиторов PARP при ишемия-реперфузи-
PARP активируется при воздействии на
онном повреждении тканей, при осложнениях
клетку стрессовых факторов, вызывающих
сахарного диабета, травмах головного мозга,
повреждение ДНК, и осуществляет синтез
артритах, воспалительных заболеваниях ки-
отрицательно заряженной поли(ADP-рибо-
шечника и септическом шоке [35-37].
зы) (PAR), выполняющей сигнальные функ-
Широкое использование синтетических
ции [15-19]. PARP играет важную роль в под-
ингибиторов PARP затруднено ввиду вызывае-
держании стабильности генома и регуляции
мых ими серьёзных побочных эффектов [38-
экспрессии генов, однако её повышенная ак-
40], поэтому в данном контексте значительный
тивность может иметь негативные послед-
интерес могут представлять природные соеди-
ствия [20-22]. Так, при ишемии/реперфузии
нения, такие как 7mGua и 8h7mGua. В част-
тканей наблюдается массированное повреж-
ности, проведённое нами токсикологическое
дение ДНК, сопровождающееся сверхактива-
исследование 7mGua продемонстрировало его
цией PARP. Это приводит к резкому падению
безопасность при пероральном введении мы-
уровня NAD+ и ATP, индукции экспрессии
шам в дозе 50 мг/кг, а также отсутствие кан-
провоспалительных генов и запуску механиз-
церогенного действия в ряде доклинических
мов клеточной гибели [23-26].
тестов [41]. В представленной работе впервые
Синтетические ингибиторы PARP ола-
изучены PARP-ингибиторные и цитопротек-
париб, рукапариб и нирапариб применяются
торные свойства природных пуринов 7mGua
для подавления репарации ДНК в терапии
и 8h7mGua на клеточной модели повреждения
онкологических заболеваний [27-29], однако
кардиомиоцитов.
область возможного применения ингибито-
ров PARP гораздо шире. Известно, что PARP
вовлечена в механизмы клеточной гибели при
МАТЕРИАЛЫ И МЕТОДЫ
заболеваниях сердечно-сосудистой, нервной,
иммунной, дыхательной и других систем орга-
В работе использовали ингибиторы PARP
3-аминобензамид (3-AB) и 7mGua, приобре-
тённые в компании «Sigma-Aldrich» (США),
а также 8h7mGua, который синтезировали по
описанной ранее методике [13]. Также исполь-
зовали среды и реагенты для культивирования
клеток («ПанЭко», Россия), эмбриональную сы-
воротку телёнка («HyClone», США), трансрети-
ноевую кислоту («ICN», США), флуоресцен-
тные красители Хёхст 33258 («Sigma-Aldrich»),
Кальцеин АМ и Гомодимер этидия III («Bio-
tium», США). Кардиомиобласты эмбриона
крысы Н9с2 были получены из коллекции кле-
точных культур ATCC («LGC Standards», Вели-
кобритания).
Клетки Н9с2 культивировали в среде
DMEM, содержащей эмбриональную сыворот-
ку телёнка (10%, v/v), L-глутамин (2 мМ) и
смесь антибиотиков пенициллин/стрептоми-
цин, при 37 °С в атмосфере 5% СО2. При про-
ведении исследований на недифференцирован-
ных кардиомиобластах культуры растили в тече-
ние 24-48 ч в среде с 10% сыворотки. В экс-
периментах с дифференцированными клетками
культуры растили 48 ч в среде с 10% сыворотки,
а затем 72 ч в среде, содержащей 1% (v/v) сыво-
Рис. 1. Химические структуры природных пуринов 7mGua
и 8h7mGua
ротки и транс-ретиноевую кислоту (45 нг/мл),
БИОХИМИЯ том 88 вып. 6 2023
964
ШРАМ и др.
для стимуляции дифференцировки в миоци-
Heart FX («Biotek», США) и конфокального
ты. Все эксперименты с клеточными культу-
микроскопа LSM 900 («Carl Zeiss», Германия).
рами проводили в 4- или 24-луночных пласти-
Статистическую обработку данных проводили
ковых планшетах («SPL», Республика Корея),
с использованием программного обеспече-
поверхность которых предварительно покры-
ния SigmaPlot («Systat Software Inc.», США) и
вали желатином.
Statistica («StatSoft Inc.», США).
Анализ степени ингибирования PARP ис-
следуемыми веществами в живых клетках про-
водили по описанной ранее методике [42].
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
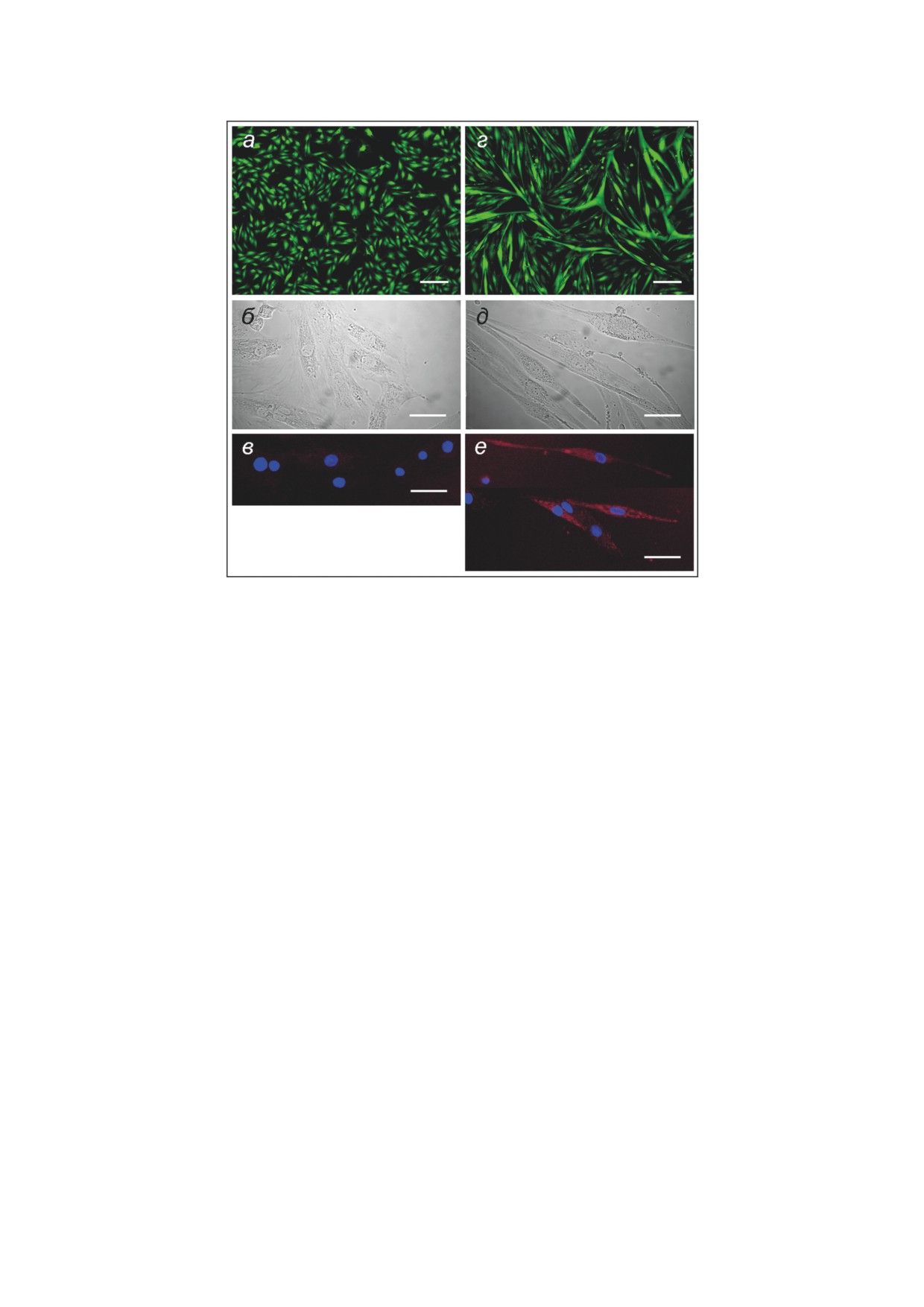
Клетки Н9с2 (недифференцированные или
дифференцированные) преинкубировали с
Эксперименты проводили на культурах как
исследуемым веществом в течение определён-
недифференцированных, так и дифференци-
ного времени в среде DMEM с 1% сыворотки,
рованных клеток - кардиомиобластов и кар-
затем вносили H2O2 до конечной концентра-
диомиоцитов крысы H9c2 (рис. 2). В процессе
ции 1 мМ, и через 5 или 10 мин клетки фик-
дифференцировки клеток H9c2 наблюдали об-
сировали охлаждённым до
0 °С метанолом.
разование многоядерных синцитий-подобных
Содержание PAR в клетках определяли им-
структур (рис. 2, г) и увеличение уровня ткане-
мунофлуоресцентным анализом с использо-
специфического маркерного белка тропони-
ванием первичных моноклональных анти-
на Т (рис. 2, е). Проведённые предварительные
тел к PAR (клон 10-H) («Santa Cruz Biotech.»,
исследования не выявили какого-либо влия-
США) и вторичных антител, конъюгирован-
ния длительной инкубации (120 ч) с 7mGua
ных с Alexa 488 («Abcam», Великобритания).
или 8h7mGua в концентрации 300 мкМ на мор-
Ядра клеток контрастировали Хёхстом 33258.
фологию и показатели жизнеспособности кле-
Для детектирования сердечного тропонина Т
ток (рис. S1, рис, S2, таблица S1 Приложения),
использовали антитела, конъюгированные с
что свидетельствует о низкой цитотоксичности
Alexa 555 («Хайтест», Россия).
данных соединений.
Для анализа цитопротекторного действия
Исследование на недифференцированных
веществ в условиях острого окислительного
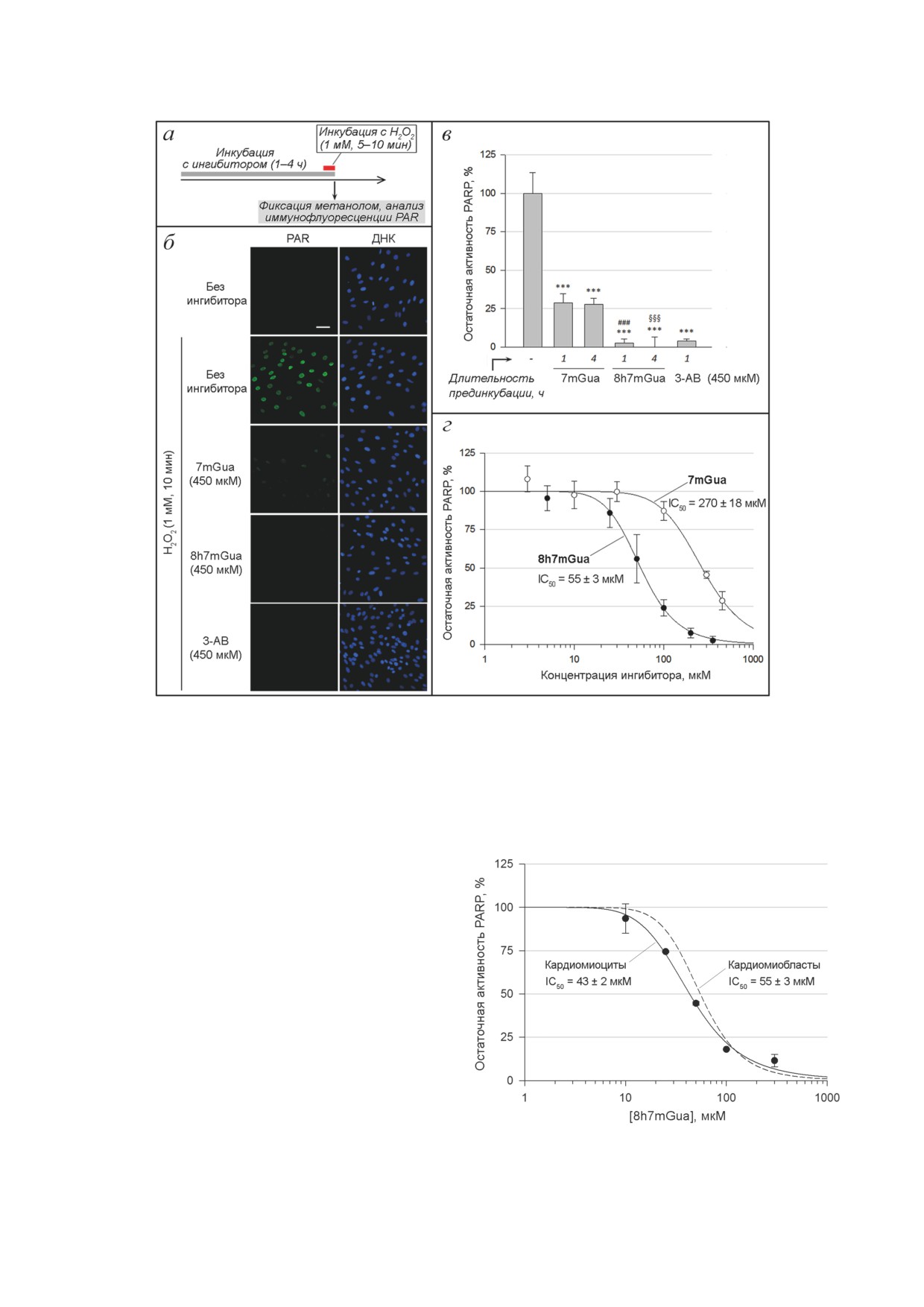
клетках Н9с2 показало, что 7mGua и 8h7mGua
стресса клетки H9c2 (недифференцированные
подавляют активность PARP, но 8h7mGua обла-
или дифференцированные) преинкубировали
дает более выраженным действием, сопостави-
с тестируемым веществом в среде DMEM с 1%
мым с классическим ингибитором PARP 3-AB
сыворотки в течение 1 ч, затем вносили H2O2
(рис. 3). В концентрации 450 мкМ 8h7mGua
до конечной концентрации 1 мМ и помещали
практически полностью подавляет фермента-
в CO2-инкубатор. Через 30 мин клетки отмы-
тивную активность, в то время как 7mGua -
вали от H2O2 и продолжали инкубировать в
примерно на 70% (рис. 3, в). Анализ дозовых
среде с тестируемым веществом ещё 24 ч, по-
зависимостей также демонстрирует более вы-
сле чего производили прижизненное окраши-
сокую эффективность 8h7mGua в сравнении
вание клеток Гомодимером этидия III, Каль-
с 7mGua: расчётные значения IC50 для этих
цеином АМ и Хёхстом 33258.
соединений оказались равными 55 и 270 мкМ
Во всех экспериментах получали и анали-
соответственно (рис. 3, г). Полученные данные
зировали образцы из 3-5 независимо выра-
хорошо согласуются с результатами экспери-
щенных культур. При определении остаточной
ментов с рекомбинантной PARP человека [13],
активности PARP анализировали 400-800 ядер
в которых 7mGua и 8h7mGua проявляли инги-
в 4-5 случайно выбранных полях лунки план-
биторное действие в диапазоне концентраций
шета (объектив 4×), а при определении плот-
10-5-10-4 М, и значения IC50 для 8h7mGua были
ности культуры и конфлюентности - от 40
в среднем в 4 раза ниже значений для 7mGua.
до 80% общей площади лунки (объектив 2,5×).
В аналогичном исследовании на диффе-
При проведении попарного сравнения ис-
ренцированных клетках H9c2 показано, что
пользовали t-критерий Стьюдента, а в случае
эффективность PARP-ингибиторного действия
множественного сравнения - однофакторный
8h7mGua близка к наблюдаемой с недиффе-
дисперсионный анализ ANOVA и апостериор-
ренцированными клетками: расчётное зна-
ный анализ Бонферрони. Полученные количе-
чение IC50 оказалось равным 43 мкМ (рис. 4).
ственные данные представлены в виде «сред-
Можно предположить, что рассматриваемые
нее значение ± стандартное отклонение».
варианты фенотипа клеток Н9с2 существенно
Анализ интенсивности флуоресценции в
не отличаются как по внутриклеточной кон-
препаратах живых и фиксированных клеток
центрации NAD+, так и по проницаемости
проводили с использованием имиджера Lion-
плазматической мембраны для 8h7mGua.
БИОХИМИЯ том 88 вып. 6 2023
PARP-ИНГИБИТОРНОЕ ДЕЙСТВИЕ ПРОИЗВОДНЫХ ГУАНИНА
965
Рис. 2. Изменение морфологии и экспрессии сердечного маркера при дифференцировке клеток H9c2. а-в - Культу-
ры недифференцированных клеток. г-е - Культуры дифференцированных клеток. а, г - Клетки после прижизнен-
ного окрашивания Кальцеином АМ (зелёный цвет). б, д - Морфология клеток при съёмке в режиме светлого поля.
в, е - Иммунофлуоресцентный анализ сердечного тропонина Т (красный цвет). Длина масштабной планки соответ-
ствует 250 мкм (а, г) или 50 мкм (б, в, д, е)
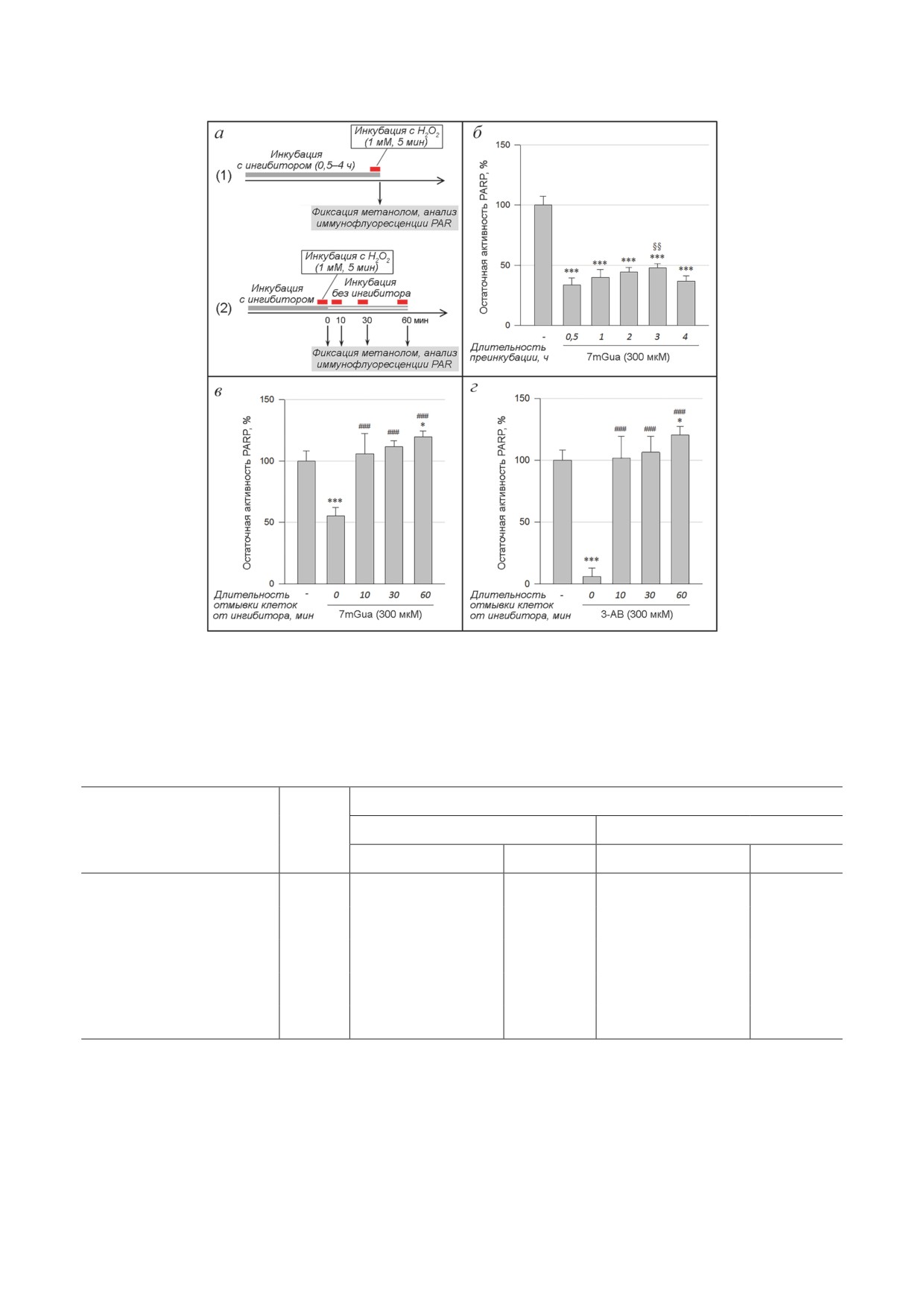
При сравнении 1- и 4-часовой преинкуба-
данные были получены и для классического
ции клеток Н9с2 с производными гуанина не
ингибитора PARP 3-AB (рис. 5, г).
было выявлено существенных различий в ин-
Для моделирования острого окислитель-
гибировании PARP (рис. 3, в). Однако при бо-
ного стресса культуры клеток Н9с2 подвергали
лее детальном исследовании было обнаружено
30-минутной инкубации в среде с Н2О2 (1 мМ)
наличие чёткой и хорошо воспроизводимой
и через 24 ч оценивали показатели, характери-
зависимости степени ингибирования PARP от
зующие степень повреждения клеток (рис. S3
времени преинкубации с 7mGua в интервале
Приложения). При этом предварительно было
0,5-4 ч (рис. 5, а и б). В диапазоне времени
установлено, что PARP-ингибиторный эффект
0,5-3 ч наблюдали некоторое снижение сте-
7mGua, 8h7mGua и 3-AB на клетки сохра-
пени ингибирования PARP, а при увеличении
няется вплоть до 24 ч после их однократного
времени преинкубации до 4 ч - небольшое
внесения в среду (таблица S2 Приложения).
усиление ингибирования. Наблюдаемый вид
В исследовании на культуре недифференци-
зависимости может быть обусловлен такими
рованных клеток H9c2 после воздействия H2O2
факторами, как наличие механизмов обратно-
наблюдали катастрофическое снижение чис-
го транспорта 7mGua (ослабление действия) и
ла живых клеток (таблица). Внесение в среду
превращение 7mGua в более активный метабо-
культивирования 7mGua и 8h7mGua в концен-
лит 8h7mGua (усиление действия). Получен-
трации 300 мкМ приводило к значительному
ные данные также указывают на то, что 7mGua
увеличению числа выживших клеток. Оказа-
достаточно быстро проникает в клетку и выхо-
лось, что наиболее сильным цитопротекторным
дит из неё. Эксперимент с отмывкой клеток
действием обладает 8h7mGua (увеличение чис-
от 7mGua показал, что для полного его уда-
ла живых клеток более чем в 3 раза). Интересно,
ления из клетки достаточно не более 10 мин
что 3-АВ, взятый в концентрации 1000 мкМ,
(рис. 5, в). Полное восстановление активности
обеспечивающей полное подавление актив-
PARP в клетках после их отмывки от 7mGua
ности PARP, уступает по эффективности цито-
указывает на обратимый характер ингиби-
протекторного действия 8h7mGua и соизмерим
рования данным соединением. Аналогичные
с 7mGua (таблица). Можно предположить, что
БИОХИМИЯ том 88 вып. 6 2023
966
ШРАМ и др.
Рис. 3. Ингибирование PARP в присутствии 7mGua и 8h7mGua в недифференцированных клетках Н9с2. а - Схема
эксперимента. б - Выборочные микрофлуоресцентные снимки, полученные в ходе анализа. В качестве положитель-
ного контроля использован 3-AB. Длина масштабной планки соответствует 50 мкм. в - PARP-Ингибиторное действие
тестируемых веществ в концентрации 450 мкМ при 1- и 4-часовой преинкубации. г - Сравнение дозовых зависимо-
стей для 7mGua и 8h7mGua (длительность преинкубации клеток с веществами - 1 ч; инкубация с 1 мМ H2O2 - 5 мин).
*** р < 0,001 относительно контроля (инкубация без тестируемых веществ). ### p < 0,001 относительно 1-часовой
преинкубации клеток с 7mGua. §§§ p < 0,001 относительно 4-часовой преинкубации клеток с 7mGua
в данной модели действие производных гуанина
обусловлено, наряду с ингибированием PARP,
некоторыми дополнительными механизмами.
Дифференцированные клетки оказались
более устойчивыми к повреждающему воздей-
ствию Н2О2 по сравнению с недифференциро-
ванными, однако и в данном случае 7mGua и
8h7mGua увеличивали выживаемость клеток.
При этом производные гуанина и 3-AB демон-
стрировали соизмеримое цитопротекторное
действие (таблица). В культуре дифферен-
цированных клеток невозможно произвести
морфометрический анализ ввиду слияния кле-
ток и многоядерности (см. рис. 2, г), поэтому
в качестве количественного показателя для
оценки выживаемости использовали конфлю-
Рис. 4. Сравнение эффективности PARP-ингибиторного
ентность
- степень покрытия поверхности
действия
8h7mGua в культурах дифференцированных
роста живыми клетками.
и недифференцированных клеток Н9с2
БИОХИМИЯ том 88 вып. 6 2023
PARP-ИНГИБИТОРНОЕ ДЕЙСТВИЕ ПРОИЗВОДНЫХ ГУАНИНА
967
Рис. 5. Динамика PARP-ингибиторного действия 7mGua в недифференцированных клетках Н9с2 при его внесении
и удалении из среды культивирования. а - Схема экспериментов. б - Влияние длительности преинкубации клеток
с 7mGua на степень ингибирования PARP. в, г - Восстановление активности PARP в клетках после отмывки от 7mGua
и 3-AB; клетки предварительно выдерживали в среде с ингибиторами в течение 1 ч. * p < 0,05 относительно контроля.
*** р < 0,001 относительно контроля. §§ p < 0,01 относительно длительности преинкубации 0,5 ч. ### p < 0,001 относи-
тельно клеток без отмывки от ингибиторов (длительность отмывки 0 мин)
Влияние 7mGua и 8h7mGua на выживаемость клеток H9с2 в модели сильного окислительного стресса, вызванного
воздействием H2O2
Содержание живых клеток в культуре
Тестируемое вещество
H2O2
Недифференцированные клетки
Дифференцированные клетки
N/см2
p*
Конфлюентность, %
p*
– (Контроль 1)
-
13 204 ± 1862
< 0,001
81,3 ± 2,0
< 0,001
– (Контроль 2)
+
240 ± 55
-
47,4 ± 2,2
-
7mGua (300 мкМ)
+
617 ± 193
0,003
52,5 ± 1,8
0,003
8h7mGua (300 мкМ)
+
807 ± 159
< 0,001
57,7 ± 2,3
< 0,001
3-АВ (1000 мкМ)
+
660 ± 182
0,002
56,1 ± 1,8
< 0,001
* Значения р относительно контроля 2.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
форма 1), причём более сильным ингибитором
является 8h7mGua [13]. Хотя было известно о
Ранее нами было установлено, что 7mGua
наличии PARP-ингибиторной активности у
и его метаболит 8h7mGua конкурентно инги-
некоторых пуринов (преимущественно у мети-
бируют рекомбинантную PARP человека (изо-
лированных производных ксантина) [43, 44],
БИОХИМИЯ том 88 вып. 6 2023
968
ШРАМ и др.
мы показали, что 7mGua существенно превос-
тканей), так и умеренной и перманентной
ходит по активности ближайший аналог 7-ме-
(например, при осложнениях сахарного диа-
тилксантин [11].
бета). Ингибиторы PARP способны оказывать
Поскольку PARP имеет чёткую ядерную
цитопротекторное действие на животных и
локализацию, её эффективные ингибиторы
клеточных моделях таких заболеваний [33, 37,
должны проникать через плазматическую мем-
51-53]. Для оценки цитопротекторной актив-
брану и диффундировать в ядро, не подвер-
ности производных гуанина мы рассмотрели
гаясь при этом превращению в неактивные
модель повреждения кардиомиоцитов в усло-
метаболиты. В представленной работе мы
виях острого окислительного стресса, имею-
попытались выяснить, способны ли 7mGua и
щую отношение к ишемия-реперфузион-
8h7mGua подавлять активность PARP в жи-
ному повреждению миокарда. Полученные
вых клетках и проявлять цитопротекторные
данные свидетельствуют о способности 7mGua
эффекты, свойственные ингибиторам PARP.
и 8h7mGua предотвращать гибель клеток при
В качестве объекта исследований была вы-
повреждающем воздействии. Интересно, что
брана линия кардиомиобластов крысы Н9с2.
по наблюдаемому цитопротекторному эффекту
Особенностью данных клеток является воз-
8h7mGua превосходит классический ингиби-
можность дифференцировки в кардиомиоци-
тор PARP 3-АВ, что может свидетельствовать
топодобный фенотип. Дифференцированные
о влиянии производных гуанина на дополни-
клетки Н9с2 по многим морфологическим,
тельные белковые мишени [54].
биохимическим и функциональным характери-
Таким образом, впервые на клеточном уров-
стикам сходны с кардиомиоцитами миокарда,
не исследованы PARP-ингибиторные и цито-
хотя и не тождественны им (в частности, отсут-
протекторные свойства производных гуанина
ствует способность к сокращению) [45-47].
7mGua и 8h7mGua. Эксперименты проведены
Для оценки ингибиторного действия про-
на культурах недифференцированных и диф-
изводных гуанина использовали предложенный
ференцированных клеток линии H9c2. Пока-
ранее протокол, основанный на иммунофлуо-
зано, что оба соединения подавляют стимули-
ресцентном анализе PAR после кратковре-
рованную H2O2 активацию PARP в клетке в
менной обработки клеток высокими дозами
диапазоне 10-5-10-4 М. При этом 8h7mGua
H2O2 [42]. Пероксид водорода быстро проника-
оказался в несколько раз более эффектив-
ет в клетку и при взаимодействии с Fe2+ превра-
ным ингибитором по сравнению с 7mGua.
щается в гидроксильный радикал, способный
При моделировании острого окислительного
вызывать повреждения ДНК (в частности, од-
стресса, индуцированного 30-минутной обра-
ноцепочечные разрывы, с которыми связыва-
боткой клеток H2O2, 8h7mGua в концентрации
ется PARP). Это приводит к быстрой активации
300 мкМ продемонстрировал цитопротектор-
PARP и синтезу PAR из клеточного NAD+.
ное действие, превосходящее по эффектив-
В результате было подтверждено ингиби-
ности классический ингибитор PARP 3-AB.
торное действие 7mGua и 8h7mGua на кле-
Полученные данные свидетельствуют о воз-
точном уровне, а также обнаружена сложная
можности разработки новых лекарствен-
зависимость степени ингибирования PARP от
ных препаратов на основе 8h7mGua и других
времени преинкубации, которая может быть
производных гуанина для лечения заболева-
обусловлена сочетанием процессов обратного
ний, ассоциированных с воспалением, окис-
транспорта и превращением 7mGua в более
лительным стрессом и повышенной актив-
сильный ингибитор 8h7mGua. Известно, что
ностью PARP.
частичное превращение 7mGua в 8h7mGua
происходит под действием фермента ксантин-
Вклад авторов. С.И. Шрам и Д.К. Нилов -
оксидазы [10]. Вопросы транспорта 7mGua
концепция и руководство работой, написание
через плазматическую мембрану пока не изу-
текста; С.И. Шрам, Т.А. Щербакова, Т.В. Аб-
чались. В качестве возможных механизмов,
рамова, Э.Ц. Барадиева, А.С. Ефремова,
наряду с пассивной диффузией, следует рас-
М.С. Смирновская - проведение эксперимен-
сматривать белок-опосредованный транспорт
тов; В.Н. Сильников и В.К. Швядас - обсу-
с участием транспортёров нуклеозидов и азо-
ждение результатов исследования и редакти-
тистых оснований [48-50].
рование текста статьи.
Патогенез заболеваний сердечно-сосуди-
Финансирование. Исследование выпол-
стой, нервной, иммунной, дыхательной и дру-
нено при финансовой поддержке Российского
гих систем сопряжён с активацией PARP, при-
фонда фундаментальных исследований (грант
чём как сильной и транзиентной (например,
№ 20-08-01161 А) за исключением указанных
при ишемия-реперфузионном повреждении
далее работ. Синтез 8-гидрокси-7-метилгуа-
БИОХИМИЯ том 88 вып. 6 2023
PARP-ИНГИБИТОРНОЕ ДЕЙСТВИЕ ПРОИЗВОДНЫХ ГУАНИНА
969
нина выполнен при поддержке Российского
ных гуанина для подавления ферментативной
научного фонда (грант № 19-74-10072).
активности PARP.
Благодарности. В работе использовано
Соблюдение этических норм. Настоящая
оборудование ЦКП «Центр клеточных и ген-
статья не содержит описания выполненных ав-
ных технологий» (НИЦ «Курчатовский инсти-
торами исследований с участием людей или ис-
тут» - ИМГ).
пользованием животных в качестве объектов.
Конфликт интересов. Д.К. Нилов, С.И. Шрам,
Дополнительные материалы. Приложе-
Т.А. Щербакова и В.К. Швядас являются авто-
ние к статье опубликовано на сайте журнала
рами патентов на использование производ-
СПИСОК ЛИТЕРАТУРЫ
1.
Weissmann, B., Bromberg, P. A., and Gutman, A. B.
9.
Litwack, M. D., and Weissmann, B. (1966) Source
(1957) The purine bases of human urine. I. Separation
of urinary
8-hydroxy-7-methylguanine in man,
and identification, J. Biol. Chem., 224, 407-422,
Biochemistry, 5, 3007-3012, doi: 10.1021/bi00873a033.
doi: 10.1016/S0021-9258(18)65040-9.
10.
Skupp, S., and Ayvazian, J. H. (1969) Oxidation of
2.
Weissmann, B., Bromberg, P. A., and Gutman,
7-methylguanine by human xanthine oxidase, J. Lab.
A. B. (1957) The purine bases of human urine. II.
Clin. Med., 73, 909-916.
Semiquantitative estimation and isotope incorporation,
11.
Нилов Д. К., Тараров В. И., Куликов А. В.,
J. Biol. Chem.,
224,
423-434, doi:
10.1016/
Захаренко А. Л., Гущина И. В., Михайлов С. Н.,
S0021-9258(18)65041-0.
Лаврик О. И., Швядас В. К. (2016) Ингибиро-
3.
Weissmann, B., and Gutman, A. B. (1957) The iden-
вание поли(ADP-рибозо)полимеразы метабо-
tification of
6-succinoaminopurine and of
8-hy-
литом нуклеиновых кислот
7-метилгуанином,
droxy-7-methylguanine as normal human urinary con-
Acta Naturae, 8, 120-128, doi: 10.32607/20758251-
stituents, J. Biol. Chem., 229, 239-250, doi: 10.1016/
2016-8-2-108-115.
S0021-9258(18)70612-1.
12.
Nilov, D., Maluchenko, N., Kurgina, T., Pushkarev, S.,
4.
Topp, H., Sander, G., Heller-Schöch, G., and
Lys, A., Kutuzov, M., Gerasimova, N., Feofanov, A.,
Schöch, G. (1987) Determination of 7-methylgua-
Švedas, V., Lavrik, O., and Studitsky, V. M. (2020)
nine, N2,N2-dimethylguanosine, and pseudouridine
Molecular mechanisms of PARP-1 inhibitor 7-methyl-
in ultrafiltrated serum of healthy adults by high-per-
guanine, Int. J. Mol. Sci., 21, 2159, doi: 10.3390/
formance liquid chromatography, Anal. Biochem., 161,
ijms21062159.
49-56, doi: 10.1016/0003-2697(87)90650-6.
13.
Кургина Т. А., Шрам С. И., Кутузов М. М.,
5.
Svoboda, P., and Kasai, H. (2004) Simultaneous
Абрамова Т. В., Щербакова Т. А., Мальцева Е. А.,
HPLC analysis of
8-hydroxydeoxyguanosine and
Поройков В. В., Лаврик О. И., Швядас В. К.,
7-methylguanine in urine from humans and rodents,
Нилов Д. К. (2022) Ингибиторное действие 7-ме-
Anal. Biochem.,
334,
239-250, doi:
10.1016/j.ab.
тилгуанина и его метаболита 8-гидрокси-7-ме-
2004.08.021.
тилгуанина на поли(ADP-рибозо)полимеразу 1
6.
Raćkowska, E., Bobrowska-Korczak, B., and
человека, Биохимия, 87, 794-803, doi: 10.31857/
Giebułtowicz, J. (2019) Development and validation
S0320972522060070.
of a rapid LC-MS/MS method for determination of
14.
Manasaryan, G., Suplatov, D., Pushkarev, S.,
methylated nucleosides and nucleobases in urine,
Drobot, V., Kuimov, A., Švedas, V., and Nilov, D.
J. Chromatogr. B Analyt. Technol. Biomed. Life Sci.,
(2021) Bioinformatic analysis of the nicotinamide
1128, 121775, doi: 10.1016/j.jchromb.2019.121775.
binding site in poly(ADP-ribose) polymerase family
7.
Sander, G., Hülsemann, J., Topp, H., Heller-Schöch, G.,
proteins, Cancers (Basel), 13, 1201, doi: 10.3390/
and Schöch, G. (1986) Protein and RNA turnover in
cancers13061201.
preterm infants and adults: a comparison based on
15.
Шиловский Г. А., Хохлов А. Н., Шрам С. И. (2013)
urinary excretion of 3-methylhistidine and of modified
Cистема поли(ADP-рибозил)ирования белков: роль
one-way RNA catabolites, Ann. Nutr. Metab., 30, 137-
в поддержании стабильности генома и детерминации
142, doi: 10.1159/000177186.
продолжительности жизни, Биохимия, 78, 473-487.
8.
Tamae, K., Kawai, K., Yamasaki, S., Kawanami, K.,
16.
Gupte, R., Liu, Z., and Kraus, W. L. (2017) PARPs
Ikeda, M., Takahashi, K., Miyamoto, T., Kato, N.,
and ADP-ribosylation: recent advances linking
and Kasai, H. (2009) Effect of age, smoking and
molecular functions to biological outcomes, Genes
other lifestyle factors on urinary 7-methylguanine and
Dev., 31, 101-126, doi: 10.1101/gad.291518.116.
8-hydroxydeoxyguanosine, Cancer Sci., 100, 715-721,
17.
Alemasova, E. E., and Lavrik, O. I. (2019) Poly(ADP-
doi: 10.1111/j.1349-7006.2009.01088.x.
ribosyl)ation by PARP1: reaction mechanism and
6
БИОХИМИЯ том 88 вып. 6 2023
970
ШРАМ и др.
regulatory proteins, Nucleic Acids Res., 47, 3811-3827,
30.
Virág, L., Robaszkiewicz, A., Rodriguez-Vargas, J. M.,
doi: 10.1093/nar/gkz120.
and Oliver, F. J. (2013) Poly(ADP-ribose) signaling
18.
Kamaletdinova, T., Fanaei-Kahrani, Z., and Wang,
in cell death, Mol. Aspects Med.,
34,
1153-1167,
Z. Q. (2019) The enigmatic function of PARP1: from
doi: 10.1016/j.mam.2013.01.007.
PARylation activity to PAR readers, Cells, 8, 1625,
31.
Curtin, N. J., and Szabo, C. (2013) Therapeutic
doi: 10.3390/cells8121625.
applications of PARP inhibitors: anticancer therapy
19.
Нилов Д. К., Пушкарев С. В., Гущина И. В., Мана-
and beyond, Mol. Aspects Med.,
34,
1217-1256,
сарян Г. А., Кирсанов К. И., Швядас В. К. (2020)
doi: 10.1016/j.mam.2013.01.006.
Моделирование фермент-субстратных комплексов
32.
Henning, R. J., Bourgeois, M., and Harbison, R. D.
поли(ADP-рибозо)полимеразы 1 человека, Биохи-
(2018) Poly(ADP-ribose) polymerase (PARP) and
мия, 85, 116-125, doi: 10.31857/S0320972520010091.
PARP inhibitors: Mechanisms of action and role in
20.
Narne, P., Pandey, V., Simhadri, P. K., and Phanithi,
cardiovascular disorders, Cardiovasc. Toxicol.,
18,
P. B. (2017) Poly(ADP-ribose)polymerase-1 hyper-
493-506, doi: 10.1007/s12012-018-9462-2.
activation in neurodegenerative diseases: the death
33.
Berger, N. A., Besson, V. C., Boulares, A. H.,
knell tolls for neurons, Semin. Cell Dev. Biol., 63, 154-
Bürkle, A., Chiarugi, A., Clark, R. S., Curtin, N. J.,
166, doi: 10.1016/j.semcdb.2016.11.007.
Cuzzocrea, S., Dawson, T. M., Dawson, V. L.,
21.
Ke, Y., Wang, C., Zhang, J., Zhong, X., Wang, R.,
Haskó, G., Liaudet, L., Moroni, F., Pacher, P.,
Zeng, X., and Ba, X. (2019) The role of PARPs in in-
Radermacher, P., Salzman, A. L., Snyder, S. H.,
flammation-and metabolic-related diseases: molecular
Soriano, F. G., Strosznajder, R. P., Sümegi, B.,
mechanisms and beyond, Cells, 8, 1047, doi: 10.3390/
Swanson, R. A., and Szabo, C. (2018) Opportunities
cells8091047.
for the repurposing of PARP inhibitors for the therapy
22.
Curtin, N. J., and Szabo, C. (2020) Poly(ADP-ribose)
of non-oncological diseases, Br. J. Pharmacol., 175,
polymerase inhibition: past, present and future,
192-222, doi: 10.1111/bph.13748.
Nat. Rev. Drug Discov., 19, 711-736, doi: 10.1038/
34.
Liu, S., Luo, W., and Wang, Y. (2022) Emerging role
s41573-020-0076-6.
of PARP-1 and PARthanatos in ischemic stroke,
23.
Szabó, G., Liaudet, L., Hagl, S., and Szabó, C.
J. Neurochem., 160, 74-87, doi: 10.1111/jnc.15464.
(2004) Poly(ADP-ribose) polymerase activation in
35.
Pacher, P., and Szabó, C. (2007) Role of poly(ADP-
the reperfused myocardium, Cardiovasc. Res., 61,
ribose) polymerase 1 (PARP-1) in cardiovascular
471-480, doi: 10.1016/j.cardiores.2003.09.029.
diseases: the therapeutic potential of PARP inhibitors,
24.
Woolley, S. M., Farivar, A. S., Naidu, B. V.,
Cardiovasc. Drug Rev., 25, 235-260, doi: 10.1111/
Salzman, A., Szabo, C., Thomas, R., Fraga, C.,
j.1527-3466.2007.00018.x.
and Mulligan, M. S. (2004) Role of poly (ADP) ri-
36.
Tao, R., Kim, S. H., Honbo, N., Karliner, J. S., and
bose synthetase in lung ischemia-reperfusion injury,
Alano, C. C. (2010) Minocycline protects cardiac
J. Heart Lung Transplant., 23, 1290-1296, doi: 10.1016/
myocytes against simulated ischemia-reperfusion in-
j.healun.2003.08.036.
jury by inhibiting poly(ADP-ribose) polymerase-1,
25.
Van Wijk, S. J., and Hageman, G. J. (2005) Poly-
J. Cardiovasc. Pharmacol., 56, 659-668, doi: 10.1097/
(ADP-ribose) polymerase-1 mediated caspase-in-
FJC.0b013e3181faeaf0.
dependent cell death after ischemia/reperfusion,
37.
Tiwari, P., Khan, H., Singh, T. G., and Grewal, A. K.
Free Radic. Biol. Med., 39, 81-90, doi: 10.1016/
(2022) Poly (ADP-ribose) polymerase: an overview of
j.freeradbiomed.2005.03.021.
mechanistic approaches and therapeutic opportunities
26.
Fujikawa, D. G. (2015) The role of excitotoxic pro-
in the management of stroke, Neurochem. Res., 47,
grammed necrosis in acute brain injury, Comput.
1830-1852, doi: 10.1007/s11064-022-03595-z.
Struct. Biotechnol. J.,
13,
212-221, doi:
10.1016/
38.
Ohmoto, A., and Yachida, S. (2017) Current status
j.csbj.2015.03.004.
of poly(ADP-ribose) polymerase inhibitors and
27.
Frampton, J. E. (2015) Olaparib: a review of its use
future directions, Onco Targets Ther., 10, 5195-5208,
as maintenance therapy in patients with ovarian
doi: 10.2147/OTT.S139336.
cancer, BioDrugs, 29, 143-150, doi: 10.1007/s40259-
39.
Walsh, C. (2018) Targeted therapy for ovarian can-
015-0125-6.
cer: the rapidly evolving landscape of PARP inhibi-
28.
Mittica, G., Ghisoni, E., Giannone, G., Genta, S.,
tor use, Minerva Ginecol., 70, 150-170, doi: 10.23736/
Aglietta, M., Sapino, A., and Valabrega, G. (2018)
S0026-4784.17.04152-1.
PARP inhibitors in ovarian cancer, Recent Pat. Anti-
40.
Jain, P. G., and Patel, B. D. (2019) Medicinal chem-
cancer Drug Discov.,
13,
392-410, doi:
10.2174/
istry approaches of poly ADP-Ribose polymerase 1
1574892813666180305165256.
(PARP1) inhibitors as anticancer agents - a recent up-
29.
Zimmer, A. S., Gillard, M., Lipkowitz, S., and
date, Eur. J. Med. Chem., 165, 198-215, doi: 10.1016/
Lee, J. M. (2018) Update on PARP inhibitors in
j.ejmech.2019.01.024.
breast cancer, Curr. Treat. Options Oncol., 19, 21,
41.
Kirsanov, K., Fetisov, T., Antoshina, E., Trukhanova, L.,
doi: 10.1007/s11864-018-0540-2.
Gor’kova, T., Vlasova, O., Khitrovo, I., Lesovaya, E.,
БИОХИМИЯ том 88 вып. 6 2023
PARP-ИНГИБИТОРНОЕ ДЕЙСТВИЕ ПРОИЗВОДНЫХ ГУАНИНА
971
Kulbachevskaya, N., Shcherbakova, T., Belitsky, G.,
follows form” model of differentiation, Mol. Omics,
Yakubovskaya, M., Švedas, V., and Nilov, D. (2022)
14, 181-196, doi: 10.1039/c8mo00036k.
Toxicological properties of 7-methylguanine, and pre-
48.
Pastor-Anglada, M., Cano-Soldado, P., Molina-
liminary data on its anticancer activity, Front. Pharma-
Arcas, M., Lostao, M. P., Larráyoz, I., Martínez-
col., 13, 842316, doi: 10.3389/fphar.2022.842316.
Picado, J., and Casado, F. J. (2005) Cell entry and
42.
Efremova, A. S., Zakharenko, A. L., Shram, S. I.,
export of nucleoside analogues, Virus Res., 107, 151-
Kulikova, I. V., Drenichev, M. S., Sukhanova,
164, doi: 10.1016/j.virusres.2004.11.005.
M. V., Khodyreva, S. N., Myasoedov, N. F., Lavrik,
49.
Cano-Soldado, P., and Pastor-Anglada, M. (2012)
O. I., and Mikhailov, S. N. (2013) Disaccharide py-
Transporters that translocate nucleosides and structur-
rimidine nucleosides and their derivatives: a novel
al similar drugs: structural requirements for substrate
group of cell-penetrating inhibitors of poly(ADP-ri-
recognition, Med. Res. Rev., 32, 428-457, doi: 10.1002/
bose) polymerase
1, Nucleosides Nucleotides Nu-
med.20221.
cleic Acids,
32,
510-528, doi:
10.1080/15257770.
50.
Inoue, K.
(2017) Molecular basis of nucleobase
2013.827793.
transport systems in mammals, Biol. Pharm. Bull., 40,
43.
Virág, L., and Szabó, C.
(2001) Purines inhibit
1130-1138, doi: 10.1248/bpb.b17-00374.
poly(ADP-ribose) polymerase activation and modu-
51.
Zingarelli, B., Cuzzocrea, S., Zsengellér, Z., Salzman,
late oxidant-induced cell death, FASEB J., 15, 99-107,
A. L., and Szabó, C. (1997) Protection against myo-
doi: 10.1096/fj.00-0299com.
cardial ischemia and reperfusion injury by 3-amino-
44.
Geraets, L., Moonen, H. J., Wouters, E. F., Bast, A.,
benzamide, an inhibitor of poly (ADP-ribose) syn-
and Hageman, G. J. (2006) Caffeine metabolites
thetase, Cardiovasc. Res., 36, 205-215, doi: 10.1016/
are inhibitors of the nuclear enzyme poly(ADP-
s0008-6363(97)00137-5.
ribose)polymerase-1 at physiological concentrations,
52.
Ilnytska, O., Lyzogubov, V. V., Stevens, M. J., Drel, V. R.,
Biochem. Pharmacol., 72, 902-910, doi: 10.1016/j.bcp.
Mashtalir, N., Pacher, P., Yorek, M. A., and Obrosova,
2006.06.023.
I. G. (2006) Poly(ADP-ribose) polymerase inhibition
45.
Hescheler, J., Meyer, R., Plant, S., Krautwurst, D.,
alleviates experimental diabetic sensory neuropathy,
Rosenthal, W., and Schultz, G. (1991) Morphological,
Diabetes, 55, 1686-1694, doi: 10.2337/db06-0067.
biochemical, and electrophysiological characterization
53.
Tas Hekimoglu, A., Toprak, G., Akkoc, H.,
of a clonal cell (H9c2) line from rat heart, Circ. Res.,
Evliyaoglu, O., Tas, T., Kelle, I., and Colpan, L.
69, 1476-1486, doi: 10.1161/01.res.69.6.1476.
(2014) Protective effect of 3-aminobenzamide, an
46.
Branco, A. F., Pereira, S. P., Gonzalez, S., Gusev, O.,
inhibitor of poly (ADP-ribose) polymerase in distant
Rizvanov, A. A., and Oliveira, P. J. (2015) Gene
liver injury induced by renal ischemia-reperfusion in
expression profiling of H9c2 myoblast differentiation
rats, Eur. Rev. Med. Pharmacol. Sci., 18, 34-38.
towards a cardiac-like phenotype, PLoS One, 10,
54.
Пушкарев С. В., Винник В. A., Шаповалова И. В.,
e0129303, doi: 10.1371/journal.pone.0129303.
Швядас В. К., Нилов Д. К. (2022) Моделирование
47.
Kankeu, C., Clarke, K., Van Haver, D., Gevaert, K.,
структуры комплекса тРНК-гуанинтрансгликози-
Impens, F., Dittrich, A., Roderick, H. L., Passante, E.,
лазы человека с 7-метилгуанином и выявление фак-
and Huber, H. J. (2018) Quantitative proteomics and
торов, определяющих взаимодействие фермента с
systems analysis of cultured H9C2 cardiomyoblasts
ингибиторами, Биохимия, 87, 550-557, doi: 10.31857/
during differentiation over time supports a “function
S0320972522040078.
NATURAL GUANINE DERIVATIVES EXERT PARP-INHIBITORY
AND CYTOPROTECTIVE EFFECTS IN A MODEL
OF CARDIOMYOCYTE DAMAGE UNDER OXIDATIVE STRESS
S. I. Shram1*, T. A. Shcherbakova2, T. V. Abramova3, E. C. Baradieva1, A. S. Efremova4,
M. S. Smirnovskaya5, V. N. Silnikov3, V. K. Švedas2,6, and D. K. Nilov2*
1 Institute of Molecular Genetics, National Research Centre “Kurchatov Institute”,
123182 Moscow, Russia; e-mail: shram-si.img@yandex.ru
2 Lomonosov Moscow State University, Belozersky Institute of Physicochemical Biology,
119992 Moscow, Russia; e-mail: nilovdm@gmail.com
3 Institute of Chemical Biology and Fundamental Medicine, Russian Academy of Sciences, Siberian Branch,
630090 Novosibirsk, Russia
4 Research Centre for Medical Genetics, 115522 Moscow, Russia
БИОХИМИЯ том 88 вып. 6 2023
6*
972
ШРАМ и др.
5 Faculty of Chemistry, Lomonosov Moscow State University, 119991 Moscow, Russia
6 Faculty of Bioengineering and Bioinformatics, Lomonosov Moscow State University, 119234 Moscow, Russia
Inhibitors of human poly(ADP-ribose) polymerase (PARP) are considered as promising agents for the treat-
ment of cardiovascular, neurological, and other diseases accompanied by inflammation and oxidative stress.
Previously, the ability of the natural compounds 7-methylguanine (7mGua) and 8-hydroxy-7-methyl-
guanine (8h7mGua) to suppress the activity of the recombinant PARP protein was demonstrated. In the
present work, we have investigated the possibility of PARP-inhibitory and cytoprotective action of 7mGua
and 8h7mGua against rat cardiomyoblast cultures (undifferentiated and differentiated H9c2). It was found
that 7mGua and 8h7mGua rapidly penetrate into cells and effectively suppress H2O2-stimulated PARP
activation (IC50 = 270 and 55 μM, respectively). The pronounced cytoprotective effects of 7mGua and
8h7mGua were shown in a cellular model of oxidative stress, and 8h7mGua exceeded the classic PARP in-
hibitor 3-aminobenzamide for effectiveness. The obtained data indicate the prospects for the development
of PARP inhibitors based on guanine derivatives and their testing on models of ischemia-reperfusion tissue
damage.
Keywords: 7-methylguanine, 8-hydroxy-7-methylguanine, poly(ADP-ribose) polymerase, inhibitor, cardiomyocytes,
oxidative stress, cytoprotection
БИОХИМИЯ том 88 вып. 6 2023