БИОХИМИЯ, 2023, том 88, вып. 6, с. 984 - 994
УДК 577.112.7
СТРУКТУРНО-ФУНКЦИОНАЛЬНЫЕ ИССЛЕДОВАНИЯ
ИЗОФОРМ ТРОПОМИОЗИНА Tpm4.1 И Tpm2.1
© 2023 А.С. Логвинов1,2, В.В. Нефёдова1, Д.С. Ямпольская1, С.Ю. Клейменов1,3,
Д.И. Левицкий1, А.М. Матюшенко1*
1 Федеральный исследовательский центр «Фундаментальные основы биотехнологии» РАН,
119071 Москва, Россия; электронная почта: ammatyushenko@mail.ru
2 Московский государственный университет имени М.В. Ломоносова, биологический факультет,
119991 Москва, Россия
3 Институт биологии развития им. Н.К. Кольцова РАН, 119334, Москва, Россия
Поступила в редакцию 28.03.2023
После доработки 05.05.2023
Принята к публикации 10.05.2023
Тропомиозин (Tpm) - это один из важнейших партнёров актинового филамента, во многом опре-
деляющий его свойства. В организмах животных существуют разные изоформы Tpm, которые, как
считается, участвуют в регуляции различных клеточных функций. Однако молекулярные меха-
низмы регуляции функций актиновых филаментов различными цитоплазматическими изофор-
мами Tpm до сих пор мало изучены. В нашей работе мы применяли различные методы для иссле-
дования свойств изоформ Tpm2.1 и Tpm4.1 и сравнивали их как между собой, так и со свойствами
изоформ Tpm, которые уже подвергались ранее более детальному изучению. Изоформы Tpm2.1
и Tpm4.1 почти не отличались друг от друга по их сродству к фибриллярному актину (F-актину),
по термостабильности их молекул и по их устойчивости к ограниченному протеолизу трипси-
ном, но заметно различались по вязкости их растворов и по термостабильности их комплексов
с F-актином. Главным отличием Tpm2.1 и Tpm4.1 от других ранее исследованных изоформ Tpm
(таких, например, как Tpm1.6 и Tpm1.7) была их крайне низкая термостабильность, измеренная
методами КД и ДСК. Возможные причины этой нестабильности детально рассмотрены при срав-
нении аминокислотных последовательностей Tpm4.1 и Tpm2.1 с последовательностями изоформ
Tpm1.6 и Tpm1.7, которые не отличались от Tpm4.1 и Tpm2.1 соответственно по экзонной структуре
их генов.
КЛЮЧЕВЫЕ СЛОВА: изоформы тропомиозина; стабильность структуры coiled-coil, актин-ассоцииро-
ванные белки, актиновые филаменты, дифференциальная сканирующая калориметрия.
DOI: 10.31857/S0320972523060088, EDN: EFOAFG
ВВЕДЕНИЕ
вого филамента. Считается, что Tpm способен
регулировать функции актинового цитоскеле-
Тропомиозин (Tpm) представляет собой
та в животной клетке и выступает своеобраз-
фибриллярный актин-связывающий белок,
ным «привратником» [3, 4], определяющим, с
присутствующий во многих структурах акти-
какими партнёрами будет взаимодействовать
нового цитоскелета. Tpm широко распростра-
актиновый филамент [5, 6]. Было показано,
нён в организмах животных и представлен во
что Tpm повышает стабильность актиновых
всех их тканях [1]. Tpm формирует так назы-
филаментов [7, 8] и предотвращает их депо-
ваемую структуру coiled-coil, образованную
лимеризацию [9, 10]. Tpm также участвует в
двумя параллельными друг другу α-спираля-
регуляции глобальных клеточных процессов,
ми [2]. За счёт концевых взаимодействий между
таких как морфогенез и тканевая дифферен-
молекулами Tpm образует вытянутую нить, ко-
цировка [11, 12], везикулярный транспорт [13,
торая плотно прилегает к поверхности актино-
14], клеточная адгезия [15, 16], а также регу-
ляция сокращения скелетных и сердечных
мышц [17, 18].
Принятые сокращения: ДСК - дифференциальная
сканирующая калориметрия; F-актин - фибриллярный
У млекопитающих обнаружено более 40 изо-
актин; Tpm - тропомиозин.
форм Tpm [1]. Большое количество изоформ
* Адресат для корреспонденции.
может лежать в основе регуляции различных
984
СВОЙСТВА ИЗОФОРМ ТРОПОМИОЗИНА Tpm4.1 И Tpm2.1
985
функций Tpm и обеспечивать взаимодействие
актину (F-актину). В одних исследованиях
с другими актин-связывающими белками [19-
было определено высокое сродство Tpm2.1
21]. Молекулы Tpm являются продуктами
к F-актину (Kd ≤ 1 мкМ) [30, 31], тогда как в
четырёх генов (TPM1, TPM2, TPM3 и TPM4),
других исследованиях оно было существенно
а большая вариабельность в синтезе изоформ
ниже (Kd = 5,5 мкМ) [32].
возникает в основном в результате альтер-
Гораздо меньше известно о свойствах изо-
нативного сплайсинга [1]. Особенности эк-
формы Tpm4.1. На данный момент имеются
зонной структуры этих изоформ и их назва-
только доказательства её существования и
ния представлены в общепринятой номенкла-
была опубликована лишь одна работа, демон-
туре Tpm [22].
стрирующая последствия снижения экспрес-
В нашей работе мы изучили свойства двух
сии этой изоформы в клетках эпителия молоч-
изоформ Tpm: Tpm2.1 и Tpm4.1. Изоформа Tpm2.1
ной железы. В этой работе было показано, что
достаточно хорошо изучена, тогда как работ,
нарушение экспрессии Tpm4.1 приводит к раз-
посвящённых Tpm4.1 очень мало. Tpm2.1 пред-
рушению межклеточных контактов и способ-
ставляет собой уникальную изоформу, кото-
ствует усилению клеточной инвазии [33].
рая экспрессируется как в гладкомышечных,
В нашей работе с использованием различ-
так и в немышечных тканях [23, 24]. В гладко-
ных подходов мы оценили свойства изоформ
мышечных клетках Tpm2.1 является частью
Tpm2.1 и Tpm4.1 и сравнили их как друг с дру-
сократительного аппарата клетки и участвует
гом, так и со свойствами других известных
в сокращении этого типа мышц [24]. Следует
изоформ Tpm.
отметить, что в гладких мышцах Tpm2.1 в ос-
новном образует гетеродимеры с другой изо-
формой Tpm, продуктом гена TPM1 (Tpm1.3
МАТЕРИАЛЫ И МЕТОДЫ
или Tpm1.4, старое название - α smooth Tm
или просто α Tm [22]) [2, 24]. Функции Tpm2.1
Получение белков. Все молекулярно-гене-
в немышечных клетках пока ещё полностью не
тические конструкции изоформ Tpm, исполь-
изучены. Известно, что он принимает участие
зуемые в этой работе, представляли собой
в формировании стресс-фибрилл в клетках и
кодирующие последовательности (CDS) с до-
участвует в передаче механических сигналов
полнительными триплетами, кодирующими
от внеклеточного матрикса [23, 25]. Сниже-
Ala и Ser перед основной последовательностью
ние экспрессии Tpm2.1 приводит к разборке
для имитации естественного N-концевого аце-
стресс-фибрилл и часто коррелирует с раз-
тилирования [34]. CDS различных изоформ
витием опухолевой трансформации и уси-
Tpm были синтезированы («Евроген», Россия)
лением клеточной инвазии [26, 27]. Tpm2.1
и клонированы в вектор pET-23a+ между сай-
часто называют раковым супрессором. Так,
тами рестрикции NdeI и EcoRI. Корректность
восстановление экспрессии этой изоформы в
всех конструкций проверена секвенированием
раковых клетках приводит к возобновлению
(«Евроген»).
нормального функционирования клеток и
Белковые препараты получали в клетках
предотвращению злокачественной трансфор-
Escherichia coli штамма C41 (DE3). Ночную куль-
мации [25, 28].
туру инокулировали в 1 литр свежей среды LB
В литературе также имеются данные о
(«Ambresco», США) в присутствии 100 мг/литр
структурно-функциональных свойствах моле-
ампициллина. Клетки росли до тех пор, пока
кулы Tpm2.1. Ранее стабильность этой изофор-
поглощение суспензии (при длине волны
мы Tpm изучали методом дифференциаль-
600 нм) не достигало 0,6, после чего индуци-
ной сканирующей калориметрии (ДСК) [29].
ровали экспрессию добавлением 1 мМ IPTG.
Плавление всей молекулы происходило в ин-
Клетки продолжали инкубировать в течение
тервале температур 20-50 °C, и при деконво-
ночи при 30 °C и постоянном перемешивании.
люции кривых избыточного теплопоглощения
Затем клетки осаждали центрифугированием
в молекуле были обнаружены три калори-
(4000 g, 50 мин) и ресуспендировали в буфере
метрических домена (т.е. частей молекулы,
для очистки (50 мМ Tris-HCl, pH 8,0).
которые денатурируют кооперативно и неза-
Изоформы Tpm очищали, как было описа-
висимо друг от друга). Среди них был иденти-
но ранее [35]. Сначала Tpm подвергали грубой
фицирован калориметрический домен, соот-
экстракции. Суспензию разрушенных клеток
ветствующий плавлению N-концевой части
инкубировали при 86 °C в течение 5 мин с по-
молекулы Tpm2.1 [29]. В литературе также
следующим центрифугированием при 15 000 g
имеются данные, хотя и довольно противо-
в течение
40 мин. Осадок отбрасывали,
речивые, о сродстве Tpm2.1 к фибриллярному
а супернатант подвергали изоэлектрическому
7
БИОХИМИЯ том 88 вып. 6 2023
986
ЛОГВИНОВ и др.
осаждению с последующим центрифугиро-
цы Tpm с концентрацией 0,5 мг/мл подвергали
ванием при 15 000 g в течение 40 мин. Осадок
воздействию трипсина, обработанного L-1-
растворяли в 50 мМ Tris-HCl (pH 8,0) и про-
тозиламидо-2-фенилэтилхлорметилкетоном
водили диализ в течение ночи против этого
(«Worthington», США). Образцы инкубировали
буфера. На заключительном этапе препара-
в течение 90 мин при 30 °С в 30 мМ Hepes-Na
ты Tpm очищали с помощью ионообменной
(рН 7,3), содержащем 100 мМ NaCl. В экспе-
хроматографии на колонке HiTrapQ HP («GE
риментах использовали массовое соотноше-
Healthcare», США) с использованием линей-
ние трипсина к Tpm, равное 1 : 300. Аликвоты
ного градиента NaCl (0-2 М). Концентрацию
образцов отбирали в разное время, а реакцию
препаратов Tpm определяли спектрофотоме-
останавливали добавлением буфера для образ-
трически с использованием коэффициентов
цов, содержащего 5 мМ фенилметилсульфонил
экстинкции E1% при 280 нм, равных 2,1 см-1 -
фторида. Протеолиз белка анализировали с по-
для Tpm4.1 и 2,73 см-1 - для Tpm2.1.
мощью электрофореза в 12,5%-ном SDS-PAGE.
Глобулярный мономер ATP-G-актин экс-
Полученный гель сканировали, и анализиро-
трагировали из ацетонового порошка мышц
вали интегральную плотность с использова-
кролика по стандартной методике [36]. F-Ак-
нием программного обеспечения ImageJ 1.53q.
тин полимеризовали из ATP-G-актина добав-
Соосаждение Tpm с F-актином. Срод-
лением 5 мМ MgCl2 и 100 мМ NaCl. За поли-
ство Tpm к F-актину оценивали с помо-
меризацией следили путём регистрации свето-
щью анализа их совместного осаждения, как
рассеяния при 350 нм с использованием флуо-
описано ранее [35]. Вкратце, 10 мкМ F-ак-
ресцентного спектрофотометра Cary Eclipse
тин, стабилизированный фаллоидином, сме-
(«Varian Australia Pty Ltd», Австралия). Пол-
шивали с Tpm в различных концентрациях
ная полимеризация F-актина занимала не бо-
(0-7,5 мкМ) в 30 мМ Hepes-Na (рН 7,3), содер-
лее 30 мин.
жащем 200 мМ NaCl. Затем актин осаждали
Метод спектроскопии кругового дихро-
вместе со связанным с ним Tpm путём ультра-
изма (КД). Эксперименты по КД проводили
центрифугирования при 100 000 g в течение
на КД-спектрофотометре Chirascan («Applied
40 мин («Beckman Coulter», США). Эквивалент-
Photophysics», Великобритания). Спектры КД
ные образцы осадка и супернатанта подвергали
для Tpm2.1 и Tpm4.1 регистрировали при 5 °C в
анализу с помощью электрофореза в 12,5%-ном
кюветах с длиной оптического пути 0,02 см при
SDS-PAGE. Полученные гели сканировали и
концентрации белка 1 мг/мл. Спектры име-
анализировали интегральную плотность с
ли стандартный вид с двумя отрицательными
использованием программного обеспечения
максимумами при 222 и 208 нм, характерными
ImageJ 1.53q. Долю F-актина, связанного с мо-
для α-спиральных белков. Термостабильность
лекулами Tpm, определяли как отношение ко-
препаратов Tpm измеряли путём регистрации
личества Tpm в осадке к количеству F-актина.
молярной эллиптичности при 222 нм в диапа-
Определение термостабильности комплексов
зоне температур 5-70 °C со скоростью нагрева
Tpm с F-актином. Диссоциацию комплексов
1 °C/мин; другие условия: концентрация Тpm
Tpm с F-актином индуцировали с помощью
составляла 1 мг/мл в 30 мМ Hepes-Na (рН 7,3),
нагревания и следили за ней по изменению
содержащем 100 мМ NaCl и 1 мМ ДТТ. Два по-
светорассеяния, как описано ранее [35]. Экс-
следовательных нагревания использовали для
перименты проводили при постоянной ско-
проверки обратимости термического развора-
рости нагрева 1 °C/мин на флуоресцентном
чивания образцов Tpm.
спектрофотометре Cary Eclipse, оснащённом
Метод дифференциальной сканирующей ка-
регулятором температуры и термоприставкой.
лориметрии. Эксперименты методом ДСК про-
Образцы содержали F-актин (20 мкМ), стаби-
водили на дифференциальном адиабатичес-
лизированный фаллоидином, и 10 мкМ Tpm.
ком сканирующем микрокалориметре MicroCal
При обработке экспериментальных данных,
VP-Capillary DSC («Malvern Instruments», США)
полученных для комплексов Tpm с F-акти-
при скорости нагревания 1 °C/мин, как описа-
ном, вычитали температурную зависимость
но ранее [37]. Концентрация Тpm составляла
светорассеяния свободного F-актина; после
2 мг/мл в 30 мМ Hepes-Na (рН 7,3), содержа-
этого кривые были аппроксимированы стан-
щем 100 мМ NaCl. Профили ДСК анализиро-
дартной сигмоидальной функцией Больцмана
вали с использованием программного обеспе-
(Boltzmann function) в программе Origin 7.0.
чения Origin 7.0 («MicroCal Inc», США), как
Основным параметром, извлекаемым из этого
описано ранее [37].
анализа, является Tdiss, т.е. та температура, при
Ограниченный протеолиз трипсином. Для
которой происходит 50%-ное снижение свето-
проведения ограниченного протеолиза образ-
рассеяния.
БИОХИМИЯ том 88 вып. 6 2023
СВОЙСТВА ИЗОФОРМ ТРОПОМИОЗИНА Tpm4.1 И Tpm2.1
987
Измерение вязкости растворов Tpm. Экспе-
рименты проводили на вискозиметре AMVn
(«Anton Paar GmbH», Австрия) с использо-
ванием капилляра объёмом 0,5 мл при 20 °C.
Для корректных расчётов вязкости удельную
плотность растворов Тpm измеряли на при-
боре DMA 4500 («Anton Paar GmbH»). Все
измерения проводили при концентрации
Tpm 2 мг/мл в 30 мМ Hepes-Na (рН 7,3), содер-
жащем 100 мМ NaCl и 1 мМ ДТТ. Измерения
повторяли трижды, а полученные значения
усредняли.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Структурные свойства изоформ Tpm2.1
и Tpm4.1. Значительная часть работы была
посвящена изучению структурных свойств
изоформ Tpm2.1 и Tpm4.1. Мы использовали
такие методы, как КД, ДСК и ограниченный
протеолиз трипсином, для описания стабиль-
ности этих изоформ Tpm. Результаты этих экс-
периментов представлены на рис. 1-3.
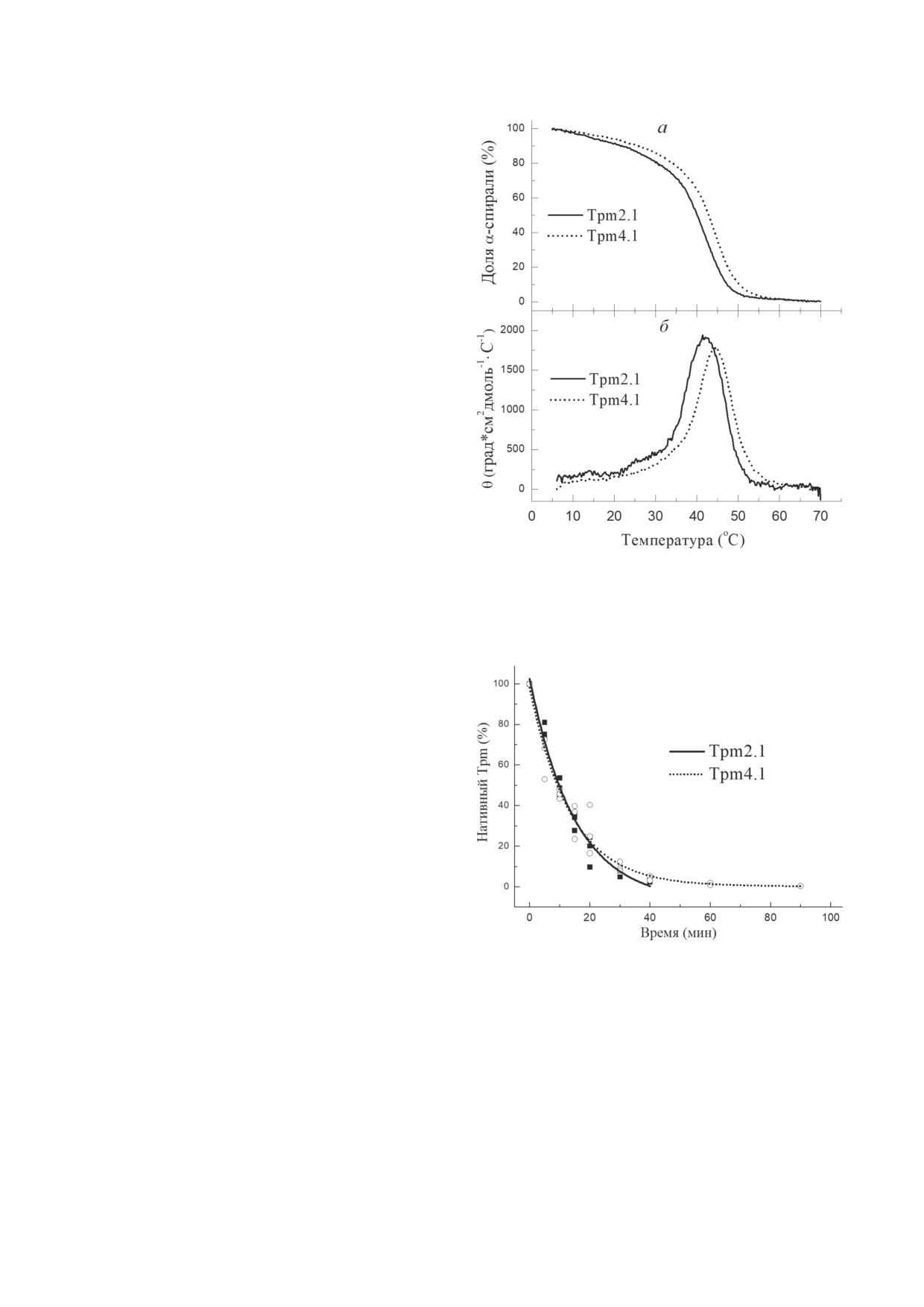
Рис. 1. Стабильность молекул Tpm2.1 и Tpm4.1, измерен-
В первую очередь мы применили метод
ная с помощью КД (а и б). Температурные зависимости
содержания α-спиралей измеряли с помощью регистра-
КД для изучения термостабильности изоформ
ции эллиптичности при 222 нм при постоянной скорости
Tpm2.1 и Tpm4.1 (рис. 1, а и б). Разрушение
нагрева (1 °C/мин)
α-спирали при нагревании для этих видов Tpm
исследовали путём измерения эллиптично-
сти при 222 нм, которая отражает содержание
α-спирали в молекуле Tpm. До 30-34 °С изо-
формы Tpm2.1 и Tpm4.1 теряют около 20%
своей α-спиральности при некооперативном
плавлении, а основная потеря спиральности
происходит при более высокой температуре,
в интервале от 34-35 до 50-52 °С (рис. 1, а).
В дифференциальной форме основной теп-
ловой переход наблюдался при
~42 °С для
Tpm2.1 и при 44 °С - для Tpm4.1 (рис. 1, б).
В целом, результаты КД показали, что термо-
стабильность Tpm4.1 была несколько выше,
чем у Tpm2.1.
Стабильность молекул Tpm4.1 и Tpm2.1
оценивали также методом ограниченного про-
теолиза трипсином, позволяющим определить
Рис. 2. Стабильность молекул Tpm2.1 и Tpm4.1, измерен-
устойчивость этих молекул к протеолизу, кото-
ная с помощью ограниченного протеолиза трипсином.
рая оказалась одинаковой для обеих изоформ
Протеолиз проводили при 30 °C при соотношении трип-
син : Tpm, равном 1 : 300
Tpm (рис. 2). Вероятно, это связано с тем,
что протеолиз происходит преимущественно
по центральной части молекулы Tpm - наи-
изоформ Tpm [35, 38]. Именно этим можно
менее стабильной части молекулы из-за нали-
объяснить тот факт, что изоформы Tpm4.1
чия в ней ряда неканонических аминокислот-
и Tpm2.1, которые мало различаются по после-
ных остатков, дестабилизирующих двойную
довательности центральной части их молекул,
спираль. Ранее было показано, что амино-
не различаются и по их устойчивости к про-
кислотная последовательность этой части мо-
теолизу трипсином.
лекулы обладает чрезвычайно высокой кон-
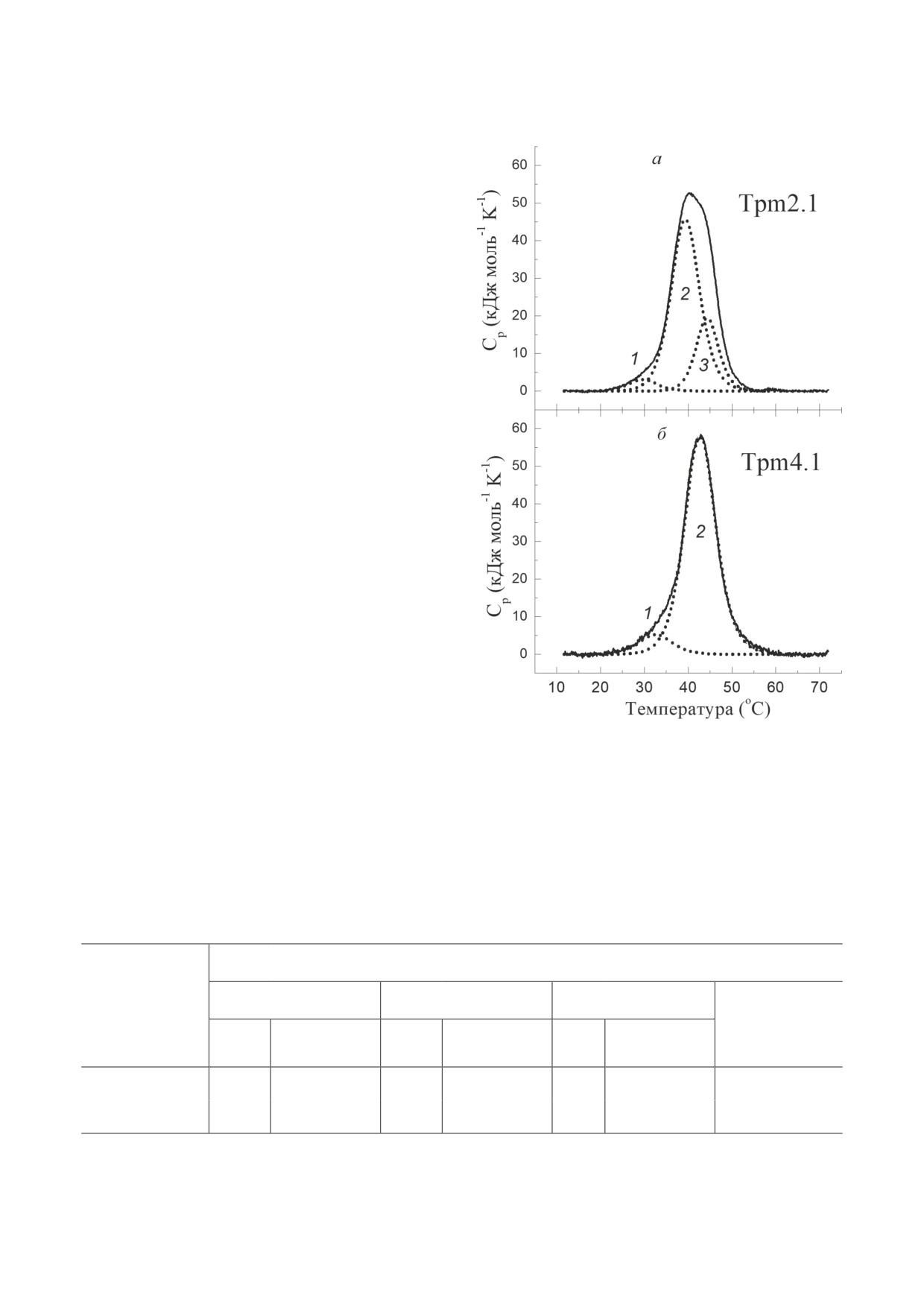
Данные ДСК (рис. 3) достаточно хоро-
сервативностью для множества самых разных
шо согласуются с результатами, полученными
БИОХИМИЯ том 88 вып. 6 2023
7*
988
ЛОГВИНОВ и др.
методом КД. Деконволюционный анализ по-
казал, что кривую ДСК для Tpm2.1 можно
разложить на три калориметрических домена
(рис. 3, а; таблица), что хорошо согласуется с
ранее опубликованными результатами
[29].
Более того, ранее было показано, что калори-
метрический домен 2 на кривой ДСК соот-
ветствует плавлению N-концевой части моле-
кулы Tpm2.1 [29]. Напротив, изоформа Tpm4.1
продемонстрировала только два калориметри-
ческих домена на кривой ДСК (рис. 2, б; таб-
лица). Вероятно, некоторые части молекулы
Tpm4.1 денатурируют вместе как единый ка-
лориметрический домен 2 или их тепловые
переходы совпадают по положению и потому
не могут быть разделены деконволюционным
анализом. Что касается наименее термоста-
бильного калориметрического домена 1, то он,
вероятно, отражает некооперативное плавле-
ние некоторых довольно малых частей молекул
Tpm2.1 и Tpm4.1. В целом, температуры тепло-
вого перехода для главных калориметрических
доменов близки для изоформ Tpm2.1 и Tpm4.1,
что свидетельствует о сходной стабильности
всех частей молекул для этих изоформ Tpm.
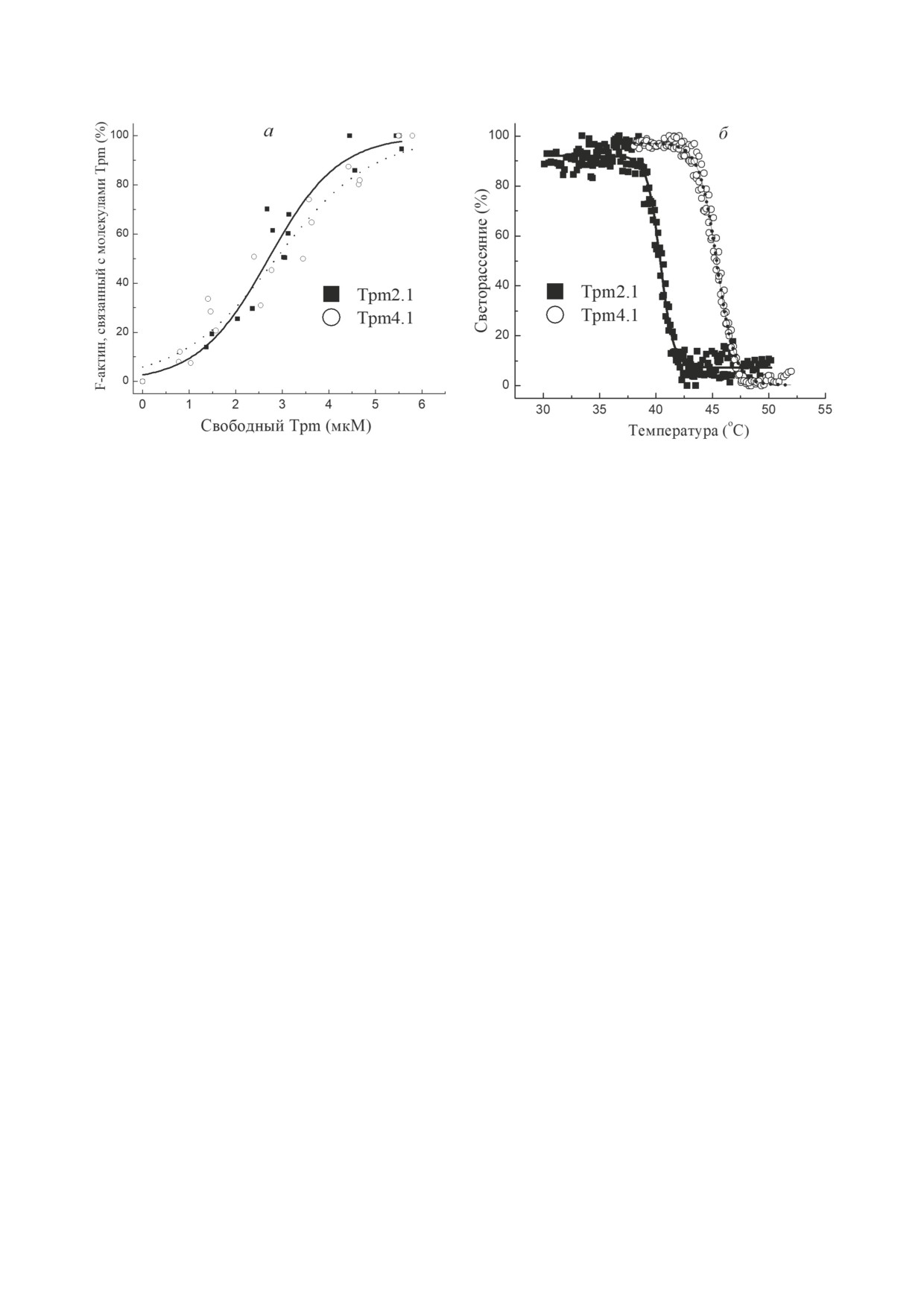
Функциональные свойства изоформ Tpm2.1
и Tpm4.1. Параметры взаимодействия Tpm2.1
и Tpm4.1 с F-актином оценивали методами
соосаждения Tpm с F-актином и регистрации
термостабильности комплексов Tpm-F-актин
по изменению светорассеяния. Результаты этих
исследований представлены на рис. 4. Срод-
ство изоформ Tpm к F-актину было практи-
чески идентичным (рис. 4, а): значение K50%
Рис. 3. Температурные зависимости избыточного тепло-
поглощения (Cp) для изоформ Tpm2.1 (а) и Tpm4.1 (б),
составляло 2,70 ± 0,18 мкМ для Tpm2.1 и 3,02 ±
полученные методом ДСК. Сплошные линии представ-
± 0,22 мкМ - для Tpm4.1.
ляют собой экспериментальные кривые после вычитания
В отличие от сродства изоформ Tpm к
инструментальных и химических базовых линий, а пунк-
F-актину (рис. 4, а), термостабильность ком-
тирными линиями показаны отдельные тепловые пере-
ходы (калориметрические домены), полученные путём
плексов Tpm-F-актин была значительно выше
деконволюции этих кривых. Каждый калориметрический
для Tpm4.1 (Tdiss = 45,4 ± 0,3 °C), чем для Tpm2.1
домен обозначен цифрами по мере увеличения термоста-
(Tdiss = 40,4 ± 0,3 °C) (рис. 4, б). Примечательно,
бильности
Калориметрические параметры для изоформ Tpm2.1 и Tpm4.1, полученные после анализа кривых ДСК
Калориметрические параметры***
Домен 1
Домен 2
Домен 3
Изоформы Tpm
∑ΔHcal**,
кДж/моль
ΔHcal,
ΔHcal,
ΔHcal,
Tm*, °C
Tm, °C
Tm, °C
кДж/моль
кДж/моль
кДж/моль
Tpm2.1
29,4
30
39,3
390
44,3
200
620
Tpm4.1
32,6
50
42,7
550
-
-
600
Примечание. * Tm - температура калориметрического домена; ** ΔHcal - значение калориметрической энтальпии;
*** Погрешность приведённых значений температуры не превышала ± 0,2 °C; для значений калориметрической
энтальпии погрешность не превышала 10%.
БИОХИМИЯ том 88 вып. 6 2023
СВОЙСТВА ИЗОФОРМ ТРОПОМИОЗИНА Tpm4.1 И Tpm2.1
989
Рис. 4. Функциональные свойства молекул Tpm. а - Сродство Tpm2.1 и Tpm4.1 к F-актину, полученное с помощью
соосаждения Tpm с F-актином. Результаты представлены на графике как доля F-актина, декорированного Tpm,
в зависимости от концентрации свободного Tpm, обнаруженного в супернатанте. Значения K50%, соответствующие
концентрациям Tpm при полунасыщении, составляют 2,70 ± 0,18 мкМ для Tpm2.1 и 3,02 ± 0,22 мкМ - для Tpm4.1.
б - Нормализованные температурные зависимости диссоциации Tpm2.1 и Tpm4.1 с поверхности F-актина. Сниже-
ние интенсивности светорассеяния отражает диссоциацию комплекса Tpm-F-актин. Значения Tdiss (т.е. той тем-
пературы, при которой интенсивность светорассеяния снижается на 50%) составляют 40,4 ± 0,3 °C для Tpm2.1
и 45,4 ± 0,3 °C - для Tpm4.1
что для Tpm2.1 значение Tdiss (40,4 ± 0,3 °C)
тельная часть Tpm4.1 (около 25%) не струк-
(рис. 4, б) было сравнимо с температурой плав-
турирована в диапазоне физиологических
ления основного калориметрического доме-
температур (рис. 1, а). Такие структурные осо-
на 2 (39,3 °C) (рис. 3, а). Это указывает на то,
бенности, вероятно, придают молекуле Tpm4.1
что стабильность комплексов Tpm2.1 с F-акти-
высокую лабильность, что может влиять на её
ном зависит в первую очередь от стабильности
функциональные свойства.
самой молекулы Tpm. Однако стабильность
Результаты, полученные методом ДСК и
комплексов F-актина с Tpm4.1 была значи-
свидетельствующие о низкой термостабиль-
тельно выше, чем термостабильность молеку-
ности изоформы Tpm2.1 (рис. 3, а), хорошо
лы Tpm4.1. Это означает, что в случае Tpm4.1
согласуются с данными, полученными ра-
существуют и другие факторы, которые мо-
нее [29]. По своей стабильности изоформы
гут влиять на стабильность его комплекса с
Tpm2.1 и Tpm4.1 очень похожи друг на друга
F-актином. Мы предположили, что допол-
(рис. 1-3). Отметим, что Tpm2.1, Tpm4.1 и ра-
нительный вклад могут вносить концевые
нее изученная изоформа Tpm2.2 [37] состав-
взаимодействия между молекулами Tpm, и
ляют когорту нестабильных изоформ Tpm.
оценили их силу методом вискозиметрии.
С большой долей вероятности уникально низ-
Действительно, вязкость раствора Тpm соста-
кая термостабильность этих изоформ Tpm мо-
вила 0,484 ± 0,001 мПа·с для Тpm4.1, что су-
жет быть важна для их функционирования.
щественно выше, чем значение, полученное
Сродство Tpm4.1 и Tpm2.1 к F-актину
для Тpm2.1 - 0,321 ± 0,002 мПа·с.
можно оценить как среднее по сравнению
с другими изоформами Tpm. Аффинность
этих изоформ уступает некоторым продук-
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
там гена TPM1, таким как Tpm1.5 (1,1 мкМ)
и Tpm1.7 (0,4 мкМ) [39]; но, с другой стороны,
Сравнение свойств Tpm2.1 и Tpm4.1 с дру-
их сродство значительно выше, чем у Tpm1.12
гими изоформами Tpm. Tpm4.1 - одна из наи-
(15,5 мкМ) [39] или Tpm3.7 (3,7 мкМ) [40].
менее стабильных изоформ Tpm. Она обладает
Примечательно, что сродство Tpm4.1 и Tpm2.1
довольно уникальными структурными свой-
к F-актину ниже, чем у других продуктов ге-
ствами. Почти все части молекулы Tpm4.1 де-
нов TPM4 и TPM2 (1,07 мкМ - для Tpm4.2 и
натурируют вместе как единый калориметри-
0,33 мкМ - для Tpm2.2) [39, 41]. Сродство
ческий домен 2 (рис. 3, б) и довольно значи-
Tpm2.1 к F-актину, полученное в наших экс-
БИОХИМИЯ том 88 вып. 6 2023
990
ЛОГВИНОВ и др.
периментах, отличается от предыдущих ис-
Ген TPM1 также экспрессирует две изо-
следований [30-32, 39-41]. Эти различия в
формы Tpm с идентичным набором экзонов,
значениях аффинности можно объяснить зна-
изоформы Tpm1.6 и Tpm1.7. Структуры эк-
чительными различиями в эксперименталь-
зонов Tpm1.6 и Tpm1.7 идентичны структу-
ных условиях, таких как используемая ионная
рам Tpm4.1 и Tpm2.1 соответственно. Однако
сила, различия в изоформах актина и др.
термостабильность молекул Tpm1.6 и Tpm1.7
Стабильность комплекса Tpm4.1 с F-акти-
значительно выше, чем у изученных изоформ.
ном (Tdiss = 45,4 °С) также находится на уров-
Особенно это касается калориметрического
не средних значений для различных изо-
домена 3, соответствующего плавлению N-кон-
форм Tpm; однако она значительно ниже, чем
цевой части молекул Tpm1.6 и Tpm1.7 [39].
у другого продукта гена ТРМ4 - Тpm4.2 (Тdiss =
Термическая стабильность этого домена была
= 49,8 °С) [39]. Что касается изоформы Tpm2.1,
выше на 7,1 °C в случае Tpm1.7 по сравнению
то она образует один из самых нестабильных
с Tpm2.1 и на 6,7 °C - в случае Tpm1.6 по срав-
комплексов с F-актином среди других изо-
нению с главным (объединённым) доменом 2
форм Tpm [39-41].
в случае Tpm4.1.
В целом, можно отметить, что основным
Для того чтобы понять, в чём может быть
отличием изучаемых нами препаратов Tpm от
причина такого различия, мы сравнили после-
других изоформ является их низкая термоста-
довательности этих изоформ (рис. 5). Tpm1.6
бильность. Довольно сложно разобраться, к
отличается от Tpm4.1 42 аминокислотными
каким функциональным последствиям это мо-
остатками, что составляет 14,7% от общей по-
жет привести. Однако можно понять, почему
следовательности. Однако 19 аминокислотных
изоформы Tpm4.1 и Tpm2.1 крайне нестабиль-
замен аналогичны (рис. 5). В свою очередь,
ны, если обратиться к их аминокислотным
Tpm1.7 отличается от Tpm2.1 49 остатками,
последовательностям и использовать то свой-
т.е. несколько больше по сравнению с преды-
ство, что структура coiled-coil строго опреде-
дущей парой. Отличие от общей последова-
ляется её первичной последовательностью.
тельности составляет 17,2%, а 27 остатков из 49
Возможные причины низкой стабильности
аналогичны (рис. 5). В целом, можно сказать,
изоформ Tpm2.1 и Tpm4.1. Предыдущие рабо-
что последовательности очень похожи друг
ты показали важность первичной последова-
на друга, однако в случае молекулы Tpm даже
тельности Tpm для формирования его стабиль-
единичная замена может сильно повлиять
ной структуры. Особую роль в стабильности
на её стабильность. Поэтому мы решили вни-
молекулы Tpm играют вариабельные экзоны
мательно посмотреть на последовательности.
генов Tpm [38]. Так, было продемонстриро-
Особое внимание при анализе уделялось поло-
вано, что стабильность многих изоформ Tpm
жениям a и d в гептадах, так как они отвечают
зависит от того, какие экзоны входят в состав
за стабильность гидрофобного кора структуры
его последовательности [38]. Исследования по
coiled-coil. Во-вторую очередь, внимание было
множественному выравниванию изоформ Tpm
сосредоточено на позициях e и g, которые мо-
показали, что основное различие в последова-
гут дополнительно стабилизировать структуру
тельностях между разными изоформами Tpm
суперспирали. Поскольку наибольшая разни-
достигается за счёт использования альтерна-
ца в стабильности наблюдается в N-концевой
тивно сплайсированных экзонов [42]. В то же
части молекул, последовательность этой части
время одни и те же экзоны высоко консерва-
анализировали в первую очередь.
тивны между разными генами [1, 42]. Это
Имеется 5 замен в выбранных положениях
означает, что изоформы Tpm, кодируемые раз-
между изоформами Tpm1.7 и Tpm2.1 в N-кон-
ными генами с одними и теми же экзонами,
цевой части их молекул. Это замены L43Q,
должны быть похожи друг на друга по своим
L57V, L64V и L71Q в позиции a и A63S - в по-
свойствам.
зиции g (первая буква кода соответствует изо-
Изоформы Tpm2.1 и Tpm4.1 имеют вариа-
форме Tpm1.7, а вторая - Tpm4.1). Ни одна из
бельные экзоны 1a2b6a9d и 1a2b6b9d соответ-
этих замен не может быть отмечена как кри-
ственно. Легко видеть, что эти изоформы от-
тическая для структуры двойной суперспи-
личаются друг от друга только экзонами 6 (6а
рали. Однако, с точки зрения теоретической
или 6b), если не учитывать экспрессию с раз-
стабильности спиральных структур [2, 44], все
ных генов. Экзон 6 приходится на централь-
замены в позиции a имеют несколько худшие
ную часть молекулы Tpm, одну из самых не-
параметры стабилизации гидрофобного кора в
стабильных частей во всей молекуле, как было
случае изоформы Tpm2.1. По-видимому, сни-
показано ранее [43], и, вероятно, поэтому эти
жение стабильности N-концевой части моле-
изоформы так близки по своей стабильности.
кулы Tpm2.1 по сравнению с Tpm1.7 можно
БИОХИМИЯ том 88 вып. 6 2023
СВОЙСТВА ИЗОФОРМ ТРОПОМИОЗИНА Tpm4.1 И Tpm2.1
991
Рис. 5. Результаты множественного выравнивания, полученные для изоформ тропомиозина Tpm1.6, Tpm1.7, Tpm2.1
и Tpm4.1. Светло-серый цвет указывает на сходные аминокислоты в первичной последовательности молекул Tpm,
темно-серый цвет - на аминокислоты, существенно различающиеся по своим свойствам, а без окраски приведены
идентичные аминокислоты. Положения аминокислот в структуре гептад выделены курсивом a-g
объяснить кумулятивным эффектом небольшо-
структуры coiled-coil. Аминокислотных за-
го снижения стабильности, вызванного заме-
мен в С-концевой части молекулы Tpm также
нами в положении a. В С-концевой части моле-
больше, как и в предыдущим случае. Однако
кулы имеется большое количество замен между
только 2 замены, A211S и V260L, находящиеся
этими двумя изоформами (рис. 5). Однако все
в положении a, могли бы повлиять на стабиль-
они в основном приходятся на позиции b, c и f,
ность суперспирали. Однако предсказать их
меньше - на позиции e и g, и только две воз-
действие сложно. Замена в положении 211 дол-
действуют на гидрофобный кор молекулы. Эти
жна приводить к небольшой дестабилизации
замены, V190A и K213E, размещены в поло-
С-концевой части молекулы Tpm4.1 по срав-
жениях a и d соответственно. Первая из них
нению с Tpm1.6, но этот эффект, вероятно,
(V190А) может вызвать незначительную деста-
устраняется заменой V260L. В пользу такой
билизацию в структуре суперспирали, а другая
интерпретации свидетельствует тот факт, что
(К213Е) не должна приводить к существенным
калориметрический домен 2 на кривых ДСК
изменениям, поскольку заряд в гидрофобном
имеет одинаковую температуру плавления как
коре молекулы независимо от его знака при-
для Tpm4.1, так и для Tpm1.6 [39].
водит к дестабилизации структуры coiled-coil.
Аналогичная ситуация наблюдается и при
сравнительном анализе последовательностей
ЗАКЛЮЧЕНИЕ
изоформ Tpm1.6 и Tpm4.1 (рис. 5). Как и в
предыдущем случае, основное отличие в ста-
В данной работе были изучены различные
бильности приходится на N-концевую часть
свойства изоформ Tpm2.1 и Tpm4.1. Показа-
молекулы Тpm, в которой не так много замен.
но, что основным отличием этих изоформ от
Особое внимание следует уделить трём из них.
других изоформ Тpm является их низкая ста-
Две из этих замен (L39V и A74T) размещены
бильность (термостабильность). Причина сни-
в позиции d и одна (A63D) - в позиции g. Все
женной стабильности этих изоформ кроется в
они могут вызывать эффект дестабилизации
группе аминокислотных остатков в гидрофоб-
БИОХИМИЯ том 88 вып. 6 2023
992
ЛОГВИНОВ и др.
ном коре молекулы, которая может дестабили-
Д.С. Ямпольская и В.В. Нефёдова - получение
зировать структуру двойной спирали (coiled-
препаратов Tpm и постановка эксперимен-
coil). Кроме того, изоформы Tpm2.1 и Tpm4.1
тов; C.Ю. Клейменов - выполнение экспе-
очень похожи друг на друга по своим свой-
риментов методом ДСК; А.М. Матюшенко и
ствам. Единственным выявленным различием
Д.И. Левицкий - написание первоначального
является термостабильность их комплексов с
текста статьи. Все авторы принимали участие
F-актином, обусловленная, по-видимому, раз-
в обсуждении результатов исследования и ре-
личиями в силе концевых взаимодействий мо-
дактировании окончательной версии статьи.
лекул этих изоформ. Принимая во внимание,
Финансирование. Работа выполнена при
что функциональные свойства Тpm часто свя-
финансовой поддержке Российского научного
заны с устойчивостью структуры coiled-coil его
фонда (грант № 22-74-10106).
молекулы, можно предположить, что снижен-
Конфликт интересов. Авторы заявляют об
ная стабильность этих изоформ может иметь
отсутствии конфликта интересов.
функциональное значение.
Соблюдение этических норм. Настоящая
статья не содержит описания каких-либо ис-
Вклад авторов. А.М. Матюшенко - кон-
следований с участием людей или животных в
цепция и руководство работой; А.С. Логвинов, качестве объектов.
СПИСОК ЛИТЕРАТУРЫ
1.
Gunning, P., O’Neill, G., and Hardeman, E.
ends of actin filaments against polymerization
(2008) Tropomyosin-based regulation of the actin
and depolymerization, FEBS Lett., 260, 266-268,
cytoskeleton in time and space, Physiol. Rev., 88, 1-35,
doi: 10.1016/0014-5793(90)80119-4.
doi: 10.1152/physrev.00001.2007.
10.
Broschat, K. O. (1990) Tropomyosin prevents de-
2.
Nevzorov, I. A., and Levitsky, D. I. (2011) Tropo-
polymerization of actin filaments from the pointed
myosin: double helix from the protein world, Bio-
end, J. Biol. Chem., 265, 21323-21329, doi: 10.1016/
chemistry (Moscow),
76,
1507-1527, doi:
10.1134/
S0021-9258(17)45363-4.
S0006297911130098.
11.
Schevzov, G., Vrhovski, B., Bryce, N. S., Elmir, S.,
3.
Tardiff, J. C. (2010) Tropomyosin and dilated cardio-
Qiu, M. R., O’Neill, G. M., Yang, N., Verrills,
myopathy: revenge of the actinomyosin “gatekeeper”,
N. M., Kavallaris, M., and Gunning, P. W. (2005)
J. Am. Coll. Cardiol., 55, 330-332, doi: 10.1016/
Tissue-specific tropomyosin isoform composition,
j.jacc.2009.11.018.
J. Histochem. Cytochem., 53, 557-570, doi: 10.1369/
4.
Manstein, D. J., and Mulvihill, D. P. (2016) Tropo-
jhc.4A6505.2005.
myosin-mediated regulation of cytoplasmic myosins,
12.
Weinberger, R. P., Henke, R. C., Tolhurst, O., Jeffrey,
Traffic, 17, 872-877, doi: 10.1111/tra.12399.
P. L., and Gunning, P. (1993) Induction of neuron-
5.
Gunning, P. W., Hardeman, E. C., Lappalainen, P.,
specific tropomyosin mRNAs by nerve growth factor
and Mulvihill, D. P. (2015) Tropomyosin - master
is dependent on morphological differentiation, J. Cell
regulator of actin filament function in the cytoskeleton,
Biol., 120, 205-215, doi: 10.1083/jcb.120.1.205.
J. Cell Sci., 128, 2965-2974, doi: 10.1242/jcs.172502.
13.
Pelham, R. J. Jr., Lin, J. J., and Wang, Y. L. (1996)
6.
Khaitlina, S. Y. (2015) Tropomyosin as a regulator of
A high molecular mass non-muscle tropomyosin iso-
actin dynamics, Int. Rev. Cell. Mol. Biol., 318, 255-291,
form stimulates retrograde organelle transport, J. Cell
doi: 10.1016/bs.ircmb.2015.06.002.
Sci., 109 (Pt 5), 981-989, doi: 10.1242/jcs.109.5.981.
7.
Goldmann, W. H. (2000) Binding of tropomyosin-
14.
Thoms, J. A., Loch, H. M., Bamburg, J. R., Gunning,
troponin to actin increases filament bending stiffness,
P. W., and Weinberger, R. P. (2008) A tropomyosin 1
Biochem. Biophys. Res. Commun., 276, 1225-1228,
induced defect in cytokinesis can be rescued by
doi: 10.1006/bbrc.2000.3608.
elevated expression of cofilin, Cell Motil. Cytoskeleton,
8.
Nabiev, S. R., Ovsyannikov, D. A., Kopylova, G. V.,
65, 979-990, doi: 10.1002/cm.20320.
Shchepkin, D. V., Matyushenko, A. M., Koubassova,
15.
Caldwell, B. J., Lucas, C., Kee, A. J., Gaus, K.,
N. A., Levitsky, D. I., Tsaturyan, A. K., and
Gunning, P. W., Hardeman, E. C., Yap, A. S., and
Bershitsky, S. Y. (2015) Stabilizing the central part
Gomez, G. A. (2014) Tropomyosin isoforms support
of tropomyosin increases the bending stiffness of the
actomyosin biogenesis to generate contractile tension
thin filament, Biophys. J., 109, 373-379, doi: 10.1016/
at the epithelial zonula adherens, Cytoskeleton, 71,
j.bpj.2015.06.006.
663-676, doi: 10.1002/cm.21202.
9.
Weigt, C., Schoepper, B., and Wegner, A.
(1990)
16.
McMichael, B. K., and Lee, B. S. (2008) Tropo-
Tropomyosin-troponin complex stabilizes the pointed
myosin 4 regulates adhesion structures and resorptive
БИОХИМИЯ том 88 вып. 6 2023
СВОЙСТВА ИЗОФОРМ ТРОПОМИОЗИНА Tpm4.1 И Tpm2.1
993
capacity in osteoclasts, Exp. Cell Res., 314, 564-573,
29.
Nevzorov, I., Redwood, C., and Levitsky, D. I. (2008)
doi: 10.1016/j.yexcr.2007.10.018.
Stability of two beta-tropomyosin isoforms: effects
17.
Craig, R., and Lehman, W. (2001) Crossbridge and
of mutation Arg91Gly, J. Muscle Res. Cell Motil., 29,
tropomyosin positions observed in native, interacting
173-176, doi: 10.1007/s10974-009-9171-3.
thick and thin filaments, J. Mol. Biol., 311, 1027-1036,
30.
Gateva, G., Kremneva, E., Reindl, T., Kotila, T.,
doi: 10.1006/jmbi.2001.4897.
and Kogan, K. (2017) Tropomyosin isoforms specify
18.
Sweeney, H. L., and Hammers, D. W. (2018) Muscle
functionally distinct actin filament populations in vitro,
contraction, Cold Spring Harb. Perspect. Biol., 10,
Curr. Biol., 27, 705-713, doi: 10.1016/j.cub.2017.01.018.
a023200, doi: 10.1101/cshperspect.a023200.
31.
Coulton, A., Lehrer, S. S., and Geeves, M. A. (2006)
19.
Fath, T. (2013) Tropomodulins and tropomyosins -
Functional homodimers and heterodimers of recom-
organizers of cellular microcompartments, Biomol.
binant smooth muscle tropomyosin, Biochemistry, 45,
Concepts, 4, 89-101, doi: 10.1515/bmc-2012-0037.
12853-12858, doi: 10.1021/bi0613224.
20.
Gray, K. T., Kostyukova, A. S., and Fath, T. (2017)
32.
Janco, M., Bonello, T. T., Byun, A., Coster, A. C. F.,
Actin regulation by tropomodulin and tropomyosin
Lebhar, H., Dedova, I., Gunning, P. W., and
in neuronal morphogenesis and function, Mol. Cell.
Böcking, T. (2016) The impact of tropomyosins on actin
Neurosci., 84, 48-57, doi: 10.1016/j.mcn.2017.04.002.
filament assembly is isoform specific, Bioarchitecture,
21.
Hardeman, E. C., Bryce, N. S., and Gunning, P. W.
6, 61-75, doi: 10.1080/19490992.2016.1201619.
(2020) Impact of the actin cytoskeleton on cell
33.
Jeong, S., Lim, S., Schevzov, G., Gunning, P. W.,
development and function mediated via tropomyosin
and Helfman, D. M. (2017) Loss of Tpm4.1 leads
isoforms, Semin. Cell Dev. Biol.,
102,
122-131,
to disruption of cell-cell adhesions and invasive
doi: 10.1016/j.semcdb.2019.10.004.
behavior in breast epithelial cells via increased Rac1
22.
Geeves, M. A., Hitchcock-DeGregori, S. E., and
signaling, Oncotarget, 8, 33544-33559, doi: 10.18632/
Gunning, P. W. (2015) A systematic nomenclature for
oncotarget.16825.
mammalian tropomyosin isoforms, J. Muscle Res. Cell
34.
Monteiro, P. B., Lataro, R. C., Ferro, J. A., and
Motil., 36, 147-153, doi: 10.1007/s10974-014-9389-6.
Reinach, F.-C.
(1994) Functional α-tropomyosin
23.
Tojkander, S., Gateva, G., Schevzov, G., Hotulainen, P.,
produced in Escherichia coli. A dipeptide extension
Naumanen, P., Martin, C., Gunning, P. W., and
can substitute the amino-terminal acetyl group,
Lappalainen, P.
(2011) A molecular pathway for
J. Biol. Chem.,
269,
10461-10466, doi:
10.1016/
myosin II recruitment to stress fibers, Curr. Biol., 21,
S0021-9258(17)34082-6.
539-550, doi: 10.1016/j.cub.2011.03.007.
35.
Matyushenko, A. M., Artemova, N. V., Shchepkin,
24.
Sanders, C., Burtnick, L. D., and Smillie, L. B. (1986)
D. V., Kopylova, G. V., Bershitsky, S. Y., Tsaturyan,
Native chicken gizzard tropomyosin is predominantly
A. K., Sluchanko, N. N., and Levitsky, D. I. (2014)
a beta gamma-heterodimer, J. Biol. Chem.,
261,
Structural and functional effects of two stabilizing
12774-12778, doi: 10.1016/S0021-9258(18)67160-1.
substitutions, D137L and G126R, in the middle part
25.
Wolfenson, H., Meacci, G., Liu, S., Stachowiak,
of α-tropomyosin molecule, FEBS J., 281, 2004-2016,
M. R., Iskratsch, T., Ghassemi, S., Roca-Cusachs, P.,
doi: 10.1111/febs.12756.
O’Shaughnessy, B., Hone, J., and Sheetz, M. P. (2016)
36.
Spudich, J. A., and Watt, S. (1971) The regulation
Tropomyosin controls sarcomere-like contractions
of rabbit skeletal muscle contraction. I. Biochemical
for rigidity sensing and suppressing growth on soft
studies of the interaction of the tropomyosin-troponin
matrices, Nat. Cell. Biol., 18, 33-42, doi: 10.1038/
complex with actin and the proteolytic fragments of
ncb3277.
myosin, J. Biol. Chem., 246, 4866-4871, doi: 10.1016/
26.
Boyd, J., Risinger, J. I., Wiseman, R. W., Merrick,
S0021-9258(18)62016-2.
B. A., Selkirk, J. K., and Barrett, J. C.
(1995)
37.
Matyushenko, A. M., Kleymenov, S. Y., Susorov,
Regulation of microfilament organization and
D. S., and Levitsky, D. I. (2018) Thermal unfolding
anchorage-independent growth by tropomyosin
1,
of homodimers and heterodimers of different skeletal-
Proc. Natl. Acad. Sci. USA,
92,
11534-11538,
muscle isoforms of tropomyosin, Biophys. Chem., 243,
doi: 10.1073/pnas.92.25.11534.
1-7, doi: 10.1016/j.bpc.2018.09.002.
27.
Stehn, J. R., Schevzov, G., O’Neill, G. M., and
38.
Nefedova, V. V., Marchenko, M. A., Kleymenov, S. Y.,
Gunning, P. W. (2006) Specialisation of the tropo-
Datskevich, P. N., Levitsky, D. I., and Matyushenko,
myosin composition of actin filaments provides new
A. M. (2019) Thermal unfolding of various human
potential targets for chemotherapy, Curr. Cancer Drug
non-muscle isoforms of tropomyosin, Biochem.
Targets, 6, 245-256, doi: 10.2174/156800906776842948.
Biophys. Res. Commun., 514, 613-617, doi: 10.1016/
28.
Mahadev, K., Raval, G. S., Bharadwaj, S.,
j.bbrc.2019.05.008.
Willingham, M. C., and Lange, E. M.
(2002)
39.
Marchenko, M., Nefedova, V., Artemova, N.,
Suppression of the transformed phenotype of breast
Kleymenov, S., Levitsky, D., and Matyushenko, A.
cancer by tropomyosin-1, Exp. Cell Res., 279, 40-51,
(2021) Structural and functional peculiarities of
doi: 10.1006/excr.2002.5583.
cytoplasmic tropomyosin isoforms, the products of
БИОХИМИЯ том 88 вып. 6 2023
994
ЛОГВИНОВ и др.
TPM1 and TPM4 genes, Int. J. Mol. Sci., 22, 5141,
42. Lees-Miller, J. P., and Helfman, D. M.
(1991)
doi: 10.3390/ijms22105141.
The molecular basis for tropomyosin isoform diversity,
40. Marchenko, M. A., Nefedova, V. V., Yampolskaya,
Bioessays, 13, 429-437, doi: 10.1002/bies.950130902.
D. S., Borzova, V. A., Kleymenov, S. Y., Nabiev, S. R.,
43. Matyushenko, A. M., Artemova, N. V., Sluchanko,
Nikitina, L. V., Matyushenko, A. M., and Levitsky,
N. N., and Levitsky, D. I. (2015) Effects of two
D. I. (2021) Comparative structural and functional
stabilizing substitutions, D137L and G126R, in
studies of low molecular weight tropomyosin isoforms,
the middle part of α-tropomyosin on the domain
the TPM3 gene products, Arch. Biochem. Biophys.,
structure of its molecule, Biophys. Chem., 196, 77-85,
710, 108999, doi: 10.1016/j.abb.2021.108999.
doi: 10.1016/j.bpc.2014.10.001.
41. Matyushenko, A. M., Shchepkin, D. V., Kopylova,
44. Arndt, K. M., Pelletier, J. N., Müller, K. M.,
G. V., Bershitsky, S. Y., and Levitsky, D. I. (2020)
Plückthun, A., and Alber, T. (2002) Comparison of
Unique functional properties of slow skeletal muscle
in vivo selection and rational design of heterodimeric
tropomyosin, Biochimie,
174,
1-8, doi:
10.1016/
coiled coils, Structure, 10, 1235-1248, doi: 10.1016/
j.biochi.2020.03.013.
s0969-2126(02)00838-9.
STRUCTURAL AND FUNCTIONAL STUDIES
OF TROPOMYOSIN ISOFORMS Tpm4.1 AND Tpm2.1
A. S. Logvinov1,2, V. V. Nefedova1, D. S. Yampolskaya1, S. Y. Kleymenov1,3,
D. I. Levitsky1, and A. M. Matyushenko1*
1 Research Centre of Biotechnology of the Russian Academy of Sciences,
119071 Moscow, Russia; e-mail: ammatyushenko@mail.ru
2 Faculty of Biology, Lomonosov Moscow State University, 119991 Moscow, Russia
3 Koltzov Institute of Developmental Biology, Russian Academy of Sciences, 119334 Moscow, Russia
Tropomyosin (Tpm) is one of the most important partners of the actin filament, largely determining its
properties. In animal organisms, there are different isoforms of Tpm, which are believed to be involved in
the regulation of various cellular functions. However, the molecular mechanisms of regulation of the func-
tions of actin filaments by various cytoplasmic isoforms of Tpm are still poorly understood. In our work,
we used various methods to study the properties of Tpm2.1 and Tpm4.1 isoforms and compared them both
with each other and with the properties of Tpm isoforms that had already been subjected to more detailed
study earlier. The isoforms Tpm2.1 and Tpm4.1 almost did not differ from each other in their affinity for
F-actin, in the thermal stability of their molecules and in their resistance to limited proteolysis by trypsin,
but they differed markedly in viscosity of their solutions and in the thermal stability of their complexes with
F-actin. The main difference of Tpm2.1 and Tpm4.1 from other previously studied Tpm isoforms (such,
for example, as Tpm1.6 and Tpm1.7) is their extremely low thermal stability measured by CD and DSC
methods. The possible causes of this instability are considered in detail when comparing the amino acid
sequences of Tpm4.1 and Tpm2.1 with the sequences of isoforms Tpm1.6 and Tpm1.7, which did not differ
from Tpm4.1 and Tpm2.1, respectively, by the exon structure of their genes.
Keywords: tropomyosin isoforms; coiled-coil stability, actin-associated proteins, actin filaments, differential scanning
calorimetry
БИОХИМИЯ том 88 вып. 6 2023