БИОХИМИЯ, 2023, том 88, вып. 6, с. 995 - 1010
УДК 576.32/.36
ФИТОГОРМОНЫ ОКАЗЫВАЮТ ВЛИЯНИЕ
НА ДИФФЕРЕНЦИРОВОЧНЫЙ СТАТУС ДЕРМАЛЬНЫХ
ФИБРОБЛАСТОВ ЧЕЛОВЕКА ПУТЁМ АКТИВАЦИИ UPR
© 2023 Е.П. Турищева1*, М.С. Вильданова1, П.А. Вишнякова2,3, Д.К. Матвеева4,
А.А. Саидова1, Г.Е. Онищенко1, Е.А. Смирнова1
1 Московский государственный университет имени М.В. Ломоносова, биологический факультет,
119991 Москва, Россия; электронная почта: kitten-caterina@yandex.ru
2 Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии
имени академика В.И. Кулакова Министерства здравоохранения РФ, 117997 Москва, Россия
3 Российский университет дружбы народов, 117198 Москва, Россия
4 ГНЦ РФ Институт медико-биологических проблем РАН, 123007 Москва, Россия
Поступила в редакцию 17.03.2023
После доработки 28.04.2023
Принята к публикации 02.05.2023
Нормализация секреторной активности и уровня дифференцировки клеток мезенхимного проис-
хождения, в том числе фибробластов, является одной из важных биомедицинских проблем. Одним
из решений этой проблемы является воздействие на сигнальный каскад «ответ на неправильно
свёрнутые белки» (UPR), который активируется при дифференцировке фибробластов. В настоя-
щем исследовании было изучено влияние фитогормонов на секреторную активность и диффе-
ренцировку культивируемых дермальных фибробластов человека. С помощью анализа уровня
экспрессии генов, кодирующих маркеры UPR, в этих клетках мы установили, что фитогормон
абсцизовая кислота (АБК) повышала экспрессию генов GRP78 и ATF4, а фитогормон гибберелли-
новая кислота (ГК) повышала экспрессию CHOP. Оценка секреторно-синтетической активности
фибробластов показала, что АБК увеличивала уровень секреции и синтеза проколлагена I и уро-
вень синтеза фибронектина, а также общую продукцию коллагеновых и неколлагеновых белков
внеклеточного матрикса дермальными фибробластами. Кроме того, АБК стимулировала синтез
маркера миофибробластов гладкомышечного актина α (α-SMA) и повышала количество миофибро-
бластов в клеточной популяции. Напротив, ГК увеличивала уровень секреции фибронектина,
но снижала уровень синтеза проколлагена I, а также общей продукции коллагеновых белков вне-
клеточного матрикса. Кроме того, при действии ГК снижался уровень синтеза α-SMA и количество
миофибробластов в клеточной популяции. Наши результаты дают основания полагать, что фито-
гормоны являются модуляторами секреторно-синтетической активности фибробластов и оказы-
вают влияние на их дифференцировочный статус.
КЛЮЧЕВЫЕ СЛОВА: абсцизовая кислота, гиббереллиновая кислота, фибробласты, миофибробласты,
заживление ран, фиброз, дифференцировка, гладкомышечный актин.
DOI: 10.31857/S032097252306009X, EDN: EFPTLN
ВВЕДЕНИЕ
нормального функционирования органов
и
тканей. Нарушение регуляции секреторно-син-
Поддержание на оптимальном уровне се-
тетической активности, вызванное изменени-
креторно-синтетических процессов у разных
ем дифференцировочного статуса клеток или
типов дифференцированных клеток важно для изменением количества дифференцированных
Принятые сокращения: АБК - абсцизовая кислота; ГК - гиббереллиновая кислота; ЭПР - эндоплазматический
ретикулум; ATF4 - активирующий фактор транскрипции 4 (activating transcription factor 4); CHOP - CCAAT/белок, гомо-
логичный энхансер-связывающему белку (CCAAT/enhancer-binding protein homologous protein); GRP78 - белок 78 кДа,
регулируемый глюкозой (glucose-regulated protein 78); IRE1 - требующий инозитол белок 1 (inositol-requiring protein 1);
PERK - киназа ЭПР, подобная белковой киназе RNA (protein kinase RNA-like endoplasmic reticulum kinase); sXBP1 -
сплайсированный X-box-связывающий белок 1 (spliced X-box-binding protein 1); UPR - ответ на неправильно свёрнутые
белки (unfolded protein response); α-SMA - гладкомышечный актин α (α-smooth muscle actin).
* Адресат для корреспонденции.
995
996
ТУРИЩЕВА и др.
клеток, ведёт к развитию широкого спектра
что АБК в микромолярных концентрациях
патологических состояний, в том числе фиб-
нормализует аномально повышенную секре-
розу, снижению регенеративного потенциа-
торную активность, вызывая снижение отло-
ла, диабету II-го типа, остеопорозу и многим
жения коллагена у фибробластов, полученных
другим. Так, например, избыточная диффе-
от больных системным склерозом [27]. Соглас-
ренцировка фибробластов в миофибробласты
но данным этих же авторов, АБК не влияет на
вызывает фиброз, сопровождающийся повы-
секреторную активность фибробластов, полу-
шенной продукцией внеклеточного матрикса,
ченных от здоровых доноров. Однако низкие
а недостаточная активность миофибробластов
концентрации и короткая продолжительность
и/или их недостаточное количество приводит
воздействия (24 ч) не позволяют сделать одно-
к подавлению регенеративных процессов [1-6].
значные выводы о характере влияния АБК на
Дедифференцировка β-клеток островков Лан-
данный тип клеток, так как анализ изменения
герганса, секретирующих инсулин, является
секреторной активности фибробластов обыч-
одной из причин, вызывающих диабет II-го
но проводится через 48 и более часов инку-
типа
[7-9], а снижение активности остео-
бации с исследуемыми агентами [2, 13, 28].
бластов в менопаузе ведёт к остеопорозу [10].
Кроме этого, авторы исследования не опре-
Следует отметить, что для дифференцировки
деляли изменение содержания в популяции
многих клеток с высокой секреторной ак-
миофибробластов, для которых характерна
тивностью, в том числе фибробластов, пред-
повышенная секреторно-синтетическая ак-
шественников β-клеток и преостеобластов,
тивность [1, 16]. Поэтому мы полагаем, что
необходима активация сигнального каскада,
влияние АБК на секреторную активность и
носящего название
«ответ на неправильно
дифференцировочный статус фибробластов
свёрнутые белки» или UPR [2, 11-18]. При
требует более глубокого изучения.
этом до настоящего времени неизвестно, яв-
Таким образом, есть основания полагать,
ляется ли активация UPR индуктором диффе-
что фитогормоны влияют на секреторно-син-
ренцировки клеток или же UPR запускается
тетическую систему и дифференцировочный
из-за повышенного синтеза секреторных бел-
статус некоторых типов культивируемых кле-
ков в процессе дифференцировки [18]. Нор-
ток, в том числе соединительнотканного про-
мализация секреторной активности и уров-
исхождения (фибробластов, мезенхимных стро-
ня дифференцировки клеток, в частности за
мальных клеток), но существующие данные
счёт воздействия на молекулярные компонен-
носят фрагментарный характер и нуждаются
ты UPR, является одной из задач терапии мно-
в верификации. В связи с этим целью нашего
гих патологий [1, 7, 9, 12, 13, 18].
исследования было изучить влияние АБК и ГК
Биологически активные молекулы, обна-
на секреторно-синтетическую активность и
руженные в различных видах растений, давно
признаки дифференцировки культивируемых
являются объектом пристального внимания в
дермальных фибробластов человека.
биологии и медицине и широко используются
для создания на их основе новых медицинских
препаратов [19-22]. Среди них определённый
МАТЕРИАЛЫ И МЕТОДЫ
интерес представляют фитогормоны - сиг-
нальные молекулы, регулирующие рост и диф-
Культивирование дермальных фибробластов
ференцировку растений. Известно, что эти
человека. Дермальные фибробласты человека
соединения могут оказывать влияние на секре-
(линия HdFb (d75)), полученные из Уникаль-
торно-синтетическую активность и дифферен-
ной научной установки «Коллекция клеточ-
цировочный статус некоторых культивируемых
ных культур» Института биологии развития
клеток животных, в том числе и человека. Так,
им. Н.К. Кольцова РАН, культивировали в сре-
например, фитогормон гиббереллиновая кис-
де DMEM/F12 («ПанЭко», Россия), содержа-
лота (ГК) повышает содержание α-амилазы в
щей 10% фетальной сыворотки телёнка (FBS;
мезенхимных стромальных клетках [23] и ак-
«HyClone», США), 2 мМ L-глутамина («Пан-
тивирует UPR и дифференцировку в культи-
Эко») и коммерческую смесь антибиотиков
вируемых нормальных и опухолевых клетках
пенициллина и стрептомицина (5 мл смеси на
эпидермоидного происхождения [24]. Другой
450 мл среды) («ПанЭко») в стандартных усло-
фитогормон, абсцизовая кислота (АБК), сти-
виях (37 °С, 5% CO2). Согласно паспорту кле-
мулирует секрецию инсулина β-клетками ост-
точной линии HdFb (d75), использованной
ровков Лангерганса и секрецию гастроинте-
в настоящем исследовании, время удвоения
стинального гормона энтероэндокринными
популяции составляло 24 ч. Клетки пассиро-
клетками [25, 26]. Кроме того, было показано,
вали смесью растворов трипсина («ПанЭко»)
БИОХИМИЯ том 88 вып. 6 2023
ФИТОГОРМОНЫ И ДИФФЕРЕНЦИРОВОЧНЫЙ СТАТУС ФИБРОБЛАСТОВ
997
и Версена («ПанЭко») в соотношении 3/7.
температуре. Для выявления белков использо-
При проведении экспериментов клетки
вали Novex™ ECL Chemiluminescent Substrate
5-8 пассажей высаживали в чашки Петри (d =
Reagent Kit («Thermo Fisher Scientific», США)
= 60 мм) и 24-луночные планшеты в концен-
и систему визуализации ChemiDoc™
(«Bio-
трации 50 000 клеток/мл или в чашки Петри
Rad»). Оптическую плотность белковых по-
(d = 35 мм) с покровными стёклами в концен-
лос определяли с помощью ImageLab Software
трации 40 000 клеток/мл и культивировали в
(«Bio-Rad»). Полученные значения для целе-
течение 24 ч. Затем в культуральную среду до-
вых белков нормировали на GAPDH.
бавляли стоковые спиртовые растворы АБК
Колориметрический полуколичественный ана-
(189 мМ) и ГК (500 мМ) («Merck», США) до
лиз общей продукции коллагеновых и неколла-
конечной концентрации 2 мМ. Время культи-
геновых белков внеклеточного матрикса. Дер-
вирования с фитогормонами составляло 24 ч,
мальные фибробласты высаживали в 24-лу-
48 ч или 7 суток. Клетки достигали конфлюэнт-
ночные планшеты («Corning», США) и после
ного монослоя через 5-6 суток после посадки.
добавления фитогормонов культивировали в
Для контрольных точек вместо фитогормонов
течение 7 суток. Следует отметить, что схемы
в культуральную среду добавляли соответствую-
экспериментов с длительным (8 суток и более)
щий объём 96%-ного этилового спирта.
культивированием клеток, продуцирующих вне-
Иммуноферментный анализ. Анализ уров-
клеточный матрикс, являются общеприняты-
ня секреции проколлагена I и фибронектина
ми [29-33]. Далее клетки промывали тёплым
проводили с помощью коммерческих набо-
PBS (pH 7,2-7,4) («ПанЭко»), фиксировали
ров Human Pro-Collagen I alpha 1 SimpleStep
насыщенным раствором пикриновой кислоты
ELISA® Kit
(«Abcam», Великобритания) и
(«Merck») в течение 30 мин, промывали дистил-
Human Fibronectin SimpleStep ELISA® Kit
лированной водой и окрашивали 0,1%-ным
(«Abcam») соответственно, согласно прото-
Sirius Red F3BA («Merck») или 0,1%-ным Fast
колам, приложенным к наборам. Оптическую
Green FCF («Merck») в течение 30 мин при
плотность измеряли с помощью анализа-
комнатной температуре на ротационном шей-
тора иммуноферментных реакций Униплан
кере для выявления коллагеновых и неколла-
(«Пикон», Россия) при длине волны 450 нм.
геновых белков соответственно. Для приготов-
Вестерн-блоттинг. Клетки лизировали в од-
ления 0,1%-ных растворов красителей сухие
нократном лизирующем буфере, содержащем
Sirius Red и Fast Green растворяли в насы-
150 мМ NaCl («ПанЭко»), 0,1% Triton X-100,
щенной пикриновой кислоте. В качестве кон-
0,5% дезоксихолат натрия, 0,1% додецилсуль-
троля использовали раствор насыщенной пи-
фат натрия, 50 мМ Tris-HCl (pH 8,0) и кок-
криновой кислоты, не содержащий красите-
тейль ингибиторов протеаз (все составляю-
лей. После окрашивания клетки промывали
щие - «Merck»). Затем в лизат добавляли бу-
дистиллированной водой и фотографирова-
фер Лэммли («Bio-Rad», США), содержащий
ли на инвертированном микроскопе Eclipse
β-меркаптоэтанол («Merck»), инкубировали ли-
Ti-U
(«Nikon», Япония; объектив
- Nikon
зат при 65 °С в течение 5 мин и дополнительно
Plan Fluor 10×/0.30). Затем красители, свя-
денатурировали в течение 2 мин при -20 °С.
завшиеся с белками внеклеточного матрикса,
Белки разделяли с помощью вертикального
растворяли в смеси 0,1% NaOH и ледяного
электрофореза, используя 8%-ные или 10%-ные
абсолютного метанола (1/1). Оптическую плот-
полиакриламидные гели. Полусухой перенос
ность полученного элюата анализировали с
белков на ПВДФ-мембрану («Bio-Rad») осу-
помощью микропланшетного ридера Micro-
ществляли с помощью Trans-Blot® Turbo™
plate Reader PR2100 («Bio-Rad») при 550 нм
RTA Mini LF PVDF TransferKit («Bio-Rad Lab-
(Sirius Red) и 620 нм (Fast Green). Для нор-
oratories», США). Затем ПВДФ-мембрану ин-
мирования полученных значений оптиче-
кубировали в 5%-ном обезжиренном молоке,
ской плотности на количество клеток про-
разведённом Tris-буфером (TBS; «Bio-Rad»),
водили окрашивание 0,5%-ным Crystal Violet
содержащем 0,1% Tween («Bio-Rad»), в тече-
(«Merck»), разведённом на абсолютном мета-
ние 30 мин при комнатной температуре. Далее
ноле, в течение 15 мин при комнатной темпе-
мембрану инкубировали с первичными анти-
ратуре. Затем краситель отмывали дистилли-
телами к GAPDH (глицеральдегид-3-фосфат-
рованной водой, и клетки фотографировали
дегидрогеназа), проколлагену I, фибронектину
на микроскопе Eclipse Ti-U. Далее связавший-
и α-SMA (гладкомышечный актин α) («Abcam»)
ся краситель растворяли в 96%-ном этаноле,
в течение ночи при +4 °С и затем со вторичны-
и оптическую плотность полученного элюата
ми антителами, конъюгированными с перок-
анализировали с помощью микропланшетного
сидазой хрена («Bio-Rad»), 1 ч при комнатной
ридера Microplate Reader PR2100 при 550 нм.
БИОХИМИЯ том 88 вып. 6 2023
998
ТУРИЩЕВА и др.
Последовательности праймеров, использованных в работе
Последовательность праймеров (5′→3′)
Название праймера
прямой
обратный
GRP78
TCTGCTTGATGTGTGTCCTCTT
GTCGTTCACCTTCGTAGACCT
ATF4
TGGCTGGCTGTGGATGG
TCCCGGAGAAGGCATCCT
CHOP
AGTCTAAGGCACTGAGCGTATC
TCTGTTTCCGTTTCCTGGTT
sXBP1
GCTGAGTCCGCAGCAGGT
CAGGGTCCAACTTGAACAGAAT
HPRT
TGACACTGGCAAAACAATGCA
GGTCCTTTTCACCAGCAAGCT
GAPDH
TGCACCACAACTGCTTAGC
GGCATGGACTGTGGTCATGAG
YWHAZ
ACTTTTGGTACATTGTGGCTTCAA
CCGCCAGGACAAACCAGTAT
Иммуноцитохимический анализ. Клетки
достоверности различий между контрольными
фиксировали 4%-ным раствором параформ-
и экспериментальными значениями использо-
альдегида («MP Biochemical», Франция), раз-
вали непараметрический двусторонний U-кри-
ведённым в PBS, и пермеабилизировали с
терий Манна-Уитни. Различия считали стати-
помощью 0,5%-ного раствора Triton X-100
стически значимыми при p < 0,05.
(«Serva», Германия). Для выявления α-SMA
использовали первичные мышиные монокло-
нальные антитела к α-SMA («Merck») и вто-
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
ричные моноклональные антитела козы к IgG
мыши, конъюгированные с Alexa Fluor 488
Анализ уровня экспрессии генов, кодирую-
(«Thermo Fisher Scientific»). Ядра визуализиро-
щих маркеры UPR. С помощью ПЦР мы про-
вали с помощью DAPI (4′,6-диамидино-2-фе-
вели оценку уровня экспрессии маркеров
нилиндол) («Merck»); препараты заключали в
UPR - GRP78 (белок 78 кДа, регулируемый
Mowiol («Hoechst», Германия). Съёмку препа-
глюкозой), ATF4 (активирующий фактор тран-
ратов проводили с помощью инвертированно-
скрипции 4), sXBP1 (сплайсированный X-box-
го флуоресцентного микроскопа Axiovert 200M
связывающий белок 1) и CHOP (CCAAT/белок,
(«Carl Zeiss», Германия; объектив - 63× PlanApo
гомологичный энхансер-связывающему белку) -
NA 1.40 Oil), снабжённого чёрно-белой цифро-
после воздействия 2 мМ АБК и ГК в течение
вой камерой Zeiss Axiocam 202 mono («Carl
24 ч (рис. 1). Срок инкубации с фитогормо-
Zeiss») и программным обеспечением Zeiss
нами и их концентрации были выбраны на
ZEN 3.3 (blue edition) («Microscope Software»,
основе полученных нами ранее данных об ак-
Германия). Полученные изображения анали-
тивации UPR через 24 ч воздействия 2 мМ ГК
зировали с помощью программы Fiji (National
в нормальных и опухолевых клетках эпидер-
Institutes of Health, США).
моидного происхождения и данных об из-
Количественная ПЦР в реальном времени.
менении морфо-функционального состояния
ПЦР проводили по описанной ранее схеме [24],
секреторно-синтетической системы дермаль-
используя праймеры («Синтол», Россия) к ге-
ных фибробластов через
24 ч воздействия
нам GRP78, ATF4, CHOP; к сплайсированной
2 мМ АБК и ГК [24, 35]. Оказалось, что при
форме мРНК XBP1 (sXBP1), HPRT, а также к
действии АБК в дермальных фибробластах по-
GAPDH и YWHAZ. Последовательности исполь-
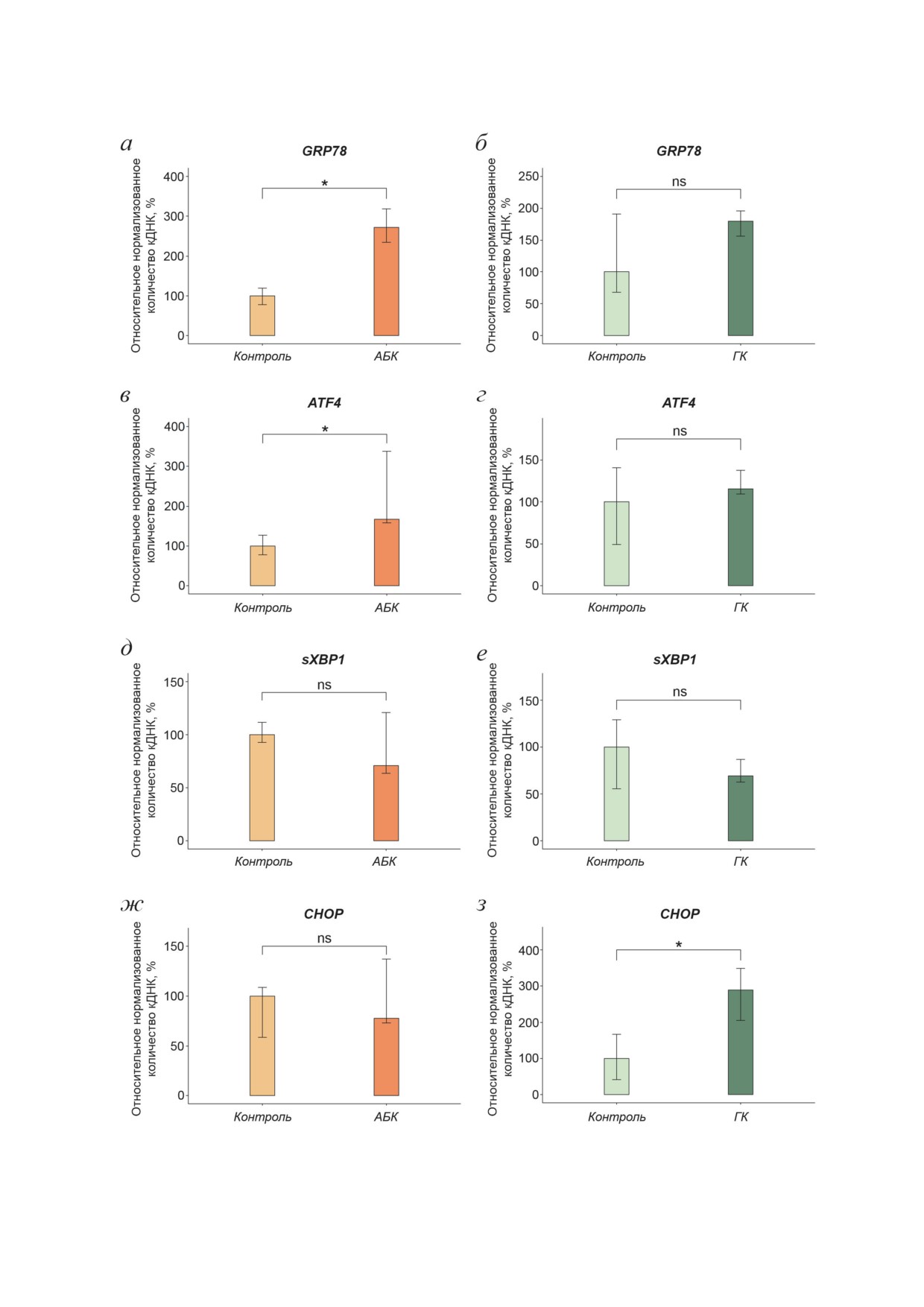
вышалась экспрессия генов GRP78 и ATF4 в 2,7
зуемых праймеров указаны в таблице. HPRT,
и 1,7 раза соответственно (рис. 1, а и в). При
GAPDH и YWHAZ использовали в качестве ре-
этом АБК не оказывала значимого влияния на
ференсных генов. ПЦР для каждого образ-
количество sXBP1 и уровень экспрессии CHOP
ца проводили в трёх технических повторах.
(рис. 1, д и ж). Напротив, ГК оказывала влия-
Результаты ПЦР анализировали по методике
ние на уровень экспрессии только CHOP, по-
Vandesompele et al. [34].
вышая его в 2,9 раза (рис. 1, б, г, е и з). Таким
Статистический анализ проводили в про-
образом, АБК и ГК активировали экспрессию
грамме RStudio 1.4.1717 (R 4.1.1). Для проверки
генов, кодирующих маркеры UPR в дермаль-
БИОХИМИЯ том 88 вып. 6 2023
ФИТОГОРМОНЫ И ДИФФЕРЕНЦИРОВОЧНЫЙ СТАТУС ФИБРОБЛАСТОВ
999
ных фибробластах, при этом паттерны их ак-
Оценка общей продукции коллагеновых и
тивации у АБК и ГК различались.
неколлагеновых белков внеклеточного матрикса.
Оценка уровня секреции проколлагена I и
Во внеклеточном матриксе, формируемом
фибронектина. В соединительной ткани наи-
фибробластами, проколлаген I и фибронек-
более распространёнными компонентами вне-
тин являются преобладающими коллагено-
клеточного матрикса, синтезируемыми фибро-
выми и неколлагеновыми белками соответ-
бластами, являются проколлаген I и фибро-
ственно [37]. Для оценки влияния АБК и ГК
нектин [36, 37]. В связи с этим с помощью ИФА
на общую продукцию коллагеновых и некол-
мы провели оценку уровня секреции прокол-
лагеновых белков внеклеточного матрикса
лагена I и фибронектина дермальными фибро-
дермальными фибробластами был проведён
бластами после воздействия фитогормонов.
полуколичественный анализ (рис. 4). Срок ин-
Мы предположили, что изменение секретор-
кубации с фитогормонами в данном экспери-
ной активности клеток может происходить
менте составлял 7 суток, что позволило детек-
позже, чем активация UPR, поэтому проана-
тировать перицеллюлярное накопление анали-
лизировали уровень секреции проколлагена I
зируемых белков, а также их внутриклеточные
и фибронектина через 24 и 48 ч культивиро-
формы. Коллагеновые и неколлагеновые бел-
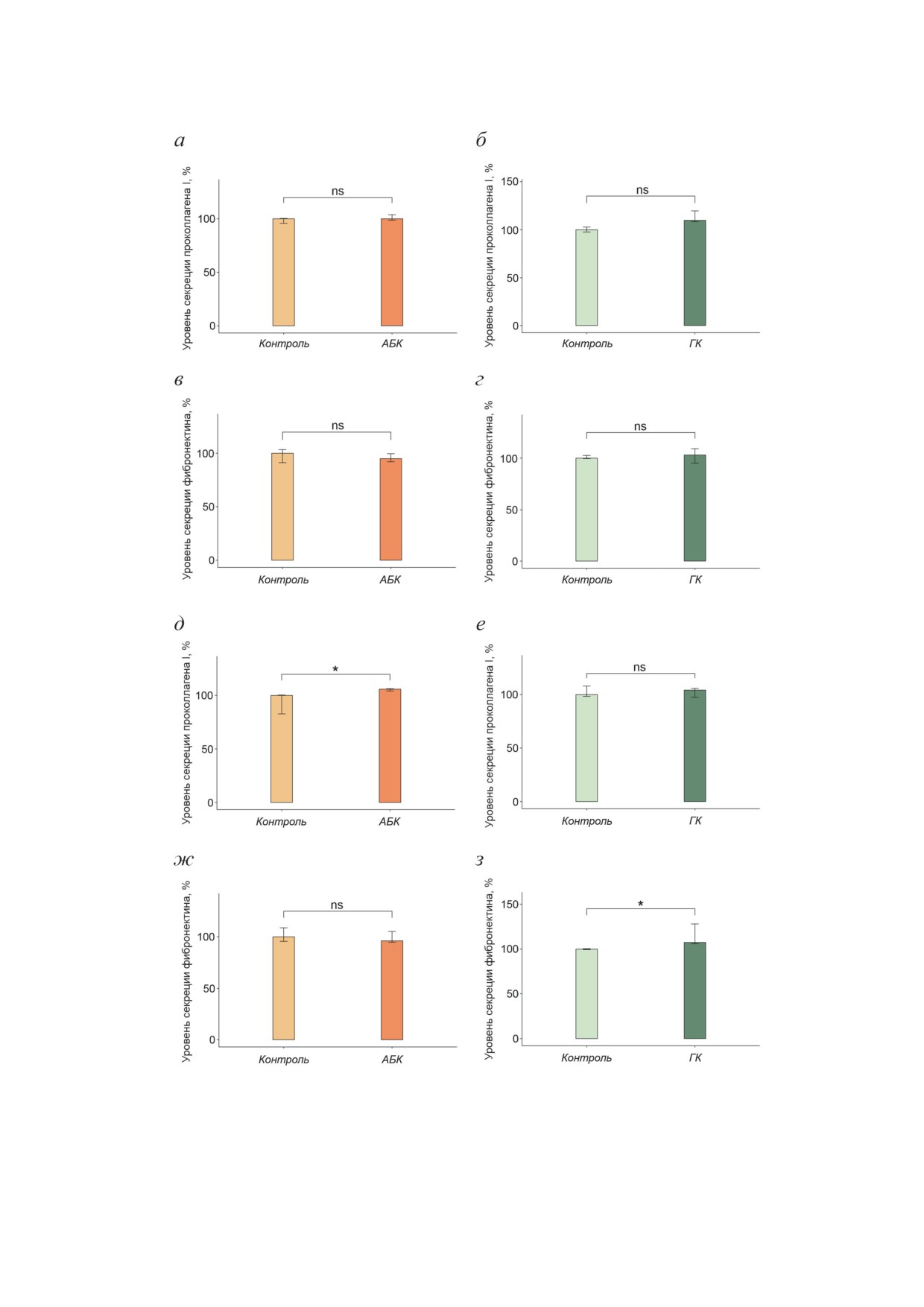
вания фибробластов с АБК и ГК (рис. 2). Как
ки матрикса выявлялись с помощью гисто-
видно из рис. 2 (а-г), АБК и ГК не вызывали
логических красителей Sirius Red и Fast Green
изменений в уровне секреции проколлагена I и
соответственно. Красители, связавшиеся с кол-
фибронектина через 24 ч воздействия. Однако
лагеновыми и неколлагеновыми белками вне-
культивирование с АБК в течение 48 ч приво-
клеточного матрикса, элюировали, и затем ана-
дило к повышению уровня секреции проколла-
лизировали оптическую плотность образцов.
гена I на 6,1% (рис. 2, д) и не влияло на уровень
Для нормирования полученных значений на
секреции фибронектина (рис. 2, ж). Культи-
количество клеток использовали окрашивание
вирование с ГК в течение 48 ч приводило к
гистологическим красителем Crystal Violet, оп-
повышению уровня секреции фибронектина
тическая плотность элюата которого пропор-
на 7,2% (рис. 2, з) и не влияло на уровень секре-
циональна количеству клеток [38].
ции проколлагена I (рис. 2, е). Таким образом,
После культивирования фибробластов с АБК
АБК и ГК оказывали влияние на секреторную
общее содержание коллагеновых белков внекле-
активность дермальных фибробластов, причём
точного матрикса возрастало на 17,4%, а со-
АБК стимулировала секрецию проколлагена I,
держание неколлагеновых белков возрастало
а ГК стимулировала секрецию фибронектина.
на 29,5% (рис. 4, а и б). После культивирова-
В связи с тем, что воздействие АБК и ГК
ния фибробластов с ГК содержание коллаге-
на секреторную активность фибробластов про-
новых белков внеклеточного матрикса, на-
являлось через 48 ч, этот срок был выбран для
оборот, снижалось на 21,0% (рис. 4, в). Содер-
дальнейшей оценки влияния фитогормонов на
жание неколлагеновых белков также снижа-
дермальные фибробласты.
лось, но изменение было статистически недо-
Оценка уровня синтеза проколлагена I и
стоверным (рис. 4, г). Полученные данные
фибронектина. Повышение уровня секреции
свидетельствуют о том, что общая продукция
проколлагена I и фибронектина может свиде-
коллагеновых и неколлагеновых белков вне-
тельствовать о повышении уровня синтеза этих
клеточного матрикса дермальными фибробла-
белков. Поэтому с помощью вестерн-блоттин-
стами при действии АБК повышалась, а при
га мы провели оценку уровня синтеза прокол-
действии ГК - снижалась, но статистически
лагена I и фибронектина после 48 ч инкубации
достоверные данные были получены только
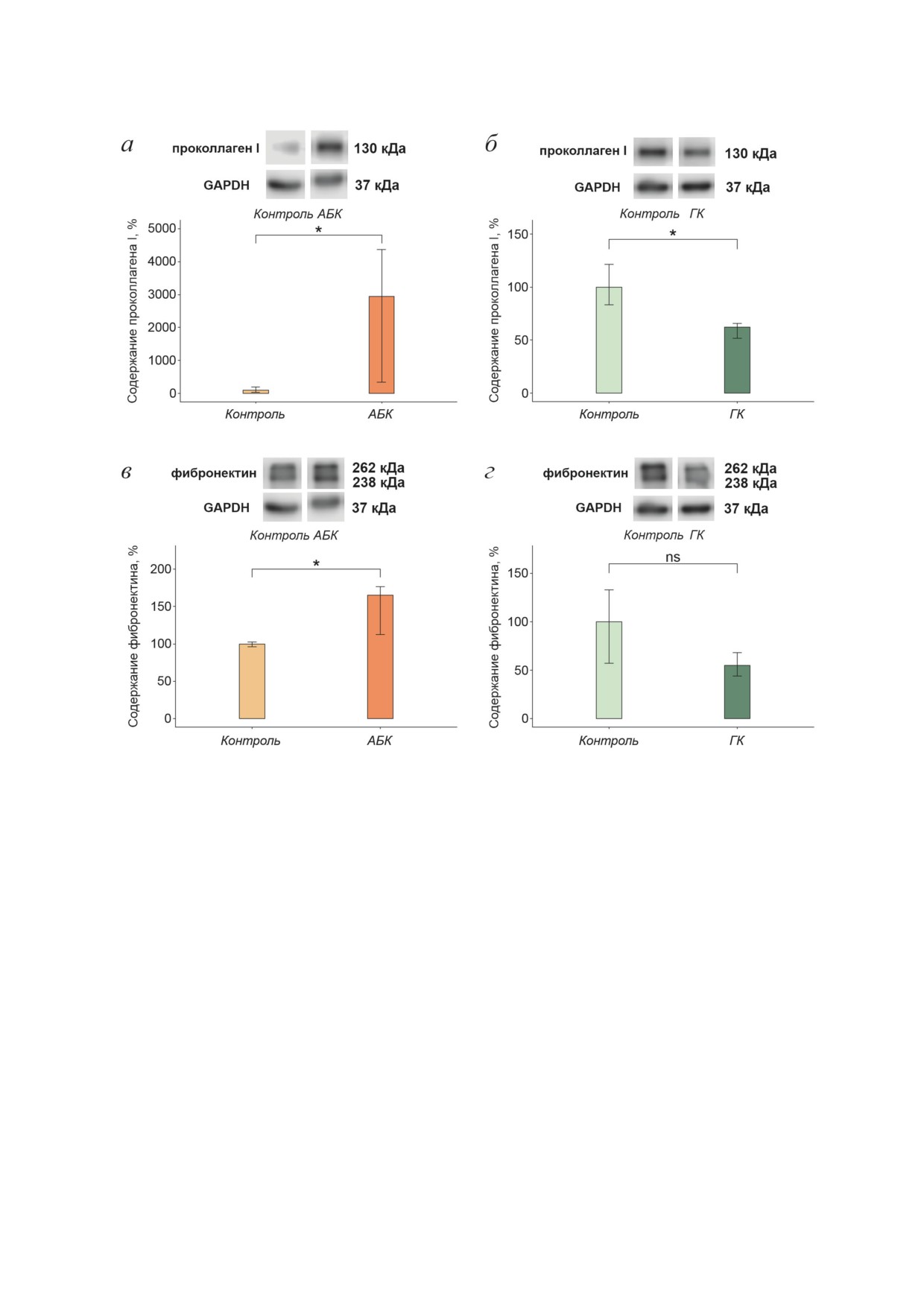
фибробластов с АБК и ГК (рис. 3). Оказалось,
для коллагеновых белков.
что АБК увеличивала уровень синтеза прокол-
Оценка уровня синтеза α-SMA и доли мио-
лагена I и фибронектина в 29,4 раза (рис. 3, а)
фибробластов в популяции фибробластов. Изме-
и в 1,6 раза (рис. 3, в) соответственно. При
нение секреторно-синтетической активности
этом ГК снижала уровень синтеза проколла-
дермальных фибробластов, наблюдаемое при
гена I в 1,6 раза (рис. 3, б), а также снижала
действии АБК и ГК в настоящем исследова-
уровень синтеза фибронектина (рис. 3, г), но
нии, может быть связано с изменением коли-
статистически недостоверно. Таким образом,
чества миофибробластов в популяции дер-
в дермальных фибробластах АБК вызывала
мальных фибробластов, так как для мио-
повышение уровня синтеза белков внеклеточ-
фибробластов характерен повышенный, по
ного матрикса - проколлагена I и фибронек-
сравнению с фибробластами, уровень синтеза
тина, а ГК достоверно индуцировала снижение
проколлагена I и фибронектина [1]. Основ-
уровня синтеза только проколлагена I.
ным маркером миофибробластов является
БИОХИМИЯ том 88 вып. 6 2023
1000
ТУРИЩЕВА и др.
Рис. 1. Уровень экспрессии генов, кодирующих маркеры UPR GRP78 (а и б), ATF4 (в и г), sXBP1 (д и е) и CHOP (ж и з)
после 24-часового воздействия АБК и ГК. Показаны медианы и интерквартильные размахи; ns - not significant (не зна-
чимо); * p < 0,05 по критерию Манна-Уитни; 7 независимых экспериментов
БИОХИМИЯ том 88 вып. 6 2023
ФИТОГОРМОНЫ И ДИФФЕРЕНЦИРОВОЧНЫЙ СТАТУС ФИБРОБЛАСТОВ
1001
Рис. 2. Влияние АБК и ГК на уровень секреции проколлагена I и фибронектина в дермальных фибробластах. а - Уро-
вень секреции проколлагена I после 24 ч воздействия АБК; б - уровень секреции проколлагена I после 24 ч воздей-
ствия ГК; в - уровень секреции фибронектина после 24 ч воздействия АБК; г - уровень секреции фибронектина
после 24 ч воздействия ГК; д - уровень секреции проколлагена I после 48 ч воздействия АБК; е - уровень секреции
проколлагена I после 48 ч воздействия ГК; ж - уровень секреции фибронектина после 48 ч воздействия АБК; з - уро-
вень секреции фибронектина после 48 ч воздействия ГК. Показаны медианы и интерквартильные размахи; ns - не зна-
чимо; * p < 0,05 по критерию Манна-Уитни; 5 независимых экспериментов
8
БИОХИМИЯ том 88 вып. 6 2023
1002
ТУРИЩЕВА и др.
Рис. 3. Влияние 48-часовой инкубации с АБК и ГК на уровень синтеза проколлагена I и фибронектина в дермальных
фибробластах. а - Содержание проколлагена I после воздействия АБК; б - содержание проколлагена I после воздей-
ствия ГК; в - содержание фибронектина после воздействия АБК; г - содержание фибронектина после воздействия ГК.
Показаны медианы и интерквартильные размахи; ns -не значимо; * p < 0,05 по критерию Манна-Уитни; 5 независи-
мых экспериментов
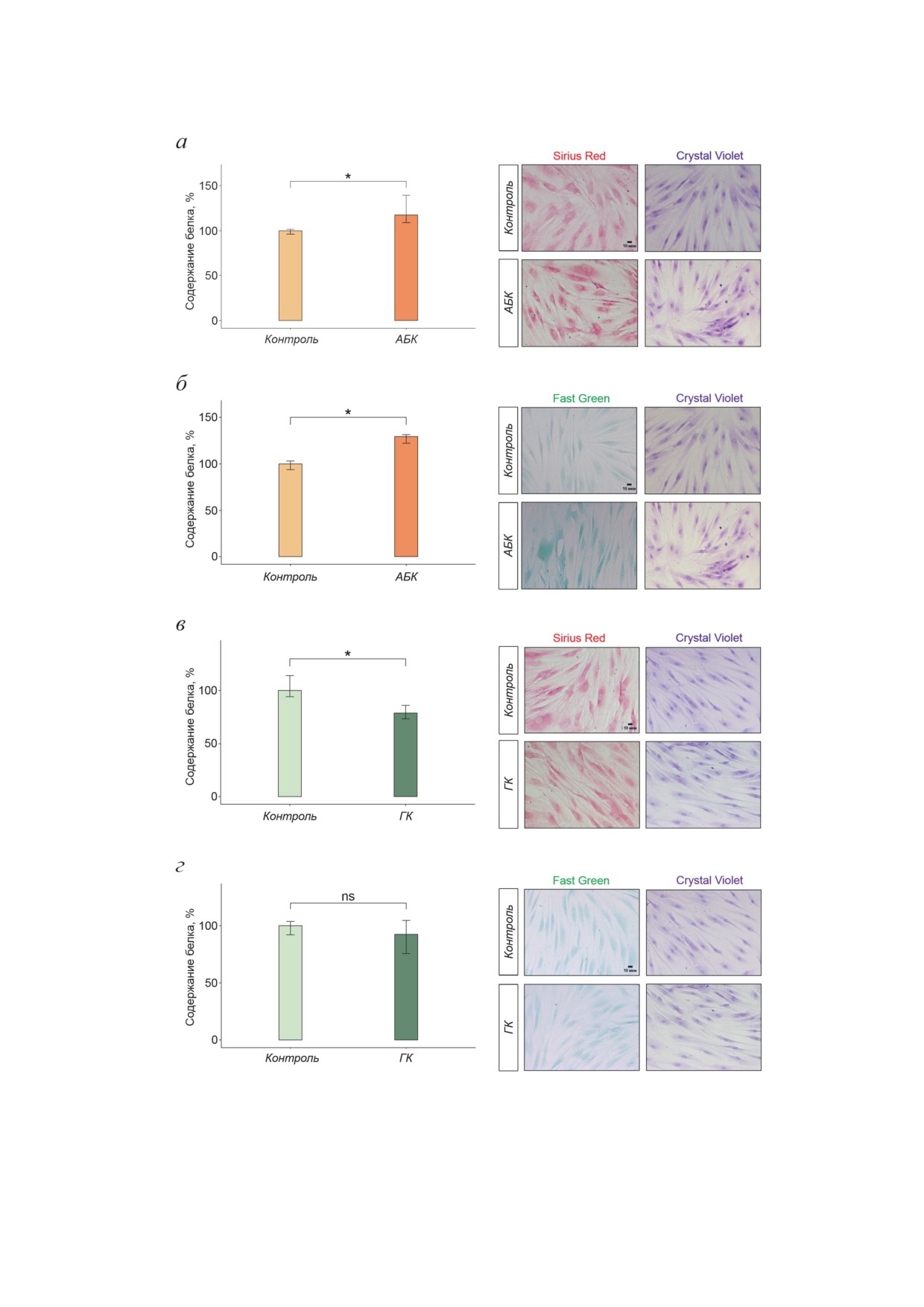
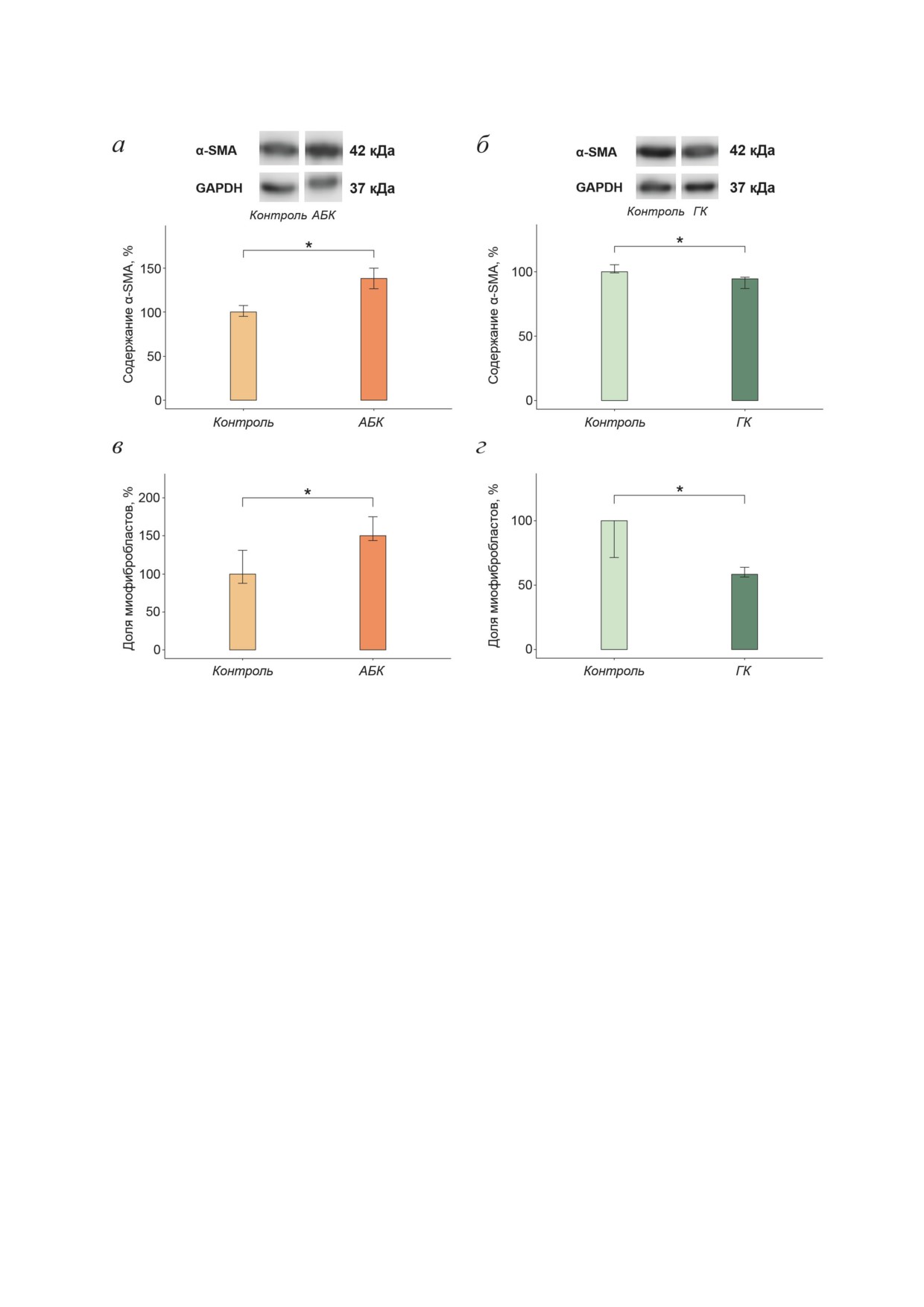
гладкомышечный актин α [2, 16, 17], поэто-
теза α-SMA и количества миофибробластов в
му была проведена оценка уровня синтеза
популяции дермальных фибробластов, а при
α-SMA с помощью вестерн-блоттинга и про-
действии ГК уровень синтеза α-SMA и коли-
изведён подсчёт доли миофибробластов в
чество миофибробластов уменьшалось.
популяции дермальных фибробластов с по-
мощью иммуноцитохимического выявления
α-SMA после 48-часового воздействия АБК
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
и ГК (рис. 5). Как видно из рис. 5, при дей-
ствии АБК уровень синтеза α-SMA повышался
Проведённые нами исследования показали,
на 38,5% (рис. 5, а), а при действии ГК - сни-
что фитогормоны АБК и ГК вызывают акти-
жался на 5,4% (рис. 5, б). Подсчёт доли мио-
вацию UPR в дермальных фибробластах чело-
фибробластов (клеток, содержащих α-SMA-
века, а также оказывают влияние на их секре-
положительные фибриллы) показал, что при
торно-синтетическую активность. UPR - это
действии АБК доля миофибробластов возра-
адаптивный ответ клетки на нарушение гомео-
стала в 1,5 раза (рис. 5, в), а при действии ГК -
стаза эндоплазматического ретикулума (ЭПР),
снижалась на 41,5% (рис. 5, г). Таким образом,
вызванное накоплением в ЭПР не свёрнутых
АБК стимулировала увеличение уровня син-
и/или неправильно свёрнутых белков [18, 39].
БИОХИМИЯ том 88 вып. 6 2023
ФИТОГОРМОНЫ И ДИФФЕРЕНЦИРОВОЧНЫЙ СТАТУС ФИБРОБЛАСТОВ
1003
Рис. 4. Влияние 7-суточной инкубации с АБК и ГК на общую продукцию коллагеновых и неколлагеновых белков вне-
клеточного матрикса дермальными фибробластами. Представлены репрезентативные изображения окрашивания кле-
ток Sirius Red (выявление коллагеновых белков матрикса), Fast Green (выявление неколлагеновых белков матрикса)
и Crystal Violet (оценка количества клеток). а - Содержание коллагеновых белков после воздействия АБК; б - содер-
жание неколлагеновых белков после воздействия АБК; в - содержание коллагеновых белков после воздействия ГК;
г - содержание неколлагеновых белков после воздействия ГК. Показаны медианы и интерквартильные размахи; ns -
не значимо; * p < 0,05 по критерию Манна-Уитни; 5 независимых экспериментов. Масштабный отрезок - 10 мкм
БИОХИМИЯ том 88 вып. 6 2023
8*
1004
ТУРИЩЕВА и др.
Рис. 5. Влияние 48-часовой инкубации с АБК и ГК на уровень синтеза α-SMA и долю миофибробластов в популя-
ции дермальных фибробластов. а - Содержание α-SMA после воздействия АБК; б - содержание α-SMA после воз-
действия ГК; в - доля миофибробластов после воздействия АБК; г - доля миофибробластов после воздействия ГК.
Показаны медианы и интерквартильные размахи; * p < 0,05 по критерию Манна-Уитни; 5 независимых экспериментов
Такое нарушение гомеостаза носит назва-
ATF4 и CHOP [18, 39, 40]. Все транскрип-
ние «стресс ЭПР». Ранее нами было показа-
ционные факторы, активирующиеся в ходе
но, что ГК вызывает активацию сигнальных
стресса ЭПР и UPR, за исключением CHOP,
путей UPR в нормальных и опухолевых клет-
повышают экспрессию генов белков ответа на
ках эпидермоидного происхождения, повы-
стресс ЭПР, направленных на восстановление
шая экспрессию генов, кодирующих основ-
гомеостаза ЭПР и его свёртывающей способ-
ные маркеры стресса ЭПР и UPR - GRP78,
ности. CHOP стимулирует стресс-опосредо-
ATF4, sXBP1 и CHOP [24]. GRP78 - это шапе-
ванную индукцию апоптоза.
рон люмена ЭПР, в отсутствие стресса ЭПР
В настоящем исследовании мы провели
связанный с тремя трансмембранными сенсо-
оценку уровня экспрессии GRP78, ATF4, sXBP1
рами стресса ЭПР - IRE1 (требующий ино-
и CHOP при воздействии АБК и ГК на клетки
зитол белок 1), PERK (киназа ЭПР, подобная
соединительнотканного происхождения - дер-
белковой киназе RNA) и ATF6 (активирую-
мальные фибробласты человека. Оказалось,
щий фактор транскрипции 6) [39]. В условиях
что АБК повышает уровень экспрессии GRP78
стресса ЭПР GRP78 отделяется от этих сен-
и ATF4, что свидетельствует об активации
соров, что вызывает их активацию. Каждый
стресса ЭПР и запуске UPR. Насколько нам
сенсор стресса ЭПР (IRE1, PERK и ATF6)
известно, это первые данные о способности
при активации запускает свой сигнальный
АБК активировать стресс ЭПР и UPR в клет-
каскад, приводящий к активации экспрес-
ках человека. При этом АБК не повышала
сии таких транскрипционных факторов, как
уровень экспрессии sXBP1. Это может быть
sXBP1
(«s» означает
«сплайсированный»), связано с тем, что АБК не активирует или бло-
БИОХИМИЯ том 88 вып. 6 2023
ФИТОГОРМОНЫ И ДИФФЕРЕНЦИРОВОЧНЫЙ СТАТУС ФИБРОБЛАСТОВ
1005
кирует сигналинг по IRE1-XBP1-пути стрес-
фибронектина в культуральную среду обуслов-
са ЭПР, а также с возможной активацией этого
лен тем, что ГК оказывает влияние на секре-
пути на более ранних сроках воздействия, а
торный путь фибронектина, который, как из-
затем снижением его активности. Отсутствие
вестно, отличается от секреторного пути про-
повышения экспрессии CHOP свидетельствует
коллагена I [41]. Проколлаген I транспорти-
о том, что АБК не индуцирует стресс-опосре-
руется из ЭПР в аппарат Гольджи в составе
дованный апоптоз, контролируемый CHOP,
COPII-везикул, которые формируются при
по крайней мере через 24 ч воздействия.
участии белка TANGO1 (transport and Golgi
В свою очередь, ГК тоже вызывала акти-
organization protein 1). Далее в аппарате Голь-
вацию UPR, о чём свидетельствует повыше-
джи проколлаген I сортируется в тубулярные
ние уровня экспрессии CHOP. Однако значи-
структуры, которые направляются к плазма-
тельного изменения уровня экспрессии генов,
тической мембране. Секреторный путь фибро-
кодирующих другие маркеры стресса ЭПР,
нектина до сих пор полностью не изучен [41].
при её воздействии не наблюдалось, что мо-
Известно, что он не зависит от белков COPII
жет быть связано с активацией сигнальных
и TANGO1. Предполагается, что в транспорте
путей UPR на более ранних сроках воздей-
фибронектина из ЭПР участвуют периостин
ствия ГК и последующим снижением их ак-
и трансмембранный P24 транспортный бе-
тивности. CHOP считается проапоптотиче-
лок 2 (TMED2), а далее фибронектин транс-
ским фактором, однако ранее мы показали,
портируется к плазматической мембране при
что ГК не вызывает значительного снижения
участии мультивезикулярных телец и секрети-
метаболической активности, а, следователь-
руется во внеклеточную среду в составе вне-
но, и гибели дермальных фибробластов при
клеточных везикул [41]. Возможно, ГК уско-
24-часовом воздействии [35]. По-видимому,
ряет транспорт фибронектина из ЭПР или
фибробласты «справляются» со стрессом ЭПР,
воздействует на формирование внеклеточных
индуцированным ГК, без активации гибели
везикул и их слияние с плазматической мем-
клеток. Данные ПЦР также позволяют заклю-
браной.
чить, что обнаруженное нами ранее расшире-
Полученные нами данные указывают на то,
ние цистерн ЭПР в дермальных фибробластах
что АБК и ГК прямо или косвенно влияют на
при действии ГК [35], по-видимому, вызвано
синтез проколлагена I и фибронектина и, воз-
активацией стресса ЭПР. Следует отметить,
можно, других коллагеновых и неколлагеновых
что в нормальных и опухолевых клетках эпи-
белков в дермальных фибробластах. Косвенное
дермоидного происхождения ГК вызывала по-
влияние этих фитогормонов может быть об-
вышение экспрессии генов, кодирующих все
условлено регуляцией экспрессии генов диф-
исследованные маркеры стресса ЭПР и UPR -
ференцировки фибробластов в миофибробла-
GRP78, ATF4, sXBP1 и CHOP [24], следователь-
сты, так как для миофибробластов характерна
но, влияние АБК и ГК на клетки разного тка-
повышенная секреторно-синтетическая актив-
невого происхождения различается.
ность, в частности повышенный уровень син-
Наши данные свидетельствуют о том, что
теза проколлагена I и фибронектина [1].
влияние АБК и ГК на секреторно-синтетиче-
В литературе есть данные об уменьшении
скую активность дермальных фибробластов
уровня синтеза и отложения коллагена I фиб-
носит противоположный характер. АБК ока-
робластами при действии АБК [27, 42]. Одна-
зывает стимулирующее действие на синтез и
ко в этих работах исследовали влияние АБК в
секрецию проколлагена I и синтез фибронек-
более низких концентрациях и на фибробла-
тина, а также повышает общую продукцию
сты из зон фиброза. Поэтому мы полагаем, что
коллагеновых и неколлагеновых белков вне-
наши данные не противоречат данным литера-
клеточного матрикса дермальными фибробла-
туры, а дополняют их.
стами. ГК, напротив, снижает уровень синтеза
Изменение секреторно-синтетической ак-
проколлагена I и продукцию коллагеновых
тивности дермальных фибробластов при дей-
белков внеклеточного матрикса. Однако ГК сти-
ствии АБК и ГК, установленное в нашем ис-
мулирует секрецию фибронектина, хотя уро-
следовании, может быть связано с изменением
вень синтеза фибронектина при её воздей-
количества миофибробластов в популяции дер-
ствии не повышается, а имеет тенденцию к
мальных фибробластов. Действительно, про-
снижению. Это может быть связано с тем, что
ведённый нами анализ уровня синтеза основ-
дермальные фибробласты отвечают на дей-
ного маркера миофибробластов - α-SMA, а
ствие ГК выбросом синтезированного фибро-
также подсчёт количества миофибробластов
нектина, однако синтез новых молекул фиб-
в популяции фибробластов показал, что АБК
ронектина ГК подавляет. Возможно, выход
вызывает повышение уровня синтеза α-SMA
БИОХИМИЯ том 88 вып. 6 2023
1006
ТУРИЩЕВА и др.
и количества миофибробластов. Эти данные
активации UPR при действии АБК отличаются
коррелируют с данными о повышении секре-
от таковых при действии других индукторов
торно-синтетической активности в популяции
дифференцировки.
дермальных фибробластов при действии АБК.
В свою очередь, повышение экспрессии
ГК, в свою очередь, снижала уровень синтеза
только CHOP при воздействии ГК вместе с
α-SMA и количество миофибробластов, что
данными о снижении секреторно-синтетиче-
коррелирует со снижением секреторно-син-
ской активности и количества миофибробла-
тетической активности в популяции дермаль-
стов в популяции фибробластов свидетель-
ных фибробластов при действии этого фито-
ствуют о том, что индуцируемый ГК UPR в
гормона. В связи с этим можно заключить, что
дермальных фибробластах связан не с актива-
наблюдаемое при действии АБК повышение
цией дифференцировки и секреторно-синте-
секреторно-синтетической активности фибро-
тической активности клеток, а с подавлением
бластов по крайней мере частично вызвано
этих процессов.
дифференцировкой фибробластов в миофиб-
Ранее нами было показано, что ГК инду-
робласты. Наблюдаемое при действии ГК сни-
цирует стресс ЭПР (UPR) и дифференцировку
жение секреторно-синтетической активности
в нормальных и опухолевых клетках человека
фибробластов может быть обусловлено умень-
эпидермоидного происхождения [24]. По-ви-
шением количества миофибробластов в по-
димому, влияние ГК на дифференцировочный
пуляции дермальных фибробластов. Для того
статус клеток разного происхождения разли-
чтобы выяснить, чем вызвано такое снижение
чается. В свою очередь, данные об активации
количества миофибробластов при действии
стресса ЭПР параллельно с дифференцировкой
ГК - подавлением дифференцировки фибро-
при воздействии АБК в литературе отсутству-
бластов в миофибробласты или гибелью мио-
ют. Было обнаружено стимулирующее влияние
фибробластов, необходимо проведение допол-
АБК на дифференцировку предшественников
нительных экспериментов.
мегакариоцитов при индукции их дифферен-
Известно, что сигнальные пути UPR уча-
цировки стандартной дифференцировочной
ствуют не только в восстановлении гомео-
смесью [44], однако индукция стресса ЭПР
стаза ЭПР, но и играют ключевую роль в диф-
в этом процессе не изучалась, хотя показано
ференцировке клеток разного тканевого про-
участие стресса ЭПР в тромбоцитопоэзе [45].
исхождения, в том числе и фибробластов [2,
13, 16-18]. Наши данные о стимуляции диф-
ференцировки фибробластов в миофибробла-
ЗАКЛЮЧЕНИЕ
сты при действии АБК свидетельствуют о том,
что UPR сопровождает дифференцировку, ин-
Таким образом, мы показали, что АБК
дуцированную АБК. Кроме того, это даёт ос-
стимулирует дифференцировку дермальных
нование полагать, что АБК может запускать
фибробластов в миофибробласты, повышая
эту дифференцировку, активируя UPR.
их секреторно-синтетическую активность и
По данным литературы, при индукции диф-
увеличивая долю миофибробластов в клеточ-
ференцировки фибробластов в миофибробла-
ной популяции. В свою очередь, ГК, напротив,
сты с помощью трансформирующего фактора
подавляет секреторно-синтетическую актив-
роста β (TGF-β) и 1%-ного экстракта сигарет-
ность дермальных фибробластов и снижает
ного дыма наблюдается повышение уровня
долю миофибробластов в клеточной популя-
синтеза GRP78 и sXBP1, но не CHOP [13, 43].
ции. Кроме того, оба фитогормона вызывают
CHOP не участвует в дифференцировке фиб-
активацию UPR в дермальных фибробластах,
робластов в миофибробласты. Исследования
имеющего, однако, разное происхождение и
уровня синтеза ATF4 в этих работах не прово-
разный сигналинг, а также оказывающего про-
дилось, однако показано, что нокдаун гена, ко-
тивоположное влияние на дифференцировоч-
дирующего PERK, мишенью которой является
ный статус фибробластов.
ATF4, подавляет дифференцировку фибробла-
Стимулирующее влияние АБК на диффе-
стов в миофибробласты [17]. Таким образом,
ренцировку фибробластов может быть исполь-
полученные нами данные о повышении уровня
зовано при разработке препаратов для уско-
экспрессии GRP78 и ATF4, но не CHOP при
рения заживления ран и лечения хронических
индукции дифференцировки фибробластов в
ран при диабете, сосудистых заболеваниях, тя-
миофибробласты соответствуют данным лите-
жёлых травмах и ожогах. При этом следует об-
ратуры. Отличия в данных по уровню экспрес-
ратить внимание как на возможность введения
сии sXBP1 в литературе и нашем исследовании
АБК в рану в составе лекарственных препара-
могут быть связаны с тем, что сигнальные пути
тов для стимуляции дифференцировки фибро-
БИОХИМИЯ том 88 вып. 6 2023
ФИТОГОРМОНЫ И ДИФФЕРЕНЦИРОВОЧНЫЙ СТАТУС ФИБРОБЛАСТОВ
1007
бластов пациента в миофибробласты, так и
способности ГК снижать количество миофиб-
на активацию дифференцировки аллогенных
робластов в популяции дермальных фибробла-
фибробластов in vitro с последующим введе-
стов на моделях фиброза in vitro и in vivo.
нием полученных миофибробластов в рану [4].
До сих пор не существует клинически
Вклад авторов. Е.А. Смирнова - концеп-
одобренных методов предотвращения форми-
ция и руководство работой; Е.П. Турищева,
рования рубцов (терапии рубцов), специально
М.С. Вильданова, Д.К. Матвеева - проведение
разработанных для ограничения или пред-
экспериментов; Е.П. Турищева, П.А. Вишняко-
отвращения фиброза кожи [46]. Предлагаемые
ва, А.А. Саидова - обсуждение результатов ис-
стратегии лечения включают в себя резекцию
следования; Е.П. Турищева - написание текста;
рубца или уменьшение его размера, использо-
Е.А. Смирнова, Г.Е. Онищенко - редактиро-
вание методов тканевой инженерии, исполь-
вание текста статьи.
зование антител и лекарственной терапии,
Финансирование. Работа выполнена при
направленной, в частности, на блокирование
финансовой поддержке Российского фон-
дифференцировки фибробластов. В связи с
да фундаментальных исследований (гран-
этим на способность ГК снижать количество
ты №№ 19-015-00233 и 20-315-90118) в рам-
миофибробластов следует обратить внима-
ках научного проекта государственного
ние при поиске способов предотвращения и
задания МГУ № 121032300098-5.
лечения фиброза и, в частности образования
Благодарности. Авторы выражают благо-
рубцов. Поэтому мы считаем важным деталь-
дарность Ашниеву Герману Альфредовичу за
ное изучение механизмов действия разных
помощь в статистической обработке данных.
фитогормонов на пути активации UPR, тем
Конфликт интересов. Авторы заявляют об
более что разные фитогормоны, вызывая
отсутствии конфликта интересов.
стресс ЭПР, оказывают противоположный
Соблюдение этических норм. Настоящая
эффект на дифференцировочный статус раз-
статья не содержит описания выполненных ав-
ных типов клеток [24]. Особенно интересным
торами исследований с участием людей или ис-
представляется исследование потенциальной
пользованием животных в качестве объектов.
СПИСОК ЛИТЕРАТУРЫ
1. Desai, V. D., Hsia, H. C., and Schwarzbauer, J. E.
regenerative therapy for scarless wound healing, Front.
(2014) Reversible modulation of myofibroblast differen-
Cell Dev. Biol., 9, 713605, doi: 10.3389/fcell.2021.713605.
tiation in adipose-derived mesenchymal stem cells, PLoS
7. Talchai, C., Xuan, S., Lin, H. V., Sussel, L., and
One, 9, e86865, doi: 10.1371/journal.pone.0086865.
Accili, D. (2012) Pancreatic β cell dedifferentiation
2. Heindryckx, F., Binet, F., Ponticos, M., Rom-
as a mechanism of diabetic β cell failure, Cell, 150,
bouts, K., Lau, J., et al. (2016) Endoplasmic reticulum
1223-1234, doi: 10.1016/j.cell.2012.07.029.
stress enhances fibrosis through IRE 1α-mediated deg-
8. Efrat, S. (2019) Beta-cell dedifferentiation in type 2
radation of miR-150 and XBP-1 splicing, EMBO Mol.
diabetes: concise review, STEM Cells, 37, 1267-1272,
Med., 8, 729-744, doi: 10.15252/emmm.201505925.
doi: 10.1002/stem.3059.
3. Hinz, B.
(2016) The role of myofibroblasts in
9. Lenghel, A., Gheorghita, A. M., Vacaru, A. M., and
wound healing, Curr. Res. Transl. Med., 64, 171-177,
Vacaru, A.-M. (2021) What is the sweetest UPR flavor
doi: 10.1016/j.retram.2016.09.003.
for the β-cell? That is the question, Front. Endocrinol.,
4. Ko, U. H., Choi, J., Choung, J., Moon, S., and Shin,
11, 614123, doi: 10.3389/fendo.2020.614123.
J. H. (2019) Physicochemically tuned myofibroblasts
10. Eastell, R., O’Neill, T. W., Hofbauer, L. C., Langdahl, B.,
for wound healing strategy, Sci. Rep.,
9,
16070,
Reid, I. R., Gold, D. T., and Cummings, S. R. (2016)
doi: 10.1038/s41598-019-52523-9.
Postmenopausal osteoporosis, Nat. Rev. Dis. Primers,
5. Las Heras, K., Igartua, M., Santos-Vizcaino, E., and
2, 16069, doi: 10.1038/nrdp.2016.69.
Hernandez, R. M. (2020) Chronic wounds: Cur-
11. Zhang, W., Feng, D., Li, Y., Iida, K., McGrath, B.,
rent status, available strategies and emerging thera-
and Cavener, D. R. (2006) PERK EIF2AK3 control
peutic solutions, J. Control. Release, 328, 532-550,
of pancreatic β cell differentiation and proliferation
doi: 10.1016/j.jconrel.2020.09.039.
is required for postnatal glucose homeostasis, Cell
6. Zou, M. L., Teng, Y. Y., Wu, J. J., Liu, S. Y., Tang,
Metab., 4, 491-497, doi: 10.1016/j.cmet.2006.11.002.
X. Y., Jia, Y., Chen, Z. H., Zhang, K. W., Sun, Z. L.,
12. Saito, A., Ochiai, K., Kondo, S., Tsumagari, K.,
Li, X., Ye, J. X., Xu, R. S., and Yuan, F. L. (2021)
Murakami, T., Cavener, D. R., and Imaizumi, K.
Fibroblasts: heterogeneous cells with potential in
(2011) Endoplasmic reticulum stress response medi-
БИОХИМИЯ том 88 вып. 6 2023
1008
ТУРИЩЕВА и др.
ated by the PERK-eIF2-ATF4 pathway is involved in
(2012) Gibberellic acid induces α-amylase expression
osteoblast differentiation induced by BMP2, J. Biol.
in adipose-derived stem cells, Int. J. Mol. Med., 30,
Chem., 286, 4809-4818, doi: 10.1074/jbc.M110.152900.
243-247, doi: 10.3892/ijmm.2012.1007.
13.
Baek, H. A., Kim, D. S., Park, H. S., Jang, K. Y.,
24.
Vildanova, M., Vishnyakova, P., Saidova, A.,
Kang, M. J., Lee, D. G., Moon, W. S., Chae, H. J.,
Konduktorova, V., Onishchenko, G., and Smirnova, E.
and Chung, M. J. (2012) Involvement of endoplasmic
(2021) Gibberellic acid initiates ER stress and
reticulum stress in myofibroblastic differentiation of
activation of differentiation in cultured human
lung fibroblasts, Am. J. Resp. Cell Mol., 46, 731-739,
immortalized keratinocytes HaCaT and epidermoid
doi: 10.1165/rcmb.2011-0121OC.
carcinoma cells A431, Pharmaceutics,
13,
1813,
14.
Jang, W.-G., Kim, E.-J., Kim, D.-K., Ryoo, H.-M.,
doi: 10.3390/pharmaceutics13111813.
Lee, K.-B., Kim, S. H., Choi, H. S., and Koh, J. T.
25.
Bruzzone, S., Bodrato, N., Usai, C., Guida, L.,
(2012) BMP2 protein regulates osteocalcin expression
Moreschi, I., Nano, R., Antonioli, B., Fruscione, F.,
via Runx2-mediated Atf6 gene transcription, J. Biol.
Magnone, M., Scarfì, S., De Flora, A., and Zocchi, E.
Chem., 287, 905-915, doi: 10.1074/jbc.M111.253187.
(2008) Abscisic acid is an endogenous stimulator of
15.
Chan, J. Y., Luzuriaga, J., Bensellam, M., Biden,
insulin release from human pancreatic islets with cyclic
T. J., and Laybutt, D. R. (2013) Failure of the adaptive
ADP ribose as second messenger, J. Biol. Chem., 283,
unfolded protein response in islets of obese mice is
32188-32197, doi: 10.1074/jbc.M802603200.
linked with abnormalities in β-cell gene expression
26.
Bruzzone, S., Magnone, M., Mannino, E., Sociali, G.,
and progression to diabetes, Diabetes, 62, 1557-1568,
Sturla, L., Fresia, C., Booz, V., Emionite, L., De
doi: 10.2337/db12-0701.
Flora, A., and Zocchi, E.
(2015) Abscisic acid
16.
Matsuzaki, S., Hiratsuka, T., Taniguchi, M.,
stimulates glucagon-like peptide-1 secretion from
Shingaki, K., Kubo, T., Kiya, K., Fujiwara, T.,
L-cells and its oral administration increases plasma
Kanazawa, S., Kanematsu, R., Maeda, T., Takamura, H.,
glucagon-like peptide-1 levels in rats, PLoS One, 10,
Yamada, K., Miyoshi, K., Hosokawa, K., Tohyama, M.,
e0140588, doi: 10.1371/journal.pone.0140588.
and Katayama, T. (2015) Physiological ER stress
27.
Bruzzone, S., Battaglia, F., Mannino, E., Parodi, A.,
mediates the differentiation of fibroblasts, PLoS One,
Fruscione, F., Basile, G., Salis, A., Sturla, L.,
10, e0123578, doi: 10.1371/journal.pone.0123578.
Negrini, S., Kalli, F., Stringara, S., Filaci, G.,
17.
Chen, Y. C., Chen, B. C., Huang, H. M., Lin,
Zocchi, E., and Fenoglio, D. (2012) Abscisic acid
S. H., and Lin, C. H. (2019) Activation of PERK in
ameliorates the systemic sclerosis fibroblast phenotype
ET-1-and thrombin-induced pulmonary fibroblast
in vitro, Biochem. Biophys. Res. Commun., 422, 70-74,
differentiation: inhibitory effects of curcumin, J. Cell.
doi: 10.1016/j.bbrc.2012.04.107.
Physiol., 234, 15977-15988, doi: 10.1002/jcp.28256.
28.
Zhang, W., Chen, D.-Q., Qi, F., Wang, J., Xiao,
18.
Turishcheva, E., Vildanova, M., Onishchenko, G.,
W.-Y., and Zhu, W. Z. (2010) Inhibition of calcium-
and Smirnova, E. (2022) The role of endoplasmic
calmodulin-dependent kinase ii suppresses cardiac
reticulum stress in differentiation of cells of mesen-
fibroblast proliferation and extracellular matrix
chymal origin, Biochemistry (Moscow), 87, 916-931,
secretion, J. Cardiovasc. Pharmacol.,
55,
96-105,
doi: 10.1134/S000629792209005X.
doi: 10.1097/FJC.0b013e3181c9548b.
19.
Budovsky, A., Yarmolinsky, L., and Ben-Shabat, S.
29.
Матвеева Д. К., Андреева Е. Р., Буравкова Л. Б.
(2015) Effect of medicinal plants on wound healing,
(2019) Выбор оптимального протокола получения
Wound Repair Regen.,
23,
171-183, doi:
10.1111/
децеллюляризованного внеклеточного маткрикса
wrr.12274.
мезенхимальных стромальных клеток из жировой
20.
Alamgir, A. N. M. (2018) Therapeutic Use of Medicinal
ткани человека, Вестн. Моск. Унив., 74, 294-300.
Plants and Their Extracts: Volume 2. Phytochemistry
30.
Basalova, N., Sagaradze, G., Arbatskiy, M., Evtu-
and Bioactive Compounds, Springer Cham, doi:
shenko, E., Kulebyakin, K., Grigorieva, O., Akopyan, Z.,
10.1007/978-3-319-92387-1.
Kalinina, N., and Efimenko, A. (2020) Secretome of
21.
Addis, R., Cruciani, S., Santaniello, S., Bellu, E.,
mesenchymal stromal cells prevents myofibroblasts
Sarais, G., Ventura, C., Maioli, M., and Pintore, G.
differentiation by transferring fibrosis-associated
(2020) Fibroblast proliferation and migration in
microRNAs within extracellular vesicles, Cells, 9,
wound healing by phytochemicals: evidence for a novel
1272, doi: 10.3390/cells9051272.
synergic outcome, Int. J. Med. Sci., 17, 1030-1042,
31.
Zhivodernikov, I. V., Ratushnyy, A. Yu., Matveeva,
doi: 10.7150/ijms.43986.
D. K., and Buravkova, L. B. (2020) Extracellular
22.
Sharma, A., Khanna, S., Kaur, G., and Singh, I.
matrix proteins and transcription of matrix-associated
(2021) Medicinal plants and their components for
genes in mesenchymal stromal cells during modeling
wound healing applications, Futur. J. Pharm. Sci., 7,
of the effects of microgravity, Bull. Exp. Biol. Med.,
53, doi: 10.1186/s43094-021-00202-w.
170, 230-232, doi: 10.1007/s10517-020-05040-z.
23.
Kasamatsu, A., Iyoda, M., Usukura, K., Sakamoto, Y.,
32.
Grigorieva, O. A., Vigovskiy, M. A., Dyachkova,
Ogawara, K., Shiiba, M., Tanzawa, H., and Uzawa, K.
U. D., Basalova, N. A., Aleksandrushkina, N. A.,
БИОХИМИЯ том 88 вып. 6 2023
ФИТОГОРМОНЫ И ДИФФЕРЕНЦИРОВОЧНЫЙ СТАТУС ФИБРОБЛАСТОВ
1009
Kulebyakina, M. A., Zaitsev, I. L., Popov, V. S., and
40.
Hetz, C.
(2012) The unfolded protein response:
Efimenko, A. Y. (2021) Mechanisms of endothelial-
controlling cell fate decisions under ER stress
to-mesenchymal transition induction by extracellular
and beyond, Nat. Rev. Mol. Cell Biol., 13, 89-102,
matrix components in pulmonary fibrosis, Bull.
doi: 10.1038/nrm3270.
Exp. Biol. Med., 171, 523-531, doi: 10.1007/s10517-
41.
Albacete-Albacete, L., Sanchez-Alvarez, M., and Del
021-05264-7.
Pozo, M. A. (2021) Extracellular vesicles: an emerging
33.
Yang, M. C., O’Connor, A. J., Kalionis, B., and
mechanism governing the secretion and biological
Heath, D. E. (2022) Improvement of mesenchymal
roles of tenascin-C, Front. Immunol., 12, 671485,
stromal cell proliferation and differentiation via
doi: 10.3389/fimmu.2021.671485.
decellularized extracellular matrix on substrates with a
42.
Chen, X., Ding, C., Liu, W., Liu, X., Zhao, Y.,
range of surface chemistries, Front. Med. Technol., 4,
Zheng, Y., Dong, L., Khatoon, S., Hao, M., Peng, X.,
834123, doi: 10.3389/fmedt.2022.834123.
Zhang, Y., and Chen, H.
(2021) Abscisic acid
34.
Vandesompele, J., De Preter, K., Pattyn, F., Poppe, B.,
ameliorates oxidative stress, inflammation, and
Van Roy, N., De Paepe, A., and Speleman, F. (2002)
apoptosis in thioacetamide-induced hepatic fibrosis
Accurate normalization of real-time quantitative RT-
by regulating the NF-kB signaling pathway in mice,
PCR data by geometric averaging of multiple internal
Eur. J. Pharmacol.,
891,
173652, doi:
10.1016/
control genes, Genome Biol., 3, RESEARCH0034,
j.ejphar.2020.173652.
doi: 10.1186/gb-2002-3-7-research0034.
43.
Song, M., Peng, H., Guo, W., Luo, M., Duan, W.,
35.
Турищева E. П., Вильданова М. С., Поташникова
Chen, P., and Zhou, Y. (2019) Cigarette smoke ex-
Д. М., Смирнова Е. А. (2020) Различная реакция
tract promotes human lung myofibroblast differ-
биосинтетической системы дермальных фибро-
entiation by the induction of endoplasmic reticu-
бластов и клеток фибросаркомы человека на дей-
lum stress, Respiration, 98, 347-356, doi: 10.1159/
ствие растительных гормонов, Цитология, 62, 566-
000502099.
580, doi: 10.31857/S0041377120080088.
44.
Huang, W., Gu, H., Zhan, Z., Wang, R., Song, L.,
36.
Kendall, R. T., and Feghali-Bostwick, C. A. (2014)
Zhang, Y., Zhang, Y., Li, S., Li, J., Zang, Y., Li, Y.,
Fibroblasts in fibrosis: novel roles and mediators, Front.
and Qian, B. (2021) The plant hormone abscisic
Pharmacol., 5, 123, doi: 10.3389/fphar.2014.00123.
acid
stimulates
megakaryocyte differentiation
37.
Bonnans, C., Chou, J., and Werb, Z. (2014) Re-
from human iPSCs in vitro, Platelets, 33, 462-470,
modelling the extracellular matrix in development
doi: 10.1080/09537104.2021.1944616.
and disease, Nat. Rev. Mol. Cell Biol., 15, 786-801,
45.
Kovuru, N., Raghuwanshi, S., Sharma, D. S.,
doi: 10.1038/nrm3904.
Dahariya, S., Pallepati, A., and Gutti, R. K. (2020)
38.
Vega-Avila, E., and Pugsley, M. K. (2011) An overview
Endoplasmic reticulum stress induced apoptosis and
of colorimetric assay methods used to assess survival
caspase activation is mediated through mitochondria
or proliferation of mammalian cells, Proc. West.
during megakaryocyte differentiation, Mitochondrion,
Pharmacol. Soc., 54, 10-14.
50, 115-120, doi: 10.1016/j.mito.2019.10.009.
39.
Sicari, D., Delaunay-Moisan, A., Combettes, L.,
46.
Tai, Y., Woods, E. L., Dally, J., Kong, D., Steadman, R.,
Chevet, E., and Igbaria, A.
(2020) A guide to
Moseley, R., and Midgley, A. C. (2021) Myofibro-
assessing endoplasmic reticulum homeostasis and
blasts: function, formation, and scope of molecular
stress in mammalian systems, FEBS J., 287, 27-42,
therapies for skin fibrosis, Biomolecules, 11, 1095,
doi: 10.1111/febs.15107.
doi: 10.3390/biom11081095.
PHYTOHORMONES AFFECT THE DIFFERENTIATION
OF HUMAN DERMAL FIBROBLASTS VIA UPR ACTIVATION
E. P. Turishcheva1*, M. S. Vildanova1, P. A. Vishnyakova2,3, D. K. Matveeva4,
A. A. Saidova1, G. E. Onishchenko1, and E. A. Smirnova1
1 Faculty of Biology, Lomonosov Moscow State University,
119991 Moscow, Russia; e mail: kitten-caterina@yandex.ru
2 National Medical Research Center for Obstetrics, Gynecology and Perinatology
Named after Academician V. I. Kulakov of Ministry of Healthcare of Russian Federation,
117997 Moscow, Russia
3 Peoples’ Friendship University of Russia, 117198 Moscow, Russia
4 Institute of Biomedical Problems, Russian Academy of Sciences, 123007 Moscow, Russia
БИОХИМИЯ том 88 вып. 6 2023
1010
ТУРИЩЕВА и др.
Normalization of secretory activity and the level of differentiation of mesenchymal cells, including fibro-
blasts, is the important biomedical problem. One of the plausible solutions to this problem is to affect the
unfolded protein response (UPR) signaling cascade, which is activated during fibroblast differentiation. In
the present study, the effect of phytohormones on the secretory activity and differentiation of cultured hu-
man dermal fibroblasts was investigated. By analyzing the expression level of genes encoding UPR markers
in these cells, we found that phytohormone abscisic acid (ABA) upregulated the expression of GRP78 and
ATF4 genes, while phytohormone gibberellic acid (GA) upregulated the expression of CHOP. Evaluation
of the biosynthetic activity of fibroblasts showed that ABA elevated the level of secretion and synthesis of
procollagen I and the level of fibronectin synthesis, as well as total production of collagen and non-colla-
gen proteins of extracellular matrix. ABA also stimulated the synthesis of smooth muscle actin α (α-SMA)
and increased the number of myofibroblasts in cell population. On the contrary, GA increased the level of
fibronectin secretion, but decreased the level of procollagen I synthesis, and reduced the total production
of collagen proteins of extracellular matrix. Concomitantly, in these conditions we observed the decreased
level of α-SMA synthesis and the number of myofibroblasts in the cell population. Our results suggest that
phytohormones are the modulators of the biosynthetic activity of fibroblasts and affect their differentiation
status.
Keywords: abscisic acid, gibberellic acid, fibroblasts, myofibroblasts, wound healing, fibrosis, differentiation, smooth
muscle actin
БИОХИМИЯ том 88 вып. 6 2023