БИОХИМИЯ, 2023, том 88, вып. 6, с. 1011 - 1034
УДК 578
РЕКОМБИНАНТНЫЕ ОНКОЛИТИЧЕСКИЕ ШТАММЫ
ВИРУСА ОСПОВАКЦИНЫ
Обзор
© 2023 Я. Шакиба1,2, П.О. Воробьев2, М. Махмуд2, А. Хамад2, Д.В. Кочетков2,
Г.М. Юсубалиева2,3,4, В.П. Баклаушев2,3,4, П.М. Чумаков2, А.В. Липатова2*
1 Московский физико-технический институт, 141701 Долгопрудный, Московская обл., Россия
2 ФГБУН Институт молекулярной биологии им. В. А. Энгельгардта Российской академии наук,
119991 Москва, Россия; электронная почта: lipatovaanv@gmail.com
3 Федеральный научно-клинический центр ФМБА России, 115682 Москва, Россия
4 Федеральный центр мозга и нейротехнологий ФМБА России, 117513 Москва, Россия
Поступила в редакцию 16.01.2023
После доработки 06.04.2023
Принята к публикации 24.04.2023
Онколитическая виротерапия представляет собой альтернативный подход к лечению онкологиче-
ских заболеваний, основанный на использовании вирусов, избирательно инфицирующих и уни-
чтожающих опухолевые клетки. Вирус осповакцины (VV, vaccinia virus) является членом семей-
ства оболочечных вирусов Poxviridae, содержащих крупный геном, представленный двуцепочечной
линейной молекулой ДНК. Подтверждённая многолетним клиническим применением безопас-
ность штаммов VV и широкие возможности для генно-инженерной модификации вируса делают
его отличной платформой для создания рекомбинантных онколитических вирусов с улучшенной
избирательностью действия и повышенной терапевтической эффективностью в отношении зло-
качественных заболеваний. Вирус может быть «вооружён» вставкой в геном последовательностей
проапоптотических молекул, усиливающих прямое цитопатическое действие вируса на опухоль,
факторами, усиливающими онкоселективность, или иммуномодулирующими белками, экспрессия
которых в инфицированных опухолевых клетках активирует иммунную систему организма-хозяи-
на и повышает перекрестное распознавание опухолевых неоантигенов T-клетками или NK-клет-
ками. В настоящем обзоре мы суммировали биоинженерные подходы, направленные на создание
рекомбинантных штаммов VV с усиленным иммунотерапевтическим действием.
КЛЮЧЕВЫЕ СЛОВА: вирус осповакцины, онколитические вирусы, рекомбинантные вирусы, иммуно-
супрессия, иммуномодуляция, цитокины.
DOI: 10.31857/S0320972523060106, EDN: EFRIKQ
ВВЕДЕНИЕ
почти 200 генов. Так же, как и у других чле-
нов семейства Poxviridae, центральный сегмент
Вирус осповакцины (VV, vaccinia virus) яв-
генома VV содержит консервативные участки,
ляется членом семейства Poxviridae. Он содер-
кодирующие белки, необходимые для репли-
жит линейную двуцепочечную ДНК длиной
кации вируса, и концевые неконсервативные
около 190 тыс. пар оснований, кодирующую участки, кодирующие белки, обеспечивающие
Принятые сокращения: CTL - цитотоксический Т-лимфоцит; CTLA-4 - гликопротеин цитотоксических T-лимфо-
цитов 4; EEV - внеклеточный оболочечный вирус; GM-CSF - гранулоцитарный-макрофагальный колониестимули-
рующий фактор; DC - dendritic cells, дендритные клетки; ITIM - ингибирующий мотив на основе остатка тирозина
иммунорецептора; IFN - интерферон; IL - интерлейкин; MAPK - митоген-активируемая протеинкиназа; MLKL -
подобная киназному домену смешанного происхождения псевдокиназа; MUC1 - муцин 1; MVA - модифицированный
вирус осповакцины Анкара; NF-κB - ядерный фактор каппа В; NK - естественный киллер; PD-1 - белок запрограм-
мированной гибели-1; PD-L1 - лиганд 1 запрограммированной гибели; Th1/2 - Т-хелпер 1/2; TIGIT - T-клеточ-
ный иммунорецептор с доменами Ig и ITIM; TK - тимидинкиназа; TME - микроокружение опухоли; TNF - фактор
некроза опухоли; Treg - регуляторные Т-клетки; VGF - вирусный ростовой фактор; VV - вирус осповакцины; VEGF -
эндотелиальный фактор роста сосудов.
* Адресат для корреспонденции.
1011
1012
ШАКИБА и др.
распознавание и проникновение вируса в
апоптотические белки, ферменты репарации
клетку-хозяина [1]. Определены две инфек-
ДНК и рибонуклеотидредуктаза, делает их
ционные формы VV: это внеклеточный обо-
устойчивыми к химиотерапии, в то время как
лочечный вирус (EEV, extracellular enveloped
штаммы VV могут целенаправленно воздей-
virus) и внутриклеточный зрелый вирус (IMV,
ствовать на такие резистентные клетки [11].
intracellular mature virus), которые различа-
Для разработки рекомбинантных вариан-
ются по способности связываться с поверх-
тов VV с повышенной онколитической актив-
ностью клетки [2]. В 1922 г. Levaditi et al. пока-
ностью были использованы различные генно-
зали, что VV может замедлять рост опухоли у
инженерные подходы. Например, рекомбинант-
мышей, что было первой демонстрацией онко-
ный VV с делецией гена тимидинкиназы (TK,
литического эффекта этого вируса в лаборатор-
thymidine kinase), участвующей в синтезе ге-
ных условиях [3]. Впоследствии было показано,
номных ДНК, повышает избирательность VV
что VV избирательно инфицирует и разрушает
в отношении опухолей, делая возможной ре-
опухолевые клетки в клеточных культурах и
пликацию этого вируса только в быстро про-
на животных моделях [4]. С 1980-х гг. реком-
лиферирующих опухолевых клетках, богатых
бинантные штаммы VV и другие поксвирусы
нуклеотидами [4]. Также модификации генов,
используются в качестве векторов в протоко-
обеспечивающие уклонение VV от иммунного
лах иммунизации при лечении инфекционных
ответа, могут усиливать онколитическое дей-
заболеваний и злокачественных новообра-
ствие и ответ иммунной системы для достиже-
зований. Векторы VV были широко исследо-
ния длительных ремиссий [12], а экспрессия
ваны в клинических испытаниях, что позво-
опухолевых антигенов или иммуномодулирую-
ляет рассматривать их как, пожалуй, самую
щих молекул может повышать онколитические
безопасную платформу для создания новых
свойства VV [13]. В настоящем обзоре при-
рекомбинантных онколитических штаммов
ведены данные о генно-инженерных подходах
для адъювантной и неоадъювантной иммуно-
к созданию рекомбинантных штаммов VV для
терапии [5].
использования в иммуновиротерапии.
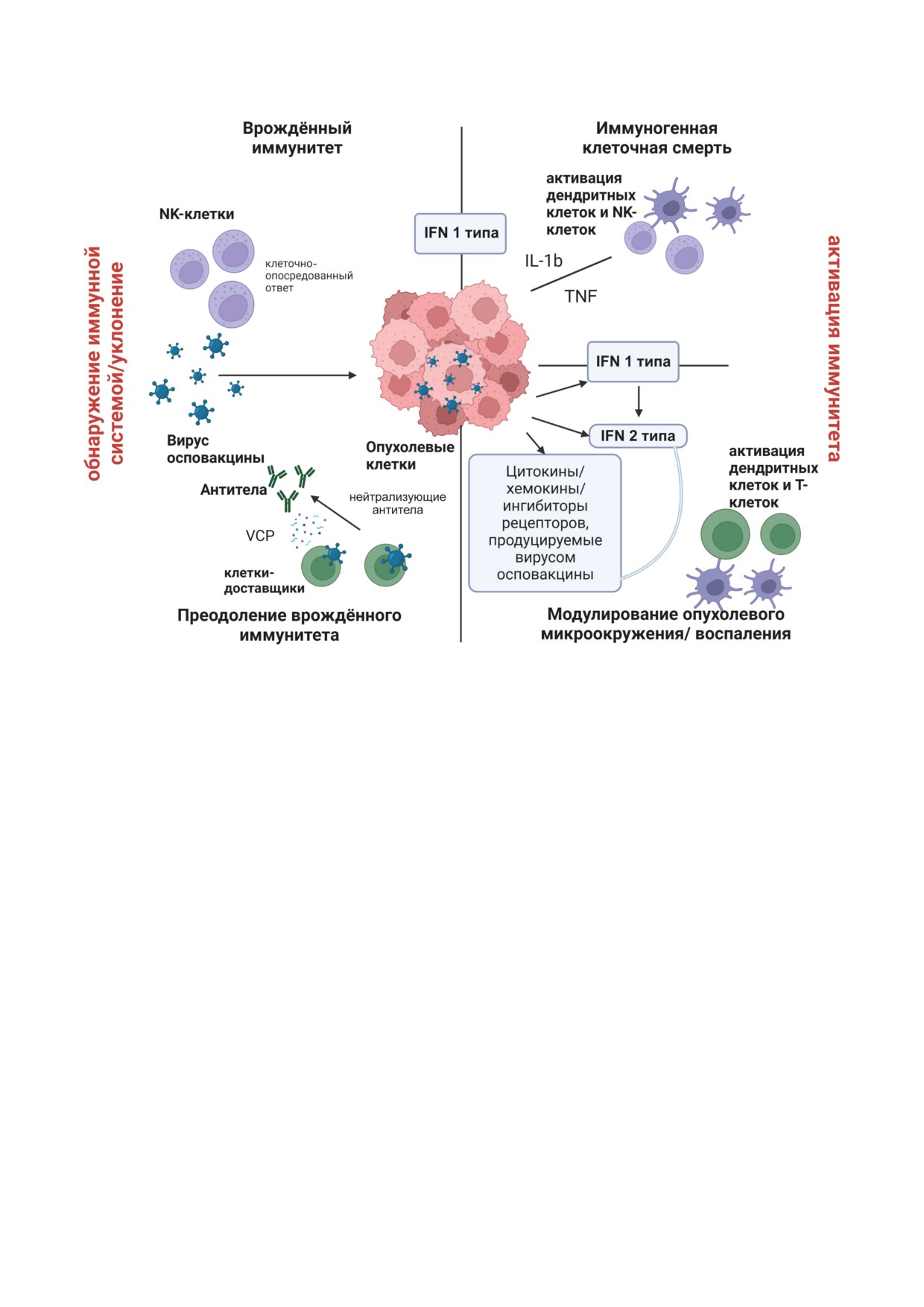
Несколько свойств VV делают его перспек-
тивным агентом для онколитической вирус-
ной терапии. Во-первых, VV был разработан
VV И ИММУННАЯ СИСТЕМА
в рамках программы Всемирной организа-
ции здравоохранения (ВОЗ) по искоренению
VV использует ряд механизмов, чтобы из-
оспы в качестве живой вакцины, которой
бежать действия противовирусного иммунного
было вакцинировано 200 миллионов человек,
ответа организма-хозяина и эффективно ин-
что подтвердило безопасность этого вируса
фицировать опухолевые клетки без риска быть
как онколитического агента и вектора для
инактивированным [14] (рисунок). На основе
доставки генов
[6]. Даже при возникнове-
данных о взаимодействии VV с некоторыми
нии экстренных ситуаций при инфекции VV
отдельными иммунными механизмами были
широко доступны антитела к этому вирусу и
получены различные рекомбинантные VV для
противовирусные препараты [7]. Во-вторых,
запуска системного противоопухолевого им-
VV обладает большим пластичным геномом,
мунного ответа.
что позволяет включать в него протяжённые
NK-Клетки (Natural killer, естественные кил-
последовательности ДНК без существенного
леры). NK-Клетки - это клетки системы врож-
снижения эффективности репликации виру-
дённого иммунитета, играющие роль первой
са [8]. В-третьих, репликация вируса в цито-
линии защиты организма-хозяина от вирусов.
плазме снижает риск интеграции вирусной
NK-Клетки также имеют важное значение в
ДНК в геном организма-хозяина. Геном ДНК-
иммунном надзоре за опухолевыми клетками
содержащего вируса VV определяет его боль-
и способны их эффективно уничтожать [15].
шую генетическую стабильность в сравнении
Перед тем как цитотоксические Т-лимфоциты
с РНК-содержащими вирусами [9]. Наконец,
(CTLs, cytotoxic T lymphocytes) запустят инак-
VV обладает тропизмом к опухолевым клеткам
тивацию вируса, инфекция VV усиливает ми-
и одновременно может успешно избегать им-
грацию NK-клеток в опухоль, запускает синтез
мунного ответа организма-хозяина [10]. Все эти
интерферонов (IFNs, interferons), цитокинов, а
природные свойства делают его не только са-
также модулирует активность основного ком-
мой безопасной, но и очень перспективной
плекса гистосовместимости класса I (MHC I,
платформой для иммунотерапии онкологиче-
сlass I major histocompatibility complex) [16]. Ко-
ских заболеваний. Повышенная экспрессия в
дируемый VV гемагглютинин (белок A56) был
опухолевых клетках таких факторов, как анти-
идентифицирован как активирующий лиганд
БИОХИМИЯ том 88 вып. 6 2023
РЕКОМБИНАНТНЫЕ ОНКОЛИТИЧЕСКИЕ ШТАММЫ VV
1013
Иллюстрация взаимодействий онколитического VV с иммунной системой, приводящих к стимуляции иммунной си-
стемы и цитолизу раковых клеток
рецепторов NKp30 и NKp46 NK-клеток, свя-
VV экспрессирует секретируемый белок VCP
зывание A56 c этими рецепторами модулиру-
(vaccinia complement protein), сходный с бел-
ет их активность и способствует приданию
ками контроля комплемента. Этот белок явля-
NK-клеткам цитотоксичных свойств [16, 17].
ется фактором вирулентности, необходимым
Из вирусных белков VV на сегодняшний день
для преодоления системы комплемента. VCP
только A56 определён как прямой модулятор
связывается с белками C3b и C4b системы
NK-клеток в VV, хотя делеция ряда других бел-
комплемента и способствует их расщеплению,
ков, таких как N1, F3 и C12, также вызывала
вызывая нарушение работы каскада фермен-
изменения ответа NK-клеток на VV-инфек-
тов системы комплемента [21]. Было показано,
цию [18].
что VCP связывается с гемагглютинином (бе-
Помимо собственных белков VV, возможно
лок A56), экспонированным на поверхности
включение в геном последовательностей экзо-
инфицированных клеток, помогая EEV-части-
генных иммуномодулирующих агентов, акти-
цам VV противодействовать системе компле-
вирующих NK-клетки и усиливающих их миг-
мента [22]. Другой защитный механизм VV
рацию в опухоль. Так, был создан рекомби-
заключается в привлечении белков организ-
нантный вариант VV, экспрессирующий хемо-
ма-хозяина, контролирующих работу системы
такcический цитокин CCL5, который привле-
комплемента, таких как CD46, CD55 и CD59.
кал NK-клетки в микроокружение инфици-
В частности, CD55 помогает EEV избежать
рованной опухоли (TME, Tumor microenvi-
разрушения системой комплемента, и это объ-
ronment) [19], а рекомбинантный VV, экспрес-
ясняет, почему EEV является более устойчи-
сирующий интерлейкин-2 (IL-2), усиливал
вой формой вируса по сравнению с IMV [23].
инфильтрацию NK-клеток в опухоли [20].
Таким образом, использование EEV-формы
Система комплемента. Система компле-
VV широко распространено в схемах вироте-
мента разрушает инфицированные вируса-
рапии для предотвращения элиминации виру-
ми клетки и усиливает фагоцитоз вирионов.
са системой комплемента [24].
БИОХИМИЯ том 88 вып. 6 2023
1014
ШАКИБА и др.
Интерфероны (IFNs). IFNs I, II и III типа
действие этих цитокинов, продуцируя раство-
играют решающую роль в противовирусной
римые рецепторы-приманки, блокирующие
защите. В ряде работ было показано, что круп-
их протеолитическое созревание или ингиби-
ные делеции на концевых участках генома VV
рующие сигналы, вызываемые цитокинами.
приводят к повышению чувствительности
VV может целенаправленно воздействовать на
вируса к действию IFNs, что позволяет пред-
IL-1, ингибируя синтез NF-κB и подавляя син-
полагать роль этих участков в кодировании
тез IL-1b [29]. Было показано, что VV ингиби-
белков, противодействующих противовирус-
рует активность IL-18, блокируя образование
ной активности IFNs. Чтобы ингибировать
зрелого белка IL-18 путём подавления белком
индукцию IFNs, VV минимизирует продукцию
B13 каспазы-1.
или распознавание патоген-ассоциированных
Белок C12, секретируемый VV, связывает
молекулярных паттернов (PAMPs, Pathogen
IL-18 [30]. VV продуцирует белки, называе-
Associated Molecular Patterns) [25]. Кроме того,
мые вирусными рецепторами TNF (vTNFR),
для индукции IFNs необходим фактор тран-
которые действуют как ложные рецепторы.
скрипции NF-κB (Nuclear factor kappa B, ядер-
Штамм Lister экспрессирует на клеточной
ный фактор каппа В), а множество внутри-
поверхности vTNFR, кодируемые вирусными
клеточных белков VV, такие как A46, A49, A52,
генами CrmC и CrmE. Эти белки-приманки
B14, C4 и E3, ингибируют этот фактор тран-
обладают сходной аминокислотной последо-
скрипции. Например, белок A46 связывается с
вательностью с TNFR, что приводит к сниже-
адапторными молекулами, ассоциированными
нию активности TNF [31]. Инфицирование
с цитоплазматическими хвостовыми участка-
штаммом MVA (Modified Vaccinia Virus Ankara,
ми Toll-подобных рецепторов (TLRs, Toll-Like
модифицированный вирус осповакцины Ан-
Receptors), позволяя белку A46 блокировать
кара) индуцирует экспрессию нескольких про-
активацию NF-κB и IFN-b. Белок A52 инги-
тивовирусных хемокинов, таких как CXCL10.
бирует активность IL-1 и деактивирует NF-κB,
Чтобы противостоять этому, VV продуци-
связываясь с IL-1-рецептор-ассоциированной
рует вирусные хемокин-связывающие белки
киназой 2 и фактором 6, ассоциированным с
(vCKBP), которые предотвращают связыва-
рецептором фактора некроза опухоли (TRAF6,
ние хемокинов со своими специфическими
Tumor Necrosis Factor Receptor-Associated Fac-
рецепторами [32]. Белки В7 и В23 штамма WR
tor 6) [26]. Другой пример вмешательства VV в
(Western Reserve) также обладают хемокин-
интерфероновый ответ связан с экспрессией
связывающей активностью [33]. Распростра-
гена B18, который кодирует аналог рецептора
нённой стратегией онколитической терапии
IFN I типа. Последний секретируется из клет-
с использованием вирусов является усиление
ки и препятствует связыванию IFN с рецеп-
онколитических свойств VV путём его «воору-
тором, тем самым предотвращая его актива-
жения» различными цитокинами или хемо-
цию [27]. В качестве примера реверсии этой
кинами, такими как GM-CSF (гранулоцитар-
активности VV против IFN был разработан
но-макрофагальный колониестимулирующий
рекомбинантный вариант вируса с удалением
фактор), IL-2, IL-12 и некоторыми другими,
генов, кодирующих противоинтерфероновые
экспрессия которых способствует формирова-
белки. Для активации IFN-β в геном VV была
нию противоопухолевого иммунитета [34]. Эта
вставлена кодирующая его последователь-
стратегия будет подробно рассмотрена ниже.
ность. Онколитическая эффективность этого
VV можно применять в качестве генети-
штамма резко возросла, так как IFN-β инги-
ческого вектора для подавления провоспа-
бирует пролиферацию раковых клеток, инду-
лительных цитокинов и других биологически
цирует противоопухолевый иммунный ответ
активных молекул, таких как фактор роста
и останавливает ангиогенез опухоли. С дру-
эндотелия сосудов (VEGF, Vascular endothelial
гой стороны, из-за нарушения сигнальных
growth factor), играющий важную роль в нео-
путей IFNs в большинстве клеток после зло-
ангиогенезе опухоли. Блокирование VEGF
качественной трансформации данный реком-
достигалось путем слияния VEGF-рецепто-
бинантный штамм может быстро распростра-
ра 1 с Fc-фрагментом IgG-антитела человека
няться в опухолевой ткани [28].
(VEGFR-1-Ig) или за счёт секреции одно-
Цитокины и хемокины. Цитокины, такие
цепочечного наноантитела (GLAF-1) против
как IL-1, IL-15, IL-18 и фактор некроза опу-
VEGF. В обоих случаях нарушалось взаимо-
холи (TNF, Tumor Necrosis Factor), участвуют
действие VEGF с рецепторами VEGF эндоте-
в развитии адаптивного иммунного ответа на
лиальных клеток, что приводило к снижению
вирусную инфекцию. Эволюция VV проис-
плотности кровеносных сосудов в опухоли.
ходила таким путём, чтобы сдерживать воз-
Снижение степени васкуляризации опухоли
БИОХИМИЯ том 88 вып. 6 2023
РЕКОМБИНАНТНЫЕ ОНКОЛИТИЧЕСКИЕ ШТАММЫ VV
1015
сопровождалось более быстрой её регресси-
Он в значительной мере способствует репли-
ей и зависело от дозы введённого вируса [35].
кации вируса за счёт активации сигнального
Gholami et al. разработали антиангиогенный
пути митоген-активируемой протеинкиназы
VV, экспрессирующий одноцепочечное нано-
(MAPK), зависимой от рецептора EGF. Уро-
антитело против VEGF. Этот вирус продемон-
вень экспрессии EGF практически во всех
стрировал шестикратное усиление регрессии
опухолевых клетках намного превышает тако-
опухоли в группе мышей с ортотопической мо-
вой в нормальных клетках. Делеция VGF в
делированной карциномой трипл-негативного
некоторой степени снижает репликацию ви-
рака молочной железы, получавших лечение,
руса, однако повышает его специфичность к
по сравнению с контрольной группой [36].
опухолевым клеткам [42]. Ещё один вирусный
белок, O1, помогает поддерживать MAPK-
зависимую передачу сигналов, инициирован-
РЕКОМБИНАНТНЫЕ ШТАММЫ
ную VGF. Предполагается, что белок О1 отве-
VV С ПОВЫШЕННОЙ
чает за остаточную вирусную патогенность,
ОНКОСЕЛЕКТИВНОСТЬЮ
наблюдаемую у мышей, инфицированных VV
с делецией VGF [43]. Поэтому ожидается, что
Большинство штаммов VV, одобренных
MAPK-зависимый рекомбинантный VV с де-
для применения в клинике и обладающих по-
лециями VGF и O1 будет существенно ослаб-
вышенной селективностью к опухолям, содер-
лен в нормальных клетках и сможет эффектив-
жат делецию гена J2R, кодирующего вирусную
но реплицироваться в опухолевых клетках с
тимидинкиназу (ТК). В нормальных клетках
повышенной активностью MAPK-зависимого
экспрессия тимидинкиназы происходит во вре-
сигнального пути [44].
мя S-фазы клеточного цикла. Однако в опухо-
Опухоли с активированными MAPK-зави-
левых клетках наблюдается повышенная экс-
симыми сигнальными путями являются под-
прессия этого фермента независимо от фазы
ходящими мишенями для сильно ослаблен-
клеточного цикла. Нарушение экспрессии ТК
ных штаммов VV. Например, аденокарцино-
в VV вынуждает вирус полагаться на внутри-
ма протоков поджелудочной железы (PDAC,
клеточные ТК, что приводит к его преимуще-
pancreatic ductal adenocarcinoma), один из наи-
ственной репликации в раковых клетках [37].
более агрессивных видов рака, обычно ха-
Нарушение открытой рамки считывания ТК
рактеризуется мутацией в четырёх значимых
удобно проводить с одновременной инсерци-
генах, связанных с MAPK-зависимым путём:
ей трансгенов в геном VV и дальнейшим отбо-
KRAS, TP53, CDKN2A и SMAD4 [45]. Консти-
ром рекомбинантных вариантов на клетках с
тутивно активированный KRAS увеличивает
делецией ТК, обработанных бромдезоксиури-
эндогенную экспрессию вышестоящего рецеп-
дином. Hung et al. показали, что нарушение
тора эпидермального фактора роста (EGFR,
гена тимидинкиназы путём встраивания гена
epidermal growth factor receptor) и запускает пе-
люциферазы в геном VV приводит к избира-
редачу сигналов нижестоящего MAPK-пути [46],
тельному заражению клеток рака яичников
что делает его идеальной мишенью для MAPK-
человека и мыши in vitro и in vivo, что вызы-
зависимых VV. В частности, для лечения PDAC
вает гибель опухолевых клеток и регрессию
был разработан MAPK-зависимый рекомбинант-
опухоли [38]. Два наиболее хорошо изучен-
ный VV, несущий суицидальный ген дрожжевой
ных штамма VV, а именно Pexa-Vec (JX-594)
цитозиндезаминазы. С помощью цитозинде-
и GL-ONC1, широко используемые в клини-
заминазы и урацилфосфорибозилтрансферазы
ческих испытаниях, характеризуются делеци-
нетоксичный 5-фторцитозин превращается в
ей TК [39, 40].
высокотоксичный 5-фторурацилмонофосфат,
Всесторонние исследования биологии VV
который, в свою очередь, образует 5-фторде-
выявили дополнительные факторы, повышаю-
зоксиуридинмонофосфат, являющийся конку-
щие его опухолевую селективность. В част-
рентным ингибитором тимидинсинтетазы,
ности, фактор роста VV (VGF, vaccinia growth
блокирующим синтез ДНК [47]. Системное
factor) является вирусным аналогом клеточ-
введение этого MAPK-зависимого VV пока-
ного эпидермального фактора роста (EGF,
зало высокую терапевтическую эффектив-
epidermal growth factor) [41]. VGF представ-
ность in vivo на мышиных моделях, что дела-
ляет собой секретируемый белок, продуцируе-
ет его перспективным агентом для терапии
мый на ранних стадиях вирусной инфекции.
PDAC [48].
При инфицировании клеток вирусом VV этот
Другим методом достижения надёжной
белок индуцирует митогены для праймиро-
избирательности VV в отношении опухоле-
вания соседних неинфицированных клеток.
вых клеток является делеция генов Spi-2/Spi-1.
БИОХИМИЯ том 88 вып. 6 2023
1016
ШАКИБА и др.
Это заменимые иммуномодулирующие гены
Помимо воспалительных реакций и высво-
VV с антиапоптотическими и противовоспа-
бождения неоантигенов в результате репли-
лительными свойствами. Они обладают сход-
кации этого вируса в TME, повышение IL-2
ной аминокислотной последовательностью с
увеличивало инфильтрацию опухоль-специфи-
серпинами (ингибиторы сериновых протеаз),
ческими Т-клетками, ограничивая при этом
противодействующими функционированию раз-
опасные для жизни побочные эффекты, свя-
личных каспаз организма-хозяина. Делеция
занные с системным введением интерлейки-
генов Spi-2/Spi-1 из генома VV делает вирус
нов. Scholl et al. описали аттенуированный
ослабленным в нормальных клетках, в то вре-
рекомбинантный штамм VV TG1031, экспрес-
мя как в раковых клетках он поддерживает
сирующий одновременно человеческий IL-2 и
репликацию и действует как мощный онко-
эпителиальный мембранный антиген муцин 1
литический агент [49, 50]. Legrand et al. пока-
(MUC1). Показана повышенная экспрессия
зали, что делеция Spi-2/Spi-1, сопровождаю-
MUC1 в большинстве опухолей молочной
щаяся экспрессией вирусного IFN-γ, улучшает
железы, в связи с чем этот белок представляет
индукцию иммунного ответа на введение VV и
собой потенциальную мишень для иммуноте-
предотвращает репликацию вируса в нормаль-
рапии. У пациентов с рецидивирующим раком
ных тканях, что делает такой вектор безопас-
молочной железы вакцинация этим вирусом
ным и эффективным [51].
стимулировала иммунную систему и приводи-
ла к регрессии опухолей [56].
IL-10. Интерлейкин-10 был впервые опи-
УСИЛЕННЫЕ ОНКОЛИТИЧЕСКИЕ
сан как фактор, продуцируемый Th2-клетками
РЕКОМБИНАНТНЫЕ ШТАММЫ VV,
(Т-хелперные клетки), ингибирующий про-
ЭКСПРЕССИРУЮЩИЕ ЦИТОКИНЫ
дукцию цитокина Th1. Это мощный ингиби-
тор противовирусного ответа с участием Т-кле-
Опухолевое микроокружение (TME) наи-
ток, предотвращающий активацию дендрит-
более злокачественных опухолей характеризу-
ных клеток (DC, dendritic cells) воспалительно-
ется высокой активностью иммуносупрессив-
го пути CD4+ Th1. Исторически IL-10 считался
ных факторов и отсутствием стимулирующих
иммунодепрессивным цитокином, усиливаю-
молекул, опухоль-специфических цитотокси-
щим ускользание опухолевых клеток из-под
ческих иммунных клеток и воспалительной
контроля иммунной системы [57]. Недавние
клеточной инфильтрации [52]. Реверсия этого
исследования показывают, что IL-10 играет
иммуносупрессивного TME в настоящее вре-
ключевую роль в установлении персистенции
мя является одной из основных задач иммуно-
вируса in vivo [58]. Оказалось, что этот цитокин
терапии опухолей. Репликация онколитиче-
обладает иммуностимулирующими и противо-
ского вируса в опухолевой ткани сама по себе
опухолевыми свойствами, включая актива-
приводит к мощному воспалению в TME, вы-
цию NK-клеток, ингибирование ангиогенеза,
зывая иммунный ответ. Предполагается, что
усиление инфильтрации макрофагов и пред-
если при этом использовать рекомбинантный
отвращение метастазирования [59]. В много-
штамм, экспрессирующий провоспалительные
численных доклинических и клинических ис-
цитокины, это ещё в большей степени будет
пытаниях была показана безопасность приме-
стимулировать иммунную систему организма-
нения IL-10 при лечении таких заболеваний,
хозяина к эффективному уничтожению опухо-
как хронический гепатит С, псориаз и болезнь
левых клеток [53] (табл. 1).
Крона, что делает его потенциально безопас-
IL-2. Интерлейкин-2 является мощным
ным инструментом для терапии рака
[60].
цитокином, который способен активировать
Сообщалось, что IL-10 улучшает терапевти-
Т-клетки и расширять их функции, активируя
ческую эффективность агентов на основе VV
противоопухолевый иммунитет. IL-2 содержит
в отношении опухолевых клеток мышей. Это
гликозилфосфатидилинозитоловый якорь с пеп-
связано с его способностью усиливать проли-
тидным линкером, презентирующий функ-
ферацию Т-клеток и его ролью в качестве хе-
циональный IL-2 на поверхности опухолевых
мотаксического агента для CD8+ Т-клеток [61].
клеток [54]. Liu et al. описали опухоль-селек-
Chard et al. получили реплицирующийся
тивный рекомбинантный VV (vvDD-IL-2-RG),
VV с удалённым геном ТК (штамм Lister), снаб-
вызывающий экспрессию мембраносвязанно-
жённый мышиным IL-10 (VVLΔTK-IL-10).
го IL-2 в инфицированных опухолевых клет-
Они протестировали его подкожное введе-
ках, и показали усиленный онколитический
ние на модели рака поджелудочной железы
эффект такого рекомбинантного VV на мо-
у трансгенных мышей. VVLΔTK-IL-10 про-
дели рака толстого кишечника у мышей [55].
демонстрировал более выраженную противо-
БИОХИМИЯ том 88 вып. 6 2023
РЕКОМБИНАНТНЫЕ ОНКОЛИТИЧЕСКИЕ ШТАММЫ VV
1017
опухолевую активность по сравнению с VV
цированные этим VV, в течение 3 дней проду-
без IL-10 (VVLΔTK), приводящую к практи-
цировали большое количество биологически
чески полной регрессии опухоли, значитель-
активного mIL-12. Чтобы вызвать образова-
ному увеличению продолжительности жизни
ние опухоли у мышей, они вводили инфици-
и выработке длительного противоопухолевого
рованные опухолевые клетки с этим рекомби-
иммунитета [62, 63]. Авторы утверждают, что
нантным вирусом, что значительно замедляло
гипоксия, связанная с агрессивным и рези-
появление опухолей и уменьшало их размер
стентным к лечению фенотипом протоковой
по сравнению с опухолями мышей, которым
аденокарциномы поджелудочной железы, не
вводили контрольный VV, не содержащий гена
приводила к ингибированию этого онколити-
mIL-12 [68].
ческого VV и может даже усиливать его актив-
IL-15. Интерлейкин-15 - цитокин, спо-
ность [63].
собствующий выживанию, пролиферации и
IL-12. Интерлейкин-12 привлёк большое
активации NK-клеток, CD8+ Т-клеток и мие-
внимание в области иммунотерапии благо-
лоидных DC CD56+. IL-15 может избирательно
даря своей важной роли в иммунной системе
стимулировать CD8+ T-клетки памяти. Несмо-
и противоопухолевой активности. В основ-
тря на то что этот цитокин является родствен-
ном IL-12 секретируется моноцитами и макро-
ным IL-2, в адаптивной иммунной системе он
фагами. Он активирует клеточный иммунитет
демонстрирует собственную активность [69].
за счёт повышения цитолитической актив-
Многочисленные исследования показывают,
ности NK-клеток, усиления специфических
что IL-15, экспрессируемый в TME, может
цитотоксических Т-клеточных ответов и отве-
ингибировать рост опухоли путем активации
тов аллореактивных лимфоцитов [64]. Кроме
Т-клеток [53, 70, 71]. Одним из уникальных
того, IL-12 индуцирует продукцию IFN лим-
свойств IL-15 является то, что его активность
фоцитами периферической крови и способ-
in vivo осуществляется через транспрезента-
ствует дифференцировке Т-клеток в клетки
цию. Это означает, что IL-15 представлен в
Th1, которые, в свою очередь, активируют
комплексе с α-субъединицей растворимого ре-
клеточно-опосредованный иммунитет
[65].
цептора IL-15 (IL-15Rα), нацеленном на клет-
Широко исследована противоопухолевая ак-
ки-мишени, такие как NK-, NKT- (Natural
тивность мышиного IL-12 (mIL-12). Систем-
Killer T, естественные киллеры Т) и Т-клетки,
ное введение рекомбинантного белка mIL-12
при этом не взаимодействуя напрямую с мем-
(rmIL-12) вызывает дозозависимое уменьше-
браносвязанным рецептором IL-15. На основе
ние метастазов меланомы B16 F10 и аденокар-
этой концепции были разработаны агонисты
циномы толстой кишки MC-38 [66]. Регрессия
IL-15, состоящие из IL-15 с частично или пол-
опухоли и повышение выживаемости мышей
ностью растворимым IL-15Rα для улучшения
наблюдались после локальной перитумораль-
его активности in vivo [72]. Растворимые ком-
ной инъекции mIL-12 в ксенотрансплантаты
плексы IL-15/IL-15Rα существенно повышают
карциномы яичника. Даже через месяц по-
время полужизни IL-15 и его биодоступность
сле образования опухоли, когда её диаметр
in vivo. Этот гибридный белок может активи-
составлял более 1,5 см, введение этого белка
ровать инфильтрированные в опухоли CD8+
приводило к полной регрессии опухоли [67].
T-клетки и способствовать разрушению уже
У мышей, которым делали инъекции клеток
образовавшихся опухолей [73].
меланомы BL-6, смешанных с секретирую-
Kowalsky et al. получили высокоспецифич-
щими белок mIL-12 фибробластами NIH3T3,
ный к опухолям онколитический штамм VV с
наблюдалась значительная задержка разви-
двойной делецией генов TK и VGF, экспрес-
тия опухоли. У мышей, иммунизированных
сирующий гибридный мышиный белок IL-15/
облучёнными опухолевыми клетками BL-6,
IL-15Rα (vvDD-IL15-Rα). Терапия мышей с
смешанными с теми же фибробластами, на-
раком яичника ID8 и аденокарциномой тол-
блюдалась значительная задержка появления
стой кишки MC38 с помощью этого реком-
пальпируемой опухоли после повторного зара-
бинантного VV продемонстрировала его значи-
жения родительскими онкогенными клетками
тельную противоопухолевую активность, уве-
BL-6, что позволяет предположить, что IL-12
личение продолжительности жизни мышей.
может вызвать специфический противоопухо-
Кроме того, этот рекомбинантный вирус моду-
левый иммунитет. Meko et al. сконструировали
лировал TME путём активации как Т-, так и
рекомбинантный нереплицирующийся штамм
NK-клеток [74].
VV, содержащий кодирующую последователь-
Цитокины с общей g-цепью, в том числе
ность mIL-12 в локусе гемагглютинина VV.
IL-15, IL-2, IL-7 и IL-21, вызывают экспрессию
Они показали, что опухолевые клетки, инфи-
белка запрограммированной смерти-1 (PD-1,
9
БИОХИМИЯ том 88 вып. 6 2023
1018
ШАКИБА и др.
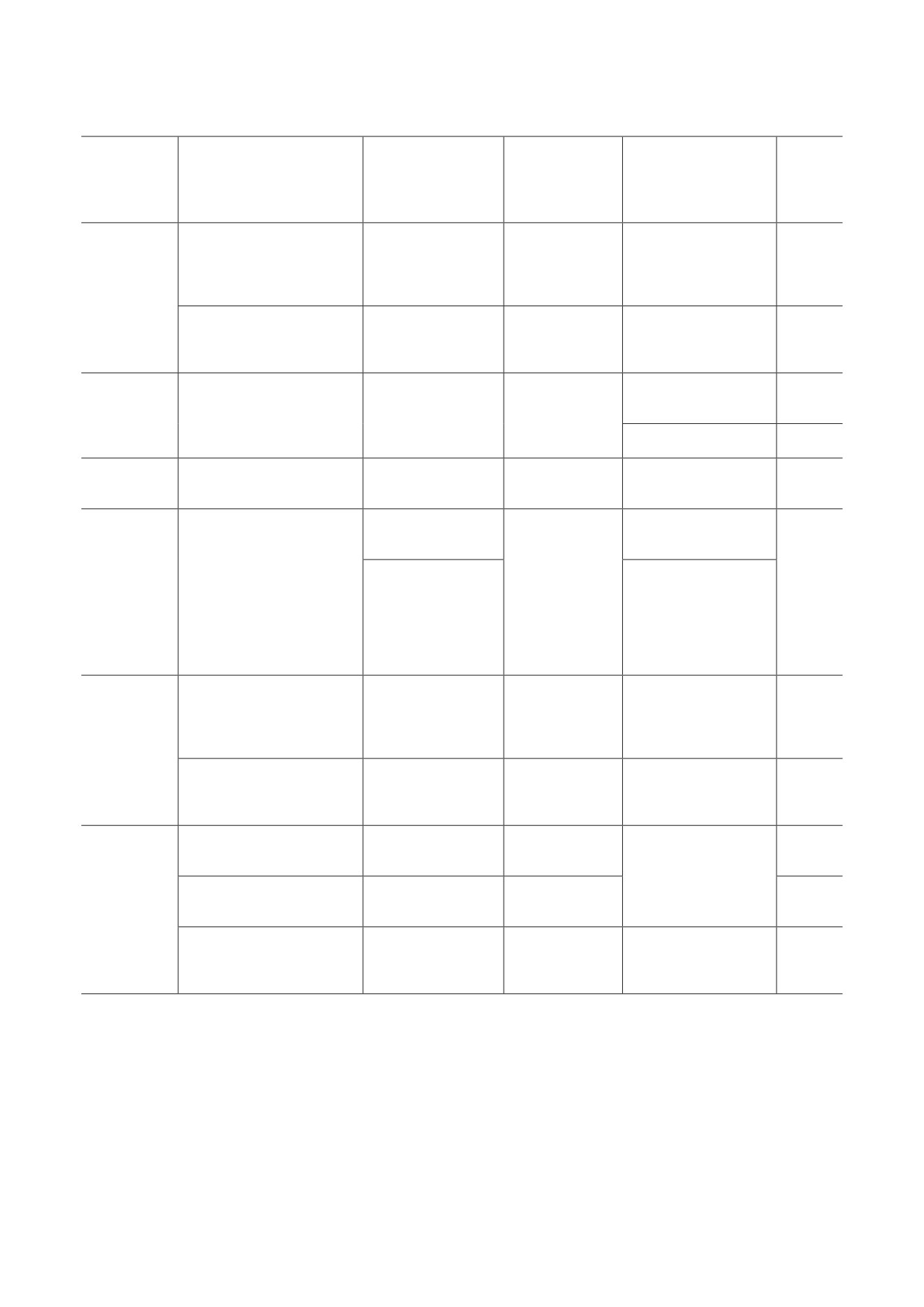
Таблица 1. Список рекомбинантных VV, экспрессирующих различные цитокины
Другие
Цитокины,
модификации
экспресси-
Варианты VV
Тип рака
Результат
Ссылки
генетического
руемые VV
материала
регрессия опухолей/
двойная делеция
рак толстой
активация опухоле-
vvDD-IL-2-RG
[55]
генов TK/VGF
кишки
специфичных
Т-клеток
IL-2
лечение рецидивов
рак молочной
TG1031
экспрессия MUC1
рака молочной
[56]
железы
железы
аденокарцинома
инфильтрация
[63]
протоков
макрофагов
IL-10
VVLΔTK-IL-10
делеция TK
поджелудочной
железы
элиминация опухолей
[62]
делеция
полная
IL-12
ivKT0327mIL-12
меланома
[68]
гемагглютинина
элиминация опухоли
двойная делеция
инфильтрация
генов TK/VGF
клеток CD8+
экспрессия
колоректальная
IL-15
vvDD-IL15-Rα
гибридного
карцинома
[74]
белка IL15/IL15-
рак яичников
регрессия опухолей
рецептор α
в сочетании
с терапией PD1
активация
меланома,
клеток CAR T;
rTTVΔTK-mIL-21
делеция TK
карцинома
[77]
инфильтрация
толстой кишки
NK-клеток
IL-21
делеция TK
VVΔTK-STCΔN1L-mIL-21
в сочетании
глиома
регрессия опухолей
[78]
с PD1-терапией
карцинома
rV-GM-CSF
делеция TK
привлечение
[87]
толстой кишки
NK-клеток, DC,
индукция опухоль-
карцинома
JX-594
делеция TK и VGF
специфичных CTLs
[86]
GM-CSF
яичников
глиобластома,
экспрессия
регрессия опухолей,
VV-GMCSF-Lact
рак молочной
[88, 92]
лактапина
усиленный апоптоз
железы
programmed death-1) и его лиганда (PD-L1) [75].
ками и NKT-клетками и выполняет различ-
Совместное применение блокады белка PD-1
ные функции в подавлении опухолей [76, 77].
и VV, снабжённого геном IL-15, значительно
Внутриопухолевое введение рекомбинантного
улучшало результаты терапии по сравнению
штамма Tian Tan VV, вооружённого мышиным
с группами, получавшими только анти-PD-1
IL-21 (rTTVΔTK-mIL-21), приводило к запуску
или vvDD-IL15-Rα [74].
системного ответа и значительной регрессии
IL-21. Интерлейкин-21 в основном се-
меланомы В16. У гуманизированных мышей
кретируется активированными CD4+ T-клет- с ксенографтами глиомы, меланомы или рака
БИОХИМИЯ том 88 вып. 6 2023
РЕКОМБИНАНТНЫЕ ОНКОЛИТИЧЕСКИЕ ШТАММЫ VV
1019
толстой кишки, VV, экспрессирующий IL-21
Помимо этого, коэкспрессия GM-CSF с
человека, продемонстрировал синергический
онкотоксическими молекулами, такими как
онколитический эффект в сочетании с CAR-T-
апоптин и лактоферрин, приводит к повыше-
клетками или инвариантными NK-клетками.
нию онколитической эффективности вирус-
Было показано, что рекомбинантный штамм
ных штаммов [88, 89]. Штамм Lister Москов-
Lister с IL21 (VVΔTK-STCΔN1L-mIL-21) в
ского института вирусных препаратов (LIVP)
комбинации с α-PD1 вызывает полную элими-
обладает высокой онколитической активно-
нацию глиомы GL261 после инъекции в опу-
стью [90]. В своей работе Grazhdantseva et al.
холь [78].
создали рекомбинантный VV на основе LIVP,
GM-CSF. GM-CSF, или колониестимули-
экспрессирующий GM-CSF человека и проду-
рующий фактор 2, представляет собой моно-
цирующий гликозилированную зрелую форму
мерный гликопротеиновый цитокин, проду-
этой молекулы в GM-CSF-зависимых клет-
цируемый Т-клетками, тучными клетками,
ках [91]. Кроме того, для повышения цито-
NK-клетками, эндотелиальными клетками,
токсичности этого варианта онкотоксической
макрофагами и фибробластами. GM-CSF яв-
молекулы в геном вируса был вставлен ген
ляется мощным индуктором специфического
лактаптина. Лактаптин представляет собой
и длительного противоопухолевого иммуни-
полипептид, полученный из грудного молока
тета, который может привлекать NK-клетки
человека, способный индуцировать апоптоз
и DC и индуцировать опухолеспецифические
в опухолевых клетках. Описанный штамм
цитотоксичные лимфоциты [79-85]. JX-594,
также содержал делецию ТК и VGF. Онко-
штамм Wyeth, экспрессирующий GM-CSF,
литическую эффективность этого реком-
вызывал положительную динамику и быстро
бинантного VV исследовали на мышиной
продвинулся в клинических испытаниях [39].
модели рака молочной железы, в качестве
Исследования клеточной линии злокаче-
контроля использовался штамм, кодирующий
ственной карциномы яичника, устойчивой к
только GM-CSF [88]. Также было показано
стандартной химиотерапии и вызывающей ги-
значительное онколитическое действие этого
перкальциемию, продемонстрировали её чув-
вируса на моделях глиобластомы человека.
ствительность к некоторым онколитическим
Данный штамм исследуется в первой фазе
вирусам, включая VV JX-594 [86]. Также был
клинических испытаний в России [92].
разработан другой рекомбинантный VV, несу-
щий ген белка GM-CSF (rV-GM-CSF). Инфи-
цирование этим рекомбинантным вирусом
ШТАММЫ VV,
линии клеток аденокарциномы толстой киш-
ЭКСПРЕССИРУЮЩИЕ ГЕНЫ
ки мыши MC-38 в конечном итоге привело к
ПОВЫШЕННОЙ ИММУНОГЕННОСТИ
подавлению роста первичной опухоли. Экс-
перименты с деплецией Т-клеток in vivo пока-
Вирусные штаммы семейства поксвирусов
зали, что подавление роста опухолевых клеток
зарекомендовали себя как эффективные и
после терапии rV-GM-CSF зависит от инфиль-
весьма безопасные индукторы Т- и В-клеточ-
трации Т-клеток CD4+ и CD8+ [87]. Хотя даль-
ного ответа. Лицензированная вакцина про-
нейшие исследования подтвердили, что инду-
тив оспы третьего поколения, MVA-BN®,
цированный иммунитет является длительным
являющаяся сильно аттенуированным орто-
и антиген-специфическим, подобный эффект
поксвирусом, демонстрирует превосходный
не наблюдался при инфицировании опухоле-
профиль безопасности и иммуногенность [93].
вых клеток МС-38 рекомбинантными штам-
Однако эффективность виротерапии с помо-
мами VV, экспрессирующими IL-2 или IL-6.
щью VV может сильно снижаться вследствие
Было показано, что паракринное высвобож-
активации иммунного ответа на собственные
дение мышиного GM-CSF опухолевыми клет-
антигены вирусного вектора. Особенно это
ками, инфицированными rV-GM-CSF, улуч-
касается VV, поскольку подавляющее боль-
шает внутреннюю иммуногенность мышиной
шинство людей старшего поколения были вак-
карциномы толстой кишки, приводя к анти-
цинированы VV в рамках программы ликви-
ген-специфическому Т-клеточному противо-
дации оспы [94]. Вирусные векторы на основе
опухолевому ответу, который останавливает
VV, экспрессирующие различные целевые ан-
образование первичной опухоли при повтор-
тигены, способны стимулировать усиленные
ной инокуляции клеток [87]. Таким образом,
клеточные и гуморальные иммунные ответы и
GM-CSF был описан как высокоэффективный
могут быть использованы как для разработки
вакцинный адъювант, обладающий значитель-
вакцин против инфекционных заболеваний,
ной противоопухолевой активностью.
так и для иммунотерапии рака [32] (табл. 2).
БИОХИМИЯ том 88 вып. 6 2023
9*
1020
ШАКИБА и др.
Кoстимулирующие молекулы. Одной из
лиферации Т-клеток и индукции CD8+ Т-кле-
стратегий повышения иммуногенности являет-
ток памяти. Онколитический VV, экспрессирую-
ся экспрессия с помощью VV-векторов белков,
щий 4-1BBL (rV-4-1BBL), обладал заметной
напрямую стимулирующих Т-клетки. Напри-
противоопухолевой активностью с увеличени-
мер, костимулирующая молекула B7.1 (CD80)
ем количества опухолевых антиген-специфич-
представляет собой интегральный мембран-
ных Т-клеток в TME на модели опухолевых
ный белок, обнаруживаемый на поверхности
ксенографтов у трансгенных мышей [99].
активированных антиген-презентирующих кле-
Флагеллин. Как только патогены дости-
ток. Когда на поверхности T-клеток проис-
гают поверхности слизистых оболочек, они
ходит связывание этой молекулы с белком
сталкиваются с первой линией защиты, пред-
CD152 или CD28, это служит костимулирую-
ставленной врождённой иммунной системой.
щим сигналом для повышения или снижения
Врождённый иммунитет активируется за счёт
активности Т-клеток
[95]. Было проведено
взаимодействия с кодируемыми зародышевой
несколько успешных исследований рекомби-
линией рецепторами распознавания образов
нантных штаммов VV, кодирующих иммунные
(PRR, pattern-recognition receptors), экспрес-
костимулирующие молекулы [96]. Hodge et al.
сируемыми на клетках врождённого имму-
показали, что терапия двумя штаммами VV,
нитета посредством уникальных микробных
один из которых экспрессировал канцеро-
компонентов, таких как PAMP, или DAMP
эмбриональный антиген (CEA, carcinoem-
(damage-associated molecular patterns) - эндо-
bryonic antigen), а другой - костимулирующую
генных молекулярных паттернов, связан-
молекулу B7.1, вызывала появление оптималь-
ных с повреждением. Семейства PRR вклю-
ных CEA-специфичных T-клеточных ответов
чают мембраносвязанные TLR (TLR1, 2, 4, 5,
и предотвращала возникновение CEA+ кар-
6 и 10) и эндосомальные TLR (TLR3, 7, 8, 9, 11,
циномы толстой кишки у мышей [97]. Позд-
12 и 13) рецепторы [51]. Первоначально сооб-
нее авторы разработали поксвирусный вектор
щалось, что бактериальный белок флагеллин
TRICOM, кодирующий три костимулирующие
связывает и активирует TLR5 на поверхности
молекулы: B7.1, ICAM (intercellular adhesion
DC, что приводит к миелоидно-зависимому
molecule, молекула межклеточной адгезии) и
высвобождению провоспалительных цитоки-
LFA-3 (lymphocyte function-associated antigen 3,
нов [100]. Позже было установлено, что цито-
антиген 3, ассоциированный с функцией лим-
зольный флагеллин также может восприни-
фоцитов). Было показано, что этот вектор вы-
маться NOD-подобными рецепторами NAIP5
зывает усиленную активацию Т-клеток по
и NLRC4, что приводит к образованию ин-
сравнению с клетками, инфицированными
фламмасомы [101].
аналогичным вирусом, кодирующим одну или
Флагеллин в настоящее время исследуется
две из этих костимулирующих молекул [98].
во многих вакцинах в качестве мощного адъю-
Иммуносупрессивное микроокружение опу-
ванта, включая вакцины для слизистых оболо-
холей вызывает локальную толерантность к
чек, используемые отдельно с антигеном или
Т-клеткам за счёт подавления костимулирую-
вводимые вместе в виде слитых белков [102].
щих молекул, таких как B7.1 (CD80). Были
Флагеллин использовался в качестве адъю-
проведены клинические испытания рекомби-
ванта при создании терапевтической вакцины
нантного VV, экспрессирующего B7.1, с уча-
против отдельных типов рака и продемонстри-
стием 12 пациентов с меланомой с использо-
ровал высокую эффективность на моделях ге-
ванием 2 различных доз вирусного препарата
нитального рака и мышиной меланомы [103].
(фаза I). У всех пациентов наблюдалось повы-
Помимо индукции врождённых иммунных
шение уровня антител и Т-клеток. Такое лече-
ответов, флагеллин влияет на адаптивный им-
ние хорошо переносилось, сообщалось лишь о
мунитет, индуцируя пролиферацию антиген-
случаях небольшого повышения температуры,
специфических CD4+ Т-клеток и активируя
боли в мышцах и утомляемости. У двух паци-
гуморальный ответ [104].
ентов наблюдалась стабилизация, а один па-
Sanos et al. разработали рекомбинантный
циент перенёс вакцинацию без осложнений и
штамм MVA, кодирующий флагеллин Salmo-
прожил более 59 месяцев после неё [96].
nella typhimurium. Авторы показали, что имму-
Другой важной для противоопухолевой ак-
низация этим вирусом системно усиливала
тивности костимулирующей молекулой явля-
гуморальный и клеточный иммунный ответ
ется гликозилированный мембранный белок
на участках слизистой оболочки. Он инду-
типа 1, называемый 4-1BBL, который связы-
цировал секрецию IL-1β и TNF-α на слизи-
вается с 4-1BB на активированных Т-клетках.
стых оболочках, что приводило к усилению
Белок 4-1BBL, в частности, необходим для про-
ответа IgA как при бронхоальвеолярном, так и
БИОХИМИЯ том 88 вып. 6 2023
РЕКОМБИНАНТНЫЕ ОНКОЛИТИЧЕСКИЕ ШТАММЫ VV
1021
при кишечном лаваже и активации миграции
ствовала лучшему выживанию животных с
CD8+ Т-клеток в мезентериальные лимфати-
экспериментальными аллографтами мелано-
ческие узлы [105].
мы B16 [111].
Колоректальный рак является одним из
Блокада иммунных контрольных точек.
самых распространённых и третьим по смерт-
В последние годы одной из активно развиваю-
ности злокачественным новообразованием в
щихся областей иммунотерапии рака стала раз-
мире [106]. Несмотря на разработку новых
работка ингибиторов иммунных контрольных
таргетных препаратов, общая пятилетняя вы-
точек. В особенности активно шёл поиск анти-
живаемость при колоректальном раке состав-
тел к PD1 - фактору программируемой кле-
ляет всего 46% [107]. Рекомбинантный покс-
точной смерти, имеющему два лиганда, PD-L1
вирус (на основе штамма вируса Tanapox),
и PD-L2, и CTLA-4 (Cytotoxic T-lymphocyte-
экспрессирующий флагеллин (кодируемый
associated protein 4) - гликопротеину цитоток-
геном fliC Salmonella enterica), вызывал регрес-
сических T-лимфоцитов-4. Сообщалось, что
сию ксенотрансплантатов колоректальной
экспрессия PD-1 повышается у мышей с депле-
карциномы HCT-116 человека у иммунодефи-
цией CD8+ T-клеток, инфицированных виру-
цитных бестимусных мышей [108]. В этом
сом лимфоцитарного хориоменингита, а блока-
эксперименте рекомбинантные вирусы имели
да PD-1/PD-L1 способствует активации CD8+
делецию гена 2L (кодирует TNF-связывающий
Т-клеток и снижает вирусную нагрузку [112].
белок), гена 66R (кодирует тимидинкиназу)
Был получен рекомбинантный штамм WR
или обоих генов сразу. Кроме того, штаммы
VV, экспрессирующий антитела к PD-1 чело-
экспрессировали мышиный гранулоцитарно-
века. Доклинические исследования на мышах
моноцитарный колониестимулирующий фак-
с моделированным раком молочной железы
тор (mGM-CSF), мышиный хемотаксический
и карциномы лёгкого показали, что такой VV
белок 1 (mCCL2/mMCP-1) или бактериаль-
повышает экспрессию IFN-γ и активирует опу-
ный флагеллин (FliC). Терапию проводили
холь-специфические цитотоксические Т-клет-
путем внутриопухолевой инъекции одного из
ки и, таким образом, представляет большой
этих рекомбинантных поксвирусов. Значи-
интерес для дальнейших клинических испыта-
тельная регрессия наблюдалась в опухолях, в
ний [113].
которые вводили штамм, экспрессирующий
CTLA-4, также известный как белок CD152,
флагеллин, с двойной делецией генов 2L и 66R
экспрессируется в основном регуляторными
(TPV/Δ2L/Δ66R/fliC). Авторы предполагают,
Т-клетками (Treg) и опосредует ослабление
что этот рекомбинантный вариант может быть
иммунного ответа, связываясь с белками CD86
эффективен и для терапии колоректального
или CD80 на поверхности антиген-презенти-
рака человека [108].
рующих клеток. Рекомбинантный VV BT-001,
Wang et al. разработали рекомбинантную
экспрессирующий рекомбинантный мышиный
противоопухолевую вакцину на основе виру-
анти-CTLA-4, оказался эффективным проти-
са осповакцины, экспрессирующую сурвивин
воопухолевым агентом, показавшим хороший
T34A (SurT24A) и флагеллин (FliC), на базе
эффект на животных моделях с имплантиро-
штамма WR VV [109]. Сурвивин (или Birc-5)
ванными опухолевыми клетками линий C38,
является членом семейства белков, ингиби-
CT26, A20 и EMT6. Анти-CTLA-4 уменьшал
рующих апоптоз, он может стимулировать
иммуносупрессивное действие Treg и, наряду
противоопухолевый цитотоксический Т-кле-
с экспрессией GM-CSF, позволил полностью
точный ответ [110]. В исследовании были про-
элиминировать опухоли у экспериментальных
демонстрированы терапевтические эффекты
животных [114].
SurT34A и показано усиление иммуногенности
Новой мишенью для стратегии ингиби-
FliC. Их комбинация в конечном итоге приве-
рования иммунных контрольных точек явля-
ла к синергическому усилению противоопухо-
ется TIGIT (T cell immunoreceptor with Ig and
левой активности в экспериментах на моделях
ITIM domains, Т-клеточный иммунорецептор
рака желудка [109].
с доменами Ig и ITIM), экспрессия которого
Нашей группой недавно был разработан
значительно повышена в опухолевых клетках.
рекомбинантный штамм LIVP VV, кодирую-
Иммунорецепторный ингибирующий мотив
щий субъединицу B флагеллина Vibrio vulnifi-
на основе тирозина (ITIM) представляет собой
cus, показавший усиленную регрессию опу-
консервативную последовательность амино-
холи на моделях мышей с меланомой B16.
кислот, обнаруженную на цитоплазматических
Онколитическая терапия этим штаммом повы-
доменах многих ингибирующих рецепторов
шала уровень TNF-α, GM-CSF, увеличива-
иммунных клеток, включая Т-клетки. Рецеп-
ла количество макрофагов в ТМE и способ-
торы, содержащие ITIM-домен, действуют как
БИОХИМИЯ том 88 вып. 6 2023
1022
ШАКИБА и др.
Таблица 2. Сведения о модификациях генома VV, направленных на усиление его онколитических свойств
Задействованные
Тип
Генетические
Описание
клетки иммунной
злокачественного
Результат
Ссылки
модификации
вариантов
системы
новообразования
усиленная активация
TRICOM;
Т-клеток, регрессия
экспрессия B7.1,
T-клетки
меланома
опухолей в фазе I
[96, 98]
ICAM и LFA-3
клинических
Экспрессия
испытаний
костимулирующих
молекул
повышение
уровня Т-клеток,
rV-4-1BBL;
CD8+ Т-клетки
карцинома
специфичных
[99]
экспрессия 4-1BBL
к опухолевым
антигенам, в TME
rMVA-fla;
кодирующий
рак желудочно-
CD8+ T-клетки
[105]
флагеллин
кишечного тракта
из S. typhimurium
IL-1β и TNF-α,
приводящие
TPV/Δ2L/Δ66R/fliC;
к повышению
Танапокс (Tanapox),
уровня ответа
экспрессирующий
иммуноглобулина G
Бактериальный
колоректальный
флагеллин
нейтрофилы
(IgG)2c и антител CTL
[108]
флагеллин
рак
из Salmonella
enterica/делеция
генов 2L и 66R
SurT24A;
cинергетическое
экспрессирующий
цитотоксические
рак желудка
привлечение Т-клеток,
[109]
сурвивин
Т-клетки
регрессия опухолей
и флагеллин (FliC)
ΔTK-Armed-VACV;
экспрессирующий
рак
цитотоксические
повышенный
человеческие
молочной железы/
[113]
Т-клетки
уровень IFN-γ
антитела
карцинома легких
против PD1
оптимизированная
BT-00;
активность
Блокада
карцинома
экспрессия антител
T-клетки
по удалению
[114]
иммунного
толстой кишки
против CTLA4
Treg/мыши на 100%
чекпойнта
свободные от опухолей
VV-α-TIGIT;
70% полной регрессии
экспрессирует
опухоли/ опухоль-
антитела против
гепатоцеллюляр-
CD8+ T-клетки
специфичная
[116]
иммуноглобулинов
ная карцинома
иммунологическая
Т-клеток
память
и домена ITIM
WR/TK-/MLKL;
надёжный иммунитет,
делеция TK
направленный против
CD8+ T-клетки
меланома
[119]
и экспрессия
неоэпитопов/гибели
Медиаторы
мышиных MLKL
иммуногенных клеток
некроптоза/
апоптоза
VVdGF-ApoS24/2;
делеция VGF
эпидермоидная
оказывает влияние
CD8+ T-клетки
[120, 121]
и экспрессия
карцинома
на путь апоптоза
апоптина
БИОХИМИЯ том 88 вып. 6
2023
РЕКОМБИНАНТНЫЕ ОНКОЛИТИЧЕСКИЕ ШТАММЫ VV
1023
врождённые ингибирующие рецепторы, вызы-
с ксенотрансплантированной эпидермоидной
вая негативную регуляцию на разных уров-
карциномой A431 человека. Авторы также по-
нях иммунного ответа [115]. Zuo et al. скон-
казали локализации этого рекомбинантного
струировали рекомбинантный онколитический
вируса в цитоплазме инфицированных клеток
штамм VV, кодирующий полное моноклональ-
и его влияние на путь апоптоза [121].
ное антитело к TIGIT (VV-α-TIGIT). Изучение
Дальнейшие модификации для повышения
противоопухолевой эффективности этого ви-
иммуногенности. Продукты некоторых вирус-
руса in vivo показало полную регрессию экспе-
ных генов, в том числе A49, A52, B15, K1 и K7,
риментальной гепатоцеллюлярной карцино-
ингибируют NF-κB-зависимые сигнальные пути
мы в 70%. Авторы показали, что VV-α-TIGIT
различными способами. Di Pilato et al. изучи-
способствовал привлечению активированных
ли влияние генов A52, B15 и K7, действующих
CD8+ T-клеток в TME. Более того, у излечен-
как ингибиторы NF-κB, на иммунную систему
ных животных не возникали опухоли при по-
мышей. Делеция этих генов приводит к запу-
вторном прививании опухолевых клеток, что
ску NF-κB при инфицировании клеток и про-
свидетельствовало о наличии у них долговре-
дукции провоспалительных цитокинов или
менной опухолеспецифической иммунологи-
хемокинов, которые рекрутируют нейтрофи-
ческой памяти [116].
лы (Nα и Nβ), DC и NK-клетки [122]. В дру-
Медиаторы некроптоза и апоптоза. Соглас-
гом исследовании было показано, что делеция
но современным взглядам на механизмы лече-
A44, A46 и C12 из генома MVA усиливает его
ния рака, гибель опухолевых клеток вследствие
иммуногенность с участием клеток врождён-
действия иммунной системы - например, не-
ного иммунитета и запускает специфический
кроптоз, сочетающий черты некроза и апоп-
Т-клеточный ответ [123]. Данные векторы ещё
тоза - является ключевым этапом противо-
не были протестированы на моделях опухолей,
опухолевого ответа [117]. Запуск некроптоза
но они могут быть потенциальными канди-
регулируется через фосфорилирование белка
датами для использования в онколитической
MLKL (mixed lineage kinase domain-like) после
виротерапии.
его прикрепления к плазматической мембране.
Другой стратегией повышения иммуноген-
Недавно было показано, что доставка мРНК,
ности вирусной терапии является использова-
кодирующей MLKL, внутрь опухоли способ-
ние метода гетерологичного прайм-бустинга
ствует формированию устойчивого противо-
путём применения двух несовпадающих покс-
опухолевого иммунитета в экспериментах на
вирусов. Например, использование комбина-
мышиных моделях
[118]. Заражение опухо-
ции векторов MVA и оспы птиц, экспресси-
левых клеток VV, экспрессирующим MLKL,
рующих два человеческих антигена, MUC1 и
приводило к гибели клеток in vitro в резуль-
CEA, наряду с TRICOM, привело к развитию
тате некроптоза. Впоследствии введение этого
специфического иммунного ответа против опу-
штамма в опухоль приводило к активации ин-
холевых антигенов [124].
тенсивного противоопухолевого Т-клеточного
Ещё одним интересным подходом явля-
ответа на опухолевые неоантигены и способ-
ется использование оболочечных онколити-
ствовало гибели инфицированных иммуно-
ческих вирусов, включая EEV-форму VV, для
генных раковых клеток in situ после заметного
расширения ответа на опухолевые антигены
улучшения противоопухолевой активности в
путём физического прикрепления опухоле-
моделях меланомы у мышей [119].
специфических пептидов, таких как эпитопы
Апоптин представляет собой богатый остат-
MHC класса I или II, к вирусной оболочке.
ками пролина неструктурный белок, выделен-
Например, эти покрытые пептидом оболочки
ный из вируса куриной анемии. Этот белок
VV вызывали сильный Т-клеточный специфи-
может индуцировать апоптоз в раковых клет-
ческий иммунный ответ на опухолевые анти-
ках и является новым противоопухолевым сред-
гены в моделях меланомы [125].
ством. Kochneva et al. сконструировали реком-
бинантный VV, имеющий делецию гена VGF
и экспрессирующий апоптин, вызывающий
СОЧЕТАНИЕ
апоптоз преимущественно в опухолевых клет-
ИСПОЛЬЗОВАНИЯ VV С ДРУГИМИ
ках. Исследования in vitro показали значитель-
ИММУНОТЕРАПЕВТИЧЕСКИМИ
ный цитолитический эффект этого штамма
ПОДХОДАМИ
на различных культурах опухолевых клеток
человека, включая A549, A431, U87MG, RD
Ген-направленная терапия с использовани-
и MCF7 [120]. Описанный вирусный штамм
ем пролекарств и ферментов. Ещё одним под-
вызывал резкую регрессию опухоли у мышей
ходом к усилению онколитического действия
БИОХИМИЯ том 88 вып. 6 2023
1024
ШАКИБА и др.
VV является терапия опухолей с использова-
сочетание с ингибиторами гистондеацетилазы
нием пролекарства и ген-специфичного фер-
(HDI, histone deacetylase inhibitors) способству-
мента (GDEPT, gene-directed enzyme prodrug
ет репликации вируса и повышает эффектив-
therapy). В этом случае нетоксичное проле-
ность терапии [128]. Дальнейшие исследова-
карство превращается в токсичное лекарство
ния показали, что HDI усиливает репликацию
уже внутри TME, убивая опухолевые клетки,
вируса и распространение онколитического VV
продуцирующие фермент. Кроме того, диф-
внутри опухоли за счёт снижения клеточного
фузия лекарства приводит к гибели клеток,
IFN-ответа и усиления вирус-индуцирован-
локализованных рядом с клетками, продуци-
ного апоптоза [129].
рующими ферменты, даже если они сами не
Francis et al. показали, что лечение онко-
экспрессируют белок, превращающий проле-
литическими VV совместно с коктейлем, со-
карство в лекарство. Ключевым ферментом в
стоящим из IFN-α, поли I: C и ингибитора
VV-опосредованном методе GDEPT является
COX-2, повышает экспрессию Th1-привлекаю-
цитозиндезаминаза в сочетании с
5-фтор-
щих хемокинов, снижает уровень Treg-при-
цитозином, которого нет в клетках млеко-
влекающих хемокинов (CCL22 и CXCL12) и
питающих [126]. Как уже упоминалось выше,
увеличивает количество опухоль-инфильтри-
это пролекарство под действием цитозинде-
рующих NK-клеток и CD8+ T-клеток в пре-
заминазы и урацилфосфорибозилтрансферазы
делах TME. Эта комбинация привела к долго-
превращается в токсичный для клеток про-
срочному выживанию мышей с карциномой
дукт
5-фторурацилмонофосфат
[47]. Такая
толстой кишки MC38 [130].
система в рекомбинантных штаммах VV про-
В другом исследовании комбинация пер-
демонстрировала лучшие терапевтические ре-
орального низкомолекулярного многоцеле-
зультаты, чем монотерапия онколитическими
вого ингибитора рецепторной тирозинкиназы
вирусами. Chalikonda et al. разработали ре-
(сунитиниба) с mpJX-594 VV показала, что ви-
комбинантный VV, который экспрессирует
рус нацеливается на кровеносные сосуды опу-
ген FCY1, кодирующий цитозиндезаминазу
холи, распространяясь в опухолевых клетках
из дрожжей Saccharomyces cerevisiae, с двой-
и вызывая их гибель, опосредованную CD8+
ной делецией генов TK и VGF. Этот реком-
T-клетками, активированными под влиянием
бинантный VV избирательно инфицировал
иммуномодулирующего действия сунитини-
опухоли яичников и вызывал их регрессию.
ба [131]. Эти исследования демонстрируют, что
Кроме того, сочетание этого VV с пролекар-
фармацевтические препараты в сочетании с
ством
5-фторцитозином привело к долго-
онколитическим вирусом могут регулировать
срочной выживаемости иммунокомпетентных
врождённый и адаптивный противоопухоле-
мышей, несущих опухоли. На этом основании
вый иммунный ответ в TME для достижения
можно предположить, что комбинированная
устойчивого терапевтического эффекта.
терапия с онколитическими вирусами явля-
Сочетание VV с химио- и радиотерапией.
ется многообещающим средством для лечения
Различные варианты использования онколи-
рака яичников [126]. Аналогичные результаты
тических вирусов в сочетании с химиотерапи-
были получены в другом исследовании по ле-
ей за счёт их взаимодополняющего действия
чению PDAC с использованием MAPK-зави-
стали новой платформой для повышения про-
симого VV, экспрессирующего суицидальный
тивоопухолевой эффективности
[132]. Кли-
ген цитозиндезаминазы дрожжей и ген ура-
нические испытания фазы I внутривенной
цилфосфорибозилтрансферазы [48].
инъекции штамма GL-ONC1 VV на пациентах
Другим пролекарством, используемым
с распространённым раком головы/шеи, про-
в этой области, является Seco-аналог, полу-
ходящих химиотерапию (с использованием
ченный из антибиотика дуокармицина SA.
цисплатина) и лучевую терапию, подтвердили
β-Галактозидаза переводит это пролекарство в
безопасность и эффективность этого лечения.
токсичную форму. Лечение рекомбинантным
Это дало возможность проводить испытания
VV, экспрессирующим β-галактозидазу, в соче-
фазы II [133]. Исследования фазы II комби-
тании с Seco-аналогом оказало положительное
нированного лечения штаммом VV TG4010
влияние на животных моделях рака молочной
с химиотерапией у пациентов с немелкокле-
железы [127].
точным раком лёгких на стадии III/IV пока-
Сочетание с лекарствами. Для повышения
зало значительную регрессию опухоли и уве-
эффективности виротерапии могут исполь-
личение показателей выживаемости
[134].
зоваться фармацевтические препараты, спо-
По-видимому, эффективность химиотерапии
собные влиять на регуляцию врождённой или
повышается в присутствии иммунотерапии
адаптивной иммунной системы. Например,
VV за счёт усиления опухолевых антиген-
БИОХИМИЯ том 88 вып. 6 2023
РЕКОМБИНАНТНЫЕ ОНКОЛИТИЧЕСКИЕ ШТАММЫ VV
1025
специфичных CD8+ Т-клеток, праймируемых
Кроме того, сочетание рекомбинантных VV
введением VV [135]. Кроме того, применение
с этими ингибирующими препаратами даёт
метода высокодозной стереотаксической луче-
оптимальный иммунный ответ против опу-
вой терапии в режиме гипофракционирова-
холей. Например, введение ранее упомяну-
ния (SBRT, hypofractionated stereotactic body
того vvDD-IL-2-RG с антителами, блокирую-
radiotherapy) вместе с VV усиливало противо-
щими иммунную контрольную точку PD-1/
опухолевый эффект in vivo и повышало проти-
PD-L1, приводило к регрессии запущенных
воопухолевое действие Т-клеток [136].
опухолей у большинства мышей [55]. А вве-
Сочетание VV с другими иммунотерапевти-
дение TG4010, хорошо изученного варианта
ческими подходами. Чтобы усилить иммуно-
MVA, экспрессирующего человеческий MUC1
стимулирующие эффекты VV, многие иссле-
и IL-2, в сочетании с лигандом TLR9 [141] и
дователи комбинируют вирусы с агонистами
блокадой PD-1 специфическим антагонистом
иммунных костимулирующих молекул или
обеспечивало оптимальные терапевтические
антагонистами иммунных коингибирующих
результаты в клинических и доклинических
молекул (например, ингибиторами иммунных
исследованиях [142].
контрольных точек) или другими методами
Foy et al. исследовали влияние комбинации
иммунотерапии. Одной из стратегий коррек-
блокады CTLA-4 с рекомбинантным модифи-
ции иммунотерапии является использование
цированным MVA, снабжённым внеклеточным
режима немиелоаблативной лимфодеплеции
доменом рецептора 2 эпидермального фактора
организма-хозяина перед клеточной терапией
роста человека (MVA-BN-HER2). Противо-
рака, такой как терапия CAR-T или адоптив-
опухолевую эффективность MVA-BN-HER2
ная Т-клеточная терапия. Обычно эта про-
отдельно или в сочетании с блокадой CTLA-4
цедура включает короткий курс химиотерапии
оценивали на моделях мышей с метастазами
для уничтожения Т-клеток [137]. Kim et al. ис-
в лёгкие. MVA-BN-HER2 значительно повы-
пользовали лимфодеплецию организма-хозяи-
шал общую выживаемость мышей по сравне-
на в качестве дополнения к иммунотерапии с
нию с контролем (без лечения) или только с
использованием VV. Они сконструировали VV,
блокадой CTLA-4, что сопровождалось зна-
экспрессирующий белок суперсемейства TNF,
чительной инфильтрацией опухоли CTLs и
названный 4-1BBL (rV-4-1BBL), в качестве
коэкспрессией TNF-α и IFN-γ. Кроме того,
костимулирующей молекулы, и оценили его
комбинация с блокадой CTLA-4 значительно
онколитическую активность в сочетании с ме-
усиливала HER2-специфичные Т-клеточные
тодом лимфодеплеции на моделях меланомы.
ответы с высокой долей коэкспрессии TNF-α
Поскольку лимфодеплеция блокирует ответ
и IL-2 с IFN-γ. При этом индуцируемый бе-
антител против вируса, выживаемость вируса
лок-костимулятор Т-клеток (ICOS) экспрес-
в TME увеличивается, что приводит к значи-
сировался на эффекторных Т-клетках CD4+ и
тельному повышению его противоопухолевой
CD8+, но не на регуляторных Т-клетках (Treg).
активности [138].
Напротив, контрольные мыши, не получав-
Как обсуждалось ранее, блокада иммун-
шие лечения или получавшие только блокаду
ных контрольных точек играет важную роль в
CTLA-4, имели повышенный уровень ICOS+
иммунотерапии. Например, ипилимумаб, гума-
Treg - фенотип, связанный с высокой супрес-
низированное моноклональное антитело, спе-
сией TME [143, 144].
цифичное к CTLA-4, является первым одоб-
ренным FDA (Управлением по санитарному
надзору за качеством пищевых продуктов и
ВЫВОДЫ
медикаментов) препаратом из нового класса
иммунотерапии рака. Ипилимумаб увеличи-
VV, являющийся первым онколитическим
вает среднюю общую выживаемость пациен-
вирусом, широко изученным в клинических
тов с метастатической меланомой и вызывает
испытаниях, демонстрирует многообещающие
стойкую регрессию опухоли [139]. Кроме того,
терапевтические результаты. За последнее де-
ниволумаб является первым человеческим мо-
сятилетие с помощью различных биоинженер-
ноклональным антителом IgG4 против PD-1.
ных подходов получено большое количество
Клинические испытания ниволумаба у паци-
его рекомбинантных штаммов с улучшенной
ентов с прогрессирующей неоперабельной
онколитической активностью. Модификации
метастатической меланомой продемонстриро-
VV включают экспрессию проапоптотических
вали удовлетворительные результаты с мень-
молекул, усиливающих прямое цитопати-
шим количеством токсических побочных эф-
ческое действие вируса на опухоль, факто-
фектов по сравнению с химиотерапией [140].
ров, усиливающих онкоселективность, или
БИОХИМИЯ том 88 вып. 6 2023
1026
ШАКИБА и др.
иммуномодулирующих белков, усиливающих
ние рукописи. В.П. Баклаушев, П.М. Чумаков,
противоопухолевый иммунный ответ. Весьма
А.В. Липатова - редактирование рукописи.
перспективно комбинирование онколити-
Финансирование. Работа выполнена при
ческой виротерапии с другими иммунотера-
поддержке Российского научного фонда (грант
певтическими подходами, обеспечивающими
№ 20-75-10157). Часть работы, связанная с
снижение гуморального ответа на вирусные
анализом сочетания лечения с онколитиче-
антигены и индукцию противоопухолевых ци-
скими вирусами и другими иммунотерапевти-
тотоксических лимфоцитов.
ческими подходами, была поддержана Россий-
ским научным фондом (грант № 22-64-00057).
Вклад авторов. Я. Шакиба - концепция
Конфликт интересов. Авторы заявляют об
обзора, анализ литературы, написание руко-
отсутствии конфликта интересов.
писи. Я. Шакиба, П.О. Воробьев, М. Махмуд,
Соблюдение этических норм. Данная статья
А. Хамад, Д.В. Кочетков, Г.М. Юсубалиева,
не содержит описания исследований с участи-
А.В. Липатова - анализ литературы и написа-
ем людей или животных.
СПИСОК ЛИТЕРАТУРЫ
1.
Carter, G. C., Law, M., Hollinshead, M., and
are differentially required for replication and patho-
Smith, G. L. (2005) Entry of the vaccinia virus in-
genesis, PLoS Pathog., 6, e1000984, doi: 10.1371/
tracellular mature virion and its interactions with
journal.ppat.1000984.
glycosaminoglycans, J. Gen. Virol., 86, 1279-1290,
12.
Wang, L. C., Lynn, R. C., Cheng, G., Alexander, E.,
doi: 10.1099/vir.0.80831-0.
Kapoor, V., Moon, E. K., Sun, J., Fridlender, Z. G.,
2.
Roberts, K. L., and Smith, G. L. (2008) Vaccinia virus
Isaacs, S. N., Thorne, S. H., and Albelda, S. M. (2012)
morphogenesis and dissemination, Trends Microbiol.,
Treating tumors with a vaccinia virus expressing IFNβ
16, 472-479, doi: 10.1016/j.tim.2008.07.009.
illustrates the complex relationships between oncolytic
3.
Levaditi, C., and Nicolau, S. (1922) On the culture of
ability and immunogenicity, Mol. Ther., 20, 736-748,
the vaccinal virus in epithelial neoplasia [in French],
doi: 10.1038/mt.2011.228.
CR Soc. Biol., 86, 928.
13.
Thorne, S. H.
(2012) Next-generation oncolytic
4.
Guse, K., Cerullo, V., and Hemminki, A. (2011) On-
vaccinia vectors, Methods Mol. Biol., 797, 205-215,
colytic vaccinia virus for the treatment of cancer,
doi: 10.1007/978-1-61779-340-0_14.
Expert Opin. Biol. Ther., 11, 595-608, doi: 10.1517/
14.
Smith, G. L., Benfield, C. T. O., Maluquer de
14712598.2011.558838.
Motes, C., Mazzon, M., Ember, S. W. J., Ferguson,
5.
Schlom, J. (2012) Therapeutic cancer vaccines: current
B. J., and Sumner, R. P. (2013) Vaccinia virus im-
status and moving forward, J. Natl. Cancer Inst.,
mune evasion: mechanisms, virulence and immuno-
104, 599-613, doi: 10.1093/jnci/djs033.
genicity, J. Gen. Virol., 94, 2367-2392, doi: 10.1099/
6.
Fenner, F. (1989) Risks and benefits of vaccinia
vir.0.055921-0.
vaccine use in the worldwide smallpox eradication
15.
Hu, W., Wang, G., Huang, D., Sui, M., and Xu, Y.
campaign, Res. Virol.,
140,
465-466; discussion
(2019) Cancer immunotherapy based on natural killer
487-491, doi: 10.1016/s0923-2516(89)80126-8.
cells: current progress and new opportunities, Front.
7.
Fenner, F. (1993) Smallpox: emergence, global spread,
Immunol., 10, 1205, doi: 10.3389/fimmu.2019.01205.
and eradication, Hist. Philos. Life Sci., 15, 397-420.
16.
Kirwan, S., Merriam, D., Barsby, N., McKinnon, A.,
8.
Thorne, S. H., Bartlett, D. L., and Kirn, D. H. (2005)
and Burshtyn, D. N. (2006) Vaccinia virus mod-
The use of oncolytic vaccinia viruses in the treatment
ulation of natural killer cell function by direct in-
of cancer: a new role for an old ally? Curr. Gene Ther.,
fection, Virology,
347,
75-87, doi:
10.1016/j.virol.
5, 429-443, doi: 10.2174/1566523054546215.
2005.11.037.
9.
Hermiston, T. (2000) Gene delivery from replication-
17.
Chisholm, S. E., and Reyburn, H. T. (2006) Recog-
selective viruses: arming guided missiles in the war
nition of vaccinia virus-infected cells by human nat-
against cancer, J. Clin. Invest., 105, 1169-1172, doi:
ural killer cells depends on natural cytotoxicity recep-
10.1172/JCI9973.
tors, J. Virol., 80, 2225-2233, doi: 10.1128/JVI.80.5.
10.
Thorne, S. H., Hwang, T. H., and Kirn, D. H. (2005)
2225-2233.2006.
Vaccinia virus and oncolytic virotherapy of cancer,
18.
Benfield, C. T. O., Ren, H., Lucas, S. J., Bahsoun, B.,
Curr. Opin. Mol. Ther., 7, 359-365.
and Smith, G. L. (2013) Vaccinia virus protein K7
11.
Gammon, D. B., Gowrishankar, B., Duraffour, S.,
is a virulence factor that alters the acute immune
Andrei, G., Upton, C., and Evans, D. H. (2010) Vac-
response to infection, J. Gen. Virol., 94, 1647-1657,
cinia virus-encoded ribonucleotide reductase subunits
doi: 10.1099/vir.0.052670-0.
БИОХИМИЯ том 88 вып. 6 2023
РЕКОМБИНАНТНЫЕ ОНКОЛИТИЧЕСКИЕ ШТАММЫ VV
1027
19.
Li, F., Sheng, Y., Hou, W., Sampath, P., Byrd, D.,
30.
Symons, J. A., Adams, E., Tscharke, D. C., Reading,
Thorne, S., and Zhang, Y.
(2020) CCL5-armed
P. C., Waldmann, H., and Smith, G. L.
(2002)
oncolytic virus augments CCR5-engineered NK cell
The vaccinia virus C12L protein inhibits mouse
infiltration and antitumor efficiency, J. Immunother.
IL-18 and promotes virus virulence in the murine
Cancer, 8, e000131, doi: 10.1136/jitc-2019-000131.
intranasal model, J. Gen. Virol.,
83,
2833-2844,
20.
Karupiah, G., Coupar, B. E., Andrew, M. E., Boyle,
doi: 10.1099/0022-1317-83-11-2833.
D. B., Phillips, S. M., Mullbacher, A., Blanden, R. V.,
31.
Alcamí, A., Symons, J. A., Collins, P. D., Williams,
and Ramshaw, I. A. (1990) Elevated natural killer cell
T. J., and Smith, G. L. (1998) Blockade of chemokine
responses in mice infected with recombinant vaccinia
activity by a soluble chemokine binding protein from
virus encoding murine IL-2, J. Immunol., 144, 290-298.
vaccinia virus, J. Immunol., 160, 624-633.
21.
McKenzie, R., Kotwal, G. J., Moss, B., Hammer,
32.
Lehmann, M. H., Kastenmuller, W., Kandemir, J. D.,
C. H., and Frank, M. M. (1992) Regulation of com-
Brandt, F., Suezer, Y., and Sutter, G. (2009) Modified
plement activity by vaccinia virus complement-control
vaccinia virus ankara triggers chemotaxis of monocytes
protein, J. Infect. Dis., 166, 1245-1250, doi: 10.1093/
and early respiratory immigration of leukocytes
infdis/166.6.1245.
by induction of CCL2 expression, J. Virol.,
83,
22.
Girgis, N. M., Dehaven, B. C., Xiao, Y., Alexander,
2540-2552, doi: 10.1128/JVI.01884-08.
E., Viner, K. M., and Isaacs, S. N. (2011) The Vaccinia
33.
Alejo, A., Ruiz-Argüello, M. B., Ho, Y., Smith, V. P.,
virus complement control protein modulates adaptive
Saraiva, M., and Alcami, A. (2006) A chemokine-
immune responses during infection, J. Virol., 85,
binding domain in the tumor necrosis factor receptor
2547-2556, doi: 10.1128/JVI.01474-10.
from variola (smallpox) virus, Proc. Natl. Acad. Sci.
23.
Isaacs, S. N., Kotwal, G. J., and Moss, B. (1992)
USA, 103, 5995-6000, doi: 10.1073/pnas.0510462103.
Vaccinia virus complement-control protein prevents
34.
Ylosmaki, E., and Cerullo, V. (2020) Design and
antibody-dependent complement-enhanced neutral-
application of oncolytic viruses for cancer immu-
ization of infectivity and contributes to virulence,
notherapy, Curr. Opin. Biotechnol., 65, 25-36, doi:
Proc. Natl. Acad. Sci. USA, 89, 628-632, doi: 10.1073/
10.1016/j.copbio.2019.11.016.
pnas.89.2.628.
35.
Guse, K., Sloniecka, M., Diaconu, I., Ottolino-
24.
Jefferson, A., Cadet, V. E., and Hielscher, A. (2015)
Perry, K., Tang, N., Ng, C., Le Boeuf, F., Bell, J. C.,
The mechanisms of genetically modified vaccinia
McCart, J. A., Ristimäki, A., Pesonen, S., Cerullo, V.,
viruses for the treatment of cancer, Crit. Rev. Oncol.
and Hemminki, A. (2010) Antiangiogenic arming of an
Hematol.,
95,
407-416, doi:
10.1016/j.critrevonc.
oncolytic vaccinia virus enhances antitumor efficacy
2015.04.001.
in renal cell cancer models, J. Virol., 84, 856-866,
25.
Thorne, S. H. (2011) Immunotherapeutic potential of
doi: 10.1128/JVI.00692-09.
oncolytic vaccinia virus, Immunol. Res., 50, 286-293,
36.
Gholami, S., Marano, A., Chen, N. G., Aguilar, R. J.,
doi: 10.1007/s12026-011-8211-4.
Frentzen, A., Chen, C. H., Lou, E., Fujisawa, S.,
26.
Bowie, A., Kiss-Toth, E., Symons, J. A., Smith, G. L.,
Eveno, C., Belin, L., Zanzonico, P., Szalay, A., and
Dower, S. K., and O’Neill, L. A. (2000) A46R and
Fong, Y. (2014) A novel vaccinia virus with dual
A52R from vaccinia virus are antagonists of host IL-1
oncolytic and anti-angiogenic therapeutic effects
and toll-like receptor signaling, Proc. Natl. Acad. Sci.
against triple-negative breast cancer, Breast Cancer
USA, 97, 10162-10167, doi: 10.1073/pnas.160027697.
Res. Treat.,
148,
489-499, doi:
10.1007/s10549-
27.
Alcami, A., Symons, J. A., and Smith, G. L. (2000)
014-3180-7.
The vaccinia virus soluble alpha/beta interferon (IFN)
37.
Moss, B. (1996) Genetically engineered poxviruses
receptor binds to the cell surface and protects cells
for recombinant gene expression, vaccination, and
from the antiviral effects of IFN, J. Virol., 74, 11230-
safety, Proc. Natl. Acad. Sci. USA, 93, 11341-11348,
11239, doi: 10.1128/jvi.74.23.11230-11239.2000.
doi: 10.1073/pnas.93.21.11341.
28.
Kirn, D. H., Wang, Y., Le Boeuf, F., Bell, J., and
38.
Hung, C. F., Tsai, Y. C., He, L., Coukos, G., Fodor, I.,
Thorne, S. H. (2007) Targeting of interferon-beta
Qin, L., Levitsky, H., and Wu, T. C. (2007) Vaccinia
to produce a specific, multi-mechanistic oncolytic
virus preferentially infects and controls human and
vaccinia virus, PLoS Med., 4, e353, doi: 10.1371/
murine ovarian tumors in mice, Gene Ther., 14, 20-29,
journal.pmed.0040353.
doi: 10.1038/sj.gt.3302840.
29.
Gerlic, M., Faustin, B., Postigo, A., Yu, E. C., Proell, M.,
39.
Heo, J., Reid, T., Ruo, L., Breitbach, C. J., Rose, S.,
Gombosuren, N., Krajewska, M., Flynn, R., Croft, M.,
Bloomston, M., Cho, M., Lim, H. Y., Chung, H. C.,
Way, M., Satterthwait, A., Liddington, R. C., Salek-
Kim, C. W., Burke, J., Lencioni, R., Hickman, T.,
Ardakani, S., Matsuzawa, S., and Reed, J. C. (2013)
Moon, A., Lee, Y. S., Kim, M. K., Daneshmand, M.,
Vaccinia virus F1L protein promotes virulence by
Dubois, K., Longpre, L., Ngo, M., et al.
(2013)
inhibiting inflammasome activation, Proc. Natl.
Randomized dose-finding clinical trial of oncolytic
Acad. Sci. USA,
110,
7808-7813, doi:
10.1073/
immunotherapeutic vaccinia JX-594 in liver cancer,
pnas.1215995110.
Nat. Med., 19, 329-336, doi: 10.1038/nm.3089.
БИОХИМИЯ том 88 вып. 6 2023
1028
ШАКИБА и др.
40.
Mori, K. M., Giuliano, P. D., Lopez, K. L., King,
genes SPI-1 and SPI-2, Cancer Res., 65, 9991-9998,
M. M., Bohart, R., and Goldstein, B. H. (2019) Pro-
doi: 10.1158/0008-5472.CAN-05-1630.
nounced clinical response following the oncolytic vac-
51.
Legrand, F. A., Verardi, P. H., Chan, K. S., Peng, Y.,
cinia virus GL-ONC1 and chemotherapy in a heavily
Jones, L. A., and Yilma, T. D.
(2005) Vaccin-
pretreated ovarian cancer patient, Anticancer Drugs,
ia viruses with a serpin gene deletion and express-
30, 1064-1066, doi: 10.1097/CAD.0000000000000836.
ing IFN-gamma induce potent immune responses
41.
McCart, J. A., Ward, J. M., Lee, J., Hu, Y., Alexander,
without detectable replication in vivo, Proc. Natl.
H. R., Libutti, S. K., Moss, B., and Bartlett, D. L.
Acad. Sci. USA, 102, 2940-2945, doi: 10.1073/pnas.
(2001) Systemic cancer therapy with a tumor-selective
0409846102.
vaccinia virus mutant lacking thymidine kinase and vac-
52.
Sharma, P., Hu-Lieskovan, S., Wargo, J. A., and
cinia growth factor genes, Cancer Res., 61, 8751-8757.
Ribas, A. (2017) Primary, adaptive, and acquired
42.
Buller, R. M., Chakrabarti, S., Cooper, J. A.,
resistance to cancer immunotherapy, Cell, 168, 707-
Twardzik, D. R., and Moss, B. (1988) Deletion of
723, doi: 10.1016/j.cell.2017.01.017.
the vaccinia virus growth factor gene reduces virus
53.
Pearl, T. M., Markert, J. M., Cassady, K. A., and
virulence, J. Virol., 62, 866-874, doi: 10.1128/JVI.
Ghonime, M. G. (2019) Oncolytic virus-based cyto-
62.3.866-874.1988.
kine expression to improve immune activity in brain
43.
Schweneker, M., Lukassen, S., Späth, M.,
and solid tumors, Mol. Ther. Oncolytics, 13, 14-21,
Wolferstätter, M., Babel, E., Brinkmann, K., Wielert,
doi: 10.1016/j.omto.2019.03.001.
U., Chaplin, P., Suter, M., and Hausmann, J. (2012)
54.
Yang, J. C., Sherry, R. M., Steinberg, S. M., Topalian,
The vaccinia virus O1 protein is required for sustained
S. L., Schwartzentruber, D. J., Hwu, P., Seipp, C. A.,
activation of extracellular signal-regulated kinase 1/2
Rogers-Freezer, L., Morton, K. E., White, D. E.,
and promotes viral virulence, J. Virol., 86, 2323-2336,
Liewehr, D. J., Merino, M. J., and Rosenberg, S. A.
doi: 10.1128/JVI.06166-11.
(2003) Randomized study of high-dose and low-
44.
Wee, P., and Wang, Z. (2017) Epidermal growth factor
dose interleukin-2 in patients with metastatic renal
receptor cell proliferation signaling pathways, Cancers
cancer, J. Clin. Oncol., 21, 3127-3132, doi: 10.1200/
(Basel), 9, 52, doi: 10.3390/cancers9050052.
JCO.2003.02.122.
45.
Li, S., Balmain, A., and Counter, C. M.
(2018)
55.
Liu, Z., Ge, Y., Wang, H., Ma, C., Feist, M., Ju, S.,
A model for RAS mutation patterns in cancers:
Guo, Z. S., and Bartlett, D. L. (2018) Modifying
finding the sweet spot, Nat. Rev. Cancer, 18, 767-777,
the cancer-immune set point using vaccinia virus
doi: 10.1038/s41568-018-0076-6.
expressing re-designed interleukin-2, Nat. Commun.,
46.
Yuan, T. L., Amzallag, A., Bagni, R., Yi, M., Afghani, S.,
9, 4682, doi: 10.1038/s41467-018-06954-z.
Burgan, W., Fer, N., Strathern, L. A., Powell, K.,
56.
Scholl, S., Squiban, P., Bizouarne, N., Baudin, M.,
Smith, B., Waters, A. M., Drubin, D., Thomson, T.,
Acres, B., Von Mensdorff-Pouilly, S., Shearer, M.,
Liao, R., Greninger, P., Stein, G. T., Murchie, E.,
Beuzeboc, P., Van Belle, S., Uzielly, B., Pouillart, P.,
Cortez, E., Egan, R. K., Procter, L., et al. (2018)
Taylor-Papadimitriou, J., and Miles, D.
(2003)
Differential effector engagement by oncogenic KRAS,
Metastatic breast tumour regression following
Cell Rep,
22,
1889-1902, doi:
10.1016/j.celrep.
treatment by a gene-modified vaccinia virus expressing
2018.01.051.
MUC1 and IL-2, J. Biomed. Biotechnol., 2003, 194-
47.
Gopinath, P., and Ghosh, S. S. (2008) Implication of
201, doi: 10.1155/S111072430320704X.
functional activity for determining therapeutic efficacy
57.
Yigit, R., Massuger, L. F., Figdor, C. G., and
of suicide genes in vitro, Biotechnol. Lett., 30, 1913-
Torensma, R. (2010) Ovarian cancer creates a sup-
1921, doi: 10.1007/s10529-008-9787-1.
pressive microenvironment to escape immune elim-
48.
Kurosaki, H., Nakatake, M., Sakamoto, T., Kuwano, N.,
ination, Gynecol. Oncol., 117, 366-372, doi: 10.1016/
Yamane, M., Ishii, K., Fujiwara, Y., and Nakamura, T.
j.ygyno.2010.01.019.
(2021) Anti-tumor effects of MAPK-dependent
58.
Brooks, D. G., Trifilo, M. J., Edelmann, K. H.,
tumor-selective oncolytic vaccinia virus armed with
Teyton, L., McGavern, D. B., and Oldstone, M. B.
CD/UPRT against pancreatic ductal adenocarcinoma
(2006) Interleukin-10 determines viral clearance
in mice, Cells, 10, 985, doi: 10.3390/cells10050985.
or persistence in vivo, Nat. Med., 12, 1301-1309,
49.
Guo, H., Callaway, J. B., and Ting, J. P. (2015) In-
doi: 10.1038/nm1492.
flammasomes: mechanism of action, role in dis-
59.
Stearns, M. E., Wang, M., Hu, Y., Garcia, F. U.,
ease, and therapeutics, Nat. Med.,
21,
677-687,
and Rhim, J. (2003) Interleukin 10 blocks matrix
doi: 10.1038/nm.3893.
metalloproteinase-2 and membrane type
1-matrix
50.
Guo, Z. S., Naik, A., O’Malley, M. E., Popovic, P.,
metalloproteinase synthesis in primary human prostate
Demarco, R., Hu, Y., Yin, X., Yang, S., Zeh, H. J.,
tumor lines, Clin. Cancer Res., 9, 1191-1199.
Moss, B., Lotze, M. T., and Bartlett, D. L. (2005)
60.
Schock, S. N., Chandra, N. V., Sun, Y., Irie, T.,
The enhanced tumor selectivity of an oncolytic
Kitagawa, Y., Gotoh, B., Coscoy, L., and Winoto, A.
vaccinia lacking the host range and antiapoptosis
(2017) Induction of necroptotic cell death by viral
БИОХИМИЯ том 88 вып. 6 2023
РЕКОМБИНАНТНЫЕ ОНКОЛИТИЧЕСКИЕ ШТАММЫ VV
1029
activation of the RIG-I or STING pathway, Cell Death
J. Interferon Cytokine Res., 39, 6-21, doi: 10.1089/
Differ., 24, 615-625, doi: 10.1038/cdd.2016.153.
jir.2018.0019.
61.
Emmerich, J., Mumm, J. B., Chan, I. H., LaFace, D.,
71.
Rhode, P. R., Egan, J. O., Xu, W., Hong, H., Webb,
Truong, H., McClanahan, T., Gorman, D. M., and
G. M., Chen, X., Liu, B., Zhu, X., Wen, J., You, L.,
Oft, M. (2012) IL-10 directly activates and expands
Kong, L., Edwards, A. C., Han, K., Shi, S., Alter, S.,
tumor-resident CD8+ T cells without de novo in-
Sacha, J. B., Jeng, E. K., Cai, W., and Wong, H. C.
filtration from secondary lymphoid organs, Can-
(2016) Comparison of the superagonist complex,
cer Res.,
72,
3570-3581, doi:
10.1158/0008-5472.
ALT-803, to IL15 as cancer immunotherapeutics in
CAN-12-0721.
animal models, Cancer Immunol. Res., 4, 49-60, doi:
62.
Tanaka, F., Tominaga, K., Shiota, M., Ochi, M.,
10.1158/2326-6066.CIR-15-0093-T.
Kuwamura, H., Tanigawa, T., Watanabe, T., Fujiwara, Y.,
72.
Van den Bergh, J. M., Lion, E., Van Tendeloo, V. F.,
Oshitani, N., Higuchi, K., Iwao, H., and Arakawa,
and Smits, E. L. (2017) IL-15 receptor alpha as the
T. (2008) Interleukin-10 gene transfer to peritoneal
magic wand to boost the success of IL-15 antitumor
mesothelial cells suppresses peritoneal dissemination
therapies: the upswing of IL-15 transpresentation,
of gastric cancer cells due to a persistently high
Pharmacol. Ther.,
170,
73-79, doi:
10.1016/
concentration in the peritoneal cavity, Cancer Gene
j.pharmthera.2016.10.012.
Ther., 15, 51-59, doi: 10.1038/sj.cgt.7701104.
73.
Epardaud, M., Elpek, K. G., Rubinstein, M. P.,
63.
Chard, L. S., Maniati, E., Wang, P., Zhang, Z.,
Yonekura, A. R., Bellemare-Pelletier, A., Bronson, R.,
Gao, D., Wang, J., Cao, F., Ahmed, J., El Khouri, M.,
Hamerman, J. A., Goldrath, A. W., and Turley, S. J.
Hughes, J., Wang, S., Li, X., Denes, B., Fodor, I.,
(2008) Interleukin-15/interleukin-15R alpha com-
Hagemann, T., Lemoine, N. R., and Wang, Y.
plexes promote destruction of established tumors
(2015) A vaccinia virus armed with interleukin-10 is a
by reviving tumor-resident CD8+ T cells, Can-
promising therapeutic agent for treatment of murine
cer Res.,
68,
2972-2983, doi:
10.1158/0008-5472.
pancreatic cancer, Clin. Cancer Res., 21, 405-416,
CAN-08-0045.
doi: 10.1158/1078-0432.CCR-14-0464.
74.
Kowalsky, S. J., Liu, Z., Feist, M., Berkey, S. E.,
64.
Trinchieri, G., and Scott, P. (1994) The role of in-
Ma, C., Ravindranathan, R., Dai, E., Roy, E. J.,
terleukin 12 in the immune response, disease and
Guo, Z. S., and Bartlett, D. L. (2018) Superagonist
therapy, Immunol. Today, 15, 460-463, doi: 10.1016/
IL-15-armed oncolytic virus elicits potent antitumor
0167-5699(94)90189-9.
immunity and therapy that are enhanced with PD-1
65.
Scott, P. (1993) IL-12: initiation cytokine for cell-
blockade, Mol. Ther., 26, 2476-2486, doi: 10.1016/
mediated immunity, Science,
260,
496-497, doi:
j.ymthe.2018.07.013.
10.1126/science.8097337.
75.
Kinter, A. L., Godbout, E. J., McNally, J. P., Sereti,
66.
Nastala, C. L., Edington, H. D., McKinney, T. G.,
I., Roby, G. A., O’Shea, M. A., and Fauci, A. S.
Tahara, H., Nalesnik, M. A., Brunda, M. J., Gately,
(2008) The common gamma-chain cytokines IL-2,
M. K., Wolf, S. F., Schreiber, R. D., and Storkus, W. J.
IL-7, IL-15, and IL-21 induce the expression of
(1994) Recombinant IL-12 administration induces
programmed death-1 and its ligands, J. Immunol., 181,
tumor regression in association with IFN-gamma
6738-6746, doi: 10.4049/jimmunol.181.10.6738.
production, J. Immunol., 153, 1697-1706.
76.
Moroz, A., Eppolito, C., Li, Q., Tao, J., Clegg, C. H.,
67.
Mu, J., Zou, J. P., Yamamoto, N., Tsutsui, T., Tai,
and Shrikant, P. A. (2004) IL-21 enhances and sus-
X. G., Kobayashi, M., Herrmann, S., Fujiwara, H.,
tains CD8+ T cell responses to achieve durable tumor
and Hamaoka, T. (1995) Administration of recombi-
immunity: comparative evaluation of IL-2, IL-15,
nant interleukin 12 prevents outgrowth of tumor cells
and IL-21, J. Immunol., 173, 900-909, doi: 10.4049/
metastasizing spontaneously to lung and lymph nodes,
jimmunol.173.2.900.
Cancer Res., 55, 4404-4408.
77.
Chen, T., Ding, X., Liao, Q., Gao, N., Chen, Y.,
68.
Meko, J. B., Tsung, K., and Norton, J. A. (1996)
Zhao, C., Zhang, X., and Xu, J. (2021) IL-21 arming
Cytokine production and antitumor effect of a
potentiates the anti-tumor activity of an oncolytic
nonreplicating, noncytopathic recombinant vaccinia
vaccinia virus in monotherapy and combination
virus expressing interleukin-12, Surgery, 120, 274-
therapy, J. Immunother. Cancer, 9, e001647, doi:
282; discussion
282-273, doi:
10.1016/s0039-6060
10.1136/jitc-2020-001647.
(96)80298-4.
78.
Sun, Y., Zhang, Z., Zhang, C., Zhang, N., Wang, P.,
69.
Waldmann, T. A. (2015) The shared and contrasting
Chu, Y., Chard Dunmall, L. S., Lemoine, N. R.,
roles of IL2 and IL15 in the life and death of normal
and Wang, Y.
(2022) An effective therapeu-
and neoplastic lymphocytes: implications for cancer
tic regime for treatment of glioma using onco-
therapy, Cancer Immunol. Res.,
3,
219-227, doi:
lytic vaccinia virus expressing IL-21 in combi-
10.1158/2326-6066.CIR-15-0009.
nation with immune checkpoint inhibition, Mol.
70.
Conlon, K. C., Miljkovic, M. D., and Waldmann,
Ther. Oncolytics, 26, 105-119, doi: 10.1016/j.omto.
T. A. (2019) Cytokines in the treatment of cancer,
2022.05.008.
БИОХИМИЯ том 88 вып. 6 2023
1030
ШАКИБА и др.
79.
Gasson, J. C.
(1991) Molecular physiology of
mal Langerhans cells, J. Exp. Med., 166, 1484-1498,
granulocyte-macrophage colony-stimulating factor,
doi: 10.1084/jem.166.5.1484.
Blood, 77, 1131-1145.
87.
McLaughlin, J. P., Abrams, S., Kantor, J., Dobrzanski,
80.
Bauer, T. V., Tregubchak, T. V., Maksyutov, A. Z.,
M. J., Greenbaum, J., Schlom, J., and Greiner,
Kolosova, I. V., Maksyutov, R. A., and Gavrilova,
J. W. (1997) Immunization with a syngeneic tumor
E. V. (2020) Development of the drug oncolytic
infected with recombinant vaccinia virus expressing
immunotherapy based on vaccinia viruses (Vaccinia
granulocyte-macrophage colony-stimulating factor
virus, Orthopoxvirus, Chordopoxvirinae, Poxviridae)
(GM-CSF) induces tumor regression and long-lasting
against breast cancer [in Russian], Vopr. Virusol., 65,
systemic immunity, J. Immunother., 20, 449-459,
49-56, doi: 10.36233/0507-4088-2020-65-1-49-56.
doi: 10.1097/00002371-199711000-00004.
81.
Deng, L., Yang, X., Fan, J., Ding, Y., Peng, Y.,
88.
Kochneva, G., Sivolobova, G., Tkacheva, A.,
Xu, D., Huang, B., and Hu, Z. (2020) An oncolytic
Grazhdantseva, A., Troitskaya, O., Nushtaeva, A.,
vaccinia virus armed with GM-CSF and IL-24 double
Tkachenko, A., Kuligina, E., Richter, V., and Koval, O.
genes for cancer targeted therapy, Onco Targets Ther.,
(2016) Engineering of double recombinant vaccinia
13, 3535-3544, doi: 10.2147/OTT.S249816.
virus with enhanced oncolytic potential for solid tumor
82.
Duggan, M. C., Jochems, C., Donahue, R. N.,
virotherapy, Oncotarget, 7, 74171-74188, doi: 10.18632/
Richards, J., Karpa, V., Foust, E., Paul, B.,
oncotarget.12367.
Brooks, T., Tridandapani, S., Olencki, T., Pan, X.,
89.
Koval, O., Kochneva, G., Tkachenko, A., Troitskaya, O.,
Lesinski, G. B., Schlom, J., and Carson III, W. E.
Sivolobova, G., Grazhdantseva, A., Nushtaeva, A.,
(2016) A phase I study of recombinant (r) vaccinia-
Kuligina, E., and Richter, V. (2017) Recombinant vac-
CEA(6D)-TRICOM and rFowlpox-CEA(6D)-TRICOM
cinia viruses coding transgenes of apoptosis-inducing
vaccines with GM-CSF and IFN-alpha-2b in patients
proteins enhance apoptosis but not immunogenicity of
with CEA-expressing carcinomas, Cancer Immunol.
infected tumor cells, Biomed Res. Int., 2017, 3620510,
Immunother., 65, 1353-1364, doi: 10.1007/s00262-
doi: 10.1155/2017/3620510.
016-1893-7.
90.
Shakiba, Y., Naberezhnaya, E., Kochetkov, D.,
83.
Heinrich, B., Klein, J., Delic, M., Goepfert, K.,
Yusubalieva, G., Vorobyev, P., Chumakov, P.,
Engel, V., Geberzahn, L., Lusky, M., Erbs, P., Pre-
Baklaushev, V., and Lipatova, A. (2023) Comparison
ville, X., and Moehler, M. (2017) Immunogenicity of
of the oncolytic activity of recombinant vaccinia virus
oncolytic vaccinia viruses JX-GFP and TG6002 in a
strains LIVP-RFP and MVA-RFP against solid tumors,
human melanoma in vitro model: studying immuno-
Bull. RSMU, 2023, doi: 10.24075/brsmu.2023.010.
genic cell death, dendritic cell maturation and interac-
91.
Grazhdantseva, A. A., Sivolobova, G. F., Tkacheva,
tion with cytotoxic T lymphocytes, Onco Targets Ther.,
A. V., Gileva, I. P., Kuligina, E. V., Rikhter, V. A., and
10, 2389-2401, doi: 10.2147/OTT.S126320.
Kochneva, G. V. (2016) Highly effective production
84.
Inoue, T., Byrne, T., Inoue, M., Tait, M. E.,
of biologically active, secreted, human granulocyte-
Wall, P., Wang, A., Dermyer, M. R., Laklai, H.,
macrophage colony-stimulating factor by recombinant
Binder, J. J., Lees, C., Hollingsworth, R., Maru-
vaccinia virus, Appl. Biochem. Microbiol., 52, 685-691,
ri-Avidal, L., Kirn, D. H., and McDonald, D. M.
doi: 10.1134/S0003683816070036.
(2021) Oncolytic vaccinia virus gene modifica-
92.
Vasileva, N., Ageenko, A., Dmitrieva, M., Nushtaeva, A.,
tion and cytokine expression effects on tumor in-
Mishinov, S., Kochneva, G., Richter, V., and
fection, immune response, and killing, Mol. Can-
Kuligina, E. (2021) Double recombinant vaccinia
cer Ther., 20, 1481-1494, doi: 10.1158/1535-7163.
virus: a candidate drug against human glioblastoma,
MCT-20-0863.
Life (Basel), 11, 1084, doi: 10.3390/life11101084.
85.
Kannanganat, S., Wyatt, L. S., Gangadhara, S.,
93. Von Krempelhuber, A., Vollmar, J., Pokorny, R.,
Chamcha, V., Chea, L. S., Kozlowski, P. A.,
Rapp, P., Wulff, N., Petzold, B., Handley, A.,
LaBranche, C. C., Chennareddi, L., Lawson, B.,
Mateo, L., Siersbol, H., Kollaritsch, H., and
Reddy, P. B., Styles, T. M., Vanderford, T. H.,
Chaplin, P. (2010) A randomized, double-blind, dose-
Montefiori, D. C., Moss, B., Robinson, H. L., and
finding Phase II study to evaluate immunogenicity
Amara, R. R. (2016) High doses of GM-CSF inhibit
and safety of the third generation smallpox vaccine
antibody responses in rectal secretions and diminish
candidate IMVAMUNE, Vaccine,
28,
1209-1216,
modified vaccinia Ankara/Simian immunodeficiency
doi: 10.1016/j.vaccine.2009.11.030.
virus vaccine protection in TRIM5alpha-restrictive
94. Verardi, P. H., Titong, A., and Hagen, C. J. (2012)
macaques, J. Immunol., 197, 3586-3596, doi: 10.4049/
A vaccinia virus renaissance: new vaccine and immu-
jimmunol.1600629.
notherapeutic uses after smallpox eradication, Hum.
86.
Witmer-Pack, M. D., Olivier, W., Valinsky, J.,
Vaccin Immunother., 8, 961-970, doi: 10.4161/hv.21080.
Schuler, G., and Steinman, R. M. (1987) Granulocyte/
95. Collins, M., Ling, V., and Carreno, B. M. (2005) The
macrophage colony-stimulating factor is essential for
B7 family of immune-regulatory ligands, Genome
the viability and function of cultured murine epider-
Biol., 6, 223, doi: 10.1186/gb-2005-6-6-223.
БИОХИМИЯ том 88 вып. 6 2023
РЕКОМБИНАНТНЫЕ ОНКОЛИТИЧЕСКИЕ ШТАММЫ VV
1031
96. Kaufman, H. L., Deraffele, G., Mitcham, J.,
Hochrein, H., and Lauterbach, H. (2017) NLRC4
Moroziewicz, D., Cohen, S. M., Hurst-Wicker, K. S.,
inflammasome-driven immunogenicity of a recombi-
Cheung, K., Lee, D. S., Divito, J., Voulo, M.,
nant MVA mucosal vaccine encoding flagellin, Front.
Donovan, J., Dolan, K., Manson, K., Panicali, D.,
Immunol., 8, 1988, doi: 10.3389/fimmu.2017.01988.
Wang, E., Hörig, H., and Marincola, F. M. (2005)
106. Chen, W., Zheng, R., Zhang, S., Zhao, P., Li, G.,
Targeting the local tumor microenvironment with
Wu, L., and He, J.
(2013) The incidences and
vaccinia virus expressing B7.1 for the treatment
mortalities of major cancers in China, 2009, Chin. J.
of melanoma, J. Clin. Invest.,
115,
1903-1912,
Cancer, 32, 106-112, doi: 10.5732/cjc.013.10018.
doi: 10.1172/JCI24624.
107. Strong, V. E., Wu, A. W., Selby, L. V., Gonen, M.,
97. Hodge, J. W., McLaughlin, J. P., Abrams, S. I.,
Hsu, M., Song, K. Y., Park, C. H., Coit, D. G., Ji,
Shupert, W. L., Schlom, J., and Kantor, J. A. (1995)
J. F., and Brennan, M. F. (2015) Differences in gastric
Admixture of a recombinant vaccinia virus containing
cancer survival between the U.S. and China, J. Surg.
the gene for the costimulatory molecule B7 and a
Oncol., 112, 31-37, doi: 10.1002/jso.23940.
recombinant vaccinia virus containing a tumor-
108. Conrad, S. J., El-Aswad, M., Kurban, E., Jeng, D.,
associated antigen gene results in enhanced specific
Tripp, B. C., Nutting, C., Eversole, R., Mackenzie, C.,
T-cell responses and antitumor immunity, Cancer Res.,
and Essani, K. (2015) Oncolytic tanapoxvirus express-
55, 3598-3603.
ing FliC causes regression of human colorectal cancer
98. Hodge, J. W., Sabzevari, H., Yafal, A. G., Gritz, L.,
xenografts in nude mice, J. Exp. Clin. Cancer Res.,
Lorenz, M. G., and Schlom, J. (1999) A triad of
34, 19, doi: 10.1186/s13046-015-0131-z.
costimulatory molecules synergize to amplify T-cell
109. Wang, M., Luo, Y., Sun, T., Mao, C., Jiang, Y.,
activation, Cancer Res., 59, 5800-5807.
Yu, X., Li, Z., Xie, T., Wu, F., Yan, H., and Teng, L.
99. Kudo-Saito, C., Hodge, J. W., Kwak, H., Kim-
(2020) The ectopic expression of survivinT34A and
Schulze, S., Schlom, J., and Kaufman, H. L. (2006)
FilC can enhance the oncolytic effects of vaccinia
4-1BB ligand enhances tumor-specific immunity
virus in murine gastric cancer, Onco Targets Ther., 13,
of poxvirus vaccines, Vaccine,
24,
4975-4986,
1011-1025, doi: 10.2147/OTT.S230902.
doi: 10.1016/j.vaccine.2006.03.042.
110. Andersen, M. H., Svane, I. M., Becker, J. C., and
100. Hayashi, F., Smith, K. D., Ozinsky, A., Hawn, T. R.,
Straten, P. T. (2007) The universal character of the
Yi, E. C., Goodlett, D. R., Eng, J. K., Akira, S.,
tumor-associated antigen survivin, Clin. Cancer Res.,
Underhill, D. M., and Aderem, A. (2001) The innate
13, 5991-5994, doi: 10.1158/1078-0432.CCR-07-0686.
immune response to bacterial flagellin is mediated
111. Shakiba, Y., Vorobyev, P. O., Naumenko, V. A.,
by Toll-like receptor
5, Nature,
410,
1099-1103,
Kochetkov, D. V., Zajtseva, K. V., Valikhov, M. P.,
doi: 10.1038/35074106.
Yusubalieva, G. M., Gumennaya, Y. D., Emelyanov,
101. Kofoed, E. M., and Vance, R. E. (2011) Innate
E. A., Semkina, A. S., Baklaushev, V. P., Chumakov,
immune recognition of bacterial ligands by NAIPs
P. M., and Lipatova, A. V. (2023) Oncolytic efficacy of
determines inflammasome specificity, Nature, 477,
a recombinant vaccinia virus strain expressing bacterial
592-595, doi: 10.1038/nature10394.
flagellin in solid tumor models, Viruses, 15, 828.
102. Weimer, E. T., Lu, H., Kock, N. D., Wozniak, D. J.,
112. Barber, D. L., Wherry, E. J., Masopust, D., Zhu, B.,
and Mizel, S. B. (2009) A fusion protein vaccine
Allison, J. P., Sharpe, A. H., Freeman, G. J., and
containing OprF epitope 8, OprI, and type A and B
Ahmed, R. (2006) Restoring function in exhausted
flagellins promotes enhanced clearance of nonmucoid
CD8 T cells during chronic viral infection, Nature,
Pseudomonas aeruginosa, Infect. Immun., 77, 2356-
439, 682-687, doi: 10.1038/nature04444.
2366, doi: 10.1128/IAI.00054-09.
113. Shi, Z., Liu, B., Huang, C., Xie, W., Cen, Y.,
103. De Melo, F. M., Braga, C. J., Pereira, F. V., Maricato,
Chen, L., and Liang, M. (2021) An oncolytic vaccinia
J. T., Origassa, C. S., Souza, M. F., Melo, A. C.,
virus armed with anti-human-PD-1 antibody and
Silva, P., Tomaz, S. L., Gimenes, K. P., Scutti, J. A.,
anti-human-4-1BB antibody double genes for cancer-
Juliano, M. A., Zamboni, D. S., Câmara, N. O.,
targeted therapy, Biochem. Biophys. Res. Commun.,
Travassos, L. R., Ferreira, L. C., and Rodrigues,
559, 176-182, doi: 10.1016/j.bbrc.2021.04.078.
E. G. (2015) Anti-metastatic immunotherapy based
114. Marchand, J.-B., Semmrich, M., Fend, L., Rehn, M.,
on mucosal administration of flagellin and immu-
Silvestre, N., Teige, I., Foloppe, F., Mårtensson, L.,
nomodulatory P10, Immunol. Cell Biol., 93, 86-98,
Quéméneur, E., and Frendeus, B. (2020) BT-001, an
doi: 10.1038/icb.2014.74.
oncolytic vaccinia virus armed with a Treg-depletion-
104. Mizel, S. B., and Bates, J. T. (2010) Flagellin as an
optimized recombinant human anti-CTLA4 antibody
adjuvant: cellular mechanisms and potential, J. Immu-
and GM-CSF to target the tumor microenvironment,
nol., 185, 5677-5682, doi: 10.4049/jimmunol.1002156.
Cancer Res., 8, doi: 10.1136/jitc-2020-SITC2020.0594.
105. Sanos, S. L., Kassub, R., Testori, M., Geiger, M.,
115. Dushek, O., Goyette, J., and van der Merwe, P. A.
Pätzold, J., Giessel, R., Knallinger, J., Bathke, B.,
(2012) Non-catalytic tyrosine-phosphorylated receptors,
Gräbnitz, F., Brinkmann, K., Chaplin, P., Suter, M.,
Immunol Rev, 250, 258-276, doi: 10.1111/imr.12008.
БИОХИМИЯ том 88 вып. 6 2023
1032
ШАКИБА и др.
116. Zuo, S., Wei, M., He, B., Chen, A., Wang, S., Kong, L.,
human costimulatory molecules, Clin. Cancer Res., 11,
Zhang, Y., Meng, G., Xu, T., Wu, J., Yang, F.,
1597-1607, doi: 10.1158/1078-0432.CCR-04-1609.
Zhang, H., Wang, S., Guo, C., Wu, J., Dong, J., and
125. Ylösmäki, E., Malorzo, C., Capasso, C., Honkasalo, O.,
Wei, J. (2021) Enhanced antitumor efficacy of a novel
Fusciello, M., Martins, B., Ylösmäki, L., Louna, A.,
oncolytic vaccinia virus encoding a fully monoclonal
Feola, S., Paavilainen, H., Peltonen, K., Hukkanen, V.,
antibody against T-cell immunoglobulin and ITIM
Viitala, T., and Cerullo, V. (2018) Personalized cancer
domain (TIGIT), EBioMedicine, 64, 103240, doi:
vaccine platform for clinically relevant oncolytic
10.1016/j.ebiom.2021.103240.
enveloped viruses, Mol. Ther., 26, 2315-2325, doi:
117. Galluzzi, L., Buqué, A., Kepp, O., Zitvogel, L., and
10.1016/j.ymthe.2018.06.008.
Kroemer, G. (2017) Immunogenic cell death in cancer
126. Chalikonda, S., Kivlen, M. H., O’Malley, M. E., Eric
and infectious disease, Nat. Rev. Immunol., 17, 97-111,
Dong, X. D., McCart, J. A., Gorry, M. C., Yin, X. Y.,
doi: 10.1038/nri.2016.107.
Brown, C. K., Zeh, H. J., Guo, Z. S., and Bartlett,
118. Van Hoecke, L., Van Lint, S., Roose, K., Van Parys, A.,
D. L. (2008) Oncolytic virotherapy for ovarian carci-
Vandenabeele, P., Grooten, J., Tavernier, J., De
nomatosis using a replication-selective vaccinia virus
Koker, S., and Saelens, X. (2018) Treatment with
armed with a yeast cytosine deaminase gene, Cancer
mRNA coding for the necroptosis mediator MLKL
Gene Ther., 15, 115-125, doi: 10.1038/sj.cgt.7701110.
induces antitumor immunity directed against neo-
127. Seubert, C. M., Stritzker, J., Hess, M., Donat, U.,
epitopes, Nat. Commun., 9, 3417, doi: 10.1038/s41467-
Sturm, J. B., Chen, N., von Hof, J. M., Krewer, B.,
018-05979-8.
Tietze, L. F., Gentschev, I., and Szalay, A. A. (2011)
119. Van Hoecke, L., Riederer, S., Saelens, X., Sutter, G.,
Enhanced tumor therapy using vaccinia virus strain
and Rojas, J. J. (2020) Recombinant viruses delivering
GLV-1h68 in combination with a β-galactosidase-ac-
the necroptosis mediator MLKL induce a potent
tivatable prodrug seco-analog of duocarmycin SA,
antitumor immunity in mice, Oncoimmunology, 9,
Cancer Gene Ther., 18, 42-52, doi: 10.1038/cgt.2010.49.
1802968, doi: 10.1080/2162402X.2020.1802968.
128. Marchini, A., Scott, E. M., and Rommelaere, J. (2016)
120. Kochneva, G. V., Babkina, I. N., Lupan, T. A.,
Overcoming barriers in oncolytic virotherapy with
Grazhdantseva, A. A., Iudin, P. V., Sivolobova, G. F.,
HDAC inhibitors and immune checkpoint blockade,
Shvalov, A. N., Popov, E. G., Babkin, I. V., Netesov,
Viruses, 8, 9, doi: 10.3390/v8010009.
S. V., and Chumakov, P. M. (2013) Apoptin enhances
129. MacTavish, H., Diallo, J. S., Huang, B., Stanford, M.,
the oncolytic activity of vaccinia virus [in Russian],
Le Boeuf, F., De Silva, N., Cox, J., Simmons, J. G.,
Mol. Biol. (Mosk), 47, 842-852.
Guimond, T., Falls, T., McCart, J. A., Atkins, H.,
121. Kochneva, G., Zonov, E., Grazhdantseva, A.,
Breitbach, C., Kirn, D., Thorne, S., and Bell, J. C.
Yunusova, A., Sibolobova, G., Popov, E., Taranov, O.,
(2010) Enhancement of vaccinia virus based oncolysis
Netesov, S., Chumakov, P., and Ryabchikova, E.
with histone deacetylase inhibitors, PLoS One, 5,
(2014) Apoptin enhances the oncolytic properties
e14462, doi: 10.1371/journal.pone.0014462.
of vaccinia virus and modifies mechanisms of tumor
130. Francis, L., Guo, Z. S., Liu, Z., Ravindranathan, R.,
regression, Oncotarget, 5, 11269-11282, doi: 10.18632/
Urban, J. A., Sathaiah, M., Magge, D., Kalinski, P.,
oncotarget.2579.
and Bartlett, D. L. (2016) Modulation of chemokines
122. Di Pilato, M., Mejías-Pérez, E., Sorzano, C. O. S.,
in the tumor microenvironment enhances oncolytic
and Esteban, M. (2017) Distinct roles of vaccinia
virotherapy for colorectal cancer, Oncotarget, 7, 22174-
virus NF-κB inhibitor proteins A52, B15, and K7
22185, doi: 10.18632/oncotarget.7907.
in the immune response, J. Virol., 91, doi: 10.1128/
131. Kim, M., Nitschké, M., Sennino, B., Murer, P.,
JVI.00575-17.
Schriver, B. J., Bell, A., Subramanian, A., McDonald,
123. Holgado, M. P., Falivene, J., Maeto, C., Amigo, M.,
C. E., Wang, J., Cha, H., Bourgeois-Daigneault, M. C.,
Pascutti, M. F., Vecchione, M. B., Bruttomesso, A.,
Kirn, D. H., Bell, J. C., De Silva, N., Breitbach,
Calamante, G., Del Médico-Zajac, M. P., and
C. J., and McDonald, D. M. (2018) Amplification of
Gherardi, M. M. (2016) Deletion of A44L, A46R
oncolytic vaccinia virus widespread tumor cell killing
and C12L vaccinia virus genes from the MVA genome
by sunitinib through multiple mechanisms, Cancer Res.,
improved the vector immunogenicity by modifying
78, 922-937, doi: 10.1158/0008-5472.CAN-15-3308.
the innate immune response generating enhanced and
132. Zhang, B., and Cheng, P. (2020) Improving antitumor
optimized specific T-cell responses, Viruses, 8, 139,
efficacy via combinatorial regimens of oncolytic
doi: 10.3390/v8050139.
virotherapy, Mol. Cancer, 19, 158, doi: 10.1186/s12943-
124. Tsang, K. Y., Palena, C., Yokokawa, J., Arlen, P. M.,
020-01275-6.
Gulley, J. L., Mazzara, G. P., Gritz, L., Yafal, A. G.,
133. Mell, L. K., Brumund, K. T., Daniels, G. A.,
Ogueta, S., Greenhalgh, P., Manson, K., Panicali, D.,
Advani, S. J., Zakeri, K., Wright, M. E., Onyeama,
and Schlom, J.
(2005) Analyses of recombinant
S. J., Weisman, R. A., Sanghvi, P. R., Martin, P. J.,
vaccinia and fowlpox vaccine vectors expressing
and Szalay, A. A. (2017) Phase I trial of intravenous
transgenes for two human tumor antigens and three
oncolytic vaccinia virus (GL-ONC1) with cisplatin
БИОХИМИЯ том 88 вып. 6 2023
РЕКОМБИНАНТНЫЕ ОНКОЛИТИЧЕСКИЕ ШТАММЫ VV
1033
and radiotherapy in patients with locoregionally
140. Vaddepally, R. K., Kharel, P., Pandey, R., Garje, R.,
advanced head and neck carcinoma, Clin. Cancer Res.,
and Chandra, A. B. (2020) Review of indications of
23, 5696-5702, doi: 10.1158/1078-0432.CCR-16-3232.
FDA-approved immune checkpoint inhibitors per
134. Ramlau, R., Quoix, E., Rolski, J., Pless, M., Lena, H.,
NCCN guidelines with the level of evidence, Cancers
Levy, E., Krzakowski, M., Hess, D., Tartour, E.,
(Basel), 12, 738, doi: 10.3390/cancers12030738.
Chenard, M. P., Limacher, J. M., Bizouarne, N.,
141. Schaedler, E., Remy-Ziller, C., Hortelano, J.,
Acres, B., Halluard, C., and Velu, T. (2008) A phase II
Kehrer, N., Claudepierre, M. C., Gatard, T.,
study of Tg4010 (Mva-Muc1-Il2) in association with
Jakobs, C., Préville, X., Carpentier, A. F., and
chemotherapy in patients with stage III/IV Non-
Rittner, K. (2017) Sequential administration of a
small cell lung cancer, J. Thorac. Oncol., 3, 735-744,
MVA-based MUC1 cancer vaccine and the TLR9
doi: 10.1097/JTO.0b013e31817c6b4f.
ligand Litenimod (Li28) improves local immune
135. Song, C. K., Han, H. D., Noh, K. H., Kang, T. H.,
defense against tumors, Vaccine,
35,
577-585,
Park, Y. S., Kim, J. H., Park, E. S., Shin, B. C., and
doi: 10.1016/j.vaccine.2016.12.020.
Kim, T. W. (2007) Chemotherapy enhances CD8+
142. Remy-Ziller, C., Thioudellet, C., Hortelano, J.,
T cell-mediated antitumor immunity induced by
Gantzer, M., Nourtier, V., Claudepierre, M. C.,
vaccination with vaccinia virus, Mol. Ther., 15, 1558-
Sansas, B., Préville, X., Bendjama, K., Quemeneur, E.,
1563, doi: 10.1038/sj.mt.6300221.
and Rittner, K. (2018) Sequential administration of
136. Chen, W. Y., Chen, Y. L., Lin, H. W., Chang, C. F.,
MVA-based vaccines and PD-1/PD-L1-blocking
Huang, B. S., Sun, W. Z., and Cheng, W. F. (2021)
antibodies confers measurable benefits on tumor
Stereotactic body radiation combined with oncolytic
growth and survival: preclinical studies with
vaccinia virus induces potent anti-tumor effect by
MVA-βGal and MVA-MUC1 (TG4010) in a murine
triggering tumor cell necroptosis and DAMPs, Cancer
tumor model, Hum. Vaccin Immunother., 14, 140-145,
Lett., 523, 149-161, doi: 10.1016/j.canlet.2021.09.040.
doi: 10.1080/21645515.2017.1373921.
137. Klebanoff, C. A., Khong, H. T., Antony, P. A., Palmer,
143. Foy, S. P., Mandl, S. J., dela Cruz, T., Cote, J. J.,
D. C., and Restifo, N. P. (2005) Sinks, suppressors
Gordon, E. J., Trent, E., Delcayre, A., Breitmeyer, J.,
and antigen presenters: how lymphodepletion enhanc-
Franzusoff, A., and Rountree, R. B. (2016) Poxvirus-
es T cell-mediated tumor immunotherapy, Trends Im-
based active immunotherapy synergizes with CTLA-4
munol., 26, 111-117, doi: 10.1016/j.it.2004.12.003.
blockade to increase survival in a murine tumor model
138. Kim, H. S., Kim-Schulze, S., Kim, D. W., and
by improving the magnitude and quality of cytotoxic
Kaufman, H. L. (2009) Host lymphodepletion en-
T cells, Cancer Immunol. Immunother., 65, 537-549,
hances the therapeutic activity of an oncolytic vac-
doi: 10.1007/s00262-016-1816-7.
cinia virus expressing 4-1BB ligand, Cancer Res., 69,
144. Mandl, S. J., Rountree, R. B., Dalpozzo, K., Do, L.,
8516-8525, doi: 10.1158/0008-5472.CAN-09-2522.
Lombardo, J. R., Schoonmaker, P. L., Dirmeier, U.,
139. Prieto, P. A., Yang, J. C., Sherry, R. M., Hughes,
Steigerwald, R., Giffon, T., Laus, R., and Delcayre, A.
M. S., Kammula, U. S., White, D. E., Levy, C. L.,
(2012) Immunotherapy with MVA-BN®-HER2
Rosenberg, S. A., and Phan, G. Q. (2012) CTLA-4
induces HER-2-specific Th1 immunity and alters
blockade with ipilimumab: long-term follow-up of 177
the intratumoral balance of effector and regulatory
patients with metastatic melanoma, Clin. Cancer Res.,
T cells, Cancer Immunol. Immunother., 61, 19-29,
18, 2039-2047, doi: 10.1158/1078-0432.CCR-11-1823.
doi: 10.1007/s00262-011-1077-4.
RECOMBINANT STRAINS OF ONCOLYTIC VACCINIA VIRUS
FOR CANCER IMMUNOTHERAPY
Review
Y. Shakiba1,2, P. O. Vorobyev2, M. Mahmoud2, A. Hamad2, D. V. Kochetkov2,
G. M. Yusubalieva2,3,4, V. P. Baklaushev2,3,4, P. M. Chumakov2, and A. V. Lipatova2*
1 Moscow Institute of Physics and Technology, 141701 Dolgoprudny, Moscow Region, Russia
2 Engelhardt Institute of Molecular Biology, Russian Academy of Sciences,
119991 Moscow, Russia; e-mail: lipatovaanv@gmail.com
3 Federal Research Clinical Center for Specialized Medical Care and Medical Technologies,
Federal Medical-Biological Agency (FMBA), 115682 Moscow, Russia
4 Federal Center of Brain Research and Neurotechnologies of the FMBA of Russia, 117513 Moscow, Russia
10
БИОХИМИЯ том 88 вып. 6 2023
1034
ШАКИБА и др.
Cancer virotherapy is an alternative therapeutic approach based on the viruses that selectively infect and kill
tumor cells. Vaccinia virus (VV) is a member of the Poxviridae family of enveloped viruses with a large linear
double-stranded DNA genome. The proven safety of VV strains as well as considerable transgene capacity of
the viral genome, make VV an excellent platform for creating recombinant oncolytic viruses for cancer ther-
apy. Furthermore, various genetic modifications can increase tumor selectivity and therapeutic efficacy of
VV by arming it with the immune-modulatory genes or proapoptotic molecules, boosting the host immune
system, and increasing cross-priming recognition of the tumor cells by T-cells or NK cells. In this review, we
summarized the data on bioengineering approaches to develop recombinant VV strains for enhanced cancer
immunotherapy.
Keywords: oncolytic virus, recombinant virus, immunosuppression, immunomodulation, cytokine, vaccinia virus
БИОХИМИЯ том 88 вып. 6 2023