БИОХИМИЯ, 2023, том 88, вып. 6, с. 1035 - 1039
ДИСКУССИЯ
УДК 579.22
ЛИПОКСИГЕНАЗА ГИГАНТСКОЙ СЕРНОЙ БАКТЕРИИ:
ЭВОЛЮЦИОННОЕ РЕШЕНИЕ ДЛЯ УВЕЛИЧЕНИЯ
РАЗМЕРА И СЛОЖНОСТИ?
© 2023 Г.Ф. Куракин
Российский национальный исследовательский медицинский университет имени Н.И. Пирогова,
117997 Москва, Россия; электронная почта: georgykurakin@gmail.com
Поступила в редакцию 17.04.2023
После доработки 17.04.2023
Принята к публикации 02.05.2023
Открытие бактерии Thiomargarita magnifica - исключительно крупного представителя гигантских
серных бактерий - заставляет обратить дополнительное внимание на гигантских серных бактерий
и пересмотреть наши недавние результаты биоинформатического исследования, в котором липок-
сигеназы были обнаружены у представителей рода Beggiatoa. Эти близкие родственники бакте-
рии T. magnifica отвечают на сходные требования к размеру путём образования многоклеточных
структур. Мы предполагаем, что их липоксигеназы - часть системы оксилипиновой сигнализации,
обеспечивающей высокий уровень сложности межклеточной коммуникации, который позволяет
им достигать больших размеров.
КЛЮЧЕВЫЕ СЛОВА: Beggiatoa, многоклеточность, липоксигеназа, Thiomargarita magnifica.
DOI: 10.31857/S0320972523060118, EDN: EFSPAI
ВВЕДЕНИЕ
нием оксилипинов Pseudomonas aeruginosa - про-
дуктов ЛОГ, которые могут участвовать в подав-
Оксилипины - это окисленные производ-
лении защитных реакций организма хозяина [6].
ные полиненасыщенных жирных кислот. Они
участвуют в различных процессах межклеточ-
ной сигнализации у многоклеточных эукариот
ЛИПОКСИГЕНАЗА
и действуют как:
ГИГАНТСКОЙ СЕРНОЙ БАКТЕРИИ
• медиаторы стресса и повреждения у жи-
вотных, растений и различных групп водо-
В статье, недавно опубликованной в жур-
рослей;
нале Biochemistry (Moscow) [1], мы представили
• феромон-подобные вещества у грибов, бу-
результаты своего биоинформатического ис-
рых и диатомовых водорослей;
следования, демонстрирующего эволюционные
• сигналы, связанные с процессами разви-
ассоциации липоксигеназ с многоклеточно-
тия, у грибов и (частично) у растений.
стью (даже в примитивных формах) и взаимо-
Во всех вышеперечисленных группах в био-
отношениями «микроорганизм-хозяин» (рис. 1).
синтезе оксилипинов участвуют липоксигена-
В настоящей статье дополнительно обсуждаем
зы (ЛОГ). Ферменты этой группы высоко кон-
первую ассоциацию - связь липоксигеназ и
сервативны и также присутствуют у некоторых
многоклеточности.
групп бактерий, таких как цианобактерии и
В домене бактерий липоксигеназы и мно-
миксобактерии [1]. Имеющиеся эксперимен-
гоклеточность встречались вместе у циано-
тальные данные свидетельствуют о том, что
бактерий и миксобактерий. Эти два таксона -
бактериальные ЛОГ функциональны и син-
самые известные примеры бактериальной
тезируют оксилипины из полиненасыщенных
многоклеточности, и именно они сформиро-
жирных кислот [2-5]. Однако функции этих
вали статистическую картину большей рас-
оксилипинов остаются неясными, за исключе-
пространённости липоксигеназ в многокле-
точных таксонах, поэтому они были включены
Принятые сокращения: ЛОГ - липоксигеназы.
в дальнейшее обсуждение.
1035
10*
1036
КУРАКИН
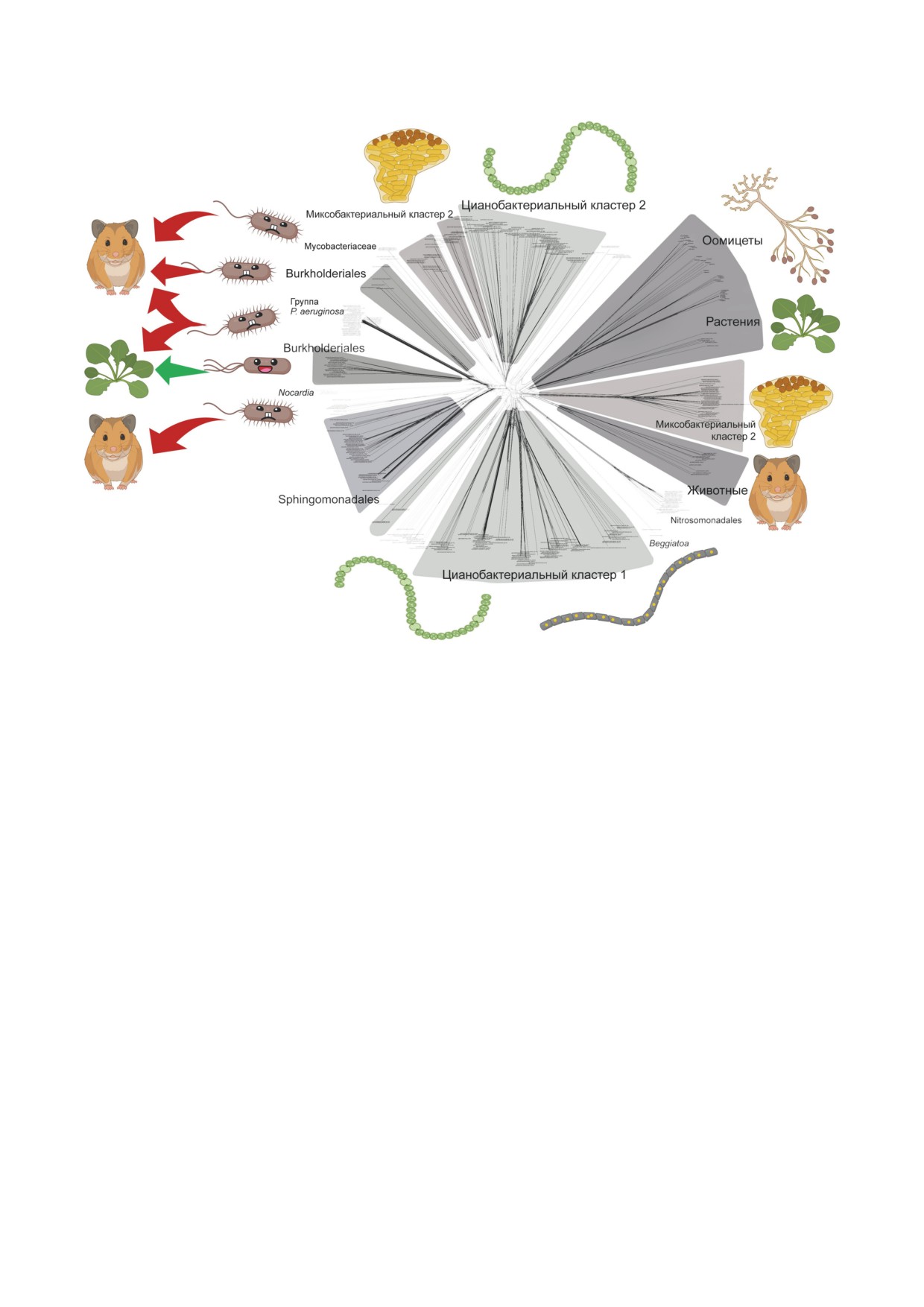
Рис. 1. Филогенетическая сеть бактериальных и эукариотических липоксигеназ (из нашей предыдущей статьи [1])
с отображением экофизиологии соответствующих бактерий. Большинство кластеров липоксигеназ ассоциированы
с многоклеточными организмами, и только небольшой сектор представлен липоксигеназами патогенных (красные
стрелки) и симбиотических (зелёная стрелка) бактерий. Это позволяет предположить, что липоксигеназы необходимы
бактериям либо для того, чтобы самим быть многоклеточными, либо для взаимодействия с многоклеточным хозяином.
Источник изображения: статья Kurakin et al., 2020 [1] (с изменениями)
Однако в нашем предыдущем исследовании
Несмотря на это, мы проигнорировали их в
ЛОГ были обнаружены ещё в одном бактери-
ходе нашего предыдущего анализа [1], так как
альном таксоне. Это род Beggiatoa, принадлежа-
обнаружили ЛОГ только у представителей рода
щий к группе, называемой «большими серными
Beggiatoa, которые не внесли существенного
бактериями» или «гигантскими серными бак-
вклада в статистику распространённости ЛОГ
териями» [7, 8]. Это название отражает их био-
на уровне порядков и в общую картину ста-
химические особенности: они являются хемо-
тистической ассоциации между ЛОГ и много-
литоавтотрофами и получают энергию за счёт
клеточностью. Однако стоит отметить, что
окисления сульфида (S2-) до сульфата (SO2-) с
присутствие ЛОГ у Beggiatoa было также под-
использованием кислорода или нитрата в каче-
тверждено биоинформатическим исследова-
стве окислителя. Название также отражает их
нием Chrisnasari et al. [10].
необычно большой размер: Beggiatoa spp. обра-
Недавнее открытие заставляет посмотреть
зуют филаменты длиной от нескольких мкм
на этот род с другой точки зрения. В июне
до 10 см, а диаметр их клеток варьируется при-
2022 г. в журнале Science была описана новая
близительно от 1 до 200 мкм. Длина филамен-
гигантская серная бактерия [11]. Эта бактерия,
тов Thioploca spp. составляет 2-5 см при диа-
названная Thiomargarita magnifica, может дости-
метре 2,5-80 мкм [9].
гать до сантиметра в длину и быть видима не-
Представители этих двух родов (так же,
вооружённым глазом. Это абсолютный рекорд
как и других родов гигантских серных бакте-
размера в бактериальном мире, который даже
рий) многоклеточные. Их длинные филаменты
был представлен в спецвыпуске «2022 Break-
состоят из нескольких сотен клеток [7], что де-
through of the Year» («Прорывы 2022 года») [12].
лает их похожими на нитчатых цианобактерий.
Тот факт, что род Thiomargarita - один из самых
БИОХИМИЯ том 88 вып. 6 2023
ЛИПОКСИГЕНАЗА ГИГАНТСКОЙ СЕРНОЙ БАКТЕРИИ
1037
близких родственников рода Beggiatoa [7], на-
пользуют разные способы приспособления к
водит на мысль, что среди видов Beggiatoa сле-
условиям границы раздела сред, содержащих
дует искать любые маркеры повышенной слож-
окислитель и восстановитель. В то время как
ности организации, включая липоксигеназы.
T. magnifica обходится без многоклеточности,
Это особенно важно, так как до открытия рода
Thioploca и Beggiatoa образуют многоклеточ-
Thiomargarita бактерии Beggiatoa spp. были ре-
ные филаменты. Однако представители рода
кордсменами в плане размера: их клетки могут
Thioploca также известны своей более сложной
достигать >100 мкм [8]. Так как один филамент
поведенческой адаптацией: они могут активно
содержит сотни клеток, он может достигать до
двигаться между слоем нитрата и богатыми
нескольких сантиметров в длину [7]. Таким
сульфидом осадками, накапливая нитрат для
образом, род Beggiatoa также заставляет пере-
дальнейшего использования в богатой суль-
смотреть наши представления об ограничениях
фидом среде [9, 15]. Beggiatoa spp., наоборот,
размера прокариот [8].
зависят от одновременной доступности окис-
Эти ограничения обусловлены биоэнерге-
лителя (кислорода) и сульфида [9, 15]. Таким
тическими причинами: ATP-синтазы, выраба-
образом, многоклеточность является для пред-
тывающие энергию для клеток, могут быть рас-
ставителей рода Beggiatoa почти единственной
положены только на мембранах, а у большин-
стратегией, позволяющей пространственно
ства бактерий единственной мембраной явля-
связывать оба необходимых им субстрата.
ется цитоплазматическая мембрана. Поэтому
Мы предполагаем, что для этого может быть
максимальный размер клетки ограничен наи-
необходим более высокий уровень межклеточ-
меньшим отношением площади поверхности к
ной коммуникации и интеграции. В свою оче-
объёму, при котором клетка ещё может полу-
редь, согласно нашей гипотезе, это может быть
чать достаточные количества ATP.
причиной присутствия липоксигеназ у Beggiatoa
С другой стороны, гигантские серные бак-
терии обитают на границах раздела сульфида и
кислорода (или сульфида и нитрата) и должны
иметь достаточную длину, чтобы перекры-
вать собой пул сульфида и пул окислителя и
использовать их вместе в своём метаболизме.
Более того, они должны иметь достаточный
объём клетки. Большинство гигантских сер-
ных бактерий достигает этого путём развития
многоклеточных форм, что позволяет им об-
разовывать большие организмы, не превышая
предельного размера клетки. T. magnifica - ин-
тересное исключение, обходящее эти ограни-
чения за счёт увеличения сложности клетки:
сложной сети внутренних мембран и напо-
минающих ядра органелл, называемых пепи-
нами (pepins), где расположены ATP-синта-
Рис. 2. Beggiatoa, Thioploca и Thiomargarita magnifica -
зы [11]. Это позволяет увеличить суммарную
близкие родственники, формирующие исключительно
поверхность мембран для синтеза ATP без
длинные структуры для использования двух простран-
ственно разделённых пулов сульфида (S2-, жёлтый) и
формирования многоклеточного организма.
кислорода либо нитрата (O2/NO–, голубой). Это создаёт
Другой представитель рода Thiomargarita -
давление отбора, направленное на увеличение длины
Thiomargarita namibiensis - также обходится без
(обозначено стрелками). Но они используют разные
многоклеточности, вместо этого используя
стратегии для преодоления ограничений на размер.
T. magnifica увеличивает общую поверхность вырабаты-
свою способность к хранению больших коли-
вающих ATP мембран путём усложнения единственной
честв нитрата. Он накапливает нитрат во вре-
клетки, в то время как Thioploca и Beggiatoa - много-
мя пассивной ресуспензии из донного осадка,
клеточные. Однако в случае Thioploca давление отбора
чтобы дальше использовать его в биохимичес-
частично ослабляется за счёт способности этих бакте-
рий к скользящему движению вверх-вниз относительно
ких процессах во время нахождения в осадке,
слизистого чехла. В отличие от них, Beggiatia зависит от
богатом сульфидом. Эта стратегия получила
контакта с двумя соединениями одновременно и поэто-
образное название «стратегия выжидания» [13]
му отвечает на давление отбора в той же степени, как и
или «задержка бактерией дыхания» [14].
T. magnifica. Мы предполагаем, что это эволюционное
требование удовлетворяется за счёт увеличения сложно-
Роды Beggiatoa, Thioploca и Thiomargarita
сти межклеточной сигнализации, и ЛОГ представителей
близко родственны друг другу в пределах се-
рода Beggiatoa играют фактически ту же роль, что пепины
мейства Beggiatoaceae, но при этом они ис-
и внутренние мембраны T. magnifica
БИОХИМИЯ том 88 вып. 6 2023
1038
КУРАКИН
и их отсутствия у Thioploca. Данные липокси-
лизации в вышеперечисленных бактериаль-
геназы могут быть сигнатурой оксилипиновой
ных таксонах.
сигнализации у представителей рода Beggiatoa,
развившейся в ответ на эволюционное требо-
Благодарности. Рисунки были созданы с по-
вание большей сложности.
мощью сервиса научной графики BioRender.com.
Предложенная гипотеза хорошо согласу-
Автор также благодарит Лебедеву Алину Алек-
ется с нашим общим предположением о связи
сеевну (ассистента кафедры теории языка, пе-
липоксигеназ, оксилипиновой сигнализации
ревода и французской филологии Тверского
и многоклеточности. В настоящее время эта
государственного университета) за литературное
связь установлена или предполагается для
редактирование английской версии этой статьи.
животных, растений, грибов, оомицет, дик-
Конфликт интересов. Автор заявляет об от-
тиостелиевых слизевиков, плазмодиофорид,
сутствии конфликта интересов.
цианобактерий и миксобактерий. Сейчас мы
Соблюдение этических норм. Настоящая
можем добавить в этот список Beggiatoa spp.
статья не содержит описания выполненных ав-
Валидация этой связи потребует эксперимен-
тором исследований с участием людей или ис-
тальных исследований оксилипиновой сигна-
пользованием животных в качестве объектов.
СПИСОК ЛИТЕРАТУРЫ
1.
Kurakin, G. F., Samoukina, A. M., and Potapova,
8.
Jørgensen, B. (2010) Big sulfur bacteria, ISME J., 4,
N. A. (2020) Bacterial and Protozoan lipoxygenases
1083-1084, doi: 10.1038/ismej.2010.106.
could be involved in cell-to-cell signaling and immune
9.
Teske, A., and Nelson, D. C. (2006) in The Prokaryotes
response suppression, Biochemistry (Moscow),
85,
(Dworkin, M., Falkow, S., Rosenberg, E., Schleifer,
1048-1063, doi: 10.1134/S0006297920090059.
K.-H., and Stackebrandt, E., eds) Springer, N. Y.,
2.
Andreou, A. Z., Vanko, M., Bezakova, L., and
pp. 784-810, doi: 10.1007/0-387-30746-X_27.
Feussner, I. (2008) Properties of a mini 9R-lipox-
10.
Chrisnasari, R., Hennebelle, M., Vincken, J. P.,
ygenase from Nostoc sp. PCC 7120 and its mutant
van Berkel, W. J., and Ewing, T. A. (2022) Bacteri-
forms, Phytochemistry, 69, 1832-1837, doi: 10.1016/
al lipoxygenases: biochemical characteristics, mo-
j.phytochem.2008.03.002.
lecular structure and potential applications, Bio-
3.
Lang, I., Göbel, C., Porzel, A., Heilmann, I., and
technol. Adv., 61, 108046, doi: 10.1016/j.biotechadv.
Feussner, I. (2008) A lipoxygenase with linoleate
2022.108046.
diol synthase activity from Nostoc sp. PCC 7120,
11.
Volland, J. M., Gonzalez-Rizzo, S., Gros, O.,
Biochem. J., 410, 347-357, doi: 10.1042/BJ20071277.
Tyml, T., Ivanova, N., Schulz, F., Goudeau, D.,
4.
An, J. U., Hong, S. H., and Oh, D. K. (2018) Re-
Elisabeth, N. H., Nath, N., Udwary, D., Malmstrom,
giospecificity of a novel bacterial lipoxygenase from
R. R., Guidi-Rontani, C., Bolte-Kluge, S., Davies,
Myxococcus xanthus for polyunsaturated fatty acids,
K. M., Jean, M. R., Mansot, J. L., Mouncey, N. J.,
Biochim. Biophys. Acta Mol. Cell Biol. Lipids, 1863,
Angert, E. R., Woyke, T., and Date, S. V. (2022) A cen-
823-833, doi: 10.1016/j.bbalip.2018.04.014.
timeter-long bacterium with DNA contained in meta-
5.
Vance, R. E., Hong, S., Gronert, K., Serhan, C. N.,
bolically active, membrane-bound organelles, Science,
and Mekalanos, J. J. (2004) The opportunistic patho-
376, 1453-1458, doi: 10.1126/science.abb3634.
gen Pseudomonas aeruginosa carries a secretable ara-
12.
Pennisi, E., Stokstad, E., Gibbons, A., Stone, R.,
chidonate 15-lipoxygenase, Proc. Natl. Acad. Sci. USA,
Cohen, J., Savitsky, Z., Voosen, P., Hutson, M., and
101, 2135-2139, doi: 10.1073/pnas.0307308101.
Kaiser, J. (2022) Runners-up, Science, 378, 1162-1167,
6.
Morello, E., Pérez-Berezo, T., Boisseau, C., Baranek, T.,
doi: 10.1126/science.adg2799.
Guillon, A., Bréa, D., Lanotte, P., Carpena, X.,
13.
Schulz, H. N., and Riechmann, D. (2000) Thiomar-
Pietrancosta, N., Hervé, V., Ramphal, R., Cenac, N.,
garita namibiensis: A giant with staying power [in Ger-
and Si-Tahar, M.
(2019) Pseudomonas aeruginosa
man], BioSpektrum, 6, 116-117.
lipoxygenase LoxA contributes to lung infection
14.
Schulz, H. N. (2002) Thiomargarita namibiensis: Giant
by altering the host immune lipid signaling, Front.
microbe holding its breath, ASM News, 68, 122-127,
Microbiol., 10, 1826, doi: 10.3389/fmicb.2019.01826.
doi: 10.1128/AEM.68.11.5746-5749.2002.
7.
Salman, V., Bailey, J. V. and Teske, A.
(2013)
15.
Kuenen, G. (1999) in Biology of the Prokaryotes
Phylogenetic and morphologic complexity of giant
(Lengeler, J. W., Drews, G., and Schlegel, H.
sulphur bacteria, Antonie van Leeuwenhoek, 104, 169-
G., eds) Thieme Stuttgart, N. Y., pp.
234-260,
186, doi: 10.1007/s10482-013-9952-y.
doi: 10.1002/9781444313314.ch10.
БИОХИМИЯ том 88 вып. 6 2023
ЛИПОКСИГЕНАЗА ГИГАНТСКОЙ СЕРНОЙ БАКТЕРИИ
1039
LIPOXYGENASE IN A GIANT SULFUR BACTERIUM:
AN EVOLUTIONARY SOLUTION FOR SIZE AND COMPLEXITY?
G. Kurakin
Pirogov Russian National Research Medical University,
117997 Moscow, Russia; e-mail: georgykurakin@gmail.com
Discovery of Thiomargarita magnifica - an exceptionally large giant sulfur bacterium - urges us to pay ad-
ditional attention to the giant sulfur bacteria and to revisit our recent bioinformatic finding of lipoxygenases
in the representatives of the genus Beggiatoa. These close relatives of Thiomargarita magnifica meet the sim-
ilar size requirements by forming multicellular structures. We hypothesize that their lipoxygenases are a part
of the oxylipin signaling system that provides high level of cell-to-cell signaling complexity which, in turn,
enables them to reach large sizes.
Keywords: Beggiatoa, multicellularity, lipoxygenase, Thiomargarita magnifica
БИОХИМИЯ том 88 вып. 6 2023