БИОХИМИЯ, 2023, том 88, вып. 7, с. 1069 - 1084
УДК 57.052
МОЛЕКУЛЯРНЫЙ ОРКЕСТР МИКРОБИОТИЧЕСКИХ
МЕТАБОЛИТОВ В СЦЕНАРИИ КАНЦЕРОГЕНЕЗА
Обзор
© 2023 О.П. Шатова1,2*, А.А. Заболотнева1, А.В. Шестопалов1,3
1 Российский национальный исследовательский медицинский университет им. Н.И. Пирогова,
биологический факультет, кафедра биохимии,
117997 Москва, Россия; электронная почта: shatova.op@gmail.com
2 Российский Университет Дружбы Народов, 117198 Москва, Россия
3 Национальный медицинский исследовательский центр
Детской гематологии, онкологии и иммунологии им. Дмитрия Рогачева, 117997 Москва, Россия
Поступила в редакцию 25.01.2023
После доработки 09.03.2023
Принята к публикации 09.03.2023
Механизмы канцерогенеза имеют необычайно сложный характер. Множество игроков обуслов-
ливают сценарий злокачественной трансформации клеток, опухолевый рост и метастазирование.
В последние десятилетия все больше внимания уделяется роли симбиотической человеку мик-
робиоты в регуляции метаболизма и функционирования иммунной системы организма хозяина.
Такой симбиоз макроорганизма и его микроорганизмов объединили в понятие холоорганизма.
В процессе коэволюции участников холоорганизма формировались пути их взаимодействия, а ме-
таболиты микробиоты приобрели особую роль - сигнальных молекул и основных регуляторов
молекулярных взаимодействий в холоорганизме. Вовлекаясь в сигнальные пути хозяина, бактери-
альные метаболиты оказались обязательными участниками как физиологических, так и патологи-
ческих процессов, включая опухолевый рост. При этом эффекты сигнальных метаболитов зача-
стую имеют разнонаправленный характер, проявляющийся в воздействии как на функции клеток
хозяина, так и на метаболическую активность и состав микробиома. В настоящем обзоре рассмат-
ривается роль некоторых микробиотических метаболитов в индукции и профилактике процесса
злокачественной трансформации клеток в организме хозяина, а также их влияние на эффектив-
ность противоопухолевой терапии. Мы постарались обратить внимание читателя на роль неко-
торых компонентов молекулярного оркестра микробных метаболитов в инициации и прогрессии
опухолевого роста.
КЛЮЧЕВЫЕ СЛОВА: микробиота, канцерогенез, сигнальные метаболиты, рак.
DOI: 10.31857/S0320972523070023, EDN: FUVBHO
ВВЕДЕНИЕ
наличие вредных привычек, воздействие усло-
вий среды (действие ультрафиолетового или
Молекулярные механизмы канцерогенеза и
ионизирующего излучения, химических суб-
патогенеза злокачественных новообразований
станций и др.), определяют инициацию зло-
имеют сложный и вместе с тем индивидуаль-
качественной трансформации клеток и спо-
ный характер [1]. Множество факторов, вклю-
собствуют прогрессивному росту опухоли [1].
чая генетические и эпигенетические особенно-
Нарастающее количество публикаций подчер-
сти, возраст, образ жизни, особенности диеты, кивает ключевую роль молекулярно-генети-
Принятые сокращения: АФК - активные формы кислорода; ВтЖК - вторичные желчные кислоты; ДК - дендрит-
ные клетки; ДХК - дезоксихолевая кислота; КЦЖК - короткоцепочечные жирные кислоты; ЛПС - липополисахарид;
ЛХК - литохолевая кислота; ОСК - опухолевые стволовые клетки; AhR - арилгидрокарбоновые рецепторы; CAR -
конститутивный андростановый рецептор; FXR - ядерный фарнезоидный Х-рецептор; GPR41 и GPR43 - рецепторы,
ассоциированные с G-белком; IDO1 - индоламинпиррол-2,3-диоксигеназа 1 (Indoleamine-pyrrole 2,3-dioxygenase);
NKT-клетки - естественные клетки-киллеры; TGR5 (GPBAR1) - ассоциированный с G-белком рецептор желчных
кислот 1; TLR - толл-подобный рецептор (toll-like receptor); Treg - регуляторные Т-клетки.
* Адресат для корреспонденции.
1069
1070
ШАТОВА и др.
ческих исследований при подборе таргетной
ции и профилактике процесса канцерогенеза
терапии [2]. В последние годы появляется все
в организме хозяина, а также их влияние на
больше доказательств способности микро-
эффективность противоопухолевой терапии.
биоты оказывать влияние на злокачествен-
ную трансформацию клеток на метаболом-
ном и молекулярно-генетическом уровнях.
МИКРОБИОТИЧЕСКИЕ ФАКТОРЫ
Все больше исследований посвящается изуче-
КАК МУТАГЕНЫ И РЕГУЛЯТОРЫ
нию влияния симбиотической микробиоты на
ПРОЛИФЕРАЦИИ КЛЕТОК
метаболизм хозяина. Развиваясь в процессе
ОРГАНИЗМА-ХОЗЯИНА
эволюции параллельно организму хозяина,
микробиота во многом формировала фено-
В процессе эволюции у многих микроор-
типы наших предков [3]. Сопряжение метабо-
ганизмов возникли механизмы повреждения
лизма макроорганизма и микробиоты, а также
ДНК, позволяющие уничтожать конкурентов
унификация сигнальных молекул, используе-
и, таким образом, выживать в микробном мире.
мых для коммуникации и регуляции совмест-
Однако в клетках хозяина эти микробные за-
ного метаболизма холоорганизма, привели к
щитные факторы могут выступать в роли му-
значимой вовлеченности микроорганизмов,
тагенов, тем самым способствуя канцероге-
а точнее - их метаболитов, в патогенез мно-
незу. Примерами могут служить колибактин,
гих заболеваний человека. В первую очередь,
экспрессируемый Escherichia coli группы B2,
к таким заболеваниям относятся метаболиче-
а также другими энтеробактериями [6], ток-
ские расстройства - ожирение, неалкоголь-
син Bacteroides fragilis (Bft), продуцируемый
ная жировая инфильтрация печени, дислипи-
энтеротоксигенными B. fragilis, и цитолеталь-
демии, инсулинорезистентность и сахарный
ный токсин растяжения (CDT), продуцируе-
диабет 2-го типа [4]. Однако развитие ряда
мый многими грамотрицательными бактерия-
онкозаболеваний также ассоциировано с воз-
ми, такими как E. coli, Shigella dysentery и H. py-
действием микроорганизмов [5]. Несмотря на
lori [7]. Известно, что и колибактин, и CDT
то что Международное агентство по исследо-
могут вызывать повреждения двухцепочечной
ванию рака (IACR) в настоящее время выде-
ДНК, хромосомную нестабильность и про-
ляет только 11 инфекционных агентов (виру-
мотировать процесс сенесценции в эукарио-
сы Эпштейн-Барра, гепатита В и С, саркомы
тических клетках [8, 9]. Токсин Bft, напротив,
Капоши (герпес-вирус 8-го типа), иммуно-
действует косвенно стимулируя образование
дефицита человека (ВИЧ), папилломавирус
активных форм кислорода (АФК), которые,
типа 16, человеческий Т-клеточный лимфо-
образуясь в высоких концентрациях, повреж-
тропный вирус типа 1 (HTLV-1), Helicobacter
дают ДНК хозяина, опережая действие меха-
pylori, Clonorchis sinensis, Opisthorchis viverrini и
низмов ее репарации [7].
Schistosoma haematobium), относящихся к пер-
Некоторые белки, экспрессируемые ком-
вой группе канцерогенных возбудителей (то
менсальными микроорганизмами, могут ак-
есть микробов, запускающих процесс злокаче-
тивировать сигнальные пути, регулирующие
ственной трансформации в клетках организ-
пролиферацию, выживание, миграцию эука-
ма-хозяина) [6], участие других микроорганиз-
риотических клеток. Примером такого факто-
мов, входящих в экосистему комменсальной
ра является белок CagA, кодируемый цитоток-
микробиоты, является не менее значимым в
син-ассоциированным геном А (СagA, cyto-
процессе канцерогенеза. Способы, с помо-
toxin associated gene) и экспрессируемый онко-
щью которых микробиота влияет на процесс
генными штаммами H. pylori типа 1; по сути,
злокачественной трансформации клеток, будь
он является фактором вирулентности H. py-
то повышение или снижение риска развития
lori [10]. Проникая в цитоплазму клеток хо-
заболеваний для хозяина, можно разделить на
зяина, CagA аберрантно активирует β-кате-
три основные группы: (1) изменение балан-
нин, тем самым запуская сигнальный путь Wnt
са между пролиферацией и гибелью клеток
и приводя к активации транскрипции ге-
хозяина, (2) модуляция функций иммунной
нов, участвующих в поддержании стволовых
системы и (3) влияние на образование мета-
свойств клеток, пролиферации, миграции,
болитов, синтезируемых организмом хозяина,
иными словами - процессах, необходимых для
поступающих с пищей и образуемых самой
поддержания злокачественного роста. Схожим
микробиотой [6].
образом представитель микробиоты полости
В настоящем обзоре мы задались целью
рта Fusobacterium nucleatum, связанный с раз-
кратко рассмотреть роль комменсальной мик-
витием колоректальной аденомы и аденокар-
робиоты, а именно ее метаболитов, в индук-
циномы человека, экспрессирует белок FadA
БИОХИМИЯ том 88 вып. 7 2023
ДИАЛОГ МИКРОБИОТИЧЕСКИХ МЕТАБОЛИТОВ
1071
(Adhesin A), который является фактором адге-
метаболиты могут особенным образом влиять
зии на поверхности бактериальных клеток, но
на иммунные реакции в развивающемся микро-
одновременно с этим может связывать E-кад-
окружении опухоли, оказывая провоспалитель-
герин хозяина, что приводит к активации
ное и/или иммуносупрессивное воздействие.
β-катенина [11]. Штаммы Salmonella typhi се-
С другой стороны, результатом длительного
кретируют белок AvrA - эффекторный белок,
сосуществования симбиотических микро- и
обусловливающий взаимодействие бактери-
макроорганизмов является продукция бакте-
ального патогена с организмом хозяина, кото-
риальными клетками протективных (противо-
рый также может активировать передачу сиг-
воспалительных и противоопухолевых) моле-
налов через β-катенин и связан с развитием
кул, позволяющих защитить организм хозяина
гепатобилиарного рака [12].
от роста злокачественной опухоли, тем самым
Феномен активации сигнального пути
обеспечив совместное выживание всего холо-
Wnt/β-катенина отражает процесс конвергент-
организма.
ной эволюции микробиоты и клеток хозяина
Желчные кислоты. Вторичные желчные
и, вероятно, связан с приспособительными ре-
кислоты (ВтЖК) являются важными метабо-
акциями микроорганизмов для создания новой
литами, образующимися в результате кишеч-
ниши обитания. Но, с другой стороны, при-
ной микробной ферментации первичных желч-
сутствие бактерий, потенцирующих рак, и их
ных кислот. К основным ВтЖК относятся
способность взаимодействовать с Е-кадгери-
дезоксихолевая кислота (ДХК), литохолевая
ном в развивающихся опухолях указывает на
кислота (ЛХК) и урсодезоксихолевая кисло-
то, что нарушение барьерной функции тка-
та (УДХК). В кишечнике ВтЖК могут влиять
ней хозяина является критическим шагом в
на структуру микробиотических сообществ [14,
развитии некоторых типов злокачественных
15]. Ряд исследований продемонстрировал, что
опухолей. В подтверждение вышесказанному
ВтЖК выступают в роли важнейших регуля-
можно привести тот факт, что производство
торных молекул, которые могут активировать
аммиака H. pylori разрушает плотные клеточ-
множество сигнальных путей [16, 17]. Под дей-
ные соединения, нарушает клеточную целост-
ствием ВтЖК может происходить индукция
ность и, соответственно, повреждает эпителий
пролиферации опухолевых клеток и ингиби-
желудка. Недавно сообщалось, что уреаза спо-
рование их апоптоза, стимуляция инвазии и
собствует росту опухоли и ее метастатическо-
метастазирования, а также индукция транс-
му распространению, индуцируя ангиогенез,
формации злокачественных клеток в опухоле-
и играет ключевую роль в прогрессировании
вые стволовые клетки (ОСК) [16]. Более того,
рака желудка [10]. Таким образом, до 20% слу-
ВтЖК способствуют канцерогенезу, регулируя
чаев онкопатологий связаны с мутагенными
функцию иммунных клеток [17]. Примечатель-
воздействиями патогенных бактерий, и еще
но, что пищевой рацион с высоким содержа-
больше - с дисбалансом кишечной микробио-
нием жиров повышает относительную числен-
ты (дисбиозом) [13].
ность сульфатредуцирующих бактерий (таких
как Desulfovibrio vulgaris), которые образуют
проканцерогенные ЛХК и ДХК [18].
ОНКОГЕННАЯ РОЛЬ
ВтЖК реализуют свои эффекты через
МИКРОБНЫХ МЕТАБОЛИТОВ
ядерный фарнезоидный Х-рецептор (FXR),
рецептор
1 желчных кислот, связанный с
Другим путем воздействия микробиоты
G-белком (GPBAR1, иначе TGR5), рецептор
на процесс злокачественной трансформации
витамина D (VDR), прегнан Х-рецептор (PXR)
клеток организма-хозяина является модуляция
и конститутивный андростановый рецептор
работы иммунокомпетентных клеток. В про-
(CAR) [19, 20]. При этом первичные желчные
цессе коэволюции системы «хозяин-микро-
кислоты в основном активируют FXR, а ВтЖК
биота» возникали не только взаимовыгодные
активируют TGR5 [21]. Активация TGR5 при-
отношения, но и формировались барьеры, не
водит к увеличению пролиферации клеток
допускающие патологического воздействия
кишечника, способствует повреждению ДНК
симбионтов на макроорганизм. Опухолевая
и индуцирует клеточную сенесценцию, при-
трансформация и воспалительные заболева-
водя к формированию секреторного фено-
ния могут возникать тогда, когда барьеры раз-
типа, ассоциированного со старением (SASP)
рушаются, а микробы и иммунная система
[21]. Более того, ВтЖК, воздействуя на TGR5,
оказываются в таких условиях и средах, в ко-
могут ингибировать функции естествен-
торых они не эволюционировали совместно.
ных клеток-киллеров (NKT-клеток), В-кле-
Как только барьеры нарушены, микробные
ток, дендритных клеток (ДК) и макрофагов.
БИОХИМИЯ том 88 вып. 7 2023
1072
ШАТОВА и др.
Так, ДХК и ЛХК могут ингибировать акти-
показаны онкопротективные свойства синте-
вацию макрофагов селезенки и кишечника,
тической УДХК в отношении развития коло-
которая индуцируется толл-подобным рецеп-
ректального рака [34].
тором-4 (TLR4) [22]. Они также могут инги-
Липополисахарид (ЛПС). ЛПС с его внут-
бировать секрецию интерлейкина-6 (IL-6),
ренним компонентом, липидом А, является
интерферона-γ (IFN-γ), фактора некроза опу-
наиболее эффективным защитным токсином
холи-α (TNF-α) и индуцировать поляриза-
клеточной стенки грамотрицательных бак-
цию противоопухолевых макрофагов M1 на
терий и обусловливает провоспалительное
проканцерогенные макрофаги M2 [23]. ДХК
действие на организм хозяина [35]. Просвет
и ЛХК подавляют секрецию TNF-α и IL-12,
кишечника - среда обитания многих трил-
тем самым ингибируя функцию ДК [19]. ВтЖК
лионов комменсальных бактерий - является
могут ингибировать функцию В-клеток, кото-
основным резервуаром ЛПС в организме чело-
рые проявляют противоопухолевое действие
века [36]. Интересно, что воздействие ЛПС на
за счет секреции антител, а также фагоцито-
апикальные, но не базолатеральные, рецеп-
за и активации системы комплемента [24].
торы эпителиальных клеток кишечника ин-
ДХК и ЛХК могут ингибировать секрецию IL-6
дуцирует их апоптоз посредством активации
и подавлять созревание В-клеток, тем са-
каспазы-3 и стимулирует разрушение плотных
мым снижая уровни иммуноглобулинов (IgE
соединений ZO-1 (каркасный белок плотного
и IgG) [22]. Известно, что NKT-клетки секре-
соединения zonula occludens-1), тем самым по-
тируют IFN-γ и TNF-α для стимуляции апоп-
вышая проницаемость эпителия. При транс-
тоза опухолевых клеток
[25]. Однако ДХК
портировке в плазме крови ЛПС связывается
и ЛХК ингибируют секрецию IFN-γ и TNF-α,
либо с ЛПС-связывающим белком (LBP),
тем самым подавляя и функцию NKT-кле-
либо с липопротеинами плазмы и вызывает
ток [23]. Кроме того, ДХК и ЛХК могут сти-
системное воспаление [37]. ЛПС участвует в
мулировать секрецию IL-10 NKT-клетками,
онкогенном процессе посредством множе-
что приводит к подавлению секреции TNF-α
ства механизмов. ЛПС может стимулировать
и активности Т-лимфоцитов [26]. ВтЖК могут
TNF-α, что впоследствии приводит к рекрути-
усиливать функцию регуляторных Т-клеток
рованию внутриклеточного ядерного фактора
(Treg), которые, как известно, способствуют
транскрипции-κB (NF-κB) с последующим
формированию иммуносупрессивного мик-
высвобождением хемокинов и воспалитель-
роокружения и прогрессированию опухоли.
ных цитокинов, включая IL-1β, IL-6, IL-8
Foxp3 является одним из ключевых факторов
и TNF-α, а также повышению уровня экс-
транскрипции семейства белков FOX, контро-
прессии индуцируемой синтазы оксида азота
лирующих развитие и функцию Treg [27]. Про-
(iNOS) и, соответственно, уровня проокси-
изводное ЛХК - изоаллоЛХК - может уве-
данта - NO [38]. TNF-α отвечает за активацию
личивать экспрессию Foxp3 в наивных CD4+
различных сигнальных путей внутри клеток,
T-клетках за счет повышения продукции АФК
ведущих к некрозу или апоптозу, поэтому иг-
в митохондриях [28]. Установлено, что ВтЖК
рает ключевую роль в устойчивости к инфек-
могут связываться не только с TGR5, но и с
циям и раку [39]. Активация TLR4-зависимого
FXR - ядерными рецепторами, экспрессиру-
сигнального пути FAK/MyD88/IRAK4 контро-
ющимися главным образом в кишечнике, пе-
лирует вызванное ЛПС воспаление кишечни-
чени и иммунных клетках [22]. Макрофаги и
ка и проницаемость плотных соединений [39].
ДК экспрессируют как TGR5, так и FXR, тогда
При этом было установлено, что повы-
как NKT-клетки экспрессируют только FXR.
шение ЛПС в сыворотке крови увеличивает
Активация этих рецепторов желчными кис-
не только риск развития рака предстательной
лотами заставляет макрофаги продуцировать
железы, но и повышает скорость метаста-
больше IL-10 и меньше IL-6 и IFN-γ, ДК -
зирования опухолевых клеток [40]. Так, при
продуцировать меньше TNF-α и IL-12, а есте-
колоректальном раке были обнаружены ста-
ственные клетки-киллеры
- продуцировать
тистически значимые отличия в концентра-
меньше остеопонтина [22].
ции ЛПС в ткани опухоли без метастазов и с
Таким образом, сигнальная функция ВтЖК
метастазами в регионарные лимфатические
связана с более высоким риском развития коло-
узлы [36, 41]. ЛПС значительно увеличивает
ректального рака, а также некоторых внекишеч-
подвижность опухолевых клеток и способству-
ных опухолей - рака печени, поджелудочной же-
ет лимфангиогенезу. Кроме того, установлено,
лезы, пищевода, рака легкого и желудка [29-33].
что ЛПС дозозависимо увеличивает экспрес-
Однако следует отметить, что в националь-
сию ангио- и лимфогенного фактора - фак-
ном когортном исследовании на Тайване были
тора роста эндотелия сосудов С (VEGF-C).
БИОХИМИЯ том 88 вып. 7 2023
ДИАЛОГ МИКРОБИОТИЧЕСКИХ МЕТАБОЛИТОВ
1073
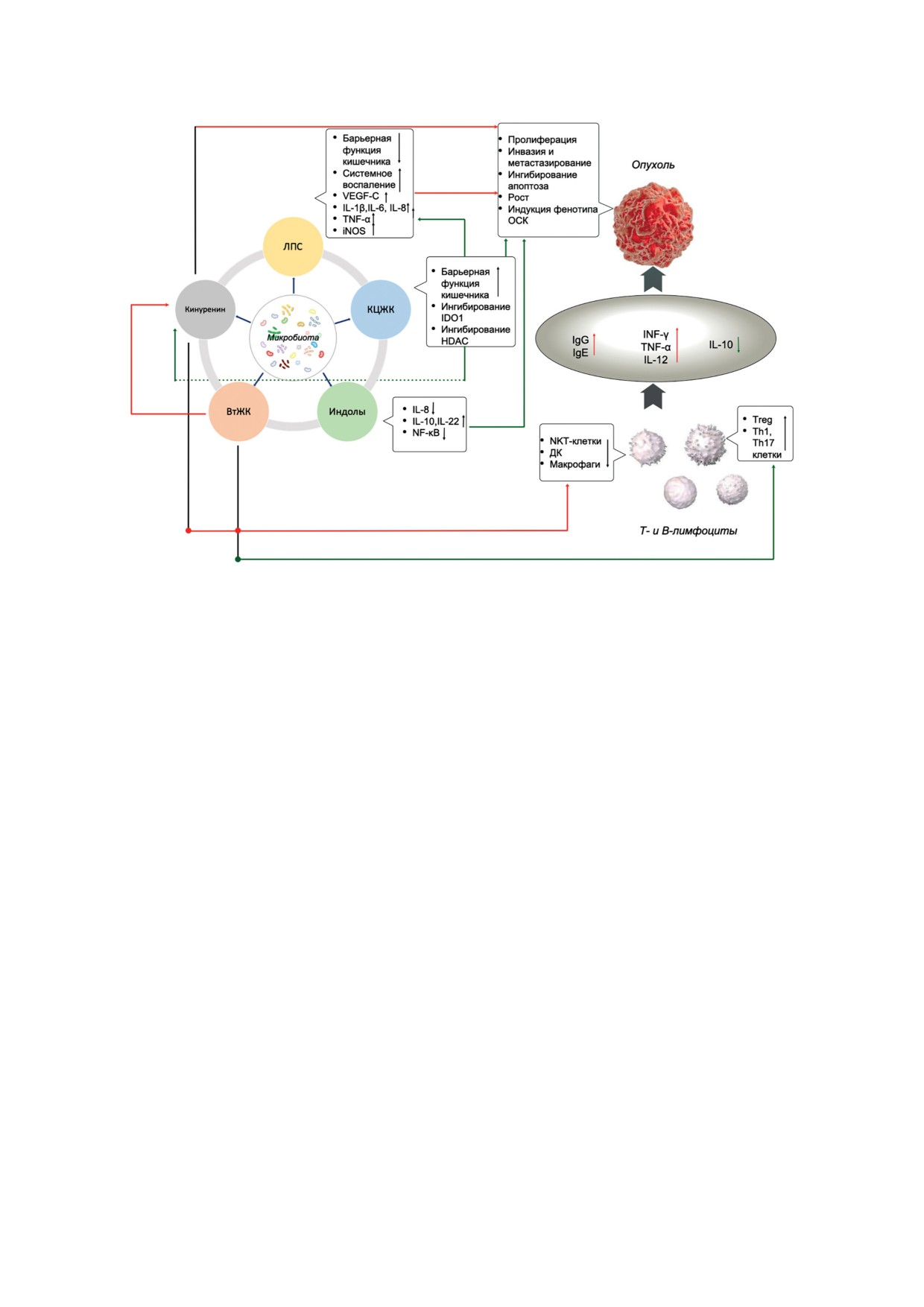
Молекулярный оркестр микробиотических метаболитов в инициации и прогрессии опухолевого роста
Также было показано, что сигнальные пути
единения имеет основополагающее значение
TLR4/NF-κB/JNK были активированы ЛПС
для здоровья хозяина и особенно критичен
для непосредственного повышения экспрес-
при канцерогенезе толстой кишки [45]. Мик-
сии VEGF-C [41]. Выступая в качестве тригге-
робное сообщество является ключевой частью
ра воспалительных реакций, ЛПС был связан
микроокружения опухоли и влияет на инициа-
с патогенезом рака, включая развитие опу-
цию злокачественной трансформации, про-
холей тучных клеток желудочно-кишечного
грессию опухолевого роста и ответ на лечение.
тракта [42] (рисунок).
Изменения в метаболизме Тrp начинаются на
В ряде исследований было продемонстри-
ранней стадии опухолевого роста как адаптив-
ровано, что различные микробные метабо-
ный механизм, позволяющий злокачествен-
литы - агонисты TLR4, действующие путем
ным клеткам избегать иммунного надзора и
активации сигнальных путей, ассоциирован-
метастазировать [46].
ных с TLR4, играют ключевую роль в регуля-
Одним из ключевых ферментов, ограни-
ции выживания и прогрессирования роста
чивающих скорость катаболизма Тrp, явля-
опухолевых клеток при раке толстой кишки,
ется индоламин-2,3-диоксигеназа 1 (IDO1),
поджелудочной железы, печени и молочной
который присутствует у Firmicutes [47]. Наи-
железы [43, 44]. Так, гиперэкспрессия TLR4
более активно IDO1 экспрессируется у родов
была установлена при колоректальном раке:
Clostridium, Lachnoclostridium, Ruminoclostridium
это способствовало повышению пролифера-
и Roseburia [47]. Активирующее влияние на
ции клеток, защите злокачественных клеток
экспрессию IDO1 оказывают провоспалитель-
от апоптоза, повышению инвазии и метаста-
ные цитокины - IFN-γ, TNF-α, простагланди-
зирования, а также созданию благоприятного
ны, липополисахариды [48]. IDO1 превращает
для опухоли клеточного микроокружения.
Тrp в N-формилкинуренин с его последую-
Более того, в последние годы все больше вни-
щей быстрой трансформацией в кинуренин,
мания уделяется изучению регуляции пере-
первый стабильный катаболит в данном пути.
дачи сигналов через TLR4 в контексте онко-
Затем из кинуренина образуются различные
генеза, связанного с колитом [44].
метаболиты, которые регулируют активность
Триптофан и его катаболиты. Метаболизм
иммунных клеток [48].
триптофана (Тrp) через кинурениновый путь и
Кинуренин регулирует иммунный гомео-
микробное превращение Тrp в индольные со- стаз в организме хозяина [49]. Эти эффекты
3
БИОХИМИЯ том 88 вып. 7 2023
1074
ШАТОВА и др.
реализуются за счет уменьшения количества
шение микробиотической продукции кинуре-
активированных Т-клеток, ДК и NKT-клеток,
нина в кале [45]. Примечательно, что введение
а также индукции апоптоза клеток Th1 для
кинурениназы, фермента, который разрушает
контроля чрезмерной воспалительной реак-
кинуренин, останавливает рост опухоли [51].
ции [45]. Каждый нижестоящий метаболит ки-
Недавно было показано, что добавки бу-
нуренина выполняет определенные функции.
тирата способствует снижению экспрессии
Кинуреновая кислота вызывает противовос-
IDO1 - таким образом, можно предположить,
палительный ответ благодаря своим антиокси-
что комменсальные бактерии контролируют
дантным свойствам, в то время как пиколи-
метаболизм Тrp и, соответственно, образова-
новая кислота проявляет противоопухолевую
ние кинуренина через обмен короткоцепочеч-
активность, подавляя активацию Т-клеток и
ных жирных кислот (КЦЖК) [47].
c-Myc (протоонкогенный белок Myc, фактор
Из индольных производных обмена Тrp
транскрипции). При этом сам c-Myc ускоряет
наиболее представленными в кишечнике яв-
поглощение Тrp в раковых клетках толстой
ляются: индол-3-ацетамид, индол-3-ацетальде-
кишки путем усиления экспрессии транспор-
гид, индол-3-пируват, индол-3-альдегид, ин-
теров Тrp (SLC7A5 и SLC1A5) [45].
дол-3-ацетат, триптамин, индол-3-пропионо-
Кроме того,
3-гидроксиантралиновая и
вая кислота и индол-3-акриловая кислота.
хинолиновая кислоты могут действовать как
Индол и производные индола, помимо того,
токсины, в том числе при раке толстой киш-
что являются критическими компонентами
ки [46]. Установлено, что при опухолевом ро-
бактериального метаболизма, играют важную
сте повышаются активность IDO1, арилформ-
связующую и сигнальную роль между функ-
амидазы и уровень кинуренина [50]. Важно
циями хозяина и микробиоты. В микробных
отметить, что сывороточные концентрации
сообществах кишечника продукция индола
кинуренина у онкобольных выше, по сравне-
влияет на образование спор, стабильность
нию со здоровыми людьми. В то же время экс-
плазмид, образование биопленки, устойчи-
прессия и активность ферментов дальнейшего
вость к антибиотикам, деление клеток и виру-
превращения кинуренина не изменяется при
лентность [52]. В организме хозяина индолы
опухолевом росте, что позволяет предполо-
активируют сигнальные пути, которые при-
жить, что кинуренин является доминантным
водят к изменениям барьерной функции ки-
метаболитом обмена Тrp, повышенным при
шечного эпителия, снижают проницаемость,
колоректальном раке [50].
способствуют иммунной толерантности, вы-
Повышенные уровни кинуренина способ-
тесняют патогены, уменьшают воспаление и
ствуют онкогенезу преимущественно двумя
контролируют выработку муцина
[53]. Ин-
путями: 1) часть продуцируемого кинуренина
дольные соединения также могут действовать
может непосредственно индуцировать инак-
через AhR, обладая как про-, так и противо-
тивацию Т-клеток и апоптоз, что приводит к
воспалительным действием [54]. Индолы мо-
уклонению от иммунного надзора; 2) остав-
гут снижать экспрессию провоспалительных
шийся кинуренин может конститутивно
факторов - IL-8 и NF-κB, и способствовать
активировать арилгидрокарбоновые рецеп-
экспрессии противовоспалительных цито-
торы (AhR), что активирует транскрипцию ге-
кинов, включая IL-10. Кроме того, индольные
нов, ответственных за ускользание опухоли от
соединения регулируют гомеостаз кишеч-
иммунного надзора, а также пролиферацию и
ника посредством индукции секреции IL-22,
метастазирование злокачественно трансфор-
что улучшает барьерную функцию, однако в
мированных клеток. Таким образом, сигналь-
контексте опухолевого роста (поздние стадии
ный путь кинуренин/AhR является одним из
заболевания) продукция IL-22 может способ-
основных факторов, способствующих разви-
ствовать прогрессивному развитию новообра-
тию рака толстой кишки [46, 50].
зования [55] (рисунок). Большинство индо-
При этом следует указать, что повышение
лов и их производных оказывают защитные
системного уровня кинуренина характерно
эффекты против воспалительных заболеваний
для больных с опухолями различной лока-
кишечника, которые зачастую предшествуют
лизации. Многие исследователи связывают
развитию рака [52].
этот факт со стимуляцией экспрессии IDO1
При изучении противоопухолевого влия-
провоспалительными цитокинами, уровень
ния Lactobacillus gallinarum было установлено,
которых повышается в организме при зло-
что данные микроорганизмы гиперпроду-
качественном опухолевом росте. Более того,
цируют Trp и индол-3-лактат и, таким обра-
у больных раком толстой кишки было обна-
зом, подавляют рост клеток колоректального
ружено снижение содержания индола и повы-
рака [56]. Также на клеточных культурах было
БИОХИМИЯ том 88 вып. 7 2023
ДИАЛОГ МИКРОБИОТИЧЕСКИХ МЕТАБОЛИТОВ
1075
показано, что обработка опухолевых клеток
кие внутриядерные уровни бутирата увеличи-
индол-3-лактатом увеличивала их апоптоз, а
вали ацетилирование гистонов и приводили
применение агонистов AhR уменьшало про-
к усилению апоптоза и снижению клеточной
тивоопухолевое действие индол-3-лактата.
пролиферации. С другой стороны, в мышиной
Было установлено, что избыточное упо-
модели онкогенеза кишечника, вызванного
требление пищевого холестерина снижает
мутациями в генах регулятора сигнального
количество нормальных представителей мик-
пути Wnt (Apc) и опухолевого супрессора, от-
робиоты кишечника - Bacteroides и Bifidobac-
ветственного за репарацию ДНК (Msh2), мик-
terium, что сопровождается снижением индол-
робиота и бутират оказывали стимулирующее
3-пропионата и развитием жировой инфиль-
действие на опухолевый рост [63]. Основным
трации печени и в конечном счете - развити-
эффектом бутирата в этой модельной системе
ем гепатоцеллюлярной карциномы [57].
было стимулирование гиперпролиферации
Короткоцепочечные
жирные кислоты.
Msh2-дефицитных эпителиальных клеток. Та-
КЦЖК являются важными посредниками ме-
ким образом, эффекты КЦЖК обусловлены
таболического сопряжения между кишечной
их способностью специфически активировать
микробиотой и организмом-хозяином. КЦЖК
определенные сигнальные пути и зависят от
могут воздействовать не только на толстую
генетических особенностей трансформирован-
кишку, но и на различные органы и системы
ных клеток и от концентрации бутирата. Эти
через системный кровоток.
исследования еще раз указывают на значи-
В недавних эпидемиологических исследо-
мость правильной интерпретации результатов
ваниях было установлено, что развитие рака
анализа микробиома и геномики опухолевых
желудка и молочной железы коррелирует с
клеток для формирования адекватных дие-
низким содержанием КЦЖК в кале [58]. Так-
тических рекомендаций для снижения риска
же недавние клинические исследования про-
развития злокачественных новообразований.
демонстрировали, что концентрация КЦЖК
Бутират может влиять на другие процессы,
в стуле больных с колоректальным раком
участвующие в эпигенетической регуляции,
ниже по сравнению со здоровыми людьми.
включая фосфорилирование и метилирование
Исследователи объясняют данное наблюде-
гистонов, метилирование ДНК и гиперацети-
ние снижением содержания бактерий, синте-
лирование негистоновых белков [13]. Установ-
зирующих КЦЖК, таких как Lachnospiraceae,
лено, что диета с бутиратом натрия уменьшает
Roseburia spp., Bifidobacterium spp., у больных с
диарею за счет снижения проницаемости ки-
раком данной локализации [59].
шечника, так как повышает экспрессию бел-
Установлено, что КЦЖК могут значи-
ков плотных контактов - клаудина-3 и окклю-
тельно снизить риск развития злокачествен-
дина [64].
ного новообразования путем ингибирования
Наиболее важными микробными группа-
роста и миграции клеток, подавления гисто-
ми, продуцирующими бутират, являются Fae-
новых деацетилаз (HDAC) и индукции апоп-
calibacterium prausnitzii и Eubacterium rectal [65].
тоза [60]. К основным КЦЖК относятся бути-
Бутират используется митохондриями коло-
рат, ацетат и пропионат [61]. Установлено, что
ноцитов, что помогает поддерживать здоро-
после внутриклеточного связывания бутирата
вый энергетический баланс данных клеток
с HDAC их ферментативная активность подав-
и способствует их пролиферации [66]. Кро-
ляется, что приводит к гиперацетилированию
ме того, бутират индуцирует экспрессию гена
гистонов и изменению экспрессии генов. Так-
P21, ингибируя сигнальный путь транскрип-
же бутират может подавлять рост опухолевых
ционного фактора AP-1 и увеличивая фос-
клеток путем активации остановки клеточ-
форилирование протоонкогена c-Fos и ми-
ного цикла и апоптоза. Так, в исследовании
тоген-активируемой киназы ERK1/2
[67].
на мышах, которых колонизировали диким
Бутират-зависимая активация пути Akt/mTOR
типом бутират-продуцирующих бактерий и
в клеточной линии гепатоцеллюлярной карци-
которых вскармливали специальной диетой,
номы приводит к активации экспрессии ауто-
содержащей пищевые волокна, установили
фагических белков (беклина 1, ATG 5, LC3-II)
подавление опухолевого роста при условии
и аутофагии, индуцированной АФК [68, 69].
применения азоксиметана и декстрансульфата
Кроме того, бутират подавляет экспрес-
натрия в качестве терапевтических средств [62].
сию микроРНК-92a (miR-92a) через c-Myc,
Согласно результатам этого исследования, гли-
что снижает пролиферацию клеток рака тол-
колитический метаболизм опухолевых клеток
стой кишки и стимулирует апоптоз [7]. Тогда
приводит к снижению метаболизма бутирата
как гиперэкспрессия miR-92a при раке тол-
и его усиленному накоплению в ядре. Высо-
стой кишки способствует росту и инвазии
БИОХИМИЯ том 88 вып. 7 2023
3*
1076
ШАТОВА и др.
путем нацеливания на kruppel-подобный фак-
злокачественных новообразований желудочно-
тор 4 (KLF4) и нижестоящий p21, а снижение
кишечного тракта используется препарат на
miR-92a может вызывать апоптоз раковых кле-
основе платины - оксалиплатин. На его эф-
ток [7].
фективность влияет взаимодействие микро-
КЦЖК способны опосредовать иммуно-
биоты кишечника и иммунной системы хо-
регуляцию через Treg, поэтому проявляют про-
зяина. Микробиота кишечника стимулирует
тивовоспалительные и антиканцерогенные эф-
миелоидные клетки для производства АФК
фекты [21].
на высоком уровне, а возникающий в резуль-
Ацетат и пропионат могут связываться
тате их действия внутриопухолевый окисли-
с рецепторами, которые ассоциированы с
тельный стресс усиливает повреждения ДНК,
G-белком - GPR41 и GPR43. Как и в случае с
связанные с оксалиплатином, что и приводит
бутиратом, стимулированные через GPR41/43
к гибели опухолевых клеток [71]. Другим при-
ацетатом и пропионатом клетки могут запу-
мером зависимого от воздействия микро-
скать сигнальный путь, предотвращающий
биоты химиопрепарата является циклофосф-
воспаление и снижающий риск злокачествен-
амид - алкилирующий агент, используемый
ной трансформации. Противовоспалительные
при гематологических злокачественных ново-
эффекты КЦЖК, обусловленные активацией
образованиях и солидных опухолях. Цикло-
GPR41/43, показаны на клетках почечного
фосфамид может повреждать эпителий тонкой
эпителия человека. Так, согласно результатам
кишки, это приводит к нарушению барьерной
исследования, КЦЖК снижали стимулирую-
функции, что, в свою очередь, делает возмож-
щую TNF-α продукцию хемоаттрактантного
ным транслокацию кишечных комменсальных
белка-1 моноцитов (MCP-1) за счет ингиби-
микроорганизмов во вторичные лимфоидные
рования фосфорилирования p38 и JNK. Также
органы, где микробы вызывают повышение
было показано, что регуляция воспаления в
пула опухоль-ассоциированных антиген-спе-
клеточных линиях человека (HeLa, HEK293)
цифических Th17-лимфоцитов [72]. Лечение
может осуществляться за счет десенсибили-
антибиотиками предотвращает такую транс-
зации GPR41/43 под влиянием β-аррестинов.
локацию микробиоты и связанную с ней по-
В случае GPR43 β-аррестин блокировал дегра-
ляризацию Т-клеток, тем самым ослабляя
дацию комплекса NF-κB с белком-ингибито-
эффективность противоопухолевой химио-
ром IκB и ядерную транслокацию NF-κB, что
терапии [73].
приводило к снижению экспрессии провоспа-
Успех иммунотерапии (а именно цито-
лительных цитокинов - IL-6 и IL-1β [70].
киновой терапии, таргетной иммунотерапии
Суммируя все вышеизложенное, можно
и вакцинотерапии) является одним из самых
отметить, что КЦЖК могут активировать раз-
значимых достижений современной онко-
личные клеточные механизмы, связанные с
логии [74]. Учитывая тесные взаимодействия
профилактикой канцерогенеза. Это влияние
микробиоты и иммунной системы, вполне
связано с регуляцией сигнальных путей, фак-
ожидаемо, что микробиотические метаболиты
торов транскрипции и состояния эпигенома.
влияют на ответ клеток хозяина на иммуно-
КЦЖК могут выступать не только как лиганды
терапию. В качестве одного из доказательств
для трансмембранных рецепторов, но и спо-
может служить снижение эффективности имму-
собны проникать в клетку и напрямую взаимо-
нотерапии CpG-олигонуклеотидами у мышей
действовать с внутриклеточными мишенями.
с подкожными опухолями, опосредованное
Однако важно учитывать, что эффекты КЦЖК
дисбиозом, возникающим при применении
могут меняться на противоположные (прокан-
антибиотиков [71]. Учитывая тот факт, что им-
церогенные) при наличии определенных гене-
мунотерапия обладает эффективностью при
тических особенностей опухолевых клеток, а
меланоме, раке мочевого пузыря, почки и лег-
также в зависимости от концентрации КЦЖК
кого, но не при раке толстой кишки (которая
в опухолевом микроокружении (рисунок).
наиболее плотно заселена бактериями) [1, 2,
75], особенно остро стоит вопрос о том, каким
образом микробиота способствует успеху им-
ВЛИЯНИЕ МИКРОБИОТИЧЕСКИХ
мунотерапии.
МЕТАБОЛИТОВ НА УСПЕХ
В исследованиях на мышах было показано,
ПРОТИВООПУХОЛЕВОЙ ТЕРАПИИ
что присутствие таких представителей мик-
робиоты кишечника, как Bifidobacterium spp.,
Микробиота кишечника значимо влияет
было способно усиливать эффективность
на эффективность химиотерапии. В химиоте-
анти-PD1 иммунотерапии [76], тогда как Bac-
рапевтической практике для лечения некоторых
teroides thetaiotaomicron и B. fragilis были связаны
БИОХИМИЯ том 88 вып. 7 2023
ДИАЛОГ МИКРОБИОТИЧЕСКИХ МЕТАБОЛИТОВ
1077
с усилением эффектов ингибиторов CTLA-4
В результате нарушений физиологии хо-
(клеточный рецептор суперсемейства имму-
зяина и состава микробиотического сообще-
ноглобулинов) [76, 77]. Кроме того, противо-
ства при инициации канцерогенеза коммен-
опухолевая эффективность анти-PD-1/L1
салы могут оказывать патогенное влияние, что
терапии была связана с несколькими бакте-
приводит к усилению воспаления в кишеч-
риями, включая Akkermansia, Faecalibacterium,
нике у хозяина, а также к образованию био-
Clostridia spp. и Bifidobacterium spp. [78]. Эти
пленки [83]. Увеличение Enterococcus faecalis и
эффекты отчасти обусловлены воздействием
E. coli усиливают выработку воспалительных
микробных метаболитов, таких как бутират и
сигнальных молекул (IFN-γ и IL-4) в клетках
пропионат. Однако несмотря на то, что в неко-
кишечника, способных индуцировать повы-
торых случаях высокие уровни КЦЖК в кале
шенную экспрессию IDO1 и изменять мета-
были связаны с более длительной выживае-
болизм организма больного [84]. F. nucleatum
мостью без прогрессирования или усиленным
вызывает значительно большую экспрессию
противоопухолевым ответом, высокие систем-
провоспалительного цитокина TNF-α, что
ные уровни КЦЖК, напротив, ассоцииро-
приводит к гиперактивации IDO1 [84]. F. nu-
ваны с плохим ответом на лечение (т.е. неэф-
cleatum и Peptostreptococcus anaerobius могут при-
фективностью терапии) [79]. Бутират также
крепляться к опухолевым клеткам через бел-
может ограничивать способность дендритных
ки адгезии к клеточной поверхности, акти-
клеток индуцировать опухольспецифичные
вируя путь PI3k/Akt, ведущий к повышенной
Т-клетки и Т-клетки памяти, тем самым огра-
пролиферации клеток [11]. Следует отметить,
ничивая эффективность иммунотерапии про-
что оба вида микроорганизмов также могут
тив CTLA-4 (cytotoxic T-lymphocyte-associated
продуцировать высокие уровни индолов в
protein 4) [80]. Альтернативные пути взаимо-
результате катаболизма Тrp. Следовательно,
действия
«микробиом-хозяин» в контексте
микробиом является ключевым фактором вос-
иммунотерапии злокачественных опухолей
паления именно за счет изменения метаболиз-
включают прямую стимуляцию ДК в лимфа-
ма Тrp [45].
тических узлах Akkermansia muciniphila [81] или
Важным, в том числе микробиотическим,
Bacteroides spp. посредством индукции проти-
онкометаболитом является кинуренин. Его об-
воопухолевого иммунного ответа Th1 и CD8+
разование, как было описано выше, зависит от
T-клеток [77].
уровня экспрессии и активности IDO1. В то же
Более того, микробиота кишечника, веро-
время установлено, что экспрессия IDO1 зави-
ятно, влияет и на токсичность иммунотера-
сит от содержания КЦЖК [47]. Эксперимен-
пии, учитывая развитие тяжелого колита у
тально подтверждено, что бутират и в меньшей
некоторых пациентов, получающих таргетную
степени пропионат, изобутират, изовалерат и
терапию [82] (например, антитела к CTLA-4
валериат подавляют активность IDO1 в бак-
и PD-L1), и значимую роль кишечных микро-
териальных супернатантах. При этом сниже-
бов в его патогенезе.
ние уровней КЦЖК в кале и в плазме крови
является плохим прогностическим признаком
в прогрессии опухоли. Отмечено и снижение
МОЛЕКУЛЯРНЫЙ ОРКЕСТР
уровней Trp и микробных индольных катабо-
МИКРОБИОТИЧЕСКИХ МЕТАБОЛИТОВ
литов, которые выполняют множество протек-
ПРИ КАНЦЕРОГЕНЕЗЕ
тивных функций [47].
Следует отметить различные иммуномоду-
Безусловно, различные метаболиты мик-
лирующие эффекты бактериальных метаболи-
робиоты кишечника оказывают разнонаправ-
тов, напрямую влияющие на избегание опу-
ленные эффекты в зависимости от их кон-
холью иммунного ответа или, напротив, на
центрации и наличия и представленности их
нацеливание иммунных клеток против клеток
специфических мишеней - рецепторов. Одна-
опухоли. Так, известно, что макрофаги после
ко, на наш взгляд, в «метаболомном звездном
активации ЛПС играют важную роль в стиму-
небе», которое, вне сомнения, отличается у
ляции образования и активности инфламма-
здоровых людей и у больных со злокачествен-
сомы, продуцирующей большие количества
ными новообразованиями, имеются свои
провоспалительных цитокинов CCL2, TNF-α,
характерные
«созвездия»
- специфические
IL-12 и IL-6. В исследовании Nastasi et al. [85]
молекулярные сдвиги, которые, согласно «эф-
было показано, что бутират и пропионат иг-
фекту домино», вовлекаются в слаженный и
рают решающую роль в модулировании им-
необратимый патологический механизм кан-
мунных ответов в зрелых ДК человека. Со-
церогенеза.
гласно результатам исследования, пропионат
БИОХИМИЯ том 88 вып. 7 2023
1078
ШАТОВА и др.
и бутират проявляли способность значительно
профиль характеризуется повышением обра-
снижать экспрессию и секрецию IL-6. Кроме
зования ВтЖК, которые являются факторами
того, бутират и пропионат снижали индуци-
агрессии в опухолевой трансформации кле-
рованную ЛПС экспрессию генов и продук-
ток. Так, ВтЖК ингибируют TLR4-зависимую
цию белков IL-12B (IL-12p40), общего ком-
активацию макрофагов селезенки и кишеч-
понента для образования как IL-12p40, так
ника [22] и, таким образом, одновременно с
и IL-23 [86]. Эти данные позволили авторам
кинуренином подавляют работу иммуноком-
выдвинуть гипотезу о том, что обе КЦЖК об-
петентных клеток и создают благоприятные
условливают наивную поляризацию Т-клеток,
для иммуносупрессии профили сигнальных
уменьшая провоспалительные функции Th1
молекул и их целевых путей (рисунок).
и Th17 и, следовательно, сдвигая баланс в сто-
рону формирования противовоспалительных
популяций, таких как Treg, при этом ставя под
ЗАКЛЮЧЕНИЕ
угрозу продукцию IL-12 и IL-23. Кроме того,
оказалось, что активность бутирата и пропио-
Фактически все ткани и органы человече-
ната является избирательной, поскольку эти
ского организма оказываются под влиянием
КЦЖК воздействовали на экспрессию первич-
комменсальной микробиоты, населяющей его.
ных генов ответа на ЛПС, (в частности, генов
Молекулярное сопряжение между бактериаль-
семейства TNF-α и CCL2), в то время как дру-
ными и эукариотическими клетками, длитель-
гие гены (например, гены человеческого лей-
но формировавшееся в процессе эволюции,
коцитарного антигена HLA-DR, кодирующего
привело к созданию сложной сети взаимодей-
рецептор главного комплекса гистосовмести-
ствий, имеющей множество пересечений в
мости класса II, CD86, IL1A, IL1B) не были
виде сигнальных путей, работа которых опре-
подвержены влиянию или даже активирова-
деляется как метаболитами микробиоты, так
лись под воздействием КЦЖК [85].
и клетками хозяина. Ожидаемо, микробиота
Кишечная щелочная фосфатаза обезвре-
оказывает влияние не только на поддержание
живает ЛПС, катализируя дефосфорилиро-
физиологических функций, но и вовлечена в
вание активной (токсичной) части липида A,
патогенез множества заболеваний человека, не
тем самым предотвращая местное воспале-
исключая злокачественный рост. Неслучайно
ние, а также транслокацию активного ЛПС
состояние дисбиоза и полиморфного мик-
в системный кровоток [37]. Активность дан-
робиома признано одной из ключевых осо-
ного фермента сильно зависит от уровня сво-
бенностей канцерогенеза
[90]. Выступая в
бодных аминокислот L-ряда и особенно от
качестве мутагенов или сигнальных молекул,
уровня L-фенилаланина (Phe) [87]. Дисбиоз и
аберрантно модулирующих работу сигнальных
повышение уровня Phe, тирозина (Tyr) и Trp
путей хозяина, микробиотические метаболиты
характерно для микробиоты, которая форми-
могут инициировать злокачественную транс-
рует микробиотическое окружение раковых
формацию, способствовать прогрессии роста
клеток [88]. В свою очередь, повышение уров-
опухоли и ее метастазированию. С другой
ня Phe приводит к ингибированию кишечной
стороны, многие метаболиты обладают онко-
щелочной фосфатазы, что логично приводит к
протективным действием, направляя работу
нарушению дефосфорилирования ЛПС и его
иммунной системы хозяина против опухоли
активной транслокации в системный крово-
или напрямую стимулируя апоптоз и сенес-
ток. Через TLR4 и NF-κB ЛПС формирует
ценцию злокачественно трансформированных
провоспалительный и проканцерогеннный ста-
клеток. Эффективность противоопухолевой
тус. Провоспалительные цитокины являются
терапии также во многом зависит от состава
регуляторами активности катаболизма Trp и
микробиома, а трансплантация микробиоты
образования кинуренина. Данная биогенная
рассматривается как один из многообещаю-
молекула подавляет иммунный надзор за зло-
щих подходов к повышению успеха лечения
качественной трансформацией клеток. В свою
и выживаемости онкологических пациен-
очередь, КЦЖК выступают с защитной функ-
тов [91]. Однако, несмотря на лавинообразное
цией, подавляя регуляторный фермент обра-
увеличение числа исследований, посвященных
зования кинуренина [47]. Однако возникший,
роли микробиоты в канцерогенезе, точные
видимо, первично проонкогенный дисбио-
механизмы действия микробных метаболитов
тический профиль характеризуется сниже-
на организм хозяина остаются непонятными.
нием числа микроорганизмов, ответственных
Мы видим, что некоторые метаболиты (на-
за продукцию бутирата и других КЦЖК [89].
пример, бутират) оказывают плейотропные и
Кроме того, проонкогенный дисбиотический
разнонаправленные эффекты на разные типы
БИОХИМИЯ том 88 вып. 7 2023
ДИАЛОГ МИКРОБИОТИЧЕСКИХ МЕТАБОЛИТОВ
1079
клеток в зависимости от состояния дифферен-
Вклад авторов. О.П. Шатова, А.А. Заболот-
цировки, определенного генетического фона,
нева - концепция и написание работы; А.В. Ше-
концентрации самого метаболита. Более того,
стопалов - редактирование текста статьи.
эффекты таких регуляторных молекул зача-
Финансирование. Работа выполнена за счет
стую находятся под влиянием других сигналь-
средств госбюджета.
ных метаболитов, продуцируемых микробио-
Конфликт интересов. Авторы декларируют
той, и опухолевого микроокружения. Изучая
отсутствие явных и потенциальных конфлик-
возможные варианты действия микробных
тов интересов, связанных с публикацией дан-
факторов, в перспективе кажется возможным
ной статьи.
использование модулирующего потенциала та-
Соблюдение этических норм. Настоящая
ких метаболитов для борьбы со злокачествен-
статья не содержит описания каких-либо ис-
ными опухолями и повышения эффективно-
следований с участием людей или животных в
сти лечения.
качестве объектов.
СПИСОК ЛИТЕРАТУРЫ
1.
Попова О. П., Шегай П. В., Иванов А. А., Дани-
Colibactin: beyond DNA damage and cancer,
лова Т. И., Алексеев Б. Я., Каприн А. Д. (2008)
Trends Microbiol.,
30,
1146-1159, doi:
10.1016/
Молекулярные механизмы развития рака предста-
j.tim.2022.05.010.
тельной железы: корреляция уровней EGF, HGF
9.
Dougherty, M. W., and Jobin, C. (2021) Shining a
и VEGF с клинико-морфологическими парамет-
light on colibactin biology, Toxins (Basel), 13, 346,
рами, Мол. Мед., 4, 40-46.
doi: 10.3390/toxins13050346.
2.
Zolotovskaia, M. A., Sorokin, M. I., Petrov, I. V.,
10.
Ansari, S., and Yamaoka, Y. (2019) Helicobacter pylori
Poddubskaya, E. V., Moiseev, A. A., Sekacheva, M. I.,
virulence factors exploiting gastric colonization and its
Borisov, N. M., Tkachev, V. S., Garazha, A. V., Kaprin,
pathogenicity, Toxins (Basel), 11, 677, doi: 10.3390/
A. D., Shegay, P. V., Giese, A., Kim, E., Roumiantsev,
toxins11110677.
S. A., and Buzdin, A. A. (2020) Disparity between
11.
Guo, P., Tian, Z., Kong, X., Yang, L., and Shan, X.,
inter-patient molecular heterogeneity and repertoires
(2020) FadA promotes DNA damage and progression
of target drugs used for different types of cancer in
of Fusobacterium nucleatum-induced colorectal cancer
clinical oncology, Int. J. Mol. Sci., 21, 1580.
through up-regulation of chk2, J. Exp. Clin. Cancer
3.
Dominguez-Bello, M. G., Godoy-Vitorino, F.,
Res., 39, 202, doi: 10.1186/s13046-020-01677-w.
Knight, R., and Blaser, M. J. (2019) Role of the
12.
Tabowei, G., Gaddipati, G. N., Mukhtar, M.,
microbiome in human development, Gut, 68, 1108-
Alzubaidee, M. J., Dwarampudi, R. S., Sheena, M.,
1114, doi: 10.1136/gutjnl-2018-317503.
Bichenapally, S., Khachatryan, V., Muazzam, A.,
4.
Agus, A., Clément, K., and Sokol, H. (2021) Gut
Hama, C., Velugoti, L., and Lubna, M. (2022) Micro-
microbiota-derived metabolites as central regulators in
biota dysbiosis a cause of colorectal cancer or not?
metabolic disorders, Gut, 70, 1174-1182, doi: 10.1136/
Cureus, 14, e30893, doi: 10.7759/cureus.30893.
gutjnl-2020-323071.
13.
Tsvetikova, S. A., and Koshel, E. I. (2020) Microbiota
5.
Matson, V., Chervin, C. S., and Gajewski, T. F.
and cancer: host cellular mechanisms activated by gut
(2021) Cancer and the microbiome - influence of the
microbial metabolites, Int. J. Med. Microbiol., 310,
commensal microbiota on cancer, immune responses,
151425, doi: 10.1016/j.ijmm.2020.151425.
and immunotherapy, Gastroenterology, 160, 600-613,
14.
Visekruna, A., and Luu, M. (2021) The role of short-
doi: 10.1053/j.gastro.2020.11.041.
chain fatty acids and bile acids in intestinal and
6.
Oh, J. K., and Weiderpass, E. (2014) Infection and
liver function, inflammation, and carcinogenesis,
cancer: global distribution and burden of diseases,
Front. Cell Dev. Biol., 9, 703218, doi: 10.3389/fcell.
Ann. Glob. Health,
80,
384-392, doi:
10.1016/
2021.703218.
j.aogh.2014.09.013.
15.
Režen, T., Rozman, D., Kovács, T., Kovács, P.,
7.
Fang, Y., Yan, C., Zhao, Q., Xu, J., Liu, Z., Gao, J.,
Sipos, A., Bai, P., and Miko, E. (2022) The role of bile
Zhu, H., Dai, Z., Wang, D., and Tang, D. (2021)
acids in carcinogenesis, Cell. Mol. Life Sci., 79, 243,
The roles of microbial products in the development
doi: 10.1007/s00018-022-04278-2.
of colorectal cancer, Bioengineered,
12,
720-735,
16.
Mikó, E., Kovács, T., Sebő, É., Tóth, J., Csonka, T.,
doi: 10.1080/21655979.2021.
Ujlaki, G., Sipos, A., Szabo, J., Mehes, G., and Bai, P.
8.
Chagneau, C. V., Payros, D., Tang-Fichaux, M.,
(2019) Microbiome microbial metabolome cancer cell
Auvray, F., Nougayrède, J. P., and Oswald, E.
interactions in breast cancer familiar, but unexplored,
(2022) The pks island: a bacterial Swiss army knife?
Cells, 8, 293, doi: 10.3390/cells8040293.
БИОХИМИЯ том 88 вып. 7 2023
1080
ШАТОВА и др.
17.
Cai, J., Sun, L., and Gonzalez, F. J. (2022) Gut
ation, Nature, 576, 143-148, doi: 10.1038/s41586-
microbiota-derived bile acids in intestinal immunity,
019-1785-z.
inflammation, and tumorigenesis, Cell Host Microbe,
29.
Hertli, S., and Zimmermann, P. (2022) Molecular
30, 289-300, doi: 10.1016/j.chom.2022.02.004.
interactions between the intestinal microbiota and the
18.
Wells, J. E., and Hylemon, P. B. (2000) Identification
host, Mol. Microbiol., 117, 1297-1307, doi: 10.1111/
and characterization of a bile acid 7α-dehydroxylation
mmi.14905.
operon in Clostridium sp. strain TO-931, a highly active
30.
Ma, C., Han, M., Heinrich, B., Fu, Q., Zhang, Q.,
7α-dehydroxylating strain isolated from human feces,
Sandhu, M., Agdashian, D., Terabe, M., Berzofsky,
Appl. Environ. Microbiol., 66, 1107-1113, doi: 10.1128/
J. A., Fako, V., Ritz, T., Longerich, T., Theriot, C. M.,
AEM.66.3.1107-1113.2000.
McCulloch, J. A., Roy, S., Yuan, W., Thovarai, V.,
19.
Biagioli, M., Marchianò, S., Carino, A., di Giorgio, C.,
Sen, S. K., Ruchirawat, M., Korangy, F., Wang, X. W.,
Santucci, L., Distrutti, E., and Fiorucci, S. (2021)
Trinchieri, G., and Greten, T. F.
(2018) Gut
Bile acids activated receptors in inflammatory bowel
microbiome-mediated bile acid metabolism regulates
disease, Cells, 10, 1281, doi: 10.3390/cells10061281.
liver cancer via NKT cells, Science, 360, eaan5931,
20.
Cai, X., Young, G. M., and Xie, W. (2021) The xeno-
doi: 10.1126/science.aan5931.
biotic receptors PXR and CAR in liver physiology, an
31.
Liu, X., Chen, B., You, W., Xue, S., and Qin, H.
update, Biochim. Biophys. Acta Mol. Basis Dis., 1867,
(2018) The membrane bile acid receptor TGR5
166101, doi: 10.1016/j.bbadis.2021.166101.
drives cell growth and migration via activation of the
21.
Meng, C., Bai, C., Brown, T. D., Hood, L. E.,
JAK2/STAT3 signaling pathway in non-small cell
and Tian, Q. (2018) Human gut microbiota and
lung cancer, Cancer Lett., 412, 194-207, doi: 10.1016/
gastrointestinal cancer, Genom. Proteom. Bioinform.,
j.canlet.2017.10.017.
16, 33-49, doi: 10.1016/j.gpb.2017.06.002.
32.
Chen, M., Ye, A., Wei, J., Wang, R., and Poon, K.
22.
Fiorucci, S., Biagioli, M., Zampella, A., and Distrutti,
(2020) Deoxycholic acid upregulates the reprogram-
E. (2018) Bile acids activated receptors regulate innate
ming factors KFL4 and OCT4 through the IL-6/
immunity, Front. Immunol., 9, 1853, doi: 10.3389/
STAT3 pathway in esophageal adenocarcinoma cells,
fimmu.2018.01853.
Technol. Cancer Res. Treat., 19, 194-207, doi: 10.1016/
23.
Fiorucci, S., Carino, A., Baldoni, M., Santucci, L.,
j.canlet.2017.10.017.
Costanzi, E., Graziosi, L., and Biagioli, M. (2021)
33.
Yasuda, H., Hirata, S., Inoue, K., Mashima, H.,
Bile acid signaling in inflammatory bowel diseases,
Ohnishi, H., and Yoshiba, M. (2007) Involvement
Dig. Dis. Sci., 66, 674-693, doi: 10.1007/s10620-
of membrane-type bile acid receptor M-BAR/
020-06715-3.
TGR5 in bile acid-induced activation of epidermal
24.
Davis, S. K., Selva, K. J., Kent, S. J., and Chung,
growth factor receptor and mitogen-activated
A. W. (2020) Serum IgA Fc effector functions in
protein kinases in gastric carcinoma cells, Biochem.
infectious disease and cancer, Immunol. Cell Biol., 98,
Biophys. Res. Commun., 354, 154-159, doi: 10.1016/
276-286, doi: 10.1111/imcb.12306.
j.bbrc.2006.12.168.
25.
Yang, P., Peng, Y., Feng, Y., Xu, Z., Feng, P., Cao, J.,
34.
Huang, W. K., Hsu, H. C., Liu, J. R., Yang, T. S.,
Chen, Y., Chen, X., Cao, X., Yang, Y., and Jie, J. (2021)
Chen, J. S., Chang, J. W., Lin, Y. C., Yu, K. H.,
Immune cell-derived extracellular vesicles
- new
Kuo, C. F., and See, L. C. (2016) The association
strategies in cancer immunotherapy, Front. Immunol.,
of ursodeoxycholic acid use with colorectal cancer
12, 771551, doi: 10.3389/fimmu.2021.771551.
risk, Medicine (Baltimore), 95, e2980, doi: 10.1097/
26.
Mirlekar, B.
(2022) Tumor promoting roles of
MD.0000000000002980.
IL-10, TGF-β, IL-4, and IL-35: Its implications
35.
Heinbockel, L., Weindl, G., Martinez-de-Tejada, G.,
in cancer immunotherapy, SAGE Open Med., 10,
Correa, W., Sanchez-Gomez, S., Bárcena-Varela, S.,
20503121211069012, doi: 10.1177/20503121211069012.
Goldmann, T., Garidel, P., Gutsmann, T., and
27.
He, B., Liu, Y., Hoang, T. K., Tian, X., Taylor, C. M.,
Brandenburg, K. (2018) Inhibition of lipopolysaccha-
Luo, M., Tran, D. Q., Tatevian, N., and Rhoads, J. M.
ride- and lipoprotein-induced inflammation by an-
(2019) Antibiotic-modulated microbiome suppresses
titoxin peptide Pep19-2.5, Front. Immunol., 9, 1704,
lethal inflammation and prolongs lifespan in Treg-
doi: 10.3389/fimmu.2018.01704.
deficient mice, Microbiome, 7, 145, doi: 10.1186/
36.
Sahoo, D. K., Borcherding, D. C., Chandra, L.,
s40168-019-0751-1.
Jergens, A. E., Atherly, T., Bourgois-Mochel, A.,
28.
Hang, S., Paik, D., Yao, L., Kim, E., Trinath, J.,
Ellinwood, N. M., Snella, E., Severin, A. J.,
Hang, S., Paik, D., Yao, L., Kim, E., Trinath, J.,
Martin, M., Allenspach, K., and Mochel, J. P.
Lu, J., Ha, S., Nelson, B. N., Kelly, S. P., Wu, L.,
(2022) Differential transcriptomic profiles following
Zheng, Y., Longman, R. S., Rastinejad, F., Devlin,
stimulation with lipopolysaccharide in intestinal
A. S., Krout, M. R., Fischbach, M. A., Littman, D. R.,
organoids from dogs with inflammatory bowel disease
and Huh, J. R. (2019) Author correction: bile acid
and intestinal mast cell tumor, Cancers (Basel), 14,
metabolites control TH17 and Treg cell differenti-
3525, doi: 10.3390/cancers14143525.
БИОХИМИЯ том 88 вып. 7 2023
ДИАЛОГ МИКРОБИОТИЧЕСКИХ МЕТАБОЛИТОВ
1081
37.
Ghosh, S. S., Wang, J., Yannie, P. J., and Ghosh, S.
Blottiere, H., and Lapaque, N. (2018) Butyrate pro-
(2020) Intestinal barrier dysfunction, LPS translo-
duced by commensal bacteria down-regulates indol-
cation, and disease development, J. Endocr. Soc., 4,
amine 2,3-dioxygenase 1 (IDO-1) expression via a dual
bvz039, doi: 10.1210/jendso/bvz039.
mechanism in human intestinal epithelial cells, Front.
38.
Cani, P. D., Amar, J., Iglesias, M. A., Poggi, M.,
Immunol., 9, 2838, doi: 10.3389/fimmu.2018.02838.
Knauf, C., Bastelica, D., Neyrinck, A. M., Fava, F.,
48.
Savitz, J. (2020) The kynurenine pathway: a finger in
Tuohy, K. M., Chabo, C., Waget, A., Delmée, E.,
every pie, Mol. Psychiatry, 25, 131-147, doi: 10.1038/
Cousin, B., Sulpice, T., Chamontin, B., Ferrières, J.,
s41380-019-0414-4.
Tanti, J. F., Gibson, G. R., Casteilla, L., Delzenne,
49.
Shestopalov, A. V., Shatova, O. P., Karbyshev, M. S.,
N. M., Alessi, M. C., and Burcelin, R.
(2007)
Gaponov, A. M., Moskaleva, N. E., Appolonova,
Metabolic endotoxemia initiates obesity and insulin
S. A., Tutelyan, A. V., Makarov, V. V., Yudin, S. M.,
resistance, Diabetes,
56,
1761-1772, doi:
10.2337/
and Roumiantsev, S. A.
(2021)
“Kynurenine
db06-1491.
switch” and obesity, Bull. Sib. Med., 20, 103-111,
39.
Nighot, M., Al-Sadi, R., Guo, S., Rawat, M.,
doi: 10.20538/1682-0363-2021-4-103-111.
Nighot, P., Watterson, M., and Ma, T. (2017) Lipo-
50.
Venkateswaran, N., Lafita-Navarro, M. C., Hao,
polysaccharide-induced increase in intestinal epi-
Y. H., Kilgore, J. A., Perez-Castro, L., Braverman, J.,
thelial tight permeability is mediated by toll-like re-
Borenstein-Auerbach, N., Kim, M., Lesner, N. P.,
ceptor 4/myeloid differentiation primary response 88
Mishra, P., Brabletz, T., Shay, J. W., DeBerardinis,
(MyD88) activation of myosin light chain kinase ex-
R. J., Williams, N. S., Yilmaz, O. H., and Conacci-
pression, Am. J. Pathol., 187, 2698-2710, doi: 10.1016/
Sorrell, M. (2019) MYC promotes tryptophan uptake
j.ajpath.2017.08.005.
and metabolism by the kynurenine pathway in
40.
Jain, S., Dash, P., Minz, A. P., Satpathi, S., Samal,
colon cancer, Genes Dev., 33, 24-26, doi: 10.15698/
A. G., Behera, P., Satpathi, P., and Senapati, S. (2019)
cst2020.01.210.
Lipopolysaccharide (LPS) enhances prostate cancer
51.
Triplett, T. A., Garrison, K. C., Marshall, N.,
metastasis potentially through NF-κB activation
Donkor, M., Blazeck, J., Lamb, C., Qerqez, A.,
and recurrent dexamethasone administration fails to
Dekker, J. D., Tanno, Y., Lu, W. C., Karamitros, C. S.,
suppress it in vivo, Prostate, 79, 168-182, doi: 10.1002/
Ford, K., Tan, B., Zhang, X. M., McGovern, K.,
pros.23722.
Coma, S., Kumada, Y., Yamany, M. S., Sentandreu, E.,
41.
Zhu, G., Huang, Q., Huang, Y., Zheng, W., Hua, J.,
Fromm, G., Tiziani, S., Schreiber, T. H., Manfredi, M.,
Yang, S., Zhuang, Z., Wang, J., and Ye, J. (2016) Li-
Ehrlich, L. I., Stone, E., and Georgiou, G. (2018)
popolysaccharide increases the release of VEGF-C
Reversal of indoleamine 2,3-dioxygenase-mediated
that enhances cell motility and promotes lymphangio-
cancer immune suppression by systemic kynurenine
genesis and lymphatic metastasis through the TLR4-
depletion with a therapeutic enzyme, Nat. Biotechnol.,
NF-κB/JNK pathways in colorectal cancer, Oncotar-
36, 758-764, doi: 10.1038/nbt.4180.
get, 7, 73711-73724, doi: 10.18632/oncotarget.12449.
52.
Hendrikx, T., and Schnabl, B.
(2019) Indoles:
42.
Hand, T. W., Vujkovic-Cvijin, I., Ridaura, V. K., and
metabolites produced by intestinal bacteria capable of
Belkaid, Y. (2016) Linking the microbiota, chronic
controlling liver disease manifestation, J. Intern. Med.,
disease, and the immune system, Trends Endocrinol.
286, 32-40, doi: 10.1111/joim.12892.
Metab., 27, 831-843, doi: 10.1016/j.tem.2016.08.003.
53.
Chew, S. S., Tan, L. T., Law, J. W., Pusparajah, P.,
43.
Zhao, H., Wu, L., Yan, G., Chen, Y., Zhou, M.,
Goh, B. H., Ab Mutalib, N. S., and Lee, L. H. (2020)
Wu, Y., and Li, Y. (2021) Inflammation and tumor
Targeting gut microbial biofilms - a key to hinder
progression: signaling pathways and targeted
colon carcinogenesis? Cancers (Basel),
12,
2272,
intervention, Signal. Transduct. Target Ther., 6, 263,
doi: 10.3390/cancers12082272.
doi: 10.1038/s41392-021-00658-5.
54.
Alexeev, E. E., Lanis, J. M., Kao, D. J., Campbell,
44.
Guo, J., Liao, M., and Wang, J. (2021) TLR4 signaling
E. L., Kelly, C. J., Battista, K. D., Gerich, M. E.,
in the development of colitis-associated cancer and its
Jenkins, B. R., Walk, S. T., Kominsky, D. J., and
possible interplay with microRNA-155, Cell Commun.
Colgan, S. P. (2018) Microbiota-derived indole me-
Signal., 19, 90, doi: 10.1186/s12964-021-00771-6.
tabolites promote human and murine intestinal ho-
45.
Venkateswaran, N., and Conacci-Sorrell, M. (2020)
meostasis through regulation of interleukin-10 re-
Kynurenine: an oncometabolite in colon cancer, Cell
ceptor, Am. J. Pathol., 188, 1183-1194, doi: 10.1016/
Stress, 4, 24-26, doi: 10.15698/cst2020.01.210.
j.ajpath.2018.01.011.
46.
Wyatt, M., and Greathouse, K. L. (2021) Targeting
55.
Busbee, P. B., Menzel, L., Alrafas, H. R., Dopkins, N.,
dietary and microbial tryptophan-indole metabolism
Becker, W., Miranda, K., Tang, C., Chatterjee, S.,
as therapeutic approaches to colon cancer, Nutrients,
Singh, U., Nagarkatti, M., and Nagarkatti, P. S. (2020)
13, 1189, doi: 10.3390/nu13041189.
Indole-3-carbinol prevents colitis and associated
47.
Martin-Gallausiaux, C., Larraufie, P., Jarry, A., Béguet-
microbial dysbiosis in an IL-22-dependent manner,
Crespel, F., Marinelli, L., Ledue, F., Reimann, F.,
JCI Insight, 5, e127551, doi: 10.1172/jci.insight.127551.
БИОХИМИЯ том 88 вып. 7 2023
1082
ШАТОВА и др.
56.
Sugimura, N., Li, Q., Chu, E. S., Lau, H. C.,
promotes tight junction protein expression in colon
Fong, W., Liu, W., Liang, C., Nakatsu, G., Su, A. C.,
in a GPR109A-dependent manner, Cell. Physiol.
Coker, O. O., Wu, W. K., Chan, F. K., and Yu, J.
Biochem., 47, 1617-1629, doi: 10.1159/000490981.
(2022) Lactobacillus gallinarum modulates the gut
65.
Li, H. B., Xu, M. L., Xu, X. D., Tang, Y. Y., Jiang,
microbiota and produces anti-cancer metabolites to
H. L., Li, L., Xia, W. J., Cui, N., Bai, J., Dai, Z. M.,
protect against colorectal tumourigenesis, Gut, 71,
Han, B., Li, Y., Peng, B., Dong, Y. Y., Aryal, S.,
2011-2021, doi: 10.1136/gutjnl-2020-323951.
Manandhar, I., Eladawi, M. A., Shukla, R., Kang,
57.
Zhang, X., Coker, O. O., Chu, E. S., Fu, K., Lau,
Y. M., Joe, B., and Yang, T. (2022) Faecalibacterium
H. C., Wang, Y. X., Chan, A. W., Wei, H., Yang, X.,
prausnitzii attenuates CKD via butyrate-renal
Sung, J. J., and Yu, J. (2021) Dietary cholesterol
GPR43 axis, Circ Res., 131, e120-e134, doi: 10.1161/
drives fatty liver-associated liver cancer by modulating
CIRCRESAHA.122.320184.
gut microbiota and metabolites, Gut, 70, 761-774,
66.
Singh, N., Gurav, A., Sivaprakasam, S., Brady, E.,
doi: 10.1136/gutjnl-2019-319664.
Padia, R., Shi, H., Thangaraju, M., Prasad,
58.
Mirzaei, R., Afaghi, A., Babakhani, S., Sohrabi,
P. D., Manicassamy, S., Munn, D. H., Lee, J. R.,
M. R., Hosseini-Fard, S. R., Babolhavaeji, K., Khani,
Offermanns, S., and Ganapathy, V. (2014) Activation of
A. A., Yousefimashouf, R., and Karampoor, S. (2021)
Gpr109a, receptor for niacin and the commensal me-
Role of microbiota-derived short-chain fatty ac-
tabolite butyrate, suppresses colonic inflammation and
ids in cancer development and prevention, Biomed.
carcinogenesis, Immunity, 40, 128-139, doi: 10.1016/
Pharmacother.,
139,
111619, doi:
10.1016/j.biopha.
j.immuni.2013.12.007.
2021.111619.
67.
Pudlo, N. A., Urs, K., Kumar, S. S., German, J. B.,
59.
Yusuf, F., Adewiah, S., Syam, A. F., and Fatchiyah, F.
Mills, D. A., and Martens, E. C. (2015) Symbiotic
(2019) Altered profile of gut microbiota and the level
human gut bacteria with variable metabolic priorities
short chain fatty acids in colorectal cancer patients,
for host mucosal glycans, mBio,
6, e01282-15,
J. Physics Conf. Ser., 1146, 012037, doi: 10.1088/
doi: 10.1128/mBio.01282-15.
1742-6596/1146/1/012037.
68.
Pant, K., Saraya, A., and Venugopal, S. K. (2017)
60.
Yang, Q., Ouyang, J., Sun, F., and Yang, J. (2020)
Oxidative stress plays a key role in butyrate-mediated
Short-chain fatty acids: a soldier fighting against
autophagy via Akt/mTOR pathway in hepatoma cells,
inflammation and protecting from tumorigenesis in
Chem. Biol. Interact.,
273,
99-106, doi:
10.1016/
people with diabetes, Front. Immunol., 11, 590685,
j.cbi.2017.06.001.
doi: 10.3389/fimmu.2020.590685.
69.
Singh, S., Singh, P. K., and Kumar, A. (2022) Butyr-
61.
Sivaprakasam, S., Bhutia, Y. D., Yang, S., and
ate ameliorates intraocular bacterial infection by pro-
Ganapathy, V. (2018) Short-chain fatty acid transport-
moting autophagy and attenuating the inflammatory
ers: role in colonic homeostasis, Compr. Physiol., 8,
response, Infect. Immun., 14, e0025222, doi: 10.1128/
299-314, doi: 10.1002/cphy.c170014.
iai.00252-22.
62.
Donohoe, D. R., Holley, D., Collins, L. B.,
70.
Tian, Y., Xu, Q., Sun, L., Ye, Y., and Ji, G. (2018)
Montgomery, S. A., Whitmore, A. C., Hillhouse, A.,
Short-chain fatty acids administration is protective
Curry, K. P., Renner, S. W., Greenwalt, A., Ryan, E. P.,
in colitis-associated colorectal cancer development,
Godfrey, V., Heise, M. T., Threadgill, D. S., Han, A.,
J. Nutr. Biochem., 57, 103-109, doi: 10.1016/j.jnutbio.
Swenberg, J. A., Threadgill, D. W., and Bultman, S. J.
2018.03.007.
(2014) A gnotobiotic mouse model demonstrates that
71.
Iida, N., Dzutsev, A., Stewart, C. A., Smith, L.,
dietary fiber protects against colorectal tumorigenesis
Bouladoux, N., Weingarten, R. A., Molina, D. A.,
in a microbiota- and butyrate-dependent manner,
Salcedo, R., Back, T., Cramer, S., Dai, R.M., Kiu, H.,
Cancer Discov., 4, 1387-1397, doi: 10.1158/2159-8290.
Cardone, M., Naik, S., Patri, A. K., Wang, E.,
CD-14-0501.
Marincola, F. M., Frank, K. M., Belkaid, Y.,
63.
Belcheva, A., Irrazabal, T., Robertson, S. J., Streutker, C.,
Trinchieri, G., and Goldszmid, R. S. (2013) Com-
Maughan, H., Rubino, S., Moriyama, E. H., Cope-
mensal bacteria control cancer response to therapy
land, J. K., Surendra, A., Kumar, S., Green, B.,
by modulating the tumor microenvironment, Science,
Geddes, K., Pezo, R. C., Navarre, W. W., Milosevic, M.,
342, 967-970, doi: 10.1126/science.1240527.
Wilson, B. C., Girardin, S. E., Wolever, T. M.,
72.
Daillère, R., Vétizou, M., Waldschmitt, N., Yama-
Edelmann, W., Guttman, D. S., Philpott, D. J.,
zaki, T., Isnard, C., Poirier-Colame, V., Duong, C. P. M.,
and Martin, A. (2014) Gut microbial metabolism
Flament, C., Lepage, P., Roberti, M. P., Routy, B.,
drives transformation of msh2-deficient colon epi-
Jacquelot, N., Apetoh, L., Becharef, S., Rusakiewicz, S.,
thelial cells, Cell, 158, 288-299, doi: 10.1016/j.cell.
Langella, P., Sokol, H., Kroemer, G., Enot, D.,
2014.04.051.
Roux, A., Eggermont, A., Tartour, E., Johannes, L.,
64.
Feng, W., Wu, Y., Chen, G., Fu, S., Li, B., Huang, B.,
Woerther, P. L., Chachaty, E., Soria, J. C., Golden, E.,
Wang, D., Wang, W., and Liu, J. (2018) Sodium
Formenti, S., Plebanski, M., Madondo, M., Ro-
butyrate attenuates diarrhea in weaned piglets and
senstiel, P., Raoult, D., Cattoir, V., Boneca, I. G.,
БИОХИМИЯ том 88 вып. 7 2023
ДИАЛОГ МИКРОБИОТИЧЕСКИХ МЕТАБОЛИТОВ
1083
Chamaillard, M., and Zitvogel, L. (2016) Enterococcus
80.
Coutzac, C., Jouniaux, J. M., Paci, A., Schmidt, J.,
hirae and Barnesiella intestinihominis facilitate cyclo-
Mallardo, D., Seck, A., Asvatourian, V., Cassard, L.,
phosphamide-induced therapeutic immunomodu-
Saulnier, P., Lacroix, L., Woerther, P. L., Vozy, A.,
latory effects, Immunity, 45, 931-943, doi: 10.1016/
Naigeon, M., Nebot-Bral, L., Desbois, M.,
j.immuni.2016.09.009.
Simeone, E., Mateus, C., Boselli, L., Grivel, J.,
73.
Viaud, S., Saccheri, F., Mignot, G., Yamazaki, T.,
Soularue, E., Lepage, P., Carbonnel, F., Ascierto,
Daillère, R., Hannani, D., Enot, D. P., Pfirschke, C.,
P. A., Robert, C., and Chaput, N. (2020) Systemic
Engblom, C., Pittet, M. J., Schlitzer, A., Ginhoux, F.,
short chain fatty acids limit antitumor effect of
Apetoh, L., Chachaty, E., Woerther, P. L., Eberl, G.,
CTLA-4 blockade in hosts with cancer, Nat. Commun.,
Bérard, M., Ecobichon, C., Clermont, D., Bizet, C.,
11, 2168, doi: 10.1038/s41467-020-16079-x.
Gaboriau-Routhiau, V., Cerf-Bensussan, N., Opolon, P.,
81.
Routy, B., le Chatelier, E., Derosa, L., Duong,
Yessaad, N., Vivier, E., Ryffel, B., Elson, C. O.,
C. P., Alou, M. T., Daillère, R., Fluckiger, A.,
Doré, J., Kroemer, G., Lepage, P., Boneca, I. G.,
Messaoudene, M., Rauber, C., Roberti, M. P., Fidelle, M.,
Ghiringhelli, F., and Zitvogel, L. (2013) The intestinal
Flament, C., Poirier-Colame, V., Opolon, P., Klein, C.,
microbiota modulates the anticancer immune
Iribarren, K., Mondragón, L., Jacquelot, N., Qu, B.,
effects of cyclophosphamide, Science, 342, 971-976,
Ferrere, G., Clémenson, C., Mezquita, L., Masip, J. R.,
doi: 10.1126/science.1240537.
Naltet, C., Brosseau, S., Kaderbhai, C., Richard, C.,
74.
Bagchi, S., Yuan, R., and Engleman, E. G. (2021)
Rizvi, H., Levenez, F., Galleron, N., Quinquis, B.,
Immune checkpoint inhibitors for the treatment of
Pons, N., Ryffel, B., Minard-Colin, V., Gonin, P.,
cancer: clinical impact and mechanisms of response
Soria, J. C., Deutsch, E., Loriot, Y., Ghiringhelli, F.,
and resistance, Annu. Rev. Pathol. Mech. Disease, 16,
Zalcman, G., Goldwasser, F., Escudier, B., Hellmann,
223-249, doi: 10.1146/annurev-pathol-042020-042741.
M. D., Eggermont, A., Raoult, D., Albiges, L.,
75.
Lichtenstern, C. R., Ngu, R. K., Shalapour, S., and
Kroemer, G., and Zitvogel, L. (2018) Gut microbiome
Karin, M.
(2020) Immunotherapy, inflammation
influences efficacy of PD-1-based immunotherapy
and colorectal cancer, Cells, 9, 1310, doi: 10.3390/
against epithelial tumors, Science,
359,
91-97,
ijms18061310.
doi: 10.1126/science.aan3706.
76.
Sivan, A., Corrales, L., Hubert, N., Williams, J. B.,
82.
Gedye, C., van der Westhuizen, A., and John, T. (2015)
Aquino-Michaels, K., Earley, Z. M., Benyamin, F. W.,
Checkpoint immunotherapy for cancer: superior
Lei, Y. M., Jabri, B., Alegre, M. L., Chang, E. B., and
survival, unaccustomed toxicities, Intern. Med. J., 45,
Gajewski, T. F. (2015) Commensal Bifidobacterium
696-701, doi: 10.1111/imj.12653.
promotes antitumor immunity and facilitates anti-
83.
Sadrekarimi, H., Gardanova, Z. R., Bakhshesh, M.,
PD-L1 efficacy, Science, 350, 1084-1089, doi: 10.1126/
Ebrahimzadeh, F., Yaseri, A. F., Thangavelu, L.,
science.aac4255.
Hasanpoor, Z., Zadeh, F. A., and Kahrizi, M. S.
77.
Vétizou, M., Pitt, J. M., Daillère, R., Lepage, P.,
(2022) Emerging role of human microbiome in cancer
Waldschmitt, N., Flament, C., Rusakiewicz, S.,
development and response to therapy: special focus
Routy, B., Roberti, M. P., Duong, C. P., Poirier-
on intestinal microflora, J. Transl. Med., 20, 301,
Colame, V., Roux, A., Becharef, S., Formenti, S.,
doi: 10.1186/s12967-022-03492-7.
Golden, E., Cording, S., Eberl, G., Schlitzer, A.,
84.
Waclawiková, B., and el Aidy, S. (2018) Role of mi-
Ginhoux, F., Mani, S., Yamazaki, T., Jacquelot, N.,
crobiota and tryptophan metabolites in the remote
Enot, D. P., Bérard, M., Nigou, J., Opolon, P.,
effect of intestinal inflammation on brain and de-
Eggermont, A., Woerther, P. L., Chachaty, E.,
pression, Pharmaceuticals,
11,
63, doi:
10.3390/
Chaput, N., Robert, C., Mateus, C., Kroemer, G.,
ph11030063.
Raoult, D., Boneca, I. G., Carbonnel, F., Chamail-
85.
Nastasi, C., Candela, M., Bonefeld, C. M., Geisler, C.,
lard, M., and Zitvogel, L. (2015) Anticancer im-
Hansen, M., Krejsgaard, T., Biagi, E., Andersen,
munotherapy by CTLA-4 blockade relies on the gut
M. H., Brigidi, P., Odum, N., Litman, T.,
microbiota, Science, 350, 1079-1084, doi: 10.1126/
and Woetmann, A.
(2015) The effect of short-
science.aad1329.
chain fatty acids on human monocyte-derived
78.
Gopalakrishnan, V., Helmink, B. A., Spencer, C. N.,
dendritic cells, Sci. Rep., 5, 16148, doi: 10.1038/
Reuben, A., and Wargo, J. A. (2018) The influence
srep16148.
of the gut microbiome on cancer, immunity, and
86.
Oppmann, B., Lesley, R., Blom, B., Timans, J. C.,
cancer immunotherapy, Cancer Cell, 33, 570-580,
Xu, Y., Hunte, B., Vega, F., Yu, N., Wang, J., Singh, K.,
doi: 10.1016/j.ccell.2018.03.015.
Zonin, F., Vaisberg, E., Churakova, T., Liu, M.,
79.
Hayase, E., and Jenq, R. R. (2021) Role of the intestinal
Gorman, D., Wagner, J., Zurawski, S., Liu, Y.,
microbiome and microbial-derived metabolites in
Abrams, J. S., Moore, K. W., Rennick, D., de Waal-
immune checkpoint blockade immunotherapy of
Malefyt, R., Hannum, C., Bazan, J. F., and Kastelein,
cancer, Genome Med., 13, 107, doi: 10.1186/s13073-
R. A. (2000) Novel p19 protein engages IL-12p40
021-00923-w.
to form a cytokine, IL-23, with biological activities
БИОХИМИЯ том 88 вып. 7 2023
1084
ШАТОВА и др.
similar as well as distinct from IL-12, Immunity, 13,
Biophys. Sin. (Shanghai), 54, 1552-1560, doi: 10.3724/
715-725, doi: 10.1016/s1074-7613(00)00070-4.
abbs.2022149.
87. Jafari, B., Ospanov, M., Ejaz, S. A., Yelibayeva, N.,
89. Eslami, M., Sadrifar, S., Karbalaei, M., Keikha, M.,
Khan, S. U., Amjad, S. T., Safarov, S., Abilov, Z. A.,
Kobyliak, N. M., Yousefi, B. (2020) Importance of
Turmukhanova, M. Z., Kalugin, S. N., Ehlers, P.,
the microbiota inhibitory mechanism on the War-
Lecka, J., Sévigny, J., Iqbal, J., and Langer, P. (2018)
burg effect in colorectal cancer cells, J. Gastro-
2-Substituted 7-trifluoromethyl-thiadiazolopyrimidones
intest. Cancer,
51,
738-747, doi:
10.1007/s12029-
as alkaline phosphatase inhibitors. Synthesis, struc-
019-00329-3.
ture activity relationship and molecular docking
90. Hanahan, D. (2022) Hallmarks of cancer: new dimen-
study, Eur. J. Med. Chem., 144, 116-127, doi: 10.1016/
sions, Cancer Discov., 12, 31-46, doi: 10.1158/2159-
j.ejmech.2017.11.068.
8290.CD-21-1059.
88. Xu, H., Liu, L., Xu, F., Liu, M., Song, Y., Chen, J.,
91. Zhang, J., Wu, K., Shi, C., and Li, G. (2022) Can-
Zhan, H., Zhang, Y., Xu, D., Chen, Y., Lu, M., and
cer immunotherapy: fecal microbiota transplantation
Chen, D.
(2022) Microbiome-metabolome analy-
brings light, Curr. Treat. Options Oncol., 23, 1777-1792,
sis reveals cervical lesion alterations, Acta Biochim.
doi: 10.1007/s11864-022-01027-2.
MOLECULAR ORCHESTRA OF MICROBIOTIC METABOLITES
IN THE SCENARIO OF CARCINOGENESIS
Review
O. P. Shatova1,2*, A. A. Zabolotneva1, and A. V. Shestopalov1,3
1 Department of Biochemistry and Molecular Biology, Faculty of Medicine,
Pirogov Russian National Research Medical University, 117997 Moscow, Russia; e-mail: shatova.op@gmail.com
2 Peoples’s Friendship University of Russia (RUDN University), 117198 Moscow, Russia
3 Dmitry Rogachev National Medical Research Center of Pediatric Hematology, Oncology and Immunology,
Ministry of Health of the Russian Federation, 117997 Moscow, Russia
The mechanisms of carcinogenesis are extremely complex. Many players determine the scenario of malignant
cell transformation, tumor growth and metastasis. In recent decades, more and more attention has been
paid to the role of the symbiotic human microbiota in the regulation of metabolism and the functioning
of the immune system of the host organism. Such a symbiosis of a macroorganism and its microorganisms
was combined into the concept of a holoorganism. In the process of coevolution of the participants of the
holoorganism, the ways of their interaction were formed, and the metabolites of the microbiota acquired
a special role - signaling molecules and the main regulators of molecular interactions in the holoorganism.
Being involved in the signaling pathways of the host, bacterial metabolites turned out to be obligatory par-
ticipants in both physiological and pathological processes, including tumor growth. At the same time,
the effects of signaling metabolites often have a multidirectional character, manifested in the impact
both on the functions of the host cells and on the metabolic activity and composition of the microbiome.
This review discusses the role of some microbiotic metabolites in the induction and prevention of the pro-
cess of malignant transformation of cells in the host organism, as well as their influence on the effectiveness
of anticancer therapy. We have tried to draw the reader’s attention to the role of some components of the
molecular orchestra of microbial metabolites in the initiation and progression of tumor growth.
Keywords: microbiota, carcinogenesis, signaling metabolites, cancer
БИОХИМИЯ том 88 вып. 7 2023