БИОХИМИЯ, 2023, том 88, вып. 7, с. 1123 - 1136
УДК 57.021
ТИОСУЛЬФИНАТЫ:
ЦИТОТОКСИЧЕСКАЯ И ПРОТИВООПУХОЛЕВАЯ АКТИВНОСТИ
Обзор
© 2023 В.В. Куликова*, Е.А. Морозова, В.С. Коваль, П.Н. Сольев,
Т.В. Демидкина,
С.В. Ревтович
Институт молекулярной биологии им. В.А. Энгельгардта РАН,
119991 Москва, Россия; электронная почта: vitviku@yandex.ru
Поступила в редакцию 25.01.2023
После доработки 12.05.2023
Принята к публикации 12.05.2023
Фармакологические свойства некоторых природных соединений делают их привлекательными для
лечения онкологических заболеваний. Серосодержащие тиосульфинаты, обнаруженные в расте-
ниях рода Allium, с давних пор известны как соединения с различными терапевтическими свой-
ствами, в том числе противоопухолевыми. На протяжении последних лет активно изучалось влия-
ние тиосульфинатов на различные стадии канцерогенеза. Исследования in vitro и in vivo показали,
что тиосульфинаты ингибируют пролиферацию раковых клеток, а также индуцируют апоптоз.
Цель настоящего обзора - обобщить современные данные о цитотоксических свойствах природ-
ных и синтетических тиосульфинатов и их применении в терапии рака. Обсуждаются механизмы
противоопухолевого действия и молекулярные мишени этих перспективных соединений. Значи-
тельная часть обзора посвящена рассмотрению новой стратегии для лечения онкологических за-
болеваний - использованию метода направленной ферментной пролекарственной терапии с воз-
можностью получения противоопухолевых тиосульфинатов in situ.
КЛЮЧЕВЫЕ СЛОВА: природные и синтетические тиосульфинаты, цитостатическая активность, проти-
воопухолевая активность, направленная ферментная пролекарственная терапия.
DOI: 10.31857/S0320972523070059, EDN: FVUZLD
ВВЕДЕНИЕ
реакционноспособным соединением, которое
взаимодействует с доступными остатками ци-
Природные сероорганические соединения
стеина в белках и низкомолекулярных тиолах,
известны своими антиоксидантными, про-
включая внутриклеточный глутатион у эука-
тивовоспалительными и противоопухолевыми
риот и грамотрицательных бактерий, а также
свойствами [1]. Эти соединения в изобилии
бацилтиол у грамположительных бактерий.
содержатся в спарже, чесноке, луке и кресто-
В высоких дозах у эукариот аллицин может ин-
цветных овощах. Сульфоксиды S-алк(ен)ил-
дуцировать апоптоз или некроз, тогда как его
L-цистеина являются предшественниками био-
более низкие, биосовместимые концентрации
логически активных тиосульфинатов общей
могут модулировать активность окислительно-
формулы R1SS(O)R2, присутствующих в гомо-
восстановительных белков и влиять на клеточ-
генатах растений рода Allium [2]. Аллицин -
ную сигнализацию [5]. Так как аллицин име-
самый известный тиосульфинат, преобладаю-
ет множество клеточных мишеней в клетках
щий в гомогенатах чеснока. Многочисленные
человека и способен ингибировать клеточную
лечебные свойства чеснока, знакомые челове-
пролиферацию, ангиогенез и метастатиче-
честву с древнейших времён, во многом
ский процесс, увеличивать экспрессию генов-
обусловлены аллицином и продуктами его
супрессоров опухоли, индуцировать апоптоз
превращений [3, 4]. Аллицин является высоко- и модулировать другие генетические пути,
Принятые сокращения: АМТС - аллилметилтиосульфинат; ДБТС - дибутилтиосульфинат; ДМТС - диметилтио-
сульфинат; ДПТС - дипропилтиосульфинат; ДЭТС - диэтилтиосульфинат; МГЛ - метионин-γ-лиаза.
* Адресат для корреспонденции.
1123
6*
1124
КУЛИКОВА и др.
весьма перспективны исследования возмож-
Исследования биологических свойств ал-
ностей применения аллицина в качестве про-
лицина начались с работ C.J. Cavallito et al., в
тивоопухолевого агента [6].
которых были исследованы его антимикроб-
Аналоги аллицина, симметричные и несим-
ные свойства [37], определена его структура и
метричные тиосульфинаты, содержащие пре-
способность окислять цистеин [38]. Было уста-
дельные и непредельные заместители, также
новлено, что аллицин окисляет сульфгидриль-
присутствуют в экстракте чеснока [7]. Тиосуль-
ные группы нескольких ферментов и нейтра-
финаты с предельными или ароматическими
лизует гидроксильные радикалы (рис. 2) [39].
заместителями химически более устойчивы,
Всестороннее исследование действия алли-
чем аллицин [8-10], обладают схожим с ним
цина на протеом клеток Jurkat [40] показало,
механизмом действия и являются перспектив-
что аллицин окисляет 332 белка протеома, и
ными кандидатами в лекарственные средства
выявило влияние окисления сульфгидриль-
для терапии злокачественных новообразова-
ных групп на основные клеточные функции
ний. Аллицин и его аналоги продемонстриро-
выбранных белков, многие из которых могут
вали противораковую активность в отноше-
быть мишенями для терапии рака.
нии различных типов опухолей (саркома [11],
Бактериальная β-глюкуронидаза (КФ 3.2.1.31)
лейкемия [12-14], меланома [15], лимфома [16],
участвует в канцерогенезе, продукты расщеп-
рак молочной железы [17-22], яичников [23-
ления её субстратов являются канцерогенны-
25], печени [18, 19], лёгких [15, 19, 26], желуд-
ми [41]. В работах Takada et al. и Morita et al.
ка [27], кишечника [15, 20, 28, 29], проста-
[42, 43] было показано, что диметилтиосуль-
ты [18, 29-31]) (табл. 1). В большинстве опуб-
финат (ДМТС) необратимо ингибировал β-глю-
ликованных обзоров, посвящённых противо-
куронидазу (IC50 = 3,6 мкМ) путём модифика-
раковым свойствам чеснока, в основном опи-
ции её свободных сульфгидрильных групп,
саны цитотоксические и терапевтические свой-
таким образом уменьшая вызванную канцеро-
ства его экстрактов [32, 33], а также продук-
генами опухоль толстого кишечника.
тов реакции β-элиминирования сульфоксида
Многочисленные исследования механизма
S-аллил-L-цистеина - аллицина и продук-
действия аллицина на раковые клетки пока-
тов его дальнейших превращений (диаллил-
зали, что он тормозит клеточный цикл в фазе
сульфида, диаллилдисульфида, диаллилтри-
G2/M и индуцирует апоптоз [44] (рис. 3). Кро-
сульфида и аджоена) [6, 34-36]. В отличие от
ме того, аллицин, как было показано на клет-
свойств аллицина, цитотоксические свойства
ках рака желудка SGC-7901, ингибирует актив-
его аналогов исследованы мало. В настоящем
ность теломеразы, которая реактивируется во
обзоре собраны и проанализированы данные
множестве опухолей [27].
о противоопухолевом потенциале природных
Впервые противоопухолевая активность
и синтетических тиосульфинатов, являющихся
четырёх диалкилтиосульфинатов - диметил-,
более перспективными по сравнению с алли-
диэтил-, дипропил-, дибутилтиосульфината
цином ввиду их большей стабильности.
(ДМТС, ДЭТС, ДПТС, ДБТС) - была показа-
на в 1957 г. [11]. В работе исследовали влияние
бинарной смеси аллииназа + субстрат (суль-
ПРИРОДНЫЕ ТИОСУЛЬФИНАТЫ
фоксид S-этил-L-цистеина) и четырёх инди-
видуальных тиосульфинатов на рост привитой
Аллицин и другие природные алкилза-
мышам опухоли саркомы 180. Предваритель-
мещённые тиосульфинаты образуются при
ная инкубация клеток саркомы in vitro либо с
разрушении клеток растений рода Allium в
бинарной смесью, либо с тиосульфинатами
результате ферментативной реакции расщеп-
перед трансплантацией мышам приводила к
ления небелковых аминокислот, сульфоксидов
ингибированию роста опухолей, и далее в те-
S-замещённого L-цистеина, катализируемой
чение 300 (бинарная смесь) и 180 (тиосульфи-
пиридоксаль-5′-фосфат-зависимой аллиина-
наты) дней не наблюдалось смертности живот-
зой (КФ 4.4.1.4, рис. 1) [7, 8].
ных. Внутривенные инъекции тиосульфинатов
Рис. 1. Схема синтеза тиосульфинатов в клетках растений (R = аллил-, метил-, пропил-, бутил-, пропенил-)
БИОХИМИЯ том 88 вып. 7 2023
ТИОСУЛЬФИНАТЫ
1125
Таблица 1. Цитотоксическая и противоопухолевая активности тиосульфинатов
Тиосульфинат
In vitro/
Источник
Клеточная линия
Результат
Ссылка
(R1SS(O)R2)
in vivo
R1 = R2 = Me,
асцитная
полное ингибирование
cинтез
in vivo
[11]
Et, Pr, Bu
саркома 180
развития асцитов
саркома 180
ингибирование роста
R1 = R2 = Et
cинтез
лимфосаркома
саркомы на 60%, роста
in vivo
[11]
Murphy-Sturm
лимфосаркомы на 40%
HL-60 (FAB M2),
NB4 (FAB M3),
ингибирование роста
R1 = R2 = Me, Pr
синтез
in vitro
[12]
U937 и MonoMac-6
лейкозных клеток
(FAB M5)
MCF-7, SW480,
R1 = R2 = Me;
выделены из
цитотоксический эффект,
HepG2,
in vitro
[18]
R1 = аллил, R2 = Me
Allium tuberosum L.
апоптоз для клеток MCF-7
LNCaр.FGC
R1 = R2 = Me;
выделены
асцитная
увеличение продолжитель-
in vivo
[18]
R1 = аллил, R2 = Me
из A. tuberosum L.
саркома 180
ности жизни животных
R1 = R2 = Me;
выделены
RC-58T/h/SA#4
торможение роста клеток
in vitro
[30]
R1 = аллил, R2 = Me
из A. tuberosum L.
DU145
по механизму апоптоза
R1 = R2 = Me;
каспаза-зависимый
R1 = аллил, R2 = Me;
выделены
HT-29
и каспаза-независимый
in vitro
[28]
экстракт из
из A. tuberosum L.
пути апоптоза клеток
A. tuberosum L.
каспаза-зависимый
R1 = R2 = Me;
выделены
РС-3
и каспаза-независимый
in vitro
[31]
R1 = аллил, R2 = Me
из A. tuberosum L.
пути апоптоза клеток
остановка клеточного
цикла в фазе G2/M,
R1 = R2 = 4-MeOPh
синтез
MCF-7/Dx
апоптоз, ингибирование
in vitro
[17]
митохондриального
дыхания клеток
MDA-MB-468,
каспаза-зависимый
R1 = R2 = 4-MeOBn
синтез
in vitro
[21]
MCF-7
апоптоз
ферментативная
асцитная
полное ингибирование
R1 = R2 = Et
in vivo
[11]
реакция
саркома 180
роста опухоли
ферментативная
ингибирование роста
R1 = R2 = аллил
ES-2
in vivo
[24]
реакция
и пролиферации опухоли
ферментативная
ингибирование роста
in vitro,
R1 = R2 = аллил
N87, CB2
[23]
реакция
и пролиферации опухоли
in vivo
хронический
ферментативная
апоптоз, ингибирование
in vitro,
R1 = R2 = аллил
лимфоцитарный
[14]
реакция
роста опухоли
in vivo
лейкоз
R1 = R2 = аллил,
ферментативная
MCF-7, SCOV-3,
цитотоксический эффект
in vitro
[25]
Me, Et, Pr
реакция
SW-620
MCF-7, SKBR3,
цитотоксический эффект,
R1 = R2 = аллил,
ферментативная
in vitro,
MDA-MB-231,
ингибирование роста
[22]
Me, Et, Pr
реакция
in vivo
T-47D
опухоли
HT-29, COLO205,
HCT116, Panc1,
цитотоксический эффект,
ферментативная
in vitro,
R1 = R2 = Pr
MIA-PaCa2, 22Rv1,
ингибирование роста
[29]
реакция
in vivo
DU-145, PC3,
опухоли
SW-620
БИОХИМИЯ том 88 вып. 7 2023
1126
КУЛИКОВА и др.
Рис. 2. Влияние тиосульфинатов на белки (адаптировано из работы Borlinghaus et al. [3]). Доступный для атаки остаток
цистеина (обозначен оранжевым) реагирует с тиосульфинатами посредством реакции дисульфидного обмена. Остаток
цистеина, доступ к которому стерически заблокирован (обозначен синим цветом), с тиосульфинатами не реагирует
мышам, предварительно привитым клетками
акция высвобождения и состояние активации
саркомы, задерживали возникновение зло-
интегрина) на модификацию их поверхност-
качественных опухолей и в некоторых случаях
ных SH-групп [47]. В работе Merhi et al. [12]
полностью предотвращали их образование
было установлено, что ДМТС и ДПТС, но не
и гибель мышей. Было исследовано влияние
аллицин, влияли на злокачественные мие-
ДЭТС на рост саркомы 180, привитой мышам,
лоидные клеточные линии человека HL-60
и лимфосаркомы Murphy-Sturm, привитой
(FAB M2), NB4 (FAB M3), U937 и MonoMac-6
крысам. После 7-дневного введения ДЭТС и
(FAB M5), воздействуя на рост клеток, диф-
двухнедельного наблюдения область саркомы
ференцировку и секрецию факторов, участ-
уменьшилась на 60%, область лимфосарко-
вующих в опухолевых процессах. Обработка
мы - на 40%. В более поздних исследованиях
лейкозных клеточных линий этими двумя тио-
на мышах с привитой асцитной опухолью сар-
сульфинатами приводила к индуцированию
комы 180 введение ДМТС и аллилметилтио-
созревания макрофагов, обладающих проти-
сульфината (АМТС) в дозе 50 мг/кг увеличи-
воопухолевой активностью, и ингибирова-
вало продолжительность жизни животных до
нию уровней секреции матриксной металло-
29 дней, для контрольной группы продолжи-
протеиназы-9 (MMP-9) и фактора некроза
тельность жизни составляла 16,8 дней [18].
опухоли (TNF-α), которые могут играть важ-
Исследование действия трёх тиосульфи-
ную роль в прогрессировании рака, влияя на
натов - аллицина, ДМТС и ДПТС - на тром-
ангиогенез опухоли, её рост и/или метаста-
боциты [45] показало, что предельные тио-
зирование. Авторы полагают, что отсутствие
сульфинаты, как и аллицин, дозозависимо
влияния аллицина объясняется его неустойчи-
ингибируют агрегацию тромбоцитов со зна-
востью. Исследуемые в работе тиосульфинаты
чениями IC50, равными 15, 19 и 9 мкМ для ал-
использовались как водные растворы, однако
лицина, ДMТС и ДПТС соответственно. Тио-
эти соединения более устойчивы в органи-
сульфинаты подавляли выпадение микроча-
ческих растворителях [17]. Вполне вероятно,
стиц и втягивание тромба и дальнейшие собы-
что объяснение авторов об отсутствии влия-
тия, индуцированные агрегацией, такие как
ния аллицина на лейкозные клетки из-за не-
активация кальпаина. Кальпаин участвует в
устойчивости при использовании его водного
инвазии опухолевых клеток и их метастазиро-
раствора правомерно. В то же время другие
вании [46]. Таким образом, в данной работе
авторы показали, что в клетках HL60 и U937
(после долгого перерыва в исследовании био-
аллицин (растворитель в работе не указан)
логической активности тиосульфинатов, на-
индуцировал ингибирование роста и вызывал
чатом в работе Weisberger et al. [11]) показана
апоптотические события, такие как блеббинг,
перспективность исследования ДМТС и ДПТС
деполяризацию митохондриальной мембраны,
как потенциальных цитотоксических и про-
высвобождение цитохрома c в цитозоль, ак-
тивоопухолевых средств. В продолжение этих
тивацию каспазы 9 и каспазы 3 и фрагмента-
исследований было установлено, что ДМТС и
цию ДНК [13].
ДПТС взаимодействуют с сульфгидрильными
Цитотоксическая и противоопухолевая ак-
группами как на поверхности тромбоцитов,
тивности тиосульфинатов, выделенных из A. tu-
так и внутри клетки, окисляя внутриклеточ-
berosum L., исследовались в нескольких работах.
ные белки, в том числе кальпаин, и исследо-
АМТС и ДМТС проявили дозо- и времязави-
ваны реакции тромбоцитов (сигналы Са2+, ре-
симый цитотоксический эффект на клеточных
БИОХИМИЯ том 88 вып. 7 2023
ТИОСУЛЬФИНАТЫ
1127
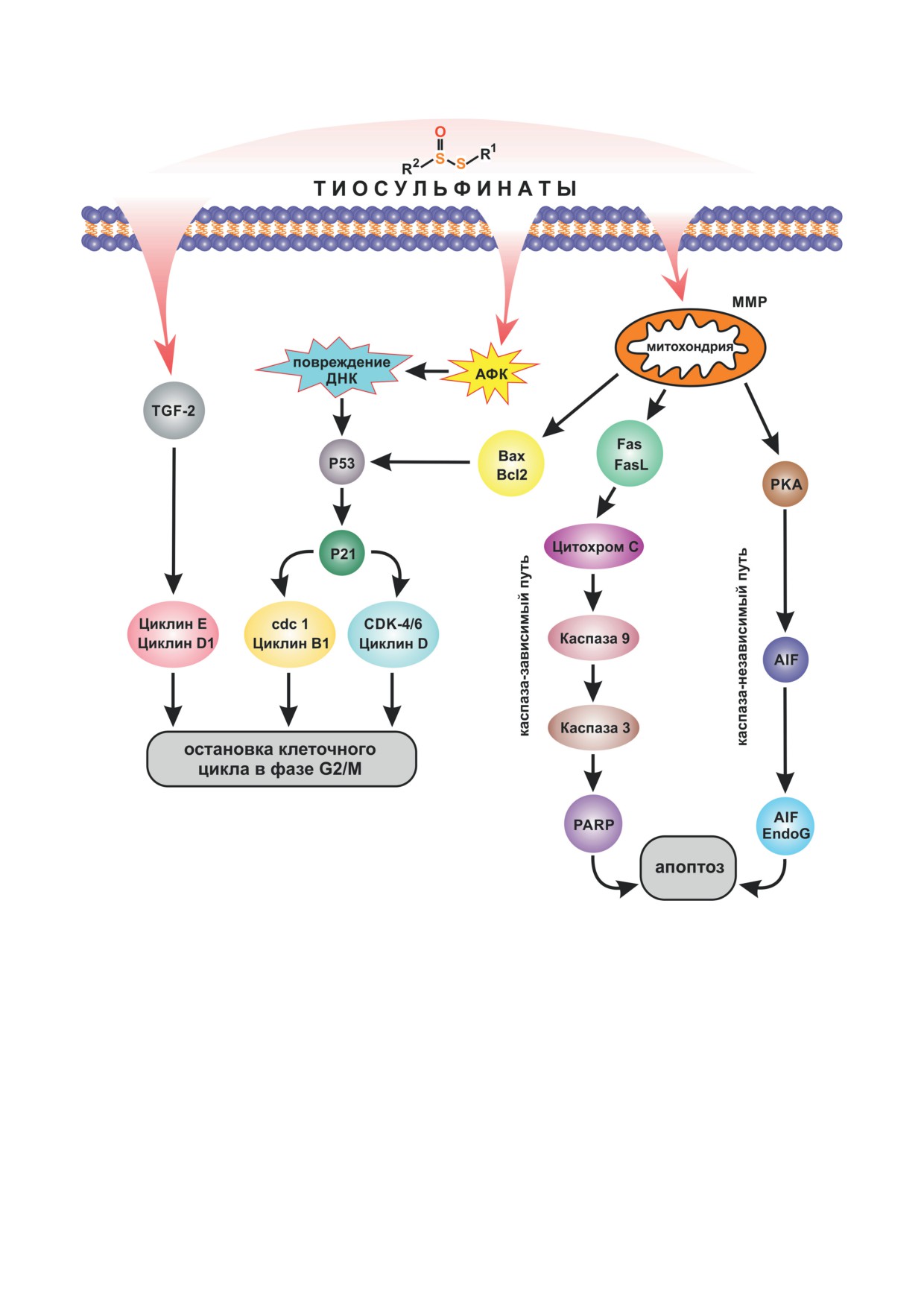
Рис. 3. Цитостатическое действие тиосульфинатов на опухолевые клетки. PKA - протеинкиназа А; AIF - фактор,
индуцирующий апоптоз; Bax - проапоптотический белок; Bcl2 - антиапоптотический белок; АФК - активные фор-
мы кислорода; PARP - поли(APD-рибоза)-полимераза; TGF-2 - трансформирующий фактор роста; EndoG - эндо-
нуклеаза G; Fas, FasL - белки семейства TNF (фактора некроза опухоли); MMP - митохондриальный мембранный
потенциал
линиях рака молочной железы MCF-7, тол-
времени и останавливали рост клеток в позд-
стого кишечника SW480, гепатоцеллюлярной
ней фазе G1. Наиболее чувствительными были
карциномы HepG2, андроген-положительных
клетки RC-58T/h/SA#4. После обработки кле-
и андроген-отрицательных клетках простаты
ток смесью тиосульфинатов наблюдали фраг-
человека LNCaP-FGC, RC-58T/h/SA#4, РС-3,
ментацию ядер и апоптототические тельца.
DU145 (табл. 2) [18, 30, 31]. АМТС оказался
Исследовав морфологические изменения кле-
наилучшим ингибитором.
ток, фрагментацию ДНК, состояние белка PAR,
Тиосульфинаты снижали количество жиз-
экспрессия которого специфически повыша-
неспособных клеток в зависимости от дозы и ется в опухолевых клетках, претерпевающих
БИОХИМИЯ том 88 вып. 7 2023
1128
КУЛИКОВА и др.
Таблица 2. Цитотоксичность тиосульфинатов из A. tubero-
может протекать как по каспаза-зависимому, так
sum L.
и по каспаза-независимому механизму (рис. 3).
Каспаза-зависимый и каспаза-независимый
IC50 (мкг/мл)
пути апоптоза клеток НТ-29 колоректального
Линии клеток
рака человека под действием тиосульфина-
ДМТС
АМТС
тов исследованы в работе Lee et al. [28]. Смесь
ДМТС и АМТС индуцировала гибель клеток
17,05
7,51
MCF-7
(155,0 мкМ)
(55,22 мкМ)
HT-29 в зависимости от дозы и времени. Обра-
ботка клеток смесью активировала каспазы 3,
16,28
7,17
8 и 9 и стимулировала расщепление белка Bid.
SW480
(148,0 мкМ)
(52,75 мкМ)
Авторы установили, что тиосульфинаты сни-
жали экспрессию антиапоптотического белка
20,2
11,81
HepG2
Bcl-2 и повышали экспрессию проапоптотиче-
(183,64 мкМ)
(86,83 мкМ)
ского белка Bax. Они также увеличивали экс-
11,24
4,04
прессию белка AIF, независимого от каспазы
LNCaP-FGC
(102,1 мкМ)
(29,71 мкМ)
фактора митохондриального апоптоза, и инду-
цировали фрагментацию ДНК и конденсацию
10,56
3,52
RC-58T/h/SA#4
хроматина в клетках HT-29.
(96,06 мкМ)
(25,28 мкМ)
18,22
8,56
PC-3
(165,6 мкМ)
(62,94 мкМ)
ЦИТОТОКСИЧЕСКАЯ
И ПРОТИВООПУХОЛЕВАЯ АКТИВНОСТИ
20,2
11,67
DU145
СИНТЕТИЧЕСКИХ ТИОСУЛЬФИНАТОВ
(183,63 мкМ)
(85,80 мкМ)
Как отмечалось выше, аналоги аллицина,
содержащие вместо непредельных заместите-
апоптоз, активности каспаз и другие призна-
лей насыщенные углеводородные или арома-
ки, характерные для апоптоза, авторы пришли
тические радикалы, более устойчивы, чем сам
к выводу, что апоптоз, индуцируемый тио-
аллицин. Установленные цитотоксические и
сульфинатами, связан с активацией каспазы 3,
противоопухолевые свойства природных тио-
8 и 9. Они также установили, что тиосульфи-
сульфинатов стимулируют синтез и исследова-
наты стимулировали расщепление белка Bid,
ние биологической активности их аналогов.
который активирует белок Bax, запускающий
В работе Roseblade et al. [17] было син-
митохондриальный путь апоптоза. Bid рас-
тезировано
22 тиосульфината и проведено
щеплялся каспазой 8, что приводило к акти-
исследование их стабильности и антипроли-
вации каспазы 9 и каспазы 3. Тиосульфина-
феративной активности на клетках MCF-7,
ты снижали экспрессию антиапоптотического
чувствительных ко многим лекарственным
белка Bcl-2, блокирующего повышение про-
средствам, и клетках MCF-7/Dx, обладающих
ницаемости мембраны митохондрий, и повы-
множественной лекарственной устойчиво-
шали экспрессию проапоптотического белка
стью. Все тиосульфинаты оказались более ста-
Bax, который ускоряет запрограммированную
бильны, чем аллицин. Использование поляр-
гибель клеток путём связывания репрессора
ных растворителей значительно увеличивало
апоптоза Bcl-2. Эти данные указывали на то,
их стабильность. За исключением единствен-
что индукция апоптоза у обработанных сме-
ного соединения, тиосульфинаты не имели
сью двух тиосульфинатов клеток может быть
каких-либо рисков токсичности и не обладали
связана с каспаза-зависимым каскадом, кото-
мутагенными, онкогенными или раздражаю-
рый включает активацию митохондриального
щими эффектами. Было проведено исследова-
пути апоптоза, инициируемого ингибирова-
ние влияния тиосульфинатов на гибель клеток,
нием белка Bcl-2 и активацией Bax. Тиосуль-
апоптоз, ход клеточного цикла и биоэнергети-
финаты повышали экспрессию AIF (фактора,
ческую функцию митохондрий.
индуцирующего апоптоз) и его транслокацию
Cимметричные и асимметричные тиосуль-
в ядра. Митохондриальный флавопротеин AIF,
финаты, содержащие преимущественно аро-
действующий независимо от каспаз, индуци-
матические фрагменты, проявили большую
рует апоптоз, перемещаясь в ядро после начала
антипролиферативную активность в отноше-
апоптоза. Суммируя все данные, авторы сдела-
нии клеток MCF-7 и MCF-7/Dx, чем аллицин
ли заключение, что тиосульфинаты тормозили
(табл. 3). Эти соединения также были эффек-
рост клеток путём запуска апоптоза, который
тивны по отношению к клеткам со множе-
БИОХИМИЯ том 88 вып. 7 2023
ТИОСУЛЬФИНАТЫ
1129
Таблица
3. Цитотоксичность тиосульфинатов вида
R1SS(O)R2
IC50 (мкМ)
Соединение
MCF-7/Dx
MCF-7
Аллицин
41,23
-
R1 = Bu,
33,74
> 50
R2 = Bu
R1 = 4-MePh,
35,99
> 50
R2 = Et
R1 = 4-MePh,
38,11
> 50
R2 = Pr
R1 = 4-MeO-Ph,
40,77
> 50
R2 = 4-MePh
Рис. 4. Синтетические аналоги аллицина с антипролифе-
R1 = 4-MeO-Ph,
18,54
46,50
ративными свойствами
R2 = 4-MeO-Ph
R1 = 4-MeO-Ph,
28,97
> 50
R2 = Et
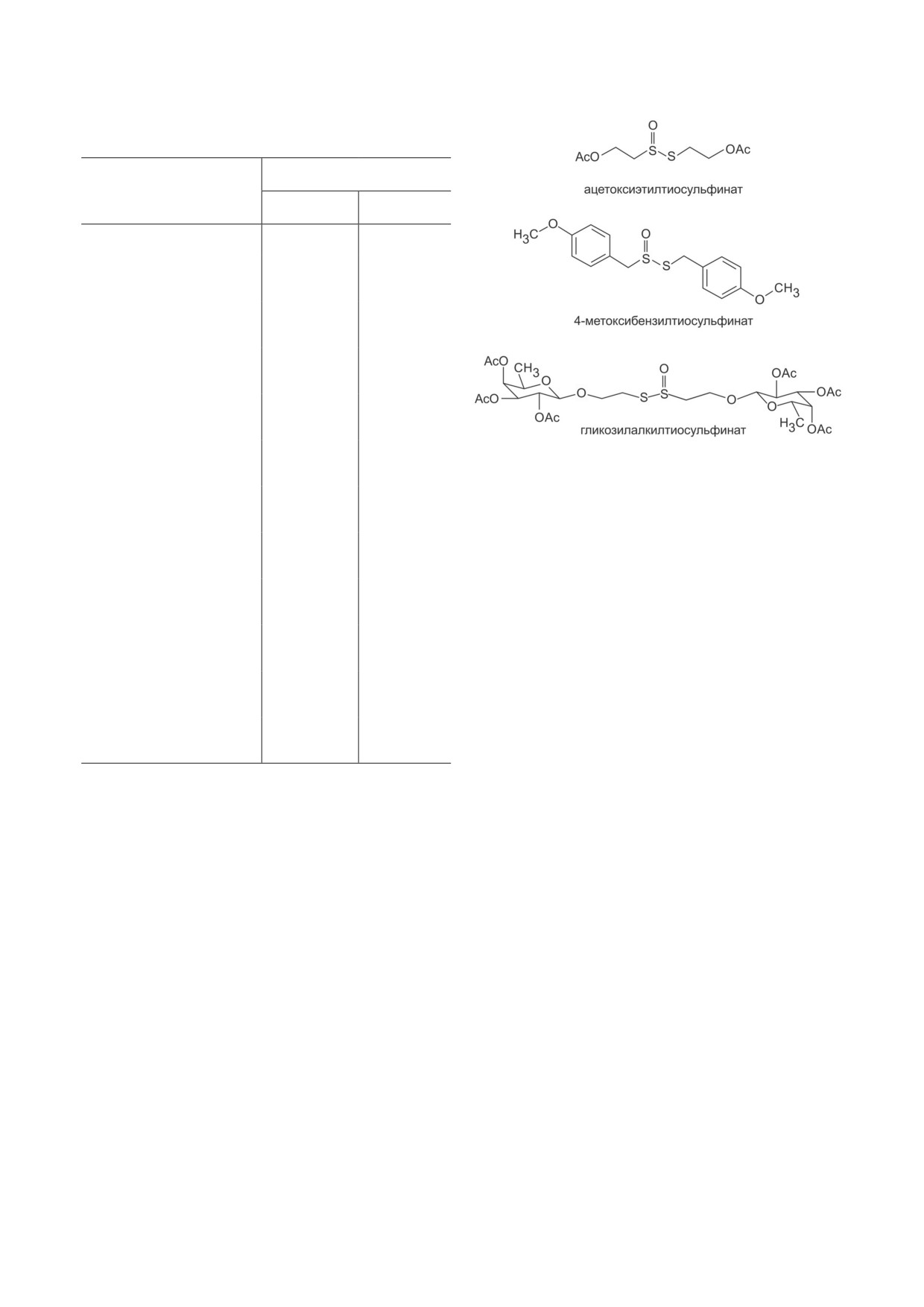
Из 19 синтезированных в работе Bhaumik
et al. [21] симметричных алкил/арил/глико-
R1 = 4-MeO-Ph,
28,97
> 50
R2 = Bu
зилалкилтиосульфинатов три соединения (R =
= ацетоксиэтил-, 4-метоксибензил-, гликозил-
R1 = 4-MeO-Ph,
алкил-) (рис. 4) показали наибольшую эффек-
45,54
> 50
R2 = t-Bu
тивность в ингибировании пролиферации кле-
ток рака молочной железы MDA-MB-468
R1 = 4-MeO-Ph,
41,11
> 50
R2 = гексил
со значениями IC50, равными 18,87, 11,34 и
22,38 мкМ соответственно. Аналогичная эф-
R1 = 4-MeO-Ph,
28,75
> 50
фективность этих соединений наблюдалась и
R2 = циклогексил
на клетках MCF-7 со значениями IC50, равны-
ми 22,36, 13,01 и 25,92 мкМ соответственно.
R1 = 4-MeO-Ph,
48,61
> 50
R2 = 4-t-BuBn
В клетках MDA-MB-468 и MCF-7 тиосуль-
финат с 4-метоксибензильным заместителем
вызывал образование активных форм кисло-
ственной лекарственной устойчивостью. Среди
рода и изменения в проницаемости митохон-
них симметричный тиосульфинат, содержа-
дрий. Для двух клеточных линий наблюдали
щий 4-метоксифенильные группы (R1SS(O)R2,
увеличение экспрессии проапоптотического
R1 = R2 = 4-MeO-Ph), который проявил наи-
белка Bax, снижение экспрессии антиапопто-
большую цитотоксическую активность как на
тического белка Bcl-2, блокирующего повыше-
клетках MCF-7/Dx, так и на клетках MCF-7.
ние проницаемости мембраны митохондрий,
Исследования влияния этого соединения на
активацию каспазы 3 и индуцированные кас-
клеточную морфологию и стадии цикла клеток
пазой повреждения ДНК, что свидетельствует
MCF-7/Dx показали, что тиосульфинат изме-
об апоптозе клеток MDA-MB-468 и MCF-7.
нил клеточную морфологию и остановил кле-
В работе Block et al. [48] были синтези-
точный цикл в фазе G2/M. Соединение дозоза-
рованы фторированные аналоги серосодер-
висимо индуцировало апоптоз и ингибировало
жащих соединений чеснока, в том числе и
митохондриальное дыхание клеток в состоянии
дифтораллицин, и исследовано их влияние на
покоя и при стрессе. Множественная лекар-
ангиогенез и тромбоз в сравнении с нефтори-
ственная устойчивость к противоопухолевым
рованными соединениями. Антиангиогенная
соединениям является серьёзной проблемой
эффективность фторированных соединений
при лечении онкологических заболеваний, и
исследовалась с использованием модели хо-
полученные в данной работе результаты демон-
риоаллантоисной мембраны цыплят и инду-
стрируют, что тиосульфинаты перспективны
цированной матригелем мышиной модели.
как новые средства против химиорезистентных
Кроме того, в цельной крови человека исследо-
опухолей.
вали влияние тех же соединений на агрегацию
БИОХИМИЯ том 88 вып. 7 2023
1130
КУЛИКОВА и др.
тромбоцитов и динамику тромбоцитарно-
доксаль-5′-фосфат-зависимая аллииназа (KФ
фибринового сгустка. Дифтораллицин, как
4.4.1.4) + аллиин, был аллицин. В работе Miron
и другие фторированные аналоги, эффек-
et al. [23] был получен ковалентный конъюгат
тивно ингибировал ангиогенез, опосредован-
аллииназы с моноклональным антителом к
ный либо фактором роста эндотелия сосудов,
рецептору эпидермального фактора роста че-
либо основным фактором роста фибробластов
ловека (ErbB2). Конъюгат связывался с опухо-
в хориоаллантоисной мембране цыплят или
левыми клетками-мишенями (клеточная линия
в матриксной модели. Дифтораллицин про-
аденокарциномы желудка человека N87, экс-
демонстрировал большее ингибирование по
прессирующая рецепторы ErbB2, и клеточная
сравнению с другими соединениями. Смерт-
линия рака яичников китайского хомяка CB2,
ности эмбрионов при этом не наблюдалось.
трансфицированная экспрессионным векто-
Аллицин и дифтораллицин показали срав-
ром млекопитающих ErbB2). После добавле-
нимый и больший по сравнению с другими
ния к клеткам аллиина наблюдалось эффек-
соединениями антитромбоцитарный эффект.
тивное ингибирование их роста. В опытах
Однако антикоагулянтная активность дифтор-
in vivo на ксенографтах N87, привитых мышам,
аллицина была больше как по сравнению с
также была продемонстрирована высокая про-
другими соединениями, так и с аллицином.
тивоопухолевая активность аллицина, обра-
Большую по сравнению с аллицином биологи-
зующегося in situ при введении животным
ческую активность дифтораллицина авторы
этого конъюгата и аллиина. При этом субстрат
объясняют тем, что введение фтора увеличило
и продукт реакции не оказывали негативного
электрофильность атома серы, т.е. способ-
действия на здоровые ткани животных. Авто-
ность соединения тиолировать сульфгидриль-
ры объясняют этот эффект отсутствием ток-
ные группы. Кроме того, введение атома фтора
сичности у аллиина и высоким уровнем кли-
в молекулу аллицина, как полагают авторы,
ренса аллицина.
должно было приводить к изменению липо-
В работе Arditti et al. [14] был получен
фильности соединения и его способности про-
конъюгат аллииназы с моноклональным анти-
никать через мембрану. Ангиогенез играет
телом ритуксимабом, которое распознаёт Т-кле-
важную роль в росте опухоли и метастазирова-
точный поверхностный антиген T11/Leu-5
нии. Поэтому дифтораллицин может быть но-
(CD20). При добавлении полученного конъю-
вым противоопухолевым препаратом, подле-
гата и аллиина к злокачественным В-клеткам,
жащим, в отличие от аллицина, патентованию.
экспрессирующим в различных количествах
Следует отметить, что в работе установлена
CD20 (клетки В-хронического лимфолейкоза
неизвестная ранее для аллицина антикоагу-
и клетки В-клеточных лимфом), образовав-
лянтная активность, что может стимулиро-
шийся in situ аллицин приводил к гибели опу-
вать исследование других тиосульфинатов как
холевых В-клеток посредством апоптоза. На
антикоагулянтов.
радиационной химере человек-мышь с приви-
тыми животным CD20+ опухолевыми клетками
В-хронического лимфолейкоза/мантийнокле-
ТИОСУЛЬФИНАТЫ В ФЕРМЕНТАТИВНОЙ
точной лимфомы/ВЭБ-трансформированных
ПРОЛЕКАРСТВЕННОЙ ТЕРАПИИ
В-клеток было показано, что однократное вве-
дение конъюгата с последующим многократ-
Новым подходом для лечения онкологиче-
ным введением аллиина приводит к значитель-
ских заболеваний является направленная фер-
ному снижению количества опухолевых клеток
ментная пролекарственная терапия опухолей.
в образцах клеток брюшины, взятых через 24 ч
Этот подход включает два этапа. На первом
после последнего введения субстрата.
выбранный фермент или его ген доставляется
Для направленной доставки аллииназы к
к опухолевым клеткам. На втором этапе не-
поверхности опухолевых клеток с гиперэкс-
токсичный субстрат (пролекарство) фермен-
прессией рецепторов эстрогена (ER+) были
тативно преобразуется в токсичное средство
получены конъюгаты аллииназы с природным
только в области опухоли. Это позволяет повы-
фитоэстрогеном дайдзеином (Dz), имеющим
сить селективность действия цитотоксического
химически сходную с эстрадиолом структу-
вещества на опухолевые клетки и снизить его
ру [24]. Конъюгат специфически связывался с
токсичность для организма в целом. Впервые
клетками рака яичников in vitro и при добав-
такой подход был применён в 1974 г. [49] и ин-
лении аллиина эффективно продуцировал
тенсивно развивается в настоящее время.
цитотоксические молекулы аллицина, которые
Первым тиосульфинатом, полученным in situ
убивали раковые клетки. Исследование био-
в составе фармакологической пары пири-
распределения меченного европием конъюгата
БИОХИМИЯ том 88 вып. 7 2023
ТИОСУЛЬФИНАТЫ
1131
аллииназа-дайдзеин на моделях ксенографтов
кислотной последовательности МГЛ Сitrobacter
ES-2 у мышей показало его преимуществен-
freundii). Мутантные формы эффективно ката-
ное накопление в опухолях по сравнению с
лизировали реакцию расщепления сульфокси-
другими тканями. Эффективность конъюгата
дов S-алк(ен)ил-L-цистеина [54, 55] и были
в присутствии аллиина также была доказана
использованы в качестве ферментной состав-
in vivo при лечении мышей с привитой опу-
ляющей фармакологической пары для испы-
холью рака яичника [24]. В течение первых
тания цитотоксической и противоопухолевой
12 дней в терапевтической группе наблюдалось
активностей тиосульфинатов, образующихся
торможение роста опухолей по сравнению с
in situ. При использовании подхода фермент-
группой животных, принимавших плацебо.
ной пролекарственной терапии необходимо,
Гистологическое исследование органов и тка-
чтобы введённый ферментный компонент был
ней не выявило каких-либо дополнительных
активен в плазме в течение периода, необходи-
очагов карциномы или признаков токсичности
мого для получения достаточного количества
препаратов.
лекарства из пролекарства. Нативная МГЛ бы-
В работе Chhabria et al. [50] показано, что
стро выводится из кровотока [56]. Для улучше-
конъюгат аллииназы с моноклональным анти-
ния фармакокинетических параметров C115H
телом к опухолевому маркеру рака поджелу-
МГЛ было использовано несколько общепри-
дочной железы CA19-9 связывается с клетками
нятых подходов, таких как пэгилирование,
рака поджелудочной железы MIA PaCa-2, и при
инкапсулирование в липосомы и полиионные
добавлении аллиина локализованная в рако-
везикулы (ПИКсомы) [57] и модификация фер-
вых клетках аллииназа вырабатывает аллицин,
мента полисиаловой кислотой [25]. Инкапсу-
который индуцирует апоптоз посредством раз-
лирование в ПИКсомы продлило стабильность
личных эпигенетических модификаций, в част-
C115H МГЛ в кровотоке более чем на 42 ч по
ности, активации экспрессии каспазы 3, фраг-
сравнению с пэгилированным ферментом [57].
ментации ДНК, остановки клеточного цикла и
Период полувыведения С115Н МГЛ, конъю-
экспрессии ингибитора циклинзависимой ки-
гированной с полисиаловой кислотой, также
назы p21WAF1/Cip1, а также образования активных
увеличился в 3-6 раз по сравнению с нативным
форм кислорода и истощения запаса глутатио-
ферментом. В реакции с сульфоксидами S-за-
на. Специфичность противоопухолевой актив-
мещённого L-цистеина каталитическая эффек-
ности аллицина, генерируемого in situ, была
тивность как инкапсулированного в ПИКсомы
продемонстрирована на нескольких типах кле-
фермента, так и его модифицированной поли-
ток с использованием новой интегрированной
сиаловой кислотой формы была сравнима с та-
дискретной системы совместного культиви-
ковой для нативной С115Н МГЛ. Цитотоксиче-
рования нескольких органов (IdMOC). Алли-
ский эффект аллицина, ДМТС, ДЭТС и ДПТС,
цин оказывал дозозависимое цитотоксическое
получаемых в парах С115Н МГЛ/сульфоксиды
действие на клеточную линию MIA PaCa-2,
S-(аллил/алкил) замещённого L-цистеина, был
тогда как для клеточных линий, не экспресси-
показан in vitro на линиях аденокарциномы
рующих антиген CA19-9 (аденокарцином яич-
MCF-7, SCOV-3 и SW-620 (табл. 4).
ников OAW 4, молочной железы MCF-7, пред-
стательной железы PC3, гепатоцеллюлярной
карциномы HepG2 и фибробластов кожи чело-
Таблица 4. Цитотоксичность тиосульфинатов, произво-
димых фармакологическими парами C115H МГЛ/суль-
века HDF), статистически значимой разницы
фоксид
в жизнеспособности клеток не наблюдалось.
Пиридоксаль-5′-фосфат-зависимая метио-
Клеточная линия
нин-γ-лиаза (КФ 4.4.1.11, МГЛ), помимо фи-
зиологической реакции γ-элиминирования
Тиосульфинат
MCF-7
SCOV-3
SW-620
L-метионина [51], катализирует реакцию β-эли-
минирования S-замещённых аналогов L-ци-
IC50, мкМ
стеина, в том числе сульфоксидов S-алк(ен)ил-
L-цистеина, продуктами которой являются
Аллицин
30,80
104,7
40,12
тиосульфинаты [52, 53]. Поскольку тиосульфи-
наты окисляют сульфгидрильные группы бел-
ДМТС
68,05
127,04
108,90
ков и могут ингибировать МГЛ, были созданы
мутантные формы фермента из нескольких
ДЭТС
21,70
119,39
36,17
бактериальных источников с заменой остатка
цистеина-115 их активных центров на гисти-
ДПТС
15,03
87,19
19,24
дин (С115Н МГЛ, нумерация согласно амино-
БИОХИМИЯ том 88 вып. 7 2023
1132
КУЛИКОВА и др.
Таблица 5. Цитотоксичность конъюгата C115H МГЛ-Dz
Значения IC50 для аллицина и ДМТС для
в присутствии сульфоксидов S-замещённого L-цистеина
линии MCF-7 оказались близки к получен-
ным данным для синтетических тиосульфина-
Клеточная линия
тов (44 мкМ и > 50 мкМ соответственно) [17].
Сульфоксид
Для ДЭТС и ДПТС показан самый высокий
MCF-7
SKBR3
MDA-MB-231
T-47D
(1 мг/мл)
цитотоксический эффект на линиях MCF-7 и
SW-620 (IC50 < 36 мкМ). Значения IC50 синте-
IC50, мкМ
тических тиосульфинатов для линии MCF-7
составляли более 50 мкМ [17]. Для клеток
Метиин
0,48
14,5
> 18,6
2,81
SCOV-3 значения IC50 для аллицина были ана-
Этиин
0,35
0,8
> 18,6
2,28
логичны данным, полученным для синтетиче-
ского аллицина (93 мкМ) для этой линии [24].
Пропиин
0,53
1,15
> 18,6
1,97
Примечательно, что для всех клеточных ли-
ний наблюдалось усиление цитотоксического
Аллиин
1,38
1,0
> 18,6
2,13
действия тиосульфинатов с увеличением дли-
ны цепи алкильных радикалов (табл. 4). Впер-
вые факт увеличения бактерицидного действия
тиосульфинатов на грамположительные бакте-
In vitro на клеточных линиях рака толстой
рии с увеличением длины их алкильных групп
кишки лучший эффект наблюдался для HT-29
был отмечен в работе Small et al. [9], где авторы
(IC50 = 6,9 мкМ). Значения IC50 для MIA-PaCa2
предположили, что удлинение алкильной груп-
и Panc1 составляли 3,4 и 3,8 мкМ соответ-
пы делает соединения более липофильными,
ственно. Среди клеточных линий рака пред-
позволяя им эффективно атаковать сульфгид-
стательной железы наиболее чувствительной к
рильные группы белков.
ДПТС оказалась линия 22Rv1 (IC50 = 5,4 мкМ).
Сохранение каталитической активности фер-
In vivo противоопухолевая активность фарма-
мента С115Н, инкапсулированного в ПИКсомы,
кологической пары была изучена на подкож-
цитотоксический эффект фармакологической
ных ксенотрансплантатах HT-29, SW-620, Panc1,
пары С115Н МГЛ + сульфоксиды S-замещён-
MIA-PaCa2 и 22Rv1 у мышей BALB/c nude.
ного L-цистеина, сравнимый с таковым для
При терапии животных фармакологической
синтетических тиосульфинатов, высокая био-
парой C115H-Dz/пропиин наблюдалось значи-
доступность инкапсулированного в ПИКсомы
тельное уменьшение объёма опухолей Panc1,
фермента - все эти факты показали перспек-
MIA-PaCa2, HT-29 и 22Rv1 (дозировка компо-
тивность применения фармакологической пары
нентов фармакологической пары составляла
как потенциального нового противоопухоле-
30 ед. конъюгата, 30 мг/мл пропиина).
вого средства. Для направленной доставки па-
ры к ER+ опухолям C115H МГЛ была конъюги-
рована с дайдзеином [22]. Конъюгат (C115H-Dz)
ЗАКЛЮЧЕНИЕ
связывался с линиями MCF-7, SKBR3, MDA-
MB-231 и T-47D рака молочной железы и в
Интенсивные исследования тиосульфина-
присутствии сульфоксидов S-(аллил/алкил)-
тов как потенциальных средств терапии рака
L-цистеина проявлял цитотоксический эффект
начались сравнительно недавно. Несмотря на
(табл. 5). Конъюгирование увеличило время
подтверждённые многообразные биологиче-
полувыведения фермента с 4,2 ч до 7,2 ч. Про-
ские активности аллицина, этот тиосульфинат
тивоопухолевое действие фармакологической
мало применяется в фармакологии. Это, веро-
пары C115H-Dz/пропиин было проверено
ятно, во многом объясняется его химической
in vivo на ксенотрансплантатах SKBR-3: пара
нестабильностью и летучестью [3-5]. Кроме
ингибировала рост опухоли на
85% (дози-
того, в крови аллицин очень быстро метабо-
ровка составила 30 ед. конъюгата, 30 мг/мл
лизируется [6, 7]. Представленные в обзоре
пропиина).
результаты позволяют считать, что более ста-
В работе Abo Qoura et al. [29] была исследо-
бильные тиосульфинаты с предельными или
вана цитотоксическая и противоопухолевая ак-
ароматическими заместителями могут быть но-
тивность фармакологической пары C115H-Dz/
выми перспективными противоопухолевыми
пропиин на линиях солидных опухолей HT-29,
средствами, действующими в том числе про-
COLO205 и HCT116 (рак толстой кишки),
тив опухолей со множественной лекарствен-
Panc1 и MIA-PaCa2 (рак поджелудочной желе-
ной устойчивостью. Поскольку тиосульфинаты
зы), 22Rv1, DU-145 и PC3 (рак предстательной
имеют множество мишеней в организме, окис-
железы).
ляя серосодержащие белки, и могут оказывать
БИОХИМИЯ том 88 вып. 7 2023
ТИОСУЛЬФИНАТЫ
1133
цитотоксический эффект на здоровые клетки,
вых клеток, а также для ликвидации вторичных
использование метода получения тиосуль-
очагов опухолевого роста.
финатов in situ с помощью ферментативной
реакции непосредственно у поверхности опу-
Вклад авторов. В.В. Куликова писала статью;
холевой клетки обещает стать перспектив-
С.В. Ревтович оформляла рисунки; Е.А. Моро-
ным направлением в терапии злокачественных
зова осуществляла поиск и подбор литератур-
новообразований. Имеющиеся в литературе
ных источников; В.С. Коваль оформлял таб-
данные свидетельствуют о том, что использо-
лицы; П.Н. Сольев анализировал литературные
вание фармакологических пар в направленной
данные; Т.В. Демидкина координировала все
ферментной терапии позволяет обеспечивать
работы.
эффективное образование тиосульфинатов не-
Финансирование. Работа выполнена при
посредственно в области опухоли и тем самым
финансовой поддержке Российского научного
уменьшать их цитотоксическое действие на
фонда (грант № 20-74-10121).
нормальные клетки организма. В перспективе
Конфликт интересов. Авторы заявляют об
такие препараты можно было бы использовать
отсутствии конфликта интересов.
в комбинированной терапии с другими извест-
Соблюдение этических норм. Настоящая ста-
ными цитостатическими агентами с целью
тья не содержит описания выполненных авто-
уменьшения вероятности возникновения рези-
рами исследований с участием людей или жи-
стентности к применяемым препаратам у рако-
вотных в качестве объектов.
СПИСОК ЛИТЕРАТУРЫ
1.
Miekus, N., Marszałek, K., Podlacha, M., Iqbal, A.,
potential therapeutic agents, Nat. Prod. Rep., 22, 351-
Puchalski, C., and Swiergiel, A. H. (2020) Health
368, doi: 10.1039/b417639c.
benefits of plant-derived sulfur compounds, glu-
8. Shen, C., Xiao, H., and Parkin, K. L. (2002) In vitro
cosinolates, and organosulfur compounds, Molecules,
stability and chemical reactivity of thiosulfinates,
25, 3804, doi: 10.3390/molecules25173804.
J. Agric. Food Chem., 50, 2644-2651, doi: 10.1021/
2.
Lawson, L. D. (1996) The composition and chemistry
jf011013e.
of garlic cloves and processed garlic, in: Garlic: The
9. Small, L. D., Bailey, J. H., and Cavallito, C. J. (1947)
Science and Therapeutic Application of Allium sativum L.
Alkyl Thiolsulfinates, J. Am. Chem. Soc., 69, 1710-
and Related Species (Koch, H. P., and Lawson, L. D.,
1713, doi: 10.1021/ja01199a040.
eds) 2nd Edn., Williams & Wilkins, Baltimore.
10. Stellenboom, N., Hunter, R., Caira, M. R., Bourne,
3.
Borlinghaus, J., Albrecht, F., Gruhlke, M. C.,
S. A., Cele, K., Qwebani, T., and le Roex, T. (2007)
Nwachukwu, I. D., and Slusarenko, A. J.
(2014)
Synthesis and inclusion of S-aryl alkylthiosulfi-
Allicin: chemistry and biological properties, Molecules,
nates as stable allicin mimics, ARKIVOC, 9, 53-63,
19, 12591-12618, doi: 10.3390/molecules190812591.
doi: 10.3998/Ark.5550190.0008.907.
4.
Batiha, G., Beshbishy, A. M., Wasef, L. G., Elewa,
11. Weisberger, A. S., and Pensky, J. (1957) Tumor-inhib-
Y. H. A., Al-Sagan, A. A., Abd El-Hack, M. E., Taha,
iting effects derived from an active principle of garlic
A. E., Abd-Elhakim, Y. M., and Devkota, H. P. (2020)
(Allium sativum), Science, 126, 1112-1114, doi: 10.1126/
Chemical constituents and pharmacological activities
science.126.3283.1112-a.
of garlic (Allium sativum L.): a review, Nutrients, 12,
12. Merhi, F., Auger, J., Rendu, F., and Bauvois, B. (2008)
872, doi: 10.3390/nu12030872.
Allium compounds, dipropyl and dimethyl thiosulfi-
5.
Borlinghaus, J., Foerster Née Reiter, J., Kappler, U.,
nates as antiproliferative and differentiating agents of
Antelmann, H., Noll, U., Gruhlke, M. C. H., and
human acute myeloid leukemia cell lines, Biologics, 2,
Slusarenko, A. J. (2021) Allicin, the odor of freshly
885-895, doi: 10.2147/btt.s3212.
crushed garlic: a review of recent progress in under-
13. Miron, T., Wilchek, M., Sharp, A., Nakagawa, Y.,
standing allicin’s effects on cells, Molecules, 26, 1505,
Naoi, M., Nozawa, Y., and Akao, Y. (2008) Allicin
doi: 10.3390/molecules26061505.
inhibits cell growth and induces apoptosis through
6.
Catanzaro, E., Canistro, D., Pellicioni, V., Vivarelli, F.,
the mitochondrial pathway in HL60 and U937
and Fimognari, C. (2022) Anticancer potential of
cells, J. Nutr. Biochem., 19, 524-535, doi: 10.1016/
allicin: A review, Pharmacol. Res., 177, 106118, doi:
j.jnutbio.2007.06.009.
10.1016/j.phrs.2022.106118.
14. Arditti, F. D., Rabinkov, A., Miron, T., Reisner, Y.,
7.
Rose, P., Whiteman, M., Moore, P. K., and Zhu,
Berrebi, A., Wilchek, M., and Mirelman, D. (2005)
Y. Z. (2005) Bioactive S-alk(en)yl cysteine sulfoxide
Apoptotic killing of B-chronic lymphocytic leuke-
metabolites in the genus Allium: the chemistry of
mia tumor cells by allicin generated in situ using a
БИОХИМИЯ том 88 вып. 7 2023
1134
КУЛИКОВА и др.
rituximab-alliinase conjugate, Mol. Cancer Ther., 4,
methionine γ-lyase with polysialic acid: two approaches
325-331, doi: 10.1158/1535-7163.325.4.2.
to antitumor therapy, Int. J. Biol. Macromol., 182,
15.
Patya, M., Zahalka, M. A., Vanichkin, A., Rabinkov, A.,
394-401, doi: 10.1016/j.ijbiomac.2021.03.201.
Miron, T., Mirelman, D., Wilchek, M., Lander, H. M.,
26.
Tyagi, G., Pradhan, S., Srivastava, T., and Mehro-
and Novogrodsky, A. (2004) Allicin stimulates lym-
tra, R. (2014) Nucleic acid binding properties of allicin:
phocytes and elicits an antitumor effect: a possible role
spectroscopic analysis and estimation of anti-tumor
of P21ras, Int. Immunol., 16, 275-281, doi: 10.1093/
potential, Biochim. Biophys. Acta, 1840, 350-356,
intimm/dxh038.
doi: 10.1016/j. bbagen.2013.09.007.
16.
Padilla-Camberos, E., Zaitseva, G., Padilla, C., and
27.
Sun, L., and Wang, X. (2003) Effects of allicin on both
Puebla, A. M. (2010) Antitumoral activity of allicin in
telomerase activity and apoptosis in gastric cancer
murine lymphoma L5178Y, Asian Pac. J. Cancer Prev.,
SGC-7901 cells, World J. Gastroenterol., 9, 1930-1934,
11, 1241-1244.
doi: 10.3748/wjg.v9.i9.1930.
17.
Roseblade, A., Ung, A., and Bebawy, M. (2017) Syn-
28.
Lee, J. H., Yang, H. S., Park, K. W., Kim, J. Y.,
thesis and in vitro biological evaluation of thiosulfinate
Lee, M. K., Jeong, I. Y., Shim, K. H., Kim, Y. S.,
derivatives for the treatment of human multidrug-
Yamada, K., and Seo, K. I. (2009) Mechanisms of
resistant breast cancer, Acta Pharmacol. Sin., 38, 1353-
thiosulfinates from Allium tuberosum L.-induced
1368, doi: 10.1038/aps.2016.170.
apoptosis in HT-29 human colon cancer cells,
18.
Park, K. W., Kim, S. Y., Jeong, I. Y., Byun, M. W.,
Toxicol. Lett.,
188,
142-147, doi:
10.1016/j.toxlet.
Park, K. H., Yamada, K., and Seo, K. I. (2007)
2009.03.025.
Cytotoxic and antitumor activities of thiosulfinates
29.
Abo Qoura, L., Morozova, E., Kulikova, V., Kar-
from Allium tuberosum L, J. Agric. Food Chem., 55,
shieva, S., Sokolova, D., Koval, V., Revtovich, S.,
7957-7961, doi: 10.1021/jf0713051.
Demidkina, T., and Pokrovsky, S. V. (2022) Methionine
19.
Ossama, M., Hathout, R. M., Attia, D. A., and
γ-lyase-daidzein in combination with S-propyl-L-
Mortada, N. D. (2019) Enhanced allicin cytotoxicity
cysteine sulfoxide as a targeted prodrug enzyme system
on HEPG-2 cells using glycyrrhetinic acid surface-
for malignant solid tumor xenografts, Int. J. Mol. Sci.,
decorated gelatin nanoparticles, ACS Omega, 4, 11293-
23, 12048, doi: 10.3390/ijms231912048.
11300, doi: 10.1021/acsomega.9b01580.
30.
Kim, S. Y., Park, K. W., Kim, J. Y., Shon, M. Y., Yee,
20.
Hirsch, K., Danilenko, M., Giat, J., Miron, T.,
S. T., Kim, K. H., Rhim, J. S., Yamada, K., and Seo,
Rabinkov, A., Wilchek, M., Mirelman, D., Levy, J.,
K. I. (2008) Induction of apoptosis by thiosulfinates
and Sharoni, Y. (2000) Effect of purified allicin, the
in primary human prostate cancer cells, Int. J. Oncol.,
major ingredient of freshly crushed garlic, on can-
32, 869-875.
cer cell proliferation, Nutr. Cancer, 38, 245-254,
31.
Kim, S. Y., Park, K. W., Kim, J. Y., Jeong, I. Y.,
doi: 10.1207/S15327914NC382_14.
Byun, M. W., Park, J. E., Yee, S. T., Kim, K. H.,
21.
Bhaumik, I., Pal, K., Debnath, U., Karmakar, P.,
Rhim, J. S., Yamada, K., and Seo, K. I. (2008) Thio-
Jana, K., and Misra, A. K. (2019) Natural product
sulfinates from Allium tuberosum L. induce apopto-
inspired allicin analogs as novel anti-cancer agents,
sis via caspase-dependent and -independent path-
Bioorg. Chem., 86, 259-272, doi: 10.1016/j.bioorg.
ways in PC-3 human prostate cancer cells, Bioorg.
2019.01.057.
Med. Chem. Lett., 18, 199-204, doi: 10.1016/j.bmcl.
22.
Morozova, E., Abo Qoura, L., Anufrieva, N., Koval, V.,
2007.10.099.
Lesnova, E., Kushch, A., Kulikova, V., Revtovich, S.,
32.
Mondal, A., Banerjee, S., Bose, S., Mazumder, S.,
Pokrovsky, V. S., and Demidkina, T. (2022) Daidzein-
Haber, R. A., Farzaei, M. H., and Bishayee, A. (2021)
directed methionine γ-lyase in enzyme prodrug
Garlic constituents for cancer prevention and therapy:
therapy against breast cancer, Biochimie, 201, 177-183,
from phytochemistry to novel formulations, Pharm.
doi: 10.1016/j.biochi.2022.05.007.
Res., 175, 105837, doi: 10.1016/j.phrs.2021.105837.
23.
Miron, T., Mironchik, M., Mirelman, D., Wilchek, M.,
33.
De Greef, D., Barton, E. M., Sandberg, E. N.,
and Rabinkov, A. (2003) Inhibition of tumor growth
Croley, C. R., Pumarol, J., Wong, T. L., Das, N.,
by a novel approach: in situ allicin generation
and Bishayee, A.
(2021) Anticancer potential of
using targeted alliinase delivery, Mol. Cancer Ther.,
garlic and its bioactive constituents: a systematic and
2, 1295-1301.
comprehensive review, Semin. Cancer Biol., 73, 219-
24.
Appel, E., Rabinkov, A., Neeman, M., Kohen, F.,
264, doi: 10.1016/j.semcancer.2020.11.020.
and Mirelman, D. (2011) Conjugates of daidzeinal-
34.
Rauf, A., Abu-Izneid, T., Thiruvengadam, M., Imran, M.,
liinase as a targeted pro-drug enzyme system against
Olatunde, A., Shariati, M. A., Bawazeer, S., Naz, S.,
ovarian carcinoma, J. Drug Target,
19,
326-335,
Shirooie, S., Sanches-Silva, A., Farooq, U., and Ka-
doi: 10.3109/1061186X.2010.504265.
zhybayeva, G. (2022) Garlic (Allium sativum L.): its
25.
Morozova, E., Anufrieva, N., Koval, V., Lesnova, E.,
chemistry, nutritional composition, toxicity, and anti-
Kushch, A., Timofeeva, V., Solovieva, A., Kulikova, V.,
cancer properties, Curr. Top. Med. Chem., 22, 957-
Revtovich, S., and Demidkina, T. (2021) Conjugates of
972, doi: 10.2174/1568026621666211105094939.
БИОХИМИЯ том 88 вып. 7 2023
ТИОСУЛЬФИНАТЫ
1135
35.
Mitra, S., Das, R., Emran, T. B., Labib, R. K., Noor-E-
Expert Opin. Ther. Targets,
26,
217-231, doi:
Tabassum, I. F., Sharma, R., Ahmad, I., Nainu, F.,
10.1080/14728222.2022.2047178.
Chidambaram, K., Alhumaydhi, F. A., Chandran, D.,
47.
Badol, P., David-Dufilho, M., Auger, J., Whiteheart,
Capasso, R., and Wilairatana, P.
(2022) Diallyl
S. W., and Rendu, F. (2007) Thiosulfinates modulate
disulfide: a bioactive garlic compound with anticancer
platelet activation by reaction with surface free sulfhy-
potential, Front. Pharmacol., 22, 943967, doi: 10.3389/
dryls and internal thiol-containing proteins, Platelets,
fphar.2022.943967.
18, 481-490, doi: 10.1080/09537100701271828.
36.
Kaschula, C. H., Hunter, R., and Parker, M. I. (2010)
48.
Block, E., Bechand, B., Gundala, S., Vattekkatte, A.,
Garlic-derived anticancer agents: structure and
Wang, K., Mousa, S. S., Godugu, K., Yalcin, M.,
biological activity of ajoene, Biofactors, 36, 78-85,
and Mousa, S. A. (2017) Fluorinated analogs of
doi: 10.1002/biof.76.
organosulfur compounds from garlic (Allium sativum):
37.
Cavallito, C. J., and Bailey, J. H. (1944) Allicin, the
synthesis, chemistry and anti-angiogenesis and
antibacterial principle of Allium sativum. I. Isolation,
antithrombotic studies, Molecules,
22,
2081, doi:
physical properties and antibacterial action, J. Am.
10.3390/molecules22122081.
Chem. Soc., 66, 1950-1951.
49.
Philpott, G. W., Bower, R. J., Parker, K. L., Shearer,
38.
Cavallito, C. J., Buck, J. S., and Suter, C. M. (1944)
W. T., and Parker, C. W. (1974) Affinity cytotoxici-
Allicin, the antibacterial principle of Allium sativum.
ty of tumor cells with antibody-glucose oxidase con-
II. Determination of the chemical structure, J. Am.
jugates, peroxidase, and arsphenamine, Cancer Res.,
Chem. Soc., 66, 1952-1954, doi: 10.1021/ja01239a049.
34, 2159-2164.
39.
Rabinkov, A., Miron, T., Konstantinovski, L.,
50.
Chhabria, S. V., Akbarsha, M. A., Li, A. P., Kharkar,
Wilchek, M., Mirelman, D., and Weiner, L. (1998)
P. S., and Desai, K. B. (2015) In situ allicin generation
The mode of action of allicin: trapping of radicals
using targeted alliinase delivery for inhibition of
and interaction with thiol containing proteins,
MIA PaCa-2 cells via epigenetic changes, oxidative
Biochim. Biophys. Acta, 1379, 233-244, doi: 10.1016/
stress and cyclin-dependent kinase inhibitor (CDKI)
s0304-4165(97)00104-9.
expression, Apoptosis, 20, 1388-1409, doi: 10.1007/
40.
Gruhlke, M. C. H., Antelmann, H., Bernhardt, J.,
s10495-015-1159-4.
Kloubert, V., Rink, L., and Slusarenko, A. J. (2019)
51.
Tanaka, H., Esaki, N., and Soda, K. (1977) Properties
The human allicin-proteome: S-thioallylation of
of L-methionine gamma-lyase from Pseudomonas
proteins by the garlic defence substance allicin and its
ovalis, Biochemistry,
16,
100-106, doi:
10.1021/
biological effects, Free Radic. Biol. Med., 131, 144-
bi00620a016.
153, doi: 10.1016/j.freeradbiomed.2018.11.022.
52.
Morozova, E. A., Revtovich, S. V., Anufrieva, N. V.,
41.
Watanabe, Y., Muroi, R., Tsuchiya, H., Uda, Y., and
Kulikova, V. V., Nikulin, A. D., and Demidkina, T. V.
Hashimoto, K. (2013) Inhibitory effect of methyl
(2014) Alliin is a suicide substrate of Citrobacter freundii
methanethiosulfinate on β-glucuronidase activity,
methionine γ-lyase: structural bases of inactivation of
Biosci. Biotechnol. Biochem.,
77,
2325-2327, doi:
the enzyme, Acta Crystallogr. D Biol. Crystallogr., 70,
10.1271/bbb.130510.
3034-3042, doi: 10.1107/S1399004714020938.
42.
Takada, H., Hirooka, T., Hiramatsu, Y., and
53.
Anufrieva, N. V., Morozova, E. A., Kulikova, V. V.,
Yamamoto, M. (1982) Effect of beta-glucuronidase
Bazhulina, N. P., Manukhov, I. V., Degtev, D. I.,
inhibitor on azoxymethane-induced colonic carcino-
Gnuchikh, E. Yu., Rodionov, A. N., Zavilgelsky,
genesis in rats, Cancer Res., 42, 331-334.
G. B., and Demidkina, T. V. (2015) Sulfoxides, ana-
43.
Morita, N., Walaszek, Z., Kinjo, T., Nishimaki, T.,
logues of L-methionine and L-cysteine as pro-
Hanausek, M., Slaga, T. J., Mori, H., and Yoshimi, N.
drugs against gram-positive and gram-negative
(2008) Effects of synthetic and natural in vivo inhibitors
bacteria, Acta Naturae, 7, 128-135, doi: 10.32607/
of β-glucuronidase on azoxymethane-induced colon
20758251-2015-7-4-128-135.
carcinogenesis in rats, Mol. Med. Rep., 1, 741-746,
54.
Morozova, E., Kulikova, V., Rodionov, A., Rev-
doi: 10.3892/mmr_00000022.
tovich, S., Anufrieva, N., and Demidkina, T. (2016)
44.
Luo, R., Fang, D., Hang, H., and Tang, Z. (2016)
Engineered Citrobacter freundii methionine γ-lyase
The mechanism in gastric cancer chemoprevention
effectively produces antimicrobial thiosulfinates,
by allicin, Anticancer Agents Med. Chem., 16, 802-809,
Biochimie,
128-129,
92-98, doi:
10.1016/j.
doi: 10.2174/1871520616666151111115443.
biochi.2016.07.007.
45.
Rendu, F., Brohard-Bohn, B., Pain, S., Bachelot-
55.
Kulikova, V. V., Anufrieva, N. V., Revtovich, S. V.,
Loza, C., and Auger, J. (2001) Thiosulfinates inhibit
Chernov, A. S., Telegin, G. B., Morozova, E. A.,
platelet aggregation and microparticle shedding at a
and Demidkina, T. V. (2016) Mutant form C115H of
calpain-dependent step, Thromb. Haemost., 86, 1284-
Clostridium sporogenes methionine γ-lyase efficiently
1291, doi: 10.1055/s-0037-1616063.
cleaves S-Alk(en)yl-L-cysteine sulfoxides to anti-
46.
Shapovalov, I., Harper, D., and Greer, P. A.
bacterial thiosulfinates, IUBMB Life, 68, 830-835, doi:
(2022) Calpain as a therapeutic target in cancer,
10.1002/iub.1562.
БИОХИМИЯ том 88 вып. 7 2023
1136
КУЛИКОВА и др.
56. Morozova, E. A., Anufrieva, N. V., Davydov, D. Zh.,
57. Morozova, E. A., Kulikova, V. V., Anufrieva, N. V.,
Komarova, M. V., Dyakov, I. N., Rodionov, A. N.,
Minakov, A. N., Chernov, A. S., Telegin, G. B.,
Demidkina, T. V., and Pokrovsky, V. S. (2017) Plasma
Revtovich, S. V., Koval, V. S., and Demidkina,
methionine depletion and pharmacokinetic properties
T. V. (2019) Methionine γ-lyase in enzyme pro-
in mice of methionine γ-lyase from Citrobacter
drug therapy: An improvement of pharmacoki-
freundii, Clostridium tetani and Clostridium sporogenes,
netic parameters of the enzyme, Int. J. Biol. Mac-
Biomed. Pharmacother., 88, 978-984, doi: 10.1016/j.
romol.,
140,
1277-1283, doi:
10.1016/j.ijbiomac.
biopha.2017.01.127.
2019.08.224.
THIOSULFINATES: CYTOTOXIC AND ANTITUMOR ACTIVITY
Review
V. V. Kulikova*, E. A. Morozova, V. S. Koval, P. N. Solyev,
T. V. Demidkina,
and S. V. Revtovich
Engelhardt Institute of Molecular Biology, Russian Academy of Sciences,
119991 Moscow, Russia; e-mail: vitviku@yandex.ru
The pharmacological value of some natural compounds makes them attractive for use in oncology. Sulfur-
containing thiosulfinates found in plants of the genus Allium have long been known as compounds with
various therapeutic properties, including antitumor. In recent years, the effect of thiosulfinates on various
stages of carcinogenesis has been actively studied. In vitro and in vivo studies have shown that thiosulfinates
inhibit the proliferation of cancer cells, as well as induce apoptosis. The purpose of this review is to summa-
rize current data on the use of natural and synthetic thiosulfinates in cancer therapy. Antitumor mechanisms
and molecular targets of these promising compounds are discussed. A significant part of the review is devot-
ed to the consideration of a new strategy for the treatment of oncological diseases - the use of the method
of directed enzyme prodrug therapy with the possibility of obtaining antitumor thiosulfinates in situ.
Keywords: natural and synthetic thiosulfinates, cytostatic activity, antitumor activity, targeted enzyme prodrug therapy
БИОХИМИЯ том 88 вып. 7 2023