БИОХИМИЯ, 2023, том 88, вып. 7, с. 1137 - 1161
УДК 577.12
S-ГЛУТАТИОНИЛИРОВАНИЕ И S-НИТРОЗИЛИРОВАНИЕ
КАК МОДУЛЯТОРЫ РЕДОКС-ЗАВИСИМЫХ ПРОЦЕССОВ
В ОПУХОЛЕВОЙ КЛЕТКЕ
Обзор
© 2023 Е.В. Калинина*, М.Д. Новичкова
Российский университет дружбы народов,
117198 Москва, Россия; электронная почта: kalinina-ev@rudn.ru
Поступила в редакцию 10.02.2023
После доработки 10.03.2023
Принята к публикации 11.03.2023
Развитие окислительного/нитрозативного стресса, связанного с активацией онкогенных путей,
является следствием роста уровня генерации активных форм кислорода и азота (АФК/АФА) в опу-
холевых клетках. Действие АФК/АФА имеет двойственный характер: высокие уровни вызывают
клеточную гибель и ограничение опухолевого роста на определенных фазах развития злокаче-
ственных новообразований, тогда как низкие концентрации позволяют осуществлять окислитель-
ные/нитрозативные модификации ключевых редокс-зависимых остатков в регуляторных белках.
Обратимость таких модификаций, как S-глутатионилирование/S-нитрозилирование, которые про-
исходят посредством электрофильной атаки АФК/АФА на нуклеофильные остатки Cys, обеспечи-
вает редокс-переключение активности сигнальных белков и возможность управления процессами
пролиферации и программированной гибели. Уровень S-глутатионилированных и S-нитрозили-
рованных белков контролируется балансом между S-глутатионилированием/деглутатионилирова-
нием и S-нитрозилированием/денитрозилированием, соотношение которых зависит от клеточного
редокс-статуса. Степень S-глутатионилирования и S-нитрозилирования белковых мишений и их
соотношение во многом определяют состояние и направление сигнальных путей в опухолевых
клетках. В обзоре рассматриваются особенности реакций S-глутатионилирования и S-нитрозили-
рования в опухолевых клетках, баланс систем, контролирующих их активность и их связь с редокс-
зависимыми процессами и опухолевым ростом.
КЛЮЧЕВЫЕ СЛОВА: активные формы кислорода и азота, окислительный и нитрозативный стресс, S-глу-
татионилирование и деглутатионилирование, S-нитрозилирование, транс-нитрозилирование, денитро-
зилирование.
DOI: 10.31857/S0320972523070060, EDN: FXFQLC
ВВЕДЕНИЕ
сти основных биологических процессов, вклю-
чая пролиферацию/дифференцировку клеток,
Редокс-баланс, во многом определяемый
метаболический гомеостаз и иммунные реак-
соотношением между генерацией активных
ции [1, 2]. АФК/АФА постоянно генерируются
форм кислорода (АФК) и активных форм азо-
как побочные продукты различных клеточных
та (АФА), с одной стороны, и уровнем анти-
процессов, и изменение их уровня выше фи-
оксидантной системы - с другой, служит ос-
зиологического редокс-диапазона способству-
нованием для клеточного редокс-гомеостаза,
ют развитию окислительного/нитрозативного
состояние которого крайне важно для активно- стресса [3, 4]. Хронический характер такого
Принятые сокращения: АФА - активные формы азота; АФК - активные формы кислорода; ПФП - пентозо-
фосфатный путь; РПЖ - рак предстательной железы; ЭТЦ - электрон-транспортная цепь; GAPDH - глицераль-
дегид-3-фосфатдегидрогеназа; Grx - глутаредоксин; GSH и GSSG - восстановленный и окисленный глутатион;
GSNO - нитрозоглутатион; GSNOR - S-нитрозоглутатионредуктаза; NF-κB - ядерный фактор κB; NO - оксид азота;
NOS - NO-синтаза; Nrf2 - NF-E2-зависимый фактор 2; PDI - протеин-дисульфид изомераза; PKC - протеинкиназа C;
Pr-SH - тиол белка; Pr-SSG - S-глутатионилированный белок; Prx - пероксиредоксин; Srx - сульфиредоксин; Trx -
тиоредоксин; TrxR - тиоредоксинредуктаза.
* Адресат для корреспонденции.
1137
7
1138
КАЛИНИНА, НОВИЧКОВА
стресса приводит к повреждению клеток, тка-
ность и их связь с редокс-зависимыми процес-
ней и органов и связан с патогенезом различных
сами и опухолевым ростом.
заболеваний, в том числе онкологических [3].
Отличительной чертой многих злокаче-
ственных новообразований и линий опухо-
ИСТОЧНИКИ ОБРАЗОВАНИЯ АФК
левых клеток является развитие
«мягкого»
В ОПУХОЛЕВЫХ КЛЕТКАХ.
окислительного/нитрозативного стресса, ко-
РАЗВИТИЕ ОКСИЛИТЕЛЬНОГО СТРЕССА
торый связан с активацией онкогенных путей
и появление которого является следствием
Опухолевые клетки характеризуются повы-
роста уровня генерации АФК/АФА, частично
шенной генерацией АФК, что в значительной
скомпенсированного адаптивным повышени-
степени инициируется действием физических
ем активности систем их элиминации [2, 5].
факторов и онкогенов, инициирующих зло-
Соответственно, продукция АФК/АФА опу-
качественную трансформацию [3, 13]. Основ-
холевыми клетками является результатом ре-
ными продуцентами АФК в клетке являются
докс-зависимой модуляции многочисленных
митохондрии, где в норме 0,2-2% потока элек-
сигнальных путей, влияющих на клеточный
тронов с комплексов I, II и III электрон-транс-
метаболизм [6]. Окислительный/нитрозатив-
портной цепи (ЭТЦ) уходит на образование
ный стресс может способствовать прогресси-
супероксида (
•-), который быстро дисмути-
рованию опухолевого роста вследствие неста-
рует до перекиси водорода (H2O2), действую-
бильности генома и хромосомных аномалий
щей как «вторичный мессенджер» в передаче
с усиленной активацией онкогенов и подав-
сигнала благодаря относительно длительно-
лением онкосупрессоров, изменением мета-
му периоду ее полураспада и способности к
болизма опухолевых клеток [7]. Повреждение
диффузии через аквапориновые каналы мем-
ДНК приводит к гидролизу оснований ДНК
бран с последующим образованием в резуль-
с образованием аддуктов, которые нарушают
тате реакции Фентона высокореакционноспо-
нормальный рост клеток за счет индукции ген-
собных гидроксильных радикалов в присут-
ных мутаций и изменения нормальной тран-
ствии ионов металлов переменной валент-
скрипции генов.
ности (Fe2+, Cu2+, Co2+). Взаимодействие су-
Опухолевые клетки адаптируются к окис-
пероксида с NO приводит к образованию пер-
лительному стрессу в краткосрочной перспек-
оксинитрита (ONOO-), способного контроли-
тиве за счет метаболического перепрограмми-
ровать сигнальные пути посредством нитрова-
рования и в долгосрочной перспективе - за
ния остатков тирозина в белках-мишенях [1].
счет генетического репрограммирования [3].
Мутации в компонентах ЭТЦ, способ-
Существенную роль в системе адаптационного
ствующие усиленному образованию АФК, от-
механизма играют реакции посттрансляцион-
мечаются во многих типах опухолей, что под-
ной модификации, приводящие к редокс-за-
тверждает значимую роль этого механизма в
висимому изменению функциональной актив-
модуляции фенотипа опухолевых клеток [14].
ности белков [8]. Низкие концентрации АФК/
Мутации NADH-дегидрогеназы (комплекс I)
АФА, поддерживаемые активностью эндо-
млекопитающих (содержащей 44 субъедини-
генной антиоксидантной системы, позволя-
цы, семь из которых (ND1, ND2, ND3, ND4,
ют осуществлять модификации посредством
ND4L, ND5 и ND6) кодируются митохондри-
электрофильной атаки АФК/АФА на нуклео-
альной ДНК, остальные - ядерным геномом)
фильные группы аминокислотных остатков
могут приводить к увеличению продукции
•-,
в регуляторных белках. Обратимый характер
поддерживая АФК-зависимые пути онко-
таких реакций обеспечивает редокс-переклю-
генеза. Так, мутации гена ND2 способствуют
чения в активности сигнальных белков. Среди
онкогенезу и метастазированию при раке мо-
редокс-модификаций реакции S-глутатиони-
лочной железы, поджелудочной железы и рото-
лирования и S-нитрозилирования, осущест-
вой полости, карциномах головы и шеи. Подоб-
вляемые через SH-группу остатков Cys в бел-
ные корреляции обнаружены для мутаций гена
ке, наиболее часто встречаемые в опухолевых
ND6 при раке легких, гена ND4 - при остром
клетках [9-12]. Уровень активности этих реак-
миелоидном лейкозе и глиобластоме [14, 15].
ций во многом связан с прогрессией опухоле-
Мутации гена ND6, вызывающие снижение ак-
вого роста.
тивности комплекса I и повышение образо-
В настоящем обзоре анализируются осо-
вания АФК, усиливают пролиферацию как
бенности реакций S-глутатионилирования и
гипер-, так и гипометастатических сублиний
S-нитрозилирования в опухолевых клетках,
клеток карциномы легких Льюиса, кото-
баланс систем, контролирующих их актив-
рая подавляется «скэвенджерами» АФК [16].
БИОХИМИЯ том 88 вып. 7 2023
МОДИФИКАЦИИ ТИОЛОВ В ОПУХОЛЕВОЙ КЛЕТКЕ
1139
Мутации, приводящие к снижению функции
ли клеток через регуляцию уровня ионов Ca2+
комплекса II при наследственной феохромо-
и активности киназы c-ABL либо стимулируя
цитоме/параганглиоме и почечно-клеточном
рост опухоли при некоторых видах рака через
раке, вызывают рост образования АФК и по-
транскрипционные факторы STAT5A (signal
давление синтеза ATP за счет окислительного
transducer and activator of transcription 5A) и
фосфорилирования [17, 18].
CREB (cAMP response element-binding protein).
Действие онкогенов может в значитель-
Таким образом, NOX5 может определять ба-
ной степени усиливать образование АФК не
ланс клеточной пролиферации и гибели опу-
только в митохондриях, но и за счет активации
холевых клеток при раке кожи, молочной же-
прооксидантных ферментов. Онкоген К-RAS
лезы и легких [27].
не только повышает митохондриальный уро-
Определенный вклад в развитие окисли-
вень АФК, вызывая трансформацию ацинар-
тельного стресса в опухолевых клетках вно-
ных клеток поджелудочной железы в интра-
сят циклооксигеназа (COX) и липоксигена-
эпителиальную неоплазию поджелудочной же-
за (LOX), благодаря активности которых об-
лезы, но и активирует NOX2 и NOX4 - изо-
разуются гидроперекиси полиненасыщенных
формы NADPH-оксидазы, основной функци-
жирных кислот с последующим превращением
ей которой является образование
•- [19, 20].
в высокореакционноспособные бифункцио-
Как и RAS, c-Myc индуцирует сложную ме-
нальные электрофилы - 4-гидроксиноненали
таболическую перестройку в опухолевых клет-
и
4-оксо-ноненали, образующие сшивки в
ках, что достигается за счет стимуляции гли-
белках и ДНК [28]. Получены убедительные
колиза, митохондриального биогенеза и глута-
доказательства, подтверждающие роль катали-
минолиза [14]. На клеточных линиях глиомы
зируемого LOX метаболизма арахидоновой и
показано, что Myc контролирует программу
линолевой кислот в развитии злокачественных
транскрипции, которая способствует катабо-
новообразований. Образующийся уровень гид-
лизму глутамина в качестве источника углерода
роперекисей жирных кислот в процессе мета-
для подпитки цикла трикарбоновых кислот,
болизма арахидоновой или линолевой кис-
тем самым поддерживая выработку АФК с
лоты влияет на регуляцию роста и выживае-
помощью ЭTЦ [21], в то же время повышение
мость клеток, ангиогенез, клеточную инвазию,
экспрессии MYC в линии P493-6 B-клеток при-
метастазирование и иммуномодуляцию. Об-
водит к увеличению митохондриальной массы,
наружено, что изоформа 12-LOX способству-
скорости потребления кислорода и показателя
ет прогрессированию и метастазированию
активности ЭTЦ, что стимулирует выработку
РПЖ [29]. Активность изоформы 5-LOX также
АФК посредством усиленного потока электро-
играет важную роль в выживании и проли-
нов через ЭТЦ [22].
ферации клеток РПЖ, поддерживая высокую
Важным источником АФК в опухолевых
экспрессию гена MYC [30].
клетках, как отмечено выше, является актив-
Существенным источником АФК может
ность изоформ NOX, принадлежащих к се-
служить активность оксидоредуктазы ERO1
мейству NADPH-оксидазы, которое состоит
(ER oxidoreductin 1), повышенная экспрес-
из семи изоферментов (NOX1-NOX5, DUOX1,
сия гена которой отмечается во многих типах
DUOX2), переносящих электроны от NADPH(H+)
опухолевых клеток и которая, наряду с про-
через мембраны на молекулярный кислород
теин-дисульфид-изомеразой (protein disulfide
с образованием супероксида [23]. Повышен-
isomerase, PDI), играет основную роль в окис-
ная экспрессия гена изоформы NOX2 отмеча-
лительных реакциях эндоплазматического стрес-
ется при раке груди, толстой кишки, желудка
са [31]. В окисленном состоянии PDI высту-
и простаты, а также при миеломоноцитарном
пает в роли дисульфидного донора, в вос-
лейкозе [24]. Гиперэкспрессия гена NOX4 уста-
становленном
- способна к изомеризации
новлена в клеточных линиях рака предстатель-
дисульфидных связей своих лигандов. Образо-
ной железы (РПЖ) DU145, PC-3 и LNCaP [25].
вавшаяся после взаимодействия с неправиль-
Подавление экспрессии гена NOX2 приводит
но свернутым белком, восстановленная фор-
к значительному снижению активности кина-
ма PDI вновь окисляется при взаимодействии
зы IKKε (inhibitor of nuclear factor kappa-B
с ERO1, последующее окисление которой с
kinase subunit epsilon), ключевого игрока в
использованием FAD как кофактора приводит
трансформации клеток, инвазивности и разви-
к образованию H2O2, которая может транспор-
тию химиорезистентности [26]. В зависимости
тироваться из ЭПР через аквапорин 8 [32].
от уровня экспрессии гена и клеточного кон-
Эффект Варбурга, связанный со значи-
текста изоформа NOX5 может играть двойную
тельной активацией анаэробного гликолиза, у
роль в опухолевых клетках, способствуя гибе-
большинства опухолевых клеток способствует
БИОХИМИЯ том 88 вып. 7 2023
7*
1
140
КАЛИНИНА, НОВИЧКОВА
повышению внутриклеточного уровня АФК за
приводит к определенному адаптивному из-
счет снижения антиоксидантного статуса в ре-
менению клеточного сигналинга, что сопро-
зультате подавления уровня образования пиру-
вождается появлением так называемого «аг-
вата и NADH(H+) с последующим снижени-
рессивного» фенотипа опухолевых клеток.
ем активности митохондриальной трансгидро-
Рост АФК вызывает изменение активности
геназы и уровня NADPH(H+), что сопрово-
фосфатаз PTP (protein tyrosine phosphatase),
ждается снижением содержания в митохондри-
PTEN (phosphatase and tensin homolog) и MAPK
альном матриксе одного из основных низко-
(mitogen-activated protein kinase), тем самым уси-
молекулярных антиоксидантов глутатиона
ливая сигнальные каскады MAPK/ERK (extra-
(GSH) в результате подавления активности
cellular signal-regulated kinase), PI3K (phosphat-
NADPH(H+)-зависимой глутатионредуктазы,
idylinositol 3-kinase/protein kinase B)/Akt (RAC
восстанавливающей GSH из его окисленной
(Rho family)-alpha serine/threonine-protein ki-
формы (GSSG) [33]. Усиление гликолиза в
nase) и PKD (protein kinase D)/NF-κB клеточ-
определенной степени сдерживается благода-
но-специфическим образом [6]. Для поддерж-
ря гиперэкспрессии гена пируваткиназы М2,
ки пролиферативных преимуществ высоких
обладающей низкой каталитической активно-
уровней АФК при одновременном снижении
стью, что приводит к накоплению фосфоенол-
риска апоптоза в опухолевых клетках активи-
пирувата, частичному подавлению триозофос-
руются редокс-зависимые факторы транскрип-
фатизомеразы и в результате - к активации
ции [3]. Согласно «реостатной» модели раз-
пентозофосфатного пути (ПФП) [34]. Обра-
вития ответа на окислительный стресс, первый
зующийся в результате повышенный уровень
уровень защитного ответа на действие умерен-
содержания NADPH(H+) сопровождается уси-
ных концентраций АФК обеспечивает акти-
лением генерации АФК благодаря активации
вация Nrf2, более высокий уровень АФК вы-
изоформ NADPH-оксидазы, использующей
зывает «включение» транскрипционных фак-
NADPH(H+) в качестве кофермента. АФК и
торов AP-1 и NF-κB, дальнейшее повышение
пируваткиназа М2 образуют отрицательную
образования АФК активирует механизмы апоп-
обратную связь, поддерживающую уровень АФК.
тоза [3].
Регулируемый АФК транскрипционный фак-
Предполагается, что транскрипционный
тор HIF-1α (hypoxia-inducible factor 1-alpha),
фактор p53, контролирующий клеточный цикл,
в свою очередь, изменяет экспрессию генов,
старение и апоптоз, осуществляет финальный
некоторые из которых связаны с эффектом
ответ на крайне высокие уровни АФК. Следует
Варбурга и сопутствующими ему путями. Об-
отметить, что при чрезмерном окислительном
наружено также, что PKM2 является коакти-
стрессе накопившийся в ядре избыточный Nrf2
ватором HIF-1α, который, в свою очередь,
может связываться с регуляторной областью
регулирует протоонкоген Myc, контролирую-
промотора гена Klf9 (Kruppel-like factor 9) и
щий экспрессию генов, связанных с процес-
активировать его экспрессию, что приводит к
сами клеточного роста и пролиферации [32,
подавлению экспрессии генов антиоксидант-
34]. Изменения, связанные с энергетическим
ных ферментов путем связывания Klf9 с их
метаболизмом, могут быть связаны с экспрес-
репрессивными сайтами и вызывает клеточ-
сией генов, регулируемых р53, включая SCO2,
ное повреждение в результате роста генера-
TIGAR и PIG3 [35].
ции АФК [37].
Повышение уровня АФК в опухолевых
Повышение уровня АФК и последующее
клетках также может быть результатом отсут-
изменение антиоксидантной системы и ре-
ствия регуляции генов антиоксидантных фер-
докс-статуса в целом может рассматриваться
ментов, опосредованной опухолевыми супрес-
как важный регулятор клеточного гомеостаза в
сорами. Примером может служить снижение
редокс-зависимой адаптации к хроническому
экспрессии генов изоформ супероксиддисму-
окислительному стрессу, связанной с процес-
тазы (SOD2), глутатионпероксидазы (GPX1) и
сами инициации и прогрессирования злокаче-
сестрина (SESN1, SESN2) после инактивации
ственных новообразований, что необходимо
гена-супрессора опухолевого роста ТР53 [5].
учитывать при разработке схем химиотерапии.
Возможны посттрансляционные модифика-
ции, в частности ацетилирование SOD2 [36],
которые придают антиоксидантным фермен-
РОЛЬ NO В ОПУХОЛЕВЫХ КЛЕТКАХ.
там прооксидантные свойства.
РАЗВИТИЕ НИТРОЗАТИВНОГО СТРЕССА
Развитие хронического окислительного
стресса в опухолевых клетках, определяемо-
У млекопитающих и человека оксид азо-
го в первую очередь высоким уровнем АФК,
та (NO) в основном синтезируется за счет
БИОХИМИЯ том 88 вып. 7 2023
МОДИФИКАЦИИ ТИОЛОВ В ОПУХОЛЕВОЙ КЛЕТКЕ
1141
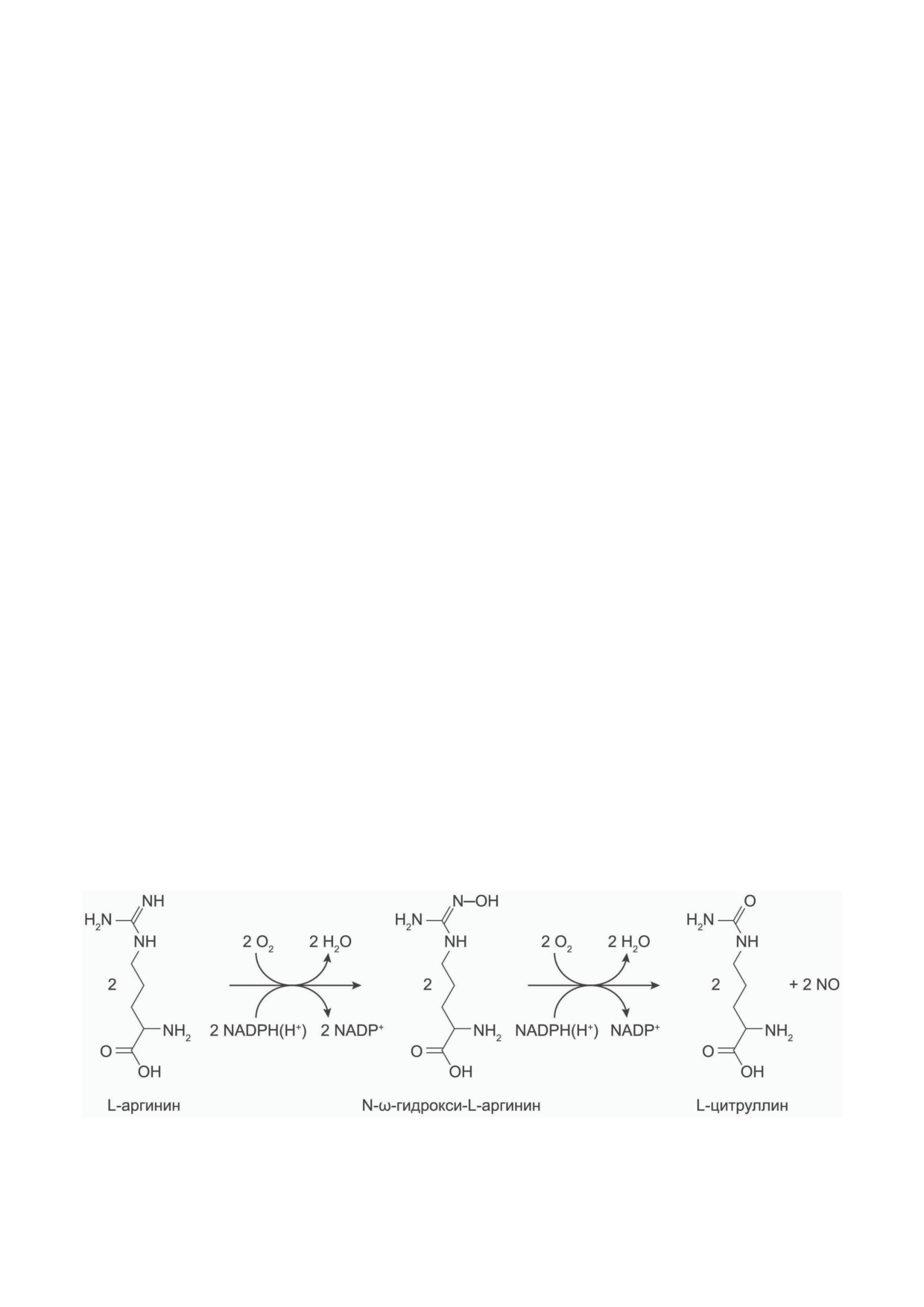
NO-синтазы, для которой известны три изо-
ца - оксигеназный. Редуктазный домен связы-
формы: две конститутивные NOS1 (нейро-
вает NADPH(H+), FAD и FMN, участвующие в
нальная, nNOS) и NOS3 (эндотелиальная,
переносе электронов на оксигеназный домен
eNOS), а также индуцибельная NOS2 (iNOS),
соседнего мономера. За счет оксигеназного
обладающие примерно
50%-ной гомологи-
домена осуществляется димеризация и коор-
ей [38]. Активность конститутивных NOS1 и
динируются ион цинка, BH4, гем и L-аргинин.
NOS3 регулируется в основном путем фосфо-
Синтезируется NO из L-аргинина при уча-
рилирования, S-нитрозилирования, белок-
стии кислорода через промежуточный продукт
белкового взаимодействия, изменения уровня
N-ω-гидрокси-L-аргинин с образованием L-цит-
кальция, благодаря чему во многом поддер-
руллина (рис. 1).
живаются стационарные концентрации NO,
NO, помимо радикальной формы (NO•),
обеспечивающие регуляцию тканевого гомео-
может существовать в виде ионов нитрозо-
стаза [39]. Напротив, индуцибельная NOS2
ния (NO+) или нитроксила (NO-), что зависит
осуществляет синтез высоких концентраций
от условий микроокружения. Реакции, в кото-
NO в ответ на действие различных факто-
рых участвует NO, можно разделить на две ка-
ров [39]. Кроме того, в матриксе и на внутрен-
тегории: прямые и непрямые [41, 42]. В первом
ней мембране митохондрий обнаружена изо-
случае NO напрямую реагирует с молекулой-
форма mtNOS - гомолог NOS1, исследование
мишенью. Напротив, в непрямых реакциях на
влияния которой на функционирование мито-
первом этапе NO реагирует с кислородом или
хондрий интенсивно проводится в последнее
супероксидом с образованием АФА, которые
время [40].
впоследствии реагируют с биологическими ми-
NOS представляет собой гомодимер, в
шенями. Прямые эффекты NO обычно осу-
котором мономеры связываются через тетра-
ществляются при его низких концентрациях,
эдрический координационный комплекс иона
тогда как непрямые взаимодействия происхо-
цинка с четырьмя остатками Cys (по два из
дят при гораздо более высоких концентрациях.
каждого мономера), располагающимися в
В свою очередь, непрямые взаимодействия
них в аминокислотной последовательности
могут быть подразделены на две категории:
CysXXXXCys. Все изоформы активны в виде
нитрозативный и окислительный стресс [42].
гомодимеров, димеризация обеспечивается
В случае окислительного стресса, характери-
между двумя оксидазными доменами при уча-
зующегося высоким уровнем АФК, и прежде
стии Zn2+ с образованием тетратиольного ком-
всего
•-, в результате реакции NO с супер-
плекса, в котором от каждого мономера уча-
оксидом образуются пероксинитрит (ONOO-)
ствует два остатка цистеина. Благодаря этой
и диоксид азота (NO2), которые являются
последовательности NOS связывает субстрат
сильными окислителями. Напротив, в случае
L-аргинин и кофермент тетрагидробиоптерин
нитрозативного стресса при условии высо-
(BH4), который облегчает димеризацию, свя-
кого уровня NO, образующийся в результате
зывание субстрата и необходим для осущест-
реакции NO с O2 (автоокисление), а также в
вления ферментативной реакции [39]. Каж-
реакции NO/
•-, N2O3 является мягким окис-
дый мономер содержит два домена: со стороны
лителем, который предпочитает нитрозатные
С-конца - редуктазный, со стороны N-кон-
нуклеофилы, такие как амины и тиолы [43].
Рис. 1. Двухстадийная реакция, катализируемая NO-синтазой. На первом этапе L-аргинин гидроксилируется с обра-
зованием N-гидрокси-L-аргинина с использованием одной молекулы кислорода и двух электронов от NADPH(H+).
На втором этапе N-гидрокси-аргинин с использованием одного электрона от NADPH(H+) и другой молекулы кисло-
рода превращается в L-цитруллин и NO
БИОХИМИЯ том 88 вып. 7 2023
1
142
КАЛИНИНА, НОВИЧКОВА
Нитрозативный стресс подразумевает, как пра-
так как экспрессия NOS3 также коррелирует с
вило, взаимодействие нитрозония (NO+) с
процессами инвазии, метастазирования, ан-
тиолами, вторичными аминами или гидрокси-
гиогенеза и резистентности [53, 54]. Установ-
группами. Баланс между процессами окисле-
лено, что ген NOS3 высокоэкспрессирован в
ния и нитрозирования во многом зависит от
различных фенотипах клеток колоректального
уровня NO.
рака, включая низкодифференцированные аде-
Экспрессия NOS и уровень NO значитель-
нокарциномы, что позволило предложить ис-
но варьируют в злокачественных новообразо-
пользовать NOS3 как возможный новый био-
ваниях и связаны как с проопухолевым, так
маркер при прогностически неблагоприятных
и с противоопухолевым эффектами [44], что
колоректальных злокачественных новообразо-
определяется концентрацией NO в среде, вре-
ваниях [53].
менем его воздействия и клеточной адапта-
В результате ряда клинических испытаний
цией к NO. Как правило, NO способствует
установлено, что экспрессия гена NOS2 свя-
выживанию и пролиферации клеток при низ-
зана со значительным числом злокачествен-
ких концентрациях (<200 нМ), тогда как при
ных новообразований, включая рак молочной
более высоком уровне (>400 нМ) NO способ-
железы, печени, шейки матки, яичников, пред-
ствует аресту клеточного цикла, апоптозу и
стательной железы, носоглотки, легких, же-
старению [45, 46]. Высокие концентрации NO
лудка, поджелудочной железы, толстой кишки
приводят к образованию активных производ-
и пищевода, меланому, глиому [55]. Высокий
ных NO (N2O3, ONNO-, NO2, NO−), которые
уровень NOS2, как и маркера воспаления
вызывают повреждение ДНК, снижая актив-
COX-2, отмечается во многих типах опухолей,
ность ДНК-лигазы и повышая тем самым
при этом отмечается, что повышение экспрес-
количество однонитевых разрывов, а также
сии NOS2 является отрицательным прогно-
могут инактивировать белки репарации ДНК
стическим маркером для пациентов с раком
и служить источником генотоксичных нитроз-
молочной железы, поджелудочной железы, же-
аминов [47, 48]. Кроме того, цитотоксическое
лудка, печени, толстой кишки, глиомы и ме-
действие NO связано с его способностью по-
ланомы, коррелирующих с ростом метастати-
давлять активность белков дыхательной цепи
ческого потенциала. Кроме того, обнаруже-
митохондрий путем связывания с FeS-класте-
но, что трансфекция NOS2 в опухолевые клет-
рами [49].
ки приводит к более агрессивным опухолям
Поэтому высокие концентрации NO, про-
in vivo, несмотря на то что in vitro они менее
дуцируемые, в частности NOS2, потенциаль-
пролиферативны [56]. Установлено существо-
ным цитостатическим/цитотоксическим фак-
вание связи между уровнями NO и p53, отра-
тором действия иммунной системы, могут
жающей тот факт, что p53 может подавлять
оказывать противоопухолевое действие, тогда
экспрессию NOS2, тогда как высокие уров-
как хроническая индукция NOS2 способствует
ни NO приводят к повышению стабилизации
активации опухолевого роста [50]. Кроме того,
p53 посредством фосфорилирования остатков
низкие концентрации NO, продуцируемые NOS1
Ser/Thr, а также накоплению p53 в клетке, что
и NOS3, ускоряют прогрессирование опухоли
приводит к остановке клеточного цикла и ини-
путем модулирования ангиогенеза, апоптоза,
циации апоптоза [56, 57].
клеточного цикла, инвазии и метастазиро-
Роль NO в онкогенезе (при NO < 200 нМ)
вания [51].
определяется его участием в ряде механиз-
Аберрантная экспрессия гена NOS1 обна-
мов, связанных с инициацией и прогрессиро-
ружена в опухолях головного мозга, легких и
ванием опухолевого роста: путем активации
глиоме [46]. Установлено, что низкие уровни
повреждения и подавления репарации ДНК,
NO, образуемого NOS1, запускают пролифе-
активации онкогенов, подавления апоптоза,
рацию в первую очередь через механизм, свя-
активации генных мутаций при хронических и
занный с cGMP, образованный цитозольной
злокачественных состояниях (накопление му-
гуанилатциклазой [52]. Клеточные линии кар-
тантного р53) и появления посттрансляцион-
циномы яичника (OVCAR3, SKOV3, ES-2) ха-
ной модификации белков, изменяющих их
рактеризуются высоким уровнем экспрессии
функциональное состояние (S-нитрозилиро-
NOS1, что связано с усилением пролифера-
вание, нитрование Tyr) [54]. Кроме того, NO
ции, инвазии и химиорезистентности опухоле-
используется в сигналинге, связанном со зло-
вых клеток [46].
качественной трансформацией, включая Wnt-,
Недавние исследования показали, что NOS3
Ras-, ERK-, Akt-, циклин D1-, mTOR-зави-
может служить маркером отрицательного про-
симые пути и участвуя в процессах ангиоге-
гноза при злокачественных новообразованиях,
неза, эпителиально-мезенхимального перехода
БИОХИМИЯ том 88 вып. 7 2023
МОДИФИКАЦИИ ТИОЛОВ В ОПУХОЛЕВОЙ КЛЕТКЕ
1143
и метастазирования [58]. Кроме того, в низких
S-Глутатионилирование представляет со-
концентрациях NO подавляет запуск апоптоза,
бой обратимую посттрансляционную модифи-
вызывая гиперэкспрессию антиапоптотиче-
кацию SH-групп остатков Cys белков с по-
ских белков Bcl-2 и Bcl-xL и ингибирова-
следующим повышением как молекулярной
ние каспаз [59]. Напротив, продолжительная
массы, так и отрицательного заряда (за счет
гиперпродукция NO действует как проапо-
остатка Glu) благодаря связыванию с глута-
птотический модулятор, активируя каспазы
тионом (GSH), что приводит не только к за-
путем высвобождения митохондриального ци-
щите остатков Cys от окислительного повреж-
тохрома c в цитоплазму, вызывая повышение
дения, но и к редокс-зависимому изменению
экспрессии генов ТР53, р38 МАРК и снижение
конформации и функциональной активности
экспрессии генов белков семейства Bcl-2 [60].
белков [10].
Пул тиолов белка находится в динамическом
состоянии равновесия с пулом глутатиона и
S-ГЛУТАТИОНИЛИРОВАНИЕ.
может служить буфером для регенерации GSH.
РЕГУЛЯЦИЯ РЕДОКС-ГОМЕОСТАЗА
S-Глутатионилирование белков происходит как
В ОПУХОЛЕВЫХ КЛЕТКАХ
спонтанно, так и ферментативно [11].
Неферментативно реакции S-глутатиони-
Изменение редокстаза в опухолевых клет-
лирования могут протекать в ходе тиол-ди-
ках сопровождается редокс-зависимым изме-
сульфидного обмена при участии тиола бел-
нением посттрансляционной модификации
ка (Pr-SH) и окисленного глутатиона GSSG:
белков, в большой степени благодаря моди-
фикации наиболее чувствительных к уровню
Pr-SH + GSSG → Pr-SSG + GSH.
АФК/АФА остатков Cys. Хотя в процентном
отношении в белках количество остатков Cys
Константа равновесия реакции Kmix выра-
не превышает 3% [9], они являются одними
жается отношением [Pr-SSG] × [GSH]/[Pr-SH] ×
из наиболее чувствительных к окислительной
× [GSSG], следовательно, доля глутатионилиро-
модификации аминокислотных остатков и в
ванного белка ([Pr-SSG] : [Pr-SH]) сильно зави-
большой степени связаны с редокс-зависимой
сит от локального соотношения [GSH] : [GSSG]
регуляцией функциональной активности бел-
[62]. Глутатионилирование белка примерно на
ков, поскольку остатки Cys принимают участие
50% (Kmix ~ 1; [Pr-SSG] : [Pr-SH] = 1) может про-
в формировании третичной и четвертичной
изойти при очень сильном падении этого соот-
структуры и входят в состав активных центров.
ношения (с 100 : 1 до 1 : 1). Для образования
В этой связи высокозначимыми редокс-зави-
значительного количества Pr-SSG необходим
симыми посттрансляционными модифика-
значительный сдвиг соотношения GSH/GSSG
циями белков являются S-глутатионилирова-
в сторону GSSG. Такой резкий сдвиг мало-
ние и S-нитрозилирование остатков Cys.
вероятен при нормальных физиологических
Значение pKa SH-группы остатка Cys опре-
условиях, за исключением тяжелого окис-
деляется структурой его микроокружения и
лительного стресса, что означает, что этот
может значительно варьировать (от 3,5 до >12).
механизм не служит основным путем глута-
Обычно при физиологическом значении рН (7,0-
тионилирования [63]. Во многих типах опу-
7,4) pKa приблизительно составляет 8,5. Сни-
холевых клеток отмечается рост GSH/GSSG
жение pKa может быть вызвано стабилизацией
благодаря индукции синтеза GSH и восстанов-
тиолат-аниона (Pr-S-) электроноакцепторны-
ления GSSG в результате повышения уровня
ми группами или соседним положительным
образования NADPH(H+) вследствие актива-
зарядом, напротив, pKa тиолата повышается в
ции ПФП [64], что отмечается как адаптив-
присутствии отрицательно заряженных групп
ный ответ на окислительный стресс. Кроме
или внутри гидрофобных складок белка [10].
того, низкие значения констант скорости вто-
Так, в непосредственной близости от остат-
рого порядка для реакции различных тиолов
ков основных аминокислот (His, Lys и Arg)
с GSSG (4,9 × 102-1,2 × 104 М-1с-1) [65] делают
pKa SH-группы снижается (обычно до 5,0-
тиол-дисульфидный обмен маловероятным со-
7,0), и при физиологическом pH такие сульф-
бытием.
гидридные группы будут диссоциированы.
Образование глутатионилированного бел-
Образующиеся тиолят-анионы являются эф-
ка возможно также в результате его взаимодей-
фективными нуклеофилами, и их реакцион-
ствия с окисленной формой глутатиона в виде
ная способность по отношению к электро-
сульфеновой кислоты (GSOH):
фильным мишеням значительно увеличива-
ется [61].
Pr-SH + GSOH → Pr-SSG + H2O.
БИОХИМИЯ том 88 вып. 7 2023
1144
КАЛИНИНА, НОВИЧКОВА
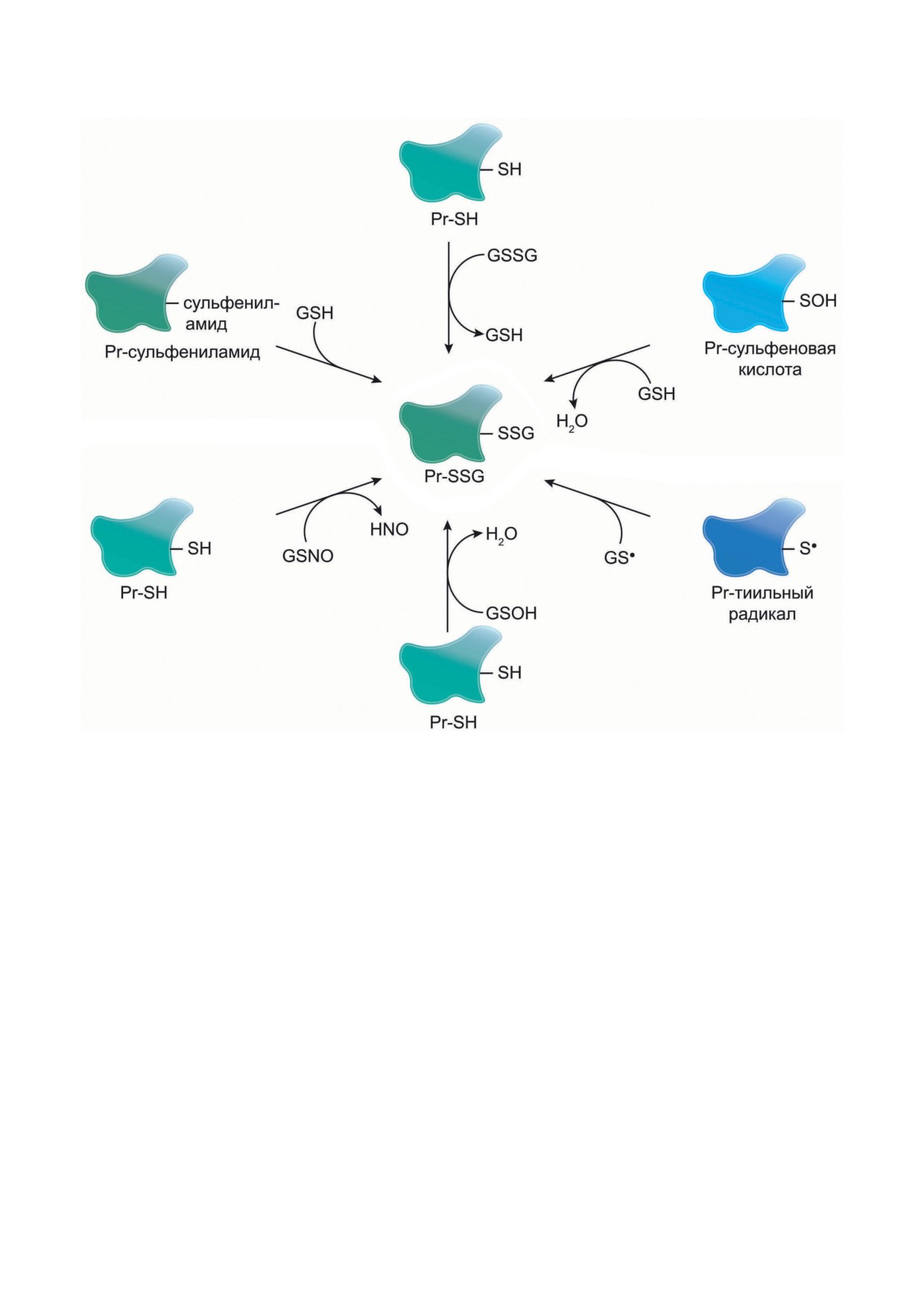
Рис. 2. Механизмы спонтанного S-глутатионилирования
Кроме того, возможен вариант тиол-ди-
сульфеновая кислота нестабильна и может
сульфидного обмена между Pr-SH и белком,
подвергаться дальнейшему окислению до суль-
который уже S-глутатионилирован (Pr′-SSG):
финовой (Pr-SO2H) и в итоге до сульфоно-
вой кислоты (Pr-SO3H), образование которой
Pr-SH + Pr′-SSG → Pr-SSG + Pr′-SH.
приводит, как правило, к необратимой дезак-
тивации белка. Таким образом, S-глутатиони-
S-Глутатионилирование может происходить
лирование сульфеновой кислоты может пред-
при взаимодействии Pr-SH или GSH с окис-
отвратить дальнейшее окисление белка по ос-
ленным производным остатка цистеина бел-
татку цистеина [66]. В физиологических усло-
ка, например, сульфеновой кислотой (-SOH),
виях внутриклеточный уровень H2O2 нахо-
тиильным радикалом (-S•), S-нитрозилом (-SNO),
дится в субмикромолярном диапазоне (10-9-
тиосульфинатом (-S(O)SR) или сульфенилами-
10-7 М) [67], поэтому спонтанное S-глутатио-
дом (циклический-S-N-CO-) (рис. 2).
нилирование in vivo по этому механизму будет
При окислительном действии АФК на Pr-SH
происходить довольно медленно. Однако в
(например, H2O2) образуется сульфеновая кис-
опухолевых клетках развитие окислительного
лота (Pr-SOH), которая затем быстро реагиру-
стресса сопровождается повышенной генера-
ет с GSH с образованием Pr-SSG:
цией H2O2. Следует также отметить, что обра-
зование сульфеновой группы в белках является
Pr-SOH + GSH → Pr-SSG + H2O.
редким событием благодаря высокой активно-
сти GPx1 и пероксиредоксина (Prx), имеющих
В микромолярных концентрациях H2O2
более высокие константы скорости второго
окисление SH-групп белка протекает быстро: порядка для реакции восстановления H2O2
БИОХИМИЯ том 88 вып. 7 2023
МОДИФИКАЦИИ ТИОЛОВ В ОПУХОЛЕВОЙ КЛЕТКЕ
1145
по сравнению с взаимодействием H2O2 с бел-
На примере тирозинфосфатазы 1В показа-
ковыми остатками Cys [68]. В то же время
но, что образование Pr-SSG, как промежуточ-
локальная инактивация пероксидаз, приводя-
ного интермедиата, может происходить при вос-
щая к высоким уровням H2O2, может способ-
становлении сульфенил-амида, циклической
ствовать сульфенилированию тиолов.
структуры, содержащей фрагмент -S-N-CO-
Одноэлектронное окисление белкового тио-
и формирующейся в условиях сильного окис-
ла или GSH, например, гидроксильным ради-
лительного стресса с участием остатка Cys215 в
калом (•OH), приводит к образованию белко-
активном центре фермента [72].
вого тиильного радикала (Pr-S•) или тиильного
Реакции неферментативного S-глутатиони-
радикала глутатиона (GS•), которые способны
лирования неспецифичны и интенсивно про-
образовывать глутатионилированный радикаль-
текают в условиях стресса. Однако скорость и
ный интермедиат (Pr-SSG•-) при взаимодей-
масштабы этого процесса значительно возра-
ствии с GSH или Pr-SH соответственно:
стают при участии ферментов, среди которых
лидирующее значение принадлежит изофор-
Pr-S• + GSH → Pr-SSG•- + H+,
ме глутатион S-трансферазы P1-1 (GSTP1-1),
Pr-SH + GS• → Pr-SSG•- + H+.
экспрессия гена которой имеет высокое про-
гностическое значение для широкого ряда
Далее, в результате взаимодействия Pr-SSG•-
злокачественных новообразований
[73,
74].
с молекулярным кислородом образуется су-
Кроме того, высокая экспрессия GSTP1 свя-
пероксид и Pr-SSG. Тиильные радикалы обра-
зана с развитием лекарственной устойчиво-
зуются в условиях окислительного или нитро-
сти опухолевых клеток, связанным с редокс-
зативного стресса и являются одними из самых
зависимым механизмом, подавлением путей
короткоживущих активированных тиолов [69]:
активации апоптоза и цитотоксичности про-
тивоопухолевых препаратов (доксорубицина,
Pr-S• + GS• → Pr-SSG.
цисплатина) [75].
Пероксиредоксины (Prx), семейство тиол-
Возможен крайне редкий вариант прямого
специфических пероксидазных ферментов, по-
образования Pr-SSG при взаимодействии од-
вышение экспрессии генов которых отме-
новременно двух радикалов Pr-S• и GS•:
чается в различных типах опухолей [76], яв-
ляются известными мишенями для GSTP1-
Pr-S• + GS• → Pr-SSG.
опосредованного обратимого глутатионилиро-
вания [77]. Каталитический цистеин в фер-
Действие NO может вызывать спонтанное
менте Prx подвержен окислению и при вос-
S-глутатионилирование. NO является слабым
становлении субстрата (Н2О2) утрачивает пер-
тиоловым окислителем, однако как S-глута-
оксидазную активность. GSTP1 способству-
тионилирование, так и S-нитрозилирование
ет глутатионилированию ранее окисленного
(см. ниже) можно стимулировать за счет вто-
остатка цистеина, тем самым восстанавливая
ричного образования АФА. Так, действие про-
активность Prx. Субстратами для глутатиони-
тивоопухолевого агента PABA/NO (O2-[2,4-
лирования являются два основных подклас-
динитро-5-(N-метил-N-4-карбоксифенилами-
са Prxs - 1-cys Prx (также известный как Prx6)
но)фенил]1-(N,N-диметиламино)диазен-1-иум-
и 2-cys Prx [77]. Каталитически активный оста-
1,2-диолата) на клетки аденокарциномы SKOV3
ток Cys47 скрыт в гидрофобном ядре Prx6,
и промиелоцитарного лейкоза HL60 вызывает
субстратами являются как Н2О2, так и гидро-
дозозависимое повышение внутриклеточного
пероксиды фосфолипидов. После восстанов-
уровня NO с последующим развитием нитро-
ления пероксида окисленный Сys47 полу-
зативного стресса, наряду с высоким уров-
чает доступ к GSH-нагруженному GSTP1 для
нем S-глутатионилирования белков, включая
реактивации Prx6 [78]. Активация Prx6 про-
β-лактатдегидрогеназу, ингибитор диссоциа-
исходит при формировании гетеродимера с
ции RhoGDP β, ATP-синтазу, фактор элон-
GSTP1-1, что способствует глутатионилиро-
гации 2, PDI, нуклеофосмин-1, шаперонин,
ванию Cys47 Prx6, вследствие чего происходят
актин, протеинтирозинфосфатазу 1B (protein
конформационные изменения гетеродимера,
tyrosine phosphatase 1B), глюкозидазу II [70].
обеспечивающие формирование дисульфид-
Следует отметить, что при взаимодействии с
ной связи между Cys47 GSTР1-1 и Cys47 Prx6,
тиолами нитрозоглутатион (GSNO) также мо-
за чем следует восстановление дисульфида
жет приводить к S-глутатионилированию [71]:
при участии GSH и регенерация Cys47 Prx6.
Убедительные данные свидетельствуют о том,
PrSH + GSNO → PrSSG + HNO.
что разные полиморфные формы GSTP1 могут
БИОХИМИЯ том 88 вып. 7 2023
1
146
КАЛИНИНА, НОВИЧКОВА
по-разному опосредовать активацию Prx6 и,
Однако недавние исследования показали, что
таким образом, влиять на его реакцию на уро-
не только ингибиторы, но и активаторы Nrf2
вень АФК. GSTP1-1A, наиболее распростра-
способны индуцировать апоптоз опухолевых
ненная полиморфная форма GSTP1, имеет
клеток [84, 85], что создает новое направление
более высокое сродство к Prx6 по сравнению
для противоопухолевой терапии. Несмотря на
с GSTP1-1B или -1D [79]. Более того, клетки
существование большого количества актива-
рака молочной железы, трансфицированные
торов Nrf2, немногие из них могут способство-
GSTP1A, показали значительно более высо-
вать апоптозу клеток. Таким образом, поиск
кую пероксидазную активность, чем клетки,
препаратов, активирующих Nrf2 и способству-
трансфицированные GSTP1B [79]. Различия в
ющих клеточному апоптозу, стал новой идеей
активности могут быть связаны с изменением
для лечения опухолей. Таким подходом может
относительного расстояния между окислен-
служить активация S-глутатионилирования.
ным Cys47 и активированным GSH, связан-
Так, на иммортализованных клетках карци-
ным с молекулой GSTP1 в различных поли-
номы шейки матки HeLa установлено, что ис-
морфных формах.
пользование
2-(7-(диэтиламино)-2-оксо-2H-
Интересно, что GSTP1-1 является редокс-
хромен-3-ил)циклогекса-2,5-диен-1,4-диона,
зависимым ферментом, ингибирование кото-
истощающего уровень GSH, приводит к уси-
рого вызывает глутатионилирование по ос-
лению S-глутатионилирования Keap-1 с по-
таткам Cys47 и Cys101, приводя к разрыву
следующей активацией ядерной транслока-
его связывания с JNK1 (c-Jun N-terminal ki-
ции Nrf2, что вызывает усиление транскрип-
nases 1) [73]. Прямое белок-белковое взаимо-
ции гена p53, снижает внутриклеточный уро-
действие GSTP1-1 с JNK1 ингибирует актив-
вень Bcl2 и, напротив, повышает содержание
ность киназы, ослабляя индуцированные JNK
Bax с последующей активацией апоптоза опу-
ответы на стресс и апоптоз. Следовательно,
холевых клеток [86].
окислительный стресс, вызывая инактивацию
Важную роль в пролиферации, инвазии,
GSTP1-1, активирует JNK.
онкогенезе и метастазировании опухоли иг-
Рост экспрессии GSTP1 в опухолевых клет-
рают изоформы протеинкиназы C (PKC) [87],
ках может способствовать онкогенезу посред-
гиперэкспрессия генов которых связана с
ством глутатионилирования и ингибирования
развитием опухолевого роста за счет синер-
такого онкосупрессора, как p53, который игра-
гетической активации нескольких путей кле-
ет ключевую роль в репарации ДНК, контроле
точного выживания и митоза, включая NF-κB-,
клеточного цикла, дифференцировке и подав-
Stat3 (signal transducer and activator of transcrip-
лении роста опухоли [80]. Так, высокий уро-
tion 3)-, PI3K/Akt-, ERK-зависимый сигна-
вень глутатионилированного р53 обнаружен в
линг [88, 89]. Обнаружено, что изоформы PKC
клетках аденокарциномы предстательной же-
(α, β, γ, ε, ζ) инактивируются в результате
лезы и меланомы [81], чему может способство-
окислительного S-глутатионилирования, что,
вать также действие окислительного стресса и
в частности, показано с использованием диа-
повреждение ДНК.
мида и GSH [90].
S-Глутатионилирование может способство-
Мишенями для S-глутатионилирования яв-
вать активации транскрипционного фактора
ляется чрезвычайно широкий ряд белков, уча-
Nrf2, контролирующего экспрессию генов фер-
ствующих практически во всех областях жизне-
ментов систем детоксикации и антиоксидант-
деятельности опухолевых клеток. В частности,
ной защиты [82, 83]. Следует отметить, что при
глутатионилирование ингибирует активность
чрезмерном окислительном стрессе накопив-
различных ферментов, участвующих в энер-
шийся в ядре избыточный Nrf2 может связы-
гетическом обмене, включая NADH-дегидро-
ваться с регуляторной областью промотора
геназу, цитохромоксидазу, ATP-азу, пируватде-
гена Klf9 и активировать его экспрессию, что
гидрогеназу, глицеральдегид-3-фосфатдегид-
приводит к подавлению экспрессии генов
рогеназу (GAPDH) [74]. Подавляя активность
антиоксидантных ферментов путем связыва-
пируваткиназы М2 и бифункционального
ния Klf9 с их репрессивными сайтами и вызы-
фермента, образующего фруктозо-2,6-бифос-
вает клеточное повреждение в результате роста
фат, S-глутатионилирование способствует уси-
уровня АФК [37]. В нормальных условиях Nrf2
лению ПФП и повышению образования
связан в цитоплазме с Keap-1 (Kelch-like ECH-
NADPH(H+), что способствует росту уров-
associated protein
1), который ограничивает
ня GSH за счет усиления активности глу-
активность Nrf2. Ингибирование Nrf2 явля-
татионредуктазы, восстанавливающей GSSG
ется нормальной стратегией эффективного
с использованием NADPH(H+) в качестве
лечения злокачественных новообразований.
кофермента [91, 92]. S-Глутатионилирование
БИОХИМИЯ том 88 вып. 7 2023
МОДИФИКАЦИИ ТИОЛОВ В ОПУХОЛЕВОЙ КЛЕТКЕ
1147
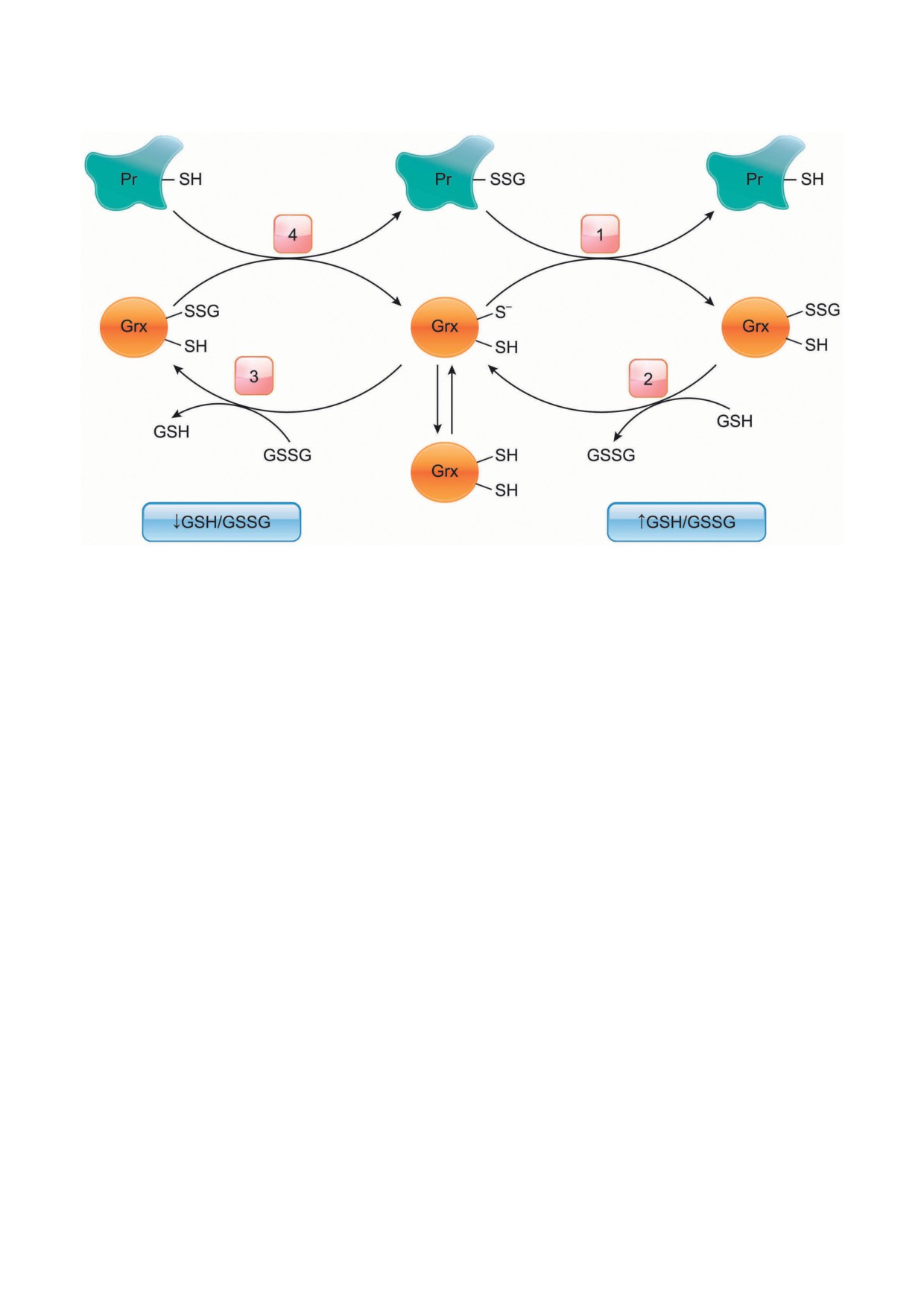
Рис. 3. Каталитический механизм глутаредоксина в зависимости от соотношения GSH/GSSH. При повышенном
уровне GSH/GSSG Grx катализирует деглутатионилирование белков: (1) глутатионилированный белок (Pr-SSG)
подвергается атаке тиолат-аниона фермента (Grx-S-) с образованием восстановленного белка (Pr-SH) и интермедиата
(Grx-SSG), который далее (2) восстанавливается с помощью GSH, образуя активный Grx-SH и GSSG. При сниже-
нии соотношения GSH/GSSG Grx катализирует S-глутатионилирование: S-глутатионилированный Grx (Grx-SSG),
образующийся в реакции с GSSG (3), реагирует с белком с образованием S-глутатионилированного белка (Pr-SSG) (4)
модулирует активность внутриклеточных сиг-
чины соотношения GSH/GSSG Grx может не
нальных путей, изменяя активность многих
только осуществлять деглутатионилирование,
белков, в частности, киназ Akt и MEKK1
но и, напротив, способствовать S-глутатиони-
(mitogen-activated protein kinase kinase 1), про-
лированию (рис. 3) [95]. При снижении GSH/
теинтирозинфосфатазу 1B, Ras-белков. S-Глу-
GSSG и повышении концентрации Н2О2 Grx2
татионилирование H-Ras по остатку Cys118
функционирует как глутатионилирующий фер-
модулирует его GTP-азную активность, вызы-
мент, например, в отношении дыхательного
вая активацию нижестоящих p38 и Akt [93].
комплекса I, тогда как при высоком уровне
Важный медиатор апоптоза каспаза-3, как
GSH/GSSG и низкой концентрации Н2О2
и ее предшественник прокаспаза-3, подверга-
Grx2 обладает деглутатионилирующей актив-
ются S-глутатионилированию. S-Глутатиони-
ностью. Такая зависимость процессов S-глу-
лирование прокаспазы-3 ингибирует ее спо-
татионилирования/деглутатионилирования,
собность подвергаться протеолитической ак-
катализируемых Grx, от клеточного редокс-
тивации. Глутатионилирование каспазы-3 по
статуса может быть возможной адаптацией,
остатку Cys135 белковой субъединицы p17,
гарантирующей, что события S-глутатиони-
присутствующему в активном центре, влияет
лирования не будут обращены вспять, пока
на доступ субстрата, снижая активность фер-
сохраняется окислительный стресс [96, 97].
мента [94].
Механизм S-глутатионилирования, ката-
Процесс S-глутатионилирования является
лизируемый Grx, протекает в несколько ста-
обратимой посттрансляционной модифика-
дий. Сначала идет нуклеофильная атака
цией, и, как правило, деглутатионилирование
тиолят-анионом Grx-S- дисульфидной связи
протекает ферментативно и более тщательно
GSSG, что приводит к образованию глутатио-
регулируется по сравнению с S-глутатионили-
нилированного интермедиата Grx-SSG, с ко-
рованием. Одним из наиболее эффективных
торого происходит перенос активированного
ферментов, восстанавливающих Pr-SSG, явля-
катионного радикала [GS•]+ на белок-мишень
ются изоформы глутаредоксина (Grx1 и Grx2).
с образованием Pr-SSG, при этом Grx опять
Следует отметить, что в зависимости от вели-
способен к катализу. Для данного процесса
БИОХИМИЯ том 88 вып. 7 2023
1
148
КАЛИНИНА, НОВИЧКОВА
отмечается также возможность обратимого
сия генов которых часто коррелирует с метаста-
образования Grx-S2 из Grx-SSG [96]. При де-
зированием и инвазивностью опухоли, химио-
глутатионилировании белок (Pr-SSG) подвер-
резистентностью и более низкой выживае-
гается атаке тиолат-аниона фермента (Grx-S-),
мостью онкологических больных
[102,
103].
образуя ковалентный интермедиат (Grx-SSG)
Однако пока не ясна значимость вклада PDI в
с высвобождением восстановленного белка
этот процесс, поскольку их основной функ-
(Pr-SH). На втором этапе, определяющем ско-
цией является обмен дисульфидными связями,
рость деглутатионилирования, происходит вос-
локализованными в структуре PDI и в белках-
становление Grx-SSG с помощью GSH с обра-
мишенях. Располагаясь в ЭПР, PDI катализи-
зованием GSSG.
рует окисление новых формирующихся белков
Сульфиредоксин (Srx) играет преимуще-
и участвует в изомеризации белков с неверно
ственную роль в деглутатионилировании не-
сформированными дисульфидными связями,
которых белков (Prx1, актин, PTP1B), возмож-
добиваясь построения их нативной структуры,
но, из-за его более высокого сродства к таким
кроме того, PDI может секретироваться клет-
белкам по сравнению с Grx. В отличие от Grx,
кой или ассоциироваться с поверхностью клетки
Srx, вероятно, не инактивируется окислитель-
для поддержания белков в восстановленном
ным стрессом, как это видно из его способ-
состоянии.
ности снижать уровень S-глутатионилирова-
ния при росте АФК [98]. Механизм деглута-
тионилирования, катализируемый Srx, имеет
S-НИТРОЗИЛИРОВАНИЕ.
сходство с механизмом, катализируемым Grx,
РЕГУЛЯЦИЯ РЕДОКС-ГОМЕОСТАЗА
и включает образование глутатионилиро-
В ОПУХОЛЕВЫХ КЛЕТКАХ
ванного по консервативному остатку Cys99
промежуточного интермедиата Srx-SSG [99].
Обратимой посттрансляционной модифи-
Деглутатионилирование, катализируемое Srx,
кацией тиоловых групп белков, наряду с S-глу-
по-видимому, имеет широкую субстратную
татионилированием, служит S-нитрозилирова-
специфичность. На клетках HEK293 с транс-
ние [4].
фекцией Srx продемонстрировано снижение
Как правило, для S-нитрозилирования
общего содержания S-глутатионилированных
тиольных групп цистеина необходимо одно-
белков, образующихся в условиях нитрозатив-
электронное окисление, которое происходит
ного стресса после обработки донором оксида
с участием О2 либо иона переходного металла,
азота PABA/NO [98].
например железа или меди [104]. Вариант воз-
На эпителиальных клетках рака молочной
можного прямого присоединения NO случа-
железы T47-D показано, что способностью
ется достаточно редко с участием тиильного
катализировать реакцию деглутатионилирова-
радикала:
ния обладает изоформа глутатионтрансферазы
GSTO1-1 [100, 101], которая имеет структурное
NO + Pr-S• → Pr-SNO.
сходство с Grx, включая Trx-подобную укладку
и сайт связывания GSH, где он может обра-
При взаимодействии NO с O2 образует-
зовывать дисульфидную связь с консерватив-
ся набор оксидов с более высокой степенью
ным остатком Cys32 активного центра. Другие
окисления азота (так называемое аутоокис-
изоформы GST, включая GSTA, GSTM, GSTP,
ление), среди которых N2O3 рассматривается
GSTT, GSTS и GSTZ, напротив, имеют ката-
как главный нитрозилирующий агент, спо-
литические остатки Tyr или Ser. GSTO1-1 ката-
собствующий появлению нитрозотиола бел-
лизирует деглутатионилирование в два этапа,
ка и нитрита. Скорость этой реакции суще-
подобно Grx: сначала Cys32 активного центра
ственно увеличивается в гидрофобных сре-
GSTO1-1 взаимодействует с Pr-SSG, в резуль-
дах, таких как мембраны, где локализована
тате образуются восстановленный Pr-SH и сме-
NOS3 [104]:
шанный дисульфид GSTO1-1-Cys32-SG, кото-
рый затем деглутатионилируется при участии
2NO + O2 → 2NO2,
GSH с образованием GSSG и функционально
NO2 + NO → N2O3,
активной GSTO1-1.
N2O3 + Pr-SH → Pr-SNO + H+ + NO−.
Способность к деглутатионированию бел-
ков обнаружена и у PDI, активация которых на-
Одним из возможных механизмов синтеза
блюдается при различных видах злокачествен-
GSNO является взаимодействие GSH c N2O3:
ных новообразований (рак почки, легких, пред-
стательной железы, меланома) и гиперэкспрес-
N2O3 + GSH → GSNO + H+ + NO−.
БИОХИМИЯ том 88 вып. 7 2023
МОДИФИКАЦИИ ТИОЛОВ В ОПУХОЛЕВОЙ КЛЕТКЕ
1149
Возможен вариант взаимодействия NO2 с
в 30-300 раз [108]. В окружении остатков-
тиолом с образованием тиильного радикала и
мишеней Cys (в пределах 8 Å) должно быть
дальнейшей его реакции с NO:
небольшое количество объемных, стерически
затрудненных остатков аминокислот (Phe, Tyr,
NO2 + Pr-SH → Pr-S• + H+ + NO−,
Arg, Leu), наличие которых препятствует взаи-
NO + Pr-S• → Pr-SNO.
модействию с NO [109].
Хотя S-нитрозилирование происходит толь-
Оба варианта ограничены по скорости на
ко с определенными остатками Cys, такая се-
этапе образования NO2, а также доступно-
лективность может частично устраняться с по-
стью NO.
мощью транс-нитрозилирования. При транс-
Описан вариант S-нитрозилирования, ка-
нитрозилировании низкомолекулярный нитро-
тализируемого ионами переходных металлов
зотиол (например, GSNO) или белок, нитро-
(Fe3+ или Cu2+), при этом происходит одноэлек-
зилированный по остатку Cys или содержащий
тронное окисление NO, а образующийся ни-
нитрозилированный ион металла (например,
трозоний (NO+) может нитрозилировать тиол,
в геме), взаимодействует с белком, подвер-
располагающийся в непосредственной близости:
гающимся S-нитрозилированию, и передает
нитрозо-группу (ON-) на остаток Cys этого
Me(n+1) + NO → Men-NO+,
белка:
Men-NO+ + Pr-SH → Pr-SNO + Men + H+.
PrS- + Pr′-SNO ↔ PrSNO + Pr′S-,
Такой механизм имеет место при аутонит-
PrS- + Me-SNO ↔ PrSNO + Me.
розилировании гемоглобина и при образова-
нии GSNO с участием церулоплазмина и цито-
Такой перенос способствует последова-
хрома с [104].
тельной удаленной передаче NO от места его
Следует отметить, что S-нитрозилирова-
синтеза, включая перенос NO между разными
ние может осуществляться только по опреде-
субклеточными структурами [110]. Транс-ни-
ленным остаткам Cys белков. Целевой остаток
трозилирование происходит при условии, что
Cys должен находиться: а) в непосредствен-
два белка непосредственно взаимодействуют
ной близости от источника образования NO,
и обладают соответствующими окислительно-
б) в белковом мотиве I/L-X-C-X2-D/E, кото-
восстановительными потенциалами, обеспе-
рый специфически распознается NOS, в) в вы-
чивающими перенос электрона с последую-
сокогидрофобной области, образованной тре-
щим переносом NO [110]. Предполагается, что
тичной белковой структурой или мембранами,
физическая ассоциация двух белков вызывает
г) в подходящем микроокружении с необхо-
конформационное изменение, позволяя реци-
димыми свойствами для образования тиолят-
пиентному тиолу образовывать тиолят-анион,
аниона [105].
который затем атакует нитрозильную группу
Согласно этим условиям первыми мише-
донора [110].
нями S-нитрозилирования являются изоформы
GSNO является наиболее распространен-
NOS, генерирующие NO [106]. Так, S-нитро-
ным S-нитрозотиолом и основным эндоген-
зилирование NOS3 ингибирует ее димериза-
ным донором NO, легко образующимся в мито-
цию и, таким образом, активацию фермента.
хондриях при переносе нитрозильной группы
Последнее предполагает, что S-нитрозилиро-
с железа гема цитохрома с на GSH и транс-
вание конститутивной NOS может служить ме-
нитрозилирующим широкий спектр белков,
ханизмом самовыключения [106]. Мотив I/L-
включая хорошо известные в клеточном сиг-
X-C-X2-D/E должен находиться внутри α-спи-
налинге NF-κB, STAT3, AKT, EGFR [111, 112].
рали, образуя большую площадь поверхности,
Опосредованное GSNO транс-нитрозилиро-
чтобы повысить доступность NO [107]. Кроме
вание субъединиц p65 и p50 NF-κB, а также
того, в рамках мотива S-нитрозилирования
киназы IκB ингибирует активацию NF-κB,
целевой тиол остатка Cys должен электро-
которая тесно связана с развитием злокаче-
статически взаимодействовать с соседними
ственных новообразований [113]. STAT3, спо-
заряженными остатками (<6 Å), что увеличи-
собствующий выживанию и пролиферации
вает его нуклеофильность, способствуя обра-
клеток, также подвергается транс-нитрозили-
зованию тиолат-аниона. S-Нитрозилирование
рованию с помощью GSNO, что приводит к
белков также предпочтительно идет по Cys-
подавлению фосфорилирования STAT3, не-
остаткам в гидрофобных областях, в которые
обходимого для его активации [114]. GSNO
легко могут проникать NO и молекулярный
может индуцировать апоптоз в клетках рака
кислород и где скорость их реакции возрастает
легкого посредством нитрозилирования Prx2
БИОХИМИЯ том 88 вып. 7 2023
1150
КАЛИНИНА, НОВИЧКОВА
по сайтам Cys51 и Cys172, вызывающего нару-
таких как Hsp60, ацетил-КоА-ацетилтранс-
шение образования димера и подавление его
фераза (acetyl-CoA acetyltransferase, ACAT1) и
антиоксидантной активности, что приводит к
потенциал-зависимый анионный канал 1 (volt-
накоплению эндогенной H2O2 с последующей
age dependent anion channel 1, VDAC1) [119].
активацией AMPK. Активированная AMPK
Повышение GAPDH-опосредованного транс-
фосфорилирует SIRT1 и тем самым ингиби-
нитрозилирования митохондриальных белков
рует его деацетилирующую активность по от-
регулирует проницаемость митохондриальной
ношению к p53 в клетках аденокарциномы
мембраны, функциональную активность ми-
легкого A549 и FOXO1 в клетках немелкокле-
тохондрий и гибель клеток [120]. В опухолевых
точного рака легких NCI-H1299 [115]. В до-
клетках нарушается GAPDH-опосредованное
клинических исследованиях отмечается про-
транс-нитрозилирование ядерных белков, что
тивоопухолевое действие GSNO, связанное с
приводит к нарушению стресс-зависимого
подавлением опухолевого роста и повышени-
апоптоза [118], одной из причин которого яв-
ем эффективности лучевой терапии [112]. Сле-
ляется подавление Siah1, которое облегчает
дует отметить, что сравнение противоопухо-
ядерную транслокацию GAPDH [114]. Экспрес-
левой активности GSNO и би- и моноядерных
сия Siah1 напрямую регулируется опухолевым
динитрозильных комплексов железа с различ-
супрессором p53, подавленным при многих
ными тиолсодержащими лигандами на модели
типах рака [121].
трансплантируемых солидных опухолей мы-
Функцию транс-нитрозилаз могут выпол-
шей позволило установить, что наибольшую
нять кальций- и цинк-связывающие белки
активность (ингибирование роста опухолевых
S100A8 и S100A9, участвующие в регуляции
клеток на 90%) оказывают динитрозильные
воспалительных процессов и иммунного отве-
комплексы железа с GSH, что связано с их
та и образующие гетеродимер кальпротектин
способностью выступать в качестве доноров
(S100A8/A9) [122], который при S-нитрозили-
нитрозония [116].
ровании превращается в противовоспалитель-
Значительную роль в транс-нитро-
ные агенты, ингибирующие активацию туч-
зилировании играет фермент GAPDH, ка-
ных клеток и взаимодействие лейкоцитов с
тализирующий превращение глицеральдегид-
эндотелием [123]. Кроме того, при индукции
3-фосфата в D-глицерат-1,3-бисфосфат. Как
NOS2 под действием воспалительных стиму-
транс-нитрозилаза, GAPDH участвует в регу-
лов S-нитрозилированный S100A8/A9 транс-
ляции транскрипции и механизма апопто-
нитрозилирует контактирующие с ним бел-
за [117,118]. GAPDH перемещается из цитозоля
ки, способствуя переносу нитрозильной груп-
в ядро при S-нитрозилировании по остатку
пы от NOS2 к отдаленным белкам-мише-
Cys150 в активном центре с помощью белка
нями [107]. В настоящее время в клетках и в
S100A8/A9, S-нитрозилированного, в свою оче-
микроциркуляторном русле идентифициро-
редь, в результате повышенной активности
вано более 100 белков, транс-нитрозилируе-
NOS2 в ответ на стресс [107, 118]. S-Нитро-
мых S100A8/A9 [107], среди которых GAPDH
зилирование GAPDH делает возможным ее
(см. выше), гемоглобин, белки цитоскелета
взаимодействие с убиквитинлигазой E3 Siah1,
(эзрин, моэзин), связывающие кортикаль-
образующийся комплекс GAPDH-Siah1 пере-
ный актин с плазматической мембраной, и
мещается в ядро, где Siah1 опосредует убик-
виментин, главный промежуточный фила-
витинирование и деградацию ядерных белков,
мент в мезенхимальных клетках и метаста-
что приводит к активации апоптоза. GAPDH
тических опухолевых клетках [107]. Предпо-
также может транс-нитрозилировать белки,
лагается, что S-нитрозилирование вызывает
участвующие в транскрипции и репарации
конформационные изменения, влияющие на
ДНК, включая деацетилазы - сиртуин-1 (sir-
стабильность белка и межбелковые взаимо-
tuin-1, SIRT1) и гистондеацетилазу 2 (histone
действия [124].
deacetylase 2, HDAC2), активность которых ин-
Уровень S-нитрозилированных белков в
гибируется S-нитрозилированием, а также бе-
клетке определяется клеточным редокс-стату-
лок репарации ДНК - ДНК-зависимую про-
сом и активностью денитрозилирования. Вы-
теинкиназу, которая, напротив, активируется
сокий статус антиоксидантной системы, по-
за счет S-нитрозилирования [118]. Кроме того,
вышающий восстановительный потенциал кле-
GAPDH участвует в активации p53-опосре-
ток, может предотвратить S-нитрозилиро-
дованного апоптоза в результате образования
вание, тогда как его снижение способствует
комплекса с p53 [117]. В ответ на стресс GAPDH
S-нитрозилированию [125]. Кроме того, уро-
также перемещается в митохондрии для транс-
вень S-нитрозилирования в клетках контроли-
нитрозилирования митохондриальных белков,
руется балансом между S-нитрозилированием
БИОХИМИЯ том 88 вып. 7 2023
МОДИФИКАЦИИ ТИОЛОВ В ОПУХОЛЕВОЙ КЛЕТКЕ
1151
и денитрозилированием. В отличие от S-нит-
ванной диэтилнитрозамином [127]. Для неко-
розилирования, которое обычно является не-
торых случаев рака молочной железы также
ферментативной реакцией (за исключением
характерно снижение экспрессии GSNOR.
прокариот), процесс денитрозилирования мо-
Так, для опухолей молочной железы с высо-
жет быть как неферментативным, так и фер-
ким уровнем экспрессии гена HER2 (human
ментативным [12]. Расщепление S-нитрозиль-
epidermal growth factor receptor 2, HER2), что
ной группы может происходить самопроиз-
часто наблюдается для агрессивных опухолей с
вольно в присутствии восстановителей (аскор-
неблагоприятным прогнозом, при фиксирова-
бат, GSH), ионов металлов (Cu2+), в результате
нии низкого уровня экспрессии GSNOR отме-
действия УФ-излучения, АФК или нуклеофи-
чено повышение пула S-нитрозилированных
лов [12] и/или катализироваться денитрозила-
белков, связанных с развитием апоптоза. При
зами, которые ферментативно удаляют нитро-
этом увеличение экспрессии GSNOR в таких
зильную группу из S-нитрозотиолов.
опухолях коррелирует с более высоким про-
Одной из основных денитрозилаз служит
центом выживаемости пациентов [128].
S-нитрозоглутатионредуктаза (GSNOR), раз-
На клетках гепатоцеллюлярной карцино-
лагающая GSNO в ходе необратимой NADH-
мы HepG2, карциномы почки 769P, эмбрио-
зависимой реакции в присутствии GSH до
нальной рабдомиосаркомы RD, аденокарци-
продуктов, характер которых определяется со-
номы молочной железы MCF7 показано, что
отношением GSH/GSSG. При высоких уров-
дефицит GSNOR приводит к усилению S-нит-
нях GSH образуются GSSG и гидроксиламин,
розилирования киназы FAK1 (focal adhesion
тогда как при низких уровнях GSH/GSSG -
kinase 1, FAK1) по Cys658, что усиливает ауто-
глутатионсульфиновая кислота и аммиак.
фосфорилирование FAK1 и поддерживает онко-
Таким образом, клеточный редокс-потенциал,
генность, обеспечивая опухолевым клеткам
зависящий от уровней NADH(H+) и GSH, яв-
способность к подвижности и росту
[130].
ляется важным фактором в контроле образо-
FAK1, известная также как протеинкиназа ти-
вания продуктов S-денитрозилирования [126].
розинкиназы 2 (PTK2), играет важную роль в
Внутриклеточные уровни S-нитрозилирован-
метастатической трансформации опухолевых
ных белков контролируются GSNOR, которая
клеток. Полученные данные позволяют рассма-
выводит из игры GSNO, как активнейшего
тривать GSNOR в качестве онкосупрессора.
участника реакций транс-нитрозилирования,
Значительный вклад в процессы денитро-
управляя тем самым пулом Pr-SNO в клетке.
зилирования вносит тиоредоксин (thioredoxin,
Сверхэкспрессия или дефекты гена GSNOR
Trx). Интерес к Trx объясняется еще тем, что
приводят к нарушению этого баланса и, как
это универсальный фермент, поскольку, по-
следствие, к нарушению NO-зависимого сиг-
мимо дисульфидредуктазной активности, что
налинга, тем самым способствуя возникнове-
определяет его как одного из ключевых игро-
нию ряда заболеваний, включая злокачествен-
ков в клеточном редокс-гомеостазе, он обла-
ные новообразования.
дает денитрозилазной и транс-нитрозилазной
Установлено, что гипоэкспрессия гена
активностью [131]. Когда фермент функциони-
GSNOR связана с возникновением и прогрес-
рует как дисульфидредуктаза и денитрозилаза,
сированием гепатоцеллюлярной карциномы и
задействованы остатки Cys32 и Cys35 в актив-
рака молочной железы [127, 128]. Так, экспрес-
ном центре, между которыми в процессе ката-
сия GSNOR снижена примерно в 50% случаев
лиза образуется дисульфидная связь, восста-
гепатоцеллюлярной карциномы, что связы-
навливаемая TrxR в присутствии NADPH(H+)
вают с хромосомной делецией GSNOR [127].
(рис. 4) [131, 132]. При этом процесс денитро-
Гепатоканцерогенез de novo после резекции
зилирования многостадийный и может проте-
опухоли и плохой прогноз у пациентов с ге-
кать по-разному, но в итоге будет происходить
патоцеллюлярной карциномой связаны как с
высвобождение нитроксила HNO или NO.
дефицитом экспрессии GSNOR, так и со сверх-
В качестве транс-нитрозилазы Trx1 функ-
экспрессией гена NOS2 [129]. Исследования на
ционирует, когда его Cys32 и Cys35 активного
линии мышей с делецией гена GSNOR позво-
центра связаны дисульфидной связью, что
лили установить, что дефицит GSNOR после
может происходить при высоких уровнях АФК
внутрибрюшинной инъекции диэтилнитроз-
и/или низкой активности TrxR. В окисленной
амина или липополисахарида приводит к
форме Trx1 может быть S-нитрозилирован по
S-нитрозилированию, убиквитинированию и
дополнительному Cys73 вне активного центра
протеасомной деградации ангиотензиногена,
и выступать уже в роли транс-нитрозилазы в
активность которого существенна при защите
отношении остатков Cys в молекулах-мише-
от гепатоцеллюлярной карциномы, индуциро-
нях. Интересно, что стабильность Trx-SNO,
БИОХИМИЯ том 88 вып. 7 2023
1152
КАЛИНИНА, НОВИЧКОВА
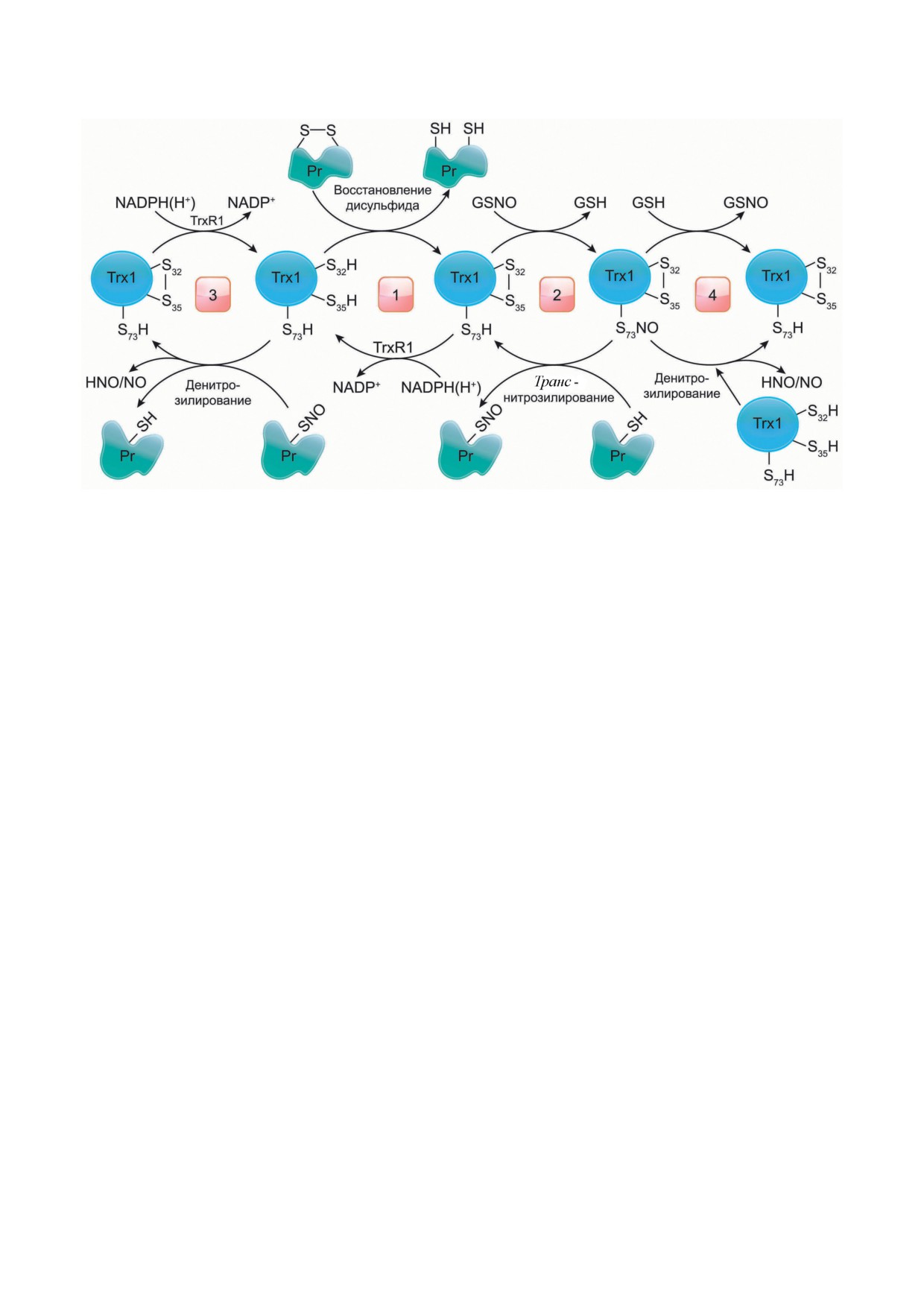
Рис. 4. Механизм транс-нитрозилирования и денитрозилирования при участии системы Trx1/TrxR1. 1 - Trx1-(SH)2,
восстанавливая дисульфидные связи в белках-мишенях, окисляется с образованием Trx1-S2, который восстанав-
ливается с помощью TrxR и NADPH(H+). 2 - При повышенном уровне АФК Trx1-S2 нитрозилируется по Cys73 вне
активного центра до SNO-Trx1-S2, который транс-нитрозилирует белки-мишени. 3 - Trx1-(SH)2 денитрозилирует
белки-мишени с образованием HNO или NO. 4 - Денитрозилирование SNO-Trx1-S2 может происходить в присут-
ствии Trx1-(SH)2 или GSH
в свою очередь, регулируется восстановителя-
пока остается неясным, может ли Trx1 катали-
ми. Например, восстановленный Trx1-(SH)2 и
зировать транс-нитрозилирование этих двух
GSH будут способствовать денитрозилирова-
инициаторных каспаз. Тем не менее экспери-
нию Trx-SNO в клетках, что влияет на баланс
ментальные данные свидетельствуют об уча-
между процессами нитрозилирования и денит-
стии редокс-зависимой системы Trx1/Trx1R в
розилирования с участием Trx [133, 134].
денитрозилировании SNO-каспазы-9 и вос-
Гиперэкспрессия гена TXN1(C32S/C35S)
становительной реактивации каспазы-8 [140,
(мутантного Trx1 с заменой Cys32 и Cys35
141]. Несомненно, что регуляция активности
серином для имитации Trx1, неактивного в
каспаз при участии Trx1 играет важную роль в
качестве дисульфидредуктазы), как показано
апоптотических сигнальных путях.
на клетках HeLa, способствует нитрозили-
Помимо каспаз, в NO-зависимой регуля-
рованию специфических белков-мишеней.
ции механизма апоптоза в опухолевых клетках
С помощью протеомного анализа было иден-
могут участвовать и другие мишени. Одним из
тифицировано 47 новых кандидатов в белки-
важнейших звеньев, вовлеченных в онкогенез,
мишени для транс-нитрозилирования Trx1 в
является изменение в клеточных сигнальных
этих клетках [133]. Наиболее хорошо охарак-
путях, в первую очередь тех, которые отвечают
теризованной мишенью оказалась эффектор-
за активацию апоптоза. Цитокины из суперсе-
ная каспаза-3. Эта модификация приводит к
мейства TNF, такие как FasL, TRAIL и TNFα,
инактивации или активации каспазы-3 в зави-
могут секретироваться различными клетками
симости от редокс-состояния Trx1 [133, 135].
в микроокружении опухоли и вызывать либо
Trx1-(SH)2 катализирует денитрозилирование
проопухолевые, либо противоопухолевые эф-
нитрозилированной по Cys163 каспазы-3, в
фекты, поскольку реализация запускаемой
то время как Trx1-SNO препятствует апоптозу
ими программы зависит от множества факто-
посредством транс-нитрозилирования того же
ров, в том числе от различных посттрансля-
цистеина каспазы-3, тем самым вызывая онко-
ционных модификаций участников передачи
генную трансформацию [134, 136-138].
сигнала, что в полной мере касается и процес-
In vitro и in vivo установлено, что инициа-
сов S-нитрозилирования и денитрозилиро-
торные каспазы-8 и -9 сигнального каскада,
вания [142, 143]. В частности, рецептор DR4,
ведущего к апоптозу, также имеют каталити-
лигандом которого выступает TRAIL, рас-
ческие остатки Cys, которые являются мише-
сматривается как опухолевый белок-супрес-
нями для S-нитрозилирования
[139]. Хотя сор, функциональная активность которого
БИОХИМИЯ том 88 вып. 7 2023
МОДИФИКАЦИИ ТИОЛОВ В ОПУХОЛЕВОЙ КЛЕТКЕ
1153
связана с запуском внешнего пути активации
Кроме того, GSNO способствует снижению
апоптоза. Донор NO нитрозилкобаламин (ана-
базальной и цитокин-стимулированной акти-
лог витамина В12) обладает высокой антипро-
вации NF-κB. Снижение активности STAT3
лиферативной активностью в клетках мела-
и NF-κB коррелировало с остановкой кле-
номы, карциномы почки и яичника, вызывая
точного цикла в S- и G2-фазах, снижением
S-нитрозилирование DR4 по остатку Cys336 в
пролиферации и активацией апоптоза. При
цитоплазматическом домене, что способству-
этом наблюдалось снижение экспрессии ге-
ет его активации. Тогда как точечная мутация
нов регуляторов клеточного цикла, таких как
C336A в DR4 приводит к потере способности
c-Myc, и антиапоптотических белков Bcl-xL
нитрозилкобаламина активировать апоптоз в
и cIAP (cellular inhibitor of apoptosis protein 1).
клетках-мишенях [144].
В модельных экспериментах in vivo на мышах
Рецептор Fas, как установлено на клетках
с ксенографтами HNSCC системное введение
колоректального рака при использовании в
GSNO вызывало снижение опухолевого роста,
качестве донора NO нитроглицерина, может
дополнительное подавление которого наблю-
S-нитрозилироваться по двум остаткам Cys199
далось при его комбинации с цисплатином и
и Cys304 [145]. Однако только S-нитрозилиро-
использованием лучевой терапии. Предпо-
вание по Cys304 приводит к активации проапоп-
лагается, что использование GSNO для бло-
тотической активности, так как такая модифи-
кирования NF-κB и STAT3, контролирующих
кация приводила к включению Fas в липидные
выживание и пролиферацию клеток, дает по-
рафты, повышению чувствительности клеток
тенциальную возможность для усиления тера-
к действию FasL и запуску апоптоза [145].
певтического эффекта традиционных методов
Кроме того, S-нитрозилирование транскрип-
лечения [114].
ционного фактора YY1 (Ying Yang 1, YY1), для
S-Нитрозилирование модулирует актив-
которого показано репрессирующее действие в
ность киназ, вовлеченных в клеточный сигна-
отношении рецептора Fas, приводит к инакти-
линг. Так, активация ERK1/2-зависимых кас-
вации YY1, что повышает экспрессию гена FAS
кадов, отвечающих за пролиферацию и выжи-
и сенсибилизацию опухолевых клеток в отно-
вание опухолевых клеток, происходит через
шении агонистов Fas [146].
фосфорилирование по остаткам Thr202 и
Изменения в передаче сигнала за счет про-
Tyr204 киназ ERK1 и ERK2 (extracellular signal-
цессов S-нитрозилирования происходят не
regulated kinases 1 and 2), обладающих 85%-ной
только за счет изменения функционирования
гомологией. На клетках глиомы U251 показа-
и активности рецепторов, но и также тран-
но [149], что использование GSNO в качестве
скрипционных факторов и киназ, вовлеченных
донора NO вызывает S-нитрозилирование ERK1
в сигнальные пути, влияющие на жизнеспо-
по Cys183, находящемуся вблизи остатков
собность клетки. В частности, S-нитрозили-
Thr202 и Tyr204, приводит к снижению фос-
рование/денитрозилирование позволяет регу-
форилирования ERK1/2 и клеточного роста.
лировать активность STAT3 и NF-κB, которые
Замена остатка Cys183 на Ala предотвращает
являются одними из ключевых транскрипци-
S-нитрозилирование ERK1, восстанавливает
онных факторов, участвующих в развитии опу-
фосфорилирование ERK1/2 и подавляет GSNO-
холевой прогрессии, химиорезистентности и
индуцированный апоптоз. Повышение фос-
метастазировании [147, 148]. Так, STAT3 регу-
форилирования ERK1/2, наряду со снижением
лирует экспрессию генов белков, отвечающих
S-нитрозилирования ERK1/2, также обнару-
за выживание клеток (Bcl-xL, cIAP, сурвивин
жено в тканях глиомы человека. С учетом свя-
и Mcl-1), генов белков клеточного цикла (на-
зи между процессами S-нитрозилирования и
пример, c-Myc, CDK2, циклин E, CDK1 и ци-
фосфорилирования ERK1/2 in vitro и in vivo,
клин B) и белков, отвечающих за опухолевый
предполагается редокс-зависимое участие этих
ангиогенез (например, VEGF). NF-κB при-
процессов в развитии лекарственной устойчи-
нимает участие в регуляции экспрессии генов
вости глиом [149].
белков клеточной выживаемости (cIAP, Bcl-2,
Таким образом, действие АФК/АФА на опу-
Bcl-xL и XIAP), клеточного цикла (c-Myc и
холевые клетки носит двойственный характер.
циклин D) и мультилекарственной устойчиво-
С одной стороны, АФК/АФА могут способ-
сти (например, MDR1) [114]. На линиях кле-
ствовать инициации злокачественной транс-
ток сквамозно-клеточной карциномы головы
формации за счет активации определенных
и шеи HNSCC показано, что активация STAT3
путей клеточного сигналинга, направленных
за счет фосфорилирования обратимо подав-
на усиление пролиферации, выживания и
ляется в результате его S-нитрозилирования
устойчивости к стрессу. Напротив, высокие
по остатку Cys259 при действии GSNO [114].
уровни АФК/АФА могут смягчить прогрессию
8
БИОХИМИЯ том 88 вып. 7 2023
1
154
КАЛИНИНА, НОВИЧКОВА
опухолеобразования в результате развития
точного гомеостаза, в частности через реакции
окислительного/нитрозативного стресса, вы-
S-глутатионилирования/S-нитрозилирования,
зывающего гибель клеток и ограничение опу-
позволят улучшить схемы противоопухолевой
холевого роста на определенных фазах разви-
терапии с учетом регуляции ключевых фер-
тия злокачественных новообразований. Низкие
ментов, контролирующих эти процессы и их
концентрации АФК/АФА, поддерживаемые
баланс.
активностью эндогенной антиоксидантной си-
стемы, позволяют осуществлять окислитель-
Вклад авторов. Е.В. Калинина - концепция,
ные/нитрозативные модификации ключевых
написание всех разделов, руководство работой;
редокс-зависимых остатков в регуляторных
М.Д. Новичкова - написание третьего и четвер-
белках. Обратимость таких модификаций, как
того разделов, редактирование текста статьи.
S-глутатионилирование/S-нитрозилирование,
Финансирование. Публикация выполнена
которые происходят посредством электро-
при поддержке Программы стратегического
фильной атаки АФК/АФА на нуклеофильные
академического лидерства РУДН.
остатки Cys, обеспечивает редокс-переключе-
Конфликт интересов. Авторы заявляют об
ния активности сигнальных белков и возмож-
отсутствии конфликта интересов.
ность управления процессами пролиферации
Соблюдение этических норм. Настоящая
и программированной гибели опухолевых кле-
статья не содержит описания каких-либо ис-
ток. Дальнейшее развитие представлений о
следований с участием людей или животных в
системах редокс-зависимого управления кле-
качестве объектов.
СПИСОК ЛИТЕРАТУРЫ
1.
Sies, H., Belousov, V. V., Chandel, N. S., Davies,
9. Kukulage, D. S. K., Matarage Don, N. N. J., and
M. J., Jones, D. P., Mann, G. E., Murphy, M. P.,
Ahn, Y. H. (2022) Emerging chemistry and biology in
Yamamoto, M., and Winterbourn, C. (2022) Defining
protein glutathionylation, Curr. Opin. Chem. Biol., 71,
roles of specific reactive oxygen species (ROS) in cell
102221, doi: 10.1016/j.cbpa.2022.102221.
biology and physiology, Nat. Rev. Mol. Cell Biol., 23,
10. Zhang, J., Ye, Z. W., Singh, S., Townsend, D. M.,
499-515, doi: 10.1038/s41580-022-00456-z.
and Tew, K. D. (2018) An evolving understanding of
2.
Ghoneum, A., Abdulfattah, A. Y., Warren, B. O.,
the S-glutathionylation cycle in pathways of redox
Shu, J., and Said, N. (2020) Redox homeostasis and
regulation, Free Radic. Biol. Med., 120, 204-216,
metabolism in cancer: a complex mechanism and
doi: 10.1016/j.freeradbiomed.2018.03.038.
potential targeted therapeutics, Int. J. Mol. Sci., 21,
11. Mieyal, J. J., Gallogly, M. M., Qanungo, S.,
3100, doi: 10.3390/ijms21093100.
Sabens, E. A., and Shelton, M. D. (2008) Molecular
3.
Hayes, J. D., Dinkova-Kostova, A. T., and Tew, K.
mechanisms and clinical implications of reversible
D. (2020) Oxidative stress in cancer, Cancer Cell, 38,
protein S-glutathionylation, Antioxid. Redox Signal.,
167-197, doi: 10.1016/j.ccell.2020.06.001.
10, 1941-1988, doi: 10.1089/ars.2008.2089.
4.
Mishra, D., Patel, V., and Banerjee, D. (2020) Ni-
12. Stomberski, C. T., Hess, D. T., and Stamler, J. S.
tric oxide and S-nitrosylation in cancers: empha-
(2019) Protein S-nitrosylation: determinants of speci-
sis on breast cancer, Breast Cancer (Auckl),
14,
ficity and enzymatic regulation of s-nitrosothiol-based
1178223419882688, doi: 10.1177/1178223419882688.
signaling, Antioxid. Redox Signal.,
30,
1331-1351,
5.
Gorrini, C., Harris, I. S., and Mak, T. W. (2013) Mod-
doi: 10.1089/ars.2017.7403.
ulation of oxidative stress as an anticancer strategy, Nat.
13. Klaunig, J. E. (2018) Oxidative stress and cancer,
Rev. Drug Discov., 12, 931-947, doi: 10.1038/nrd4002.
Curr. Pharm. Des.,
24,
4771-4778, doi:
10.2174/
6.
Moloney, J. N., and Cotter, T. G. (2018) ROS
1381612825666190215121712.
signalling in the biology of cancer, Semin. Cell Dev.
14. Raimondi, V., Ciccarese, F., and Ciminale, V. (2020)
Biol., 80, 50-64, doi: 10.1016/j.semcdb.2017.05.023.
Oncogenic pathways and the electron transport chain:
7.
Brieger, K., Schiavone, S., Miller, F. J., and Krause,
a dangeROS liaison, Br. J. Cancer, 122, 168-181,
K.-H. (2012) Reactive oxygen species: from health to
doi: 10.1038/s41416-019-0651-y.
disease, Swiss Med. Wkly., 142, w13659, doi: 10.4414/
15. Tan, A. S., Baty, J. W., and Berridge, M. V. (2014)
smw.2012.13659.
The role of mitochondrial electron transport in
8.
Pan, S., and Chen, R. (2022) Pathological implica-
tumorigenesis and metastasis, Biochim. Biophys. Acta,
tion of protein post-translational modifications in
1840, 1454-1463, doi: 10.1016/j.bbagen.2013.10.016.
cancer, Mol. Aspects Med., 86, 101097, doi: 10.1016/
16. Ishikawa, K., Takenaga, K., Akimoto, M.,
j.mam.2022.101097.
Koshikawa, N., Yamaguchi, A., Imanishi, H.,
БИОХИМИЯ том 88 вып. 7 2023
МОДИФИКАЦИИ ТИОЛОВ В ОПУХОЛЕВОЙ КЛЕТКЕ
1155
Nakada, K., Honma, Y., and Hayashi, J.
(2008)
cellular context, determining cancer cell susceptibility
ROS-generating mitochondrial DNA mutations can
to cisplatin, Oncotarget, 6, 39235-39246, doi: 10.18632/
regulate tumor cell metastasis, Science, 320, 661-664,
oncotarget.5743.
doi: 10.1126/science.1156906.
28.
Speed, N., and Blair, I. A. (2011) Cyclooxygenase-
17.
Hoekstra, A. S., and Bayley, J. P. (2013) The role of
and lipoxygenase-mediated DNA damage, Cancer
complex II in disease, Biochim. Biophys. Acta, 1827,
Metastasis Rev., 30, 437-447, doi: 10.1007/s10555-
543-551, doi: 10.1016/j.bbabio.2012.11.005.
011-9298-8.
18.
Cecchini, G. (2013) Respiratory complex II: role in
29.
Krishnamoorthy, S., Jin, R., Cai, Y., Maddipati, K. R.,
cellular physiology and disease, Biochim. Biophys. Acta,
Nie, D., Pagès, G., Tucker, S. C., and Honn, K. V.
1827, 541-542, doi: 10.1016/j.bbabio.2013.02.010.
(2010) 12-Lipoxygenase and the regulation of hypoxia-
19.
Liou, G. Y., Doppler, H., DelGiorno, K. E.,
inducible factor in prostate cancer cells, Exp. Cell Res.,
Zhang, L., Leitges, M., Crawford, H. C., Murphy,
316, 1706-1715, doi: 10.1016/j.yexcr.2010.03.005.
M. P., and Storz, P. (2016) Mutant KRas-Induced
30.
Sarveswaran, S., Chakraborty, D., Chitale, D., Sears, R.,
mitochondrial oxidative stress in acinar cells upreg-
and Ghosh, J. (2015) Inhibition of 5-lipoxygenase
ulates EGFR signaling to drive formation of pancre-
selectively triggers disruption of c-Myc signaling in
atic precancerous lesions, Cell Rep., 14, 2325-2336,
prostate cancer cells, J. Biol. Chem., 290, 4994-5006,
doi: 10.1016/j.celrep.2016.02.029.
doi: 10.1074/jbc.M114.599035.
20.
Chong, S. J. F., Lai, J. X. H., Eu, J. Q., Bellot,
31.
Johnson, B. D., Geldenhuys, W. J., and Hazlehurst,
G. L., and Pervaiz, S. (2018) Reactive oxygen species
L. A. (2020) The role of ERO1α in modulating can-
and oncoprotein signaling-A dangerous liaison,
cer progression and immune escape, J. Cancer Im-
Antioxid. Redox Signal., 29, 1553-1588, doi: 10.1089/
munol. (Wilmington),
2,
103-115, doi:
10.33696/
ars.2017.7441.
cancerimmunol.2.023.
21.
Vafa, O., Wade, M., Kern, S., Beeche, M., Pandita,
32.
Arfin, S., Jha, N. K., Jha, S. K., Kesari, K. K.,
T. K., Hampton, G. M., and Wahl, G. M. (2002)
Ruokolainen, J., Roychoudhury, S., Rathi, B., and
c-Myc can induce DNA damage, increase reactive ox-
Kumar, D. (2021) Oxidative stress in cancer cell me-
ygen species, and mitigate p53 function: a mechanism
tabolism, Antioxidants (Basel), 10, 642, doi: 10.3390/
for oncogene-induced genetic instability, Mol. Cell, 9,
antiox10050642.
1031-1044, doi: 10.1016/s1097-2765(02)00520-8.
33.
El Sayed, S. M., Mahmoud, A. A., El Sawy, S. A.,
22.
Li, F., Wang, Y., Zeller, K. I., Potter, J. J., Wonsey,
Abdelaal, E. A., Fouad, A. M., Yousif, R. S., Hashim,
D. R., O’Donnell, K. A., Kim, J. W., Yustein, J. T.,
M. S., Hemdan, S. B., Kadry, Z. M., Abdelmoaty,
Lee, L. A., and Dang, C. V. (2005) Myc stimulates
M. A., Gabr, A. G., Omran, F. M., Nabo, M. M., and
nuclearly encoded mitochondrial genes and mito-
Ahmed, N. S. (2013) Warburg effect increases steady-
chondrial biogenesis, Mol. Cell. Biol., 25, 6225-6234,
state ROS condition in cancer cells through decreas-
doi: 10.1128/MCB.25.14.6225-6234.2005.
ing their antioxidant capacities (anticancer effects
23.
Vermot, A., Petit-Härtlein, I., Smith, S. M. E., and
of 3-bromopyruvate through antagonizing Warburg
Fieschi, F.
(2021) NADPH oxidases (NOX): an
effect), Med. Hypotheses, 81, 866-870, doi: 10.1016/
overview from discovery, molecular mechanisms to
j.mehy.2013.08.024.
physiology and pathology, Antioxidants (Basel), 10,
34.
Patra, K. C., and Hay, N.
(2014) The pentose
890, doi: 10.3390/antiox10060890.
phosphate pathway and cancer, Trends Biochem. Sci.,
24.
Konaté, M. M., Antony, S., and Doroshow, J. H.
39, 347-354, doi: 10.1016/j.tibs.2014.06.005.
(2020) Inhibiting the activity of NADPH oxidase
35.
Luo, W., Hu, H., Chang, R., Zhong, J., Knabel, M.,
in cancer, Antioxid. Redox Signal.,
33,
435-454,
O’Meally, R., Cole, R. N., Pandey, A., and Semenza,
doi: 10.1089/ars.2020.8046.
G. L. (2011) Pyruvate kinase M2 is a PHD3-stimulated
25.
Kumar, B., Koul, S., Khandrika, L., Meacham,
coactivator for hypoxia-inducible factor 1, Cell, 145,
R. B., and Koul, H. K. (2008) Oxidative stress in
732-744, doi: 10.1016/j.cell.2011.03.054.
inherent in prostate cancer cells and is required for
36.
He, C., Danes, J. M., Hart, P. C., Zhu, Y., Huang, Y.,
aggressive phenotype, Cancer Res., 68, 1777-1785,
de Abreu, A. L., O’Brien, J., Mathison, A. J.,
doi: 10.1158/0008-5472.CAN-07-5259.
Tang, B., Frasor, J. M., Wakefield, L. M., Ganini, D.,
26.
Mukawera, E., Chartier, S., Williams, V., Pagano,
Stauder, E., Zielonka, J., Gantner, B. N., Urrutia, R.
P. J., Lapointe, R., and Grandvaux, N.
(2015)
A., Gius, D., and Bonini, M. G. (2019) SOD2 acetyl-
Redox-modulating agents target NOX2-dependent
ation on lysine 68 promotes stem cell reprogramming
IKKepsilon oncogenic kinase expression and
in breast cancer, Proc. Natl. Acad. Sci. USA, 116,
proliferation in human breast cancer cell lines, Redox
23534-23541, doi: 10.1073/pnas.1902308116.
Biol., 6, 9-18, doi: 10.1016/j.redox.2015.06.010.
37.
Zucker, S. N., Fink, E. E., Bagati, A., Mannava, S.,
27.
Dho, S. H., Kim, J. Y., Kwon, E. S., Lim, J. C., Park,
Bianchi-Smiraglia, A., Bogner, P. N., Wawrzyniak,
S. S., and Kwon, K. S. (2015) NOX5-L can stimulate
J. A., Foley, C., Leonova, K. I., Grimm, M. J.,
proliferation and apoptosis depending on its levels and
Moparthy, K., Ionov, Y., Wang, J., Liu, S., Sexton, S.,
БИОХИМИЯ том 88 вып. 7 2023
8*
1
156
КАЛИНИНА, НОВИЧКОВА
Kandel, E. S., Bakin, A. V., Zhang, Y., Kaminski, N.,
Hofseth, L. J., and Wyatt, M. D. (2009) Differential
Segal, B. H., and Nikiforov, M. A. (2014) Nrf2
effects of reactive nitrogen species on DNA base ex-
amplifies oxidative stress via induction of Klf9, Mol.
cision repair initiated by the alkyladenine DNA gly-
Cell, 53, 916-928, doi: 10.1016/j.molcel.2014.01.033.
cosylase, Carcinogenesis, 30, 2123-2129, doi: 10.1093/
38.
Hosseini, N., Kourosh-Arami, M., Nadjafi, S., and
carcin/bgp256.
Ashtari, B. (2022) Structure, distribution, regula-
48.
Deryagina, V. P., Rizhova, N. I., Savluchinskaya, L. A.,
tion, and function of splice variant isoforms of ni-
and Kirsanov, K. I. (2021) Role of nitric oxide and
tric oxide synthase family in the nervous system,
endothelial NO synthase in carcinogenesis, Adv. Mol.
Curr. Protein Pept. Sci., 23, 510-534, doi: 10.2174/
Oncol., 8, 29-39, doi: 10.17650/2313-805X-2021-8-2-
1389203723666220823151326.
29-39.
39.
Förstermann, U., and Sessa, W. C. (2012) Nitric oxide
49.
Bastian, N. R., Yim, C. Y., Hibbs, J. B., and Samlowski,
synthases: regulation and function, Eur. Heart J., 33,
W. E. (1994) Induction of iron-derived EPR signals in
829-837, doi: 10.1093/eurheartj/ehr304.
murine cancers by nitric oxide. Evidence for multiple
40.
Sakamuri, S. S. V. P., Sperling, J. A., Evans, W. R.,
intracellular targets, J. Biol. Chem., 269, 5127-5131,
Dholakia, M. H., Albuck, A. L., Sure, V. N., Satou, R.,
doi: 10.1016/S0021-9258(17)37664-0.
Mostany, R., and Katakam, P. V. G. (2020) Nitric
50.
Vannini, F., Kashfi, K., and Nath, N. (2015) The dual
oxide synthase inhibitors negatively regulate respiration
role of iNOS in cancer, Redox Biol., 6, 334-343,
in isolated rodent cardiac and brain mitochondria,
doi: 10.1016/j.redox.2015.08.009.
Am. J. Physiol. Heart Circ. Physiol., 318, H295-H300,
51.
Wu, X., Wang, Z. F., Xu, Y., Ren, R., Heng., B. L.,
doi: 10.1152/ajpheart.00720.2019.
and Su, Z. X. (2014) Association between three eNOS
41.
Wink, D. A., Hanbauer, I., Grisham, M. B., Laval, F.,
polymorphisms and cancer risk: a meta-analysis, Asian
Nims, R. W., Laval, J., Cook, J., Pacelli, R., Lieb-
Pac. J. Cancer Prev., 15, 5317-5324, doi: 10.7314/
mann, J., Krishna, M., Ford, P. C., and Mitchell, J. B.
apjcp.2014.15.13.5317.
(1996) Chemical biology of nitric oxide: regulation and
52.
Kotake, M., Sato, K., Mogi, C., Tobo, M., Aoki, H.,
protective and toxic mechanisms, Curr. Top. Cell. Reg-
Ishizuka, T., Sunaga, N., Imai, H., Kaira, K.,
ul., 34, 159-187, doi: 10.1016/s0070-2137(96)80006-9.
Hisada, T., Yamada, M., and Okajima, F. (2014)
42.
Thomas, D. D., Ridnour, L. A., Isenberg, J. S., Flores-
Acidic pH increases cGMP accumulation through
Santana, W., Switzer, C. H., Donzelli, S., Hussain, P.,
the OGR1/phospholipase C/Ca2+/neuronal NOS
Vecoli, C., Paolocci, N., Ambs, S., Colton, C. A.,
pathway in N1E-115 neuronal cells, Cell. Signal., 26,
Harris, C. C., Roberts, D. D., and Wink, D. A. (2008)
2326-2332, doi: 10.1016/j.cellsig.2014.07.010.
The chemical biology of nitric oxide: Implications in
53.
Penarando, J., Lopez-Sanchez, L. M., Mena, R., Guil-
cellular signaling, Free Radic. Biol. Med., 45, 18-31,
Luna, S., Conde, F., Hernández, V., Toledano, M.,
doi: 10.1016/j.freeradbiomed.2008.03.020.
Gudiño, V., Raponi, M., Billard, C., Villar, C., Díaz, C.,
43.
Wink, D. A., Cook, J. A., Kim, S., Vodovotz, Y.,
Gómez-Barbadillo, J., De la Haba-Rodríguez, J.,
Pacelli, R., Krishna, M. C., Russo, A., Mitchell, J. B.,
Myant, K., Aranda, E., and Rodríguez-Ariza, A.
Jourd’heuil, D., Miles, A. M., and Grisham, M. B.
(2018) A role for endothelial nitric oxide synthase in
(1997) Superoxide modulates the oxidation and nitro-
intestinal stem cell proliferation and mesenchymal
sation of thiols by nitric oxide derived reactive interme-
colorectal cancer, BMC Biol., 16, 3, doi: 10.1186/
diates, J. Biol. Chem., 272, 11147-11151, doi: 10.1074/
s12915-017-0472-5.
jbc.272.17.11147.
54.
Wang, H., Wang, L., Xie, Z., Zhou, S., Li, Y.,
44.
Choudhari, S. K., Chaudhary, M., Bagde, S.,
Zhou, Y., and Sun, M. (2020) Nitric oxide (NO)
Gadbail, A. R., and Joshi, V. (2013) Nitric oxide
and NO synthases (NOS)-based targeted therapy for
and cancer: a review, World J. Surg. Oncol., 11, 118,
colon cancer, Cancers (Basel), 12, 1881, doi: 10.3390/
doi: 10.1186/1477-7819-11-118.
cancers12071881.
45.
Ambs, S., and Glynn, S. A. (2011) Candidate pathways
55.
Thomas, D. D., and Wink, D. A. (2017) NOS2 as an
linking inducible nitric oxide synthase to a basal-like
emergent player in progression of cancer, Antioxid. Re-
transcription pattern and tumor progression in human
dox Signal., 26, 963-965, doi: 10.1089/ars.2016.6835.
breast cancer, Cell Cycle, 10, 619-624, doi: 10.4161/
56.
Wink, D. A., Ridnour, L. A., Hussain, S. P., and
cc.10.4.14864.
Harris, C. C. (2008) The reemergence of nitric oxide
46.
Zou, Z., Li, X., Sun, Y., Li, L., Zhang, Q., Zhu, L.,
and cancer, Nitric Oxide, 19, 65-67, doi: 10.1016/
Zhong, Z., Wang, M., Wang, Q., Liu, Z., Wang, Y.,
j.niox.2008.05.003.
Ping, Y., Yao, K., Hao, B., and Liu, Q. (2020) NOS1
57.
Li, C. Q., Pang, B., Kiziltepe, T., Trudel, L. J.,
expression promotes proliferation and invasion and
Engelward, B. P., Dedon, P. C., and Wogan, G. N.
enhances chemoresistance in ovarian cancer, Oncol.
(2006) Threshold effects of nitric oxide-induced
Lett., 19, 2989-2995, doi: 10.3892/ol.2020.11355.
toxicity and cellular responses in wild-type and p53-
47.
Jones, L. E. Jr, Ying, L., Hofseth, A. B., Jelezcova, E.,
null human lymphoblastoid cells, Chem. Res. Toxicol.,
Sobol, R. W., Ambs, S., Harris, C. C., Espey, M. G.,
19, 399-406, doi: 10.1021/tx050283e.
БИОХИМИЯ том 88 вып. 7 2023
МОДИФИКАЦИИ ТИОЛОВ В ОПУХОЛЕВОЙ КЛЕТКЕ
1157
58.
Hickok, J. R., and Thomas, D. D.
(2010) Ni-
unfolded protein response, Cancer Res., 69, 7626-
tric oxide and cancer therapy: the emperor has NO
7634, doi: 10.1158/0008-5472.CAN-09-0493.
clothes, Curr. Pharm. Des., 16, 381391, doi: 10.2174/
71.
West, M. B., Hill, B. G., Xuan, Y. T., and
138161210790232149.
Bhatnagar, A. (2006) Protein glutathiolation by ni-
59.
Mintz, J., Vedenko, A., Rosete, O., Shah, K.,
tric oxide: an intracellular mechanism regulating re-
Goldstein, G., Hare, J. M., Ramasamy, R., and
dox protein modification, FASEB J., 20, 1715-1717,
Arora, H. (2021) Current advances of nitric oxide in
doi: 10.1096/fj.06-5843fje.
cancer and anticancer therapeutics, Vaccines (Basel),
72.
Salmeen, A., Andersen, J. N., Myers, M. P., Meng,
9, 94, doi: 10.3390/vaccines9020094.
T. C., Hinks, J. A., Tonks, N. K., and Barford, D.
60.
Hara, M. R., and Snyder, S. H.
(2006) Nitric
(2003) Redox regulation of protein tyrosine phos-
oxideGAPDH-Siah: a novel cell death cascade, Cell.
phatase 1B involves a sulphenyl-amide intermediate,
Mol. Neurobiol., 26, 527-538, doi: 10.1007/s10571-
Nature, 423, 769-773, doi: 10.1038/nature01680.
006-9011-6.
73.
Townsend, D. M., Manevich, Y., He, L., Hutchens, S.,
61.
Bechtel, T. J., and Weerapana, E. (2017) From struc-
Pazoles, C. J., and Tew, K. D. (2009) Novel role for
ture to redox: the diverse functional roles of disul-
glutathione S-transferase pi. Regulator of protein
fides and implications in disease, Proteomics, 17, 10,
S-Glutathionylation following oxidative and nitrosative
doi: 10.1002/pmic.201600391.
stress, J. Biol. Chem., 284, 436-445, doi: 10.1074/
62.
Gilbert, H. F. (1995) Thiol/disulfide exchange equi-
jbc.M805586200.
libria and disulfide bond stability, Methods Enzymol.,
74.
Singh, R. R., and Reindl, K. M. (2021) Glutathione
251, 8-28, doi: 10.1016/0076-6879(95)51107-5.
S-transferases in cancer, Antioxidants (Basel), 10, 701,
63.
Gilbert, H. F. (1990) Molecular and cellular as-
doi: 10.3390/antiox10050701.
pects of thiol-disulfide exchange, Adv. Enzymol.
75.
Ściskalska, M., and Milnerowicz, H. (2020) The role
Relat. Areas Mol. Biol., 63, 69-172, doi: 10.1002/
of GSTπ isoform in the cells signalling and anticancer
9780470123096.ch2.
therapy, Eur. Rev. Med. Pharmacol. Sci., 24, 8537-
64.
Kalinina, E. V., and Gavriliuk, L. A. (2020) Glutathi-
8550, doi: 10.26355/eurrev_202008_22650.
one synthesis in cancer cells, Biochemistry (Moscow),
76.
Kim, Y., and Jang, H. H. (2019) The role of peroxire-
85, 895-907, doi: 10.1134/S0006297920080052.
doxin family in cancer signaling, J. Cancer Prev., 24,
65.
Szajewski, R. P., and Whitesides, G. M. (1980) Rate
65-71, doi: 10.15430/JCP.2019.24.2.65.
constants and equilibrium constants for thiol-disulfide
77.
Chae, H. Z., Oubrahim, H., Park, J. W., Rhee, S. G.,
interchange reactions involving oxidized glutathione,
and Chock, P. B. (2012) Protein glutathionylation in
J. Am. Chem. Soc., 102, 2011-2026, doi: 10.1021/
the regulation of peroxiredoxins: a family of thiol-spe-
ja00526a042.
cific peroxidases that function as antioxidants, mo-
66.
Barinova, K. V., Serebryakova, M. V., Muronetz, V. I.,
lecular chaperones, and signal modulators, Antioxid.
and Schmalhausen, E. V. (2017). S-glutathionylation
Redox Signal., 16, 506-523, doi: 10.1089/ars.2011.4260.
of glyceraldehyde-3-phosphate dehydrogenase in-
78.
Manevich, Y., and Fisher, A. B. (2005) Peroxire-
duces formation of C150-C154 intrasubunit disulfide
doxin 6, a 1-Cys peroxiredoxin, functions in antiox-
bond in the active site of the enzyme, Biochim. Bio-
idant defense and lung phospho-lipid metabolism,
phys. Acta Gen. Subj., 1861, 3167-3177, doi: 10.1016/
Free Radic. Biol. Med., 38, 1422-1432, doi: 10.1016/
j.bbagen.2017.09.008.
j.freeradbiomed.2005.02.011.
67.
Arbault, S., Pantano, P., Sojic, N., Amatore, C.,
79.
Manevich, Y., Hutchens, S., Tew, K., and Town-
Best-Belpomme, M., Sarasin, A., and Vuillaume, M.
send, D. (2013) Allelic variants of glutathione S-trans-
(1997) Activation of the NADPH oxidase in human
ferase P1-1 differentially mediate the peroxidase
fibroblasts by mechanical intrusion of a single cell with
function of peroxiredoxin VI and alter membrane
an ultramicroelectrode, Carcinogenesis, 18, 569-574,
lipid peroxidation, Free Radic. Biol. Med., 54, 62-70,
doi: 10.1093/carcin/18.3.569.
doi: 10.1016/j.freeradbiomed.2012.10.556.
68.
Deponte, M.
(2017) The incomplete glutathione
80.
Levine, A. J. (1997) p53, the cellular gatekeeper for
puzzle: just guessing at numbers and figures? An-
growth and division, Cell, 88, 323-331, doi: 10.1016/
tioxid. Redox Signal., 27, 1130-1161, doi: 10.1089/
s0092-8674(00)81871-1.
ars.2017.7123.
81.
Yusuf, M. A., Chuang, T., Bhat, G. J., and Srivenugo-
69.
Gallogly, M. M., and Mieyal, J. J. (2007) Mechanisms
pal, K. S. (2010) Cys-141 glutathionylation of human
of reversible protein glutathionylation in redox
p53: Studies using specific polyclonal antibodies in
signaling and oxidative stress, Curr. Opin. Pharmacol.,
cancer samples and cell lines, Free Radic. Biol. Med.,
7, 381-391, doi: 10.1016/j.coph.2007.06.003.
49, 908-917, doi: 10.1016/j.freeradbiomed.2010.06.020.
70.
Townsend, D. M., Manevich, Y., He, L., Xiong, Y.,
82.
Sporn, M. B., and Liby, K. T. (2012) NRF2 and
Bowers, R. R. Jr., Hutchens, S., and Tew, K. D. (2009)
cancer: the good, the bad and the importance of
Nitrosative stress-induced s-glutathionylation of pro-
context, Nat. Rev. Cancer, 12, 564-571, doi: 10.1038/
tein disulfide isomerase leads to activation of the
nrc3278.
БИОХИМИЯ том 88 вып. 7 2023
1158
КАЛИНИНА, НОВИЧКОВА
83.
Chang, L. C., Fan, C. W., Tseng, W. K., and Hua,
93.
Adachi, T., Pimentel, D. R., Heibeck, T., Hou, X.,
C. C. (2021) The level of S-glutathionylated protein is
Lee, Y. J., Jiang, B., Ido, Y., and Cohen, R. A. (2004)
a predictor for metastasis in colorectal cancer and cor-
S-glutathiolation of Ras mediates redox-sensitive sig-
related with those of Nrf2/Keap1 pathway, Biomark-
naling by angiotensin II in vascular smooth muscle
ers, 26, 780-787, doi: 10.1080/1354750X.2021.1999503.
cells, J. Biol. Chem., 279, 29857-29862, doi: 10.1074/
84.
Bonay, M., Roux, A. L., Floquet, J., Retory, Y.,
jbc.M313320200.
Herrmann, J. L., Lofaso, F., and Deramaudt, T. B.
94.
Boudreau, M. W., Peh, J., Hergenrother, P. J. (2019)
(2015) Caspase-independent apoptosis in infected
Procaspase-3 overexpression in cancer: a paradox-
macrophages triggered by sulforaphane via Nrf2/
ical observation with therapeutic potential, ACS
p38 signaling pathways, Cell Death Discov., 1, 15022,
Chem. Biol., 14, 2335-2348, doi: 10.1021/acschembio.
doi: 10.1038/cddiscovery.2015.22.
9b00338.
85.
Zhao, X., Dong, W., Gao, Y., Shin, D. S., Ye, Q.,
95.
Beer, S. M., Taylor, E. R., Brown, S. E., Dahm, C. C.,
Su, L., Jiang, F., Zhao, B., and Miao, J. (2017) Novel
Costa, N. J., Runswick, M. J., and Murphy, M. P.
indolyl-chalcone derivatives inhibit A549 lung cancer
(2004) Glutaredoxin 2 catalyzes the reversible oxidation
cell growth through activating Nrf-2/HO-1 and
and glutathionylation of mitochondrial membrane
inducing apoptosis in vitro and in vivo, Sci. Rep., 7,
thiol proteins: Implications for mitochondrial redox
3919, doi: 10.1038/s41598-017-04411-3.
regulation and antioxidant defence, J. Biol. Chem.,
86.
Wang, L., Qu, G., Gao, Y., Su, L., Ye, Q., Jiang, F.,
279, 47939-47951, doi: 10.1074/jbc.M408011200.
Zhao, B., and Miao, J. (2018) A small molecule target-
96.
Ukuwela, A. A., Bush, A. I., Wedd, A. G., and Xiao, Z.
ing glutathione activates Nrf2 and inhibits cancer cell
(2017) Reduction potentials of protein disulfides and
growth through promoting Keap-1 S-glutathionyla-
catalysis of glutathionylation and deglutathionylation
tion and inducing apoptosis, RSC Adv., 8, 792-804,
by glutaredoxin enzymes, Biochem. J., 474, 3799-3815,
doi: 10.1039/c7ra11935f.
doi: 10.1042/BCJ20170589.
87.
Kawano, T., Inokuchi, J., Eto, M., Murata, M., and
97.
Pal, D., Rai, A., Checker, R., Patwardhan, R. S.,
Kang, J. H. (2022) Protein kinase C (PKC) isozymes
Singh, B., Sharma, D., and Sandur, S. K. (2021) Role
as diagnostic and prognostic biomarkers and thera-
of protein S-Glutathionylation in cancer progression
peutic targets for cancer, Cancers (Basel), 14, 5425,
and development of resistance to anti-cancer drugs,
doi: 10.3390/cancers14215425.
Arch. Biochem. Biophys., 704, 108890, doi: 10.1016/
88.
Benavides, F., Blando, J., Perez, C. J., Garg, R.,
j.abb.2021.108890.
Conti, C. J., DiGiovanni, J., and Kazanietz, M. G.
98.
Findlay, V. J., Townsend, D. M., Morris, T. E., Fraser,
(2011) Transgenic overexpression of PKC-epsilon in
J. P., He, L., and Tew, K. D. (2006) A novel role for
the mouse prostate induces preneoplastic lesions, Cell
human sulfiredoxin in the reversal of glutathionylation,
Cycle, 10, 268-277, doi: 10.4161/cc.10.2.14469.
Cancer Res., 66, 6800-6806, doi: 10.1158/0008-5472.
89.
Wang, H., Gutierrez-Uzquiza, A., Garg, R., Barrio-
CAN-06-0484.
Real, L., Abera, M. B., Lopez-Haber, C., Rosemblit,
99.
Park, J. W., Mieyal, J. J., Rhee, S. G., and Chock,
C., Lu, H., Abba, M., and Kazanietz, M. G. (2014)
P. B. (2009) Deglutathionylation of 2-Cys perox-
Transcriptional regulation of oncogenic protein kinase
iredoxin is specifically catalyzed by sulfiredoxin,
C (PKC) by STAT1 and Sp1 proteins, J. Biol. Chem.,
J. Biol. Chem., 284, 23364-23374, doi: 10.1074/jbc.
289, 19823-19838, doi: 10.1074/jbc.M114.548446.
M109.021394.
90.
Ward, N. E., Stewart, J. R., Ioannides, A. C. G., and
100. Menon, D., and Board, P. G. (2013) A role for
O’Brian, C. A. (2000) Oxidant-induced S-glutathiola-
glutathione transferase Omega 1 (GSTO1-1) in the
tion inactivates protein kinase C-α (PKC-α): a poten-
glutathionylation cycle, J. Biol. Chem., 288, 25769-
tial mechanism of PKC isozyme regulation, Biochem-
25779, doi: 10.1074/jbc.M113.487785.
istry, 39, 10319-10329, doi: 10.1021/bi000781g.
101. Hughes, M. M., Hooftman, A., Angiari, S., Tum-
91.
Manuel, A., Qian, X., van de Wetering, C., Chia, S. B.,
mala, P., Zaslona, Z., Runtsch, M. C., McGettrick,
Aboushousha,R., van der Velden, J., Dixon, A. E.,
A. F., Sutton, C. E., Diskin, C., Rooke, M., Taka-
Poynter, M., Lam, Y.-W., Irvin, C. G., and Janssen-
hashi, S., Sundararaj, S., Casarotto, M. G., Dahl-
Heininger, Y. M. W. (2019) S-glutathionylation of py-
strom, J. E., Palsson-McDermott, E. M., Corr, S. C.,
ruvate kinase M2 is associated with metabolic repro-
Mills, K. H. G., Preston, R. J. S., Neamati, N., Xie, Y.,
gramming and cytokine production in the develop-
Baell, J. B., Board, P. G., and O’Neill, L. A. J. (2019)
ment of allergic obese airway disease, in A21, Advances
Glutathione transferase omega-1 regulates NLRP3
in Asthma Pathogenesis, A1048, doi: 10.1164/ajrccm-
inflammasome activation through NEK7 degluta-
conference.2019.199.1_MeetingAbstracts.A1048.
thionylation, Cell Rep., 29, 151-161.e5, doi: 10.1016/
92.
Seo, M., and Lee Y. H. (2014) PFKFB3 regulates ox-
j.celrep.2019.08.072.
idative stress homeostasis via its S-glutathionylation
102. Ruoppolo, M., and Freedman, R. B. (1995) Refolding
in cancer, J. Mol. Biol., 426, 830-842, doi: 10.1016/
by disulfide isomerization: the mixed disulfide between
j.jmb.2013.11.021.
ribonuclease T1 and glutathione as a model refolding
БИОХИМИЯ том 88 вып. 7 2023
МОДИФИКАЦИИ ТИОЛОВ В ОПУХОЛЕВОЙ КЛЕТКЕ
1159
substrate, Biochemistry, 34, 9380-9388, doi: 10.1021/
carcinoma, Redox Biol.,
6,
41-50, doi:
10.1016/
bi00029a014.
j.redox.2015.07.001.
103. Yang, S., Jackson, C., Karapetyan, E., Dutta, P.,
115. Zhang, Y., Sun, C., Xiao, G., Shan, H., Tang, L.,
Kermah, D., Wu, Y., Wu, Y., Schloss, J., and Vadgama,
Yi, Y., Yu, W., and Gu, Y. (2019) S-nitrosylation of
J. V. (2022) Roles of protein disulfide isomerase in
the Peroxiredoxin-2 promotes S-nitrosoglutathi-
breast cancer, Cancers (Basel), 14, 745, doi: 10.3390/
one-mediated lung cancer cells apoptosis via AMPK-
cancers14030745.
SIRT1 pathway, Cell Death Dis., 10, 329, doi: 10.1038/
104. Martínez-Ruiz, A., Araújo, I. M., Izquierdo-Álvarez, A.,
s41419-019-1561-x.
Hernansanz-Agustín, P., Lamas, S., and Serrador, J.
116. Vanin, A. F., Ostrovskaya, L. A., Korman, D. B.,
(2013) Specificity in S-nitrosylation: a short-range
Rykova, V. A., Bluchterova, N. V., and Fomina, M. M.
mechanism for NO signaling? Antioxid. Redox Signal.,
(2020) The antitumor properties of dinitrosyl iron
19, 1220-1235, doi: 10.1089/ars.2012.5066.
complexes with thiol-containing ligands and S-nitro-
105. Nakamura, T., and Lipton, S. A. (2016) Protein S-ni-
soglutathione in experiments, Biophysics, 65, 39-50,
trosylation as a therapeutic target for neurodegen-
doi: 10.1134/s0006350920010236.
erative diseases, Trends Pharmacol. Sci., 37, 73-84,
117. Hara, M. R., Agrawal, N., Kim, S. F., Cascio, M. B.,
doi: 10.1016/j.tips.2015.10.002.
Fujimuro, M., Ozeki, Y., Takahashi, M., Cheah,
106. Ravi, K., Brennan, L. A., Levic, S., Ross, P. A., and
J. H., Tankou, S. K., Hester, L. D., Ferris, C. D.,
Black, S. M. (2004) S-nitrosylation of endothelial nitric
Hayward, S. D., Snyder, S. H., and Sawa, A. (2005)
oxide synthase is associated with monomerization and
S-nitrosylated GAPDH initiates apoptotic cell death
decreased enzyme activity, Proc. Natl. Acad. Sci. USA,
by nuclear translocation following Siah1 binding,
101, 2619-2624, doi: 10.1073/pnas.0300464101.
Nat. Cell Biol., 7, 665-674, doi: 10.1038/ncb1268.
107. Jia, J., Arif, A., Terenzi, F., Willard, B., Plow, E. F.,
118. Kornberg, M. D., Sen, N., Hara, M. R., Juluri, K. R.,
Hazen, S. L., and Fox, P. L. (2014) Target-selective
Nguyen, J. V., Snowman, A. M., Law, L., Hester,
protein S-nitrosylation by sequence motif recognition,
L. D., and Snyder, S. H. (2010) GAPDH mediates
Cell, 159, 623-634, doi: 10.1016/j.cell.2014.09.032.
nitrosylation of nuclear proteins, Nat. Cell Biol., 12,
108. Möller, M. N., Li, Q., Vitturi, D. A., Robinson, J. M.,
1094-1100, doi: 10.1038/ncb2114.
Lancaster, J. R. J., and Denicola, A. (2007) Membrane
119. Kohr, M. J., Murphy, E., and Steenbergen, C. (2014)
“lens” effect: focusing the formation of reactive
Glyceraldehyde-3-phosphate dehydrogenase acts as a
nitrogen oxides from the *NO/O2 reaction, Chem.
mitochondrial trans-S-nitrosylase in the heart, PLoS
Res. Toxicol., 20, 709-714, doi: 10.1021/tx700010h.
One, 9, e111448, doi: 10.1371/journal.pone.0111448.
109. Bartberger, M. D., Liu, W., Ford, E., Miranda, K. M.,
120. Nakajima, H., Itakura, M., Kubo, T., Kaneshige, A.,
Switzer, C., Fukuto, J. M., Farmer, P. J., Wink, D. A.,
Harada, N., Izawa, T., Azuma, Y. T., Kuwamura, M.,
and Houk, K. N. (2002) The reduction potential
Yamaji, R., and Takeuchi, T. (2017) Glyceraldehyde-
of nitric oxide (NO) and its importance to NO
3-phosphate dehydrogenase (GAPDH) aggregation
biochemistry, Proc. Natl.Acad. Sci. USA, 99, 10958-
causes mitochondrial dysfunction during oxidative
10963, doi: 10.1073/pnas.162095599.
stress-induced cell death, J. Biol. Chem., 292, 4727-
110. Nakamura, T., and Lipton, S. A. (2013) Emerging role
4742, doi: 10.1074/jbc.M116.759084.
of protein-protein transnitrosylation in cell signaling
121. Wen, Y. Y., Yang, Z. Q., Song, M., Li, B. L., Yao,
pathways, Antioxid. Redox Signal.,
18,
239-249,
X. H., Chen, X. L., Zhao, J., Lu, Y. Y., Zhu, J. J., and
doi: 10.1089/ars.2012.4703.
Wang, E. H. (2010) The expression of SIAH1 is down-
111. Broniowska, K. A., Diers, A. R., and Hogg, N. (2013)
regulated and associated with Bim and apoptosis in
S-nitrosoglutathione, Biochim. Biophys. Acta, 1830,
human breast cancer tissues and cells, Mol. Carcinog.,
3173-3181, doi: 10.1016/j.bbagen.2013.02.004.
49, 440-449, doi: 10.1002/mc.20615.
112. Giri, S., Rattan, R., Deshpande, M., Maguire, J. L.,
122. Hsu, K., Champaiboon, C., Guenther, B. D., Soren-
Johnson, Z., Graham, R. P., and Shridhar, V. (2014)
son, B. S., Khammanivong, A., Ross, K. F., Geczy,
Preclinical therapeutic potential of a nitrosylating
C. L., and Herzberg, M. C. (2009) Anti-infective
agent in the treatment of ovarian cancer, PLoS One, 9,
protective properties of s100 calgranulins, Antiin-
e97897, doi: 10.1371/journal.pone.0097897.
flamm. Antiallergy Agents Med. Chem., 8, 290-305,
113. Marozkina, N. V., and Gaston, B. (2012) S-Nitro-
doi: 10.2174/187152309789838975.
sylation signaling regulates cellular protein inter-
123. Lim, S. Y., Raftery, M., Cai, H., Hsu, K., Yan,
actions, Biochim. Biophys. Acta,
1820,
722-729,
W. X., Hseih, H. L., Watts, R. N., Richardson, D.,
doi: 10.1016/j.bbagen.2011.06.017.
Thomas, S., Perry, M., and Geczy, C. L. (2008)
114. Kaliyaperumal, K., Sharma, A. K., McDonald, D. G.,
S-nitrosylated S100A8: novel anti-inflammatory
Dhindsa, J. S., Yount, C., Singh, A. K., Won, J. S.,
properties, J. Immunol., 181, 5627-5636, doi: 10.4049/
and Singh, I. (2015) S-Nitrosoglutathione-mediated
jimmunol.181.8.5627.
STAT3 regulation in efficacy of radiotherapy and
124. Baritaki, S., Huerta-Yepez, S., Sahakyan, A.,
cisplatin therapy in head and neck squamous cell
Karagiannides, I., Bakirtzi, K., Jazirehi, A., and
БИОХИМИЯ том 88 вып. 7 2023
1
160
КАЛИНИНА, НОВИЧКОВА
Bonavida, B. (2010) Mechanisms of nitric oxide-
134. Sengupta, R., Ryter, S. W., Zuckerbraun, B. S.,
mediated inhibition of EMT in cancer: inhibition of
Tzeng, E., Billiar, T. R., and Stoyanovsky, D. A.
the metastasis-inducer Snail and induction of the
(2007) Thioredoxin catalyzes the denitrosation of
metastasis-suppressor RKIP, Cell Cycle, 9, 4931-4940,
low-molecular mass and protein S-nitrosothiols,
doi: 10.4161/cc.9.24.14229.
Biochemistry, 46, 8472-8483, doi: 10.1021/bi700449x.
125. Fernando, V., Zheng, X., Walia, Y., Sharma, V.,
135. Mitchell, D. A., Morton, S. U., Fernhoff, N. B., and
Letson, J., and Furuta, S. (2019) S-nitrosylation: an
Marletta, M. A. (2007) Thioredoxin is required for
emerging paradigm of redox signaling, Antioxidants
S-nitrosation of procaspase-3 and the inhibition of
(Basel), 8, 404, doi: 10.3390/antiox8090404.
apoptosis in Jurkat cells, Proc. Natl. Acad. Sci. USA,
126. Staab, C. A., Alander, J., Brandt, M., Lengqvist, J.,
104, 11609-11614, doi: 10.1073/pnas.0704898104.
Morgenstern, R., Grafström, R. C., and Höög, J. O.
136. Stoyanovsky, D. A., Scott, M. J., and Billiar, T. R.
(2008) Reduction of S-nitrosoglutathione by alcohol
(2013) Glutathione and thioredoxin type 1 cooper-
dehydrogenase 3 is facilitated by substrate alcohols via
atively denitrosate HepG2 cells-derived cytosolic
direct cofactor recycling and leads to GSH-controlled
S-nitrosoproteins, Org. Biomol. Chem., 11, 4433-
formation of glutathione transferase inhibitors, Bio-
4437, doi: 10.1039/c3ob40809d.
chem. J., 413, 493-504, doi: 10.1042/BJ20071666.
137. Ren, X., Sengupta, R., Lu, J., Lundberg, J. O., and
127. Wei, W., Li, B., Hanes, M. A., Kakar, S., Chen, X.,
Holmgren, A. (2019) Characterization of mammalian
and Liu, L.
(2010) Snitrosylation from GSNOR
glutaredoxin isoforms as S-denitrosylases, FEBS Lett.,
deficiency impairs DNA repair and promotes
593, 1799-1806, doi: 10.1002/1873-3468.13454.
hepatocarcinogenesis, Sci. Transl. Med., 2, 19ra13,
138. Sengupta, R., and Holmgren, A. (2012) The role of
doi: 10.1126/scitranslmed.3000328.
thioredoxin in the regulation of cellular processes by
128. Canas, A., Lopez-Sanchez, L. M., Penarando, J.,
S-nitrosylation, Biochim. Biophys. Acta, 1820, 689-
Valverde, A., Conde, F., Hernández, V., Fuentes, E.,
700, doi: 10.1016/j.bbagen.2011.08.012.
López-Pedrera, C., de la Haba-Rodríguez, J. R.,
139. Mnatsakanyan, R., Markoutsa, S., Walbrunn, K.,
Aranda, E., and Rodríguez-Ariza, A. (2016) Altered
Roos, A., Verhelst, S. H. L., and Zahedi, R. P.
S-nitrosothiol homeostasis provides a survival advan-
(2019) Proteome-wide detection of S-nitrosylation
tage to breast cancer cells in HER2 tumors and reduces
targets and motifs using bioorthogonal cleavable-
their sensitivity to trastuzumab, Biochim. Biophys. Acta,
linker-based enrichment and switch technique, Nat.
1862, 601-610, doi: 10.1016/j.bbadis.2016.02.005.
Commun., 10, 2195, doi: 10.1038/s41467-019-10182-4.
129. Hoshida, Y., Villanueva, A., Kobayashi, M., Peix, J.,
140. Okamoto, S., Nakamura, T., Cieplak, P., Chan, S. F.,
Chiang, D. Y., Hernández, V., Fuentes, E., López-
Kalashnikova, E., Liao, L., Saleem, S., Han, X.,
Pedrera, C., de la Haba-Rodríguez, J. R., Aranda, E.,
Clemente, A., Nutter, A., Sances, S., Brechtel, C.,
and Rodríguez-Ariza, A. (2008) Gene expression in
Haus, D., Haun, F., Sanz-Blasco, S., Huang, X.,
fixed tissues and outcome in hepatocellular carcinoma,
Li, H., Zaremba, J. D., Cui, J., Gu, Z., Nikzad, R.,
N. Engl. J. Med., 359, 1995-2004, doi: 10.1056/
Harrop, A., McKercher, S. R., Godzik, A., Yates,
NEJMoa0804525.
J. R. 3rd, and Lipton, S. A. (2014) S-nitrosylation-
130. Rizza, S., Di Leo, L., Pecorari, C., Giglio, P.,
mediated redox transcriptional switch modulates
Faienza, F., Montagna, C., Maiani, E., Puglia, M.,
neurogenesis and neuronal cell death, Cell Rep., 8,
Bosisio, F. M., Petersen, T. S., Lin, L., Rissler, V.,
217-228, doi: 10.1016/j.celrep.2014.06.005.
Viloria, J. S., Luo, Y., Papaleo, E., De Zio, D.,
141. Veron, D., Aggarwal, P. K., Velazquez, H.,
Blagoev, B., and Filomeni, G.
(2023) GSNOR
Kashgarian, M., Moeckel, G., and Tufro, A. (2014)
deficiency promotes tumor growth via FAK1
Podocyte-specific VEGF-a gain of function induc-
S-nitrosylation, Cell Rep., 42, 111997, doi: 10.1016/
es nodular glomerulosclerosis in eNOS null mice,
j.celrep.2023.111997.
J. Am. Soc. Nephrol., 25, 1814-1824, doi: 10.1681/
131. Benhar, M. (2015) Nitric oxide and the thioredoxin
ASN.2013070752.
system: a complex interplay in redox regulation, Bio-
142. Sharma, V., Fernando, V., Letson, J., Walia, Y.,
chim. Biophys. Acta, 1850, 2476-2484, doi: 10.1016/
Zheng, X., Fackelman, D., and Furuta, S. (2021)
j.bbagen.2015.09.010.
S-nitrosylation in tumor microenvironment, Int. J.
132. Benhar, M., Forrester, M. T., Hess, D. T., and
Mol. Sci., 22, 4600, doi: 10.3390/ijms22094600.
Stamler, J. S. (2008) Regulated protein denitrosylation
143. Plenchette, S., Romagny, S., Laurens, V., and
by cytosolic and mitochondrial thioredoxins, Science,
Bettaieb, A. (2015) S-Nitrosylation in TNF superfamily
320, 1050-1054, doi: 10.1126/science.1158265.
signaling pathway: implication in cancer, Redox Biol.,
133. Wu, C., Liu, T., Chen, W., Oka, S., Fu, C., Jain, M. R.,
6, 507-515, doi: 10.1016/j.redox.2015.08.019.
Parrott, A. M., Baykal, A. T., Sadoshima, J., and Li, H.
144. Tang, Z., Bauer, J. A., Morrison, B., and Lindner,
(2010) Redox regulatory mechanism of transnitrosyla-
D. J. (2006) Nitrosylcobalamin promotes cell death via
tion by thioredoxin, Mol. Cell. Proteomics, 9, 2262-
S nitrosylation of Apo2L/TRAIL receptor DR4, Mol.
2275, doi: 10.1074/mcp.M110.000034.
Cell. Biol., 26, 5588-5594, doi: 10.1128/MCB.00199-06.
БИОХИМИЯ том 88 вып. 7 2023
МОДИФИКАЦИИ ТИОЛОВ В ОПУХОЛЕВОЙ КЛЕТКЕ
1161
145. Leon-Bollotte, L., Subramaniam, S., Cauvard, O.,
147. Wilczynski, J., Duechler, M., and Czyz, M. (2011)
Plenchette-Colas, S., Paul, C., Godard, C., Martinez-
Targeting NF-κB and HIF-1 pathways for the
Ruiz, A., Legembre, P., Jeannin, J. F., and Bettaieb, A.
treatment of cancer: part I, Arch. Immunol. Ther. Exp.
(2011) S-nitrosylation of the death receptor fas
(Warsz), 59, 289-299, doi: 10.1007/s00005-011-0131-4.
promotes fas ligand-mediated apoptosis in cancer
148. Egloff, A. M., and Grandis, J. R. (2011) Response
cells, Gastroenterology, 140, 2009-2018, doi: 10.1053/
to combined molecular targeting: defining the
j.gastro.2011.02.053.
role of P-STAT3, Clin. Cancer Res., 17, 393-395,
146. Hongo, F., Garban, H., Huerta-Yepez, S., Vega, M.,
doi: 10.1158/1078-0432.CCR-10-2925.
Jazirehi, A. R., Mizutani, Y., Miki, T., and Bona-
149. Jin, L., Cao, Y., Zhang, T., Wang, P., Ji, D., Liu, X.,
vida, B. (2005) Inhibition of the transcription factor
Shi, H., Hua, L., Yu, R., and Gao, S. (2018) Effects of
Yin Yang
1 activity by S-nitrosation, Biochem.
ERK1/2 S-nitrosylation on ERK1/2 phosphorylation
Biophys. Res. Commun., 336, 692-701, doi: 10.1016/
and cell survival in glioma cells, Int. J. Mol. Med., 41,
j.bbrc.2005.08.150.
1339-1348, doi: 10.3892/ijmm.2017.3334.
S-GLUTATHIONYLATION AND S-NITROSYLATION AS MODULATORS
OF REDOX-DEPENDENT PROCESSES IN CANCER CELL
Review
E. V. Kalinina* and M. D. Novichkova
Peoples’s Friendship University of Russia (RUDN University),
117198 Moscow, Russia; e-mail: kalinina-ev@rudn.ru
The development of oxidative/nitrosative stress associated with the activation of oncogenic pathways is a
consequence of an increase in the level of generation of reactive oxygen and nitrogen species (ROS/RNS)
in tumor cells. The action of ROS/RNS is dual: high levels cause cell death and limit tumor growth at
certain phases of malignant neoplasm development, while low concentrations allow oxidative/nitrosative
modifications of key redox-dependent residues in regulatory proteins. The reversibility of such modifica-
tions as S-glutathionylation/S-nitrosylation, which occur through the electrophilic attack of ROS/RNS
on the nucleophilic residues of Cys, provides redox switching in the activity of signaling proteins and the
ability to control the processes of proliferation and programmed death. The level of S-glutathionylated
and S-nitrosylated proteins is controlled by the balance between S-glutathionylation/deglutathionylation
and S-nitrosylation/denitrosylation, the ratio of which depends on the cellular redox status. The degree of
S-glutathionylation and S-nitrosylation of protein targets and their ratio largely determines the state and
directions of signaling pathways in cancer cells. The review discusses the features of S-glutathionylation and
S-nitrosylation reactions in cancer cells, the balance of systems that control their activity and their relation-
ship with redox-dependent processes and tumor growth.
Keywords: reactive oxygen and nitrogen species, oxidative and nitrosative stress, cancer cells, S-glutathionylation and
deglutathionylation, S-nitrosylation, trans-nitrosylation, denitrosylation
БИОХИМИЯ том 88 вып. 7 2023