БИОХИМИЯ, 2023, том 88, вып. 7, с. 1162 - 1172
УДК 577.151.45
МЕТИОНИНОВАЯ ЗАВИСИМОСТЬ РАКОВЫХ КЛЕТОК -
МИШЕНЬ МЕТИОНИНАЗЫ
Обзор
© 2023 В.С. Покровский1,2,3*, Л. Або Кура1,2, Е.А. Демидова1, Ц. Хань4, Р.М. Хоффман4,5
1 Национальный медицинский исследовательский онкологический центр им. Н.Н. Блохина
Министерства здравоохранения Российской Федерации,
115478 Москва, Россия; электронная почта: v.pokrovsky@ronc.ru
2 Научно-исследовательский институт молекулярной и клеточной медицины
Российского университета дружбы народов (РУДН),
117198 Москва, Россия; электронная почта: louay.ko@gmail.com
3Научно-технологический университет «Сириус», отдел биотехнологии, 354340 Сочи, Россия
4 AntiCancer Inc., 92111 Сан-Диего, Калифорния, США; электронная почта: all@anticancer.com
5 Калифорнийский университет, отделение хирургии,
92037-7400 Сан-Диего, Ла-Хойя, Калифорния, США
Поступила в редакцию 11.02.2023
После доработки 12.03.2023
Принята к публикации 13.03.2023
Все типы раковых клеток отличаются метиониновой зависимостью, известной как эффект Хофф-
мана. Ограничение поступления метионина (L-Met) подавляет рост и пролиферацию раковых
клеток, между тем как нормальные клетки от дефицита L-Met не страдают. Метиониновая зави-
симость является мишенью метиониназы (METase), которая показала свою эффективность и без-
опасность на всех изученных типах опухолевых моделей in vitro и in vivo, как в монотерапии, так и
в комбинации с другими противоопухолевыми препаратами. Примерно 6 лет назад была получена
METase, которая может применяться перорально как добавка к пище, улучшая результаты лече-
ния некоторых пациентов с распространёнными опухолями. К настоящему моменту METase была
изучена в 8 клинических исследованиях, включая 2 в 1990-х гг. и 6 - в более позднее время. Этот
обзор посвящён клиническим исследованиям ограничения поступления L-Met в опухолевые клет-
ки при помощи METase, в частности, при помощи пероральной лекарственной формы METase
или в комбинации с другими препаратами в лечении пациентов с прогрессирующим раком.
КЛЮЧЕВЫЕ СЛОВА: метиониновая зависимость, метионин-γ-лиаза, пероральная METase, эффект
Хоффмана, клиническое исследование, ограничение метионина, разрушающий метионин фермент.
DOI: 10.31857/S0320972523070072, EDN: FXHDNJ
ВВЕДЕНИЕ
аминокислот [1]. 50 лет назад была обнаружена
зависимость опухолевых клеток от L-Met [2],
Более чем 60 лет исследований метабо-
которая получила название «эффекта Хофф-
лизма раковых клеток показали, что отсут-
мана» [3]. Зависимость от L-Met обусловлена
ствие определённых аминокислот подавляет
повышенной потребностью в этой аминокис-
рост и пролиферацию раковых клеток гораздо
лоте опухолевых клеток, которые расходуют её
более выраженно, чем для нормальных кле-
на реакции трансметилирования [2, 4-8].
ток [1]. Sugimura et al. впервые показали, что
Ограничение поступления L-Met может
удаление аминокислоты метионина (L-Met) из
быть эффективной стратегией в лечении опу-
диеты крыс с опухолями уменьшает рост опу-
холей, зависимых от L-Met для роста и выжи-
холи более выраженно, чем удаление других вания, между тем как на нормальные клетки
Принятые сокращения: CEA - карциноэмбриональный антиген; L-Hcy - L-гомоцистеин; L-Met - метионин;
METase - метиониназа; o-rMETase - пероральная rMETase; PSA - простат-специфичный антиген; rMETase - рекомби-
нантная METase; SAM - аденозилметионин.
* Адресат для корреспонденции.
1162
МЕТИОНИНОВАЯ ЗАВИСИМОСТЬ РАКОВЫХ КЛЕТОК
1163
ограничение L-Met в присутствии L-гомоци-
ния и является основным донором метильных
стеина (L-Hcy) выраженного цитотоксическо-
групп для метилирования ДНК, РНК и хро-
го действия не оказывает [2, 4, 9, 10]. В не-
матина [3, 9, 22]. SAM впоследствии превра-
скольких исследованиях in vivo использовалась
щается в S-аденозилгомоцистеин (SAH) через
ограничивающая L-Met диета и сообщалось об
серию реакций трансметилирования. SAH за-
ингибировании роста опухоли и возрастающей
тем при помощи аденозилгомоцистеиназы рас-
продолжительности жизни животных [11, 12].
падается на гомоцистеин, который может за-
Вегетарианская диета, которая может умень-
тем реметилироваться с получением L-Met
шить поступление L-Met, может быть эффек-
метионинсинтазой (MS; EC 2.1.1.13) в присут-
тивной стратегией, предотвращающей рост
ствии N5-метилтетрагидрофолата (N5-MTHF)
опухолей у человека [11, 12], но при этом сни-
и кобаламина как кофактора полного метио-
жение уровня L-Met в организме может быть
нинового цикла [3].
недостаточным. Другой эффективной страте-
В нормальных условиях MS реметилирует
гией, препятствующей опухолевому росту, мо-
приблизительно 50% L-Hcy с образованием
жет быть использование метиониназы (METase),
L-Met во всех тканях. Активность MS необ-
которая уменьшает концентрацию L-Met в кро-
ходима не только для реметилирования L-Hcy,
вотоке [13]. Ограничение поступления L-Met
но также и для поддержания клеточных уров-
с пищей в сочетании с химиотерапией было
ней восстановленного тетрагидрофолата, ко-
впервые использовано почти 40 лет назад [14].
торый необходим для одноуглеродного мета-
Современные исследования делают акцент на
болизма в клетках [3, 23]. L-Hcy может также
применении METase в сочетании с другими
быть реметилирован с использованием бе-
химиотерапевтическими агентами [15-20].
таина, который образуется из холина бетаин-
Настоящий обзор посвящён эффектив-
гомоцистеин-S-метилтрансферазой (BHMT;
ности METase, в частности, её пероральной
EC 2.1.1.5), которая экспрессируется преиму-
лекарственной формы, в качестве самостоя-
щественно в печени и почках и не зависит от
тельного средства или в комбинации с химио-
присутствия фолатов [3].
терапевтическими агентами при лечении па-
Альтернативно, цистатион-бета-синтаза
циентов с поздней стадией злокачественных
(EC 4.2.1.22) может преобразовывать L-Hcy в
новообразований, включая гормон-независи-
пути транссульфурации, где L-Hcy превраща-
мый рак простаты, рак яичников, рак подже-
ется в цистатион, который затем под действи-
лудочной железы, рак прямой кишки и инва-
ем цистатионазы (EC 4.4.1.1) превращается в
зивный дольковый рак молочной железы.
цистеин, использующийся в синтезе глутатио-
на и поддержании окислительно-восстанови-
тельного баланса [3].
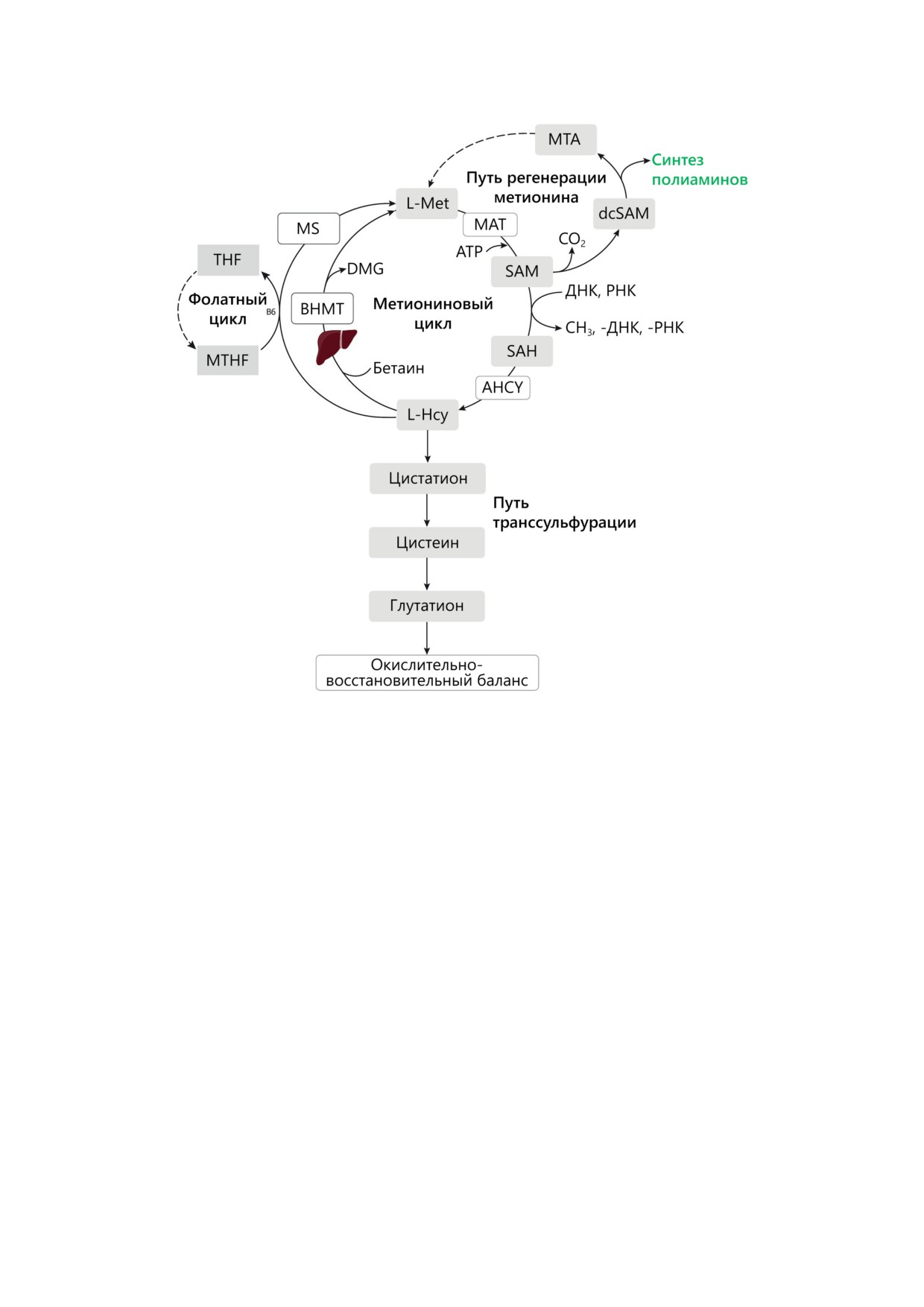
МЕТАБОЛИЗМ L-Met
Низкий уровень L-Met - причина падения
уровня SAM, который имеет следующие эф-
L-Met - серосодержащая аминокислота,
фекты: (1) ингибирование ферментов BHMT
необходимая для жизнедеятельности и роста
и MTHFR и предотвращение активации ци-
клеток. Метаболизм L-Met можно разделить на
статион-бета-синтазы для поддержания цикла
три различных пути: (1) цикл L-Met, который
L-Met [3]; (2) накопление 5-MTHF, который
продуцирует аденозилметионин (SAM) [21];
ингибирует глицин-N-метилтрансферазу и
(2) путь восстановления L-Met, который пе-
переключает потребление SAM на ДНК-ме-
рерабатывает L-Met из побочных продуктов
тилтрансферазы [3]; и (3) преимущественное
(S-метил-5′-тиоаденозина) пути синтеза поли-
усиление экспрессии гена MAT, что говорит о
аминов [3]; и (3) путь транссульфурации, кото-
том, что контроль за образованием SAM осу-
рый продуцирует антиоксидант глутатион (ри-
ществляется для поддержания его постоянных
сунок) [3]. Кроме того, поскольку метаболизм
клеточных уровней [3].
фолатов и цикл L-Met тесно связаны, они оба
Восстановительные пути также восстанав-
могут косвенно влиять на биосинтез нуклео-
ливают L-Met, который необходим для синте-
тидов. Фолаты необходимы для синтеза L-Met
за полиаминов [3]. SAM декарбоксилируется и
(рисунок), и неудивительно, что раковые забо-
утилизируется в синтезе полиаминов [3]. Мно-
левания зависимы от фолиевой кислоты [10].
жественные ферментативные шаги требуются
На первом этапе метаболизма L-Met ме-
для преобразования метилтиоаденозина в ме-
тионинаденозилтрансфераза (MAT; EC 2.5.1.6)
тилтиорибозу и, в конечном счёте, в метилтио-
в присутствии ATP катализирует образование
оксобутират (MTOB).
SAM из L-Met, который используется как ко-
Таким образом, биосинтез SAM контроли-
фактор в большинстве реакций метилирова-
рует сохранение клеточных концентраций SAM.
БИОХИМИЯ том 88 вып. 7 2023
1164
ПОКРОВСКИЙ и др.
Обзор метаболизма L-Met: SAM, S-аденозилметионин; MAT, метионинаденозилтрансфераза; SAH, S-аденозилгомо-
цистеин; AHCY, аденозилгомоцистеиназа; MS, метионинсинтаза; BHMT, бетаин-гомоцистеин-S-метилтрансфераза;
dcSAM, декарбоксилат SAM; MTA, метилтиоаденозин; DMG, диметилглицин; 5-MTHF, 5-метилтетрагидрофолат;
и THF, тетрагидрофолат
Эти скоординированные взаимодействия по-
тем не менее раковые клетки имеют повы-
зволяют клеткам поддерживать синтез белков
шенную потребность в её работе, поскольку
и полиаминов и другие реакции метилирова-
используют чрезмерное количество L-Met для
ния для клеточного роста и выживания при
реакций трансметилирования и, таким обра-
диете с низким уровнем L-Met.
зом, могут быть более уязвимы к дефициту
L-Met [5, 27-28].
На сегодняшний день все изученные ли-
УЯЗВИМЫЕ МЕСТА
нии нормальных клеток показали отсутствие
МЕТАБОЛИЗМА ОПУХОЛИ:
метиониновой зависимости и растут почти так
МЕТИОНИНОВАЯ ЗАВИСИМОСТЬ
же хорошо в среде Met- Hcy+, как и в среде Met+
Hcy-, несмотря на активный синтез L-Met из
Метиониновая зависимость является по-
L-Hcy в раковых клетках [24, 25]. Из 23 иссле-
всеместной и фундаментальной отличитель-
дованных клеточных линий различных типов
ной чертой раковых клеток [24, 25]. Метиони-
злокачественных опухолей человека 11 вообще
новая зависимость была впервые описана как
не растут в среде Met- Hcy+, таким образом, их
неспособность опухолевых клеток выживать и
можно считать полностью L-Met-зависимы-
расти при замене L-Met в культуральной среде
ми, и три клеточные линии дают в ней мини-
на его предшественник L-Hcy [2, 8, 26-27].
мальный рост [24]. Впоследствии, используя
В нормальных и некоторых опухолевых
чувствительность к METase как показатель
клетках активны естественные пути ресинтеза
метиониновой зависимости, все тестируемые
L-Met из L-Hcy с помощью метионинсинтазы,
раковые клеточные линии были идентифици-
БИОХИМИЯ том 88 вып. 7 2023
МЕТИОНИНОВАЯ ЗАВИСИМОСТЬ РАКОВЫХ КЛЕТОК
1165
рованы как зависимые от L-Met [25]. Согласно
ских больных. Ферменты, снижающие уровень
этим результатам, метиониновая зависимость
L-Met, в монотерапии или в комбинации с
часто наблюдается у многих видов опухоле-
диетой с низким содержанием L-Met и химио-
вых клеток человека, и предполагается, что это
терапевтическими препаратами имеют потен-
может быть важным фактором в онкогенной
циал как новая парадигма в лечении рака [32].
трансформации и терапевтической мишенью.
Метионин-γ-лиаза (methioninase; EC 4.4.1.11,
Позитронно-эмиссионная томография (ПЭТ)
метиониназа, METase) является бактериаль-
с [11С]L-Met показала яркий сигнал и была
ным пиридоксаль-5′-фосфат-зависимым фер-
более специфичной для обнаружения опухо-
ментом, она катализирует гамма-элиминацию
левых клеток, чем изображения, полученные
L-Met с образованием альфа-кетомасляной
с [18F]дезоксиглюкозой, представляя дополни-
кислоты, метилмеркаптана и аммиака [33-35].
тельные доказательства того, что метиони-
Впервые METase была использована для лече-
новая зависимость характерна для всех типов
ния рака в 1973 г. Kreis et al., когда на модели
раковых клеток [29]. Эти данные позволяют
карциномы крыс Уокера-256 было показано
предположить, что различия потребности в
ингибирование роста опухоли ферментом, вы-
L-Met между раковыми и нормальными клет-
деленным из Clostridium sporogenes [36]. Этот
ками могут быть более выраженными, чем раз-
фермент подавлял рост опухоли более эффек-
личия потребности в глюкозе.
тивно, чем рацион без L-Met, и не вызывал
Метиониновая зависимость раковых кле-
потерю массы тела [36]. Однократное внутри-
ток обусловлена избыточной активацией ре-
венное введение METase истощало уровень
акций трансметилирования, которая, вероят-
L-Met в плазме крови до 8% от контроль-
но, является причиной гиперметилирования
ного уровня [36]. Ген METase был клониро-
ДНК [22, 30], приводящего к анеуплоидии в
ван из Pseudomonas putida и экспрессирован в
опухолевых клетках [22, 30], или же гипер-
E. coli [13], и было показано, что он эффекти-
метилированием лизиновых меток гисто-
вен против всех типов рака in vitro и in vivo [37-
на Н3 [27, 28].
49]. Пегилированная рекомбинантная METase
В среде Met- Hcy+ ингибирование роста
(rMETase) была использована in vivo для уве-
L-Met-зависимых раковых клеток приводит
личения периода полувыведения и минимиза-
к уменьшению доли делящихся клеток в по-
ции иммунологических реакций [50].
пуляции, в отличие от накопления клеток в
Единственным побочным эффектом внут-
фазе G1 в культуре нормальных фибробластов
ривенного введения пегилированной rMETase
при высокой плотности в среде с добавлением
у обезьян была непродолжительная ане-
L-Met [31]. Ограничение L-Met останавливает
мия [50]. После внутривенной инъекции ко-
раковые клетки в фазе S/G2 клеточного цикла
фактор rMETase пиридоксаль-5′-фосфат (PLP)
и приводит к гибели клоногенных клеток, ко-
быстро диссоциировал, что привело к сниже-
торые эквивалентны инициирующим опухоль
нию активности фермента
[50]. Наблюдав-
клеткам, и делает раковые клетки чувствитель-
шиеся проблемы анафилаксии и диссоциации
ными к препаратам, специфически действую-
PLP rMETase были решены при помощи пер-
щим на клеточный цикл [28, 31].
оральной доставки rMETase (o-rMETase): при
пероральном применении rMETase действует
в желудочно-кишечном тракте без попадания
ОГРАНИЧЕНИЕ ПОСТУПЛЕНИЯ L-Met
в кровь. В моделях ортотопических ксено-
трансплантатов (PDOX) у мышей o-rMETase
Из-за окислительного стресса и гиперпро-
продемонстрировала исключительную эффек-
лиферации, вызванной онкогенным перепро-
тивность против рефрактерной саркомы, рака
граммированием, раковые клетки имеют вы-
поджелудочной железы, рака толстой кишки
сокую потребность в L-Met. Когда происходит
и меланомы [40-43, 45].
такое увеличение потребности в L-Met одно-
временно с ограничением его доступности,
в результате окислительного стресса и отсут-
КЛИНИЧЕСКИЕ НАБЛЮДЕНИЯ
ствия предшественников нуклеотидов проявля-
ется метаболическая уязвимость, называемая
Ранние клинические испытания рацио-
метиониновой зависимостью, которая являет-
нов питания с ограничением L-Met с химио-
ся отличительной чертой раковых клеток. Ис-
терапией и без неё показали многообещающие
пользование метиониновой зависимости при
результаты у некоторых пациентов с поздней
диете с низким содержанием L-Met показало
стадией рака. С 1990-х гг. были проведены
многообещающие результаты у онкологиче-
пилотные клинические испытания первой
БИОХИМИЯ том 88 вып. 7 2023
1
166
ПОКРОВСКИЙ и др.
Резюме клинических исследований METase
Комбинация
Заболевание
Тип
Количество
Дозы и режимы
с другими химио-
Развитие
Авторы
(состояние)
METase
пациентов
применения
терапевтическими
заболевания
препаратами
От 5000
до 20 000 единиц
Прогрессирующий
нереком-
Tan et al.
путём внутри-
рак молочной
бинантная
3
-
-
(1996)
венной инфузии
железы
METase
[51]
в течение 4 или 10 ч
однократно
Рак лёгких,
От 5000 до 20 000
молочной железы,
единиц в течение
Tan et al.
лимфома
rMETase
9
6-24 ч путём внут-
-
-
(1997)
и рак почки
ривенной инфузии
[34]
на поздних стадиях
однократно
500 единиц
o-rMETase
ежедневно, раз-
делённые на две
Прогрессирующий
один пациент:
уровень PSA
пероральные дозы
Han
рак яичников
пероральный приём
снизился,
по 250 единиц
et al.
и рак
o-rMETase
2
дексаметазона
уровень
в течение 1 мес.
(2020)
предстательной
и диета с низким
гемоглобина
для пациента
[20]
железы
содержанием L-Met
повысился
с раком яичников
или 3 мес.
для пациента
с раком простаты
500 единиц
o-rMETase
Han
Прогрессирующий
ежедневно,
один пациент:
уровень PSA
et al.
рак предстательной
o-rMETase
2
разделённые на две
диета с низким
снизился
(2021)
железы
пероральные дозы
содержанием L-Met
[19]
по 250 единиц
в течение 1 мес.
500 единиц
o-rMETase
Han
Прогрессирующий
ежедневно,
уровень PSA
et al.
рак предстательной
o-rMETase
1
-
разделённые на две
стабилен
(2021)
железы
пероральные дозы
[18]
по 250 единиц
уровень
500 единиц
CA19-9
o-rMETase
снизился;
Kubota
IV стадия рака
ежедневно,
FOLFIRINOX
объём опухоли
et al.
поджелудочной
o-rMETase
1
разделённые на две
или FOLFIRI
не изменился
(2022)
железы
пероральные дозы
каждые две недели
при компью-
[16]
по 250 единиц
терной
в течение 19 мес.
томографии
500 единиц
уровень CEA
o-rMETase
снизился;
Kubota
ежедневно,
объём опухоли
диета с низким
et al.
Рак прямой кишки
o-rMETase
1
разделённые на две
не изменился
содержанием L-Met
(2022)
пероральные дозы
при компью-
[15]
по 250 единиц
терной
в течение 18 мес.
томографии
диета с низким
уровень СЕА
содержанием L-Met,
снизился;
доксорубицин
Инвазивная
250 единиц
объём опухоли
Kubota
и циклофосфамид
дольковая
o-rMETase
не изменился
et al.
o-rMETase
1
в течение первых
карцинома
ежедневно каждые
при компью-
(2022)
3 мес., затем
молочных желез
6 ч в течение 6 мес.
терной томо-
[17]
доцетаксел
графии
в течение
и METPET
следующих 3 мес.
БИОХИМИЯ том 88 вып. 7
2023
МЕТИОНИНОВАЯ ЗАВИСИМОСТЬ РАКОВЫХ КЛЕТОК
1167
фазы для оценки цитотоксичности, фармако-
В ранних клинических исследованиях,
кинетики, истощения L-Met и определения
проведённых Han et al. [18-20], уровень цир-
максимальной переносимой дозы METase,
кулирующего L-Met у 67-летней женщины с
rMETase
[34,
51] и недавно появившейся
поздней стадией рака яичников снизился на
o-rMETase [15-20].
50% в течение 4 ч после приёма 250 единиц
Пробное клиническое испытание первой
o-rMETase. Четырём взрослым пациентам с
фазы с использованием нерекомбинантной
прогрессирующим раком простаты было на-
METase P. putida показало отсутствие острой
значено 500 единиц o-rMETase ежедневно, раз-
клинической токсичности или побочных эф-
делённых на 2 пероральные дозы по 250 еди-
фектов после воздействия METase [51] в дозе
ниц с разной продолжительностью введения.
менее 20 000 единиц при внутривенной инфу-
У пациента 1 уровень простат-специфичного
зии в течение 10 ч. У пациента 1 (5000 единиц)
антигена (PSA) снизился на 70% с 2000 нг/мл в
и пациента 2 (10 000 единиц) с распростра-
начале терапии до примерно 600 нг/мл в тече-
нённым раком молочной железы истощение
ние трёх месяцев приёма o-rMETase и декса-
L-Met началось через 30 мин после начала
метазона перорально (таблица), оба препарата
инфузии и продолжалось 4 ч после её заверше-
внесли вклад в снижение уровня PSA. За 4 нед.
ния. Значительное снижение уровня L-Met в
приёма o-rMETase у пациентов 2 и 3 произо-
сыворотке крови составило 19%, 35% и 50% в
шло снижение уровня PSA на 38% и 20% соот-
конце терапии у пациента 1, пациента 2 и па-
ветственно, затем его уровень стабилизировал-
циента 3 (20 000 единиц в течение 10 ч внутри-
ся. Пациент 2 придерживался вегетарианской
венной инфузии) соответственно [51]. Резуль-
диеты с низким содержанием L-Met, что мог-
тат исследований показал наличие корреляции
ло повлиять на уровни L-Met и PSA. Уровень
снижения L-Met c дозой rMETase и временем
L-Met у этого пациента снизился на 42,7% в
инфузии.
течение 12 дней с использованием o-rMETase.
В другом клиническом исследовании пер-
За 6 недель до начала терапии у пациента 4
вой фазы была использована rMETase, кото-
резко вырос уровень PSA с 38 до 56 нг/мл, но
рая была клонирована из P. putida и экспрес-
к 15 неделе после начала приёма o-rMETase
сирована в E. coli, для истощения пула L-Met
его уровень стабилизировался на 62 нг/мл. Не
в сыворотке крови пациентов с раком. Девять
наблюдалось клинической токсичности и дру-
пациентов с поздней стадией рака лёгких, мо-
гих побочных эффектов ни у одного из пациен-
лочных желез, лимфомы и рака почки полу-
тов с прогрессирующим раком предстательной
чали однократную внутривенную инфузию
железы после лечения o-rMETase отдельно или
rMETase в дозах от 5000 до 20 000 единиц в
в комбинации с диетой с низким содержанием
течение 6-24 ч (таблица). Клинической ток-
L-Met. Эти результаты позволяют предполо-
сичности не наблюдалось ни у одного пациен-
жить, что диета с низким содержанием L-Met,
та после лечения rMETase. Истощение L-Меt
а также изменение дозы o-rMETase может
началось в течение первого часа после начала
помочь снизить уровни L-Met и PSA в крови,
инфузии rMETase и достигало максимума че-
тем самым предотвращая прогрессию рака
рез 2 ч. Низкая концентрация L-Met сохраня-
простаты.
лась в течение всей инфузии и 2 ч с момента
Согласно статистике, лишь у около 5% па-
её окончания. L-Met у пациентов снижался до
циентов с IV стадией рака поджелудочной же-
всего 0,1 мкM в течение 2 ч, что сопоставимо
лезы, принимавших FOLFIRINOX, происхо-
с 300-кратным истощением без признаков ток-
дила стабилизация заболевания в течение
сичности [34]. Однако авторы не оценивали
18 мес. с момента постановки диагноза [16].
противоопухолевую активность этого лечения.
В клиническом исследовании ограничение
Согласно этим результатам, rMETase безопас-
L-Met при помощи o-rMETase, принимаемой
на при внутривенном введении и эффективно
2 раза в день как добавка к пище, и диеты с
истощает свою биохимическую мишень
-
низким содержанием L-Met показало очевид-
L-Met сыворотки крови.
но взаимоусиливающий эффект в комбинации
Восемь пациентов с различными солидны-
с FOLFIRINOX или FOLFIRI каждые 2 недели.
ми опухолями, включая гормон-независимый
Для мониторинга прогрессирования заболева-
рак простаты, рак яичников, рак поджелудоч-
ния использовался уровень ракового антиге-
ной железы, рак прямой кишки и инвазивный
на 19-9 (CA19-9) в крови и компьютерная томо-
дольковый рак молочной железы, получали
графия (таблица). У пациента с поздней стадией
o-rMETase в качестве отдельной добавки или
рака поджелудочной железы заболевание ста-
в комбинации с химиотерапевтическими аген-
билизировалось, и он оставался живым через
тами [15-20].
19 мес. после постановки диагноза [16].
БИОХИМИЯ том 88 вып. 7 2023
1
168
ПОКРОВСКИЙ и др.
Другое клиническое исследование осущест-
в лечении пациентов с различными видами
влялось с участием пациентов с раком прямой
злокачественных новообразований. Благодаря
кишки, в нём уровень L-Met снижали с помо-
отсутствию у o-rMETase поздних побочных эф-
щью o-rMETase и диеты с низким содержанием
фектов и токсичности она становится идеаль-
L-Met. Уровень карциноэмбрионального анти-
ным агентом для стратегии комбинированной
гена (CEA) был стабилен в течение 18 мес. после
терапии поздних стадий рака. С наступлением
начала терапии. Пациенты регулярно прохо-
эры o-rMETase иммуногенные осложнения,
дили ректороманоскопию, при которой изме-
связанные со способом введения нативных
рялся размер опухоли (таблица). Согласно этим
форм фермента (внутривенные инъекции) и
результатам, o-rMETase в качестве добавки к
необходимостью частого введения, судя по
пище и диета с низким содержанием L-Met мо-
всему, были устранены. Новые технологии сде-
гут быть эффективны при раке толстой кишки с
лали возможным проведение обширных фар-
долгосрочной стабилизацией заболевания [15].
макокинетических и фармакодинамических
Ограничение L-Met при помощи o-rMETase
исследований o-rMETase, что даёт возмож-
каждые 6 ч в течение 6 мес. и диета с низким со-
ность разработать более эффективный режим
держанием L-Met показали взаимоусиливаю-
дозирования препарата для клинического
щий эффект в комбинации с доксорубицином
применения. Наилучшие результаты, по-ви-
и циклофосфамидом, которые применялись
димому, достигаются посредством фармако-
первые 3 мес., затем с доцетакселом в течение
логически направленной и индивидуальной
последующих 3 мес., что привело к полному
терапевтической стратегии. Можно надеяться
ответу, который ожидается менее чем у 10%
на скорую разработку деталей такой стратегии,
пациентов с инвазивной дольковой карцино-
что даст возможность полностью реализовать
мой молочных желез, получающих только нео-
потенциал rMETase в клинической практике.
адъювантную химиотерапию. Уровень СЕА в
Наконец, выявление L-Met-зависимых био-
крови и компьютерная томография использо-
маркеров опухолей, таких как важные эпигене-
вались для отслеживания развития заболева-
тические признаки, и более глубокое понима-
ния, а полный ответ был продемонстрирован с
ние клеточного ответа на ограничение L-Met
помощью METPET через 6 мес., когда терапия
в опухолевых клетках могут дать более эффек-
была завершена (таблица) [17].
тивные методы борьбы с раком за счёт его уни-
Ни в одном клиническом исследовании не
кальной метаболической уязвимости.
было выявлено выраженной токсичности или
побочных эффектов после длительного перио-
Вклад авторов. Вадим С. Покровский, Луай
да лечения с o-rMETase в виде добавки в дозе
Або Кура и Елена А. Демидова - сбор и анализ
500 единиц в день, разделённой на две пер-
информации, написание и редактирование ру-
оральные дозы по 250 единиц. Эти результа-
кописи, создание иллюстраций; Цинхун Хань и
ты предполагают, что использование METase
Роберт М. Хоффман - редактирование рукопи-
может быть безопасной и эффективной стра-
си. Все авторы одобрили окончательный вариант
тегией снижения уровней циркулирующего и
рукописи до её представления к публикации.
внутриклеточного L-Met без изменения дие-
Финансирование. Данное исследование
ты, тем самым ускоряя клиническое примене-
поддержано государственной программой Ми-
ние ограничения L-Met.
нистерства образования и науки, госзадание
№ 075-01551-23-00 (ФССП-2023-0006).
Конфликт интересов. Авторы заявляют об
ЗАКЛЮЧЕНИЕ
отсутствии конфликта интересов.
Соблюдение этических норм. Данная статья
Из описанного выше можно сделать вывод,
не содержит исследований с участием людей или
что o-rMETase является важным дополнением
животных, проведённых кем-либо из авторов.
СПИСОК ЛИТЕРАТУРЫ
1. Sugimura, T., Birnbaum, S. M., Winitz, M.,
chem. Biophys., 81, 448-455, doi: 10.1016/0003-9861
and Greenstein, J. P.
(1959) Quantitative nutri-
(59)90225-5.
tional studies with water-soluble, chemically de-
2. Hoffman, R. M., and Erbe, R. W. (1976) High in vivo
fined diets. VIII. The forced feeding of diets each
rates of methionine biosynthesis in transformed
lacking in one essential amino acid, Arch. Bio-
human and malignant rat cells auxotrophic for me-
БИОХИМИЯ том 88 вып. 7 2023
МЕТИОНИНОВАЯ ЗАВИСИМОСТЬ РАКОВЫХ КЛЕТОК
1169
thionine, Proc. Natl. Acad. Sci. USA, 73, 1523-1527,
for human cancer cells based on a metabolic defect,
doi: 10.1073/pnas.73.5.1523.
J. Natl. Cancer Inst., 76, 629-639, doi: 10.1093/
3.
Kaiser, P. (2020) Methionine dependence of cancer,
jnci/76.4.629.
Biomolecules, 10, 568, doi: 10.3390/biom10040568.
15.
Kubota, Y., Han, Q., Hamada, K., Aoki, Y., Masaki, N.,
4.
Coalson, D. W., Mecham, J. O., Stern, P. H., and
Obara, K., Tsunoda, T., and Hoffman, R. M. (2022)
Hoffman, R. M. (1982) Reduced availability of en-
Long-term stable disease in a rectal-cancer pa-
dogenously synthesized methionine for S-adenosyl-
tient treated by methionine restriction with oral re-
methionine formation in methionine-dependent can-
combinant methioninase and a low-methionine
cer cells, Proc. Natl. Acad. Sci. USA, 79, 4248-4251,
diet, Anticancer Res., 42, 3857-3861, doi: 10.21873/
doi: 10.1073/pnas.79.14.4248.
anticanres.15877.
5.
Stern, P. H., and Hoffman, R. M. (1984) Elevat-
16.
Kubota, Y., Han, Q., Hozumi, C., Masaki, N.,
ed overall rates of transmethylation in cell lines
Yamamoto, J., Aoki, Y., Tsunoda, T., and Hoffman,
from diverse human tumors, In Vitro, 20, 663-670,
R. M. (2022) Stage IV pancreatic cancer patient
doi: 10.1007/BF02619617.
treated with FOLFIRINOX combined with oral
6.
Stern, P. H., Mecham, J. O., Wallace, C. D., and
methioninase: a highly-rare case with long-term stable
Hoffman, R. M. (1983) Reduced free-methionine in
disease, Anticancer Res., 42, 2567-2572, doi: 10.21873/
methionine-dependent SV40-transformed human fi-
anticanres.15734.
broblasts synthesizing apparently normal amounts of
17.
Kubota, Y., Han, Q., Masaki, N., Hozumi, C.,
methionine, J. Cell. Physiol., 117, 9-14, doi: 10.1002/
Hamada, K., Aoki, Y., Obara, K., Tsunoda, T., and
jcp.1041170103.
Hoffman, R. M.
(2022) Elimination of axillary-
7.
Singhal, T., Narayanan, T. K., Jacobs, M. P., Bal, C.,
lymph-node metastases in a patient with invasive
and Mantil, J. C. (2012) 11C-methionine PET for grad-
lobular breast cancer treated by first-line neo-adjuvant
ing and prognostication in gliomas: a comparison
chemotherapy combined with methionine restriction,
study with 18F-FDG PET and contrast enhancement
Anticancer Res.,
42,
5819-5823, doi:
10.21873/
on MRI, J. Nucl. Med., 53, 1709-1715, doi: 10.2967/
anticanres.16089.
jnumed.111.102533.
18.
Han, Q., and Hoffman, R. M.
(2021) Chronic
8.
Tisdale, M. J. (1980) Effect of methionine deprivation
treatment of an advanced prostate-cancer patient with
on methylation and synthesis of macromolecules,
oral methioninase resulted in long-term stabilization
Br. J. Cancer, 42, 121-128, doi: 10.1038/bjc.1980.210.
of rapidly rising PSA levels, In Vivo, 35, 2171-2176,
9.
Hoffman, R. M. (1984) Altered methionine me-
doi: 10.21873/invivo.12488.
tabolism, DNA methylation and oncogene expres-
19.
Han, Q., and Hoffman, R. M. (2021) Lowering and
sion in carcinogenesis, Biochim. Biophys. Acta BBA
stabilizing PSA levels in advanced-prostate cancer
Rev. Cancer,
738,
49-87, doi:
10.1016/0304-419X
patients with oral methioninase, Anticancer Res., 41,
(84)90019-2.
1921-1926, doi: 10.21873/anticanres.14958.
10.
Hoffman, R. M., Coalson, D. W., Jacobsen, S. J., and
20.
Han, Q., Tan, Y., and Hoffman, R. M. (2020) Oral
Erbe, R. W. (1981) Folate polyglutamate and mono-
dosing of recombinant methioninase is associated
glutamate accumulation in normal and SV40-trans-
with a 70% drop in PSA in a patient with bone-
formed human fibroblasts, J. Cell. Physiol., 109,
metastatic prostate cancer and 50% reduction in
497-505, doi: 10.1002/jcp.1041090316.
circulating methionine in a high-stage ovarian cancer
11.
Epner, D. E., Morrow, S., Wilcox, M., and Houghton,
patient, Anticancer Res., 40, 2813-2819, doi: 10.21873/
J. L. (2002) Nutrient intake and nutritional indexes
anticanres.14254.
in adults with metastatic cancer on a phase I clinical
21.
Cantoni, G. L. (1975) Biological methylation: select-
trial of dietary methionine restriction, Nutr. Cancer,
ed aspects, Annu. Rev. Biochem., 44, 435-451, doi:
42, 158-166, doi: 10.1207/S15327914NC422_2.
10.1146/annurev.bi.44.070175.002251.
12.
Hoshiya, Y., Guo, H., Kubota, T., Inada, T.,
22.
Hoffman, R. M. (2015) Development of recombinant
Asanuma, F., Yamada, Y., Koh, J., Kitajima, M.,
methioninase to target the general cancer-specific
Hoffman, R. M. (1995) Human tumors are methionine
metabolic defect of methionine dependence: a 40-
dependent in vivo, Anticancer Res., 15, 717-718.
year odyssey, Expert Opin. Biol. Ther., 15, 21-31,
13.
Tan, Y., Xu, M., Tan, X., Tan, X., Wang, X.,
doi: 10.1517/14712598.2015.963050.
Saikawa, Y., Nagahama, T., Sun, X., Lenz, M., and
23.
Pokrovsky, V. S., Abo Qoura, L., Morozova, E., and
Hoffman, R. M. (1997) Overexpression and large-
Bunik, V. I. (2022) Predictive markers for efficien-
scale production of recombinant L-methionine-α-
cy of the amino-acid deprivation therapies in can-
deamino-γ-mercaptomethane-lyase for novel anti-
cer, Front. Med., 9, 1035356, doi: 10.3389/fmed.
cancer therapy, Protein Expr. Purif., 9, 233-245, doi:
2022.1035356.
10.1006/prep.1996.0700.
24.
Mecham, J. O., Rowitch, D., Wallace, C. D., Stern,
14.
Stern, P. H., and Hoffman, R. M. (1986) Enhanced
P. H., and Hoffman, R. M. (1983) The metabolic
in vitro selective toxicity of chemotherapeutic agents
defect of methionine dependence occurs frequently
9
БИОХИМИЯ том 88 вып. 7 2023
1170
ПОКРОВСКИЙ и др.
in human tumor cell lines, Biochem. Biophys. Res.
(1997) Recombinant methioninase infusion reduces
Commun.,
117,
429-434, doi:
10.1016/0006-291X
the biochemical endpoint of serum methionine
(83)91218-4.
with minimal toxicity in high-stage cancer patients,
25.
Tan, Y., Xu, M., and Hoffman, R. M. (2010) Broad
Anticancer Res., 17, 3857-3860.
selective efficacy of recombinant methioninase and
35.
Hoffman, R. M. (2017) Is DNA methylation the new
polyethylene glycol-modified recombinant methi-
guardian of the genome? Mol. Cytogenet., 10, 11,
oninase on cancer cells in vitro, Anticancer Res., 30,
doi: 10.1186/s13039-017-0314-8.
1041-1046.
36.
Kreis, W., and Hession, C. (1973) Biological effects
26.
Yamamoto, J., Han, Q., Inubushi, S., Sugisawa, N.,
of enzymatic deprivation of L-methionine in cell
Hamada, K., Nishino, H., Miyake, K., Kumamoto, T.,
culture and an experimental tumor, Cancer Res.,
Matsuyama, R., Bouvet, M., Endo, I., and Hoffman,
33, 1866-1869.
R. M. (2020) Histone methylation status of H3K4me3
37.
Higuchi, T., Kawaguchi, K., Miyake, K., Han, Q.,
and H3K9me3 under methionine restriction is unstable
Tan, Y., Oshiro, H., Sugisawa, N., Zhang, Z.,
in methionine-addicted cancer cells, but stable in
Razmjooei, S., Yamamoto, N., Hayashi, R., Kimura, H.,
normal cells, Biochem. Biophys. Res. Commun., 533,
Miwa, S., Igarashi, K., Chawla, S. P., Singh, A. S.,
1034-1038, doi: 10.1016/j.bbrc.2020.09.108.
Eilber, F. C., Singh, S. R., Tsuchiya, H., and Hoffman,
27.
Yamamoto, J., Inubushi, S., Han, Q., Tashiro, Y.,
R. M. (2018) Oral recombinant methioninase com-
Sugisawa, N., Hamada, K., Aoki, Y., Miyake, K.,
bined with caffeine and doxorubicin induced regres-
Matsuyama, R., Bouvet, M., Clarke, S. G., Endo, I.,
sion of a doxorubicin-resistant synovial sarcoma in a
and Hoffman, R. M. (2020) The linkage of methi-
PDOX mouse model, Anticancer Res., 38, 5639-5644,
onine addiction, overmethylation of histone H3 ly-
doi: 10.21873/anticanres.12899.
sines and malignancy demonstrated when cancer
38.
Higuchi, T., Oshiro, H., Miyake, K., Sugisawa, N.,
cells revert to methionine-independence, bioRxiv,
Han, Q., Tan, Y., Park, J., Zhang, Z., Razmjooei, S.,
doi: 10.1101/2020.12.04.412437.
Yamamoto, N., Hayashi, K., Kimura, H., Miwa, S.,
28.
Wang, Z., Yip, L. Y., Lee, J. H. J., Wu, Z., Chew,
Igarashi, K., Bouvet, M., Chawla, S. P., Singh, S. R.,
H. Y., Chong, P. K. W., Teo, C. C., Ang, H. Y., Peh,
Tsuchiya, H., and Hoffman, R. M. (2019) Oral re-
K. L. E., Yuan, J., Ma, S., Choo, L. S. K., Basri, N.,
combinant methioninase, combined with oral caffeine
Jiang, X., Yu, Q., Hillmer, A. M., Lim, W. T., Lim,
and injected cisplatinum, overcome cisplatinum-
T. K. H., Takano, A., Tan, E. H., Tan, D. S. W.,
resistance and regresses patient-derived orthotopic
Ho, Y. S., Lim, B., and Tam, W. L. (2019) Methi-
xenograft model of osteosarcoma, Anticancer Res., 39,
onine is a metabolic dependency of tumor-initiating
4653-4657, doi: 10.21873/anticanres.13646.
cells, Nat. Med., 25, 825-837, doi: 10.1038/s41591-
39.
Higuchi, T., Sugisawa, N., Yamamoto, J., Oshiro, H.,
019-0423-5.
Han, Q., Yamamoto, N., Hayashi, K., Kimura, H.,
29.
Kubota, Y., Sato, T., Hozumi, C., Han, Q., Aoki, Y.,
Miwa, S., Igarashi, K., Tan, Y., Kuchipudi, S.,
Masaki, N., Obara, K., Tsunoda, T., and Hoffman,
Bouvet, M., Singh, S. R., Tsuchiya, H., and Hoffman,
R. M. (2023) Superiority of [11C] methionine over
R. M. (2020) The combination of oral-recombinant
[18F] deoxyglucose for PET imaging of multiple cancer
methioninase and azacitidine arrests a chemothera-
types due to the methionine addiction of cancer, Int. J.
py-resistant osteosarcoma patient-derived orthotopic
Mol. Sci., 24, 1935, doi: 10.3390/ijms24031935.
xenograft mouse model, Cancer Chemother. Pharma-
30.
Bloomfield, M., and Duesberg, P. (2016) Inherent
col., 85, 285-291, doi: 10.1007/s00280-019-03986-0.
variability of cancer-specific aneuploidy generates
40.
Kawaguchi, K., Han, Q., Li, S., Tan, Y., Igarashi, K.,
metastases, Mol. Cytogenet.,
9,
90, doi:
10.1186/
Kiyuna, T., Miyake, T., Miyake, M., Chmielowski, B.,
s13039-016-0297-x.
Nelson, S. D., Russell, T. A., Dry, S. A., Li, Y.,
31.
Hoffman, R. M., and Jacobsen, S. J. (1980) Reversible
Singh, A. S., Eckardt, M. A. R., Unno, M., Eilber,
growth arrest in simian virus 40-transformed human
F. C., and Hoffman, R. M.(2018) Targeting me-
fibroblasts, Proc. Natl. Acad. Sci. USA, 77, 7306-7310,
thionine with oral recombinant methioninase
doi: 10.1073/pnas.77.12.7306.
(o-rMETase) arrests a patient-derived orthotopic
32.
Yamamoto, J., Han, Q., Simon, M., Thomas, D., and
xenograft (PDOX) model of BRAF-V600E mutant
Hoffman, R. M. (2022) Methionine restriction: ready
melanoma: implications for chronic clinical cancer
for prime time in the cancer clinic? Anticancer Res.,
therapy and prevention, Cell Cycle, 17, 356-361, doi:
42, 641-644, doi: 10.21873/anticanres.15521.
10.1080/15384101.2017.1405195.
33.
Tanaka, H., Esaki, N., and Soda, K. (1985) A versa-
41.
Kawaguchi, K., Han, Q., Li, S., Tan, Y., Igarashi, K.,
tile bacterial enzyme: l-methionine γ-lyase, Enzyme
Murakami, T., Unno, M., and Hoffman, R. M. (2019)
Microb. Technol., 7, 530-537, doi: 10.1016/0141-0229
Efficacy of recombinant methioninase (rMETase)
(85)90094-8.
on recalcitrant cancer patient-derived orthotopic
34.
Tan, Y., Zavala, J., Han, Q., Xu, M., Sun, X., Tan, X.,
xenograft (PDOX) mouse models: a review, Cells, 8,
Tan, X., Magana, R., Geller, J., and Hoffman, R. M.
410, doi: 10.3390/cells8050410.
БИОХИМИЯ том 88 вып. 7 2023
МЕТИОНИНОВАЯ ЗАВИСИМОСТЬ РАКОВЫХ КЛЕТОК
1171
42.
Kawaguchi, K., Higuchi, T., Li, S., Han, Q., Tan, Y.,
Kotlov, M. I., Belyi, Y. F., Pokrovsky, V. S., and
Igarashi, K., Zhao, M., Miyake, K., Kiyuna, T.,
Demidkina, T. V. (2013) Kinetic Parameters and Cy-
Miyake, M., Ohshiro, H., Sugisawa, N., Zhang, Z.,
totoxic Activity of Recombinant Methionine γ-Lyase
Razmjooei, S., Wangsiricharoen, S., Chmielowski, B.,
from Clostridium tetani, Clostridium sporogenes,
Nelson, S. D., Russell, T. A., Dry, S. M., Li, Y.,
Porphyromonas gingivalis and Citrobacter freundii,
and Hoffman, R. M. (2018) Combination therapy of
Acta Naturae,
5,
92-98, doi:
10.32607/20758251-
tumor-targeting Salmonella typhimurium A1-R and oral
2013-5-3-92-98.
recombinant methioninase regresses a BRAF-V600E-
47.
Morozova, E. A., Anufrieva, N. V., Davydov, D. Zh.,
negative melanoma, Biochem. Biophys. Res. Commun.,
Komarova, M. V., Dyakov, I. N., Rodionov, A. N.,
503, 3086-3092, doi: 10.1016/j.bbrc.2018.08.097.
Demidkina, T. V., and Pokrovsky, V. S. (2017) Plasma
43.
Kawaguchi, K., Miyake, K., Han, Q., Li, S., Tan, S.,
methionine depletion and pharmacokinetic properties
Igarashi, K., Kiyuna, K., Miyake, M., Higuchi, T.,
in mice of methionine γ-lyase from Citrobacter
Oshiro, H., Zhang, Z., Razmjooei, S., Wangsiri-
freundii, Clostridium tetani and Clostridium sporogenes,
charoen, S., Bouvet, M., Singh, S. R., Unno, M., and
Biomed. Pharmacother, 88, 978-984, doi: 10.1016/
Hoffman, R. M. (2018) Oral recombinant methion-
j.biopha.2017.01.127.
inase (o-rMETase) is superior to injectable rMETase
48.
Pokrovsky, V. S., Anisimova, N. Y., Davydov, D. Zh.,
and overcomes acquired gemcitabine resistance in
Bazhenov, S. V., Bulushova, N. V., Zavilgelsky, G. B.,
pancreatic cancer, Cancer Lett., 432, 251-259, doi:
Kotova, V. Y., and Manukhov, I. V. (2019) Methionine
10.1016/j.canlet.2018.06.016.
gamma lyase from Clostridium sporogenes increases
44.
Yoshioka, T., Wada, T., Uchida, N., Maki, H.,
the anticancer effect of doxorubicin in A549 cells
Yoshida, H., Ide, N., Kasai, H., Hojo, K., Shono, K.,
and human cancer xenografts, Invest. New Drugs,
Maekawa, R., Yagi, S., Hoffman, R. M., and Sugita, K.
37, 201-209, doi: 10.1007/s10637-018-0619-4.
(1998) Anticancer efficacy in vivo and in vitro, synergy
49.
Pokrovsky, V. S., Chepikova, O. E., Davydov, D. Zh.,
with
5-fluorouracil, and safety of recombinant
Zamyatnin, A. A., Lukashev, A. N., and Lukasheva,
methioninase, Cancer Res., 58, 2583-2587.
E. V. (2019) Amino acid degrading enzymes and their
45.
Oshiro, H., Tome, Y., Kiyuna, T., Yoon, S. N., Lwin,
application in cancer therapy, Curr. Med. Chem., 26,
T. M., Han, Q., Tan, Y., Miyake, K., Higuchi, T.,
446-464, doi: 10.2174/0929867324666171006132729.
Sugisawa, N., Katsuya, Y., Park, J. H., Zang, Z.,
50.
Yang, Z., Wang, J., Yoshioka, T., Li, B., Lu, Q.,
Razmjooei, S., Bouvet, M., Clary, B., Singh, S. R.,
Li, S., Sun, X., Tan, Y., Yagi, S., Frenkel, E. P.,
Kanaya, F., Nishida, F., and Hoffman, R. M. (2019)
and Hoffman, R. M. (2004) Pharmacokinetics, me-
Oral recombinant methioninase overcomes colorectal-
thionine depletion, and antigenicity of recombinant
cancer liver metastasis resistance to the combination of
methioninase in primates, Clin. Cancer Res., 10, 2131-
5-fluorouracil and oxaliplatinum in a patient-derived
2138, doi: 10.1158/1078-0432.CCR-03-0068.
orthotopic xenograft mouse model, Anticancer Res.,
51.
Tan, Y., Zavala, J., Xu, M., Zavala, J., and Hoffman,
39, 4667-4671, doi: 10.21873/anticanres.13648.
R. M. (1996) Serum methionine depletion without
46.
Morozova, E. A., Kulikova, V. V., Yashin, D. V.,
side effects by methioninase in metastatic breast cancer
Anufrieva, N. V., Anisimova, N. Y., Revtovich, S. V.,
patients, Anticancer Res., 16, 3937-3942.
METHIONINE ADDICTION OF CANCER CELLS
TARGETED BY METHIONINASE
Review
V. S. Pokrovsky1,2,3*, L. Abo Qoura1,2, E. A. Demidova1, Q. Han4, and R. M. Hoffman4,5
1 N. N. Blokhin National Medical Research Center of Oncology of Ministry of Health of Russian Federation,
115478 Moscow, Russia; e-mail: v.pokrovsky@ronc.ru
2 Research Institute of Molecular and Cellular Medicine,
People’s Friendship University of Russia (RUDN University),
117198 Moscow, Russia; e-mail: louay.ko@gmail.com
3 Department of Biotechnology, Sirius University of Science and Technology, 354340 Sochi, Russia
4 AntiCancer Inc., San Diego, CA 92111, USA; e-mail: all@anticancer.com
5 Department of Surgery, University of California, San Diego, La Jolla, CA 92037-7400, USA
БИОХИМИЯ том 88 вып. 7 2023
9*
1172
ПОКРОВСКИЙ и др.
All types of cancer are addicted to methionine, which is known as the “Hoffman effect”. Restricting me-
thionine inhibits the growth and proliferation of all tested types of cancer cells, while normal cells are unaf-
fected. Methionine addiction is targeted with methioninase (METase), which has been shown to be effective
and safe as a therapy for all types of cancer cells and animal cancer models, either alone or in combination
with common cancer medications. Approximately six years ago, researchers developed a rMETase that may
be taken orally as a supplement and has resulted in anecdotal positive results in patients with advanced can-
cer. Currently, there are 8 clinical studies on METase, including 2 from the 1990s and 6 more recent ones.
This review focuses on the clinical studies of METase-mediated methionine restriction, specifically the oral
dosage form of rMETase as a supplement alone or in combination with common chemotherapeutic agents
in the treatment of patients with advanced cancer.
Keywords: methionine addiction, methionine γ-lyase, oral methioninase, Hoffman effect, clinical study, methionine
restriction, methionine-degrading enzyme
БИОХИМИЯ том 88 вып. 7 2023