БИОХИМИЯ, 2023, том 88, вып. 7, с. 1191 - 1203
УДК 615.28
ГИСТОНОВЫЕ МЕТИЛТРАНСФЕРАЗЫ КАК НОВАЯ МИШЕНЬ
ЭПИГЕНЕТИЧЕСКОГО ДЕЙСТВИЯ ВОРИНОСТАТА
© 2023 В.П. Максимова1#, Ю.В. Макусь1,2#, В.Г. Попова1,3, А.Ю. Прус1,4,
О.Г. Усалка1,5, Е.С. Трапезникова5, Е.М. Жидкова1, Г.А. Белицкий1,
М.Г. Якубовская1, К.И. Кирсанов1,2*
1 ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России,
115478 Москва, Россия; электронная почта: kkirsanov85@yandex.ru
2 ФГАОУ ВО «Российский университет дружбы народов», 117198 Москва, Россия
3 ФГБОУ ВО «Российский химико-технологический университет имени Д.И. Менделеева»,
125047 Москва, Россия
4 ФГБОУ ВО «МИРЭА - Российский технологический университет», 119571 Москва, Россия
5 ФГАОУ ВО «Первый МГМУ им И.М. Сеченова» Минздрава России, 119991 Москва, Россия
Поступила в редакцию 02.02.2023
После доработки 13.04.2023
Принята к публикации 20.04.2023
Характерными изменениями в системе эпигенетической регуляции экспрессии генов, сопровож-
дающими процесс злокачественной трансформации клетки, являются аберрантное метилирова-
ние и ацетилирование гистонов. Активно используемым в клинической онкологической практике
эпигенетически активным препаратом является вориностат, противоопухолевый эффект которого,
как правило, связывают с ингибированием гистоновых деацетилаз. Эффекты этого препарата на
метилирование гистонов изучены недостаточно. Используя тест-систему HeLa TI, позволяющую
оценить интегральный эффект эпигенетически активных соединений по активации экспрессии ре-
портерного гена GFP, и нокдаун генов интерферирующими РНК, мы показали, что ингибирующее
действие вориностата направлено не только на HDAC1, но и на SUV39H1, SUV39H2, SUV420H1,
EZH2. С помощью Вестерн-блоттинга была подтверждена способность вориностата подавлять
экспрессию ферментов SUV39H1/2, SUV420H1, EZH2 и, кроме того, было впервые выявлено его
ингибирующее действие на экспрессию ферментов SUV420H2 и DOT1L. Полученные данные рас-
ширяют представление об эпигенетических эффектах вориностата и демонстрируют необходимость
масштабного анализа его активности в отношении других эпигенетических ферментов. Деталь-
ное понимание механизма эпигенетического действия вориностата будет способствовать его более
адекватному использованию в терапии опухолей с аберрантным эпигенетическим профилем.
КЛЮЧЕВЫЕ СЛОВА: ЗНО с аберрантным эпигенетическим профилем, вориностат, SAHA, метилирова-
ние гистонов, гистоновые метилтрансферазы (HMT), тест-система HeLa TI, SUV39H1, SUV39H2, EZH2,
SUV420H1, SUV420H2, DOT1L.
DOI: 10.31857/S0320972523070096, EDN: FXUMTH
ВВЕДЕНИЕ
мутациям генов, амплификации генов и хро-
мосомным транслокациям. При этом опухоле-
Необратимый процесс опухолевой транс-
вая трансформация сопровождается обширным
формации клеток обусловлен генетическими по-
перепрограммированием транскриптома, ко-
вреждениями ДНК, приводящими к точечным торое происходит за счет изменения паттерна
Принятые сокращения: Б/т - нетрансфицированные клетки; ЗНО - злокачественные новообразования; 5-aza -
5-азацидин; CBL0137 - кураксин CBL0137; DNMT - ДНК-метилтрансферазы; G9a, GLP, SUV39H1, SUV39H2 - гисто-
новые метилтрансферазы класса KMT1; DOT1L - гистоновая метилтрансфераза класса KMT4; EZH2 - гистоновая
метилтрансфераза класса KMT6; HDAC - гистоновые деацетилазы; HeLa TI - популяция клеток HeLa Трихоста-
тин А-Индуцируемая; HMT - гистоновые метилтрансферазы; KMT - лизиновые метилтрансферазы; me - метильная
группа; SAHA - вориностат (субероиланилид гидроксамовой кислоты); SUV420H1, SUV420H2 - гистоновые метил-
трансферазы класса KMT5; TSA - трихостатин А.
* Адресат для корреспонденции.
# Авторы внесли равный вклад в работу.
1191
1
192
МАКСИМОВА и др.
эпигенетических модификаций, в том числе
SUV39H1/H2), UNC0642 и BIX01294 (ингиби-
метилирования гистонов [1]. Метилирование
торы G9a/GLP), находятся на стадии докли-
гистонов является одним из ключевых эпи-
нических испытаний [29-32]. В свою оче-
генетических механизмов регуляции тран-
редь, агенты Pinometostat (ингибитор DOT1L),
скрипции и играет важную роль в таких про-
SHR2554 (ингибитор EZH2), PRT543 (ингиби-
цессах, как репликация ДНК, репарация и
тор PRMT5) и EZM8266 (ингибитор G9a) про-
рекомбинация ДНК, транскрипция генов, раз-
ходят клинические испытания для терапии па-
витие клеточного цикла и пространствен-
циентов с опухолями кроветворной системы,
ная организация хромосом [2-4]. В основ-
а также солидными ЗНО [33-35]. В 2020 г. для
ном метильные (me) модификации распо-
противоопухолевой терапии был одобрен пер-
лагаются на аминокислотных остатках лизина
вый ингибитор HMT - таземетостат, действие
и аргинина N-концевых хвостов гистонов Н3
которого направлено на подавление фермен-
и Н4 и подразделяются на метки, активирую-
тативной активности EZH2 [36].
щие транскрипцию (H3K4me2/3, H3K36me2/3,
Вориностат, также известный как SAHA
H3K79me1/2/3) [3, 5, 6] и ответственные за
или Золинза®, является ингибитором гистоно-
подавление экспрессии генов (H3K9me2/3,
вых деацетилаз (HDAC) классов I, II и IV [37].
H4K20me3, H3K27me3) [7-9]. Сочетание раз-
Данный препарат применяется для лечения
личных гистоновых модификаций играет клю-
пациентов с прогрессирующей, рецидивирую-
чевую роль для образования эухроматина и
щей или устойчивой к химиотерапии кожной
гетерохроматина [10]. Процесс катализа мети-
Т-клеточной лимфомой [38]. Механизм дей-
лирования и деметилирования гистонов осу-
ствия вориностата заключается в связывании
ществляют ферменты антагонисты - гистоно-
иона цинка, находящегося в активном цент-
вые метилтрансферазы (HMT) и деметилазы,
ре HDAC, в результате чего происходит инги-
которые функционируют в сложных белковых
бирование каталитической активности фер-
комплексах, состоящих из различных хрома-
мента. Следствием ингибирования HDAC яв-
тин-модифицирующих ферментов, транскрип-
ляется повышение ацетилирования гистонов
ционных факторов или белков-репрессоров
и активация транскрипции [37]. В результате
транскрипции [11, 12]. Формирование абер-
действия вориностата возрастает ацетилиро-
рантного профиля метилирования гистонов
вание не только гистоновых белков, но и ряда
является результатом структурных нарушений
негистоновых факторов транскрипции, а так-
в генах метилтрансфераз и деметилаз, а также
же белков, участвующих в регуляции клеточ-
результатом некорректной экспрессии данных
ной пролиферации, миграции и гибели клет-
ферментов в результате внешних воздействий
ки [39]. Обширные исследования in vitro и
и/или опосредованного влияния генетических
in vivo на различных моделях опухолей демон-
нарушений, вызвавших необратимую транс-
стрируют сильные противоопухолевые эффек-
формацию клетки [13]. Гиперэкспрессия и му-
ты вориностата, включая индукцию ареста кле-
тации HMT наблюдаются при различных ти-
точного цикла, апоптоза и аутофагии, в том
пах злокачественных новообразований (ЗНО),
числе в клетках с развившейся химиорези-
поскольку изменения в структуре хроматина
стентностью [40]. В настоящее время накоплен
могут влиять на сигнальные пути и паттерны
ряд данных клинических испытаний (фазы I
экспрессии генов, которые способствуют он-
и II) о положительном эффекте вориностата в
когенезу [14].
комбинированной терапии таких заболеваний,
Наиболее часто вовлеченными в процесс
как множественная миелома, колоректальная
канцерогенеза являются метилтрансферазы
карцинома, саркома, миелодиспластический
EZH1/2, SETDB1, SUV39H1, SUV420H1/2, G9a,
синдром, нейробластома [41-45].
GLP, DOT1L, PRMT5, PRMT6, сверхэкспрес-
Данные опубликованных исследований сви-
сия которых наблюдается и часто коррелирует
детельствуют о том, что ингибирование HDAC
с худшим прогнозом при таких ЗНО, как рак
не является единственным механизмом дей-
молочной железы, рак предстательной желе-
ствия вориностата на систему эпигенетической
зы, рак яичников, легких, шейки матки, кожи
регуляции транскрипции. Было показано, что
и др. [9, 15-28]. Таким образом, данные фер-
ингибиторы HDAC, в том числе вориностат,
менты являются перспективными мишенями
способствуют увеличению степени метилиро-
для противоопухолевой терапии. В настоя-
вания гистона 3 по лизину 4 (H3K4me1/2/3)
щее время идет активный поиск и исследо-
за счет miRNA-опосредованного подавления
вание низкомолекулярных соединений, спо-
экспрессии лизиновых деметилаз семейства
собных модулировать активность HMT. Ряд
JARID1 - RBP2, PLU-1, SMCX и LSD1, отно-
модуляторов, таких как Chaetocin (ингибитор
сящейся к семейству KDM1 [46]. Также про-
БИОХИМИЯ том 88 вып. 7 2023
НОВЫЙ МЕХАНИЗМ ДЕЙСТВИЯ ВОРИНОСТАТА
1193
демонстрирована способность вориностата ин-
клеток HeLa, содержащих эпигенетически ре-
гибировать экспрессию ДНК-метилтрансфе-
прессированный вектор на основе вируса
раз DNMT1 и DNMT3b как на уровне мРНК,
саркомы птиц, кодирующий репортерный
так и на уровне белка [47]. Кроме того, в не-
ген GFP. Популяция HeLa TI была получена
скольких исследованиях было показано, что
в 2008 г. лабораторией А.М. Скалка (Anna
вориностат вызывает небольшое, но статисти-
Marie Skalka) и Р. Катца (Richard Katz) из
чески значимое снижение уровня модифика-
Онкологического центра Фокса Чейза (Fox
ций H3K9me3 и H3K9me2 [46, 47]. Также было
Chase Cancer Center, Филадельфия, США) [50].
продемонстрировано локус-специфическое влия-
В 2011 г. в рамках выполнения общего про-
ние вориностата на гистоновые метилтранс-
екта клеточная популяция HeLa TI была пре-
феразы SUV39H1 и EZH2 [48, 49]. Несмотря на
доставлена в распоряжение отдела хими-
это, детального изучения интегрального влия-
ческого канцерогенеза НМИЦ онкологии
ния вориностата на метилирование гистонов и
им. Н.Н. Блохина. В 2021 г. в нашей лаборатории
на опосредующие его HMT не проводили.
была завершена верификация возможности ис-
Представленное исследование было на-
пользования клеток HeLa TI в качестве тест-
правлено на анализ влияния вориностата на
системы для анализа эпигенетической актив-
процесс метилирования гистонов на инте-
ности ксенобиотиков [51].
гральном уровне. В качестве модельной си-
Клетки культивировали во флаконах T-75
стемы в работе была использована популяция
(«Eppendorf», Германия) в среде Игла, модифи-
клеток HeLa TI, несущих в своем геноме эпи-
цированной Дульбекко (DMEM), содержащей
генетически репрессированный репортерный
4,5 г/литр глюкозы («ПанЭко», Россия), 10% (v/v)
ген GFP, кодирующий зеленый флуоресцент-
термически инактивированной эмбриональ-
ный белок. Активация экспрессии GFP про-
ной телячьей сыворотки (FBS;
«Biosera»,
исходит при запуске 15 различных эпигене-
Франция), смесь антибиотиков пенициллина
тических факторов снятия репрессии генов,
(50 ед./мл) и стрептомицина (50 мкг/мл) («Пан-
в том числе генов белков, регулирующих аце-
Эко») и 2 мМ L-глутамина («ПанЭко»). Куль-
тилирование и метилирование гистонов [50].
тивирование проводили в стандартных усло-
Нокдаун генов определенных эпигенетических
виях (37 °C, 5% CO2).
ферментов в клетках HeLa TI позволяет оце-
Анализ характера эпигенетического действия
нить вклад кодируемых ими белков в эпигене-
вориностата в тест-системе HeLa TI. Анализ
тическую регуляцию транскрипции. В каче-
реактивации эпигенетически репрессированно-
стве альтернативного подхода, позволяющего
го гена GFP при совместном действии нок-
провести более широкое исследование в связи
дауна гена HDAC1 и эпигенетических моду-
с меньшей трудоемкостью и затратностью, для
ляторов трихостатина А,
5-азацитидина и
анализа эффектов эпигенетических препа-
кураксина CBL0137 в тест-системе HeLa TI.
ратов использовали определение содержания
Трихостатин А (TSA; «Selleckchem», США),
ферментов с помощью Вестерн-блоттинга.
5-азацидин (5-aza; «Merck», Германия) и ку-
Конкретные задачи работы включали: (1) про-
раксин CBL0137 (CBL0137; «Инкурон», Рос-
вести моделирование эффектов ингибиторов
сия) растворяли в
100%-ном диметилсуль-
с различным действием на гистоновые деаце-
фоксиде (ДМСО, «ПанЭко»), стоковая кон-
тилазы при нокдауне гена HDAC1 в тест-си-
центрация растворов составила 10 мМ. Клетки
стеме HeLa TI для дальнейшего определения
HeLa TI высеивали в 24-луночный планшет
характера эпигенетичечкого действия вори-
(«Eppendorf») по 20 000 клеток в лунку и че-
ностата; (2) провести анализ изменений экс-
рез 10 ч проводили трансфекцию 5 нМ siRNA
прессии репортерного гена GFP при действии
(малые интерферирующие РНК) к мРНК
вориностата на клетках HeLa TI с нокдау-
гена HDAC1 (GS3065). Для нокдауна исполь-
ном генов HDAC1, EZH2, SUV39H1, SUV39H2
зовали набор из 4 siRNA («Qiagen», Германия).
и SUV420H1; (3) оценить эффекты вориноста-
Трансфекцию осуществляли с помощью реак-
та на экспрессию гистоновых метилтранс-
тива HiPerFect Transfection Reagent («Qiagen»)
фераз EZH2, SUV39H1, SUV39H2, SUV420H1,
по протоколу производителя. Концентрации
SUV420H2, G9a, GLP, DOT1L.
siRNA были выбраны по рекомендации про-
изводителя и составляли концентрации, при
которых происходит практически полная
МАТЕРИАЛЫ И МЕТОДЫ
(не менее 80%) репрессия транскрипции гена-
мишени. Нокдаун от неспецифических эф-
Культивирование клеток. В исследовании
фектов дифференцировали с помощью набо-
использовали клетки HeLa TI - популяцию
ра siRNA AllStars Negative Control («Qiagen»),
БИОХИМИЯ том 88 вып. 7 2023
1
194
МАКСИМОВА и др.
который представляет собой несколько siRNA
составляло 0,1% (v/v). Через 24 ч после обра-
к мРНК генов, не имеющих гомологии ни с
ботки проводили смену среды и через 48 часов
одним известным геном млекопитающих. Под-
осуществляли проточную цитометрию, как опи-
тверждение селективного действия siRNA к
сано выше.
гену-мишени было осуществлено с помощью
Анализ экспрессии гистоновых метилтранс-
метода Вестерн-блоттинг и ПЦР в реальном
фераз при действии вориностата. Для экспери-
времени (данные не приводятся). Количество
мента использовали вориностат в концентра-
жизнеспособных клеток после нокдауна со-
ции 10 мМ, растворенный в ДМСО. Клетки
ставляло не менее 80% от общего количества
HeLa TI высеивали в 6-луночные планшеты
клеток. На следующий день (через 24 ч после
по 250 000 клеток в лунку и инкубировали с
трансфекции) клетки обрабатывали нетоксич-
вориностатом (5 мкМ) в течение 24 ч, а также
ными концентрациями TSA (0,12 мкМ), 5-aza
с ДМСО (конечное содержание - 0,1% (v/v)) в
(10 мкМ), CBL0137 (0,6 мкМ) и инкубиро-
качестве отрицательного контроля. Для полу-
вали в течение 24 ч. Конечная концентрация
чения общей фракции белка использовали бу-
ДМСО в среде с клетками не превышала 0,1%.
фер для анализа радиоиммунопреципитации
Затем проводили замену среды на свежую и
(RIPA): 50 мМ Tris-HCl, 150 мМ NaCl (оба -
через 48 ч клетки снимали с подложки с по-
«ПанЭко»), 1% (v/v) Triton X-100 («Ferak», Гер-
мощью 0,25% (v/v) раствора трипсин-ЭДТА
мания), 0,5% (w/v) дезоксихолат натрия («Диаэм»,
(«ПанЭко»), промывали фосфатно-солевым
Россия), 0,1% (w/v) Ds-Na («Serva», Герма-
буфером (PBS) с последующим центрифуги-
ния), коктейль ингибиторов протеаз («Roche»,
рованием (250 g, 5 мин) и проводили проточ-
Швейцария). Клетки лизировали 1 ч при 4 °С,
ную цитометрию с помощью прибора BD
после чего лизаты центрифугировали (1790 g,
FACSCanto II («BD Biosciences», Бельгия). Для
5 мин,
4 °С), отбирали супернатант, содер-
поддержания высокой жизнеспособности кле-
жащий общую фракцию белков, и денатури-
ток при хранении клеточной суспензии был
ровали белок в течение 5 мин в буфере для
использован раствор PBS с 2%-ной FBS. В ходе
нанесения («Merck», Германия). Количествен-
анализа использовали синий лазер (488 нм)
ное определение белка проводили по методу
и канал FITC (530/30 нм).
Бредфорда [52]. Разделение белков проводи-
Анализ реактивации эпигенетически репрес-
ли с помощью вертикального электрофореза
сированного гена GFP при действии ворино-
в 10%-ном ПААГ в буфере Tris-Gly с Ds-Na
стата и нокдауне генов HDAC1/HMT в тест-
(25 мМ Tris, 190 мМ Gly, 10% (w/v) Ds-Na),
системе HeLa TI. Вориностат («Selleckchem»)
после чего осуществляли перенос белков на
растворяли в ДМСО, стоковая концентрация
нитроцеллюлозную мембрану («Bio-Rad», США)
составляла 10 мM. Клетки HeLa TI высевали и
с размером пор 0,45 мкм (условия переноса
проводили трансфекцию siRNA к мРНК генов
для белков 25-100 кДа: 250 мА, 1 ч; для бел-
HDAC1 (GS3065), EZH2 (GS2146), SUV39H1
ков 100-150 кДа: 100 В, 1 ч). Для исследования
(GS6839), SUV39H2 (GS79723), SUV420H1
использовали кроличьи антитела
(«Abcam»,
(GS51111), как описано ранее. Для нокдауна каж-
Великобритания) к гистоновым метилтранс-
дого из генов использовали набор из 4 siRNA.
феразам: EZH2 (ab228697; разведение 1 : 7000),
Концентрации siRNA были выбраны по реко-
SUV39H1 (ab245380; разведение
1 : 3000),
мендациям производителя и составляли кон-
SUV39H2 (ab229493; разведение
1 : 3000),
центрации, при которых происходит прак-
DOT1L (ab64077; разведение
1 : 500), G9a
тически полная (не менее
80%) репрессия
(ab183889; разведение 1 : 3000), GLP (ab241306;
транскрипции гена-мишени. Нокдаун от не-
разведение 1 : 5000); а также кроличьи анти-
специфических эффектов дифференцирова-
тела
(«ThermoFisher Scientific», Германия):
ли с помощью набора siRNA AllStars Negative
SUV420H1 (PA5-40926; разведение 1 : 3000) и
Control, как описано выше. Количество жиз-
SUV420H2 (PA-109891; разведение 1 : 3000).
неспособных клеток после нокдауна составля-
Для контроля загрузки белка использовали
ло не менее 80% от общего количества клеток.
кроличьи антитела к белку β-актин («Abcam»;
Через 24 ч после трансфекции клетки обраба-
разведение: 1 : 10 000). В качестве вторичных
тывали вориностатом (5 мкМ). Данная кон-
антител использовали козьи антитела («Abcam»;
центрация вориностата являлась нетоксич-
разведение: 1 : 5000), конъюгированные с пер-
ной для клеток при индивидуальном действии
оксидазой хрена. Для детекции белков исполь-
агента (жизнеспособность клеток составляла
зовали проявляющий реагент Clarity™ Western
не менее 95% от процента жизнеспособных
ECL Substrate («Bio-Rad») и систему цифровой
клеток в анализируемой популяции). Конеч-
обработки изображений ImageQuant LAS 4000
ное содержание ДМСО при обработке клеток
(«GE Healthcare», США). Оценка белковых
БИОХИМИЯ том 88 вып. 7 2023
НОВЫЙ МЕХАНИЗМ ДЕЙСТВИЯ ВОРИНОСТАТА
1195
полос была проведена с помощью программы
циями эпимодуляторов с различным механиз-
ImageJ. Все эксперименты были выполнены в
мом действия происходит увеличение уровня
четырех независимых повторах.
реактивации экспрессии GFP относительно
Статистический анализ данных проводили
индивидуального действия агентов [51]. Осно-
с помощью программного обеспечения GraphPad
вываясь на этих данных, мы предположили,
Prism 8.3.0. Нормальность распределения дан-
что наличие эпигенетических эффектов во-
ных оценивали с помощью критерия Колмо-
риностата, не сопряженных с ингибировани-
горова-Смирнова. Для анализа значимости
ем HDAC, можно будет детектировать в клет-
различий в количестве GFP+-клеток при дей-
ках HeLa TI при нокдауне гена HDAC1.
ствии агентов TSA, 5-aza, CBL0137 и нокдауне
На первом этапе исследования было про-
гена HDAC1 использовали однофакторный
ведено моделирование эффектов ингибито-
дисперсионный анализ ANOVA с пост-тестом
ров с различным действием на гистоновые
Тьюки для множественных сравнений. Для
деацетилазы при нокдауне гена HDAC1 в тест-
анализа значимости различий в доле GFP+-
системе HeLa TI для дальнейшего определе-
клеток при действии вориностата после нок-
ния характера эпигенетического действия во-
дауна генов HDAC1, EZH2, SUV39H1, SUV39H2,
риностата. Для этого мы оценили уровень
SUV420H1 использовали двухфакторный дис-
реактивации экспрессии гена GFP по количе-
персионный анализ ANOVA с пост-тестом
ству GFP+-клеток при нокдауне гена HDAC1 и
Тьюки. Оценку значимости различий уровней
обработке модуляторами: (1) относящимся к
экспрессии гистоновых метилтрансфераз по-
ингибиторам HDAC (трихостатин А), (2) имею-
сле обработки клеток вориностатом проводи-
щим смешанный механизм действия (курак-
ли с помощью t-теста Стьюдента. Пороговый
син CBL0137) и (3) не влияющим на HDAC
уровень статистической значимости для всех
(5-азацитидин). Трихостатин А - ингибитор I
методов составлял p < 0,05.
и II классов HDAC из группы гидроксамовых
кислот природного происхождения [56]; 5-аза-
цитидин - нуклеозидный аналог цитидина,
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
деметилирующий ДНК за счет ингибирова-
ния DNMT [57]. CBL0137 - низкомолекуляр-
Основной эпигенетический эффект вори-
ное соединение из группы кураксинов второго
ностата заключается в неселективном ингиби-
поколения, является активатором супрессора
ровании HDAC. Наибольшее сродство агент
опухолей белка р53, а также ингибирует гисто-
проявляет к ферментам HDAC1, HDAC2,
новый шаперон FACT, что приводит к инте-
HDAC3 и HDAC6. Вориностат имеет близкие
гральному ремоделированию хроматина и ак-
концентрации ингибирования HDAC1, HDAC3
тивации транскрипции [58]. Также, по данным
и HDAC6, при этом падение экспрессии более
Zhou et al. [59], CBL0137 увеличивает уровень
выражено для белка HDAC1 [53, 54].
ацетилирования гистона Н3 и снижает коли-
Тест-система HeLa TI представляет собой
чество модификаций H3K9me3 и H3K27me3
популяцию клеток HeLa, несущих эпигене-
в промоторах генов интерферонового сигна-
тически репрессированный вектор на основе
линга. Было показано, что обработка клеток
вируса саркомы птиц, содержащий репортер-
набором siRNA, не имеющих сродства к ге-
ный ген GFP. Эпигенетическая репрессия ге-
нам млекопитающих (siNEG), не приводила
на GFP в клетках HeLa TI обусловлена дей-
к статистически значимому изменению уров-
ствием более чем 15 факторов, включающих
ня реактивации GFP относительно нетранс-
хроматин-модифицирующие ферменты раз-
фицированных клеток (Б/т) вне зависимости
личных классов, а также гистоновые шапе-
от обработки клеток. Уровень реактивации
роны [50]. При этом вклад ферментов HDAC
экспрессии GFP в Б/т-клетках составил 4,2%;
в эпигенетическом сайленсинге гена GFP в
в клетках, обработанных siNEG
-
4,5%
тест-системе реализуется в основном за счет
(рис. 1, а; рис. П1 в Приложении).
действия HDAC1 [55]. Ранее было показано,
Обработка клеток ДМСО, используемо-
что популяция HeLa TI чувствительна к широ-
го в качестве контроля растворителя, также
кому спектру эпигенетических модуляторов, в
не приводила к изменению количества GFP+-
том числе ингибиторам HDAC, а также инги-
клеток по сравнению с необработанными
биторам DNMT, HMT и BRD (белки из класса
клетками (Б/т-К, siNEG-К). При нокдауне
бромодоменов). Кроме того, тест-система мо-
HDAC1 было зарегистрировано увеличение
жет быть использована для анализа синергиче-
уровня реактивации экспрессии GFP до 43,5%,
ского эпигенетического эффекта химических
что превышает значения для необработан-
соединений: при обработке клеток комбина-
ных клеток в 10 раз. Обработка клеток TSA
БИОХИМИЯ том 88 вып. 7 2023
1196
МАКСИМОВА и др.
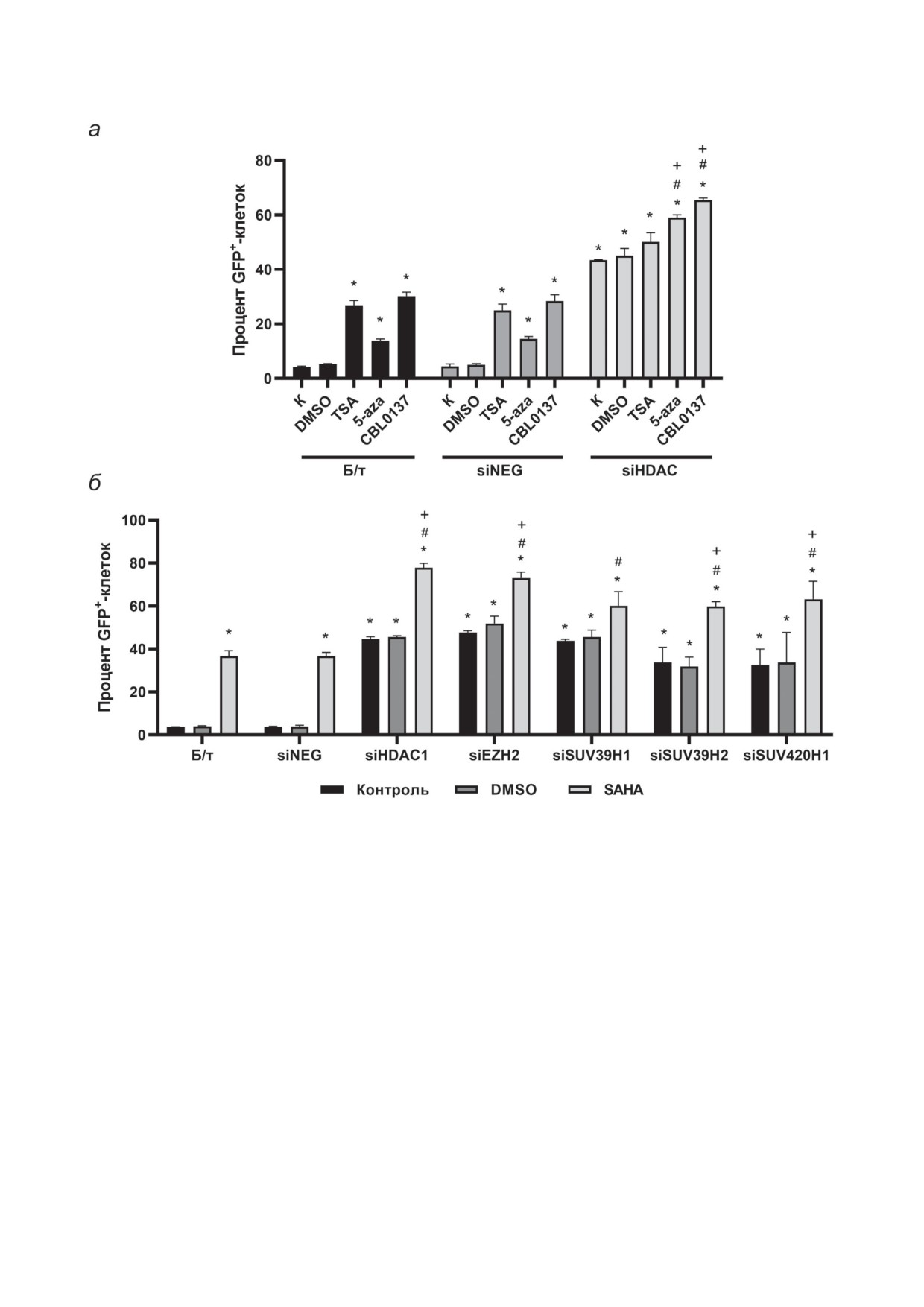
Рис. 1. Реактивация эпигенетически репрессированного гена GFP в тест-системе HeLa TI. а - При действии эпи-
генетических модуляторов TSA, 5-aza, CBL0137 и нокдауна HDAC1. б - При действии вориностата (SAHA) и нокдауна
HDAC1, EZH2, SUV39H1, SUV39H2, SUV420H1. Результаты проточной цитометрии (M ± SD). К - необработанные
клетки, отрицательный контроль; Б/т - нетрансфицированные клетки; siNEG - клетки, трансфицированные siRNA,
не имеющими гомологии ни с одним известным геном млекопитающих (отрицательный контроль трансфекции);
«*» - количество GFP+-клеток при действии TSA/5-aza/CBL0137/SAHA или siRNA значимо различается по срав-
нению с отрицательным контролем (siNEG-К), p < 0,01; «#» - количество GFP+-клеток при действии TSA/5-aza/
CBL0137/SAHA в группе с нокдауном значимо различается по сравнению с одноименными пробами в группе siNEG,
p < 0,05; «+» - количество GFP+-клеток при действии TSA/5-aza/CBL0137/SAHA значимо различается по сравнению
с отрицательным контролем внутри группы siHDAC1/siEZH2/siSUV39H1/siSUV39H2/siSUV420H1, p < 0,05
приводила к увеличению количества GFP+-
до 59%, что может говорить о суммировании
клеток до 25% для нетрансфицированных клеток
эффектов ингибирования экспрессии HDAC1
(Б/т-TSA) и до 27% - для клеток, обработанных
и DNMT в тест-системе HeLa TI. Кураксин
siNEG. В то же время при нокдауне HDAC1 и
CBL0137 при индивидуальном действии вызы-
последующей обработке TSA уровень реакти-
вал увеличение уровня реактивации экспрес-
вации GFP составлял около 50%, что соответ-
сии GFP до 28-30%. После обработки клеток
ствовало индивидуальному действию siHDAC.
с нокдауном HDAC1 происходило увеличение
В результате обработки клеток 5-aza проис-
числа GFP+-клеток до 65,5%, что в 2 раза
ходило увеличение числа GFP+-клеток до 14%,
превышает эффект CBL0137 и практически
а при действии 5-aza и нокдауне HDAC1 -
в 1,5 раза - эффект siHDAC1. Результаты иссле-
БИОХИМИЯ том 88 вып. 7 2023
НОВЫЙ МЕХАНИЗМ ДЕЙСТВИЯ ВОРИНОСТАТА
1197
дования демонстрируют, что при действии агента,
как при индивидуальном действии ворино-
не влияющего на HDAC, но влияющего на другие
стата (в 2,1 раза), так и при нокдауне HDAC1
факторы эпигенетической репрессии гена GFP
(в 1,7 раза). Таким образом, при действии
в тест-системе HeLa TI (например, 5-aza),
ингибитора HDAC вориностата и нокдауне
должно происходить суммирование эффектов
HDAC1 в тест-системе HeLa TI происходит
нокдауна HDAC1 и модулятора. При наличии
увеличение количества GFP+-клеток, что сви-
перекрестных эффектов модулятора и нокдауна
детельствует о дополнительном HDAC-незави-
гена HDAC1 будет наблюдаться частичное или
симом эпигенетическом эффекте соединения.
полное перекрытие уровня реактивации GFP,
Нокдаун генов EZH2, SUV39H1, SUV39H2
как в случае с TSA. При действии эпигенетиче-
и SUV420H1 вызывал значительное увеличение
ского модулятора широкого действия, не огра-
количества GFP+-клеток относительно отри-
ничивающегося влиянием на HDAC, как в слу-
цательного контроля: EZH2 (48%; 12,9 раза),
чае CBL0137, будет происходить значительное
SUV39H1
(44%;
11,8 раза), SUV39H2
(34%;
усиление реактивации экспрессии GFP.
9,1 раза), SUV420H1 (33%; 8,8 раза) (рис. 1, б).
На следующем этапе исследования был
Анализ степени реактивации экспрессии GFP
осуществлен анализ характера эпигенетиче-
при действии вориностата и нокдауне EZH2
ского действия вориностата в клетках HeLa TI
выявил увеличение числа GFP+-клеток до 73%,
при нокдауне гена HDAC1, а также ряда генов
что в 1,5 раза превышает эффект siEZH2 и
метилтрансфераз: EZH2, SUV39H1, SUV39H2,
в 2 раза - эффект вориностата. В то же время при
SUV420H1. EZH2 - метилтрансфераза семей-
нокдауне SUV39H1 с последующей обработкой
ства KMT6, входит в состав репрессивного
вориностатом наблюдалась устойчивая тенден-
белкового комплекса PRC2 и опосредует ди- и
ция к росту популяции GFP+-клеток относи-
триметилирование сайта H3K27, ассоцииро-
тельного индивидуального действия siRNA
ванного с репрессией транскрипции [13]. Гомо-
и агента (в 1,4 и в 1,6 раза соответственно).
логи SUV39H1 и SUV39H2 относятся к классу
Обработка клеток вориностатом после нок-
метилтрансфераз KMT1 и опосредуют триме-
дауна гена SUV39H2 приводила к реактивации
тилирование сайта H3K9. Белок SUV420H1,
экспрессии GFP в 60% клеток, что в 1,8 раза
наравне со своим гомологом SUV420H2, явля-
и 1,6 раза больше, чем при индивидуальном
ется ключевым ферментом в триметилирова-
действии siSUV39H2 и вориностата соответ-
нии H4K20me3 и играет важную роль в репли-
ственно. Обработка клеток вориностатом при
кации и репарации ДНК, а также в регуляции
нокдауне SUV420H1 вызывала увеличение ко-
клеточного цикла [60]. Образование модифи-
личества GFP+-клеток до 63,2%, что в 1,9 раза
каций H3K9me3 и H4K20me3 способствует за-
больше относительно эффекта siSUV420H1
пуску механизма метилирования ДНК посред-
и в 1,7 раза - относительно эффекта ворино-
ством рекрутирования гетерохроматинового
стата. Полученные результаты демонстрируют
белка HP1 и DNMT, таким образом, способ-
«пересечение» эффектов вориностата и нок-
ствуя репрессии транскрипции [61, 62]. H3K9me3
дауна генов EZH2, SUV39H2 и SUV420H1, что
и H4K20me3 играют важную роль для образо-
говорит о потенциальном влиянии ворино-
вания плотной структуры хроматина в пери-
стата на эти ферменты. Стоит заметить, что
центрических и теломерных повторах гетеро-
нокдаун генов SUV39H1, SUV39H2 и SUV420H1
хроматина, а также участвуют в замалчивании
в клетках HeLa TI с последующей обработ-
экспрессии генов в эухроматине [63, 64].
кой вориностатом вызывал снижение про-
Количество GFP+-клеток в отрицательном
цента жизнеспособных клеток до 65%. Высо-
контроле (Б/т-К) составило 3,7%, в контроле
кая токсичность может быть объяснена тем,
трансфекции (siNEG-K) - 3,4% (рис. 1, б; рис. П2
что метилтрансферазы SUV39H1, SUV39H2 и
в Приложении). Как и ранее, действие siNEG
SUV420H1 являются ключевыми ферментами,
не приводило к изменению профиля реакти-
катализирующими модификации H3K9me3 и
вации гена GFP по сравнению с Б/т-клетками.
H4K20me3, которые играют ключевую роль в
При действии ДМСО (контроль растворителя)
организации структуры хромосом и потеря ко-
статистически значимого изменения количе-
торых может быть критична даже при кратко-
ства GFP+-клеток зарегистрировано не было.
срочном действии siRNA [65].
Нокдаун HDAC1 вызывал реактивацию экс-
Полученные на модельной системе HeLa TI
прессии GFP в 45% клеток. Вориностат вы-
данные свидетельствовали о том, что ворино-
зывал реактивацию в 37% клеток (рис. 1, б).
стат способен неселективно ингибировать экс-
Действие вориностата при нокдауне HDAC1
прессию целого ряда гистоновых метилтранс-
приводило к увеличению доли GFP+-клеток
фераз. В связи с этим на заключительном
до 78%, что превышало уровень реактивации
этапе исследования была поставлена задача
БИОХИМИЯ том 88 вып. 7 2023
1198
МАКСИМОВА и др.
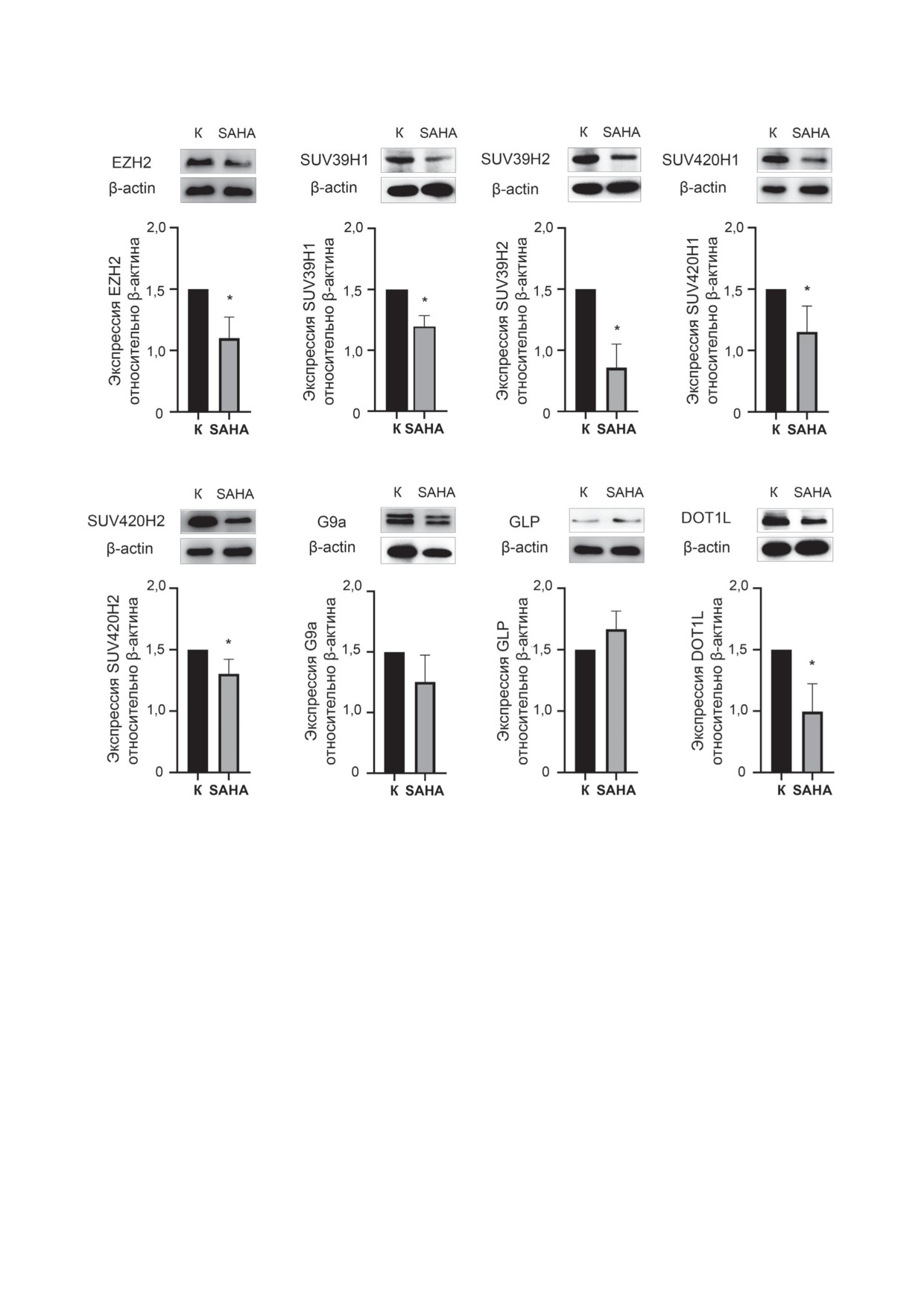
Рис. 2. Уровень экспрессии гистоновых метилтрансфераз при действии вориностата (SAHA). Результаты и денситоме-
трический анализ Вестерн-блоттинга (M ± SD). К - отрицательный контроль; «*» - различия статистически значимы
относительно отрицательного контроля; p < 0,05
с использованием альтернативного подхода, а
триметилирование H3K79. DOT1L участвует
именно Вестерн-блоттинга, оценить влияние
во многих клеточных процессах, включая ге-
вориностата на уровень содержания не только
номный импринтинг, ответ на повреждение
ферментов, для которых был продемонстри-
ДНК, а также процессы более высокого уров-
рован эффект на модельной системе HeLa TI,
ня - эритропоэз, дифференцировка клеток,
но и ряда других метилтрансфераз гистонов,
эмбриональное развитие [67]. Сверхэкспрес-
вовлеченных в прогрессию ЗНО. Таким обра-
сия DOT1L приводит к активации транскрип-
зом, в перечень исследуемых были добавле-
ции, в том числе теломерных последовательно-
ны метилтрансферазы SUV420H2, G9a, GLP
стей [68]. Более того, метилирование H3K79,
и DOT1L. Родственные метилтрансферазы
опосредованное DOT1L, ограничивает рекру-
G9a и GLP функционируют в составе гетеро-
тирование репрессивных белков в гетерохро-
димерного комплекса и опосредуют моно- и
матиновые области [69].
диметилирование H3K9, а также индуци-
Было продемонстрировано, что при дей-
руют процесс метилирования ДНК [66]. Бе-
ствии вориностата происходит общее снижение
лок DOT1L - метилтрансфераза, представляю-
экспрессии белка EZH2 в 1,8 раза (рис. 2). Полу-
щая класс КМТ4, катализирует моно-, ди- и
ченные данные хорошо согласуются с результа-
БИОХИМИЯ том 88 вып. 7 2023
НОВЫЙ МЕХАНИЗМ ДЕЙСТВИЯ ВОРИНОСТАТА
1199
тами исследования Nordstrom et al. [49], пока-
ЗАКЛЮЧЕНИЕ
завших снижение уровня EZH2 и модификации
H3K27me3 в промоторной области гена SOX11,
В настоящем исследовании было показано,
кодирующего фактор транскрипции 11, при
что эпигенетические эффекты вориностата, по-
действии 5 мкМ вориностата. Кроме того, Shi
мимо ингибирования HDAC, распространяют-
et al. [70] сообщали о высокой чувствительности
ся и на гистоновые метилтрансферазы. Нами
клеток немелкоклеточного рака легких с высо-
впервые была показана способность ворино-
ким уровнем экспрессии EZH2 к обработке во-
стата снижать интегральный уровень гисто-
риностатом, а также о положительной корреля-
новых метилтрансфераз SUV39H2, SUV420H1,
ции экспрессии ферментов EZH2 и HDAC1.
SUV420H2 и DOT1L, которые гиперэкспрес-
Также было выявлено, что при действии
сированы при различных ЗНО. Новые дан-
вориностата происходит значимое снижение
ные о механизме эпигенетического действия
количества белков SUV39H1 (в 1,6 раза) и
вориностата будут способствовать более адек-
SUV39H2 (в 2,8 раза), ответственных за моди-
ватному использованию данного препарата в
фикацию H3K9me3 (рис.
2). Наблюдаемый
противоопухолевой терапии, а также должны
эффект вориностата на
метилтрансферазу
способствовать пониманию молекулярных ме-
SUV39H1 согласуется с данными Natarajan
ханизмов его побочных эффектов. В совокуп-
et al. [48], которые продемонстрировали на
ности, полученные данные могут послужить
модели рака яичника in vitro снижение экс-
механистической базой для расширения обла-
прессии метилтрансфераз DNMT3A, SUV39H1
сти применения вориностата, и, как следствие,
и PRMT1 при действии сопоставимой дозы
увеличения эффективности терапии опухолей
вориностата (7,5 мкМ). Для белков GLP и G9a,
с аберрантным эпигенетическим профилем.
входящих в комплекс, опосредующий димети-
лирование H3K9, не было зарегистрировано
Вклад авторов. В.П.М., К.И.К., М.Г.Я. -
статистически значимого изменения уровня
разработка концепции исследования; К.И.К.,
экспрессии. Однако при этом наблюдалась
М.Г.Я. - руководство исследованием, редак-
тенденция к снижению количества G9a
тирование текста; В.П.М., Ю.В.М. - написа-
(в 1,4 раза). Нами также было показано, что
ние текста; В.П.М., Ю.В.М., В.Г.П., А.Ю.П.,
вориностат вызывает снижение экспрессии
О.Г.У., Е.С.Т., Е.М.Ж. - проведение экспери-
метилтрансфераз SUV420H1 и SUV420H2, опо-
ментов; В.П.М., Ю.В.М., Е.М.Ж. - подготовка
средующих метилирование репрессивной мет-
иллюстраций; В.П.М., К.И.К., М.Г.Я., Г.А.Б. -
ки H4K20me3, в 1,3 и 1,5 раза соответственно.
обсуждение результатов исследования.
Выявленное влияние вориностата на данные
Финансирование. Работа выполнена при
белки может объяснять его способность вызы-
финансовой поддержке Российского научного
вать реорганизацию хроматина, что возможно
фонда (грант № 21-75-10163).
связано с установленным для вориностата ге-
Конфликт интересов. Авторы заявляют об
нотоксическим действием [71, 72]. Также нами
отсутствии конфликта интересов.
было продемонстрировано, что после обработ-
Соблюдение этических норм. Настоящая
ки клеток вориностатом происходит ингибиро-
статья не содержит описания каких-либо ис-
вание экспрессии (в 2 раза) белка DOT1L, от-
следований с участием людей или животных в
ветственного за метилирование сайта H3K79.
качестве объектов.
Влияние вориностата на ферменты SUV39H2,
Дополнительные материалы. Приложение к
SUV420H1, SUV420H2 и DOT1L в опублико-
статье опубликовано на сайте журнала «Био-
ванных ранее данных не было описано.
СПИСОК ЛИТЕРАТУРЫ
1. Tian, X., Zhang, S., Liu, H. M., Zhang, Y. B., Blair,
cancers, Nat. Rev. Cancer, 21, 413-430, doi: 10.1038/
C. A., Mercola, D., Sassone-Corsi, P., and Zi, X.
s41568-021-00357-x.
(2013) Histone lysine-specific methyltransferases and
3. Lam, U. T. F., Tan, B. K. Y., Poh, J. J. X., and Chen,
demethylases in carcinogenesis: new targets for cancer
E. S. (2022) Structural and functional specificity of
therapy and prevention, Curr. Cancer Drug Targets, 13,
H3K36 methylation, Epigenetics Chromatin, 15, 17,
558-579, doi: 10.2174/1568009611313050007.
doi: 10.1186/s13072-022-00446-7.
2. Zhao, S., Allis, C. D., and Wang, G. G.
(2021)
4. Greer, E. L., and Shi, Y. (2012) Histone methyla-
The language of chromatin modification in human
tion: a dynamic mark in health, disease and inher-
БИОХИМИЯ том 88 вып. 7 2023
1200
МАКСИМОВА и др.
itance, Nat. Rev. Genet., 13, 343-357, doi: 10.1038/
EZH2-CCF-cGAS Axis Promotes Breast Cancer
nrg3173.
Metastasis, Int. J. Mol. Sci., 23, 1788, doi: 10.3390/
5.
Santos-Rosa, H., Schneider, R., Bannister, A. J.,
ijms23031788.
Sherriff, J., Bernstein, B. E., Emre, N. C., Schreiber,
17.
Entezari, M., Taheriazam, A., Paskeh, M. D. A.,
S. L., Mellor, J., and Kouzarides, T. (2002) Active
Sabouni, E., Zandieh, M. A., Aboutalebi, M.,
genes are tri-methylated at K4 of histone H3, Nature,
Kakavand, A., Rezaei, S., Hejazi, E. S., Saebfar, H.,
419, 407-411, doi: 10.1038/nature01080.
Salimimoghadam, S., Mirzaei, S., Hashemi, M.,
6.
Farooq, Z., Banday, S., Pandita, T. K., and Altaf, M.
and Samarghandian, S. (2023) The pharmacological
(2016) The many faces of histone H3K79 methylation,
and biological importance of EZH2 signaling in
Mutat. Res. Rev. Mutat. Res., 768, 46-52, doi: 10.1016/
lung cancer, Biomed. Pharmacother., 160, 114313,
j.mrrev.2016.03.005.
doi: 10.1016/j.biopha.2023.114313.
7.
Cutter DiPiazza, A. R., Taneja, N., Dhakshna-
18.
Zakharova, V. V., Magnitov, M. D., Del Maestro, L.,
moorthy, J., Wheeler, D., Holla, S., and Grewal,
Ulianov, S. V., Glentis, A., Uyanik, B., Williart, A.,
S. I. S. (2021) Spreading and epigenetic inheritance of
Karpukhina, A., Demidov, O., Joliot, V., Vassetzky, Y. S.,
heterochromatin require a critical density of histone H3
Mege, R. M., Piel, M., Razin, S. V., and Ait-Si-Ali, S.
lysine 9 tri-methylation, Proc. Natl. Acad. Sci. USA,
(2022) SETDB1 fuels the lung cancer phenotype by
118, e2100699118, doi: 10.1073/pnas.2100699118.
modulating epigenome, 3D genome organization and
8.
Schotta, G., Lachner, M., Sarma, K., Ebert, A.,
chromatin mechanical properties, Nucleic Acids Res.,
Sengupta, R., Reuter, G., Reinberg, D., and
50, 4389-4413, doi: 10.1093/nar/gkac234.
Jenuwein, T. (2004) A silencing pathway to induce
19.
Liu, Z., Liu, J., Ebrahimi, B., Pratap, U. P., He, Y.,
H3-K9 and H4-K20 trimethylation at constitutive
Altwegg, K. A., Tang, W., Li, X., Lai, Z., Chen, Y.,
heterochromatin, Genes Dev.,
18,
1251-1262,
Shen, L., Sareddy, G. R., Viswanadhapalli, S.,
doi: 10.1101/gad.300704.
Tekmal, R. R., Rao, M. K., and Vadlamudi, R. K.
9.
Padeken, J., Methot, S. P., and Gasser, S. M. (2022)
(2022) SETDB1 interactions with PELP1 contributes
Establishment of H3K9-methylated heterochro-
to breast cancer endocrine therapy resistance, Breast
matin and its functions in tissue differentiation and
Cancer Res., 24, 26, doi: 10.1186/s13058-022-01520-4.
maintenance, Nat. Rev. Mol. Cell Biol., 23, 623-640,
20.
Zhang, L., Tian, S., Zhao, M., Yang, T., Quan, S., Song, L.,
doi: 10.1038/s41580-022-00483-w.
and Yang, X. (2021) SUV39H1-mediated DNMT1 is
10.
Murakami, Y. (2013) Heterochromatin and Euchroma-
involved in the epigenetic regulation of Smad3 in cer-
tin, in Encyclopedia of Systems Biology (Dubitzky, W.,
vical cancer, Anticancer Agents Med. Chem., 21, 756-
Wolkenhauer, O., Cho, K.-H., and Yokota, H. eds)
765, doi: 10.2174/1871520620666200721110016.
Springer New York, New York, NY, pp. 881-884,
21.
Saha, N., and Muntean, A. G. (2021) Insight into the
doi: 10.1007/978-1-4419-9863-7_1413.
multi-faceted role of the SUV family of H3K9 methyl-
11.
Dimitrova, E., Turberfield, A. H., and Klose, R. J.
transferases in carcinogenesis and cancer progression,
(2015) Histone demethylases in chromatin biology and
Biochim. Biophys. Acta Rev. Cancer, 1875, 188498,
beyond, EMBO Rep., 16, 1620-1639, doi: 10.15252/
doi: 10.1016/j.bbcan.2020.188498.
embr.201541113.
22.
Vougiouklakis, T., Sone, K., Saloura, V., Cho, H. S., Su-
12.
Taylor-Papadimitriou, J., and Burchell, J. M. (2022)
zuki, T., Dohmae, N., Alachkar, H., Nakamura, Y., and
Histone methylases and demethylases regulating
Hamamoto, R. (2015) SUV420H1 enhances the phospho-
antagonistic methyl marks: changes occurring in
rylation and transcription of ERK1 in cancer cells, On-
cancer, Cells, 11, 1113, doi: 10.3390/cells11071113.
cotarget, 6, 43162-43171, doi: 10.18632/oncotarget.6351.
13.
Chen, Y., Ren, B., Yang, J., Wang, H., Yang, G.,
23.
Moshiri, A., Cheng, H., Kim, S., and Saloura, V. J.
Xu, R., You, L., and Zhao, Y. (2020) The role of
(2023) SUV420H1 as a novel target in HPV-negative
histone methylation in the development of digestive
head and neck squamous cell carcinoma, Cancer Res.,
cancers: a potential direction for cancer management,
83, 6284, doi: 10.1158/1538-7445.AM2023-6284.
Signal. Transduct. Target Ther., 5, 143, doi: 10.1038/
24.
Viotti, M., Wilson, C., McCleland, M., Koeppen, H.,
s41392-020-00252-1.
Haley, B., Jhunjhunwala, S., Klijn, C., Modrusan, Z.,
14.
Yang, Y., Zhang, M., and Wang, Y. (2022) The roles of
Arnott, D., Classon, M., Stephan, J. P., and Mellman, I.
histone modifications in tumorigenesis and associated
(2018) SUV420H2 is an epigenetic regulator of epithe-
inhibitors in cancer therapy, J. Natl. Cancer Center, 2,
lial/mesenchymal states in pancreatic cancer, J. Cell
277-290, doi: 10.1016/j.jncc.2022.09.002.
Biol., 217, 763-777, doi: 10.1083/jcb.201705031.
15.
Lee, S. H., Li, Y., Kim, H., Eum, S., Park, K., and
25.
Nachiyappan, A., Gupta, N., and Taneja, R. (2022)
Lee, C. H. (2022) The role of EZH1 and EZH2 in
EHMT1/EHMT2 in EMT, cancer stemness and
development and cancer, BMB Rep., 55, 595-601,
drug resistance: emerging evidence and mechanisms,
doi: 10.5483/BMBRep.2022.55.12.174.
FEBS J., 289, 1329-1351, doi: 10.1111/febs.16334.
16.
Duan, D., Shang, M., Han, Y., Liu, J., Liu, J., Kong,
26.
Alexandrova, E., Salvati, A., Pecoraro, G., Lamberti, J.,
S. H., Hou, J., Huang, B., Lu, J., and Zhang, Y. (2022)
Melone, V., Sellitto, A., Rizzo, F., Giurato, G.,
БИОХИМИЯ том 88 вып. 7 2023
НОВЫЙ МЕХАНИЗМ ДЕЙСТВИЯ ВОРИНОСТАТА
1201
Tarallo, R., Nassa, G., and Weisz, A. (2022) Histone
Eur. J. Pharmacol.,
944,
175590, doi:
10.1016/j.
methyltransferase DOT1L as a promising epigenetic
ejphar.2023.175590.
target for treatment of solid tumors, Front. Genet., 13,
36.
Hoy, S. M. (2020) Tazemetostat: first approval, Drugs,
864612, doi: 10.3389/fgene.2022.864612.
80, 513-521, doi: 10.1007/s40265-020-01288-x.
27.
Wu, Y., Wang, Z., Han, L., Guo, Z., Yan, B., Guo, L.,
37.
Richon, V. M. (2006) Cancer biology: mechanism of
Zhao, H., Wei, M., Hou, N., Ye, J., Wang, Z., Shi, C.,
antitumour action of vorinostat (suberoylanilide hy-
Liu, S., Chen, C., Chen, S., Wang, T., Yi, J., Zhou, J.,
droxamic acid), a novel histone deacetylase inhibitor,
Yao, L., Zhou, W., et al. (2022) PRMT5 regulates
Br. J. Cancer, 95, S2-S6, doi: 10.1038/sj.bjc.6603463.
RNA m6A demethylation for doxorubicin sensitivity in
38.
Siegel, D., Hussein, M., Belani, C., Robert, F.,
breast cancer, Mol. Ther., 30, 2603-2617, doi: 10.1016/
Galanis, E., Richon, V. M., Garcia-Vargas, J., Sanz-
j.ymthe.2022.03.003.
Rodriguez, C., and Rizvi, S. (2009) Vorinostat in solid
28.
Chen, Z., Gan, J., Wei, Z., Zhang, M., Du, Y.,
and hematologic malignancies, J. Hematol. Oncol., 2,
Xu, C., and Zhao, H. (2022) The emerging role
31, doi: 10.1186/1756-8722-2-31.
of PRMT6 in cancer, Front Oncol,
12,
841381,
39.
Singh, B. N., Zhang, G., Hwa, Y. L., Li, J., Dowdy,
doi: 10.3389/fonc.2022.841381.
S. C., and Jiang, S. W. (2010) Nonhistone protein
29.
Jiang, H., Li, Y., Xiang, X., Tang, Z., Liu, K., Su,
acetylation as cancer therapy targets, Expert Rev.
Q., Zhang, X., and Li, L. (2021) Chaetocin: A re-
Anticancer Ther., 10, 935-954, doi: 10.1586/era.10.62.
view of its anticancer potentials and mechanisms,
40.
Lee, Y. J., Won, A. J., Lee, J., Jung, J. H., Yoon, S.,
Eur. J. Pharmacol.,
910,
174459, doi:
10.1016/
Lee, B. M., and Kim, H. S. (2012) Molecular mech-
j.ejphar.2021.174459.
anism of SAHA on regulation of autophagic cell death
30.
Zhang, S., Guo, J., Zhang, H., Tong, L., and
in tamoxifen-resistant MCF-7 breast cancer cells,
Zhang, L. (2023) Gliotoxin induced ferroptosis by
Int. J. Med. Sci., 9, 881-893, doi: 10.7150/ijms.5011.
downregulating SUV39H1 expression in esophageal
41.
Brown, S., Pawlyn, C., Tillotson, A.-L., Sherratt, D.,
cancer cells, Recent Pat. Anticancer Drug Discov., 18,
Flanagan, L., Low, E., Morgan, G. J., Williams, C.,
397-407, doi: 10.2174/1574892817666220905114120.
Kaiser, M., Davies, F. E., and Jenner, M. W. (2021)
31.
Rahman, Z., Bazaz, M. R., Devabattula, G., Khan,
Bortezomib, vorinostat, and dexamethasone combina-
M. A., and Godugu, C. (2021) Targeting H3K9 meth-
tion therapy in relapsed myeloma: results of the phase 2
yltransferase G9a and its related molecule GLP as a
MUK four trial, Clin. Lymphoma Myeloma Leuk., 21,
potential therapeutic strategy for cancer, J. Biochem.
154-161.e153, doi: 10.1016/j.clml.2020.11.019.
Mol. Toxicol., 35, e22674, doi: 10.1002/jbt.22674.
42.
Bilotti, E., Vesole, D. H., McBride, L., Schmidt, L.,
32.
Lin, H. Y., Wu, H. J., Chen, S. Y., Hou, M. F., Lin,
Gao, Z., Gilani, M., McNeill, A., Bednarz, U.,
C. S., and Chu, P. Y. (2022) Epigenetic therapy com-
Richter, J., Mato, A., Graef, T., and Siegel, D. S.
bination of UNC0638 and CI-994 suppresses breast
(2016) Vorinostat in combination with lenalidomide
cancer via epigenetic remodeling of BIRC5 and
and dexamethasone in lenalidomide-refractory mul-
GADD45A, Biomed. Pharmacother.,
145,
112431,
tiple myeloma, Clin. Lymphoma Myeloma Leuk., 16,
doi: 10.1016/j.biopha.2021.112431.
558-562, doi: 10.1016/j.clml.2016.08.001.
33.
Rugo, H. S., Jacobs, I., Sharma, S., Scappaticci, F.,
43.
Wang, Y., Janku, F., Piha-Paul, S., Hess, K., Broad-
Paul, T. A., Jensen-Pergakes, K., and Malouf, G. G.
dus, R., Liu, L., Shi, N., Overman, M., Kopetz, S.,
(2020) The promise for histone methyltransferase
Subbiah, V., Naing, A., Hong, D., Tsimberidou,
inhibitors for epigenetic therapy in clinical oncology:
A. M., Karp, D., Yao, J., and Fu, S. (2020) Phase I
a narrative review, Adv. Ther.,
37,
3059-3082,
studies of vorinostat with ixazomib or pazopanib imply
doi: 10.1007/s12325-020-01379-x.
a role of antiangiogenesis-based therapy for TP53
34.
Stein, E. M., Garcia-Manero, G., Rizzieri, D. A.,
mutant malignancies, Sci. Rep., 10, 3080, doi: 10.1038/
Tibes, R., Berdeja, J. G., Savona, M. R., Jongen-
s41598-020-58366-z.
Lavrenic, M., Altman, J. K., Thomson, B., Blakemore,
44.
Prebet, T., Braun, T., Beyne-Rauzy, O., Dreyfus, F.,
S. J., Daigle, S. R., Waters, N. J., Suttle, A. B.,
Stammatoullas, A., Wattel, E., Ame, S., Raffoux, E.,
Clawson, A., Pollock, R., Krivtsov, A., Armstrong,
Delaunay, J., Charbonnier, A., Ades, L., Fenaux, P.,
S. A., DiMartino, J., Hedrick, E., Lowenberg, B.,
and Vey, N. (2014) Combination of vorinostat and low
and Tallman, M. S. (2018) The DOT1L inhibitor
dose cytarabine for patients with azacitidine-refracto-
pinometostat reduces H3K79 methylation and has
ry/relapsed high risk myelodysplastic syndromes, Leuk.
modest clinical activity in adult acute leukemia, Blood,
Res., 38, 29-33, doi: 10.1016/j.leukres.2013.07.023.
131, 2661-2669, doi: 10.1182/blood-2017-12-818948.
45.
DuBois, S. G., Granger, M. M., Groshen, S.,
35.
Marzochi, L. L., Cuzziol, C. I., Nascimento Filho, C.,
Tsao-Wei, D., Ji, L., Shamirian, A., Czarnecki, S.,
Dos Santos, J. A., Castanhole-Nunes, M. M. U.,
Goodarzian, F., Berkovich, R., Shimada, H.,
Pavarino, E. C., Guerra, E. N. S., and Goloni-
Villablanca, J. G., Vo, K. T., Pinto, N., Mosse, Y. P.,
Bertollo, E. M. (2023) Use of histone methyltransferase
Maris, J. M., Shusterman, S., Cohn, S. L., Goldsmith,
inhibitors in cancer treatment: a systematic review,
K. C., Weiss, B., Yanik, G. A., Twist, C. J., Irwin, M. S.,
11
БИОХИМИЯ том 88 вып. 7 2023
1202
МАКСИМОВА и др.
Haas-Kogan, D. A., Park, J. R., Marachelian, A.,
attenuates epidermoid squamous cell carcinoma growth
and Matthay, K. K. (2021) Randomized phase II trial
by dampening mTOR signaling pathway in a human
of MIBG versus MIBG, vincristine, and irinotecan
xenograft murine model, Toxicol. Appl. Pharmacol.,
versus MIBG and vorinostat for patients with
266, 233-244, doi: 10.1016/j.taap.2012.11.002.
relapsed or refractory neuroblastoma: a report from
55.
Poleshko, A., Kossenkov, A. V., Shalginskikh, N.,
NANT consortium, J. Clin. Oncol., 39, 3506-3514,
Pecherskaya, A., Einarson, M. B., Skalka, A. M.,
doi: 10.1200/JCO.21.00703.
and Katz, R. A. (2014) Human factors and pathways
46.
Huang, P. H., Chen, C. H., Chou, C. C., Sargeant,
essential for mediating epigenetic gene silencing,
A. M., Kulp, S. K., Teng, C. M., Byrd, J. C., and
Epigenetics, 9, 1280-1289, doi: 10.4161/epi.32088.
Chen, C. S. (2011) Histone deacetylase inhibitors stim-
56.
Xiao, W., Chen, X., Liu, X., Luo, L., Ye, S., and Liu, Y.
ulate histone H3 lysine 4 methylation in part via tran-
(2014) Trichostatin A, a histone deacetylase inhibitor,
scriptional repression of histone H3 lysine 4 demeth-
suppresses proliferation and epithelial-mesenchymal
ylases, Mol. Pharmacol., 79, 197-206, doi: 10.1124/
transition in retinal pigment epithelium cells, J. Cell.
mol.110.067702.
Mol. Med., 18, 646-655, doi: 10.1111/jcmm.12212.
47.
Li, C. T., Hsiao, Y. M., Wu, T. C., Lin, Y. W., Yeh,
57.
Christman, J. K. (2002) 5-Azacytidine and 5-aza-2′-
K. T., and Ko, J. L. (2011) Vorinostat, SAHA, re-
deoxycytidine as inhibitors of DNA methylation:
presses telomerase activity via epigenetic regulation
mechanistic studies and their implications for can-
of telomerase reverse transcriptase in non-small cell
cer therapy, Oncogene, 21, 5483-5495, doi: 10.1038/
lung cancer cells, J. Cell Biochem., 112, 3044-3053,
sj.onc.1205699.
doi: 10.1002/jcb.23229.
58.
Jin, M. Z., Xia, B. R., Xu, Y., and Jin, W. L. (2018)
48.
Natarajan, U., Venkatesan, T., and Rathinavelu, A.
Curaxin CBL0137 exerts anticancer activity via diverse
(2021) Effect of the HDAC inhibitor on histone
mechanisms, Front. Oncol., 8, 598, doi: 10.3389/
acetylation and methyltransferases in A2780 ovarian
fonc.2018.00598.
cancer cells, Medicina (Kaunas), 57, 456, doi: 10.3390/
59.
Zhou, D., Park, J. G., Wu, Z., Huang, H., Fiches,
medicina57050456.
G. N., Biswas, A., Li, T. W., Ma, Q., Martinez-
49.
Nordstrom, L., Andersson, E., Kuci, V., Gustavsson, E.,
Sobrido, L., Santoso, N., and Zhu, J. (2021) FACT
Holm, K., Ringner, M., Guldberg, P., and Ek, S.
subunit SUPT16H associates with BRD4 and con-
(2015) DNA methylation and histone modifications
tributes to silencing of antiviral interferon signaling,
regulate SOX11 expression in lymphoid and solid
bioRxiv, doi: 10.1101/2021.04.21.440833.
cancer cells, BMC Cancer, 15, 273, doi: 10.1186/
60.
Gabellini, D., and Pedrotti, S. (2022) The SUV4-
s12885-015-1208-y.
20H histone methyltransferases in health and disease,
50.
Poleshko, A., Einarson, M. B., Shalginskikh, N.,
Int. J. Mol. Sci., 23, 4736, doi: 10.3390/ijms23094736.
Zhang, R., Adams, P. D., Skalka, A. M., and Katz,
61.
Lachner, M., O’Carroll, D., Rea, S., Mechtler, K.,
R. A. (2010) Identification of a functional network
and Jenuwein, T. (2001) Methylation of histone H3
of human epigenetic silencing factors, J. Biol. Chem.,
lysine 9 creates a binding site for HP1 proteins, Nature,
285, 422-433, doi: 10.1074/jbc.M109.064667.
410, 116-120, doi: 10.1038/35065132.
51.
Maksimova, V., Shalginskikh, N., Vlasova, O., Usalka, O.,
62.
Ren, W., Fan, H., Grimm, S. A., Kim, J. J., Li, L.,
Beizer, A., Bugaeva, P., Fedorov, D., Lizogub, O., Le-
Guo, Y., Petell, C. J., Tan, X.-F., Zhang, Z.-M.,
sovaya, E., Katz, R., Belitsky, G., Kirsanov, K., and
Coan, J. P., Yin, J., Kim, D. I., Gao, L., Cai, L.,
Yakubovskaya, M. (2021) HeLa TI cell-based assay
Khudaverdyan, N., Çetin, B., Patel, D. J., Wang, Y.,
as a new approach to screen for chemicals able to
Cui, Q., Strahl, B. D., Gozani, Or, Miller, K. M.,
reactivate the expression of epigenetically silenced
O’Leary, S. E., Wade, P. A., Wang, G. G., and Song, J.
genes, PLoS One, 16, e0252504, doi: 10.1371/journal.
(2021) DNMT1 reads heterochromatic H4K20me3 to
pone.0252504.
reinforce LINE-1 DNA methylation, Nat. Commun.,
52.
Kruger, N. J. (2009) The Bradford Method For
12, 2490, doi: 10.1038/s41467-021-22665-4.
Protein Quantitation, in The Protein Protocols
63.
Dang-Nguyen, T. Q., Haraguchi, S., Furusawa, T.,
Handbook (Walker, J. M., ed.) Humana Press, Totowa,
Somfai, T., Kaneda, M., Watanabe, S., Akagi, S.,
NJ, pp. 17-24, doi: 10.1007/978-1-59745-198-7_4.
Kikuchi, K., Tajima, A., and Nagai, T. (2013) Down-
53.
Suzuki, T., Kasuya, Y., Itoh, Y., Ota, Y., Zhan, P.,
regulation of histone methyltransferase genes SUV39H1
Asamitsu, K., Nakagawa, H., Okamoto, T., and
and SUV39H2 increases telomere length in embryonic
Miyata, N. (2013) Identification of highly selective and
stem-like cells and embryonic fibroblasts in pigs, J. Re-
potent histone deacetylase 3 inhibitors using click chem-
prod. Dev., 59, 27-32, doi: 10.1262/jrd.2012-118.
istry-based combinatorial fragment assembly, PLoS
64.
Abini-Agbomson, S., Gretarsson, K., Shih, R. M.,
One, 8, e68669, doi: 10.1371/journal.pone.0068669.
Hsieh, L., Lou, T., Ioannes, P. D., Vasilyev, N., Lee, R.,
54.
Kurundkar, D., Srivastava, R. K., Chaudhary, S. C.,
Wang, M., Simon, M., Armache, J.-P., Nudler, E.,
Ballestas, M. E., Kopelovich, L., Elmets, C. A., and
Narlikar, G., Liu, S., Lu, C., and Armache, K.-J.
Athar, M. (2013) Vorinostat, an HDAC inhibitor
(2023) Catalytic and non-catalytic mechanisms of
БИОХИМИЯ том 88 вып. 7 2023
НОВЫЙ МЕХАНИЗМ ДЕЙСТВИЯ ВОРИНОСТАТА
1203
histone H4 lysine 20 methyltransferase SUV420H1,
Walker, K., Rolfe, P. A., Herbolsheimer, E., Zeit-
bioRxiv, doi: 10.1101/2023.03.17.533220.
linger, J., Lewitter, F., Gifford, D. K., and Young,
65. Nicetto, D., and Zaret, K. S. (2019) Role of H3K9me3
R. A.
(2005) Genome-wide map of nucleosome
heterochromatin in cell identity establishment and
acetylation and methylation in yeast, Cell, 122, 517-
maintenance, Curr. Opin. Genet. Dev.,
55,
1-10,
527, doi: 10.1016/j.cell.2005.06.026.
doi: 10.1016/j.gde.2019.04.013.
70. Shi, B., Behrens, C., Vaghani, V., Riquelme, E. M.,
66. Tachibana, M., Matsumura, Y., Fukuda, M., Kimu-
Rodriguez-Canales, J., Kadara, H., Lin, H., Lee, J.,
ra, H., and Shinkai, Y. (2008) G9a/GLP complexes
Liu, H., Wistuba, I., and Simon, G. (2019) Oncogenic
independently mediate H3K9 and DNA methylation
enhancer of zeste homolog 2 is an actionable target in
to silence transcription, EMBO J., 27, 2681-2690,
patients with non-small cell lung cancer, Cancer Med.,
doi: 10.1038/emboj.2008.192.
8, 6383-6392, doi: 10.1002/cam4.1855.
67. Shah, S., and Henriksen, M. A. (2011) A novel dis-
71. Petruccelli, L. A., Dupere-Richer, D., Pettersson, F.,
rupter of telomere silencing
1-like (DOT1L) in-
Retrouvey, H., Skoulikas, S., and Miller, W. H., Jr.
teraction is required for signal transducer and
(2011) Vorinostat induces reactive oxygen species and
activator of transcription 1 (STAT1)-activated gene ex-
DNA damage in acute myeloid leukemia cells, PLoS
pression, J. Biol. Chem., 286, 41195-41204, doi: 10.1074/
One, 6, e20987, doi: 10.1371/journal.pone.0020987.
jbc.M111.284190.
72. Attia, S. M., Al-Khalifa, M. K., Al-Hamamah, M. A.,
68. Song, Y., Wu, F., and Wu, J. (2016) Targeting histone
Alotaibi, M. R., Attia, M. S. M., Ahmad, S. F.,
methylation for cancer therapy: enzymes, inhibitors,
Ansari, M. A., Nadeem, A., and Bakheet, S. A.
biological activity and perspectives, J. Hematol. Oncol.,
(2020) Vorinostat is genotoxic and epigenotoxic in
9, 49, doi: 10.1186/s13045-016-0279-9.
the mouse bone marrow cells at the human equivalent
69. Pokholok, D. K., Harbison, C. T., Levine, S.,
doses, Toxicology, 441, 152507, doi: 10.1016/j.tox.
Cole, M., Hannett, N. M., Lee, T. I., Bell, G. W.,
2020.152507.
HISTONE METHYLTRANSFERASES
AS A NEW TARGET FOR THE EPIGENETIC ACTION BY VORINOSTAT
V. P. Maksimova1#, J. V. Makus1,2#, V. G. Popova1,3, A. Yu. Prus1,4, O. G. Usalka1,5,
E. S. Trapeznikova5, E. M. Zhidkova1, G. A. Belitsky1,
M. G. Yakubovskaya1, and K. I. Kirsanov1,2*
1 National Medical Research Center of Oncology named after N. N. Blokhin,
115478 Moscow, Russia; e-mail: kkirsanov85@yandex.ru
2 Peoples’ Friendship University of Russia, 117198 Moscow, Russia
3 Russian University of Chemical Technology named after D. I. Mendeleev, 125047 Moscow, Russia
4 MIREA - Russian Technological University, 119571 Moscow, Russia
5 I. M. Sechenov First Moscow State Medical University
of the Ministry of Health of the Russian Federation (Sechenov University), 119991 Moscow, Russia
Aberrant methylation and acetylation of histones are characteristic changes in the system of epigenetic reg-
ulation of gene expression accompanying the process of malignant transformation of the cell. Vorinostat is
the epigenetic modulator that actively used in clinical oncology practice. The antitumor activity of vorinos-
tat is considered to be associated with only with the inhibition of histone deacetylases. The effects of this
drug on histone methylation have not been sufficiently studied. Using the HeLa TI test system, which allows
evaluating the integral effect of epigenetically active compounds by activating the expression of the reporter
gene GFP, and knockdown of genes by small interfering RNAs, we showed that the inhibitory effect of vori-
nostat is directed not only at HDAC1, but also at EZH2, SUV39H1, SUV39H2, SUV420H1. Using Western
blotting, the ability of vorinostat to suppress the expression of enzymes EZH2, SUV39H1/2, SUV420H1
was confirmed and, in addition, its ability to inhibit the expression of enzymes SUV420H2 and DOT1L was
revealed. The data obtained expand the understanding of the epigenetic effects of vorinostat and demon-
strate the need for a large-scale analysis of its activity in relation to other epigenetic enzymes. A detailed
understanding of the mechanism of epigenetic action of vorinostat will contribute to its more adequate use
in the treatment of tumors with an aberrant epigenetic profile.
Keywords: malignant neoplasms with aberrant epigenetic profile, vorinostat, SAHA, histone methylation, histone
methyltransferases (HMTs), HeLa TI test system, SUV39H1, SUV39H2, EZH2, SUV420H1, SUV420H2, DOT1L
БИОХИМИЯ том 88 вып. 7 2023
11*