БИОХИМИЯ, 2023, том 88, вып. 7, с. 1223 - 1236
УДК 577.218;616-006.81.04
ВЛИЯНИЕ ВНЕКЛЕТОЧНОЙ ДНК ИЗ СЫВОРОТКИ КРОВИ
ЗДОРОВЫХ МЫШЕЙ И МЫШЕЙ С МЕТАСТАТИЧЕСКОЙ
МЕЛАНОМОЙ В16 НА ИЗМЕНЕНИЕ ОНКОГЕННЫХ
СВОЙСТВ КЛЕТОК МЕЛАНОМЫ
© 2023 А.А. Филатова1,2, Л.А. Алексеева1, И.А. Савин1, А.В. Сенькова1,
М.А. Зенкова1, Н.Л. Миронова1*
1 Институт химической биологии и фундаментальной медицины, СО РАН,
630090 Новосибирск, Россия; электронная почта: mironova@niboch.nsc.ru
2 Новосибирский государственный университет, факультет естественных наук,
630090 Новосибирск, Россия
Поступила в редакцию 31.01.2023
После доработки 13.03.2023
Принята к публикации 13.03.2023
В настоящее время значительное повышение уровней внеклеточной ДНК (внДНК) в крови паци-
ентов является общепризнанным маркером развития онкологических заболеваний. Несмотря на то
что такая опухоль-ассоциированная внДНК хорошо изучена, ее биологические функции остаются
невыясненными. В данной работе мы исследовали влияние внДНК, выделенной из сыворотки кро-
ви мышей с метастатической меланомой B16-F10, на поведение клеток меланомы B16-F10 in vitro.
Было обнаружено, что состав внДНК мышей с меланомой значительно отличается от внДНК
сыворотки крови здоровых мышей и по представленности онкогенов и мобильных генетических
элементов (МГЭ) схож с геномной ДНК клеток B16. Показано, что внДНК из сыворотки крови
мышей с меланомой проникала в клетки В16, вследствие чего в клетках увеличивалась представ-
ленность фрагментов онкогенов и МГЭ, и вызывала увеличение экспрессии мРНК Dnase1l3, коди-
рующего секретируемую ДНКазу, в 5 раз при отсутствии изменения экспрессии мРНК онкогенов
Jun, Fos, Ras и Myc. ВнДНК здоровых мышей вызывала активацию экспрессии мРНК EndoG, коди-
рующего внутриклеточную регуляторную ДНКазу, и повышение в 4 раза экспрессии мРНК онко-
генов Fos и Ras, являющихся триггерами большого числа сигнальных каскадов от ингибирования
апоптоза до усиления пролиферации опухолевых клеток. Таким образом, очевидно, что циркули-
рующая внДНК способна проникать в клетки и, несмотря на то что не было обнаружено измене-
ний на уровне жизнеспособности и миграционной активности опухолевых клеток, внДНК даже
при однократном воздействии способна вызывать на клеточном уровне изменения, усиливающие
онкогенность клеток-реципиентов.
КЛЮЧЕВЫЕ СЛОВА: циркулирующие внеклеточные ДНК, меланома B16.
DOI: 10.31857/S0320972523070114, EDN: FYAWBZ
ВВЕДЕНИЕ
окружения, гибнущие при развитии заболева-
ния; и клетки иммунной системы, преимуще-
Развитие онкологических заболеваний у па-
ственно макрофаги и нейтрофилы [2]. Состав
циентов часто сопровождается повышением
циркулирующих внДНК зависит от типа онко-
уровня циркулирующих внеклеточных ДНК
логического заболевания и его стадии, поэтому
(внДНК) в крови [1]. Существует три основных
многие исследователи используют анализ про-
источника внДНК: опухолевые клетки, как на-
филя внДНК для диагностики и мониторинга
ходящиеся в первичном опухолевом узле, так
опухолевого процесса. Для некоторых типов
и циркулирующие в кровотоке при запущен-
рака, где состав внДНК в основном отражает
ных стадиях заболевания; клетки опухолевого особенности ДНК и хроматина опухолевой
Принятые сокращения: внДНК - внеклеточные ДНК; МГЭ - мобильные генетические элементы; h-внДНК - внДНК
здоровых мышей; В16-ДНК - суммарная ДНК клеток В16; B16CM-внДНК - внДНК из кондиционной среды клеток В16;
В16S-внДНК - внДНК мышей с метастатической меланомой В16; NET - нейтрофильные внеклеточные ловушки.
* Адресат для корреспонденции.
1223
1224
ФИЛАТОВА и др.
клетки, в пуле внДНК анализируют геномный
с различными метастатическими формами
и эпигеномный профили, что позволяет оце-
опухолей коррелировало с уменьшением первич-
нить опухолевую нагрузку и скорректировать
ного опухолевого узла и снижением количества
лечение [3]. Анализ соотношения мутантных
метастазов, что говорит о функциональной зна-
фрагментов онкогенов, ретротранспозонов и
чимости внДНК в опухолевой прогрессии [15-
мобильных генетических элементов (МГЭ),
17]. Стоит отметить, что внДНК является ком-
изменения метилирования внДНК с успехом
понентом опухолевого окружения, постоянно
применяют в клинических и преклинических
присутствующим в высокой концентрации и
исследованиях [4-6].
потенциально влияющим как на сами опу-
Несмотря на то что предпринимаются ак-
холевые клетки, так и на клетки опухолевого
тивные попытки исследовать состав внДНК,
микроокружения. Однако до сих пор нет ра-
выполнено не так много исследований, посвя-
бот, описывающих влияние внДНК на сами
щенных функциональной роли внДНК. Отно-
опухолевые клетки, несмотря на то что накоп-
сительно хорошо изученными являются так
лены данные о возможности взаимодействия
называемые нейтрофильные внеклеточные ло-
внДНК с их рецепторами [9]. Таким образом,
вушки (NET), которые образуются из нейтро-
изучение влияния внДНК на опухолевые клет-
филов при выбрасывании собственного геном-
ки является актуальной задачей и может быть
ного материала и содержимого гранул с фор-
важным для раскрытия фундаментальных про-
мированием обширной сети, в том числе и в
цессов онкогенеза.
опухолевом окружении [7]. Образование NET
Целью данной работы является изучение
в опухолевом окружении провоцирует рост
биологических эффектов, которые оказывает
опухоли и ее инвазию [8]. Для некоторых ти-
внДНК, выделенная из сыворотки крови мышей
пов опухолевых клеток показано наличие
с метастатической меланомой B16, на клет-
рецептора CCDC25, селективно узнающего
ки B16 in vitro. Показано, что внДНК способна
именно ДНК-составляющую NET по остаткам
проникать в клетки-реципиенты и вызывать
8-OH-дезоксигуанозина (8-OHdG) и активи-
в них активацию экспрессии внутриклеточ-
рующего миграцию опухолевых клеток по пути
ных и секреторных ДНКаз, а также онкогенов
ILK-PARVB [9].
Fos и Ras, являющихся триггерами множества
Некоторые исследователи предполагают,
сигнальных каскадов от блокировки апоптоза
что циркулирующая внДНК может участвовать
до усиления пролиферации. Несмотря на то
в горизонтальном переносе, проникая в здоро-
что внДНК не влияла на жизнеспособность и
вые клетки организма и вызывая в них измене-
миграционную активность клеток-реципиен-
ния, приводящие к формированию опухолевого
тов, вызванная внДНК активация экспрессии
микроокружения, преметастатической ниши и
ДНКаз и онкогенов может вносить существен-
метастазов [10]. В области изучения эффектов
ный вклад в процесс усиления онкогенных
опухолеспецифической внДНК на развитие па-
свойств опухолевых клеток.
тологических процессов выполнено лишь не-
сколько пионерских работ [11-13]. Была об-
наружена способность опухолеспецифической
МАТЕРИАЛЫ И МЕТОДЫ
внДНК, полученной от пациентов с колорек-
тальным раком, проникать в фибробласты
Опухолевые клетки. Клетки меланомы
мыши [11]. Была показана способность внДНК
В16-F10 (далее, клетки В16) были приобре-
и хроматина из сыворотки крови пациентов с
тены в Институте цитологии РАН (Санкт-
различными типами рака при проникновении
Петербург, Россия). Клетки В16 инкубирова-
в клетку попадать в ядро и интегрироваться в
ли в среде DMEM («ThermoFisher Scientific»,
геном клетки-реципиента [13]. В недавней ра-
США) с
10%-ной эмбриональной телячь-
боте Souza et al. [14] показано, что внДНК из
ей сывороткой
(«ThermoFisher Scientific»),
крови больных раком предстательной железы
1%-ным раствором антибиотика-антимико-
поглощалась клетками неопухолевых линий
тика (100 ед./мл пенициллина, 100 мкг/мл
предстательной железы (RWPE-1 и PNT-2),
стрептомицина и 0,25 мкг/мл амфотерицина;
что приводило к изменению экспрессии ряда
«ThermoFisher Scientific») в атмосфере 5% СО2
генов и миРНК, связанных с онкогенезом,
при 37 °С (стандартные условия) и регулярно
и усилению миграционных свойств клеток.
пассировали для поддержания экспоненциаль-
В наших недавних работах было обнаружено,
ного роста.
что снижение концентрации опухолеспеци-
Мыши. В работе использовали 10-14-не-
фической внДНК под действием ДНКазы I
дельных мышей-самцов линии C57Bl/6 (да-
в сыворотке крови мышей-опухоленосителей
лее C57Bl) развода вивария ИХБФМ СО РАН
БИОХИМИЯ том 88 вып. 7 2023
ВЛИЯНИЕ ВНЕКЛЕТОЧНОЙ ДНК ИЗ СЫВОРОТКИ КРОВИ
1225
(Новосибирск, Россия). К началу эксперимен-
вали при 350 g в течение 20 мин при 4 °C, после
та масса животного (mean ± SD) составляла
чего супернатант удаляли. Клетки лизировали
20,0 ± 1,5 г. Животных содержали по 10 особей
в 600 мкл раствора, содержащего 100 мM Tris-HCl
в клетке в хорошо освещенном помещении.
(pH 8,0), 5 мM ЭДТА; 200 мM NaCl; 0,2% SDS
Мыши имели свободный доступ к еде и воде.
и 10 нг/мл протеиназы K в течение 4 ч при
Опухолевая модель. Для формирования
65 °C при постоянном перемешивании. Далее
метастатической модели меланомы В16 сус-
ДНК выделяли смесью фенол/хлороформ (1/1;
пензию клеток меланомы B16 (0,5 × 106 кле-
v/v), как описано выше, и осаждали 96%-ным
ток на мл) в 0,2 мл физиологического раствора
этанолом в присутствии 0,3 M ацетата натрия
(0,9%-ный водный раствор хлорида натрия)
при -20 °С в течение 18 ч. ДНК отделяли цен-
внутривенно вводили мышам. На 21-е сутки
трифугированием, осадок промывали 80%-ным
после введения опухолевых клеток прижиз-
этанолом, высушивали, растворяли в воде
ненно собирали кровь из ретро-орбитального
и хранили при -20 °С. Концентрацию ДНК
синуса, мышей подвергали эвтаназии путем
определяли с помощью Qubit™ fluorimeter и
дислокации шейных позвонков. Легкие соби-
Quant-iT™ dsDNA HS Assa kit.
рали и фиксировали в 10%-ном формалине
Исследование влияния внДНК на клетки ме-
(рН 7,0; «БиоВитрум», Россия) для последую-
ланомы В16. Клетки В16 высаживали в бессы-
щего патоморфологического исследования. Чис-
вороточной среде DMEM в 24-луночный план-
ло поверхностных метастазов в легких подсчи-
шет в плотности 0,5 × 106 клеток на лунку, чтобы
тывали с помощью бинокуляра.
через 12 ч клеточная культура достигла состоя-
Получение кондиционной среды. Клетки
ния 95%-ного конфлюэнтного монослоя. Че-
В16 инкубировали в бессывороточной среде
рез 24 ч среду заменяли на свежую бессыво-
DMEM в стандартных условиях в течение 24 ч.
роточную среду DMEM, добавляли h-внДНК
Среду собирали и использовали для выделе-
или B16S-внДНК до концентрации 100 нг/мл
ния внДНК.
и инкубировали в стандартных условиях в те-
Получение сыворотки крови. Образцы кро-
чение 24 ч. Клетки собирали, из одной части
ви здоровых мышей (0,2 мл) брали из ретро-
клеточного осадка выделяли суммарную ДНК
орбитального синуса. Сыворотку из образцов
экстракцией фенолом/хлороформом с после-
крови здоровых мышей и мышей с метаста-
дующим осаждением этанолом, как описано
тической меланомой В16 получали методом
выше. Из второй части клеточного осадка вы-
формирования тромба путем инкубации при
деляли РНК с помощью Trizol («ThermoFisher
37 °С в течение 30 мин с последующей инку-
Scientific»), согласно стандартному протоколу.
бацией при 4 °С в течение ночи. Тромб извле-
Качество и концентрацию выделенной РНК
кали и сыворотку центрифугировали (1500 g,
оценивали с помощью NanoDrop® ND-1000,
4 °С, 20 мин). Образцы сывороток хранили
качество и концентрацию ДНК оценивали
при -70 °С.
с помощью Qubit™ fluorimeter и Quant-iT™
Выделение внДНК. ВнДНК из кондицион-
dsDNA HS Assa kit.
ной среды (В16CM-внДНК), сыворотки крови
Определение количества последовательно-
здоровых мышей (h-внДНК) и мышей с мета-
стей (представленности) МГЭ и онкогенов во
статической меланомой В16 (В16S-внДНК)
внДНК с помощью qPCR. Количество последо-
выделяли экстракцией фенолом/хлороформом
вательностей МГЭ и онкогенов в составе B16-
(1/1; v/v) с последующим концентрированием
ДНК, В16CM-внДНК, h-внДНК и B16S-внДНК
методом обратимой сорбции на силикатном
определяли с помощью qPCR. Амплификацию
сорбенте с помощью QI Aquick Gel Extraction
проводили в реакционной смеси объемом 20 мкл,
kit («Qiagen», США) [17]. Чистоту выделен-
содержащей
0,1-0,5 нг ДНК, SYBR-Green-
ной ДНК оценивали с помощью NanoDrop®
containing Bio Master CorHS-qPCR («Биолаб-
ND-1000 («ThermoFisher Scientific»), концен-
микс», Россия) и по 0,6 мкМ прямого и об-
трацию измеряли с помощью Qubit™ fluorime-
ратного специфических праймеров к МГЭ
ter («Invitrogen», США) и Quant-iT™ dsDNA
(B1_mus2, L1td1) и онкогенам (Braf, Hmga2,
HS Assa kit («ThermoFisher Scientific»).
Myc, Fos, Jun, Ras, P53) (табл. 1). Условия реак-
Выделение суммарной ДНК из клеток В16
ции: 95 °C - 6 мин; 95 °C - 15 с, 60 °C - 20 с,
(В16-ДНК). С клеток В16 собирали среду, клет-
70 °C - 60 с, 50 циклов. В качестве референса
ки открепляли 0,25%-ным раствором трип-
использовался Gapdh.
сина в ЭДТА, промывали PBS, осаждали цен-
Определение уровня экспрессии МГЭ, ДНКаз
трифугированием при 300 g в течение 5 мин.
и онкогенов с помощью RT-qPCR. Для при-
Клеточный осадок обрабатывали 0,25%-ным
готовления кДНК использовали реакцион-
раствором трипсина в ЭДТА и центрифугиро-
ную смесь объемом 40 мкл, содержащую 2 мкг
БИОХИМИЯ том 88 вып. 7 2023
1226
ФИЛАТОВА и др.
Таблица 1. Последовательность праймеров, использованных в работе
Последовательности праймеров 5′→3′
Наименование
прямой праймер
обратный праймер
Праймеры для qPCR
B1_mus2
GAGACAGGCGGATTTCTGAGT
TGTAGCCCTGGCTGTCCT
L1td1
GCCAGGTATCTGTGCATCTT
ACTCTAGCTCTCTCCTGAGTTT
Braf
GCTCACAGACTAGGCGTAAAT
GGAGAGACAAGTGCTGTAGAAG
Hmga2
CCTTCACAGTCCCAGGTTTAG
AAGAGAGCTTGTGGGCTTATC
Myc
CGACTACGACTCCGTACAGC
CCAGATATCCTCACTGGGCG
Fos
GAGAATCCGAAGGGAAAGGAATA
GTAGGTGAAGACGAAGGAAGAC
Jun
GTTGAGCTCAGGCTGGATAAG
CTGTGCGAACTGGTATGAGTATAG
Ras
GCTCTGTGTCCATCTACTCATC
AGCCATCAAAGTCTCCTTATCC
P53
CAGTCTACTTCCCGCCATAAA
CAGCAGAGACCTGACAACTATC
Gapdh
AATGGTGAAGGTCGGTGTG
ACAAGCTTCCCATTCTCGG
Праймеры для RT-qPCR
L1td1 Orf1
GAACCAAGACCACTCACCATCA
CCCTGGACTGGGCGAAGT
L1td1 Orf2
GCGGTTCCTCAGAAAATTGG
TGCCCAGGAGAGGTATTGCT
Dnase1l3
TATCCACACCTCACTCCTATCC
CAACAGAGTCAAGGGCCATAA
Dffa
TGCCTTGAACTGGGACATAAA
GCTGAGGGTGTCTACCAATAAC
Dffb
CAGGAATAAGTCGGGCTATCTG
CGGTGCGCTTCTTCTCTATTA
Endog
GCTCCTTCACTCTGTGCTAAC
CCACGTGGTTCTTCCCAATAA
Fos
GAGAATCCGAAGGGAAAGGAATA
GTAGGTGAAGACGAAGGAAGAC
Jun
GTTGAGCTCAGGCTGGATAAG
CTGTGCGAACTGGTATGAGTATAG
Myc
CGACTACGACTCCGTACAGC
CCAGATATCCTCACTGGGCG
Ras
CAAGATGGATTGCACGCAGG
GCAGCCGATTGTCTGTTGTG
β-актин
AGCCATGTACGTAGCCATCCA
TCTCCGGAGTCCATCACAATG
суммарной клеточной РНК, 5 × ОТ-буфер mix
праймеров к МГЭ (L1td1 Orf1, L1td1 Orf2),
(«Биолабмикс»), 100 ед. обратной транскрип-
ДНКазам (Dnase1l3, Dffa, Dffb, Endog) и онко-
тазы MMuLV-RH («Биолабмикс») и 0,05 мкМ
генам (Fos, Jun, Myc, Ras) (табл. 1). Условия ре-
праймера dT15. Реакцию обратной транскрип-
акции: 95 °C - 6 мин; 95 °C - 15 с, 60 °C - 20 с,
ции проводили в следующем режиме: 42 °C -
70 °C - 60 с, 45 циклов. В качестве референса
1 ч, 70 °C - 10 мин.
использовался β-актин.
Реакционная смесь для qPCR объемом
Исследование влияния внДНК на жизнеспо-
25 мкл содержала 0,1-0,5 нг кДНК, БиоМа-
собность, миграционную активность и апоптоз
стер HS-qPCR SYBR Blue («Биолабмикс») и по
клеток B16. МТТ-тест. Клетки высаживали
0,6 мкМ прямого и обратного специфических
в 96-луночный планшет по 1,5 × 104 клеток на
БИОХИМИЯ том 88 вып. 7 2023
ВЛИЯНИЕ ВНЕКЛЕТОЧНОЙ ДНК ИЗ СЫВОРОТКИ КРОВИ
1227
лунку в бессывороточной среде DMEM. Через
(105 клеток/мышь), через 21 день проводили
24 ч среду заменяли на свежую бессывороточ-
забор крови, выводили мышей из экспери-
ную среду DMEM, добавляли h-внДНК или
мента и определяли количество поверхност-
B16S-внДНК до концентраций 5-100 нг/мл и
ных метастазов в легких. ВнДНК выделяли из
инкубировали в стандартных условиях в тече-
сыворотки крови, как описано в разделе «Ма-
ние 24 ч. Далее к клеткам добавляли раствор
териалы и методы». Схема получения образцов
МТТ до концентрации 0,5 мг/мл, инкубирова-
внДНК показана на рис. 1, а. При внутривен-
ли в течение 3 ч и анализировали, как описано
ном введении меланома B16 развивается в виде
ранее [18].
множественных метастатических опухолевых
Scratch-тест. Клетки в бессывороточ-
узлов, в первую очередь в легочной ткани жи-
ной среде DMEM высаживали в 6-луночный
вотных (рис. 1, б). На 21-е сутки развития опу-
планшет в плотности 1,5 × 106 клеток на лунку,
холи количество поверхностных метастазов в
чтобы через 12 ч клеточная культура достигла
среднем составило 50, однако при этом наблю-
состояния
90%-ного конфлюэнтного моно-
дался разброс в количестве метастазов на особь
слоя. В клеточном монослое наносили цара-
от 25 до 150 (рис. 1, в).
пины шириной 0,5 мм носиком пипетки на
Развитие опухолевого процесса (метаста-
200 мкл, трижды промывали PBS, добавляли
зы в легких) у мышей сопровождалось значи-
бессывороточную среду DMEM, h-внДНК
тельным повышением концентрации циркули-
или B16S-внДНК до концентрации 100 нг/мл
рующих внДНК в сыворотке крови мышей-
и инкубировали в стандартных условиях в те-
опухоленосителей (рис. 1, г). Так, медианное
чение 24 ч. Границы царапины маркировали и
значение концентрации внДНК в сыворот-
фотографировали зоны повреждения в тече-
ке крови мышей-опухоленосителей составило
ние суток с помощью микроскопа Zeiss Primo
1000 нг/мл, а разброс значений варьировал от
Vert («Zeiss», Германия). Скорость миграции
100 до 2500 нг/мл (рис. 1, г). Медианное значе-
клеток оценивали с помощью программного
ние концентрации внДНК сыворотки крови у
обеспечения ImageJ [17].
здоровых мышей было 35 нг/мл, а разброс зна-
Апоптоз. Клетки В16 высаживали в бес-
чений варьировал от 0 до 150 нг/мл (рис. 1, г).
сывороточной среде DMEM в 24-луночный
Для дальнейших экспериментов исполь-
планшет в плотности 0,5 × 106 клеток на лунку.
зовали сыворотки крови от мышей-опухоле-
Через 12 ч среду заменяли на свежую бессыво-
носителей с количеством поверхностных мета-
роточную среду DMEM, добавляли h-внДНК
стазов в легких не менее 25 и концентрацией
и B16S-внДНК до концентрации 100 нг/мл и
внДНК в сыворотке крови не менее 250 нг/мл,
инкубировали в стандартных условиях в тече-
а также сыворотки крови здоровых мышей с
ние 24 ч. Анализ апоптоза проводили с исполь-
концентрацией внДНК не менее 50 нг/мл. По-
зованием набора Annexin V-FITC («Abcam»,
сле выделения внДНК объединяли по группам.
Великобритания) в соответствии с протоко-
Таким образом, были получены объединен-
лом производителя на проточном цитометре
ные препараты внДНК животных-опухоле-
NovoCyte («ACEA Biosciences», США).
носителей (B16S-внДНК) и здоровых живот-
В качестве контроля для МТТ-теста, Scratch-
ных (h-внДНК). Также для сравнения состава
теста и определения уровня апоптоза исполь-
фрагментов была выделена внДНК из конди-
зовали клетки В16, инкубированные в бессы-
ционной среды клеток В16 (B16CM-внДНК) и
вороточной среде DMEM в течение 24 ч.
суммарная ДНК клеток В16 (В16-ДНК).
Статистический анализ. Для статистиче-
Препараты внДНК были охарактеризова-
ской обработки данных использовали t-тест
ны по уровню представленности фрагментов
критерия Стьюдента и однофакторный дис-
онкогенов и МГЭ методом qPCR. В табл. 2
персионный анализ ANOVA с апостериорным
приведены данные по представленности фраг-
критерием Тьюки (Tukey). Значение p ≤ 0,05
ментов МГЭ и онкогенов в B16CM-внДНК,
отражало статистически достоверные отличия.
h-внДНК и B16S-внДНК. Уровень представ-
Для статистического анализа использовали
ленности фрагментов МГЭ и онкогенов в
программу STATISTICA 10.0.
В16-ДНК был использован в качестве рефе-
ренса сравнения.
Видно, что последовательности МГЭ и
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
онкогенов слабо представлены в h-внДНК по
сравнению с их уровнями представленности
Получение и характеризация образцов внДНК
в В16-ДНК. Составы B16S-внДНК и B16CM-
из сыворотки крови. Мышам линии C57Bl
внДНК были похожи по уровню представленно-
внутривенно вводили клетки меланомы В16
сти выбранных фрагментов: последовательности
БИОХИМИЯ том 88 вып. 7 2023
1228
ФИЛАТОВА и др.
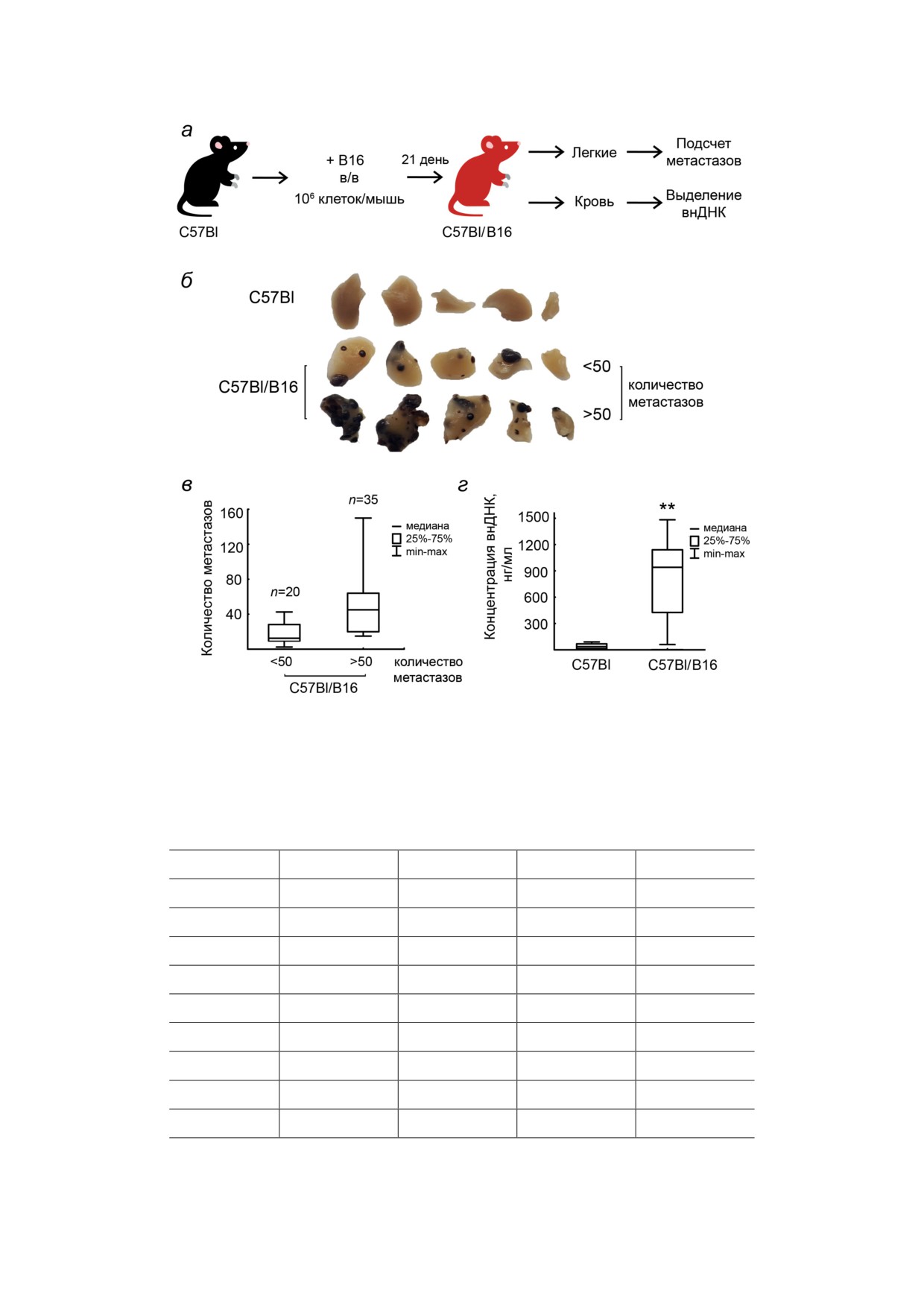
Рис. 1. Характеризация метастатической модели меланомы. a - Дизайн эксперимента. б - Легкие здоровых мышей
и мышей-опухоленосителей с количеством поверхностных метастазов <50 и >50. в - Разброс среди мышей-опу-
холеносителей с количеством метастазов <50 (n = 20) и >50 (n = 35). г - Концентрация внДНК в сыворотке крови
здоровых мышей и мышей-опухоленосителей с количеством метастазов >50 (n = 35). Данные проанализированы
с использованием однофакторного анализа ANOVA с апостериорным критерием Тьюки и представлены в виде медиа-
ны, ** p < 0,001
Таблица 2. Представленность фрагментов МГЭ и онкогенов в внДНК сыворотки крови здоровых мышей, мышей с
меланомой, геномной ДНК В16 и кондиционной среде клеток В16
Гены
h-внДНК
B16S-внДНК
B16CM-внДНК
B16-ДНК
B1_mus1
-
++
++
++
B1_mus2
-
++
++
++
L1td1 Orf2
-
++
++
++
Braf
-
-
-
-
Hmga2
-
-
-
-
Jun
-
-
-
-
Myc
-
++
++
+
Ras
-
+
++
+
P53
-
-
-
-
Примечание. Уровень представленности фрагментов онкогенов и МГЭ был определен с помощью qPCR. «-» - от-
носительное содержание последовательностей менее 0,3 отн. ед.; «+» - 0,3-0,7 отн. ед.; «++» - более 0,7 отн. ед.;
отн. ед. - относительные единицы, количество копий гена, нормированное на количество копий Gapdh.
БИОХИМИЯ том 88 вып. 7 2023
ВЛИЯНИЕ ВНЕКЛЕТОЧНОЙ ДНК ИЗ СЫВОРОТКИ КРОВИ
1229
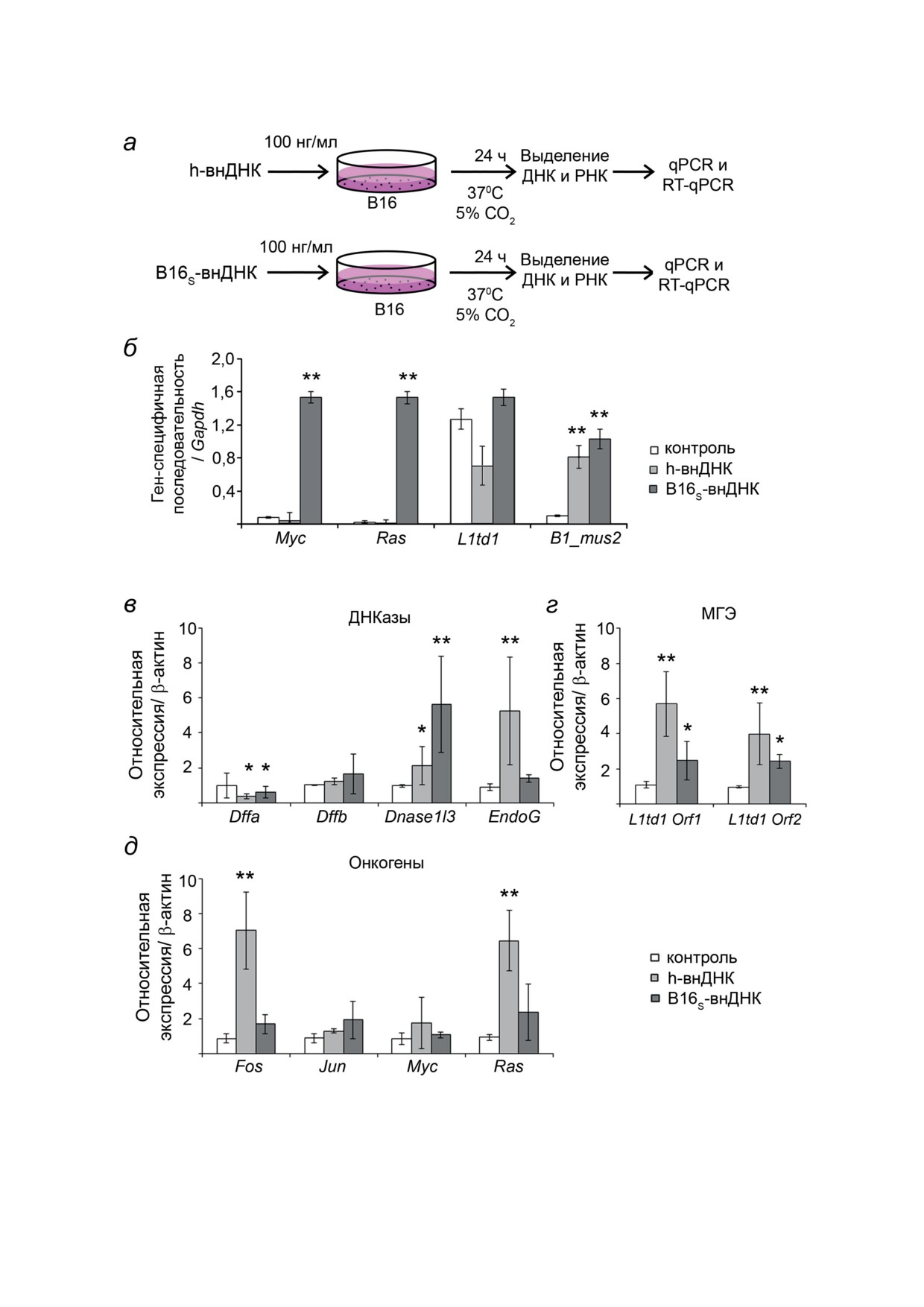
Рис. 2. Влияние B16S-внДНК на свойства клеток меланомы B16. a - Схема эксперимента. б - Изменение представлен-
ности фрагментов Myc, Ras, L1td1 и B1_mus2 в клетках B16 после инкубации с B16S-внДНК. Данные qPCR. В каче-
стве референсного гена использовали Gapdh. в-д - Влияние B16S-внДНК на уровни экспрессии ДНКаз (в), МГЭ (г)
и онкогенов (д) в клетках B16. Данные RT-qPCR. В качестве референсного гена использовали β-актин. Контроль -
интактные клетки. Данные анализировали с использованием критерия Стьюдента (t-тест) и представляли как
среднее ± SEM; * p < 0,05; ** p < 0,001
БИОХИМИЯ том 88 вып. 7 2023
1230
ФИЛАТОВА и др.
генов Hmga2, Braf, P53 и Jun детектировались
мы В16 значительно отличается от действия
слабо, последовательности B1_mus1, B1_mus2,
h-внДНК: для B16S-внДНК наблюдается зна-
L1td1 Orf2 и Myc были представлены на доста-
чительное увеличение уровня экспрессии
точно высоком уровне - более 0,7 относи-
Dnase1L3 по сравнению с интактными клет-
тельных единиц (отн. ед.) (табл. 2). Отличия
ками (контролем) и незначительное статисти-
были обнаружены только для гена Ras, пред-
чески недостоверное увеличение экспрессии
ставленность фрагментов которого в конди-
мРНК Dffb и EndoG (рис. 2, в). Интересно, что
ционной среде была выше как по сравнению с
внДНК обоих типов привели к достоверному
В16-ДНК, так и с B16S-внДНК.
снижению уровня экспрессии мРНК Dffa.
Изучение влияния B16S-внДНК на свойства
И B16S-внДНК и h-внДНК приводили к
клеток меланомы B16. Для изучения влияния
увеличению экспрессии мРНК L1td1 (Orf1 и
B16S-внДНК на свойства клеток B16 к клеткам
Orf2), однако более выраженный эффект был
в бессывороточной среде DMEM добавляли
отмечен для h-внДНК (рис. 2, г). Следует от-
h-внДНК или B16S-внДНК до концентрации
метить, что h-внДНК вызывала более значи-
100 нг/мл и инкубировали в стандартных усло-
мое изменение экспрессии генов в клетках ме-
виях в течение 24 ч. По окончании инкубации
ланомы В16, чем B16S-внДНК: h-внДНК вы-
клетки собирали, выделяли суммарную ДНК
зывала 4-кратное повышение уровня мРНК
и определяли представленность фрагментов
онкогенов Fos и Ras по сравнению с контро-
онкогенов (Myc, Ras) и МГЭ (B1_mus2, L1td1)
лем (рис. 2, д), тогда как B16S-внДНК вызы-
методом qPCR (рис. 2, а).
вала слабое статистически недостоверное по-
Из приведенных данных (рис. 2, б) видно,
вышение экспрессии всех четырех исследован-
что B16S-внДНК приводит к многократному
ных онкогенов (рис. 2, д).
увеличению представленности фрагментов обо-
Одной из задач данного исследования было
их онкогенов и B1_mus2. H-внДНК вызывала в
изучить, как внДНК опухолевого происхожде-
клетках меланомы В16 достоверное увеличение
ния влияет на жизнеспособность и миграци-
представленности только фрагментов B1_mus2
онную активность опухолевых клеток, и спо-
и не оказывала влияния на представленность
собна ли внДНК после попадания в опухолевые
онкогенов и фрагментов L1td1 (рис. 2, б).
клетки запускать в них апоптоз in vitro. Для
Ни h-внДНК, ни B16S-внДНК не вызывали в
определения уровня апоптоза клетки меланомы
клетках В16 достоверного изменения пред-
В16 инкубировали в присутствии B16S-внДНК
ставленности фрагментов L1td1. Таким обра-
в концентрации 100 нг/мл в течение 24 ч, а за-
зом, можно заключить, что внДНК способна
тем окрашивали аннексином V-FITC/PI и ана-
проникать в клетки меланомы В16.
лизировали с помощью проточной цитометрии
Помимо представленности фрагментов он-
(рис. 3, а). Жизнеспособность клеток В16 опре-
когенов и МГЭ для оценки изменений в клет-
деляли с помощью МТТ-теста после их инку-
ках-реципиентах после их инкубации с B16S-
бации в присутствии h-внДНК или B16S-внДНК
внДНК, оценивали изменение уровней мРНК
в концентрации 10-100 нг/мл в течение 24 ч
ряда ключевых ДНКаз (Dffa, Dffb, Dnase1L3,
(рис. 3, б). Влияние внДНК на миграцию клеток
EndoG), являющихся маркерами первичного
В16 исследовали методом «scratch»-теста: клет-
ответа клетки на присутствие экзогенной ДНК,
ки В16 инкубировали в присутствии h-внДНК
онкогенов (Ras, Myc, Fos, Jun), которые явля-
или B16S-внДНК в концентрации 100 нг/мл и
ются триггерами внутриклеточных процессов
тестировали скорость зарастания ими царапи-
и основными показателями клеточного мета-
ны, формируемой в монослое (рис 3, в и г).
болизма, и LINE-элемента L1td1 (Orf1, Orf2),
Оказалось, что ни h-внДНК, ни B16S-внДНК
указывающего на активацию/подавление ре-
не влияют на уровень апоптоза, жизнеспособ-
тротранспозиции (рис. 2, в).
ность и миграционные свойства клеток В16
Оказалось, что h-внДНК в 2 раза повышает
(рис. 3). Таким образом, аутологичная внДНК
уровень мРНК Dnase1L3, кодирующего внут-
не меняла макросвойства клеток меланомы ни
риклеточную секреторную ДНКазу, и вызыва-
в плане усиления проопухолевой активности
ет 5-кратное повышение уровня мРНК EndoG,
(пролиферация, миграция), ни в плане анти-
кодирующего ДНКазу, участвующую преиму-
опухолевой активности (апоптоз).
щественно в негативной регуляции апоптоза
и ограничивающую экспрессию другой секре-
торной ДНКазы - ДНКазы I (рис. 2, в). При
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
этом уровень экспрессии мРНК Dffb, коди-
рующей апоптотическую ДНКазу, не менял-
В настоящий момент накоплено большое
ся. Действие B16S-внДНК на клетки мелано-
количество данных о составе циркулирующих
БИОХИМИЯ том 88 вып. 7 2023
ВЛИЯНИЕ ВНЕКЛЕТОЧНОЙ ДНК ИЗ СЫВОРОТКИ КРОВИ
1231
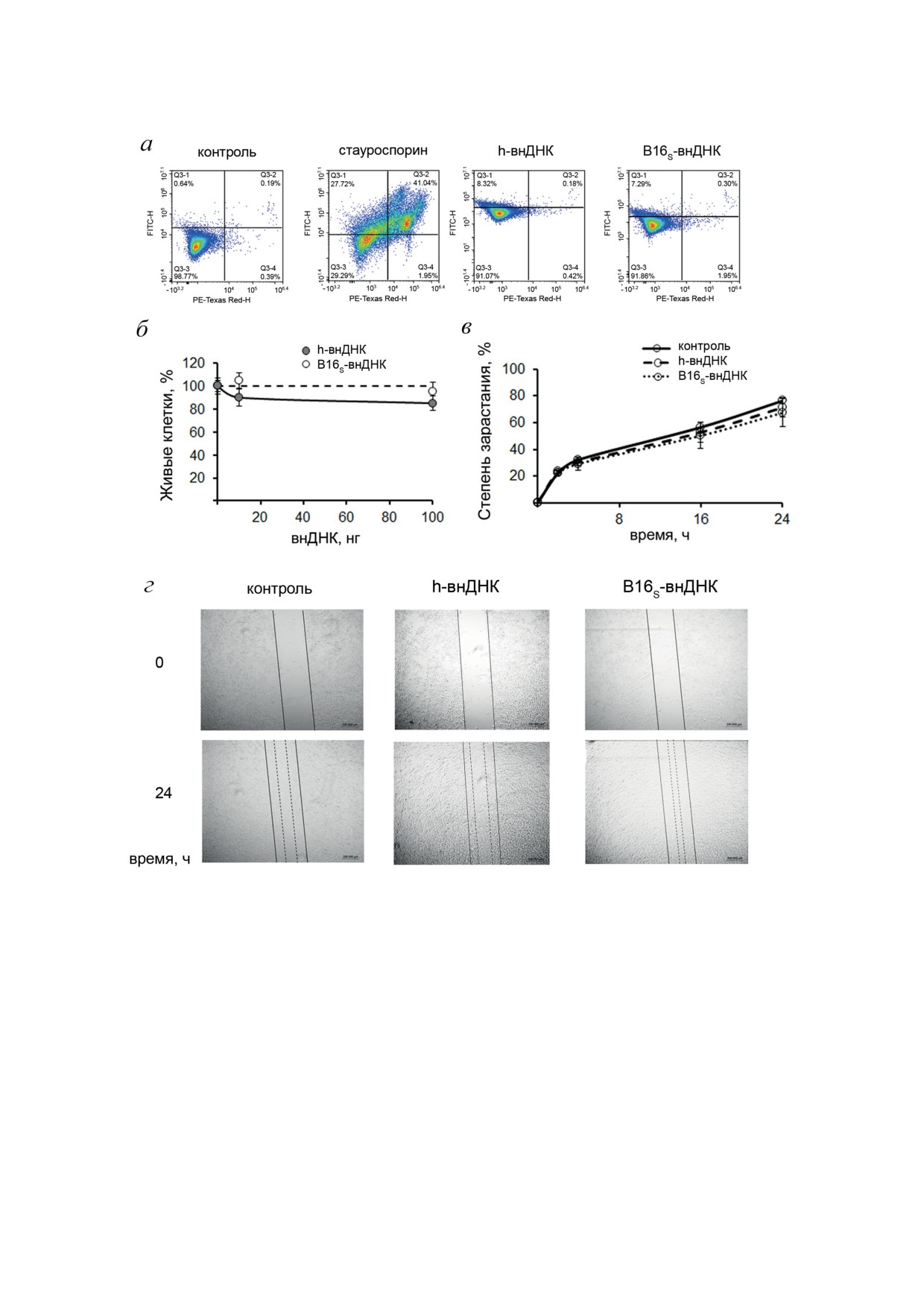
Рис. 3. Влияние B16S-внДНК на апоптоз, жизнеспособность и миграционную активность клеток меланомы В16.
а - Влияние внДНК на способность запускать апоптоз клеток B16. Результаты проточной цитометрии. Q3-1 -
аннексин V-FITC-/PI+, некроз; Q3-2 - аннексин V-FITC+/PI+, поздний апоптоз; Q3-3 - аннексин V-FITC-/PI-,
живые клетки; Q3-4 - аннексин V-FITC+/PI-, ранний апоптоз. Положительный контроль позднего апоптоза - клет-
ки В16, обработанные стауроспорином (0,1 мкг/1 млн клеток). б - Влияние внДНК на жизнеспособность клеток B16.
Данные МТТ-теста. Данные представлены как среднее ± SEM. в - Степень зарастания царапины клетками B16 через
24 ч инкубации с внДНК. Данные Scratch-теста. г - Фотографии зарастания царапин клетками B16 через 24 ч инку-
бации с внДНК (4-кратное увеличение). Сплошная линия - границы царапины в момент времени 0; пунктирные
линии - граница клеточного фронта через 24 ч. Контроль - интактные клетки В16 без обработки
внДНК в крови высших организмов при раз-
о возможной роли внДНК в канцерогенезе,
личных патологиях, но биологические функ-
что подтверждается некоторыми эксперимен-
ции внДНК до сих пор активно изучаются.
тальными данными [11, 13, 14, 19]. В несколь-
В клинической практике предпринимаются
ких работах было сделано предположение,
попытки использовать характеристики внДНК
что внДНК опухолевого происхождения, в со-
для ранней диагностики онкологических забо-
став которой в том числе входят и фрагменты
леваний [2]. Углубленное исследование харак-
онкогенов, может вести себя подобно онко-
теристик внДНК позволило поставить вопрос
вирусам, что открывает альтернативный путь
БИОХИМИЯ том 88 вып. 7 2023
1232
ФИЛАТОВА и др.
метастазирования [11, 13, 14]. Открытие ДНК-
апоптоза может объясняться видовым кон-
содержащих микровезикул и полученные до-
фликтом [21, 22]. И в данном исследовании, и
казательства горизонтального переноса ДНК
в работе Mitra et al. [13] использовались одни
для многих клеточных линий и организмов
и те же концентрации внДНК (100 нг/мл).
позволили укрепить эту гипотезу [19]. Несмо-
Тем не менее наши данные показали, что кон-
тря на то что накоплены некоторые данные о
центрации внДНК в крови животных-опу-
функциональном воздействии внДНК опухо-
холеносителей могут достигать
1500 нг/мл,
левого происхождения на здоровые клетки,
и поэтому в условиях организма постоянно
отсутствуют данные о влиянии такой внДНК
пополняющийся пул опухолеспецифической
на сами опухолевые клетки.
внДНК в высоких концентрациях может вызы-
Целью данной работы было исследование
вать более выраженные апоптотические сигна-
влияния циркулирующих B16S-внДНК на опу-
лы, сопровождающиеся усилением или ослаб-
холевые клетки для понимания механизмов,
лением инвазивных свойств опухолевых клеток.
опосредующих участие циркулирующих опу-
Тем не менее, несмотря на отсутствие эф-
холеспецифических внДНК в процессах онко-
фектов внДНК на жизнеспособность, апоптоз
трансформации. В нашей работе в качестве
и миграцию клеток меланомы В16, было обна-
внДНК опухолевого происхождения была ис-
ружено, что как B16S-внДНК, так h-внДНК
пользована B16S-внДНК из сыворотки крови
вызывают изменение уровней мРНК ряда клю-
мышей с метастатической меланомой В16, для
чевых генов: ДНКаз, как генов первичного
которой характерно образование большого
ответа на присутствие экзогенной ДНК; онко-
числа метастазов в легких и высокая концен-
генов, которые являются триггерами внутри-
трация внДНК в сыворотке крови. Принимая
клеточных каскадов, в том числе и каскадов,
во внимание, что клетки опухоли также испы-
опосредующих онкотрансформацию [23]; и ре-
тывают давление от внДНК, генерированных
тротранспозона L1td1.
здоровыми клетками, особенно на ранних ста-
Было показано, что ни один тип внДНК
диях развития опухоли, h-внДНК также была
не вызывал повышения уровня экспрессии
использована в экспериментах.
мРНК Dffb, кодирующего проапоптотическую
Нами было обнаружено, что состав B16S-
ДНКазу, что может быть признаком отсутствия
внДНК значительно отличается от состава
токсических эффектов внДНК. Тем не менее
h-внДНК и по представленности последова-
оба типа внДНК вызывали снижение уровня
тельностей онкогенов и МГЭ схож как с сум-
экспрессии мРНК ДНКазы Dffa, которая яв-
марной В16-ДНК, так и с B16CM-внДНК. Эти
ляется специфическим ингибитором ДНКазы
результаты подтверждают, что внДНК при мета-
Dffb. В норме оба белка находятся в форме
статической меланоме имеет преимуществен-
неактивного гетеродимера, и при возникнове-
но опухолевое происхождение и отражает со-
нии внешней угрозы в виде чужеродной ДНК
став геномной ДНК клеток В16, что позволяет
либо при увеличении общей концентрации
рассматривать данную внДНК как опухоле-
внутриклеточной ДНК происходит диссоциа-
специфичную. Это согласуется с тем, что ге-
ция гетеродимера с высвобождением активной
ном опухолевых клеток отличается от генома
субъединицы Dffb [24]. Для подавления избы-
нормальных клеток, и во многих случаях изме-
точного функционирования Dffb требуется
ненный профиль внДНК отражает превалиро-
новая порция Dffa, однако снижение экспрес-
вание в этом пуле ДНК из опухолевых клеток
сии мРНК Dffa, кодирующего белок-ингиби-
над ДНК из нормальных клеток [20].
тор, говорит о повышенной готовности клетки
Интересно, что ни B16S-внДНК, ни h-внДНК
к расщеплению ДНК [25].
не оказывали никаких эффектов как с точки
B16S-внДНК вызывала очень умеренное
зрения усиления проопухолевой активности,
повышение уровня мРНК гена, кодирующего
так и противоопухолевой активности. В работе
EndoG, нуклеазу широкого спектра действия,
Mitra et al. [13] было показано, что внДНК из
негативного регулятора апоптоза и участни-
крови пациентов с опухолями способна про-
ка процессов репарации [26]. В норме EndoG
никать в ядра клеток и адгезироваться хрома-
локализуется в митохондриях и только при
тином, что приводило к двуцепочечным раз-
разрушении митохондрий при апоптозе попа-
рывам в ДНК и, как следствие, запуску ран-
дает в ядро, где может приводить к разруше-
них стадий апоптоза в клетках-реципиентах.
нию хроматина, активации других ДНКаз и
Тем не менее следует отметить, что в работе
усилению апоптотического каскада [27]. По-
Mitra et al. [13] использовали внДНК человека,
лученные нами данные указывают на то, что
а в качестве клеток-реципиентов - фибро-
повышение уровня мРНК EndoG может кор-
бласты NIH3T3 мыши, поэтому индукция
релировать с ограничением запуска апоптоза.
БИОХИМИЯ том 88 вып. 7 2023
ВЛИЯНИЕ ВНЕКЛЕТОЧНОЙ ДНК ИЗ СЫВОРОТКИ КРОВИ
1233
Следует отметить, что под действием h-внДНК
личается от условно нормальной циркулирую-
уровень мРНК EndoG возрастал в значительно
щей внДНК, как правило, в сторону увеличе-
большей степени, чем под действием B16S-
ния представленности GC-богатых последо-
внДНК.
вательностей, что также может приводить к
B16S-внДНК вызывала значительное по-
изменению TLR9-сигналинга [34]. Опухоле-
вышение уровня мРНК Dnase1l3, кодирующе-
специфическая внДНК может характеризовать-
го секретируемую ДНКазу. Dnase1l3 способна
ся повышенной представленностью 8-охоdG,
расщеплять ДНК в ДНК-белковых комплек-
что влияет на ее узнавание рецепторами, и, со-
сах и является мощным инструментом защиты
ответственно, на запускаемые ею сигнальные
клеток от чужеродной ДНК либо собственной
пути в клетке [35]. Таким образом, уровень
ДНК при увеличении ее концентрации вслед-
активации внутриклеточных сигналов в опу-
ствие обменных процессов в организме [28,
холевых клетках под действием опухолеспе-
29]. Таким образом, инкубация клеток в при-
цифичной ДНК, которая является для клеток
сутствии внДНК приводит к включению меха-
В16 аутологичной, и условно нормальной ДНК
низмов защиты клетки от избыточной ДНК.
различается.
При анализе влияния B16S-внДНК на
уровни онкогенов в клетках В16 было обнару-
жено лишь слабое повышение уровня мРНК
ЗАКЛЮЧЕНИЕ
онкогенов Fos, Jun (кодирует регуляторы тран-
скрипции) и Ras (кодирует белок-мессенджер,
Суммируя все вышесказанное, можно за-
участвующий во многих сигнальных каска-
ключить, что как внДНК из сыворотки крови
дах). При этом h-внДНК приводила к значи-
здоровых мышей, так и внДНК из сыворот-
тельному (в 4 раза) повышению уровня мРНК
ки крови мышей с метастатической мелано-
онкогенов Fos и Ras относительно контро-
мой В16 при воздействии на клетки В16 вы-
ля, а повышения экспрессии Jun не наблюда-
зывает выраженный ответ: увеличение экс-
лось [30].
прессии внутриклеточных и секретируемых
Белки Jun и Fos склонны к димеризации,
ДНКаз, которые не только защищают клетку
и в норме существуют либо димеры Jun-Jun
от избыточной концентрации ДНК, но яв-
и Fos-Fos, обладающие относительно низкой
ляются регуляторами процессов апоптоза.
способностью связываться с ДНК [31], либо
ВнДНК здоровых мышей вызывала увеличе-
смешанные димеры Jun-Fos, более стабиль-
ние уровня мРНК онкогенов Fos и Ras, являю-
ные и обладающие более сильной ДНК-связы-
щихся триггерами большого числа сигнальных
вающей активностью по сравнению с гомоди-
каскадов от блокировки апоптоза до усиления
мерами [31]. Наблюдаемое повышение уровня
пролиферации опухолевых клеток. Активация
мРНК Fos свидетельствует об активации кле-
процессов транскрипции и внутриклеточного
точных каскадов, что может приводить к сти-
сигналинга в опухолевых клетках под дей-
муляции пролиферации и инвазии опухоле-
ствием внДНК обоих типов, продемонстри-
вых клеток. Наблюдаемое увеличение уровня
рованная in vitro, может усилить чувствитель-
мРНК Ras (ген малой GTPазы, являющейся
ность опухолевых клеток к другим стимулам
промежуточным звеном в цепи передачи сиг-
(гистонам, низкомолекулярным медиаторам,
налов во многих клеточных каскадах) также
факторам роста и т.д.), которые циркулируют в
является признаком активации клеточных ка-
кровотоке вместе с внДНК in vivo [36]. В итоге
скадов, приводящей к усилению онкотранс-
общая мобилизация клеточных процессов мо-
формации [32].
жет способствовать пролиферации опухолевых
Интересным результатом является обна-
клеток, формированию опухолевого микро-
руженная способность h-внДНК вызывать на
окружения, росту опухолевого узла, усилению
уровне мРНК активацию в опухолевых клетках
миграции и в конечном итоге усилению онко-
сигнальных путей, усиливающих онкотранс-
генеза, формированию преметастатической
формацию в значительно большей степени,
ниши и метастазированию.
чем B16S-внДНК. Опухолеспецифическая цир-
кулирующая внДНК отличается от условно нор-
Вклад авторов. М.Н.Л., З.М.А. - идея и
мальной циркулирующей внДНК измененным
руководство исследованием; Ф.А.А., А.Л.А.,
статусом метилирования и может активиро-
С.А.В., С.И.А. - проведение исследований;
вать сигнальные пути через внутриклеточные
А.Л.А., М.Н.Л. - обсуждение результатов экс-
TLR9-рецепторы, узнающие, как правило, неме-
периментов с согласованием со всеми автора-
тилированные СpG-мотивы [33]. Кроме того,
ми; Ф.А.А., А.Л.А., М.Н.Л. - написание руко-
GC-состав опухолеспецифической внДНК от-
писи; З.М.А. - редактирование рукописи.
13
БИОХИМИЯ том 88 вып. 7 2023
1234
ФИЛАТОВА и др.
Финансирование. Работа выполнена при
с рекомендациями по правильному использо-
поддержке Российского научного фонда (грант
ванию и уходу за лабораторными животными
№ 22-14-00289).
(Директива ЕСС 2010/63/ЕС). Все экспери-
Конфликт интересов. Авторы заявляют об
менты на животных были одобрены и выпол-
отсутствии конфликта интересов.
нены по рекомендациям биоэтического коми-
Соблюдение этических норм. Все процеду-
тета ФИЦ «Институт цитологии и генетики
ры с животными проводились в соответствии СО РАН» (Новосибирск, Россия).
СПИСОК ЛИТЕРАТУРЫ
1.
Oellerich, M., Schütz, E., Beck, J., Kanzow, P.,
disease, Trends Microbiol., 31, 280-293, doi: 10.1016/
Plowman, P. N., Weiss, G. J., and Walson, P. D.
j.tim.2022.10.002.
(2017) Using circulating cell-free DNA to monitor
8.
Sounbuli, K., Mironova, N., and Alekseeva, L. (2022)
personalized cancer therapy, Crit. Rev. Clin. Lab. Sci.,
Diverse neutrophil functions in cancer and promising
54, 205-218, doi: 10.1080/10408363.2017.1299683.
neutrophil-based cancer therapies, Int. J. Mol. Sci.,
2.
Balla, A., Bhak, J., and Biró, O. (2022) The application
23, 15827, doi: 10.3390/ijms232415827.
of circulating tumor cell and cell-free DNA liquid
9.
Yang, L., Liu, Q., Zhang, X., Liu, X., Zhou, B.,
biopsies in ovarian cancer, Mol. Cell Probes, 66,
Chen, J., Huang, D., Li, J., Li, H., Chen, F., Liu, J.,
101871, doi: 10.1016/j.mcp.2022.101871.
Xing, Y., Chen, X., Su, S., and Song, E.
(2020)
3.
Otandault, A., Anker, P., Al Amir Dache, Z.,
DNA of neutrophil extracellular traps promotes can-
Guillaumon, V., Meddeb, R., Pastor, B., Pisareva, E.,
cer metastasis via CCDC25, Nature, 583, 133-138,
Sanchez, C., Tanos, R., Tousch, G., Schwarzen-
doi: 10.1038/s41586-020-2394-6.
bach, H., and Thierry, A. R. (2019) Recent advances in
10.
García-Olmo, D. C., and García-Olmo, D. (2013)
circulating nucleic acids in oncology, Ann. Oncol., 30,
Biological role of cell-free nucleic acids in cancer:
374-384, doi: 10.1093/annonc/mdz031.
the theory of genometastasis, Crit. Rev. Oncog., 18,
4.
Thierry, A. R., El Messaoudi, S., Mollevi, C., Raoul,
153-161, doi: 10.1615/critrevoncog.v18.i1-2.90.
J. L., Guimbaud, R., Pezet, D., Artru, P., Assenat, E.,
11.
García-Olmo, D., García-Olmo, D. C., Domínguez-
Borg, C., Mathonnet, M., De La Fouchardière, C.,
Berzosa, C., Guadalajara, H., Vega, L., and García-
Bouché, O., Gavoille, C., Fiess, C., Auzemery, B.,
Arranz, M. (2012) Oncogenic transformation induced
Meddeb, R., Lopez-Crapez, E., Sanchez, C., Pastor, B.,
by cell-free nucleic acids circulating in plasma (ge-
and Ychou, M. (2017) Clinical utility of circulating
nometastasis) remains after the surgical resection of
DNA analysis for rapid detection of actionable
the primary tumor: a pilot study, Expert Opin. Biol.
mutations to select metastatic colorectal patients for
Ther., 12 Suppl
1, S61-S68, doi: 10.1517/14712598.
anti-EGFR treatment, Ann. Oncol., 28, 2149-2159,
2012.685151.
doi: 10.1093/annonc/mdx330.
12.
Olmedillas-López, S., García-Olmo, D. C., García-
5.
Bachet, J. B., Bouché, O., Taieb, J., Dubreuil, O.,
Arranz, M., Peiró-Pastor, R., Aguado, B., and García-
Garcia, M. L., Meurisse, A., Normand, C., Gornet,
Olmo, D. (2018) Liquid biopsy by NGS: differen-
J. M., Artru, P., Louafi, S., Bonnetain, F., Thirot-
tial presence of exons (DPE) in cell-free DNA re-
Bidault, A., Baumgaertner, I., Coriat, R., Tougeron, D.,
veals different patterns in metastatic and nonmeta-
Lecomte, T., Mary, F., Aparicio, T., Marthey, L.,
static colorectal cancer, Cancer Med., 7, 1706-1716,
Taly, V., Blons, H., Vernerey, D., and Laurent-Puig, P.
doi: 10.1002/cam4.1399.
(2018) RAS mutation analysis in circulating tumor
13.
Mittra, I., Khare, N. K., Raghuram, G. V.,
DNA from patients with metastatic colorectal cancer:
Chaubal, R., Khambatti, F., Gupta, D., Gaikwad, A.,
the AGEO RASANC prospective multicenter study,
Prasannan, P., Singh, A., Iyer, A., Singh, A.,
Ann. Oncol., 29, 1211-1219, doi: 10.1093/annonc/
Upadhyay, P., Nair, N. K., Mishra, P. K., and
mdy061.
Dutt, A. (2015) Circulating nucleic acids damage
6.
Keller, L., Guibert, N., Casanova, A., Brayer, S.,
DNA of healthy cells by integrating into their ge-
Farella, M., Delaunay, M., Gilhodes, J., Martin, E.,
nomes, J. Biosci., 40, 91-111, doi: 10.1007/s12038-
Balagué, G., Favre, G., Pradines, A., and Meyer, N.
015-9508-6.
(2019) Early circulating tumour DNA variations
14.
Souza, A. G., Bastos, V. A. F., Fujimura, P. T.,
predict tumour response in melanoma patients treated
Ferreira, I. C. C., Leal, L. F., da Silva, L. S., Laus,
with immunotherapy, Acta Derm. Venereol., 99, 206-
A. C., Reis, R. M., Martins, M. M., Santos, P. S.,
210, doi: 10.2340/00015555-3080.
Corrêa, N. C. R., Marangoni, K., Thomé, C. H.,
7.
Poli, V., and Zanoni, I. (2022) Neutrophil intrinsic
Colli, L. M., Goulart, L. R., and Goulart, V. A. (2020)
and extrinsic regulation of NETosis in health and
Cell-free DNA promotes malignant transformation in
БИОХИМИЯ том 88 вып. 7 2023
ВЛИЯНИЕ ВНЕКЛЕТОЧНОЙ ДНК ИЗ СЫВОРОТКИ КРОВИ
1235
non-tumor cells, Sci. Rep., 10, 21674, doi: 10.1038/
cells by CRISPRa-mediated activation of cytidine
s41598-020-78766-5.
deaminases, Int. J. Mol. Sci., 21, 6865, doi: 10.3390/
15.
Alekseeva, L. A., Mironova, N. L., Brenner, E. V.,
ijms21186865.
Kurilshikov, A. M., Patutina, O. A., and Zenkova,
23.
Cotterman, R., Jin, V. X., Krig, S. R., Lemen, J. M.,
M. A. (2017) Alteration of the exDNA profile in blood
Wey, A., Farnham, P. J., and Knoepfler, P. S. (2008)
serum of LLC-bearing mice under the decrease of tu-
N-Myc regulates a widespread euchromatic program
mour invasion potential by bovine pancreatic DNase I
in the human genome partially independent of its role
treatment, PLoS One, 12, e0171988, doi: 10.1371/
as a classical transcription factor, Cancer Res., 68,
journal.pone.0171988.
9654-9662, doi: 10.1158/0008-5472.CAN-08-1961.
16.
Alekseeva, L. A., Sen’kova, A. V., Zenkova, M. A.,
24.
Judson, H., van Roy, N., Strain, L., Vandesompele, J.,
and Mironova, N. L.
(2020) Targeting circulat-
Van Gele, M., Speleman, F., and Bonthron, D. T.
ing SINEs and LINEs with DNase I provides me-
(2000) Structure and mutation analysis of the gene en-
tastases inhibition in experimental tumor models,
coding DNA fragmentation factor 40 (caspase-activat-
Mol. Ther. Nucleic Acids, 20, 50-61, doi: 10.1016/
ed nuclease), a candidate neuroblastoma tumour sup-
j.omtn.2020.01.035.
pressor gene, Hum Genet., 106, 406-413, doi: 10.1007/
17.
Alekseeva, L., Sen’kova, A., Savin, I., Zenkova, M.,
s004390000257.
and Mironova, N.
(2021) Human recombinant
25.
Larsen, B. D., and Sorensen, C. S. (2017) The caspase-
DNase I (Pulmozyme®) inhibits lung metastases in
activated DNase: apoptosis and beyond, FEBS J., 284,
murine metastatic b16 melanoma model that correlates
1160-1170, doi: 10.1111/febs.13970.
with restoration of the DNase activity and the decrease
26.
Alekseeva, L., and Mironova, N. (2021) Role of
SINE/LINE and c-Myc fragments in blood cell-
cell-free DNA and deoxyribonucleases in tumor
free DNA, Int. J. Mol. Sci., 22, 12074, doi: 10.3390/
progression, Int. J. Mol. Sci., 22, 12246, doi: 10.3390/
ijms222112074.
ijms222212246.
18.
Park, J. G., Kramer, B. S., Steinberg, S. M.,
27.
Fahmi, T., Wang, X., Zhdanov, D. D., Islam, I.,
Carmichael, J., Collins, J. M., Minna, J. D., and
Apostolov, E. O., Savenka, A. V., and Basnakian, A. G.
Gazdar, A. F.
(1987) Chemosensitivity testing
(2020) DNase I induces other endonucleases in
of human colorectal carcinoma cell lines using a
kidney tubular epithelial cells by its DNA-degrading
tetrazolium-based colorimetric assay, Cancer Res.,
activity, Int. J. Mol. Sci., 21, 8665, doi: 10.3390/
47, 5875-5879.
ijms21228665.
19.
Lee, T. H., Chennakrishnaiah, S., Audemard, E.,
28.
McCord, J. J., Engavale, M., Masoumzadeh, E.,
Montermini, L., Meehan, B., and Rak, J. (2014)
Villarreal, J., Mapp, B., Latham, M. P., Keyel, P. A.,
Oncogenic ras-driven cancer cell vesiculation leads
and Sutton, R. B.
(2022) Structural features of
to emission of double-stranded DNA capable of
Dnase1L3 responsible for serum antigen clearance,
interacting with target cells, Biochem. Biophys.
Commun. Biol.,
5,
825, doi:
10.1038/s42003-022-
Res. Commun.,
451,
295-301, doi:
10.1016/j.bbrc.
03755-5.
2014.07.109.
29.
Wang, G., Lam, W. K. J., Ling, L., Ma, M. L.,
20.
Baca, S. C., Prandi, D., Lawrence, M. S., Mosquera,
Ramakrishnan, S., Chan, D. C. T., Lee, W. S., Cheng,
J. M., Romanel, A., Drier, Y., Park, K., Kitabaya-
S. H., Chan, R. W. Y., Yu, S. C. Y., Tse, I. O. L., Wong,
shi, N., MacDonald, T. Y., Ghandi, M., Van Allen, E.,
W. T., Jiang, P., Chiu, R. W. K., Allen Chan, K. C.,
Kryukov, G. V., Sboner, A., Theurillat, J. P., Soong,
and Lo, Y. M. D. (2022) Fragment ends of circulating
T. D., Nickerson, E., Auclair, D., Tewari, A., Beltran, H.,
microbial DNA as signatures for pathogen detection
Onofrio, R. C., Boysen, G., Guiducci, C., Barbieri,
in sepsis, Clin. Chem., 69, 189-201, doi: 10.1093/
C. E., Cibulskis, K., Sivachenko, A., Carter, S. L.,
clinchem/hvac197.
Saksena, G., Voet, D., Ramos, A. H., Winckler, W.,
30.
Udou, T., Hachisuga, T., Tsujioka, H., and Kawara-
Cipicchio, M., Ardlie, K., Kantoff, P. W., Berger,
bayashi, T. (2004) The role of c-jun protein in
M. F., Gabriel, S. B., Golub, T. R., Meyerson, M.,
proliferation and apoptosis of the endometrium
Lander, E. S., Elemento, O., Getz, G., Demichelis, F.,
throughout the menstrual cycle, Gynecol. Obstet.
Rubin, M. A., and Garraway, L. A. (2013) Punctuated
Invest., 57, 121-126, doi: 10.1159/000075701.
evolution of prostate cancer genomes, Cell, 153, 666-
31.
Leech, J. T., Brennan, A., Don, N. A., Mason,
677, doi: 10.1016/j.cell.2013.03.021.
J. M., and Kad, N. M. (2022) In vitro single mole-
21.
Chen, R., Du, J., Zhu, H., and Ling, Q. (2021) The role
cule and bulk phase studies reveal the AP-1 transcrip-
of cGAS-STING signalling in liver diseases, JHEP
tion factor cFos binds to DNA without its partner
Rep., 3, 100324, doi: 10.1016/j.jhepr.2021.100324.
cJun, J. Biol. Chem., 298, 102229, doi: 10.1016/j.jbc.
22.
Brezgin, S., Kostyusheva, A., Ponomareva, N.,
2022.102229.
Volia, V., Goptar, I., Nikiforova, A., Shilovskiy,
32.
Li, C., Kuai, L., Cui, R., and Miao, X. (2022) Mela-
I., Smirnov, V., Kostyushev, D., and Chulanov, V.
nogenesis and the targeted therapy of melanoma, Bio-
(2020) Clearing of foreign episomal DNA from human
molecules, 12, 1874, doi: 10.3390/biom12121874.
БИОХИМИЯ том 88 вып. 7 2023
13*
1236
ФИЛАТОВА и др.
33. Roers, A., Hiller, B., and Hornung, V.
(2016)
12 Suppl
1, S99-S111, doi: 10.1517/14712598.2012.
Recognition of endogenous nucleic acids by the innate
690028.
immune system, Immunity, 44, 739-754, doi: 10.1016/
35. Kawai, K., Li, Y. S., Song, M. F., and Kasai, H.
j.immuni.2016.04.002.
(2010) DNA methylation by dimethyl sulfoxide and
34. Kostjuk, S., Loseva, P., Chvartatskaya, O., Ershova, E.,
methionine sulfoxide triggered by hydroxyl radical
Smirnova, T., Malinovskaya, E., Roginko, O.,
and implications for epigenetic modifications,
Kuzmin, V., Izhevskaia, V., Baranova, A., Ginter, E.,
Bioorg. Med. Chem. Lett., 20, 260-265, doi: 10.1016/
and Veiko, N. (2012) Extracellular GC-rich DNA
j.bmcl.2009.10.124.
activates TLR9- and NF-kB-dependent signaling
36. Duvvuri, B., and Lood, C. (2019) Cell-free DNA as a
pathways in human adipose-derived mesenchymal
biomarker in autoimmune rheumatic diseases, Front.
stem cells (haMSCs), Expert. Opin. Biol. Ther.,
Immunol., 10, 502, doi: 10.3389/fimmu.2019.00502.
IMPACT OF CELL-FREE DNA FROM BLOOD SERUM
OF MICE WITH METASTATIC MELANOMA ON THE ENHANCEMENT
OF ONCOGENIC PROPERTIES OF MELANOMA CELLS
A. A. Filatova1,2, L. A. Alekseeva1, I. A. Savin1, A. V. Sen’kova1,
M. A. Zenkova1, and N. L. Mironova1*
1 Institute of Chemical Biology and Fundamental Medicine, Siberiab Branch of Russian Academy of Sciences,
630090 Novosibirsk, Russia; e-mail: mironova@niboch.nsc.ru
2 Faculty of Natural Sciences, Novosibirsk State University, 630090 Novosibirsk, Russia
Currently, a significant increase in the levels of circulating cell-free DNA (cfDNA) in the blood of patients
is a generally recognized marker of the development of oncological diseases. Although tumor-associated
cfDNA has been well studied, its biological functions remain unclear. In this work, we investigated the effect
of cfDNA isolated from the blood serum of mice with B16-F10 metastatic melanoma on the properties of
B16-F10 melanoma cells in vitro. It was found that the profile of cfDNA isolated form blood serum of mice
with melanoma differs significantly from the cfDNA isolated from blood serum of healthy mice, and is
similar concerning the abundance of oncogenes and mobile genetic elements (MGE) to the genomic DNA
of B16 cells. It was shown that cfDNA of mice with melanoma penetrated into B16 cells, resulting to the
increase in the abundance of oncogenes and MGE fragments, and caused the 5-fold increased mRNA lev-
el of the secreted DNase Dnase1l3 and a slight increase of the mRNA level of the Jun, Fos, Ras, and Myc
oncogenes. cfDNA of healthy mice caused increasing of mRNA level of the intracellular regulatory DNase
EndoG and a 4-fold increase of mRNA level of Fos and Ras oncogenes, which are well-known triggers of a
large number of signal cascades, from apoptosis inhibition to increased tumor cell proliferation. Thus, it is
obvious that the circulating cfDNA of tumor origin is able to penetrate into cells and, despite the fact that no
changes were found in the level of viability and migration activity of tumor cells, cfDNA, even with a single
exposure, can cause changes at the cellular level that increase the oncogenicity of recipient cells.
Keywords: circulating cell-free DNA, melanoma B16
БИОХИМИЯ том 88 вып. 7 2023