БИОХИМИЯ, 2023, том 88, вып. 7, с. 1268 - 1280
УДК 577.12
ЭКСПРЕССИЯ, ВНУТРИКЛЕТОЧНАЯ ЛОКАЛИЗАЦИЯ
И СОЗРЕВАНИЕ ЦИСТЕИНОВЫХ КАТЕПСИНОВ
В ЭМБРИОНАЛЬНОЙ И ОПУХОЛЕВЫХ КУЛЬТУРАХ
КЛЕТОК ПОЧКИ
© 2023 А.С. Фролова1,2, Н.К. Тихомирова3, И.И. Киреев3, Е.Ю. Зерний3, А. Пароди2,
К.И. Иванов2, А.А. Замятнин мл.1,2,3,4*
1 Институт молекулярной медицины,
Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский университет), 119991 Москва, Россия
2 Научно-технологический университет «Сириус», 354340 Сочи, Россия
3 НИИ физико-химической биологии имени А.Н. Белозерского,
Московский государственный университет имени М.В. Ломоносова,
119992 Москва, Россия; электронная почта: zamyat@belozersky.msu.ru
4 Московский государственный университет имени М.В. Ломоносова,
факультет биоинженерии и биоинформатики, 119234 Москва, Россия
Поступила в редакцию 24.02.2023
После доработки 24.05.2023
Принята к публикации 24.05.2023
Цистеиновые катепсины играют важную роль при развитии опухолей и метастазировании, а их
экспрессия повышена во многих опухолевых клетках. Помимо протеолиза белков внеклеточ-
ного матрикса и сигнальных молекул на поверхности клетки, цистеиновые катепсины участвуют
в канцерогенезе посредством других механизмов, включающих деградацию транскрипционных
факторов и нарушение функционирования сигнальных каскадов в клеточном ядре. На данный
момент известна роль ряда катепсинов в определённых типах рака, однако нет исследований всех
11 цистеиновых катепсинов в одной опухоли или опухолевой модели. В настоящей работе мы оце-
нивали и сравнивали экспрессию, локализацию и степень созревания всех 11 цистеиновых катеп-
синов в эмбриональных клетках почки HEK293 и клеточных линиях рака почки 769-P и А-498.
Нами было показано, что в опухолевых клетках экспрессия катепсинов V, B, Z, L и S повышена
в 3-9 раз по сравнению с эмбриональными клетками. Также было установлено, что цистеиновые
катепсины детектируются не только в цитоплазме, но и в клеточных ядрах как эмбриональных,
так и опухолевых клеток. Так, например, более половины специфического флуоресцентного сиг-
нала от катепсинов Z и K обнаруживалось в ядрах опухолевых клеток, а в случае катепсина F
доля этого фермента в клеточном ядре превышала 88%. Более того, было обнаружено, что мно-
гие цистеиновые катепсины представлены в виде зрелого фермента именно в опухолевых клетках.
В дальнейшем полученные результаты могут быть использованы для разработки новых диагно-
стических систем, а также для дальнейшего изучения цистеиновых катепсинов в качестве потен-
циальных терапевтических мишеней.
КЛЮЧЕВЫЕ СЛОВА: цистеиновые катепсины, внутриклеточная локализация, экспрессия белков, созре-
вание протеиназ, рак почки.
DOI: 10.31857/S032097252307014X, EDN: FYLWMO
ВВЕДЕНИЕ
Они имеют общую доменную структуру,
но
различаются по молекулярной массе и функ-
Цистеиновые катепсины являются лизо-
циям. Основная роль цистеиновых протеиназ
сомальными протеиназами и относятся к па-
заключается в деградации белков и регуляции
паин-подобным ферментам. Группа цистеи-
клеточных процессов [1]. На основе амино-
новых катепсинов состоит из 11 ферментов:
кислотной последовательности продомена ка-
катепсины B, C, F, H, K, L, O, S, V, W и Z (X). тепсины подразделяют на L-, B- и F-подобные
катепсины [2].
Принятые сокращения: GAPDH - глицеральдегид-3-
Катепсины состоят из сигнального N-кон-
фосфатдегидрогеназа.
цевого пептида, продомена и каталитического
* Адресат для корреспонденции.
домена [3]. Катепсины синтезируются в виде
1268
ЭКСПРЕССИЯ И ЛОКАЛИЗАЦИЯ КАТЕПСИНОВ
1269
неактивной проформы. В процессе многосту-
В целом, функциональная роль
«ядерных»
пенчатого созревания от проформы отщепля-
цистеиновых катепсинов пока малоизучена.
ется сигнальный пептид и продомен, и обра-
Однако показано, что наличие ядерного ка-
зуется зрелый фермент. В некоторых случаях
тепсина L коррелирует с негативным прогно-
в процессе созревания катепсины образуют
зом выживаемости онкологических пациен-
одну или несколько промежуточных форм [4].
тов [36].
Цистеиновые катепсины экспрессируются
Многие исследования фокусируются на
практически всеми клетками организма. Не-
изучении одного определённого цистеинового
которые из них имеют выраженную экспрес-
катепсина. Несмотря на то что многие катеп-
сию в определённых органах человеческого
сины экспрессируются при определённом типе
тела. Например, в группе иммунных клеток
рака, в литературе практически отсутствуют
катепсин S крайне распространён в антиген-
работы, направленные на изучение экспрессии
презентирующих клетках [5], а катепсин W
всех цистеиновых катепсинов одновременно.
экспрессируется преимущественно NK-клет-
С целью заполнить этот пробел в настоящем
ками и T-лимфоцитами [6]. Повышенная экс-
исследовании мы изучили уровни экспрессии
прессия катепсинов наблюдается при опухолях
всех 11 цистеиновых катепсинов в эмбрио-
мозга [7-9], раке груди [10-13], колоректаль-
нальных клетках почки человека HEK293 и в
ном раке [14, 15], меланоме [16], неходжкин-
опухолевых линиях почки 769-P и А-498, а так-
ской лимфоме [17], плоскоклеточной карци-
же определили локализацию и степень созре-
номе [18], раке лёгких [19], желудка [20], ти-
вания цистеиновых катепсинов, присутствую-
моме [21], раке почки [22, 23], щитовидной
щих в этих клетках.
железы [24, 25], крупногранулярном лимфоци-
тарном лейкозе [26]. Из литературных данных
известно, что у пациентов с почечно-клеточ-
МАТЕРИАЛЫ И МЕТОДЫ
ным раком в клетках наблюдается повышен-
ная экспрессия катепсина B в сравнении с
Культивирование клеточных линий. Клеточ-
окружающими неопухолевыми клетками [27].
ные линии карциномы почки человека 769-Р,
Катепсин K используется как диагностиче-
А-498 и человеческие эмбриональные клетки
ский маркер при TFE3/TFEB-реаранжиро-
почки HEK293 были получены из американ-
ванной почечно-клеточной карциноме и по-
ской коллекции типовых культур. Клетки 769-Р
чечной эпителиоидной ангиомиолипоме [23].
и А-498 выращивали на флаконах в среде
Повышенную экспрессию цистеиновых ка-
RPMI-1640, дополненной 10%-ной эмбрио-
тепсинов в опухолевых клетках часто свя-
нальной телячьей сывороткой (v/v) и 1%-ной
зывают с плохим прогнозом [7, 28], общей
смесью антибиотиков пенициллин-стрептоми-
низкой выживаемостью [29] и метастазиро-
цин (v/v) («Gibco», США) при 37 °С в атмо-
ванием [30].
сфере 5% CO2. Клетки HEK293 выращивали на
Цистеиновые катепсины рассматриваются
среде DMEM с теми же добавками и в тех же
в качестве потенциальных маркеров и мише-
условиях.
ней для диагностики и лечения определённых
Получение антител против катепсина L.
типов рака. К потенциальным маркерам мож-
Поликлональные антитела против катепсина L
но отнести катепсин B [27], катепсин H [14],
были получены и очищены в соответствии с
а также катепсин К [23]. Ингибирование ак-
обычной процедурой [37]. Вкратце, очищен-
тивности катепсина B в клетках гепатоцел-
ный рекомбинантный катепсин L (1 мг/мл)
люлярной карциномы приводит к снижению
смешивали в соотношении 1 : 1 с 1 мл вспо-
клеточного роста опухоли [31, 32]. Пептиды,
могательного адъюванта Фрейнда и подкожно
полученные на основе субстратов папаин-по-
вводили кролику. Через месяц иммунизацию
добной цистеиновой протеиназы тритикаина-
усилили путём введения рекомбинантного ка-
альфа, снижают миграцию опухолевых кле-
тепсина L (1 мг/мл), смешанного с неполным
ток почек, формирование сфероидов и коло-
адъювантом Фрейнда в том же соотношении.
ний [22]. Нокаут катепсина Z и B при раке гру-
Через две недели после повторной иммуниза-
ди приводит к уменьшению метастазирования
ции собрали кровь, и антитела очистили ме-
и размеров опухоли [33].
тодом аффинной хроматографии. Для этого
Несмотря на то что цистеиновые катеп-
1,2 мг рекомбинантного катепсина L смешали
сины изначально были описаны как лизо-
с 0,6 мл CNBr-активированной сефарозы («GE
сомальные протеиназы, их обнаруживают
Lifesciences», США), следуя инструкциям про-
в ядрах клеток, а также в некоторых других
изводителя. Сыворотку разбавили в 2 раза рас-
внутриклеточных компартментах [25, 34, 35].
твором PBS и загрузили на иммуноаффинную
БИОХИМИЯ том 88 вып. 7 2023
1270
ФРОЛОВА и др.
колонку. Антитела были удалены с колонки
в течение 30 мин во льду. Клеточный ли-
0,2 М глицином (pH 2,5), элюат нейтрализовали
зат центрифугировали на 16 000 g при темпе-
1 М Tris-HCl (pH 9,0). Антитела осадили сухим
ратуре +4 °С в течение 15 мин. Полученный
сульфатом аммония до насыщения 75%. Оса-
клеточный лизат смешивали с 2× буфером для
док антител центрифугировали, суспендирова-
нанесения образцов (125 мМ Tris-HCl, pH 6,8,
ли в 50%-ном насыщенном растворе сульфата
20%-ный глицерин (v/v), 4%-ный SDS (w/v),
аммония и хранили при 4 °С.
0,004%-ный бромфеноловый синий (w/v),
Фракционирование клеточных структур.
10%-ный 2-меркаптоэтанол (v/v)) и прогрева-
Фракционирование клеточных линий на цито-
ли в течение 5 мин при 96 °С. На ПААГ нано-
плазматическую и ядерную фракции проводи-
сили по 30 мкг клеточного лизата.
ли по основной методике [38] с некоторыми
Вестерн-блот. Готовые образцы разделя-
модификациями. Клетки отмывали от среды
ли в 14%-ном ПААГ и переносили на PVDF-
охлаждённым PBS. К клеткам добавляли саха-
мембрану («Merck Millipore», США). В работе
розный буфер (0,32 М сахароза, 3 мМ CaCl2,
использовали антитела к катепсинам V, C, B,
2 мМ ацетат магния, 0,1 мМ ЭДТА, 10 мМ
K, W, Z, O, H, S («Abcam», Великобритания),
Tris-HCl, 1 мМ ДТТ, 0,5%-ный NP-40 (v/v),
катепсину L, катепсину F, глицеральдегид-3-
коктейль ингибиторов протеиназ
(«Sigma-
фосфатдегидрогеназе (GAPDH), ламинам А/С
Aldrich», США)), собирали скребком с клеточ-
(«Thermo Fisher Scientific», США), а также вто-
ного пластика и переносили в пробирку во
ричные антитела, конъюгированные с пер-
льду. Через 30 мин инкубации во льду с перио-
оксидазой хрена («Thermo Fisher Scientific»).
дическим пипетированием образцы центри-
Мембраны проявляли набором Clarity Western
фугировали в течение 15 мин при 3000 g, +4 °С.
ECL Substrate («Bio-Rad», США). Денсито-
После центрифугирования отбирали суперна-
метрический анализ проводили в программе
тант, содержащий цитоплазматическую фрак-
GelAnalyzer
19.1. Полученные данные нор-
цию, и ресуспендировали ядерный осадок в
мировали к контролю нагрузки GAPDH и
сахарозном буфере без добавления NP-40.
представляли в относительных единицах.
После центрифугирования при 3000 g, +4 °С в
Проверку чистоты цитоплазматической и ядер-
течение 5 мин ядра ресуспендировали сначала
ной фракций проводили по цитоплазмати-
в низкосолевом буфере (20 мM HEPES, pH 7,9,
ческому белку GAPDH и ядерным белкам
20%-ный глицерин (v/v), 1,5 мM MgCl2, 0,02 M
ламинам A/C.
KCl, 0,2 мM ЭДТА, 0,5 мM ДТТ, коктейль ин-
Флуоресцентная микроскопия. Клетки от-
гибиторов протеиназ («Sigma-Aldrich»)), по-
мывали в охлаждённом PBS, фиксировали в
том в высокосолевом буфере (20 мM HEPES,
4%-ном PFA (w/v)/PBS в течение 10 мин и пер-
pH 7,9, 20%-ный глицерин (v/v), 1,5 мM MgCl2,
меабилизовали в 0,25%-ном Triton X-100 (v/v)
0,8 М KCl, 0,2 мM ЭДТА, 1%-ный NP-40 (v/v),
в течение 10 мин. Для блокировки неспеци-
0,5 мM ДТТ, коктейль ингибиторов протеи-
фических сайтов связывания клетки блоки-
наз («Sigma-Aldrich»)). Ядра инкубировали в те-
ровали в 1%-ном BSA (w/v)/1× PBS-T/100 мM
чение 30 мин во льду и центрифугировали на
глицине в течение 30 мин. Далее клетки ин-
16 000 g в течение 15 мин при +4 °С. Отобран-
кубировали с первичными антителами, опи-
ный супернатант содержал ядерную фрак-
санными в разделе «Вестерн-блот», 1 ч при
цию. Цитоплазматическую и ядерную фракции
комнатной температуре. После этого к клет-
хранили при -80 °С. Фракции смешивали с
кам добавили меченные флуорофором вторич-
2× буфером для нанесения образцов (125 мМ
ные антитела
(«Thermo Fisher Scientific»)
Tris-HCl, pH 6,8, 20%-ный глицерин (v/v),
на 1 ч. Ядра клеток окрашивали ядерным кра-
4%-ный SDS (w/v),
0,004%-ный бромфе-
сителем DAPI («Thermo Fisher Scientific») и
ноловый синий (w/v), 10%-ный 2-меркапто-
заключали в монтирующую среду
(«Sigma-
этанол (v/v)) и прогревали в течение 5 мин
Aldrich»). Клетки визуализировали на конфо-
при 96 °С. На ПААГ наносили по 6 мкг цито-
кальном микроскопе C2 на платформе Eclipse
плазматической фракции и 60 мкг ядерной
Ti-E («Nikon», Япония). Анализ флуоресцент-
фракции.
ных изображений проводили в программе
Получение образцов клеточных лизатов.
ImageJ 1.53c.
Клетки аккуратно промывали охлаждённым
Анализ результатов. Статистический анализ
PBS и лизировали в RIPA-буфере (150 мM
результатов был выполнен с использованием
NaCl, 50 мM Tris-HCl, pH 8,0, 1%-ный NP-40
программы GraphPad Prism 8.4.3. Результа-
(v/v),
0,5%-ный дезоксихолат натрия (w/v),
ты сравнительного анализа экспрессии пред-
0,1%-ный SDS (w/v)) с добавлением коктей-
ставлены как среднее значение ± стандартное
ля ингибиторов протеиназ («Sigma-Aldrich»)
отклонение.
БИОХИМИЯ том 88 вып. 7 2023
ЭКСПРЕССИЯ И ЛОКАЛИЗАЦИЯ КАТЕПСИНОВ
1271
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
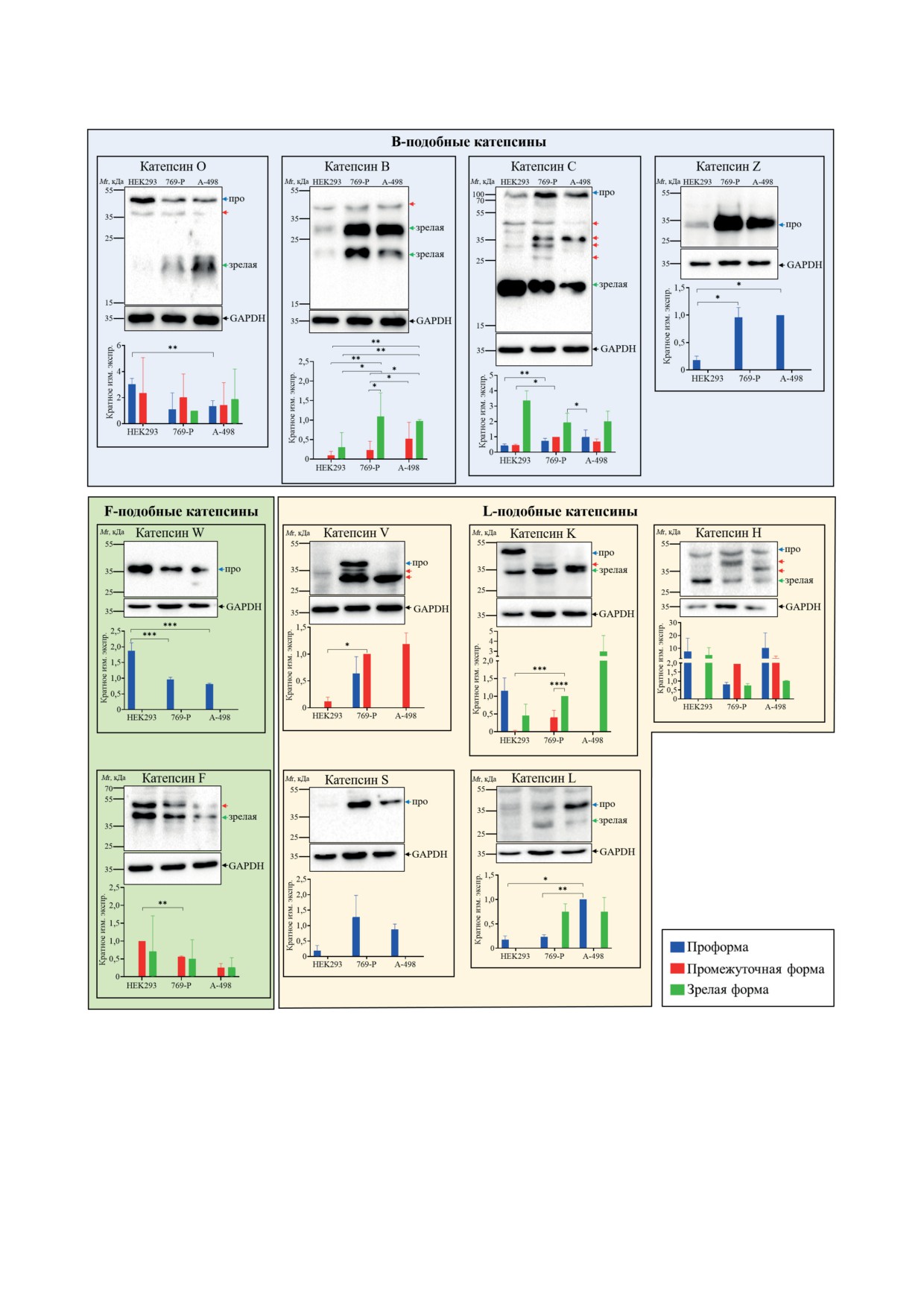
Таким образом, исходя из полученных
результатов, можно заключить, что все 11 ци-
Экспрессия цистеиновых катепсинов раз-
стеиновых катепсинов продуцируются как
личается в эмбриональных и опухолевых клет-
эмбриональными, так и опухолевыми клетка-
ках почки. Для определения уровня экспрессии
ми, однако уровень их экспрессии, а также на-
цистеиновых катепсинов в эмбриональных и
бор форм, характерных для разных этапов со-
опухолевых клетках почки был проведён ве-
зревания ферментов, могут существенно раз-
стерн-блоттинг клеточных лизатов (рис.
1).
личаться. При этом опухолевые клетки почки
Результаты анализа показали, что все 11 ци-
содержат достоверно большее количество ка-
стеиновых катепсинов обнаруживаются как в
тепсинов V, B, Z, L и S по сравнению с эмбри-
эмбриональных клетках почки HEK293, так и
ональными клетками почки.
в двух опухолевых линиях клеток почки, 769-P
Цистеиновые катепсины присутствуют в яд-
и A-498. Однако между эмбриональной и опу-
рах и в цитоплазме эмбриональных и опухолевых
холевыми линиями были выявлены значимые
клеток почки, но в разных соотношениях. На сле-
различия в уровне экспрессии, а также в нали-
дующем этапе исследования изучалась внутри-
чии различных форм цистеиновых катепси-
клеточная локализация цистеиновых катеп-
нов, отражающих степени созревания фермен-
синов в эмбриональных и опухолевых клетках
тов. Выяснилось, что опухолевые клетки почки
почки. Цистеиновые катепсины, окрашенные с
продуцируют в среднем больше катепсина V
помощью антител, конъюгированных с флуорес-
(в 9,34 раз), катепсина Z (в 5,5), катепсина L
центным красителем, визуализировали с помо-
(в 3,34), катепсина S (в 9,2) и катепсина B
щью конфокальной микроскопии (рис. 2). Ядра
(в 3,34) в сравнении с эмбриональными клет-
клеток окрашивали ядерным красителем DAPI.
ками почки. Примечательно, что, помимо уве-
Результаты микроскопии показали, что все
личенной экспрессии катепсинов L и B, в опу-
цистеиновые катепсины детектировались как
холевых клетках также детектировалось боль-
в цитоплазме, так и в ядрах эмбриональных и
шее количество зрелых форм этих белков.
опухолевых клеток почки. Тем не менее рас-
В опухолевых клетках уровень содержания
пределение конкретных белков между цито-
проформы и промежуточной формы катепси-
плазмой и ядром существенно различалось.
на C был выше, чем в эмбриональных клет-
Например, около 90% сигнала катепсина F
ках, в то время как уровень содержания зре-
приходилось на ядра эмбриональных и опухо-
лой формы катепсина C снижался. Количество
левых клеток. Исходя из распределения флуо-
проформы и промежуточной формы катепси-
ресцентных сигналов в клетках, был сделан
на O, наоборот, оказалось снижено в опухо-
вывод о том, что большая часть катепсинов Z,
левых клетках по сравнению с содержанием
B, O, K и H (более 50% от всего сигнала) со-
катепсина O в эмбриональных клетках, а зре-
держится в ядрах клеток 769-Р, в то время как
лый катепсин O с молекулярной массой около
в ядрах клеток А-498 представлено больше ка-
20 кДа детектировался исключительно в опу-
тепсина Z и K.
холевых клетках. В опухолевых клетках почки
Сигнал от некоторых цистеиновых катеп-
катепсин K присутствовал преимущественно в
синов в цитоплазме и ядре различался между
зрелой форме, а в эмбриональных клетках, на-
эмбриональными и опухолевыми клетками
оборот, было больше проформы катепсина K.
почки. В эмбриональных клетках 49% сигнала
Количественное содержание проформы и про-
от катепсина V и 65,15% сигнала от катепси-
межуточной формы катепсина H различалось
на W детектировалось в ядрах клеток, в то
во всех трёх клеточных линиях. Однако зрелая
время как в опухолевых клетках происходило
форма катепсина H в опухолевых клетках была
снижение сигнала до 22,94% и 24,76% для ка-
представлена в меньшем количестве, чем в эм-
тепсина V и до 16% и 16,46% для катепсина W
бриональных клетках.
в ядрах клеток 769-Р и A-498 соответственно.
Экспрессия всех F-подобных катепсинов
Проанализировав распределение катепси-
(катепсина F и W) оказалась выше в эмбрио-
нов B, O и Z в эмбриональных и опухолевых
нальных клетках почки по сравнению с экс-
клетках, мы обнаружили статистические раз-
прессией в опухолевых клетках. Помимо вы-
личия только в одной из клеточных линий в
явленных изменений в уровнях экспрессии
сравнении с эмбриональными клетками. Так,
катепсинов в эмбриональных и опухолевых
в ядрах опухолевых клеток 769-Р уровень ка-
клетках следует отдельно отметить, что в опу-
тепсина Z был снижен с 73,35% до 50,1%, а в
холевых клетках дополнительно детектиро-
опухолевых клетках А-487 достоверно снижа-
вались промежуточные формы катепсинов V,
лась ядерная локализация катепсина B с 55,68%
K, C и H.
до 21,65% и катепсина O с 66,92% до 39,88%.
БИОХИМИЯ том 88 вып. 7 2023
1272
ФРОЛОВА и др.
Рис. 1. Экспрессия B-, F- и L-подобных цистеиновых катепсинов в эмбриональных клетках почки HEK293 и опухо-
левых клетках почки 769-P и A-498. Анализ клеточных лизатов проводился с помощью вестерн-блоттинга. Мембраны
окрашивались с помощью антител против 11 цистеиновых катепсинов, а также против GAPDH с целью количествен-
ного контроля нанесения образцов. Про - проформа катепсина, зрелая - зрелая форма катепсина, стрелки без под-
писей - промежуточные формы катепсинов. Гистограммы представляют результаты обсчёта вестерн-блотов (среднее
значение и среднеквадратичное отклонение). Кратное изменение экспрессии вычислено как отношение значения
интенсивности сигнала полосы белка к медианному значению интенсивности сигнала полосы белка. Медиана была
выбрана среди значений интенсивностей сигналов полос белков, которые представлены на рисунке для определён-
ного катепсина. Все значения интенсивностей сигналов полос белков были нормализованы по GAPDH. * p < 0,05,
** p < 0,01, *** p < 0,001, **** p < 0,0001
БИОХИМИЯ том 88 вып. 7 2023
ЭКСПРЕССИЯ И ЛОКАЛИЗАЦИЯ КАТЕПСИНОВ
1273
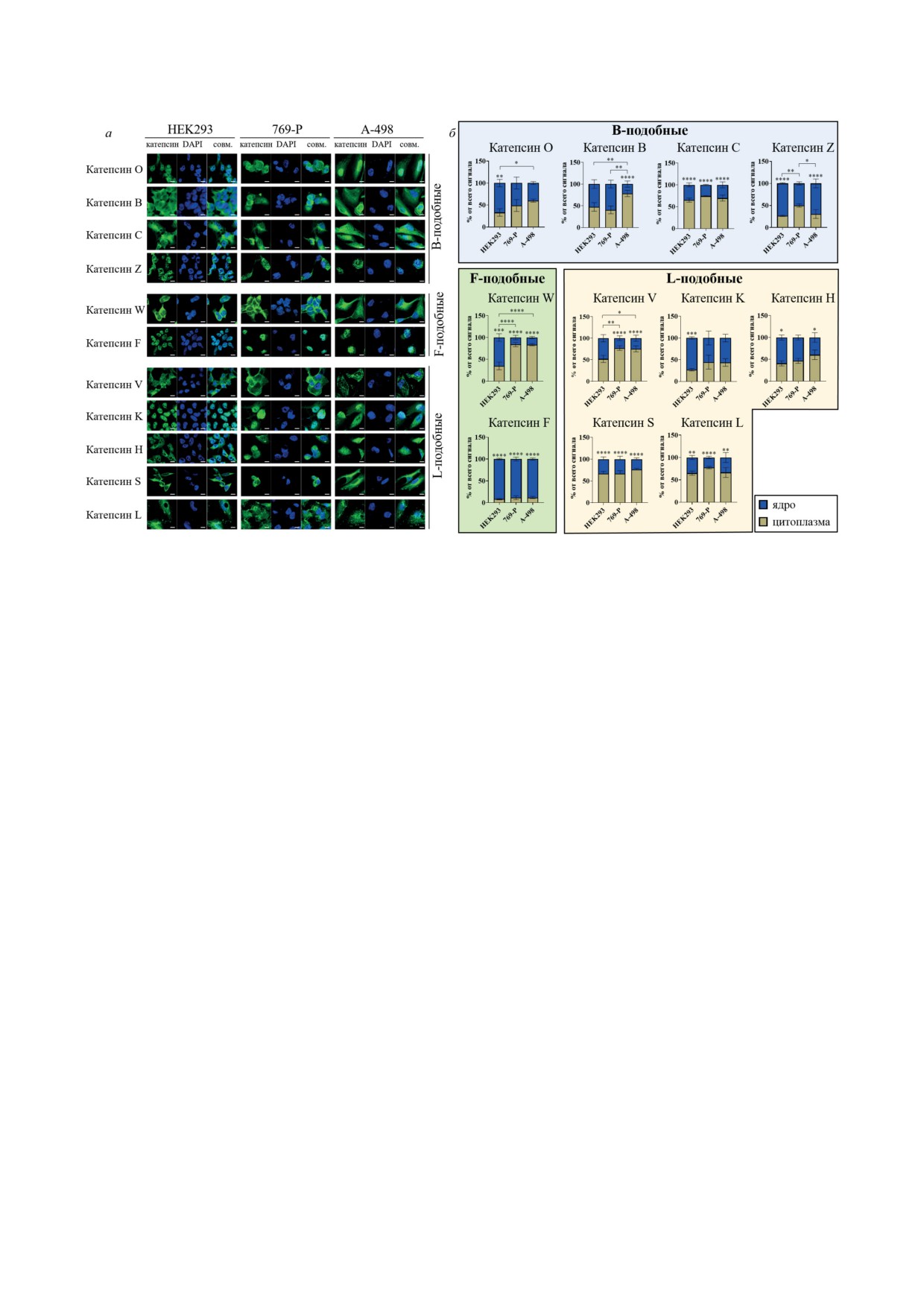
Рис. 2. Внутриклеточная локализация B-, F- и L-подобных цистеиновых катепсинов в эмбриональных клетках почки
HEK293 и опухолевых клетках почки 769-P и A-498. а - Микрофотографии, полученные с помощью конфокальной
микроскопии. Окрашивание проводилось с помощью антител к цистеиновым катепсинам и параллельно с помощью
ядерного красителя DAPI. Размер масштабной шкалы - 10 мкм. Совм. - совмещённая фотография. б - Результаты
обсчёта соотношений флуоресцентных сигналов от конъюгированных антител, детектируемых в цитоплазме или
в ядре в клеточных линиях HEK293, 769-P и А-498 (среднее значение и среднеквадратичное отклонение). * p < 0,05,
** p < 0,01, *** p < 0,001, **** p < 0,0001
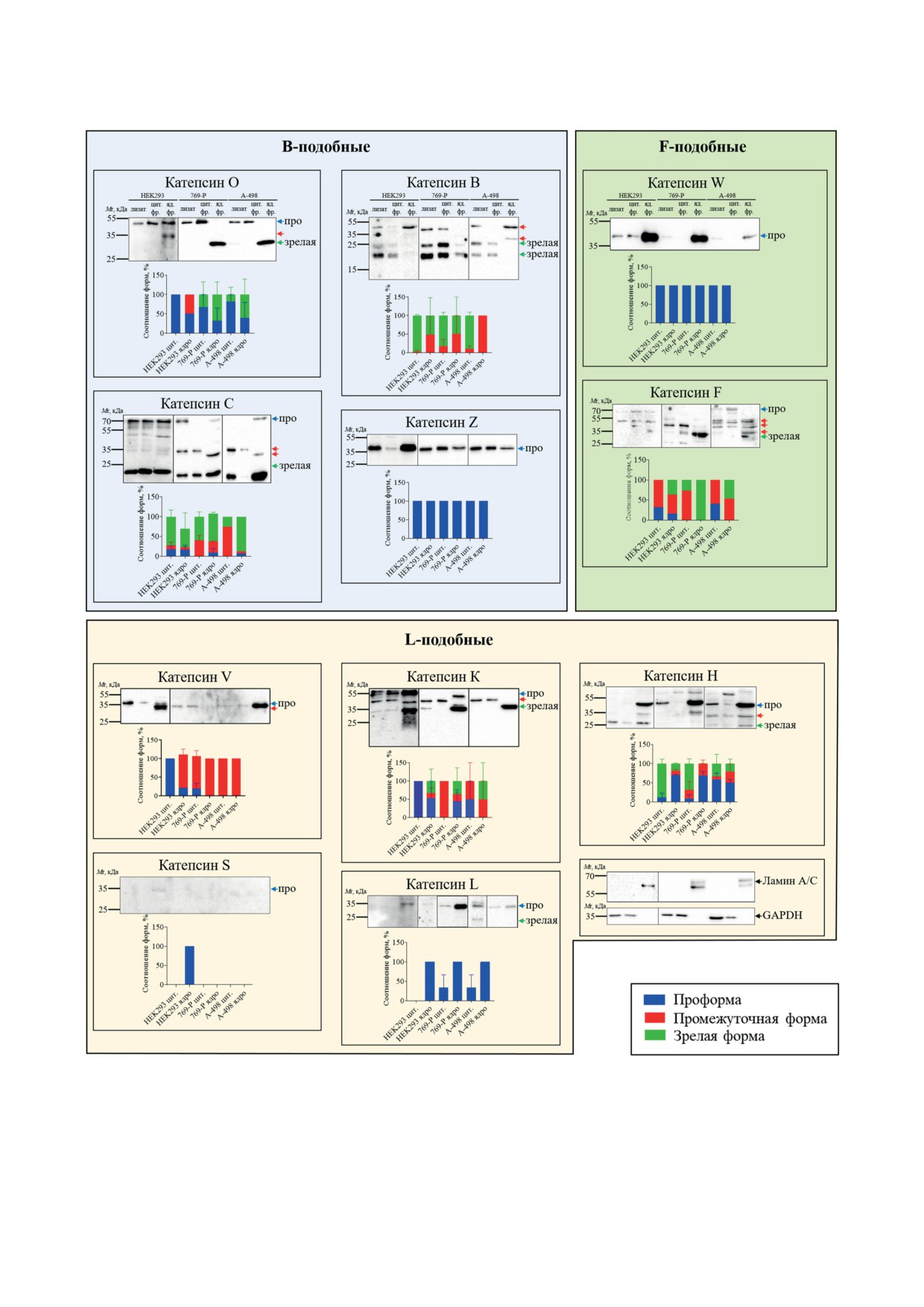
В то же время флуоресцентные сигналы
в клетках в виде проформы: проформа бел-
от катепсинов S, H, K, L и C, детектируемые в
ков определялась в цитоплазме и ядрах клеток
цитоплазме и ядрах, в эмбриональных и опу-
(рис. 3). Проформы, а также зрелые формы ка-
холевых клетках не показали достоверных раз-
тепсинов K, C, F и H определялись в ядерных
личий.
фракциях, полученных из всех трёх клеточных
Полученные результаты позволяют заклю-
линий. При анализе фракций на наличие ка-
чить, что цистеиновые катепсины содержатся
тепсина S выявлялась только проформа в ядер-
в ядрах и цитоплазме как в эмбриональных,
ной фракции эмбриональных клеток почки.
так и в опухолевых клетках почки. Однако со-
Катепсин O в зрелой активной форме детек-
отношения содержания отдельных ферментов
тировался в ядерной фракции, полученной из
в ядре и цитоплазме могут достоверно разли-
опухолевых клеток, в то время как в ядерной
чаться в зависимости от типа клеток.
фракции эмбриональных клеток определялась
Цистеиновые катепсины созревают в опухо-
исключительно проформа и промежуточная
левых клетках почки эффективнее, чем в эмбрио-
форма. Катепсин B преимущественно опреде-
нальных клетках почки. Следующий этап ис-
лялся в цитоплазматической фракции в виде
следования заключался в определении различ-
промежуточной и зрелой формы, в то время
ных форм катепсинов, образующихся при со-
как в ядерной фракции содержалось лишь
зревании ферментов и содержащихся в цито-
только небольшое количество промежуточной
плазме и ядрах эмбриональных и опухолевых
формы катепсина B.
клеток почки. Методом фракционирования
Исходя из результатов, представленных
клеточных компонентов были получены цито-
выше, можно сделать вывод, что в ядрах кле-
плазматическая и ядерная фракции, которые
ток цистеиновые катепсины представлены во
анализировали с помощью вестерн-блоттинга
всех возможных формах. Формы катепсина О
с использованием антител ко всем 11 катепси-
и B различаются в ядерной фракции эмбрио-
нам (рис. 3).
нальных и опухолевых клеток почки. Кроме
Анализ с помощью вестерн-блоттинга по-
того, также можно сделать вывод о том, что
казал, что катепсины Z, W, V и L содержатся процессы созревания катепсинов происходят
БИОХИМИЯ том 88 вып. 7 2023
1274
ФРОЛОВА и др.
Рис. 3. Определение различных форм B-, F- и L-подобных цистеиновых катепсинов в эмбриональных клетках поч-
ки HEK293 и опухолевых клетках почки 769-P и A-498. Анализ клеточных лизатов и фракций проводился с помо-
щью вестерн-блоттинга. Мембраны окрашивались с помощью антител против 11 цистеиновых катепсинов. Антитела
к GAPDH и ламинам А/С использовали для проверки чистоты цитоплазматической и ядерной фракций. Про - про-
форма катепсина, зрелая - зрелая форма катепсина, стрелки без подписей - промежуточные формы катепсина,
цит. фр. - цитоплазматическая фракция, яд. фр. - ядерная фракция. Гистограммы представляют результаты обсчёта
вестерн-блотов (среднее значение и стандартная ошибка среднего)
БИОХИМИЯ том 88 вып. 7 2023
ЭКСПРЕССИЯ И ЛОКАЛИЗАЦИЯ КАТЕПСИНОВ
1275
эффективнее в ядрах и цитоплазме опухолевых
ции. Логично предположить, что онкогенная
клеток, чем в ядрах и цитоплазме эмбриональ-
роль катепсинов К и О в развитии рака поч-
ных клеток.
ки может быть обусловлена их более полной
активацией. Гипотеза о том, что эффектив-
ное созревание катепсинов К и О обуслов-
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
ливает их активное вовлечение в процесс
канцерогенеза, согласуется с недавно опубли-
Полученные в настоящей работе резуль-
кованными данными о роли этих катепсинов
таты подтверждают и дополняют имеющиеся
в развитии рака предстательной железы [45]
в литературе данные о том, что экспрессия
и груди [11].
практически всех цистеиновых катепсинов по-
Наличие множественных промежуточных
вышена в опухолевых клетках [7-26]. На мо-
форм катепсинов в опухолевых клетках почки
лекулярном уровне повышенная экспрессия
можно объяснить каталитической активно-
и секреция цистеиновых катепсинов ведёт к
стью цистеиновых протеиназ. Известно, что
протеолизу белков внеклеточного матрикса
катепсины K и V могут расщеплять катепсин C
и поверхностных мембранных белков, что,
с образованием нескольких промежуточных
в свою очередь, приводит к разрушению меж-
форм [50]. Молекулярный вес этих промежу-
клеточных контактов, миграции раковых кле-
точных форм соответствует размерам фраг-
ток и метастазированию опухоли [39].
ментов катепсина C, найденных нами в опухо-
В настоящей работе мы обнаружили по-
левых клетках почки.
вышенную экспрессию катепсинов B и L в
При анализе экспрессии цистеиновых ка-
клетках рака почки. В других опухолевых клет-
тепсинов мы обнаружили, что экспрессия и
ках, таких как клетки рака поджелудочной
формы катепсинов О, С, V, H и L различаются
железы, также наблюдается повышенный уро-
в опухолевых клетках 769-P и А-498. Исполь-
вень катепсинов B и L [40, 41]. На мышиной
зуемые в данной работе опухолевые клеточные
модели канцерогенеза клеток островков под-
линии 769-Р и A-498 принадлежат к группе
желудочной железы RIP1-Tag2 было показано
карцином почки. Некоторые исследователи
участие катепсинов B и L в протеолизе супрес-
относят линию А-498 к папиллярной клеточ-
сора опухолей Е-кадгерина [42], что ведёт к
ной карциноме почки, в то время как линия
активации эпителиально-мезенхимального пе-
769-P принадлежит к группе светлоклеточного
рехода. Это, в свою очередь, приводит к уси-
рака почки. Эти группы имеют разные моле-
лению метастазирования и химиорезистент-
кулярные и гистологические характеристи-
ности опухолевых клеток [43]. Мы предпола-
ки [51, 52]. Так, например, в клеточных лини-
гаем, что в опухолевых клетках почки может
ях 769-Р и А-498 наблюдался разный уровень
происходить аналогичное расщепление Е-кад-
роста клеток при добавлении растительных
герина при помощи катепсинов B и L. Мы так-
экстрактов [53], а также отличалась чувстви-
же увидели повышенную экспрессию катепси-
тельность клеток в ответ на TRAIL-индуци-
нов H, K и Z, для которых были определены
рованный апоптоз [54]. Исходя из вышеука-
молекулярные механизмы участия этих фер-
занных молекулярных, морфологических и
ментов в развитии рака простаты [44, 45] и
биохимических различий между клеточными
печени [46]. Более того, результаты, получен-
линиями 769-Р и A-498, в них можно ожидать
ные в настоящей работе, согласуются с лите-
разного уровня экспрессии цистеиновых ка-
ратурными данными о том, что повышенный
тепсинов и разного соотношения их процесси-
уровень катепсинов наблюдается при раке
рованных форм.
мозга [7-9, 47], груди [10-13], лёгких [19],
В настоящей работе мы показали, что все
кишечника [14, 15], кожи [16] и простаты [44,
11 цистеиновых катепсинов присутствуют в
45, 48, 49].
ядрах как эмбриональных, так и опухолевых
Интересно, что в опухолевых клетках поч-
клеток почки. Эти результаты подтверждаются
ки происходит изменение соотношения форм
литературными данными о ядерной локализа-
катепсинов K и O в сторону зрелых форм этих
ции ряда катепсинов в раковых клетках [15, 23,
ферментов. Зрелая форма катепсина K явля-
25, 36, 49-58]. Вместе с тем мы впервые пока-
ется каталитически активной и обычно обра-
зали, что катепсины O, W, Z и K присутствуют
зуется внутри лизосом [1]. Соответственно,
не только в цитоплазме, но и в клеточном ядре.
преобладание зрелой формы катепсинов К и
Обнаруженная в настоящей работе ядер-
О в раковых клетках может свидетельствовать
ная локализация цистеиновых катепсинов в
о более полном процессинге этих ферментов
клетках рака почки подтверждается литера-
в лизосомах, ведущему к их полной актива-
турными данными об их канцерогенной роли
БИОХИМИЯ том 88 вып. 7 2023
1276
ФРОЛОВА и др.
в клеточном ядре. Так, например, активная,
ЗАКЛЮЧЕНИЕ
зрелая форма катепсина L обнаруживается
в ядре клеток колоректальной карциномы
В настоящей работе было проведено
HCT116, где она участвует в нарушении кле-
сравнение уровней экспрессии цистеиновых
точного цикла [57]. Более того, в этих клет-
катепсинов в эмбриональных и опухолевых
ках отсутствует физиологический ингибитор
клетках почки. Мы определили, что экспрес-
катепсина L - стефин B. Молекулярный меха-
сия цистеиновых катепсинов V, B, Z, F и H
низм канцерогенного действия катепсина L в
повышена в опухолевых клетках. По наличию
клеточном ядре связан с протеолизом тран-
зрелых форм ферментов можно сделать вывод
скрипционного фактора CDP/Cux, который
о том, что процессы созревания происходят
участвует в регуляции клеточного цикла [59]
более активно в опухолевых клетках по сравне-
и может выступать в роли онкогена [60]. Дру-
нию с эмбриональными. Также была описана
гой пример включает в себя катепсины B, K,
локализация для всех 11 цистеиновых катепси-
L и S, ассоциированные с ядерной мембра-
нов в одной клеточной модели и обнаружено,
ной и регулирующие ядерный транспорт бел-
что все эти ферменты в разной степени при-
ков SMAD, которые являются важными ком-
сутствуют в клеточном ядре. Важно, что часть
понентами сигнального пути TGF-β. Этот
катепсинов была обнаружена в ядре в актив-
сигнальный путь играет важную роль как в
ной форме, что позволяет предположить, что
развитии рака [61], так и в противораковом
цистеиновые катепсины являются функцио-
иммунитете [62]. Ещё один представитель се-
нально активными не только в цитоплазме, но
мейства цистеиновых катепсинов, катепсин V,
и в ядрах клеток. Функции некоторых катеп-
также обнаруживается в ядрах клеток карци-
синов с ядерной локализацией активно изуча-
номы щитовидной железы. Его укороченная
ют, но молекулярные механизмы их действия
N-терминальная ядерная форма, вероятно,
и субстраты ещё только предстоит выявить.
участвует в нарушении клеточного цикла и вы-
Мы надеемся, что результаты настоящей рабо-
зывает гиперпролиферацию [24].
ты по изучению экспрессии и локализации ци-
Результаты нашего исследования показы-
стеиновых катепсинов найдут своё применение
вают, что в опухолевых клетках почки зрелые
в будущем, в том числе при поиске опухолевых
цистеиновые катепсины частично локализу-
маркеров в тканях пациентов с раком почки.
ются в ядрах клеток. Из литературных дан-
ных известно, что катепсины активируются
Вклад авторов. А.С.Ф., А.А.З. - концеп-
при кислых значениях pH [63] или при помо-
ция и руководство работой; А.С.Ф., Н.К.Т.,
щи других протеиназ [50]. С другой стороны,
И.И.К. - проведение экспериментов; А.С.Ф.,
повышение pH обычно приводит к потере
Е.Ю.З., А.П., К.И.И., А.А.З. - обсуждение
катепсинами своей активности [64]. Мы пред-
результатов исследования; А.С.Ф., А.А.З. - на-
полагаем, что в pH-нейтральной среде кле-
писание текста; А.С.Ф., К.И.И., А.А.З. - ре-
точного ядра катепсины могут либо частично
дактирование текста статьи.
терять свою активность, либо менять свою
Финансирование. Работа выполнена при фи-
субстратную специфичность, что позволяет
нансовой поддержке Российского фонда фунда-
предотвратить неспецифическую деградацию
ментальных исследований (грант № 21-75-30020).
ядерных белков. Помимо этого, каталити-
Конфликт интересов. Авторы заявляют об
ческая активность катепсинов в ядре клетки
отсутствии конфликта интересов.
может регулироваться их селективными ин-
Соблюдение этических норм. Настоящая
гибиторами стефинами, ядерная локализа-
статья не содержит описания каких-либо ис-
ция которых подтверждается литературными
следований с участием людей или животных в
данными [65].
качестве объектов.
СПИСОК ЛИТЕРАТУРЫ
1. Yadati, T., Houben, T., Bitorina, A., and Shiri-
Cathepsins. In: Proteases in Physiology and Patholo-
Sverdlov, R. (2020) The ins and outs of cathepsins:
gy, Springer, Singapore, doi: 10.1007/978-981-10-
physiological function and role in disease management,
2513-6_11.
Cells, 9, 1679, doi: 10.3390/cells9071679.
3. Turk, V., Stoka, V., Vasiljeva, O., Renko, M., Sun, T.,
2. Manchanda, M., Fatima, N., Chauhan, S.S. (2017)
Turk, B., and Turk, D. (2012) Cysteine cathepsins:
Physiological and Pathological Functions of Cysteine
from structure, function and regulation to new
БИОХИМИЯ том 88 вып. 7 2023
ЭКСПРЕССИЯ И ЛОКАЛИЗАЦИЯ КАТЕПСИНОВ
1277
frontiers, Biochim. Biophys. Acta Proteins Proteomics,
14.
Schweiger, A., Christensen, I. J., Nielsen, H. J.,
1824, 68-88, doi: 10.1016/j.bbapap.2011.10.002.
Sørensen, S., Brünner, N., and Kos, J. (2018) Serum
4.
Bestvater, F., Dallner, C., and Spiess, E. (2005) The
cathepsin H as a potential prognostic marker in
C-terminal subunit of artificially truncated human
patients with colorectal cancer, Int. J. Biol. Markers,
cathepsin B mediates its nuclear targeting and
19, 289-294, doi: 10.1177/172460080401900406.
contributes to cell viability, BMC Cell Biol., 6, 16,
15.
Tamhane, T., Njenga, R. W., Burden, R. E., Büth, H.,
doi: 10.1186/1471-2121-6-16.
Maelandsmo, G. M., Haugen, M. H., Scott, C. J.,
5.
Hsing, L. C., and Rudensky, A. Y. (2005) The ly-
and Brix, K. (2021) Trafficking of full-length and
sosomal cysteine proteases in MHC class II an-
N-terminally truncated cathepsin B in human
tigen presentation, Immunol. Rev.,
207,
229-241,
colorectal carcinoma cells, Appl. Sci., 11, 11936,
doi: 10.1111/j.0105-2896.2005.00310.x.
doi: 10.3390/app112411936.
6.
Stoeckle, C., Gouttefangeas, C., Hammer, M.,
16.
Kos, J., Stabuc, B., Schweiger, A., Krasovec, M.,
Weber, E., Melms, A., and Tolosa, E. (2009) Cathepsin
Cimerman, N., Kopitar-Jerala, N., and Vrhovec, I.
W expressed exclusively in CD8+ T cells and NK cells,
(1997) Cathepsins B, H, and L and their inhibitors
is secreted during target cell killing but is not essential
stefin A and cystatin C in sera of melanoma patients,
for cytotoxicity in human CTLs, Exp. Hematol., 37,
Clin Cancer Res., 3, 1815-1822.
266-275, doi: 10.1016/J.EXPHEM.2008.10.011.
17.
Dheilly, E., Battistello, E., Katanayeva, N., Sungalee, S.,
7.
Cheng, X., Ren, Z., Liu, Z., Sun, X., Qian, R.,
Michaux, J., Duns, G., Wehrle, S., Sordet-Dessimoz, J.,
Cao, C., Liu, B., Wang, J., Wang, H., Guo, Y.,
Mina, M., Racle, J., et al. (2020) Cathepsin S reg-
et al. (2022) Cysteine cathepsin C: a novel potential
ulates antigen processing and T cell activity in
biomarker for the diagnosis and prognosis of glio-
non-Hodgkin lymphoma, Cancer Cell, 37, 674-689.
ma, Cancer Cell Int., 22, 53, doi: 10.1186/S12935-
e12, doi: 10.1016/j.ccell.2020.03.016.
021-02417-6.
18.
Haider, A. S., Peters, S. B., Kaporis, H., Cardinale, I.,
8.
Majc, B., Habič, A., Novak, M., Rotter, A.,
Fei, J., Ott, J., Blumenberg, M., Bowcock, A. M.,
Porčnik, A., Mlakar, J., Župunski, V., Fonović,
Krueger, J. G., and Carucci, J. A. (2006) Genom-
U. P., Knez, D., Zidar, N., et al. (2022) Upregula-
ic analysis defines a cancer-specific gene expression
tion of cathepsin X in glioblastoma: interplay with
signature for human squamous cell carcinoma and
γ-enolase and the effects of selective cathepsin X in-
distinguishes malignant hyperproliferation from be-
hibitors, Int. J. Mol. Sci., 23, 1784, doi: 10.3390/
nign hyperplasia, J. Invest. Dermatol., 126, 869-881,
ijms23031784.
doi: 10.1038/sj.jid.5700157.
9.
Verbovšek, U., Motaln, H., Rotter, A., Atai, N. A.,
19.
Yang, L., Zeng, Q., Deng, Y., Qiu, Y., Yao, W., and
Gruden, K., Van Noorden, C. J. F., and Lah, T. T.
Liao, Y. (2022) Glycosylated cathepsin V serves as
(2014) Expression analysis of all protease genes reveals
a prognostic marker in lung cancer, Front. Oncol.,
cathepsin K to be overexpressed in glioblastoma, PLoS
12, 876245, doi: 10.3389/fonc.2022.876245.
One, 9, e0142116, doi: 10.1371/journal.pone.0111819.
20.
Teller, A., Jechorek, D., Hartig, R., Adolf, D.,
10.
Xiao, Y., Cong, M., Li, J., He, D., Wu, Q., Tian, P.,
Reißig, K., Roessner, A., and Franke, S. (2015) Dys-
Wang, Y., Yang, S., Liang, C., Liang, Y., et al. (2021)
regulation of apoptotic signaling pathways by inter-
Cathepsin C promotes breast cancer lung metastasis
action of RPLP0 and cathepsin X/Z in gastric can-
by modulating neutrophil infiltration and neutrophil
cer, Pathol. Res. Pract., 211, 62-70, doi: 10.1016/
extracellular Trap formation, Cancer Cell, 39, 423-437.
j.prp.2014.09.005.
e7, doi: 10.1016/J.CCELL.2020.12.012.
21.
Kiuchi, S., Tomaru, U., Ishizu, A., Imagawa, M.,
11.
Cairns, J., Ingle, J. N., Wickerham, L. D., Weinshil-
Kiuchi, T., Iwasaki, S., Suzuki, A., Otsuka, N.,
boum, R., Liu, M., and Wang, L. (2017) SNPs near
Deguchi, T., Shimizu, T., et al. (2017) Expression of
the cysteine proteinase cathepsin O gene (CTSO)
cathepsins V and S in thymic epithelial tumors, Hum.
determine tamoxifen sensitivity in ERα-positive breast
Pathol., 60, 66-74, doi: 10.1016/j.humpath.2016.09.027.
cancer through regulation of BRCA1, PLoS Genet., 13,
22.
Rudzińska, M., Parodi, A., Maslova, V. D., Efremov,
e1007031, doi: 10.1371/JOURNAL.PGEN.1007031.
Y. M., Gorokhovets, N. V., Makarov, V. A., Popkov,
12.
Santamaría, I., Velasco, G., Cazorla, M., Fueyo, A.,
V. A., Golovin, A. V., Zernii, E. Y., and Zamyatnin,
Campo, E., and López-Otín, C. (1998) Cathepsin
A. A. (2020) Cysteine cathepsins inhibition affects
L2, a novel human cysteine proteinase produced
their expression and human renal cancer cell
by breast and colorectal carcinomas, Cancer Res.,
phenotype, Cancers (Basel), 12, 1310, doi: 10.3390/
58, 1624-1630.
cancers12051310.
13.
Sereesongsaeng, N., McDowell, S. H., Burrows, J. F.,
23.
Caliò, A., Brunelli, M., Gobbo, S., Argani, P.,
Scott, C. J., and Burden, R. E. (2020) Cathepsin V
Munari, E., Netto, G., and Martignoni, G. (2021)
suppresses GATA3 protein expression in luminal A
Cathepsin K: a novel diagnostic and predictive bio-
breast cancer, Breast Cancer Res., 22, 139, doi: 10.1186/
marker for renal tumors, Cancers (Basel), 13, 2441,
S13058-020-01376-6.
doi: 10.3390/cancers13102441.
БИОХИМИЯ том 88 вып. 7 2023
1278
ФРОЛОВА и др.
24.
Al-Hashimi, A., Venugopalan, V., Sereesongsaeng, N.,
Han, Y. P., and Zamyatnin, A. A. (2019) Lost or
Tedelind, S., Pinzaru, A. M., Hein, Z., Springer, S.,
forgotten: the nuclear cathepsin protein isoforms
Weber, E., Führer, D., Scott, C. J., et al.
(2020)
in cancer, Cancer Lett., 462, 43-50, doi: 10.1016/
Significance of nuclear cathepsin V in normal thy-
j.canlet.2019.07.020.
roid epithelial and carcinoma cells, Biochim. Bio-
35.
Hiwasa, T., and Sakiyama, S.
(1996) Nuclear
phys. Acta Mol. Cell Res., 1867, 118846, doi: 10.1016/
localization of procathepsin L/MEP in ras-
j.bbamcr.2020.118846.
transformed mouse fibroblasts, Cancer Lett.,
99,
25.
Tedelind, S., Poliakova, K., Valeta, A., Hunegnaw, R.,
87-91, doi: 10.1016/0304-3835(95)04041-2.
Yemanaberhan, E. L., Heldin, N. E., Kurebayashi, J.,
36.
Sullivan, S., Tosetto, M., Kevans, D., Coss, A.,
Weber, E., Kopitar-Jerala, N., Turk, B., Bogyo, M.,
Wang, L., O’Donoghue, D., Hyland, J., Sheahan, K.,
and Brix, K. (2010) Nuclear cysteine cathepsin variants
Mulcahy, H., and O’Sullivan, J. (2009) Localiza-
in thyroid carcinoma cells, Biol. Chem., 391, 923-935,
tion of nuclear cathepsin L and its association with
doi: 10.1515/BC.2010.109.
disease progression and poor outcome in colorec-
26.
Kothapalli, R., Bailey, R. D., Kusmartseva, I., Mane, S.,
tal cancer, Int. J. Cancer, 125, 54-61, doi: 10.1002/
Epling-Burnette, P. K., and Loughran, T. P. (2003)
ijc.24275.
Constitutive expression of cytotoxic proteases and
37.
Senin, I. I., Tikhomirova, N. K., Churumova, V. A.,
down-regulation of protease inhibitors in LGL leu-
Grigoriev, I. I., Kolpakova, T. A., Zinchenko, D. V.,
kemia, Int. J. Oncol.,
22,
33-39, doi:
10.3892/
Philippov, P. P., and Zernii, E. Y. (2011) Amino
ijo.22.1.33.
acid sequences of two immune-dominant epitopes
27.
Rudzinska-Radecka, M., Frolova, A. S., Balakireva,
of recoverin are involved in Ca2+/recoverin-depen-
A. V., Gorokhovets, N. V., Pokrovsky, V. S., Sokolova,
dent inhibition of phosphorylation of rhodopsin,
D. V., Korolev, D. O., Potoldykova, N. V., Vinarov,
Biochemistry (Moscow), 76, 332-338, doi: 10.1134/
A. Z., Parodi, A., et al. (2022) In silico, in vitro, and
S0006297911030060.
clinical investigations of cathepsin B and stefin A
38.
Dyer, R. B., and Herzog, N. K. (1995) Isolation of
mRNA expression and a correlation analysis in kidney
intact nuclei for nuclear extract preparation from
cancer, Cells, 11, 1455, doi: 10.3390/CELLS11091455.
a fragile B-lymphocyte cell line, Biotechniques,
28.
El-Nadi, M., Hassan, H., Amer, M., Mohamed,
19, 192-195.
M. M., El-Shinawi, M., and Ibrahim, S. A. (2019)
39.
Olson, O. C., and Joyce, J. A. (2015) Cysteine
Cathepsin L is a potential marker for triple-nega-
cathepsin proteases: regulators of cancer progression
tive breast cancer, Egypt. Acad. J. Biol. Sci. C Physi-
and therapeutic response, Nat. Rev. Cancer,
15,
ol. Mol. Biol., 11, 29-36, doi: 10.21608/EAJBSC.
712-729, doi: 10.1038/nrc4027.
2019.26817.
40.
Fujimoto, T., Tsunedomi, R., Matsukuma, S.,
29.
Vizin, T., Christensen, I., Nielsen, H., and Kos, J.
Yoshimura, K., Oga, A., Fujiwara, N., Fujiwara, Y.,
(2012) Cathepsin X in serum from patients with col-
Matsui, H., Shindo, Y., Tokumitsu, Y., et al. (2021)
orectal cancer: relation to prognosis, Radiol. Oncol.,
Cathepsin B is highly expressed in pancreatic cancer
46, 207, doi: 10.2478/V10019-012-0040-0.
stem-like cells and is associated with patients’
30.
Tan, G.-J., Peng, Z.-K., Lu, J.-P., and Tang, F.-Q.
surgical outcomes, Oncol. Lett., 21, 30, doi: 10.3892/
(2013) Cathepsins mediate tumor metastasis, World J.
OL.2020.12291.
Biol. Chem., 4, 91, doi: 10.4331/WJBC.V4.I4.91.
41.
Singh, N., Das, P., Gupta, S., Sachdev, V., Srivasatava, S.,
31.
Chen, C. H., Bhasin, S., Khanna, P., Joshi, M.,
Datta Gupta, S., Pandey, R. M., Sahni, P., Chau-
Joslin, P. M., Saxena, R., Amin, S., Liu, S., Sindhu, S.,
han, S. S., and Saraya, A. (2014) Plasma cathepsin L:
Walker, S. R., et al. (2019) Study of cathepsin B
a prognostic marker for pancreatic cancer, World J.
inhibition in VEGFR TKI treated human renal cell
Gastroenterol.,
20,
17532, doi:
10.3748/WJG.V20.
carcinoma xenografts, Oncogenesis, 8, 15, doi: 10.1038/
I46.17532.
S41389-019-0121-7.
42.
Gocheva, V., Zeng, W., Ke, D., Klimstra, D.,
32.
Gondi, C. S., and Rao, J. S. (2013) Cathepsin B as
Reinheckel, T., Peters, C., Hanahan, D., and Joyce,
a cancer target, Expert Opin. Ther. Targets, 17, 281,
J. A. (2006) Distinct roles for cysteine cathepsin genes
doi: 10.1517/14728222.2013.740461.
in multistage tumorigenesis, Genes Dev., 20, 543-556,
33.
Sevenich, L., Schurigt, U., Sachse, K., Gajda, M.,
doi: 10.1101/gad.1407406.
Werner, F., Müller, S., Vasiljeva, O., Schwinde, A.,
43.
Loh, C. Y., Chai, J. Y., Tang, T. F., Wong, W. F.,
Klemm, N., Deussing, J., et al. (2010) Synergistic
Sethi, G., Shanmugam, M. K., Chong, P. P., and
antitumor effects of combined cathepsin B and
Looi, C. Y. (2019) The E-cadherin and N-cadherin
cathepsin Z deficiencies on breast cancer progression
switch in epithelial-to-mesenchymal transition:
and metastasis in mice, Proc. Natl. Acad. Sci. USA,
signaling, therapeutic implications, and challenges,
107, 2497, doi: 10.1073/PNAS.0907240107.
Cells, 8, 1118, doi: 10.3390/CELLS8101118.
34.
Soond, S. M., Kozhevnikova, M. V., Frolova, A. S.,
44.
Jevnikar, Z., Rojnik, M., Jamnik, P., Doljak, B.,
Savvateeva, L. V., Plotnikov, E. Y., Townsend, P. A.,
Fonović, U. P., and Kos, J. (2013) Cathepsin H
БИОХИМИЯ том 88 вып. 7 2023
ЭКСПРЕССИЯ И ЛОКАЛИЗАЦИЯ КАТЕПСИНОВ
1279
mediates the processing of talin and regulates
Altieri, D. C. (2002) Induction and regulation of
migration of prostate cancer cells, J. Biol. Chem., 288,
tumor necrosis factor-related apoptosis-inducing li-
2201-2209, doi: 10.1074/JBC.M112.436394.
gand/Apo-2 ligand-mediated apoptosis in renal cell
45.
Wu, N., Wang, Y. Z., Wang, K. K., Zhong, B. Q.,
carcinoma, Cancer Res., 62, 3093-3099.
Liao, Y. H., Liang, J. M., and Jiang, N.
(2022)
55.
Yang, Z., Liu, Y., Qin, L., Wu, P., Xia, Z., Luo, M.,
Cathepsin K regulates the tumor growth and metasta-
Zeng, Y., Tsukamoto, H., Ju, Z., Su, D., et al. (2017)
sis by IL-17/CTSK/EMT axis and mediates M2 mac-
Cathepsin H-mediated degradation of HDAC4 for
rophage polarization in castration-resistant prostate
matrix metalloproteinase expression in hepatic stellate
cancer, Cell Death Dis., 13, 813, doi: 10.1038/s41419-
cells, Am. J. Pathol., 187, 781-797, doi: 10.1016/
022-05215-8.
J.AJPATH.2016.12.001.
46.
Wang, J., Chen, L., Li, Y., and Guan, X. Y. (2011)
56.
Goulet, B., Sansregret, L., Leduy, L., Bogyo, M.,
Overexpression of cathepsin Z contributes to tumor
Weber, E., Chauhan, S. S., and Nepveu, A. (2007)
metastasis by inducing epithelial-mesenchymal transi-
Increased expression and activity of nuclear cathepsin
tion in hepatocellular carcinoma, PLoS One, 6, 24967,
L in cancer cells suggests a novel mechanism of
doi: 10.1371/JOURNAL.PONE.0024967.
cell transformation, Mol. Cancer Res., 5, 899-907,
47.
Sivaparvathi, M., Sawaya, R., Gokaslan, Z. L.,
doi: 10.1158/1541-7786.MCR-07-0160.
Chintala, K. S., and Rao, J. S. (1996) Expression
57.
Tamhane, T., Lllukkumbura, R., Lu, S., Maelandsmo,
and the role of cathepsin H in human glioma pro-
G. M., Haugen, M. H., and Brix, K. (2016) Nuclear
gression and invasion, Cancer Lett., 104, 121-126,
cathepsin L activity is required for cell cycle
doi: 10.1016/0304-3835(96)04242-5.
progression of colorectal carcinoma cells, Biochimie,
48.
Rojnik, M., Jevnikar, Z., Mirkovic, B., Janes, D.,
122, 208-218, doi: 10.1016/j.biochi.2015.09.003.
Zidar, N., Kikelj, D., and Kos, J. (2011) Cathep-
58.
Maubach, G., Lim, M. C., and Zhuo, L. (2008) Nu-
sin H indirectly regulates morphogenetic protein-4
clear cathepsin F regulates activation markers in rat
(BMP-4) in various human cell lines, Radiol. Oncol.,
hepatic stellate cells, Mol. Biol. Cell, 19, 4238-4248,
45, 259, doi: 10.2478/V10019-011-0034-3.
doi: 10.1091/mbc.e08-03-0291.
49.
Burton, L. J., Dougan, J., Jones, J., Smith, B. N.,
59.
Goulet, B., Truscott, M., and Nepveu, A. A. (2006)
Randle, D., Henderson, V., and Odero-Marah, V. A.
Novel proteolytically processed CDP/Cux isoform of
(2017) Targeting the nuclear cathepsin L CCAAT
90 kDa is generated by cathepsin L, Biol. Chem., 387,
displacement protein/cut homeobox transcription
1285-1293, doi: 10.1515/BC.2006.159.
factor-epithelial mesenchymal transition pathway in
60.
Feng, F., Zhao, Z., Zhou, Y., Cheng, Y., Wu, X., and
prostate and breast cancer cells with the Z-FY-CHO
Heng, X. (2021) CUX1 facilitates the development
inhibitor, Mol. Cell. Biol., 37, e00297-16, doi: 10.1128/
of oncogenic properties via activating Wnt/β-catenin
MCB.00297-16.
signaling pathway in glioma, Front. Mol. Biosci., 8,
50.
Lamort, A. S., Hamon, Y., Czaplewski, C., Giel-
705008, doi: 10.3389/FMOLB.2021.705008.
don, A., Seren, S., Coquet, L., Lecaille, F., Lesner, A.,
61.
Zhao, M., Mishra, L., and Deng, C. X. (2018) The
Lalmanach, G., Gauthier, F., et al. (2019) Processing
role of TGF-β/SMAD4 signaling in cancer, Int. J.
and maturation of cathepsin C zymogen: a biochemi-
Biol. Sci., 14, 111, doi: 10.7150/IJBS.23230.
cal and molecular modeling analysis, Int. J. Mol. Sci.,
62.
MaruYama, T., Chen, W. J., and Shibata, H. (2022)
20, 4747, doi: 10.3390/IJMS20194747.
TGF-β and cancer immunotherapy, Biol. Pharm.
51.
Brodaczewska, K. K., Szczylik, C., Fiedorowicz, M.,
Bull., 45, 155-161, doi: 10.1248/BPB.B21-00966.
Porta, C., and Czarnecka, A. M. (2016) Choosing
63.
Turk, B., Dolenc, I., Lenarcic, B., Krizaj, I., Turk, V.,
the right cell line for renal cell cancer research, Mol.
Bieth, J. G., and Björk, I. (1999) Acidic pH as
Cancer, 15, 83, doi: 10.1186/S12943-016-0565-8.
a physiological regulator of human cathepsin L
52.
Sinha, R., Winer, A. G., Chevinsky, M., Jakubowski, C.,
activity, Eur. J. Biochem., 259, 926-932, doi: 10.1046/
Chen, Y. B., Dong, Y., Tickoo, S. K., Reuter, V. E.,
j.1432-1327.1999.00145.x.
Russo, P., Coleman, J. A., et al. (2017) Analysis of
64.
Turk, B., Dolenc, I., Zerovnik, E., Turk, D., Gu-
renal cancer cell lines from two major resources enables
bensek, F., and Turk, V. (1994) Human cathep-
genomics-guided cell line selection, Nat. Commun., 8,
sin B is a metastable enzyme stabilized by spe-
15165, doi: 10.1038/ncomms15165.
cific ionic interactions associated with the active
53.
Carvalho, M., Ferreira, P. J., Mendes, V. S., Silva, R.,
site, Biochemistry, 33, 14800-14806, doi: 10.1021/
Pereira, J. A., Jerónimo, C., and Silva, B. M. (2010)
bi00253a019.
Human cancer cell antiproliferative and antioxidant
65.
Paraoan, L., Ratnayaka, A., Spiller, D. G., Hiscott, P.,
activities of Juglans regia L., Food Chem. Toxicol., 48,
White, M. R. H., and Grierson, I. (2004) Unexpect-
441-447, doi: 10.1016/j.fct.2009.10.043.
ed intracellular localization of the AMD-associated
54.
Griffith, T. S., Fialkov, J. M., Williams, R. D., Scott,
cystatin C variant, Traffic, 5, 884-895, doi: 10.1111/
D. L., Azuhata, T., Sandler, A. D., Wall, N. R., and
J.1600-0854.2004.00230.X.
БИОХИМИЯ том 88 вып. 7 2023
1280
ФРОЛОВА и др.
EXPRESSION, INTRACELLULAR LOCALIZATION AND MATURATION
OF CYSTEINE CATHEPSINS IN RENAL EMBRYONIC
AND CANCER CELL LINES
A. S. Frolova1,2, N. K. Tikhomirova3, I. I. Kireev3, E. Yu. Zernii3, A. Parodi2,
K. I. Ivanov2, and A. A. Zamyatnin, Jr.1,2,3,4*
1 Institute of Molecular Medicine, Sechenov First Moscow State Medical University, 119991 Moscow, Russia
2 Scientific Center for Translation Medicine, Sirius University of Science and Technology, 354340 Sochi, Russia
3 Belozersky Institute of Physico-Chemical Biology, Lomonosov Moscow State University,
119992 Moscow, Russia; e-mail: zamyat@belozersky.msu.ru
4 Faculty of Bioengineering and Bioinformatics, Lomonosov Moscow State University, 119234 Moscow, Russia
Cysteine cathepsins play an important role in tumor development and metastasis. The expression of these
enzymes is often increased in many types of tumor cells. Cysteine cathepsins contribute to carcinogenesis
through a number of mechanisms, including proteolysis of extracellular matrix and signaling molecules on
the cell surface, as well as degradation of transcription factors and disruption of signaling cascades in the
cell nucleus. Distinct oncogenic functions have been reported for several members of the cysteine cathepsin
family in various types of cancer, but a comparative study of all eleven cysteine cathepsins in one exper-
imental model is still missing. In this work, we assessed and compared the expression, localization, and
maturation of all eleven cysteine cathepsins in embryonic kidney cells HEK293 and kidney cancer cell lines
769-P and A-498. We found that the expression of cathepsins V, B, Z, L, and S was 3- to 9-fold higher
in kidney tumor cells than in embryonic cells. We also showed that all cysteine cathepsins were present in
varying amounts in the nucleus of both embryonic and tumor cells. Notably, more than half of the cathepsin
Z or K and over 88% of cathepsin F were localized in tumor cell nuclei. Moreover, mature forms of cysteine
cathepsins were more prevalent in tumor cells than in embryonic cells. These results can be further used
to develop novel diagnostic tools and may assist in the investigation of cysteine cathepsins as potential ther-
apeutic targets.
Keywords: cysteine cathepsins, subcellular localization, protein expression, protease maturation, renal cancer
БИОХИМИЯ том 88 вып. 7 2023