БИОХИМИЯ, 2023, том 88, вып. 8, с. 1352 - 1365
УДК 57.083;57.088
АНАЛИЗ ТРАНСФЕРРИНА В МОЧЕ У БОЛЬНЫХ
РАКОМ МОЧЕВОГО ПУЗЫРЯ С ПОМОЩЬЮ НАНОТЕЛ
© 2023 А.М. Сачко1, О.С. Горяйнова1, Т.И. Иванова1,2, И.Ю. Николаева3,
М.Е. Тарнопольская3, А.Ю. Бычков3, М.Я. Гаас4, Н.В. Воробьев5,6,
А.Д. Каприн4,7, П.В. Шегай4,7, С.В. Тиллиб1*
1 Институт биологии гена РАН,
119334 Москва, Россия; электронная почта: tillib@genebiology.ru
2 Медицинский радиологический научный центр им. А.Ф. Цыба -
филиал ФГБУ «НМИЦ радиологии» Минздрава России, 249036 Обнинск, Калужская обл., Россия
3 Московский государственный университет имени М.В. Ломоносова, геологический факультет,
119234 Москва, Россия
4 Российский университет дружбы народов, 117198 Москва, Россия
5 Московский научно-исследовательский онкологический институт имени П.А. Герцена -
филиал ФГБУ «НМИЦ радиологии» Минздрава России, 125284 Москва, Россия
6 Первый Московский государственный медицинский университет
имени И.М. Сеченова Минздрава России, 119991 Москва, Россия
7 Национальный медицинский исследовательский центр радиологии Минздрава России,
125284 Москва, Россия
Поступила в редакцию 30.11.2022
После доработки 14.06.2023
Принята к публикации 03.07.2023
Известно, что коэффициент насыщения трансферрина (Tf) железом в крови человека является
важным клиническим параметром. Для анализа тонких изменений в относительной представлен-
ности разных форм трансферрина, потенциально связанных с патологическим процессом, могут
быть использованы специфические антитела. Недавно авторы данного исследования смогли по-
лучить и охарактеризовать высокоспецифические однодоменные антитела (нанотела), узнаю-
щие преимущественно железо-насыщенную (holo-Tf) или железо-ненасыщенную (apo-Tf) форму
трансферрина. В данной работе в условиях более приближенных к физиологическим, чем в ранее
проводимых экспериментах, мы дополнительно продемонстрировали, что эти уникальные нано-
тела обладают чрезвычайно высокой дифференциальной специфичностью связывания разных
форм Tf в различных биологических жидкостях человека. Нам удалось с помощью этих нанотел
впервые провести анализ относительной представленности форм Tf в образцах мочи больных
раком мочевого пузыря (РМП). Было показано, что повышение концентрации общего Tf в образ-
цах мочи, нормализованных по креатинину, ассоциировано со степенью прогресса и роста злока-
чественности РМП. В образцах здоровых доноров и на ранних стадиях РМП (G1) Tf детектируется
в сильно меньших количествах (в сравнении с более поздними стадиями) и лишь при дополни-
тельном концентрировании исследуемых проб. Для большинства исследованных образцов мочи
больных РМП ожидаемо (как ранее показано в случае Tf в крови терминальных больных раком
яичников) концентрация аpo-Tf явно выше, чем holo-Tf, особенно в случае наиболее продвину-
того мышечно-инвазивного РМП. Неожиданностью для нас стало обнаружение в образцах мочи
некоторых больных РМП примерно равных количеств apo-Tf и «holo-Tf». Мы предположили, что
фракция «holo-Tf» в данном случае в значительной степени может быть представлена «вторичными
комплексами», образуемыми apo-Tf в соединении с ионами, отличными от Fe3+, накапливающи-
мися в моче некоторых раковых больных и способными связываться с apo-Tf, меняя его конфор-
мацию в направлении holo-Tf. Методом масс-спектроскопии с ионизацией в индуктивно-связан-
ной плазме мы получили первые результаты, подтверждающие предположенную нами гипотезу.
Препарат «holo-Tf» в этих образцах мочи оказался сильно обогащен цинком и никелем. Также в
этом препарате наблюдается относительное обогащение кадмием, но он присутствует в силь-
но меньших концентрациях. Полученные данные указывают на то, что используемое нанотело,
Принятые сокращения: МС-ИСП - масс-спектроскопия с ионизацией в индуктивно-связанной плазме; РМП - рак
мочевого пузыря; Tf - белок трансферрин; apo-Tf - не содержащая железо форма Tf; holo-Tf - насыщенная железом
форма Tf; TfR - рецептор трансферрина.
* Адресат для корреспонденции.
1352
АНАЛИЗ ТРАНСФЕРРИНА В МОЧЕ
1353
узнающее преимущественно железо-насыщенную форму трансферрина (holo-Tf), способно так-
же связывать Tf в ассоциации с иными ионами металлов, отличными от железа. Эта способность
потенциально может открыть новые возможности в исследованиях относительной представлен-
ности разных ионов металлов в ассоциации с трансферрином в биологических жидкостях человека
в норме и патологии.
КЛЮЧЕВЫЕ СЛОВА: однодоменное антитело, нанотело, апо- и голо-трансферрин, аффинная хромато-
графия, рак мочевого пузыря, МС-ИСП.
DOI: 10.31857/S0320972523080055, EDN: IJFNHI
ВВЕДЕНИЕ
лей на продвинутых стадиях болезни [4], то до
последнего времени мало внимания уделялось
Поддержание и регуляция гомеостаза же-
другому белку острой фазы - трансферрину.
леза, необходимого микроэлемента для клю-
Уровень сывороточного Tf снижен при воспа-
чевых физиологических процессов, осущест-
лениях, злокачественных процессах, в случае
вляется целым каскадом белков, в котором
перегрузки железом и повышен при дефици-
сбой одного из звеньев может приводить к
те железа [5]. Совсем недавно авторы данной
тяжелым патологическим последствиям
[1].
статьи с соавторами показали, что измерение
Транспорт железа и депонирование осущест-
уровня трансферрина и его насыщенности же-
вляется в основном посредством комплексов
лезом в крови имеет большой потенциал в
железо/трансферрин и железо/ферритин. Вы-
оценке риска как рака яичников, так и функ-
сокая скорость пролиферации большинства
ционального железодефицита у пациентов с
опухолевых клеток, зависящая в том числе от
диагнозом рак яичников [6].
поступления достаточного количества железа,
Важным клиническим параметром явля-
часто ассоциирована с повышенной экспрес-
ется коэффициент насыщения трансферрина
сией рецепторов трансферрина [2]. Трансфер-
железом, который рассчитывается как отно-
рин (Tf) - это гликопротеин размером 80 кДа,
шение содержания железа в крови пациента к
состоящий из двух гомологичных частей, или
показателю общей железосвязывающей способ-
долей (N- и C- по 40 кДа). Каждая доля спо-
ности сыворотки крови [7]. Для более прямого
собна связывать один ион свободного трех-
анализа тонких изменений в относительной
валентного железа (Fe3+), то есть к Tf можно
представленности разных форм Tf, потенци-
присоединить до двух ионов железа. Насыщен-
ально связанных с патологическим процессом,
ную железом форму Tf обозначают как holo-Tf.
могут быть использованы специфические ан-
Не содержащая железо форма Tf, называемая
титела. Недавно авторы данного исследования
apo-Tf, способна с высокой эффективностью
смогли получить и охарактеризовать, по-ви-
связывать Fe3+ в крови, превращаясь в holo-Tf,
димому, первые такие высокоспецифические
и транспортировать Fe3+ на поверхность клет-
однодоменные антитела (нанотела), узнающие
ки для интернализации посредством взаимо-
преимущественно holo-Tf (aTf1) или аpo-Tf
действия с рецептором трансферрина (TfR).
(aTf2) [8]. Было показано, что параллельное
Комплекс железосвязанного Tf c рецептором,
использование иммуносорбентов, создавае-
образующийся на поверхности клетки, интер-
мых на основе этих нанотел, потенциально
нализуется посредством клатрин-зависимого
может выявлять изменения в относительной
эндоцитоза. Работа протонного насоса в эндо-
представленности аpo- и holo-Tf в биологи-
сомальной мембране приводит к снижению
ческих жидкостях человека. Так, с помощью
pH до 5,5, что запускает конформационные
метода, основанного на иммуноаффинной
изменения как в Tf, так и в TfR1, которые ве-
хроматографии и последующего электрофоре-
дут к последующему высвобождению железа
тического фракционирования специфически
и превращению holo-Tf в apo-Tf. Трехвалент-
связавшихся и затем элюированных изоформ
ное железо (Fe3+) превращается в двухвалент-
трансферрина, мы недавно продемонстри-
ное железо (Fe2+), комплекс рецептор/apo-Tf
ровали заметное уменьшение доли железо-
затем возвращается на поверхность клетки, где
насыщенного трансферрина (holo-Tf) отно-
apo-Tf высвобождается из связи с рецептором
сительно свободного от железа трансферрина
при нейтральных значениях pH [3].
(apo-Tf) в плазме крови больных раком яич-
Если для ферритина было показано, что
ников женщин [6]. Если в норме отношение
его уровень в сыворотке крови может являть-
holo-Tf/apo-Tf определялось в диапазоне 30-
ся биомаркером для выявления ряда опухо-
55%/45-70%, то у больных раком яичников
БИОХИМИЯ том 88 вып. 8 2023
1
354
САЧКО и др.
это соотношение - 10-23%/77-95%. Полу-
с ионизацией в индуктивно-связанной плазме
ченные результаты наглядно демонстрируют
(МС-ИСП). Препарат «holo-Tf» в образцах
эффективность данного метода анализа, и его
мочи, где не было явного преобладания apo-Tf,
применение может быть ценным дополнением
оказался сильно обогащен цинком и нике-
при выборе тактики лечения онкологических
лем. Полученные данные указывают на то,
больных с разными формами железодефицита,
что используемое нанотело, узнающее преиму-
а также при формировании группы риска сре-
щественно железо-насыщенную форму транс-
ди больных с новообразованиями яичников.
феррина (holo-Tf), способно также связывать
В представленной работе с помощью спе-
трансферрин в ассоциации с иными ионами
циально разработанной аффинной хромато-
металлов, отличными от железа. Эта способ-
графии со стадией элюции при нейтральном
ность потенциально может открыть новые
значении pH мы показали, что полученные
возможности в исследованиях относительной
ранее два нанотела обладают альтернативной
представленности разных ионов металлов в
специфичностью и способны связывать в био-
ассоциации с трансферрином в биологических
логических жидкостях человека или только
жидкостях человека в норме и патологии.
тот эпитоп Tf, который формируется в отсут-
ствие связи Тf (доли Tf) c ионами металлов
(эпитоп apo-Tf), или альтернативный эпи-
МАТЕРИАЛЫ И МЕТОДЫ
топ Tf (доли Tf), для формирования которого
требуется связь Tf с ионами металлов (эпитоп
Образцы мочи и плазмы крови. В работе ис-
holo-Tf). Иммуносорбенты на основе этих на-
пользовали образцы мочи 13 первичных боль-
нотел были затем использованы с целью ана-
ных, находящихся на лечении по поводу РМП в
лиза диагностического потенциала как уровня
отделении онкоурологии Московского научно-
общего Tf, так и соотношения holo-Tf и аpo-Tf
исследовательского онкологического инсти-
в образцах мочи больных раком мочевого пу-
тута имени П.А. Герцена - филиала «НМИЦ
зыря (РМП) на разных стадиях болезни. Нам
радиологии» Минздрава России (таблица).
удалось показать прямую количественную ас-
У 12 больных диагностирована уротелиальная
социацию общего Tf c прогрессом РМП. Для
карцинома мочевого пузыря, представленная в
большинства образцов мочи мы наблюдали
большинстве случаев (8) немышечно-инвазив-
ожидаемое заметное уменьшение доли holo-Tf
ным РМП - № 2-9. Мышечно-инвазивный
относительно apo-Tf, как это ранее было пока-
рак диагностирован у 4 пациентов - № 10-13.
зано для Tf в крови больных раком яичников
У одного пациента были обнаружены добро-
женщин [6]. Вместе с тем в ряде проб мочи
качественные новообразования мочевого пу-
больных РМП мы обнаружили неожиданное
зыря (№ 1). Постановку диагноза и классифи-
(в сравнении с большинством других иссле-
кацию заболеваний проводили в соответствии
дованных в этой работе проб) относительное
с клиническими рекомендациями Минздрава
увеличение доли Tf, выделяемого с помощью
России (протокол от 20.12.2019 г. № 10/2-3-4).
нанотел aTf1, связывающих holo-Tf. Известно,
Образцы утренней мочи вскоре после получе-
что раковые клетки, как правило, требуют по-
ния транспортировали из Московского научно-
вышенное количество ионов железа, что дол-
исследовательского онкологического инсти-
жно приводить к относительному уменьшению
тута имени П.А. Герцена в Институт биологии
holo-Tf. Для объяснения наблюдаемых эпизо-
гена РАН, где их сразу подвергали низкоско-
дических случаев увеличения доли holo-Tf в
ростному центрифугированию (2000 g, 15 мин)
моче некоторых больных РМП мы выдвину-
при комнатной температуре. Аликвоты супер-
ли гипотезу о том, что выявляемый «holo-Tf»
натантов помещали на хранение в морозиль-
может состоять в значительной мере из вто-
ник на -80 °С. Образцы утренней мочи здо-
ричных комплексов, образованных apo-Tf в
ровых доноров брали у добровольцев разного
соединении с ионами, отличными от Fe3+ и
пола, не отличающихся значимо по возрасту от
накапливающимися в моче ракового больного.
больных РМП исследуемой группы.
Связывaние apo-Tf с такими ионами предпо-
Плазма крови здорового донора получена в
ложительно меняет конформацию Tf, делая
Медицинском радиологическом научном цен-
доступными эпитопы, характерные именно
тре им. А.Ф. Цыба - филиале «НМИРЦ» Мин-
для holo-Tf, которые узнаются holo-Tf-специ-
здрава России.
фическим нанотелом. Мы получили первые
Работа с нанотелами, создание и использо-
подтверждения данной гипотезы с помощью
вание иммуносорбентов. Мы использовали про-
анализа ионов металлов в препарате «holo-Tf»
дуценты нанотел, а также протоколы наработки
в образцах мочи методом масс-спектрометрии
и очистки адаптированных нанотел, узнающих
БИОХИМИЯ том 88 вып. 8 2023
АНАЛИЗ ТРАНСФЕРРИНА В МОЧЕ
1355
Характеристика проб мочи больных РМП
№/Диагноз
Возраст
Стадия
Степень
Белок (Б)
Креатинин (Кр)
Пол
Б/Kр
(а, б, в)
(годы)
(TNM)
злокачественности*
г/литр
г/литр
1а
Ж
74
-
-
0,079
1,513
0,052
2б
М
54
рT1N0M0
G1
0,186
2,720
0,068
3б
М
61
рT1N0M0
G1
0,139
5,328
0,026
4б
М
31
cT1N0M0
G1
0,035
1,157
0,031
5б
Ж
79
рT1N0M0
HG (G2)
0,371
3,589
0,103
6б
М
71
рT1N0M0
HG (G2)
0,624
5,782
0,108
7б
М
58
pT1N0M0
HG (G2)
0,373
2,300
0,162
8б
Ж
44
pT1N0M0
HG (G2)
0,233
0,496
0,470
9б**
Ж
83
pT1N0M0
-
1,345
1,522
0,884
10в
М
81
рT2N0M0
HG (G3)
0,943
2,839
0,332
11в
М
62
pT2N0M0
HG
1,865
1,755
1,063
12в**
Ж
68
pT2N0M0
-
1,947
0,983
1,980
13в
М
62
рT4aN1M0
HG (G4)
0,757
0,128
5,896
Примечание. Диагноз: а - доброкачественное новообразование (№ 1); б - немышечно-инвазивный РМП (№ 2-9);
в - мышечно-инвазивный РМП (№ 10-13).
* Высокая степень злокачественности, низкодифференцированная опухоль - HG (high-grade), G2-G4; низкая
степень злокачественности, высокодифференцированная опухоль - LG (low grade), G1.
** Установить степень злокачественности клеток не удалось для данного образца.
holo-Tf (aTf1) или аpo-Tf (aTf2), которые со-
описано ранее [8, 9]. Примерно 300 мкг нано-
всем недавно были получены и описаны соав-
тел брали для пришивки на каждые 100 мкл
торами данной статьи [8]. Получаемые нано-
сефарозы. Таким образом получали иммуно-
тела содержат на С-конце длинную линкерную
сорбенты (иммуноаффинные колонки), спе-
последовательность (28 аминокислот длинного
цифичность которых определялась свойствами
варианта шарнирного участка неканоническо-
иммобилизованного нанотела. Эти иммуносор-
го верблюжьего антитела), после которой идут
бенты использовали, как описано ранее [8, 9].
два пептидных фрагмента: гемагглютинин
Опыты с разными образцами мочи, норма-
(НА)-таг, позволяющий детектировать нано-
лизованными (выравненными) относительно
тело с помощью коммерческих антител к этому
концентрации креатинина и соответственно
пептиду, и последовательность из 6 остатков
разбавленными не менее чем в 2 раза в 1× PBS
гистидина (His-таг), позволяющая эффектив-
(137 мМ NaCl,
2,7 мМ KCl,
10 мМ Na2HPO4,
но очищать содержащий ее белок с помощью
2 мМ KH2PO4, pH 7,4), проводили параллель-
металл-хелатной аффинной хроматографии на
но на отдельных колонках. Промывку несвя-
Ni2+-NTA-агарозе, используя HIS-Select Niсkel
завшегося материала проводили 1× PBS в три
Affinity Gel («Sigma-Aldrich», США). Линкер-
этапа 10-кратным объемом колонки, и за-
ный линейный участок содержит 4 удобно
тем связавшийся материал элюировали 0,1 М
расположенных и хорошо доступных остатка
Glycine-HCl (pH 2,5) в три этапа 3-кратным
лизина. По этим остаткам очень удобно про-
объемом колонки с последующей нейтрализа-
водить химические реакции пришивки других
цией элюата до pH 7,0 добавлением 1 М Tris.
молекул, в том числе иммобилизовать нанотело
Эксперименты по иммобилизации адап-
на CNBr-сефарозе. Адаптированные нанотела
тированных нанотел на Ni2+-NTA-агарозе и
пришивали к CNBr-активированной сефа-
последующему иммуноаффинному фракцио-
розе 4В («GE Healthcare Life Sciences», США),
нированию компонентов плазмы крови по-
согласно рекомендациям производителя, и как
дробно описаны ниже.
БИОХИМИЯ том 88 вып. 8 2023
1
356
САЧКО и др.
Электрофорез белков. Электрофоретиче-
3%-ной азотной кислотой. Измерения прово-
ский анализ белков обычно проводили в гра-
дились на квадрупольном масс-спектрометре
диентном (5-19%) SDS-ПААГ по Лэммли, как
SUPEC 7000 («Focused Photonics Inc», Китай)
описано нами ранее [8, 9]. Использовали при-
с ионизацией в индуктивно-связанной плазме.
бор MiniProtean 3 («Bio-Rad», США), источник
Детектирование ионов осуществлялось элек-
питания - Эльф-4 («ДНКТехнология», Рос-
тронным умножителем, сохраняющим линей-
сия). В качестве белкового маркера исполь-
ность в диапазоне 9-10 порядков величины,
зовали либо Spectra Multicolor Broad Range
что достигается автоматическим переключе-
Protein Ladder
(«Thermo Fisher Scientific»,
нием между режимами счета импульсов и
США), либо Precision Plus Protein Standards
аналоговым. Калибровку чувствительности
Dual Color («Bio-Rad»). В качестве маркеров
прибора по всей шкале масс проводили по эта-
использовали также коммерческие препараты
лонным 68-элементным калибровочным рас-
holo-Transferrin human (holo-Tf), apo-Transferrin
творам А и B (ICP-MS-68A; «HPS», США),
human (apo-Tf) фирмы «Sigma-Aldrich» и пре-
включающим все анализируемые элементы в
парат рекомбинантного растворимого рецеп-
пробах. Для контроля качества измерений и
тора трансферрина sTfR («HyTest», Россия).
учета дрейфа чувствительности прибора ана-
Для разделения apo-Tf и holo-Tf использова-
лизы образцов чередовали с анализами эта-
ли электрофорез в «неденатурирующем» ПААГ,
лонного образца с периодичностью 1 : 10. В ка-
разработанный Nowakowski et al. [10] (в моди-
честве внутреннего стандарта в пробы вводили
фикации, представленной на интернет-странице
индий в концентрации 10 нг. Относительная
погрешность анализа составляла 0,5-2%.
который мы адаптировали для эффективного
разделения holo-Tf и apo-Tf [8]. Использовали
8%-ный разделяющий и 4%-ный концентри-
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
рующий гели. По окончании электрофореза
гель отмывали в дистиллированной воде (3 раза
В непосредственно предшествующих дан-
по 5 мин), затем окрашивали белки в Imperial™
ному исследованию экспериментах, которые
Protein Stain («Thermo Fisher Scientific»). Под-
были совсем недавно опубликованы [8], мы
готовку проб для электрофоретического фрак-
описали получение и продемонстрировали по-
ционирования белков в различных образцах
тенциал применения (в формате иммуносор-
проводили, как описано ранее [9, 10]. Объемы
бентов) высокоспецифических однодоменных
аликвот определяли в каждом конкретном слу-
антител (нанотел), узнающих преимуществен-
чае. Объем наносимой на гель пробы умень-
но holo-Tf (aTf1) или аpo-Tf (aTf2) человека.
шали, концентрируя белки с помощью филь-
Нам удалось подобрать вариант «неденатури-
трационно-центрифужных приспособлений
рующего» ПААГ-электрофореза, в котором, в
Amicon («Millipore», США) c размером отсе-
отличие от более традиционного электрофо-
чения 10 кДа, или осаждали, используя метод
реза в SDS-ПААГ, очень сильно различаются
Wessel-Fluеgge [11].
электрофоретические подвижности двух форм
Измерение концентрации креатинина и об-
трансферрина, apo-Tf и holo-Tf, что позволяет
щего белка в образцах мочи. Количественное
их количественно оценивать в образце биоло-
содержание креатинина и общего белка
гической жидкости человека.
определяли с помощью анализатора мочи
В недавно опубликованной работе, посвя-
URiСКАН-БК («Эйлитон», Россия) и наборов
щенной анализу форм Tf в сыворотках крови
реагентов той же фирмы для количественного
больных раком яичников [6], мы с другими
определения содержания креатинина (Креа-
соавторами продемонстрировали, что с помо-
тинин-UTS) и белка (ПГК-UTS) в моче, со-
щью полученных анти-Tf-нанотел, пришитых
гласно протоколу фирмы-изготовителя.
к сефарозе, удается с очень высокой специ-
Масс-спектрометрия с ионизацией в индук-
фичностью выделять трансферрин из сыворот-
тивно-связанной плазме. Препараты для ана-
ки крови человека. При фракционировании в
лиза получали в результате иммуноаффин-
SDS-ПААГ связавшихся и затем элюирован-
ной хроматографии аликвот биологических
ных белков мы детектировали практически
жидкостей на колонках с иммобилизованным
только один белок - трансферрин. Исполь-
нанотелом (aTf1), узнающим holo-Tf. Препа-
зуя эти же нанотела, а также разработанные
раты (элюаты с колонок) нормировали по ко-
методы фракционирования разных форм Tf, в
личеству трансферрина (100 мкг) и передавали
данной статье мы сфокусировали внимание на
на анализ в одинаковых объемах (300 мкл).
исследовании Tf в моче больных раком моче-
Для измерения раствор разбавляли в 10 раз
вого пузыря.
БИОХИМИЯ том 88 вып. 8 2023
АНАЛИЗ ТРАНСФЕРРИНА В МОЧЕ
1357
В ранее проводимой работе [8] для иссле-
ной элюции 25 мМ имидазола белки в элюате
дования связываемых иммобилизованными на
не детектировали (не показано). Из преды-
сефарозе нанотелами разных изоформ транс-
дущих наших опытов с аналогично модифи-
феррина, разделяя связавшиеся белки в «не-
цированными нанотелами мы знаем, что они
денатурирующем» ПААГ, мы использовали
обычно элюируются при концентрации имида-
коммерческие препараты Tf (holo-Tf и apo-Tf
зола выше 75 мМ. Из совокупности данных
фирмы «Sigma-Aldrich»), которые содержали
мы предполагаем, что после связывания с Tf y
примеси друг друга. При иммуноаффинной
данных нанотел немного уменьшается проч-
хроматографии для элюции связавшихся бел-
ность связи с Ni2+-NTA-агарозой, и комплексы
ков использовали кислые значения pH, при
нанотела с трансферрином элюируются при
которых могли разрушаться комплексы Tf c
меньших концентрациях имидазола, чем сво-
железом и holo-Tf мог превращаться в apo-Tf,
бодное нанотело. При 250 мМ элюируется бе-
как это происходит в эндосомах in vivo. Ука-
лок размером чуть меньше, чем Tf, без нанотел,
занные факторы могли влиять на получаемый
по-видимому, связавшийся непосредственно с
результат соотношения связываемых наноте-
Ni2+-NTA-агарозой. Из полученного резуль-
лами разных изоформ трансферрина. В пред-
тата мы заключили, что для данного метода
варительных экспериментах в этой работе мы
фракционирования оптимальным для элюции
попытались исключить эти факторы, чтобы
комплексов трансферрина, связавшегося с на-
уточнить степень специфичности используе-
нотелом, будет использование 70 мМ имидазо-
мых нанотел для разных форм Tf в биологи-
ла, а Ni2+-NTA-агарозу следует максимально
ческих жидкостях человека. В качестве источ-
загружать иммобилизуемыми нанотелами (по
ника Tf мы взяли сначала свежевыделенную
крайней мере 5 мг нанотел на 1 мл колонки),
плазму крови нашего коллеги-добровольца
чтобы максимально насытить колонку наноте-
(взятую в медицинском учреждении в тот же
лом и таким образом, по возможности, макси-
день без заморозки), а адаптированные нано-
мально экранировать прямое связывание бел-
тела были иммобилизованы на Ni2+-NTA-ага-
ков плазмы, включая Tf, c Ni2+-NTA-агарозой.
розе благодаря присутствию His-тага на их
В таких предположительно оптимизирован-
С-конце. Впоследствии иммобилизованное на-
ных условиях мы провели иммуноаффинную
нотело и связавшийся с ним белок могут быть
аффинно проэлюированы раствором, содер-
жащим высокую концентрацию имидазола,
при нейтральном значении рН. В данном мето-
де основным нежелательным фоновым эффек-
том является способность некоторых белков
плазмы крови связываться напрямую с Ni2+-
NTA-агарозой. Мы попытались учесть этот
факт и провели тщательный подбор условий
фракционирования.
Плазму крови
(250 мкл), разведенную
в 3 раза 1× PBS (до 750 мкл), пропускали один
раз через колонку с иммобилизованными
нанотелами (использовали колонку объе-
мом 500 мкл, на которой было иммобили-
зовано примерно
1,5 мг нанотел). Колонку
промывали трижды тремя объемами 1× PBS
с 10 мМ имидазола, затем проводили аффин-
ную элюцию в том же растворе, увеличивая
ступенчато концентрацию имидазола: 25, 50,
100 и 250 мМ. Каждый этап элюции вклю-
чал добавление элюирующего раствора 3 раза
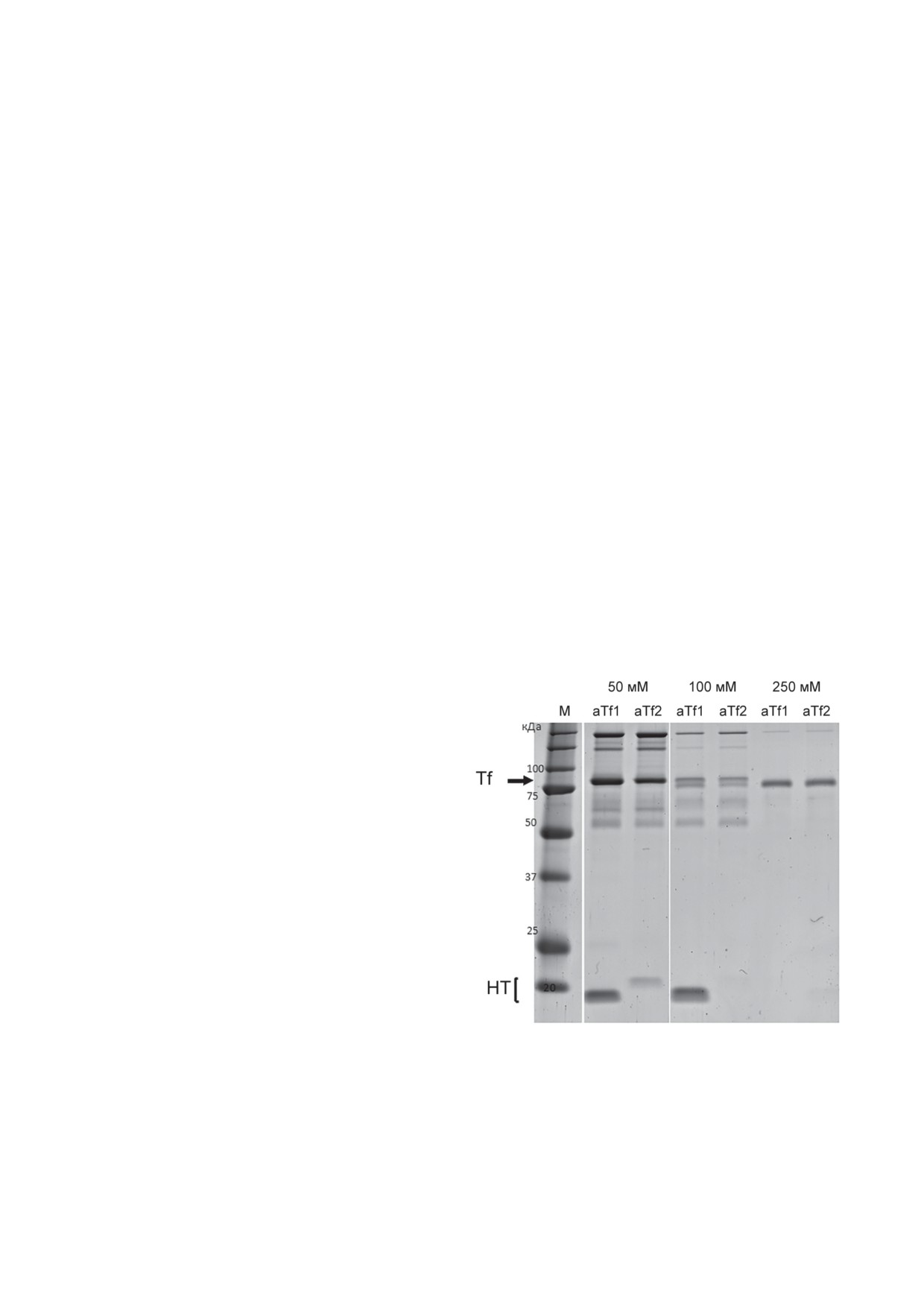
Рис. 1. Подбор условий элюции разными концентра-
циями имидазола (50 мМ, 100 мМ и 250 мМ) белков
по 500 мкл. Белки в полученных элюатах ана-
плазмы крови, связавшихся иммуносорбентами, при-
лизировали с помощью электрофореза в гра-
готовленными на основе нанотел (НТ: aTf1 или aTf2),
диентном SDS-ПААГ в восстанавливающих
иммобилизованных на Ni2+-NTA-агарозе. Представлена
условиях. Как видно на рис. 1, основная часть
электрофореграмма белков, фракционированных в
градиентном (5-19%) SDS-ПААГ. Стрелкой показано
Tf в комплексе с нанотелом элюировалась
положение трансферрина (Tf). В крайней левой до-
в присутствии
50 мМ имидазола, меньшая
рожке нанесен маркер (М) и указаны размеры (кДа)
часть - 100 мМ имидазола. При предваритель-
маркерных полос
БИОХИМИЯ том 88 вып. 8 2023
1358
САЧКО и др.
Рис. 2. Электрофоретический анализ в «неденатурирующем» 8%-ном BisTris-ПААГ (а и в) связавшихся белков
и трансферрина (Tf) плазмы крови здорового донора (а) или мочи больного РМП (в) с нанотелами (aTf1, aTf2
и К - контрольными нанотелами, не связывающими Tf), содержащими His-таг и иммобилизованными на Ni2+-NTA-
агарозе. Маркерные белки: apo-Tf, holo-Tf и sTfR. б - Электрофорез в градиентном (5-19%) SDS-ПААГ исходного
образца белков мочи (Исх.) того же больного. Стрелками обозначены места локализации на геле apo-Tf и holo-Tf;
пунктиром обозначены потенциальные формы Tf; М - маркер; СА - сывороточный альбумин
хроматографию с тремя приготовленными ко-
продемонстрировать в условиях более при-
лонками, две из которых содержали иммо-
ближенных к физиологическим, чем в преды-
билизованные нанотела aTf1 и aTf2, а третья,
дущих экспериментах, что нанотела aTf1 и aTf2
контрольная (К), была насыщена ранее нами
действительно обладают чрезвычайно высокой
полученными нанотелами, которые не узна-
специфичностью связывания разных форм
ют мажорные белки человека. Плазму крови
Tf из плазмы крови человека и являются на
(500 мкл) пропускали один раз через колонку
сегодняшний день уникальными инструмен-
с иммобилизованными на Ni2+-NTA-агарозе
тами для исследований соотношения разных
нанотелами (на колонке объемом 500 мкл было
форм Tf в биологических жидкостях. Можно
иммобилизовано примерно
3 мг нанотел).
видеть, что apo-Tf-специфическое нанотело
Колонку промывали трижды тремя объемами
aTf2 вообще не связывает железо-насыщеный
1× PBS с 10 мМ имидазола, затем проводили
holo-Tf и при этом связывает мажорный бе-
аффинную элюцию тремя объемами элюирую-
лок, аналогичный по подвижности основной
щего раствора с 70 мМ имидазола. Белки в по-
полосе маркерного препарата apo-Tf. В то же
лученных элюатах анализировали с помощью
время нанотело aTf1 эффективно связывает
электрофореза в
«неденатурирующем» геле.
именно holo-Tf. Мы предполагаем, что каждое
На рис. 2, а представлены полученные резуль-
из используемых нанотел потенциально спо-
таты электрофореза в
«неденатурирующем»
собно связывать также формы Tf, в которых
8%-ном BisTris-ПААГ связавшихся белков и
только одна из двух долей (N- или C-) связана
трансферрина (Tf) плазмы крови с нанотелами,
с ионом железа (металла). Эти промежуточные
иммобилизованными на Ni2+-NTA-агарозе.
формы, скорее всего, должны разделяться при
Можно наглядно видеть полосы, соответ-
используемом электрофорезе, и, возможно,
ствующие белкам плазмы крови, специфиче-
их (и их посттрансляционно модифициро-
ски (в отношении используемых нанотел) или
ванные формы) мы видим как специфиче-
неспецифически (как фон с Ni2+-NTA-ага-
ские минорные полосы (в элюатах каждого из
розой, аналогичный фону в случае колонки с
двух имуносорбентов с анти-Tf-нанотелами)
неспецифическим нанотелом, К) связываю-
в дополнение к неспецифическим фоновым
щиеся с используемыми иммуносорбентами.
белкам, сорбирующимся непосредственно на
В качестве маркерных белков были использо-
Ni2+-NTA-агарозе [12] и выявляемых также и
ваны коммерческие препараты apo-Tf, holo-Tf
в контрольной дорожке на рис. 2, а.
и sTfR1 (растворимый рецептор трансферри-
Применение Ni2+-NTA-агарозы для связы-
на 1). Данные результаты нужно рассматривать
вания трансферрина хоть и позволяет на «не-
как дополнительные к полученным нами же
денатурирующем» геле детектировать формы
ранее [6, 9], в которых уже была показана вы-
трансферрина, движущиеся в этом случае с
сокая специфичность к трансферрину исполь-
существенно различающейся подвижностью,
зуемых нанотел. В данном случае нам удалось
не подвергая их воздействию кислых условий
БИОХИМИЯ том 88 вып. 8 2023
АНАЛИЗ ТРАНСФЕРРИНА В МОЧЕ
1359
элюирования с CNBr-сефарозы, но и приводит
мы для последующих параллельных анализов
к визуализации прочих связывающихся непо-
форм трансферрина в образцах мочи больных
средственно с Ni2+-NTA-агарозой белков (пред-
раком мочевого пузыря решили использовать
ставлены в контрольной пробе, К, на рис. 2, а).
иммуносорбенты с нанотелами, пришитыми
На более традиционном SDS-ПААГ, в отличие
к сефарозе, и проводить фракционирование
от «неденатурирующего» геля, все формы Tf
связавшихся, а затем элюированных белков
движутся с одинаковой подвижностью, что
в SDS-ПААГ.
было показано нами ранее [6, 9].
В последующей работе были использо-
Аналогично описанному выше экспери-
ваны аннотированные образцы мочи 13 пер-
менту с плазмой крови здорового донора мы
вичных больных с диагнозом рак мочевого
провели иммуноаффинную хроматографию и
пузыря (таблица). Во всех образцах мы опреде-
последующее фракционирование связавшихся
лили концентрации креатинина (Кр) и общего
белков в «неденатурирующем» ПААГ для об-
белка (Б). Полученные данные приведены в
разца мочи больного РМП (на рис. 2, в пред-
таблице. Из представленных данных можно
ставлен результат для образца № 8 из таблицы,
видеть, что отношение концентрации белка к
в котором выявляются как apoTf, так и holoTf).
концентрации креатинина в моче прямо кор-
Аликвота мочи (2500 мкл) была сконцентри-
релирует со степенью прогресса РМП от немы-
рована в 10 раз (до 250 мкл) и один раз пропу-
шечно-инвазивных к мышечно-инвазивным и
щена через колонку с иммобилизованными на
более злокачественным стадиям болезни.
Ni2+-NTA-агарозе нанотелами (использовали
Далее, мы провели сравнительный коли-
колонку объемом 100 мкл, на которой было
чественный анализ общего Тf в образцах мочи
иммобилизовано примерно 600 мкг нанотел).
указанных в таблице больных, нормализован-
Колонку промывали трижды тремя объемами
ных (выравненных) относительно концентра-
1× PBS с 10 мМ имидазола, затем проводили
ции креатинина в этих образцах. Для фракцио-
аффинную элюцию тремя объемами элюи-
нирования брали аликвоты (500 мкл) исходных
рующего раствора с 70 мМ имидазола. Белки
образцов мочи больных и разводили их в 2 раза
в полученных элюатах анализировали с помо-
в 1× PBS. Контрольные образцы мочи здоро-
щью электрофореза в градиентном «неденату-
вых доноров (ЗК1, ЗК2) брали по 14 мл и кон-
рирующем» (6-10%) BisTris-ПААГ. На рис. 2, б
центрировали в 14 раз. Все пробы параллель-
представлено фракционирование в SDS-ПААГ
но были пропущены через индивидуальные
исходного образца белков мочи. Из нашей
100 мкл колонки с предварительно иммоби-
предыдущей работы с этим образцом [9] мы
лизованными на CNBr-сефарозе нанотелами
знаем, что самым мажорным белком в нем яв-
(300 мкг на 100 мкл колонки). Элюаты оса-
ляется сывороточный альбумин (СА, он пол-
дили по Wessel-Fluegge, растворили в буфере
ностью уходит в проскок), а Tf присутствует
для нанесения на гель (для электрофорезов по
в существенно увеличенном по сравнению с
Лэммли) и наносили на гель аликвоты, соот-
нормой количестве (от соответствующей ему
ветствующие относительным объемам исход-
полосы на рис. 2, в отходят стрелки). Из пред-
ных образцов, выравненных по креатинину.
ставленного результата можно видеть, что и
Белки в полученных элюатах анализировали
здесь, как в случае плазмы крови, apo-Tf-спе-
с помощью электрофореза в градиентном
цифическое нанотело aTf2 вообще не связы-
(5-19%) SDS-ПААГ в восстанавливающих усло-
вает железо-насыщеный holo-Tf и при этом
виях. На рис. 3 представлен результат электро-
связывает мажорный белок, аналогичный по
фореза объединенных элюатов (общего Tf) из
подвижности основной полосе маркерного пре-
нормализованных образцов мочи. Видно, что
парата apo-Tf. В то же время нанотело aTf1
повышение концентрации общего Tf в образ-
эффективно связывает именно holo-Tf. Пунк-
цах мочи ассоциировано со степенью про-
тирными линиями на рис. 2, в обозначены
гресса и роста злокачественности РМП. В об-
положения других минорных предполагаемых
разцах здоровых доноров и на ранних стадиях
форм трансферрина, в которых только одна из
РМП (G1) Tf присутствует в сильно меньших
двух долей (N- или C-) связана с ионом железа
количествах (его можно увидеть при концен-
(металла). Такие формы, как можно предпо-
трировании и нанесении соответствующих об-
ложить, особенно хорошо видны в коммерче-
разцов в 10-кратных количествах), кроме того,
ском маркерном препарате apo-Tf.
использовался высокочувствительный метод
Убедившись дополнительно в высокой спе-
окрашивания серебром [13] для детекции ма-
цифичности связывания Tf из биологической
лопредставленного в исследуемых препаратах
жидкости с помощью иммобилизованных на-
мочи трансферрина. Данный метод окраши-
нотел aTf1 и aTf2 и описанного выше метода,
вания используется для более чувствительной
БИОХИМИЯ том 88 вып. 8 2023
1360
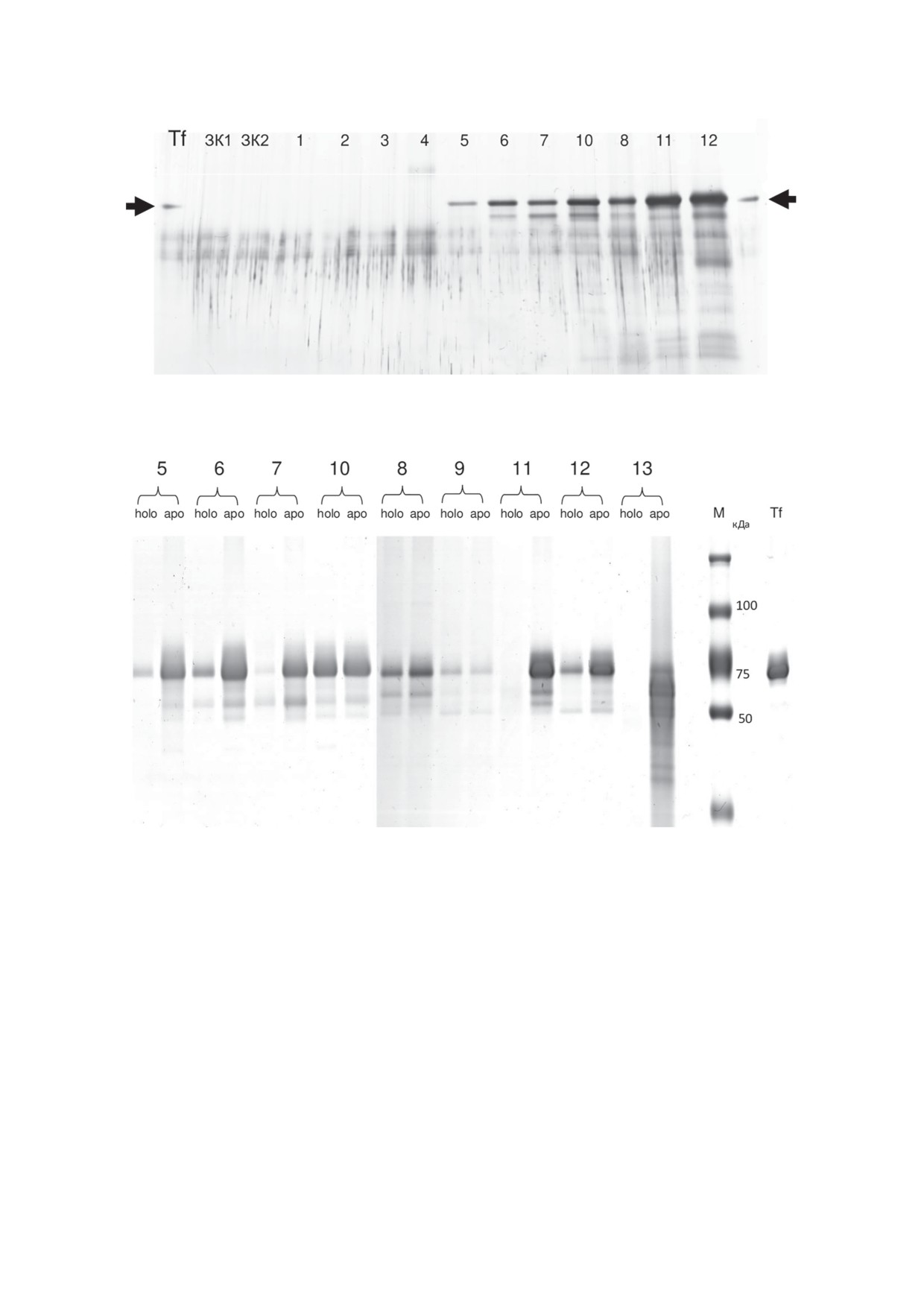
САЧКО и др.
Рис. 3. Детекция трансферрина в образцах мочи больных РМП, нормализованных по креатинину, в градиентном (5-
19%) SDS-ПААГ. Указаны номера образцов из таблицы. В двух крайних лунках (по бокам) нанесен коммерческий
препарат Tf как маркер; ЗК1 и ЗК2 - образцы мочи здоровых доноров
Рис. 4. Детекция разных форм трансферрина (holo-Tf и apo-Tf) в образцах мочи больных РМП (указаны номера образ-
цов из таблицы), нормализованных по креатинину. Элюаты белков, полученные в результате проведения иммуно-
аффинных хроматографий на колонках с нанотелами aTf1 (holo-Tf+) или aTf2 (аpo-Tf+), фракционированы в гради-
ентном (5-19%) SDS-ПААГ в восстанавливающих условиях. Справа нанесены маркер (М) и коммерческий препарат
трансферрина (Tf)
детекции белков на электрофореграмме, что,
В образцах мочи, где детектировали Tf,
в свою очередь, приводит к усилению сигнала
провели исследование относительной пред-
не только целевых белков, но и фоновых, что
ставленности разных форм Tf с помощью им-
видно на данном изображении. Известно, что
муносорбентов на основе нанотел aTf1 и aTf2.
в раковых клетках активируются различные
Колонки с иммобилизованными нанотелами
клеточные стрессы, такие как репликативный,
были взяты с большим запасом по емкости
протеотоксический, окислительный [14], ко-
(600 мкг нанотела на 100 мкл объема колонки),
торые могут приводить к деградации белков, и
чтобы надежно связать весь соответствующий
на продвинутых стадиях развития РМП часто
компонент из образца мочи. На рис. 4 пред-
выявляют деградацию белков. В наших экспе-
ставлены полученные результаты.
риментах мы, предположительно, видим такую
Для большинства исследованных образцов
частичную деградацию трансферрина (в об-
ожидаемо (как в случае Tf в крови больных ра-
разцах с 6 по 12 на рис. 3).
ком яичников поздних стадий) концентрация
БИОХИМИЯ том 88 вып. 8 2023
АНАЛИЗ ТРАНСФЕРРИНА В МОЧЕ
1361
аpo-Tf выше, чем holo-Tf, особенно в случае
были выявлены сопоставимые количества apo-
наиболее продвинутого мышечно-инвазивно-
и holo-Tf. Метод МС-ИСП отличается очень
го РМП (образцы № 11, 12 и 13). В образце
высокой чувствительностью и способностью
№ 13 наблюдается деградация в элюате аpo-Tf
определять в одном образце сразу многие
и полное отсутствие белка в элюате holo-Tf.
металлы. Препараты для анализа получали в
Подобная экстремальная картина в случае
результате иммуноаффинной хроматографии
образца № 11, где практически нет holo-Tf и
аликвот биологических жидкостей на колон-
очень много аpo-Tf. Отметим, что в элюатах
ках с иммобилизованным нанотелом (aTf1),
выявляются белковые продукты, движущие-
узнающим holo-Tf. Препараты (элюаты с коло-
ся при электрофорезе быстрее Tf. Помимо
нок) нормировали по количеству трансферрина
потенциально возможной деградации Tf, эти
(100 мкг) и передавали на анализ в одинаковых
продукты могут соответствовать и другим бел-
объемах
(300 мкл). Для измерения раствор
кам, ассоциированным с Tf. Например, это
разбавляли в 10 раз 3%-ной азотной кисло-
могут быть мажорные белки экстраклеточных
той. В качестве контроля брали аналогично
везикул, на поверхности которых находится Tf.
приготовленный и нормированный препарат
Это, конечно же, только наше предположение
«holo-Tf» из плазмы крови здорового донора.
и вопрос будущего специального изучения.
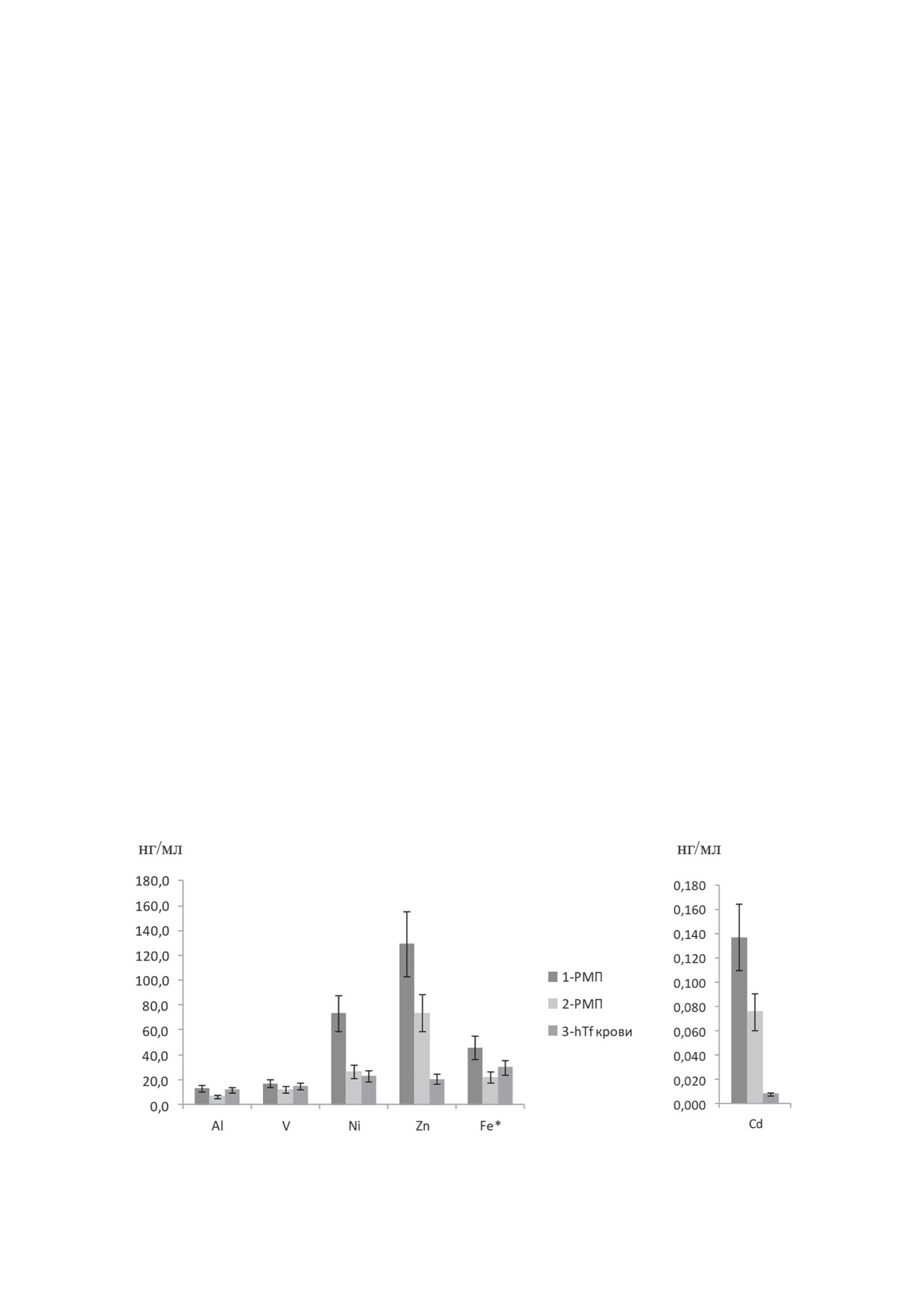
Первые полученные результаты МС-ИСП ко-
В приведенных на рис. 4 результатах вызывает
личественного определения ряда выбранных
особые вопросы детекция почти одинаковых
ионов металлов (Al, V, Cr, Fe*, Co, Ni, Cu,
количеств обеих форм Tf в образцах № 8-10.
Zn, Y, Cd), ассоциированных с Tf в моче ука-
Этот результат для нас оказался неожиданным.
занных больных и в крови здорового донора,
Для его объяснения мы выдвинули гипотезу:
представлены на рис. 5 (указаны данные для
наблюдаемый «holo-Tf» может быть результа-
выявляемых металлов с учетом вычитаемого
том формирования вторичных комплексов,
фона используемых буферных растворов).
образуемых apo-Tf в соединении с ионами,
Cr, Co, Cu, Y не были детектированы во всех
отличными от Fe3+, но накапливающимися в
пробах «holo-Tf». Представленные результаты
моче ракового больного и способными при
о детектированных металлах подтверждают
недостатке ионов Fe3+ связываться с apo-Tf,
предположенную нами гипотезу. Препараты
меняя его конформацию и делая доступными
«holo-Tf» в этих образцах мочи оказались силь-
эпитопы, характерные именно для holo-Tf, ко-
но обогащены цинком и никелем, по сравне-
торые узнаются holo-Tf-специфическим нано-
нию с препаратом «holo-Tf» из крови здоро-
телом aTf1.
вого донора, тогда как ионы алюминия (Al) и
Для проверки предположенной гипотезы
ванадия (V) определялись в примерно одина-
мы провели масс-спектрометрический ана-
ковых концентрациях. Также в этих препара-
лиз с ионизацией в индуктивно-связанной
тах наблюдается относительное обогащение
плазме препаратов «holo-Tf», выделенных из
кадмием, но он присутствует в сильно мень-
мочи больных РМП (№ 8 и № 10), в которых
ших концентрациях (в правой части рис. 5).
Рис. 5. Результаты определения методом МС-ИСП концентраций металлов (в нг/мл), присутствующих в наибольших
количествах в образцах мочи № 10 (1-РМП) и № 8 (2-РМП) и крови (hTf крови), нормированных на 100 мкг «holo-Tf».
Представлены средние данные двух измерений с указанием доверительного интервала
6
БИОХИМИЯ том 88 вып. 8 2023
1
362
САЧКО и др.
Полученные данные указывают на то, что ис-
для Fe3+ металлсвязывающих сайтов; с помо-
пользуемое нанотело aTf1, узнающее преиму-
щью смешанного связывания, когда один из
щественно железо-насыщенную форму транс-
сайтов уже связан с Fe3+; путем образования
феррина (holo-Tf), способно также связывать
связи с белковой поверхностью Tf, в котором
трансферрин в ассоциации с иными ионами
обе доли уже связаны с ионом железа. Tf по-
металлов, отличными от железа. Эта способ-
тенциально с разной эффективностью может
ность потенциально может открыть новые
доставлять связанные с ним ионы металлов,
возможности в исследованиях относительной
отличные от канонического Fe3+, в клетки по-
представленности разных ионов металлов в
средством эндоцитоза, опосредованного ре-
ассоциации с трансферрином в биологических
цептором трансферрина [19].
жидкостях человека в норме и патологии.
С другой стороны, была выявлена явная
В проведенных измерениях для всех ионов
ассоциация между уровнями тяжелых метал-
металлов, кроме ионов железа, были полу-
лов в моче с повышенным риском уротели-
чены надежные результаты с хорошим совпа-
альной карциномы (самого частого вари-
дением соответствующих данных калибровки.
анта РМП) [20]. Chang et al. [20] измеряли
В случае ионов железа (Fe*) было выявлено
мышьяк, кадмий, хром, содержание никеля и
неполное совпадение измеряемого значения
свинца в моче 205 человек с РМП (уротели-
в образце с соответствующей калибровочной
альной карциномой) и 406 здоровых людей.
полосой, что могло немного исказить резуль-
Используя масс-спектрометрию с индуктив-
тат определения. Одним из объяснений этого
но-связанной плазмой, они обнаружили, что
может быть известный факт, что гидроксид же-
в образцах мочи пациентов с РМП были зна-
леза Fe(OH)3, который может образовываться
чительно повышены концентрации кадмия,
при высвобождении ионов железа от Tf при
хрома и никеля по сравнению с образцами
элюции в кислых условиях holo-Tf, связавше-
от здоровых людей. Повышенное количество
гося с иммобилизованным на сефарозе нано-
определенных металлов в моче (таких, как
телом, плохо растворим и, в отличие от гидр-
цинк) может быть следствием приема опреде-
оксидов других металлов, выпадает в осадок
ленных витаминов или особой диеты.
при значениях рН от 2 до 8 [15].
Доставка особых ионов металлов в клет-
Полученные результаты вполне согласу-
ки организма может иметь как токсический
ются с данными других исследований. Так,
эффект для клетки, так и потенциально мо-
известно, что железо-ненасыщенный apo-Tf,
жет быть использована для разработки новых
мажорный вариант трансферрина в крови
терапевтических подходов лечения рака. Оха-
(примерно 2 мг/мл), способен связывать, по-
рактеризованные нами нанотела могут быть
мимо ионов железа, и многие другие поступаю-
полезным инструментом в этих исследованиях
щие в кровь ионы металлов [16], такие, как
и разработках.
Co3+, Co2+, Cu2+, Ni2+, Zn2+, Cd2+. Трансферрин
является важным сывороточным транспорт-
В качестве заключения отметим, что в дан-
ным агентом для большинства ионов двух- и
ной работе с помощью уникальных инструмен-
трехвалентных металлов. Предполагается, что
тов, какими являются ранее нами полученные
трансферрин играет важную роль в транспорте
и дополнительно охарактеризованные в этой
Ti4+, VO2+ (V4+), Cr3+, Ru3+ и Bi3+ - всех ионов
работе нанотела, специфически связывающие
металлов, имеющих потенциальное терапев-
строго определенную форму трансферрина
тическое значение. Трансферрин может играть
(или holo-Tf, или apo-Tf), нам впервые удалось
физиологическую роль в транспорте марганца
провести анализ представленности этих форм
в виде трехвалентного иона. Однако этот белок
трансферрина в образцах мочи больных раком
может также играть роль в переносе в ткани
мочевого пузыря и получить принципиально
потенциально токсичных ионов Al3+ и актини-
новые результаты. Мы показали, что повыше-
дов, включая Pu4+ [16].
ние концентрации общего Tf в образцах мочи
Известно, что в норме в крови человека
ассоциировано со степенью прогресса и роста
только примерно 30% сайтов потенциально-
злокачественности РМП. В образцах здоровых
го связывания Fe3+ в Tf уже задействовано, и
доноров и на ранних стадиях РМП (G1) Tf де-
остается много сайтов в N-доле, С-доле или
тектируется в сильно меньших количествах
обеих долях молекул Tf, которые потенциаль-
лишь при дополнительном концентрировании.
но могут связать многие другие ионы металлов
Для большинства исследованных образцов
при дефиците ионов железа [17, 18]. Показаны
мочи больных РМП ожидаемо (как в случае Tf
разные возможные механизмы связывания
в крови больных раком яичников поздних ста-
других ионов с Tf: посредством тех же, что и
дий) концентрация аpo-Tf выше, чем holo-Tf,
БИОХИМИЯ том 88 вып. 8 2023
АНАЛИЗ ТРАНСФЕРРИНА В МОЧЕ
1363
особенно в случае наиболее продвинутого мы-
нова, Т.И. Иванова, С.В. Тиллиб - наработка
шечно-инвазивного РМП. Неожиданностью
нанотел, создание иммуноаффинных сорбен-
стало обнаружение почти одинаковых коли-
тов, проведение экспериментов по выделению
честв обеих форм Tf в ряде образцов мочи боль-
разных форм трансферрина; И.Ю. Николаева,
ных РМП. Это, по-видимому, объясняется тем,
М.Е. Тарнопольская, А.Ю. Бычков - проведе-
что фракция «holo-Tf» в данном случае в зна-
ние анализов методом масс-спектрометрии
чительной степени представлена «вторичными
с ионизацией в индуктивно-связанной плаз-
комплексами», образуемыми apo-Tf в соедине-
ме; М.Я. Гаас, Н.В. Воробьев, А.Д. Каприн,
нии с ионами, отличными от Fe3+, накаплива-
П.В. Шегай - поставка образцов мочи от оха-
ющимися в моче некоторых раковых больных
рактеризованных больных; С.В. Тиллиб - на-
и способными связываться с apo-Tf, меняя его
писание статьи.
конформацию в направлении holo-Tf. Методом
Финансирование. Работа выполнена при
масс-спектроскопии с ионизацией в индуктив-
финансовой поддержке Российского научного
но-связанной плазме мы получили этому под-
фонда (грант № 20-14-00305).
тверждение. Препарат «holo-Tf» в этих образ-
Конфликт интересов. Авторы заявляют об
цах мочи оказался сильно обогащен цинком и
отсутствии конфликта интересов.
никелем. Полученные данные указывают на то,
Соблюдение этических норм. Все процеду-
что используемое нанотело, узнающее преиму-
ры, выполненные с участием биологических
щественно железо-насыщенную форму транс-
жидкостей, соответствуют этическим стандар-
феррина (holo-Tf), способно также связывать
там институционального и/или националь-
трансферрин в ассоциации с иными ионами
ного комитета по исследовательской этике,
металлов, отличными от железа. Эта способ-
Хельсинкской декларации 1964 года и ее по-
ность потенциально может открыть новые
следующим изменениям или сопоставимым
возможности в исследованиях относительной
нормам этики. От каждого участника, вклю-
представленности разных ионов металлов в
ченного в исследование, получено инфор-
ассоциации с трансферрином в биологических
мированное добровольное согласие. Работа
жидкостях человека в норме и патологии.
одобрена Этическими комитетами ИБГ РАН
(разрешение от 18.01.2021) и Московского на-
Вклад авторов. С.В. Тиллиб - концепция и
учно-исследовательского онкологического ин-
руководство работой; А.М. Сачко, О.С. Горяй- ститута имени П.А. Герцена.
СПИСОК ЛИТЕРАТУРЫ
1. Torti, S. V., and Torti, F. M. (2020) Iron: the
6. Ivanova, T. I., Klabukov, I. D., Krikunova, L. I.,
cancer connection, Mol. Aspects Med., 75, 100860,
Poluektova, M. V., Sychenkova, N. I., Khorokhorina,
doi: 10.1016/j.mam.2020.100860.
V. A., Vorobyev, N. V., Gaas, M. Ya., Baranovskii,
2. Candelaria, P. V., Leoh, L. S., Penichet, M. L., and
D. S., Goryainova, O. S., Sachko, A. M., Shegay,
Daniels-Wells, T. R. (2021) Antibodies targeting the
P. V., Kaprin, A. D., and Tillib, S. V. (2022) Prognostic
transferrin receptor 1 (TfR1) as direct anti-cancer
value of serum transferrin analysis in patients with
agents, Front. Immunol., 12, 607692, doi: 10.3389/
ovarian cancer and cancer-related functional iron
fimmu.2021.607692.
deficiency: a Retrospective case-control study, J. Clin.
3. Yiannikourides, A., and Latunde-Dada, G. O.
Med., 11, 7377, doi: 10.3390/jcm11247377.
(2019) A short review of iron metabolism and
7. Elsayed, M. E., Sharif, M. U., and Stack, A. G. (2016)
pathophysiology of iron disorders, Medicines (Basel),
Transferrin saturation: a body iron biomarker, Adv. Clin.
6, 85, doi: 10.3390/medicines6030085.
Chem., 75, 71-97, doi: 10.1016/bs.acc.2016.03.002.
4. Ramírez-Carmona, W., Díaz-Fabregat, B., Yuri
8. Tillib, S. V., Goryainova, O. S., Sachko, A. M., and
Yoshigae, A., Musa de Aquino, A., Scarano, W. R.,
Ivanova, T. I. (2022) High-affinity single-domain
de Souza Castilho, A. C., Avansini Marsicano, J., Leal
antibodies for analyzing human apo- and holo-trans-
do Prado, R., Pessan, J. P., and de Oliveira Mendes, L.
ferrin, Acta Naturae,
14,
98-102, doi:
10.32607/
(2022) Are serum ferritin levels a reliable cancer bio-
actanaturae.11663.
marker? A systematic review and meta-analysis,
9. Тиллиб С. В, Горяйнова О. С., Сачко А. М., Ива-
Nutr. Cancer, 74, 1917-1926, doi: 10.1080/01635581.
нова Т. И., Гаас М. Я., Воробьев Н. В., Каприн
2021.1982996.
А. Д., Шегай П. В. (2022) Однодоменные анти-
5. Szőke, D., and Panteghini, M. (2012) Diagnostic
тела для предобработки протеома мочи человека
value of transferrin, Clin. Chim. Acta, 413, 1184-1189,
с целью анализа онкобиомаркеров, Молекулярная
doi: 10.1016/j.cca.2012.04.021.
биология, 56, 671-684.
БИОХИМИЯ том 88 вып. 8 2023
6*
1
364
САЧКО и др.
10. Nowakowski, A. B., Wobig, W. J., and Petering,
16. Vincent, J. B., and Love, S. (2012) The binding
D. H. (2014) Native SDS-PAGE: high resolution
and transport of alternative metals by transferrin,
electrophoretic separation of proteins with retention
Biochim. Biophys. Acta, 1820, 362-378, doi: 10.1016/
of native properties including bound metal ions,
j.bbagen.2011.07.003.
Metallomics, 6, 1068-1078, doi: 10.1039/c4mt00033a.
17. Williams, J., and Moreton, K. (1980) The distribution
11. Wessel, D., and Fluegge, U. I. (1984) A method for the
of iron between the metal-binding sites of transferrin
quantitative recovery of protein in dilute solution in
human serum, Biochem. J.,
185,
483-488, doi:
the presence of detergents and lipids, Anal. Biochem.,
10.1042/bj1850483.
138, 141-143, doi: 10.1016/0003-2697(84)90782-6.
18. Sun, H., Li, H., and Sadler, P. J. (1999) Transferrin
12. Wang, F., Chmil, C., Pierce, F., Ganapathy, K.,
as a metal ion mediator, Chem. Rev., 99, 2817-2842,
Gump, B. B., MacKenzie, J. A., Metchref, Y., and
doi: 10.1021/cr980430w.
Bendinskas, K. (2013) Immobilized metal affinity
19. Benjamín-Rivera, J. A., Cardona-Rivera, A. E., Vázquez-
chromatography and human serum proteomics,
Maldonado, Á. L., Dones-Lassalle, C. Y., Pabón-
J. Chromatogr. B Anal. Technol. Biomed. Life Sci., 934,
Colon, H. L., Rodríguez-Rivera, H. M., Rodríguez, I.,
26-33, doi: 10.1016/j.jchromb.2013.06.032.
González-Espiet, J. C., Pazol, J., Pérez-Ríos, J. D.,
13. Hochstrasser, D. F., Patchornik, A., and Merril,
Catala-Torres, J. F., Carrasquillo Rivera, M.,
C. R. (1988) Development of polyacrylamide gels that
De Jesus-Soto, M. D., Cordero-Virella, N. A.,
improve the separation of proteins and their detection
Cruz-Maldonado, P. M., González-Pagan, P.,
by silver staining, Anal. Biochem.,
173,
412-423,
Hernández-Ríos, R., Gaur, K., Loza-Rosas, S. A.,
doi: 10.1016/0003-2697(88)90208-4.
and Tinoco, A. D. (2020) Exploring serum transferrin
14. Luo, J., Solimini, N. L., and Elledge, S. J. (2009)
regulation of nonferric metal therapeutic function
Principles of cancer therapy: oncogene and non-
and toxicity, Inorganics,
8,
48, doi:
10.3390/
oncogene addiction, Cell, 136, 823-837, doi: 10.1016/
inorganics8090048.
j.cell.2009.02.024.
20. Chang, C. H., Liu, C. S., Liu, H. J., Huang,
15. Zapién Serrano, L. Z., Ortiz Lara, N. O., Ríos Vera,
C. P., Huang, C. Y., Hsu, H. T., Liou, S. H., and
R. R., and Cholico-González, D. (2021) Removal
Chung, C. J. (2016) Association between levels of
of Fe(III), Cd(II), and Zn(II) as hydroxides by
urinary heavy metals and increased risk of urothelial
precipitation-flotation system, Sustainability,
13,
carcinoma, Int. J. Urol., 23, 233-239, doi: 10.1111/
11913, doi: 10.3390/su132111913.
iju.13024.
ANALYSIS OF TRANSFERRIN IN URINE IN PATIENTS
WITH BLADDER CANCER USING NANOBODIES
A. M. Sachko1, O. S. Goryainova1, T. I. Ivanova1,2, I. Yu. Nikolaeva3,
M. E. Tarnopolskaia3, A. Yu. Bychkov3, M. Ya. Gaas4, N. V. Vorob’ev5,6,
A. D. Kaprin4,7, P. V. Shegay4,7, and S. V. Tillib1*
1 Institute of Gene Biology, Russian Academy of Sciences,
119334 Moscow, Russia; e-mail: tillib@genebiology.ru
2 Tsyb Medical Radiological Research Centre - Branch of the National Medical Research Radiological Centre
of the Ministry of Health of the Russian Federation, 249036 Obninsk, Russia
3 Faculty of Geology, Lomonosov Moscow State University,119234 Moscow, Russia
4 Peoples’ Friendship University of Russia (RUDN University), 117198 Moscow, Russia
5 Hertsen Moscow Oncology Research Institute - Branch of the National Medical Research Radiological Centre
of the Ministry of Health of the Russian Federation, 125284 Moscow, Russia
6 Sechenov First Moscow State Medical University
of the Ministry of Health of the Russian Federation, 119991 Moscow, Russia
7 National Medical Research Radiological Centre of the Ministry of Health of the Russian Federation,
125284 Moscow, Russia
It is known that the saturation ratio of transferrin (Tf) with iron in human blood is an important clini-
cal parameter. Specific antibodies can be used to analyze subtle changes in the relative abundance of dif-
ferent forms of transferrin potentially associated with a pathological process. Recently, the authors of this
study were able to obtain and characterize highly specific single-domain antibodies (nanobodies) that
predominantly recognize the iron-saturated (holo-Tf) or iron-unsaturated (apo-Tf) form of transferrin.
БИОХИМИЯ том 88 вып. 8 2023
АНАЛИЗ ТРАНСФЕРРИНА В МОЧЕ
1365
In this work, under conditions closer to physiological than in previous experiments, we further demon-
strated that these unique nanobodies have extremely high differential binding specificity for different forms
of Tf in different human biological fluids. Using these nanobodies, we were able to analyze for the first
time the relative abundance of transferrin forms in urine samples from patients with bladder cancer (BC).
We have shown that an increase in the concentration of total Tf in urine samples normalized for creatinine
is associated with the degree of progress and growth of malignancy of BC. In the samples of healthy do-
nors and in the early stages of BC (G1), Tf is detected in much smaller amounts (compared to later stages)
and only with additional concentration of the studied samples. For most of the studied urine samples from
BC patients, it is expected (as previously shown in the case of Tf in the blood of terminal ovarian cancer
patients) that the concentration of apo-Tf is clearly higher than holo-Tf, especially in the case of the most
advanced muscle-invasive BC. It was a surprise for us that approximately equal amounts of apo-Tf and
“holo-Tf” were found in the urine samples of some patients with BC. We hypothesized that the “holo-Tf”
fraction in this case can be largely represented by “secondary complexes” formed by apo-Tf in combina-
tion with ions other than Fe3+, which accumulate in the urine of some cancer patients and are able to bind
to apo-Tf, changing its conformation towards holo-Tf. Using inductively coupled plasma ionization mass
spectroscopy (ICP-MS), we obtained the first results confirming our hypothesis. The “holo-Tf” prepa-
ration in these urine samples was found to be highly enriched in zinc and nickel. Also in this preparation,
a relative enrichment in cadmium is observed, but it is present in much lower concentrations. The data ob-
tained indicate that the nanobody used, recognizing predominantly the iron-saturated form of transferrin
(holo-Tf), is also capable of binding transferrin in association with other metal ions that are different from
iron. This ability could potentially open up new possibilities in studies of the relative abundance of various
metal ions in association with transferrin in human biological fluids in normal and pathological conditions.
Keywords: single-domain antibody, nanobody, apo- and holo-transferrin, affinity chromatography, bladder cancer,
ICP-MS
БИОХИМИЯ том 88 вып. 8 2023