БИОХИМИЯ, 2023, том 88, вып. 9, с. 1445 - 1460
УДК 577.21
ПОСЛЕДНИЕ РАЗРАБОТКИ В ОБЛАСТИ БИОТЕХНОЛОГИИ
РЕКОМБИНАНТНЫХ ФРАГМЕНТОВ АНТИТЕЛ
Обзор
© 2023 N. Zelenovic1, L. Filipovic2, M. Popovic3*
1 Center for Chemistry, Institute for Chemistry, Technology and Metallurgy,
National Institute of Republic of Serbia, University of Belgrade, 11000 Belgrade, Serbia
2 Innovative Centre, Faculty of Chemistry, University of Belgrade, 11000 Belgrade, Serbia
3 Department of Biochemistry, Faculty of Chemistry, University of Belgrade,
11000 Belgrade, Serbia; e-mail: la_bioquimica@chem.bg.ac.rs
Поступила в редакцию 13.05.2023
После доработки 12.07.2023
Принята к публикации 18.08.2023
Применение антител в биотехнологии и биомедицине неуклонно растёт с 1980-х гг. Будучи уни-
кальными и высокоспецифичными биореагентами, моноклональные антитела (monoclonal
antibodies, mAb) широко используются и одобрены в качестве терапевтических агентов. Однако
использование mAb в терапевтических целях имеет определённые ограничения. Фрагменты ан-
тител (antibody fragments, AbF) с сохранёнными антигенсвязывающими сайтами потенциально
способны преодолеть недостатки обычных mAb, такие как гетерогенное распределение в тканях
после системного применения, особенно в случае солидных опухолей, а также Fc-опосредованная
активация иммунной системы в присутствии свидетеля. AbF имеют лучший коэффициент био-
распределения благодаря более низкой молекулярной массе. Они сохраняют функциональные
особенности mAb, такие как специфичность к антигену и возможность его связывать, при этом
гораздо лучше проникая в ткани. Дополнительным преимуществом AbF является возможность
их производства в бактериальных и дрожжевых клетках благодаря небольшому размеру, более
прочной структуре и отсутствию посттрансляционных модификаций. В данном обзоре описыва-
ются разные подходы к получению AbF, приводятся недавние примеры их синтеза в бактериальных
и дрожжевых системах экспрессии и методы оптимизации их получения.
КЛЮЧЕВЫЕ СЛОВА: фрагменты антител, бактериальная экспрессия, дрожжевая экспрессия, scFv, VHH.
DOI: 10.31857/S0320972523090014, EDN: WSLAON
ВВЕДЕНИЕ
антител (monoclonal antibodies, mAb) с исполь-
зованием классической гибридомной техноло-
Применение антител стало неотъемлемой
гии имеет ограничения, поскольку гибридомы
частью диагностики, медицинской визуали-
обычно имеют слабую секрецию и генетически
зации и терапии. В частности, они регулярно
нестабильны [2]. Таким образом, на получение
используются в различных клинических ана-
достаточного количества mAb требуется в сред-
лизах, включая иммуноблоттинг, проточную
нем от 6 до 8 месяцев. Мышиные mAb иммуно-
цитометрию и иммуногистохимию [1], напри-
генны и малоэффективны из-за ксеногенной
мер, для обнаружения антигенов или токсинов.
структуры Fc, поэтому для их терапевтического
Антитела можно получить в моноклональной
применения требуется дальнейшая гуманиза-
форме, что делает возможным их широкое при-
ция, что повышает цену изготовления [1].
менение в лечении рака и воспалительных забо-
Разработка методов производства реком-
леваний. Однако продукция моноклональных бинантных mAb в 1980-х гг. дала возможность
Принятые сокращения: AbF - antibody fragment, фрагмент антитела; mAb - monoclonal antibody, моноклональ-
ное антитело; scFv - single-chain variable fragments, одноцепочечные вариабельные фрагменты; VHH - variable domains
of heavy-chain antibody, вариабельные домены антител из тяжёлых цепей.
* Адресат для корреспонденции.
1445
1446
ZELENOVIC и др.
производить антитела в большом масштабе
AbF. Методы дисплея, особенно фагового, яв-
для использования в доклинических и клини-
ляются важной движущей силой для открытия
ческих испытаниях. Несмотря на очевидные
антител, которые в дальнейшем можно модифи-
преимущества, mAb также имеют некоторые
цировать, оптимизировать и синтезировать [4].
недостатки, такие как высокая стоимость и
AbF можно получить с помощью протео-
временные ограничения, связанные с их про-
лиза или генной инженерии (рис. 1). Самыми
изводством. Большая молекулярная масса и
хорошо изученными типами AbF являются
гетеротетрамерная структура как классиче-
участки связывания антигена (fragment antigen-
ских, так и гуманизированных mAb делают их
binding regions, Fab), scFv и VHH. Fab можно
неподходящими для некоторых применений
получить с помощью ферментного расщепле-
in vivo. В качестве альтернативы были созданы
ния IgG папаином или пепсином, дающего по
различные типы фрагментов антител (antibody
два Fab- или F(ab′)2-фрагмента соответствен-
fragments, AbF). Самые распространённые из
но. Прорыв в производстве рекомбинантных
них - одноцепочечные вариабельные фраг-
антител произошёл с получением scFv путём
менты (single-chain variable fragments, scFv), од-
соединения вариабельных доменов тяжёлых и
нодоменные антитела или вариабельные доме-
средних цепей (VH и VL соответственно) пеп-
ны антител из тяжёлых цепей (variable domains
тидным линкером с формированием единой
of heavy-chain antibodies, VHH), а также вариа-
полипептидной цепи. AbF такого типа сохра-
бельные фрагменты нового антиген-рецеп-
няют антигенсвязывающие свойства mAb, но
тора иммуноглобулина (variable fragments of
могут экспрессироваться в E. coli [5]. VHH,
immunoglobulin new antigen receptor, VNAR) [3].
полученные из антител, состоящих только из
Благодаря техникам фагового и дрожжевого
тяжёлых цепей (встречающихся в природе у
дисплея, которые существенно ускорили выяв-
верблюдовых), стабильны и могут связываться
ление антител к различным антигенам и дали
с антигеном, несмотря на отсутствие лёгкой
возможность оптимизировать структуру анти-
цепи. Структура и функции VHH сходны с та-
тел для улучшения их связывающих свойств,
ковыми для VH-доменов обычных антител, за
стал возможным скрининг больших библиотек
исключением ключевых мутаций в каркасном
Рис. 1. Структура антител различных форматов. а - Обычные mAb; б - антитела только из тяжёлых цепей; в - фраг-
мент F(ab′)2, г - фрагмент Fab, д - scFv; е - VHH; ж - биспецифичный слитный белок рецептор T-клеток (TCR)-scFv;
з - пегилированный Fab; и - слитный белок scFv-усечённый экзотоксин A Pseudomonas; к - тандемные VHH.
Красные линии показывают межцепочечные дисульфидные мостики, внутрицепочечные дисульфидные мостики
не показаны
БИОХИМИЯ том 88 вып. 9 2023
МИКРОБНАЯ ЭКСПРЕССИЯ ФРАГМЕНТОВ АНТИТЕЛ
1447
участке 2, отвечающем за взаимодействие ме-
ПРОДУКЦИЯ AbF В КЛЕТКАХ E. coli
жду вариабельными доменами в обычных им-
муноглобулинах. Благодаря своей повышен-
E. coli как клетка-хозяин экспрессии AbF.
ной структурной стабильности и пониженной
Прокариотические системы экспрессии ши-
склонности к агрегации VHH предпочтитель-
роко используются для биосинтеза различных
ны в условиях, требующих высокостабильных
типов рекомбинантных белков, в том числе ал-
антител (повышенная концентрация детергента,
лергенов, ферментов и AbF [13-15]. Чаще всего
низкий pH), и могут использоваться для визуа-
в качестве бактериальной клетки-хозяина ис-
лизации и лечения онкологических, инфекци-
пользуется E. coli, которая из модельного орга-
онных, воспалительных и нейродегенеративных
низма для исследований превратилась в проду-
заболеваний [3]. Несмотря на более короткий
цент гетерологичных белков в промышленных
период полувыведения из кровообращения пу-
масштабах. Около 30% биофармацевтических
тём фильтрации в почках, AbF обладают рядом
препаратов всего мира синтезируются имен-
уникальных преимуществ перед классически-
но в E. coli, которая всё ещё используется как
ми mAbs, в частности, улучшенным проник-
золотой стандарт синтеза рекомбинантных
новением в ткани, особенно солидные опухо-
белков [9, 14]. Этот организм хорошо изучен и
ли [6], более высоким соотношением опухоль/
тщательно охарактеризован, его можно легко
орган [7] и способностью эффективно прони-
контролировать различными молекулярными
кать через биологические (например, эпители-
инструментами. E. coli, как клетка-хозяин экс-
альные и эндотелиальные) барьеры [8].
прессии рекомбинантных AbF, имеет преиму-
scFv и VHH становятся биотерапевтически-
щества перед другими системами экспрессии,
ми агентами, поскольку их малый размер обес-
включая быстрый рост, минимальную слож-
печивает лучшее проникновение в ткани [9].
ность среды, низкую стоимость производства
Для эффективной оценки концентрации белков
и лёгкость его масштабирования. Она остаётся
в плазме на основании их фармакокинетики
оптимальным вариантом для масштабного и
можно использовать коэффициент биораспре-
недорогого производства негликозилирован-
деления (biodistribution coefficient, BC - отно-
ных рекомбинантных белков. Поскольку AbF
шение концентраций mAb в ткани и плазме).
не гликозилированы, их можно синтезировать
Соотношение между BC и размером белка дало
в клетках E. coli без потери функциональных
возможность вывести значения BC50 для всех
свойств [16]. Несколько лекарств, основан-
тканей. Большая молекулярная масса приведёт
ных на AbF и одобренных FDA и EMA, были
к уменьшению величины 50%-ного поглощения
успешно синтезированы в E. coli (табл. 1). AbF
белка тканью. Для большинства тканей значе-
можно синтезировать в различных клеточ-
ние BC50 составило ~35 кДа, указывая на то, что
ных компартментах, например, в периплазме
распределение AbF в ткани может происходить
(ранибизумаб и цертолизумаб пегол) и внекле-
более эффективно по сравнению с mAb [10].
точном пространстве (каплацизумаб и опорту-
Меньший размер AbF и лучшие значения BC50
зумаб), или же производить в составе телец
могут помочь в подборе дозировки и введении
включения с последующим рефолдингом (те-
AbF, особенно в случае несистемного примене-
бентафусп и бролуцизумаб) [9, 17].
ния [11]. AbF обладают высокими значениями
Разработано множество стратегий полу-
BC50 для почек, показывая, что они с высокой
чения высокого выхода рекомбинантных AbF.
вероятностью будут фильтроваться и реабсор-
При использовании в качестве продуцента
бироваться из мочи [10, 12]. За последние годы
E. coli следует учесть три главных аспекта про-
рекомбинантные AbF стали одними из самых
дукции AbF: штаммы, векторы и условия куль-
широко используемых биофармацевтических
тивирования.
продуктов для терапевтического применения, а
Традиционные подходы к синтезу AbF в клет-
также для иммунодетекции, очистки и биосепа-
ках E. coli. AbF могут быть успешно получены
рации [3]. Причиной популярности AbF в био-
в цитоплазме и периплазме, хотя у каждого из
технологии является возможность их биосин-
этих вариантов есть свои ограничения [19]. На-
теза в бактериальных и/или дрожжевых клетках
пример, если достигнуть высокого уровня син-
и, следовательно, более низкие затраты на про-
теза AbF в цитоплазме, белки могут неправиль-
изводство каждого миллиграмма белка. Данный
но свернуться и сформировать нерастворимые
обзор сосредоточен на последних достижениях
тельца включения. Секреция в периплазму де-
в области продукции AbF в прокариотических
лает возможным формирование естественных
и эукариотических системах экспрессии, таких
дисульфидных связей, но периплазматическое
как Escherichia coli, Saccharomyces cerevisiae и
пространство ограничено, что приводит к мень-
Pichia pastoris.
шему выходу или формированию агрегатов.
БИОХИМИЯ том 88 вып. 9 2023
1448
ZELENOVIC и др.
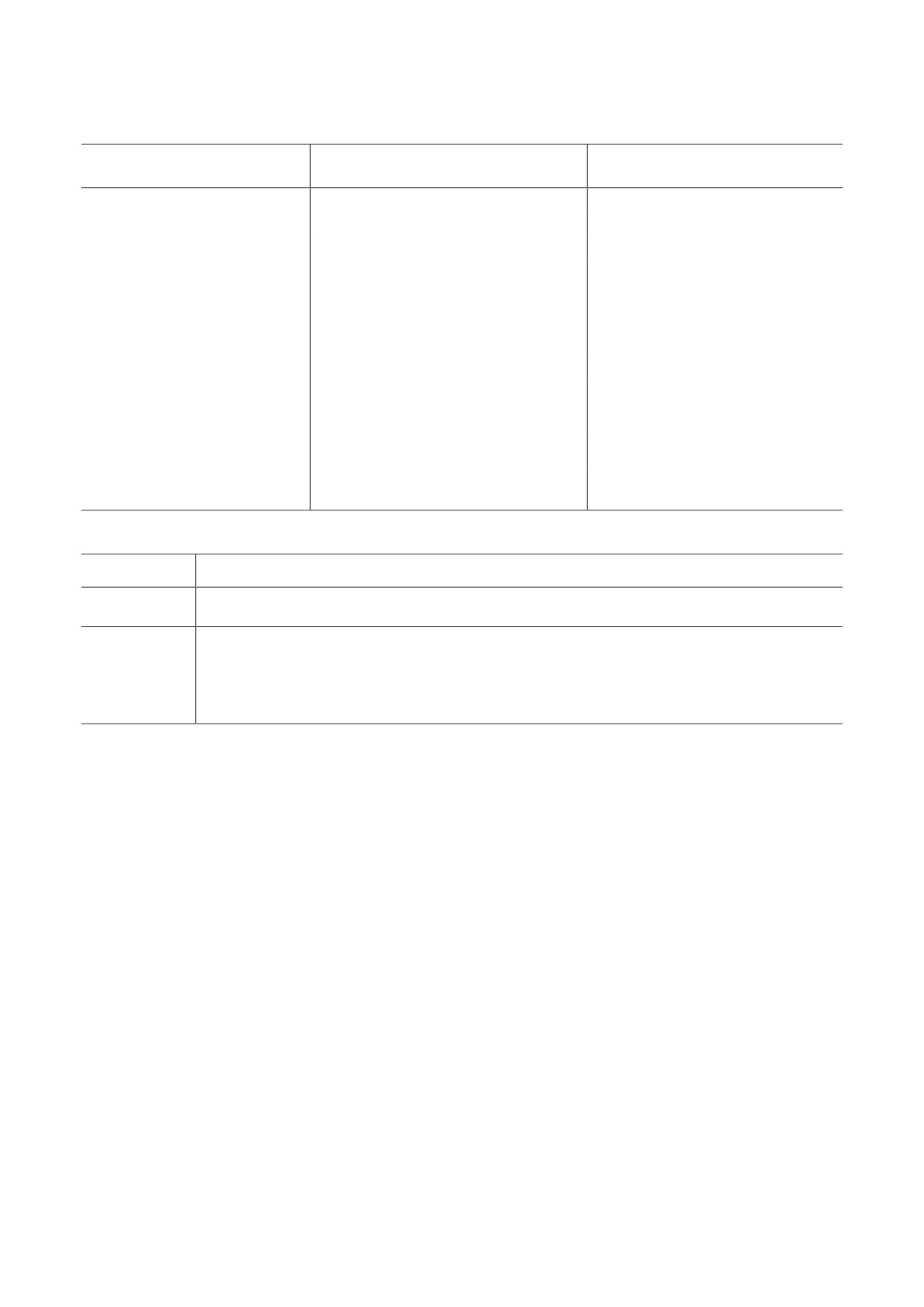
Таблица 1. Одобренные FDA и EMA терапевтические AbFs, синтезированные в клетках E. coli [18]
Год одобрения
Название
Терапевтическое применение
Формат AbF
(FDA или EMA)
мышиный биспецифический
Блинатумомаб
острый лимфобластный лейкоз
2014
тандемный scFv
стабилизированный дисульфидом
Моксетумомаб
слитный белок Fv (dsFv)-PE38-
волосатоклеточный лейкоз
2018
пасудотокс
фрагмент экзотоксина A
Pseudomonas
приобретённая тромботическая
Каплацизумаб
гуманизированное нанотело
2019
тромбоцитопеническая пурпура
неоваскулярная возрастная
Бролуцизумаб
гуманизованный scFv
2019
макулярная дегенерация
неоперабельная или метастатическая
биспецифичный слитный
Тебентафусп
2022
увеальная меланома
белок TCR-scFv
возрастная макулярная
Ранибизумаб
дегенерация, диабетическая
Fab
2006
ретинопатия, макулярный отёк
Цертолизумаб
активный псориатический артрит
пегилированный Fab
2008
пегол
гуманизированный слитный
Опортузумаб
рак мочевого пузыря
белок scFv-усечённый
2021
монатокс
экзотоксин A Pseudomonas
Периплазма обеспечивает более прямой под-
дукции. Некоторые группы исследователей по-
ход к очистке белков, поскольку её можно ли-
казали, что активность дисульфид-изомеразы
зировать в очень мягких условиях. Внешняя
DsbC может увеличить выход функциональных
мембрана может быть разрушена с помощью
AbF. Например, комбинирование этого подхо-
осмотического шока, механического воздей-
да с коэкспрессией оксидоредуктаз оказалось
ствия или лёгкой термической обработки.
лучшей стратегией синтеза белка в цитоплазме
Также периплазматическое пространство, в от-
с высоким выходом (до 72 мг/л) [25, 26]. Слия-
личие от цитоплазмы, содержит лишь 4-8% от
ние с другими белками (например, GFP) мо-
нативных белков E. coli, что упрощает процесс
жет улучшить растворимость целевого белка.
очистки [20].
Другие метки для слияния, такие как SNAP и
Самой распространённой стратегией про-
SORT, могут привести к лучшей экспрессии,
дукции AbF является экспрессия белков в рас-
но также и усложнить процесс очистки [27].
творимой форме в цитоплазме - она проста,
Хотя AbF не гликозилированы, другие пост-
обычно даёт высокий выход белка и не требует
трансляционные модификации важны для их
введения сигнальной последовательности в
функциональной активности. Так, scFv со-
вектор [21]. Однако экспрессия белка в цито-
держат две дисульфидные связи, а Fab - пять
плазме бактериальной клетки может приводить
или шесть. Производство AbF с естественны-
к некорректному формированию дисульфид-
ми дисульфидными связями является слож-
ных связей, что вызывает накопление реком-
ным, особенно в больших масштабах. Приме-
бинантных антител главным образом в виде
ром успешного биосинтеза AbF с корректно
телец включения. Тельца включения можно
сформированными дисульфидными связями
подвергнуть рефолдингу и формированию ди-
в цитоплазме E. coli является использование
сульфидных связей in vitro, после чего очистить
системы CyDisCo, основанной на коэкспрес-
для восстановления функциональной актив-
сии фермента Erv1p, формирующего дисуль-
ности [22]. Рекомбинантные AbF также могут
фидные связи, и дисульфид-изомеразы белка
продуцироваться в цитозоле с использованием
(protein disulfide isomerase, PDI). Данную си-
мутантных штаммов E. coli, сверхэкспресси-
стему протестировали для экспрессии и очист-
рующих дисульфид-изомеразу для усиленного
ки одиннадцати scFv и одиннадцати Fab, экс-
формирования дисульфидных связей [23, 24].
прессированных с одинаковых векторов при
Чтобы обеспечить синтез рекомбинантных
одинаковых условиях. Применение CyDisCo
белков в растворимой форме, лучше стремить-
дало большое количество AbF, прошедших
ся к оптимальной, а не максимальной их про-
естественный фолдинг и обладающих биоло-
БИОХИМИЯ том 88 вып. 9 2023
МИКРОБНАЯ ЭКСПРЕССИЯ ФРАГМЕНТОВ АНТИТЕЛ
1449
Таблица 2. Модификации штаммов E. coli [39]
Вид модификации
Название штамма
Характеристики/Применение
BL21(DE3),
сниженная деградация
Отсутствие протеаз (Lon и OmpT)
BL21Star(DE3)
чужеродного белка
CodonPlus-RIL
(BL21-RIL),
экспрессия редких кодонов
Дополнение редкими тРНК
CodonPlus-RP
(arg, ile, leu, pro)
(BL21-RP), Rosetta
Мутации в генах глутатионредуктазы (gor)
Origami, Shuffle T7,
повышенное образование
и тиоредоксинредуктазы (trxB)
Rosetta-gami («Novagen»)
дисульфидных связей в цитозоле
Введение промотора (araBAD) или ингибитора
BL21-AI, pLyS
экспрессия токсичных белков
промотора T7 (лизоцим фага T7)
Введение хорошо титруемого промотора
экспрессия глобулярных
Lemo21(DE3)
рамнозы (Prha)
или мембранных белков
Введение рестрицирующей метилцитозин-
McrA, McrBC, Mrr
сниженное метилирование
эндонуклеазы
штамм
снижение неправильного
Коэкспрессия шаперона
от «Agilent Technologies»
фолдинга белка
гической активностью, что было показано на
хотя они продуцируют большое количество
спектрах кругового дихроизма. Выход очищен-
ацетата, который может негативно влиять на
ных scFv и Fab-фрагментов составлял до 240 и
синтез белка и рост клеток [32]. Штаммы B,
42 мг/л соответственно [28].
полученные на основе штаммов K, напротив,
По сравнению с цитоплазмой (с восста-
производят меньше ацетата, что позволяет вы-
навливающей средой) периплазма лучше под-
ращивать клетки при более высоких концен-
ходит для формирования дисульфидных свя-
трациях глюкозы [33]. Таким образом, штам-
зей в AbF, поскольку предоставляет для них
мы K лучше подходят для скрининга, в то время
более окисляющую среду. Кроме того, присут-
как штаммы B - для продукции белка для био-
ствие множества шаперонов и изомераз, таких
фармацевтического применения [34].
как система Dsb, способствует правильному
VHH обычно продуцируются в системе
формированию дисульфидных связей. Боль-
экспрессии E. coli WK6 [35], разработанной на
шинство белков сначала продуцируется в ци-
основе штамма K12 и используемой для инду-
топлазме и затем секретируется в периплазму
цируемой экспрессии генов VHH. Клетки этих
различными путями (Sec, SRP и Tat). Для пе-
штаммов обладают высокой скоростью репли-
реноса в периплазму белкам требуется наличие
кации и оказались наилучшим вариантом для
на N-конце сигнального пептида (SpA, PhoA,
корректного формирования дисульфидной свя-
PelB, OmpA, OmpT, DsbA, TorT или TolT), ко-
зи. VHH, экспрессируемые в периплазматиче-
торый вместе с молекулярными шаперонами и
ское пространство, обычно модифицированы
дисульфид-изомеразами (система Dsb) помо-
различными метками, что существенно сни-
гает белкам правильно сворачиваться и фор-
жает вероятность формирования телец вклю-
мировать дисульфидные связи. Для прямой
чения [35, 36]. Клетки E. coli WK6 успешно
секреции белков в периплазму можно исполь-
использовались для высокопроизводительного
зовать около 20 сигнальных пептидов [29].
синтеза VHH против шиповидного белка ви-
Подобная таргетная периплазматическая се-
руса SARS-CoV-2 и пищевых аллергенов [37, 38].
креция использовалась во многих случаях, на-
пример, для экспрессии PGT135 в количествах
до ~1,2 г/л [8] или нескольких гуманизиро-
ВЕКТОРЫ ДЛЯ СИНТЕЗА AbF
ванных Fab′ с выходом до 2,4 г/л [30].
Штаммы E. coli, использованные для син-
Выбор промотора важен для регуляции
теза AbF. В биотехнологии часто используется
экспрессии и зависит от природы целевого
несколько штаммов (табл. 2), в частности,
белка [40-43]. Помимо промотора T7, исполь-
штаммы E. coli K-12 (MG1655, JM109, W3110,
зуемого чаще всего, есть несколько других про-
BW25113, DH5α, DH1, WK6) и B (BL21,
моторов, обладающих определёнными пре-
BL21(DE3), BL21(DE3) pLysS, BL21(DE3)
имуществами. Например, промотор araBAD
Rosetta) [31]. Чаще используются штаммы K,
является сильным, строго регулируемым
БИОХИМИЯ том 88 вып. 9 2023
1450
ZELENOVIC и др.
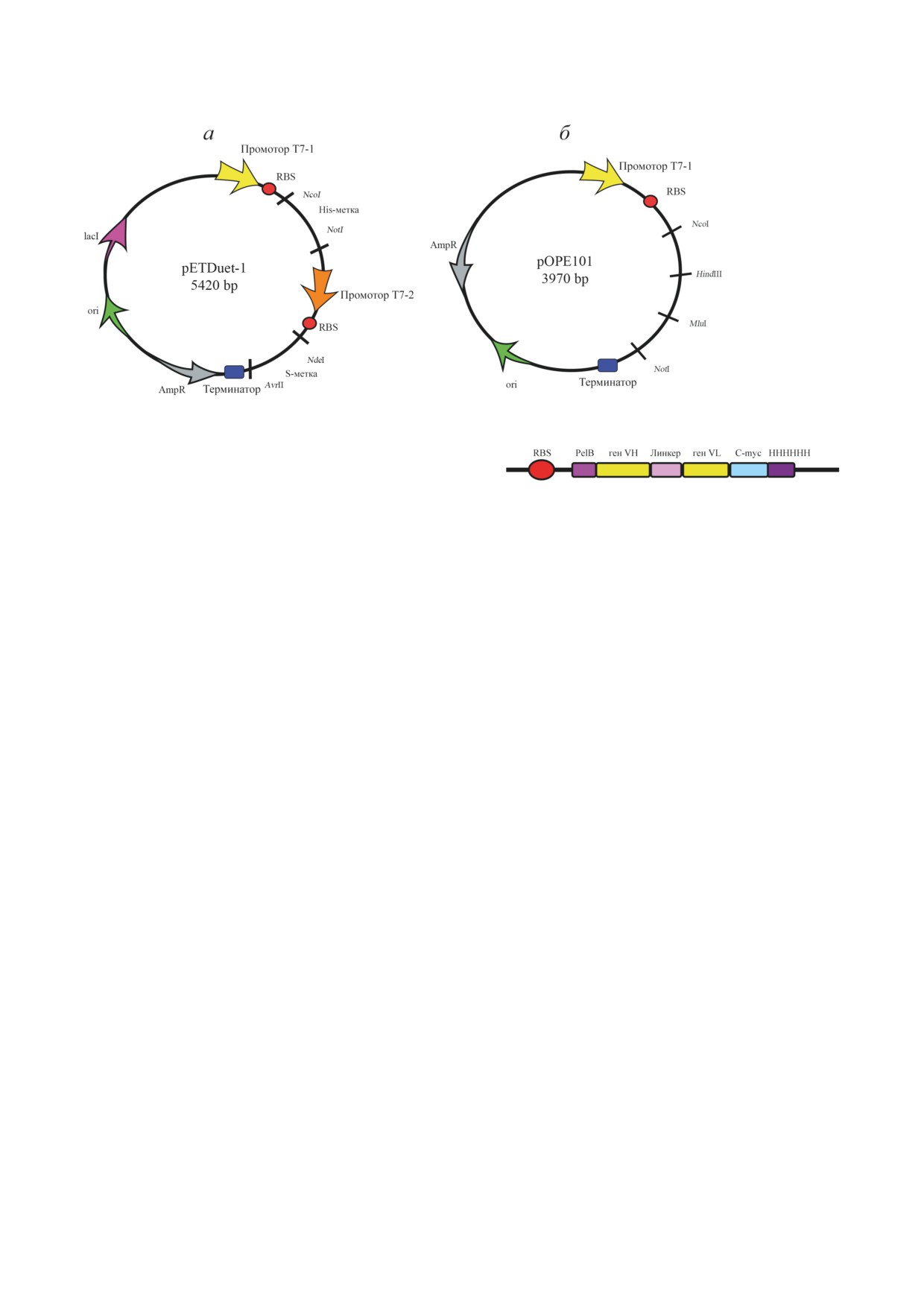
Рис. 2. Плазмиды pETDUET-1 (а) и pOPE101 (б), использованные для бактериальной экспрессии AbF
и хорошо титруемым, он используется глав-
УСЛОВИЯ КУЛЬТИВИРОВАНИЯ
ным образом для экспрессии токсичных бел-
ДЛЯ СИНТЕЗА AbF С ВЫСОКИМ ВЫХОДОМ
ков. Ещё один промотор, cspA - это промотор
холодового шока, дающий возможность экс-
Для высокого выхода AbF в клетках E. coli
прессировать белки при низких температурах
требуется оптимизировать множество пара-
(с оптимумом 10-25 °C) [44].
метров производства, таких как температура,
Для синтеза AbF обычно используется
перемешивание, время культивирования, аэра-
несколько векторов. Компания «Progen» раз-
ция, источники углерода, среда, тип индук-
работала новый вектор для клонирования,
ции [42, 43].
pOPE101, который обеспечивает биосинтез
Влияние температуры на выход AbF хо-
scFv в растворимой форме (рис. 2) в клет-
рошо изучено. Хотя максимальная скорость
ках E. coli. Он включает сильный IPTG-инду-
роста E. coli наблюдается при 37 °C, экспрес-
цируемый промотор T7, ген устойчивости к
сию рекомбинантных антител оказалось лучше
ампициллину, лидерную последовательность,
производить при более низких температурах
обеспечивающую экспрессию белка в пери-
(25 °C), поскольку её затрудняет деградация
плазме, и метку C-myc/His6 для облегчения
белка и формирование телец включения [45].
очистки. В случае scFv тяжёлую цепь кло-
В нескольких исследованиях сообщалось,
нировали по сайтам NcoI и HindIII, а лёг-
что сложные среды, такие как TB (terrific broth)
кую - по сайтам MluI и NotI. Две цепи со-
или EnPresso, стимулируют рост клеток, что
единялись линкером из 18 аминокислотных
приводит к сверхэкспрессии продукта [46].
остатков, который делал возможной коэкс-
Однако насыщенность среды роста не оказы-
прессию двух целевых белков. Новый вектор
вает существенного воздействия на выход бел-
pETDUET-1 (рис. 2), разработанный компа-
ка, на который в большей степени влияет ами-
нией «Novagen», содержит два сайта множе-
нокислотная последовательность, чем состав
ственного клонирования (multiple cloning sites,
среды [47].
MCS), в каждом из которых есть промотор T7.
Оптимизация концентрации источников
Сайт MSC2 заканчивается терминатором T7.
углерода (глюкоза, глицерол, лактоза, глицин)
Этот вектор также содержит метку His6 в сай-
может положительно влиять на экспрессию
те MSC1 и метку S в сайте MSC2, его можно
AbF. Как правило, снижение концентрации
использовать с любым совместимым штам-
глюкозы и увеличение содержания глицерола
мом E. coli [40]. Вектор pETDUET-1 приме-
в среде увеличивает количество внеклеточных
няли, например, для синтеза rHu (биоаналога
VHH [48]. Глицин воздействует на пептидогли-
ранибизумаба) с выходом до 2,8 мг/л (в этом
кановый слой бактериальной клеточной стенки,
случае лёгкие и тяжёлые цепи клонировали
что увеличивает проницаемость клеток, и белки
в два MCS) [41].
могут легче выходить в культуральную среду.
БИОХИМИЯ том 88 вып. 9 2023
МИКРОБНАЯ ЭКСПРЕССИЯ ФРАГМЕНТОВ АНТИТЕЛ
1451
После того, как было открыто, что 13% после-
формирование дисульфидных мостиков и дру-
довательности VHH представлено остатками
гие посттрансляционные модификации для
глицина, добавка глицина в среду для культи-
экспрессируемых гетерологичных белков эука-
вирования стала использоваться для снижения
риотического происхождения [52, 53]. Произ-
метаболической нагрузки; глицин действует как
водство белков с помощью дрожжей малоза-
предшественник в синтезе AbF [49].
тратно, и процесс их получения в ферментёрах
Снижение концентрации IPTG иногда
легко масштабируется. Дрожжи также гораздо
может улучшать растворимость и активность
более толерантны к таким факторам фермен-
синтезируемых белков за счёт снижения их
тации, как pH, присутствие ингибиторов фер-
экспрессии. Оптимальная концентрация IPTG
ментации, высокая концентрация сахара и
зависит от конкретного белка и должна под-
этанола и т.д., по сравнению с клетками E. coli
бираться для каждого AbF. Сообщается о ши-
(табл. 3) [54].
роком диапазоне возможных концентраций
Распространённые виды дрожжей (табл. 4),
IPTG (от 0,005 до 5 мМ), хотя наиболее часто
используемые в качестве клеток-хозяев экс-
используемая концентрация IPTG для T7 lac-
прессии рекомбинантных белков, могут являть-
промотора составляет 1 мМ. В некоторых слу-
ся неметилотрофными (Saccharomyces cerevisiae,
чаях нет необходимости использовать мак-
Yarrowia lipolytica, Kluyveromyces lactis) и метило-
симально возможную концентрацию IPTG,
трофными (Pichia pastoris, Hansenula polymorpha,
поскольку это может перегрузить клетку и ин-
Candida boidinii). S. cerevisiae и P. pastoris соот-
дуцировать формирование телец включения.
ветственно представляют две группы, наиболее
Напротив, низкий уровень IPTG часто сокра-
часто используемые для продукции белков с
щает образование телец включения и улучшает
терапевтическим применением [57].
фолдинг и стабильность белка [46].
S. cerevisiae является непатогенным орга-
низмом, в целом признанным безопасным
(generally recognized as safe, GRAS), что спо-
ЭКСПРЕССИЯ AbF В ДРОЖЖАХ
собствовало его использованию в пищевой
промышленности. Геном штамма S. cerevisiae
Хотя у продукции AbF в E. coli есть пре-
S288C был первым полностью секвенирован-
имущества (быстрый рост клеток, лёгкость
ным эукариотическим геномом [58], который
манипуляций и минимальная сложность сре-
дал огромное количество информации о гене-
ды), у неё также есть и недостатки, в том числе
тике и клеточной биологии дрожжей и сделал
формирование телец включения из-за окис-
возможным лёгкость генетического манипу-
ляющей внутриклеточной среды. Чтобы полу-
лирования этим видом. Достижения в области
чить растворимые функциональные антитела
генной инженерии, стабильность системы экс-
из телец включения, требуется дополнитель-
прессии и лёгкость культивирования сделали
ный рефолдинг [50]. Это привело к разработке
S. cerevisiae перспективным хозяином для био-
эукариотических систем экспрессии. Самым
синтеза mAb и AbF. Продукция VHH ламы в
доступным эукариотическим организмом для
S. cerevisiae является хорошо отлаженным про-
продукции рекомбинантных белков являют-
мышленным процессом с выходом до сотен
ся дрожжи. У этих одноклеточных эукариот
мг/л [59]. В промышленности и исследованиях
есть многочисленные преимущества. Дрожжи
применяется широкий спектр штаммов дрож-
легко растут на простых средах и достигают
жей, а для экспрессии рекомбинантных белков
высокой плотности клеток при культивиро-
чаще всего используется штамм BJ5464.
вании в малых и больших масштабах. Биохи-
Для экспрессии рекомбинантных белков
мия, генетика и клеточная биология дрожжей
требуется трансформация клетки-хозяина хи-
хорошо изучены, что позволяет легко прово-
мическим способом или электропорацией
дить с ними генетические манипуляции. Как
(рис. 3) для введения вектора, несущего интере-
система экспрессии рекомбинантных белков,
сующий ген. Благодаря быстрой пролиферации
дрожжи поддерживают продукцию маленьких
дрожжей вектор размножается вместе с целе-
и больших (более 50 кДа) белков с высоким
вым геном. Многие эукариотические векторы,
выходом и низким уровнем загрязнения эндо-
так называемые челночные, могут существо-
генными белками [51]. Дрожжи секретируют
вать как в бактериальных, так и в эукариотиче-
только несколько собственных белков, что
ских клетках. У них два ориджина репликации
облегчает очистку выделяемых во внеклеточ-
и два набора маркерных генов, один из которых
ное пространство рекомбинантных белков.
функционирует в E. coli, а другой - в эукарио-
Кроме того, дрожжи обеспечивают гликози-
тической системе экспрессии, чаще всего дрож-
лирование, метилирование, ацилирование,
жах. Существует три типа векторов экспрессии
БИОХИМИЯ том 88 вып. 9 2023
1452
ZELENOVIC и др.
Таблица 3. Характеристики прокариотических и эукариотических систем экспрессии [55, 56]
Клетка-хозяин
Прокариотическая (E. coli)
Эукариотическая (дрожжевая)
для экспрессии
Рост
быстрый рост (30 мин)
быстрый рост (90 мин)
Сложность среды
минимальная
минимальная
Стоимость производства
низкая
низкая
Возможность
масштабирования
высокая
высокая
производства
присутствует, секреция
Внеклеточная экспрессия
отсутствует, секреция в периплазму
в среду культивирования
Фолдинг белка
обычно требуется рефолдинг
рефолдинга не требуется
различные посттрансляционные
Посттрансляционные
отсутствие эукариотических
модификации, сильное
модификации
посттрансляционных модификаций
гликозилирование маннозы
средний
Риск загрязнения
низкий
(например, эндотоксинами)
белки низкой и высокой
Тип белка
белки низкой молекулярной массы
молекулярной массы
Таблица 4. Наиболее часто используемые штаммы S. cerevisiae и P. pastoris
Дрожжи
Штаммы
BY4716, W303, S288c, A634A, CEN.PK
S. cerevisiae
BJ5464, Σ1278b, SK1, BY4741, BY4742, BY4743
дикий тип (Y-11430, X-33)
штаммы с различными способностями к использованию метанола (Mut+, Muts, Mut-)
P. pastoris
штаммы с отсутствием протеазной активности (SMD1163, SMD1165, SMD1168)
штаммы с отсутствием гистидиндегидрогеназы (GS115, KM71, SMD1168)
для S. cerevisiae: эписомальные плазмиды (epi-
У YIp отсутствует ориджин репликации, и
somal plasmids, YEp), интегрирующиеся плаз-
они встраиваются в геном хозяина, в то время
миды (integrating plasmids, YIp) и центромер-
как YCp могут реплицироваться автономно в
ные плазмиды (centromeric plasmids, YCp).
клетке-хозяине в небольшом количестве копий.
YEp являются наиболее часто используе-
Гетерологичные гены помещаются под
мыми векторами как для внутри-, так и вне-
контроль особых промоторов для увеличения
клеточной продукции гетерологичных белков.
уровня экспрессии [50, 60]. Эти промоторы
Эти векторы получены из небольшой (2 мкм)
могут быть конститутивными, т.е. постоянно
круговой плазмиды, множественные копии
активными, или индуцируемыми, т.е. активи-
которой присутствуют во многих встречаю-
руемыми специфическими стимулами. Сти-
щихся в природе штаммах S. cerevisiae. Плаз-
мулы для промоторов, полученных из генов
мида реплицируется независимо от хромосом
S. cerevisiae, обеспечивают эффективную тран-
дрожжей, так как содержит собственный ори-
скрипцию гетерологичных генов, помещённых
джин репликации. Отбор клонов S. cerevisiae
в эписомальные векторы. Легко регулируемые
основан на использовании мутантных (ауксо-
индуцируемые промоторы необходимы для
трофных) штаммов, которым для роста тре-
одновременного синтеза нескольких гетеро-
буется конкретная аминокислота (гистидин,
логичных белков. Например, промоторы, ин-
триптофан, лейцин) или нуклеотид (урацил);
дуцируемые галактозой, быстро отвечают на
они могут расти на минимальной среде только
её добавление и усиливают транскрипцию до
тогда, когда она дополнена соответствующим
1000 раз [61]. В клетках S. cerevisiae галактоза
питательным веществом. В векторе содержит-
метаболизируется в последовательности ре-
ся функциональный ген дикого типа, воспол-
акций до глюкозо-6-фосфата, который всту-
няющий мутантный ген хозяина.
пает в гликолиз или пентозофосфатный путь.
БИОХИМИЯ том 88 вып. 9 2023
МИКРОБНАЯ ЭКСПРЕССИЯ ФРАГМЕНТОВ АНТИТЕЛ
1453
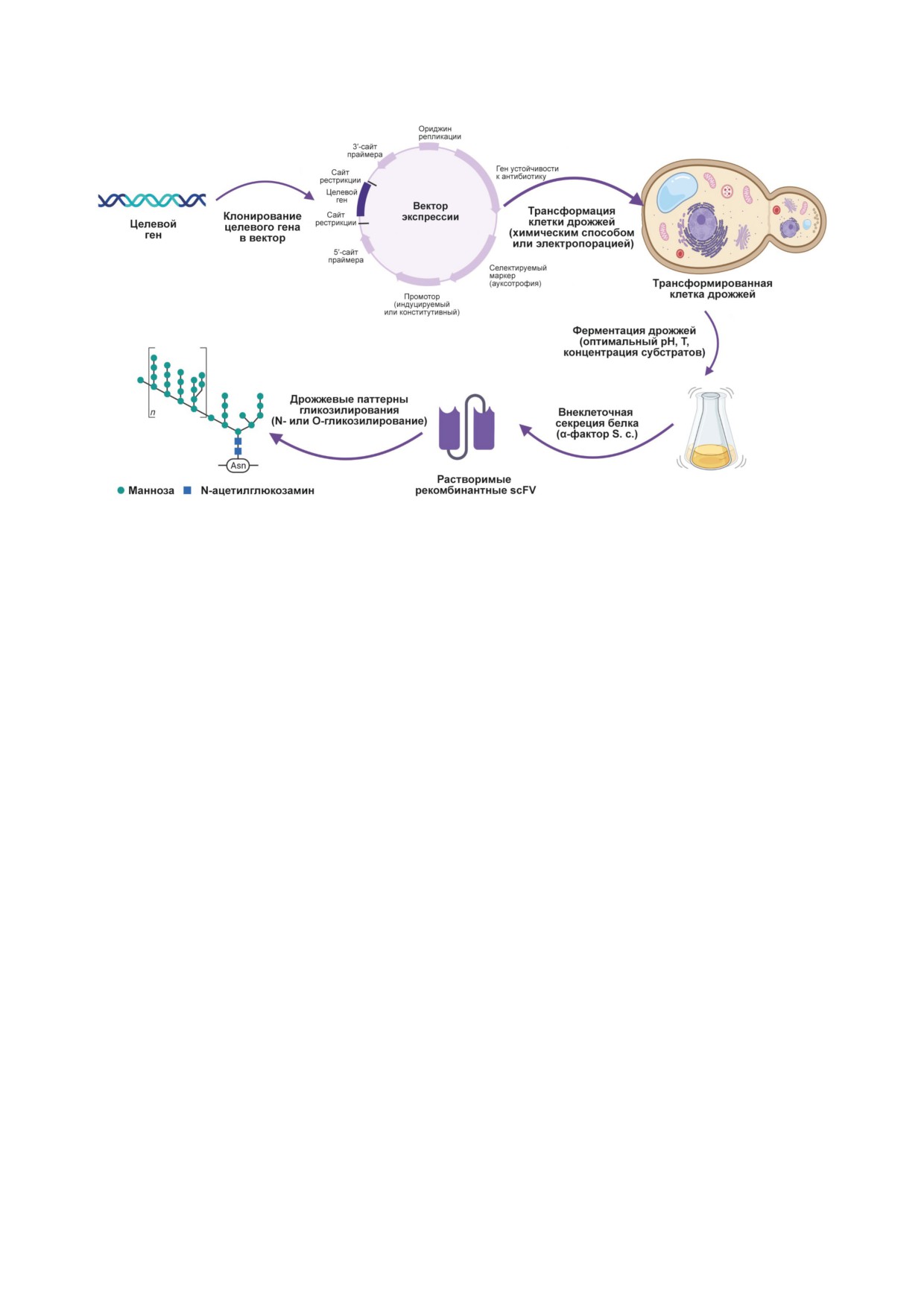
Рис. 3. Экспрессия AbF в дрожжах: необходимый ген клонируют в векторе экспрессии, дрожжевые клетки трансфор-
мируют получившейся конструкцией, оптимизируют процесс ферментации; AbF производят в большом масштабе
и анализируют их профили гликозилирования. Создано с использованием ресурса BioRender.com с разрешения
Такое превращение необходимо, поскольку гли-
AbF не гликозилированы и, следователь-
колитические ферменты не распознают галакто-
но, могут экспрессироваться в дрожжах. Так,
зу. Этот принцип используется для экспрессии
S. cerevisiae использовали для получения таких
гетерологичных белков в дрожжах с использо-
основанных на AbF лекарств, как ранибизумаб
ванием промоторов GAL1 и GAL10, которые
(Ran, Fab-фрагмент), пекселизумаб (Pex; scFv-
строго регулируют экспрессию генов метабо-
пептид) и другие (табл. 5). Для этого использо-
лизма галактозы. Галактоза является непри-
вался штамм B184 с существенно повышенным
вычным питательным веществом для дрож-
синтезом α-амилазы, полученный из штамма
жей, которое может использоваться в качестве
AAC за счёт случайного мутагенеза и микро-
единственного источника углерода при отсут-
флюидного скрининга. Удаление амилазной
ствии глюкозы в среде [62].
плазмиды из штамма B184 дало штамм HA,
Производство рекомбинантных VHH ламы
который затем трансформировали плазмида-
в достаточном количестве - хорошо отрабо-
ми, созданными путём введения нанотела Nan
танный промышленный процесс, который
(состоящего из одного домена V-типа), генов
возможен благодаря стабильности и раство-
антител Pex и Ran в вектор CPOTud. Хотя три
римости молекулы VHH. Растворимость VHH
фрагмента антител обладают различной моле-
вызвана его гидрофильностью, которая делает
кулярной массой и посттрансляционными мо-
возможной секрецию VHH из эндоплазмати-
дификациями, все они успешно экспрессиро-
ческого ретикулума (ЭР). В отличие от VHH,
вались в штамме HA S. cerevisiae [65].
производные scFv более гидрофобны, а поэто-
Гиперманнозилирование может привести к
му менее растворимы и могут накапливаться
понижению активности, повышению иммуно-
в ЭР [63]. Эту проблему можно решить путём
генности, уменьшению периода полувыведе-
создания штаммов дрожжей со сверхэкспрес-
ния из сыворотки и снижению терапевтиче-
сией шаперонов и фолдаз, т.е. белков, обес-
ской эффективности гликопротеинов (рис. 3).
печивающих корректный фолдинг с после-
Однако в случае AbF гиперманнозилирования
дующей секрецией scFv [64]. Также создаются
можно избежать путём инактивации генов ман-
новые штаммы для увеличения общей способ-
нозилтрансфераз Mnn2p и Mnn11p, отвечающих
ности дрожжей к секреции; такого результата
за этот тип гликозилирования. Нокаут гена
можно достичь, управляя внутриклеточным
Och1p, кодирующего α-1,6-маннозилтрансфе-
перемещением белков, уменьшая их расщеп-
разу, также увеличил продукцию рекомбинант-
ление протеазами и контролируя ответ на теп-
ных белков, в том числе AbF. Следовательно,
ловой шок, что ведёт к более высокому уровню
модификация N-гликозилирования может при-
продукции белка [50].
водить к усилению секреции белков [66].
БИОХИМИЯ том 88 вып. 9 2023
1454
ZELENOVIC и др.
Таблица 5. Терапевтические AbF, синтезированные в S. cerevisiae и получившие одобрение FDA либо проходящие кли-
нические испытания
Год
Непатентованное название
Назначение
Структура
одобрения
Пекселизумаб
аортокоронарное шунтирование
scFvv
в фазе 3
(Pex, гуманизированный)
и ангиопластика
Ранибизумаб
макулярная дегенерация
Fab
2006
(Ran, гуманизированный)
ревматоидный артрит,
бивалентные
Вобарилизумаб (ALX-0061)
в фазе 2
системная красная волчанка
биспецифичные VHH
инфекции нижних дыхательных путей,
ALX-0171
тривалентные VHH
в фазе 2
профилактика РСВ-инфекции
Многие гетерологичные гены клонирова-
белков [52]. Использование P. pastoris для кон-
ны вместе с сигнальной последовательностью,
тролируемой экспрессии гетерологичных бел-
кодирующей пептид, облегчающий перенос
ков возможно благодаря существованию хоро-
рекомбинантного белка через клеточную мем-
шо регулируемых и эффективных промоторов,
брану и его выход во внешнюю среду. Добав-
возможности выращивать клетки до высокой
ление сигнальной последовательности может
плотности в биореакторах на простой среде,
существенно упростить процесс очистки бел-
а также секреции небольшого количества эн-
ка. Чаще всего в дрожжах используется сиг-
догенных белков, что существенно упрощает
нальная последовательность, полученная из
очистку белковых продуктов [67].
гена фактора спаривания α1 (mating factor α1,
Вектор для трансформации P. pastoris дол-
MFα1) (рис. 3). Обычно её вводят непосред-
жен быть линеаризован для эффективной ин-
ственно перед интересующим геном
[67].
теграции в дрожжевой геном путём гомоло-
Помимо сигнальной последовательности, экс-
гичной рекомбинации с формированием ста-
прессируемый ген может содержать метку
бильных трансформантов. Для экспрессии ге-
(чаще на C-конце), которая облегчает очистку
терологичных белков часто применяется инду-
белка и его количественное определение. Чаще
цируемый промотор гена алкогольоксидазы,
всего используются такие метки, как полигис-
AOX1, с использованием метанола в качестве
тидиновая и GFP [62]. Так, scFv-фрагмент с
индуктора. Этот промотор ингибируется глю-
присоединённым к C-концу GFP был синтези-
козой, глицеролом и большинством других ис-
рован в штамме S. cerevisiae BJ5464, и для от-
точников углерода [62, 69]. В качестве альтер-
слеживания его внутриклеточного процессин-
нативы можно использовать конститутивные
га использовалась флуоресценция GFP [68].
промоторы, поскольку уровень экспрессии, ко-
Однако, у дрожжей S. cerevisiae есть неко-
торый они обеспечивают, аналогичен тако-
торые ограничения, в числе которых неста-
вому для индуцируемых. Наиболее часто при-
бильность плазмид, гипергликозилирование и
меняемый конститутивный промотор - pGAP,
низкий выход белка. Это послужило причиной
который в норме регулирует экспрессию гена
разработки альтернативных систем экспрессии,
глицеральдегид-3-фосфатдегидрогеназы [62].
включая метилотрофные дрожжи P. pastoris.
Некоторые векторы экспрессии P. pastoris
Как и S. cerevisiae, P. pastoris является од-
содержат дополнительную последовательность
ноклеточным эукариотическим организмом
(например, пре-про-последовательность MFα1
со статусом GRAS [50], который можно легко
S. cerevisiae) непосредственно после промотора,
подвергать генетическим манипуляциям и куль-
которая служит сигналом секреции экспрес-
тивировать. Клетки P. pastoris дают множество
сируемого белка [69]. Очистка секретируемого
посттрансляционных модификаций, таких как
белка достигается главным образом за счёт
правильный фолдинг белка, гликозилирова-
сепарации среды ферментации от дрожжевой
ние и формирование дисульфидных связей.
биомассы путём центрифугирования. После
По сравнению с клетками насекомых или
этого рекомбинантные белки можно концен-
млекопитающих клетки P. pastoris дают воз-
трировать и очищать различными методами,
можность проводить более быстрый, лёгкий
такими как ультрафильтрация, преципитация
и выгодный синтез рекомбинантных белков.
или хроматография, в зависимости от свойств
Главным преимуществом P. pastoris по срав-
целевого белка. В качестве примера упомя-
нению с S. cerevisiae является более низкая
нем производство нанотела анти-CEACAM5
степень гетерологического гликозилирования
в P. pastoris GS115 под контролем промотора
БИОХИМИЯ том 88 вып. 9 2023
МИКРОБНАЯ ЭКСПРЕССИЯ ФРАГМЕНТОВ АНТИТЕЛ
1455
pGAP с выходом ~50 мг/л. Очищенные нанотела
ника углерода дрожжи S. cerevisiae используют
использовались в раннем обнаружении карци-
2%-ную глюкозу или 2%-ную раффинозу, экс-
ноэмбрионального антигена (carcinoembryonic
прессия дрожжей в них индуцируется добавле-
antigen, CEA) в сыворотке у пациентов с опухо-
нием к среде 2%-ной галактозы. Для экспрес-
лями желудочно-кишечного тракта [70].
сии рекомбинантных AbF клетки S. cerevisiae
Отбор трансформированных клонов кле-
обычно выращивают при 28-30 °C [72]. Ещё
ток-хозяев ведётся за счёт введения генов
одним компонентом, необходимым для роста
устойчивости к антибиотикам. Существует две
клеток, является метанол, используемый в
группы векторов, которые придают клетке-
качестве источника углерода. Он также инду-
хозяину устойчивость к канамицину (pPIC3K
цирует экспрессию генов, тем самым увели-
и pPIC9K) и зеоцину (pPICZ) соответствен-
чивая продукцию белков. Однако чрезмерно
но [57]. Эти векторы также содержат уни-
высокие концентрации метанола (более 5%)
кальные сайты для эндонуклеаз рестрикции,
могут быть вредны из-за формирования ток-
используемые для клонирования целевых ге-
сичных продуктов, в то время как его низ-
нов, а также последовательности меток (6×His
кие концентрации (ниже 1%) вызывают про-
или GFP), которые позволяют проводить бо-
теолитическое расщепление гетерологичных
лее простую очистку гетерологичных белков.
белков. Оптимальная концентрация метано-
Новая система экспрессии белка в P. pastoris
ла - 2-2,5% [55]. Экспрессию белка можно
под названием PichiaPink может производить
улучшить введением 0,5-1,0%-ного сорбитола
белок в больших количествах (до 12 г/л). Она
в дополнение к метанолу. Сорбитол является
была представлена компанией «Thermo Fischer
источником углерода, который не индуцирует
Scientific» (США). Разница между штаммом,
и не подавляет промотор AOX, поэтому выра-
используемом в данной системе, и обычными
щивание дрожжей на смеси метанол/сорби-
штаммами заключается в методе отбора, осно-
тол снижает токсические эффекты метанола,
ванном на комплементарности адениновых
а также повышает плотность клеток и произ-
ауксотрофов (а не на устойчивости к анти-
водительность всего процесса [55, 73].
биотикам). На настоящий момент существует
Ещё одним важным фактором для выра-
четыре штамма, которые можно использовать
щивания P. pastoris является температура. Оп-
для трансформации и внеклеточной экспрес-
тимальная температура для этих дрожжей со-
сии белка. Белки переносятся во внеклеточную
ставляет 30 °C. Её повышение до 32 °C вызы-
среду с помощью восьми последовательностей
вает клеточную смерть и понижение экспрес-
секреции. Преимущество такой системы экс-
сии белка, а снижение температуры ниже 28 °C
прессии в том, что её легко масштабировать от
обеспечивает жизнеспособность клеток, умень-
низких до больших объёмов ферментации [52].
шает протеолитическое расщепление экс-
Впервые P. pastoris использовали как си-
прессируемого белка и увеличивает его вы-
стему экспрессии для получения человече-
ход [55, 74]. Ещё одним критическим факто-
ских AbF LR и 10FG2, которые клонировали в
ром, влияющим на продукцию белка, является
вектор pPICZαA и экспрессировали в штамме
время экспрессии. Для получения достаточной
P. pastoris X33. Вектор содержал сигнальную
клеточной биомассы клетки P. pastoris выра-
последовательность секреции α-фактора, что
щиваются 96 ч. Однако сообщалось, что долгое
делало возможной внеклеточную экспрессию
время выращивания клеток влияет на протео-
рекомбинантных белков. Оба экспрессирован-
литическую деградацию рекомбинантных бел-
ных AbF могли связывать токсины скорпиона,
ков. Следовательно, для успешной продукции
показывая, что их биохимические и функцио-
белка требуется оптимизация времени инкуба-
нальные свойства остались неизменными.
ции. Было обнаружено, что экспрессия белка
Кроме того, выход рекомбинантных белков
происходит главным образом в интервале ме-
в P. pastoris был выше, чем в клетках E. coli [71].
жду 72 и 96 ч, хотя начаться может уже через
48 ч после индукции роста [55, 75].
Клетки P. pastoris оказались прекрасным
СТРАТЕГИИ УЛУЧШЕНИЯ
хозяином экспрессии для синтеза AbF. Два
ЭКСПРЕССИИ AbF В ДРОЖЖАХ
рекомбинантных нанотела, полученных в
P. pastoris - ALX061 и ALX00171 - нашли при-
Стратегии улучшения продукции гетеро-
менение в лечении ревматоидного артрита
логичных белков основаны на варьирова-
и респираторно-синцитиальной инфекции
нии условий (температуры, времени инкуба-
(РСВ - respiratory syncytial virus, RSV) соответ-
ции, концентрации субстрата) культивирова-
ственно [50]. Некоторые AbF использовались
ния S. cerevisiae и P. pastoris. В качестве источ-
для молекулярной визуализации - например,
БИОХИМИЯ том 88 вып. 9 2023
1456
ZELENOVIC и др.
scFv, направленный на ген специфических
его очистки. Выход рекомбинантных белков в
калиевых каналов сердца у человека (human
дрожжах высок и может достигать от милли-
ether-a-go-go-related gene 1, hERG1), который
граммов до граммов на литр. Таким образом,
является отличительным признаком зарожда-
дрожжи обеспечивают быструю и экономи-
ющихся опухолей. Нативный анти-hERG1 scFv
чески выгодную продукцию рекомбинантных
и его мутантный анти-hERG1-вариант scFv-
белков.
Cys были синтезированы в клетках P. pastoris
Другими системами, разработанными для
GS115. Максимальный уровень экспрессии
экспрессии терапевтических AbF, являются
белка достигался через 72 ч после её индукции.
клетки млекопитающих, растения и бакуло-
Мутантный вариант scFv-hERG1-Cis, в кото-
вирусы. Клетки млекопитающих - это един-
ром остаток цистеина заменял фенилаланин
ственная система экспрессии, которая может
в каркасном участке 3 домена VH, был более
продуцировать нативные белки человека с
стабилен в сыворотке и обладал большей аф-
правильными паттернами посттрансляцион-
финностью к антигену hERG1 на поверхности
ных модификаций. Экспрессия в клетках мле-
клеток, что делает его удобным инструментом
копитающих является дорогостоящей, слож-
для молекулярной визуализации и диагности-
ной и времязатратной, а её выход часто низок.
ки рака in vivo [76].
Очистка AbF, продуцированных в системах
млекопитающих, требует удаления вирусов, что
прибавляет дополнительный уровень сложно-
ЗАКЛЮЧЕНИЕ
сти ко всей процедуре [9].
И БУДУЩИЕ ПЕРСПЕКТИВЫ
Растительные системы экспрессии также
дают ряд преимуществ, включая низкую стои-
Продукция AbF была протестирована во
мость производства и высокий выход белка.
множестве эукариотических и прокариотиче-
Несмотря на то, что в таких системах бел-
ских систем экспрессии, например, в клет-
ки могут проходить корректный фолдинг, их
ках млекопитающих, трансгенных животных,
посттрансляционные модификации, особен-
трансгенных растениях, клетках насекомых,
но гликозилирование, отличаются от таковых
нитчатых грибах, водорослях, простейших,
в человеческих клетках и могут приводить к
дрожжах и бактериях. Однако у E. coli есть ряд
иммуногенности для таких AbF, что ограни-
уникальных по сравнению с другими систе-
чивает возможности применения трансгенных
мами преимуществ, особенно для крупномас-
растений. В зависимости от использованных
штабного производства. Несомненно, клетки
промоторов синтезированные в растениях бел-
E. coli имеют множество преимуществ, включая
ки могут запасаться в листьях, семенах или же
быстрый рост, высокий уровень экспрессии,
в тех и других. Хотя экспрессия белков может
возможности для генной инженерии благодаря
быть высокой, их препараты также могут быть
обширным познаниям о генетике и молекуляр-
загрязнены другими веществами, такими как
ной биологии этого организма, большое коли-
полифенолы и протеазы, которые затрудняют
чество векторов экспрессии, мутантных штам-
очистку [9].
мов клеток-хозяев и экономически выгодные
Бакуловирусные системы экспрессии яв-
среды/условия культивирования.
ляются прекрасной платформой для синтеза
За два последних десятилетия дрожжевые
и посттрансляционных модификаций белков
системы экспрессии стали обычным явлением
человека. По сравнению с другими системами
в продукции рекомбинантных AbF. У них есть
они обладают выдающейся гибкостью и воз-
ряд преимуществ перед бактериями, поскольку
можностью синтеза по принципу «включай
они непатогенны, легко выращиваются и обес-
и работай» в системах бакуловирус/клетка
печивают высокий уровень экспрессии реком-
насекомого. Хотя разработка систем экспрес-
бинантных белков. В отличие от прокариоти-
сии AbF в клетках насекомых и растений ещё
ческих систем экспрессии, дрожжевые могут
находится на ранней стадии как в части иссле-
производить антитела с подобными челове-
дований, так и в клинических условиях, эти
ческим паттернами гликозилирования. Экс-
системы потенциально способны радикально
прессия в бактериальных клетках часто при-
изменить всю сферу синтеза и разработки AbF
водит к формированию телец включения, в то
за счёт быстрой и экономически выгодной
время как дрожжи обеспечивают правильный
их экспрессии.
фолдинг белка и формирование функциональ-
ных белков. Сигнальные последовательности
Вклад авторов. M.P. - руководство рабо-
дают возможность прямо секретировать белок
той; L.F., N.Z., M.P. - написание и редактиро-
в среду, что облегчает дальнейший процесс
вание текста статьи.
БИОХИМИЯ том 88 вып. 9 2023
МИКРОБНАЯ ЭКСПРЕССИЯ ФРАГМЕНТОВ АНТИТЕЛ
1457
Финансирование. Работа была финанси-
Конфликт интересов. Авторы заявляют об
рована Министерством образования, науки и
отсутствии конфликта интересов.
технологического развития Республики Сер-
Соблюдение этических норм. Данная статья
бия (контракты №№ 451-03-47/2023-01/200168,
не содержит описания проведённых авторами
451-03-47/2023-01/200288 и
451-03-47/2023-
исследований с участием людей или использо-
01/200026).
ванием животных в качестве объектов.
СПИСОК ЛИТЕРАТУРЫ
1.
Mitra, S., and Tomar, P. C.
(2021) Hybridoma
11.
Balthasar, J., and Fung, H. L. (1994) Utilization of
technology; advancements, clinical significance, and
antidrug antibody fragments for the optimization of
future aspects, J. Genet. Eng. Biotechnol., 19, 159,
intraperitoneal drug therapy: studies using digoxin as a
doi: 10.1186/s43141-021-00264-6.
model drug, J. Pharmacol. Exp. Ther., 268, 734-739.
2.
Liu, J. K. (2014) The history of monoclonal antibody
12.
Dugel, P. U., Koh, A., Ogura, Y., Jaffe, G. J.,
development - progress, remaining challenges and
Schmidt-Erfurth, U., Brown, D. M., Gomes, A. V.,
future innovations, Ann. Med. Surg. (Lond), 3, 113-116,
Warburton, J., Weichselberger, A., Holz, F. G., HAWK
doi: 10.1016/j.amsu.2014.09.001.
and HARRIER Study Investigators (2020) HAWK
3.
De Marco, A. (2011) Biotechnological applications of
and HARRIER: phase 3, multicenter, randomized,
recombinant single-domain antibody fragments, Mi-
double-masked trials of brolucizumab for neovascular
crob. Cell Fact., 10, 44, doi: 10.1186/1475-2859-10-44.
age-related macular degeneration, Ophthalmology,
4.
Geyer, C. R., McCafferty, J., Dubel, S., Bradbury,
127, 72-84, doi: 10.1016/j.ophtha.2019.04.017.
A. R., and Sidhu, S. S. (2012) Recombinant antibodies
13.
Popovic, M., Andjelkovic, U., Burazer, L., Lindner, B.,
and in vitro selection technologies, Methods Mol. Biol.,
Petersen, A., and Gavrovic-Jankulovic, M.
(2013)
901, 11-32, doi: 10.1007/978-1-61779-931-0_2.
Biochemical and immunological characterization of
5.
Ahmad, Z. A., Yeap, S. K., Ali, A. M., Ho, W. Y.,
a recombinantly-produced antifungal cysteine pro-
Alitheen, N. B., and Hamid, M. (2012) scFv antibody:
teinase inhibitor from green kiwifruit (Actinidia de-
principles and clinical application, Clin. Dev.
liciosa), Phytochemistry,
94,
53-59, doi:
10.1016/
Immunol., 2012, 980250, doi: 10.1155/2012/980250.
j.phytochem.2013.06.006.
6.
Pluen, A., Boucher, Y., Ramanujan, S., McKee, T. D.,
14.
Abughren, M., Popović, M., Dimitrijević, R., Buraz-
Gohongi, T., di Tomaso, E., Brown, E. B., Izumi, Y.,
er, L., Grozdanović, M., Atanasković-Marković, M.,
Campbell, R. B., Berk, D. A., and Jain, R. K. (2001)
and Gavrović-Jankulović, M. (2012) Optimization
Role of tumor-host interactions in interstitial dif-
of the heterologous expression of banana glucanase
fusion of macromolecules: cranial vs. subcutaneous
in Escherichia coli, J. Serb. Chem. Soc., 77, 43-52,
tumors, Proc. Natl. Acad. Sci. USA, 98, 4628-4633,
doi: 10.2298/JSC110309158A.
doi: 10.1073/pnas.081626898.
15.
Arbabi-Ghahroudi, M., Tanha, J., and MacKenzie, R.
7.
Khawli, L. A., Biela, B., Hu, P., and Epstein,
(2005). Prokaryotic expression of antibodies, Can-
A. L.
(2003) Comparison of recombinant deriva-
cer Metastasis Rev., 24, 501-519, doi:10.1007/s10555-
tives of chimeric TNT-3 antibody for the radioim-
005-6193-1.
aging of solid tumors, Hybrid Hybridomics, 22, 1-9,
16.
Charlton, K. A. (2004) Expression and Isolation of
doi: 10.1089/153685903321538026.
Recombinant Antibody Fragments in E. coli. in Antibody
8.
Thurber, G. M., and Wittrup, K. D. (2008) Quan-
Engineering: Methods and Protocols (Lo, B. K. C., ed)
titative spatiotemporal analysis of antibody frag-
Humana Press, Totowa, NJ, pp. 245-254.
ment diffusion and endocytic consumption in
17.
Walsh, G.
(2010) Biopharmaceutical benchmarks
tumor spheroids, Cancer Res.,
68,
3334-3341,
2010, Nat. Biotechnol., 28, 917-924, doi: 10.1038/
doi: 10.1158/0008-5472.Can-07-3018.
nbt0910-917.
9.
Pirkalkhoran, S., Grabowska, W. R., Kashkoli, H. H.,
18.
Kang, T. H., and Seong, B. L. (2020) Solubility, stabil-
Mirhassani, R., Guiliano, D., Dolphin, C., and Khali-
ity, and avidity of recombinant antibody fragments ex-
li, H. (2023) Bioengineering of antibody fragments:
pressed in microorganisms, Front. Microbiol., 11, 1927,
challenges and opportunities, Bioengineering (Basel),
doi: 10.3389/fmicb.2020.01927.
10, 122, doi: 10.3390/bioengineering10020122.
19.
Choi, J., and Lee, S. (2004) Secretory and extracel-
10.
Li, Z., Krippendorff, B. F., Sharma, S., Walz, A. C.,
lular production of recombinant proteins using Esch-
Lavé, T., and Shah, D. K. (2016) Influence of mo-
erichia coli, Appl. Microbiol. Biotechnol., 64, 625-635,
lecular size on tissue distribution of antibody frag-
doi: 10.1007/s00253-004-1559-9.
ments, MAbs,
8,
113-119, doi:
10.1080/19420862.
20.
Sandomenico, A., Sivaccumar, J. P., and Ruvo, M.
2015.1111497.
(2020) Evolution of Escherichia coli expression system
2
БИОХИМИЯ том 88 вып. 9 2023
1458
ZELENOVIC и др.
in producing antibody recombinant fragments, Int. J.
coli to improve recombinant protein production, Appl.
Mol. Sci., 21, 6324, doi: 10.3390/ijms21176324.
Microbiol. Biotechnol., 99, 10367-10377, doi: 10.1007/
21.
Challener, C. A. (2015) Fermentation for the future,
s00253-015-6955-9.
BioPharm Int., 28, 30-31.
32.
Selas Castiñeiras, T., Williams, S. G., Hitchcock,
22.
Basu, A., Li, X., and Leong, S. S. J. (2011) Refolding
A. G., and Smith, D. C. (2018) E. coli strain engineer-
of proteins from inclusion bodies: rational design and
ing for the production of advanced biopharmaceutical
recipes, Appl. Microbiol. Biotechnol.,
92,
241-251,
products, FEMS Microbiol. Lett., 365, fny162, doi:
doi: 10.1007/s00253-011-3513-y.
10.1093/femsle/fny162.
23.
Popovic, M., Mazzega, E., Toffoletto, B., and de
33.
Sørensen, H. P., and Mortensen, K. K. (2005) Ad-
Marco, A.
(2018) Isolation of anti-extra-cellular
vanced genetic strategies for recombinant protein
vesicle single-domain antibodies by direct panning on
expression in Escherichia coli, J. Biotechnol., 115,
vesicle-enriched fractions, Microb. Cell Factor., 17, 6,
113-128, doi: 10.1016/j.jbiotec.2004.08.004.
doi: 10.1186/s12934-017-0856-9.
34.
Hayat, S. M., Farahani, N., Golichenari, B., and
24.
De Marco, A. (2022) Cytoplasmic production of na-
Sahebkar, A. (2018) Recombinant protein expression
nobodies and nanobody-based reagents by co-ex-
in Escherichia coli (E. coli): what we need to know,
pression of sulfhydryl oxidase and DsbC isomerase,
Curr. Pharmaceut. Design, 24, 718-725, doi: 10.2174/
Methods Mol. Biol., 2446, 145-157, doi: 10.1007/
1381612824666180131121940.
978-1-0716-2075-5_7.
35.
Pardon, E., Laeremans, T., Triest, S., Rasmussen, S. G.,
25.
Veggiani, G., and de Marco, A. (2011) Improved
Wohlkönig, A., Ruf, A., Muyldermans, S., Hol, W. G.,
quantitative and qualitative production of single-
Kobilka, B. K., and Steyaert, J. (2014) A general pro-
domain intrabodies mediated by the co-expression of
tocol for the generation of Nanobodies for structur-
Erv1p sulfhydryl oxidase, Protein Express. Purif., 79,
al biology, Nat. Protocols, 9, 674-693, doi: 10.1038/
111-114, doi: 10.1016/j.pep.2011.03.005.
nprot.2014.039.
26.
Rahbarizadeh, F., Rasaee, M. J., Forouzandeh-
36.
Jember, T. F. (2021) Molecular cloning, expression and
Moghadam, M., and Allameh, A.-A. (2005) High
purification of recombinant VHH proteins expressed
expression and purification of the recombinant
in E. coli, Am. J. Mol. Biol., 11, 129-141, doi: 10.4236/
camelid anti-MUC1 single domain antibodies in
ajmb.2021.114011.
Escherichia coli, Protein Express. Purif., 44, 32-38,
37.
Su, Q., Shi, W., Huang, X., Wan, Y., Li, G., Xing, B.,
doi: 10.1016/j.pep.2005.04.008.
Xu, Z. P., Liu, H., Hammock, B. D., Yang, X.,
27.
Djender, S., Schneider, A., Beugnet, A., Crepin, R.,
Yin, S., and Lu, X. (2022) Screening, expression, and
Desrumeaux, K. E., Romani, C., Moutel, S., Perez,
identification of nanobody against SARS-CoV-2 spike
F., and de Marco, A. (2014) Bacterial cytoplasm as an
protein, Cells, 11, 3355, doi: 10.3390/cells11213355.
effective cell compartment for producing functional
38.
Hu, Y., Wang, Y., Lin, J., Wu, S., Muyldermans, S.,
VHH-based affinity reagents and Camelidae IgG-like
and Wang, S. (2022) Versatile application of nano-
recombinant antibodies, Microb. Cell Factor., 13, 140,
bodies for food allergen detection and allergy immu-
doi: 10.1186/s12934-014-0140-1.
notherapy, J. Agricult. Food Chem., 70, 8901-8912,
28.
Gaciarz, A., Veijola, J., Uchida, Y., Saaranen,
doi: 10.1021/acs.jafc.2c03324.
M. J., Wang, C., Hörkkö, S., and Ruddock, L. W.
39.
Hemamalini, N., Ezhilmathi, S., and Mercy, A. A.
(2016) Systematic screening of soluble expression
(2020) Recombinant protein expression optimization
of antibody fragments in the cytoplasm of E. coli,
in Escherichia coli: a review, Ind. J. Animal Res., 54,
Microb. Cell Factor., 15, 22, doi: 10.1186/s12934-
653-660, doi: 10.18805/ijar.B-3808.
016-0419-5.
40.
Gupta, S. K., and Shukla, P. (2017) Microbial plat-
29.
Humphreys, D. P., Sehdev, M., Chapman, A. P.,
form technology for recombinant antibody fragment
Ganesh, R., Smith, B. J., King, L. M., Glover, D. J.,
production: a review, Crit. Rev. Microbiol., 43, 31-42,
Reeks, D. G., and Stephens, P. E. (2000) High-level
doi: 10.3109/1040841X.2016.1150959.
periplasmic expression in Escherichia coli using a eu-
41.
Mehta, D., Chirmade, T., Tungekar, A. A., Gani, K.,
karyotic signal peptide: importance of codon usage
and Bhambure, R. (2021) Cloning and expression of
at the 5′ end of the coding sequence, Protein Express.
antibody fragment (Fab) I: Effect of expression con-
Purif., 20, 252-264, doi: 10.1006/prep.2000.1286.
struct and induction strategies on light and heavy chain
30.
Ellis, M., Patel, P., Edon, M., Ramage, W., Dick-
gene expression, Biochem. Engin. J., 176, 108189, doi:
inson, R., and Humphreys, D. P. (2017) Develop-
10.1016/j.bej.2021.108189.
ment of a high yielding E. coli periplasmic expression
42.
Henry, K. A., Sulea, T., van Faassen, H., Hussack,
system for the production of humanized Fab’ frag-
G., Purisima, E. O., MacKenzie, C. R., and Arb-
ments, Biotechnol. Prog., 33, 212-220, doi: 10.1002/
abi-Ghahroudi, M. (2016) A rational engineering
btpr.2393.
strategy for designing protein A-binding camelid sin-
31.
Liu, M., Feng, X., Ding, Y., Zhao, G., Liu, H., and
gle-domain antibodies, PLoS One, 11, e0163113, doi:
Xian, M. (2015) Metabolic engineering of Escherichia
10.1371/journal.pone.0163113.
БИОХИМИЯ том 88 вып. 9 2023
МИКРОБНАЯ ЭКСПРЕССИЯ ФРАГМЕНТОВ АНТИТЕЛ
1459
43.
Bossi, S., Ferranti, B., Martinelli, C., Capasso, P., and
56.
De Sá Magalhães, S., and Keshavarz-Moore, E.
de Marco, A. (2010) Antibody-mediated purification of
(2021) Pichia pastoris (Komagataella phaffii) as a cost-
co-expressed antigen-antibody complexes, Protein Ex-
effective tool for vaccine production for low- and
press. Purif., 72, 55-58, doi: 10.1016/j.pep.2010.01.003.
middle-income countries (LMICs), Bioengineering
44.
Jia, B., and Jeon, C. O. (2016) High-throughput re-
(Basel), 8, 119, doi: 10.3390/bioengineering8090119.
combinant protein expression in Escherichia coli:
57.
Baghban, R., Farajnia, S., Rajabibazl, M.,
current status and future perspectives, Open Biol., 6,
Ghasemi, Y., Mafi, A., Hoseinpoor, R., Rahbarnia, L.,
160196, doi: 10.1098/rsob.160196.
and Aria, M. (2019) Yeast expression systems: overview
45.
Farshdari, F., Ahmadzadeh, M., Nematollahi, L., and
and recent advances, Mol. Biotechnol., 61, 365-384,
Mohit, E. (2020) The improvement of anti-HER2 scFv
doi: 10.1007/s12033-019-00164-8.
soluble expression in Escherichia coli, Braz. J. Pharm.
58.
Goffeau, A., Barrell, B. G., Bussey, H., Davis, R. W.,
Sci., 56, doi: 10.1590/s2175-97902019000317861.
Dujon, B., Feldmann, H., Galibert, F., Hoheisel,
46.
Zarschler, K., Witecy, S., Kapplusch, F., Foerster, C.,
J. D., Jacq, C., Johnston, M., Louis, E. J., Mewes,
and Stephan, H. (2013) High-yield production of
H. W., Murakami, Y., Philippsen, P., Tettelin, H.,
functional soluble single-domain antibodies in the
and Oliver, S. G. (1996) Life with 6000 genes, 274,
cytoplasm of Escherichia coli, Microb. Cell Factor., 12,
546-567, doi: 10.1126/science.274.5287.546.
97, doi: 10.1186/1475-2859-12-97.
59.
Gorlani, A., de Haard, H., and Verrips, T. (2012)
47.
Farasat, A., Rahbarizadeh, F., Ahmadvand, D., and
Expression of VHHs in Saccharomyces cerevisiae,
Yazdian, F. (2017) Optimization of an anti-HER2
Methods Mol. Biol.,
911,
277-286, doi:
10.1007/
nanobody expression using the Taguchi meth-
978-1-61779-968-6_17.
od, Prepar. Biochem. Biotechnol., 47, 795-803, doi:
60.
Chee, M. K., and Haase, S. B. (2012) New and re-
10.1080/10826068.2017.1342259.
designed pRS plasmid shuttle vectors for genetic ma-
48.
Studier, F. W. (2005) Protein production by auto-induc-
nipulation of Saccharomyces cerevisiae, G3 (Bethesda,
tion in high-density shaking cultures, Protein Express.
Md.), 2, 515-526, doi: 10.1534/g3.111.001917.
Purif., 41, 207-234, doi: 10.1016/j.pep.2005.01.016.
61.
Berlec, A., and Strukelj, B. (2013) Current state and
49.
Zou, C., Duan, X., and Wu, J. (2014) Enhanced extra-
recent advances in biopharmaceutical production in
cellular production of recombinant Bacillus deramificans
Escherichia coli, yeasts and mammalian cells, J. Indust.
pullulanase in Escherichia coli through induction mode
Microbiol. Biotechnol.,
40,
257-274, doi:
10.1007/
optimization and a glycine feeding strategy, Biores. Tech-
s10295-013-1235-0.
nol., 172, 174-179, doi: 10.1016/j.biortech.2014.09.035.
62.
Carlesso, A., Delgado, R., Ruiz Isant, O., Uwangue, O.,
50.
Spadiut, O., Capone, S., Krainer, F., Glieder, A., and
Valli, D., Bill, R. M., and Hedfalk, K. (2022) Yeast
Herwig, C. (2014) Microbials for the production of
as a tool for membrane protein production and struc-
monoclonal antibodies and antibody fragments, Trends
ture determination, FEMS Yeast Res., 22, foac047,
Biotechnol., 32, 54-60, doi: 10.1016/j.tibtech.2013.10.002.
doi: 10.1093/femsyr/foac047.
51.
Demain, A. L., and Vaishnav, P. (2009) Production
63.
Joosten, V., Lokman, C., van den Hondel, C. A.,
of recombinant proteins by microbes and higher or-
and Punt, P. J. (2003) The production of antibody
ganisms, Biotechnol. Adv., 27, 297-306, doi: 10.1016/
fragments and antibody fusion proteins by yeasts
j.biotechadv.2009.01.008.
and filamentous fungi, Microb. Cell Factor., 2, 1,
52.
Gupta, S. K., and Shukla, P. (2017) Sophisticated clon-
doi: 10.1186/1475-2859-2-1.
ing, fermentation, and purification technologies for
64.
Xu, P., Raden, D., Doyle, F. J., 3rd, and Robinson,
an enhanced therapeutic protein production: a review,
A. S. (2005) Analysis of unfolded protein response
Front. Pharmacol., 8, 419, doi: 10.3389/fphar.2017.00419.
during single-chain antibody expression in Saccaro-
53.
Vieira Gomes, A. M., Souza Carmo, T., Silva Car-
myces cerevisiae reveals different roles for BiP and PDI
valho, L., Mendonça Bahia, F., and Parachin, N. S.
in folding, Metab. Engin., 7, 269-279, doi: 10.1016/
(2018) Comparison of yeasts as hosts for recom-
j.ymben.2005.04.002.
binant protein production, Microorganisms, 6, 38,
65.
Wang, Y., Li, X., Chen, X., Nielsen, J., Petranovic, D.,
doi: 10.3390/microorganisms6020038.
and Siewers, V. (2021) Expression of antibody frag-
54.
Hong, M. S., Velez-Suberbie, M. L., Maloney, A. J.,
ments in Saccharomyces cerevisiae strains evolved for
Biedermann, A., Love, K. R., Love, J. C., Mukhopad-
enhanced protein secretion, Microb. Cell Fact., 20,
hyay, T. K., and Braatz, R. D. (2021) Macroscopic
134, doi: 10.1186/s12934-021-01624-0.
modeling of bioreactors for recombinant protein pro-
66.
Tang, H., Wang, S., Wang, J., Song, M., Xu, M.,
ducing Pichia pastoris in defined medium, Biotechnol.
Zhang, M., Shen, Y., Hou, J., and Bao, X. (2016)
Bioeng., 118, 1199-1212, doi: 10.1002/bit.27643.
N-hypermannose glycosylation disruption enhances
55.
Karbalaei, M., Rezaee, S. A., and Farsiani, H. (2020)
recombinant protein production by regulating secre-
Pichia pastoris: A highly successful expression system
tory pathway and cell wall integrity in Saccharomyces
for optimal synthesis of heterologous proteins, J. Cell.
cerevisiae, Scientific reports, 6, 25654, doi: 10.1038/
Physiol., 235, 5867-5881, doi: 10.1002/jcp.29583.
srep25654.
БИОХИМИЯ том 88 вып. 9 2023
2*
1460
ZELENOVIC и др.
67. Ahmad, M., Hirz, M., Pichler, H., and Schwab, H.
73. Gao, M.-J., Li, Z., Yu, R.-S., Wu, J.-R., Zheng, Z.-Y.,
(2014) Protein expression in Pichia pastoris: recent
Shi, Z.-P., Zhan, X.-B., and Lin, C.-C. (2012) Meth-
achievements and perspectives for heterologous pro-
anol/sorbitol co-feeding induction enhanced porcine
tein production, Appl. Microbiol. Biotechnol.,
98,
interferon-α production by P. pastoris associated with
5301-5317, doi: 10.1007/s00253-014-5732-5.
energy metabolism shift, Bioprocess Biosystems Engin.,
68. Huang, D., and Shusta, E. V. (2006) A yeast platform
35, 1125-1136, doi: 10.1007/s00449-012-0697-1.
for the production of single-chain antibody-green
74. Gao, M. J., Zhan, X. B., Gao, P., Zhang, X., Dong,
fluorescent protein fusions, Appl. Environ. Microbiol.,
S. J., Li, Z., Shi, Z. P., and Lin, C. C. (2015) Improv-
72, 7748-7759, doi: 10.1128/aem.01403-06.
ing performance and operational stability of porcine
69. Frenzel, A., Hust, M., and Schirrmann, T. (2013) Ex-
interferon-α production by Pichia pastoris with com-
pression of recombinant antibodies, Front. Immunol.,
binational induction strategy of low temperature and
4, 217, doi: 10.3389/fimmu.2013.00217.
methanol/sorbitol co-feeding, Appl. Biochem. Biotech-
70. Chen, Q., Zhou, Y., Yu, J., Liu, W., Li, F., Xian, M.,
nol., 176, 493-504, doi: 10.1007/s12010-015-1590-6.
Nian, R., Song, H., and Feng, D. (2019) An efficient
75. Farsiani, H., Mosavat, A., Soleimanpour, S., Sa-
constitutive expression system for Anti-CEACAM5
deghian, H., Akbari Eydgahi, M. R., Ghazvini, K.,
nanobody production in the yeast Pichia pastoris,
Sankian, M., Aryan, E., Jamehdar, S. A., and Rezaee,
Protein Expr. Purif.,
155,
43-47, doi:
10.1016/
S. A. (2016) Fc-based delivery system enhances immu-
j.pep.2018.11.001.
nogenicity of a tuberculosis subunit vaccine candidate
71. Gómez-Ramírez, I. V., Corrales-García, L. L., Pos-
consisting of the ESAT-6:CFP-10 complex, Mol. Bio-
sani, L. D., Riaño-Umbarila, L., and Becerril, B.
Systems, 12, 2189-2201, doi: 10.1039/c6mb00174b.
(2023) Expression in Pichia pastoris of human an-
76. Duranti, C., Carraresi, L., Sette, A., Stefanini, M.,
tibody fragments that neutralize venoms of Mexi-
Lottini, T., Crescioli, S., Crociani, O., Iamele, L.,
can scorpions, Toxicon, 223, 107012, doi: 10.1016/
De Jonge, H., Gherardi, E., and Arcangeli, A. (2018)
j.toxicon.2022.107012.
Generation and characterization of novel recombinant
72. Guthrie, C., and Fink, G. R. (2002) Guide to Yeast
anti-hERG1 scFv antibodies for cancer molecular
Genetics and Molecular and Cell Biology, Part C, Gulf
imaging, Oncotarget, 9, 34972-34989, doi: 10.18632/
Professional Publishing.
oncotarget.26200.
RECENT DEVELOPMENTS IN BIOPROCESSING
OF RECOMBINANT ANTIBODY FRAGMENTS
Review
N. Zelenovic1, L. Filipovic2, and M. Popovic3*
1 Center for Chemistry, Institute for Chemistry, Technology and Metallurgy,
National Institute of Republic of Serbia, University of Belgrade, 11000 Belgrade, Serbia
2 Innovative Centre, Faculty of Chemistry, University of Belgrade, 11000 Belgrade, Serbia
3 Department of Biochemistry, Faculty of Chemistry, University of Belgrade,
11000 Belgrade, Serbia; e-mail: la_bioquimica@chem.bg.ac.rs
Biotechnological and biomedical applications of antibodies have been on a steady rise since the 1980s.
As unique and highly specific bioreagents, monoclonal antibodies (mAbs) have been widely exploited and
approved as therapeutic agents. However, the use of mAbs has limitations for therapeutic applications.
Antibody fragments (AbFs) with preserved antigen-binding sites have a significant potential to overcome
the disadvantages of conventional mAbs, such as heterogeneous tissue distribution after systemic adminis-
tration, especially in solid tumors, and Fc-mediated bystander activation of the immune system. AbFs pos-
sess better biodistribution coefficient due to lower molecular weight. They preserve the functional features
of mAbs, such as antigen specificity and binding, while at the same time, ensuring much better tissue pen-
etration. An additional benefit of AbFs is the possibility of their production in bacterial and yeast cells
due to the small size, more robust structure, and lack of posttranslational modifications. In this review,
we described current approaches to the AbF production with recent examples of AbF synthesis in bacterial
and yeast expression systems and methods for the production optimization.
Keywords: antibody fragments, bacterial expression, yeast expression, scFv, VHH
БИОХИМИЯ том 88 вып. 9 2023