БИОХИМИЯ, 2023, том 88, вып. 9, с. 1545 - 1555
УДК 577.22
ДИМЕРНЫЙ ACE2-FC ЭКВИВАЛЕНТЕН МОНОМЕРНОМУ ACE2
В СУРРОГАТНОМ ТЕСТЕ ВИРУС-НЕЙТРАЛИЗУЮЩЕЙ
АКТИВНОСТИ АНТИТЕЛ
© 2023 Д.Э. Колесов, Е.А. Гаямова, Н.А. Орлова, И.И. Воробьев*
ФИЦ Биотехнологии РАН, 119071 Москва, Россия; электронная почта: ptichman@gmail.com
Поступила в редакцию 13.05.2023
После доработки 14.06.2023
Принята к публикации 16.06.2023
Ангиотензин-превращающий фермент 2 (ACE2) является основным клеточным рецептором для
опасных сарбековирусов SARS-CoV и SARS-CoV-2. Его рекомбинантный внеклеточный домен
используется для мониторинга уровня протективного гуморального иммунного ответа на ви-
русную инфекцию или вакцину методом суррогатного вирус-нейтрализующего теста (сВНТ).
Растворимый ACE2 также рассматривается как вариант антивирусной терапии, потенциально
нечувствительной к изменениям шиповидного белка SARS-CoV-2. Для широкого тестирования
методом сВНТ необходимо использовать препараты ACE2 или его конъюгатов с постоянными
свойствами. Ранее нами была получена клеточная линия - продуцент растворимого мономерного
ACE2, и было показано, что такой вариант ACE2 может быть использован в сВНТ, предпочтитель-
но в форме конъюгата с пероксидазой хрена (HRP). Для получения стабильной и универсально
применимой формы растворимого ACE2 была получена клеточная линия - продуцент слитного
белка ACE2-Fc с высокой продуктивностью, более 150 мг/л целевого белка при культивировании
в перемешиваемой колбе. Аффинно очищенный ACE2-Fc представляет собой смесь димерной
и тетрамерной форм, но позволяет получать линейные кривые ингибирования антителами ком-
плексообразования с рецептор-связывающим доменом шиповидного белка SARS-CoV-2. Система
тестирования сВНТ на основе ACE2-Fc-HRP может быть использована для практического измере-
ния уровней вирус-нейтрализующих антител в отношении различных циркулирующих вариантов
вируса SARS-CoV-2.
КЛЮЧЕВЫЕ СЛОВА: ангиотензин-превращающий фермент 2, SARS-CoV-2, сВНТ, вирус-нейтрализа-
ция, протективный иммунитет.
DOI: 10.31857/S0320972523090075, EDN: WTUYAA
ВВЕДЕНИЕ
расщепляет сосудосуживающий пептид ангио-
тензин II до сосудорасширяющего пептида
Ангиотензин-превращающий фермент 2 че-
ангиотензин 1-7 и быстро покидает кровоток с
ловека (АПФ2, ACE2, EC
3.4.17.23)
- это
периодом полувыведения около 3 ч [1]. Мем-
трансмембранный белок с коротким внутри-
бранно-связанный ACE2 является основным
клеточным доменом, обладающий свойствами
клеточным рецептором для опасных сарбеко-
цинк-зависимой металлопротеазы и экспрес-
вирусов SARS-CoV (коронавирус, вызываю-
сирующийся на поверхности клеток многих
щий тяжёлый острый респираторный синдром)
тканей, в том числе и эпителия дыхательных
и SARS-CoV-2, а также для альфакоронави-
путей. Мембранно-связанная форма ACE2 под
руса HCoV-NL63, вызывающего сезонные ин-
действием протеазы ADAM17 (дезинтегрин и
фекции дыхательных путей [2].
металлопротеиназный домен 17) превращает-
Достигнутый коллективный защитный им-
ся в растворимый ACE2 [1], который активно мунитет к пандемическому вирусу SARS-CoV-2
Принятые сокращения: ВНА - вирус-нейтрализующие антитела; ВНТ - вирус-нейтрализующий тест; мкАт -
моноклональное антитело; сВНТ - суррогатный вирус-нейтрализующий тест; ACE2 - ангиотензин-превращающий
фермент 2; CHO - линия клеток яичника китайского хомячка; Fc - кристаллизуемый фрагмент иммуноглобулина;
HRP - пероксидаза хрена; IC50 - концентрация, вызывающая ингибирование на 50%; MALS - многоугловая детек-
ция рассеяния света; MTX - метотрексат; PBS - фосфатно-буферизованный раствор; RBD - рецептор-связывающий
домен; SARS-CoV-2 - коронавирус 2, вызывающий тяжёлый острый респираторный синдром.
* Адресат для корреспонденции.
1545
1546
КОЛЕСОВ и др.
основан на возникновении у вакцинирован-
биотинилированный ACE2 как верхний слой
ных или переболевших вирус-нейтрализую-
ИФА. Ранее нами было предложено проводить
щих антител (ВНА), которые в основном состо-
сВНТ при использовании RBD для первого
ят из антител к рецептор-связывающему домену
слоя и конъюгата ACE2-HRP для верхнего
(RBD) шиповидного (S) белка вируса, препят-
слоя [7]. Такой вариант сВНТ был пригоден
ствующих его связыванию с ACE2. Уровень
для построения линейной зависимости уровня
ВНА ограниченно коррелирует с уровнем сы-
ингибирования взаимодействия RBD : ACE2
вороточного иммуноглобулина G (IgG) к RBD
от концентрации исследуемой сыворотки, что
или S-белку; из общего титра IgG, определяе-
существенно уменьшает необходимое число
мого по ИФА (иммуноферментному анализу),
разведений тестируемых образцов для опре-
нельзя предсказать уровень ВНА [3].
деления уровня ВНА и упрощает расчёт
Поскольку уровень антител к S-белку и
концентрации, вызывающей ингибирование
уровень ВНА после вакцинации или инфекции
на 50% (IC50).
постепенно снижаются, в будущем возможно
Мономерный ACE2, изготавливаемый для
повторное распространение новых вариантов
использования в качестве диагностического
SARS-CoV-2, что может иметь эпидемиологи-
реагента, обычно содержит на C-конце белка
ческие последствия. Регулярное измерение
гексагистидиновый кластер; такой реагент не
уровней ВНА при помощи вирус-нейтрали-
может участвовать в образовании мультимер-
зующих тестов (ВНТ) позволит своевременно
ных комплексов, но может быть менее стаби-
выявлять потерю ВНА в общей популяции
лен при хранении, чем димерный ACE2-Fc
либо выборках вакцинированных или пере-
(слитный белок внеклеточного домена ACE2
болевших лиц, при этом тестирование может
и кристаллизуемого фрагмента IgG).
проводиться против текущих циркулирующих
Для сВНТ, построенного на ингибирова-
вариантов вируса, всё более отличающихся от
нии образования комплексов ACE2 : RBD на
исходного варианта 2019 г.
поверхности микрочастиц и детекции трёх-
Золотым стандартом ВНТ считается тест на
слойных комплексов проточной цитометрией,
нейтрализацию бляшкообразования (PRNT):
было показано, что димерный ACE2-Fc прак-
культуру лабораторно адаптированного изучае-
тически непригоден для получения кривых
мого вируса добавляют к чувствительным клет-
ингибирования комплексообразования ACE2
кам и затем подсчитывают число вирус-инду-
и RBD вирус-нейтрализующими монокло-
цированных бляшек в монослое. Уровнем ВНА
нальными антителами (мкАт) или антителами
назначают максимальное разведение тестируе-
из сывороток крови. Мы предположили, что
мой сыворотки крови, для которого сниже-
в случае обычного формата сВНТ в форме
ние числа бляшек составило более 50%. Тест
конкурентного ИФА конъюгат димерного
PRNT, таким образом, является полуколиче-
ACE2-Fc с HRP будет эквивалентен конъюгату
ственным. Исследования патогенных для че-
мономерного ACE2. Димерный ACE2-Fc, как
ловека вирусов в таком формате крайне слож-
и другие слитные с Fc рекомбинантные белки,
ны и требуют применения мер обеспечения
потенциально может быть получен в больших
биобезопасности высокого уровня [4]. Живой
количествах в стабильно трансфицированных
вирус может быть заменён псевдотипирован-
клетках CHO (линия клеток яичника китай-
ным с репортёрным геном, такой тест (пВНТ)
ского хомячка) и использован для изготовле-
уже может проводиться в условиях BSL-2 [5],
ния реактива для сВНТ с постоянными свой-
но его трудоёмкость всё ещё очень высока, и
ствами.
он не может проводиться как рутинный в кли-
нических и диагностических лабораториях.
Суррогатный ВНТ (сВНТ) обычно про-
МАТЕРИАЛЫ И МЕТОДЫ
водится как конкурентный ИФА с детекцией
количества комплекса RBD : ACE2, уровнем
Молекулярное клонирование. Ген, кодирую-
ВНА считают разведение сыворотки, при ко-
щий слитный полипептид ACE2-Fc, содер-
тором взаимодействие RBD с ACE2 падает
жащий внеклеточный домен ACE2 (амино-
вдвое (ID50). Один из наиболее распростра-
кислотные остатки
319-541) с природным
нённых наборов для сВНТ, cPass [6] производ-
сигнальным пептидом (а.о. 1-14) и кристал-
ства компании «Genscript» (США), использует
лизуемый фрагмент (Fc) человеческого IgG1,
мономерный ACE2 в качестве первого слоя и
собирали на основе плазмиды pTF-ACE2s [7],
конъюгат RBD с пероксидазой хрена (HRP)
которая кодирует растворимый АСЕ2 и де-
в качестве верхнего слоя. Другие варианты
понирована нами в репозиторий Addgene
сВНТ используют RBD как первый слой и
(plasmid #162786, рис. 1).
БИОХИМИЯ том 88 вып. 9 2023
ВЛИЯНИЕ FС-ФРАГМЕНТА IgG НА СВОЙСТВА РАСТВОРИМОГО ACE2
1547
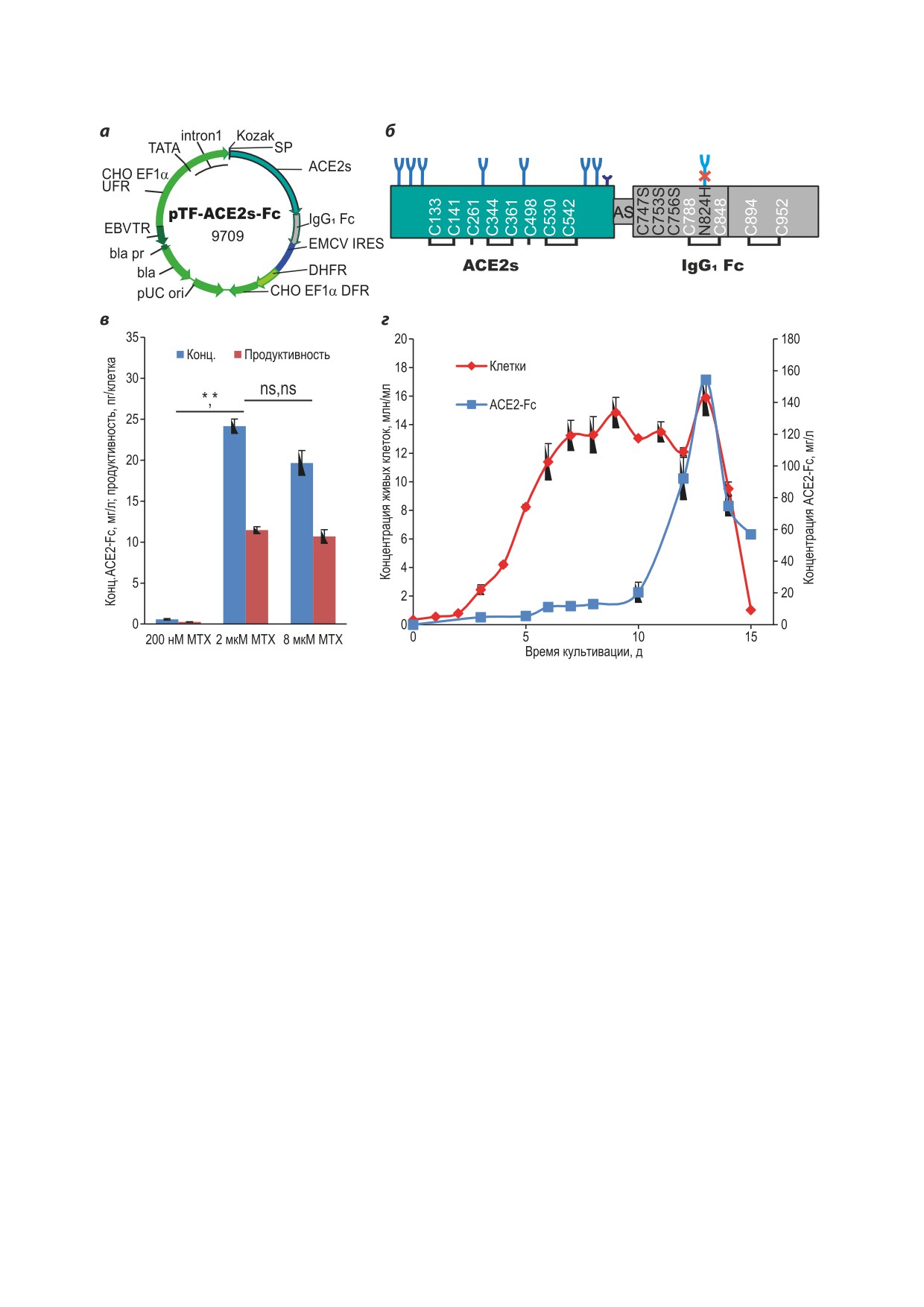
Рис. 1. Схема экспрессионной конструкции pTF-ACE2s-Fc (а), схема экспрессируемого слитного белка (б), дина-
мика удельной продуктивности клеток после проведения селекции и при амплификации трансгена под действием
метотрексата (MTX) (в), кривая накопления ACE2-Fc при длительном культивировании (г). Обозначения: pUC ori -
область начала репликации плазмиды pUC; bla - открытая рамка считывания бета-лактамазы; bla pr - промотор
гена bla; EBVTR - фрагмент конкатемера терминальных повторов вируса Эпштейна-Барр человека; CHO EF1α
UFR - область, фланкирующая ген фактора элонгации трансляции 1 альфа китайского хомячка «выше по течению»;
TATA - ТАТА-бокс; intron 1 - интрон 1 гена фактора элонгации трансляции 1 альфа китайского хомячка; Kozak -
синтетическая консенсусная последовательность Козак; SP - область, кодирующая сигнальный пептид гена ACE2;
ACE2s - открытая рамка считывания внеклеточного домена ACE2; EMCV IRES - внутренний сайт связывания ри-
босом вируса энцефаломиокардита лошадей; DHFR - открытая рамка считывания дигидрофолатредуктазы мыши;
CHO EF1α DFR - область, фланкирующая ген фактора элонгации трансляции 1 альфа китайского хомячка «ниже
по течению», включающая терминатор, сигнал полиаденилирования и 3′-нетранслируемую область этого гена.
Стрелками указаны направления транскрипции генов. На панели (б) существующие остатки Cys обозначены белым
шрифтом, замены - чёрным шрифтом. Синие фрагменты - известные сайты N-гликозилирования, тёмно-синий
фрагмент - сайт O-гликозилилирования. AS - линкерный дипептид, связывающий ACE2 и Fc-фрагмент. Планки
погрешностей здесь и далее соответствуют стандартному отклонению, статистические различия по критерию Стью-
дента, n = 2, * р < 0,05; ** р < 0,01; ns: р > 0,05
Последовательность, кодирующую фраг-
размером 712 п.н. выделяли из 1%-ного агароз-
мент Fc IgG1 человека с аминокислотными
ного геля набором PCR Clean-Up System («Ев-
заменами C220S, C226S, C229S, N297H (нуме-
роген»), клонировали в вектор pAL2-T («Ев-
рация по Каббату), получали методом ПЦР
роген») с образованием плазмиды pAL2-Fс,
с использованием смеси полимераз Encyclo
верифицировали нуклеотидную последова-
(«Евроген», Россия), плазмиды p1.1-Tr2-V-
тельность методом секвенирования, выреза-
RBDv2-Fc [8] в качестве матрицы, прайме-
ли фрагмент NheI-NheI размером
704 п.н.
ров AD-FcNheF (5′-AGCTAGCGAGCCCAAG
и лигировали с плазмидой pTF-ACE2s, ре-
AGCAGCGAT-3′) и AD-FcNheR (5′-CGCTA
стрицированной той же эндонуклеазой. По-
GCTACTTACCAGGACTAAGAG-3′), содержа-
скольку открытая рамка считывания (ОРС)
щих добавленные последовательности для
фрагмента Fc включала стоп-кодон, С-кон-
узнавания эндонуклеазой NheI. Продукт ПЦР
цевые тэги вектора рТF не транслировались.
БИОХИМИЯ том 88 вып. 9 2023
1548
КОЛЕСОВ и др.
Ориентацию вставки определяли методом
Capto Q («Cytiva») на скорости 1 мл/мин. Ко-
ПЦР с колоний с использованием праймера к
лонку промывали раствором 20 мМ фосфата
pTF-sACE2s SQ-ACE1512-F [7] и AD-FcNheR.
натрия, рН 7,4; целевой белок элюировали гра-
Полученные плазмиды pTF-sACE2-Fc секве-
диентом концентрации NaCl от 0 до 0,5 М
нировали с тех же праймеров и использовали
в 10 объёмах колонки. Концентрацию очи-
для трансфекции клеток CHO. Для выделе-
щенного ACE2-Fc определяли при помощи
ния плазмид использовали наборы Plasmid
УФ-спектрофотометрии, используя раствор
Miniprep и Plasmid Midiprep 2.0 («Евроген»).
фильтрата, возникающего при ультрафиль-
Получение поликлональных линий-проду-
трации очищенного белка, в качестве рас-
центов. Клетки линии СНО 4BGD [9] вели
твора сравнения. Коэффициент поглощения
в культуральной среде ProCHO5
(«Lonza»,
при λ = 280 нм для ACE2-Fc был определён по
Швейцария) с добавлением 8 мМ глутамина
аминокислотной последовательности слит-
в виде смеси добавок глутамина и аланилглу-
ного белка и составил 1,78 ОЕ·мл/мг. Раствор
тамина («ПанЭко», Россия). Проводили тран-
элюированного ACE2-Fc концентрировали до
сфекцию методом электропорации на аппарате
1-2 мг/мл с помощью центрифужных концен-
Neon («Invitrogen», США) в режиме 1700 В,
траторов Vivaspin 30 000 MWCO («Sartorius»,
10 мс, в соотношении 60 мкг ДНК/10 млн кле-
Германия) и хранили при -70 °С. Конъюги-
ток. Получали стабильную линию в присут-
рование ACE2-Fc с HRP проводили периодат-
ствии селекционного агента MTX в концентра-
ным методом.
ции 200 нМ с пассированием каждые 3-7 дней
Аналитическая гель-фильтрация ACE2-Fc.
до восстановления жизнеспособности клеток
Олигомерное состояние полученного препа-
более 90%, после этого увеличивали концен-
рата ACE2-Fc оценивали методом аналитиче-
трацию MTX до 2 мкМ и вели пассирование до
ской гель-фильтрации на колонке Superdex 200
восстановления жизнеспособности выше 85%,
10/300 GL («GE Healthcare», США), подвижная
затем повторяли амплификацию при концен-
фаза
- фосфатно-буферизованный раствор
трации MTX 8 мкМ. Измерение концентрации
(PBS), скорость потока 0,5 мл/мин. В качестве
ACE2-Fc в культуральной среде проводили при
стандартов молекулярной массы использовали
помощи ИФА с антителом и конъюгатом анти-
набор белков производства «GE Healthcare».
тела к Fc-фрагменту IgG1 человека («ХЕМА»,
ДСН-ПААГ-Электрофорез. Разделение вели
Россия). В качестве калибратора концентра-
при концентрации акриламида в разделяю-
ции использовали мкАт IgG1 человека, затем -
щем геле 12,5%, окрашивание проводили при
очищенный ACE2-Fc. Все количественные
помощи коллоидного раствора Кумасси сине-
данные в статье приведены для калибратора
го. Восстановленный образец получали при
ACE2-Fc.
добавлении дитиотреитола до 20 мМ и прогре-
Культивация линии для препаративной нара-
вании 5 мин при 95 °C непосредственно перед
ботки белка проводилась в 30 мл среды ActiPro
электрофорезом.
Medium («Cytiva», США) с добавлением 6 мМ
Определение
олигомерного
состояния
аланилглутамина, помещённых в перемешивае-
ACE2-Fc при помощи детекции многоуглового
мые колбы Эрленмейера на 125 мл, при 37 °C,
рассеяния (MALS). Разделение форм ACE2-Fc
5% CO2, 155 об./мин и при амплитуде качалки
вели на колонке Superdex 200 Increase 5/150 GL
12 мм. Поддерживали концентрацию глюкозы
(«Cytiva»), подвижная фаза - 20 мМ фосфата
в среде в районе 22 мМ, при падении рН ниже
натрия, pH 7,4, 100 мМ NaCl. Детекцию вели
7,00 добавляли 5 М NaOH.
при помощи УФ-детектора на 280 нм и MALS-
Очистка белка. ACE2-Fc выделяли из
детектора miniDAWN
(«Wyatt Technology»,
30-60 мл кондиционированной среды мето-
США). Расчёт молекулярной массы вели при
дом аффинной хроматографии на 1-мл ко-
помощи штатного программного обеспечения
лонке, содержащей сорбент MabSelect SuRe
детектора.
(«Cytiva»), подвижная фаза - 20 мМ Tris-HCl,
Измерение кинетических и равновесных кон-
pH 7,5,
150 мМ NaCl, скорость нанесения
стант взаимодействия проводили методом по-
0,5 мл/мин, объём промывки 20 мл после ста-
верхностного плазмонного резонанса (ППР) на
билизации базовой линии. Элюцию проводи-
биосенсоре iMSPR-Pro («Icluebio», Республика
ли раствором 50 мМ цитрата натрия, рН 3,2.
Корея). Поверхность сенсорного чипа NTA
Собранный элюат целевого белка немедлен-
(«Icluebio») насыщали раствором NiCl2 (0,5 мМ,
но нейтрализовали раствором Tris-основания
150 мкл, 30 мкл/мин), проводили иммобили-
до pH 7,0. Нейтрализованный элюат разбав-
зацию RBD Wuhan (дикий тип) или RBD beta
ляли 5 объёмами деионизованной воды и нано-
(B.1.351) (25 мкг/мл, 150 мкл, 10 мкл/мин в
сили на 1-мл анионообменную колонку HiTrap
обоих случаях), оба варианта RBD содержали
БИОХИМИЯ том 88 вып. 9 2023
ВЛИЯНИЕ FС-ФРАГМЕНТА IgG НА СВОЙСТВА РАСТВОРИМОГО ACE2
1549
на C-конце 10xHis-кластер и были получены,
при 37 °C. Лунки пять раз промывали PBST.
как описано ранее [7, 8]. Далее в проточную
Вносили раствор субстрата и инкубировали
ячейку биосенсора вводили ACE2-Fc в концен-
микропланшеты ровно 10 мин при комнатной
трации от 50 до 300 нМ (150 мкл, 30 мкл/мин)
температуре (+25 ± 2 °C). Реакцию останавли-
в растворе
25 мМ фосфата натрия, рН 7,4,
вали 100 мкл 5%-ной ортофосфорной кислоты
150 мМ NaCl. После каждого введения ACE2-Fc
и измеряли оптическую плотность при 450 нМ.
проводили регенерацию поверхности имидазо-
Расчёт IC50 проводили, как указано в работе
лом (0,4 М, 150 мкл, 30 мкл/мин). Измерения
Колесова и соавт. [7].
проводили относительно контрольной ячейки,
Статистический анализ проводили с исполь-
в которой на поверхности чипа не иммобили-
зованием t-критерия Стьюдента.
зовали RBD, а остальные реагенты вносили так
же, как в опытную ячейку. Сигнал биосенсора
измеряли в относительных единицах изме-
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
рения - RU. Аппроксимацию кинетических
зависимостей проводили с помощью програм-
Для получения рекомбинантного ACE2-Fc
мы TraceDrawer 1.9.1 («Ridgeview Instruments»,
нами была использована ОРС негликозилиро-
Швеция).
ванного Fc-фрагмента IgG1 человека с заме-
Иммуноферментный анализ, сВНТ. Для ко-
ной остатков Cys, образующих межцепочечные
личественного анализа содержания ACE2-Fc
S-S связи, на остатки Ser. Такой Fc-фрагмент
в культуральной жидкости проводили ИФА с
образует нековалентную димерную структуру и
иммобилизованными мкАт мыши к тяжёлой
пригоден для стандартной аффинной очистки
цепи IgG человека (XG36, «Хема», Россия). Для
при помощи протеин А-сефарозы (рис. 1, б).
всех вариантов ИФА и сВНТ после иммобили-
Векторную плазмиду pTF-ACE2s-Fc трансфи-
зации антигена планшеты трижды промывали
цировали в клетки линии CHO 4BGD, про-
PBS с 0,1%-ным Tween 20 (PBST) и блокирова-
водили первичную селекцию стабильно тран-
ли 3%-ным раствором БСА («Диа-М», Россия)
сфицированных клеток, а затем увеличивали
в PBS. Для детекции использовали конъюгат
их продуктивность при помощи двух шагов
антител к тяжёлой цепи IgG человека с HRP
геномной амплификации в присутствии 2 и
(T271X, «Хема») в разведении 1 : 20 000. В каче-
8 мкМ MTX. Только первый шаг амплифика-
стве калибратора использовали гуманизирован-
ции привёл к увеличению общей продуктив-
ное мкАт или очищенный ACE2-Fc с известной
ности клеток от 0,6 ± 0,1 до 24 ± 0,9 мг/л целе-
концентрацией. Исследуемые и контрольные
вого белка за 3 дня культивирования (рис. 1, в),
образцы анализировали в двух повторностях.
дальнейшее увеличение концентрации MTX
Детекцию проводили с помощью готового рас-
привело к небольшому падению концентра-
твора 3,3′,5,5′-тетраметилбензидина гидрохло-
ции целевого белка в среде, что может соответ-
рида («Биотест-системы», Россия), реакцию
ствовать достижению максимально возможной
останавливали через 10 мин 5%-ным раство-
удельной продуктивности клеток для данного
ром фосфорной кислоты. Детектировали ин-
белка. Полученная нами пиковая концентра-
тенсивность окраски при 450 нм.
ция ACE2-Fc (рис. 1, д) в среде - 154 мг/л -
Для оценки способности ACE2-Fc связы-
существенно превосходит опубликованные
вать RBD S-белка коронавируса SARS-CoV-2
ранее значения, не превышавшие 1 мг/л [10],
проводили ИФА, иммобилизуя в ячейках им-
и соответствует пиковой концентрации для
мунологического микропланшета полученный
поликлональной линии клеток-продуцентов
ACE2-Fc в количестве 200 нг/лунку в PBS. Для
ACE2, полученной нами ранее при помощи
детекции использовали конъюгат RBD-HRP [7].
аналогичной векторной плазмиды и двух ци-
Для определения уровня ВНА в лунках
клов геномной амплификации.
микропланшета иммобилизовали RBD SARS-
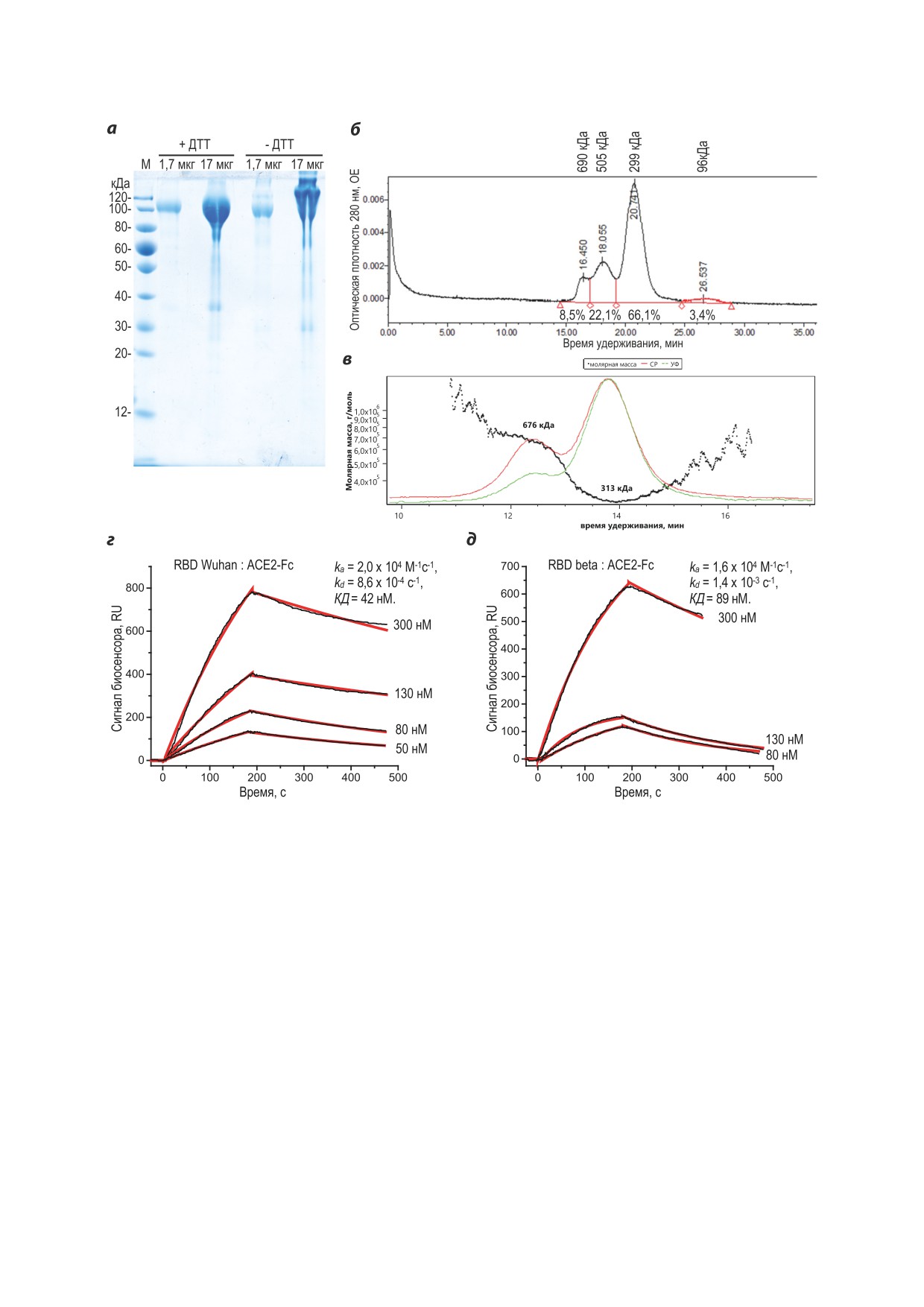
Выделенный и очищенный ACE2-Fc не
CoV-2 дикого типа или варианта бета по 20 нг
содержал ковалентных мультимеров по дан-
на лунку в растворе 50 мМ карбоната натрия,
ным ДСН-ПААГ и практически не содер-
pH 9,4. Анализируемые образцы сывороток
жал примесных белков (рис. 2, а). По данным
крови, полученных от доноров-реконвалесцен-
гель-фильтрации ACE2-Fc представляет собой
тов в 2020-2021 гг. [7], разводили в 1%-ном
смесь димерной и тетрамерной форм, при этом
БСА в PBS в диапазоне 1 : 20-1 : 160, вносили
обе формы элюируют быстрее ожидаемого
по 50 мкл в лунки микропланшета и инку-
времени (рис. 2, б). Кажущаяся молекулярная
бировали в течение 30 мин при 37 °C, а затем
масса основной димерной формы ACE2-Fc,
добавляли конъюгат ACE2-Fc-HRP в концен-
определённая при помощи MALS-детектора,
трации 312,5 нг/мл и инкубировали ещё 1 ч
также составила 313 кДа (рис. 2, в, теоретически
БИОХИМИЯ том 88 вып. 9 2023
1550
КОЛЕСОВ и др.
Рис. 2. Характеризация полученного белка ACE2-Fc методами ДСН-ПААГ (а), гель-фильтрации с УФ-детекцией (б)
и с детекцией MALS (в), определение константы диссоциации ACE2-Fc и RBD вариантов SARS-CoV-2 методом ППР
(г, д). Обозначения: М - маркер молекулярных масс, +ДТТ - внесение дитиотреитола до 10 мМ в образец для элек-
трофореза; -ДТТ - без добавления дитиотреитола; 1,7 мкг, 17 мкг - количество целевого белка, внесённого в лунки
геля, СР - светорассеяние, УФ - оптическая плотность на 280 нм, ka - константа скорости ассоциации, kd - константа
скорости диссоциации
рассчитанная молекулярная масса мономера
89 нМ, что также соответствует литературным
ACE2-Fc - 110 кДа), что может быть объяс-
данным.
нено сильным N-гликозилированием белка и
Реагент для проведения сВНТ был полу-
увеличением размера его глобулы.
чен путём стандартной конъюгации ACE2-Fc
Константа диссоциации (КД) ACE2-Fc и
с HRP периодатным методом. Полученный
RBD Wuhan, определённая методом поверх-
реагент ACE2-Fc-HRP так же, как и моно-
ностного плазмонного резонанса (ППР), со-
мерный ACE2-HRP, давал в ИФА линейную
ставила 42 нМ (рис. 2, г); для данного вари-
зависимость оптической плотности раствора
анта RBD и мономерного ACE2 КД составляла
субстрата реакции от концентрации ACE2-Fc-
33 нМ при измерении кинетики образования
HRP (рис. 3, а), вследствие этого расчёт сте-
и распада комплекса иммобилизованного мо-
пени ингибирования может выполняться без
номерного ACE2 и RBD, находящегося в рас-
построения полной S-образной кривой инги-
творе [7]. Константа диссоциации ACE2-Fc
бирования. Ингибирование образования ком-
и RBD вируса SARS-CoV-2 бета составила
плекса RBD : ACE2-Fc-HRP нейтрализующими
БИОХИМИЯ том 88 вып. 9 2023
ВЛИЯНИЕ FС-ФРАГМЕНТА IgG НА СВОЙСТВА РАСТВОРИМОГО ACE2
1551
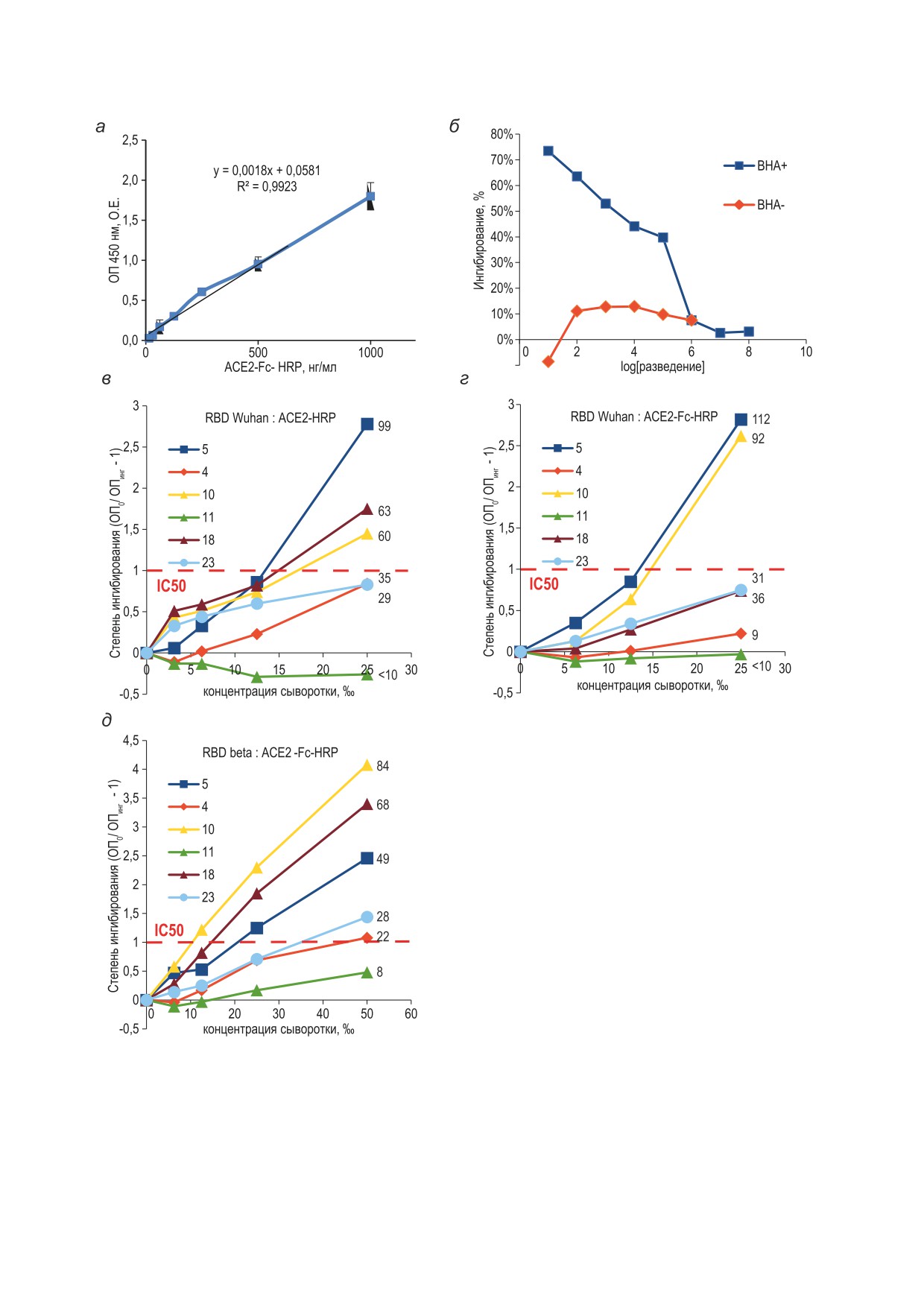
Рис. 3. Сравнительный анализ кривых ингибирования связывания ACE2-Fc-HRP и ACE2-HRP с RBD S-белка
SARS-CoV-2 дикого типа. Калибровочная кривая зависимости сигнала в ИФА от концентрации ACE2-Fc-HRP (а),
зависимость ингибирования связывания ACE2-Fc-HRP с RBD от разведения сывороток крови реконвалесцентов
с высоким (ВНА+) и низким (ВНА-) содержанием ВНА (б), кривые ингибирования для образцов сывороток крови
из контрольной панели NIBSC (в-д). В нижнем слое на панелях a-г использован RBD Wuhan, на панели д - RBD
beta. Панели a, б, г, д - ACE2-Fc-HRP, панель в - ACE2-HRP. Значения ID50, выраженные как разведения тестируе-
мых образцов, обеспечивающие 50%-ное ингибирование, приведены справа от соответствующих кривых ингиби-
рования для панелей в-д. Обозначения: ОП 450 нм - оптическая плотность образцов, ОП0 - оптическая плотность
контрольных образцов, ОПинг - оптическая плотность образцов с добавлением антител
БИОХИМИЯ том 88 вып. 9 2023
1552
КОЛЕСОВ и др.
антителами в высокой концентрации приво-
помощи реагентов ACE2-HRP и ACE2-Fc-HRP
дило к почти полному прекращению связыва-
не наблюдается существенного изменения IC50.
ния ACE2-Fc и RBD (рис. 3, б), а присутствие
Мы считаем, что причиной больших различий
антител к RBD, не имеющих вирус-нейтрали-
в определяемом уровне IC50 между различными
зующего действия, вызывало видимое инги-
коммерческими наборами для сВНТ в одних и
бирование связывания RBD-Fc-HRP и RBD
тех же образцах являются не различия в состоя-
не более чем на 15%.
нии реагента ACE2, а особенности связывания
Для набора контрольных образцов сыво-
с антителами конъюгатов RBD-HRP и разли-
роток крови из калибраторной панели NIBSC,
чающиеся протоколы прединкубации иссле-
исследованных нами ранее в сВНТ с мономер-
дуемых образцов с RBD-HRP.
ным ACE2-HRP, было установлено, что опре-
При проведении сВНТ с RBD в качестве
деляемые IC50 для димерного ACE2-Fc-HRP
иммобилизованного на поверхности микро-
близки к IC50 для мономерного ACE2-HRP
планшетов антигена кооперативное взаимодей-
(рис. 3, в, г). При замене RBD Wuhan на RBD
ствие молекул иммуноглобулинов или димер-
варианта вируса beta наблюдалось уменьшение
ных молекул ACE2-Fc одновременно с двумя
IС50 для 5 из 6 тестируемых образцов, анало-
молекулами RBD представляется крайне мало-
гичные данные были получены ранее для моно-
вероятным. Так, при нанесении 100 нг RBD на
мерного ACE2-HRP. Таким образом, димер-
одну лунку стандартного 96-луночного микро-
ный ACE2-Fc при обычном выполнении сВНТ
планшета среднее расстояние между центрами
в формате ИФА эквивалентен мономерному
соседних молекул RBD составит около 300 нм,
ACE2, может быть получен в больших коли-
что на два порядка превышает их молекуляр-
чествах при помощи стабильно трансфициро-
ный радиус. При использовании ACE2-Fc в ка-
ванных клеток CHO и пригоден для исполь-
честве иммобилизованного антигена остаётся
зования в рутинном тестировании динамики
возможным взаимодействие с ним двух моле-
титров ВНА в отношении циркулирующих ва-
кул RBD-HRP либо двух иммунокомплексов,
риантов вируса SARS-CoV-2.
содержащих цепочки из молекул иммуногло-
булинов и молекул RBD-HRP, и образование
таких мультимерных комплексов может давать
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
завышенные величины IC50, поэтому данный
формат постановки сВНТ в настоящей работе
Суррогатные методы определения уровней
не исследовался.
ВНА, не требующие использования вирусов и
Константа диссоциации мономеров ACE2
культивируемых клеток, могут широко исполь-
и RBD S-белка SARS-CoV-2 дикого типа
зоваться при наблюдениях за последствиями
составляет около 30 нМ, а для многих вирус-
вакцинации, определении текущего состояния
нейтрализующих мкАт, направленных против
коллективного иммунитета (herd immunity),
SARS-CoV-2 дикого типа, были получены зна-
оценки вирулентности новых вариантов виру-
чительно более низкие константы диссоциа-
сов, а также скрининга библиотек малых мо-
ции. Это ограничило интерес исследователей
лекул - ингибиторов комплексообразования
к созданию и исследованиям препаратов ACE2
S-белка с рецептором, либо быстрой оценки
в качестве противовирусных средств. Эволю-
вирус-нейтрализующей способности мкАт [11].
ция SARS-CoV-2 достаточно быстро привела к
Один из наиболее распространённых в мире
потере эффективности мкАт, получивших вре-
наборов для сВНТ, cPass, показывает корреля-
менную регистрацию в качестве лекарствен-
цию с данными ВНТ несколько хуже, чем пря-
ных средств. Ферментативно активный рас-
мой ИФА с S-фрагментом S-белка [12].
творимый ACE2 ранее проходил клинические
В целом, различные варианты реализации
испытания при респираторном дистресс-син-
сВНТ для SARS-CoV-2, описанные в литера-
дроме взрослых и продемонстрировал доста-
туре, дают сходные значения величины корре-
точную безопасность для пациентов, но недос-
ляции результатов сВНТ и «настоящего» ВНТ.
таточную эффективность [14]. При местном
Одновременно с этим при детальном сравне-
применении в качестве аэрозоля этот препарат
нии значений IC50, определённых для одних и
также был достаточно безопасен для здоро-
тех же образцов сыворотки при помощи разных
вых добровольцев, но его эффективность как
наборов для сВНТ, выявлялись сильные коли-
противовирусного средства была продемон-
чественные различия между наборами (см., на-
стрирована только на животной модели [15].
пример, рис. 2 в работе Pieri et al. [13]). В нашем
Аффинность ACE2 к S-белку SARS-CoV-2
случае при сравнении вычисляемых IC50 для
может быть увеличена до достижения КД око-
одних и тех же образцов сывороток с ВНА при
ло 10 нМ при внесении в ACE2 трёх мутаций:
БИОХИМИЯ том 88 вып. 9 2023
ВЛИЯНИЕ FС-ФРАГМЕНТА IgG НА СВОЙСТВА РАСТВОРИМОГО ACE2
1553
T27Y, L79T, N330Y [16], такая КД сохраняется
ЗАКЛЮЧЕНИЕ
и для ACE2-Fc, при этом IC50 в ВНТ составляет
также около 10 нМ [17]. Набор мутаций A25V,
Димерный слитный белок ACE2-Fc может
K31N, E35K, L79F в ACE2 позволил получить
быть получен в больших количествах в клетках
КД с RBD SARS-CoV-2 дикого типа менее
CHO при помощи векторной плазмиды на ос-
1 нМ [18], при ко-культивации вируса SARS-
нове нетранслируемых областей гена EEF1A1
CoV-2 с таким ACE2-Fc не наблюдали эволю-
китайского хомячка и выделен в чистом виде
ции вируса против нейтрализации слитным
как смесь димерной и тетрамерной форм. Ди-
белком в течение 15 пассажей. Тем не менее
мерный ACE2-Fc может быть конъюгирован с
такая настройка ACE2 на большую аффин-
HRP при помощи стандартного протокола и
ность к известным вариантам вируса SARS-
полностью эквивалентен мономерному ACE2
CoV-2 может привести как к ухудшению
в качестве реагента для сВНТ. Получение фер-
аффинности против новых вариантов этого
ментативно неактивных вариантов ACE2-Fc
вируса, так и к падению аффинности по срав-
как прототипов противовирусных лекарствен-
нению с природным ACE2 для новых вирусов,
ных средств может быть предметом дальней-
использующих его в качестве рецептора.
ших исследований.
Ферментативно неактивные варианты ACE2
сохраняют способность связываться с S-белком
Вклад авторов. И.И. Воробьев - концеп-
сарбековирусов. На примере S-белка SARS-
ция и руководство работой; Е.А. Гаямова,
CoV было показано, что ACE2-Fc с мутациями
Д.Э. Колесов, Н.А. Орлова - проведение экс-
H374N и H378N ингибирует псевдотипирован-
периментов; все авторы - обсуждение результа-
ный вирус в ВНТ с IC50 около 2 нМ [19]. Неже-
тов исследования; И.И. Воробьев и Н.А. Орло-
лательная ферментативная активность ACE2
ва - написание текста; Н.А. Орлова - редак-
может быть устранена как точечными мутация-
тирование текста статьи.
ми, так и необратимыми ингибиторами [20],
Финансирование. Работа выполнена при
что также может быть использовано для полу-
частичной финансовой поддержке Россий-
чения лекарственных препаратов ACE2-Fc.
ского фонда фундаментальных исследований
Более совершенные варианты ACE2-Fc, иссле-
(грант № 18-04-00091).
дованные к настоящему моменту, содержат
Благодарности. Авторы выражают благо-
как точечные мутации, блокирующие карбок-
дарность Н.Н. Случанко (Институт биохимии
сипептидазную активность ACE2, так и уко-
им. Баха, ФИЦ Биотехнологии РАН) за про-
роченные формы внеклеточной части ACE2,
ведение определения молекулярной массы
варианты искусственной шарнирной области
ACE2-Fc при помощи MALS-детекции, Са-
IgG и несколько вариантов Fc-фрагмента, обес-
фенковой И.В. (ibid.) за проведение определе-
печивающих разный спектр его эффекторных
ния константы диссоциации ACE2-Fc и RBD
функций [21].
методом ППР, Кострикиной Е.С. (ООО «Хе-
Описанная в настоящей работе система
ма-Медика») за получение конъюгата ACE2-
экспрессии гена ACE2-Fc обладает достаточ-
Fc-HRP.
ной удельной продуктивностью для получения
Конфликт интересов. Авторы заявляют об
прототипа лекарственного средства, которое
отсутствии конфликта интересов.
может потребоваться при возникновении но-
Соблюдение этических норм. Настоящая
вых вариантов SARS-CoV-2 с высокой пато-
статья не содержит описания каких-либо ис-
генностью или новых видов коронавирусов,
следований с участием людей или животных в
использующих рецептор ACE2.
качестве объектов.
СПИСОК ЛИТЕРАТУРЫ
1. Lambert, D. W., Yarski, M., Warner, F. J., Thornhill, P.,
2. Smith, M. K., Tusell, S., Travanty, E. A., Berkhout, B.,
Parkin, E. T., Smith, A. I., Hooper, N. M., and
van der Hoek, L., and Holmes, K. V. (2006) Human
Turner, A. J.
(2005) Tumor necrosis factor-alpha
angiotensin-converting enzyme 2 (ACE2) is a receptor
convertase (ADAM17) mediates regulated ectodomain
for human respiratory coronavirus NL63, Adv. Exp.
shedding of the severe-acute respiratory syndrome-
Med. Biol., 581, 285-288, doi: 10.1007/978-0-387-
coronavirus (SARS-CoV) receptor, angiotensin-
33012-9_48.
converting enzyme-2 (ACE2), J. Biol. Chem., 280,
3. Bohn, M. K., Lippi, G., Horvath, A., Sethi, S., Koch, D.,
30113-30119, doi: 10.1074/jbc.M505111200.
Ferrari, M., Wang, C. B., Mancini, N., Steele, S.,
8
БИОХИМИЯ том 88 вып. 9 2023
1554
КОЛЕСОВ и др.
and Adeli, K. (2020) Molecular, serological, and
CoV-2 spike protein variant binding affinity to an
biochemical diagnosis and monitoring of COVID-19:
angiotensin-converting enzyme 2 fusion glycopro-
IFCC taskforce evaluation of the latest evidence,
teins, PLoS One, 17, e0278294, doi: 10.1371/journal.
Clin. Chem. Lab. Med., 58, 1037-1052, doi: 10.1515/
pone.0278294.
cclm-2020-0722.
11.
Zhang, S., Gao, C., Das, T., Luo, S., Tang, H.,
4.
Bewley, K. R., Coombes, N. S., Gagnon, L.,
Yao, X., Cho, C. Y., Lv, J., Maravillas, K., Jones, V.,
McInroy, L., Baker, N., Shaik, I., St-Jean, J. R.,
Chen, X., and Huang, R. (2022) The spike-ACE2
St-Amant, N., Buttigieg, K. R., Humphries, H. E.,
binding assay: An in vitro platform for evaluating
Godwin, K. J., Brunt, E., Allen, L., Leung, S., Brown,
vaccination efficacy and for screening SARS-CoV-2
P. J., Penn, E. J., Thomas, K., Kulnis, G., Hallis, B.,
inhibitors and neutralizing antibodies, J. Immunol.
Carroll, M., et al. (2021) Quantification of SARS-
Methods, 503, 113244, doi: 10.1016/j.jim.2022.113244.
CoV-2 neutralizing antibody by wild-type plaque
12.
Ru, Z., Xhang, Y., Wu, J., Huang, H., Liang, Y.,
reduction neutralization, microneutralization and
Yang, X., Wu, J., and Lou, J. (2021) Comparison of
pseudotyped virus neutralization assays, Nat. Protoc.,
the SARS-CoV-2 surrogate virus neutralization test
16, 3114-3140, doi: 10.1038/s41596-021-00536-y.
(sVNT) assay and direct binding ELISA (S-IgG)
5.
Vandergaast, R., Carey, T., Reiter, S., Lathrum, C.,
with the cytopathic effect assay (CPE) in analyzing
Lech, P., Gnanadurai, C., Haselton, M., Buehler, J.,
the neutralization antibody of vaccination people,
Narjari, R., Schnebeck, L., Roesler, A., Sevola, K.,
J. Clin. Immunol. Immunother., 7, 063, doi: 10.24966/
Suksanpaisan, L., Bexon, A., Naik, S., Brunton, B.,
CIIT-8844/1000063.
Weaver, S. C., Rafael, G., Tran, S., Baum, A., et al.
13.
Pieri, M., Infantino, M., Manfredi, M., Nuccetelli, M.,
(2021) IMMUNO-COV v2.0: Development and
Grossi, V., Lari, B., Tomassetti, F., Sarubbi, S.,
validation of a high-throughput clinical assay for
Russo, E., Amedei, A., Benucci, M., Casprini, P.,
measuring SARS-CoV-2-neutralizing antibody titers,
Stacchini, L., Castilletti, C., and Bernardini, S.
mSphere, 6, e0017021, doi: 10.1128/mSphere.00170-21.
(2022) Performance evaluation of four surrogate Virus
6.
Tan, C. W., Chia, W. N., Qin, X., Liu, P., Chen, M. I.,
Neutralization Tests (sVNTs) in comparison to the in
Tiu, C., Hu, Z., Chen, V. C., Young, B. E., Sia, W. R.,
vivo gold standard test, Front. Biosci. (Landmark Ed),
Tan, Y. J., Foo, R., Yi, Y., Lye, D. C., Anderson,
27, 74, doi: 10.31083/j.fbl2702074.
D. E., and Wang, L. F. (2020) A SARS-CoV-2 surro-
14.
Khan, A., Benthin, C., Zeno, B., Albertson, T. E.,
gate virus neutralization test based on antibody-me-
Boyd, J., Christie, J. D., Hall, R., Poirier, G., Ronco,
diated blockage of ACE2-spike protein-protein inter-
J. J., Tidswell, M., Hardes, K., Powley, W. M., Wright,
action, Nat. Biotechnol., 38, 1073-1078, doi: 10.1038/
T. J., Siederer, S. K., Fairman, D. A., Lipson, D. A.,
s41587-020-0631-z.
Bayliffe, A. I., and Lazaar, A. L. (2017) A pilot clinical
7.
Kolesov, D. E., Sinegubova, M. V., Dayanova, L. K.,
trial of recombinant human angiotensin-converting
Dolzhikova, I. V., Vorobiev, I. I., and Orlova, N. A.
enzyme 2 in acute respiratory distress syndrome, Crit.
(2022) Fast and accurate surrogate virus neutralization
Care, 21, 234, doi: 10.1186/s13054-017-1823-x.
test based on antibody-mediated blocking of the
15.
Shoemaker, R. H., Panettieri, R. A., Jr., Libutti,
interaction of ACE2 and SARS-CoV-2 spike protein
S. K., Hochster, H. S., Watts, N. R., Wingfield, P.
RBD, Diagnostics (Basel), 12, 393, doi: 10.3390/
T., Starkl, P., Pimenov, L., Gawish, R., Hladik, A.,
diagnostics12020393.
Knapp, S., Boring, D., White, J. M., Lawrence, Q.,
8.
Рязанова А. Ю., Ходак Ю. А., Орлова Н. А., Сине-
Boone, J., Marshall, J. D., Matthews, R. L., Chole-
губова М. В., Даянова Л. К., Ковнир С. В., Коро-
wa, B. D., Richig, J. W., Chen, B. T., et al. (2022) De-
бова С. В., Лёдов В. А., Ковальчук А. Л., Алхазова
velopment of an aerosol intervention for COVID-19
Б. И., Головина М. Э., Воробьёв И. И., Апарин
disease: Tolerability of soluble ACE2 (APN01) ad-
П. Г. (2022) Рецепторсвязывающий домен S-бел-
ministered via nebulizer, PLoS One, 17, e0271066,
ка SARS-CoV-2, слитый с негликозилированным
doi: 10.1371/journal.pone.0271066.
кристаллизующимся фрагментом IgG1 человека:
16.
Chan, K. K., Dorosky, D., Sharma, P., Abbasi,
получение и оценка иммуногенности, Биотехно-
S. A., Dye, J. M., Kranz, D. M., Herbert, A. S., and
логия, 38, 12-19, doi: 10.56304/S0234275822060102.
Procko, E. (2020) Engineering human ACE2 to opti-
9.
Orlova, N. A., Dayanova, L. K., Gayamova, E. A.,
mize binding to the spike protein of SARS coronavi-
Sinegubova, M. V., Kovnir, S. V., and Vorobiev, I. I.
rus 2, Science, 369, 1261-1265, doi: 10.1126/science.
(2022) Targeted knockout of the dhfr, glul, bak1, and
abc0870.
bax genes by the multiplex genome editing in CHO
17.
Wines, B. D., Kurtovic, L., Trist, H. M., Esparon, S.,
cells, Dokl Biochem Biophys, 502, 40-44, doi: 10.1134/
Lopez, E., Chappin, K., Chan, L. J., Mordant,
S1607672922010082.
F. L., Lee, W. S., Gherardin, N. A., Patel, S. K.,
10.
Matthews, A. M., Biel, T. G., Ortega-Rodriguez, U.,
Hartley, G. E., Pymm, P., Cooney, J. P., Beeson,
Falkowski, V. M., Bush, X., Faison, T., Xie, H.,
J. G., Godfrey, D. I., Burrell, L. M., van Zelm,
Agarabi, C., Rao, V. A., and Ju, T. (2022) SARS-
M. C., Wheatley, A. K., Chung, A. W., et al. (2022)
БИОХИМИЯ том 88 вып. 9 2023
ВЛИЯНИЕ FС-ФРАГМЕНТА IgG НА СВОЙСТВА РАСТВОРИМОГО ACE2
1555
Fc engineered ACE2-Fc is a potent multifunctional
spiratory syndrome coronavirus spike protein effi-
agent targeting SARS-CoV2, Front. Immunol., 13,
ciently infect cells expressing angiotensin-converting
889372, doi: 10.3389/fimmu.2022.889372.
enzyme 2, J. Virol., 78, 10628-10635, doi: 10.1128/
18. Higuchi, Y., Suzuki, T., Arimori, T., Ikemura, N.,
JVI.78.19.10628-10635.2004.
Mihara, E., Kirita, Y., Ohgitani, E., Mazda, O.,
20. Svilenov, H. L., Delhommel, F., Siebenmorgen, T.,
Motooka, D., Nakamura, S., Sakai, Y., Itoh, Y.,
Ruhrnossl, F., Popowicz, G. M., Reiter, A.,
Sugihara, F., Matsuura, Y., Matoba, S., Okamoto, T.,
Sattler, M., Brockmeyer, C., and Buchner, J. (2023)
Takagi, J., and Hoshino, A. (2021) Engineered ACE2
Extrinsic stabilization of antiviral ACE2-Fc fusion
receptor therapy overcomes mutational escape of
proteins targeting SARS-CoV-2, Commun. Biol., 6,
SARS-CoV-2, Nat. Commun., 12, 3802, doi: 10.1038/
386, doi: 10.1038/s42003-023-04762-w.
s41467-021-24013-y.
21. Hernández, T., Bermúdez, E., Fundora, T., and
19. Moore, M. J., Dorfman, T., Li, W., Wong, S. K.,
Sánchez, B. (2022) COVID-19 therapy based on
Li, Y., Kuhn, J. H., Coderre, J., Vasilieva, N., Han, Z.,
soluble ACE2: the use of receptor-Fc fusion proteins,
Greenough, T. C., Farzan, M., and Choe, H. (2004)
Open Acc. J. Bio Sci., 4, 1970-1975, doi: 10.38125/
Retroviruses pseudotyped with the severe acute re-
OAJBS.000472.
DIMERIC ACE2-FC IS EQUIVALENT TO MONOMERIC ACE2
IN THE SURROGATE VIRUS NEUTRALIZATION TEST
D. E. Kolesov, E. A. Gaiamova, N. A. Orlova, and I. I. Vorobiev*
Federal Research Center “Fundamentals of Biotechnology”, Russian Academy of Sciences,
119071 Moscow, Russia; e-mail: ptichman@gmail.com
Angiotensin converting enzyme 2 (ACE2) is the main cellular receptor for the dangerous sarbecoviruses
SARS-CoV and SARS-CoV-2. Its recombinant extracellular domain is used to monitor the level of the
protective humoral immune response to a viral infection or vaccine using a surrogate virus neutralization
test (sVNT). Soluble ACE2 is also being considered as an antiviral therapy option potentially insensitive
to changes in the SARS-CoV-2 spike protein. For widespread sVHT testing, it is necessary to use ACE2
preparations or ACE2 conjugates with constant properties. Previously, we obtained a cell line that produces
soluble monomeric ACE2 and showed that this variant of ACE2 can be used in sBHT, preferably in the form
of a conjugate with horseradish peroxidase. To obtain a stable and universally applicable form of soluble
ACE2, a cell line was obtained that produced the ACE2-Fc fusion protein with high productivity, more than
150 mg/l of the target protein during cultivation in a stirred flask. Affinity-purified ACE2-Fc is a mixture of
dimeric and tetrameric forms, but allows one to obtain linearizable antibody inhibition curves for complex-
ation with the receptor-binding domain of the SARS-CoV-2 spike protein. The ACE2-Fc-HRP based sVHT
testing system can be used to practically measure the levels of virus-neutralizing antibodies against various
circulating variants of the SARS-CoV-2 virus.
Keywords: angiotensin-converting enzyme 2, SARS-CoV-2, sVHT, virus neutralization, protective immunity
БИОХИМИЯ том 88 вып. 9 2023
8*