Представление о гликокаликсе как о неотъемлемой части плазматической мембраны, окружающей клетки, было сформировано еще в середине прошлого века (Bennett, 1963; Ito, 1974). Наиболее хорошо гликокаликс развит у клеток, интенсивно обменивающихся материалами с окружающей средой: у энтероцитов (Ito, 1965) и эндотелиоцитов (Luft, 1966); при этом степень его развития и морфология могут существенно варьировать (Ito, 1974; Pries et al., 2000). Морфологическое разнообразие гликокаликса, очевидно, связано с комплексом выполняемых им или приписываемых ему функций, как общих, так и специфических. В числе общих функций обычно отмечают обеспечение механической прочности плазматической мембраны, “узнавание” и транспорт определенных молекул (функция “молекулярного сита”), межклеточные взаимодействия, барьерную функцию и др. (Уголев, 1985). К специфическим функциям, например, свойственным только гликокаликсу эндотелиоцитов, относят его способность оказывать влияние на гемодинамику, свертываемость крови и взаимоотношения иммунных клеток с эндотелием, а также участвовать в регенерации и в воспалительном ответе (Максименко, Турашев, 2011а, 2011б; Pries et al., 2000; Weinbaum et al., 2007). Важное функциональное значение имеет отрицательный заряд слоя гликокаликса, препятствующий прикреплению клеток крови и молекул плазмы к эндотелию (Weinbaum et al., 2007; Wang, Widlansky, 2012). Роль гликокаликса в нормальном функционировании, например, клеток эндотелия, подчеркивается его обратимым и неспецифическим истончением в случаях ряда заболеваний (Hahn et al., 2021). Большинство этих функций, как общих, так и специфических, связаны с рецепторной способностью гликокаликса или основаны на ней.
Эндопаразитические черви, существуя в организме хозяина, вступают с ним в сложные, обычно антагонистические, взаимоотношения. Гликокаликс, покрывающий кожный эпителий гельминтов, играет важнейшую роль в комплексе этих отношений, не только участвуя в обмене материалами между паразитом и хозяином, но и принимая негативный ответ последнего и тем или иным образом уменьшая эффективность этого ответа (Lumsden, 1975; Никишин, 2016, 2018). О значении гликокаликса в жизнедеятельности гельминтов свидетельствует морфологическое разнообразие его форм, последовательно меняющихся на протяжении жизненного цикла паразита. Наибольшего развития гликокаликс достигает у личиночных форм гельминтов, например, у мирацидиев и церкариев трематод (Ждярска, Соболева, 1986; Галактионов, Добровольский, 1987; Chiang, Caulfield, 1988), а также у метацестод и у тканевых форм некоторых цестод (Никишин, 2016). При этом при переходе паразита к следующему в их жизненном цикле хозяину поверхность тегумента церкарий, включая гликокаликс, может видоизменяться вплоть до полной ее смены, что наблюдается, например, у шистосоматид (Hockley, McLaren, 1973; Horak et al., 1998; Řimnáčová et al., 2017).
У многих акантоцефалов, в жизненный цикл которых включается паратенический хозяин, в течение их жизни образуется шесть форм гликокаликса, причем его наиболее развитый слой, достигающий толщины 1–2 мкм и более, обнаружен на этапах тканевого паразитизма, т.е. у цистакантов в промежуточных хозяевах, а в некоторых случаях у молодых особей в паратенических хозяевах (Никишин, 2018). Как известно, в паратенических хозяевах акантоцефалы подвергаются защитной реакции организма хозяина, в том числе инкапсуляции. При этом в зависимости от вида хозяина в составе капсулы, окружающей, например, скребня Corynosoma strumosum (Rudolphi, 1802), могут преобладать или лейкоциты (лейкоцитарная капсула), или фибробласты и их производные (фибробластическая капсула) (Скоробрехова, Никишин, 2013; Никишин, Скоробрехова, 2020; Skorobrekhova, Nikishin, 2011), но в обоих случаях на поверхности паразита формируется толстый слой гликокаликса. Однако в некоторых видах паратенических хозяев скребни, хотя и окружены лейкоцитарными капсулами, но толстый слой гликокаликса на их поверхности не образуется. Эти сведения в совокупности с некоторыми другими фактами позволили сформулировать гипотезу о двух стратегиях взаимоотношений акантоцефалов с паратеническими хозяевами (Никишин, Скоробрехова, 2018).
Изучая морфологию акантоцефала C. strumosum, инвазирующего паратенических хозяев разных видов в естественных и экспериментальных условиях, мы обнаружили явление сбрасывания гликокаликса у коринозом, инвазировавших как тихоокеанского белокорого палтуса Hippoglossus stenolepis Schmidt, 1904 (Pleuronectidae) естественным путем, так и толстощека Миддендорфа Hadropareia middendorffii Schmidt, 1904 (Zoarcidae) в условиях эксперимента. Ниже приведено описание данных случаев.
МАТЕРИАЛ И МЕТОДИКА
Исследованы две группы акантоцефалов. Акантоцефалы первой группы были извлечены из толстощеков, инвазированных естественным путем или экспериментально. Два эксперимента с 23 толстощеками были проведены в лабораторных условиях в сентябре–ноябре 2012 г. Подопытные рыбы были отловлены в окрестностях г. Магадан на участке, контрольные обловы которого показали отсутствие естественной инвазии. Для заражения использовали около 100 коринозом из бельдюг и толстощеков, инвазированных естественным путем. Вскрытие производили через 3, 14, 30 и 50 сут со дня заражения. В результате инвазированными оказались 16 толстощеков, причем наибольшее количество скребней локализовалось на брыжейке кишечника, тогда как на брюшной стенке, печени и гонадах были обнаружены единичные паразиты. Электронно-микроскопически были изучены два скребня через 3 сут после инвазии, один скребень через 14 сут и по два скребня через 30 и 50 сут после заражения (подробное описание экспериментов опубликовано ранее (Скоробрехова, Никишин, 2021б).
Акантоцефалы второй группы были извлечены из палтуса, инвазированного естественным образом. Гельминтов фиксировали в 2% глутаровом альдегиде на 0.1 М фосфатном буфере, постфиксировали в 1% тетраоксиде осмия на 0.2 М фосфатном буфере, обезвоживали в спиртах возрастающей концентрации и заключали в смесь эпона и аралдита. Полутонкие срезы, полученные на ультрамикротоме LKB IV, окрашивали смесью кристаллического фиолетового и метиленового синего и изучали в световом микроскопе Olympus CX 41. Ультратонкие срезы получали на ультрамикротоме PT-PC, контрастировали 1% раствором уранилацетата в 70% спирте и изучали в электронном микроскопе JEM 1400 PLUS. Всего было изучено 35 коринозом из толстощеков и 12 коринозом из палтуса, инвазированных естественным образом, а также 58 коринозом из толстощеков, инвазированных в эксперименте.
РЕЗУЛЬТАТЫ
В толстощеках, инвазированных естественным путем, коринозомы были окружены трехслойными лейкоцитарными капсулами из клеток хозяина. Внутренний слой капсул состоял из дегенерирующих клеток, в среднем и наружном слоях преобладали макрофаги и лейкоциты при небольшом количестве фибробластов (рис. 1а). В среднем слое клеточные элементы располагались плотно, а в наружном – рыхло. Более полное описание капсулы, окружавшей коринозом в толстощеке, инвазированном естественным образом, опубликовано ранее (Скоробрехова, Никишин, 2021а).
Рис. 1.
Скребень Corynosoma strumosum из толстощека Миддендорфа Hadropareia middendorffii, зараженного естественным образом: а – капсула, окружающая скребня, и поверхность его тегумента при небольшом увеличении; б – слой гликокаликса на поверхности тегумента скребня при большем увеличении. Обозначения: gl – гликокаликс, icl – внутренний слой капсулы, mcl – средний слой капсулы, teg – тегумент скребня (а, б – электронная микроскопия). Масштаб: 2 мкм.

Поверхность всех исследованных акантоцефалов, инвазировавших толстощеков, была покрыта толстым (0.6–2.4 мкм) слоем гликокаликса, образованным плотно расположенными филаментами и мелкими гранулами умеренной электронной плотности (рис. 1а, 1б). Узкий внутренний слой гликокаликса с волнистой поверхностью характеризовался повышенной электронной плотностью. С поверхностью гликокаликса контактировали дегенерирующие клетки внутреннего слоя капсулы.
На 3-и сут после экспериментального заражения толстощеков все коринозомы были окружены прерывистым или почти сплошным слоем макрофагов и лейкоцитов хозяина (рис. 2а). На поверхности скребней располагался слой гликокаликса толщиной 1.5–2.1 мкм. В некоторых участках гликокаликс был отделен от поверхности тегумента, но сохранял непрерывность (рис. 2б, 2в). В этих случаях в пространстве между слоем гликокаликса и поверхностью тегумента иногда наблюдались фрагменты дегенерирующих клеток хозяина.
Рис. 2.
Скребень Corynosoma strumosum из экспериментально зараженного толстощека Миддендорфа Hadropareia middendorffii на 3-и сут эксперимента: а – формирующаяся капсула, состоящая из лейкоцитов (стрелки); б – слой гликокаликса, отделившийся от тегумента скребня; в – отделение слоя гликокаликса от тегумента скребня; г – трубчатые образования (двойные стрелки) и везикулы (одинарные стрелки) в толще слоя гликокаликса. Обозначения: gl – гликокаликс, teg – тегумент скребня (а, б – световая микроскопия, в, г – электронная микроскопия). Масштаб: а, б – 20, в – 1, г – 0.5 мкм.

Наружная поверхность гликокаликса была неровной (рис. 2в), в него часто внедрялись псевдоподии макрофагов хозяина, которые, однако, не достигали тегумента паразита. В толще слоя гликокаликса часто наблюдались скопления мелких везикул и трубчатых образований диаметром 18–26 нм, внешне и по размерам напоминающих микротрубочки (рис. 2г). На 14-е сут и позже, а также у коринозом, инвазировавших толстощеков естественным образом, отделение слоя гликокаликса от тегумента не наблюдалось.
Детальное описание тегумента и окружающей капсулы коринозом, извлеченных из палтуса, опубликовано ранее (Скоробрехова, Никишин, 2017). Обнаружены две модификации коринозом, по-разному воспринимавшие гистологические красители. Менее интенсивно окрашивающиеся скребни были окружены однослойными капсулами, образованными преимущественно крупными плотно расположенными макрофагами с включением небольшого числа нейтрофилов и плазмоцитов, а также фибробластов в наружной части капсул. Толщина этих капсул составляла 80–265 мкм (рис. 3а). Более интенсивно окрашивающиеся коринозомы были заключены в относительно менее толстую (33–101 мкм) двухслойную капсулу, внутренний слой которой был образован преимущественно макрофагами, а наружный – преимущественно фибробластами. Поверхность тегумента этих скребней, в отличие от тегумента коринозом из толстощека, была покрыта тонким (не более 0.1 мкм) слоем гликокаликса, поэтому при наблюдении на небольшом увеличении создавалось впечатление, что клетки капсулы вплотную прилегают к наружной мембране тегумента (рис. 3б).
Рис. 3.
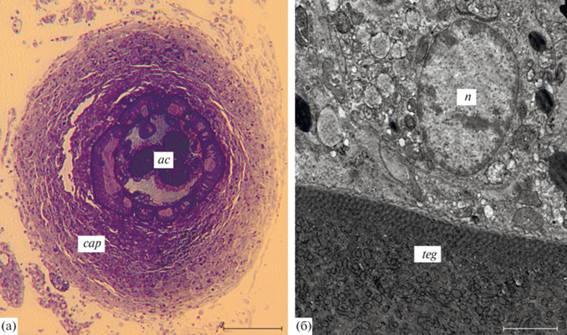
Скребень Corynosoma strumosum из тихоокеанского белокорого палтуса Hippoglossus stenolepis, зараженного естественным образом: а – скребень, окруженный однослойной капсулой, состоящей из многочисленных макрофагов и небольшого количества фибробластов; б – макрофаг внутреннего слоя капсулы, вплотную прилежащий к тегументу скребня (толстый слой гликокаликса на поверхности тегумента отсутствует). Обозначения: ac – скребень, cap – капсула, n – ядро макрофага, teg – тегумент скребня (а – световая микроскопия, б – электронная микроскопия). Масштаб: а – 100, б – 2 мкм.
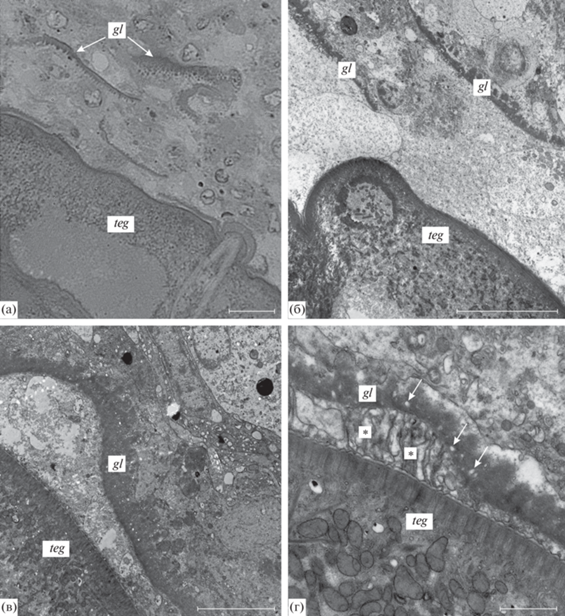
Во внутренней части капсул, окружавших двух коринозом в палтусе, обнаружен слой гомогенного плотного материала толщиной 0.7–2.5 мкм (рис. 4а, 4б, 4в) с включением светлых везикул диаметром 0.04–0.2 мкм (рис. 4г). В основании слоя отмечены мембранные профили разной формы, напоминавшие фрагменты наружной мембраны тегумента (рис. 4г). В некоторых участках этот слой соприкасался с поверхностью тегумента (рис. 4б), в других участках он был прерывистым, не был связан с тегументом, а его отдельные фрагменты были обнаружены в толще капсулы (рис. 4а, 4б), однако на большем своем протяжении он сохранял непрерывность и был ориентирован параллельно поверхности тегумента (рис. 4в). В участках, где слой находился вблизи тегумента, между ними наблюдались мембранные профили, сходные с отмеченными в основании слоя. Иногда мембранные профили продолжались в наружную мембрану тегумента; в этих случаях между этой мембраной и остальной частью тегумента наблюдалось светлое пространство, а на поверхности тегумента выявлялась ненарушенная мембрана, предположительно сформированная заново (рис. 4г). Гомогенный характер материала, образующего слой, его тесная связь с тегументом во многих участках и расположение вокруг паразита позволяют рассматривать этот слой как модифицированный гликокаликс, отделенный от тегумента вместе с наружной мембраной.
Рис. 4.
Скребень Corynosoma strumosum из тихоокеанского белокорого палтуса Hippoglossus stenolepis, зараженного естественным образом: а, б – фрагменты слоя плотного материала, напоминающего гликокаликс в толще капсулы; в – отделение слоя плотного материала, напоминающего гликокаликс, от тегумента скребня; г – мембранные профили (*) между тегументом скребня и слоем плотного материала, напоминающего гликокаликс; стрелками показаны светлые везикулы в толще плотного материала. Обозначения: gl – гликокаликс, teg – тегумент скребня (а – световая микроскопия, б, в, г – электронная микроскопия). Масштаб: а, б – 10, в – 5, г – 1 мкм.
ОБСУЖДЕНИЕ
Прежде, чем интерпретировать описанные феномены, напомним, что в промежуточных хозяевах эмбриональные личинки акантоцефалов (аканторы) развиваются в цистакантов, которые у многих видов окружаются неклеточной цистой и покрываются толстым слоем гликокаликса (Никишин, 2018). При попадании в организм паратенического хозяина гликокаликс цистакантов, вероятно, должен быть разрушен ферментами желудочно-кишечного тракта. Это предположение основано на результатах гистохимических исследований, свидетельствующих о том, что основу гликокаликса составляют кислые и нейтральные мукополисахариды (Lumsden, 1975). Таким образом, гликокаликс, покрывающий скребней в паратеническом хозяине, по всей вероятности, является новообразованием (Никишин, 2018).
Необходимо отметить, что цистаканты Corynosoma strumosum, извлеченные из гаммаруса Spinulogammarus ochotensis (Brandt, 1851), хотя и были заключены в неклеточную цисту, но не покрывались развитым слоем гликокаликса (Skorobrekhova, Nikishin, 2019). Возможно, рачки этого вида не являются специфичными промежуточными хозяевами C. strumosum, поэтому гликокаликс на поверхности цистакантов не формируется. В пользу данной версии свидетельствует тот факт, что все обнаруженные цистаканты были в разной степени инкапсулированы клетками хозяина и находились в угнетенном состоянии или были погибшими (Skorobrekhova, Nikishin, 2019). Это, однако, не противоречит выводу о новообразовании гликокаликса на поверхности коринозом в паратенических хозяевах определенных видов, включая толстощека, а, напротив, свидетельствует в его пользу. Другие описания цистакантов данного вида в литературе отсутствуют.
Отношения коринозомы и толстощека соответствуют первой стратегии взаимоотношений скребней с паратеническими хозяевами, которая подразумевает обязательное образование на поверхности паразита толстого слоя гликокаликса, а также разрушение и меланизацию внутреннего слоя капсулы (лейкоцитарной или фибробластической) (Никишин, Скоробрехова, 2018).
Отделение слоя гликокаликса от тегумента коринозом, инвазирующих толстощека, наблюдалось только в экспериментальных условиях на 3 сут эксперимента, т.е. на начальном этапе инвазии. На 14 сут и последующие дни эксперимента, а также при естественной инвазии толстощека коринозомами, слой гликокаликса имел обычный вид и на всем протяжении был связан с тегументом червей. Подчеркнем, что во всех случаях, включая ранние сроки эксперимента, коринозомы были инкапсулированы лейкоцитарными капсулами, внутренний слой которых, прилегающий к поверхности гликокаликса, состоял из дегенерирующих клеток, подвергающихся меланизации. Эти данные в совокупности с вероятной защитной ролью гликокаликса позволяют предположить, что смена гликокаликса у коринозом в толстощеке обусловлена накоплением в нем факторов, возникших при взаимодействии клеток хозяина с только что внедрившимся паразитом.
Отношения коринозомы с палтусом, как и с другими камбаловыми рыбами, относятся ко второй стратегии взаимоотношений скребней с паратеническими хозяевами, при которой толстый слой гликокаликса на поверхности тегумента паразита не формируется и не происходят дегенерация и меланизация клеток внутренней части капсулы (Никишин, Скоробрехова, 2018). В наших исследованиях этой схеме соответствовали взаимоотношения большинства коринозом с палтусом. Описанный феномен был обнаружен только у двух паразитов. Можно предположить, что у скребней, попавших в палтуса, на первом этапе инвазии гликокаликс все-таки формируется, однако по мере инкапсуляции паразита и накопления в нем антигенов он сбрасывается вместе с наружной мембраной тегумента, разрушается и в дальнейшем замещается “обычным” тонким слоем. Различия между двумя модификациями коринозом из палтуса по толщине окружающей их капсулы и способности к окрашиванию, возможно, также связаны с разным по длительности периодом паразитирования, но для более точной интерпретации этого факта необходимы дальнейшие исследования.
Обнаруженный феномен утраты гликокаликса одновременно с наружной мембраной тегумента паразитического червя не уникален. Подобное явление отмечено у церкарий шистосоматид в процессе инвазии ими теплокровного позвоночного (окончательного хозяина) и трансформации их в шистосомулы (Horak et al., 1998; Řimnáčová et al., 2017). У церкарии Trichobilharzia szidati сбрасываемые элементы (наружная мембрана тегумента и толстый слой гликокаликса) заменяются мембраной с тонким слоем гликокаликса, формируемыми de novo; эти факты расцениваются как стратегия уклонения от иммунного ответа хозяина (Horak et al., 1998). Отметим, что сбрасывание гликокаликса может быть инициировано и в экспериментальных условиях в культуре (Samuelson, Caulfild, 1982; Lammas, Duffus, 1983). Принимая во внимание, что и церкарии шистосом, проникающие в хозяина, и шистосомулы, паразитирующие в нем, и коринозомы, паразитирующие в паратенических хозяевах, являются тканевыми паразитами, мы рассматриваем феномен обновления поверхностной части тегумента коринозом как одну из защитных стратегий. По аналогии с трематодами эта стратегия реализуется на начальном этапе тканевого паразитизма и включает обновление слоя иммуноаттрактивного гликокаликса, а в некоторых случаях (не исключено, что во всех) и наружной мембраны тегумента. Данный феномен имеет место только на начальном этапе инвазии паратенического хозяина, что подтверждено упомянутыми результатами экспериментального заражения толстощеков. В случае с палтусом мы, вероятно, также наблюдали начальный этап инвазии, поскольку тегумент большинства других коринозом в этом хозяине был покрыт обычным тонким слоем гликокаликса и не имел признаков смены или изменения наружной мембраны.
Стратегия уклонения от иммунного ответа хозяина путем сбрасывания поверхностных элементов оболочек или покровов характерна не только для многоклеточных паразитов. Внеклеточные формы малярийных плазмодиев преодолевают негативную реакцию антител хозяина на спорозоитов, сбрасывая молекулы поверхностных белков, что нивелирует эффективность этих антител (Zambrano-Vila et al., 2002). Иной процесс, приводящий к сходному результату, описан у лейшманий, метациклические промастиготы которых могут нейтрализовать действие комплемента, сбрасывая мембраноатакующий комплекс (Puentes et al., 1990). Не вдаваясь в обсуждение молекулярных механизмов уклонения от реакции хозяина, отметим, что эти примеры иллюстрируют, в сущности, общее явление, характеризующее отношения паразита и хозяина на организменном уровне. Можно предположить, что стратегия уклонения тканевых паразитов от иммунного ответа хозяина путем смены/обновления поверхностной части их организма носит общий характер и используется паразитическими организмами, принадлежащими к разным таксономическим группам. Для проверки этого предположения необходимы дальнейшие исследования.