ВВЕДЕНИЕ
Неуклонный рост резистентности патогенных микроорганизмов к антимикробным препаратам разных поколений является серьезным вызовом обществу, масштаб которого таков, что не может быть решен традиционными путями, связанными с получением новых антибиотиков, пул которых продолжает сужаться, в то время как число мультирезистентных штаммов неумолимо растет [1–3]. Одним из альтернативных высокоэффективных способов борьбы с локализованными инфекциями является антимикробная фотодинамическая терапия (АФДТ) [3–8], которая представляет собой отличную от традиционной терапии антибиотиками стратегию лечения. АФДТ основана на селективном накоплении в микробных клетках окрашенных веществ, так называемых фотосенсибилизаторов (ФС), которые, будучи малотоксичными в темноте, при воздействии видимого света заданной длины волны и мощности, способны генерировать активные формы кислорода, что позволяет эффективно инактивировать патогенную микрофлору [3–5].
Введенные в клиническую практику или испытываемые в лабораториях для лечения опухолей неэлектролитные и анионные ФС на основе порфиринов, хлоринов или фталоцианинов [9–11] способны инактивировать грамположительные микроорганизмы [3, 4, 8, 12], однако грамотрицательные бактерии, имеющие внешнюю липополисахаридную мембрану, обычно оказываются малочувствительными к терапевтическим дозам таких ФС [12, 13]. Использование поликатионных фотосенсибилизаторов или ФС, конъюгированных с катионными полимерами, или добавка к растворам ФС потенцирующих агентов позволяет снизить число КОЕ Грам (–) патогенов в процессе АФДТ на несколько порядков (см. [4–6, 14, 15] и ссылки в этих работах), однако одновременно увеличивается темновая токсичность и существенно повышается стоимость препаратов.
В этой связи в настоящей работе представлены результаты исследования фотодинамической активности полусинтетического хлоринового ФС, содержащего одну катионную группу, в отношении трех нозокомиальных антибиотикорезистентных Грам (–) микроорганизмов группы ESKAPE [12]. Исследуемый ФС получается в 4 стадии из сине-зеленой водоросли Spirulina platensis, имеет высокую степень чистоты, растворим в водных средах, обнаруживает эффективную генерацию синглетного кислорода и, таким образом, может рассматриваться как новый перспективный агент для АФДТ.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
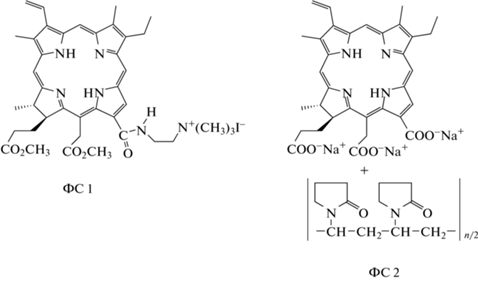
Структуры молекул монокатионного хлорина, а также широко используемого в клинической практике ФС “Фоторан е6” представлены на рис. 1. Двухстадийный синтез ФС 1 из доступного метилфеофорбида а, его идентификация методами 1Н ЯМР-спектроскопии и масс-спектрометрии, определение величины квантового выхода синглетного кислорода химическим и спектроскопическим методами, ассоциация и агрегация молекул ФС в водных растворах подробно рассмотрены ранее [16–18]. Используемые в работе реагенты: фотосенсибилизатор “Фоторан е6” (Ранфарма, Россия), ε-полилизин (число полимеризации ~30, Китай), Твин 80 (Panreac, Испания), этилендиаминтетраацетат натрия (Na2H2Edta, Panreac) использовались без дополнительной очистки.
Рис. 1.
Структурные формулы исследуемых ФС: 13(1)–(2'-триметиламмониоэтилиодид)амид-15(2),17(3)-диметиловый эфир хлорина е6 (ФС 1), тринатриевая соль хлорина е6 в смеси с поливинилпирролидоном (“Фоторан е6”, ФС 2).
Фотоинактивация патогенной микрофлоры проводилась с помощью светодиодной панели (БМЦ, Белоруссия), излучающей в диапазоне длин волн 580–720 нм с максимумом испускания при 660 нм [19]. Плотность светового излучения или энергетическая освещенность (доза излучения) определялась на основании показаний неселективного радиометра “Аргус 03” (ВНИИОФИ, Россия) и составляла 40 или 80 Дж см–2.
Все бактериологические исследования с нозокомиальными условно-патогенными микроорганизмами проводились в сертифицированной клинико-диагностической лаборатории Ивановской областной клинической больницы. Суточные культуры штаммов микроорганизмов на среде Олькеницкого смывали стерильным физиологическим раствором и доводили до концентрации ~(2.4–2.7) × 108 КОЕ в 1 мл (0.8–0.9 ед. по стандарту МакФарланда). Посевную дозу 2 × 107 КОЕ в 1 мл готовили из исходной взвеси путем разведения. Методика проведения фотоинактивации была в целом аналогичной, описанной ранее [6], с тем различием, что высев на плотную питательную среду осуществлялся непосредственно после проведения эксперимента. Подсчет числа КОЕ проводился через 24 ч инкубации в термостате при 37°С. Полученные результаты представлены на рис. 2–4.
Рис. 2.
Фотоинактивация Pseudomonas aeruginosa in vitro: 1 – 100 мкмоль кг–1 (ФС2); 2 – 100 мкмоль кг–1 (ФС2) + + 0.025 мас. % ε-полилизина; 3 – 100 мкмоль кг–1 (ФС1), 4 – 100 мкмоль кг–1 (ФС1) + 0.5 мас. % Твин 80. Световой контроль – 6 × 106 КОЕ. Патоген резистентен к препаратам “Меропенем”, “Ципрофлоксацин”, “Цефепим”, “Имипенем”, “Цефоперазон”, “Гентамицин”, чувствителен к “Полимиксину”.
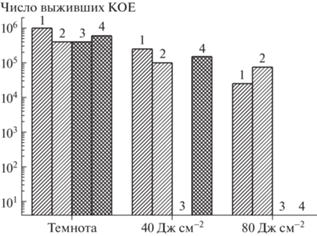
Рис. 3.
Фотоинактивация Enterobacter cloacae: 1 –50 мкмоль кг–1 (ФС2), 2 – 50 мкмоль кг–1 (ФС2) + + 0.1 мас. % ε-полилизина, 3 – 25 мкмоль кг–1 (ФС1), 4 – 50 мкмоль кг–1 (ФС1). Световой контроль – 2 × × 106 КОЕ. Патоген резистентен к препаратам “Фурадонин”, “Ципрофлоксацин”, “Цефтриаксон”, “Ампициллин”, “Цефотаким”, “Налидиксовая кислота”, чувствителен к “Гентамицина сульфату”.
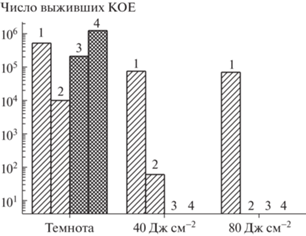
Рис. 4.
Фотоинактивация Acinetobacter baumannii: 1 –100 мкмоль кг–1 (ФС2) + 0.1 мас. % Na2H2Edta; 2 –100 мкмоль кг–1 (ФС2) + 0.1 мас. % ε-полилизина; 3 –50 мкмоль кг–1 (ФС1); 4 – 50 мкмоль кг–1 (ФС1) + + 0.1 мас. % Na2H2Edta. Световой контроль – 2 × × 106 КОЕ. Патоген резистентен к препаратам “Меропенем”, “Ципрофлоксацин”, “Цефепим”, “Имипенем”, “Гентамицин”, “Цефтазидим”, “Цефоперазон”, чувствителен к “Полимиксину”.

ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Результаты исследования темновой и световой токсичности монокатионного хлорина и анионного фотосенсибилизатора “Фоторан е6” в отношении нозокомиальной планктонной формы синегнойной палочки представлены на рис. 2. Как видно, оба ФС обладают низкой темновой токсичностью, и число КОЕ Pseudomonas aeruginosa практически не отличается от контроля. ФС 1 при облучении с дозой 40 Дж см–2 позволяет полностью инактивировать патоген, в то время как при добавке неионогенного поверхностно-активного вещества (ПАВ) Твин 80, образующего устойчивый комплекс с ФС, для полного подавления роста требуется 80 Дж см–2.
Возможно, это связано со сложностями диффузии синглетного кислорода из мицеллярной матрицы в условиях избытка ПАВ, что требует более высоких доз световой энергии. Интересно отметить, что снижение концентрации ФС 1 в два раза не сказывается на эффективности фотоинактивации патогена. В свою очередь, “Фоторан е6” даже при добавке 0.025 мас. % ε-полилизина и дозе 80 Дж см–2 не позволяет снизить начальное число КОЕ даже на два порядка.
При исследовании антимикробной активности в отношении Enterobacter cloacae (рис. 3) обнаруживаются в целом аналогичные тенденции: растворы обоих ФС имеют достаточно низкую темновую цитотоксичность, а при облучении красным светом ФС 1 позволяет полностью инактивировать патоген уже при облучении с дозой 40 Дж см–2. Как видно из полученных данных, концентрация раствора ФС 1, по сравнению с синегнойной палочкой, может быть снижена в четыре раза без потери эффективности фотоинактивации.
Фотоинактивация с ФС 2 независимо от величины энергетической освещенности снижает число КОЕ лишь на порядок. Добавка к раствору “Фоторан е6” 0.1 мас. % ε-полилизина позволяет при дозе облучения 80 Дж см–2 полностью инактивировать патогенную микрофлору, однако наблюдаемое повышение эффективности в значительной степени является следствием усиления темновой токсичности (см. рис. 3), вызванной добавкой катионного полимера, который имеет высокую аффинность к внешней мембране Грам (–) бактерий [4, 19].
На рис. 4 представлены результаты фотоинактивации еще одного антибиотикорезистентного патогена из группы ESKAPE [12], поиск альтернативных путей инактивации которого имеет большое значение [3, 12]. Как видно, растворы обоих ФС обнаруживают ощутимую темновую цитотоксичность, при этом добавка 0.1 мас. % Na2H2Edta к раствору ФС 1 приводит к полной гибели патогена через 40 мин инкубации в темноте, в то время как в растворе ФС 2 она снижает число КОЕ лишь на два порядка. Поскольку этилендиаминтетраацетат натрия дестабилизирует внешнюю мембрану и ускоряет проникновение молекул ФС внутрь грамотрицательных бактерий [19, 20], разумно заключить, что в присутствии Na2H2Edta катионный ФС 1 проникает внутрь микробной клетки, что приводит к более выраженной цитотоксичности. Облучение красным светом позволяет полностью инактивировать патоген, при этом световой дозы уже в 40 Дж см–2 оказывается вполне достаточно, чтобы понизить число КОЕ на 5–6 порядков.
ВЫВОДЫ
Результаты проведенных исследований показывают, что монокатионный хлорин обладает выраженной фотодинамической активностью в отношении планктонных форм нозокомиальных антибиотикорезистентных грамотрицательных бактерий, которая значительно выше, чем у анионных ФС на основе хлорина е6. Оптимальными условиями для эффективной фотоинактивации Грам (–) патогенов можно считать концентрацию ФС – 50 мкмоль кг–1 и дозу светового излучения – 80 Дж см–2, которая сообщается за 15 мин облучения. Предварительные оценки показывают, что эти же параметры могут быть использованы для фотоинактивации смешанной микрофлоры, в том числе и находящейся в состоянии биопленки. Установлено, что добавка нетоксичных в темноте для грамотрицательных бактерий небольших количеств ε-полилизина или Na2H2Edta (0.05–0.1 мас. %), повышающих сродство молекул ФС к внешней липополисахаридной мембране, усиливает антимикробное действие ФС.