Радиационные методы
УДК 620.179.15:539.1.074
ПОЛИТЕТРАФТОРЭТИЛЕН В ВЫСОКОДОЗНОЙ ЭПР-ДОЗИМЕТРИИ
ДЛЯ КОНТРОЛЯ РАДИАЦИОННЫХ ТЕХНОЛОГИЙ
© 2019 г. И.И. Мильман1,2*, А.И. Сюрдо1,2, Р.М. Абашев1,2, А.Н. Цмокалюк2,
Н.Е. Берденев2, Е.Н. Агданцева2, М.А. Попова2
1Институт физики металлов имени М.Н. Михеева УрО РАН, Россия 620108 Екатеринбург,
ул. Софьи Ковалевской,18
2Уральский федеральный университет имени первого Президента России Б.Н. Ельцина,
Россия 620002 Екатеринбург, Мира, 19
*E-mail: milmanii@imp.uran.ru
Поступила в редакцию 04.07.2019; после доработки 14.08.2019
Принята к публикации 15.08.2019
Приведен краткий перечень основных направлений в радиационных технологиях, использующих ионизирующие
излучения в широком диапазоне доз и энергий. Обоснована необходимость контроля доз в облучаемых объектах и диа-
гностики полей излучений. Отмечено, что в мировой практике эти задачи решаются с помощью дозиметрических ЭПР-
систем и детекторов на основе L-α-аланина. На примере проведения радиационной стерилизации изделий медицинской
техники излучением ускорителя электронов получена серия экспериментальных результатов, подтверждающих возмож-
ность применения политетрафторэтилена в качестве детектора дозиметрических ЭПР-систем для контроля радиацион-
ных технологий.
Ключевые слова: политетрафторэтилен, электронный парамагнитный резонанс, L-α-аланин, эталонные дозиметры,
рабочие дозиметры, ионизирующее излучение.
DOI: 10.1134/S0130308219110016X
ВВЕДЕНИЕ
В настоящее время исследования и технологические разработки в области радиационной тех-
нологии (РТ) проводятся в следующих основных направлениях: радиография и интроскопия,
включая крупногабаритные объекты, модификация материалов, исследование радиационного ста-
рения и разрушения материалов, стерилизация медицинских изделий, радиационная обработка
пищевых продуктов, диагностика и терапия злокачественных новообразований и неопухолевых
заболеваний, обеззараживание токсичных отходов производства. Многие из этих направлений
используют гамма-изотопные источники и пучки электронов, получаемые с помощью электрон-
ных ускорителей. В зависимости от решаемых задач в РТ используют электроны с энергиями до
50 МэВ, при этом требуемая доза облучения может находиться в пределах 0,5 — 106 Гр [1, 2].
Существенно более широкая номенклатура видов ионизирующих излучений используется в ядер-
ной медицине. Для лучевой терапии наиболее эффективны высокоэнергетические протоны, уско-
ренные ионы углерода, водорода, гелия и кислорода с энергиями до 400 МэВ, а доставляемые в
мишень дозы за цикл фракционного облучения не превышают 2 Гр [3—5]. Лучевая терапия
быстрыми нейтронами (6,3 МэВ) начинает входить в арсенал методов ядерной медицины [6].
Неотъемлемой частью РТ во всех ее применениях является дозиметрический контроль, наи-
более жесткие требования к которому предъявляются при модификации материалов, стерилиза-
ции медицинских изделий, радиационной обработке пищевых продуктов, диагностике и тера-
пии. В современных дозиметрических системах, предназначенных для регистрации фотонных и
корпускулярных излучений в широком интервале доз и энергий, используются ионизационные
камеры, полупроводниковые и сцинтилляционные детекторы, радиохромные пленки, термолю-
минесцентные и оптически стимулированные детекторы, особое место занимают дозиметриче-
ские системы, основанные на измерении электронного парамагнитного резонанса (ЭПР) [7—11].
ЭПР-спектрометрия, как метод радиационной дозиметрии, была предложена несколько десяти-
летий назад. В основе метода лежит зависимость величины сигнала ЭПР от связанной с по-
глощенной дозой концентрацией неспаренных электронов, образующихся под действием иони-
зирующих излучений во многих материалах. Достоинством метода является высокая точность,
неразрушающее считывание информации, возможность многократного использования одного и
того же детектора без влияния на сигнал.
Политетрафторэтилен в высокодозной ЭПР-дозиметрии...
53
За рубежом аланиновая ЭПР-дозиметрия обеспечивается специализированными, высокопро-
изводительными ЭПР-спектрометрами с комплектами аттестованных L-α-аланиновых детекто-
ров. Так, например, аланиновая дозиметрическая ЭПР-система MS 5000 (Magnettech GmbH,
Берлин, Германия), работающая на частоте 9,2—9,6 ГГц, в диапазоне больших доз от 0,5 до бо-
лее чем 200 кГр, затрачивает на одно измерение 10 с. В диапазоне низких доз, менее 1 до 20 Гр,
время измерения возрастает до 120 с [12]. Вместе с тем хорошо известно, что практически все
направления в РТ связаны с необходимостью проведения большого объема относительных и
абсолютных измерений параметров радиационного процесса. Это особенно четко сформули-
ровано в требованиях международных стандартов на проведение радиационной стерилизации
медицинской техники и пищевых продуктов [13—15]. В этих же документах рекомендовано
применение ЭПР-дозиметрии и определен порядок передачи единиц поглощенной дозы вторич-
ным эталонам или рабочим детекторам ионизирующих излучений. В России ЭПР-дозиметрия
не получила широкого распространения из-за отсутствия специализированного оборудования.
Тем не менее некоторые задачи РТ могут быть решены с помощью имеющихся в стране ис-
следовательских ЭПР-спектрометров при наличии детекторов из доступного, недорогого мате-
риала с налаженной технологией изготовления, близкого по параметрам с ЭПР-детектором на
основе L-α-аланина.
Цель данной работы — выбор и исследование ЭПР-дозиметрического материала, пригодного
для изготовления вторичного эталона или рабочего детектора при выполнении рутинных измере-
ний в радиационных технологиях на основе ускорителей электронов, в том числе в технологии сте-
рилизации одноразовых медицинских изделий и продуктов питания. Актуальность темы продикто-
вана тем, что практически все направления в РТ связаны с необходимостью проведения большого
объема относительных и абсолютных измерений доз. Требуется доступный и недорогой материал
с налаженной технологией изготовления, близкий по физическим свойствам к L-α-аланину.
МЕТОДИКА И ОБРАЗЦЫ
В качестве объекта исследования выбран политетрафторэтилен (ПТФЭ) — (C2F4)n производ-
ства АО «ГалоПолимер», Россия. Этот материал называется также фторопластом-4 или тефло-
ном. В предварительных исследованиях было обнаружено, что в образцах ПТФЭ образуются
парамагнитные центры, регистрируемые в спектрах ЭПР. При этом было установлено, что зату-
хание сигнала ЭПР не превышало 2 % за год хранения при нормальных условиях. Возможность
применения ПТФЭ в дозиметрических ЭПР-системах обсуждается также зарубежными исследо-
вателями [16—20]. Обоснованием выбора объекта исследования являлись уникальные свойства
ПТФЭ: химическая инертность, высокая температура разложения (415 °C), доступность и воз-
можность создания воспроизводимых геометрических форм детекторов с помощью механиче-
ской обработки. При выборе материала, в плане расширения его практического применения,
учитывались его анизотропность, тканеэквивалентность и биологическая совместимость.
Параллельно с ПТФЭ-детекторами, в тех же экспериментальных условиях измерялись ЭПР-
спектры некалиброванных L-α-аланиновых детекторов в виде пленок фирмы Kodak, признан-
ных Международным Агентством по Атомной Энергии (IAEA) стандартными ЭПР-детекторами
для измерения высоких доз облучения в рутинных и эталонных измерениях [9].
Исследуемые образцы детекторов на основе ПТФЭ представляют собой цилиндры высотой
1 см и диаметром 1,5 мм. Облучение образцов производилось в центре радиационной стери-
лизации Уральского федерального университета, включающем линейный ускоритель электро-
нов UELR-10-10S на 10 МэВ и конвейерную линию подачи продуктов в позицию облучения.
Измерения спектров ЭПР проводились с помощью ЭПР-спектрометра ELEXSYS E500. В каче-
стве первичного эталона поглощенной дозы электронного излучения для передачи единиц
поглощенной дозы аланиновым и ПТФЭ-детекторам (рабочим эталонам) использовался меж-
государственный стандартный образец (МСО) поглощенной дозы фотонного и электронного
излучений (сополимер с феназиновым красителем) СО ПД(Ф)Р-5/50 с погрешностью аттеста-
ции не более ±7 %, при P=0,95; №1735:2011 в Реестре МСО. Облучение и измерения ЭПР-
сигналов проводились при комнатной температуре. Рабочая частота спектрометра была рав-
ной 9,88 ГГц, мощность излучения 2 мВт, амплитуда модуляции 6 Гс, диапазон изменения
магнитного поля от 10 до 150 Гс. Величина сигнала ЭПР, связанная с поглощенной дозой
облучения, оценивалась по максимальной амплитуде и по площади производной спектра
поглощения в относительных единицах.
Дефектоскопия
№ 11
2019
54
И.И. Мильман, А.И. Сюрдо, Р.М. Абашев и др.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
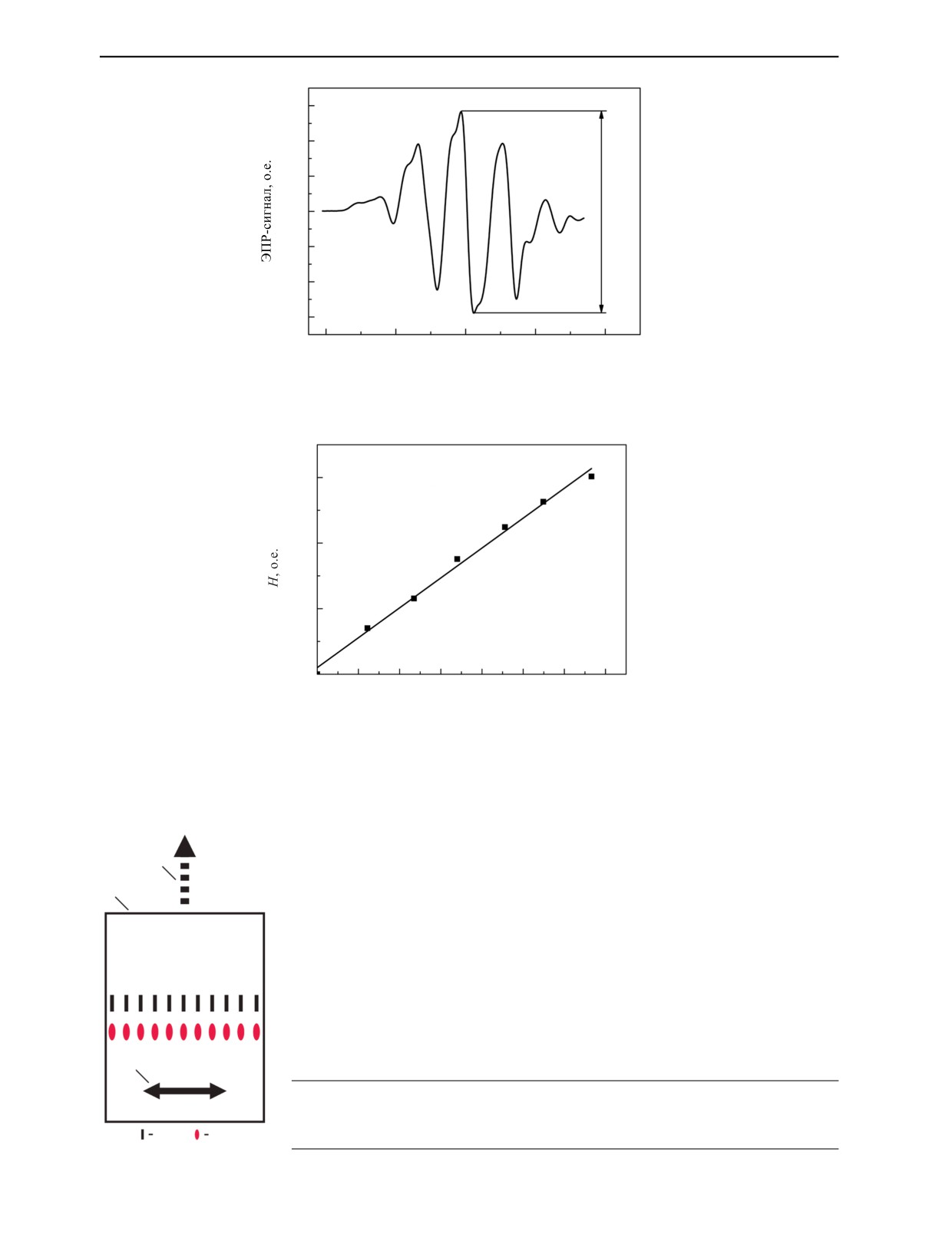
На рис. 1 показан контейнер для облучения, транспорта и хранения L-α-аланиновых (полоска)
и ПТФЭ-детекторов (1 и 2). Здесь же показана окрашенная излучением пленка эталонного детек-
тора СО ПД(Ф)Р-5/50 (3).
3
1
2
Рис. 1. Контейнер для облучения, транспорта и хранения аланиновых (1) и ПТФЭ-детекторов (2). Стрелкой отмечена
окрашенная излучением пленка эталонного образца СО ПД(Ф)Р-5/50 (3).
Принятая методика обработки спектра в ЭПР-дозиметрии предусматривает два варианта: по
амплитуде самого высокого пика первой производной сигнала поглощения Н или по площади под
ее кривой S1 + S2. На рис. 2 представлены оба варианта обработки спектра на примере ЭПР-спектра
ПТФЭ-детектора.
12
8
4
S1
H
В0
0
S2
-4
-8
3440
3480
3520
3560
B, Гс
Рис. 2. Параметры ЭПР-сигнала ПТФЭ-детектора при дозе облучения 12,2 кГр: H — высота, S1 + S2 — площадь,
В0 — величина резонансного магнитного поля.
В табл. 1 приведены параметры ЭПР-сигналов ПТФЭ-детектора в диапазоне доз облучения
12,2—66,6 кГр. Рассчитанное значение g-фактора или фактора Ланде по среднему значению
величины резонансного магнитного поля В0 оказалось 2,018. Оно близко к известному из лите-
ратуры значению 2,016 для облученного ПТФЭ [19]. Это свидетельствует о том, что в указанном
диапазоне доз не происходит структурных изменений детектора, влияющих на его электронные
свойства.
Дефектоскопия
№ 11
2019
Политетрафторэтилен в высокодозной ЭПР-дозиметрии...
55
Таблица
1
Доза облучения и параметры ЭПР-сигналов ПТФЭ-детектора
№
Dn, кГр
H, о.е.
S1+S2, о.е.
B0, Гс
1
12,2
21,9
286,2
3494,0
2
23,5
40,5
530,9
3494,5
3
34,0
58,2
770,6
3493,7
4
45,6
71,3
962,1
3493,0
5
54,9
83,0
1104,1
3492,6
6
66,6
102,1
1364,5
3492,5
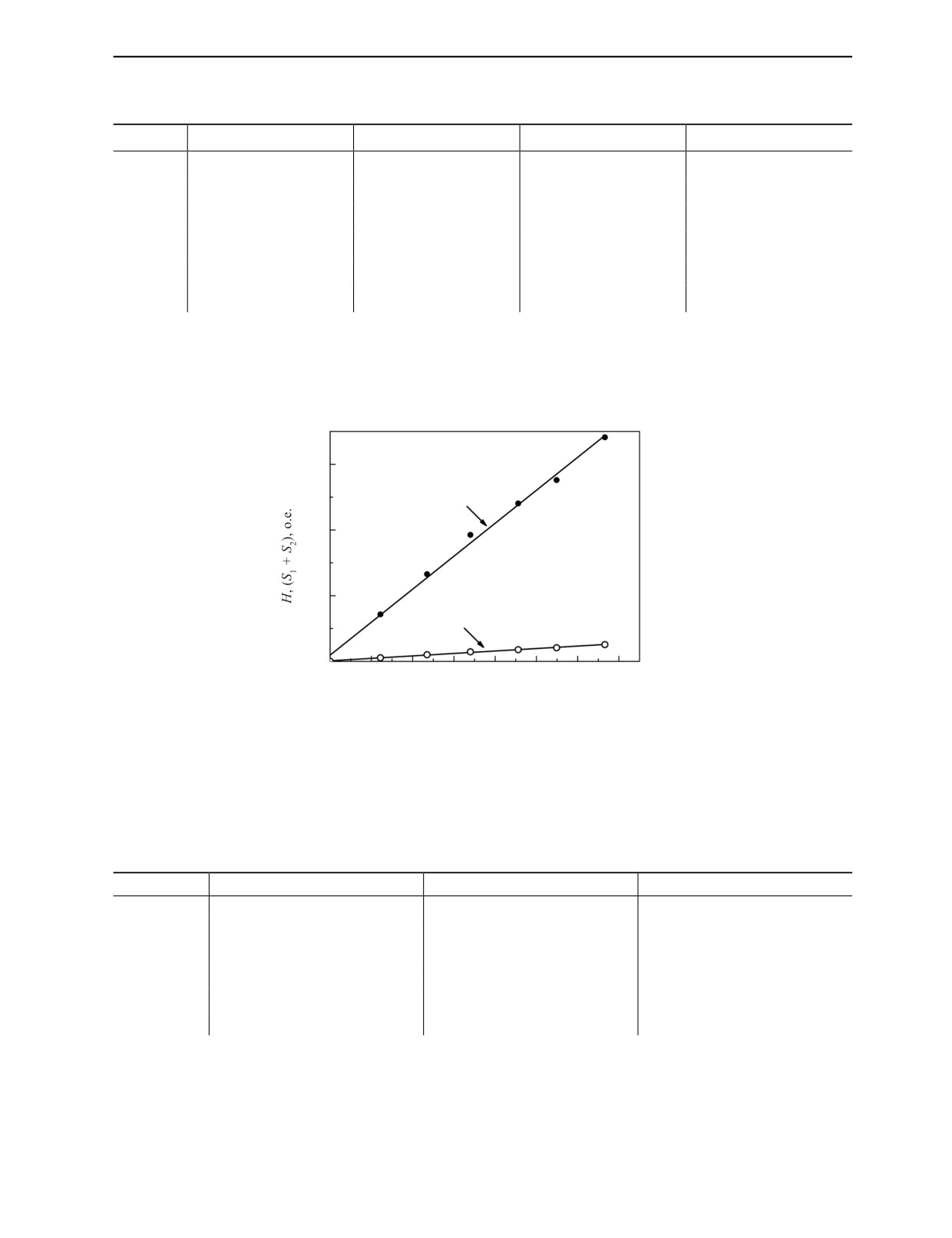
Данные табл. 1 использованы для построения зависимости величины сигнала ЭПР от дозы
облучения ПТФЭ-детектора, построенные по пику Н (1) и площади (S1 + S2) (2), рис. 3.
y = (20,08±0,59)∙x
1200
2
800
400
1
y = (1,49±0,05)∙x
0 0
10
20
30
40
50
60
70
Доза, кГр
Рис. 3. Величина сигнала ЭПР, построенная по пику Н (1) и площади (S1 + S2) (2), от дозы облучения ПТФЭ-детектора.
В табл. 2 приведены параметры ЭПР-сигналов аланинового детектора в диапазоне доз облуче-
ния 12,2—66,6 кГр.
Таблица
2
Доза облучения и параметры ЭПР-сигналов аланинового детектора
№
Dn, кГр
H, о.е.
B0, Гс
1
12,2
35,1
3521,0
2
23,5
57,7
3545,0
3
34,0
87,8
3520,9
4
45,6
112,2
3542,0
5
54,9
131,5
3522,0
6
66,6
150,8
3445,1
Типичный ЭПР-сигнал облученного L-α-аланинового детектора приведен на рис. 4.
Рассчитанное значение g-фактора составило 2,002, что близко к g-фактору свободного электро-
на. Дозовая зависимость величины сигнала ЭПР для L-α-аланинового детектора, построенная по
максимальному пику, приведена на рис. 5.
Дефектоскопия
№ 11
2019
56
И.И. Мильман, А.И. Сюрдо, Р.М. Абашев и др.
18
12
6
0
H
-6
-12
-18
3440
3480
3520
3560
3600
B, Гс
Рис. 4. ЭПР-сигнал L-α-аланинового детектора при дозе 12,2 кГр; H — высота.
150
y = (2,28±0,08)∙x
100
50
00
10
20
30
40
50
60
70
Доза, кГр
Рис. 5. Зависимость величины сигнала ЭПР от дозы облучения аланинового детектора.
Одним из важных этапов проведения радиационной стерилизации изделий медицинской
техники и продуктов питания является установление распределения поглощенной дозы на
поверхности транспортной тары вдоль направления сканирования
электронного пучка и определение ширины развертки. Под шириной
развертки понимается расстояние между точками кривой распределе-
г
ния поглощенной дозы на поверхности транспортной тары, в которой
в
коэффициент неравномерности не должен превышать величины
R = Dmax / Dmin, где Dmax и Dmin — максимальные и минимальные дозы.
Для измерения коэффициента неравномерности распределения погло-
щенной дозы в реальных условиях ПТФЭ- и аланиновые ЭПР-
детекторы размещались от края до края на поверхности транспортной
1
3
5
7
9
11
2
4
6
8
10
тары вдоль направления сканирования через 3 см друг от друга, как
это показано на рис. 6.
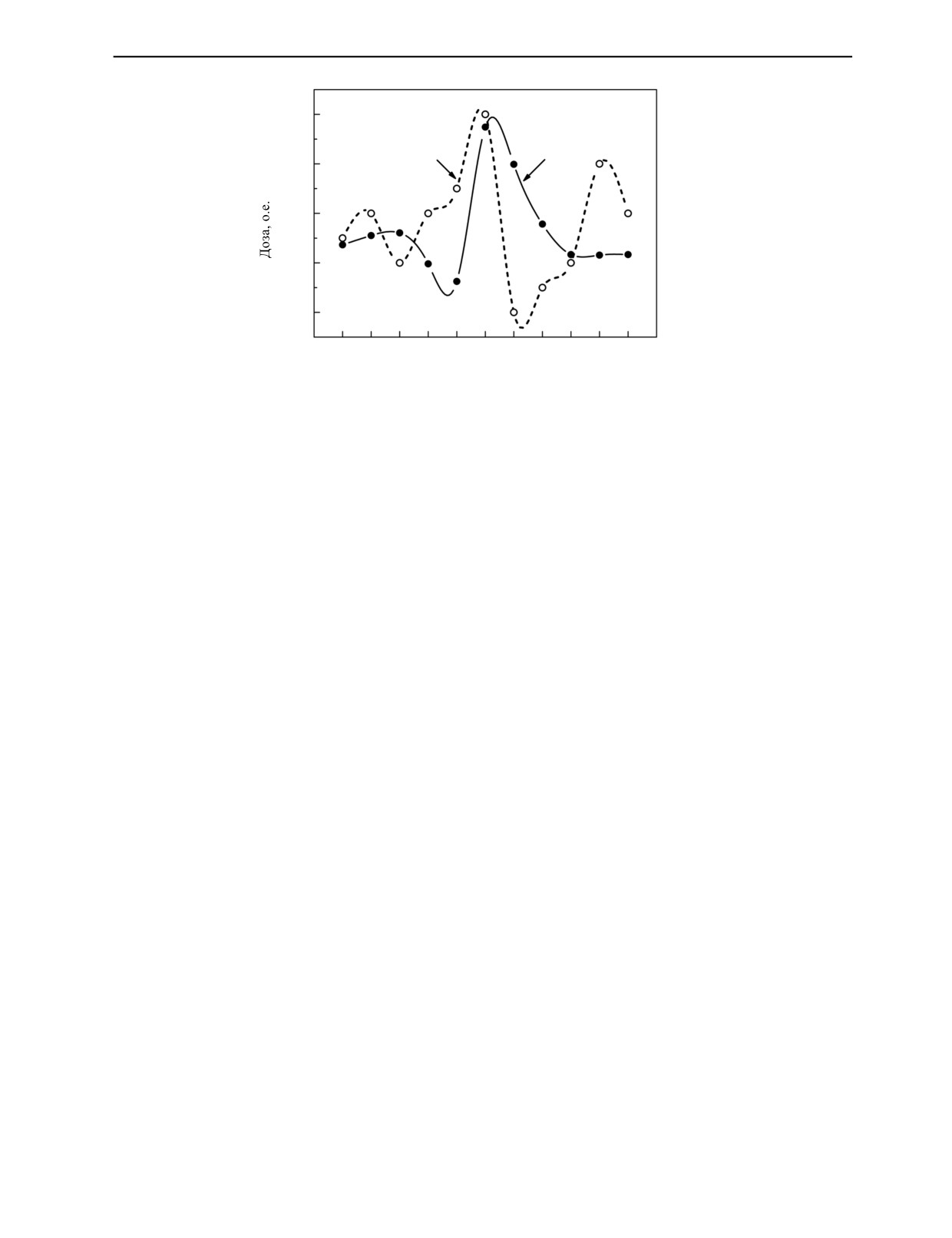
Результаты измерения неравномерности распределения поглощенной
дозы на поверхности контейнеров представлены на рис. 7.
д
Рис. 6. Схема расположения ПТФЭ- (а) и L-α-аланиновых (б) детекторов на поверхности
транспортного контейнера (в). Стрелками показано направление движения контейнера
а
б
(г) и развертка электронного пучка (д).
Дефектоскопия
№ 11
2019
Политетрафторэтилен в высокодозной ЭПР-дозиметрии...
57
1,00
1
2
0,98
0,96
0,94
0,92
1
2
3
4
5
6
7
8
9
10
11
Номер детектора
Рис. 7. Распределение поглощенной дозы по поверхности транспортной тары:
1 — L-α-аланиновый детектор, 2 — ПТФЭ-детектор.
Данные рис. 7 использовались для расчета коэффициента неравномерности поглощенной
дозы R по поверхности транспортной тары. При использовании L-α-аланинового ЭПР-
детектора величина R оказалась равной 1,09, а для ПТФЭ-детектора — 1,08. Обе величины
укладываются в нормативные требования [13]. Как видно из рис. 7, максимальное значение
дозы на поверхности транспортной тары приходится на ее геометрический центр при нормаль-
ном положении электронного пучка относительно сканируемой поверхности. Поскольку изме-
ренный коэффициент неравномерности не превышает нормативных требований, можно сделать
вывод об удовлетворительной работе системы развертки электронного пучка, обеспечивающей
сокращение времени сканирования центральной части поверхности транспортной тары относи-
тельно ее периферийных участков.
Результаты проведенных исследований, представленные на рис. 3 и 5, характеризуются линей-
ной зависимостью величины сигнала ЭПР в диапазоне доз 10—50 кГр, отсутствием нулевого
сигнала и деградации электронных свойств ПТФЭ- и аланиновых детекторов. Параметры измерен-
ных спектров полностью совпали с имеющимися в литературе, в том числе и для ПТФЭ-детекторов
зарубежного происхождения [19]. Поскольку облучение детекторов осуществлялось путем много-
кратного прохождения зоны облучения в течение нескольких часов, линейность дозовых характе-
ристик ПТФЭ- и L-α-аланиновых детекторов характеризует качество транспортной системы и
временную стабильность тока пучка. Действительно, нестабильность перемещения облучаемых
детекторов в зоне облучения, обусловленная возможными механическими колебаниями транс-
портной системы, или временной дрейф тока пучка приводили бы к отклонению от линейности
дозовой зависимости как для ПТФЭ, так и L-α-аланиновых детекторов. Таким образом, контроль
линейности дозовых характеристик обеспечивает воспроизводимость условий проведения радиа-
ционной стерилизации.
Особенно важным для практического применения оказалось то, что образцы ПТФЭ-детекторов
изготавливались в лабораторных условиях в требуемом количестве из доступного материала.
Таким детекторам могла быть придана любая воспроизводимая геометрическая форма, согласо-
ванная с конструкцией резонатора ЭПР-спектрометра любого типа. Выход ЭПР-сигнала может
регулироваться как путем увеличения массы ПТФЭ-детектора, так увеличением мощности высо-
кочастотных колебаний, подаваемой в объеме резонатора. Как показали наши измерения, при
увеличении мощности высокочастотных колебаний с 2 до 4 мВт интенсивность ЭПР-сигнала воз-
растала в два раза.
Дозиметрические ЭПР-системы с использованием ПТФЭ оказываются особенно полезными
при подготовке к аудиторскому контролю радиационных технологий, требующему большого объ-
ема измерений параметров излучения и оценок распределений доз в облучаемом объекте и окру-
жающем пространстве.
Дефектоскопия
№ 11
2019
58
И.И. Мильман, А.И. Сюрдо, Р.М. Абашев и др.
ЗАКЛЮЧЕНИЕ
В диапазоне доз, рекомендуемом для стерилизации одноразовых медицинских изделий и
пищевых продуктов, выполнены калибровочные облучения ПТФЭ- и аланиновых детекторов с
измерением соответствующих ЭПР-спектров. Облучения производились с помощью промышлен-
ного ускорителя электронов совместно с эталонными пленочными дозиметрами. Полученные
результаты калибровки доказывают возможность применения ПТФЭ-детекторов в качестве рабо-
чих детекторов ЭПР-дозиметров для повседневного контроля и диагностики качества радиацион-
ных технологий с использованием электронных ускорителей.
Работа выполнена в рамках государственного задания Минобрнауки России (тема «Эксперти-
за», № АААА-А19-119062590007-2).
СПИСОК ЛИТЕРАТУРЫ
1. Hamm R.W., Hamm M.E. (ed.). Industrial accelerators and their applications. London: World Scientific,
2012. 420 p.
2. Trojanowicz M., Bobrowski K., Szreder T., Bojanowska-Czajka A. Gamma-ray, X-ray and electron beam
based processes / Advanced Oxidation Processes for Waste Water Treatment. Academic Press,
2018.
P. 257—331.
3. Tessonnier T., Mairani A., Brons S., Haberer T., Debus J., Parodi K. Experimental dosimetric comparison
of 1H, 4He, 12C and 16O scanned ion beams // Physics in Medicine and Biology. 2017. V. 62. P. 3958—3982.
4. Durante M., Paganetti H. Nuclear physics in particle therapy: a review // Reports on Progress in
Physics. IOP Publishing. 2016. V. 79. Article ID 096702. 59 p.
5. Suita H., DeLaney T., Goldberg S., Paganetti H., Clasie B., Gerweck L., Niemierko A., Hall E., Jacob
Flanz J., Hallman J., Trofimov A. Proton vs carbon ion beams in the definitive radiation treatment of cancer
patients // Radiotherapy and Oncology. 2010. V. 95. P. 3—22.
6. Scharmann A. Past and Present of ESR in Radiation Applications // Applied Radiation and Isotopes.
1996. V. 47. No. 11/12. P. 110—117.
7. Ravotti F. Dosimetry Techniques and Radiation Test Facilities for Total Ionizing Dose Testing // IEEE
Transaction on Nuclear Science. 2018. V. 65. No. 8. P. 1440—1464.
8. Gallo S., Iacoviello G., Bartolotta A., Dondi D., Panzeca S., Maurizio Marrale M. ESR dosimeter
material properties of phenols compound exposed to radiotherapeutic electron beams // Nuclear Instruments
and Methods in Physics Research Section B: Beam Interactions with Materials and Atoms. 2017. V. 407.
P. 110—117.
9. Bailiff I.K., Sholom S., McKeever S.W.S. Retrospective and emergency dosimetry in response to
radiological incidents and nuclear mass-casualty events: A review // Radiation Measurements. 2016. V. 94.
P. 83—139.
10. Aydas C., Cam S.T. Identification of irradiated foodstuffs using ESR microwave saturation // Applied
Radiation and Isotopes. 2017. V. 122. No. 4. P. 14—20.
11. Aleksieva K.I., Nicola D., Yordanov N.D. Various approaches in EPR identification of gamma-irradiated
plant foodstuffs: A review // Food Research International. 2018. V. 105. P. 1019—1028.
ния 7.04.2019).
13. ISO 11137-3-2017. Sterilization of health care products — Radiation — Part 3: Guidance on dosimetric
aspects of development, validation and routine.
14. Guidelines for the development, validation and routine of industrial radiation processed. Vienna:
International Atomic Energy Agency, 2013. 148 p. (IAEA radiation technology series, ISSN 2220—7341; no. 4)
15. ISO/ASTM 51431:2005. Practice for dosimetry in electron beam and x-ray (bremsstrahlung) irradiation
facilities for food processing.
16. Judeikis H.S., Hedgpeth H., Siegel S. Free radical yields in polytetrafluoroethylene as the basis for a
radiation dosimeter // Journal of Radiation Research. 1968. V. 35. No. 2. P. 247—262.
17. Wu Y., Chengyue Sun C., Wu Y., Xing Y., Guo B., Wang Y., Sui Yu. The degradation behavior and
mechanism of polytetrafluoroethylene under low energy proton irradiation // Nuclear Instruments and Methods
in Physics Research Section B: Beam Interactions with Materials and Atoms. 2018. V. 430. P. 47—53.
18. Furuta M., Matsugaki A., Nakano T., Hirata I, Kato K., Oda T., Sato M., Okazakie M. Molecular level
analyses of mechanical properties of PTFE sterilized by Co-60 γ-ray irradiated for clinical use // Radiation
Physics and Chemistry. 2017. V. 139. P. 126—131.
19. Vehar D.W., Griffin P.J., Quirk T. EPR/PTFE Dosimetry for Test Reactor Environments // Journal of
ASTM International. 2012. V. 9. No. 5. P. 1—11.
20. Azorin J., Rivera T., Solis T. A new ESR dosimeter based on polytetrafluoroethylene // Applied
Radiation and Isotopes. 2000. V. 52. P. 1243—1245.
Дефектоскопия
№ 11
2019