Радиационные методы
УДК 620.179.15
ПОРТАТИВНАЯ РАДИОМЕТРИЧЕСКАЯ СИСТЕМА, ЕЕ ОСНОВНЫЕ
ЭЛЕМЕНТЫ И ВАРИАНТЫ ПРИМЕНЕНИЯ
© 2021 г. С.В. Панкин1,*, А.И. Сюрдо1
1Институт физики металлов имени М.Н. Михеева УрО РАН,
Россия 620108 Екатеринбург, ул. Софьи Ковалевской, 18
E-mail: *pankin@imp.uran.ru
Поступила в редакцию 06.08.2021; после доработки 22.09.2021
Принята к публикации 24.09.2021
Обсуждены основные элементы разрабатываемой портативной радиометрической системы (ПРС) и варианты ее
применения. При разработке детекторных модулей ПРС использованы кремниевые фотоумножители, что позволило
значительно уменьшить их размеры. Подобного рода устройства и системы находят свое приложение в решении раз-
личных задач медицинской радионуклидной диагностики, требующих увеличенного поля зрения, расширенного времен-
ного диапазона исследования и мобильности. Основной целью работы был поиск оптимальной конфигурации элементов
ПРС для обеспечения ее минимальных размеров и одновременно максимальной эффективности регистрации излучения
с учетом особенностей исследуемых объектов и кинетики протекающих в них процессов. Кроме того, дополнительно
рассмотрен алгоритм подбора минимально необходимого для каждого исследования количества активности радиоактив-
ного препарата.
Ключевые слова: портативный радиометр, гамма-излучение, радиофармпрепарат, сцинтиграфия, кремниевый
фотоумножитель.
DOI: 10.31857/S0130308221100067
ВВЕДЕНИЕ
Наиболее сложной из применяемых сейчас систем для проведения радионуклидной диагно-
стики является однофотонный эмиссионный компьютерный томограф (ОФЭКТ) [1]. Основным
ограничением ОФЭКТ является небольшое поле зрения его детекторной подсистемы, как правило,
не превышающее 400×500 мм2, что существенно ограничивает возможности анализа простран-
ственного распределения введенного радиофармпрепарата (РФП), а также динамики его переме-
щения в объекте исследования [2]. ОФЭКТ также обладает большими размерами и массой, что
предполагает его размещение только в специально оборудованных помещениях, а, следовательно,
проведение диагностирования пациентов в стационарных условиях. В современном неразрушаю-
щем контроле и медицине возникает все больше диагностических задач, для решения которых
требуется увеличенное поле зрения, высокое пространственное и временное разрешение, расши-
ренный временной диапазон исследования как в области малых, так и больших времен, а также
мобильность, что не могут пока предоставить современные томографические системы. Одним из
вариантов решения такого рода задач может быть использование систем с несколькими миниатюр-
ными детекторными модулями, установленными в удаленных друг от друга зонах [3].
Портативные медицинские радиометры на основе кремниевых фотоумножителей обладают
рядом преимуществ в сравнении с аналогичными, но с применением вакуумных фотоэлектронных
умножителей (ФЭУ). В иностранной литературе [4] кремниевые фотоумножители обозначаются
как Silicon Photomultiplier или SiPM. Детекторные модули радиометров c SiPM имеют существен-
но меньшие габариты и сниженные требования к источникам питания [5]. Портативная радиоме-
трическая система (ПРС), разработанная совместно специалистами кафедры экспериментальной
физики УрФУ и лаборатории интеллектуальных систем диагностики ИФМ УрО РАН, предназна-
чена для реализации исследований радионуклидной диагностики в нескольких режимах: гамма-
зондирование, 2D-сканирование и динамическая сцинтиграфия [6, 7]. Наиболее значимыми преи-
муществами разработанной ПРС являются более высокая эффективность регистрации излучения
и возможность максимально близкого подведения ее миниатюрных детекторных модулей в инди-
видуальных проекциях по отношению к объекту исследования [4]. Поэтому для демонстрации
преимуществ ПРС в сравнении с современными томографическими системами важно рассмотреть
варианты применения ПРС для исследования объектов малого размера, расположенных вблизи
органов и тканей с повышенной чувствительностью к воздействию ионизирующего излучения,
например глаза. В этой связи необходимо также описать логику выбора основных элементов ПРС
с учетом требований к применяемому в медицине радиометрическому оборудованию и предло-
56
С.В. Панкин, А.И. Сюрдо
жить алгоритм подбора оптимального количества активности вводимого препарата, учитывающий
свойства детекторных модулей, индивидуальные параметры их коллиматоров и требования к вели-
чине временного окна при динамическом исследовании.
Поэтому целью работы были выбор оптимальной конфигурации ПРС для обеспечения мини-
мальности размеров ее детекторных модулей и в то же время максимально возможной их эффек-
тивности регистрации излучения с учетом особенностей исследуемых объектов и кинетики про-
текающих в них процессов, а также разработка алгоритма расчета соответствующего выбранной
методике значения активности вводимого препарата.
ПОРТАТИВНАЯ РАДИОМЕТРИЧЕСКАЯ СИСТЕМА, ЛОГИКА ВЫБОРА ОСНОВНЫХ
ЭЛЕМЕНТОВ
ПРС разрабатывалась как многофункциональный медицинский радиометр для проведения
радионуклидных исследований кинетики накопления и выведения радиофармпрепарата, а также
его распределения в объекте исследования. Одним из важнейших условий, поставленных при раз-
работке было соблюдение баланса между качественными характеристиками детекторного модуля
и его габаритами [6]. ПРС включает 4 детекторных модуля гамма-излучения (рис. 1, поз. 11, 12, 13,
14), оснащенных набором сменных коллиматоров (поз. 2), которые позволяют с необходимым про-
странственным разрешением эффективно регистрировать накопление РФП в интересующих
зонах. Каждый детекторный модуль ПРС состоит из нескольких элементов: сцинтилляционный
кристалл CsI-Tl (поз. 3), кремниевый фотоумножитель типа SiPM (поз. 4), предусилитель сигнала
(поз. 5) и герметично вмонтированный в корпус разъем (поз. 6). Блок обработки сигнала (поз. 7) и
персональный компьютер (поз. 8) обеспечивают управление процессами измерения, сбора, обра-
ботки и анализа получаемых данных [7].
8
7
2
3
4
5
6
11
12
13
14
Рис.
1.
Общий вид портативной радиометрической системы и структура детекторного модуля (вставка):
11, 12, 13, 14 — детекторные модули ПРС; 2 — коллиматор; 3 — сцинтилляционный кристалл; 4 — SiPM; 5 — предусилитель;
6 — разъем; 7 — блок обработки сигнала; 8 — персональный компьютер.
Выбор основных элементов детекторного модуля ПРС во многом связан с необходимостью
достижения максимальной эффективности регистрации гамма-излучения, характеризующей
число зарегистрированных детекторным модулем фотонов относительно числа падающих. Так,
эффективность регистрации излучения в значительной степени зависит от выбора материала и
размеров сцинтилляционного кристалла, типа SiPM и параметров коллиматора. Кроме того, боль-
шую роль играют значения энергий гамма-излучения у используемых при диагностике изотопных
источников. При разработке детекторного модуля предполагалось, что ПРС будет использоваться
преимущественно с наиболее часто применяемым при длительных динамических радионуклид-
ных исследованиях радиофармпрепаратом на основе изотопа Tc99m. Эффективная энергия гамма-
квантов у Tc99m составляет 140 кэВ. Сама процедура выбора сцинтилляционного кристалла, крем-
ниевого фотоумножителя и расчета параметров коллиматоров описана в [8, 9].
Дефектоскопия
№ 10
2021
Портативная радиометрическая система, ее основные элементы и варианты применения
57
АЛГОРИТМ ПОДБОРА ОПТИМАЛЬНОГО ЗНАЧЕНИЯ КОЛИЧЕСТВА ВВОДИМОЙ
АКТИВНОСТИ В СООТВЕТСТВИИ С ПАРАМЕТРАМИ ВЫБРАННОГО КОЛЛИМАТОРА
В качестве примера рассмотрен случай исследования состояния слезной железы, обладающей
крайне малыми размерами и низкой функциональной активностью, что делает практически невоз-
можным исследование ее выделительной функции в динамическом режиме с применением
ОФЭКТ [10, 11]. При исследовании слезной железы томографическая установка дает возможность
лишь оценить в статике объем функционально активной ткани. В связи с этим, как один из наи-
более перспективных вариантов применения ПРС, была выбрана радионуклидная диагностика
подсистем зрительного аппарата и, в частности, слезопродуцирующей системы.
Эффективность функционирования желез может быть оценена из данных радионуклидного
исследования [12]. Из них также можно определить такой диагностически важный параметр как
секреторно-экскреторный коэффициент (СЭК). Он рассчитывается как отношение интенсивностей
излучения в области исследуемой железы при накоплении радиофармпрепарата в ее тканях до Imax
и после стимуляции лимонным соком Imin:
I
-
I
max
min
СЭК =
⋅100 %.
(1)
Imax
Здесь уместно отметить, что прямое исследование кинетики перемещения жидких радиоактив-
ных источников в малых объектах остается актуальной и во многих случаях нерешенной задачей
[13]. Более того, такого рода задачи возникают не только в медицинской, но и в технической и
технологической диагностике, например, при контроле различных радиаторных систем, использу-
емых в радиационно-технологических процессах [14]. Поэтому для указанных целей крайне
важно подобрать правильное соотношение между эффективностью регистрации и пространствен-
ным разрешением детектирующей подсистемы. Оно определяется выбором параметров коллима-
тора — устройства, ограничивающего распространение излучения, исходящего из определенной
области до пучка с заданным телесным углом. Одновременно коллиматор защищает детектирую-
щую часть от рассеянного излучения [15]. Согласно [15], количество регистрируемых в единицу
времени гамма-квантов I детекторным модулем с коллиматором определяется как
I= G · D · h,
(2)
где G — геометрическая эффективность коллиматора, определяемая как площадь поля его зрения
на поверхности протяженного источника излучения; D — активность источника, нормированная
на видимую коллиматором, площадь и определяемая в направлении центральной оси коллиматора;
h — суммарная эффективность регистрации излучения сцинтиллятором и ФЭУ.
Для более полной характеризации указанных параметров, влияющих на эффективность
регистрации гамма-квантов детекторным модулем, и их взаимосвязи с другими параметрами
радионуклидной диагностики необходимо отметить следующее. Значение D определяется
количеством введенного радиофармпрепарата, а также особенностями его распределения и
накопления в исследуемом объекте. В соответствии с [16] полезный эффект от проведенной
радионуклидной диагностики должен быть значительно больше, чем вред, нанесенный при
введении радиофармпрепарата. Следовательно, количество вводимой активности должно быть
минимальным, но, с другой стороны, достаточным для получения статистически достоверной
информации. Указанная выше геометрическая эффективность G характеризует геометриче-
ские параметры коллиматора. Повышение величины G за счет, например, увеличения радиуса
входного отверстия коллиматора приведет к ухудшению пространственного разрешения детек-
торного модуля [15].
Анализируя все выше рассмотренные особенности ПРС и выбранной методики, может
быть определена минимально необходимая активность вводимого радиофармпрепарата. В
норме значения СЭК для слюнной околоушной и слюнной подчелюстной желез находятся в
диапазоне 43—47 % [17]. Для достоверного определения нахождения значения СЭК в диапа-
зоне указанных нормальных значений желательно обеспечить точность измерения СЭК не
ниже, чем (47 % - 43 %) /3 = 1,3 %. Тогда допустимая относительная ошибка при определении
СЭК не будет превышать E = 1,3 % / 43% =0,03, а величины Imax и Imax - Imin, входящие в выра-
жение (1) для СЭК, будут связаны с ней следующим образом:
E = MaxError{СЭК}/СЭК,
Дефектоскопия
№ 10
2021
58
С.В. Панкин, А.И. Сюрдо
где MaxError{СЭК} — максимально допустимая абсолютная ошибка определения для СЭК.
MaxError{СЭК} также может быть определена как корень из суммы квадратов произведений част-
ных производных выражения (1) и отклонений от истинных значений ∆I при определении Imax и
Imin:
2
2
I
−
I
I
−
I
max
min
max
min
∂
∆I
∂
∆I
2
2
I
I
∆I
I
·∆I
max
max
min
MaxError
{
СЭК
}
/ 100
=
+
=
+
(3)
2
∂I
∂I
I
I
min
max
max
max
Ошибка измерения интенсивности излучения ∆I детекторным модулем ПРС может быть оце-
нена из выражения для ошибки определения интенсивности излучения, выражаемой через коэф-
фициент Стьюдента tст и среднеквадратичное отклонение σ: ∆I = σ · tст . С учетом вышеуказанных
условий, поскольку СЭК определяется при анализе лишь одного пика кинетической кривой, то
количество измерений n будет равно 2, а достаточная вероятность нахождения полученного значе-
ния в заданном диапазоне ошибки P = 0,95. При указанных n = 2 и P = 0,95 коэффициент Стью-
дента равен 12. Значение среднеквадратичного отклонения σ определено во время тестировании
ПРС и для ∆t = 30 с составило 3,5 имп/с [10]. В итоге можно рассчитать значение ∆I, которое
равняется 42 имп/с.
Если преобразовать выражение (1) к виду:
Imin = (1 - СЭК/100) Imax,
то станет видно, что наименьшее значение Imin будет получаться при максимальном значении СЭК
~47 %. Тогда доля препарата при СЭК=47 %, остающаяся в железе после стимуляции слюновыде-
ления, составит 100 % - 47 % = 53 %.
Из выражения (3) можно выразить Imax:
2
2
1+
(
1−
{
СЭК
/ 100
})
·∆I
(
)
I
=
(4)
max
2
(
MaxError
{
СЭК
}
/ 100
)
Зная требования к точности определения СЭК, а именно MaxError{СЭК}=1,3 %, а также зна-
чение ∆I = 42 имп/с и максимально возможное значение СЭК = 47 %, можно оценить Imax. Таким
образом, минимально необходимое для обеспечения требуемой точности определения СЭК значе-
ние интенсивности излучения Imax должно быть не менее 3400 имп/с.
Используя вычисленное Imax и выражение (2), можно оценить минимально необходимую актив-
ность Amin. Так как в выражении (2) D — это активность плоского источника [15], равная A/S, то:
I
·S I
·
S
max
A
min
=
=
·
·
G
h G
h
Величина Amin будет именно минимальной необходимой, поскольку при ее меньшем значении
невозможно будет достоверно различить максимумы и минимумы на зависимостях изменения
интенсивности излучения от времени в тканях железы.
ТЕСТИРОВАНИЕ ПРЕДЛОЖЕННОГО АЛГОРИТМА НА СПЕЦИАЛЬНОЙ МОДЕЛИ
СЛЕЗНЫХ И СЛЮННЫХ ЖЕЛЕЗ
Общий вид разработанного для тестирования предложенных алгоритмов работы с ПРС фанто-
ма слезных и слюнных желез представлен на рис. 2 [12]. Он создан на основе проточной конструк-
ции с заполняемыми жидкостью капсулами. Детекторные модули ПРС (поз. 1', 1'', 1''') размещают-
ся вблизи моделируемых слезных (2) и слюнных (3), (4) желез (см. рис. 2). Поток раствора радио-
фармпрепарата нагнетается в систему силиконовых трубок с внутренним диаметром 3 мм из спе-
циальных контейнеров (поз. 5, 6, 7). Сток от каждой из желез направляется с выхода капсул в
общий контейнер (поз. 8) с помощью таких же силиконовых трубок, как и на их входе. Серия фан-
томных экспериментов проведена в соответствии со следующим алгоритмом. После установки
Дефектоскопия
№ 10
2021
Портативная радиометрическая система, ее основные элементы и варианты применения
59
9'
5
1'
2'
2''
9''
6
1''
3'
3''
9'''
7
4'
4''
1'''
8
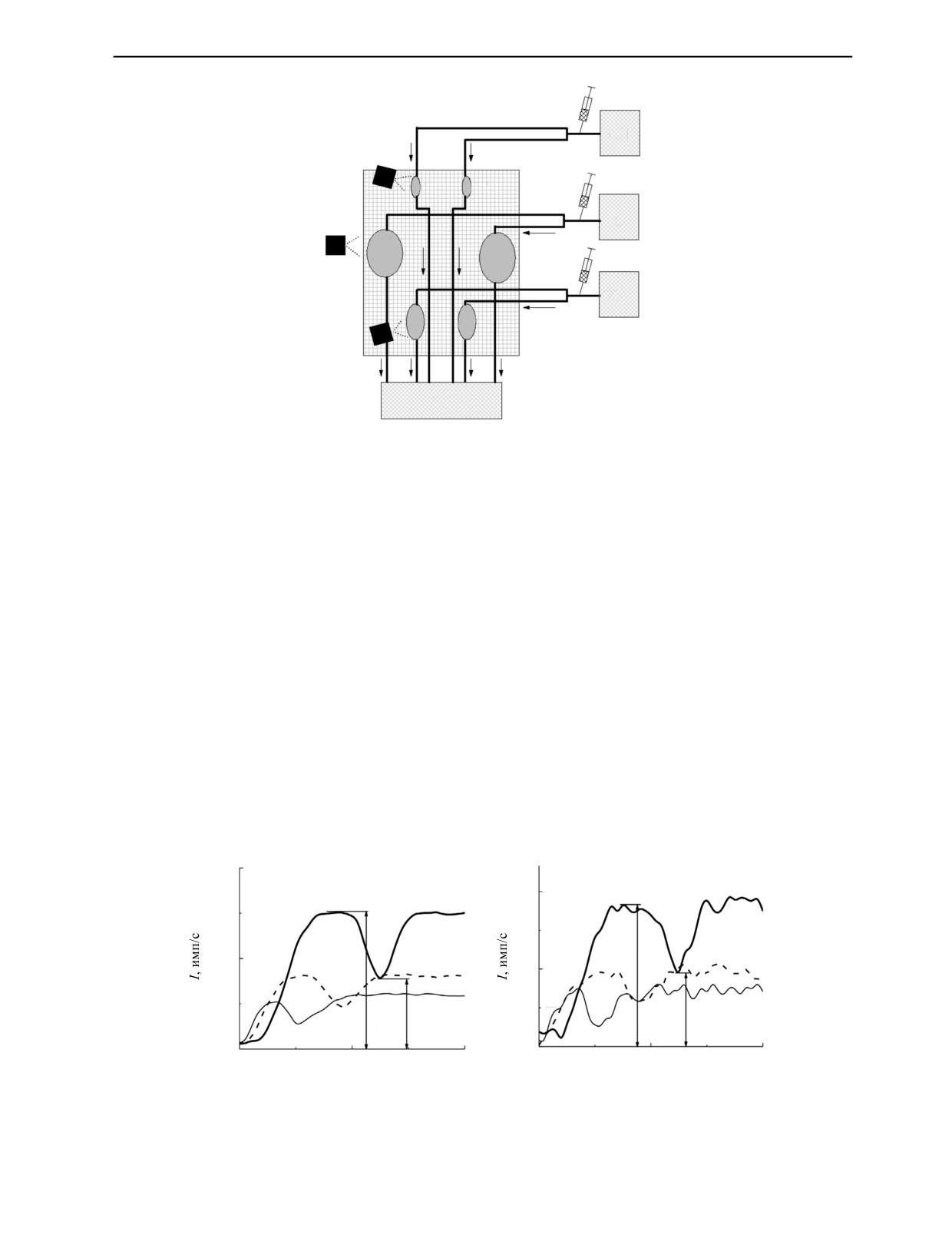
Рис. 2. Блок-схема фантома слезопродуцирующей системы:
1', 1'', 1''' — детекторные модули ПРС: 2', 3', 4', 2'', 3'', 4'' — капсулы, имитирующие железы слезные и слюнные железы;
5, 6, 7 — контейнеры с радиофармпрепаратом; 8 — общий контейнер стока; 9', 9'',9''' — шприцы с дистиллированной водой.
детекторных модулей ПРС вблизи капсул, имитирующих слезные и слюнные железы, фантом
помещался в поле зрения детекторной подсистемы. В капсулы, имитирующие железы, подавался
раствор радиофармпрепарата. В результате, после полного заполнения каждой капсулы-имитатора
активность радиофармпрепарата в каждой из них соответствовала требуемому значению, ранее
рассчитанному для ПРС.
Одной из задач тестирования ПРС и предложенных методик была проверка достаточности рас-
четно-оцененной активности вводимого радиофармпрепарата для проведения радионуклидных
исследований слезных и слюнных желез со стандартным временным окном ∆t = 30 с. Для сравни-
тельных ОФЭКТ-исследований выбиралось стандартное расстояние между детекторной подсисте-
мой и фантомом, равное 50 мм [12]. Для ОФЭКТ-системы был выбран многоканальный низкоэ-
нергетический коллиматор высокого разрешения LEHR, имеющий сонаправленное расположение
цилиндрических каналов и позволяющий получить при указанном расстоянии 50 мм требуемое
значение δ = 10 мм.
На рис. 3 показаны временные зависимости изменения интенсивности излучения в околоуш-
ной (кривая 1) и подчелюстной (кривая 2) слюнных железах, а также в слезной железе (кривая 3).
а
б
1200
300
1
1
600
2
2
150
3
3
I
Imin_1
Imax_1
I
max_1
min_1
00
600
1200
0 0
600
1200
t, c
Рис. 3. Зависимости изменения интенсивности излучения от времени в околоушной слюнной (кривая 1), подчелюстной
слюнной (кривая 2) и слезной (кривая 3) железах при их регистрации с использованием ПРС (а) и ОФЭКТ (б).
Дефектоскопия
№ 10
2021
60
С.В. Панкин, А.И. Сюрдо
Для примера, на кривой 1, связанной с перемещением радиофармпрепарата в слюнной околоуш-
ной железе, определены значения Imin_1 и Imax_1. В результате проведенных с использованием вы-
ражения (1) расчетов были получены средние значения секреторно-экскреторных коэффициентов
СЭК1, СЭК2 и СЭК3 для каждой из вышеуказанных желез, а также значения ошибки их вычисления
относительно истинного соответственно E1, E2, E3. Значения СЭКi и соответствующие значения Ei,
вычисленные из ПРС-данных, не превышают требуемых [17] и составляют: СЭК1 = 48,1±0,5 %,
E1 = 0,02 при P = 0,95, n = 10; СЭК2= 43,1±0,4%, E2 = 0,02 при P = 0,95, n = 10, СЭК3= 44,9±0,5 %,
E3 = 0,02 при P = 0,95, n = 10. Важно, что Ei = 0,02 не превысило максимально допустимый уровень
ошибки определения СЭК Emax = 0,03, а результаты тестирования ПРС подтвердили возможность
точного определения СЭК3, обычно не вычисляемого при проведении исследований с применени-
ем ОФЭКТ из-за малых размеров и слабой функциональной активности слезных желез на фоне
окружающих тканей.
Параметры СЭК, полученные из ОФЭКТ-данных, были определены со значительно большими
погрешностями, и все значения Еi превысили допустимое Eдоп, Еi ≥ Eдоп=0,03: СЭК1 = 46,2±3,2 %,
E1 = 0,07 при P = 0,95, n = 10; СЭК2= 42±4,2 %, E2 = 0,10 при P = 0,95, n = 10; СЭК3= 45,7±6,8 %,
E3 = 0,15 при P = 0,95, n = 10. Одной из основных причин больших погрешностей в ОФЭКТ- ис-
следованиях является недостаточность вводимой активности радиофармпрепарата, которая была
оптимальной для ПРС-опытов.
Таким образом, результаты фантомных экспериментов показали, что при исследованиях слез-
ных и слюнных желез, ПРС имеет в сравнении с ОФЭКТ-системами ряд преимуществ. Наиболее
важным результатом является то, что использование ПРС позволяет не только получать уникаль-
ную информацию, но и снижать дозовую нагрузку, а также себестоимость подобных диагно-
стических процедур. Более того, преимущество в эффективности регистрации ПРС может быть
использовано как для уменьшения активности вводимого радиофармпрепарата, так и для повы-
шения временного разрешения с сохранением требуемой статистики счета. Кроме того, фантом-
ное тестирование с применением ПРС выявило возможность уточненного описания участков
кинетических кривых, соответствующих снижению и увеличению количества радиофармпрепа-
рата в железе. В перспективе, указанное преимущество может быть использовано для разработки
методик углубленной оценки динамики накопления и выведения радиофармпрепарата и харак-
теризации функции слезных и слюнных желез, а также выявления влияния различных внешних
раздражающих факторов.
ВЫВОДЫ
В работе рассмотрена и обоснована логика выбора элементов портативной радиометрической
системы. Благодаря использованию твердотельных фотоумножителей в сочетании со сцинтилля-
ционными кристаллами CsI(Tl), детекторные модули портативной радиометрической системы
обладают уменьшенными размерами и оптимальной эффективностью регистрации гамма-излуче-
ния от источника на основе Tc99m. Выбранная конфигурация позволяет в ряде случаев достигать
улучшенного в сравнении с однофотонными эмиссионными компьютерными томографами диа-
гностического результата. Предложенный алгоритм применения портативной радиометрической
системы для оценки секреторно экскреторного коэффициента слезной железы, разработан с уче-
том ее преимуществ перед применяемыми аналогичными системами. В частности, значение
активности вводимого радиофармпрепарата может быть подобрано таким образом, чтобы дозовая
нагрузка на пациента была минимальна без снижения точности определения секреторно экскре-
торного коэффициента. Важно также отметить, что кроме основного медицинского назначения
разработанная система может найти применение в промышленности для неразрушающего контро-
ля проходимости капиллярных трубок, контроля герметичности клапанов и т.п.
Работа выполнена в рамках государственного задания МИНОБРНАУКИ России
(тема «Экспертиза», № АААА-А19-119062590007-2) при частичной поддержке РФФИ (проект
№ 20-48-660045).
СПИСОК ЛИТЕРАТУРЫ
1. Tsui B.M. Quantitative single-photon emission computed tomography: Basics and clinical considerations
// Semin. Nucl. Med. 1994. No. 24. P. 38—65.
2. Bailey D.L., Humm J.L. Nuclear Medicine Physics / A Handbook for Teachers and Students. Vienna:
International atomic energy agency, 2014. P. 736.
Дефектоскопия
№ 10
2021
Портативная радиометрическая система, ее основные элементы и варианты применения
61
3. Mahadev V. Measurement of Effective Renal Plasma Flow: Evaluation of Clinical Uses in Combination
with Renography / Dynamic Studies with Radioisotopes in Medicine. Proceedings of the Symposium on
Dynamics Studies with Radioisotopes in Clinical Medicine and Research International Atomic Energy Agency.
1971. P. 299—320.
4. Громыко М.В., Крымов А.Л., Игнатьев О.В. Сцинтилляционный β-радиометр: особенности при-
менения и выбор детектора / Физика. Технологии. Инновации. Сборник научных трудов. № 4.
С. 47—53.
5. Prekeges J. Nuclear Medicine Instrumentation. Washington: Jones & Bartlett Publishers,
2012.
P. 550.
6. Патент на полезную модель №185203 Российская Федерация, RU 185203 U1. Детектирующий
модуль гамма-излучения [Текст] / Панкин С.В., Мильман И.И., Сарычев М.Н., Зеленин А.А.; заявитель
и патентообладатель ООО «Стагирит Медицинские Инновации» — № 2018121357; приор. 08.06.2018,
опубл. 26.11.2018.
7. Панкин С.В., Сюрдо А.И. Портативная радиометрическая система для радионуклидной диагно-
стики // АНРИ. 2018. № 2. С. 40—47.
8. Панкин С.В. Портативная радиометрическая система для медицинской радионуклидной диагно-
стики: структура и основные возможности применения // Биомедицинская радиоэлектроника. 2021.
№ 2. С. 47—55.
9. Pankin S.V., Surdo A.I. A portable radiometric system for nuclear medicine // Radiation Measurements.
2019. P. 10—12.
10. Barna S., Garai I. Clinical utility of SPECT/CT and CT-dacryocystography-enhanced dacryoscintigraphy
in the imaging of lacrimal drainage system obstruction // Ann. Nucl. Med. 2019. P. 746—754.
11. Chen S., Wang Y. Virtual Touch Quantification of the Salivary Glands for Diagnosis of Primary Sjögren
Syndrome // J. Ultrasound Med. 2016. P. 2607—2613.
12. Pankin S.V., Surdo A.I. A phantom model of the lacrimal and salivary glandular structures // AIP
Conference Proceedings. 2019. V. 2174. No. 020152.
13. Kumar Sanjay, Mahto Dalgobind. Recent Trends in Industrial and Other Engineering Applications of
Non Destructive Testing: A Review // International Journal of Scientific & Engineering Research. 2013. V. 4.
P. 13.
14. Baldev Raj, Jayakumar T. Practical Non-destructive Testing. Woodhead Publishing, 2002. P. 184.
15. Beck R.N. Collimators for radioisotope scanning systems — medical radioisotope scanning. Vienna:
International Atomic Energy Agency, 1964. P. 211—232.
16. Постановление главного государственного санитарного врача российской федерации от 20 июля
2015 г. N 31: [Об утверждении СанПиН 2.6.1.3288-15 «Гигиенические требования по обеспечению
радиационной безопасности при подготовке и проведении позитронной эмиссионной томографии»].
М: ЦЕНТРМАГ. С. 90.
17. Лишманов Ю.Б., Чернов В.И. Радионуклидная диагностика для практических врачей. Томск:
STT, 2004. C. 294.
Дефектоскопия
№ 10
2021