Общие вопросы дефектоскопии
УДК 620.179:620.179.18
ПОЛУЧЕНИЕ НАНОЧАСТИЦ ГИДРОКСИАПАТИТА ИЗ ЕСТЕСТВЕННЫХ
ЗУБОВ
© 2021 г. Фатемех Мирджалили1,*, Алиреза Навабазам2, Нина Саманизаде1
1Исламский университет Азад, Мейбод, Иран
2Университет медицинских наук Шахида Садуги, Йезд, Иран
*E-mail: Fm.mirjalili@gmail.com
Поступила в редакцию 04.07.2020; после доработки 11.09.2020
Принята к публикации 11.09.2020
Гидроксиапатит — наиболее важный биокерамический материал благодаря своей структуре и химическому составу,
схожий с материалом костей и зубов. В этом исследовании наночастицы гидроксиапатита получали из естественных
зубов в два этапа. Первоначально наночастицы ГА получались из всего зуба, на втором этапе зуб был разделен на дентин
и корень, и наночастицы ГА были получены из обеих частей зубов в отдельности. Сначала только что удаленные чело-
веческие зубы (весь зуб, дентин и корень) были кальцинированы при температуре 850 °C, а затем были исследованы
влияние времени перемешивания, влияние поверхностно-активного вещества и влияние различных температур.
Результаты РД подтвердили наличие фазы гидроксиапатита во всех образцах. Фосфатные связывающие группы PO43-
при 1470 см-1 и 669 см-1 были подтверждены результатами фурье-ИКС FTIR. Результаты АЭСЭМ показали, что наноча-
стицы гидроксиапатита с размерами в диапазоне 29—46 нм при времени перемешивания 36 ч с добавлением ЦТАБ в
качестве поверхностно-активного вещества при 850 °C были получены без агломератов и с хорошей дисперсии.
Ключевые слова: естественные зубы, гидроксиапатит, ЦТАБ, фосфатная полоса.
DOI: 10.31857/S0130308221020068
1. ВВЕДЕНИЕ
На сегодняшний день инженерия биоматериалов представляют собой быстро развивающу-
юся междисциплинарную область на стыке инженерии, науки и здравоохранения; ее результа-
ты в отношении вопросов, связанных со здоровьем человека, также очевидны и признаны во
всем мире. Основная доля рынка среди всех продуктов из биоматериалов принадлежит орто-
педическим биоматериалам [1], таким как материалы на основе гидроксиапатита (ГА). Имея
химическую формулу Ca10(PO4)6(OH)2, ГА является основным минеральным компонентом
костей [2] и зубов [3]. Таким образом, ГА очень часто используется в материалах имплантатов,
особенно в ортопедической хирургии костей [2] и имплантации других твердых тканей [3],
например, в стоматологической и эстетической хирургии. ГА — наиболее часто используемый
биоактивный материал для создания биомиметических имплантатов нового поколения, что
указывает на хорошую биоактивность и биосовместимость [4, 5]. Потребность в ГА имеет
место из-за замены Ca2+, а также из-за того, что он может быть использован в качестве мате-
риала для заживления разрывов кости в ортопедии [7, 8]. Аллотрансплантаты (это импланта-
ты, взятые из организма особи и трансплантированные особи того же вида [9]) и ксенотран-
сплантаты (имплантаты, пересаживаемые от одной особи к особи другого вида, например,
бычья кость) также являются альтернативой, но эти трансплантаты могут сопровождаться
различными потенциальными инфекциями [10]. С другой стороны, синтезированный ГА явля-
ются еще одной возможной основой, но они не содержат микроэлементов (например, строн-
ция), которые имеют решающее значение. В настоящее время для этой цели используются
природные материалы для создания фосфатов кальция с помощью синтеза, включая высоко-
температурное прокаливание [10] или путем применения различных процессов химического
превращения карбоната кальция [11].
ГА-биокерамика может быть получена синтетическим или естественным путем.
Синтезированные ГА заслуживают доверия, но их производство обычно сложное, требует много
времени и затратно. Натуральная биокерамика, хоть и имеет естественное происхождение, воз-
можно, может являться переносчиком некоторых нежелательных серьезных заболеваний, таких
как вирус иммунодефицита человека (ВИЧ) или губчатая энцефалопатия крупного рогатого скота
(ГЭКРС) [10, 12].
Несмотря на то, что ГА считается стабильным в биологических жидкостях, поскольку он
демонстрирует самую низкую растворимость из фосфатно-кальциевых материалов в очень узком
диапазоне pH > 7,3, многочисленные исследования подтвердили микроструктурную деградацию
52
Фатемех Мирджалили, Алиреза Навабазам, Нина Саманизаде
материалов in vitro и in vivo. Были описаны различные случаи, при которых ГА подвергается дегра-
дации. Также бывает, что образуется мало механических взаимосвязей биологических тканей с
имплантированным ГА [13].
Аналогичным образом механические свойства, такие как межфазная прочность кости и ГА и
вязкость разрушения самого ГA, могут быть резко уменьшены. В некоторых случаях упоминалось,
что частицы, отделившиеся от имплантатов ГА, могут вызывать локальное воспаление или трение
третьего тела [14].
Следовательно, требуется биокерамика на основе ГА с лучшей устойчивостью к расслоению /
деградации. С этой точки зрения, интерес вызвал фосфат кальция, содержащиеся в человеческих
зубах, которые очень стабильны в биологической среде. В течение многих лет получаемые био-
логическим путем фосфаты кальция вызывали интерес из-за их низкой стоимости производства и
состава аналогичного человеческой кости. В частности, несколько видов фосфатов кальция, полу-
ченных непосредственно из бычьей кости, были применены в качестве материалов для замены
костного трансплантата [15].
В последние годы ГА, получаемый из зубов, рассматривается как новый биоматериал. Dong
и др. сообщили о естественном получении ГА из зубов человека и доказали улучшение механи-
ческих свойств ГА, полученного из зубов, при добавлении биостекла [16]. Более того, результа-
ты исследования in vivo, проведенного Ola et al., указывали на потенциал ГА, полученного из
зубов, в качестве безопасного биоматериала для костной трансплантации [17,18].
Данное исследование направлено на синтез и определение характеристик гидроксиапатита из
недавно удаленных человеческих зубов (целые зубы, дентин и корень). Новизной этого исследова-
ния являются изучение влияния времени перемешивания, поверхностно-активного вещества и
различных температур, а также изучение морфологических и микроструктурных свойств наноча-
стиц ГА из всего зуба, дентина и корня.
2. МАТЕРИАЛЫ И МЕТОДЫ
Зубы в количестве приблизительно 100 штук поливали водой, используя при этом щетку, далее
их сушили при комнатной температуре. После этого зубы прокаливали при 850 °C в течение 1 ч со
скоростью нагрева 5 °C/мин на воздухе. Было обнаружено, что при этой температуре органические
компоненты полностью выгорают, и только неорганическая фаза фосфата кальция из дентина и
эмалевых материалов остается. На этом этапе мы не отделяли дентин от эмали (как разные источ-
ники фосфата кальция). Затем прокаленные зубы были физически измельчены, помещены в этанол
и затем размолоты в шаровой мельнице в течение 12 ч. Затем 2 г измельченного в шаровой мель-
нице зубного порошка в 100 мл раствора этанола в течение 30 мин интенсивно перемешивали при
25 °C (первый раствор). Готовился раствор 1,43 г Ca(NO3)24H2O в 50 см3 этанола и медленно
добавляли каплями к первому раствору, чтобы получить соотношение Ca/P равному 1,67. Раствор
аммиака использовался в качестве агента для доведения pH до 11. Раствор перемешивали в тече-
ние 24 ч, сушили при 110 °C в течение 8 ч и спекали при 850 °C в течение 2 ч. На втором этапе,
после приготовления второго раствора, его перемешивали в течение разного времени (2,12, 24, 36)
при pH 11 и сушили в печи при 110 °C в течение 24 ч, прокаливали при 850 °C в течение 2 ч.
В следующей части для улучшения свойств был введено поверхностно-активное вещество (ЦТАБ,
Merck, Германия). После подготовки первого и второго раствора ЦТАБ в качестве поверхностно-
активного вещества добавляли ко второму раствору и медленно добавляли по каплям к первому
раствору. Конечный раствор перемешивали в течение 36 ч. После фильтрации материалы промы-
вали дистиллированной водой и сушили при 110 °C в течение 24 ч и, наконец, прокаливали при
850 °C в течение 2 ч. Таким образом, проверено влияние различных температур (750, 850, 1050 °C)
на получение наночастиц ГА.
На втором этапе дентин очень легко отделялся от корня зуба из-за значительной разницы в
содержании воды. Полученный дентин измельчали, а порошок просеивали. Составная часть содер-
жала частицы размером от 100 до 150 мм. Порошки выдерживали пару дней в атмосферных усло-
виях для поглощения влаги. Дентин прокаливали при 850 ° C в течение 1 ч со скоростью нагрева
5 C/мин на воздухе и измельчали вместе, помещали в этанол и затем измельчали в шаровой мель-
нице в течение 12 ч. Затем 2 г порошка дентина, измельченного на шаровой мельнице, смешивали
с 100 мл раствора этанола в течение 30 мин и перемешивали при 25 ° C (первый раствор). Готовили
раствор 1,43 г Ca (NO3) 2 · 4H2O в 50 см3 этанола (раствор 2), чтобы получить соотношение Ca/P
1,67. Раствор аммиака был использован в качестве агента для доведения pH до 11. После приготов-
ления двух растворов ЦТАБ в качестве поверхностно-активного вещества добавляли ко второму
Дефектоскопия
№ 2
2021
Получение наночастиц гидроксиапатита из естественных зубов
53
раствору и по каплям добавляли первый раствор. Конечный раствор перемешивали в течение 36 ч,
фильтровали и сушили при 110 ° C в течение 24 ч и прокаливали при 850 ° C за 2 ч.
В последней части корень зуба прокаливали при 800 °C в течение 1 ч со скоростью нагрева
5 °C/мин на воздухе. Затем 2 г порошка корня измельчали на шариковой мельнице в 100 мл рас-
твора этанола и перемешивали в течение 30 мин при 25 °C. После приготовления раствора к
нему добавляли ЦТАБ в качестве поверхностно-активного вещества и перемешивали в течение
36 ч, фильтровали, сушили при 110 °C в течение 24 ч и прокаливали при 850 °C в течение 2 ч.
Определение фаз проводилось методом рентгеновской дифракции (РД) с помощью PW1800,
компании Philips, используя излучение Cu Kα, пропускаемое через никелевый фильтр, в диапа-
зоне углов 2θ = 10—60 ° со скоростью сканирования 5° в минуту. Инфракрасный спектрометр с
преобразованием Фурье (фурье-ИКС) от Perkin Elmer Spectrum серии 100 использовали с уни-
версальным методом нарушенного полного внутреннего отражения (НПВО). Микроструктуры
порошков идентифицировались методом автоэмиссионной сканирующей электронной микро-
скопии (АЭСЭМ) (Philips—Zeiss—Германия).
3. РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
3.1. Результаты РД для нанокристаллического гидроксиапатита из природных зубов
Пик РД для порошка гидроксиапатита проиллюстрирован на рис. 1. Прямая базовая линия и
острые пики дифрактограммы на рис. 1 подтверждают, что образцы были хорошо кристаллизова-
ны. РД-диаграмма показывает, что образцы, в основном, состоят из ГА в соответствии со стандарт-
ным значением (JCPDS09-432). С другой стороны, в образцах присутствовала другая кристалли-
ческая фаза трикальцийфосфата (ТКФ) (JCPDS09-169).
100
Гидроксиапатит
64
Витлокит
36
16
4
0
0
10
20
30
40
50
2Θ, град
Рис. 1. Рентгеновская дифрактограмма гидроксиапатита, синтезированного из естественных зубов.
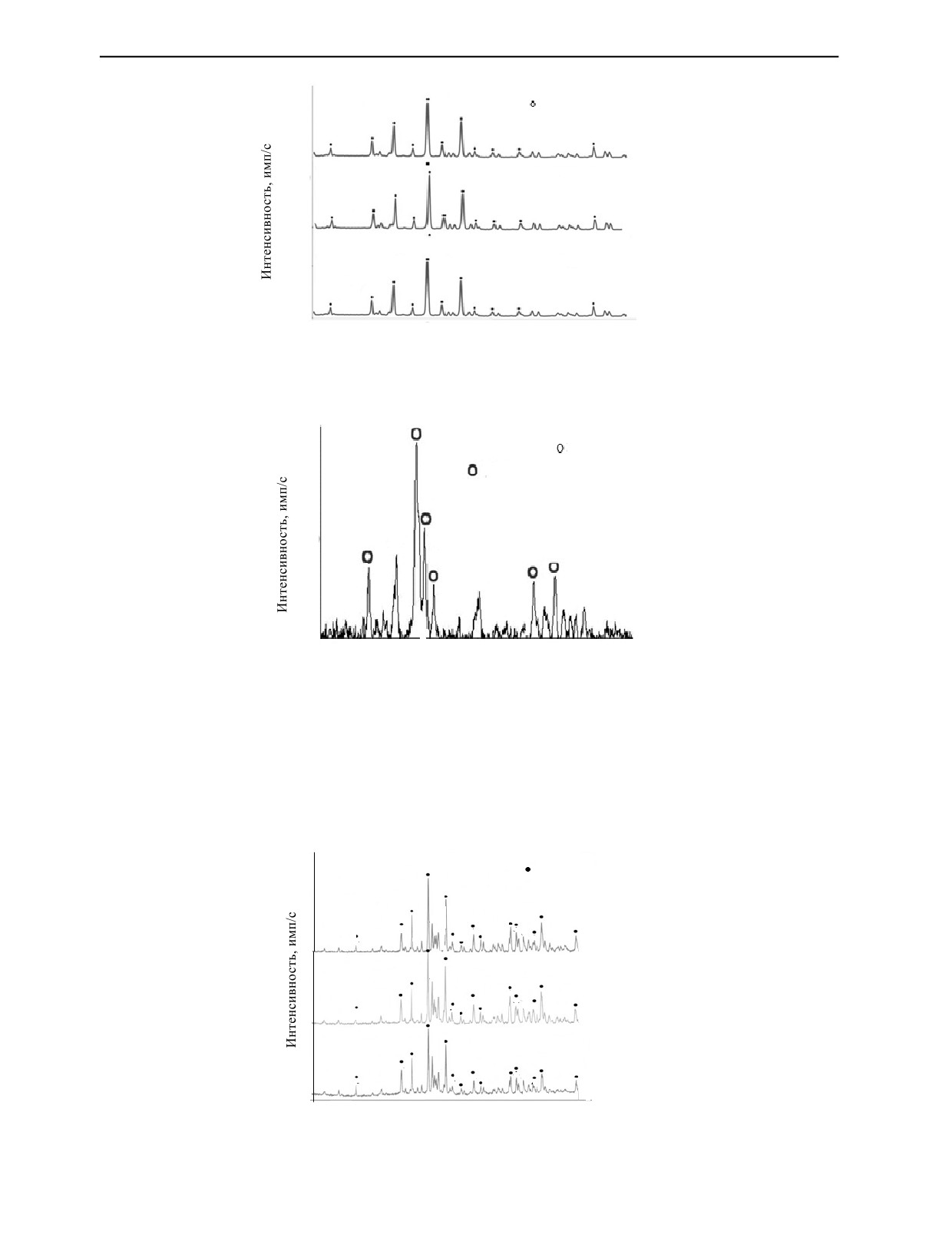
Дифрактограммы гидроксиапатита, синтезированного из естественных зубов при разном вре-
мени перемешивания 12, 24 и 36 ч, показаны на рис. 2. Острые пики на дифрактограммах при
разном времени перемешивания (12, 24, 36) соответствуют фазе ГА как основной фазе, согласован-
ной с картой Объединенного комитета по порошковым дифракционным стандартам (JCPDS) PDF
№ JCPDS09-0432.
На рис. 3 показана дифрактограмма фторапатита, синтезированного из естественных зубов с
использованием ЦТАБ в качестве поверхностно-активного вещества. Пики на дифрактограмме
показали, что основными фазами во всех образцах были фторапатиты согласно карте JCPDS PDF
№ 00-003-0736. В случае гидроксиапатита возможно замещение такими элементами, как K, Na,
Mg, Pb, Cd, Ba и Sr вместо кальция, B, Cr, Ge, Si, S, As и CO3 вместо фосфора и Br, Cl, F , BO2, CO3
вместо гидроксильной группы [19—21]. Вступающие группы могут вводиться в систему произ-
вольно или случайно во время обработки ГА [22—25]. Вступающие группы, которые случайно
попадают в систему, включают фторид, хлор, магний, углерод, стронций, алюминий, лантан и
железо. Когда фтор, введенный в структуру апатита из-за его более высокой электроотрицатель-
Дефектоскопия
№ 2
2021
54
Фатемех Мирджалили, Алиреза Навабазам, Нина Саманизаде
450
12 ч
Гидроксиапатит
400
350
300
250
24 ч
200
150
100
36 ч
50
0
20
25
30
35
40
45
50
2Θ, град
Рис. 2. Рентгеновская дифрактограмма гидроксиапатита, синтезированного из естественных зубов при разном времени
перемешивания.
100
Фторапатит
64
36
16
4
0
20
25
30
35
40
45
50
55
60
2Θ, град
Рис. 3. Рентгеновская дифрактограмма фторапатита, синтезированного из естественных зубов с использованием поверх-
ностно-активного вещества.
ности, находится ближе к сторонам параллелограмма покрытого кальцием треугольника, это соз-
дает более прочную связь и, следовательно, более стабильную структуру. В этом случае его хими-
ческая стабильность повышается, а растворимость понижается [23, 26].
Дифрактограммы фторапатита, синтезированного из естественных зубов с использованием ЦТАБ
в качестве поверхностно-активного вещества при различных температурах показаны на рис. 4.
Фторапатит
700 °С
850 °С
1050 °С
10
20
30
40
50
60
2Θ, град
Рис. 4. Дифрактограммы фторапатита, синтезированного из естественных зубов при различных температурах.
Дефектоскопия
№ 2
2021
Получение наночастиц гидроксиапатита из естественных зубов
55
Фторапатит
10
30
50
70
2Θ, град
Рис. 5. Рентгеновская дифрактограмма фторапатита, синтезированного из дентина.
Дифрактограммы показывают, что фазы всех образцов при разных температурах были фазами
фторапатита. Кроме того, между ними не наблюдали значительной разницы, что указывает на то,
что увеличение температуры не влияет на фазовую структуру конечного образца. На втором этапе
дентин очень легко отделялся от корня зуба и проверялся отдельно. Пик дифрактограммы порош-
ка дентина с поверхностно-активным веществом после 36-часового перемешивания проиллюстри-
рован на рис. 5. На дифрактограмме на рис. 5 показано, что образцы в основном представляют
собой ГА по JCPDS No. 00-003-0736.
Фторапатит
20
35
50
65
2Θ, град
Рис. 6. Рентгеновская дифрактограмма фторапатита, синтезированного из корня зуба.
На рис. 6 показана дифрактограмма корня зуба. На дифрактограмме показано, что доминирую-
щей фазой были фазы ГА согласно карте JCPDS PDF No. 00-003-0736.
3.2. Результаты фурье-ИКС для нанокристаллического порошка гидроксиапатита
из естественных зубов
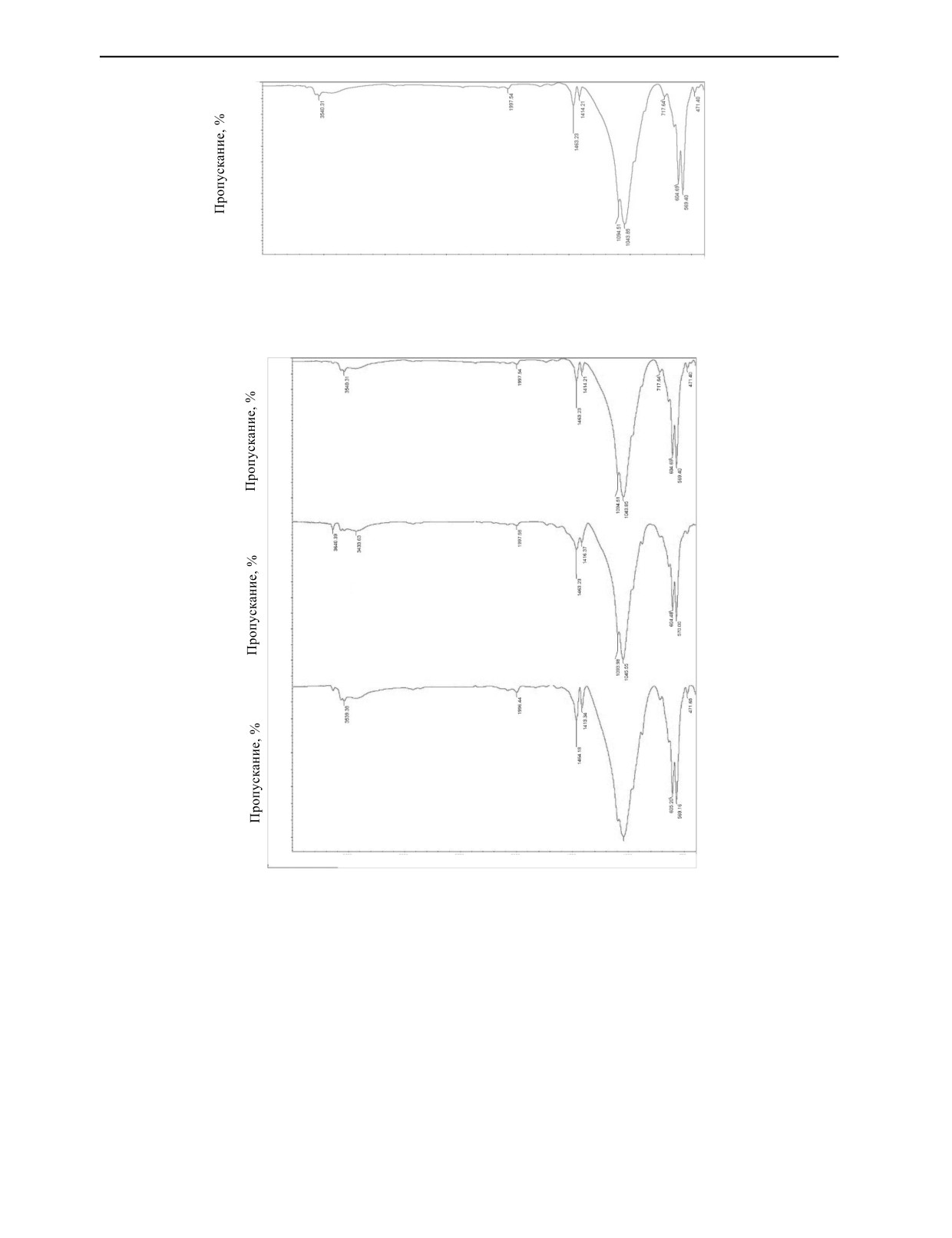
Фурье-ИКС-спектры гидроксиапатита, синтезированного из естественных зубов, показыва-
ющие поглощение при 400—4000 см-1, приведены на рис. 7. Фурье-ИКС показывает наличие
фосфатных (PO43-) связей при 471 и 604 см-1 и 717—730 см-1, связанных с P2O72, и связей HPO42-
при 599 см-1, которые связаны с ГА [25—27]. Связи гидроксильной группы (ОН) при 3500 см-1
и полоса P—H при 1997 см-1 относятся к ГА [28—30].
Фурье-ИКС-спектры гидроксиапатита, синтезированного из естественных зубов при разном
времени перемешивания показаны на рис. 8.
Полосы поглощения в областях примерно 599 см-1 связаны с деформациями кристаллической
решетки гидроксиапатита. Пики при волновых числах 604 и 3433 см-1 являются следствием рас-
тяжения гидроксильных ионов в кристаллической гидроксиапатитовой решетке [31—33]. Пики
при 1043 и 1084 см-1 являются следствием растяжения фосфатной группы в кристаллической
гидроксиапатитовой решетке [34—36].
Дефектоскопия
№ 2
2021
56
Фатемех Мирджалили, Алиреза Навабазам, Нина Саманизаде
90
80
70
60
50
40
30
20
10
0
3500
3000
2500
2000
1500
1000
500
Волновое число, см-1
Рис. 7. Кривая фурье-ИКС гидроксиапатита, синтезированного из естественных зубов.
90
80
70
60
12 ч
50
40
30
20
10
0
90
80
70
60
24 ч
50
40
30
20
10
0
100
90
80
70
60
36 ч
50
40
30
20
10
0
3500
3000
2500
2000
1500
1000
500
Волновое число, см-1
Рис. 8. Фурье-ИКС-кривые гидроксиапатита, синтезированного из естественных зубов при разном времени перемеши-
вания.
Кроме того, между ними не наблюдалось значительной разницы, это указывает на то, что раз-
личное время перемешивания не влияет на структуру связей в конечном образце.
На рис.
9 представлен фурье-ИКС-спектр синтезированных наночастиц фторапатита.
Соответствующий фурье-ИКС-спектр содержит все колебания от v4 до v1, относящиеся к фосфат-
ной группе в структуре апатита [16]. Также были два связанных пика 564 и 603 см-1, принадлежа-
щих к группе колебаний v4 [17]. Представленный пик в 741 см-1 представляет собой гидроксиль-
ную цепочку, которая была обнаружена в этой структуре, насыщенной фтором [21]. Пики с волно-
выми числами 3700 см-1 были связаны с O—H-группами. Центральный пик 873 см-1 вместе с
полосой 1640 см-1 с краями на 1413 и 1465 см-1 были отнесены к структурным карбонатным
группам (CO3 (2-)) [19]. Присутствие этой группы отражает биодоступность фторапатита.
Дефектоскопия
№ 2
2021
Получение наночастиц гидроксиапатита из естественных зубов
57
Полоса O-H
Полоса O-H
3900
3400
2900
2400
1900
1400
900
400
Волновое число, см-1
Рис. 9. Фурье-ИКС-кривые фторапатита, синтезированного из естественных зубов с использованием поверхностно-
активного вещества.
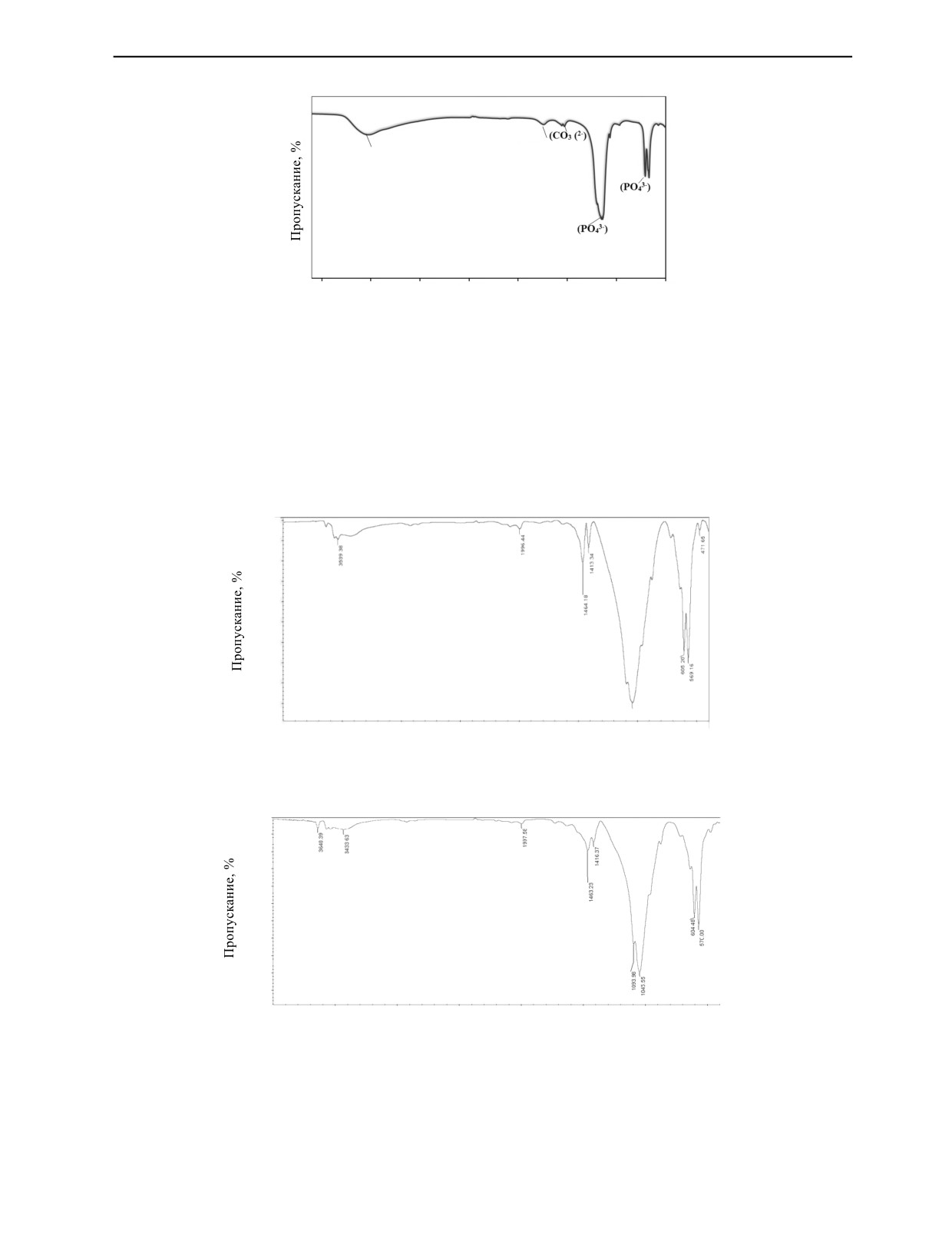
Фурье-ИКС-спектры фторапатита, синтезированного из дентина и корня зуба, показывающие
поглощение при 400—4000 см-1, показаны на рис. 10 и 11. Колебания v4-v1относятся с фосфатной
группой в структуре апатита [16]. Фурье-ИКС-спектры показывают наличие фосфатных (PO43-)
связей при 570 и 604 см-1, связанных с решеткой фторапатита [35]. Пики с волновыми числами
3440, 3640 см-1 были связаны с O—H-группами [34, 36].
100
90
80
70
60
50
40
30
20
10
3500
3000
2500
2000
1500
1000
500
Волновое число, см-1
Рис. 10. Фурье-ИКС-кривые фторапатита, синтезированного из дентина.
100
90
80
70
60
50
40
30
20
10
0
3500
3000
2500
2000
1500
1000
500
Волновое число, см-1
Рис. 11. Фурье-ИКС-кривые фторапатита, синтезированного из корня зуба.
Представленный пик при 750 см-1 является гидроксильной цепочкой, обнаруженной в этой
структуре, насыщенной фтором [22].
Дефектоскопия
№ 2
2021
58
Фатемех Мирджалили, Алиреза Навабазам, Нина Саманизаде
3.3. Морфологические свойства нанокристаллического гидроксиапатита, синтезированного
из естественных зубов
На рис. 12а—в показаны АЭСЭМ-изображения гидроксиапатита, синтезированного из есте-
ственных зубов с использованием ЦТАБ в качестве поверхностно-активного вещества и времени
перемешивания 36 ч после прокаливания при различных температурах.
а
б
в
Рис. 12. АЭСЭМ-изображение образцов: 750 °C (a); 850 °C (б); 1050°C (в).
Как показывают изображения, во всех образцах наблюдалась хорошая дисперсия. У образца на
рис. 12a размеры частиц лежали в диапазоне 12—42 нм, частицы имели правильную форму и
образовывали агломераты, а у образца на рис. 12б диапазон размеров частиц был в пределах
20—50 нм, частицы имели правильную геометрическую форму без образования агломератов, и у
образца на рис. 12в размеры частиц были примерно 30—60 нм, кластер частицы обладал хорошей
дисперсией и малым количеством агломератов. Следовательно, при повышением температуры раз-
мер частиц увеличивался. Синтезированный порошок с агломерациями препятствовал росту зерна
частиц при высоких температурах. На поверхности системы частиц можно было увидеть очень
мелкозернистые сферические частицы. Следовательно, был сделан вывод, что лучшим был обра-
зец на рис. 12б с мелкими частицами сферической формы и без агломератов.
АЭСЭМ-изображения дентина и корня после прокаливания при 850 °C показаны на рис. 13.
а
б
Рис. 13. АЭСЭМ-изображение образцов из дентина (а); из корня (б).
Что касается рис. 13, диапазон размеров частиц дентина составлял около 19—35 нм, частицы
имели сферическую форму, хорошую дисперсию и малую степень агломерации. Более того, в
образце из корня форма частиц была полностью сферической без агломератов, диапазон размеров
частиц находился в пределах 29—46 нм.
Дефектоскопия
№ 2
2021
Получение наночастиц гидроксиапатита из естественных зубов
59
4. ЗАКЛЮЧЕНИЕ
В этом исследовании наночастицы гидроксиапатита были подготовлены в два этапа из есте-
ственных зубов. На первом этапе использовались зубы полностью, а на втором этапе для приготов-
ления наночастиц гидроксиапатита дентин и корень использовались по отдельности. Затем было
исследовано влияние времени перемешивания, поверхностно-активных веществ и температуры на
полученные наночастиц гидроксиапатита. Рентгеновские дифрактограммы всех образцов показа-
ли, что образцы в основном состоят из фазы ГА в соответствии со стандартным значением
(JCPDS09-432), а с увеличением времени перемешивания (12, 24, 36 ч между ними не наблюдалось
значительной разницы в содержании фазы ГА. Это указывает на то, что время перемешивания не
влияет на кристаллическую структуру конечного образца. Характеристические пики на дифракто-
грамме образца с ЦТАБ в качестве поверхностно-активного вещества показали, что основными
фазами была фаза фторапатита (по карте JCPDS PDF 00-003-0736) с гексагональной кристалличе-
ской структурой. Также в результате фурье-ИКС полосы с волновым числом 669 и 1470 см-1 при-
надлежали к группе фосфатных полос (PO3-).
На основе АЭСЭМ-изображений был сделан вывод, что лучший образец с мелкими частицами
и сферической формой без агломератов был получен при времени перемешивания 36 ч с ЦТАБ в
качестве поверхностно-активного вещества при 850 °C. Авторы заявляют об отсутствии конфлик-
та интересов.
СПИСОК ЛИТЕРАТУРЫ
1. Gunduz O., Sahin Y.M., Agathopoulos S., Ben-Nissan B., Oktar. F. A New Method for Fabrication of
Nano hydroxyapatite and TCP from the Sea Snail Cerithium Vulgatum // Journal of Nanomaterials. 2014.
V. 2014. P. 1—6.
2. Jamiu K.O., Danyuo Y., Abdulazeez Baruwa D., Akeem A.A. Synthesis and characterization of
hydroxyapatite from bovine bone for production of dental implants // Journal of Applied Biomaterials &
Functional Materials. 2019. V. 1. P. 1—7.
3. Ivanova T.I., Frank-Kamenetskaya O.V., Kol’tsov A.B., Ugolkov V.L. Crystal Structure of Calcium-
Deficient Carbonated Hydroxyapatite, Thermal Decomposition // Journal of Solid State Chemistry. 2001.
V. 160. P. 340—349.
4. Kalita S.J., Bhardwaj A., Bhatt H.A. Nanocrystalline Calcium Phosphate Ceramics in Biomedical
Engineering // Materials Science and Engineering C. 2007. V. 27. P. 441—449.
5. Murugan R., Ramakrishna S. Development of Nanocomposites for Bone Grafting // Composites Science
and Technology. 2005. V. 65. P. 2385—2406.
6. Riman R.E., Suchanek W.L., Byrappa K., Chen C.W., Oakes C. Solution Synthesis of Hydroxyapatite
Designer Particulates // Solid State Ionics. 2002. V. 151. P. 393—402.
7. Benaqqa C., Chevalier J., Saa daoui M., Fantozzi G. Slow Crack Growth Behaviour of Hydroxyapatite
Ceramics // Biomaterials. 2005. V. 26. P. 6106—6112.
8. Orlovskii V.P., Komlev V.S., Barinov S.M. Hydroxyapatite and Hydroxyapatite-Based Ceramics //
Inorganic Materials. 2002. V. 38. P. 973—984.
9. Pasteris J.D. Lack of OH in Nanocrystalline Apatite as a Function of Atomic Order: Implications for
Bone and Biomaterials // Biomaterials. 2004. V. 25. P. 229—38.
10. Dorozhkina E.I., Dorozhkina S.V. Mechanism of Solid-State Transformation of a Calicium-Deficient
Hydroxyapatite (CDHA) into Biphasic Calcium Phosphate (BCP) at Elevated Temperatures // Chem. Mater.
2002. V. 14. P. 4267—4272.
11. Vallet-Regi M., Gonza´lez-Calbet J.M. Calcium Phosphates as Substitution of Bone Tissues // Progress
in Solid State Chemistry. 2004. V. 32. P. 1—31.
12. Sugiyama S., Ichii T., Matsumoto H., Hayashi H. Effect of Calcination and Sieving of Calcium
Hydroxyapatite on Ion-Exchangeability with Lead Cation in the Presence and Absence of HCl // Advances in
Environmental Research. 2002. V. 62. P. 285—289.
13. Zhang H.G., Zhu Q., Wang Y. Morphologically Controlled Synthesis of Hydroxyapatite with Partial
Substitution of Fluorine // Chem. Mater. 2005. V. 17. P. 5824—5830.
14. Kannan S., Rebelo A., Ferreira J.M.F. Novel Synthesis and Structural Characterization of Fluorine
and Chlorine Co-Substituted Hydroxyapatites // Journal of Inorganic Biochemistry. 2006. V.
100.
P. 1692—1697.
15. Medvecky L., Stulajterov´a R., Parila´k L., Trpcˇevska J., Barinov S.M. Influence of Manganese on
Stability and Particle Growth of Hydroxyapatite in Simulated Body Fluid // Colloids and Surfaces A:
Physicochem. Eng. Aspects. 2006. V. 281. P. 221—229.
16. Dong S.S., Jong K.K. Dissolution of Human Teeth-Derived Hydroxyapatite // Annals of Biomedical
Engineering. 2008. V. 36. No. 1. P. 132—140.
Дефектоскопия
№ 2
2021
60
Фатемех Мирджалили, Алиреза Навабазам, Нина Саманизаде
17. Ola Saleh M. Preparation of Hydroxyapitate from Natural Resources Literature Review // GSJ. 2018.
V. 6. P. 46—52.
18. Kim T.G., Park B. Synthesis and Growth Mechanisms of One-Dimensional Strontium Hydroxyapatite
Nanostructures // Inorg. Chem. 2005. V. 44. P. 9895—9901.
19. Bhatnagar V.M. Refinement of the Synthetic Hydroxyapatite Cell Parameters // Contr. Mineral. and
Petrol.1969. V. 22. P. 375—378.
20. Aoki H., Kato K., Ogiso M., Tabata T. Studies on the Application of Apatite to Dental Materials //
J. Dent. Eng. 1977. V. 18. P. 151—156.
21. Monroe A.E., Ward V., Ward D.B., McMullen J. New Calcium Phosphate Ceramic Material for Bone
and Tooth Implants // J. Dent. Res. 1971.V. 50. P. 860—865.
22. Manafi S.A., Mirjalili F., Reshadi R. Synthesis and evaluation of the bioactivity of fluorapatite-45s5
bioactive glass nanocomposite // Progress in Biomaterials. 2019. V. 8. P. 77—89.
23. Zhang H.G., Zhu Q. Surfactant-Assited Preparation of Fluoride-Substituted Hydroxyapatite Nanorods
// Mater. Letter. 2005. V. 59. P. 3054—3058.
24. Jones F.H. Teeth and Bones: Application of Surface Science to Dental Materials and Related
Biomaterials // Surface science reports. 2001. V. 42. P. 75—205.
25. Jarcho M., Kay J.F., Gumaer K.I., Doremus R.H., Drobeck H.P. Tissue, Cellular, and Subcellular
Events at a Bone-Ceramic Hydroxyapatite Interface // J. Bioeng. 1977. V. 1. P. 79—92.
26. Wang Y., Zhang S., Wei K., Zhao N., Chen J., Wang X. Hydrothermal Synthesis of Hydroxyapatite
Nanopowders Using Cationic Surfactant as a Template // Materials Letters. 2006. V. 6. P. 1486—1487.
27. Sadasivan S., Khushalani D., Mann S. Synthesis of Calcium Phosphate Nanofilaments in Reverse
Micelles // Chem. Mater. 2005. V. 17. P. 2765—2770.
28. Prelot B., Zemb T. Calcium Phosphate Precipitation in Catanionic Templates // Mater. Sci. Eng. C.
2005. V. 25. P. 553—559.
29. Wei K., Wang Y., Lai C., Ning C., Wu D., Wu G., Zhao N., Chen X., Ye J. Synthesis and Characterization
of Hydroxyapatite Nanobelts and Nanoparticles // Materials Letters. 2005. V. 59. P. 220—225.
30. Zhang Y., Zhou L., Li D., Xue N., Xu X., Li J. Oriented Nano-Structured Hydroxyapatite from the
Template // Chemical Physics Letters. 2003. V. 376. P. 493—497.
31. Zhang F., Zhou Z., Yang S., Mao L., Chen H., Yu X. Hydrothermal Synthesis of Hydroxyapatite
Nanorods in the Presence of Anionic Starburst Dendrimer // Materials Letters. 2005. V. 59. P. 1422—1425.
32. Lin K., Chang J., Cheng R., Ruan M. Hydrothermal Microemulsion Synthesis of Stoichiometric Single
Crystal Hydroxyapatite Nanorods with Mono-Dispersion and Narrow-Size Distribution // Materials Letters.
2007. V. 61. P. 1683—1687.
33. Liu Y., Hou D., Wang G. A Simple Wet Chemical Synthesis and Characterization of Hydroxyapatite
Nanorods // Materials Chemistry and Physics. 2004. V. 86. P. 69—73.
34. Cao M., Wang Y., Guo C., Qi Y., Hu C. Preparation of Ultrahigh-Aspect-Ratio Hydroxyapatite
Nanofibers in Reverse Micelles under Hydrothermal Conditions // Langmuir. 2004. V. 20. P. 4784—4786.
35. Pang Y.X., Bao X. Influence of Temperature, Ripening Time and Calcination on the Morphology and
Crystallinity of Hydroxyapatite Nanoparticles // Journal of the European Ceramic Society. 2003. V. 23.
P. 1697—1704.
36. Ye W., Wang X.X. Ribbon-like and Rod-Like Hydroxyapatite Crystals Deposited on Titanium Surface
with Electrochemical Method // Materials Letters. 2007. V. 17. P. 405—409.
37. Nilesh R., Rutika B., Sudhindra B., Nilima T. Comparative evaluation of Nano-Hydroxyapatite
preparation and Calcium Sucrose Phosphate on microhardness of deciduous teeth after iron drop exposure —
An in-vitro study // J. Clin. Exp. Dent. 2017. V. 9 (4). P. 579—583.
38. Suat O., Mehmet Y. Studies on Characterization of Bovine Hydroxyapatite/CaTiO3 Biocomposites //
Advances in Materials Science and Engineering. 2016. V. 2016. P. 1—8.
Дефектоскопия
№ 2
2021