Озеро Кулундинское расположено на юге Западной Сибири в области замкнутого стока Обь-Иртышского междуречья. Это крупнейший водоем Кулундинской равнины и Алтайского края. Площадь его акватории в разные годы и сезоны колеблется от 720 до 728 км2, средняя глубина 2.6–3.0 м, максимальная глубина 3.5–4.0 м, озерная котловина характеризуется как округлая, немного вытянутая, протяженность около 35 км, берега пологие, местами с солонцово-солончаковыми комплексами. Озеро бессточное, в него впадают реки Кулунда и Суетка. Вода горько-соленая, величина минерализации меняется от 40 до 131 г/л [1]. Гидрологические, гидрохимические и гидробиологические наблюдения Росгидромета на озере не проводятся.
В настоящее время озеро Кулундинское как и ряд других гипергалинных озер этого региона, имеет важное хозяйственное значение для ведения интенсивной добычи водных биологических ресурсов – цист жаброногого рачка артемии, которые используются как стартовый корм в аквакультуре и ценное сырье для производства фармацевтических и косметических препаратов [2, 3]. Однако продуктивность артемии и добыча (вылов) биоресурсов на гипергалинных озерах этого региона подвержены существенным колебаниям и плохо прогнозируются [4].
Водные сообщества наиболее быстро реагируют на изменения экологических факторов, воздействующих на озера. При этом время реакции сообщества определяется характерной продолжительностью жизненных циклов входящих в сообщество видов. Для планктонных беспозвоночных юга Западно-Сибирской равнины жизненные циклы обычно составляют от нескольких дней до нескольких месяцев. Несмотря на довольно длительный период изучения зоопланктона озеро Кулундинское [5–7], зависимости его динамики от факторов окружающей среды ранее были изучены в основном на уровне феноменологического анализа. Поэтому целью настоящего исследования является изучение состава, структуры и динамики зоопланктона озера под влиянием природных факторов с использованием современных методов математической статистики.
МАТЕРИАЛ И МЕТОДЫ
Натурные данные получены в ходе комплексных лимнологических и гидробиологических исследований озера Кулундинское в 2017–2021 гг. В течение этих лет пробы отбирали ежемесячно по единой сетке из 48 станций (рис. 1). Отбор и обработку проб зоопланктона проводили по стандартным гидробиологическим методикам [8, 9]. Пробы отбирали ежемесячно в период с апреля (или мая) по октябрь с помощью малой планктонной сети Апштейна (размер ячеи 64 мкм), фиксировали формалином, обрабатывали в камеральных условиях с использованием камеры Богорова и стереомикроскопа МБС-10. Таксономическое определение зоопланктона проводили с использованием ряда пособий [10–12]. Общую минерализацию и pH воды измеряли в аккредитованной лаборатории ОАО “Кучуксульфат”.
Для статистического анализа влияния факторов использовали метод главных компонент (PCA) и факторный анализ [13]. Расчеты выполнены в пакетах программ MS Excel-2017 и Statistica 10.
РЕЗУЛЬТАТЫ
Основные абиотические факторы. Температура поверхностного слоя воды в оз. Кулундинское за исследованный период года (апрель–октябрь) максимальных значений достигала в июле 2020 г. – 29.4°С, а минимальных в апреле 2019 г. – 0.1°С. Прозрачность воды в разные периоды времени колебалась от 0.1 м в мае 2019 г. до 1.3 м в апреле 2017 г.
По величине минерализации воды озеро относится к гипергалинным водоемам [14]. В 2017–2021 гг. соленость воды в озере колебалась от 87.0 до 94.2 г/л (табл. 1). По многолетним наблюдениям (2000–2019 гг.) соленость воды находилась в пределах от 32.0 г/дм3 в апреле 2019 г. до 126.8 г/дм3 в апреле 2016 г. Обычно наблюдалось повышение концентрации солей в воде (рапе) к концу вегетационного сезона.
Таблица 1.
Основные физико-химические показатели воды оз. Кулундинское в апреле–октябре 2017–2021 гг. (минимум–максимум)
| Показатели | 2017 г. | 2018 г. | 2019 г. | 2020 г. | 2021 г. |
|---|---|---|---|---|---|
| Температура, °С | 6.0–24.0 | 5.5–23.6 | 0.1–28.1 | 6.4–29.4 | 4.5–24.0 |
| Прозрачность, м | 0.9–1.3 | 0.3–0.8 | 0.1–1.0 | 0.3–0.9 | 0.4–1.2 |
| рН | 8.5–8.9 | 8.6–8.9 | 8.3–8.7 | 7.8–8.8 | 8.5–8.9 |
| Соленость, г/дм3 | 65.6–127 | 75.1–93.0 | 32.0–88.6 | 74.0–94.2 | 50.0–96.0 |
Значение pH воды относилось к слабощелочной области шкалы и колебалось от 7.8 (июль 2020 г.) до 8.9 (май и июль 2017 г., май 2018 и 2021 гг.).
В 2021 г. концентрации нитритов (0.02–0.07 мг/дм3), нитратов (17.2–33.05 мг/дм3) и фосфатов (0.06–0.12 мг/дм3) в разные периоды исследований были невысокими, а содержание ионов аммония (до 4.44 мг/дм3 в мае) было повышенным и значительно превышало норматив (0.05 мг/дм3) ПДК для рыбохозяйственных водоемов России. Перманганатная окисляемость воды колебалась от 28.97 (в апреле) до 89.25 мгО2/дм3 (в июле), т.е. содержание органических веществ в воде повышенное. Содержание железа в воде составляло 0.07–0.17 мг/дм3, хлоридов – 12.8–38.7 г/дм3, сульфатов – 4.8–17.6 г/дм3. Согласно гидрохимической классификации О.А. Алекина [15], по составу основных ионов вода озера хлоридно-сульфатная группы натрия.
Зоопланктон оз. Кулундинское представлен 9 видами: 6 – Rotifera, 1 – Cladocera, 1 – Copepoda и 1 – Anostraca. Большинство встреченных видов относятся к солоноватоводной фауне: Polyarthra dolichoptera Idelson, 1925, Asplanchna priodonta Gosse, 1850, Keratella cochlearis (Gosse, 1851), K. quadrata (Müller, 1786), Heхarthra oхyuris (Zernov, 1903), Moina macrocopa (Straus, 1820). К галобионтам относятся коловратка Brachionus plicatilis Müller, 1786, веслоногий рачок Cletocamptus retrogressus Schmankech, 1875 и жаброногий рачок Artemia sp.
В 2017 г. на фоне опреснения рапы оз. Кулундинское с 126.8 (апрель) до 87.0 г/дм3 (июнь) в моновидовом зоопланктоне, состоящем только из жаброногого рачка артемии (см. табл. 1), сначала появлялись отдельные представители копепод (Cl. retrogressus), а затем (в октябре) и коловраток (Br. plicatilis).
В 2018 г. при продолжающемся уменьшении минерализации (до 75.1 г/дм3 в июле) коловратки и веслоногие рачки вместе составляли 52.4% численности зоопланктона в июне, а в июле их доля увеличилась до 64.7%. В составе зоопланктона впервые отмечены ветвистоусые рачки (M. macrocopa), которые составляли 16.2% от общей численности. В августе и сентябре в зоопланктоне преобладали солоноватоводные коловратки, кладоцеры и копеподы, а жаброноги составляли только 0.5% численности в августе и 0.3% в сентябре.
В 2019 г. соленость воды снизилась до 32.0 г/дм3, в результате чего коловратки с веслоногими рачками в апреле и мае составляли 75.0 и 81.0% численности зоопланктона соответственно, а артемия только 0.3 и 6.2%. В июне отмечалась непродолжительная вспышка численности жаброногов до 82.4%. С июля по октябрь доля артемии значительно снизилась и вновь преобладали солоноватоводные таксоны, доля галобионтов была значительно ниже.
В 2020 г. на фоне некоторого восстановления солености воды (до 94.2 г/дм3) отмечалось стабильное доминирование коловраток, копепод и кладоцер. Доля артемии в июне составляла только 9.1%, в июле она повысилась до 14.4%, в августе и сентябре вновь снизилась до 0.3 и 0.2% соответственно.
В 2021 г. наблюдалась сходная динамика минерализации воды (максимум – 96.0 г/дм3) и зоопланктона. Видовой состав зоопланктона достиг максимального разнообразия (9 видов). Лидирующее положение по численности принадлежало солоноватоводным таксонам. В целом за весь период наблюдений отмечалось увеличение численности рачков артемии и их цист на 30% и уменьшение численности прочих таксонов на 12% по сравнению с 2020 г.
Максимальная численность науплиусов артемии (980 тыс. экз/м3) наблюдалась в апреле 2017 г. (табл. 2) В течение года их численность обычно значительно снижалась, а в октябре 2020 и 2021 гг. они не были обнаружены. Наибольшая численность цист также выявлена в апреле 2017 г. – 849 тыс. экз/м3, затем она ежегодно уменьшалась и в апреле 2021 г. составляла всего 12.2 экз/м3. Максимум присутствия ювенильной стадии артемии было зафиксирован в июле 2017 г. (12.5 тыс. экз/м3). В апреле 2017–2019 гг. и октябре 2020–2021 гг. они отсутствовали. Для численности предвзрослых и взрослых особей артемии наблюдалась сходная динамика.
Таблица 2.
Показатели развития основных таксонов зоопланктона и основных стадий жизненного цикла Artemia в апреле–октябре 2017–2021 гг. (минимум–максимум)
| Таксоны | 2017 г. | 2018 г. | 2019 г. | 2020 г. | 2021 г. |
|---|---|---|---|---|---|
| Численность, тыс. экз/м3 | |||||
| Rotifera | 0–0.17 | 0–384 | 0.12–236 | 36.2–1820 | 30.8–1550 |
| Cladocera | 0 | 0–93.6 | 0–430 | 0–35.3 | 0–30.1 |
| Copepoda | 0–21.02 | 2.10–43.0 | 0.64–143 | 10.5–89.2 | 8.94–75.9 |
| Artemia: | 0.07–980 | 0.45–66.0 | 0.19–34.0 | 0.06–19.9 | 15.9–90.6 |
| науплиусы | 0.02–980 | 0.02–65.5 | 0.19–31.2 | 0–6.86 | 0–8.92 |
| ювенильные | 0–12.5 | 0–9.41 | 0–7.37 | 0–8.95 | 0–11.6 |
| предвзрослые | 0–14.6 | 0–4.09 | 0–15.04 | 0.01–7.63 | 0.01–9.92 |
| взрослые | 0–1.08 | 0–1.73 | 0–0.25 | 0.05–0.58 | 0.05–0.31 |
| цисты | 129–850 | 27.8–394 | 20.1–42.6 | 12.2–69.7 | 15.9–90.6 |
| Биомасса, г/м3 | |||||
| Rotifera | 0–0.0003 | 0–1.53 | 0.001–0.95 | 0.14–7.29 | 0.12–6.21 |
| Cladocera | 0 | 0–5.06 | 0–4.59 | 0–1.59 | 0–1.35 |
| Copepoda | 0–0.63 | 0.07–1.51 | 0.02–48.5 | 0.37–3.12 | 0.31–2.65 |
| Artemia | 0.03–167 | 0.18–9.28 | 1.63–20.0 | 0.35–11.7 | 0.26–17.7 |
Анализ влияния экологических факторов. Для выявления основных природных факторов, влияющих на структуру зоопланктона, использовали метод главных компонент. Были проанализированы выборки четырех гидрофизических и гидрохимических факторов (температуры, плотности, минерализации и рН воды) и 13 показателей структуры зоопланктона (численность и биомасса в целом и основных таксономических групп: коловраток, ветвистоусых, веслоногих и жаброногих рачков, а также отдельных стадий жизненного цикла артемии) за 2017–2021 гг. по ежемесячным данным (рис. 2).
Рис. 2.
Результаты анализа влияния экологических факторов на зоопланктон оз. Кулундинское методом главных компонент (Principal Component & Classification Analysis). На осях – значения факторов матрицы корреляций: Salinity – соленость, Transparency – прозрачность, Temperature – температура; стадии жизненного цикла артемии: Nauplia – науплиусы, Juvenile – ювенильные, Subadults – предвзрослые, Adults – взрослые, Cysts – цисты; N – численность, B – биомасса.
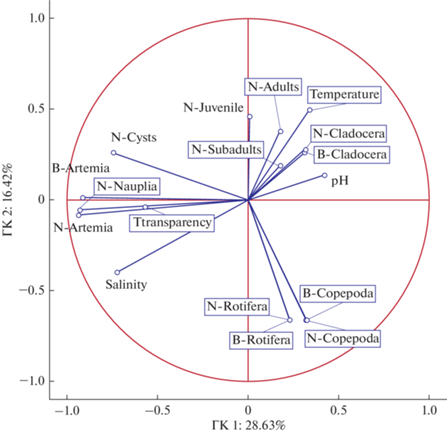
По графику “каменистой осыпи” были установлены главные компоненты ГК1, ГК2 и ГК3, охватывающие 59.3% дисперсии всех изученных переменных (табл. 3). Переменные, вошедшие в ГК1, относились в основном к влиянию величины солености на показатели развития популяции артемии. Эти показатели имели большие факторные нагрузки. В ГК2 основное значение имела температура поверхностного слоя воды, а также показатели численности и биомассы коловраток и веслоногих рачков. Их факторные нагрузки были невысокие. Вклад ГК2 в общую дисперсию значительно меньше. К ГК3 можно отнести рН воды, численность и биомассу ветвистоусых рачков. Учитывая низкую факторную нагрузку для рН и небольшую долю от общей объясненной дисперсии, вклад этой компоненты существенно меньше, чем ГК2. Таким образом, ГК1 лидирует в объяснении общей дисперсии, но ее доля не является преобладающей.
Таблица 3.
Факторные нагрузки для трех главных компонент (ГК1, ГК2 и ГК3) по всему перечню изученных переменных (жирным шрифтом выделены нагрузки >0.7)
| Переменные | ГК1 | ГК2 | ГК3 |
|---|---|---|---|
| Температура воды, °С | 0.34 | 0.50 | –0.43 |
| Прозрачность воды, м | –0.57 | –0.03 | –0.01 |
| Минерализация воды, г/дм3 | –0.72 | –0.40 | –0.13 |
| рН воды | 0.42 | 0.14 | 0.53 |
| Численность, экз/м3: | |||
| Rotifera | 0.23 | –0.66 | –0.23 |
| Cladocera | 0.31 | 0.28 | –0.83 |
| Copepoda | 0.32 | –0.66 | –0.27 |
| Artemia (общая) | –0.94 | –0.08 | –0.23 |
| Биомасса, г/м3: | |||
| Rotifera | 0.23 | –0.66 | –0.23 |
| Cladocera | 0.31 | 0.26 | –0.82 |
| Copepoda | 0.32 | –0.66 | –0.27 |
| Artemia | –0.92 | 0.02 | –0.27 |
| науплиусов Artemia | –0.93 | –0.05 | –0.23 |
| ювенильных Artemia | 0.01 | 0.46 | –0.02 |
| предвзрослых Artemia | 0.18 | 0.19 | 0.06 |
| взрослых Artemia | 0.18 | 0.39 | –0.40 |
| цист Artemia | –0.75 | 0.26 | 0.01 |
| Доля общей дисперсии, % | 28.6 | 16.4 | 14.3 |
Из графика главных компонент (см. рис. 2) следует, что переменные численности и биомассы Rotifera и Copepoda образуют компактную группу в его правой нижней части, что означает их тесную положительную корреляцию, т.е. сходство реакций этих таксонов на изменения окружающей среды. Переменные численности цист и предвзрослой стадии артемии находятся почти по диагонали от первой группы. Это свидетельствует о высокой отрицательной корреляции между ними, что, вероятно, обусловлено их противоположной реакцией на изменения экологических параметров. Наибольшие нагрузки на первую компоненту имеют общая численность и биомасса всех стадий артемии, а также науплиусов, тесно связанных между собой. Они находятся в левой части графика, как и переменная солености воды. Однако связь между этими переменными не прямая, а, вероятно, в некоторой степени опосредованная. Переменная солености лежит напротив переменных численности и биомассы Cladocera, а также численности взрослой артемии, что отражает противоположность их динамики, но факторные нагрузки последних невелики. Можно заметить также противопоставление солености и pH, что, вероятно, обусловлено изменением водородного потенциала воды вследствие выпадения части солей в осадок при высокой минерализации воды.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Озера с повышенной минерализацией воды широко распространены во всем мире [16]. Во второй половине прошлого века начались исследования, раскрывающие важность солености воды для формирования озерных биоценозов, и в частности зоопланктона [17, 18]. Некоторые исследователи определяют соленость как основной экологический фактор, влияющий на таксономическое разнообразие беспозвоночных в континентальных водоемах и морях [19]. Наиболее изучены закономерности изменения числа видов и обилия зоопланктона с увеличением минерализации воды на примерах водоемов Австралии [20–24], Канады [18, 25], Крыма [26–29] и Сибири [30–32]. Показано, что соленость воды в пределах 95–100 г/дм3 является барьером для развития всех солоноватоводных видов.
Многие исследователи полагают, что другие экологические факторы также сильно влияют на структуру биоценозов при увеличении солености озер. Выделенные ими факторы для объяснения изменения таксономического разнообразия включают конкуренцию, хищничество и другие биологические взаимодействия [33, 34]. В нашем случает фактор хищничества можно исключить, поскольку хищные виды не обнаружены. Отмечено [35], что соленость действует на биоценозы совместно с другими факторами, при этом она затрагивает иные факторы, которые затем влияют на характеристики зоопланктона, т.е. действуют опосредованно. Напрямую связана с соленостью плотность воды. Некоторые другие абиотические факторы – температура, прозрачность и pH воды, в течение года, как правило, изменяются синхронно солености, что обусловлено сменой гидрологических сезонов. Эти изменения особенно четко влияют на чередование стадий жизненного цикла рачка артемии. Также показано [18], что воздействие может оказывать не столько сумма ионов в воде, сколько их химический состав.
За период исследования оз. Кулундинское формирующий эффект минерализации воды на структуру сообщества зоопланктона выражался в смене доминанта артемии на солоноватоводные виды. В 2017 г. при минерализации воды более 100 г/дм3 артемия в течение года достигала 100% численности зоопланктона. В 2018–2021 гг. при минерализации менее 100 г/дм3 существенную долю численности зоопланктона составляли коловратки, веслоногие и ветвистоусые рачки. Такая же тенденция отмечена на гипергалинных озерах Крыма [28] и Большом соленом озере (США) [35].
Результаты проведенного анализа с использованием метода главных компонент соответствуют современным представлениям об экологии рачка артемии и его взаимоотношениях с представителями солоноватоводной фауны. При высокой минерализации воды рачок артемия также подвержен негативному воздействию избыточного осмотического давления водной среды, но он приспособлен к этому воздействию значительно лучше своих конкурентов, поэтому получает существенное преимущество [1, 3]. На примере Аральского моря показано [36], что при уменьшении солености основные перестройки в структуре трофической цепи связаны со сменой доминирующих групп зоопланктона с различным типом питания. При этом происходит уменьшение обилия артемии и рост численности мелких галобионтов, что, вероятно, связано с конкуренцией за пищу. Результаты нашего анализа подтверждают опосредованность воздействия величины минерализации на показатели обилия популяции артемии и трофическую цепь оз. Кулундинское.
Согласно биолимнологическому районированию С.В. Герда [37], оз. Кулундинское относится к Барабинско-Кулундинской озерной области. Отличительная особенность озер этого региона – малая глубина котловин и повышенная минерализация воды. Известно [38], что экосистемы озер этой области подвержены циклическим сукцессиям, так как климат на юге Западной Сибири характеризуется чередованием сухих и влажных периодов, что приводит к значительным колебаниям уровня воды и площади бессточных озер [39]. Колебания уровня воды являются причиной существенных изменений гидрохимического и гидробиологического режимов озер [40].
Ранее выполненный Фурье-анализ среднегодовых (за вегетационный период) значений минерализации воды оз. Кулундинское и продуктивности артемии в 2000–2020 гг. [41] показал схожесть спектров данных. Для обоих рядов выявлены циклы продолжительностью 6–7 лет, а наиболее характерен цикл, равный 10 годам, что близко по продолжительности 11-летнему солнечному циклу. Причем 10-летний цикл наиболее сильно проявляется у величины минерализации. Для наиболее изученного водоема области замкнутого стока Обь-Иртышского междуречья – оз. Чаны, также характерны ярко выраженные внутривековые колебания гидрологического режима, связанные с изменением увлажненности территории, обусловленной как солнечной активностью, так и переменой климата [42]. Изменение уровня оз. Чаны хорошо коррелирует с изменением годовой суммы осадков на юге Западной Сибири [43]. При изучении многолетней динамики биомассы макрозообентоса этого озера были получены данные [44], которые хорошо согласовывались со структурой колебаний уровня воды оз. Чаны: 1) внутривековые циклы – 40 лет и более; 2) предположительно связанные с солнечной активностью – 10–20 лет; 3) высокочастотные – 3–6 лет [45]. Колебания уровней и солености воды неизбежно ведут к измененяем таксономического состава и структуры водных сообществ, в том числе оз. Кулундинское. Именно такой период смены фаз водности с регрессии на трансгрессию был охвачен нами в данном исследовании.
Таким образом, опреснение воды в период трансгрессивной фазы водности в 2017–2021 гг. обусловило потерю доминирующего положения жаброногого рачка в сообществе, как и было отмечено в предыдущие периоды высокой солености воды – 105–140 г/дм3 [5]. В связи с этим в последние годы хозяйственное значение озера уменьшалось из-за отсутствия биосырья – промысловых скоплений цист артемии.
ВЫВОДЫ
1. Среди изученных факторов формирования зоопланктона оз. Кулундинское наибольшее влияние на его состав и структуру оказывала минерализация воды. Эта переменная имеет наибольшую из проанализированных экологических факторов нагрузку в ГК1 (–0.72).
2. В 2017–2021 гг. на оз. Кулундинское наблюдалось резкое изменение состава и структуры зоопланктонного сообщества. Характерный для гипергалинных озер моновидовой артемиевый зоопланктон заместился на комплекс солоноватоводных видов коловраток, ветвистоусых и веслоногих рачков, а также галобионтов B. plicatilis и C. retrogressus. Роль жаброногов в планктоне снизилась до минимальных значений. Эти изменения обусловлены опреснением воды озера на фоне увеличения его водности.
3. При уменьшении минерализации воды менее 100 г/дм3 с 2017 г. (127 г/м3) по 2021 г. (96 г/дм3) максимальная (летняя) биомасса артемии снизилась с 167 до 17.7 г/м3. При этом максимальные биомассы коловраток, ветвистоусых и веслоногих рачков увеличились с 0.003, 0 и 0.63 до 6.21, 1.35 и 2.65 г/м3 соответственно.
4. В течение года минимальные значения минерализации воды в озере наблюдались весной, после поступления талых вод с водосборного бассейна, а максимальные отмечались в летний период (в июле). При этом численность артемии максимальна в весенне-летний период, а солоноватоводных видов – в летне-осенний.
Исследование выполнено в рамках государственного задания ИВЭП СО РАН по теме “Исследование разнообразия и структурно-функциональной организации водных экосистем для сохранения и рационального использования водных и биологических ресурсов Западной Сибири”.
Авторы подтверждают отсутствие конфликта интересов.