ЭНТОМОЛОГИЧЕСКОЕ ОБОЗРЕНИЕ, 99, 1, 2020
УДК 591.3 : 591.54 : 591.52 : 595.7 : 574.24
CЕЗОННОЕ РАЗВИТИЕ КЛОПОВ-СЛЕПНЯКОВ (HETEROPTERA,
MIRIDAE): ПОДСЕМ. MIRINAE, ТРИБА MIRINI
© 2020 г. А. Х. Саулич,1* Д. Л. Мусолин2**
1Санкт-Петербургский государственный университет
Университетская наб., 7-9, С.-Петербург, 199034 Россия
*e-mail: 325mik40@gmail.com
2Санкт-Петербургский государственный лесотехнический
университет им. С. М. Кирова
Институтский пер., 5, литер «У», С.-Петербург, 194021 Россия
**e-mail: musolin@gmail.com
Поступила в редакцию 19.06.2019 г.
После доработки 30.01.2020 г.
Принята к публикации 30.01.2020 г.
В обзоре представлены сведения, позволяющие охарактеризовать сезонное развитие кло-
пов-слепняков трибы Mirini (подсем. Mirinae) и оценить степень изученности сезонных адаптаций
в этом таксоне. Рассмотрены экологические реакции, участвующие в контроле сезонного разви-
тия 14 видов из 5 родов (Adelphocoris, Apolygus, Lygus, Lygocoris и Stenotus). Все исследованные
виды мирин - широкие полифаги, образующие разное число поколений в разных климатических
поясах. Изученные представители 4 родов (Adelphocoris, Apolygus, Lygocoris и Stenotus) зимуют
на эмбриональной стадии, а клопы рода Lygus - на стадии имаго. Ярко выраженная способность
к перелетам на дальние расстояния, развившаяся в связи с необходимостью поиска цветущих
растений для питания и размножения, выявлена у некоторых видов родов Adelphocoris и Lygus,
в частности у Lygus pratensis. Однако в отличие от многих других насекомых, которые соверша-
ют дальние миграции в состоянии имагинальной диапаузы, мигрирующие самки слепняков рода
Adelphocoris содержат в яйцеводах уже зрелые яйца. Эта особенность вида способствует успеш-
ной колонизации самками новых территорий независимо от присутствия самцов, так как им не
требуется дополнительного оплодотворения после миграции. Для большинства эксперимен-
тально исследованных видов трибы Mirini в лабораторных условиях определены температурные
параметры развития и суммы эффективных температур, необходимые для завершения полной
генерации, а в совокупности с наблюдениями в природных условиях для некоторых видов также
определено количество завершаемых за год поколений. На примере 3 видов рода Adelphocoris
(A. triannulatus, A. suturalis и A. lineolatus) детально проанализирована роль длины дня в регуля-
ции сезонного развития. Условия формирования и окончания имагинальной диапаузы подробно
изучены у Lygus hesperus на юге США. Сезонное развитие Lygocoris pabulinus - пример необыч-
ной облигатной смены растения-хозяина в течение года. У этого слепняка за зимовкой диапау-
зирующих яиц в тканях древесных растений следуют переход личинок на травянистые растения
и развитие летних поколений на них - сезонная стратегия, характерная скорее для равнокрылых
хоботных (Homoptera), чем для клопов (Heteroptera). В целом проведенный анализ свидетель-
ствует о слабой изученности экологии представителей подсем. Mirinae, несмотря на их хо-
зяйственную важность. Большинство публикаций касается лишь немногих экспериментально
7
изученных видов и ограничивается данными по температурным нормам развития отдельных
географических популяций. Лишь на примере отдельных популяций некоторых видов детально
проанализирована и показана определяющая роль фотопериодических адаптаций в регуляции
годичного цикла (например, как у Adelphocoris triannulatus), хотя именно такие данные необ-
ходимы для прогноза сезонного развития и распространения опасных и полезных насекомых,
поскольку сезонный цикл каждой географической популяции вида строго синхронизирован
с локальными условиями ее существования.
Ключевые слова: биологический метод контроля вредителей, вольтинизм, длина дня, защита
растений, имагинальная диапауза, полужесткокрылые, сезонное развитие, сезонный покой, фо-
топериод, фотопериодическая реакция.
DOI: 10.31857/S0367144520010013
Сезонное развитие насекомых характеризуется чрезвычайным разнообразием, труд-
но поддающимся строгой классификации. В его основе лежат адаптации, повышаю-
щие способность локальных популяций выживать, максимально эффективно
использовать ресурсы среды и формировать специфический тип годичного цикла в ус-
ловиях выраженной сезонности климата. В ранее опубликованных работах (Musolin,
Saulich, 1999; Саулич, Мусолин, 2007; Saulich, Musolin, 2018) мы предложили выде-
лить 4 основные категории явлений, определяющие сезонный цикл насекомых:
- активное состояние и реакции, управляющие активным развитием, преимуще-
ственно его скоростью;
- диапауза и реакции, управляющие формированием, протеканием и прекращением
состояний физиологического покоя разной глубины;
- миграции и реакции, обеспечивающие активное избегание неблагоприятных усло-
вий путем активного перемещения, и
- сезонный полифенизм и реакции, контролирующие морфологические и физиологи-
ческие признаки (окраску, форму, размеры и пропорции частей тела, степень развития
крыльев и др.), часто тесно связанные с состоянием диапаузы или иной формой сезон-
ного покоя.
Именно на основе комбинации этих сезонных адаптаций в большинстве случаев
и реализуется существующее разнообразие сезонных схем у насекомых, которое при-
нято сводить к нескольким основным типам (Саулич, Мусолин, 2014; Saulich, Musolin,
2018).
Согласно современным представлениям, слепняки (Miridae) - это самое большое се-
мейство в отряде настоящих полужесткокрылых (Heteroptera). В него входят 8 подсе-
мейств, примерно 50 триб, свыше 1500 родов и более 11 100 видов (Cassis, Schuh, 2012;
Namyatova et al., 2016; Henry, 2017; Konstantinov et al., 2018).
В предыдущей публикации (Саулич, Мусолин, 2019) проанализированы сезонные
адаптации и образованные на их основе фенологические схемы представителей одного
из подсемейств слепняков - Bryocorinae. Из примерно 1000 видов этого большого так-
сона доступны данные о сезонных адаптациях только 5 видов - Dicyphus errans (Wolff),
D. hesperus Knight, Macrolophus melanotoma (A. Costa), M. pygmaeus (Rambur)
и Nesidiocoris tenuis (Reuter). Все они относятся к одной трибе - Dicyphini. Однако
даже ограниченные материалы, приведенные в предыдущем обзоре, свидетельствуют
о разнообразии сезонных адаптаций, свойственных слепнякам-бриокоринам. Так,
8
из 5 перечисленных видов 3 (M. melanotoma, M. pygmaeus и N. tenuis) имеют гомо-
динамный сезонный цикл если не на всем, то как минимум на части ареала. В разных
климатических поясах в зависимости от температуры эти клопы образуют
от 2 до 6 и большего числа поколений в течение лета (как N. tenuis в Египте), а зимний
период переживают на разных стадиях развития либо в состоянии оцепенения, либо
в физиологически активном состоянии, используя для этого разнообразные убежища,
защищающие их от низких температур. При этом личинки и имаго активно питаются,
а у самок созревают яйца. Два других вида - D. errans и D. hesperus - имеют гетероди-
намный сезонный цикл, формируя имагинальную диапаузу, наступление которой кон-
тролируется фотопериодической реакцией (ФПР) длиннодневного типа. Кроме того,
у D. errans обнаружена фотопериодическая регуляция скорости роста личинок, спо-
собствующая своевременному достижению диапаузирующей (в данном случае - има-
гинальной) стадии, необходимой для успешной зимовки. У D. hesperus выявлена
географическая изменчивость порога ФПР и установлено, что чувствительностью
к длине дня особи обладают только на личиночной стадии. Обнаружены у бриокорин
и такие сезонные адаптации, как крыловой полиморфизм, или полифенизм
(у D. errans), и изменения окраски тела, связанные с состоянием диапаузы (у D. he-
sperus) (Саулич, Мусолин, 2019).
Данная статья посвящена сезонным адаптациям, свойственным клопам другого под-
семейства - Mirinae Hahn, 1833, включающего более 300 родов из 6 триб: Herdoniini,
Hyalopeplini, Mecistoscelidini, Mirini, Restheniini и Stenodemini. Только 2 из этих триб -
Mirini Hahn, 1833 (около 250 родов) и Stenodemini China, 1943 (примерно 35 родов) -
имеют всесветное распространение, представители остальных 4 триб - обитатели
тропиков и субтропиков (Schuh, Slater, 1995; Schuh, Weirauch, 2020). Палеарктическая
фауна подсем. Mirinae представлена примерно 950 видами из 126 родов (Kerzhner,
Josifov, 1999). Настоящий обзор содержит материалы, характеризующие сезонные
адаптации клопов трибы Mirini.
Род ADELPHOCORIS Reuter, 1896
Adelphocoris triannulatus (Stål, 1858).
Распространен на юге Сибири и Дальнего Востока России, в Китае, Корее и Японии
(Винокуров и др., 2010). Заселяет травянистые сообщества и сельскохозяйственные
угодья. Вредит в основном растениям семейства бобовых, что характерно для многих
видов рода Adelphocoris (Винокуров, Канюкова, 1995).
Сезонное развитие A. triannulatus экспериментально исследовано в Таканабе (Япо-
ния; 32.1° с. ш., 131.5° в. д.), где он в массе обнаружен на полях батата, или сладкого
картофеля, и впервые отмечен как фитозоофаг, хотя питание животной пищей для ви-
дов рода Adelphocoris до сих пор считалось не характерным. В опытах, проведенных
в лабораторных условиях, определены температурные параметры развития при раз-
ных температурах от 15 до 30 °C, на основе которых установлены нижние температур-
ные пороги (НТП) развития яиц (10.0 °C), личинок (12.7 °C) и созревания самок
(13.5 °C). Сумма эффективных температур (СЭТ), необходимая для завершения этих
стадий развития, составила 186.3, 184.8 и 67.5 гр.-дн. соответственно, что в сумме при-
ближается к 440 гр.-дн. (Tajima et al., 2018).
9
Зимовка клопов происходит на стадии яйца. В лабораторных экспериментах было
показано, что наступление зимней эмбриональной диапаузы контролируется условия-
ми содержания самок материнского поколения. В длинном дне (16 ч света в сутки) сам-
ки откладывают активно развивающиеся яйца, тогда как в короткодневных условиях
(10 и 12 ч света) подавляющее число отложенных яиц детерминировано на диапаузу.
Порог ФПР индукции эмбриональной диапаузы практически не зависит от температу-
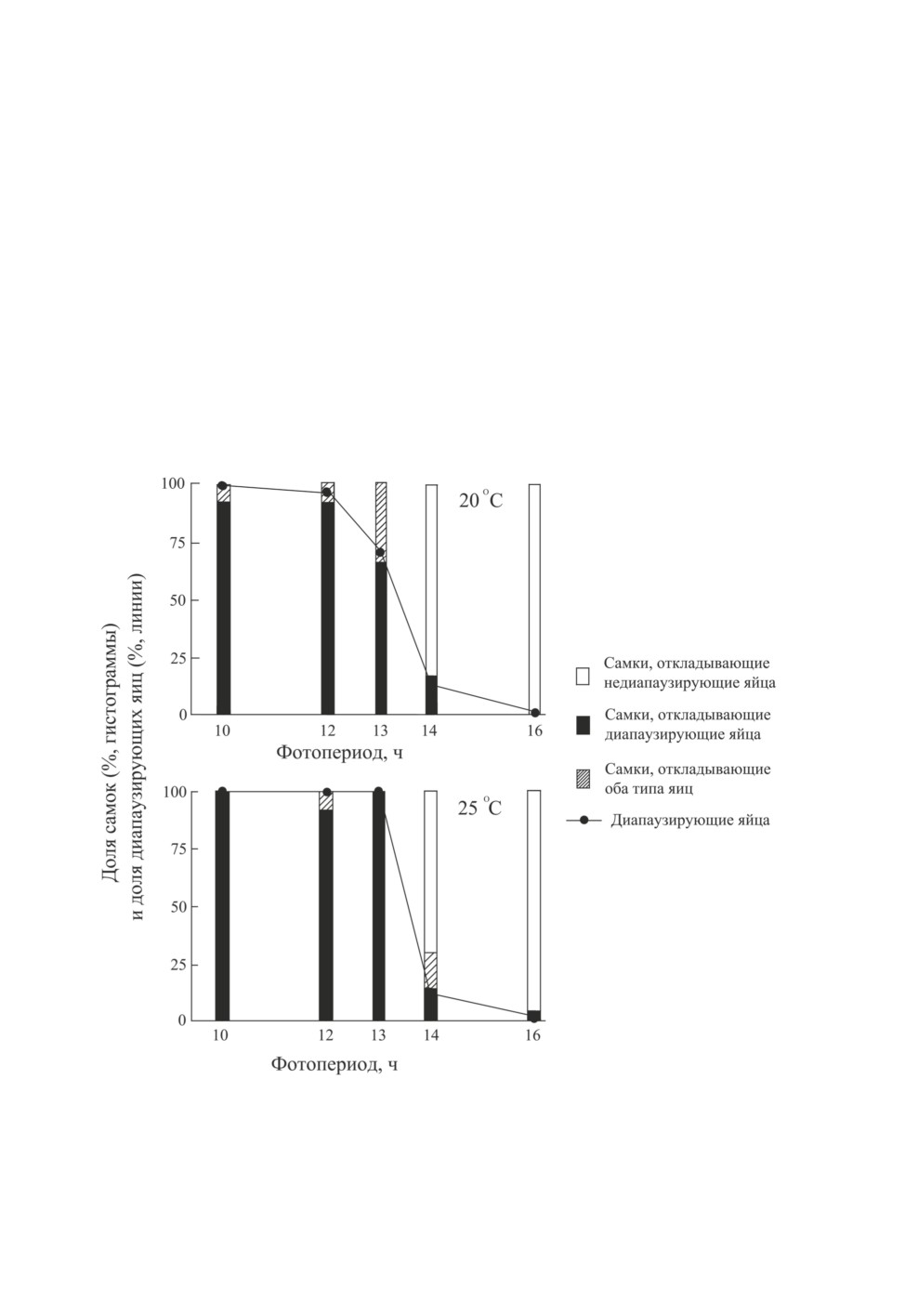
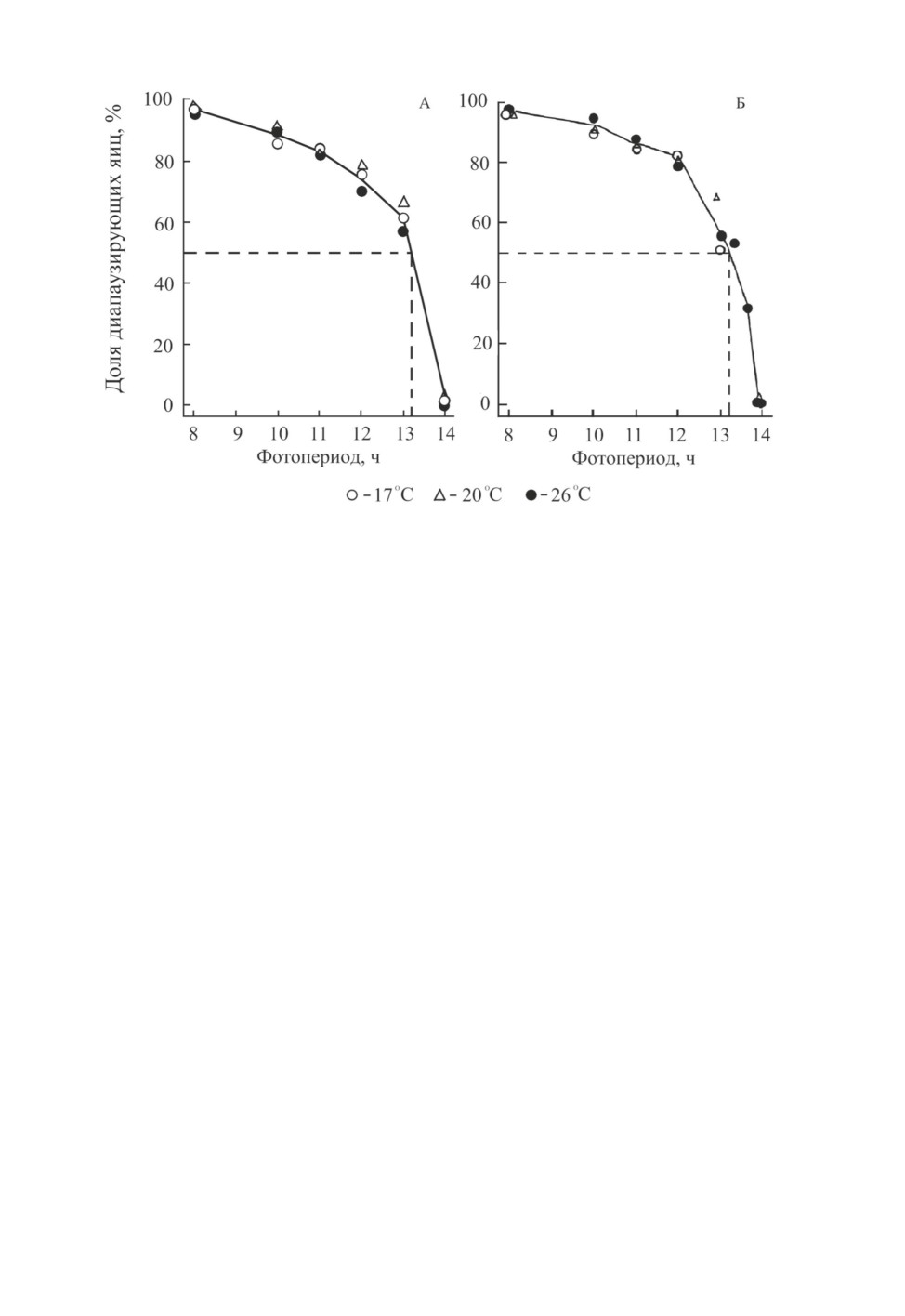
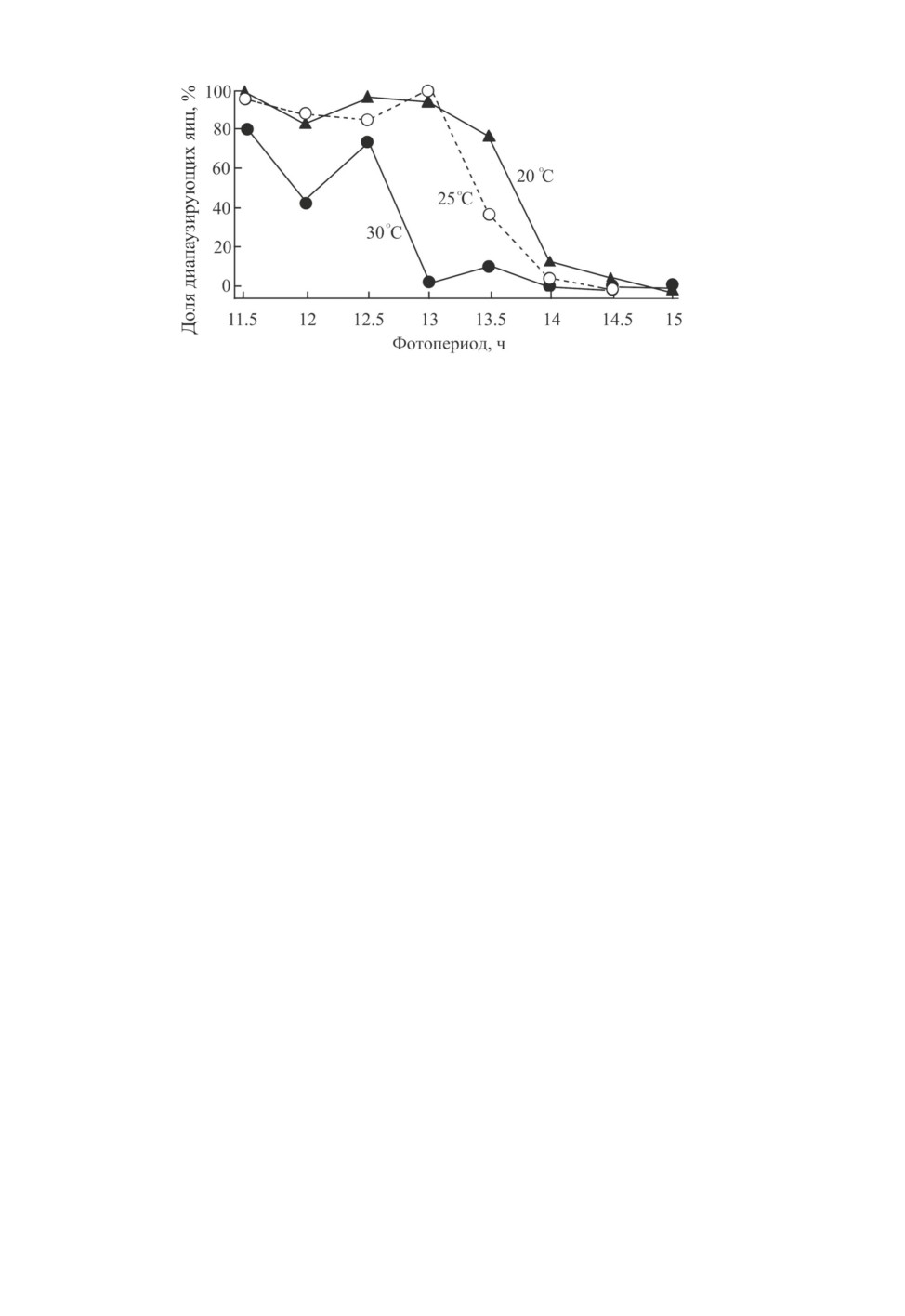
ры: он составил 13.4 ч при 20 °C и 13.7 ч при 25 °C (Tajima et al., 2018; рис. 1).
У самок A. triannulatus обнаружена способность изменять физиологический статус
откладываемых яиц в случае изменения внешних фотопериодических условий, дей-
ствующих непосредственно на самих самок. Так, в эксперименте 10 самок, выращен-
ные в длинном дне (16 ч), в день окрыления были перенесены в короткий день (12 ч;
рис. 2). После периода созревания все самки начинали откладывать активно развиваю-
щиеся (т. е. недиапаузирующие) яйца. Пять из этих самок вскоре погибли (нижняя
часть рисунка), а оставшиеся 5 вскоре после переноса их в короткий день постепенно
начали откладывать диапаузирующие яйца (Tajima et al., 2018).
Рис. 1. Доля диапаузирующих яиц, отложенных самками Adelphocoris triannulatus (Stål)
при содержании в разных фотопериодах при температурах 20 °С или 25 °С, и доля самок,
отложивших недиапаузирующие яйца, диапаузирующие яйца или оба типа яиц в тех же
условиях. Популяция из Таканабе (Япония; 32.1° с. ш., 131.5° в. д.) (по: Tajima et al., 2018).
10
Рис. 2. Влияние изменения фотопериода на физиологический статус откладываемых самкой
яиц при переносе самок Adelphocoris triannulatus (Stål) из длиннодневных условий (16 ч света
в сутки) в короткодневные (12 ч света в сутки). Популяция из Таканабе (Япония; 32.1° с. ш.,
131.5° в. д.) (по: Tajima et al., 2018).
Каждый прямоугольник представляет данные по отдельной самке (с характеристикой яиц, которые
она откладывала; обозначения справа). Температура 25 °С. По горизонтальной оси - период после
имагинальной линьки и переноса в короткодневные условия.
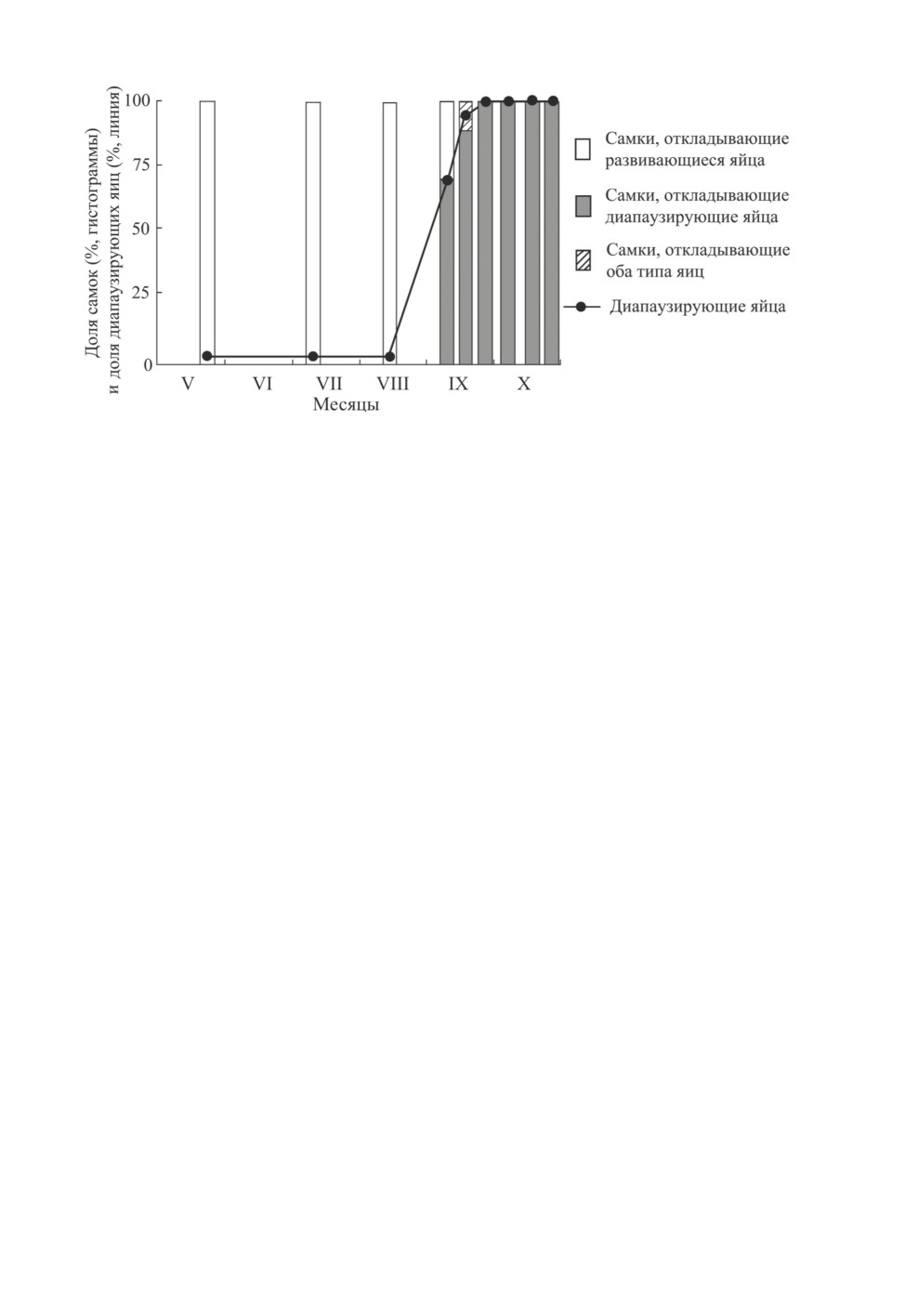
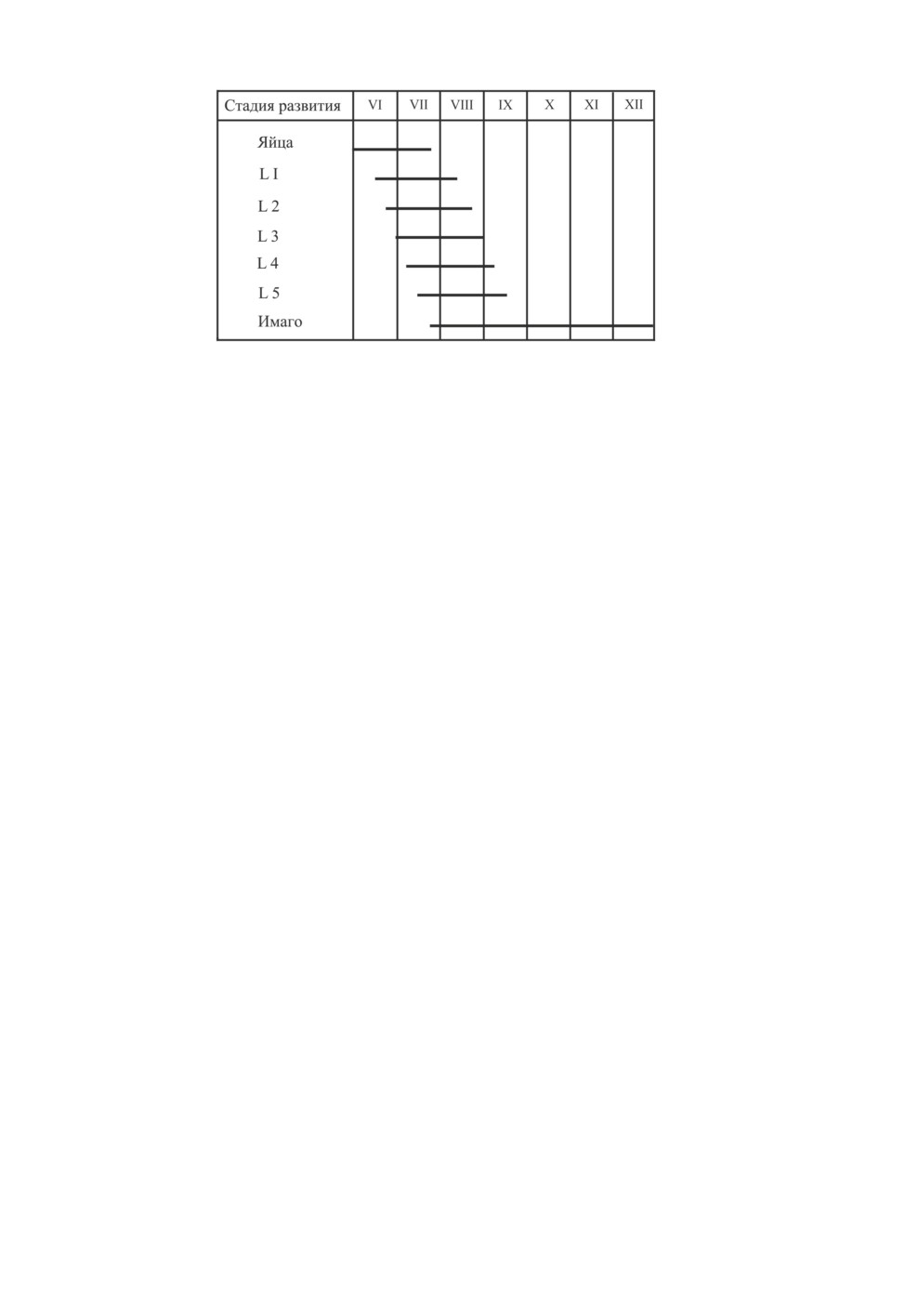
Наблюдения в природных условиях показывают, что первые диапаузирующие яйца
самки начинают откладывать в начале сентября (рис. 3), когда температура воздуха
еще достаточно высокая, а длина дня соответствует пороговому значению ФПР
A. triannulatus, установленному в лабораторных условиях (см. рис. 1).
Основываясь на результатах лабораторных экспериментов и наблюдений в поле, ав-
торы предполагают, что в природных условиях окрыление имаго перезимовавшего по-
коления A. triannulatus происходит с конца апреля по начало июня. С конца июня и в
июле активны имаго I летнего поколения, а в августе-сентябре - имаго II летнего поко-
ления. Рано окрыляющиеся самки II поколения откладывают сначала развивающиеся
яйца (из которых появится еще одно - III - поколение), а при дальнейшем уменьшении
длины дня короче критической они переключаются на откладку диапаузирующих яиц,
которые останутся зимовать. Как показали лабораторные эксперименты (рис. 3), коли-
чество таких самок во II поколении невелико, но, переключаясь на откладывание диа-
паузирующих яиц, они начинают формировать зимующий запас популяции.
Из зимующих диапаузирующих яиц личинки отродятся только весной следующего
года.
Таким образом, на юге Японии A. triannulatus способен завершать 3 или даже 4 поко-
ления за вегетационный сезон, однако ухудшающиеся условия питания поздней осе-
нью и понижение температуры снижают вероятность успешного завершения III
поколения, самки которого должны отложить диапаузирующие яйца. Зимняя диапауза
приурочена к поздним этапам эмбриогенеза, т. е. необходимо время на то, чтобы эм-
брионы успели ее достичь. Авторы (Tajima et al., 2018) никогда не встречали личинок
в природе в октябре и ноябре. Всё это подчеркивает важность способности самок пе-
реключаться с откладки активно развивающихся яиц на откладку диапаузирующих,
поскольку нет гарантии того, что следующее поколение сможет успешно сформиро-
вать зимующий запас.
11
Рис. 3. Сезонное изменение доли диапаузирующих яиц, откладываемых самками
Adelphocoris triannulatus (Stål). Популяция из Таканабе (Япония; 32.1° с. ш., 131.5° в. д.)
(по: Tajima et al., 2018).
Самок, собранных в природных условиях с конца мая до конца октября, переносили в лабораторные
условия (длинный день 16 ч, температура 25 °С), где определяли физиологический статус отложенных
ими в течение 3 дней яиц и долю самок, откладывающих диапаузирующие, развивающиеся яйца
или оба типа яиц.
Adelphocoris lineolatus (Goeze, 1778) (люцерновый клоп; alfalfa plant bug).
Транспалеарктический вид: распространен в Западной Европе, на севере Африки
(Алжир, Тунис), в Передней Азии, Афганистане, Пакистане, Монголии, Китае, Корее
и Японии. В начале XX в. вид непреднамеренно завезен в Северную Америку (штат
Айова) и Канаду (Новая Шотландия), откуда распространился далеко на юг (Южная
Каролина в США) и запад (Альберта в Канаде) (Wheeler, Henry, 1992; Kerzhner, Josifov,
1999; Винокуров и др., 2010). Adelphocoris lineolatus - полифаг с ярко выраженным
предпочтением бобовых, повреждает люцерну, эспарцет, реже донник, клевер, люпин
и другие бобовые травы, спорадически - хлопчатник, арахис, нут, чечевицу, сою, фа-
соль, подсолнечник. Иногда во втором поколении повреждает семенники сахарной све-
клы (Пучков, 1966).
Зимует A. lineolatus на стадии яйца в состоянии диапаузы. Зимовка, как обычно
при эмбриональной диапаузе у мирид, протекает в стеблях растений (Пучков, 1966;
Schaefer, Panizzi, 2000; Wheeler, 2001). Формирование диапаузы контролируется ФПР
длиннодневного типа. Чувствительная к длине дня стадия (имаго материнского поко-
ления с 5-6-го дня после окрыления) была установлена в результате изучения активно-
сти нейросекреторных клеток у самок люцернового клопа из североамериканских
популяций (Ewen, 1966).
В разных зонах естественного ареала A. lineolatus завершает в год от одного
до 3 или 4 поколений, на юге ареала - до 5 (Пучков, 1966). В Северной Америке
в Саскачеване (Канада) завершается только 1 поколение в год; южнее - в Миннесоте
(США) - отмечено 2 неполных поколения, при этом все зимующие яйца были отложе-
ны самками I поколения. Предполагается, что адаптация подобных чужеродных видов
к новым условиям северных регионов осуществлялась благодаря переходу к моноволь-
12
тинному сезонному циклу. Поскольку все клопы II поколения не достигают половозре-
лости, особи с генетически закрепленным более коротким порогом ФПР постепенно
элиминируются из популяции, не участвуя в размножении, в результате чего порог
ФПР постепенно увеличивается, усиливая моновольтинизм популяции (Craig, 1963;
Ewen, 1966). В Висконсине (США) завершается 2 полных поколения (Wipfli et al., 1989;
Wheeler, 2001).
По данным для Украины, нижний температурный порог развития A. lineolatus со-
ставляет примерно 11.5 °C. Для завершения личиночной стадии требуется СЭТ около
250 гр.-дн. (Пучков, 1966).
В начале XXI в. в Китае с введением в культуру генно-модифицированного хлопчат-
ника (в геном которого встроен ген бактерии Bacillus thuringiensis для повышения
устойчивости к чешуекрылым-фитофагам) несколько видов мирид рода Adelphocoris,
ранее считавшихся второстепенными вредителями, были переведены в разряд серьез-
ных вредителей этой культуры (Lu et al., 2008, 2009b, 2010a). Среди них - A. lineolatus,
A. suturalis (Jakovlev, 1882) и A. fasciaticollis Reuter, 1903, резко различающиеся по ге-
ографическому распространению. Adelphocoris lineolatus имеет широкий ареал, изве-
стен из Европы, Азии и Северной Америки (см. выше), A. suturalis распространен
в основном на юге Дальнего Востока России, в Китае, Корее и Японии (Kerzhner,
Josifov, 1999; Винокуров и др., 2010), а A. fasciaticollis отмечен только в Китае и Корее
(Kerzhner, Josifov, 1999). Распространение этих видов на территории Китая также раз-
лично: A. suturalis встречается в основном в регионах с умеренным климатом,
A. lineolatus и A. fasciaticollis предпочитают более прохладный климат. Различается
и их фенология. Adelphocoris suturalis образует 4-5 поколений за сезон, A. lineolatus
и A. fasciaticollis - 3-4. Личинки A. suturalis отрождаются из перезимовавших яиц
в начале апреля, личинки двух других видов - в середине-конце апреля (Lu et al.,
2009b). Для того чтобы объяснить обнаруженные различия, было исследовано влияние
температуры в диапазоне от 10 до 35 °C на продолжительность развития и выживае-
мость преимагинальных стадий этих 3 видов, совместно обитающих на хлопковых по-
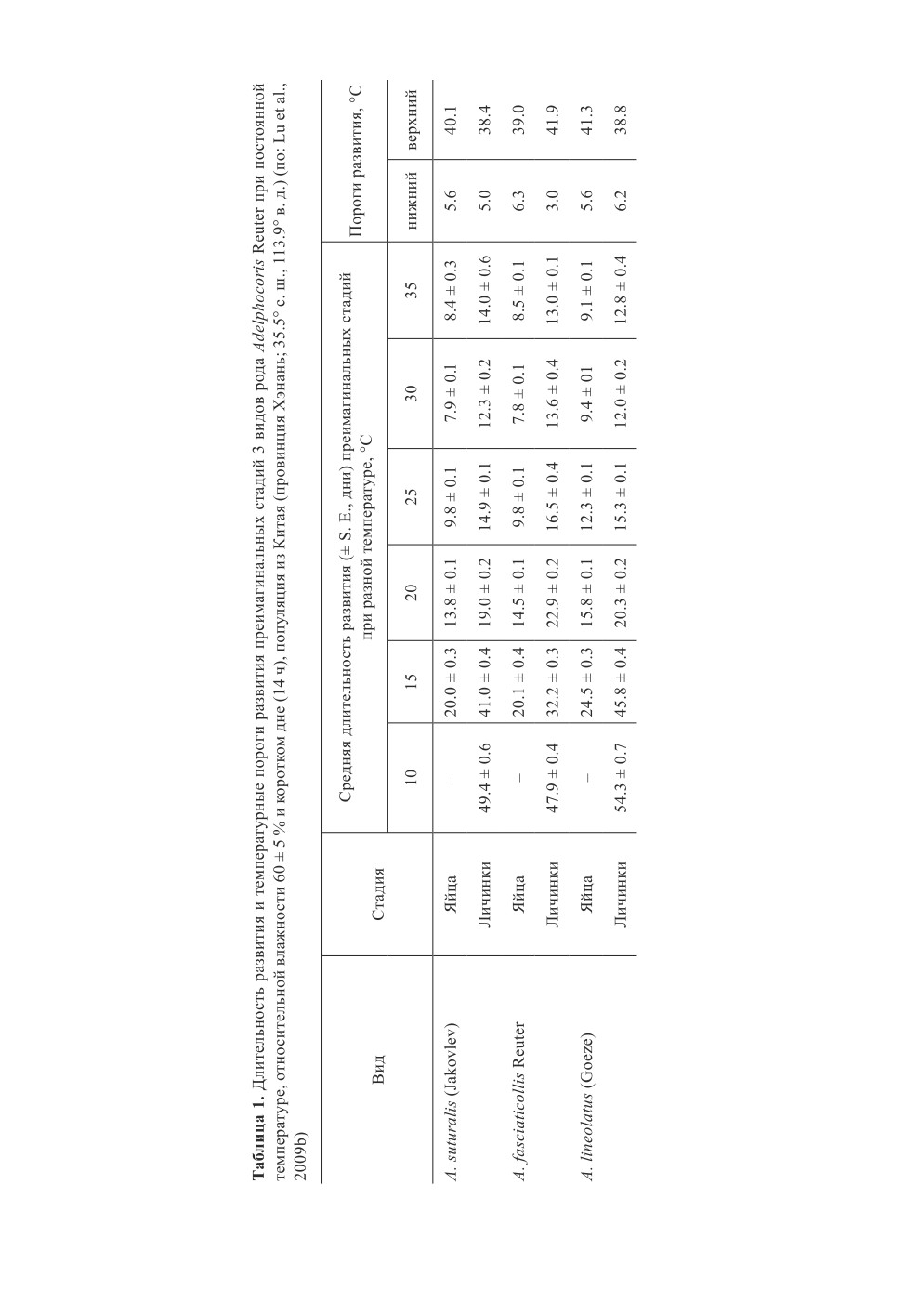
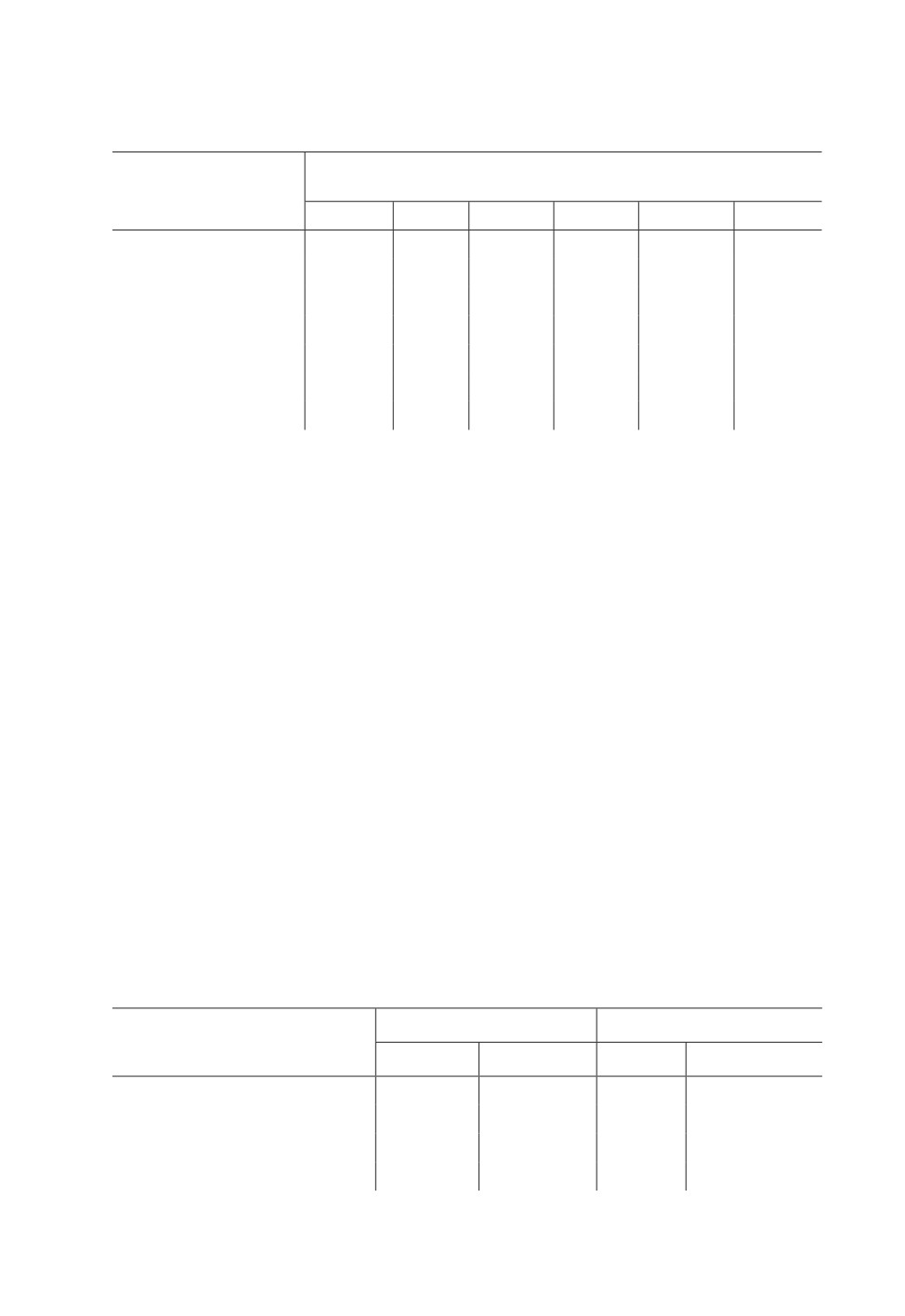
лях в Китае (провинция Хэнань; 35.5° с. ш., 113.9° в. д.) (Lu et al., 2009b; табл. 1).
С использованием регрессионного анализа установлено, что СЭТ для развития яиц и
личинок составила для A. suturalis - 189.9 и 308.8; для A. fasciaticollis - 188.8 и 366.7;
для A. lineolatus - 231.7 и 291.6 гр.-дн. соответственно (Lu et al., 2009b).
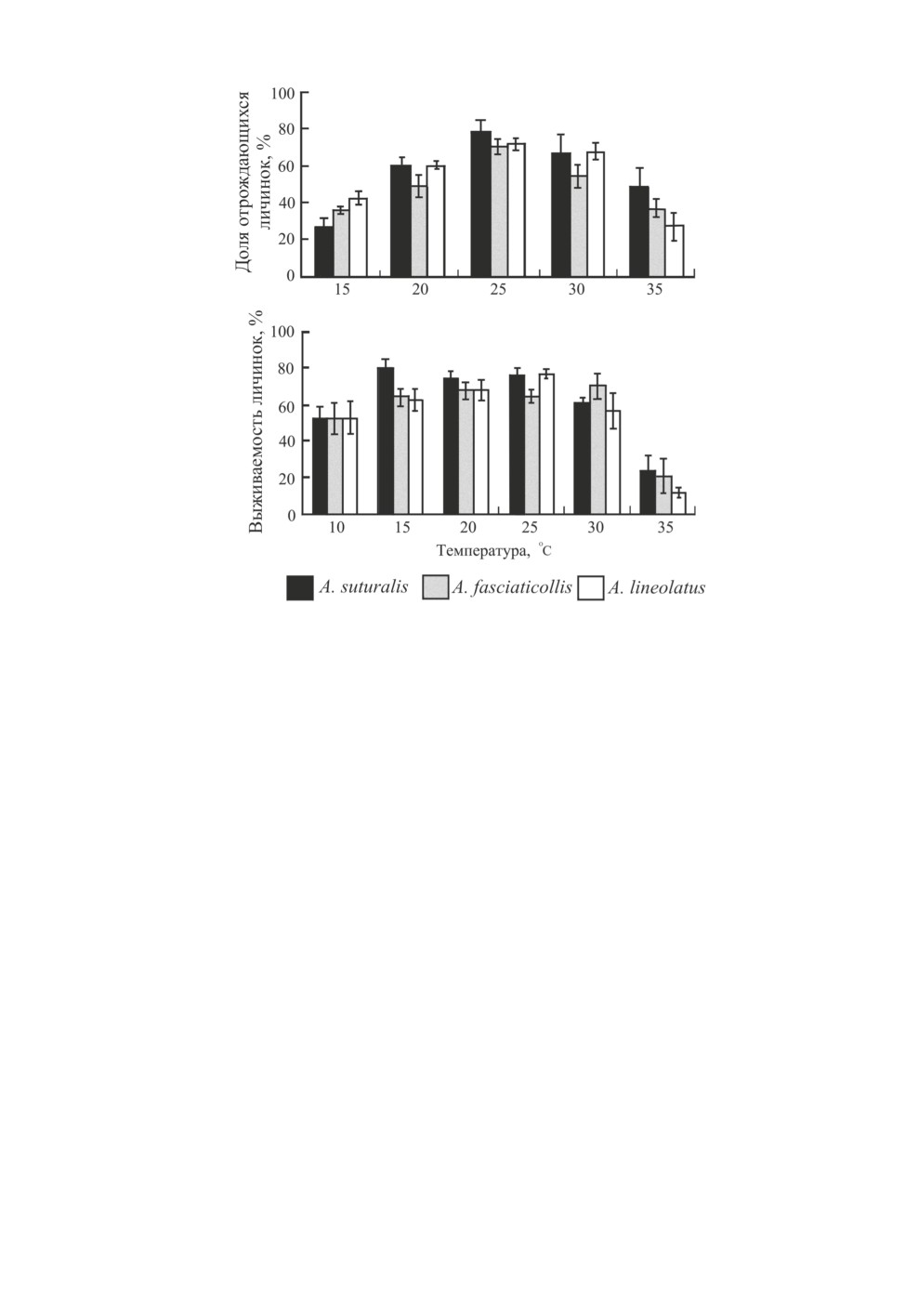
Показатели успешности выхода личинок из яиц и их выживаемости статистически
значимо зависели от температуры у всех 3 видов (рис. 4).
Исследования миграционного поведения, проведенные в Китае (Lu et al., 2009a), по-
казали, что в экспериментальных лабораторных условиях (методику см.: Beerwinkle
et al., 1995; Cheng et al., 1997) оплодотворенные самки A. suturalis и A. fasciaticollis
преодолевают до 40 км в течение 8 ч непрерывного полета. Несколько меньшие спо-
собности проявили самки A. lineolatus, однако и они в течение более чем пятичасового
полета преодолевали около 30 км. Половозрелые самцы всех 3 видов оказались значи-
тельно менее выносливыми. Способность к длительному полету определялась не толь-
ко половой принадлежностью клопов, но и их возрастом. Она достигала
максимального значения к 10-13-му дню после окрыления клопов, постепенно пони-
жаясь с дальнейшим увеличением их возраста. Оптимальной для перелетов оказалась
температура 20-23 °C при относительной влажности воздуха 64-68 %.
13
Рис. 4. Выживаемость яиц и личинок Adelphocoris suturalis (Jakovlev), A. fasciaticollis Reuter
и A. lineolatus (Goeze) при постоянных температурах от 10 до 35 °С.
Приведены средние значения с ошибкой среднего. Популяция из провинции Хэнань
(Китай; 35.5° с. ш., 113.9° в. д.) (по: Lu et al., 2009b).
Все 3 вида зимуют в состоянии эмбриональной диапаузы (Chen et al., 2010). Роль
температуры и фотопериода в индукции зимней диапаузы изучена только у A. suturalis.
В экспериментах использованы клопы из популяции, обитающей в провинции Хэнань
(север Китая; 35.1° с. ш., 113.5° в. д.). Диапауза индуцируется в короткодневных усло-
виях (Feng et al., 2012). Критическая длина дня при температурах от 17 до 26 °C оказа-
лась практически одинаковой и составила
13 ч
18 мин, что свидетельствует
о термостабильности ФПР в заданном интервале температур (рис. 5, А).
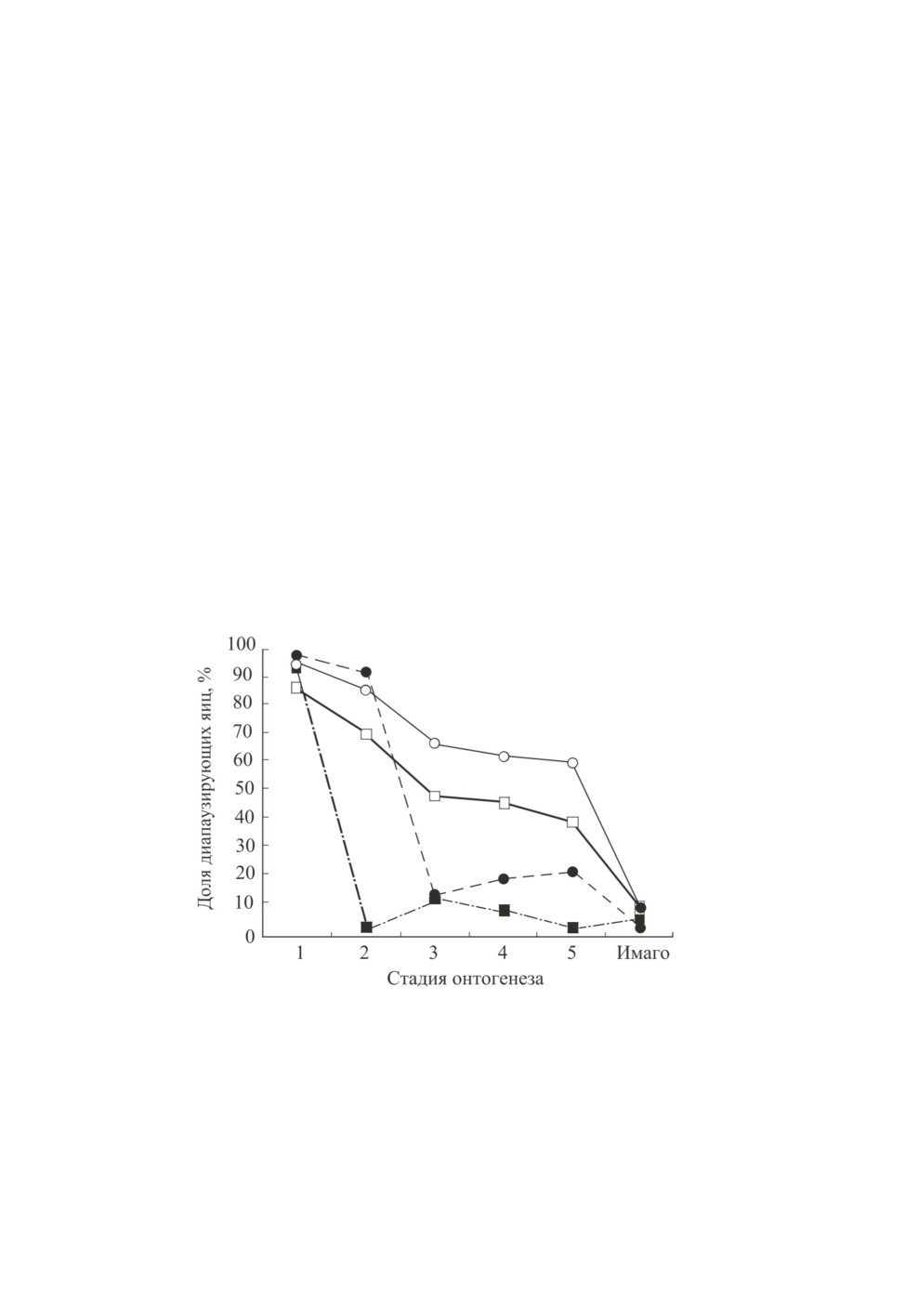
Для определения чувствительной к длине дня стадии развития A. suturalis личинок,
начиная с определенного возраста (от I до V), или имаго этого вида из длинного дня пе-
реносили и далее содержали в двух короткодневных режимах 8 и 10 ч света в сутки
(рис. 6). Максимальное количество диапаузирующих яиц отложили самки из варианта
с личинками, содержавшимися в коротком дне, начиная с I возраста. В следующем ва-
рианте (содержание в коротком дне личинок, начиная со II возраста) доля диапаузиру-
ющих яиц была меньше. С увеличением возраста испытуемых личинок на момент
переноса в короткий день от III до V количество диапаузирующих яиц в потомстве са-
мок уменьшалось и сократилось до нуля в варианте опыта, когда в коротком дне содер-
жали только имаго. Таким образом, чувствительность к длине дня была максимальной
у личинок I возраста материнского поколения. Уровень чувствительности к фотопери-
оду у личинок A. suturalis всех возрастов зависел и от длины дня. В более коротком
15
Рис. 5. Фотопериодическая реакция индукции зимней эмбриональной диапаузы
у Adelphocoris suturalis (Jakovlev) (А) и Apolygus lucorum (Meyer-Dür) (Б) при температурах
17, 20 и 26 °С. Популяции из провинции Хэнань (Китай; 35.1° с. ш., 113.5° в. д.)
(по: Feng et al., 2012).
Пунктиром показан порог ФПР.
дне (в данном случае 8 ч света в сутки) он был выше, чем в вариантах с более длинным
днем (10 ч). Снижение чувствительности от I к V возрасту шло постепенно и синхрон-
но при разных фотопериодических режимах, но в обоих вариантах длины дня имаго
не обладали способностью воспринимать и оценивать длину дня, поэтому все яйца,
отложенные самками из этого режима, были недиапаузирующими (Feng et al., 2012).
Род APOLYGUS China, 1941
Apolygus lucorum (Meyer-Dür, 1847) (green plant bug).
Трансевразиатский вид, завезен в Северную Америку. Данные о находках в Африке
(Алжир и Египет) считаются ошибочными (Zhang, Zhao, 1996; Kerzhner, Josifov, 1999;
Винокуров и др., 2010).
В природных условиях Дальнего Востока России и в Японии клопы были отмечены
на разных видах полыни (Artemisia) (Винокуров, Канюкова, 1995; Watanabe et al., 1997),
однако оказалось, что и личинкам, и имаго свойственна широкая полифагия. Особенно
ярко это свойство проявилось с введением в культуру генно-модифицированного хлоп-
чатника, и Apolygus lucorum, наравне с видами рода Adelphocoris (см. выше), приобрел
статус ключевого вредителя не только хлопчатника, но и многих других сельскохозяй-
ственных культур, включая зерновые, овощные и плодовые (Lu et al., 2008, 2010a; Lu,
Wu, 2011; Pan et al., 2013).
16
Таблица 2. Длительность развития преимагинальных стадий Apolygus lucorum (Meyer-Dür)
при постоянной температуре. Популяция из провинции Хэбэй (Китай; 39.5° с. ш., 116.7° в. д.)
(по: Lu et al., 2010b)
Средняя длительность развития (± S. E., дни) преимагинальных
Стадия развития
стадий при разных температурах, °C
10
15
20
25
30
35
Яйцо
-
14.9 ± 0.3
11.0 ± 0.2
8.2 ± 0.1
6.7 ± 0.1
6.3 ± 0.1
Личинка I возраста
7.3 ± 0.4
5.6 ± 0.2
3.6 ± 0.1
3.0 ± 0.1
2.0 ± 0.1
2.6 ± 0.2
Личинка II возраста
5.9 ± 0.4
4.0 ± 0.2
2.8 ± 0.2
1.6 ± 0.1
1.6 ± 0.1
2.3 ± 0.4
Личинка III возраста
5.6 ± 0.5
4.4 ± 0.2
2.4 ± 0.1
2.2 ± 0.1
1.5 ± 0.1
1.7 ± 0.3
Личинка IV возраста
6.5 ± 0.4
4.5 ± 0.2
2.6 ± 0.1
1.8 ± 0.1
1.9 ± 0.1
2.1 ± 0.3
Личинка V возраста
12.9 ± 0.7
7.7 ± 0.2
4.1 ± 0.1
3.2 ± 0.1
3.0 ± 0.1
2.4 ± 0.3
Личинка с I по V возраст
38.2 ± 0.8
26.2 ± 0.2
15.5 ± 0.2
11.8 ± 0.2
10.2 ± 0.2
11.1 ± 0.6
Благодаря ярко выраженной миграционной активности A. lucorum дает вспышки
массовых размножений на обширных территориях (Lu et al., 2007). Поскольку имаго
обычно живут долго и поколения перекрываются, количество генераций, завершаемых
в году, определить трудно. В связи с этим в лабораторных условиях было исследовано
влияние постоянных температур на развитие преимагинальных стадий A. lucorum
(Lu et al., 2010b; табл. 2).
На основании полученных данных с применением метода линейной регрессии опре-
делены НТП и СЭТ, необходимая для завершения одного поколения. Они составили
3.2 °C и 179.2 гр.-дн. для яиц и 3.7 °C и 262.4 гр.-дн. для личинок соответственно. Рас-
чет возможного количества ежегодно реализуемых поколений, проведенный на основе
полученных данных, показал, что на севере Китая A. lucorum может завершать до 5 по-
колений за год (Lu et al., 2010b).
Сравнение показателей развития преимагинальных стадий Apolygus lucorum и 3 ви-
дов рода Adelphocoris (Lu et al., 2010b; табл. 3), совместно обитающих на хлопковых
полях, свидетельствует о том, что НТП и яиц, и личинок ниже, а также СЭТ, необходи-
мая для завершения этих стадий, у A. lucorum значительно меньше, чем у слепняков
рода Adelphocoris. Это объясняет фенологию указанных видов на севере Китая,
Таблица 3. Температурные нормы развития преимагинальных стадий Apolygus lucorum (Meyer-
Dür) и 3 видов рода Adelphocoris Reuter при питании хлопком. Популяции из провинции Хэбэй
(Китай; 39.5° с. ш., 116.7° в. д.) (по: Ting, 1963 - цит. по: Lu et al., 2010b)
Яйца
Личинки
Вид
НТП, °C
СЭТ, гр.-дн.
НТП, °C
СЭТ, гр.-дн.
Apolygus lucorum
3.0
188
4.6
340
Adelphocoris suturalis (Jakovlev)
5.4
214
9.0
329
A. fasciaticollis Reuter
7.8
186
7.0
373
A. lineolatus (Goeze)
5.2
213
6.7
409
17
где Apolygus lucorum обычно завершает 5 поколений за год, а виды рода Adelphocoris -
только 3 или 4.
Так же, как адельфокорисы, аполигусы зимуют в состоянии эмбриональной диапау-
зы. В лабораторных условиях исследована в сравнительном плане роль температуры
и фотопериода в индукции зимней диапаузы у A. lucorum (Feng et al., 2012). В экспери-
ментах использованы особи из популяции, обитающей в провинции Хэнань (север Ки-
тая; 35.1° с. ш., 113.5° в. д.).
Диапаузу у A. lucorum индуцирует короткий день. Критическая длина дня при темпе-
ратурах от 17 до 26 °C оказалась термостабильной (13 ч 19 мин) и очень близкой к та-
ковой у A. suturalis (13 ч 18 мин; рис. 5, А и Б). Однако у популяции A. lucorum,
обитающей на три градуса севернее (Китай, провинция Шаньдун), фотопериодиче-
ский порог индукции диапаузы изменялся в зависимости от температуры и составил
13 ч 10 мин при 17 °C, 12 ч 58 мин при 20 °C, и 12 ч 51 мин при 23 °C (Zhuo et al., 2011 -
цит. по: Feng et al., 2012).
Максимальная чувствительность к длине дня у A. lucorum так же, как и у A. suturalis,
оказалась приуроченной к стадии личинки I возраста материнского поколения, но
у A. suturalis она постепенно понижалась от I к V возрасту, тогда как у A. lucorum резко
снижалась уже во II возрасте. В обоих случаях динамика потери чувствительности
к длине дня зависела от фотопериода: чем короче был день (в данном случае 8 ч света
в сутки), тем резче была выражена эта чувствительность (рис. 6).
Рис. 6. Индукция зимней эмбриональной диапаузы у потомства Adelphocoris suturalis (Jakovlev)
(сплошные линии) и Apolygus lucorum (Meyer-Dür) (пунктирные линии) при содержании
личинок, начиная с разного возраста, и имаго родительского поколения в короткодневных
фотопериодических режимах 8 ч света в сутки (круглые символы) и 10 ч
(квадратные символы). Популяции из провинции Хэнань (Китай; 35.1° с. ш., 113.5° в. д.)
(по: Feng et al., 2012).
По горизонтальной оси - стадия жизненного цикла и возраст (обозначен цифрами) личинок,
в котором их переносили из длинного дня в короткий. Температура 26 °С.
18
Род LYGUS Hahn 1833
Этот род - один из крупнейших в подсем. Mirinae. Он объединяет более 50 извест-
ных видов, распространенных по всему свету, из них 34 - обитатели Северной Амери-
ки, 19 - Европы, и 2 вида известны из Китая. Считается, что ни один американский
вид не натурализовался в Европе, при этом отдельные европейские виды очень редко,
но отмечаются на американском континенте (Kelton, 1975; Kerzhner, Josifov, 1999;
Aglyamzyanov, 2009); исключение составляет Lygus rugulipennis.
Lygus rugulipennis Poppius, 1911 (травяной клоп; European tarnished plant bug).
Ареал голарктический: в Палеарктике вид отмечен от Великобритании и Испании
до Дальнего Востока России и Японии (Kerzhner, Josifov, 1999; Винокуров и др., 2010),
в Северной Америке - от Аляски до севера Калифорнии и юга Колорадо (Schwartz,
Foottit, 1998). Из 19 палеарктических видов рода Lygus (Aglyamzyanov,
2009)
L. rugulipennis - не только самый распространенный, но и наиболее массовый и вредо-
носный (Пучков, 1966). До недавнего времени трудности диагностики слепняков при-
водили к ошибочному определению ряда видов, в том числе этого. Так, многие указания
Lygus pratensis L. из Англии или L. disponsi Linnavuori из Японии в действительности
относятся к L. rugulipennis (Kerzhner, Josifov, 1999; Schaefer, Panizzi, 2000). Современ-
ные молекулярно-генетические методы видовой диагностики позволят, вероятно, избе-
гать подобных ошибок.
Lygus rugulipennis - широкий полифаг, питается более чем на 400 видах травянистых
и кустарниковых растений из 57 семейств (Holopainen, Varis, 1991; Schaefer, Panizzi,
2000; Wheeler, 2001). Клопы используют все сочные части растений, но предпочитают
генеративные органы; повреждают многие культуры, в том числе бобовые, зерновые,
плодовые, декоративные и лекарственные растения. Отмечено, например, питание ли-
чинок и имаго на сеянцах сосны обыкновенной, причем в лабораторных условиях по-
казано, что клопы способны полноценно завершать развитие полного поколения
питаясь лишь хвоей сосны (Holopainen, 1986). В Англии травяной клоп сильно вредит
на плантациях клубники и земляники (Easterbrook, 1997). Характерную особенность
всех поколений L. rugulipennis составляет большая подвижность. Клопы легко переко-
чевывают с одних видов растений на другие и в поисках сочной растительности легко
преодолевают расстояния в 1-2 км (Пучков, 1966).
Зимуют взрослые клопы. Самки L. rugulipennis всегда залегают на зимовку с нераз-
витыми яичниками, тогда как у самцов осенью гонады ярко-зеленые, не отличающиеся
по виду от зрелых. Часть клопов остается зимовать под растительными остатками сре-
ди стерни многолетних трав, другие переселяются в заросли кустарников, полезащит-
ные полосы, на опушки лесов, расположенные нередко на расстоянии в несколько
километров. После зимовки самки обычно откладывают яйца в стебли и черешки ли-
стьев многолетних бобовых трав (Пучков, 1966).
На севере Европы (Шотландия, Швеция) травяной клоп имеет моновольтинный се-
зонный цикл (Kullenberg, 1944; Stewart, 1969). Подробные исследования фенологии
L. rugulipennis на сахарной свекле проведены в окрестностях Тиккурилы (Финляндия;
60.3° с. ш., 25.0° в. д.; Varis, 1972, 1995), где за год завершается также только одно по-
коление (рис. 7). Зимуют имаго под остатками травянистой и древесной растительно-
19
Рис. 7. Фенология Lygus rugulipennis Poppius в окрестностях Тиккурилы (Финляндия;
60.3° с. ш., 25.0° в. д.; по: Varis, 1972).
сти, при этом смертность во время зимовки обычно очень высока, достигая 80 % (Varis,
1972).
На большей части Палеарктики L. rugulipennis реализует 2 поколения в год (Пучков,
1966). В частности, такие данные приводят для Чехии (Sedivy, Honek, 1983), Румынии
(Cojocaru, 1997) и Венгрии (Kocka, 1985). По наблюдениям в Англии (Southwood,
Leston, 1959), этот слепняк также образует 2 поколения, причем перезимовавшие сам-
ки после откладки яиц живут очень долго, что необычно для клопов. Некоторые особи
доживают до августа, следовательно, в природных популяциях могут одновременно
встречаться особи не только 2 последовательных поколений (материнского и дочерне-
го), но и «бабушки с внуками». Любопытная особенность фенологии этого вида отме-
чена в Польше. Клопы, питаясь на голубом люпине (род Lupinus), образуют 1 поколение
за год, а на белом и желтом - 2 (Gorski, 1996).
На юге Палеарктики развивается до 4 поколений (Асанова, Искаков, 1977); в Ита-
лии - 3-4 (Tavella et al., 1994, 1997), на Японских островах вид би- и тривольтинный
(Hori, Hanada, 1970).
Исследования, выполненные в Англии (Кент; примерно 50° с. ш., 0° в. д.) и направ-
ленные в первую очередь на оптимизацию защитных мероприятий против вредной де-
ятельности L. rugulipennis на ремонтантных сортах земляники, установили,
что перезимовавшие под остатками дикой растительности клопы образуют I поколе-
ние, развитие которого проходит как на землянике, так и на диких растениях. Имаго
этого I летнего поколения окрыляются в конце июня и в начале июля. Часть из них
остается на дикой растительности, образуя II поколение, большая же часть перелетает
на посадки ремонтантной земляники, где развивается II, а иногда и III поколение вре-
дителя. За счет иммигрантов численность популяции на землянике стремительно воз-
растает, причиняя ощутимый вред вследствие питания личинок на завязывающихся
плодах (Easterbrook, 1997, 2000; Easterbrook et al., 2003; Xu et al., 2014). Предложена
модель, позволяющая прогнозировать сроки развития L. rugulipennis на посадках зем-
ляники поздних сроков плодоношения и способствующая своевременному использо-
ванию инсектицидов против этого вредителя. Вместе с тем, недавние наблюдения
в Англии обнаружили, что клопы I поколения могут мигрировать и причинять вред
20
и многим другим культурам, включая ранние сорта земляники, ежевику, малину и т. д.
(Xu et al., 2014).
Lygus pratensis (Linnaeus, 1758) (полевой клоп, или слепняк луговой; tarnished plant
bug).
Ареал - западно-центральнопалеарктический: практически вся Европа, Индия
(Kerzhner, Josifov, 1999; Винокуров и др., 2010); на Британских островах относительно
редок (Woodroffe, 1966); указания данного вида из различных регионов Сибири требу-
ют уточнения (Винокуров и др., 2010).
Lygus pratensis - один из самых обычных видов рода. Биологически и экологически
очень близок к L. rugulipennis, имеет очень похожий ареал и часто обитает на полях
совместно с ним, но в несколько меньших количествах, особенно в Западной Европе
(Пучков, 1966). Широкий полифаг. Сильно вредит бобовым, зерновым, огородным
и плодовым культурам, особенно люцерне, свекле, кукурузе, табаку, хлопчатнику, ты-
кве, картофелю, конопле, подсолнечнику, винограду, огурцам, малине, землянике
и многим другим растениям. В Китае отмечено 52 вида растений из 18 семейств, на ко-
торых встречаются личинки и имаго полевого клопа (Lu, Wu, 2008). Lygus pratensis -
переносчик многих заболеваний растений, в частности крапчатости листьев картофеля,
вирусной болезни люцерны, бактериоза фасоли, мозаичной болезни табака и свеклы
(Пучков, 1966). На Памире этот слепняк поставил под угрозу возможность возделыва-
ния картофеля (Асанова, Искаков, 1977).
На севере России полевой клоп дает 1 поколение за год, на юге - до 4 трудно разгра-
ничиваемых поколений (Пучков, 1966). На юге Финляндии (Хельсинки, 60° с. ш.,
25° в. д.) отмечается 1 поколение (Varis, 1997), в Казахстане (Алматы, 43° с. ш., 77°
в. д.) - 3 поколения (Асанова, Искаков, 1977), в Испании (Дуэро, 41.8° с. ш.,
8.4° в. д.) - 4 (Asensio de la Sierra, 1973), на северо-западе Китая (Синьцзян-Уйгурский
автономный район, 41° с. ш.) - до 4 поколений (Yang, Yang, 2001). Зимуют имаго
под растительными остатками. Весной клопы переселяются на вегетирующие расте-
ния, где проходят дополнительное питание и размножаются.
Полевой клоп обладает сильно выраженной способностью к дальним миграциям.
Есть сведения о регистрации особей этого вида в воздушном планктоне на высоте
до 915 м над ур. м. (Johnson, Southwood, 1949).
Изучению особенностей биологии и эко-физиологии L. rugulipennis большое внима-
ние уделяют в Китае, поскольку на северо-западе страны (Синьцзян-Уйгурский авто-
номный район) он отмечен как основной вредитель хлопка и люцерны (Yang, Yang,
2001; Zhang et al., 2017). По наблюдениям на севере региона, имаго этого вида после
зимовки появляются в конце апреля, и самки откладывают яйца на сорные растения
и плодовые культуры (груша, виноград), на которых развиваются особи I поколения.
Имаго этого поколения в июле перелетают на хлопковые поля и образуют II поколение.
Именно особи II и III поколений, развиваясь на хлопке, создают максимальную чис-
ленность популяции. Имаго III поколения окрыляются в конце августа и мигрируют
в места зимовки (Liu et al., 2015). На юге Синьцзяна перезимовавшие имаго выходят
из диапаузы в марте, и клопы местной популяция успевают образовать 4 поколения,
из которых I и IV питаются на древесных культурах, а II и III - на хлопке (Yang et al.,
2004).
21
По лабораторным данным для популяции L. pratensis из Корла (Синьцзян, Китай,
41.4° с. ш., 85.5° в. д.), НТП развития яиц составляет 11.97 °C, личинок - 12.08 °C.
Необходимая для завершения эмбриональной стадии СЭТ составляет 131.6 гр.-дн.,
для личиночной стадии - 208.3 гр.-дн. Наиболее благоприятен для преимагинального
развития повышенный уровень относительной влажности воздуха - около 75 % (Liu
et al., 2015).
Среди североамериканских видов рода Lygus интерес представляют 4: Lygus
lineolaris, L. borealis, L. hesperus и L. elisus, наиболее изученные в связи с их суще-
ственным экономическим значением (Schwartz, Foottit, 1992; Gerber, Wise, 1995).
Lygus lineolaris (Palisot de Beauvois, 1818) (tarnished plant bug).
Этот вид широко распространен по всему североамериканскому континенту от Кана-
ды до Мексики и известен как основной вредитель хлопка, рапса и люцерны. Личинок
и имаго L. lineolaris находили на 328 видах растений из 55 семейств (Young, 1986). Чис-
ло поколений L. lineolaris в этом регионе изменяется от 1 на севере Канады (60º с. ш.)
до 4 и более перекрывающихся поколений на юге США (33º с. ш.) (Strong et al., 1969;
Kelton, 1975; Snodgrass et al., 1984). Клопы благополучно развиваются на разных рас-
тениях и, как правило, в разных поколениях заселяют разные культуры, легко переме-
щаясь на большие расстояния. Питаясь в основном растительным кормом, клопы
употребляют и животную пищу, нападая на разных насекомых - слепняков Adelphocoris
lineolatus, картофельную цикадку Empoasca fabae (Harris), яйца и личинок колорадско-
го жука Leptinotarsa decemlineata (Say), люцернового долгоносика Hypera postica
(Gyllenhal), мелких гусениц и многих других членистоногих (Wheeler, 2001). Зимуют
имаго (Guppy, 1958; Kelton, 1975).
В Манитобе (Виннипег, юг Канады; 49.9º с. ш., 97.1º з. д.) L. lineolaris образует
2 перекрывающихся поколения в год (Gerber, Wise, 1995). Перезимовавшие имаго по-
являются в апреле-мае на люцерне, землянике и других травянистых растениях
и в течение мая-июня откладывают яйца. Личинки I поколения встречаются до кон-
ца июля, а с конца июня до начала августа идет окрыление имаго I поколения. Личинки
II поколения заканчивают развитие осенью и окрыляются в конце сентября. Однако
первые, наиболее рано окрыляющиеся имаго появляются уже в августе, так что в авгу-
сте поколения частично перекрываются. Окрыляющиеся поздней осенью имаго фор-
мируют зимнюю диапаузу, и самки уходят на зимовку с неразвитыми половыми
продуктами (остановка развития гонад на стадии превителлогенеза). В некоторые годы
до 20 % особей I поколения остаются зимовать. Первое поколение обычно проходит
на люцерне, а II, более многочисленное, на рапсе, причем миграция взрослых клопов
на поля рапса строго синхронизирована с периодом его цветения (Gerber, Wise, 1995).
В Ашвилле (Северная Каролина, США; 35.5° с. ш., 82.5° з. д.) L. lineolaris образует
2 или 3 поколения в год (Stewart, Khoury, 1976). Перезимовавшие имаго появляются
в конце марта, имаго летнего поколения окрыляются с конца мая по август, имаго
II поколения появляются в конце августа или сентябре и остаются зимовать. В середи-
не лета, возможно, проходит еще одно поколение (McPherson et al., 1983).
На юге североамериканского континента подробно исследована популяция
L. lineolaris в Стоунвилле (Миссисипи, США; 33.4° с. ш., 90.9° з. д.), где этот вид в
обычные годы образует 2 поколения, а в теплые - 3, проявляя иногда круглогодичную
22
активность (Bariola, 1969; Kelton, 1975; Snodgrass et al., 1984; Snodgrass, 2003; Villavaso,
Snodgrass, 2004).
В лабораторных экспериментах было установлено, что постоянное содержание ли-
чинок L. lineolaris при температурах 21 и
27
°C и короткодневных условиях
12 и 12.5 ч света в сутки вызывает формирование диапаузы у всех окрыляющихся има-
го. Перенос диапаузирующих имаго в более высокую температуру (27 °C) и в более
продолжительный фотопериод (13.5 ч) через две недели приводит к терминации диапа-
узы и полной репродуктивной активности всех особей. В том случае, когда преимаги-
нальное развитие идет при длине дня 13 ч света в сутки, все окрыляющиеся имаго
активны и способны к размножению. Эти данные свидетельствуют о том, что порог
ФПР при исследованных температурах находится между 12.5 и 13 ч света в сутки. Чув-
ствительность к длине дня проявляют и личинки, и имаго (Bariola, 1969).
В дальнейшем основное внимание исследователей было сконцентрировано на выяс-
нении роли длины дня в индукции диапаузы в природных популяциях L. lineolaris
(Snodgrass, 2003). Для этого в течение 3 лет в разные сроки, начиная с августа, собира-
ли личинок и отмечали количество диапаузирующих особей среди имаго, окрыляю-
щихся в разных сериях. Установленная ранее в лабораторных экспериментах
критическая длина дня, определяющая формирование диапаузы у половины тестируе-
мых особей (12.5 ч света в сутки), наступает в регионе исследований 12-14 сентября
(Snodgrass, 2003). В сериях личинок, собранных в августе, среди окрыляющихся имаго
диапаузирующих особей было немного (не более 7-8 %). В дальнейшем их количество
постепенно возрастало, достигая 100 % в сериях личинок, которых собирали в кон-
це октября или начале ноября.
Интересная особенность годичного цикла L. lineolaris в дельте Миссисипи была об-
наружена при изучении сроков терминации диапаузы у имаго, зимующих на разных
видах растений. У клопов, зимовавших на цветущих растениях яснотки стеблеобъем-
лющей (Lamium amplexicaule L.), диапауза терминировалась уже в декабре. Так, среди
собранных с этого растения имаго количество диапаузирующих не превышало в кон-
це декабря 9 %, а более 90 % самок были репродуктивно активными и не менее 50 %
из них уже содержали зрелые яйца (Snodgrass, 2003). У клопов, зимовавших на остат-
ках разных травянистых растений, возобновление активности начинается в январе, т. е.
на месяц позже. По мнению авторов (Snodgrass et al., 1984, 2012; Snodgrass, 2003), за-
вершение диапаузы в декабре связано с наличием благоприятного корма - цветущих
растений Lamium amplexicaule. Это предположение нашло подтверждение и в экспери-
ментах. Лабораторные тесты показали, что при наличии цветущих растений и при бла-
гоприятной температуре клопы активизируются даже в короткодневных условиях,
обычно поддерживающих диапаузное состояние. Благодаря ранней терминации диапа-
узы у Lygus lineolaris на юге континента местная популяция успевает образовать вес-
ной дополнительное поколение, имаго которого окрыляются уже во второй
половине марта.
К сожалению, несмотря на подробные экспериментальные исследования влияния
внешних факторов на развитие L. lineolaris и в лабораторных, и в природных условиях
юга североамериканского континента (Snodgrass et al., 2012), неясными остаются неко-
торые особенности сезонного развития местных популяций этого вида. В частности,
непонятно, насколько независимы популяции, зимующие на разных кормовых расте-
ниях и образующие вследствие этого разное количество поколений; каким образом
23
происходит разделение популяции по растениям на время зимовки; почему часть попу-
ляции остается на зимовку на увядающих поздней осенью сорняках, а другая мигриру-
ет на вегетирующую и цветущую зимой яснотку, не оптимальную для питания
в весенний период; как происходило освоение яснотки (инвазионного в Северной Аме-
рике растения) в качестве оптимального растения-хозяина для питания зимой? Эти и
некоторые другие вопросы требуют дальнейших исследований.
Lygus borealis (Kelton, 1955).
Типичный обитатель степной зоны (прерий) Канады (Scudder, 2014). Сезонное раз-
витие исследованной популяции этого вида в Манитобе сходно с таковым L. lineolaris
(Gerber, Wise, 1995).
Lygus hesperus (Knight, 1917) (западный полевой клоп; western tarnished plant bug).
Широко распространен по всему западному побережью Северной Америки (регион
Скалистых гор) от Британской Колумбии (Канада) до штата Нью-Мексико (США),
где в зависимости от тепловых ресурсов вегетационного сезона развивается
от 1 до 5 поколений. Сезонное развитие L. hesperus исследовано наиболее подробно
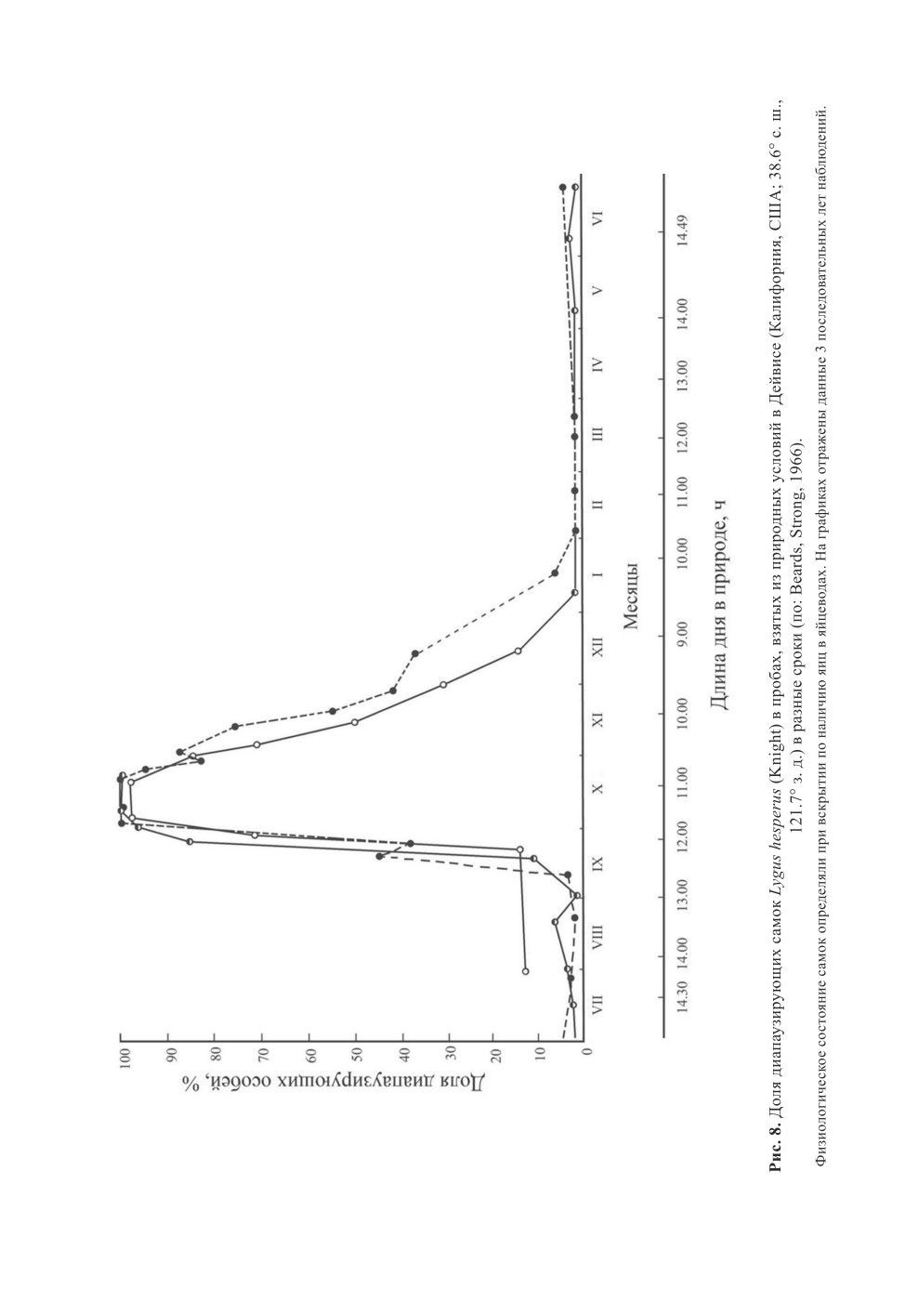
в Дейвисе (Калифорния, США; 38.6° с. ш., 121.7° з. д.). Здесь в зависимости от мест-
ных температурных условий он производит от 3 до 5 поколений в течение года (Beards,
Strong, 1966; Gillespie et al., 2003). Первые диапаузирующие самки появляются во вто-
рой половине сентября, когда длина дня уменьшается до 12.5 ч света в сутки. В нача-
ле октября все самки находятся в диапаузном состоянии (рис. 8).
Однако уже в течение ноября доля диапаузирующих особей L. hesperus в природных
популяциях стремительно снижается, и в январе все клопы физиологически готовы
к активной жизнедеятельности и, в частности, к размножению. В декабре-феврале
самки откладывают яйца. Относительно низкая температура в это время года, видимо,
задерживает отрождение личинок, так как появление первых из них отмечают не ранее
начала апреля. Ранняя терминация диапаузы у зимующих клопов L. hesperus кажется
необычной, но она соответствует данным, полученным в специальных наблюдениях
в этом же регионе (Шафтер, Калифорния, США; 35.5° с. ш., 119.3° з. д.) другим авто-
ром (Leigh, 1966; рис. 9). Первые диапаузирующие самки L. hesperus были отмечены
уже в сентябре. В октябре их количество стремительно возрастало, достигая максиму-
ма в середине месяца, а к январю практически все самки оказывались репродуктивно
активными.
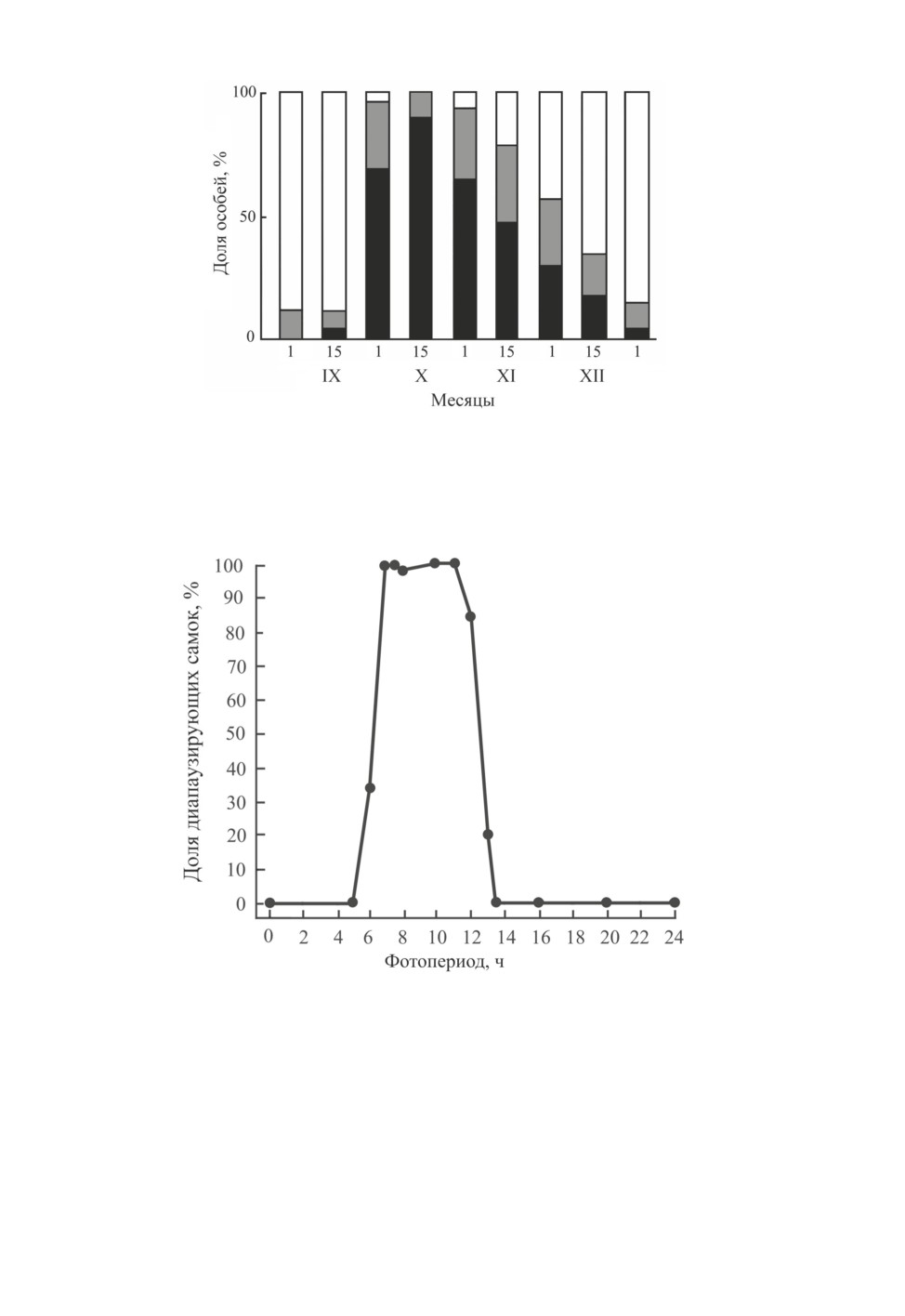
Условия индукции имагинальной диапаузы экспериментально исследованы для по-
пуляции L. hesperus из Дейвиса. При 27 ºС клопы формируют диапаузу в короткоднев-
ных условиях, с длиной дня от 6 до 13 ч света в сутки. Правый экологически значимый
порог ФПР близок к 12.5 ч (Beards, Strong, 1966; рис. 10). В специальных опытах с пе-
реносами физиологически активных клопов из длинного дня (16 ч света в сутки) в ко-
роткий (10 ч) и диапаузирующих клопов из короткого дня в длинный было показано,
что фотопериодические сигналы воспринимаются и личинками, и имаго (Beards,
Strong, 1966). Позже было обнаружено, что для индукции диапаузы наибольшее значе-
ние имеет длина дня в период развития личинок IV возраста. Критическая длина дня,
индуцирующая наступление имагинальной диапаузы, наступает в природе 1 сентября.
Но, как было показано в лабораторных экспериментах, короткий день необходим
не только для индукции диапаузы у L. hesperus, но и для ее поддержания, так как даже
24
Рис. 9. Доля диапаузирующих и активных самок Lygus hesperus (Knight) в природных
популяциях в Шафтере (Калифорния, США; 35.5° с. ш., 119.3° з. д.) в течение осенних
и зимних месяцев (по: Leigh, 1966).
Черные поля - диапаузирующие самки, светлые - активные, серые - самки на ранних этапах оогенеза.
Физиологическое состояние самок определяли при вскрытии.
Рис. 10. Фотопериодическая реакция индукции зимней имагинальной диапаузы у самок Lygus
hesperus (Knight) при температуре 27 °С. Популяция из Дейвиса (Калифорния, США;
38.6° с. ш., 121.7° з. д.) (по: Beards, Strong, 1966).
10 длиннодневных стимулов в период имагинальной жизни полностью снимают эф-
фект короткого дня, т. е. терминируют диапаузу (Spurgeon, 2017).
В дальнейшем большой цикл работ по изучению реакций, участвующих в регуляции
сезонного развития L. hesperus, был выполнен на двух популяциях, обитающих на юге
Северной Америки: из Шафтера (Калифорния, США; 35.5° с. ш., 119.3° з. д.) и Мари-
26
копа (Аризона, США; 33.5º с. ш., 112.5º з. д.). Исследованы температурные нормы раз-
вития всех стадий онтогенеза при постоянных (Cooper, Spurgeon, 2012, 2013, 2015)
и переменных температурах (Spurgeon, Brent, 2019), физиология и регуляция репро-
дуктивного процесса (Brent, 2010a, 2010b; Brent, Spurgeon, 2011), морфологические
особенности клопов в состоянии диапаузы (Spurgeon, Brent, 2010), разница в индукции
диапаузы между полами (Spurgeon, Brent, 2015), термостабильность ФПР (Spurgeon,
2020). Особо отмечена возможность эндогенных изменений тенденции к диапаузе
в лабораторных культурах западного полевого клопа при длительном их содержании
в постоянных условиях (Spurgeon, 2012). В целом эти материалы не только подтверди-
ли полученные ранее результаты, но существенно расширили представления об эколо-
гических механизмах, на основе которых осуществляется синхронизация сезонного
развития L. hesperus с локальными условиями климата.
Lygus elisus Van Duzee, 1914 (pale legume bug).
Встречается на западе Северной Америки от Аляски до штата Нью-Мексико (США),
на востоке достигает штата Айова. Этот вид в Северной Америке не такой многочис-
ленный, как L. hesperus, но один из самых распространенных слепняков рода Lygus
и один из немногих полевых клопов, сильно повреждающих семена рапса (Schwartz,
Foottit, 1992). Комплекс наиболее вредоносных видов рода Lygus в штате Техас имеет
следующую количественную структуру: Lygus hesperus - 87 %, L. lineolaris - 12 %,
L. elisus - 1 % (Bommireddy et al., 2004).
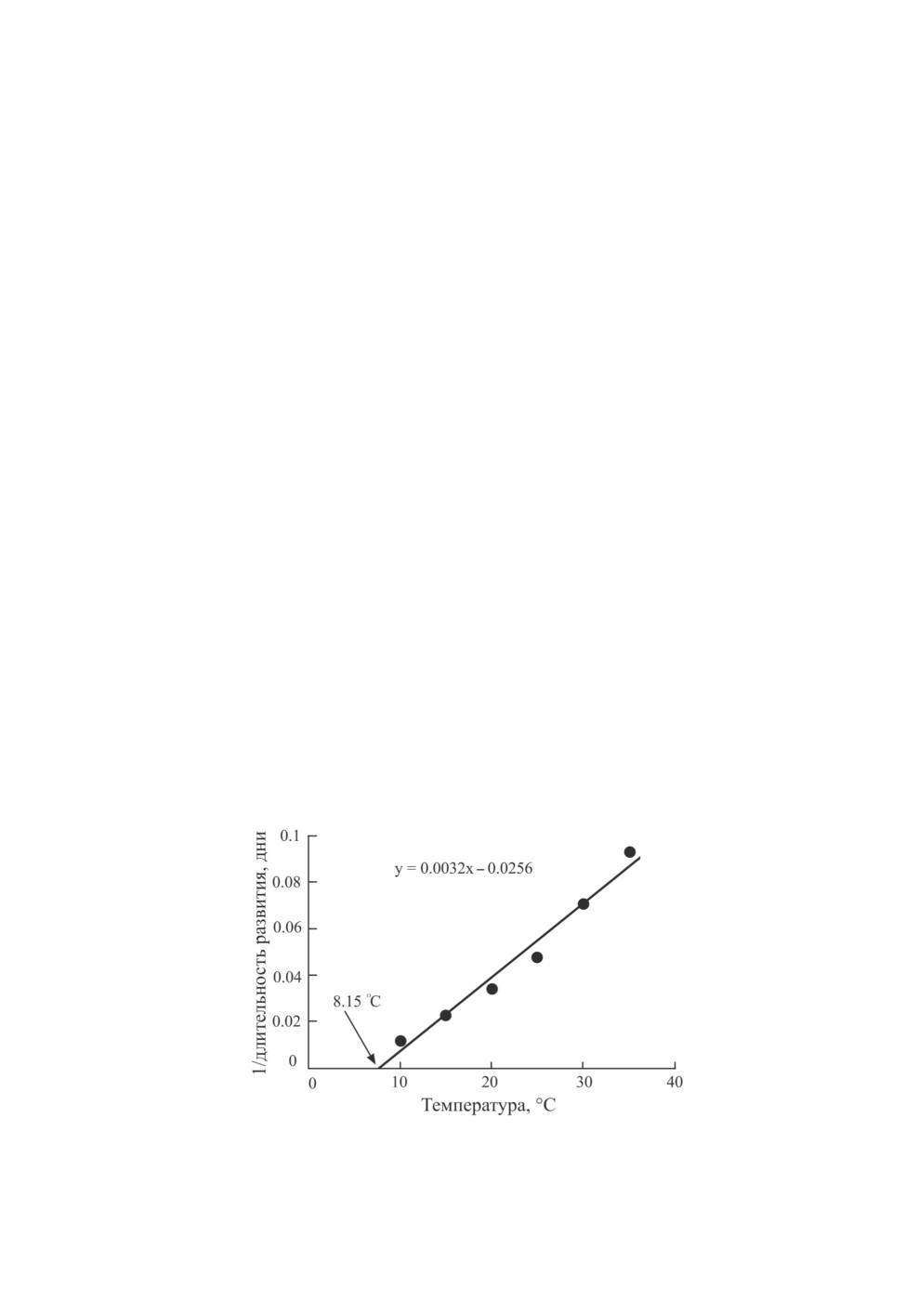
Экспериментально исследованы температурные нормы развития преимагинальных
стадий и определен НТП развития личинок L. elisus популяции из Лаббока (Техас,
США; 33.6° с. ш., 101.9° з. д.; Bommireddy et al., 2004; рис. 11).
Исследована также популяция L. elisus из Летбриджа (Альберта, Канада; 49.7° с. ш.,
112.8° з. д.), где этот вид, как считали, образует 2 поколения за вегетационный сезон
и зимует на стадии имаго (Salt, 1945). Согласно же более поздним данным (Butts, Lamb,
1991), L. elisus в этом регионе завершает только 1 поколение.
Рис. 11. Влияние температуры на скорость развития личинок Lygus elisus Van Duzee.
Популяция из Лаббока (Техас, США; 33.6° с. ш., 101.9° з. д.) (по: Bommireddy et al., 2004).
Стрелкой показан нижний температурный порог развития личинок.
27
Род LYGOCORIS Reuter, 1875
Lygocoris pabulinus (Linnaeus, 1761) (common green capsid).
Ареал голарктический: вид широко распространен в Евразии, в Северной Америке
встречается трансконтинентально (включая США с Аляской и Канаду) (Kelton, 1971;
Yasunaga, 1991; Wheeler, Henry 1992; Schaefer, Panizzi, 2000; Винокуров и др., 2010).
В Центральной Европе L. pabulinus дает 2 поколения в год, на севере (Швеция) - 1.
В особо теплые годы в Нидерландах наблюдали частичное III поколение. В качестве
кормовых использует две группы растений - древесные породы (яблоня, груша, слива,
вишня, боярышник и др.), на которых зимуют яйца и непродолжительное время пита-
ются личинки младших возрастов, и травянистые растения (крапива, конский щавель,
картофель, сахарная свекла и многие другие), на которых проходит большая часть жиз-
ненного цикла летом (Southwood, Leston, 1959; Blommers et al., 1997).
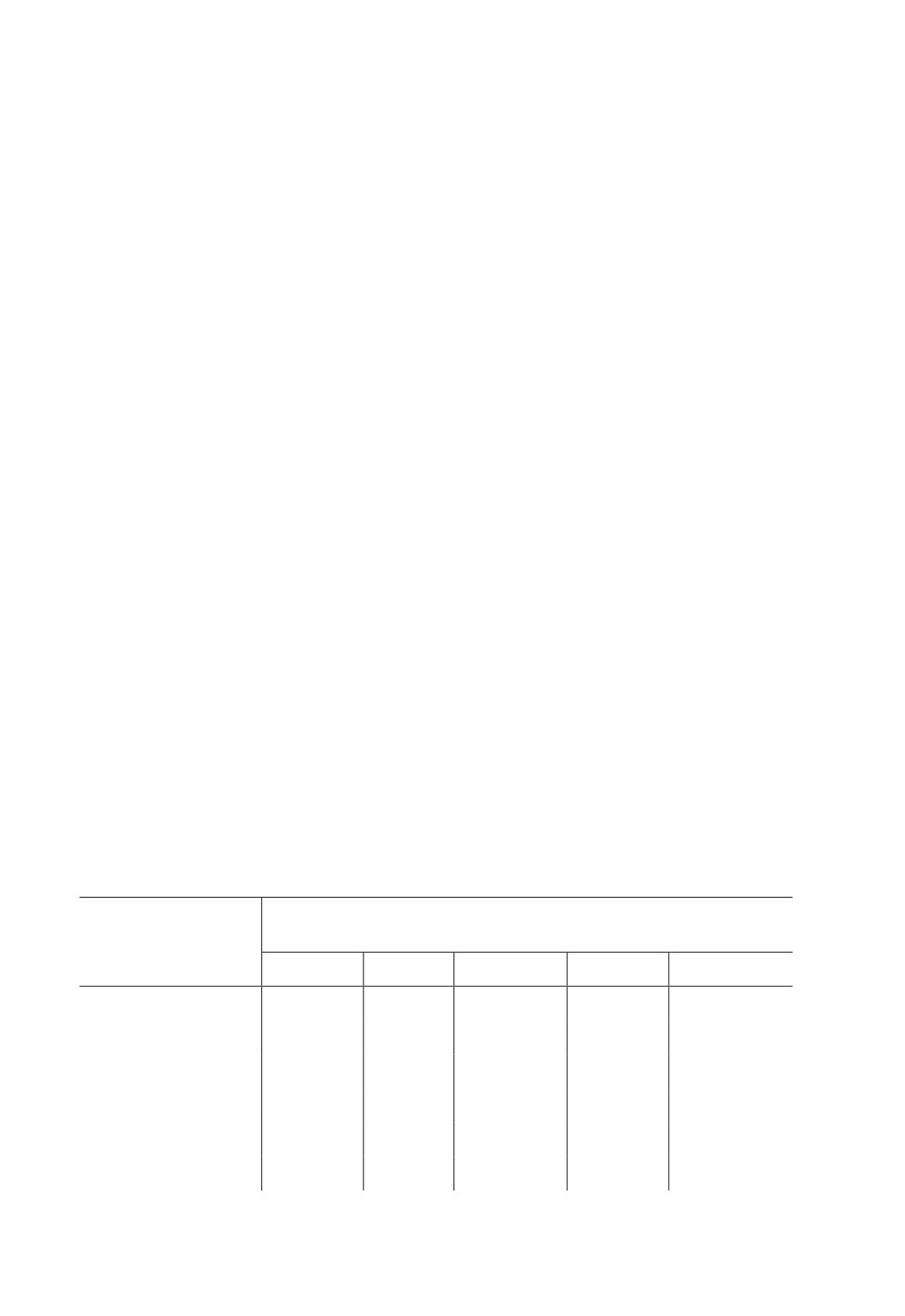
Исследованы температурные нормы развития популяции L. pabulinus из Шуленбурга
(Бельгия; 52.4° с. ш., 6.5° в. д.) (Mols, 1990; табл. 4).
Сезонный цикл L. pabulinus подробно изучен и в Вагенингене (Нидерланды;
52.0° с. ш., 5.7° в. д.) (Blommers et al., 1997). В конце лета при уменьшении длины
дня (16.5 ч и менее) во время развития личинок самки покидают травянистые расте-
ния, на которых они развивались летом, и начинают откладывать диапаузирующие
яйца. В качестве субстрата они используют молодые побеги разных кустарников и де-
ревьев не только лиственных пород, но и хвойных. После зимовки личинки I поколе-
ния отрождаются в апреле-мае и непродолжительное время питаются на древесных
породах соками флоэмы на тонких кончиках побегов, в бутонах и на молодых плодах,
а затем мигрируют на травянистые растения, так как древесные растения уступают
травянистым по питательным свойствам (Blommers et al., 1997), вследствие чего
на древесных растениях клоп не может успешно завершить онтогенез. Длинный день
(17 ч и более) во время их развития стимулирует самок к откладке летних (недиапаузи-
рующих) яиц в стебли травянистых растений.
Таблица 4. Температурные нормы развития яиц и личинок Lygocoris pabulinus (Linnaeus)
при разных температурах. Популяция из Шуленбурга (Бельгия; 52.4° с. ш., 6.5° в. д.) (по: Mols,
1990)
Средняя длительность развития (± S. E., дни) преимагинальных
стадий при разных температурах, °C
Стадия развития
11.3
14.5
19.0
20.0
25.0
Яйцо
32.2 ± 2.0
23.4 ± 1.3
17.6 ± 1.0
13.5 ± 0.6
11.0 ± 0.7
Личинка I возраста
7.1 ± 1.7
6.6 ± 1.6
4.0 ± 0.4
3.3 ± 1.0
2.8 ± 0.7
Личинка II возраста
7.0 ± 1.6
6.4 ± 1.6
3.6 ± 0.5
3.4 ± 0.5
2.8 ± 0.7
Личинка III возраста
7.5 ± 1.8
6.9 ± 1.6
3.9 ± 0.8
3.4 ± 0.9
3.1 ± 1.1
Личинка IV возраста
8.4 ± 1.7
7.7 ± 1.6
4.6 ± 0.5
3.7 ± 0.8
2.9 ± 0.8
Личинка V возраста
11.8 ± 0.5
10.8 ± 1.0
6.4 ± 0.8
5.8 ± 0.5
5.5 ± 0.8
28
Личинки II поколения L. pabulinus проводят всю свою жизнь на травянистых расте-
ниях. Короткий день (16.5 ч и менее) во второй половине лета вызывает миграцию са-
мок на древесную растительность и откладку зимующих диапаузирующих яиц;
при этом достаточным стимулом оказывается воздействие даже нескольких коротких
дней. В эксперименте личинки V возраста проявили большую чувствительность к ко-
роткодневным сигналам, чем личинки II возраста (Blommers et al., 1997).
Терминация эмбриональной диапаузы L. pabulinus происходит под действием охлаж-
дения яиц до температуры -4...+3 °C в течение 6 недель и последующей инкубации
в +17 °C по крайней мере в течение 2 недель. Отрождение личинок из перезимовавших
на древесных породах яиц начиналось независимо от СЭТ, накопленной выше НТП
зимующих яиц (4 °C), значения которой колебались в течение 15 лет наблюдений
в Бристоле (Англия) от 201 до 325 гр.-дн. (Wightman, 1968). Как показано на примере
некоторых видов насекомых (в частности L. pabulinus), для возобновления весеннего
развития им необходим определенный уровень влажности субстрата (Blommers et al.,
1997; Kerzhner, Josifov, 1999; Wheeler, 2001). Весеннее возобновление вегетации на-
прямую связано с сокодвижением у растений и, следовательно, влажностью тканей,
окружающих перезимовавшие яйца клопа.
Сезонное развитие L. pabulinus - это редкий для полужесткокрылых с поливольтин-
ным сезонным циклом пример кардинальной смены растения-хозяина (с древесных
на травянистые растения), которая скорее характерна для равнокрылых хоботных
(Homoptera).
Род STENOTUS Jakovlev, 1877
Stenotus rubrovittatus (Matsumura, 1913) (sorghum plant bug).
Распространен на юге Дальнего Востока России, в Китае, Корее и Японии (Кержнер,
1972; Kerzhner, Josifov, 1999; Винокуров и др., 2010).
В Хиросиме (Япония; 34.4° с. ш., 132.4° в. д.) S. rubrovittatus образует 4 поколения
в год. Личинки отрождаются из перезимовавших яиц в середине апреля. По результа-
там отлова клопов на светоловушку установлено, что в районе исследований четко вы-
ражены 4 пика лёта имаго: I - первая половина июня; II - вторая половина июля;
III - первая половина августа; IV - вторая половина сентября. Взрослые особи всех
поколений мигрируют с некультивируемой травянистой растительности на поля риса
(Hayashi, Nakazawa, 1988).
Экспериментально исследована популяция S. rubrovittatus из Азучу (Япония, пре-
фектура Хиросима; 35.0° с. ш., 135.9° в. д.), где прослежена динамика формирования
эмбриональной диапаузы в природных условиях. Для этого, начиная с августа, каждые
5 дней отлавливали самок и отмечали количество диапаузирующих яиц, отложенных
самками в сериях с разными сроками сбора. Установлено, что доля диапаузирующих
яиц быстро нарастает, начиная с 1-й декады сентября, и достигает 100 % в начале октя-
бря (Shigehisa, 2008).
В лабораторных условиях выявлена роль температуры и длины дня в индукции зим-
ней эмбриональной диапаузы у S. rubrovittatus (Shigehisa, 2008; рис. 12). Родительское
поколение содержали в разных условиях и определяли физиологическое состояние от-
ложенных самками яиц. Критическая длина дня при 20 и 25 °C оказалась близкой
29
Рис. 12. Индукция зимней эмбриональной диапаузы у Stenotus rubrovittatus (Matsumura).
Популяция из Азучу (Япония; 35.0° с. ш., 135.9° в. д.). (по: Shigehisa, 2008).
Клопы родительского поколения от яйца до имаго содержались в разных фотопериодических режимах
при постоянных температурах 20, 25 и 30 °С.
к 13.5 ч. Более высокая температура (30 °C) существенно подавляет тенденцию к фор-
мированию диапаузы, однако даже в короткодневном режиме 11.5 ч света в сутки
при этой температуре диапаузирует до 80 % яиц.
Stenotus binotatus (Fabricius, 1794) (стенотус двухточечный, timothy plant bug).
Этот европейско-сибирский вид завезен в Северную Америку, на Гавайи, в Австра-
лию и Новую Зеландию. Возможно, на о. Сахалин, Южные Курилы и в Японию также
был завезен (Kerzhner, Josifov, 1999; Namyatova et al., 2013). Вредит многолетним тра-
вам (Пучков, 1972). Зимует на стадии яйца.
В Великобритании личинки S. binotatus отрождаются в начале июня, имаго окрыля-
ются в июле, но уже в августе встречаются очень редко (Southwood, Leston, 1959).
По наблюдениям других авторов (Butler, 1923), имаго встречаются с июня по октябрь.
Таким образом, в Великобритании S. binotatus дает 1 поколение в год.
В Обихиро (Япония; 42.9° с. ш., 143.2° в. д.) личинки I возраста S. binotatus появля-
ются на колосках ежи сборной в середине июня, имаго окрыляются в июле, а в нача-
ле августа обычно уже исчезают. Для питания личинкам необходимы именно семена
растения, на других частях растений личинки погибают уже в III возрасте (Hori et al.,
1985). Здесь вид также развивается в 1 поколении.
ЗАКЛЮЧЕНИЕ
В данном обзоре представлены сведения по сезонному развитию клопов-слепняков
трибы Mirini (подсем. Mirinae), позволяющие охарактеризовать сезонное развитие,
свойственное клопам этого таксона, и оценить степень его изученности в отношении
сезонных адаптаций.
По литературным данным в сравнительном плане рассмотрены экологические реак-
ции, участвующие в контроле сезонного развития 14 видов из 5 родов мирин:
30
Adelphocoris, Apolygus, Lygus, Lygocoris и Stenotus. Все исследованные виды - широкие
полифаги, образующие разное число поколений в разных климатических поясах. Пред-
ставители 4 родов зимуют на эмбриональной стадии, а клопы рода Lygus зимуют
на стадии имаго. Все изученные слепняки привлекли внимание специалистов вслед-
ствие их большого экономического значения: в сельскохозяйственных зонах своих об-
ширных ареалов они отнесены к разряду наиболее опасных вредителей разнообразных
бобовых культур. Особняком стоит Adelphocoris triannulatus, обнаруженный на полях
батата в Японии и характеризующийся специфическими чертами, отличающими его от
других видов рода Adelphocoris - каннибализмом личинок и фитозоофагией имаго, не-
известными у остальных видов этого рода (Tajima et al., 2018). Подобная пищевая
специализация, сочетающая питание и растительной, и животной пищей, пока отмече-
на среди слепняков трибы Mirini только у Lygus pratensis (Wheeler, 2001).
На примере 3 видов-полифагов из рода Adelphocoris, совместно обитающих на хлоп-
ковых полях Китая, показано, что существует четкая корреляция между широтой спек-
тра кормовых растений и величиной ареала. В отличие от A. lineolatus и A. suturalis,
питающихся более чем на 100 видах растений и имеющих широкое географическое
распространение, узкий круг кормовых растений A. fasciaticollis (не более 30 видов
растений) резко ограничивает его ареал территориями Китая (центральные, северные
и юго-восточные районы) и Кореи (Kerzhner, Josifov, 1999).
Ярко выраженная способность к перелетам на дальние расстояния, развившаяся
в связи с поиском цветущей растительности, выявлена у видов рода Adelphocoris
(Craig, 1963; Пучков, 1966; Ewen, 1966) и отдельных видов рода Lygus, в частности у
L. pratensis. Известны находки особей этого вида на высоте до 915 м над ур. м. (Johnson,
Southwood, 1949).
В отличие от большинства насекомых, которые мигрируют в состоянии репродук-
тивной диапаузы (Johnson, 1969; Саулич, 1999), самки рода Adelphocoris, совершаю-
щие перелеты, содержат в яйцеводах зрелые яйца. Эта особенность мигрирующих
самок способствует успешной колонизации ими новых территорий независимо от при-
сутствия самцов, так как самкам не требуются дополнительное оплодотворение после
миграции (Lu et al., 2009a).
Для большинства экспериментально исследованных видов трибы Mirini определены
температурные нормы развития - известна длительность развития отдельных стадий
онтогенеза и всего преимагинального периода при разных температурах; с применени-
ем уравнений линейной регрессии установлены пороги развития и суммы тепла, необ-
ходимые для завершения генерации. В совокупности с наблюдениями в природных
условиях определено количество реально завершаемых за год поколений.
На примере 3 видов рода Adelphocoris (A. triannulatus, A. suturalis и A. lineolatus)
детально проанализирована роль длины дня в регуляции сезонного развития. Зимняя
эмбриональная диапауза всех 3 видов контролируется длиной дня, но чувствитель-
ной к длине дня оказалась разные стадии. Если у A. suturalis максимальную чувстви-
тельность к длине дня проявляют личинки I возраста материнского поколения (Feng
et al., 2012), то у A. triannulatus и A. lineolatus восприятие и оценка длины дня осу-
ществляются на имагинальной стадии материнского поколения (Ewen, 1966; Tajima
et al., 2018). При этом обнаружено, что если в течение жизни самки A. triannulatus
фотопериодические условия меняются на противоположные, например, с длинно-
31
го дня на короткий, как это происходит в природе осенью, физиологический статус
откладываемых ею яиц тоже может измениться (Tajima et al., 2018). Пока длина дня
в природе превышает критическое значение ФПР, самки откладывают активно разви-
вающиеся (недиапаузирующие) яйца. При уменьшении продолжительности светлой
части суток и переходе длины дня через пороговое значение самки переключаются
на откладку диапаузирующих яиц. Подобные примеры пока известны лишь у не-
многих видов насекомых; в частности, такое же свойство обнаружено у слепняка
Trigonotylus caelestialium Kirkaldy из трибы Stenodemini этого же подсем. Mirinae (Kudô,
Kurihara, 1989).
Условия формирования и окончания имагинальной диапаузы наиболее подробно из-
учены у североамериканского вида Lygus hesperus на юге США. Основную роль в ин-
дукции диапаузы местной популяции играет длина дня в период развития личинок
IV возраста. В начале октября все самки находятся в состоянии зимней имагинальной
диапаузы, однако уже в течение ноября доля диапаузирующих особей в природных
популяциях стремительно снижается, и в январе все клопы физиологически готовы
к активной жизнедеятельности и, в частности, к размножению. Ранняя терминация
зимней имагинальной диапаузы у L. hesperus кажется необычной, но она подтвержда-
ется данными, полученными в специальных наблюдениях, проведенных ранее в этом
же регионе другим автором (Leigh, 1966), а также доказана экспериментально
(Spurgeon, 2017). Оказалось, что короткий день необходим не только для индукции
диапаузы у L. hesperus, но и для ее поддержания, так как даже 10 длиннодневных сти-
мулов в период имагинальной жизни полностью снимают эффект короткого
дня (Spurgeon, 2017). Большой цикл работ по изучению сезонных адаптаций L. hesperus,
выполненный позже на 2 популяциях с юга Северной Америки (из Калифорнии и Ари-
зоны: Spurgeon, Brent, 2015), существенно расширил представления об экологических
механизмах, контролирующих сезонное развитие клопов-слепняков.
Сезонное развитие Lygocoris pabulinus - необычный, но яркий пример облигатной
смены растения-хозяина в течение года. У этого вида за зимовкой диапаузирующих
яиц в тканях древесных растений следует переход личинок на травянистые растения
и развитие на них летних поколений. Такой сезонный цикл больше характерен для рав-
нокрылых хоботных (Homoptera), чем для клопов.
В заключение следует отметить, что проведенный анализ имеющейся литературы
свидетельствует о слабой изученности трибы Mirini, несмотря на его большое эконо-
мическое значение. Большинство публикаций ограничивается данными по темпера-
турным нормам развития и касается небольшого числа экспериментально изученных
видов. Лишь на примере отдельных популяций некоторых видов детально проанализи-
рована и показана определяющая роль фотопериодических адаптаций в регуляции го-
дичного цикла (например, как у Adelphocoris triannulatus), хотя именно такие данные
необходимы для прогноза сезонного развития и распространения опасных и полезных
насекомых, поскольку сезонный цикл каждой географической популяции вида строго
синхронизирован с локальными условиями ее существования.
ФИНАНСИРОВАНИЕ
Исследование частично поддержано Российским фондом фундаментальных иссле-
дований (грант № 17-04-01486А) и благотворительным «Фондом Инессы».
32
СПИСОК ЛИТЕРАТУРЫ
Асанова Р. Б., Искаков Б. В. 1977. Вредные и полезные полужесткокрылые Казахстана. Определитель.
Алма-Ата: Кайнар, 204 с.
Винокуров Н. Н., Канюкова Е. В. 1995. Полужесткокрылые насекомые (Heteroptera) Сибири. Новосибирск:
Наука, 237 с.
Винокуров Н. Н., Канюкова Е. В., Голуб В. Б. 2010. Каталог полужесткокрылых насекомых (Heteroptera)
Азиатской части России. Новосибирск: Наука, 320 с.
Кержнер И. М. 1972. Новые и малоизвестные полужесткокрылые (Heteroptera) с Дальнего Востока СССР.
Труды Зоологического института АН СССР 52: 276-295.
Пучков В. Г. 1966. Главнейшие клопы-слепняки - вредители сельскохозяйственных культур. Киев: Наукова
думка, 172 с.
Пучков В. Г. 1972. Отряд Hemiptera (Heteroptera) - полужесткокрылые. В кн.: О. Л. Крыжановский,
Е. М. Данциг (ред.). Насекомые и клещи - вредители сельскохозяйственных культур. Т. 3. Л.: Наука,
с. 222-262.
Саулич А. Х. 1999. Сезонное развитие насекомых и возможности их расселения. СПб.: Издательство
Санкт-Петербургского университета, 247 с.
Саулич А. Х., Мусолин Д. Л. 2007. Времена года: разнообразие сезонных адаптаций и экологических меха-
низмов контроля сезонного развития полужесткокрылых (Heteroptera) в умеренном климате. Труды
Биологического НИИ СПбГУ 53: 25-106.
Саулич А. Х., Мусолин Д. Л. 2014. Сезонные циклы щитников (Heteroptera, Pentatomidae) умеренного пояса:
разнообразие и регуляция. Энтомологическое обозрение 93 (2): 263-302.
Саулич А. Х., Мусолин Д. Л. 2019. Сезонное развитие клопов-слепняков (Heteroptera, Miridae): Подсем.
Bryocorinae. Энтомологическое обозрение 98 (2): 281-301.
Aglyamzyanov R. 2009. Revision der paläarktischen Arten der Gattung Lygus Hahn, 1833 (Heteroptera: Miridae).
Entomologische Zeitschrift mit Insekten-Börse 119 (6): 249-276.
Asensio de la Sierra E. 1973. El Lygus pratensis (Linn.) como plaga de la alfalfa para semilla [Lygus pratensis
(Linn.) as a pest of seed crops of lucerne]. Anales del Instituto Nacional de Investigaciones Agrarias. Serie
Proteccion Vegetal 3: 349-358.
Bariola L. A. 1969. The biology of the tarnished plant bug, Lygus lineolaris (Beauvois) and its nature of damage and
control on cotton. Ph. D. Dissertation. College Station, Texas: Texas A & M University, 102 p.
Beards G. W., Strong F. E. 1966. Photoperiod in relation to diapause in Lygus hesperus Knight. Hilgardia 37 (10):
345-362.
Beerwinkle K. R., Lopez Jr., J. D., Cheng D., Lingren P. D., Meola R. W. 1995. Flight potential of feral Helicoverpa
zea (Lepidoptera: Noctuidae) males measured with a 32-channel, computer-monitored, flight-mill system.
Environmental Entomology 24: 1122-1130.
Blommers L. H. M., Vaal F. W. N. M., Helsen H. H. M. 1997. Life history, seasonal adaptations and monitoring of
common green capsid Lygocoris pabulinus (L.) (Hemiptera, Miridae). Journal of Applied Entomology 121:
389-398.
Bommireddy P. L., Parajulee M. N., Porter D. O. 2004. Influence of constant temperatures on life history of immature
Lygus elisus (Hemiptera: Miridae). Environmental Entomology 33 (6): 1549-1553.
Brent C. S. 2010a. Reproduction of the western tarnished plant bug, Lygus hesperus, in relation to age, gonadal
activity and mating status. Journal of Insect Physiology 56: 28-34.
Brent C. S. 2010b. Reproductive refractoriness in the western tarnished plant bug (Hemiptera: Miridae). Annals of
the Entomological Society of America 102 (2): 300-306.
Brent C. S., Spurgeon D. W. 2011. Diapause response of laboratory reared and native Lygus hesperus Knight
(Hemiptera: Miridae). Environmental Entomology 40 (2): 455-461.
Butler E. A.1923. A Biology of the British Hemiptera-Heteroptera. London: H. F. & G. Witherby, 682 p.
Butts R. A., Lamb R. J. 1991. Seasonal abundance of three Lygus species (Heteroptera: Miridae) in oilseed rape and
alfalfa in Alberta. Journal of Economic Entomology 84 (2): 450-456.
Cassis J., Schuh R. T. 2012. Systematics, biodiversity, biogeography, and host associations of the Miridae (Insecta:
Hemiptera: Heteroptera: Cimicomorpha). Annual Review of Entomology 57: 377-404.
Chen P., Feng H., Li G., Guo X. 2010. Morphology of diapause and non-diapause eggs of Adelphocoris suturalis.
Plant Protection 36: 80-82.
33
Cheng D. F., Tian Z., Sun J. R., Ni H. X., Li G. B. 1997. A computer-monitored flight mill system for tiny insects
such as aphid. Acta Entomologica Sinica 40: 172-179.
Cojocaru D. S.1997. Cercetari privind biologia plosnitei de camp Lygus rugulipennis Poppius, 1911 [Romanian;
Research on biology of the field bug, Lygus rugulipennis Poppius, 1911]. Analele Institutului de Cercetari
Pentru Cereale Protectia Plantelor 28 (1): 79-89.
Cooper W. R., Spurgeon D. W. 2012. Temperature dependent development of Lygus hesperus (Hemiptera: Miridae)
nymphs. Journal of Economic Entomology 105 (3): 860-865.
Cooper W. R., Spurgeon D. W. 2013. Temperature-dependent egg development of Lygus hesperus (Hemiptera:
Miridae). Journal of Economic Entomology 106 (1): 124-130.
Cooper W. R., Spurgeon D. W. 2015. Temperature-dependent survival of adult Lygus hesperus (Hemiptera: Miridae).
Environmental Entomology 44 (3): 808-813.
Craig C. H. 1963. The alfalfa plant bug, Adelphocoris lineolatus (Goeze) in northern Saskatchewan. The Canadian
Entomologist 95: 6-13.
Easterbrook M. A. 1997. The phenology of Lygus rugulipennis, the European tarnished plant bug, on late-season
strawberries, and control with insecticides. Annals of Applied Biology 131: 1-10.
Easterbrook M. A. 2000. Relationships between the occurrence of misshapen fruit on late-season strawberry in the
United Kingdom and infestation by insects, particularly the European tarnished plant bug, Lygus rugulipennis.
Entomologia Experimentalis et Applicata 96: 59-67.
Easterbrook M. A., Fitzgerald J. D., Pinch C., Tooley J., Xu X.-M. 2003. Development times and fecundity of
three important arthropod pests of strawberry in the United Kingdom. Annals of Applied Biology 143:
325-331.
Ewen A. B. 1966. A possible endocrine mechanism for inducing diapause in the eggs of Adelphocoris lineolatus
(Goeze) (Hemiptera: Miridae). Experientia 22 (7): 470.
Feng H., Chen P., Li G., Feng Q., Guo X. 2012. Diapause induction in Apolygus lucorum and Adelphocoris suturalis
(Hemiptera: Miridae) in Northern China. Environmental Entomology 41 (6): 1606-1611.
Gerber G. H., Wise I. L. 1995. Seasonal occurrence and number of generations of Lygus lineolaris and L. borealis
(Heteroptera: Miridae) in southern Manitoba. The Canadian Entomologist 127 (4): 543-559.
Gillespie D. R., Foottit R. G., Shipp J. L., Schwartz M. D., Quiring D. M. J., Wang K. H. 2003. Diversity, distribution
and phenology of Lygus species (Hemiptera: Miridae) in relation to vegetable greenhouses in the lower
Fraser Valley, British Columbia, and southwestern Ontario. Journal of the Entomological Society of British
Columbia 100: 43-54.
Gorski R. 1996. Dynamika wystepowania zmienika lucernowca (Lygus rugulipennis Poppius) na polach lubinu
[Dynamics of occurrence of Lygus rugulipennis Poppius in lupin fields]. Roczniki Akademii Rolniczej W
Poznaniu, Ogrodnictwo 24: 19-27 [in Polish, with English Summary].
Guppy J. C. 1958. Insect surveys of clovers, alfalfa, and birdsfoot trefoil in eastern Ontario. The Canadian
Entomologist 90: 523-531.
Hayashi H., Nakazawa K. 1988. Studies on the bionomics and control of the sorghum plant bug, Stenotus rubrovittatus
Matsumura (Hemiptera: Miridae) 1. Habitat and seasonal prevalence in Hiroshima Prefecture. Bulletin of the
Hiroshima Prefectural Agricultural Experiment Station 51: 45-53 [in Japanese, with English Summary].
Henry T. J. 2017. Biodiversity of Heteroptera. In: R. G. Foottit, P. H. Adler (eds). Insect Biodiversity: Science and
Society. 2nd edn. Oxford, U. K.: Wiley-Blackwell, pp. 279-335.
Holopainen J. K. 1986. Damage caused by Lygus rugulipennis Popp. (Heteroptera, Miridae) to Pinus sylvestris L.
seedlings. Scandinavian Journal of Forest Research 1: 343-349.
Holopainen J. K., Varis A.-L. 1991. Host plants of the European tarnished plant bug Lygus rugulipennis Poppius
(Het., Miridae). Journal of Applied Entomology 111: 484-498.
Hori K., Hanada T. 1970. Biology of Lygus disponsi Linnavuori (Hemiptera, Miridae) in Obihiro. Research Bulletin
of Obihiro University. Series I 2 (6): 304-317.
Hori K., Hashimoto Y., Kuramochi K. 1985. Feeding behavior of the timothi plant bug Stenotus binotatus (Hemiptera:
Miridae) and the effect of its feeding on orchard grass. Applied Entomology and Zoology 20 (1): 13-19.
Johnson C. G. 1969. Migration and Dispersal of Insects by Flight. London: Methuen, 766 p.
Johnson C. G., Southwood T. R. E. 1949. Seasonal records in 1947 and 1948 of flying Hemiptera-Heteroptera,
particularly Lygus pratensis L., caught in nets 50 ft. to 3,000 ft. above the ground. Proceedings of the Royal
Entomological Society of London. Series A. General Entomology 24: 128-130.
Kelton L. A. 1971. Review of Lygocoris species found in Canada and Alaska (Heteroptera: Miridae). Memoirs of the
Entomological Society of Canada 83: 1-87.
34
Kelton L. A. 1975. The lygus bugs (genus Lygus Hahn) of North America (Hemiptera: Miridae). Memoirs of the
Entomological Society of Canada 95: 1-101.
Kerzhner I. M., Josifov M. 1999. Family Miridae Hahn, 1833. In: B. Aukema, Ch. Rieger (eds.). Catalogue of
the Heteroptera of the Palaearctic Region. Vol. 3. Cimicomorpha II. Amsterdam, The Netherlands: The
Netherlands Entomology Society, 577 p.
Kocka F. 1985. Adatok a napraforgoban karosito mezei poloskak biologiajahox es kartetelehez [Biology of plant
bugs and the damage caused in sunflower]. Novenyvedelem 21 (9): 390-394 [in Hungarian].
Konstantinov F. V., Namyatova A. B., Cassis G. 2018. A synopsis of the bryocorine tribes (Heteroptera:
Miridae: Bryocorinae): key, diagnoses, hosts and distributional patterns. Invertebrate Systematics 32:
866-891.
Kudô S., Kurihara M. 1989. Effects of maternal age on induction of egg diapause in the rice leaf bug,
Trigonotylus coelestialium Kirkaldy (Heteroptera; Miridae). Applied Entomology and Zoology 57 (2):
440-447.
Kullenberg B. 1944. Studien über die Biologie der Capsiden. Zoologiska Bidrag från Uppsala 23: 1-522.
Leigh T. F. 1966. A reproductive diapause in Lygus hesperus Knight. Journal of Economic Entomology 59 (3):
1280-1281.
Liu B., Li H.-Q., Ali A., Li H.-B., Liu J., Yang Y.-Zh., Lu Y.-H. 2015. Effects of temperature and humidity on
immature development of Lygus pratensis (L.) (Hemiptera: Miridae). Journal of Asia-Pacific Entomology
18 (2): 139-143.
Lu Y. H., Qiu F., Feng H. Q., Li H. B., Yang Z. C., Wyckhuys K. A. G., Wu K. M. 2008. Species composition and
seasonal abundance of pestiferous plant bugs (Hemiptera: Miridae) on Bt cotton in China. Crop Protection
27: 465-472.
Lu Y. H., Wu K. M. 2008. Biology and Control Methods of the Mirids. Beijing, China: Golden Shield Press,
151 p.
Lu Y. H., Wu K. M. 2011. Mirid bugs in Сhina: pest status and management strategies. Outlook Pest Management
22: 248-252.
Lu Y. H., Wu K. M., Guo Y. Y. 2007. Flight potential of Lygus lucorum Meyer-Dür (Heteroptera: Miridae).
Environmental Entomology 36: 1007-1013.
Lu Y. H., Wu K. M., Jiang Y. Y., Xia B., Li P., Feng H. Q., Wyckhuys K. A. G., Guo Y. Y. 2010a. Mirid bug outbreaks
in multiple crops correlated with wide-scale adoption of Bt cotton in China. Science 328: 1151-1154.
Lu Y. H., Wu K. M., Wyckhuys K. A. G., Guo Y. Y. 2009a. Comparative flight performance of three important pest
Adelphocoris species of Bt cotton in China. Bulletin of Entomological Research 90: 543-550.
Lu Y. H., Wu K. M., Wyckhuys K. A. G., Guo Y. Y. 2009b. Comparative study of temperature-dependent
life histories of three economically important Adelphocoris spp. Physiological Entomology
34:
318-324.
Lu Y., Wu K., Wyckhuys K. A. G., Guo Y. 2010b. Temperature-dependent life history of the green plant
bug, Apolygus lucorum (Meyer-Dür) (Hemiptera: Miridae). Applied Entomology and Zoology 45:
387-393.
McPherson J. E., Weber B. C., Henry T. J. 1983. Seasonal flight patterns of Hemiptera in a North Carolina black
walnut plantation. 7. Miridae. The Great Lakes Entomologist 16 (2): 35-42.
Mols P. J. M. 1990. Forecasting orchard pests for adequate timing of control measures. Proceedings of the Section
Experimental and Applied Entomology of the Netherlands Entomological Society (N. E. V., Amsterdam) 1:
75-81.
Musolin D. L., Saulich A. H. 1999. Diversity of seasonal adaptations in terrestrial true bugs (Heteroptera) from the
Temperate Zone. Entomological Science 2 (4): 623-639.
Namyatova A. A., Konstantinov F. V., Cassis G. 2016. Phylogeny and systematics of the subfamily Bryocorinae
based on morphology with emphasis on the tribe Dicyphini sensu Schuh. Systematic Entomology 41:
3-40.
Namyatova A. A., Schwartz M. D., Cassis G. 2013. First record of the genus Stenotus Jakovlev from Australia, with
two new species, and a list of mirine species from Witchelina Nature Reserve (Insecta: Heteroptera: Miridae:
Mirinae: Mirini). Journal of Natural history 47 (13-14): 987-1008.
Pan H., Lu Y., Wyckhuys K. A., Wu K. 2013. Preference of a polyphagous mirid bug, Apolygus lucorum (Meyer-
Dür) for flowering host plants. PLoS One 8 (7): e68980. doi: 10.1371/journal.pone.0068980.
Salt R. W. 1945. Number of generations of Lygus hesperus Knt. and L. elisus Van D. in Alberta. Scientific Agriculture
25 (10): 573-576.
35
Saulich A. Kh., Musolin D. L. 2018. Seasonal cycles of Pentatomoidea. In: J. E. McPherson (ed.). Invasive Stink
Bugs and Related Species (Pentatomoidea): Biology, Higher Systematics, Semiochemistry, and Management.
Boca Raton, Florida, U. S. A.: CRC Press, pp. 565-607.
Schaefer C. W., Panizzi A. R. (eds). 2000. Heteroptera of Economic Importance. Boca Raton, Florida, U. S. A.:
CRC Press, 828 p.
Schuh R. T., Slater J. A. 1995. True Bugs of the World (Hemiptera: Heteroptera): Classification and Natural History.
Ithaca, New York, U. S. A.: Cornell University Press, 338 p.
Schuh R. T., Weirauch C. 2020. True Bugs of the World (Hemiptera: Heteroptera): Classification and Natural
History. 2nd edn. Manchester, U. K.: Siri Scientific Press, 768 p. + 32 pl. (Monographs Series, vol. 8).
Schwartz M. D., Foottit R. G. 1992. Lygus bugs on the prairies. Biology, systematics, and distribution. Technical
Bulletin 1992-4E. Canada, Ottawa, Ontario, 44 p.
Schwartz M. D., Foottit R. G. 1998. Revision of the Nearctic Species of the Genus Lygus Hahn, with a Review of
the Palaearctic Species (Heteroptera: Miridae). Memoirs on Entomology, International. Vol. 10. Gainesville,
Florida, U. S. A.: Associated Publishers, 428 p.
Scudder G. G. E. 2014. The Heteroptera (Hemiptera) of the Prairies Ecozone of Canada. In: H. A. Cárcamo,
D. J. Giberson (eds). Arthropods of Canadian Grasslands. Vol. 3. Biodiversity and Systematics. Part 1.
Canada, Ottawa, Ontario: Biological Survey of Canada, pp. 283-309.
Sedivy J., Honek A. 1983. Flight of Lygus rugulipennis Popp. (Heteroptera, Miridae) to a light trap. Zeitschrift für
Pflanzenkrankheiten und Pflanzenschutz 90 (3): 238-243.
Shigehisa S. 2008. Seasonal changes in egg diapause induction and effects of photoperiod and temperature on egg
diapause in the sorghum plant bug, Stenotus rubrovittatus (Matsumura) (Heteroptera: Miridae). Japanese
Journal of Applied Entomology and Zoology 52 (4): 229-232 [in Japanese].
Snodgrass G. L. 2003. Role of reproductive diapause in the adaptation of the tarnished plant bug (Hetero-
ptera: Miridae) to its winter habitat in the Mississippi River Delta. Environmental Entomology 32:
945-952.
Snodgrass G. L., Jackson R. E., Perera O. P., Allen K. C., Luttrell R. G. 2012. Effect of food and temperature on
emergence from diapause in the tarnished plant bug (Hemiptera: Miridae). Environmental Entomology 41
(6): 1302-1310.
Snodgrass G. L., Scott W. P., Smith J. W. 1984. Host plants and seasonal distribution of the tarnished plant bug
(Hemiptera: Miridae) in the delta of Arkansas, Louisiana, and Mississippi. Environmental Entomology 13:
110-116.
Southwood T. R. E., Leston D. 1959. Land and Water Bugs of the British Isles. London and New York, U. K.:
Frederick Warne and Co., 436 p.
Spurgeon D. W. 2012. Physiological consequences of laboratory rearing of Lygus hesperus (Hemiptera: Miridae).
Environmental Entomology 41: 415-419.
Spurgeon D. W. 2017. Instar- and stage-specific photoperiodic diapause response of Lygus hesperus (Hemiptera:
Miridae). Journal of Insect Science 17 (6): 1-7.
Spurgeon D. W. 2020. Diapause response of Lygus hesperus (Hemiptera: Miridae) at different temperatures. Journal
of Entomological Science 55 (1): 126-129.
Spurgeon D. W., Brent C. S. 2010. Morphological characters of diapause in Lygus hesperus Knight (Hemiptera:
Miridae). Journal of Entomological Science 45: 303-316.
Spurgeon D. W., Brent C. S. 2015. Diapause response to photoperiod in an Arizona population of Lygus hesperus
(Hemiptera: Miridae). Journal of Entomological Science 50 (3): 238-247.
Spurgeon D. W., Brent C. S. 2019. Development and survival of Lygus hesperus (Hemiptera: Miridae) nymphs
jisesa/iez003
Stewart R. K. 1969. The biology of Lygus rugulipennis Poppius (Hemiptera: Miridae) in Scotland. Transactions of
the Entomological Society of London 120: 437-457.
Stewart R. K., Khoury H. 1976. The biology of Lygus lineolaris (Palisot de Beauvois) (Hemiptera: Miridae) in
Quebec. Annals of the Entomological Society of Quebec 21: 52-63.
Strong F. E., Sbeldabl J. A., Hugbes P. R., Hussein M. K. 1969. Reproductive biology of Lygus hesperus Knight.
Hilgardia 40 (4): 105-147.
Tajima J., Miyahara R., Terao M., Shintani Y. 2018. Environmental control of the seasonal life of zoophytophagous
mirid, Adelphocoris triannulatus (Hemiptera; Miridae). Applied Entomology and Zoology
53
(3):
333-341.
36
Tavella L., Alma A., Arzone A. 1997. Lygus rugulipennis Poppius, a minor pest in the peach orchards of northwestern
Italy. Bulletin OILB/SROP 20 (6): 1-5.
Tavella L., Alma A., Arzone A., Galliano A., Bricco D., Rinaudo M. 1994. Indagini bio-etologiche su Lygus
rugulipennis Poppius in pescheti piemontesi (Rhynchota, Miridae) [Bio-ecological studies on Lygus
rugulipennis Poppius (Rhynchota, Miridae) in peach orchards in Piedmont]. Informatore Fitopatologico 44
(7-8): 43-48.
Ting Y. Q. 1963. Studies on the ecological characteristics of cotton mirids I. Effect of temperature and humidity
on the development and distribution of the pests. Acta Phytophylacica Sinica 2: 285-296 [in Chinese with
English summary].
Varis A.-L. 1972. The biology of Lygus rugulipennis Popp. (Het., Miridae) and the damage caused by this species to
sugar beet. Annales Agriculturae Fenniae 11: 1-56.
Varis A.-L. 1995. Species composition, abundance, and forecasting of Lygus bugs (Heteroptera: Miridae) on field
crops in Finland. Journal of Economic Entomology 88 (4): 855-858.
Varis A.-L.1997. Seasonal occurrence of Lygus bugs on field crops in Finland. Agricultural and Food Science in
Finland 6 (5-6): 409-413.
Villavaso E. J., Snodgrass G. L. 2004. Diapause in tarnished plant bug (Heteroptera: Miridae) reared in dynamic
photoperiod environmental cabinets. Journal of Agricultural and Urban Entomology 21: 87-97.
Watanabe K., Kikuchi S., Tanaka T. 1997. Seasonal occurrence of Lygocoris (Apolygus) lucorum (Meyer-Dür)
(Heteroptera: Miridae) on Artemisia spp. Annual Report of the Society of Plant Protection of North Japan
48: 181-183.
Wheeler A. G., Jr. 2001. Biology of the Plant Bugs (Hemiptera: Miridae): Pests, Predators, Opportunists. Ithaca,
New York, U. S. A.: Cornell University Press, 507 p.
Wheeler A. G., Jr., Henry T. J. 1992. A Synthesis of the Holarctic Miridae (Heteroptera): Distribution, Biology, and
Origin, with Emphasis on North America. Thomas Say Foundation Monographs. Vol. 15. Lanham, Maryland,
U. S. A.: Entomological Society of America, 282 p.
Wightman J. A. 1968. Termination of egg diapause in Lygocoris pabulinus (Heteroptera: Miridae). Long Ashton
Research Station Reports (Bristol), 154-156.
Wipfli M. S., Wedberg J. L., Hogg D. B., Syverud T. D. 1989. Insect pests associated with birdsfoot trefoil, Lotus
corniculatus, in Wisconsin. The Great Lakes Entomologist 22 (1): 25-33.
Woodroffe G. E. 1966. The Lygus pratensis complex (Hemiptera, Miridae) in Britain. Entomologist 99:
201-206.
Xu X.-M., Jay Ch. N., Fountain M. T., Linka J., Fitzgerald J. D. 2014. Development and validation of a model
forecasting the phenology of European tarnished plant bug Lygus rugulipennis in the U. K. Agricultural and
Forest Entomology 16: 265-272.
Yang M.-C., Yang T. 2001. Occurrence and control of Lygus pratensis in South Xinjiang. Plant Protection 27 (5):
31-32 [in Chinese].
Yang X., Jin B. F. Meng J. W., Zhu B. 2004. Outbreaks of Lygus pratensis in southern Xinjiang in 2003. China
Cotton 31: 43.
Yasunaga T. 1991. A revision of the plant bug, genus Lygocoris Reuter from Japan. Part I (Heteroptera, Miridae,
Lygus-complex). Japanese Journal of Entomology 59: 435-448.
Young O. P. 1986. Host plants of the tarnished plant bug, Lygus lineolaris (Heteroptera: Miridae). Annals of the
Entomological Society of America 79 (4): 747-762.
Zhang L.-J., Cai W.-Z., Luo J.-Y., Zhang S., Wang C.-Y., Lv L.-M., Zhu X.-Z., Wang L., Cui J.-J. 2017.
Phylogeographic patterns of Lygus pratensis (Hemiptera: Miridae): Evidence for weak genetic structure
pone.0174712.
Zhang S. M., Zhao Y. X. 1996. The Geographical Distribution of Agricultural and Forest Insects in China. Beijing,
China: China Agriculture Press, 400 p. [in Chinese].
Zhuo D.-G., Li Z.-H., Men X.-Y., Yu Y., Zhang A.-S., Li L.-L., Zhang S.-C. 2011. Effects of photoperiod and
temperature on diapause induction of Apolygus lucorum Meyer-Dür (Hemiptera: Miridae). Acta Entomologica
Sinica 54: 1082-1086.
37
SEASONAL DEVELOPMENT OF PLANT BUGS (HETEROPTERA, MIRIDAE):
SUBFAMILY MIRINAE, TRIBE MIRINI
A. Kh. Saulich, D. L. Musolin
Key words: adult diapause, biological control, day length, dormancy, seasonal development,
photoperiod, photoperiodic response, plant protection, true bugs, voltinism.
SUMMARY
The paper reviews available data that allow to characterize seasonal development of the plant bugs
(Mirinae: Mirini) and evaluate our understanding of their seasonal adaptations. The ecological responses
involved in the control of seasonal development of 14 species from five genera (Adelphocoris, Apolygus,
Lygus, Lygocoris, and Stenotus) are analyzed in detail. All studied species are broadly polyphagous and
produce varying number of annual generations in different climatic zones. The studied representatives
of four genera (namely, Adelphocoris, Apolygus, Lygocoris, and Stenotus) hibernate at the embryonic
stage, and bugs of the genus Lygus do so at the adult stage. The pronounced ability to fly over long
distances evolved to enable the search for flowering vegetation was recorded in some species of the
genera Adelphocoris and Lygus, in particular, Lygus pratensis. However, unlike many insects that make
distant migrations in the state of adult diapause, females of plant bugs of the genus Adelphocoris migrate
having mature eggs in their oviducts. This feature of the species allows females to successfully colonize
new areas even without males, as females do not need additional fertilization in a colonized area. For
the majority of species from the tribe Mirini experimentally studied in laboratory, the temperature
parameters of development and the sum of effective temperatures necessary to complete the full
generation were calculated. When combined with observations done under natural conditions, these
data allowed to precisely estimate the number of generations produced by the species or population
during a year. The role of day length in the control of seasonal development is analyzed in detail in
three species of the genus Adelphocoris (A. triannulatus, A. suturalis, and A. lineolatus). The conditions
inducing and terminating adult diapause have been studied in detail in Lygus hesperus in the southern
United States. The seasonal development of Lygocoris pabulinus is an unusual example of an obligate
change of the host plant during the year. In this species, the overwintering of diapausing eggs in the
tissues of woody plants is followed by the shift of nymphs to and further development of the summer
generations on grassy plants. Such seasonal strategy is characteristic of aphids (Homoptera) rather than
true bugs (Heteroptera). The analysis of the data indicates that the control of seasonal development of
plant bugs of the subfamily Mirinae is still poorly understood despite their high economic importance.
Most of reports deal with a small number of experimentally studied species and are limited to the
data on temperature parameters of development. Only a limited number of species are studied well
enough. Data obtained stress the important role of photoperiodic adaptations in the control of seasonal
development. Such data are necessary for the analysis and forecast of the species’ seasonal development
and spread of harmful and beneficial insect species, since the seasonal cycle of each population of the
species is strictly synchronized with the local conditions of its existence.
38