ЭНТОМОЛОГИЧЕСКОЕ ОБОЗРЕНИЕ, 100, 1, 2021
УДК 591.3 : 591.54 : 591.52 : 595.7 : 574.24
CЕЗОННОЕ РАЗВИТИЕ КЛОПОВ-СЛЕПНЯКОВ (HETEROPTERA,
MIRIDAE): ПОДСЕМ. MIRINAE, ТРИБА STENODEMINI
© 2021 г. А. Х. Саулич, 1* Д. Л. Мусолин 2**
1 Санкт-Петербургский государственный университет
Университетская наб., 7-9, С.-Петербург, 199034 Россия
*e-mail: 325mik40@gmail.com
2 Санкт-Петербургский государственный лесотехнический
университет им. С. М. Кирова
Институтский пер., 5, литер «У», С.-Петербург, 194021 Россия
**e-mail: musolin@gmail.com
Поступила в редакцию 14.01.2020 г.
После доработки 23.05.2020 г.
Принята к публикации 23.05.2020 г.
Проанализированы сезонные адаптации 8 наиболее изученных видов, относящихся к 4 родам
трибы Stenodemini. Моновольтинный сезонный цикл на основе облигатной диапаузы свойствен
4 из исследованных видов - Stenodema calcarata, S. laevigata, Leptopterna dolabrata и L. ferrugata.
Виды рода Stenodema имеют зимнюю имагинальную диапаузу, а оба вида рода Leptopterna
зимуют на стадии яйца. У остальных 4 исследованных видов (Notostira elongata, N. erratica,
Trigonotylus caelestialium и T. tenuis) сезонный цикл поливольтинный, и в разных географиче-
ских зонах в зависимости от климатических условий они могут завершать от 1 до 5 поколений
в год, зимуя в состоянии имагинальной (род Notostira) или эмбриональной (род Trigonotylus)
диапаузы. Индукция зимней диапаузы осуществляется под контролем фотопериодической ре-
акции, хорошо исследованной у видов рода Trigonotylus. В длиннодневных условиях самки от-
кладывают активно развивающиеся яйца, в короткодневных - диапаузирующие. У стенодемин
представлены крыловая и цветовая формы полиморфизма. На примере L. dolabrata показано, что
высокие температура и плотность содержания в период развития личинок старших (IV и V) воз-
растов вызывают появление длиннокрылых самок (обычно доминируют короткокрылые самки),
а самцы всегда длиннокрылые. Цветовой полиморфизм у видов с моновольтинным сезонным
циклом (род Stenodema) проявляется в смене охристо-коричневой окраски тела у зимующих осо-
бей осенью на ярко-зеленую весной, а у поливольтинных видов (например, Notostira elongata)
альтернативные цветовые формы связаны с разными поколениями: особи летнего поколения
имеют яркую окраску травяного цвета, а самки зимующего поколения - охристо-коричневую
(самцы не зимуют). На примере Trigonotylus caelestialium убедительно показано, что пищевой
фактор может иметь самостоятельное значение в индукции диапаузы. Способность самок откла-
дывать одновременно развивающиеся и диапаузирующие яйца в середине лета на фоне высокой
температуры и длинного дня можно рассматривать как адаптивную стратегию, позволяющую
сохраниться хотя бы части будущего потомства в условиях нестабильности кормовой базы.
В целом обзор данных по сезонному развитию клопов трибы Stenodemini, так же, как и исследо-
ванной ранее трибы Mirini, свидетельствует о слабой изученности даже экономически важных
14
видов семейства Miridae. На основании этих сведений удается создать лишь общее представление
о сезонных адаптациях и годичных циклах, свойственных клопам-слепнякам.
Ключевые слова: биологический метод контроля вредителей, вольтинизм, диапауза, длина дня,
защита растений, личиночное развитие, полужесткокрылые, сезонное развитие, сезонный поли-
морфизм, фотопериодическая реакция.
DOI: 10.31857/S0367144521010020
Подсем. Mirinae Hahn, 1833 включает более 300 родов из 6 триб мировой фауны:
Herdoniini, Hyalopeplini, Mecistoscelini, Mirini, Resthenini и Stenodemini. Только две из
них - Mirini Hahn, 1833 и Stenodemini China, 1943 - распространены всесветно, пред-
ставители остальных триб - обитатели только тропических и субтропических
регионов (Schuh, Slater,
1995; Kerzhner, Josifov,
1999; Schuh, Weirauch,
2020).
В предыдущей публикации (Саулич, Мусолин, 2020) мы рассмотрели годичные циклы
развития и сезонные адаптации, обеспечивающие синхронизацию годичного цикла
с внешними условиями у видов трибы Mirini. В настоящей статье представлены адап-
тации, выполняющие эту функцию у представителей трибы Stenodemini. По разным
взглядам, триба включает от 32 (Schwartz, 2010) до 35 (Schuh, 2002-2013; Mrós,
Wojciechowski, 2011) родов с более чем 200 видами.
Род STENODEMA Laporte, 1833
Stenodema calcarata (Fallén, 1807) (стенодема шиповатая).
Ареал транспалеарктический: вся Европа, кроме крайнего севера, север Африки
(Марокко, Алжир, Тунис), Казахстан и Средняя Азия, север Китая, Корея (Северная и
Южная), Япония. В горах Швейцарии клопов этого вида находили на высоте до 4000 м
(Kerzhner, Josifov, 1999; Винокуров и др., 2010). Широкий полифаг, потенциальный
вредитель зерновых культур, нередок на кукурузе и люцерне. Отмечается также на
свекле, моркови и рисе (Пучков, 1972; Асанова, Искаков, 1977).
Сезонный цикл моновольтинный по всему ареалу. Зимуют имаго. Весной после зи-
мовки клопы появляются обычно в апреле. В мае самки откладывают яйца, и личинки
развиваются в течение июня-июля. В середине августа окрыляются имаго, которые
остаются зимовать (Butler, 1923; Southwood, Leston, 1959).
Еще в начале XX в., вероятно, впервые для полужесткокрылых, Э. Батлер (Butler,
1923) опубликовал данные по фенологии S. calcarata на Британских островах с де-
тальным описанием цветовых вариаций имаго в разные сезоны года. По наблюдениям
Э. Батлера, имаго встречаются с февраля по октябрь. Особи, собранные с февраля по
июнь или начало июля, имеют зеленую окраску тела, а с июля по октябрь - всегда
охристую или коричневую. В начале ноября коричневые особи уходят на зимовку и
остаются в местах зимовки до весны следующего года, однако, по наблюдениям
Э. Батлера, появляющиеся весной имаго всегда зеленые. Поскольку личинки никогда
не встречались зимой, автор пришел к заключению, что эти зеленые весенние имаго
не могут быть вторым поколением. Следовательно, в течение зимовки клопы посте-
пенно меняют окраску с коричневой на зеленую. В поддержку этой версии Э. Батлер
отметил, что в июне у некоторых клопов отдельные участки тела имели зеленую
окраску, тогда как остальные части все еще оставались охристыми. При этом была
подмечена еще одна особенность: все весенние зеленые особи были самками, из чего
был сделан вывод, что зимуют только самки, оплодотворенные осенью. Смена окраски
15
у самок представляется адаптивной, поскольку ранней весной клопы обычно нахо-
дятся на корнях и стеблях растений и лишь с появлением листьев переходят на
листовую пластинку, постепенно меняя к этому моменту свою окраску (Butler, 1923).
Две сезонные формы S. calcarata описаны также в Швеции, при этом отмечено, что
зимуют и самцы, но, в отличие от самок, за время зимовки они окраску обычно не ме-
няют, а остаются коричневыми (Kullenberg, 1944). Позже подобное явление сезонной
смены окраски тела, описанное для многих видов полужесткокрылых, получило на-
звание сезонного полифенизма (полиморфизма) (Tauber et al., 1986; Walker, 1986;
Саулич, Мусолин, 2007а, 2007б; Saulich, Musolin, 2018).
Stenodema laevigata (Linnaeus, 1758) (стенодема гладкая).
Ареал транспалеарктический: вся Европа, кроме крайнего севера, север Африки
(Марокко, Алжир, Тунис), Казахстан и Средняя Азия, север и северо-запад Китая
(Kerzhner, Josifov, 1999). Полифаг. Повреждает зерновые культуры и злаковые травы.
Моновольтинный вид, зимуют имаго (Southwood, Leston, 1959; Пучков, 1972; Аса-
нова, Искаков, 1977). Сезонное развитие S. laevigata подробно исследовано на юге Ан-
глии (Woodward, 1952). В отличие от S. calcarata, у S. laevigata зимуют и самки, и
самцы. В течение осени идет подготовка к зимовке: накапливаются жировые резервы
и сокращается содержание свободной воды в теле клопов, как это свойственно насе-
комым при формировании диапаузы. Яйца не развиваются, и созревание самок полно-
стью задерживается до весны. Самцы медленно созревают в течение зимы, но копу-
ляция происходит только весной, после чего они вскоре погибают. Во второй половине
мая самцы встречаются очень редко и полностью отсутствуют в конце июня. Самки
живут примерно на месяц дольше, и некоторые из них доживают до конца июля. Яйце-
кладка начинается во второй половине мая и продолжается до конца июня или начала
июля. Личинки отрождаются в течение июня-июля, продолжительность их развития
в природных условиях составляет около одного месяца. В июле окрыляются первые
имаго нового поколения, поэтому в течение короткого периода летом можно встретить
одновременно взрослых особей, принадлежащих к разным поколениям - прошлогод-
нему (перезимовавшему) и новому (летнему). Подобно S. calcarata этому виду свой-
ствен сезонный цветовой полифенизм: перед зимовкой имаго охристые, а в конце
весны появляются клопы, имеющие травяно-зеленую окраску (Woodward, 1952).
Род LEPTOPTERNA Fieber, 1858
Leptopterna dolabrata (Linnaeus, 1758) (лептоптерна луговая, злаковый луговой
клоп; meadow plant bug).
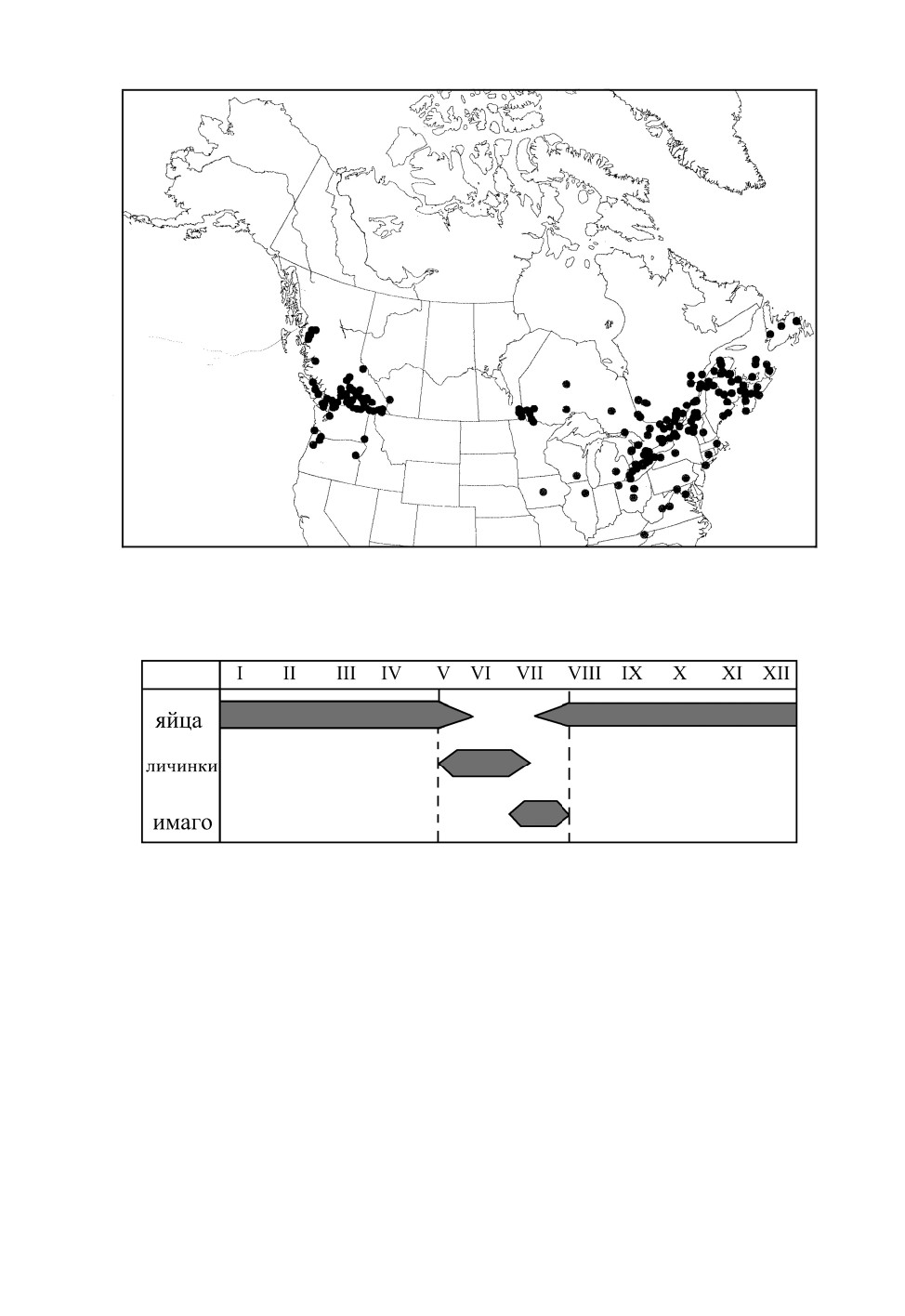
Ареал голарктический; в Северную Америку вид завезен (Butler, 1923; Wheeler,
Henry, 1992; Kerzhner, Josifov, 1999), натурализовался на востоке и западе, но не в цен-
тральной части континента (рис. 1), и обитает совместно с аборигенным видом
L. amoena Uhler (Scudder, Schwartz, 2001). Вредит семенникам многолетних злаков
(Пучков, 1972; Винокуров и др., 2010).
Сезонный цикл лептоптерны луговой строго моновольтинный: на всем протяжении
ареала завершается только одно поколение в год, зимуют яйца (рис. 2).
16
Рис. 1. Ареал Leptopterna dolabrata (L.) в Северной Америке (по: Scudder, Schwartz, 2001).
Рис. 2. Сезонный цикл Leptopterna dolabrata (L.) в Киле
(Германия, 54.3° с. ш., 10.1° в. д.; по: Braune, 1971).
В Германии (Киль, 54.3° с. ш., 10.1° в. д.) личинки отрождаются в мае, имаго окрыля-
ются в июле и откладывают диапаузирующие яйца. Диапауза облигатная. Таким об-
разом, 9 месяцев в году продолжается зимняя эмбриональная диапауза, и лишь 2-3 ме-
сяца клопы активны (Braune, 1971; название вида в работах Х.Ю. Брауне приведено
с ошибкой как Leptopterna dolobrata). Терминация диапаузы происходит под дей-
ствием пониженных температур. В лабораторных условиях показано, что активация
более половины зимующих яиц возможна только после длительного (в течение
210 дней) содержания их при температуре +5 °C (Braune, 1973). По мнению автора,
одна из причин строгого моновольтинизма лептоптерны луговой - особенности пи-
тания личинок. Основными кормовыми растениями для них служат доступные только
в начале лета Dactylis glomerata L. и Alopecurus pratensis L., на ушках (парные бо-
17
ковые выросты в месте соединения пластинки и влагалища листа) которых только и
питаются личинки I-III возрастов. Личинки старших возрастов и имаго L. dolabrata
способны питаться на листьях и стеблях кормовых растений.
У взрослых особей L. dolabrata ярко выражен крыловой диморфизм, который прояв-
ляется в том, что самки бывают короткокрылыми и длиннокрылыми, самцы - всегда
длиннокрылые (рис. 3). Этот диморфизм контролируется и генетически, и экологи-
чески (внешними факторами среды; Braune, 1983). Сравнительный анализ длины
крыла самцов и длиннокрылых самок показал, что размеры крыльев у особей разного
пола практически не различаются, но при этом обнаружено, что среди самок суще-
ствуют только две формы: либо длиннокрылые, либо короткокрылые, никаких проме-
жуточных форм нет (рис. 4). Процентное соотношение короткокрылых и длинно-
крылых самок различается в разных популяциях лептоптерны. В окрестностях Киля
преобладают короткокрылые самки, их доля в отдельные годы составляет до 90 %.
Чтобы понять механизм, регулирующий доли длиннокрылых и короткокрылых
самок в популяции L. dolabrata, была проведена серия экспериментов. В первом из
них личинок I возраста собирали в природных условиях в Киле, переносили в лабора-
торные условия (17…25 °C; фотопериод 12 ч день : 12 ч ночь) и далее при разной
плотности содержания выращивали в нейлоновых садках до окрыления имаго. Этот
эксперимент показал, что с увеличением плотности содержания (от 25 до 400 личинок
в одном садке) многократно растет и доля длиннокрылых самок (с 3.9…7.4 до 44.1 %;
табл. 1). В следующем эксперименте изучали влияние не только плотности содер-
жания личинок, но и температуры, причем эти факторы (и их комбинации) воздей-
ствовали на личинок и младших (I-III), и старших (IV и V) возрастов. Как и в первом
эксперименте, с ростом плотности содержания личинок повышалась и доля длинно-
крылых особей среди взрослых самок (табл. 2). Понижение температуры, однако, вы-
Рис. 3. Крыловой диморфизм у Leptopterna dolabrata (L.) (по: Braune, 1983).
1 - длиннокрылый самец; 2 - короткокрылая самка; 3-5 - передняя и задняя пары крыльев:
3 - самцов, 4 - длиннокрылых самок, 5- короткокрылых самок.
18
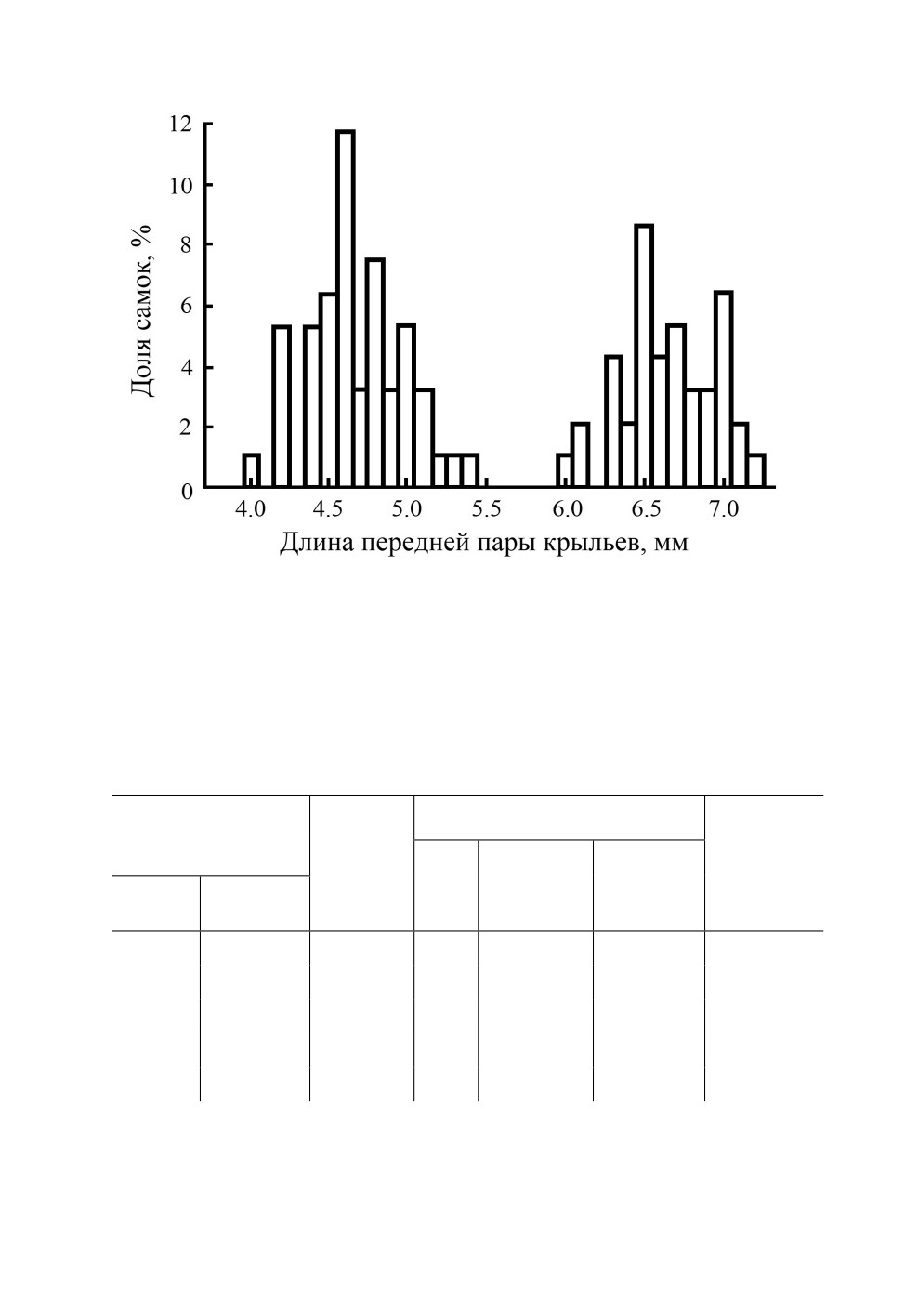
Рис. 4. Бимодальное распределение доли самок Leptopterna dolabrata (L.) по длине передней
пары крыльев (n = 93) в популяции из Киля (Германия, 54.3° с. ш., 10.1° в. д.)
(по: Braune, 1983).
Первый пик (со средней длиной крыла около 4.5 мм) - короткокрылые самки, второй пик
(со средней длиной около 6.5 мм) - длиннокрылые самки.
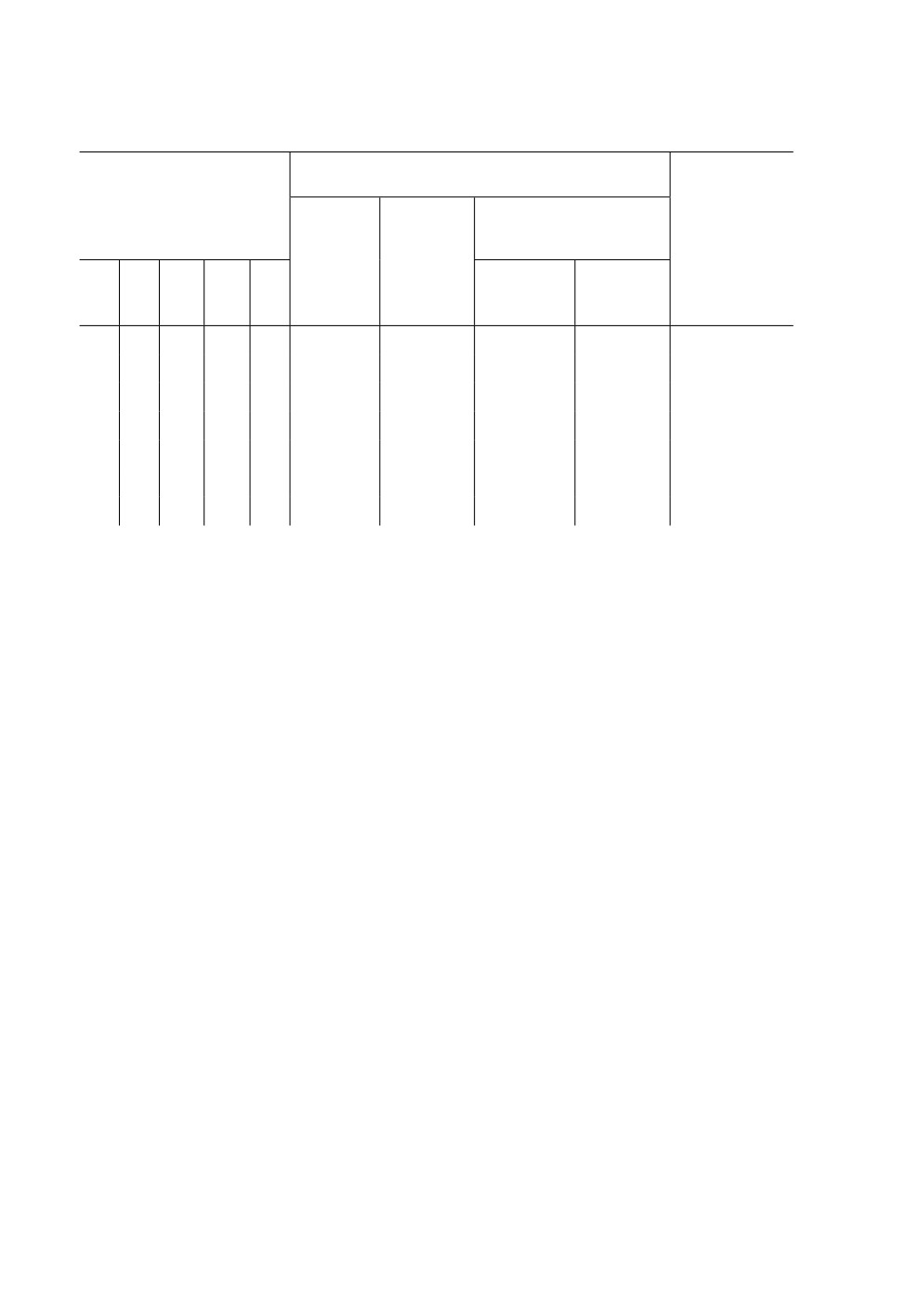
Таблица 1. Влияние плотности содержания личинок на проявление крылового диморфизма
у самок Leptopterna dolabrata (L.) (по: Braune, 1983)*
Количество окрылившихся имаго
Количество личинок
Доля длинно-
Смертность
коротко-
длинно-
крылых самок
личинок (%)
самцов
крылых
крылых
(%)
в экспери-
в садке
самок
самок
менте
25
250
16.0
116
87
7
7.4
50
250
13.2
115
98
4
3.9
100
200
25.0
87
60
3
4.8
200
400
28.3
170
85
32
27.4
400
400
22.8
216
52
41
44.1
П р и м е ч а н и е. * Личинки I возраста были собраны в природе, перенесены в лабораторные условия
(17…25 °С; фотопериод 12 ч день : 12 ч ночь) и далее выращивались при разной плотности содержания
в нейлоновых садках (30 × 22 × 35 см).
19
Таблица 2. Влияние плотности содержания личинок и температуры в разные фазы суточного
цикла (днем и ночью) на крыловой диморфизм у самок Leptopterna dolabrata (L.) (по: Braune,
1983)
Экспериментальные
Количество
условия на протяжении
разных личиночных
Доля
окрылившихся самок
возрастов
личинок
окрылив-
длиннокрылых
в одном
шихся
самок (%)
садке
самцов
коротко-
длинно-
I
II
III
IV
V
крылые
крылые
n
n
n
n
n
400
171
112
44
28.2
N
N
N
N
N
400
154
61
93
60.4
N *
N *
N *
N *
N *
400
174
92
59
39.1
n
n
n
N
N
600
248
99
113
53.3
N
N
N
n
n
600
256
129
81
38.6
N *
N *
N *
N
N
400
169
68
75
52.4
N
N
N
N *
N *
400
157
91
69
43.1
Пр им еча н ия. n - низкая плотность содержания (50 личинок/садок); ритм температуры: 22 °С днем
(12 ч), 16 °С ночью (12 ч); N - высокая плотность содержания (200 личинок/садок); ритм температуры: 22 °С
днем (12 ч), 16 °С ночью (12 ч); N * - высокая плотность содержания (200 личинок/садок); температура:
16 °С днем и ночью.
зывало снижение доли длиннокрылых самок. Наиболее сильно эти эффекты прояви-
лись при воздействии этих факторов на личинок старших возрастов (Braune, 1983).
В данных экспериментах были выявлены разные формы крылового полиморфизма.
Это и генетический половой диморфизм (наличие разных крыловых форм у предста-
вителей разных полов), и экологический диморфизм (дифенизм) у самок, природа
которого не вполне ясна (вероятно, он регулируется как генетическими, так и экологи-
ческими факторами). Однако такой полиморфизм вряд ли можно назвать сезонным,
так как вид дает только одно поколение в год. Вероятно, если условия в стации ста-
бильны и благоприятны, то в популяции велика доля короткокрылых самок, а при
ухудшении экологических условий, когда грозит истощение кормовой базы (при пере-
населении или при слишком высоких температурах), формируется больше длинно-
крылых самок, которые при необходимости вместе с самцами могут мигрировать,
перелетая в новые стации с более благоприятными условиями. Кроме того, коротко-
крылые самки созревают быстрее длиннокрылых, так как им не нужно расходовать
энергию на развитие крыловой мускулатуры (Braune, 1983), и сэкономленные ресурсы
они могут направить на репродукцию.
Leptopterna ferrugata (Fallén, 1807).
Ареал голарктический (Scudder, Schwartz, 2001; Винокуров и др., 2010). Предпочи-
тает влажные биотопы, болота (Винокуров, Канюкова, 1995), хотя в Англии вид счи-
тают более сухолюбивым, чем L. dolabrata (Southwood, Leston, 1959). Повреждает по-
севные травы. В Северной Америке отмечен как вредитель семян ржи.
20
Дает одно поколение в год (Southwood, Leston, 1959; Асанова, Искаков, 1977).
Зимуют яйца, отложенные в стебли растений. Имаго наиболее многочисленны в июле,
к концу августа обычно отмирают. По наблюдениям в Англии, самцы всегда полно-
крылые, самки в основном короткокрылые. Длиннокрылые самки встречаются очень
редко (не более 4 % особей в популяциях), а короткокрылость у них проявляется
в разной степени (Butler, 1923; Southwood, Leston, 1959).
Род NOTOSTIRA Fieber, 1858
Notostira elongata (Geoffroy, 1785) (стройный странствующий клоп).
Ареал западно-центральнопалеарктический (Винокуров и др., 2010). Вредит зла-
ковым травам и зерновым культурам (Пучков, 1972; Асанова, Искаков, 1977).
Сезонное развитие и фенология подробно изучены на юге Англии (Woodward, 1952).
Как оказалось, автор исследовал особенности развития N. elongata, ошибочно опре-
делив его как N. erratica (на ошибку указали позже: Woodroffe, 1977; см. также:
Wheeler, 2001, c. 80). Notostira elongata на Британских островах развивается в двух
поколениях за сезон (Woodward, 1952; Dolling, 1973). Имаго разных поколений (лет-
него и осеннего) различаются по цвету, размерам и пропорциям частей тела. Летние
особи крупнее и имеют более длинные антенны и крылья, чем у особей зимующего
поколения (Southwood, Leston, 1959). Зимуют самки второго поколения. После
зимовки c апреля-мая самки начинают откладывать яйца. Личинки отрождаются
в мае-июне, а в июне-июле окрыляются имаго первого (летнего) поколения. Имаго
быстро созревают и дают начало второму (осеннему) поколению. Личинки этого вто-
рого поколения встречаются вплоть до сентября.
Имаго осеннего поколения окрыляются в основном в августе-сентябре. Копуляция
происходит осенью, после чего самцы вскоре погибают. В отличие от них самки вто-
рого поколения живут долго. Осенью они накапливают небольшие жировые запасы и
избавляются от излишней свободной воды в организме. Как показали вскрытия, яйце-
воды этих самок содержат ооциты на начальных этапах развития, которые при вы-
сокой температуре способны переходить к интенсивному росту. Однако низкая темпе-
ратура зимой приостанавливает их дальнейший рост до весны следующего года.
С наступлением теплых весенних дней самки постепенно созревают и начинают от-
кладывать яйца. В это время окраска их тела изменяется незначительно. Если осенью
они имели охристо-коричневый цвет, то в период откладки яиц брюшко самок стано-
вится зеленоватым. В отличие от близких в систематическом отношении особей рода
Stenodema (S. calcarata, S. laevigata), имеющих моновольтинный сезонный цикл и
резко меняющих окраску в течение зимовки от охристо-коричневой осенью до ярко-
зеленой весной, у N. elongata отличаются особи только дочернего (летнего) поколения,
тело которых имеет яркую травяную окраску. Таким образом, важно подчеркнуть, что
у стенодемы окраска изменяется у одной и той же особи, а у N. elongata различие
в окраске проявляется между особями разных поколений (Woodward, 1952).
В экспериментальных условиях на примере популяции N. elongata из Аскота
(Англия, Беркшир; 51.4° с. ш., 0.7° в. д.) показано, что смена физиологических состо-
яний у клопов (активность - имагинальная диапауза - терминация диапаузы), а также
чередование цветовых форм, контролируются длиной дня (Dolling, 1973). По резуль-
татам опытов, проведенных в лаборатории при 20 °C, обнаружено, что существует
21
фотопериодический порог (15-16 ч света в сутки), определяющий судьбу следующего
поколения. Коричневые самки, окрылившиеся при длине дня меньше пороговой, про-
дуцировали также поколение с коричневой окраской. В том случае, когда длина дня
превышала пороговое значение, развитие потомства шло по альтернативному сце-
нарию: формировалась дочерняя генерация с зеленой окраской, как это обычно проис-
ходит в природных условиях в начале лета. Потомство зеленых самок, содержавшихся
в фотопериоде 16 ч света в сутки, было смешанным при доминировании коричневой
формы. Результаты опытов по терминации диапаузы дали основание предполагать,
что диапаузирующие самки реагируют на изменяющуюся длину дня (Dolling, 1973).
Проведенные в Германии (Тюрингия, Йена: 50.9° с. ш., 11.6° в. д.) исследования
подтвердили обоснованность такого предположения. Было обнаружено, что развитие
ооцитов у перезимовавших самок начинается по окончании диапаузы, а триггером ак-
тивации в этом случае выступала длина дня, но не температура (Wegener, 1997).
Notostira erratica (Linnaeus, 1758) (северный странствующий клопик).
Ареал палеарктический: вся Европа, кроме крайнего севера, Казахстан и Средняя
Азия, Грузия, Армения, Азербайджан, Турция, Иран, Туркмения (Kerzhner, Josifov,
1999). Вредит зерновым культурам и возделываемым травам.
На севере Казахстана образует 2 или 3 поколения в год (Асанова, Искаков, 1977).
Исследован в Англии, где завершает 2 поколения в год с зимовкой имаго. Так же, как
у N. elongata, самки в зависимости от физиологического состояния (репродуктивно
активные или диапаузирующие) имеют разную окраску тела: зимующие особи
охристо-коричневые с розоватым оттенком, активные - ярко-зеленые (Butler, 1923).
Род TRIGONOTYLUS Fieber, 1858
Trigonotylus caelestialium (Kirkaldy, 1902) (хлебный клопик; rice leaf bug).
Ареал голарктический (Винокуров и др., 2010). Описан из Китая, значительно позже
был обнаружен в Германии (Wagner, 1956) и Польше (Korcz, 1979), почти одновре-
менно с этим впервые отмечен в Северной Америке (Carvalho, Wagner, 1957; цит. по:
Wheeler, Henry, 1985), в дальнейшем был выявлен во многих штатах США и провин-
циях Канады. Относительно недавно вид был обнаружен в Италии (Giudici, Villa,
2006). Вредит зерновым культурам, особенно пшенице, рису и посевным травам, по-
вреждая и вегетативные органы, и зерна.
В разных зонах в соответствии с температурными условиями дает от 1 до 5 поко-
лений за год. Зимуют яйца. Раннеэмбриональная диапауза формируется в период об-
разования зародышевой пластинки (germ-band stage), как это происходит у всех ис-
следованных видов сем. Miridae с диапаузой на стадии яйца (Cobben, 1968).
В Па ле а р кт ике T. caelestialium - самый многочисленный и наиболее широко
распространенный вид рода. В отдельные годы в центральных районах России чис-
ленность хлебных клопиков бывает очень высокой, достигая
1500 особей на
100 взмахов сачком (Михайлова, 1979). На большей части палеарктического ареала
завершаются 2 или 3 поколения в год (Пучков, 1972; Асанова, Искаков, 1977; Шек,
Евдокимов, 1981). Сроки отрождения личинок первого поколения сильно варьируют
по годам, что определяет нестабильность всего фенологического развития. Так, по на-
22
блюдениям в Центрально-Черноземной зоне России, Поволжье и на Урале, окрыление
имаго второго поколения наблюдается с начала июля до середины августа. При раннем
окрылении второго поколения в теплые годы развивается третье, как правило, мало-
численное поколение (Михайлова, 1980). В Тюмени отмечают 2 поколения в год (Сан-
никова, Гарбар, 1981), на севере Казахстана - 3 (Шек, Евдокимов, 1981).
Тщательные исследования T. caelestialium проведены в Японии, где этот вид серь-
езно вредит рису (Higuchi, 2010; цит. по: Shintani, 2017). По данным лабораторных
экспериментов, наступление зимней эмбриональной диапаузы у T. caelestialium кон-
тролируется длиной дня, действующей на материнское поколение, при этом чувстви-
тельность к длине дня проявляют и личинки старших возрастов, и имаго. В условиях
длинного дня самки откладывают развивающиеся яйца, а в условиях короткого дня -
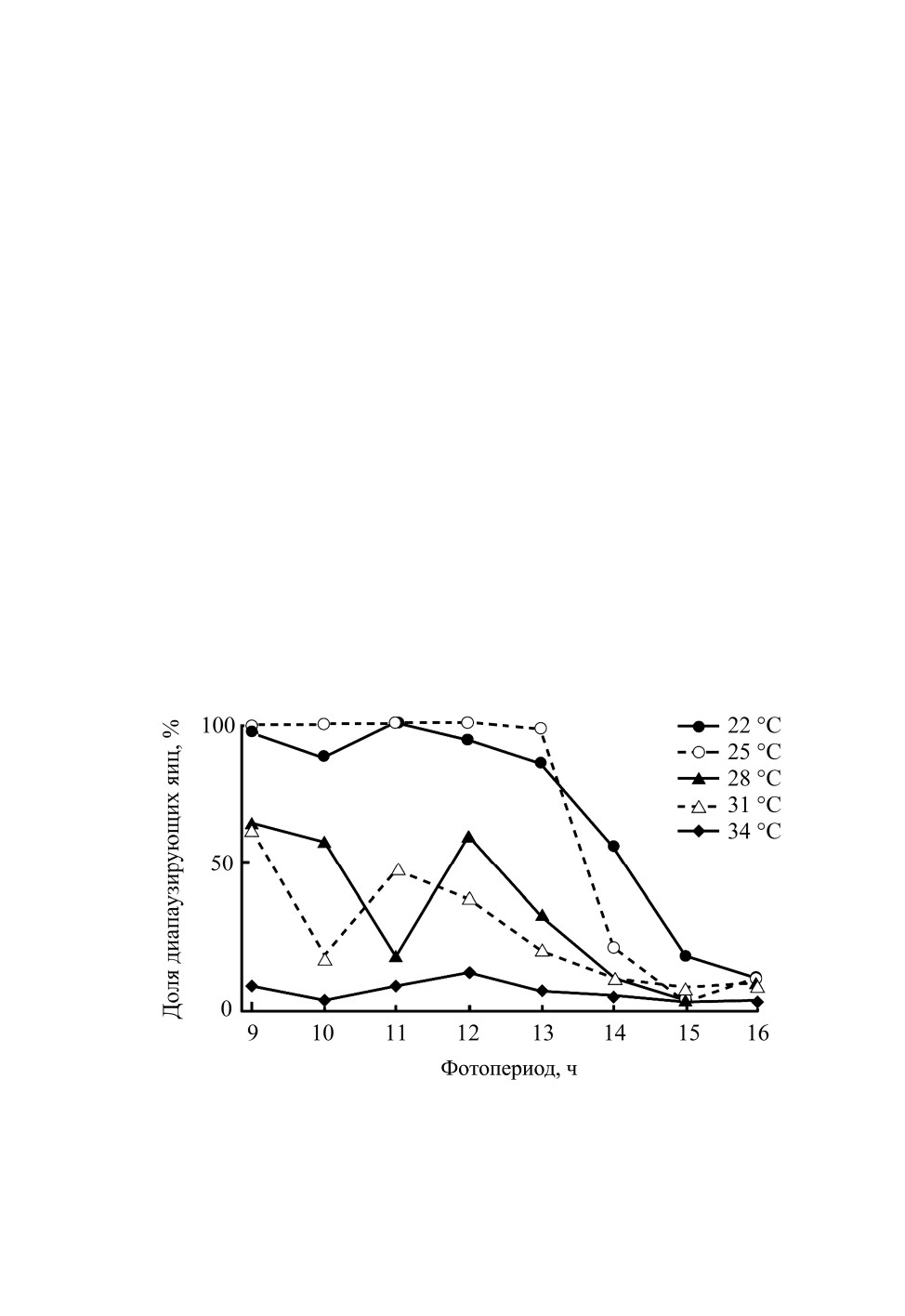
диапаузирующие (Okuyama, 1982; Kudô, Kurihara, 1989). На примере популяции
хлебных клопиков из Дзёэцу (Ниигата, 37.1° с. ш., 138.2° в. д.) показано, что адек-
ватный ответ самок на длину дня проявляется лишь при температуре ниже 25 °C. При
самой высокой из исследованных температур (34 °C) независимо от фотопериода
самки откладывают только недиапаузирующие яйца (рис. 5; Higuchi, Takahashi, 2005).
Длиннодневная фотопериодическая реакция индукции зимней эмбриональной диа-
паузы у T. caelestialium проявляет слабую географическую изменчивость, что под-
тверждается близким значением ее порога у исследованных географических попу-
ляций хлебных клопиков с о. Хоккайдо и из г. Дзёэцу, расположенного на 6° южнее.
В обоих случаях порог реакции расположен между 13 и 14 ч при температурах
23-25 °C (Okuyama, 1982; Higuchi, Takahashi, 2005).
При исследовании роли возраста самок в процессе короткодневной индукции
зимней эмбриональной диапаузы у T. caelestialium обнаружилось, что по мере ста-
Рис. 5. Влияние фотопериода и температуры на долю (%) диапаузирующих яиц Trigonotylus
caelestialium (Kirkaldy) в Дзёэцу (Япония, Ниигата, 37.1° с. ш., 138.2° в. д.; по: Higuchi,
Takahashi, 2005). Клопов родительского поколения от яйца до имаго содержали
в условиях константных длины дня и температуры.
23
рения самки утрачивают чувствительность к короткому дню и доля недиапаузиру-
ющих яиц в их потомстве возрастает (Kudô, Kurihara, 1989).
На о. Хоккайдо (Асахикава, 43.7° с. ш., 142.4° в. д.) за вегетационный сезон развива-
ются 3 поколения и в августе самки откладывают первые диапаузирующие яйца.
В дальнейшем количество диапаузирующих яиц постепенно возрастает, и в сентябре
все 100 % яиц, отложенных самками третьего поколения, находятся в состоянии диа-
паузы (Okuyama, 1982; цит. по: Kudô, Kurihara, 1988). Южнее (о. Хонсю; Мориока,
39.7° с. ш., 141.1° в. д.) отмечается 5 поколений T. caelestialium за сезон, но часть
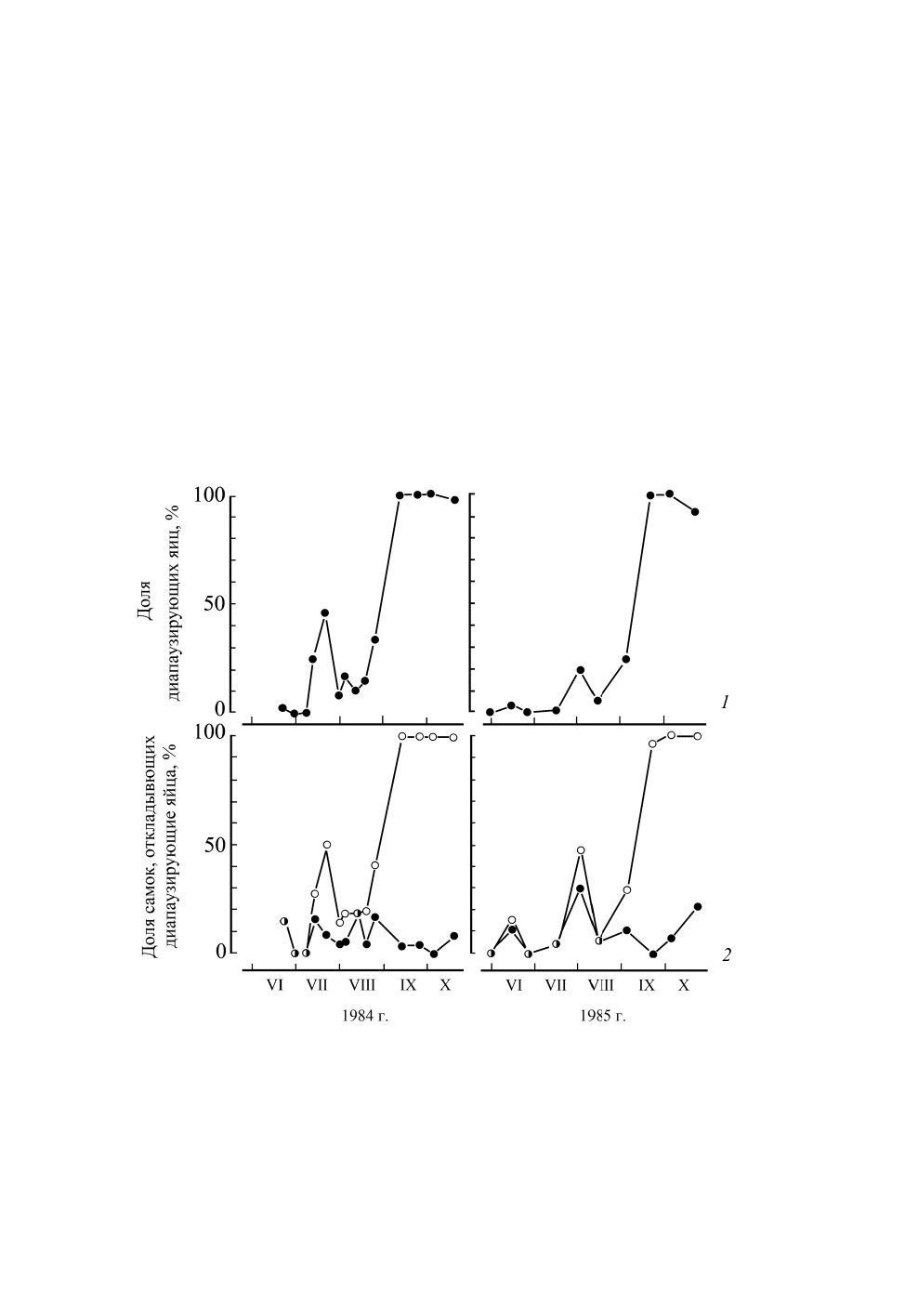
самок уже в июне откладывает диапаузирующие яйца (рис. 6, 1). В июле доля таких
самок достигает 50 %, а затем сокращается (рис. 6, 2), при этом доля диапаузирующих
яиц в потомстве отдельных самок изменяется от 3 до 100 %. Таким образом, в зависи-
мости от зоны обитания сезонная динамика формирования эмбриональной диапаузы
меняется. На севере Японии доля диапаузирующих яиц постепенно возрастает от ав-
густа к сентябрю, тогда как южнее максимальная доля диапаузирующих яиц отмеча-
ется уже в середине лета (Kudô, Kurihara, 1988).
Рис. 6. Сезонное изменение доли (%) диапаузирующих яиц и доли самок, откладывающих
диапаузирующие и активно развивающиеся яйца в природных популяциях Trigonotylus
caelestialium (Kirkaldy) в разные годы в Мориоке (Япония, о. Хонсю, 39.7° с. ш., 141.1° в. д.;
по: Kudô, Kurihara, 1988).
1 - изменение доли самок, откладывающих диапаузирующие яйца (светлые символы), и самок,
откладывающих и диапаузирующие, и активно развивающиеся (т. е. недиапаузирующие) яйца
(темные символы) в природных популяциях; 2 - изменение доли диапаузирующих яиц.
24
Убедительные данные о влиянии вида и физиологического состояния кормового
растения на формирование диапаузы у T. caelestialium были получены и в опытах
с использованием в качестве корма растений с разными сроками вегетации (Shintani,
2004; Shintani, Nagamine, 2020). В экспериментах учитывали количество диапаузиру-
ющих яиц в потомстве самок, собранных на разных видах злаков (Poaceae), произрас-
тающих на трех близко расположенных (150-400 м) экспериментальных участках, что
позволило нивелировать различия влияния температуры и длины дня на развитие и
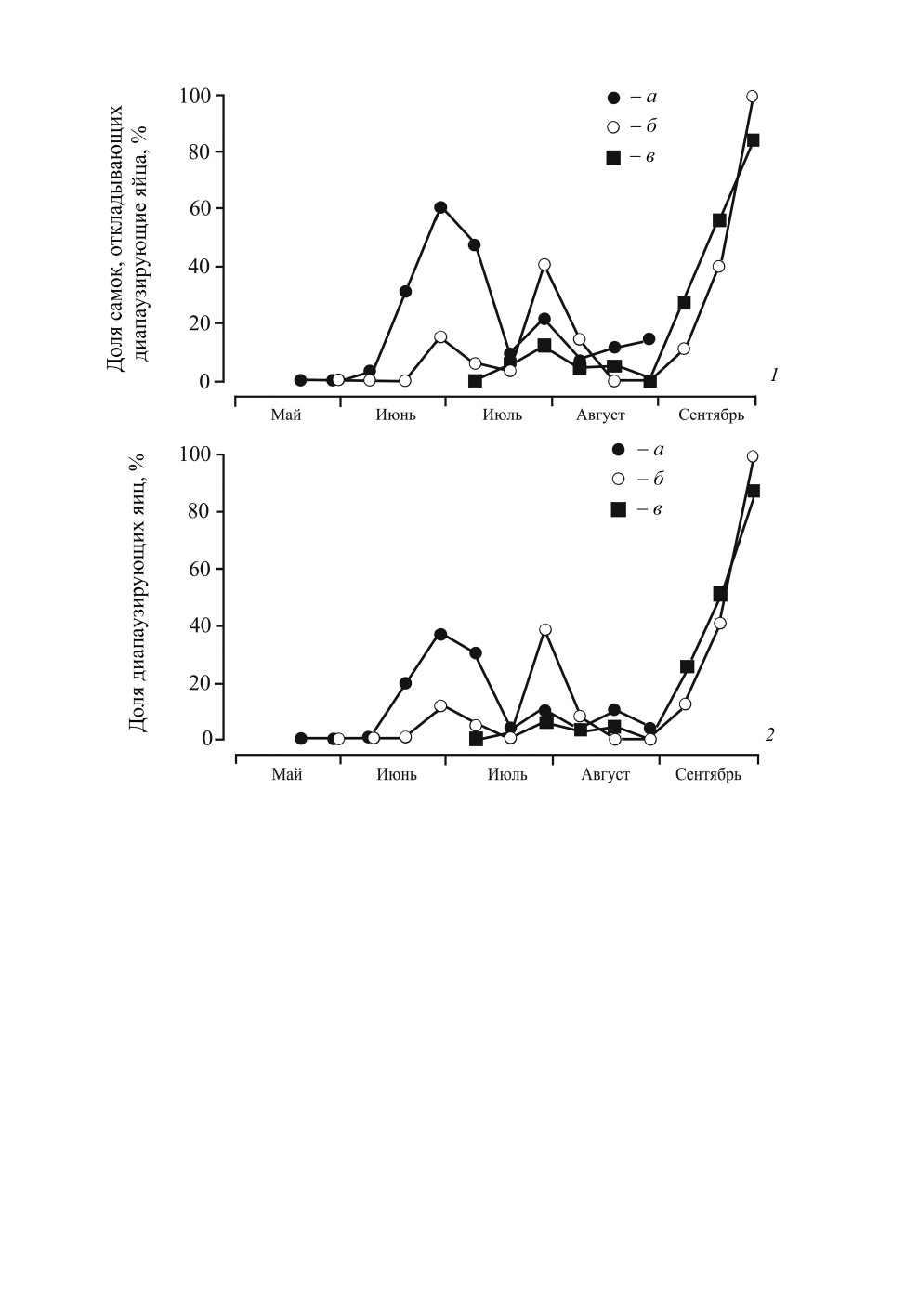
физиологическое состояние самок материнского поколения (рис. 7). На первом участке
(линия а) произрастали виды злаков с ранней вегетацией, которые к середине лета по
мере старения становились малопригодными для питания клопов. На втором участке
(б) произрастали злаки, период активной вегетации которых завершался на 30 дней
позже. На третьем участке (в) росли другие виды растений этого же семейства c более
длительными периодами вегетации, физиологическое состояние которых оставалось
удовлетворительным до поздней осени. Первый пик доли диапаузирующих яиц отчет-
ливо выражен в потомстве самок, собранных на участке а, что, несомненно, было сти-
мулировано физиологическим состоянием их кормового растения. Второй пик доли
диапаузирующих яиц сдвинут примерно на 30 дней, что совпадает с периодом, во
время которого происходит старение злаков на участке б. Лишь самки, собранные на
участке в, откладывали в основном недиапаузирующие яйца до самого конца августа,
поскольку качество (физиологическое состояние) кормового растения сохранялось на
благоприятном для питания клопов уровне до конца лета (рис. 7; Shintani, 2004;
Shintani, Nagamine, 2020).
Эти полевые данные получили подтверждение и в лабораторных условиях: самки,
собранные в природе в конце июня (когда на участке а наблюдали пик доли диапаузи-
рующих яиц), очень отчетливо и быстро реагировали на предложенные им в лабора-
тории кормовые растения. Если самкам предлагали в качестве корма собранные в при-
роде уже подсыхающие к этому времени растения лисохвоста равного (Alopecurus
aequalis Sobol.), 40-100 % таких самок продолжали откладывать диапаузирующие
яйца. Однако если самкам в лаборатории предлагали оптимальный свежий корм (про-
ростки пшеницы Triticum aestivum L.), они очень быстро переключались на откладку
недиапаузирующих яиц (Shintani, Nagamine, 2020).
Диапауза, наступающая у насекомых летом в условиях длинного дня и высокой тем-
пературы, обычно рассматривается как особая форма покоя - летняя диапауза, или
эстивация (Саулич, Мусолин, 2017). В данном случае, несмотря на раннее формиро-
вание эмбриональной диапаузы у T. caelestialium, она все-таки является зимней диапа-
узой, поскольку ее основная экологическая функция - переживание зимнего сезона, и
личинки из покоящихся яиц отрождаются только весной следующего года (Kudô,
Kurihara, 1988), а не в конце лета, как при летней диапаузе.
В Н е ар ктике T. caelestialium широко известен как вредитель зерновых культур
(Blinn, Yonke, 1986). Подробно прослежено сезонное развитие популяции хлебного
клопика в штате Пенсильвания (США, ≈ 40° с. ш.). Личинки из перезимовавших яиц
отрождаются с середины апреля до начала мая, и уже в первой неделе мая встреча-
ются личинки II-IV возрастов, а в конце мая появляются первые имаго. Личинки
младших возрастов второго поколения в массе встречаются в середине июля.
В дальнейшем летние поколения перекрываются, и особи, принадлежащие к разным
поколениям, встречаются одновременно. По мнению некоторых авторов (Wheeler,
25
Рис. 7. Сезонное изменение доли (%) диапаузирующих яиц Trigonotylus caelestialium (Kirkaldy)
на трех участках в Дзёэцу (Япония, Ниигата, 37.1° с. ш., 138.2° в. д.), различающихся
по срокам вегетации кормовых растений (Poaceae): а - раннелетняя, б - среднелетняя;
в - позднелетняя (по: Shintani, Nagamine, 2020).
1 - доля (%) самок, откладывающих диапаузирующие яйца; 2 - доля (%) диапаузирующих яиц.
Самок собирали с разных растений с интервалом в 10 дней, подсчитывали количество и определяли
состояние яиц, отложенных ими в течение первых двух дней после переноса в лабораторию.
Henry, 1985), появление личинок I и II возрастов в конце августа отмечает начало чет-
вертого поколения, имаго которого откладывают зимующие яйца. В штате Миссури
(37.2° с. ш.) обычно реализуются 2 или 3 поколения в течение сезона (Blinn, Yonke,
1986), в Вайоминге (Wyoming, 42° с. ш.) отмечено развитие только 1 поколения за год
(Stephens, 1982).
Trigonotylus tenuis Reuter, 1893 (rice leaf bug).
Распространен в центральной части и на юге Европы, на севере Африки, в Азии,
Центральной Америке, в Австралии, в тропических и субтропических широтах обоих
26
полушарий (Kerzhner, Josifov, 1999). При питании вредит злакам (в первую очередь -
культивируемому рису), а также представителям семейств мальвовых и сложно-
цветных (Shintani, Higuchi, 2008).
Факторы, регулирующие сезонный цикл T. tenuis, экспериментально исследованы
в Японии (Shintani, Higuchi, 2008). Trigonotylus tenuis, так же как T. caelestialium, имеет
поливольтинный сезонный цикл с зимовкой на эмбриональной стадии. Наступление
эмбриональной диапаузы определяется продолжительностью дня в период развития
родительского поколения. В длинном дне самки откладывают развивающиеся яйца,
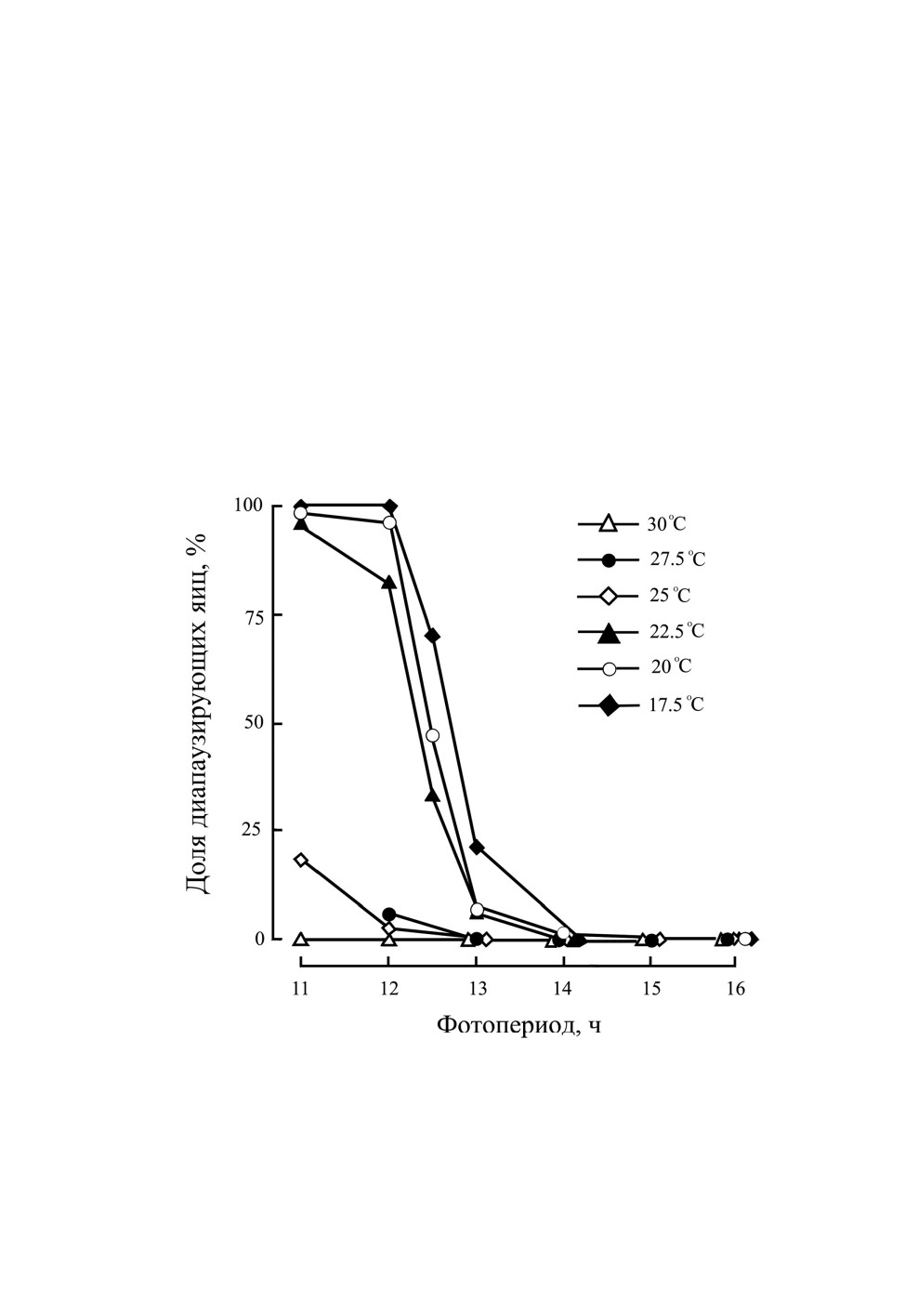
а в коротком - диапаузирующие. Фотопериодическая реакция длиннодневного типа
зависит от температуры. При 17.5, 20.0 и 22.5 °C самки проявляют отчетливую ре-
акцию на длину дня, а при более высокой температуре (25, 27.5 и 30 °C) самки не
реагируют на длину дня и во всех фотопериодических режимах откладывают недиа-
паузирующие яйца (рис. 8).
Сравнительный анализ эко-физиологических свойств T. tenuis и T. caelestialium по-
казал, что в схеме сезонного развития этих 2 видов много общего. Длительность
Рис. 8. Фотопериодическая реакция индукции эмбриональной диапаузы у Trigonotylus
tenuis Reuter при различной температуре; популяция из окр. Изуми-Сано (Япония, Осака,
34.4° с. ш., 135.3° в. д.) (по: Shintani, Higuchi, 2008). Особей материнского поколения
содержали при разных комбинациях длины дня и температуры и учитывали долю
диапаузирующих яиц в потомстве.
27
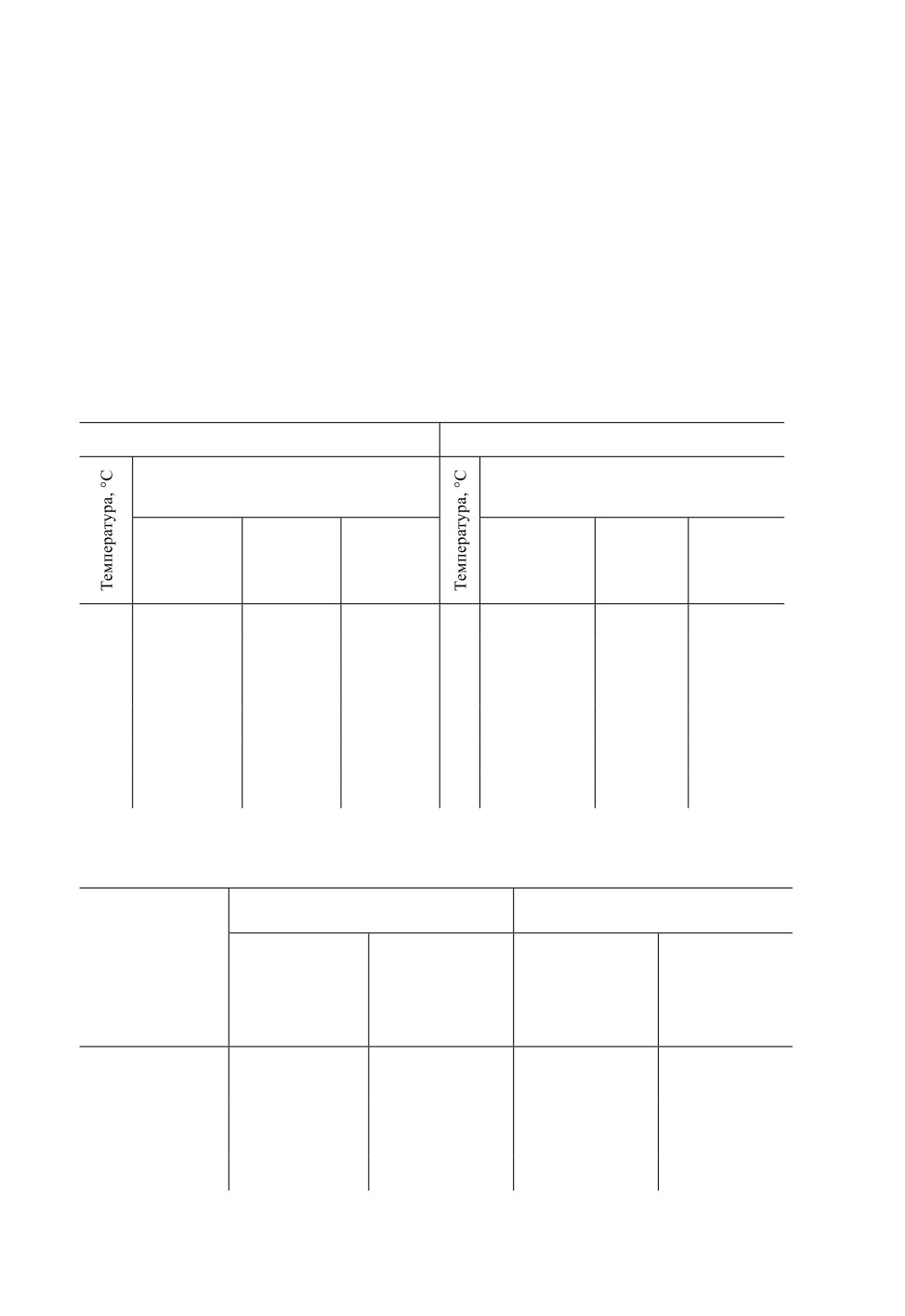
развития яиц и личинок, а также продолжительность преовипозиционного периода
в пределах исследованных температур варьировали слабо (табл. 3). Мало различались
и показатели нижнего температурного порога развития и сумм эффективных темпе-
ратур, обеспечивающих завершение одной полной генерации у сравниваемых видов
(табл. 4).
Анализируя результаты исследования, авторы пришли к заключению, что небольшие
различия в температурных нормах развития отдельных стадий и свойствах фотопери-
одических реакций, контролирующих сроки наступления диапаузы и определяющие
фенологию локальных популяций, свидетельствуют о более южном происхождении
T. tenuis по сравнению с T. caelestialium (Shintani, Higuchi, 2008).
Таблица 3. Продолжительность отдельных онтогенетических периодов у Trigonotylus tenuis
Reuter (по: Shintani, Higuchi, 2008) и T. caelestialium Kirkaldy (по: Takahashi, 2001) при разных
температурах
T. tenuis
T. caelestialium
Продолжительность периода,
Продолжительность периода,
m ± S. D., дн.
m ± S. D., дн.
Эмбриональ-
Личиночная
Созревание
Эмбриональ-
Личиноч-
Созревание
ная стадия
стадия
самок
ная стадия
ная стадия
самок
17.5
-
33.0 ± 3.4
-
15.0
25.5 ± 1.09
-
10.3 ± 2.30
20.0
12.5 ± 1.0
21.2 ± 1.8
6.2 ± 1.4
19.0
11.6 ± 0.50
27.9 ± 2.42
6.8 ± 1.77
22.5
9.0 ± 0.7
15.5 ± 1.2
4.4 ± 1.2
23.0
7.6 ± 0.50
17.4 ± 0.28
4.4 ± 1.12
25.0
7.1 ± 0.6
12.4 ± 1.1
3.5 ± 0.9
27.0
6.0 ± 0.24
12.0 ± 1.07
3.1 ± 0.68
27.5
6.2 ± 0.4
10.8 ± 0.9
3.2 ± 0.6
31.0
5.0 ± 0.19
9.1 ± 0.66
2.9 ± 0.64
30.0
5.4 ± 0.3
9.2 ± 0.6
2.9 ± 0.6
-
-
-
-
Таблица 4. Эко-физиологические параметры развития Trigonotylus tenuis Reuter (по: Shintani,
Higuchi, 2008) и T. caelestialium Kirkaldy (по: Takahashi, 2001) в Японии
T. tenuis
T. caelestialium
Онтогенетические
Нижний
Сумма
Нижний
Сумма
периоды
температурный
эффективных
температурный
эффективных
порог развития,
температур,
порог развития,
температур,
°С
гр.-дн.
°С
гр.-дн.
Эмбриональная
12.5
91.9
10.4
114.9
стадия
Личиночная
12.7
155.8
13.6
161.3
стадия
Созревание самок
11.7
49.7
9.4
59.9
28
ОБСУЖДЕНИЕ
В данном обзоре проанализированы сезонные адаптации лишь 8 подробно исследо-
ванных видов, относящихся к 4 родам трибы Stenodemini. Тем не менее, они создают
представление о разнообразии реакций, участвующих в контроле сезонного развития
и формировании годичных циклов у представителей этой небольшой (около 200 видов)
трибы.
Среди стенодемин отмечен крыловой полиморфизм, который широко распространен
в некоторых таксонах полужесткокрылых, например у водных и околоводных видов
(Andersen, 1982; Schuh, Slater, 1995; Musolin, Saulich, 1999; Саулич, Мусолин, 2007а,
2007б). На примере Leptopterna dolabrata показано, что крыловой диморфизм контро-
лируется и генетически (самки - короткокрылые и полнокрылые, самцы - всегда пол-
нокрылые), и экологически (Braune, 1983). Высокие температура и плотность содер-
жания в период развития личинок IV и V возрастов увеличивают в популяции долю
длиннокрылых самок, хотя, как правило, такие особи редко встречаются в природе.
Полиморфизм по окраске тела проявляется у разных видов стенодемин по-разному,
что, вероятно, связано с типом сезонного цикла. Представители рода Stenodema
(S. calcarata, S. laevigata) имеют моновольтинный сезонный цикл и резко меняют
окраску в течение зимовки от охристо-коричневой осенью до ярко-зеленой весной,
а у близкого в систематическом отношении поливольтинного вида Notostira elongata
альтернативные цветовые формы связаны с разными поколениями: особи летнего
поколения имеют яркую травяную окраску, а самки следующего (зимующего) поко-
ления - охристо-коричневую. Таким образом, важно подчеркнуть, что у стенодем
окраска изменяется у одной и той же особи, а у N. elongata сезонный полиморфизм по
окраске проявляется у особей разных поколений (Woodward, 1952). Смена цветовых
форм у N. elongata контролируется длиной дня (Dolling, 1973).
Моновольтинный сезонный цикл на основе облигатной диапаузы свойствен 4 из ис-
следованных видов - Stenodema calcarata, S. laevigata, Leptopterna dolabrata и L. fer-
rugata. При этом виды рода Stenodema имеют имагинальную диапаузу, а оба вида рода
Leptopterna зимуют на стадии яйца. У остальных 4 исследованных видов сезонный
цикл поливольтинный, и в разных географических зонах в зависимости от климатиче-
ских условий они могут завершать от 1 до 5 поколений, зимуя в состоянии имаги-
нальной (род Notostira) или эмбриональной (род Trigonotylus) диапаузы. Индукция
зимней диапаузы осуществляется под контролем фотопериодической реакции, хорошо
исследованной у видов рода Trigonotylus. В длиннодневных условиях самки отклады-
вают активно развивающиеся яйца, в короткодневных - диапаузирующие.
Сравнительный анализ эко-физиологических свойств Trigonotylus tenuis и T. caele-
stialium показал, что в характере сезонного развития этих 2 видов есть как сходные
черты (поливольтинный сезонный цикл, температурные нормы развития), так и раз-
личия, в частности, касающиеся свойств фотопериодической реакции индукции диа-
паузы и связанные с более южным происхождением T. tenuis.
Для многих насекомых, в том числе фитофагов, показано, что вид кормового рас-
тения или его физиологическое состояние (т. е. пригодность для питания) могут вызы-
вать наступление диапаузы на определенной для вида стадии развития и таким об-
разом изменять вольтинизм популяции. Значение этого фактора проявляется при
индукции как летней, так и зимней диапауз. Известно, что летняя диапауза у насе-
29
комых формируется в условиях длинного дня и при высокой температуре, а зимняя -
в противоположных условиях: в коротком дне и при низкой температуре. В период
формирования диапаузы (как летней, так и зимней) качество корма снижается; это яв-
ление характеризуется сезонностью и предсказуемо. При этом сигнальная функция
корма вуалируется динамикой длины дня и температуры, как более надежными инди-
каторами приближающихся изменений окружающей среды (Данилевский, 1961;
Tauber et al., 1986; Hunter, McNeil, 1997; Саулич, Волкович, 2004; Takagi, Miyashita,
2008; Liu et al., 2010; Dalin, Nylin, 2012; Saulich, Musolin, 2018).
Однако убедительные данные, полученные на примере T. caelestialium, подтвер-
ждают и самостоятельное значение пищевого фактора в индукции диапаузы (Kudô,
Kurihara, 1988; Higuchi, Takahashi, 2005). В условиях природных опытов на фоне вы-
сокой температуры и длинного дня в середине лета самки при питании неблагопри-
ятным кормом откладывали яйца, часть которых находилась в состоянии диапаузы
именно зимнего типа. Эмбриогенез в таком случае приостанавливается на ранней
стадии развития яиц, и личинки из них отрождаются только весной следующего года,
как это происходит обычно при зимней диапаузе. Способность самок откладывать од-
новременно развивающиеся и диапаузирующие яйца можно рассматривать как
адаптивную стратегию, позволяющую сохраниться хотя бы части будущего потомства
в условиях нестабильности кормовой базы (Shintani, 2004; Shintani, Nagamine, 2020).
К сожалению, осталось непонятным, каким образом яйца, находящиеся в состоянии
зимней диапаузы, выдерживают условия высоких позднелетних температур, абсо-
лютно не соответствующих температурным требованиям диапаузирующих стадий на-
секомых.
В целом обзор данных по сезонному развитию клопов трибы Stenodemini, так же
как и исследованной ранее трибы Mirini (Саулич, Мусолин, 2020), свидетельствует
о слабой изученности даже экономически важных видов подсем. Mirinae. На осно-
вании этих сведений удается создать лишь общее представление о сезонных адапта-
циях и годичных циклах, свойственных клопам сем. Miridae. Остается только со-
жалеть о том, что обширные современные программы каталогизации биоразнообразия
окружающей среды в основном посвящены изучению и сохранению обилия видов
живых организмов, но оставляют в стороне разнообразие их жизненных стратегий.
ФИНАНСИРОВАНИЕ
Исследование частично поддержано благотворительным «Фондом Инессы».
СПИСОК ЛИТЕРАТУРЫ
Асанова Р. Б., Искаков Б. В. 1977. Вредные и полезные полужесткокрылые Казахстана. Алма-Ата: Кайнар,
204 с.
Винокуров Н. Н., Канюкова Е. В. 1995. Полужесткокрылые насекомые (Heteroptera) Сибири. Новосибирск:
Наука, 238 с.
Винокуров Н. Н., Канюкова Е. В., Голуб В. Б. 2010. Каталог полужесткокрылых насекомых (Heteroptera)
Азиатской части России. Новосибирск: Наука, 320 с.
Данилевский А. С. 1961. Фотопериодизм и сезонное развитие насекомых. Л.: Издательство Ленинградского
университета, 243 с.
Михайлова Н. А. 1979. Факторы динамики численности Trigonotylus coelestialium Kirk. (Hemiptera, Miridae).
Зоологический журнал 58 (6): 839-848.
Михайлова Н. А. 1980. К прогнозу хлебных клопов. Защита растений 9: 47.
30
Пучков В. Г. 1972. Отряд Hemiptera (Heteroptera) - Полужесткокрылые. В кн.: Крыжановский О. Л., Данциг
Е. М. (ред.). Насекомые и клещи - вредители сельскохозяйственных культур. Т. 1. Л.: Наука,
с. 222-262.
Санникова М. Ф., Гарбар Л. И. 1981. Хлебный клопик в Тюменской обл. Защита растений 4: 29.
Саулич А. Х., Волкович Т. А. 2004. Экология фотопериодизма насекомых. СПб.: Издательство Санкт-Петер-
бургского университета, 276 с.
Саулич А. Х., Мусолин Д. Л. 2007а. Времена года: разнообразие сезонных адаптаций и экологических меха-
низмов контроля сезонного развития полужесткокрылых (Heteroptera) в умеренном климате. В кн.:
А. А. Стекольников (ред.). Стратегии адаптаций наземных членистоногих к неблагоприятным услови-
ям среды, c. 25-106. (Труды Биологического НИИ СПбГУ, т. 53).
Саулич А. Х., Мусолин Д. Л. 2007б. Сезонное развитие водных и околоводных полужесткокрылых насеко-
мых (Heteroptera). СПб.: Издательство Санкт-Петербургского университета, 205 с.
Саулич А. Х., Мусолин Д. Л. 2017. Летняя диапауза как особая сезонная адаптация насекомых: разнообразие
форм проявления, механизмов контроля и экологическое значение. Энтомологическое обозрение 96
Саулич А. Х., Мусолин Д. Л. 2020. Сезонное развитие клопов-слепняков (Heteroptera, Miridae): подсем.
Mirinae, триба Mirini. Энтомологическое обозрение 99 (1): 7-38. doi: 10.31857/S0367144520010013
Шек Г. Х., Евдокимов Н. Я. 1981. Вредители зерновых в Казахстане. Защита растений 8: 26-29.
Andersen N. M. 1982. The Semiaquatic Bugs (Hemiptera, Gerromorpha): Phylogeny, Adaptations, Biogeography,
and Classification. Klampenborg, Denmark: Scandinavian Science Press, 455 p. (Entomonograph, vol. 13).
Blinn R. L., Yonke T. R. 1986. Laboratory life history of Trigonotylus coelestialium (Kirkaldy) (Heteroptera:
Miridae). Journal of the Kansas Entomological Society 59 (4): 735-737.
Braune H. J. 1971. Der Einfluss der Temperatur auf Eidiapause und Entwicklung von Weichwanzen (Heteroptera,
Miridae). Oecologia 8 (3): 223-266. doi: 10.1007/BF00346473
Braune H. J. 1973. The role of temperature in controlling obligatory diapause. In: W. Wieser (ed.). Effect of
Temperature on Ectothermic Organisms. Berlin: Springer, p. 233-238.
Braune H. J. 1983. The influence of environmental factors on wing polymorphism in females of Leptopterna
dolobrata (Heteroptera, Miridae). Oecologia 60 (3): 340-347. doi: 10.1007/BF00376849
Butler E. A. 1923. A Biology of the British Hemiptera-Heteroptera. London, Great Britain: Witherby, 682 p.
Cobben R. H. 1968. Evolutionary Trends in Heteroptera. Part I. Eggs, Architecture of the Shell, Gross Embryology
and Eclosion. Wageningen: Centre for Agricultural Publishing and Documentation, 376 p.
Dalin P., Nylin S. 2012. Host plant quality adaptively affects the diapause threshold: evidence from leaf beetles in
willow plantations. Ecological Entomology 37 (6): 490-499. doi: 10.1111/j.1365-2311.2012.01387.x
Dolling W. R. 1973. Photoperiodically determined phase production and diapause termination in Notostira elongata
(Geoffroy) (Hemiptera: Miridae). Entomologist’s Gazette 24 (1): 75-79.
Giudici M. L., Villa B. 2006. Trigonotylus caelestialium Kirkaldy (Heteroptera, Miridae, Mirinae, Stenodemini) su
riso in Italia. Informatore Fitopatologico 6: 18-23.
Higuchi H. 2010. Ecology and management of rice bugs causing pecky rice. Japanese Journal of Applied Entomology
and Zoology 54: 171-188 (in Japanese with English summary). doi: 210.1303/jjaez.2010.171
Higuchi H., Takahashi A. 2005. Seasonal changes in egg diapause induction and effects of photoperiod and
temperature on egg diapause in the rice leaf bug, Trigonotylus caelestialium (Kirkaldy) (Heteroptera:
Miridae). Japanese Journal of Applied Entomology and Zoology 49: 113-118 (in Japanese with English
summary). doi: 10.1303/jjaez.2005.113
Hunter M. D., McNeil J. N. 1997. Host-plant quality influences diapause and voltinism in a polyphagous insect
herbivore. Ecology 78 (4): 977-986. doi: 10.2307/2265851
Kerzhner I. M., Josifov M. 1999. Family Miridae Hahn, 1833. In: B. Aukema, Ch. Rieger (eds). Catalogue of the
Heteroptera of the Palaearctic Region. Vol. 3. Amsterdam, the Netherlands: The Netherlands Entomological
Society, 577 p.
Korcz A. 1979. Trigonotylus coelestialium (Kirk.) (Heteroptera, Miridae), new to the Polish fauna. Polskie Pismo
Entomologiczne 49: 175-183.
Kudô S., Kurihara M. 1988. Seasonal occurrence of egg diapause in the rice leaf bug, Trigonotylus coelestialium
Kirkaldy (Hemiptera, Miridae). Applied Entomology and Zoology 23 (3): 365-366.
Kudô S., Kurihara M. 1989. Effects of maternal age on induction of egg diapause in the rice leaf bug, Trigonotylus
coelestialium Kirkaldy (Heteroptera; Miridae). Japanese Journal of Entomology 57 (2): 440-447.
Kullenberg B. 1944. Studien über die Biologie der Capsiden. Zoologische Beiträge aus Uppsala 23: 1-522.
Liu Z. D., Gong P. Y., Li D. M., Wei W. 2010. Pupal diapause of Helicoverpa armigera (Hübner) (Lepidoptera:
Noctuidae) mediated by larval host plants: pupal weight is important. Journal of Insect Physiology 56 (12):
1863-1870. doi: 10.1016/j.jinsphys.2010.08.007
31
Mrós E., Wojciechowski W. 2011. The systematic position of the tribe Stenodemini (Heteroptera: Cimicomorpha:
Miridae: Mirinae) in the light of the male internal reproductive system. Journal of Natural History 45
(25-26): 1563-1588. doi: 10.1080/00222933.2011.559595
Musolin D. L., Saulich A. H. 1999. Diversity of seasonal adaptations in terrestrial true bugs (Heteroptera) from the
temperate zone. Entomological Science 2 (4): 623-639.
Okuyama S. 1982. Role of day-length in the oviposition of dormant eggs by the rice leaf bug, Trigonotylus
coelestialium Kirkaldy, and condition for release from the dormancy. Annual Report of Plant Protection in
North Japan 33: 89-92 (In Japanese).
Saulich A. Kh., Musolin D. L. 2018. Seasonal cycles of Pentatomoidea. In: J. E. McPherson (ed.). Invasive Stink
Bugs and Related Species (Pentatomoidea): Biology, Higher Systematics, Semiochemistry, and Management.
Boca Raton, FL, U. S. A.: CRC Press, p. 565-607.
Schuh R. T. 1995. Plant Bugs of the World (Insecta: Heteroptera: Miridae): Systematic Catalog, Distribution, Host
List and Bibliography. New York: New York Entomological Society, xii + 1329 p.
Schuh R. T. 2002-2013. On-Line Systematic Catalog of Plant Bugs (Insecta: Heteroptera: Miridae). [URL:
Schuh R. T., Slater J. A. 1995. True Bugs of the World (Hemiptera: Heteroptera): Classification and Natural History.
Ithaca, New York, U. S. A.: Cornell University Press, 338 p.
Schuh R. T., Weirauch C. 2020. True Bugs of the World (Hemiptera: Heteroptera): Classification and Natural
History. 2nd edn. Manchester, U. K.: Siri Scientific Press, 768 p. + 32 pl. (Monographs Series, vol. 8).
Schwartz M. D. 2010. Revision of the Stenodemini with a review of the included genera (Hemiptera: Heteroptera:
Miridae: Mirinae). Proceedings of the Entomological Society of Washington
110
(4): 1111-1201.
doi: 10.4289/0013-8797-110.4.1111
Scudder G. G. E., Schwartz M. D. 2001. The genus Leptopterna Fieber (Heteroptera: Miridae: Stenodemini) in
North America. Proceedings of the Entomological Society of Washington 103 (4): 797-806.
Shintani Y. 2004. Adaptive significance of oviposition of diapause eggs in summer in the rice leaf bug, Trigonotylus
caelestialium. In: XXII International Congress of Entomology. Brisbane, Australia. 2004. Abstract
CD. Section 8. Abstract 1528.
Shintani Y., Higuchi H. 2008. Developmental parameters and photoperiodism in Trigonotylus tenuis (Reuter)
(Heteroptera; Miridae). Applied Entomology and Zoology 43 (2): 259-264. doi: 10.1303/ez.2008.259
Shintani Y., Nagamine K. 2020. Microhabitat variation in egg diapause incidence in summer within a local
population: an adaptation to decline in hostplant suitability in the rice leaf bug, Trigonotylus caelestialium
(Hemiptera: Miridae). Environmental Entomology 49 (4): 912-917. doi: 10.1093/ee/nvaa063
Southwood T. R. E., Leston D. 1959. Land and Water Bugs of the British Isles. London, Great Britain: Frederick
Warne and Co., 436 p.
Stephens G. M. 1982. The Plant Bug Fauna (Heteroptera: Miridae) of Grasses (Poaceae) of the Medicine Bow
Mountains and Pole Mountain Ranger District, Wyoming. University of Wyoming Agricultural Experiment
Station. Science Monograph 43, 175 p.
Takagi S., Miyashita Y. 2008. Host plant quality influences diapause induction of Byasa alcinous (Lepidoptera:
Papilionidae).
Annals of the Entomological Society of America
101:
392-396.
doi: 10.1603/0013-8746(2008)101[392:HPQIDI]2.0.CO;2
Takahashi A., Higuchi H. 2001. Effect of temperature on the development of rice leaf bug, Trigonotylus caelestialium
(Kirkaldy) (Heteroptera: Miridae). Proceedings of the Association of Plant Protection of Hokuriku 49: 19-22
(in Japanese).
Tauber M. J., Tauber C. A., Masaki S. 1986. Seasonal Adaptations of Insects. New York, New York, U. S. A.: Oxford
University Press, 411 p.
Wagner F.
1956. Trigonotylus coelestialium Kirk. in Nordwestdeutschland (Heteroptera, Miridae).
Naturwissenschaftlichen Vereins für Schleswig-Holstein 28: 69-71.
Walker T. J. 1986. Stochastic polyphenism: coping with uncertainty. Florida Entomologist 69 (1): 46-62.
doi: 10.2307/3494744
Wegener C. 1997. Termination der Diapause von Notostira elongata (Heteroptera: Miridae). Mitteilungen des
Thüringer Entomologen-Verbandes e. V. 4 (1): 22-23.
Wheeler A. G. 2001. Biology of the Plant Bugs (Hemiptera: Miridae): Pests, Predators, Opportunists. Ithaca, New
York, U. S. A.: Cornell University Press, xvi + 508 p.
Wheeler A. G. Jr., Henry T. J. 1985. Trigonotylus coelestialium (Hemiptera: Miridae), a pest of small grains: seasonal
history, host plants, damage, and description of adult and nymphal stages. Proceedings of the Entomological
Society of Washington 87 (4): 699-713.
Wheeler A. G. Jr., Henry T. J. 1992. A Synthesis of the Holarctic Miridae (Heteroptera): Distribution, Biology, and
Origin, with Emphasis on North America. Lanham, MD, U. S. A.: Entomological Society of America, 282 p.
(Thomas Say Foundation Monographs, 15).
32
Woodroffe G. E. 1977. Notostira erratica (L.) and Notostira elongata (Geoffroy) (Hemiptera, Miridae) in the British
Isles. Entomologist’s Gazette 28: 123-126.
Woodward T. E. 1952. Studies of the reproductive cycle of three species of British Heteroptera, with special
reference to the overwintering stages. Transactions of the Royal Entomological Society of London 103 (5):
171-214.
SEASONAL DEVELOPMENT OF PLANT BUGS (HETEROPTERA, MIRIDAE):
SUBFAMILY MIRINAE, TRIBE STENODEMINI
A. Kh. Saulich, D. L. Musolin
Key words: diapause, biological control, day length, dormancy, nymphal development,
seasonal development, photoperiodic response, plant protection, true bugs, voltinism.
SUMMARY
The seasonal adaptations of eight better studied species belonging to four genera of the tribe
Stenodemini are analyzed. A univoltine seasonal cycle with obligate diapause is characteristic of four
studied species - Stenodema calcarata, S. laevigata, Leptopterna dolabrata, and L. ferrugata. Species
of the genus Stenodema have winter adult diapause, whereas both species of the genus Leptopterna
overwinter at the egg stage. In the remaining four species (Notostira elongata, N. erratica, Trigonotylus
caelestialium, and T. tenuis), the seasonal cycle is multivoltine, and in different climatic zones, these
species can complete from 1 to 5 generations per year, depending on the climatic conditions, and
overwinter in the state of adult (Notostira spp.) or embryonic (Trigonotylus spp.) diapause. Induction of
winter diapause is controlled by the photoperiodic response, which is well studied in species of the genus
Trigonotylus. Under the long-day conditions, females lay non-diapausing (i. e. directly developing)
eggs, whereas under the short-day conditions they produce diapausing eggs. In stenodemines, examples
of the wing and colour polymorphism are recorded. Thus, in L. dolabrata, it was shown that high
temperature and crowding during development of elder nymphs (IV and V instars) promote appearance
of long-winged females, whereas short-winged females usually dominate in the wild (males are always
long-winged). Body colour polymorphism in species with a univoltine seasonal cycle (Stenodema spp.)
appears as the change of body colour of the overwintering individuals from russet-brown in the autumn
to bright green in the spring. In multivoltine species (e. g., Notostira elongata), alternative colour forms
are associated with different generations: adults of the summer generation have a bright grassy body
colour and females of the overwintering generation are russet-brown (males do not overwinter). The
example of Trigonotylus caelestialium convincingly demonstrates that the nutritional factor can have
independent value in the induction of diapause. The ability of females to produce simultaneously directly
developing and diapausing eggs in the middle of the summer under conditions of high temperature and
long day might be considered as an adaptive strategy that allows at least a part of the future offspring
to survive under conditions of unstable food supply. In general, a review of the data on the seasonal
development of true bugs of the tribe Stenodemini, as well as of the previously studied tribe Mirini,
indicates poor knowledge of even the economically important species of plant bugs (Miridae). Based
on these data, it is possible to create only a general view of the seasonal adaptations and annual cycles
characteristic of the plant bugs of the subfamily Mirinae.
33