ЭНТОМОЛОГИЧЕСКОЕ ОБОЗРЕНИЕ, 100, 4, 2021
УДК 595.768.24: 630*453
МИКОБИОТА КОРОЕДОВ РОДА IPS DEGEER, 1775
(COLEOPTERA, CURCULIONIDAE: SCOLYTINAE: IPINI)
И ЕЕ ХОЗЯЙСТВЕННОЕ ЗНАЧЕНИЕ
© 2021 г. М. О. Романенко,1, 2* Дж. А. Угву,3, 4** Л. О. Иващенко1***
1 Белорусский государственный технологический университет
ул. Свердлова, 13а, Минск, 220006 Республика Беларусь
2 Latvian State Forest Research Institute «Silava»
111 Rigas str., Salaspils, LV-2169 Latvia
*e-mail: Romina_mo@bk.ru (автор, ответственный за переписку),
***e-mail: lyba281997@mail.ru
3 Forestry Research Institute of Nigeria
PMB 5054, Jericho, Ibadan, Oyo State, Nigeria
4 Department of Forest Sciences, University of Helsinki
P.O. Box 27, FIN-00014 Helsinki, Finland
**e-mail dr.amaka2013@gmail.com
Поступила в редакцию 27.04.2021 г.
После доработки 12.07.2021 г.
Принята к публикации 12.07.2021 г.
Рассмотрена микобиота короедов рода Ips DeGeer, 1775 (Coleoptera, Curculionidae: Scolytinae:
Ipini) на основе трех основных типов тесного взаимодействия грибов и короедов. Приведен на
основе литературных данных список фитопатогенных грибов, ассоциированных с настоящми ко-
роедами рода Ips. Особое внимание в статье уделяется видам короедов - переносчикам возбуди-
телей болезней древесных растений и деревоокрашивающих грибов из родов Ophiostoma Syd.
et P. Syd., Ceratocystis Ellis et Halst., Ceratocystiopsis (Siemaszko) H. P. Upadhyay et W. B. Kendr.,
Grosmannia (Grosmann) Goid., Endoconidiophora Münch и Fusarium Link. Проанализированы
основные энтомопатогенные грибы (Beauveria bassiana (Bals.-Criv.) Vuill., Metarhizium anisopliae
(Metschnikoff) Sorokin), которые показали высокую эффективность при использовании их в био-
логическом контроле насекомых-вредителей.
Ключевые слова: Ips, микобиота, амброзиальная микофлора, Ophiostomataceae, паразитизм
грибов.
DOI: 10.31857/S0367144521040067
Микробиом короедов образован грибами, бактериями, нитчатыми нематодами и их
комбинациями (Clayton et al., 2015). Грибной компонент микробиома, как доминиру-
ющий, изучен наиболее полно и диагностируется на экзоскелете, в кишечнике и гемо-
целе насекомых (Douglas, 2015).
797
Несмотря на широкую изученность микофлоры короедов рода Ips, остается ряд
вопросов: какой из грибных компонентов связан с короедом перманентно, а какой вре-
менно? Какие взаимосвязи могут быть полезными или вредными для приспособлен-
ности как короедов, так и грибов в биокомплексе «грибы-короед-переносчик-расте-
ние-хозяин»?
Об актуальности исследований комплекса «короеды-грибы» свидетельствует по-
следняя волна усыхания насаждений от короеда-типографа, которая началась в 2012 г.
и к середине 2018 г. приняла характер «биологического пожара». Страны Центральной
Европы, включая Германию, Австрию, Чехию и Польшу, сообщали о массовых по-
вреждениях лесов - около 40 млн м3 древесины в 2018 г. Ущерб несут и другие страны,
включая Россию (Malakhova et al., 2015; Selikhovkin et al., 2017), Белоруссию (Кухта и
др., 2014), Францию, Швейцарию и Великобританию. Национальное агентство лес-
ного хозяйства Франции оценивает ущерб от усыхания лесов в 2018-2019 гг. в размере
от 60 до 100 млн м3 древесины. В Чехии усыхание лесов от короеда-типографа
в 2019 г. достигло кульминации - почти 100 млн м3 древесины было заготовлено за по-
следнее десятилетие из-за повреждения древостоев короедом, и более половины этого
объема было добыто за последние четыре года (Toth, 2020). Пораженная короедами и
грибами древесина в настоящее время продается по всей Европе.
Взгляды на ассоциации «насекомые-ксилофаги-грибы» в последние десятилетия
часто изменялись, однако основные типы тесного взаимодействия грибов и короедов
рода Ips (Coleoptera, Curculionidae: Scolytinae: Ipini) можно объединить в три класси-
ческие группы:
1) использование короедами амброзиальных грибов для питания;
2) перенос короедами грибов - возбудителей болезней древесных растений и дере-
воокрашивающих грибов;
3) паразитизм грибов на короедах.
Два первых типа напоминают симбиоз, в том числе и мутуализм; есть в этих отно-
шениях и признаки комменсализма, когда выгоду получает только одна сторона без
вреда или выгоды для другой.
Считается, что с каждым видом короедов связан четко определенный комплекс
грибов, который сохраняется в популяции насекомого в течение сезона и ряда лет и
даже остается постоянным при переходе короеда с одной кормовой породы на другую
(Kaarik, 1975).
Использование короедами амброзиальных грибов для питания
Амброзиальная микофлора короедов рода Ips изучена довольно слабо и не является
абсолютно необходимой для развития личинок. Сама по себе амброзия представляет
собой пленку, образующуюся на стенках ходов короедов, которую эти насекомые по-
требляют при питании. Амброзия в течение нескольких дней формирует в ходах ко-
роеда в тканях живого дерева питательный слой, который состоит преимущественно
из спороносящих структур грибов и служит основным источником пищи для взрослых
короедов и их личинок. Считается, что в состав амброзии входят дрожжи и несовер-
шенные грибы из класса Deuteromycetes: рода Ambrosiella Brader ex Arx et Hennebert
798
(Kinuura, 1995), Monacrosporium ambrosium Gadd et Loos, Ambrosiella xylebori Brader
ex Arx et Hennebert, Cephalosporium Corda (Batra, 1985), a также роды Pichia
E. C. Hansen, Hansenula Syd. et P. Syd. и другие (Густелева, Исаев, 1982).
Одну из самых полных классификаций пищевых режимов ксилофагов, связанных
с использованием амброзиальных грибов, предложил Б. М. Мамаев (Мамаев, 1977),
выделивший четыре их основные группы.
Ферментативная ксилофагия. Личинки заселяют сравнительно свежую кору и дре-
весину, прокладывая ходы, забитые буровой мукой. Они обладают наиболее полным
набором ферментов, способных переваривать клетчатку и гемицеллюлозу, и не свя-
заны с определенными видами грибов.
Амброзийная ксиломицетофагия. Личинки обитают в свободных от трухи ходах, на
стенках которых развиваются грибы. Эти грибы составляют основную часть рациона,
а древесина хотя и заглатывается, но слабо переваривается в связи с неполным на-
бором ферментов.
Деструктивная ксиломицетофагия. Личинки прокладывают ходы, забитые опилками
и экскрементами, и заглатывают древесину или кору, пронизанную мицелием грибов и
уже в какой-то степени ими разрушенную. Некоторые представители этой группы
заносят споры грибов в древесину в период откладки яиц, у других возникает трофи-
ческая связь с определенными видами дереворазрушающих грибов, встречающихся
в древесине в естественных условиях.
Сапроксилофагия. Личинки питаются разрушенной грибами древесиной (сукцессия
грибов в древесине уже завершается, обильны остатки отмершего мицелия). Древе-
сина переваривается в кишечнике личинок с помощью экстрацеллюлярных внутрики-
шечных симбионтов.
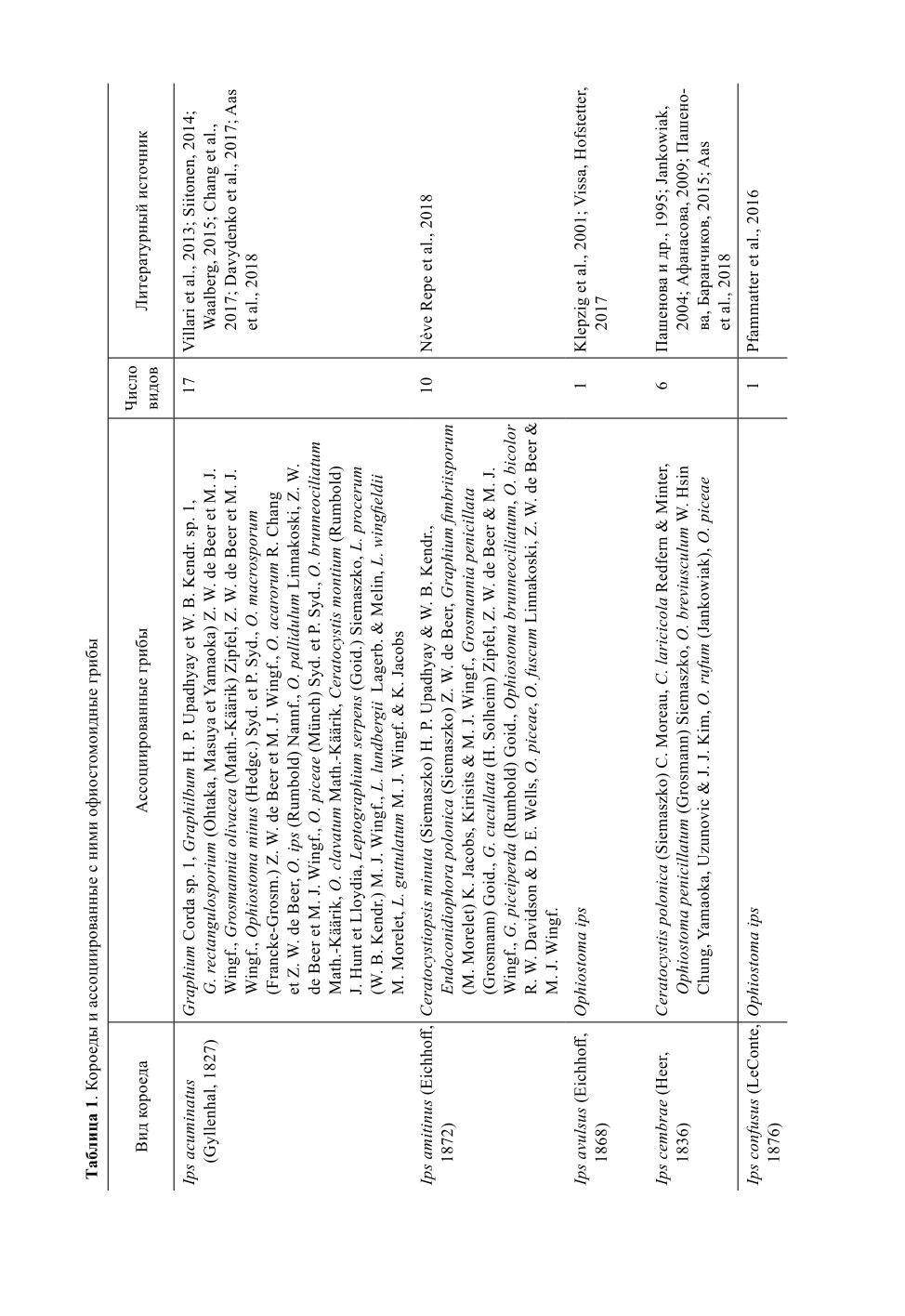
В публикациях упоминаются следующие виды короедов рода Ips, ассоциированные
с амброзиальными грибами (без указания состава амброзиальной микофлоры):
Ips avulsus (Eichhoff, 1868), I. apache (Lanier, 1991), I. bonanseai (Hopkins, 1905),
I. borealis (Swaine, 1911), I. calligraphus (Germar, 1824), I. chinensis (Kurenzov et Ko-
nonov, 1966), I. cribricollis (Eichhoff, 1869), I. hauseri (Reitter, 1894), I. hoppingi (Lanier,
1970), I. integer (Eichhoff, 1869), I. lecontei (Swaine, 1924), I. montanus (Eichhoff, 1881),
I. perroti (Swaine, 1915), I. woodi (Thatcher, 1965) (Wood, 1982; Cognato, 2015;
Kirkendall, 2015; Vissa, Hofstetter, 2017; Birkemoe et al., 2018).
Короеды как переносчики грибов - возбудителей болезней древесных растений
и деревоокрашивающих грибов
Существует немало достоверных свидетельств развития комплексов грибов в ходах
короедов, что позволяет говорить о существовании определенных групп фитопато-
генных грибов, переносимых тем или иным короедом (табл. 1). Этот тип взаимодей-
ствия можно разделить в свою очередь на несколько направлений (Линдеман, 2004).
1. Перенос короедами патогенов, преимущественно возбудителей сосудистых забо-
леваний, способных вызвать гибель здорового дерева.
2. Перенос менее агрессивных патогенов, преимущественно сумчатых и несовер-
шенных деревоокрашивающих грибов. Эти грибы иногда при массовом заселении
799
ксилофагов и здоровых деревьев способны вызывать гибель обратимо ослабленных
деревьев.
Широко распространенная связь между короедами и грибами является одним из
самых интересных примеров симбиоза в природе. Наиболее показательны ассоциации
короедов с грибами из сем. Ophiostomataceae Nanf. Эти грибы вызывают заболонные
окраски заготовленной древесины (чаще встречается порок древесины под названием
синева, рис. 1) и опасные болезни - сосудистые микозы, приводящие к быстрому и
массовому усыханию и гибели древостоев, чем наносят существенный экономиче-
ский ущерб лесному хозяйству и деревообрабатывающей отрасли.
Сосудистые микозы у хвойных деревьев вызывают в основном грибы родов
Ceratocystis Ellis et Halst., Ceratocystiopsis H. P. Upadhyay et W. B. Kendr., Ophiostoma
Рис. 1. Синева древесины, вызванная офиостомоидными грибами в ходах Ips acuminatus Gyll.
на Pinus sylvestris L. Фотографии М. Романенко.
803
Syd. et P. Syd. и Graphium Corda. Именно эти грибы сем. Ophiostomataceae вызывают
вилт (увядание) деревьев, что благоприятствует развитию и питанию насекомых-кси-
лофагов. Первичные мутуалистические грибы у короедов представлены видами родов
Grosmannia Goid., Endoconidiophora Münch и Fusarium Link. (Kirkendall, 2015; Vissa,
2017; Birkemoe et al., 2018).
Короеды могут формировать симбиоз как с одним видом гриба из сем. Ophio-
stomataceae (преимущественно Ophiostoma ips или O. bicolor), так и с несколькими.
Сведения о симбиозе грибов и короедов ежегодно пополняются. К настоящему вре-
мени детально изучены симбиотические связи грибов с Ips typographus, I. sexdentatus,
I. cembrae и I. acuminatus - наиболее хозяйственно значимыми видами короедов, для
которых характерны типичные вспышки массового размножения с формированием
хронических очагов усыхания древостоев.
Обобщение сведений в современных публикациях позволяет сделать вывод, что ко-
роеды рода Ips способны формировать устойчивые мутуалистические связи с грибами
из 9 родов 2 семейств (табл. 2).
Виды офиостомоидных грибов, поселяясь на древесине, вызывают изменение ее
окраски вследствие накопления пигментов, в том числе меланина, в гифах мицелия и
спорах. На торцевой стороне древесины хвойных и лиственных пород возникают
пятна, а на боковых поверхностях - пятна и полосы, окрашенные в различные цвета и
оттенки (Linnakoski et al., 2010), поэтому данные грибы относят к экологической
группе деревоокрашивающих. Особо следует отметить ущерб, вызываемый порчей
древесины сухостойных и валежных деревьев, образующихся в очагах развития усы-
хания от короедов. Стоимость древесины патологического отпада значительно снижа-
ется, поскольку при проведении рубок такие деревья учитываются как дровяные (Toth,
2020). Кроме этого, изменяются основные физико-механические свойства древесины.
Например, основной ущерб от усыхания ельников под влиянием короеда-типографа
сводится к снижению технических качеств древесины усохших деревьев. Анализ ди-
намики физико-механических свойств древесины, заселенной короедом-типографом и
его личинками, показал, что в течение года предел прочности древесины при сжатии
вдоль волокон снижается почти на 12 %, а предел прочности древесины при статиче-
ском изгибе и ударная вязкость - почти на 21 % (Ларинина и др., 2014).
Исследования малопатогенных и непатогенных грибов, ассоциированных с ксило-
фагами, разрознены и немногочисленны, достаточно полно изучен лишь состав мико-
флоры Ips acuminatus (Villari, 2013; Davydenko et al., 2017) и I. typographus (Persson
et al., 2009; Linnakoski et al., 2016) (табл. 3).
Приведенный перечень видов грибов - необязательный (неспецифичный) компо-
нент микофлоры короедов, частота их встречаемости может варьировать в значи-
тельных пределах. Кроме указанных в табл. 3 видов базидиальных грибов есть данные
о том, что Ips knausi часто вступает в симбиоз с грибами Heterobasidion annosum
и Armillaria mellea (Vahl) P. Kumm., вызывающими вредоносные корневые гнили
деревьев (Livingston et al., 1983).
804
Таблица 2. Грибы, ассоциированные с настоящими короедами
Семейство
Род
Вид
Ceratocystidaceae
Ceratocystiopsis
C. minuta, C. pallidobrunnea
Ceratocystis
C. laricicola, C. bhutanensis, C. polonica
Endoconidiophora
Endoconidiophora fujiensis, E. polonica
3
7
Ophiostomataceae
Graphilbum
G. cf. rectangulosporium
Graphium
G. fimbriisporum, G. pseudormiticum, G. microcarpum
Grosmannia
G. abieticola, G. olivacea, G. penicillata, G. aoshimae,
G. cucullata, G. europhioides, G. fimbriisporum,
G. piceiperda
Leptographium
L. fruticetum, L. taigense, L. guttulatum, L. hughesii,
L. procerum, L. truncatum, L. zhangii, L. abietinum
Ophiostoma
O. abietinum, O. acarorum, O. ainoae, O. araucariae,
O. bicolor, O. breviusculum, O. brunneociliatum,
O. clavatum, O. cucullatum, O. davidsonii,
O. europhioides, O. floccosum, O. fuscum,
O. genhense, O. hongxingense, O. ips, O. japonicum,
O. lotiforme, O. macrosporum, O. minus,
O. nikkoense, O. obscura, O. olgensis, O. olivaceum,
O. pallidulum, O. penicillatum, O. peniculi, O. piceae,
O. piceaperdum, O. pluriannulatum, O. poligraphi,
O. polonicum, O. pseudobicolor, O. quercus,
O. rectangulosporium, “O. rectangulosporium-
like”, O. rufum, O. shangrilae, O. stenoceras,
O. subelongati, O. tetropii, O. tingens, O. xinganense
Pesotum
P. ainoae (= Ophiostoma ainoae), P. fragrans
Итого
6
65
2
9
72
Паразитизм грибов на короедах
Энтомопатогенные микроорганизмы, в том числе грибы, участвуют в регуляции
численности насекомых в природе. Первыми из энтомопатогенных организмов были
описаны возбудители грибных инфекций (Штеришис и др., 2004) - возможно, благо-
даря тому, что признаки грибных заболеваний насекомых наиболее заметны невоору-
женным глазом (образование видимого мицелия, спороношений, в том числе пло-
довых тел).
Самый активный агент биологического контроля короедов - гриб Beauveria bassiana
(Bals.-Criv.) Vuill. (табл. 4), который показал биологическую эффективность в отно-
шении 7 видов рода Ips, в том числе и хозяйственно значимых в Европе I. acuminatus
и I. typographus. Beauveria bassiana - один из наиболее широко распространенных
энтомопатогенных грибов, он часто используется в биологическом контроле насеко-
мых-вредителей во всем мире, главным образом из-за широкого диапазона его хозяев,
805
Таблица 4. Энтомопатогенные грибы, ассоциированные с короедами рода Ips DeGeer
Вид короеда
Виды грибов
Литературный источник
I. acuminatus
Aspergillus P. Micheli ex Haller,
Draganova et al., 2007;
Beauveria bassiana
Steinwender et al.,
2010; Середич и др.,
2019
I. grandicollis
B. bassiana
Yousuf et al., 2014
I. longifolia
B. bassiana
Khanday et al., 2018
(Stebbing, 1909)
I. pilifrons (Swaine,
B. bassiana
Benjamin et al., 2002
1912)
I. stebbingi
B. bassiana, Metarhizium anisopliae (Metschn.)
Khanday et al., 2018
(Strohmeyer,
Sorokin, Lecanicillium lecanii (Zimm.)
1908)
Zare et W. Gams
I. pini
B. bassiana
Steinwender et al., 2010
I. typographus
B. bassiana, M. anisopliae
Севницкая, 2017;
Mudrončeková et al.,
2019
который включает более 700 видов насекомых (Штеришис, 2004). Эффективность
биопрепарата на основе этого гриба в отношении I. typographus достигает 99 %
(Mudrončeková, 2013), в отношении I. sexdentatus - 96.7 % (Draganova, 2007). Пора-
женные B. bassiana короеды становятся морщинистыми и сухими, покрываются
белым налетом спор, что делает их похожими на цукаты, поэтому это заболевание на-
зывается «белым мускардином» (рис. 2).
Среди энтомопатогенных грибов большой интерес представляет гриб Metarhizium
anisopliae, эффективность которого по отношению к особям короеда-типографа со-
ставляет 90 % (Mudrončeková, 2013). По своим биологическим и паразитическим
свойствам данный гриб близок к возбудителям белого мускардиноза (рис. 2), при этом
Рис. 2. Ips sexdentatus Borner, инфицированный грибом Beauveria bassiana (Bals.) Vuill.
Фотографии авторов.
807
Рис. 3. Ips acuminatus Gyll., инфицированный грибом Aspergillus sp. 3. Фотография М. Романенко.
не вызывает массовых эпизоотий и легко культивируется на искусственных пита-
тельных средах.
Особую группу патогенов насекомых составляют грибы рода Aspergillus -преиму-
щественно типичные сапрофиты. Они в определенных условиях способны разви-
ваться и плодоносить в тканях живых насекомых, выделяя при этом низкомолеку-
лярные вторичные метаболиты, которые вызывают гибель короедов с типичными
симптомами и признаками конидиального спороношения на мертвых особях (рис. 3).
Lecanicillium lecanii (телеоморфа ранее именовалась Cordyceps confragosa (Mains)
G. H. Sung, J. M. Sung, Hywel-Jones et Spatafora, синонимы этого названия также
Verticillium lecanii (Zimm.) Viégas, Cephalosporium lecanii Zimm.; Akanthomyces lecanii
Shrestha) в лабораторных условиях способен вызывать смертность 18.3 % особей Ips
stebbingi.
Таким образом, микобиота, ассоциированная с настоящими короедами, достаточно
разнообразна, но до конца не изучена. Детальное изучение грибного компонента ми-
кробиома стволовых вредителей проводилось только для отдельных видов короедов,
вызывающих массовое ослабление деревьев или хронические очаги усыхания на-
саждений.
Безусловно, самые известные партнеры короедов - офиостомоидные грибы, 72 вида
из 10 родов 2 семейств. С годами не только увеличивается количество видов офиосто-
моидных грибов (хотя это можно объяснить увеличением исследований с примене-
нием более точных молекулярно-генетических методов), что указывает на необходи-
мость более тщательного исследования взаимоотношений в системе «короеды-грибы».
Постепенно идет также перемещение связанных с короедами офиостомоидных грибов
в различных частях Европы. Примером может служить миграция Ceratocystis polonica,
ассоциированного с Ips typographus в Подмосковье. Этот гриб, который считается наи-
более опасным высоковирулентным фитопатогеном, способным привести дерево к ги-
бели даже в отсутствие переносчика, ранее был описан как ассоциант для типографа
только в европейской и азиатской частях его ареала (Пашенова и др., 2018). Сведения
808
о патогенности многих офиостоматоидных грибов для растений-хозяев отсутствуют.
Вопрос о том, играют ли грибные ассоцианты, в частности и офиостомоидные грибы,
столь же значительную роль в усилении или подавлении иммунитета растений к насе-
комым, остается открытым. Практически не уделяется внимания изучению меха-
низмов взаимодействия неагрессивных ксилофагов и грибов в сапротрофных усло-
виях, данный тип ассоциации полностью выпал из поля зрения исследователей, хотя
сведения о ней могут уточнить общую картину симбиотических отношений в ком-
плексе «короеды-микобиота» (Six, 2011).
Агрессивные виды короедов рода Ips переносят вирулентные грибы, способству-
ющие им в заселении и уничтожении деревьев (Six, 2011). В частности, Ips sexdentatus
и I. acuminatus могут быть переносчиками Fusarium circinatum - возбудителя опасного
ракового заболевания сосны (Fernández-Fernández et al., 2019). Вероятно, некоторые
неагрессивные короеды также могут переносить патогенные грибы (Six, 2011). Пока-
зано, что неагрессивные короеды, поражающие корни или основание мертвых, осла-
бленных или здоровых деревьев, переносят патогенный гриб Leptographium terebrantis
Barras et Perry (Krokene, Solheim, 1998).
Особого внимания требуют взаимодействия грибов отдела Basidiomycota и ство-
ловых вредителей; в последнее время для обозначения очага развития пестрой си-
товой гнили корней сосны (возбудитель ее - гриб Heterobasidion annosum) все чаще
используют термин «комплексное поражение», подчеркивая этим, что очаги развива-
ются с участием и гриба, и стволовых вредителей (Livingston et al., 1983). По данным
А. И. Воронцова, стволовые вредители служат непосредственной причиной усыхания
сосны в очагах корневой губки (Воронцов, 1978), вчетверо увеличивая долю погиба-
ющих деревьев. Споры Heterobasidion annosum в таких очагах выделяются из корней
сосны до и после нападения короедов.
Таким образом, несмотря на десятилетия интенсивных исследований комплекса
«короеды-грибы» и «короеды-грибы-растения», полной ясности в понимании их
взаимоотношений и взаимовлияния нет, поэтому данные работы необходимо продол-
жать с применением комплексного подхода.
ФИНАНСИРОВАНИЕ
Работа выполнена при поддержке БРФФИ № Б21М-041 от 01.07.2021 г.
СПИСОК ЛИТЕРАТУРЫ
Афанасова Е. Н. 2009. Грибы синевы древесины, переносимые короедами в хвойных лесах Средней Сибири.
В кн.: И. Н. Павлов, Н. П. Кутафьева (ред.). Макромицеты бореальной зоны: материалы Всероссий-
ской научно-практической конференции. 11-13 марта 2009 г. Красноярск: Сибирский государствен-
ный технологический университет, с. 138-144.
Воронцов А. И. 1978. Патология леса. М.: Лесная промышленность, 267 с.
Густелева Л. А., Исаев А. С. 1982. Микрофлора насекомых-ксилофагов. Новосибирск: Наука, 118 с.
Кухта В. Н., Блинцов А. И., Сазонов А. А. 2014. Короеды ели европейской и мероприятия по регулированию
их численности. Минск: БГТУ, 216 с.
Ларинина Ю. А., Блинцов А. И., Хвасько А. В. и др. 2014. Изменение механических свойств древесины усы-
хающих и сухостойных деревьев ели европейской. Труды БГТУ. Серия 1: Лесное хозяйство, природо-
пользование и переработка возобновляемых ресурсов
1:
handle/123456789/11478
809
Леднев Г. Р., Левченко М. В., Казарцев И. А. 2019. Грибы, ассоциированные с короедом-типографом (Ips
typographus) в Ленинградской области. Микология и фитопатология 53 (2): 80-89. doi: 10.1134/
S0026364819020065.
Линдеман Г. В. 2004. Роль паразитов, хищников и внутривидовой конкуренции в динамике численности раз-
личных экологических групп короедов. Лесоведение 2: 50-54.
Мамаев Б. М. 1977. Биология насекомых - разрушителей древесины. В кн.: Л. П. Познанин (ред.). М.:
ВИНИТИ АН СССР, 214 с. (Итоги науки и техники. Серия «Энтомология», т. 3).
Пашенова Н. В., Баранчиков Ю. Н. 2015. Связь офиостомовых грибов с насекомыми-ксилофагами в хвойных
лесах. В кн.: Биотические связи грибов: мосты между царствами. Материалы VII всероссийской ми-
кологической школы-конференции с международным участием. Сборник докладов и тезисов. М.: Зве-
нигородская биологическая станция МГУ, 232 с.
Пашенова Н. В., Ветрова В. П., Матренина Р. М. и др. 1995. Офиостомовые грибы в ходах большого листвен-
ничного короеда. Лесоведение (6): 62-68.
Пашенова Н. В. и др. 2002. Деревоокрашивающие грибы сем. Ophiostomataceae в ходах вредителей хвойных
в Сибири. В кн.: Т. А. Белозерская и др. (ред.). Современная микология в России. Первый съезд мико-
логов России. Тезисы докладов. М.: Национальная Академия микологии, с. 74.
Пашенова Н. В., Серая Л. Г., Баранчиков Ю. Н. 2018. Перенос офиостомовых грибов короедом-типографом
в Московской области. Защита и карантин растений
4:
asp?id=32732718
Середич М. О., Ярмолович В. А., Бубен А. В. 2019. Биологическая эффективность штамма гриба Аspergillus
sp. 3 in vivo в защите заготовленной древесины от вершинного короеда. В кн.: Ю. Н. Баранчиков (ред.).
Мониторинг и биологические методы контроля вредителей и патогенов древесных растений: от тео-
рии к практике. Материалы Второй Всероссийской конференции с международным участием.
М.: Издательство: ИЛ СО РАН, 157-158.
Севницкая Н. Л. 2017. Оценка эффективности применения энтомопатогенного гриба Beauveria bassiana
(Bals.) Vuill. в защите еловых насаждений от короеда-типографа. Труды БГТУ (Минск). Серия 1, Лес-
ное хозяйство, природопользование и переработка возобновляемых ресурсов, № 2: 192-198.
Селиховкин А. В., Варенцова Е. Ю., Поповичев Б. Г. 2017. Сплошные санитарные рубки как метод контроля
плотности популяций стволовых вредителей и распространения дендропатогенных организмов в со-
временных условиях на примере Ленинградской области. Известия Санкт-Петербургской лесотехни-
ческой академии 220: 186-199. doi: 10.21266/20794304.2017.220.186-199
Штеришис М. В., Джалилов Ф. С.-У., Андреева И. В. и др. 2004. Биологическая защита растений: учебник.
М.: Колос, 264 с.
Aas T., Solheim H., Jankowiak R. et al. 2018. Four new Ophiostoma species associated with hardwood-infesting
bark beetles in Norway and Poland. Fungal Biology 122 (12): 1142-1158. doi: 10.1016/j.funbio.2018.08.001
Alamouti S. M., Kim J. J., Breuil C. 2006. A new Leptographium species associated with the northern spruce
engraver,Ipsperturbatus,inwesternCanada.Mycologia98(1):149-160.doi:10.1080/15572536.2006.11832722
Batra L. R. 1985. Ambrosia beetles and their associated fungi: research trends and techniques. Proceedings: Plant
Benjamin M. A., Zhioua E., Ostfeld R. S. 2002. Laboratory and field evaluation of the entomopathogenic fungus
Metarhizium anisopliae (Deuteromycetes) for controlling questing adult Ixodes scapularis (Acari: Ixodidae).
Journal of Medical Entomology 39 (5): 723-728. doi: 10.1603/0022-2585-39.5.723
Birkemoe T., Jacobsen R. M., Sverdrup-Thygeson A. et al. 2018. Insect-fungus interactions in dead wood systems.
In: M. Ulyshen (ed.). Saproxylic Insects. Zoological Monographs, vol 1. Cham: Springer, p. 377-427.
doi: 10.1007%2F978-3-319-75937-1_12.
Chang R., Duong T. A., Taerum S. J. et al. 2017. Ophiostomatoid fungi associated with conifer-infesting beetles and
their phoretic mites in Yunnan, China. MycoKeys 28: 19. doi: 10.3897/mycokeys.28.21758.
Clayton K. A., Gall C. A., Mason K. L. et al. 2015. The characterization and manipulation of the bacterial microbiome
of the Rocky Mountain wood tick, Dermacentor andersoni. Parasites & Vectors 8: 632. https://doi.
org/10.1186/s13071-015-1245-z
810
Cognato A. I. 2015. Biology, systematics, and evolution of Ips. In F. E. Vega, R. W. Hofstetter (eds). Bark Beetles:
Biology and Ecology of Native and Invasive Species. San Diego, California: Elsevier Inc. Academic Press,
p. 351-370.
Davidson R. W. 1955. Wood-staining fungi associated with bark beetles in Engelmann spruce in Colorado.
Davydenko K., Vasaitis R., Menkis A. 2017. Fungi associated with Ips acuminatus (Coleoptera: Curculionidae) in
Ukraine with a special emphasis on pathogenicity of ophiostomatoid species. European Journal of Entomology
114: 77-85. doi: 10.14411/eje.2017.011
Draganova S., Takov D., Doychev D. 2007. Bioassays with isolates of Beauveria bassiana (Bals.) Vuill. and
Paecilomyces farinosus (holm.) Brown & Smith against Ips sexdentatus Boerner and Ips acuminatus Gyll.
(Coleoptera: Scolytidae). Plant Science 44: 24-28.
Douglas A. E. 2015. Multiorganismal insects: diversity and function of resident microorganisms. Annual Review of
Entomology 60: 17. doi: 10.1146/annurev-ento-010814-020822
Fang J., Liu M., Zhang S. et al. 2020. Chemical signal interactions of the bark beetle with fungal symbionts, and
host/non-host trees. Journal of Experimental Botany 71 (19): 6084-6091. doi: 10.1093/jxb/eraa296
Fernández-Fernández M., Naves M., Musolin P. et al. 2019. Pine pitch canker and insects: Regional risks,
environmental regulation, and practical management options. Forests 10 (8): 649. doi: 10.3390/f10080649
Haberkern K. E., Illman B. L., Raffa K. F. 2002. Bark beetles and fungal associates colonizing white spruce in the
Great Lakes region. Canadian Journal of Forest Research 32 (7): 1137-1150. doi:10.1139/x02-033
Jankowiak R. 2004. Interakcje midzy owadami kambiofagicznymi, grzybami i rosliną. Kosmos 53 (1): 39-50.
Jeger M. et al. 2017. Pest categorisation of Ips typographus. EFSA Journal 15 (7): e04881. doi: 10.2903/j.
efsa.2017.4881.
Jurc M., Milijasevic T. 2006. Fungi associated with dead bark beetles from several hosts. In: Proceedings of 8th
European Congress of Entomology, September 17-22, 2006, Izmir, Turkey. Poster.
Kaarik A. 1975. Succession of microorganisms during wood decay. In: W. Liese (Ed.). Biological Transformation of
Wood by Microorganisms. Proceedings of the Sessions on Wood Products Pathology at the 2nd International
Congress of Plant Pathology, September 10-12, 1973, Minneapolis/USA. Berlin; Heidelberg: Springer,
p. 39-51.
Kandasamy D., Gershenzon J., Hammerbacher A. 2016. Volatile organic compounds emitted by fungal associates of
conifer bark beetles and their potential in bark beetle control. Journal of Chemical Ecology 42: 952-969.
Kelsi V. V. [Интернет-документ] 2020. European Spruce Bark Beetle Infestation Affecting U.S. and EU Softwood
Exports. United States International Trade Commission. Executive Briefing on Trade, February 2020. [URL:
softwood_lumber.pdf]
Khanday A. L., Buhroo A. A., Ranjith A. P. et al. 2018. Evaluating the efficacy of entomopathogenic fungi against
the bark beetle, Ips stebbingi Strohmeyer (Coleoptera, Curculionidae: Scolytinae) in India. Entomological
Kinuura H. 1995. Symbiotic fungi associated with ambrosia beetles. Japan Agricultural Research Quarterly 29 (1):
57-63.
Kirisits T., Wingfield M. J., Chhetri D. B. 2002. Studies on the association of blue-stain fungi with the Eastern
Himalayan spruce bark beetle (Ips schmutzenhoferi) and with other bark beetles in Bhutan. Yusipang report.
CORET, no. 2.
Kirkendall L. R., Biedermann P. H. W., Jordal B. H. 2015. Evolution and diversity of bark and ambrosia beetles. In:
F. E. Vega, R. W. Hofstetter (eds). Bark Beetles: Biology and Ecology of Native and Invasive Species.
Elsevier Inc. Academic Press, p. 85-156. doi: 10.1016/B978-0-12-417156-5.00003-4.
Krokene P., Solheim H. 1998. Pathogenicity of four blue-stain fungi associated with aggressive and nonaggressive
Linnakoski R., De Beer Z. W., Ahtiainen J. et al. 2010. Ophiostoma spp. associated with pine- and spruce-infesting
bark beetles in Finland and Russia. Persoonia: Molecular Phylogeny and Evolution of Fungi 25 (1): 72-93.
doi: 10.3767/003158510X550845
811
Linnakoski R., Mahilainen S., Harrington A. et al. 2016. Seasonal succession of fungi associated with Ips typographus
beetles and their phoretic mites in an outbreak region of Finland. PLoS One 11 (5): e0155622. doi: 10.1371/
journal.pone.0155622
Livingston W. H., Mangini A. C., Kinzer H. G. et al. 1983. Association of root diseases and bark beetles (Coleoptera:
Scolytidae) with Pinus ponderosa in New Mexico. Plant Disease 67: 674-676.
Mudrončeková S., Mazán M., Nemcovic M., Salamon I. 2013. Entomopathogenic fungus species Beauveria
bassiana (Bals.) and Metarhizium anisopliae (Metsch.) used as mycoinsecticide effective in biological
control of Ips typographus (L.). Journal of Microbiology, Biotechnology and Food Sciences 2 (6):
2469-2472.
Nеve Repe A., Groot M., Jurc M. 2018. Assemblages of ophiostomatoid fungi vectored by Ips amitinus (Coleoptera:
Scolytinae) on norway spruce depend on colonization time, position on the host tree and development stage.
Persson Y., Vasaitis R., Långström B. 2009. Fungi vectored by the bark beetle Ips typographus following hibernation
under the bark of standing trees and in the forest litter. Microbial Ecology 58: 651-659. doi: 10.1007/s00248-
009-9520-1
Pfammatter J. A., Malas K. M., Raffa K. F. 2016. Behaviours of phoretic mites (Acari) associated with Ips pini and
Ips grandicollis (Coleoptera: Curculionidae) during host-tree colonization. Agricultural and Forest
Entomology 18 (2): 108-118. doi: 10.1111/afe.12143
Sallе A., Monclus R., Yart A. et al. 2005. Fungal flora associated with Ips typographus: frequency, virulence, and
ability to stimulate the host defence reaction in relation to insect population levels. Canadian Journal of
Forest Research 35 (2): 365-373. doi: 10.1139/X04-186
Schroeder M., Cocos D. 2018. Performance of the tree-killing bark beetles Ips typographus and Pityogenes
chalcographus in non-indigenous lodgepole pine and their historical host Norway spruce. Agricultural and
Forest Entomology 20 (3): 347-357. doi: 10.1111/afe.12267
Siitonen J. 2014. Ips acuminatus kills pines in southern Finland. Silva Fennica 48 (4): id 1145. doi: 10.14214/
sf.1145
Six D. L., Wingfield M. J. 2011. The role of phytopathogenicity in bark beetle-fungus symbioses: a challenge to the
classic paradigm. Annual Review of Entomology
56:
ento-120709-144839.
Solheim H. 1992. Fungal succession in sapwood of Norway spruce infested by the bark beetle Ips typographus.
Steinwender B. M., Krenn H. W., Wegensteiner R. 2010. Different effects of the insectpathogenic fungus Beauveria
bassiana (Deuteromycota) on the bark beetle Ips sexdentatus (Coleoptera: Curculionidae) and on its predator
Thanasimus formicarius (Coleoptera: Cleridae). Journal of Plant Diseases and Protection 117: 33-38.
Toth D., Maitah M., Maitah K. et al. 2020. The impacts of calamity logging on the development of spruce wood
Van Wyk M., Roux J., Barnes I. et al. 2004. Ceratocystis bhutanensis sp. nov., associated with the bark beetle Ips
schmutzenhoferi on Picea spinulosa in Bhutan. Studies in Mycology 50 (2): 365-379.
Villari C., Tomlinson J. A., Battisti A. et al. 2013. Use of loop-mediated isothermal amplification for detection of
Ophiostoma clavatum, the primary blue stain fungus associated with Ips acuminatus. Applied and
Vissa S., Hofstetter R. W. 2017. The role of mites in bark and ambrosia beetle-fungal interactions. In: V. Shields
(ed.). Insect Physiology and Ecology. London, UK: Intech Press, p. 135-156.
Waalberg M. E. 2015. Fungi Associated with Three Common Bark Beetle Species in Norwegian Scots Pine Forest.
Wang Z., Liu Y., Wang H. et al. 2020. Ophiostomatoid fungi associated with Ips subelongatus, including eight new
Wermelinger B. 2004. Ecology and management of the spruce bark beetle Ips typographus - a review of recent
research. Forest Ecology and Management 202 (1-3): 67-82. doi: 10.1016/j.foreco.2004.07.018
Wood S. L. 1982. The bark and ambrosia beetles of North and Central America (Coleoptera: Scolytidae), a taxonomic
monograph. Life Science Museum and Department of Zoology, Brigham Young University 6: 1-1359.
812
Yamaoka Y. 2017. Taxonomy and pathogenicity of ophiostomatoid fungi associated with bark beetles infesting
conifers in Japan, with special reference to those related to subalpine conifers. Mycoscience 58 (4): 221-235.
Yousuf F., Gurr G. M., Carnegie A. J. et al. 2014. Biology of the bark beetle Ips grandicollis Eichhoff (Coleoptera:
Scolytinae) and its arthropod, nematode and microbial associates: a review of management opportunities for
Australia. Austral Entomology 53 (3): 298-316. doi: 10.1111/aen.12077
Yousuf F., Carnegie A. J., Bashford R. et al. 2018. The fungal matrices of Ophiostoma ips hinder movement of the
biocontrol nematode agent, Deladenus siricidicola, disrupting management of the woodwasp, Sirex noctilio.
BioControl 63 (5): 739-749. doi: 10.1007/s10526-018-9897-1
Zhao T., Kandasamy D., Krokene P. et al. 2019. Fungal associates of the tree-killing bark beetle, Ips typographus,
vary in virulence, ability to degrade conifer phenolics and influence bark beetle tunneling behavior. Fungal
Ecology 38: 71-79. doi:10.1016/j.funeco.2018.06.003
MYCOBIOTA OF BARK BEETLES OF THE GENUS IPS DEGEER, 1775
(COLEOPTERA, CURCULIONIDAE: SCOLYTINAE: IPINI)
AND ITS ECONOMIC IMPACT
M. O. Ramanenka, J. A. Ugwu, L. О. Ivashchanka
Key words: Ips, mycobiota, ambrosial mycoflora, Ophiostomataceae, fungal parasitism.
SUMMARY
The mycobiota of bark beetles of the genus Ips DeGeer, 1775 is considered with respect to three
main types of close interaction between fungi and bark beetles. The review provides an updated list
of phytopathogenic fungi associated with true bark beetles in accordance with the data available in
the modern scientific literature. Particular attention is paid to the species of bark beetles, which are
carriers of pathogens of woody plants and woody fungi of the genera Ophiostoma Syd. et P. Syd.,
Ceratocystis Ellis et Halst., Ceratocystiopsis (Siemaszko) H. P. Upadhyay et W. B. Kendr., Grosmannia
(Grosmann) Goid., Endoconidiophora Münch, and Fusarium Link. Also, the main entomopathogenic
fungi (Beauveria bassiana Link, Metarhizium anisopliae (Metchnikoff) Sorokin) were analyzed, which
showed high effectiveness when used in the biological control of insect pests.
813