ЭНТОМОЛОГИЧЕСКОЕ ОБОЗРЕНИЕ, 102, 2, 2023
УДК 595.771; 591.498
ФУНКЦИИ СЛУХОВОЙ СИСТЕМЫ САМОК КРОВОСОСУЩИХ
КОМАРОВ (DIPTERA, CULICIDAE)
© 2023 г. Д. Н. Лапшин, 1* Д. Д. Воронцов 2**
1 Институт проблем передачи информации им. А. А. Харкевича РАН
Б. Каретный переулок, 19, стр. 1, Москва, 127051 Россия
*e-mail: lapshin@iitp.ru
2 Институт биологии развития им. Н. К. Кольцова РАН
ул. Вавилова, 26, Москва, 119334 Россия
**e-mail: colupaika@gmail.com
Поступила в редакцию 31.01.2023 г.
После доработки 12.05.2023 г.
Принята к публикации 12.05.2023 г.
У самок комаров хорошо развита слуховая система, биологическая функция которой до конца
еще не определена. Согласно современным представлениям, на этапе сближения самцов и самок
комаров их акустическое взаимодействие проявляется во взаимной подстройке частоты крыло-
вых взмахов. Есть также наблюдения, указывающие на возможность использования самками
акустического канала при поиске объектов нападения. Если кровососущие комары используют
слух для обнаружения животных-прокормителей, то можно ожидать сопряженности характе-
ристик слуха комаров и акустических параметров шумов или звуков, издаваемых этими жи-
вотными. В связи с этим возник вопрос, способны ли самки комаров обнаруживать человека,
ориентируясь на его голос?
В качестве объектов исследований были выбраны самки комаров Aedes (Ochlerotatus)
excrucians Walker. Комары этого вида весьма многочисленны в биотопах, где с высокой веро-
ятностью можно встретить людей, например, по берегам рек, в перелесках и парках рядом с
жильем.
Электрофизиологические исследования частотно-пороговых характеристик слуховых рецеп-
торов самок комаров A. excrucians показали, что оптимумы большинства рецепторов расположе-
ны в диапазоне частот от 40 до 140 Гц, их минимальные пороги находятся в диапазоне 32-40 дБ.
Сравнение частотно-пороговых характеристик слуховых рецепторов самок комаров с усред-
ненными спектрами человеческой речи показало, что комары в большинстве случаев могут вос-
принимать человеческие голоса и ориентироваться на них в процессе нападения.
Ключевые слова: Culicidae, Aedes excrucians, слух комаров, частотная настройка, акустическая
стимуляция.
DOI: 10.31857/S0367144523020016, EDN: DRUVYE
205
Восприятие звуковых колебаний у комаров осуществляется перистыми антеннами.
Вибрации антенны передаются джонстонову органу (ДО), расположенному в ее осно-
вании. ДО комаров содержит несколько тысяч рецепторов (Boo, Richards, 1975), пре-
образующих вибрации антенны в электрические потенциалы (Roth, 1948; Belton,
1974). Морфологически антенны и джонстоновы органы у самцов и самок устроены
сходно, но количество слуховых рецепторов у самок примерно в два раза меньше, и их
антенны не имеют такого обильного опушения, как у самцов. Согласно современным
представлениям, основная функция слуха самцов комаров состоит в том, чтобы обна-
ружить в пространстве конспецифическую самку и идентифицировать ее по звуку по-
лета. Естественно, слух самок комаров первоначально также исследовали в контексте
репродуктивного поведения. Было обнаружено, что в процессе взаимного сближения
самцы и самки комаров меняют частоту взмахов крыльями. Проявление такого взаи-
модействия внешне выглядело как подстройка фундаментальных частот биений кры-
льями к целочисленному соотношению (Cator et al., 2009; Warren et al., 2009; Gibson
et al., 2010; Pennetier et al., 2010; Aldersley et al., 2016, Simões et al., 2016).
Вместе с тем, известно несколько примеров привлечения самок кровососущих кома-
ров криками земноводных (Borkent, Belton, 2006; Bartlett-Healy et al., 2008). В отличие
от обоняния, восприятие акустических сигналов практически не зависит от направле-
ния ветра. В условиях густых зарослей акустическая пеленгация животного по шуму
его движения или вокализации дает очевидные преимущества в дальности обнаруже-
ния по сравнению со зрением.
Если акустический канал используется кровососущими комарами для обнаружения
прокормителя, можно ожидать определенной сопряженности характеристик слуха ко-
маров и акустических параметров звуков, издаваемых потенциальными объектами на-
падения.
Г. Менда с соавт. (Menda et al., 2019), основываясь на результатах своих исследова-
ний, предположили, что самок комаров Aedes aegypti L. могут привлекать звуки, сход-
ные по спектру с человеческой речью. Однако A. aegypti - исходно тропический вид,
активно исследуемый во многих лабораториях в качестве распространителя опасных
для человека заболеваний. Биоакустические характеристики этих комаров (частота
взмахов крыльями в полете, диапазоны оптимальной слуховой чувствительности)
существенно отличаются от аналогичных параметров представителей того же рода,
обитающих в средней полосе России.
В качестве объектов исследований мы выбрали самок Aedes (Ochlerotatus) excrucians
Walker. Это массовый вид, характерный для территории Евразии (Халин, Горностаева,
2008). Комары часто залетают в жилые помещения, а в естественных условиях пред-
почитают нападать на верхнюю часть тела животного. У защищенного одеждой чело-
века они нападают в основном на лицо и шею (Попов, 1953). По нашим многолетним
наблюдениям, комары A. excrucians приобрели высокую численность там, где с наи-
большей вероятностью можно встретить людей: по берегам рек, в перелесках и парках
рядом с жильем. В то же время, при выраженной антропофильности самки
A. excrucians нападают также и на птиц (Кухарчук, 1981; Лопатина и др., 2007).
Комары A. excrucians в центральном регионе России дают две волны численности.
Выплод комаров первой стадии происходит в лесах и парках, заливаемых водой во
206
время весеннего половодья, тогда как комары второй стадии развиваются в основном
по берегам рек (Попов, 1953).
Ранее в электрофизиологических экспериментах на самках комаров A. excrucians
были измерены частотно-пороговые характеристики ДО в стационарном состоянии и
при имитации действия на слуховую систему полетной вибрации (Лапшин, 2012). По-
казано, что при имитации условий полета слуховая чувствительность подопытных на-
секомых в зоне оптимума (90-120 Гц) возрастает в среднем на 6 дБ (т. е. в два раза в
линейном масштабе). На частотах 50 Гц или ниже эта разница увеличивается до 16 дБ
(более чем в 6 раз).
В другом исследовании мы измерили индивидуальные частотные настройки рецеп-
торов ДО (характеристические частоты) самок комаров трех видов, в том числе
A. excrucians (Lapshin, Vorontsov, 2013). Эти опыты показали, что рецепторы ДО суще-
ственно различаются по своим оптимальным частотам. В электрофизиологических
экспериментах на самцах симпатрического вида A. communis Deg. было также показа-
но, что пороговая чувствительность отдельных рецепторов ДО варьирует в пределах
десяти децибел (Lapshin, Vorontsov, 2021). Возможно, что такое разнообразие способ-
ствует расширению динамического диапазона слуховой системы комаров.
Из-за разнообразия индивидуальных характеристик слуховых рецепторов комаров
общепринятая практика усреднения экспериментальных данных может приводить к
существенному искажению конечных результатов в сторону завышения порогов чув-
ствительности и к расширению частотной зоны оптимума слухового восприятия.
С учетом этого обстоятельства основной упор в нашей работе сделан на анализе рас-
пределения индивидуальных характеристик рецепторов ДО в контексте возможности
слуховой системы самок комаров воспринимать звуки человеческой речи.
МАТЕРИАЛ И МЕТОДИКА
В качестве объекта исследований был выбран Aedes excrucians Walker по критериям
повсеместной распространенности, антропофильности и длительного периода вы-
плода имаго.
Самок комаров собирали в местах их естественного обитания в Московской обл. на
берегах р. Ока (Каширский р-н, 54°51ʹ N, 38°21ʹ E) и в Москве (Раменка, 55°42ʹ N,
37°29ʹ E).
В летние сезоны 2019-2022 гг. в 48 экспериментах было измерено 78 частотно-поро-
говых характеристик (аудиограмм) рецепторов ДО и 16 аудиограмм слуховых интер-
нейронов.
Акустическая стимуляция
Камера для акустической стимуляции состояла из двух симметричных частей,
каждая из которых представляла собой трубу из пластика диаметром 120 мм с динами-
ческим излучателем (динамиком) WS 13BF (1045), Visaton (Германия), закрепленным
в торце. Два динамика в собранной камере располагалась один напротив другого и
электрически были соединены последовательно и противофазно. При колебаниях
диффузоров динамиков периодически смещался небольшой объем воздушной массы
вокруг подопытного комара, закрепленного в геометрическом центре камеры. На ан-
207
тенны комара при этом действовало переменное усилие, пропорциональное мгно-
венной скорости воздушного потока. Столик с закрепленным на нем комаром
ориентировали в пространстве относительно динамиков таким образом, чтобы
акустические волны действовали на антенну с исследуемым ДО под углом 45° относи-
тельно сагиттальной плоскости тела насекомого. Такое направление было выбрано на
основании результатов измерений угловой ориентации рецепторов джонстоновых ор-
ганов самок комаров Culex pipiens pipiens L. (Lapshin, Vorontsov, 2023). По этим дан-
ным, наибольшее количество слуховых рецепторов у самок ориентировано в первом и
третьем квадрантах.
Экспериментальная установка была смонтирована на виброизолированной платфор-
ме. Устройство установки и метод фиксации подопытного насекомого в рабочей
области подробно описаны в наших более ранних наших работах (Лапшин, 2012;
Lapshin, Vorontsov, 2013).
В ходе экспериментов контроль уровня стимуляции осуществляли с помощью кон-
денсаторного дифференциального микрофона NR-23158-000 (Knowles Electronics,
U.S.A.). Все данные измерений колебательной скорости воздушной среды около подо-
пытного комара приведены к логарифмической шкале в единицах децибел. За 0 дБ
принято значение уровня колебательной скорости, или Sound Particle Velocity Level
(УКС, или SPVL), 4.85·10-5 мм/с, которое в условиях свободного поля соответствует
стандартному значению 2·10-5 Па уровня звукового давления, или Sound Pressure Level
(0 дБ УЗД, или SPL).
Регистрация электрофизиологической активности рецепторов
Перед опытом комара фиксировали токопроводящим клеем на основе крахмала на
столике из металлизированного пластика, служившего индифферентным электродом.
Для внеклеточной регистрации электрической активности в аксонах антеннального
нерва были использованы стеклянные микроэлектроды. Электрическое сопротивле-
ние электродов из боросиликатного стекла (1B100F-4, WPI Inc.), заполненных 0.9%-
ным раствором NaCl после прокола кутикулы в основании ДО (в гибком сочленении
между скапусом и педицелом), составляло 10-110 МОм.
Сигнал с микроэлектрода поступал на вход изготовленного в лаборатории усилите-
ля постоянного тока (УПТ, Первис, 1983) с входным сопротивлением более 10 ГОм) и
далее, после дополнительного усиления (Ku = 10), - на аналогово-цифровой преобра-
зователь Е14-440 («Л-Кард», Россия). Одновременно по двум другим каналам АЦП
производилась регистрация дополнительно усиленных сигналов (Ku = 1000) с выхода
УПТ и от дифференциального микрофона, установленного рядом с подопытным насе-
комым (контроль акустического стимула). После преобразования в цифровой код эти
данные фиксировали в памяти компьютера.
В начале опыта после прокола кутикулы в основании джонстонова органа и по мере
углубления электрода к антеннальному нерву препарат непрерывно стимулировали
последовательностью тональных пульсов с частотой заполнения 70-100 Гц и уровнем
60 дБ УКС. После резкого увеличения амплитуды ответных электрофизиологических
реакций до уровня ≥ 0.5 мВ (полный размах отклонения сигнала) приступали к изме-
208
рению частотно-пороговых характеристик. При последовательном измерении порогов
частоту заполнения тональных посылок изменяли с шагом 5 Гц.
Тестовый стимул, использованный при измерении характеристик рецепторов ДО,
представлял собой непрерывный тон c варьируемыми амплитудой и частотой заполне-
ния. В качестве критерия порогового ответа рецептора было принято устойчивое пре-
вышение на 2 дБ амплитудных выбросов, синхронных с синусоидальным заполнением
стимулирующего сигнала относительно среднего значения стационарного шума. Из-
мерение порога при неизменных условиях стимуляции проводили не менее двух раз.
Стабильность регистрации ответной активности контролировали в ходе измерения ау-
диограмм, проводя повторные измерения порогов на определенных частотах, обычно
на 100 Гц.
При тестировании слуховых интернейронов использовали непрерывную последова-
тельность тональных пульсов длительностью 100 мс каждый с периодом следования
600 мс. Длительность фронтов нарастания/спада синусоидального заполнения в ка-
ждом пульсе составляла примерно 25 мс. За ответ принимали вызванную активность
нейронов, содержавшую два или больше число спайков на один тональный пульс.
Акустическая регистрация звуков полета комаров
Звуки полета множества самцов в рое записывали с помощью цифрового регистра-
тора Zoom H2 (Zoom Corp, Китай). Звуки полета самок комаров регистрировали тем
же способом во время их попыток нападать на человека. Температуру окружающей
среды, влажность и освещенность измеряли в местах проведения экспериментов с по-
мощью многофункционального измерителя CEM DT-8820.
Обработка данных
Анализ аудиограмм, измеренных в электрофизиологических экспериментах, заклю-
чался в выделении главных минимумов на частотно-пороговых кривых. Каждый та-
кой минимум характеризовался тремя числами: центральная частота (Гц),
минимальный порог (дБ УКС) и температура во время проведения опыта (°C). Далее
частоты нормировали к 20 °C по ранее опубликованной методике (Lapshin, Vorontsov,
2021) в соответствии с формулой:
F20 = Ft (1 + k (20 - t))
где t - температура во время измерения порога на частоте Ft,
F20 - нормированное значение частоты,
k = 0.02 - коэффициент, характеризующий сдвиг частотно-пороговых графиков по
оси частот в зависимости от температуры.
Температурное нормирование позволило более объективно сравнивать результаты
измерений, полученные при разных температурах.
В качестве контроля был использован массив данных по частотным настройкам слу-
ховых рецепторов, полученный в процессе акустического тестирования самок
A. excrucians методом положительной обратной связи (Lapshin, Vorontsov, 2013). Эти
данные также были подвергнуты температурному нормированию.
209
Записи акустических сигналов, зарегистрированных в роях самцов, и звуков полета
самок использовали для определения средних частот взмахов крыльями комаров с по-
мощью спектрального анализа (программа «Sound Forge 10 Pro» (Sony, Япония)). По-
лученные значения частот затем нормировали к температуре 20°C по методике,
описанной выше.
РЕЗУЛЬТАТЫ
Регистрация звуков полета комаров
Усредненная частота биений крыльев самцов по данным спектрального анализа за-
писей звуков летавших в роях комаров с учетом последующего температурного нор-
мирования составила Fm = 463 Гц (σ = 31 Гц, N = 12). С помощью аналогичного
анализа записей звуков полета самок получена усредненная частота биений их кры-
льев Ff = 274 Гц (σ = 18 Гц, N = 12).
Реакции рецепторов на звук
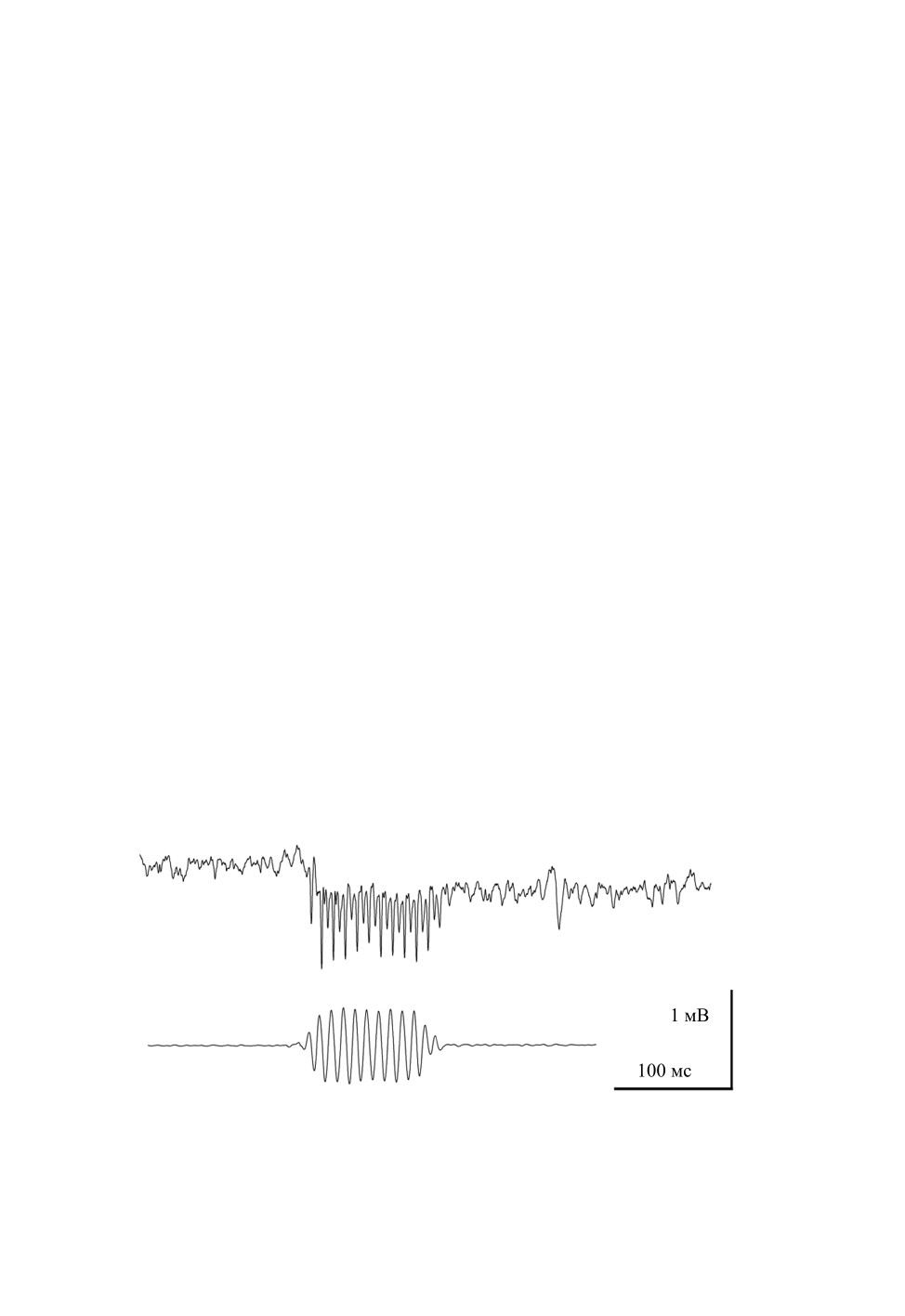
На рис. 1 приведен пример реакции слухового рецептора на предъявление тонально-
го пульса. Ответ, зарегистрированный внеклеточно в антеннальном нерве, состоял из
суммы медленного гиперполяризационного потенциала и быстрой переменной со-
ставляющей, синхронизированной с синусоидальными волнами стимула. В ответах,
как правило, доминировал спектральный компонент, равный второй гармонике часто-
ты заполнения тональной посылки.
Аудиограммы слуховых рецепторов
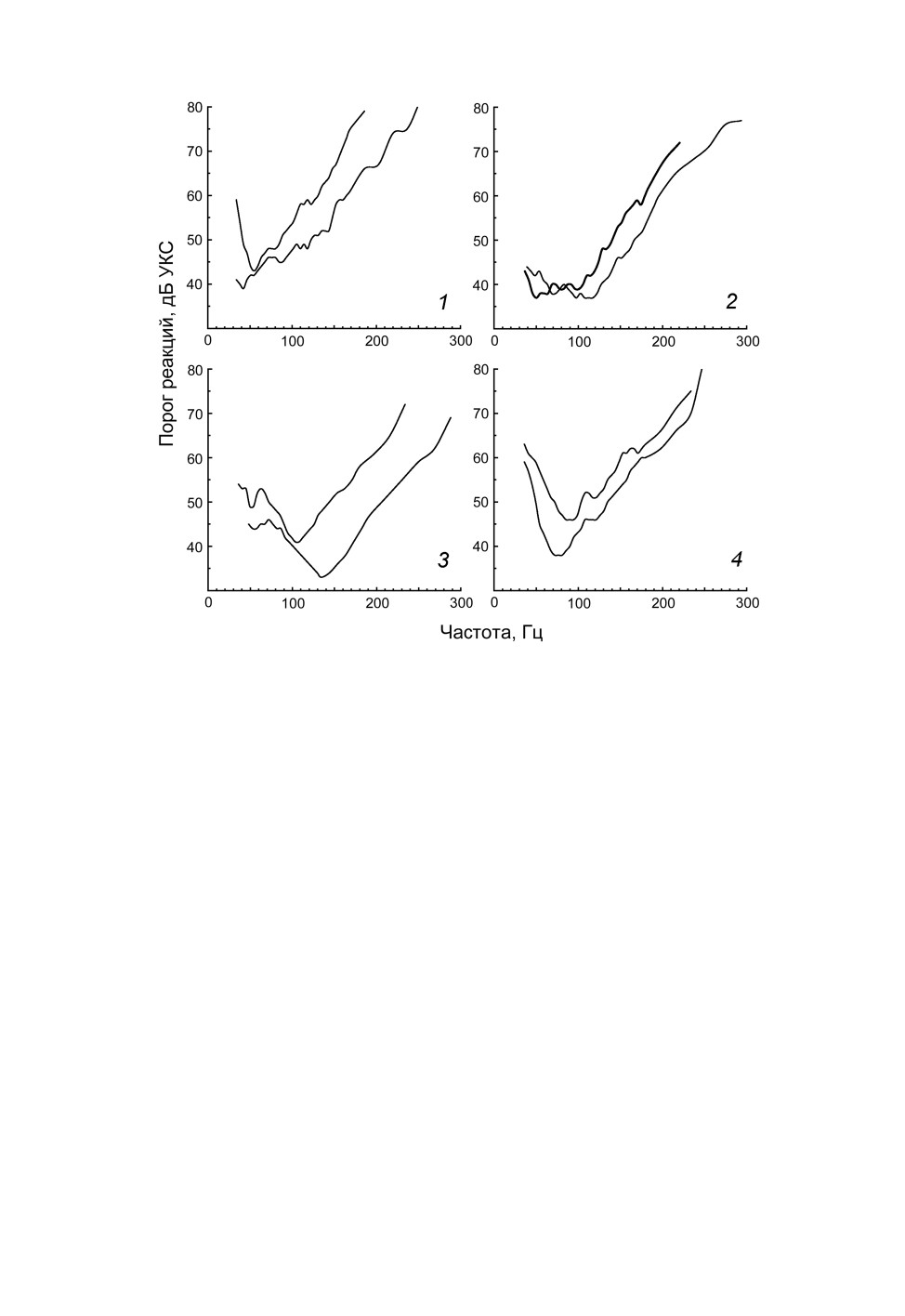
По форме аудиограмм и положению основного порогового минимума исследован-
ные рецепторы можно разделить на три основные группы. Наиболее низкочастотные
рецепторы характеризовались положением оптимума на частотах 60 Гц и ниже
(рис. 2, 1). В четырех опытах из этой группы не удалось определить частоту основного
Рис. 1. Осциллограмма реакции рецептора джонстонова органа самки комара Aedes excrucians
Walker на тональный пульс. Внеклеточная регистрация. Частота заполнения стимула 100 Гц,
амплитуда 60 дБ УКС. Стимул изображен под осциллограммой.
210
Рис. 2. Примеры аудиограмм (частотно-пороговых кривых) рецепторов джонстонова органа
(1-3) и слуховых интернейронов (4) самок комаров Aedes excrucians Walker.
оптимума из-за ограниченных возможностей стимулирующей системы в диапазоне
ниже 40 Гц.
Особую группу составляли аудиограммы, не имевшие четко выраженного миниму-
ма (рис. 2, 2), характерного для частотно-избирательных элементов (результаты деся-
ти опытов). Возможно, такой эффект возникал за счет суммирования ответной
активности двух или трех рецепторов, входивших в состав одной сенсиллы.
Аудиограммы большинства зарегистрированных рецепторов имели характерную ко-
локоловидную форму с оптимумом в диапазоне 90-120 Гц (примеры на рис. 2, 3), ре-
цепторы с настройкой на частоте 140 Гц и выше встречались значительно реже (всего
4 случая во всей серии). На ветвях аудиограмм, как правило, наблюдались один или
несколько локальных оптимумов. Например, правые (высокочастотные) ветви двадца-
ти рецепторных аудиограмм содержали локальный минимум в диапазоне 190-210 Гц.
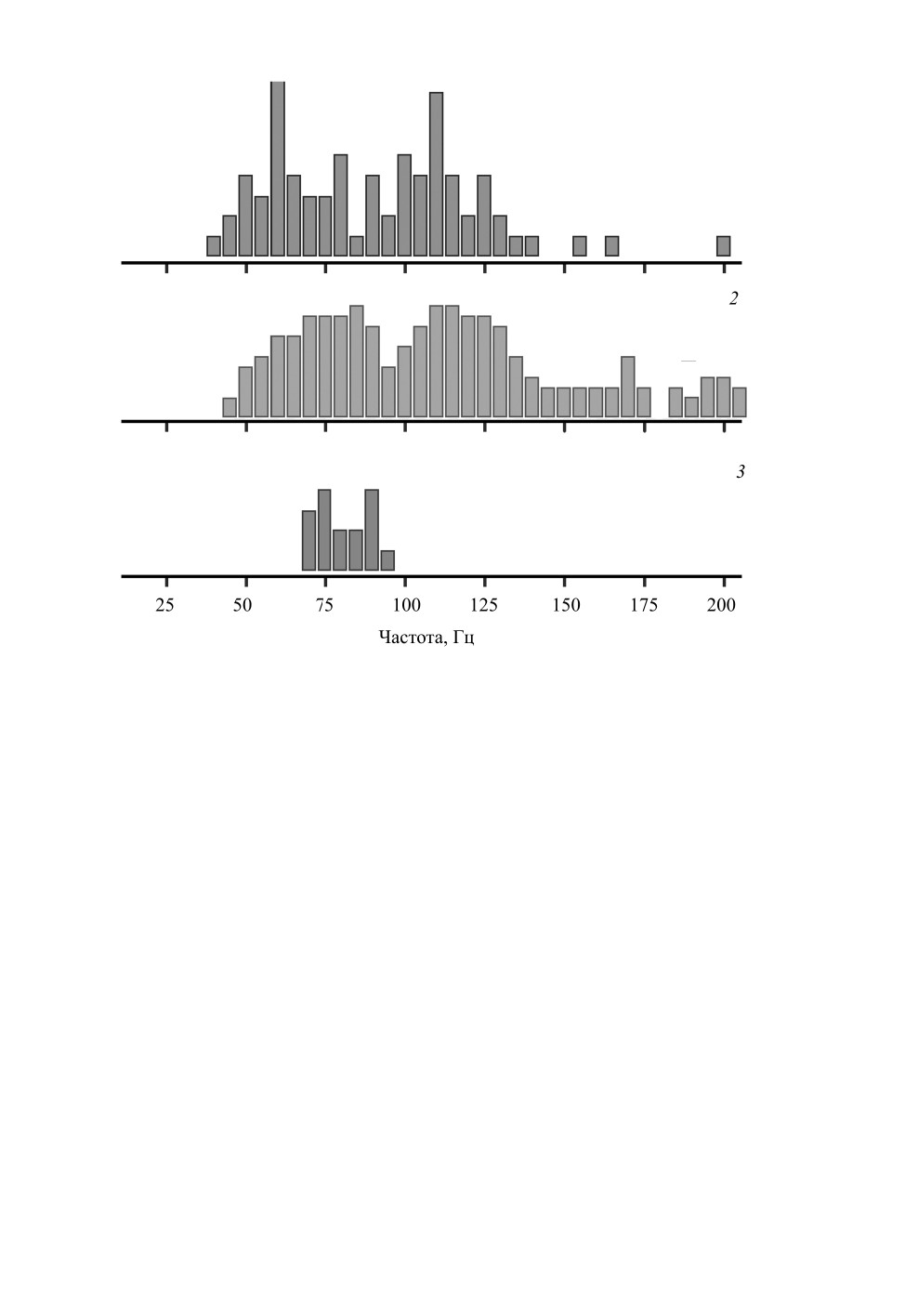
Распределение оптимальных частот исследованных рецепторов ДО иллюстрирует
гистограмма на рис. 3, 1. Гистограмма содержит два выраженных пика на 60 и 110 Гц.
Эти пики сохранялись на прежних позициях при вариациях ширины каналов гисто-
граммы от 4 до 10 Гц/бин. С учетом типичной ширины аудиограмм области чувстви-
тельности рецепторов, принадлежавших к двум основным пикам гистограммы,
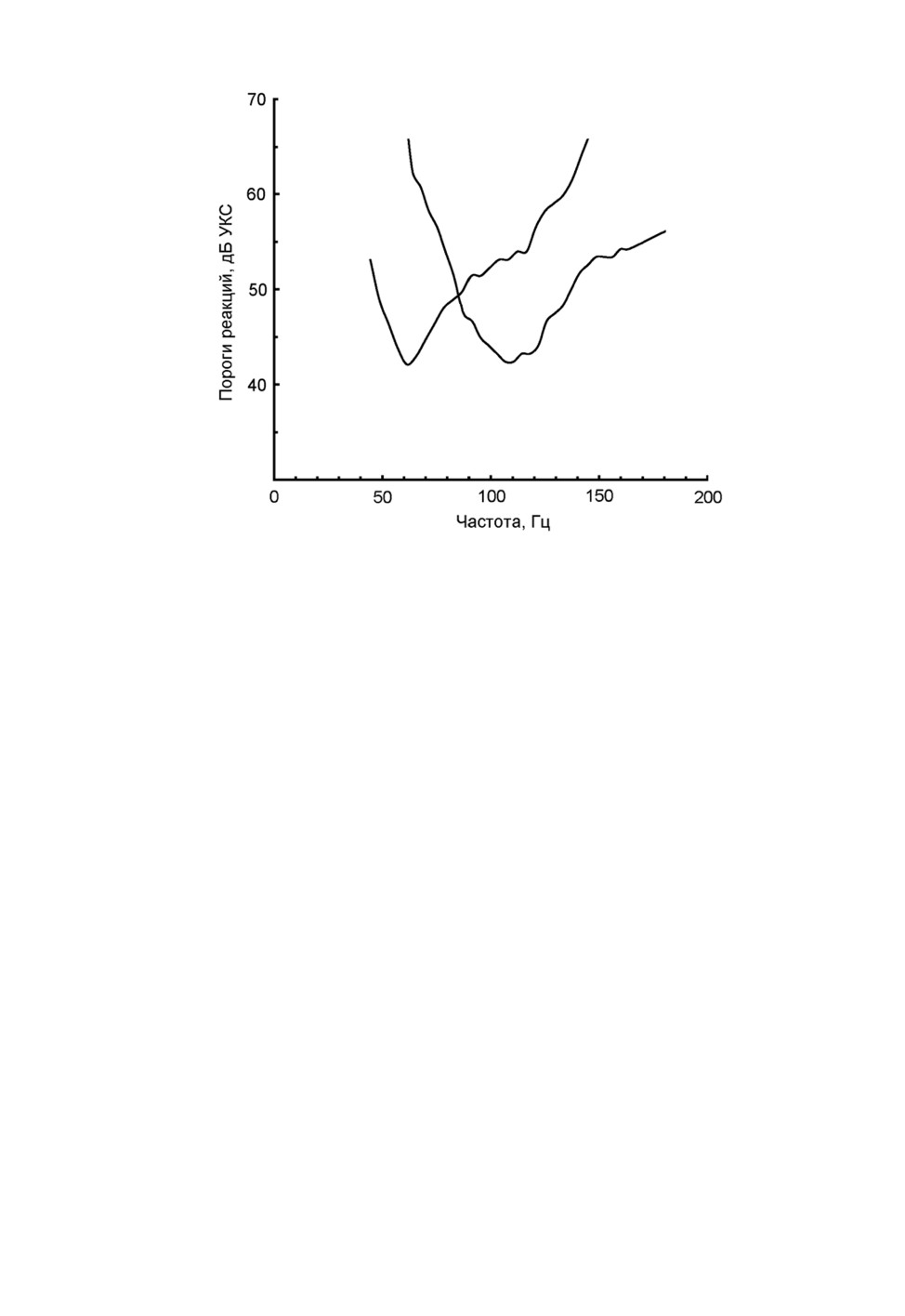
211
Рис. 3. Гистограммы распределения оптимальных частот слуховых рецепторов и
интернейронов у самок комаров Aedes excrucians Walker.
1 - распределение частотных оптимумов аудиограмм рецепторов джонстонова органа (N = 78),
2 - распределение частот автовозбуждения рецепторов джонстонова органа (по: Lapshin, Vorontsov, 2013;
N = 208, с последующей температурной коррекцией к 20 °C), 3 - распределение частотных оптимумов
аудиограмм слуховых интернейронов (N = 16).
взаимно перекрывались примерно на уровне 7 дБ выше положения их основных ми-
нимумов (рис. 4).
На рис. 3, 2 показано распределение значений характеристических частот (частот
автовозбуждения) рецепторов ДО, измеренных ранее на самках того же вида (Lapshin,
Vorontsov, 2013) и затем нормированных к температуре 20 °C. На этой гистограмме
также выделяются две группы рецепторов, но в сглаженной форме, т. е. без выражен-
ных пиков. Более высокочастотные группы на гистограммах (см. рис. 3, 1, 2) располо-
жены примерно в одном диапазоне (100-130 Гц), но низкочастотная группа на
гистограмме рис. 3, 2 несколько сдвинута вправо относительно положения аналогич-
ной группы на гистограмме на рис. 3, 1. В связи с этим надо иметь в виду, что гисто-
грамма на рис. 3, 1 построена по ответам наиболее чувствительных рецепторов,
обнаруженных в каждом конкретном отведении, тогда как методика автовозбуждения
позволяла измерять характеристические частоты также и других рецепторов, чья ак-
212
Рис. 4. Примеры аудиограмм типичных слуховых рецепторов самки Aedes excrucians
Walker с оптимумами на частотах 60 и 110 Гц.
тивность при синусоидальной стимуляции маскировалась ответами более чувстви-
тельных рецепторов.
Аудиограммы слуховых интернейронов
Наряду с рецепторными ответами неоднократно была зарегистрирована импульсная
(спайковая) активность слуховых интернейронов. Амплитуда ответных разрядов в
этих случаях не зависела от уровня стимуляции. Область кутикулы, под которой были
зарегистрированы реакции интернейронов, на фотографии головы комара ограничена
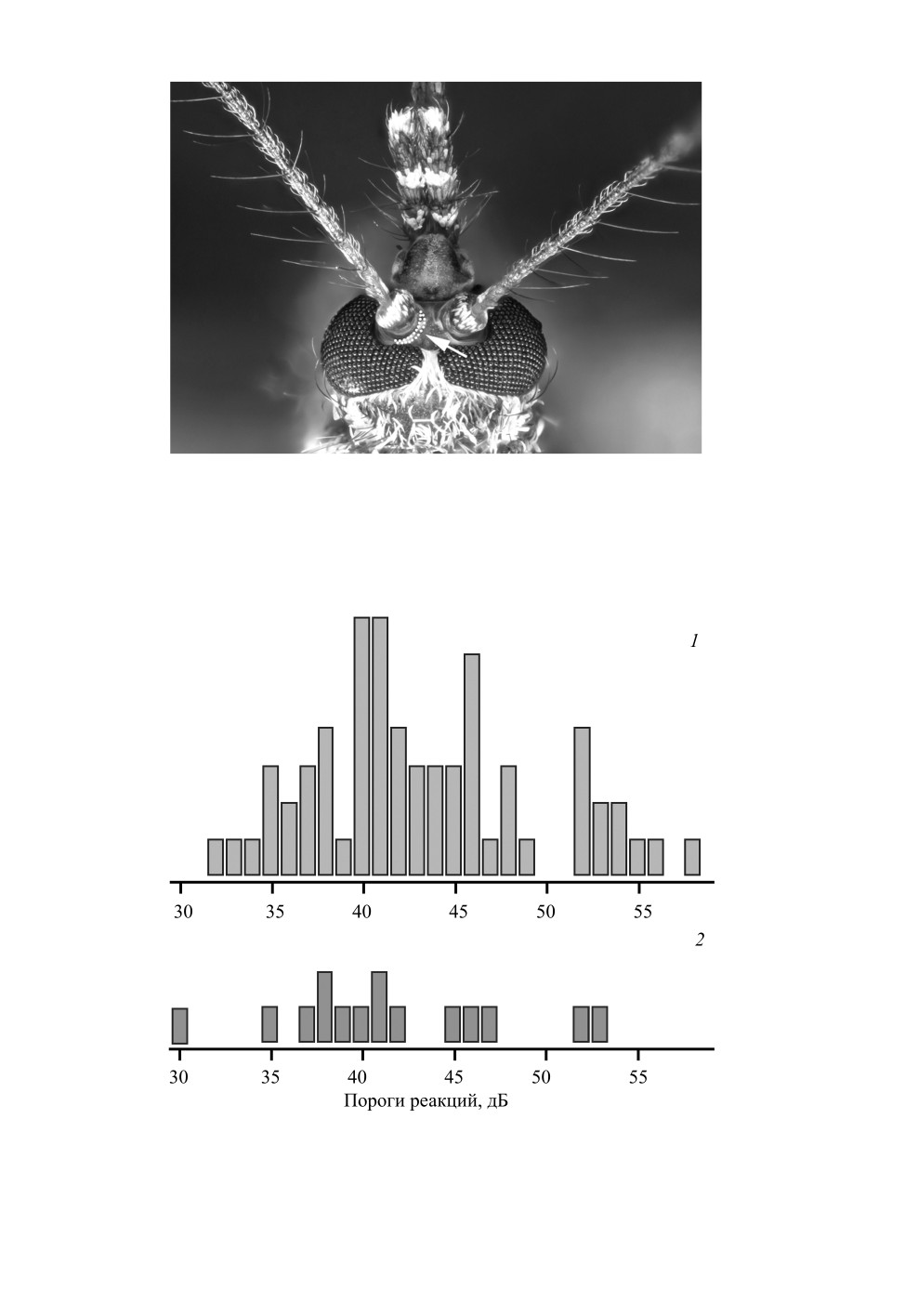
пунктирной линией, на которую дополнительно указывает стрелка (рис. 5).
На большинстве аудиограмм интернейронов (14 из 16) были видны признаки влия-
ния входов от нескольких рецепторов, выраженные на графиках в виде дополнитель-
ных локальных минимумов (см. рис. 2, 4).
Распределение значений частот основных оптимумов интернейронов на гистограм-
ме представлено в виде локальной группы в пределах диапазона 70-95 Гц (см.
рис. 3, 3).
Минимальные пороги реакций на звук
При оценке возможностей слуховой системы в первую очередь важны данные о ми-
нимальных зарегистрированных порогах рецепторов и интернейронов, получающих
213
Рис. 5. Голова самки Aedes excrucians Walker.
Граница зоны, где под кутикулой были зарегистрированы ответы слуховых интернейронов, отмечена
белыми точками. На зону также указывает стрелка.
Рис. 6. Гистограмма распределения минимальных порогов рецепторов джонстонова органа
(1, N = 78) и слуховых интернейронов (2, N = 16) самок Aedes excrucians Walker.
214
слуховой вход. На рис. 6, 1 представлена гистограмма распределения минимальных
порогов реакций слуховых рецепторов. На гистограмме видно, что нарастание вероят-
ности регистрации низкопороговых рецепторов начинается со значения 35 дБ УКС,
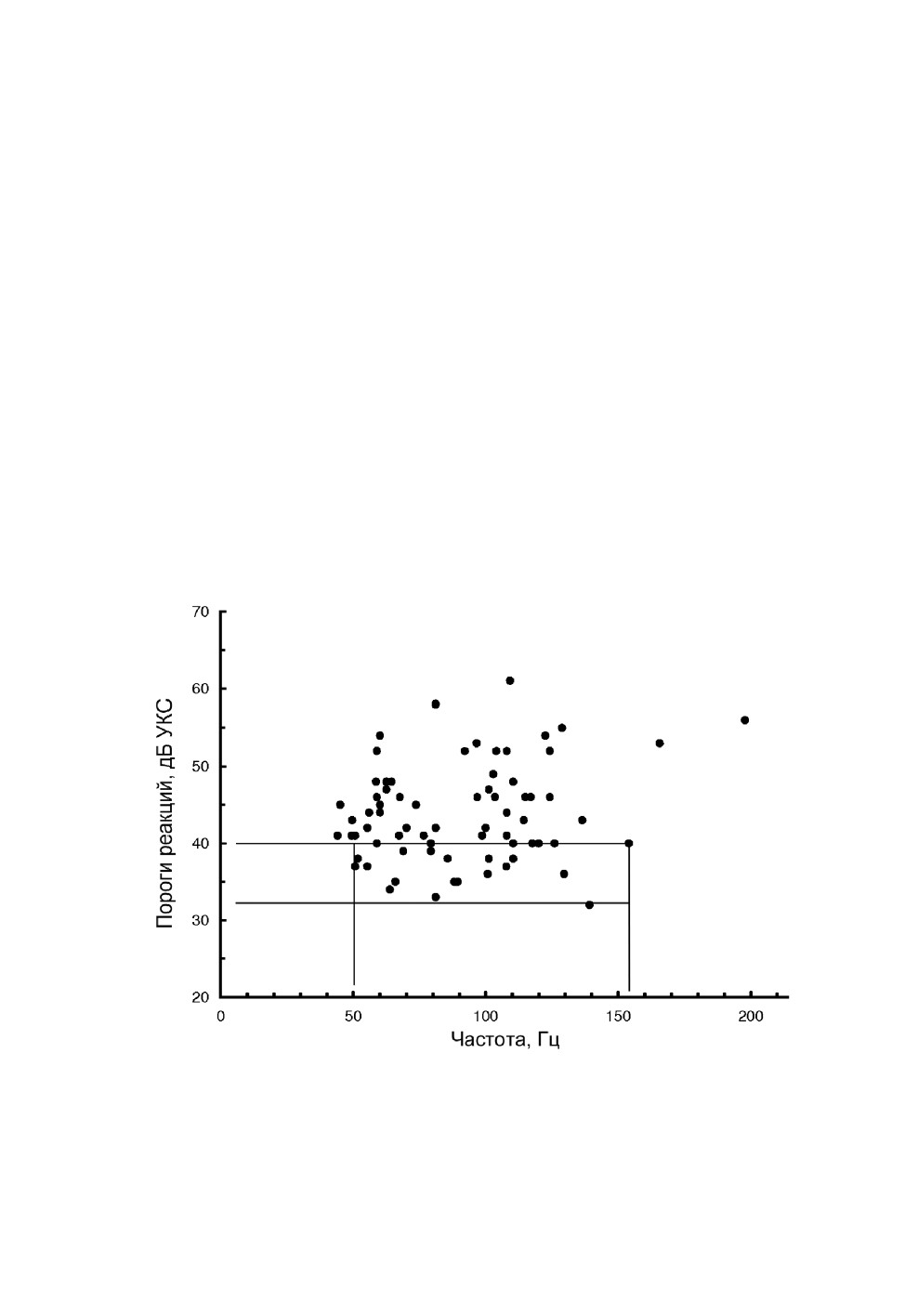
а основной пик расположен на уровне 40-41 дБ УКС. На точечной диаграмме на
рис. 7 также видно, что частотные настройки рецепторов с порогами 40 дБ УКС и ни-
же занимают диапазон 50-155 Гц, т. е. в этих пределах самки комаров обладают высо-
кой акустической чувствительностью, мало зависящей от несущей частоты
синусоидального стимула.
При частоте стимуляции 210 Гц, соответствующей середине частотного диапазона
фундаментальных гармоник женских голосов (Fitch, Holbrook, 1970), 23 % (18 из 78)
исследованных нами рецепторов реагировали на сигналы с амплитудой 56 дБ УКС
или более.
Если по частотам оптимумов исследованные интернейроны составили вполне одно-
родную группу (см. рис. 3, 3), то по данным измерения минимальных порогов анало-
гичный вывод сделать нельзя: разброс порогов в группе интернейронов превышал
20 дБ (от 30 до 53 дБ УКС; см. рис. 6, 2).
ОБСУЖДЕНИЕ
Исследование акустико-физиологических характеристик слуха неотделимо от пони-
мания биологических задач, решаемых этой системой. В этом аспекте в первую оче-
Рис. 7. Точечная диаграмма, иллюстрирующая распределение оптимумов аудиограмм
рецепторов джонстонова органа самок Aedes excrucians Walker в координатах
«Частота - Порог реакции».
На поле диаграммы тонкими горизонтальными и вертикальными линиями выделена группа рецепторов
с пороговыми оптимумами 40 дБ УКС и менее в частотном диапазоне 50-155 Гц.
215
редь следует рассмотреть участие слуховой системы комаров в репродуктивном
поведении. За время многолетних исследований были получены подробные сведения
о физиологии слуховой системы самцов комаров, тогда как о восприятии самками аку-
стических сигналов известно значительно меньше.
Ранее было показано, что на последнем этапе сближения самцов и самок комаров их
акустическое взаимодействие внешне проявляется во взаимной подстройке частоты
взмахов крыльями к целочисленным отношениям (Gibson, Russell, 2006; Cator et al.,
2009; Pennetier et al., 2010; Aldersley et al., 2016; Aldersley, Cator, 2019). Такое взаимо-
действие в качестве элемента брачного поведения получило название «гармоническая
конвергенция» (Cator et al., 2009). По мнению авторов этой статьи, оплодотворенные
самки теряют способность перестраивать частоту взмахов крыльями при акустиче-
ском взаимодействии с самцами и, таким образом, исключаются из повторных взаимо-
действий в рое.
Иную точку зрения на причины возникновения целочисленного соотношения частот
взмахов в паре самец-самка предложили П. Симоэс с соавт. (Simões et al., 2016, 2018).
По их мнению, такой режим может возникать как внешнее проявление процесса опти-
мизации режима восприятия комбинационных гармоник в слуховой системе комаров
(более подробно о влиянии на комбинационные гармоники частоты крыловых взмахов
самцов и самок будет сказано далее).
Напротив, Дж. Сомерс с соавт. (Somers et al., 2022) на основании статистического
анализа процессов частотных перестроек самцов и самок комаров сделали вывод, что
нет доказательств акустического взаимодействия между полами, и все события, имею-
щие признаки «гармонической конвергенции», могут быть объяснены случайностью.
Этот вывод противоречит более раннему исследованию, также основанному на анали-
зе статистики частот совместного полета самок и самцов комаров, где были выявлены
взаимные перестройки (Aldersley et al., 2016).
При обсуждении темы акустического взаимодействия самцов и самок комаров в
форме целочисленной подстройки частот крыловых взмахов следует иметь также
в виду, что аналогичное состояние, называемое в физике резонансом на высших гар-
мониках, соответствует локальному энергетическому минимуму системы в целом
(Yang et al., 2012). Энергетический минимум является условием и признаком локаль-
ной стабильности системы. Аналогичный эффект у комаров мог возникать в силу об-
щих физических закономерностей, определяющих взаимодействие нелинейных
осцилляторов.
Перечисленные гипотезы в той или иной степени взаимно противоречивы, и на их
основании пока нельзя отвергать идею «гармонической конвергенции» у комаров.
Вне зависимости от наличия или отсутствия биологической значимости процедуры
подстройки частот взмахов крыльями в паре самец-самка для реализации акустиче-
ского взаимодействия в паре необходимо, чтобы:
1) самки и самцы могли в полете слышать друг друга, и
2) и те, и другие обладали способностью к частотному анализу комбинационных
гармоник.
216
Способность самок воспринимать звук полета самца, частота которого выше, чем
у самки, была показана в электрофизиологических экспериментах в условиях ими-
тации полетной вибрации (Лапшин, 2012). При действии на периферическую слухо-
вую систему самки непрерывного тонального сигнала с частотой, равной частоте
первой гармоники звука полета самок того же вида, в активности ее слуховых рецеп-
торов наблюдались ответы на высокие частоты, недоступные для восприятия в стаци-
онарном режиме, т. е. без имитации полета. При этом формировалась дополнительная
частотная область чувствительности, расположенная выше частоты имитации полета.
Эта область была названа «зеркальным каналом», у самок она перекрывала диапазон
изменчивости первой гармоники звука полета конспецифических самцов. Если самка
комара способна воспринимать звук полета самца, остается вопрос о ее способности к
частотному анализу этого сигнала.
При одновременном действии на летящего комара сильной механической вибрации
от его собственных крыльев и внешнего, сравнительно слабого сигнала от другой осо-
би в периферической части слуховой системы за счет эффектов нелинейности форми-
руется ряд комбинационных гармоник (биений) с частотами, описываемыми общей
формулой:
iFm ± jFf
где i и j - целые числа, а Fm и Ff - гармоники звука полета соответственно самца и
самки. Обычно наибольшую амплитуду имеют комбинационные гармоники с частота-
ми, определяемыми малыми значениями i и j (например, 1 или 2). В электрофизиоло-
гических экспериментах было показано, что часть таких гармоник влияет на
активность слуховых рецепторов и интернейронов (Warren et al., 2009; Gibson et al.,
2010; Лапшин, 2012; Simões et al., 2016, 2018).
Рассмотрим конкретные значения комбинационных частот в паре самец-самка ко-
маров A. excrucians. По данным акустических измерений Fm = 463 Гц, и Ff = 274 Гц.
В процессе восприятия летящей самкой сигнала самца одна из основных комбинаци-
онных гармоник, формирующихся в ее слуховой системе, будет равна разности значе-
ний частот первых гармоник действующих сигналов, или Fm - Ff = 189 Гц (i = j = 1).
На гистограмме на рис. 3, 2, действительно, присутствует группа рецепторов в сход-
ном диапазоне частот (190-205 Гц). В этом же диапазоне на высокочастотных ветвях
аудиограмм некоторых рецепторов ДО наблюдались локальные минимумы. Однако
при интерпретации экспериментальных данных больший интерес представляет ком-
бинационная гармоника, описываемая формулой:
2Ff - Fm = 2 × 274 - 463 = 85 Гц (j = 2, i = 1)
Полученное значение примерно совпадает с серединой диапазона распределения
оптимумов слуховых интернейронов (см. рис. 3, 3), что может быть признаком повы-
шенного интереса комаров к этой частотной области.
В то же время, эти же интернейроны характеризуются большой индивидуальной из-
менчивостью значений минимальных порогов (см. рис. 6, 2), причем распределение
порогов интернейронов занимает примерно тот же диапазон, что и распределение по-
рогов слуховых рецепторов (см. рис. 6, 1). Пороги реакций интернейронов оценива-
лись по количеству спайков в ответ на единичный акустический пульс, тогда как
217
ответы рецепторов определялись по относительному увеличению уровня электрофи-
зиологического сигнала. Сходный вид распределений порогов, полученных с помо-
щью двух разных методик, позволяют сделать вывод о взаимном соответствии
критериев, использованных при измерении порогов реакций нейронов слуховой си-
стемы комаров.
Можно предположить, что слуховые рецепторы и интернейроны за счет разных
индивидуальных порогов совокупно перекрывают большой диапазон амплитуд вход-
ных сигналов и тем самым обеспечивают динамический диапазон слуховой системы в
целом. В свою очередь, широкий динамический диапазон необходим для сохранения
способности к частотному анализу в процессе сближения комара с источником звука,
когда амплитуда воспринимаемых сигналов по мере уменьшения расстояния увеличи-
вается на порядок и более. Учитывая высокую чувствительность части исследованных
интернейронов, можно также сделать вывод, что процесс анализа сигналов начинает-
ся в слуховой системе самки еще до начала активного акустического взаимодействия
в их паре.
Положение главных пиков (60 и 100-120 Гц) на гистограмме на рис. 3, 1 характери-
зует частоты настройки большинства наиболее чувствительных рецепторов ДО. Имен-
но такие рецепторы мы с большой вероятностью находили при поиске качественного
отведения в антеннальном нерве, поскольку для них характерна наибольшая амплиту-
да электрофизиологических ответов на тестовый сигнал. Однако форма пиков на ги-
стограмме не отражает реальную ширину настройки слуховых рецепторов: области
чувствительности рецепторов двух основных групп (60, 100-120 Гц) должны взаимно
перекрываться (см. рис. 4). Сопоставление уровней ответов на звук в этих двух груп-
пах потенциально позволяет оценить частоту входного сигнала в диапазоне между
двумя оптимумами. Таким образом, слуховая система самок комаров по всем призна-
кам способна различать звуковые частоты и, следовательно, может обеспечить акусти-
ческое взаимодействие самцов и самок в брачном поведении.
Следующий вопрос: может ли слуховая система самок комаров способствовать це-
ленаправленному поиску человека как объекта нападения?
Наши измерения показали, что оптимумы слуховых рецепторов самок с порогами
40 дБ УКС и ниже занимают диапазон 50-155 Гц (см. рис. 7), т. е. в этих пределах сам-
ки комаров обладают высокой акустической чувствительностью, мало зависящей от
спектрального состава стимула. Граница этого диапазона со стороны низких частот,
скорее всего, определяется конвективными шумами атмосферы (Goodfriend, 1977; Ка-
жан и др., 2015) в сочетании с шумом набегающего потока воздуха в условиях полета.
Со стороны высоких частот слуховая чувствительность ограничена вибрацией и шу-
мом от собственных крыльев.
В средней полосе России человек - самый многочисленный из потенциальных объ-
ектов нападения. В обычной жизни люди защищены от комаров одеждой, за исключе-
нием кистей рук и головы, поэтому манера комаров A. excrucians нападать на верхнюю
часть тела должна повышать вероятность успеха. Возникает вопрос, способны ли ко-
мары обнаружить человека, ориентируясь на его голос?
Фундаментальная (нижняя) частота речи взрослого мужчины находится в диапазоне
от 85 до 155 Гц, для взрослой женщины типичны частоты от 165 до 255 Гц (Fitch,
Holbrook, 1970). Таким образом, низкочастотная часть спектра голоса среднестатисти-
218
ческого мужчины в значительной части перекрывается диапазоном максимальной слу-
ховой чувствительности самок комаров A. excrucians (см. рис. 7). Женский голос
частично выходит за пределы этого диапазона. Однако при частоте стимуляции 210 Гц,
соответствующей середине частотного диапазона женских голосов, 23 % исследован-
ных нами рецепторов реагировали на сигналы с амплитудой 56 дБ УКС или более -
это уровень нормальной разговорной речи. Можно сделать вывод, что голоса людей
доступны для восприятия и частотного анализа самкам комаров и потенциально могут
служить дополнительным ориентиром в процессах поиска и нападения кровососов на
человека.
ФИНАНСИРОВАНИЕ
Работа выполнена в рамках государственной программы фундаментальных исследо-
ваний ИППИ РАН FFNU-2022-0025.
СПИСОК ЛИТЕРАТУРЫ
Кажан В. Г., Мошков П. А., Самохин В. Ф. 2015. Природный фон при проведении акустических испытаний
самолетов на аэродроме базирования малой авиации. Наука и образование. МГТУ им. Н. Э. Баумана.
Электронный журнал 7: 146-170.
Кухарчук Л. П. 1981. Кровососущие комары в местах массового пролета и гнездования птиц в Барабинской
низменности. В кн.: К. Т. Юрлов (ред.). Экология и биоценотические связи перелетных птиц Западной
Сибири. Новосибирск: Наука, Сибирское отделение; Биологический институт АН СССР, 288 с.
Лапшин Д. Н. 2012. Слуховая система самок кровососущих комаров (Diptera, Culicidae): акустическое вос-
приятие в условиях имитации полета. Энтомологическое обозрение 91 (3): 465-484. [Lapshin
D. N. 2013. The auditory system of blood-sucking mosquito females (Diptera, Culicidae): acoustic perception
during flight simulation. Entomological Review 93 (2): 135-149.
Лопатина Ю. В., Безжонова О. В., Федорова М. В., Булгакова Т. В., Платонов А. Е. 2007. Комплекс кровосо-
сущих комаров (Diptera, Culicidae) в очаге лихорадки Западного Нила в Волгоградской области.
III. Виды, питающиеся на птице и человеке, и ритмы их ночной активности. Медицинская паразито-
логия и паразитарные болезни 4: 37-43.
Первис Р. 1983. Микроэлектродные методы внутриклеточной регистрации и ионофореза. М.: Мир, 208 с.
Попов В. М. 1953. Материалы по экологии комаров Aedes excrucians Walk., Aedes cinerius Meig. в условиях
лесной зоны Западной Сибири. Медицинская паразитология и паразитарные болезни 22 (6): 521-528.
Халин А. В., Горностаева Р. М. 2008. К таксономическому составу кровососущих комаров (Diptera: Culicidae)
мировой фауны и фауны России (критический обзор). Паразитология 42 (5): 350-381.
Aldersley A., Champneys A. R., Homer M., Robert D. 2016. Quantitative analysis of harmonic convergence in
mosquito auditory interactions. Jornal of Royal Society Interface 13 (117): 20151007.
Aldersley A., Cator L. J. 2019. Female resistance and harmonic convergence influence male mating success in Aedes
aegypti. Scientific Reports 9 (2145).
Bartlett-Healy K., Crans W., Gaugler R. 2008. Phonotaxis to amphibian vocalizations in Culex territans (Diptera:
Culicidae). Annals of the Entomological Society of America 101: 95-103.
Belton P. 1974. An analysis of direction finding in male mosquitoes. In: L. B. Browne (ed.). Experimental Analysis
of Insect Behaviour. Heidelberg; New York: Springer, p. 139-148.
Boo K. S., Richards A. G. 1975. Fine structure of scolopidia in Johnston’s organ of female Aedes aegypti compared
with that of the male. Journal of Insect Physiology 21: 1129-1139.
Borkent A., Belton P. 2006. Attraction of female Uranotaenia lowii (Diptera: Culicidae) to frog calls in Costa Rica.
The Canadian Entomologist 138: 91-94.
219
Cator L. J., Arthur B. J., Harrington L. C., Hoy R. R. 2009. Harmonic convergence in the love songs of the dengue
vector mosquito. Science 323: 1077-1079.
Fitch J. L., Holbrook A. 1970. Modal vocal fundamental frequency of young adults. Archives of Otolaryngology 92:
379-382.
Gibson G., Russell I. J. 2006. Flying in tune: sexual recognition in mosquitoes. Current Biology 16 (13): 1311-1316.
Gibson G., Warren B., Russell I. 2010. Humming in tune: sex and species recognition by mosquitoes on the wing.
Journal of the Association for Research in Otolaryngology 11: 527-540.
Goodfriend L. S. 1977. Range of sound levels in the outdoor environment. In: G. M. Heisler, L. P. Herrington (eds).
Proceedings of the Conference on Metropolitan Physical Environment; Gen. Tech. Rep. NE-25. Upper
Darby, PA: U. S. Department of Agriculture, Forest Service, Northeastern Forest Experiment Station,
Lapshin D. N., Vorontsov D. D. 2013. Frequency tuning of individual auditory receptors in female mosquitoes
(Diptera, Culicidae). Journal of Insect Physiology 59: 828-839.
Lapshin D. N., Vorontsov D. D. 2021. Frequency tuning of swarming male mosquitoes (Aedes communis, Culicidae)
and its neural mechanisms. Journal of Insect Physiology 132: 104233.
Lapshin D. N., Vorontsov D. D. 2023. Mapping the auditory space of Culex pipiens female mosquito in 3D.
Menda G., Nitzany E. I., Shamble P. S., Wells A., Harrington L. C., Miles R. N., Hoy R. R. 2019. The long and short
of hearing in the mosquito Aedes aegypti. Current Biology 29 (4): 709-714.
Pennetier C., Warren B., Dabire K. R., Russell I. J., Gibson G. 2010. «Singing on the Wing» as a mechanism for
species recognition in the malarial mosquito Anopheles gambiae. Current Biology 20: 131-136.
Roth L. M. 1948. A study of mosquito behavior; an experimental laboratory study of the sexual behavior of Aedes
Simões P. M. V., Ingham R. A., Gibson G., Russell I. J. 2016. A role for acoustic distortion in novel rapid frequency
modulation behaviour in free-flying male mosquitoes. Journal of Experimental Biology 219: 2039-2047.
Simões P. M. V., Ingham R. A., Gibson G., Russell I. J. 2018. Masking of an auditory behaviour reveals how male
mosquitoes use distortion to detect females. Proceedings of the Royal Society B, Bological Sciences 285:
20171862.
Somers J., Georgiades M., Su M. P., Bagi J., Andrés M., Alampounti A., Mills G., Ntabaliba W., Moore S. J.,
Spaccapelo R. et al. 2022. Hitting the right note at the right time: Circadian control of audibility in Anopheles
mosquito mating swarms is mediated by flight tones. Science Advances 8 (2).
Warren B., Gibson G., Russell I. J. 2009. Sex recognition through midflight mating duets in Culex mosquitoes is
Yang N., Long Z., Wang F. 2012. Harmonic synchronization model of the mating dengue vector mosquitoes. Chinese
Science Bulletin 57: 4043-4048.
FUNCTIONS OF THE AUDITORY SYSTEM OF BITING
FEMALE MOSQUITOES (DIPTERA, CULICIDAE)
D. N. Lapshin, D. D. Vorontsov
Key words: Culicidae, Aedes excrucians, mosquito hearing, frequency tuning, acoustic
stimulation.
220
SUMMARY
Female mosquitoes possess a complex auditory system, the biological function of which has not yet
been fully understood. Male and female mosquitoes are known to mutually adjust the frequencies of
their wingbeats when approaching each other. To make such interaction possible, they need to hear each
other and to be able to discriminate frequencies.
Some recent data indicate that biting female mosquitoes can also use acoustic channel to detect their
hosts. One can expect that the parameters of mosquito’s hearing reflect the acoustic properties of noises
or other sounds emitted by the host animals. In this regard, it is worth asking whether mosquitoes are
able to detect humans by their voices.
We studied female mosquitoes of Aedes (Ochlerotatus) excrucians Walker. They are abundant in
the biotopes where people are likely to be found, for example, along the river banks and in the village
parks. In electrophysiological experiments, we measured the frequency-threshold characteristics of
auditory receptors. The highest sensitivity of most receptors was found in the frequency range from
40 to 140 Hz, with minimum threshold values of 32-40 dB SPVL (Sound Particle Velocity Level). A
comparison of the frequency-threshold characteristics of female mosquitoes with the averaged spectra
of human speech indicates that, in most cases, mosquitoes can hear human voices and can use them as
a cue for finding and attacking humans.
221