ЭНТОМОЛОГИЧЕСКОЕ ОБОЗРЕНИЕ, 102, 3, 2023
УДК 633.31 : 595.771 : 595.792
ВЗАИМООТНОШЕНИЯ ГАЛЛИЦЫ ASPHONDYLIA MIKI WACHTL
(DIPTERA, CECIDOMYIIDAE) С КОРМОВЫМ РАСТЕНИЕМ,
ЛЮЦЕРНОЙ ПОСЕВНОЙ (MEDICAGO SATIVA),
И ЭКТОПАРАЗИТАМИ ЕЕ ЛИЧИНОК И КУКОЛОК
(HYMENOPTERA, EULOPHIDAE) В ЛЕСОСТЕПИ
СРЕДНЕГО ПОВОЛЖЬЯ
© 2023 г. В. Г. Каплин, 1* О. В. Кошелева, 1** И. А. Володина 2***
1 Всероссийский научно-исследовательский институт защиты растений
шоссе Подбельского, 3, С.-Петербург-Пушкин, 196608 Россия
*e-mail: ctenolepisma@mail.ru, **e-mail: koscheleva_o@mail.ru
2 Поволжский научно-исследовательский институт селекции и семеноводства
ул. Шоссейная, 76, пос. Усть-Кинельский, Самарская обл., 446442 Россия
***e-mail: volodinair1980@yandex.ru
Поступила в редакцию 27.04.2023 г.
После доработки 22.08.2023 г.
Принята к публикации 22.08.2023 г.
Исследования проводились в посевах люцерны изменчивой (Medicago sativa ssp. × varia)
в 2018-2022 гг. в лесостепной зоне Самарской обл. Галлы Asphondylia miki учитывали в посевах
люцерны с начала их образования до конца вегетации культуры на площадках от 0.1 до 1 м2
в десятикратной повторности. Статистическая обработка данных проводилась методами диспер-
сионного анализа. При весеннем посеве люцерны, а также в ее многолетних посевах галлица
A. miki развивается в двух поколениях, а при летнем посеве в первый год жизни культуры в од-
ном поколении в году, зимуют куколки в галлах, лёт имаго зимовавшего поколения протекает в
апреле. Наибольшие поврежденность люцерны личинками галлицы A. miki (40-68 % генератив-
ных побегов) и численность ее галлов (500-830 экз./м2) наблюдались в первый год жизни куль-
туры при ее посеве в летний период при совпадении массового лёта имаго с бутонизацией лю-
церны, что приводило к значительным потерям урожайности семян люцерны (13-81 %).
В летних посевах люцерны первого года развития без применения химических средств защиты
растений паразитические перепончатокрылые способствуют гибели личинок и куколок A. miki в
среднем в 60 % ее галлов. Среди паразитов преобладает Sigmophora brevicornis (Eulophidae) -
грегарный эктопаразит преимущественно личинок A. miki, на долю которого приходилось около
77 % особей выявленных паразитов. В популяции S. brevicornis самцы и самки по окраске тела
относились к трем группам: с наиболее светлой коричневато-желтой, более темной желтова-
то-коричневой и буроватой окраской, на долю которых приходилось соответственно 53, 28
и 19 % особей этого паразита.
Ключевые слова: сорт, сроки и способ посева, численность галлов, вредоносность, Sigmophora
brevicornis, грегарный эктопаразит, эффективность, фенотипы.
DOI: 10.31857/S0367144523030036, EDN: YDPYLT
421
Обширный род галлиц Asphondylia Loew, 1850 включает около 310 галлообразу-
ющих видов, распространенных в Северной и Южной Америке, Европе, Азии, Аф-
рике и Австралии. Они трофически связаны с формирующимися завязями и плодами
растений преимущественно семейств Asteraceae
(16.3
%), Fabaceae
(11.4
%),
Chenopodiaceae (9.1 %), Lamiaceae (7.2 %), Zygophyllaceae (4.6 %), Rubiaceae (3.9 %),
Solanaceae (3.3 %), Verbenaceae (3.2 % описанных видов рода) (Gagné, Jaschhof, 2021).
Род Asphondylia относится к сем. Cecidomyiidae (Diptera), подсем. Cecidomyiinae,
трибе Asphondyliini и подтрибе Asphondyliina. Личинки Asphondylia вызывают образо-
вание галлов в цветках и плодах (Bernardo et al., 2021), дают в году несколько поко-
лений, зимуют куколки в галлах на кормовых растениях. В Восточной Палеарктике
и Индо-Малайской области род Asphondylia - единственный в подтрибе Asphondyliina,
у куколок которого развиты морфологические приспособления для вылета имаго из
галла (Tokuda, Yukawa, 2007).
Люцерновая плодовая галлица Asphondylia miki Wachtl, 1880 широко распростра-
нена в Европе (Франция, Германия, Польша, Австрия, Италия, Чехия, Венгрия, Ру-
мыния, Болгария, Словения, Сербия, Украина, европейская часть России). Этот вид
известен также из Западной Сибири и Северной Америки (Webster, 1912; Simova-Tošič
et al., 1996, 2000; Skuhravá, Skuhravý, 2010; Skuhravá et al., 2014; Федоренко, Яковлев,
2015; Федотова, 2019 и др.). В Среднем Поволжье он обычен в посевах люцерны и на
дикорастущих видах этого рода (Федотова, 2019). Asphondylia miki трофически связан
с многолетними травянистыми бобовыми (Fabaceae), преимущественно с люцерной
(Medicago sativa, M. falcata, M. saxatilis, M. coerulea), реже развивается на лядвенце
(Lotus corniculatus) и чечевице (Lens culinaris). Самки A. miki откладывают яйца
в завязь, прокалывая бутон яйцекладом; отродившиеся личинки превращают форми-
рующийся боб в крупный бессемянный галл клювовидной формы. Обычно в галле
развиваются по одной личинке, питающейся паренхимой галла. Поврежденный боб -
укороченный и набухший, его стенка сочно-мясистая, изнутри выстлана белым мице-
лием, который, по-видимому, заносят самки при откладке яиц для питания личинок.
Известны симбиотические отношения галлиц родов трибы Asphondyliini с широко
распространенным эндофитным грибом Botryosphaeria dothidea (Moug.) Ces. & De
Not, развивающимся внутри галлов.
Ассоциированные с галлами Asphondylia в бутонах растений сем. Lamiaceae грибы
были идентифицированы как B. dothidea, Alternaria spp. и Cladosporium spp. (Bernardo
et al., 2021).
В Европе A. miki практически повсеместно относится к второстепенным вредителям
люцерны, против которого не применяются химические средства защиты растений
(Darvas et al., 2000). Наибольшая встречаемость A. miki отмечена в Германии (Lange,
1936; Bollow, 1954). В Краснодарском крае этот вид чаще вредит в осенние месяцы и
накапливается по краям плохо убранных посевов люцерны, вредит преимущественно
орошаемой люцерне, на которой поражает иногда 15 % бобов (Пономаренко, 1949;
Девяткин и др., 2013). В Правобережной лесостепи Украины в 2013 и 2014 гг. в се-
менных посевах люцерны 1-го и 2-го годов численность имаго A. miki в укосах энто-
мологическим сачком составляла 25-31 экз./100 взмахов (Федоренко, Яковлев, 2015).
Вероятно, неприменение химических средств защиты растений против A. miki способ-
ствовало сохранению его естественных взаимоотношений с паразитическими пере-
пончатокрылыми и сдерживанию возрастания численности A. miki, однако видовой
422
состав паразитов этой галлицы слабо изучен. К эктопаразитам личинок галлиц рода
Asphondylia относятся перепончатокрылые сем. Pteromalidae, Eurytoma dentata Mayr
(Noyes, 2012) и Eu. nesiotes Crawf. (Tiwari, 1974) из сем. Eurytomidae, Eupelmus
muellneri Ruschka (Eupelmidae), Neochrysocharis violaceus Askew и Sigmophora
brevicornis (Panzer) (Eulophidae) (Dorchin et al., 2014); к эндопаразитам личинок и ку-
колок - Torymoides violaceus (Nic.) (Torymidae) (Рзаева, 1971).
МАТЕРИАЛ И МЕТОДИКА
Наши исследования проводились в посевах люцерны изменчивой (Medicago sativa ssp. ×
varia), или пестрой, сортов пестрогибридного типа Изумруда и Чишминская 131 в 2018-2022 гг.
в лесостепной зоне Самарской обл. в окр. пос. Усть-Кинельский на опытных полях Поволжского
НИИ селекции и семеноводства (ПНИИСС) им. П. Н. Константинова. Сорт Изумруда включен в
Государственный реестр селекционных достижений Российской Федерации по Волго-Вятскому
(4) и Средневолжскому (7) регионам с 2014 г., а сорт Чишминская 131 - с 1990 г. по Уральскому
(9) региону. Венчики цветков у Изумруды пестрой окраски, преобладают цветки синей и голубой
окраски, желтых и белых цветков 3-10 %, цветки с темно-фиолетовой окраской встречаются
редко. Венчики цветков Чишминской 131 у основания фиолетовые различных оттенков, реже от
зеленовато-голубых до белых. У сорта Чишминская бобы спиральные, обычно до трех оборотов,
у Изумруды бобы закручены в 2-3 оборота.
Посев люцерны проводили 16-20 мая, а в 2022 г. - также 15 июня сплошным рядовым, а также
широкорядным беспокровными способами с шириной междурядий соответственно 13-15 и
45-60 см. При сплошном рядовом посеве норма высева семян составляла 12-15, при широко-
рядном - 5 кг/га. Глубина заделки семян - 1.0-1.5 см. Удобрения и химические средства защиты
растений от сорняков, болезней и вредителей перед посевом и в период вегетации люцерны не
применялись. В 2022 г. в летний период посев люцерны проводился сухими семенами, а также
семенами, замоченными в воде на 4-5 часов за 1 день до посева, и семенами, скарифицирован-
ными перед посевом. При летнем посеве всходы появлялись на 7-8-й день, ветвление наступало
на 22-25-й, фаза бутонизации - на 61-65-й, цветения - 75-80-й день, созревания плодов - на
130-140-й день после посева.
Учеты галлов Asphondylia miki в посевах люцерны проводили с начала их образования до
конца вегетации культуры на площадках от 0.1 до 1 м2 в десятикратной повторности. При вы-
сокой численности галлов в первый год развития люцерны определялись также количество рас-
тений, генеративных побегов, в том числе с галлами в экз./м2 и %, число кистей соцветий на ге-
неративном побеге, в том числе с галлами (%) и общее количество галлов на 1 м2. В конце
сентября галлы собирали в пакеты и мешочки для выведения из них паразитов, при этом часть
галлов вскрывали сразу после сбора для определения зимующих стадий A. miki и зараженности
их паразитами. Вылетевших из галлов паразитов фиксировали в 70%-ном этиловом спирте для
последующего определения. Часть галлов в пакетах и мешочках хранили в зимний период в хо-
лодильнике и вскрывали их в конце марта - начале апреля.
Статистическая обработка данных проводилась методами дисперсионного (стандартное от-
клонение) и корреляционного анализов (табл. 1).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Влияние сорта, сроков и способов посева люцерны на численность галлов
и вредоносность Asphondylia miki
В лесостепи Самарской обл. в посевах люцерны 2-3-го годов развития, а также при
ее весеннем посеве во второй декаде мая в первый год развития численность галлов
423
Asphondylia miki в сентябре-октябре была незначительной и не превышала 0.7 экз./м2.
Самки A. miki откладывают яйца в завязи бутонов неоплодотворенных цветков лю-
церны. В первый год развития культуры при совпадении массового лёта галлиц с буто-
низацией численность галлов резко возрастала, что наблюдалось нами впервые в
2022 г. при проведении посева люцерны 15 июня. Бутонизация и начало цветения мо-
лодых растений с одним генеративным побегом наблюдались во второй половине ав-
густа, что совпало с массовым лётом имаго A. miki. Зеленые мясистые галлы A. miki
формировались в конце августа - начале сентября, а их учеты проводились в конце
сентября - первой половине октября. Длина сформированных галлов A. miki состав-
ляла 8.2-9.5, ширина 2.8-4.7 мм, в среднем 9.0 × 3.4 мм (рис. 1). Личинка в галле пита-
ется паренхимой внутренней стенки мясистого галла и мицелием гриба при его на-
личии. При этом стенка галла истончается. На пестрогибридных сортах люцерны
изменчивой Изумруда и Чишминская 131 в молодых посевах первого года в конце сен-
тября сформированные галлы A. miki отмечены на 40-68 % генеративных побегов лю-
церны. При этом в сплошных посевах этот показатель составлял в среднем 68 %,
а в широкорядных - 50-53 %. На одном побеге с галлами их число составляло
в среднем около 7.5, а число бобов с семенами - 6-12. В сплошном посеве сорта Изум-
руда на генеративных побегах с галлами на долю галлов приходилось в среднем 58 %,
в широкорядном посеве этого сорта 62.5 %, а сорта Чишминская - 78.5% общего коли-
чества галлов и неповрежденных бобов с семенами (табл. 1). Общее количество
галлов A. miki в сплошном посеве сорта Изумруда составляло в среднем 825, а в широ-
корядном посеве сортов Изумруда и Чишминская 131 в среднем было почти одина-
ковым и составляло 616-619 экз./м2. В сплошном посеве сорта Изумруда потери
урожайности семян за счет вредоносности A. miki составили в среднем 64 %, а в ши-
рокорядном посеве сортов Изумруда - 24 %, Чишминская 131 - 33 %.
Предпосевная обработка семян физическими приемами оказала достоверное вли-
яние на поврежденность растений люцерны плодовой галлицей. Количество непо-
врежденных генеративных побегов возрастало у сорта Изумруда от 42 % в опыте с
посевом сухих семян до 48 % - скарифицированных и до 51 % - замоченных в воде
перед посевом, а у сорта Чишминская 131 - соответственно от 42 до 45 и 61 %. Коли-
чество поврежденных галлицей побегов снижалось от 58 до 52 и 49 % у сорта Изум-
руда, и от 57 до 55 и 39 % у сорта Чишминская 131 с коэффициентом корреляции у
обоих сортов до -0.998. Вероятно, это связано со сроками появления всходов и их
развития, сравнительно поздними при посеве сухих семян и более ранними - при по-
севе семян скарифицированных и особенно замоченных в воде перед посевом. Число
галлов на одном поврежденном A. miki побеге люцерны при этом у сорта Изумруда
снижалось от 10 экз. при посеве сухих семян до 7 и 5 экз. в опытах со скарифициро-
ванными и увлажненными семенами, а у сорта Чишминская 131, напротив, возрастало
соответственно от 6 до 7 и 9 экз. Общее количество галлов в этих опытах менялось
аналогично, у Изумруды от 761 до 587 и 501, Чишминской 131 - от 543 до 586 и
730 экз./м2. Потери урожайности семян Изумруды в опыте с сухими семенами состав-
ляли в среднем 81, скарифицированными - 19 и увлажненными - 13 %, а в опыте
с Чишминской 131, соответственно 46, 28 и 31 %.
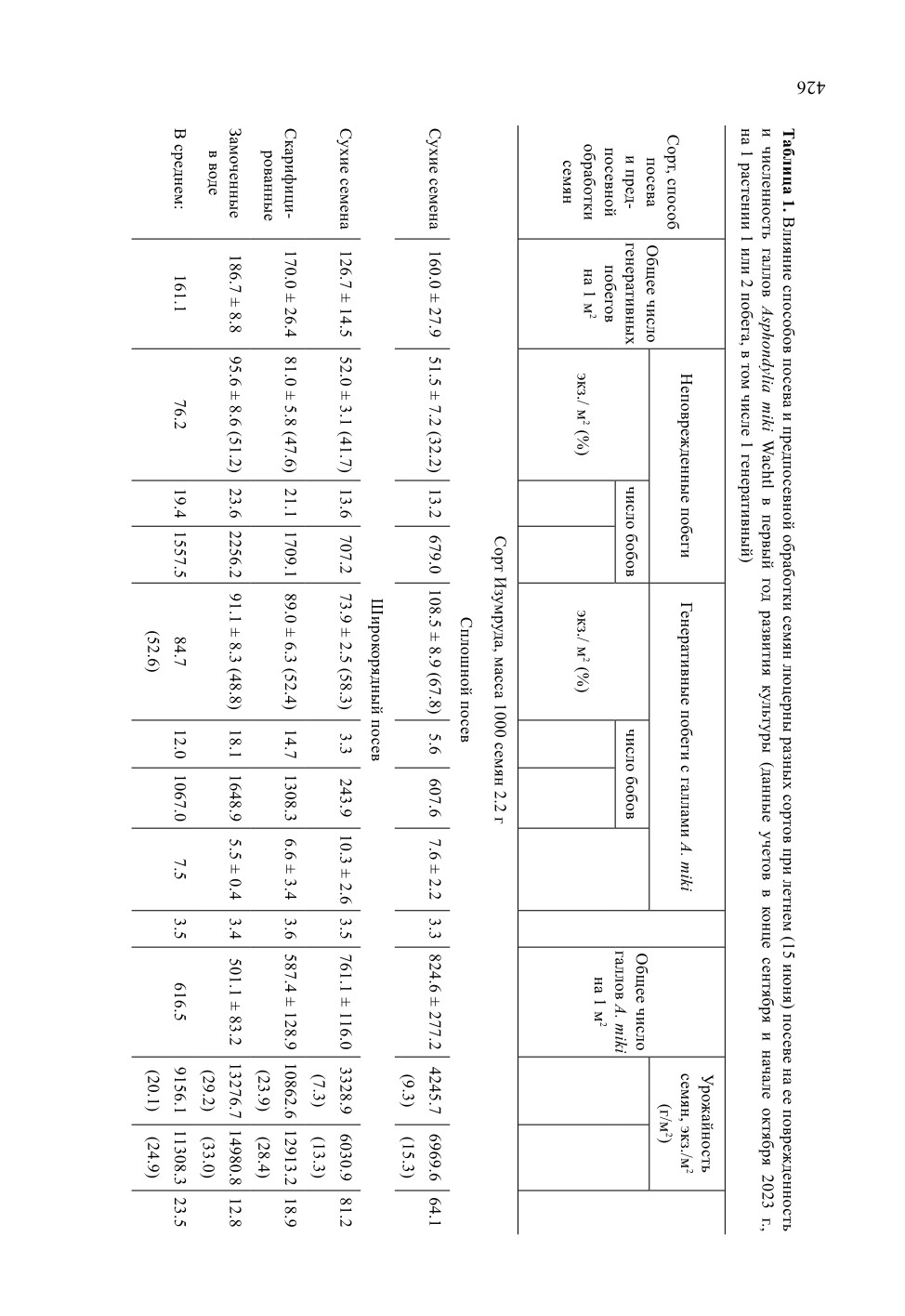
У куколок A. miki в передней части головы хорошо развиты две сравнительно
длинные вытянуто-треугольные склеротизованные лопасти, на дорсальной стороне
груди расположены две продольные пары сближенных небольших, сильно склероти-
зованных заостренных рожков, а на II-VIII тергитах брюшка 5 или 6 поперечных
424
Рис. 1. Галлы Asphondylia miki Wachtl на люцерне. Фото И. А. Володиной.
425
на
1 побеге
экз./ м2
на
1 побеге
на 1 м2
число галлов
на 1 побеге
Число семян в бобе
Фактическая
Потенциаль-
ная
Потери урожайности
семян, %
на
1 побеге
экз./ м2
на
1 побеге
на 1 м2
число галлов
на 1 побеге
Число семян в бобе
Фактическая
Потенциаль-
ная
Потери урожайности
семян, %
рядов шипиков (рис. 2), с помощью которых перед вылетом имаго куколка просверли-
вает округлое отверстие в стенке галла и заметно высовывается из него, затем экзувий
куколки лопается по продольной линии тела в области головы и груди и происходит
вылет имаго. Массовый вылет имаго из галлов наблюдался в первой половине апреля
2023 г. Среди собранных в этот период с растений 20 перезимовавших галлов экзувий
куколок и лётные отверстия в стенке галла обнаружены у 8 (40 %) галлов. В 12 (60 %)
галлах были потемневшие остатки погибших личинок галлиц с признаками питания
ими личинок паразитов, а также куколки и имаго паразитов.
Состав, численность и влияние паразитических перепончатокрылых
на Asphondylia miki
В лесостепи Самарской обл. наибольшее влияние на численность люцерновой пло-
довой галлицы оказывает грегарный (групповой) эктопаразит Sigmophora brevicornis,
Рис. 2. Куколка Asphondylia miki Wachtl.
1 - передний конец головы и дорсальная часть груди с лопастями и шипами сверлильного аппарата,
2 - II и III тергиты брюшка, 3 - VI тергит брюшка с опорными шипиками.
Масштабная линейка - 0.1 мм.
428
самки которого откладывают яйца в сравнительно хорошо развитые галлы с личин-
ками средних и старших возрастов и куколками. Род Sigmophora Rondani включает
13 описанных видов, распространенных в Австралии (S. otis (Walker), S. io (Girault),
S. spenceri (Girault) и S. mediosulcata (Girault)), Новой Гвинее (S. papuana Ikeda), Индии
(S. polyseta (Sarawat)), на Мадагаскаре, в Западной и Центральной Африке (соответ-
ственно S. tumidifrons Ikeda, S. prolixa Ikeda и S. lutea Ikeda), Средиземноморье
(S. italica (Domenichini)), юго-восточной Палеарктике (S. aceris Ikeda и S. divorsa
Ikeda) и в южной Палеарктике от Европы до северной Индии, Китая, Кореи, Японии и
Вьетнама (S. brevicornis). Sigmophora brevicornis паразитирует в галлах галлиц родов
Asphondylia, Contarinia Rondani, Eumarchalia Del Guercio, Kiefferia Mik и Schizomyia
Kieffer; S. italica и S. aceris - в галлах Asphondylia, у остальных видов рода Sigmophora
хозяева пока не известны (Ikeda, 1999). Длина тела самок в популяциях рода
Sigmophora составляла в Австралии и Новой Гвинее 1.7-3.0, в Восточной Палеарктике
и Индии - 2.0-3.6, Африке - 1.6-4.6 мм, у Sigmophora brevicornis 1.9-2.4 мм, в среднем
увеличиваясь с востока на запад и с юга на север.
Из галлов A. miki, собранных в последней декаде сентября и начале октября 2022 г. в
летних посевах люцерны первого года, в лабораторных условиях в конце сентября -
первой декаде октября 2022 г. происходил массовый вылет паразитических перепонча-
токрылых, главным образом Sigmophora brevicornis (97 ♀, 66 ♂), на долю которых
приходилось около 77 % всех вылетевших паразитов. При вскрытии в конце марта
2023 г. 30 галлов, хранившихся в холодильнике, в одном из были обнаружены нор-
мально развитые погибшие 2 ♀ и 3 ♂ S. brevicornis, в 20 (66.7 %) галлах - по 3-14 ку-
колок S. brevicornis, и лишь в 2 (6.7 %) галлах по одной развитой куколке галлицы
A. miki, что свидетельствует о высокой эффективности S. brevicornis в снижении чис-
ленности плодовой люцерновой галлицы. Среди собранных с растений 20 перезимо-
вавших галлов в первой половине апреля 2023 г. экзувий куколок и летные отверстия
в стенке галла обнаружены у 8 (40 %) галлов A. miki, при их вскрытии в лаборатории
в 12 (60 %) галлах обнаружены потемневшие остатки погибших личинок галлиц
с признаками питания ими личинками паразитов, а также куколки и имаго паразитов.
Окраска тела самцов и самок S. brevicornis трехцветная, включает разной интенсив-
ности черный, коричневый и желтый цвета. Вылетевшие из галлов A. miki самки и
самцы паразитов S. brevicornis по окраске тела относились к трем фенотипам наиболее
светлой коричневато-желтой, желтовато-коричневой и темной окраски (табл. 2), на
долю которых в популяции S. brevicornis приходилось соответственно 52 ♀ и 33 ♂;
32 ♀ и 12 ♂; 13 ♀ и 18 ♂, или 53.1, 27.5 и 19.4 % учтенных особей (см. табл. 2, рис. 3).
В австралийских популяциях тело взрослых особей от черного до темно- или
бледно-коричневого; от черного до желтого и коричневого, и от желтого до коричне-
вого; ноги от бледно- до темно-коричневых, или от бледно-коричневых до желтых; на
Новой Гвинее - тело и усики желтые, ноги - бледно-коричневые. В африканских по-
пуляциях - тело коричневое с желтой головой, или желтое с коричневым брюшком,
ноги - бледно-коричневые; в индийской популяции - коричневое или бледно-корич-
невое с желтыми ногами; в Восточной Палеарктике - с желтой головой, черной с жел-
тыми частями грудью, черным с желтыми участками брюшком; или желтое, с темно-
коричневой до черной с желтым грудью, брюшко темно-коричневое с желтыми
основанием и вершиной, желтой вентральной поверхностью, ноги желтые; в европей-
ских популяциях - тело желтое с черными отметинами до преимущественно черного
429
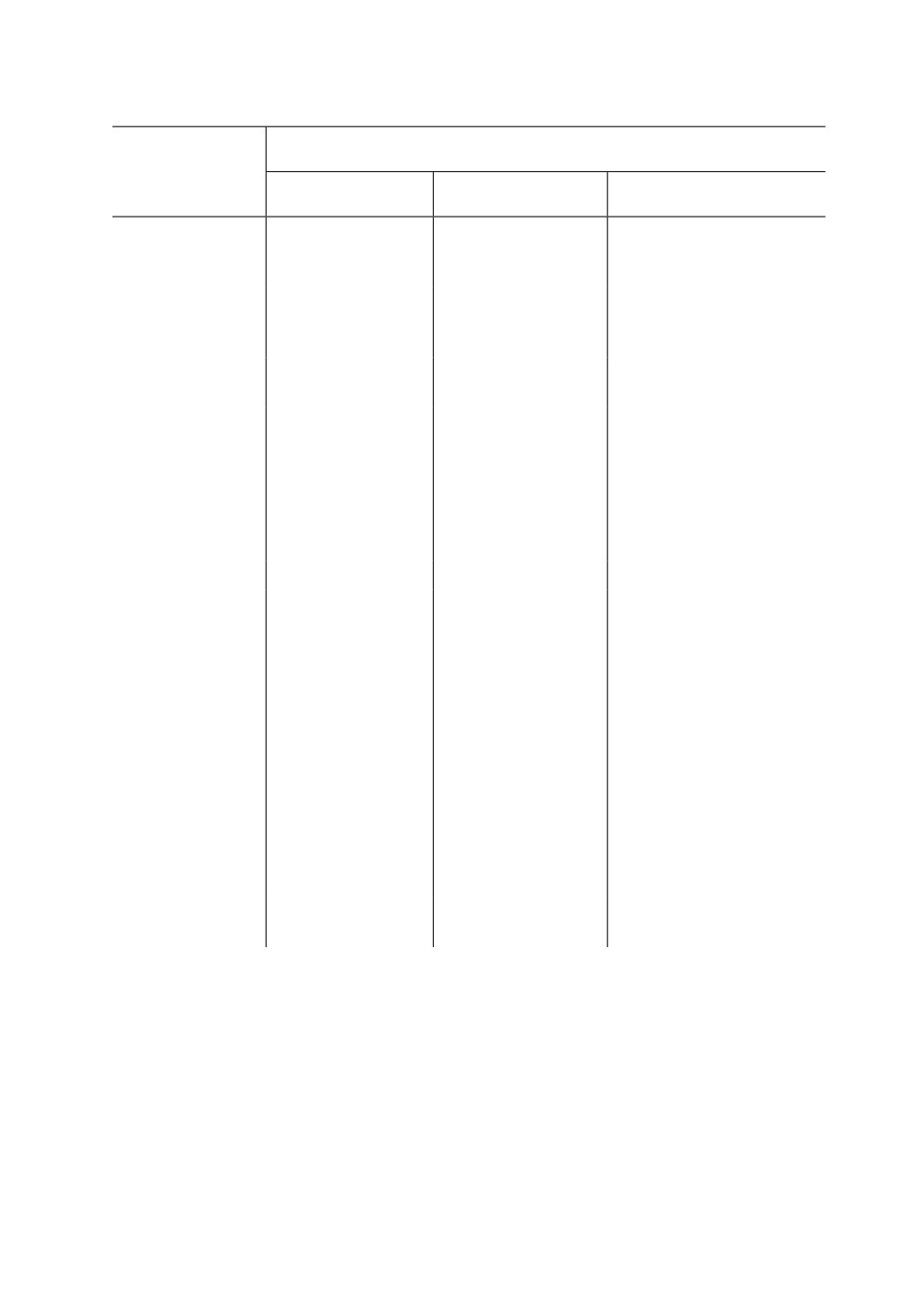
Таблица 2. Окраска тела имаго эктопаразита Sigmophora brevicornis (Panzer)
Фенотип окраски
Часть тела
Коричневато-желтая
Желтовато-коричневая
Темная
Голова
Лицо
Полностью желтое
Желтое с широкой
Темно-коричневое,
или с коричне-
продольной ко-
или с бледно-желтыми
ватым участком
ричневой полосой
участками на щеках
под усиковыми
от глазкового
и внутренних краях глаз
ямками
треугольника до
наличника; щеки
с коричневыми
участками
Глазковый тре-
Желтый или коричне-
Коричневый
Коричневый
угольник
ватый
Затылок
Черный
Черный
Темно-коричневый
Жгутик усика
Коричневатый
Коричневый
Темно-коричневый
Основной членик
Желтый, сверху
Темно-коричневый
Темно-коричневый
усика
коричневатый
Поворотный
Коричневый
Темно-коричневый
Темно-коричневый
членик
Мезосома
Преимущественно
Преимущественно
Темно-коричневая
желтая
темно-коричневая
Лопатки
Полностью желтые
Желтые с коричневым
Коричневатые
или с коричневым
пятном в передней
пятном в передней
части
части
Аксиллы
Полностью желтые
Коричневые, за
Коричневатые
исключением жел-
того заднего края
Переднеспинка
Желтая с черным
Черная с желтоватыми
От темно-коричневой
пятном в антеро-
задними углами
до черной
медиальной части
Щит
От полностью
Черный, за исклю-
От темно-коричневого
среднеспинки
желтого до тем-
чением желтых
до черного
но-коричневого в
заднего и боковых
антеромедиальной
краев; иногда пол-
части
ностью черный
Щитик
Желтый с бледно-ко-
Желтый с черными
Коричневатый
ричневатыми
боками, иногда с
боками
темным пятном
посередине
Заднещитик
Желтый
Желтый
Бледно-желтый
430
Таблица 2 (продолжение)
Фенотип окраски
Часть тела
Коричневато-желтая
Желтовато-коричневая
Темная
Промежуточный
Темно-коричневый,
Темно-коричневый
От темно-коричневого до
сегмент
или желтоватый
черного
на боках
Склерит между
Желтый
Темно-коричневый
Темно-коричневый
боками передне-
и среднегруди
Бока среднегруди
Желтые
От желтых до тем-
Темно-коричневые
но-коричневых
Ноги
Желтые, кроме
Желтые, кроме
Желтые, исключая одно-
темно-коричневых
частично или пол-
цветные с телом тазики
оснований задних
ностью темно-ко-
тазиков и свет-
ричневых тазиков
ло-коричневых ос-
и иногда затемнен-
нований передних
ных вершин бедер
тазиков
Метасома
Стебелек
Желтоватый
Желтоватый
Коричневатый
Брюшко
Коричневатое,
У самок коричневое
Темно-коричневое, более
кроме желтых
с небольшими
бледное в основании
оснований всех
желтыми пятнами
тергитов, первого
на боках; у самцов
и последнего тер-
обычно полностью
гитов целиком и
коричневое
продольных полос
на боках брюшка.
У самцов брюшко
обычно целиком
коричневое или в
основании блед-
но-желтое
Наружные створки
Темно-коричневые
Темно-коричневые
Черноватые
яйцеклада
(Ikeda, 1999). Самцы и самки рода Sigmophora имеют сходную окраску тела, которая
определяется преимущественно ненаследственной (модификационной, или фенотипи-
ческой) изменчивостью, связанной с динамикой природных условий их местооби-
таний, является в значительной мере покровительственной и играет важную роль в их
взаимоотношениях с хищниками и сверхпаразитами. Самцы и самки Sigmophora до-
полнительно питаются нектаром на цветках растений перед отладкой яиц. В России и
других странах возделывают пестрогибридные сорта люцерны изменчивой с фиоле-
товой, синей, бледно-синей, желтой окраской венчиков. Разные их сочетания в от-
431
Рис. 3. Разные типы окраски тела имаго Sigmophora brevicornis(Panzer): I - наиболее светлая
коричневато-желтая, II - желтовато-коричневая, III - наиболее темная. Фото О. В. Кошелевой.
дельные годы обеспечивают преимущество для определенных фенотипов имаго
S. brevicornis при поиске цветков и питании в них нектаром и при поиске галлов A. miki
для откладки яиц.
Среди прочих паразитов из галлов A. miki в конце сентября, а также в первой и
второй декадах октября наблюдался вылет имаго также грегарного палеарктического
эктопаразита Eurytoma dentata Mayr (зубчатая эвритома) (16 ♀, 16 ♂) (15.1 %) и эндо-
паразитов личинок и куколок A. miki из сем. Pteromalidae (1 ♀, 1 ♂) (0.9 %), а также
прочих не определенных паразитов из сем. Eurytomidae (8 ♀, 7 ♂) (7.1 %). Самки
Eu. dentata откладывают яйца в галлы на бобовых растениях, вызванные личинками
галлиц Asphondylia gennadii (Marchal), A. miki, A. prunorum Wachtl, A. sarothamni
(Loew). Отродившиеся личинки зубчатой эвритомы присасываются к личинкам галлиц
и после их гибели питаются как фитофаги, высасывая соки из стенок галла (Tiwari,
1974; Noyes, 2012; Зерова, Фурсов, 2020).
432
ВЫВОДЫ
1. В лесостепи Среднего Поволжья в весенних посевах люцерны во все годы ее раз-
вития галлица Asphondylia miki развивается в двух поколениях, в летних посевах
в первый год жизни культуры - в одном поколении; зимуют куколки в галлах на расте-
ниях, лёт имаго зимовавшего поколения протекает в апреле.
2. Наибольшая поврежденность люцерны личинками галлицы A. miki (40-68 % гене-
ративных побегов) наблюдается в первый год жизни летних посевов при совпадении
массового лёта имаго с бутонизацией культуры, когда численность галлов составляет
500-830 экз./м2. Это приводит к значительным потерям урожайности семян люцерны
(13-81 %). Посев увлажненных семян люцерны уменьшает потери их урожайности
в 1.5-6.3 раза.
3. В летних посевах люцерны первого года развития без применения химических
средств защиты растений паразитические перепончатокрылые способствуют гибели
личинок и куколок A. miki в среднем в 60 % ее галлов. Среди паразитов преобладает
Sigmophora brevicornis (Eulophidae) - грегарный эктопаразит преимущественно ли-
чинок A. miki, на долю которого приходилось около 77 % особей выявленных параз-
итов.
4. В популяции S. brevicornis самцы и самки имели сходную окраску тела и относи-
лись к трем фенотипам: с наиболее светлой коричневато-желтой, желтовато-корич-
невой и темной окраской, на долю которых приходилось соответственно 53, 28 и 19 %
особей паразита.
5. Покровительственная окраска тела паразитов играет важную роль в их взаимоот-
ношениях с хищниками и сверхпаразитами. В связи с изменением условий развития
по годам она обеспечивает преимущества для определенных фенотипов имаго
S. brevicornis при поиске цветков люцерны для дополнительного питания в них нек-
таром и поиске галлов A. miki для откладки яиц.
СПИСОК ЛИТЕРАТУРЫ
Девяткин А. М., Маркова И. А., Белый А. И. 2013. Вредители, болезни и сорняки люцернового агроценоза:
монография. Краснодар: Кубанский государственный аграрный университет, 477 с.
Зерова М. Д., Фурсов В. Н. 2020. Обзор палеарктических видов рода Eurytoma Ill. группы robusta с описани-
ем нового вида из Узбекистана (Hymenoptera, Chalcidoidea: Eurytomidae). Энтомологическое обозре-
ние 99 (2): 448-465.
Пономаренко Д. А. 1949. Борьба с вредителями семенной люцерны. М.: Сельхозгиз, 216 c.
Рзаева Л. М. 1971. Материалы к изучению фауны хальцид (Chalcidoidea) Азербайджанской ССР. Известия
Академии наук Азербайджанской ССР. Серия биологических наук 3: 83-90.
Федоренко И. П., Яковлев И. В. 2015. Видовой состав фитофагов люцернового агроценоза в Правобережной
лесостепи Украины. В кн.: Защита растений. Сборник научных трудов. Вып. 39. Минск: Научно-прак-
тический центр НАН Беларуси по земледелию и др., с. 247-255.
Федотова З. А. 2019. Новые и малоизвестные для фауны России виды галлиц (Diptera, Cecidomyiidae) из
Среднего Поволжья. Труды Ставропольского отделения русского энтомологического общества. Мате-
риалы XII Международной научно-практической интернет-конференции «Актуальные вопросы энто-
мологии» (Ставрополь, 30 октября 2019 г. К 15-летию Ставропольского отделения Русского
энтомологического общества РАН). Выпуск 15. Ставрополь: с. 20-32.
Bernardo U., Nugnes F., Gargiulo S., Nicoletti R., Becchimanzi A., Stinca A., Viggiani G. 2021. An integrative study
on Asphondylia spp. (Diptera: Cecidomyiidae), causing flower galls on Lamiaceae, with description,
phenology, and associated fungi of two new species. Insects 12 (11): 958.
433
Bollow H.
1954. Die Luzerneblütengallmücke und die anderen Luzerne-schädigenden Gallmückenarten.
Pflanzenschutz München 6: 144-175.
Darvas B., Skuhravá M., Andersen A. 2000. 1.15. Agricultural dipteran pests of the Palaearctic region. In: L. Papp,
B. Darvas (eds). Contributions to a Manual of Palaearctic Diptera. Vol. 1. General and Applied Dipterology.
Budapest: Science Heraid, p. 565-650.
Dorchin N., Mifsud D., Askew R. 2014. Saltbush-associated Asphondylia species (Diptera: Cecidomyiidae) in the
Mediterranean Basin and their chalcidoid parasitoids (Hymenoptera: Chalcidoidea). Zootaxa 3869 (4):
383-396.
Gagné R. J., Jaschhof M. 2021. A Catalog of the Cecidomyiidae (Diptera) of the World. Fifth Edition. Digital. 816
p.
Ikeda E. A. 1999. Revision of the world species of Sigmophora Rondani (Hymenoptera, Eulophidae). Insecta
Matsumurana. New Series 55: 37-74.
Lange L. 1936. Pflanzengallen der Umgebung Naumburgs und anderer Gebiete. Mitteilungen des Thüringischen
Botanischen Vereins 43: 57-79.
Noyes J. S.
2012. Universal Chalcidoidea Database. World Wide Web electronic publication.
[URL:
Simova-Tošić D., Skuhravá M., Skuhravý V. 1996. Gall midges (Diptera: Cecidomyiidae) of Slovenia. Scopolia 36:
1-23.
Simova-Tošić D., Skuhravá M., Skuhravý V. 2000. Gall midges (Diptera: Cecidomyiidae) of Serbia. Acta
Entomologica Serbica 5 (1/2): 47-93.
Skuhravá M., Skuhravý V. 2010. Gall midges (Diptera, Cecidomyiidae) of South Tyrol (Italy) - Summary and
results and zoogeographical analysis. Gredleriana 10: 275-324.
Skuhravá M., Skuhravý V., Meyer H. 2014. Gall Midges (Diptera: Cecidomyiidae: Cecidomyiinae) of Germany -
Faunistics, Ecology and Zoogeography. Kiel: Faunistisch-Ökologische Arbeitsgemeinschaft Ökologie-
Zentrum, Universität Olshausenstrasse, 200 p.
Tiwari N. K. 1974. Eurytoma nesiotes Crawford (Hym. Chalcidoidea) an external parasite of the gall midge
Asphondylia sesami Felt. Zeitschrift für Angewandte Entomologie 77: 169-194.
Tokuda M., Yukawa J. 2007. Biogeography and evolution of gall midges (Diptera: Cecidomyiidae) inhabiting broad-
leaved evergreen forests in Oriental and eastern Palearctic regions. Oriental Insects 41 (1): 121-139.
https/doi.org//10.1080/00305316.2007.10417502
Webster F. M. 1912. The Alfalfa Gall Midge. (Asphondylia miki Wachtl.). Washington, D. C.: United States
Department of Agriculture, Bureau of Entomology, Circular no. 147, 4 p.
RELATIONSHIPS OF THE GALL MIDGE, ASPHONDYLIA MIKI WACHTL
(DIPTERA, CECIDOMYIIDAE), WITH THE HOST PLANT, ALFALFA
(MEDICAGO SATIVA), AND ECTOPARASITES OF ITS LARVAE
AND PUPAE (HYMENOPTERA, EULOPHIDAE)
IN THE FOREST-STEPPE OF THE MIDDLE VOLGA REGION
V. G. Kaplin, O. V. Kosheleva, I. A. Volodina
Key words: variety, timing and method of sowing, number of galls, harmfulness, Sigmophora
brevicornis, gregarious ectoparasite, efficacy, phenotypes.
SUMMARY
The studies were carried out in crops of alfalfa (Medicago sativa ssp. × varia) in 2018-2022 in the
forest-steppe of Samara Province. Asphondylia miki galls were taken into account in alfalfa crops from
the beginning of their formation to the end of the growing season on sites from 0.1 to 1 m2 in 10-fold
repetition. Statistical processing of the obtained data was carried out by methods of variance analysis.
At spring sowing of alfalfa, as well as in its perennial crops, gall midge A. miki develops in two, and
during summer sowing in the first year of the culture’s life in one generation per year, pupae overwinter
in galls, the imago of the wintering generation occurs in April. The greatest damage to alfalfa by the
434
larvae of A. miki (40-68% of generative shoots) and the number of its galls (500-830 copies/m2) were
observed in the first year of the culture’s life when it was sown in summer, with the coincidence of the
greatest flight of imago with the budding of the culture, which led to significant losses in the yield of
alfalfa seeds (13-81%). In summer alfalfa crops of the first year of development without the use of
chemical plant protection agents, parasitic hymenopterans contribute to the death of larvae and pupae of
A. miki in on average 60% of its galls. Among them, a gregarious ectoparasite Sigmophora brevicornis
(Eulophidae) mainly preying on A. miki larvae accounted for about 77% of the individuals of the
identified parasites. In the S. brevicornis population, males and females had similar body coloration
and belonged to three phenotypes: the lightest brownish yellow, yellowish brown, and dark coloration,
which accounted for 53, 28 and 19% of parasite individuals, respectively.
435